3. Studieneinheit
Werbung

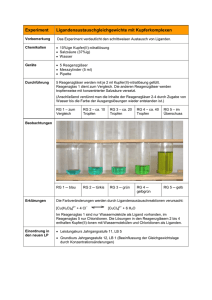
Praktikum Chemie für Mediziner und Zahnmediziner 37 3. Studieneinheit Lernziele • Komplexbildungsreaktionen • Beeinflussung der Komplexgleichgewichte durch verschiedene Parameter • Farbigkeit von Komplexen, photometrische Titration Stichworte zur theoretischen Vorbereitung Komplexchemie, Photometrie, Komplexgleichgewicht, Komplexbildungskonstante, Lambert-BeerGesetz Praktische Punkte Bestimmung des unbekannten Cobaltgehaltes einer Probe durch photometrische Titration. Weniger als 5% Abweichung vom vorgegebenen Wert: 1 Punkt, 5 – 10 % Abweichung: 0.5 Punkte, mehr als 10% Abweichung: 0 Punkte. Gliederung 3.1 Komplexbildung zwischen Fe3+ und SCN (Versuch in Zweiergruppen) 3.2 Komplexbildung zwischen Co2+ und verschiedenen Liganden (Versuch in Zweiergruppen) 3.3 Benutzung eines Photometers (Vorführung) 3.4 Bestimmung der Ligandenzahl im EDTA-Co2+-Komplex (Versuch in Achtergruppen) 3.5 Photometrische Titration einer Co2+-Lösung mit EDTA (Versuch in Achtergruppen) 38 Dritte Studieneinheit 3.1 Komplexbildung zwischen Fe3+ und SCN Der Versuch ist in Zweiergruppen durchzuführen und umfaßt insgesamt vier Teilversuche: Komplexbildungsreaktion, Einfluß von Verdünnung auf Farbintensität und Komplexbildungsgleichgewicht, Verschiebung des Gleichgewichts durch Erhöhung von c(Fe3+) bzw. c(SCN ), Beeinflussung des Gleichgewichts durch Zusatz von Fremdsubstanzen. Benötigte Geräte 10 Reagenzgläser in Reagenzglasständer weißes Blatt Papier (selbst organisierten) zwei 2 mL Messpipetten mit Peleusball Spatel zwei Pasteurpipetten Benötigte Lösungen Gst.-Symbole R-Sätze entionisiertes Wasser (H2O) - S-Sätze - - 0.1 M Eisen(III)chlorid-Lösung (FeCl3) Xn 22-38-41 0.1 M Ammoniumthiocyanat-Lösung (NH4SCN) Xn 20/21/22-32 2-13 Natriumchlorid (NaCl) Ascorbinsäure - - - - - - - di-Natriumhydrogenphosphat (Na2HPO4) konz. Salzsäure (HCl) 26-39 C 34-37 26-36/37/39-45 Arbeitsvorschrift Füllen Sie sich ausreichende Mengen an FeCl3- bzw. NH4SCN-Lösung in je ein beschriftetes Reagenzglas (Arbeitsgefäße, zu ca. ¾ voll machen). Wenn nach Abschluß der Versuchsreihe noch NH4SCN-Lösung übrig bleibt, dann bewahren Sie diese für Versuch 3.2 auf. 3.1.1 Komplexbildungsreaktion Stellen Sie eine Eisenrhodanid-Lösung her. Nehmen mit Sie dazu (mit separaten Messpipetten!) je 2 mL FeCl3- Lösung und 6 mL NH4SCN-Lösung aus den Arbeitsgefäßen und mischen Sie beide Lösungen in einem leeren Reagenzglas. Welche Farbänderung beobachten Sie? Bewahren Sie die Eisenrhodanid-Lösung für den nächsten Versuch auf und verwenden Sie die jeweilige Messpipette auch in den folgenden Versuchen ausschließlich für die entsprechende Lösungen (FeCl3 bzw. NH4SCN). Formulieren Sie die zugehörige Reaktionsgleichung. Praktikum Chemie für Mediziner und Zahnmediziner 39 3.1.2 Einfluß von Verdünnung auf Farbintensität und Komplexbildungsgleichgewicht 1. Geben Sie mit einer Pasteurpipette je 30 Tropfen der Eisenrhodanid-Lösung in zwei Reagenzgläser. 2. Geben Sie in zwei andere Reagenzgläser je 0.5 mL FeCl3-Lösung. 3. Verdünnen Sie eine der beiden Eisenrhodanid-Lösungen und eine der FeCl3-Lösungen mit entionisiertem Wasser, indem Sie die Reagenzgläser etwa bis zur Hälfte auffüllen und durch Umschwenken homogenisieren. 4. Vergleichen Sie die Farbintensitäten von der Eisenrhodanid-Lösung und der verdünnten Eisenrhodanid-Lösung sowie der FeCl3-Lösung und der verdünnten FeCl3-Lösungen, indem Sie sie a) von vorne b) von oben gegen ein Blatt weißes Papier im Hintergrund betrachten. Erklären Sie die Beobachtung bei den FeCl3-Lösungen mit Hilfe des Lambert-Beer-Gesetzes. Je dunkler die Lösungen erscheinen, desto größer ist die Extinktion. Berücksichtigen Sie dabei, wie sich die Verdünnung auf die Konzentration und die Betrachtungsrichtung auf die Schichtdicke auswirkt. Erklären Sie die Beobachtungen für die Eisenrhodanid-Lösung ebenfalls mit Hilfe des LambertBeer-Gesetzes sowie mit der Wirkung von Verdünnung auf das Komplexgleichgewicht: Fe3+ + 3 SCN K= Fe(SCN)3 c ( Fe ( SCN ) 3 ( c Fe 3 + ) ) c ( SCN ) 3 Wie wirkt sich eine Verdünnung auf die Lage des Gleichgewichts aus? Hinweis: Die Verschiebung von Gleichgewichten in Lösung durch Verdünnung läßt sich analog zur Verschiebung von Gleichgewichten in der Gasphase durch Druckminderung nach dem Prinzip von Le Chatelier betrachten. 40 Dritte Studieneinheit 3.1.3 Verschiebung des Gleichgewichtes durch Vergrößerung von c(Fe3+) bzw. c(SCN ) 1. Entnehmen Sie aus dem Arbeitsgefäß 1 mL Eisenrhodanid-Lösung und geben Sie diese in ein Reagenzglas. Verdünnen Sie die Lösung mit 10 mL ention. Wasser. 2. Geben Sie mit einer Pasteurpipette je 30 Tropfen von der eben durch Verdünnung hergestellten Eisenrhodanid-Lösung in drei Reagenzgläser. 3. Geben Sie in eines der Reagenzgläser 0.5 mL FeCl3-Lösung, in das zweite 0.5 mL NH4SCNLösung. Füllen Sie das dritte mit entionisiertem Wasser so weit auf, bis es den gleichen Füllstand hat wie die beiden anderen Reagenzgläser und homogenisieren Sie die Lösungen. Auswertung Erklären Sie die beobachteten Farbunterschiede anhand der Verschiebung des Komplexbildungsgleichgewichtes nach dem Prinzip von Le Chatelier. 3.1.4 Beeinflussung des Gleichgewichts durch Zusatz von Fremdsubstanzen 1. Geben Sie mit einer Pasteurpipette je 30 Tropfen von der Eisenrhodanid-Lösung in vier Reagenzgläser. 2. Geben Sie ins erste Reagenzglas drei Spatelspitzen Ascorbinsäure, ins zweite drei Spatelspitzen NaCl, ins dritte drei Spatelspitzen Na2HPO4 und ins vierte 50 Tropfen konzentrierte Salzsäure. Überlegen Sie, wie die entsprechenden Substanzen ins Komplexbildungsgleichgewicht eingreifen und erklären Sie Ihre Beobachtungen. Hinweis: Ascorbinsäure ist ein Reduktionsmittel, FePO4 ist eine schwerlösliche Verbindung, HSCN ist eine schwache Säure. Praktikum Chemie für Mediziner und Zahnmediziner 41 3.2 Komplexbildung zwischen Co2+ und verschiedenen Liganden Der Versuch ist in Zweiergruppen durchzuführen. Versuchsdurchführung im Abzug! Benötigte Geräte 2 Reagenzgläser pro Achtergruppe 3 Reagenzgläser pro Zweiergruppe 1 Stopfen Reagenzglasständer vier Pasteurpipetten Spatel Benötigte Lösungen Gst.-Symbole R-Sätze 0.1 M Cobalt(II)chlorid-Lösung (CoCl2) T, N S-Sätze 49-E22-42/43- 53-22-45-60-61 50/53 Ammoniumthiocyanat (NH4SCN) Xn 20/21/22-32 2-13 Diethylether [(C2H5)2O] F+, Xn 12-19-22-66-67 9-16-29-33 1-Pentanol (CH3(CH2)4OH) Xn 10-20 24/25 NH3/NH4Cl-Pufferlösung (pH = 10) Xi 36/37/38 26 0.1 N EDTA-Lsg. Xn 22 - Arbeitsvorschrift 1. Füllen Sie pro Achtergruppe zwei entsprechend beschriftete Reagenzgläser etwa zur Hälfte mit Diethylether und NH3/NH4Cl-Pufferlösung (pH = 10) (Arbeitsgefäße). Beschriften Sie pro Zweiergruppe drei Reagenzgläser mit den Buchstaben A, B und C mit denen Sie die Versuche A-C durchführen. Geben Sie pro Zweiergruppe je 30 Tropfen der 0.1 M CoCl2-Lösung in jedes dieser drei Reagenzgläser. 2. Versuch A: Geben Sie zwei Spatelspitzen NH4SCN zu der CoCl2-Lösung in Reagenzglas A und homogenisieren Sie den Inhalt. Beobachten Sie die Farbe. Geben Sie mittels Pasteurpipetten je 25 Tropfen 1-Pentanol und 25 Tropfen Diethylether zu. Diethylether und 1-Pentanol mischen sich nicht mit dem Wasser und bilden die obere Phase. Verschließen Sie das Reagenzglas mit einem Stopfen, halten diesen mit dem Daumen fest und extrahieren die wäßrige Phase durch Schütteln (Vorsicht! Diethylether hat einen hohen Dampfdruck.). Welche Farbe nimmt die obere Phase an? 3. Versuch B: Geben Sie je 30 Tropfen der Pufferlösung pH = 10 zur CoCl2-Lösung in Reagenzglas B und Reagenzglas C und homogenisieren Sie die Inhalte. Welche Beobachtung machen Sie? 42 Dritte Studieneinheit 4. Versuch C: Geben Sie 30 Tropfen EDTA-Lösung zur Lösung in Reagenzglas C und homogenisieren Sie den Inhalt. Ändert sich die Farbe der Lösung? 5. Entsorgung: Restlicher Diethylether-Vorrat und Oberphase von Reagenzglas A: Lösungsmittel-Abfälle. Spülen Sie Reagenzglas A mit wenig(!) Ethanol ( Lösungsmittel- Abfälle). Geben Sie alle anderen Lösungen zum Schwermetall-Abfall und spülen Sie die Reagenzgläser mit entionisiertem Wasser. A: Co2+ B: Co2+ C: Co2+ + SCN + NH3/NH4+ + NH3/NH4+ + Pentanol/Ether + EDTA Auswertung Welche Reaktion läuft in Reagenzglas A ab, welcher Komplex ist für die resultierende Farbe verantwortlich? Welche Reaktionen laufen in Reagenzglas B ab, welche Komplexe sind für die resultierende Farbe verantwortlich? O O O Welche Reaktionen laufen in Reagenzglas C ab, welche Komplexe sind für die resultierende Farbe verantwortlich? HO HN HO HN O + + O O Ethylendiamintetraessigsäure (EDTA) Praktikum Chemie für Mediziner und Zahnmediziner 43 3.3 Benutzung eines Photometers Im Praktikum werden Handspektrometer verwendet. Auf der Vorderseite befindet sich in der Mitte der Ein-/Ausschalter. Auf der Oberseite des Gerätes befindet sich ein „Schacht“, in den Sie eine mit Wasser oder Lösung A gefüllte Küvette einführen und die Lichtschutzabdeckung aufsetzen. Die Kalibration, d.h. die Einstellung auf Durchlässigkeit = 100 % bzw. Extinktion = 0, nehmen Sie durch Drücken des Knopfes „o“ vor. Dadurch wird erreicht, dass die Eigenabsorption des Wassers bei späteren Messungen automatisch kompensiert wird. Nun ist das Gerät einsatzbereit. Für Ihre Messung spülen Sie die Küvette einmal mit der zu vermessenden Lösung und stellen die gefüllte Küvette in den Schacht. Danach setzten Sie erneut die Lichtschutzabdeckung auf und starten die Messung durch Drücken von „✔ “. Nach kurzer Zeit erscheint auf dem Display der Messwert. Analog können Sie alle Proben nacheinander vermessen. Achten Sie jedoch hierbei darauf das Gerät weder abzuschalten, noch auf den Knopf „o“ zu drücken, da Sie sonst die Kalibration erneut durchführen müssen. Sie erhalten während der 3. Studieneinheit durch Ihren Assistenten am Gerät in Ihrer BoxAusrüstung eine Einführung in die Benutzung des Photometers. Achtung: Die Grundeinstellungen am Gerät sind nicht über einen längeren Zeitraum stabil. Daher überprüfen Sie gegebenenfalls diese Einstellungen vor jeder Messreihe! 44 Dritte Studieneinheit 3.4 Bestimmung der Ligandenzahl im EDTA-Co2+-Komplex Der Versuch ist in Achtergruppen durchzuführen. Benötigte Geräte acht Messkolben (100 mL) acht Pasteurpipetten 10 mL Vollpipette mit Peleusball eine Photometerküvette, Schichtdicke d = 1 cm Bürette Photometer Benötigte Lösungen Gst.-Symbole R-Sätze S-Sätze entionisiertes Wasser (H2O) - - - 0.1 M Cobalt(II)chlorid-Lösung (CoCl2) T, N 49-E22-42/43-50/53 53-22-45-60-61 0.1 N EDTA-Lsg. Xn 22 - Arbeitsvorschrift 1. Beschriften Sie die acht 100 mL Messkolben mit den Buchstaben von A - H 2. Pipettieren Sie jeweils 10 ml der 0.1 M CoCl2-Lösung in jeden der acht Messkolben. 3. Füllen Sie die 0.1 N EDTA-Lösung in eine Bürette und geben Sie von dort die jeweils erforderliche Menge (siehe Tabelle unten) in den jeweiligen Messkolben. 4. Füllen Sie jeden Messkolben bis zur Eichmarkierung mit entionisiertem Wasser auf und homogenisieren Sie den Inhalt durch Umschwenken. 5. Nehmen Sie eine Küvette, spülen Sie diese zunächst mit Lösung aus Messkolben A aus, füllen Sie die Küvette mit dieser Lösung, stellen Sie die Küvette ins Photometer, stellen Sie die Wellenlänge auf 505 nm und regeln Sie eine Absorbtion = 0 ein. Beachten Sie die Hinweise hinsichtlich der Bedienung des Photometers in Unterkapitel 3.3. Geben Sie die Lösung anschließend zum Schwermetall-Abfall. 6. Spülen Sie die Küvette mit Lösung B aus, füllen sie die Küvette mit dieser Lösung, stellen Sie die Küvette ins Photometer und messen Sie die Absorbtion. Geben Sie die Lösung anschließend ebenfalls zum Schwermetall-Abfall. 7. Verfahren Sie mit den Lösungen C bis H wie mit Lösung B. Verwenden Sie für jede Lösung eine eigene Pasteurpipette zum Überführen aus den Messkolben in die Küvetten. 8. Entsorgung: Bewahren Sie die EDTA-Lösung in der Bürette für den nächsten Versuch auf. Geben Sie alle anderen Lösungen zum Schwermetall-Abfall und spülen Sie die Glasgeräte mit entionisiertem Wasser. Praktikum Chemie für Mediziner und Zahnmediziner B Lösung Nr A 0.1 M CoCl2-Lösung 10 mL 10 mL 10 mL 10 mL 10 mL 10 mL 10 mL 10 mL 0.1 M EDTA-Lösung 0 mL 2 mL C 45 4 mL D 6 mL E 8 mL F G H 10 mL 12 mL 14 mL gemessene Extinktion Auswertung Tragen Sie die Werte in einem Diagramm auf E V(0.1 N EDTA) / mL 46 Dritte Studieneinheit Welche chemische Reaktion liegt Ihren Beobachtungen zugrunde? Wie interpretieren Sie den Anstieg der Extinktion bei EDTA-Zusatz? Warum geht die Kurve in eine Waagerechte über? Was bedeutet das? Zeigen Sie, wie man die stöchiometrische Zusammensetzung des Kobaltkomplexes bestimmen kann! Praktikum Chemie für Mediziner und Zahnmediziner 47 3.5 Photometrische Titration einer Co2+-Lösung mit EDTA Der Versuch ist in Achtergruppen durchzuführen. Benötigte Geräte: wie in Unterkapitel 3.4 Benötigte Lösungen Gst.-Symbole R-Sätze S-Sätze entionisiertes Wasser (H2O) - - - 0.1 N EDTA-Lsg. Xn 22 - Arbeitsvorschrift 1. Holen Sie Ihren Probe bei den Assistenten ab und nennen Sie Ihre Boxnummer. Sie erhalten dann die CoCl2-Lösung unbekannter Konzentration in einem 100 mL Messkolben (Gesamtprobe) und einen Ergebniszettel. 2. Füllen Sie den Messkolben mit entionisiertem Wasser exakt auf 100 mL (bis zum Markierungsring) auf und homogenisieren Sie den Inhalt durch Umschwenken, so wie in Unterkapitel 1.3 beschrieben. 3. Beschriften Sie acht leere und saubere 100 mL Messkolben mit den Buchstaben von A – H. 4. Pipettieren Sie jeweils 10 mL aus der Gesamtprobe in jeden der sieben Messkolben. 5. Füllen Sie 0.1 N EDTA-Lösung in eine Bürette und geben Sie von dort die jeweils erforderliche Menge (siehe Tabelle unten) in den jeweiligen Messkolben. 6. Füllen Sie jeden Messkolben bis zur Eichmarkierung mit entionisiertem Wasser auf und homogenisieren Sie den Inhalt durch Umschwenken. 7. Verfahren Sie bezüglich der photometrischen Messungen wie in Unterkapitel 3.4. 8. Geben Sie den Messkolben mit Ihrer Probelösung zusammen mit dem Abgabezettel bei den Assistenten ab. Lösung Nr A B C D E F G H CoCl2-Lösung mit 10 mL 10 mL 10 mL 10 mL 10 mL 10 mL 10 mL 10 mL unbekanntem Gehalt 0.1 M EDTA-Lösung gemessene Absorbtion 0.0 mL 1.0 mL 2.0 mL 3.0 mL 4.0 mL 5.0 mL 6.0 mL 7.0 mL 48 Dritte Studieneinheit Auswertung Tragen Sie die gemessenen Absorbtionswerte in einem Diagramm gegen die entsprechenden Volumina 0.1 N EDTA auf E V(0.1 N EDTA) / mL 1. Legen Sie jeweils Ausgleichsgeraden durch den steilen und den flachen Kurventeil. Der Schnittpunkt zwischen beiden gibt Ihnen den Äquivalenzpunkt an. 2. Fällen Sie vom Schnittpunkt das Lot auf die Volumen-Achse und bestimmen Sie aus diesem Wert, V, die bis zum Äquivalenzpunkt verbrauchte Stoffmenge, n, an EDTA (c = 0.1 mol·L–1): n = c·V 3. Berechnen Sie daraus die Stoffmenge an Co2+-Ionen in dem aus der Gesamtprobe entnommenen Volumen (10 mL) und dann die Stoffmenge an Co2+-Ionen in der Gesamtprobe. 4. Berechnen Sie dann die Masse, m, an Co2+ in der Gesamtprobe (M(Co) = 58.93 g·mol–1). Tragen Sie diesen Wert auf dem Ergebniszettel ein und geben Sie diesen bei den Assistenten ab.