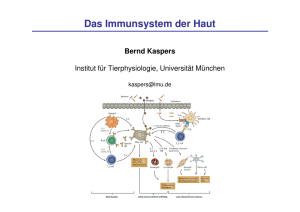
Einfluss von Interleukin-18 auf das Th1/Th2
Werbung

Aus dem Zentrum für Kinderheilkunde und Jugendmedizin der Albert-Ludwigs-Universität Freiburg i. Br. Einfluss von Interleukin-18 auf das Th1/Th2-Zytokingleichgewicht mononukleärer Nabelschnurblutzellen in vitro INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. Vorgelegt 2005 von Dörte Schaefer geboren in Hannover Dekan: Prof. Dr. C. Peters 1. Gutachter: PD Dr. M. Kopp 2. Gutachter: PD Dr. C. Schempp Jahr der Promotion: 2005 Für meine Eltern I Inhaltsverzeichnis 1. Einleitung……………………………………………………….... 1 1.1 Immunologische Grundlagen der Atopieentstehung……………………… 2 1.1.1. Antigenpräsentierende Zellen………………………………………………………. 3 1.1.2. T-Lymphozyten……………………………………………………………………….. 5 1.1.3. B-Lymphozyten……………………………………………………………………….. 7 1.1.4. Mastzellen…….……………………………………………………………………….. 8 1.2. Zytokine der Th1/Th2-Immunantwort………………………………………... 8 1.2.1. Interleukin-4……………………..……………………………………………………. 8 1.2.2. Interleukin-13…………………………………………………………………………. 9 1.2.3. Interferon-γ………………………………………………………………………….... 11 1.2.4. Interleukin-18…………………………………………………………………………. 12 1.3. Th1/Th2-Immunität und Schwangerschaft………………………………….. 16 1.4. Das neonatale Immunsystem……………………………………………….. 17 1.5. Fragestellung………………………………………………………………….. 20 2. Material und Methoden……………………………………….... 21 2.1. Studienpopulation…………………………………………………………….. 21 2.2. Abnahme des Nabelschnurblutes…………………………………………... 21 2.3. Dichtegradientenzentrifugation…………………………………………….... 22 2.4. Zell-Zählung………………………………………………………………….... 23 2.5. Einfrieren von CBMC…………………………………………………………. 24 2.6. Auftauen von CBMC………………………………………………………….. 24 2.7. Magnetic Activated Cell Sorting (MACS) zur Anreicherung CD4+ Zellen 2.8. Durchflusszytometrie mittels Fluorescence Activated Cell Sorter (FACS)…………………………………………………………………………. 2.9. 25 27 Zellstimulation…………………………………………………………………. 29 2.10. Quantitative Zytokinbestimmung mittels ELISA für IFN-γ und IL-13……. 30 II 3. Ergebnisse………………………………………………….......... 34 3.1. Nachweis der IL-18-Sekretion mononukleärer Nabelschnurblutzellen…. 3.2. Ermittlung optimaler Stimulationsbedingungen für die Stimulation 34 mononukleärer Zellen mit IL-18……………………………………………... 36 3.3. Wirkung von IL-18 auf die Zytokinfreisetzung BLG- oder PHA stimulierter CBMCs…………………………………………………………… 3.4. Effekt der Präinkubation auf die Zytokinsekretion von CBMC………………………………………………………………………….. 3.5. 41 47 Wirkung von IL-18 auf die Zytokinsekretion stimulierter CD4+ Zellen………….......................................................................................... 50 4. Diskussion………………………………………………………... 57 4.1. Nachweis der IL-18-Sekretion durch CBMC. ..……………………………. 4.2. Einfluss von IL-18 auf das Th1/Th2-Zytokinprofil mononukleärer 59 Nabelschnurblutzellen………………………………………………………... 60 4.3. Einfluss der Präinkubation auf das Th1/Th2-Zytokinprofil mononukleärer Nabelschnurblutzellen………………………………………………………... 63 4.4. Wirkung von IL-18 auf die Zytokinsekretion von CD4+ Zellen…………… 4.5. Neonatale Immunität und Th2-Immunantwort……………………………… 69 5. Zusammenfassung……………………………………………… 73 65 III 6. Anhang……………………………………………………………. 74 6.1. Materialübersicht ……….………………………………………................... 74 6.2. Daten ………………………………………………………………………….. 76 7. Literaturverzeichnis………………………………………….…. 84 8. Publikation……………………………………………………….. 9. Danksagung……………………………………………………… 105 10. Lebenslauf………………………………………………………... 106 98 IV Abbildungsverzeichnis Abb. 1.1. Pathopysiologie atopischer Erkrankungen…………………………….…………. 3 Abb. 3.1. IL-18-Konzentration in den Zellüberständen von CBMC……….……………….. 35 Abb. 3.2. IFN-γ-Konzentration in den Zellüberständen von CBMC nach Stimulation mit 100, 200 oder 400 ng/ml IL-18 und PHA oder BLG……... ……………………… Abb. 3.3. IL-13-Konzentration in den Zellüberständen von CBMC nach Stimulation mit 100, 200 oder 400 ng/ml IL-18 und PHA oder BLG……... ……………………… Abb. 3.4. Abb. 3.10. Abb. 3.11. Abb. 3.12. 46 IFN-γ-Konzentration in den Zellüberständen von CBMC nach Präinkubation mit IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA…. Abb. 3.9. 45 IL-13-Konzentration in den Zellüberständen von CBMC nach Stimulation mit BLG, IL-18 oder BLG und IL-18…………………………………………………….. Abb. 3.8. 44 IL-13-Konzentration in den Zellüberständen von CBMC nach Stimulation mit PHA, IL-18 oder PHA und IL-18…………………………………………………….. Abb. 3.7. 43 IFN-γ-Konzentration in den Zellüberständen von CBMC nach Stimulation mit BLG, IL-18 oder BLG und IL-18…………………………………………………….. Abb. 3.6. 39 IFN-γ-Konzentration in den Zellüberständen von CBMC nach Stimulation mit PHA, IL-18 oder PHA und IL-18……………………………………………………. Abb. 3.5. 37 48 IL-13-Konzentration in den Zellüberständen von CBMC nach Präinkubation IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA……… 49 Durchflusszytometrische Immunotypisierung von CBMC mittels FACS……….. 51 + Durchflusszytometrische Immunotypisierung von CD4 Zellen mittels FACS…. 52 + IFN-γ-Konzentration in den Zellüberständen von CD4 Zellen nach Präinkubation mit IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA oder BLG……………………………………………………… Abb. 3.13. 53 IL-13-Konzentration in den Zellüberständen von CD4+ Zellen nach Präinkubation mit IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA oder BLG…………………………………………………….... 55 V Tabellenverzeichnis Tab. 3.1. IFN-γ- und IL-13-Konzentrationen in Zellüberständen von CBMC nach Stimulation mit PHA, IL-18 oder PHA und IL-18 für 48 Stunden………………... Tab. 3.2. 42 IFN-γ- und IL-13-Konzentrationen in Zellüberständen von CBMC nach Stimulation mit BLG, IL-18 oder BLG und IL-18 für fünf Tage…………………... 42 VI Abkürzungsverzeichnis Abb. APC BLG bzw. CB CBMC(s) CD d DC DMSO FACS FCS FITC FL FSC g GM-CSF h IFN Ig IGIF IL LPS MACS MHC min Neg. NK-Zellen PAF PBMC(s) PBS PE PHA pos. SSC St.-Abw. Tab. TGF Th-Zellen TLR TNF U VCAM Abbildung Antigen präsentierende Zelle Betalaktoglobulin beziehungsweise Nabelschnurblut Cord blood mononuclear cell(s) Cluster of differentiation Tag Dendritic cells Dimethylsulfoxid Fluorescence Activated Cell Sorter Fetal Calf Serum Fluorescein-Isothocyanat Fluorescenz Forward Scatter Erdbeschleunigung (9,81 m/s2) Granulocyte macrophage colony stimulating factor Stunde Interferon Immunglobulin Interferon gamma inducing factor Interleukin Lipopolysaccharid Magnetic Activated Cell Sorter Major hiscompatibility complex Minute Negativ (-kontrolle) Natürliche Killlerzellen Platelet activating factor Peripheral blood mononuclear cell(s) Phosphate Buffered Saline Phycoerythrin Phytohämagglutinin positiv Sideward Scatter Standardabweichung Tabelle Transforming growth factor T- Helferzellen Toll-like-receptors Tumor necrosis factor Units, Einheiten Vascular adhesion molecule Einleitung 1 1. Einleitung Die Prävalenz der atopischen Erkrankungen Asthma bronchiale, atopische Dermatitis und allergische Rhinitis ist in den letzten Jahrzehnten signifikant angestiegen (Vollmer, Osborne et al. 1998). Insbesondere im Kindesalter ist eine starke Zunahme der Atopieprävalenz zu verzeichnen (Omran, Russell et al. 1996; Maziak, Behrens et al. 2003). Im Rahmen der International Study of Asthma and Allergies in Childhood (ISAAC) wurden mittels standardisierter Fragebögen weltweit die Prävalenzen atopischer Erkrankungen bei Schulkindern erhoben (ISAAC 1998). Für Westdeutschland ergab sich bei 12-15 jährigen Kindern eine Prävalenz des Asthma bronchiale von 13,1%, der allergischen Rhinitis von 14,7% und der atopischen Dermatitis von 7,3% (Duhme, Weiland et al. 1998). Die ISAACStudie zeigte sowohl eine signifikant größere Prävalenz atopischer Erkrankungen in West- im Vergleich zu Ostdeutschland als auch eine grosse Variabilität der Prävalenz atopischer Erkrankungen weltweit (Duhme, Weiland et al. 1998). Bis zu 20-fache Unterschiede wurden zwischen Regionen hoher und niedriger Atopieprävalenz festgestellt. Großbritannien, Australien, Neuseeland und Irland stellten die Länder mit der höchsten Atopieprävalenz dar. Innerhalb Europas besteht ein Ost-West-Gefälle mit signifikant niedrigeren Erkrankungsraten in Osteuropa (ISAAC 1998). Hinsichtlich der Ursachen für den Anstieg der Prävalenz atopischer Erkrankungen werden zahlreiche Einflussfaktoren diskutiert. In Anbetracht des starken Prävalenzanstiegs innerhalb der letzten Jahrzehnte, der weltweit grossen Variabilität der Prävalenz atopischer Erkrankungen (ISAAC 1998) sowie der signifikanten Prävalenzunterschiede zwischen Ostund Westeuropa (ISAAC 1998) sowie Ost- und Westdeutschland (Duhme, Weiland et al. 1998), werden insbesondere Umweltfaktoren bezüglich eines Einflusses auf die Atopieneigung untersucht. Diese schliessen Veränderungen in der Anzahl und Art frühkindlicher Infektionen (de Marco, Pattaro et al. 2004) beziehungsweise der kindlichen Exposition gegenüber mikrobiellen Strukturen (Braun-Fahrlander, Riedler et al. 2002), Veränderungen der gastrointestinalen Mikroflora (Kalliomaki, Salminen et al. 2001) und der Ernährung, wie beispielsweise der Aufnahme von Antioxidantien und Fettsäuren (Black and Sharpe 1997; Bodner, Godden et al. 1999; Devereux, Barker et al. 2002), mit ein. Hinsichtlich des Atopierisikos bei familiärer Atopieanamnese besteht bei Neonaten mit mütterlicher Atopieanamnese ein höheres Risiko für die Entwicklung einer Atopie in der Einleitung 2 frühen Kindheit, als bei Neonaten mit väterlicher atopischer Erkrankung (Litonjua, Carey et al. 1998). Als Ursachen für eine allergische Sensibilisierung des Feten werden maternale Antikörper, das intrauterine Zytokinmilieu und der transplazentare Transfer von Antigenen diskutiert (Jones, Miles et al. 1996; Warner, Jones et al. 1997; Litonjua, Carey et al. 1998). Neben den umweltbedingten Einflussfaktoren in der frühen Kindheit scheinen genetische Faktoren für die Atopieentwicklung von maßgeblicher Bedeutung zu sein (Donovan and Finn 1999). Das Verständnis immunologischer Zusammenhänge bei Neonaten und im frühen Kindesalter ist von zentraler Bedeutung, um neben den pathophysiologischen Vorgängen der Atopieentstehung auch prädisponierende Faktoren für die Genese atopischer Erkrankungen aufzeigen zu können. Die Kenntnis dieser immunologischen Zusammenhänge könnte langfristig für die Entwicklung neuer Ansätze einer ursachenbezogenen Atopieprävention von Bedeutung sein. 1.1. Immunologische Grundlagen der Atopieentstehung In der Pathogenese atopischer Erkrankungen erfolgt eine komplexe Interaktion zwischen TZellen, B-Zellen und antigenpräsentierenden Zellen (APC). Das Resultat dieser Interaktion stellt die Entwicklung einer Entzündungsreaktion dar, die mit Zytokinfreisetzung, IgESekretion und bronchialer Hyperreagibilität einhergeht. Einleitung Antigenpräsentierende Zelle Allergen Viren, Bakterien Naive T-Zelle TH1-Zelle TH2-Zelle IL-5 3 IL-4 IL-13 B-Zelle Y Y FY F F Y Y IgE Reg.T-Zelle IL-10 TGF-β F F IL-2 IL-12 IFN-γ Eosinophiler Mastzelle Basophiler Allergische Reaktion Zytotoxische Immunantwort Abb. 1.1.: Pathopysiologie atopischer Erkrankungen 1.1.1. Antigenpräsentierende Zellen Bei der Induktion einer Immunantwort erfolgt zunächst die Darbietung des Fremdantigens durch antigenpräsentierende Zellen (Steinman 1991; Holt and Jones 2000). Potente antigenpräsentierende Zellen (APC) stellen dendritische Zellen, Makrophagen, LangerhansZellen und Kupffer-Zellen dar (Trombetta and Mellman 2005). Nach Phagozytose extrazellulärer Antigene erfolgt die proteolytische Spaltung der aufgenommenen Antigene in lineare Peptide im Phagolysosom (Turley, Inaba et al. 2000). Durch das endoplasmatische Retikulum werden MHC II-Moleküle generiert, die in MHC II-loading Kompartimente freigesetzt werden und bis zu ihrer Beladung mit Peptidfragmenten durch eine invariante Kette blockiert sind (Ceman and Sant 1995). Nach Abspaltung der invarianten Kette wird diese durch das antigene Peptid ersetzt (Stebbins, Peterson et al. 1996). Das mit dem Einleitung Antigenfragment versehene MHC II-Molekül wird auf der 4 Zelloberfläche der antigenpräsentierenden Zelle exprimiert. MHC Moleküle der Klasse II bestehen aus einer α- und einer β-Kette. Beide Ketten weisen einen zytoplasmatischen Anteil, eine transmembranäre Domäne und zwei extrazelluläre Domänen auf. Die extrazellulären Domänen α1 und β1 bilden eine Vertiefung, über die die Bindung des antigenen Peptids erfolgt (Chaplin 2003). Die β2-Domäne des MHC IIKomplexes interagiert mit CD4-Molekülen, wodurch die Antigenerkennung von Antigenen, die durch MHC II-Moleküle präsentiert werden, auf CD4+ Zellen beschränkt wird (Konig, Huang et al. 1992). MHC II-Moleküle werden auf B-Zellen, Dendritischen Zellen, Monozyten und Makrophagen exprimiert (Chaplin 2003). Dendritische Zellen sind antigenpräsentierende Zellen, die für die Initiation einer Immunantwort von zentraler Bedeutung sind (Langrish, Buddle et al. 2002). Nach Vieira et al. können zwei Subpopulationen dendritischer Zellen unterschieden werden. Naive dendritische Zellen differenzieren in Anwesenheit von IFN-γ zu dendritischen Zellen Typ1 und setzen bei Kontakt mit naiven T-Zellen IL-12(p70) frei, das die Induktion einer Th1-Immunantwort vermittelt. PGE2 und IL-10 induzieren demgegenüber die Reifung naiver DCs zu dendritischen Zellen Typ2, welche die Differenzierung naiver T-Zellen zu Th2-Zellen stimulieren. Dementsprechend können in Abhängigkeit von dem umgebenden Zytokinmilieu naive dendritische Zellen sowohl zu Th1- als auch zu Th2-induzierenden dendritischen Zellen heranreifen (Vieira, de Jong et al. 2000). Durch Langenkamp et al. konnte aufgezeigt werden, dass hinsichtlich der Induktion verschiedener Immunantworten durch DCs die Kinetik der Reifung dendritischer Zellen von Bedeutung ist. Nach LPS-Stimulation weisen aktivierte dendritische Zellen in den ersten Stunden eine ausgeprägte IL-12-Sekretion auf, einhergehend mit einer starken Th1-induzierenden Wirkung, wohingegen Zellen des selben Stimulationsansatzes zu einem späteren Zeitpunkt einen überwiegend Th2-induzierenden Effekt aufzeigen (Langenkamp, Messi et al. 2000) Einleitung 5 1.1.2. T-Lymphozyten T-Zellen sind durch die Expression des T-Zell-Rezeptors gekennzeichnet (Chaplin 2003). Dieser vermittelt die Erkennung von Peptidantigenen, die über MHC-Komplexe der Klasse I oder II dargeboten werden. Die antigenspezifischen α- und β-Ketten des T-Zell-Rezeptors sind mit invarianten Ketten assoziiert, die als CD3 bezeichnet werden. Durch CD3 wird die Signaltransduktion nach Bindung des T-Zell-Rezeptors an einen Antigen-MHC-Komplex vermittelt (Chaplin 2003). Für die vollständige T-Zellaktivierung ist neben der Bindung des T-Zell-Rezeptors an den Antigen-MHC-Komplex die Interaktion kostimulatorischer Moleküle wie CD28 bzw. CD154 (CD40L) auf der T-Zelloberfläche und CD80/CD86 (Synonym B7.1/B7.2) bzw. CD40 auf der Oberfläche antigenpräsentierender Zellen von Bedeutung (Lenschow, Walunas et al. 1996; Van Kooten and Banchereau 1996). Anhand ihrer Effektorfunktionen werden verschiedene T-Zell-Subpopulationen unterschieden: CD8+ T-Zellen vermitteln einen zytotoxischen Effekt gegenüber Zellen, die mit intrazellulären Bakterien oder Viren infiziert sind oder infolge von Mutationen veränderte Proteine auf der Oberfläche präsentieren (Mescher 1995). CD4+ T-Zellen regulieren als sogenannte T-Helfer-Zellen zelluläre und humorale Immunreaktionen (Williams, Chang et al. 1991). Dabei weisen CD4+ T-Zellen unterschiedliche Differenzierungen auf, die jeweils durch eine charakteristische Zytokinsekretion gekennzeichnet sind: • Th0-Zellen: Nach antigenspezifischer Stimulation naiver CD4+ T-Zellen differenzieren diese zu Th0-Zellen, welche insbesondere durch die Freisetzung von IL-2 gekennzeichnet sind (Chaplin 2003). Darüber hinaus sezernieren Th0-Zellen sowohl Th1- als auch Th2-spezifische Zytokine wie Interferon-γ (IFN-γ), Lymphotoxin (LT), IL-4, IL-5, IL-6, IL-9, IL-10, IL-3, GM-CSF und TNF-α (Mosmann and Sad 1996). Nach Stimulation differenzieren Th0-Zellen in Abhängigkeit von dem umgebenden Zytokinmilieu zu Th1- oder Th2-Zellen (Mosmann and Coffman 1989). • Th1-Zellen: Th1-Zellen führen zu einer Aktivierung von Makrophagen und sind dadurch an der intrazellulären Erregerabtötung beteiligt (Janeway, C.A. et al. 1999). Zudem sind Th1-spezifische Zytokine bei der Induktion zellvermittelter Entzündungsreaktionen von zentraler Bedeutung (Mosmann and Coffman Einleitung 6 1989). Die Immunreaktion vom verzögerten Typ wird durch Th1-Zellen vermittelt und ist durch eine erhöhte Expression von IFN-γ gekennzeichnet (Yamamura, Uyemura et al. 1991; Tsicopoulos, Hamid et al. 1992). Th1-Zellen sezernieren unter anderem die Zytokine IL-2, IFN-γ, LT, IL-3, TNF-α und GM-CSF (Mosmann and Sad 1996). • Th2-Zellen: Th2-Zellen führen zu einer Aktivierung von B-Zellen und stimulieren deren Differenzierung zu Antikörper-produzierenden Zellen (Janeway, C.A. et al. 1999). Th2-Lymphozyten sind unter anderem durch die Sekretion von IL-4, IL5, IL-6, IL-9, IL-10 und IL-13 sowie IL-3, TNF-α und GM-CSF gekennzeichnet (Mosmann and Sad 1996; Wills-Karp, Luyimbazi et al. 1998). IL-4 und IL-13 induzieren im Rahmen der Immunglobulinsynthese den Immunglobulinklassenwechsel der B-Zelle zu IgE (Mosmann and Coffman 1989; Zhang, Clark et al. 1991). Th2-Lymphozyten sind daher bei den atopischen Erkrankungen Asthma bronchiale, allergische Rhinitis und atopische Dermatitis von zentraler Bedeutung (Wierenga, Snoek et al. 1990; Robinson, Hamid et al. 1992). Die für die Th1- beziehungsweise Th2-Immunantwort charakteristischen Zytokine führen zu einer Inhibition der Ausreifung und Funktion des jeweils anderen Phänotyps. IFN-γ hemmt die Proliferation von Th2-Zellen sowie die IgE-Synthese humaner PBMC in vitro (Pene, Rousset et al. 1988; Fiorentino, Bond et al. 1989). IL-4 induziert eine verminderte Expression der ß2-Untereinheit des IL-12-Rezeptors auf Th2-Zellen und wirkt damit der Th1induzierenden Wirkung von IL-12 entgegen (Szabo, Dighe et al. 1997). Demgegenüber stimuliert IL-4 die Differenzierung naiver T-Zellen zu Th2-Zellen, während IFN-γ, IL-12 und TGF-β die Entwicklung einer Th1-Immunantwort induzieren (Kamogawa, Minasi et al. 1993; Mosmann and Sad 1996; Szabo, Dighe et al. 1997). Neben den Th1- und Th2-Zellen existieren weitere, spezifische T-Zell-Populationen wie zum Beispiel Th3-Zellen und regulatorische T-Zellen (CD4+ CD25+), denen eine immunmodulatorische Funktion in der Th1-/ Th2-Balance zukommt. Th3-Zellen sezernieren TGF-β (Fukaura, Kent et al. 1996). Regulatorische T-Zellen sind unter anderem durch die Freisetzung von IL-10 und TGF-β (Chen, Kuchroo et al. 1994; Kronenberg and Rudensky 2005) gekennzeichnet. Einleitung 7 1.1.3. B-Lymphozyten B-Zellen sind durch die Synthese von Immunglobulinen (Ig) gekennzeichnet (Chaplin 2003). Immunglobuline setzen sich aus zwei identischen schweren Ketten und zwei identischen leichten Ketten zusammen (Chaplin 2003). Die aminoterminalen Enden der schweren und leichten Ketten stellen variable Regionen dar, an denen die Antigenbindung erfolgt (Chaplin 2003). Jedes Immunglobulin weist zwei identische antigenbindende Regionen auf. Das carboxyterminle Ende der leichten Ketten und der schweren Ketten ist innerhalb der Immunglobulin-Subklassen konstant. Die konstanten Regionen der schweren Ketten bilden die Fc-Domäne des Immunglobulins, über die die Bindung von Antikörpern an Fc-Rezeptoren vermittelt wird (Chaplin 2003). Naive B-Zellen exprimieren IgM und IgD auf der Zelloberfläche. Nach der Antigenbindung an die auf der Zelloberfläche exprimierten Immunglobuline, erfolgt die Internalisierung und Prozessierung des Antigens, sowie die nachfolgende Präsentation der Antigenfragmente über MHC II-Komplexe auf der B-Zelloberfläche. Antigenaufnahme durch naive B-Zellen resultiert in einer gesteigerten Expression von MHC II und der Kostimulatoren CD80 und CD86. Aktivierte T-Helfer-Zellen vermitteln über die Interaktion von CD40-Ligand auf der T-Zelloberfläche und CD40 auf der Oberfläche der B-Zellen eine B-Zellaktivierung. Der Immunglobulinklassenwechsel wird durch Zytokine, die unter anderem von T-Helfer-Zellen freigesetzt werden, vermittelt. IL-4 und IL-13 induzieren den Klassenwechsel der Immunglobuline zu IgE, IL-10 stimuliert die Expression von IgG1 und IgG3 und IFN-γ induziert die Expression von IgG2. Durch TGF-β wird der Immunglobulinklassenwechsel zu IgA vermittelt (Chaplin 2003). Einleitung 8 1.1.4. Mastzellen Basophile und Mastzellen stellen die wichtigsten Effektorzellen im Rahmen der allergischen Entzündungsreaktion dar und sind durch die Expression hochaffiner IgE-Rezeptoren (FcεRI) auf der Zelloberfläche gekennzeichnet (Kinet 1989; Beaven and Metzger 1993; Costa, Weller et al. 1997). Die Antigenbindung an mastzellständige Immunglobuline der Klasse IgE führt zur Degranulation der Mastzellen mit Freisetzung bzw. de-novo Synthese von zahlreichen Entzündungsmediatoren. Hierzu zählen Histamin, Tryptase und Serotonin sowie Lipidmediatoren (Leukotriene, PAF) und Zytokine wie IL-4, IL-5, IL-6, IL-13 (Paul, Seder et al. 1993; Costa, Weller et al. 1997; Chaplin 2003). 1.2. Zytokine der Th1/Th2-Immunantwort 1.2.1. Interleukin-4 Interleukin-4 ist ein monomeres Proteinmolekül, welches als Precursor-Molekül synthetisiert wird (Kruse, Lehrnbecher et al. 1991). Der humane IL-4-Rezeptor setzt sich aus einer IL-4spezifischen α-Kette und der γ-Kette des IL-2 Rezeptors zusammen (Kondo, Takeshita et al. 1993; Galizzi, Zuber et al. 1990). Durch das Vorliegen der IL-2Rγ-Kette wird die Affinität der Bindung von IL-4 an den IL-4Rα signifikant erhöht (Russell, Keegan et al. 1993). IL-4 wird vornehmlich durch T-Lymphozyten, Mastzellen sowie basophile- und eosinophile Granulozyten freigesetzt. Insbesondere CD4+ T-Gedächtniszellen setzen große Mengen an IL4 frei (DeKruyff, Fang et al. 1995), wohingegen CD8+ T-Zellen nur in geringem Umfang IL-4 sezernieren (Seder, Boulay et al. 1992). Die IL-4-Freisetzung durch T-Zellen wird über den T-Zell-Rezeptor vermittelt. Die Freisetzung von IL-4 durch Mastzellen wird durch die Quervernetzung hochaffiner Fc-Rezeptoren induziert (Tunon de Lara, Okayama et al. 1994). Die Wirkung von IL-4 besteht in einer Induktion der Expression von Oberflächen-IgM, CD23, CD40 und MHC II auf ruhenden B-Zellen (Shields, Armitage et al. 1989). Zudem übt IL-4 eine chemotaktische Wirkung auf B-Zellen aus (Komai-Koma, Liew et al. 1995). IL-4 wirkt kostimulatorisch auf die antigenvermittelte B-Zellproliferation (Llorente, Mitjavila et al. Einleitung 9 1990). In Anwesenheit mononukleärer Zellen oder CD4+ T-Zellen kann IL-4 die Sekretion von IgE durch B-Zellen induzieren. Der Immunglobulinklassenwechsel von IgM zu IgG1 und IgE wird ebenfalls durch IL-4 stimuliert (Schultz, Rothman et al. 1992). IL-4 stimuliert die Proliferation von CD8+ und CD4+ T-Zellen (Mitchell, Davis et al. 1989). Die zytotoxische Aktivität von CD8+ T-Zellen, NK- und monozytären Zellen wird durch IL-4 inhibiert. Daneben führt IL-4 zu einer Reduktion der Zytokinexpression von NK- und monozytären Zellen (Hayakawa, Salmeron et al. 1991; Yu, Kirken et al. 1998). Im Gegensatz zu IL-4 wird die zytotoxische Wirkung von T-Lymphozyten durch die p40Untereinheit von IL-12 verstärkt (Abdi and Herrmann 1997). Demgegenüber supprimiert IL-4 die Expression von IL-12Rβ auf der T-Zelloberfläche (Szabo, Dighe et al. 1997). IL-4 führt zu einer Aktivierung von Mastzellen und eosinophilen Granulozyten (Romagnani 1994). Im Rahmen des Asthma bronchiale, der allergischen Rhinitis und der atopischen Dermatitis wurde eine erhöhte IL-4-Sekretion durch T-Lymphozyten festgestellt (Corrigan 1995). 1.2.2. Interleukin-13 Ist ein monomeres Protein von 112 Aminosäuren, welches als Precursor-Molekül mit 132 Aminosäuren synthetisiert wird (Minty, Chalon et al. 1993). Der humane IL-13-Rezeptor ist als Heterodimer aus der IL-4Rα-Kette sowie der IL-13-spezifischen IL-13Rα1-Kette aufgebaut (Callard, Matthews et al. 1996; Wills-Karp and Chiaramonte 2003). Für IL-13 konnte keine Bindung an den IL-4Rα nachgewiesen werden (Zurawski, Vega et al. 1993). IL4Rα-Antikörper inhibieren jedoch die Wirkung von IL-13 (Lin, Migone et al. 1995). IL-4Rα scheint die Affinität von IL-13 gegenüber dem IL-13R zu erhöhen (Hilton, Zhang et al. 1996) und für die Signaltransduktion von entscheidender Bedeutung zu sein (Keegan, Johnston et al. 1995). Über die IL-4Rα-Kette kann zudem eine Bindung von IL-4 an den IL-13-Rezeptor erfolgen (de Vries 1998). Die Ähnlichkeit des Effektes von IL-4 und IL-13 könnte auf der gemeinsamen Rezeptorkomponente IL-4Rα basieren. Humanes IL-13 wird unter anderem durch aktivierte CD4+- und CD8+ T-Zellen freigesetzt (de Waal Malefyt, Abrams et al. 1995; de Vries 1996). Die IL-13-Sekretion durch CD4+ T-Zellen erfolgt durch T-Zellen der Differenzierung Th0, Th1 oder Th2 (de Vries and Zurawski 1995). IL-13 wird, im Gegensatz zu IL-4, durch naive CD45RA+ T-Zellen produziert, was auf die Einleitung 10 Bedeutung von IL-13 für die Initiation der IgE-Synthese hindeuten könnte (de Vries 1998). Die IL-13-Synthese und -Sekretion durch humane B-Zellen konnte mit Hilfe EBVtransformierter B-Zellen nachgewiesen werden (de Waal Malefyt, Abrams et al. 1995). Basophile Granulozyten und Mastzellen produzieren IL-13 nach IgE-Rezeptor-vermittelter Zellaktivierung (Burd, Thompson et al. 1995). Eosinophile Granulozyten setzen IL-13 nach Stimulation mit GM-CSF oder IL-5 frei (Schmid-Grendelmeier, Altznauer et al. 2002). T-Zellen exprimieren keinen IL-13R, so dass IL-13 im Gegensatz zu IL-4 keine Th2induzierende Wirkung auf T-Zellen zukommt (de Waal Malefyt, Abrams et al. 1995; Sornasse, Larenas et al. 1996; de Vries 1998). IL-13 stimuliert die Proliferation und Differenzierung humaner B-Zellen (Defrance, Carayon et al. 1994). IL-13 induziert die Expression von CD23, CD71, CD72, IgM und MHC II auf der B-Zelloberfläche (Punnonen, Aversa et al. 1993; Defrance, Carayon et al. 1994; de Waal Malefyt, Abrams et al. 1995; de Vries 1996). Die IgE-Synthese sowie der Immunglobulinklassenwechsel zu IgG4 und IgE können durch IL-13 induziert werden (Punnonen, Aversa et al. 1993; Punnonen and de Vries 1994; de Waal Malefyt, Abrams et al. 1995; de Vries 1996). Auch für unreife, humane, fetale B-Zellen konnte die Synthese von IgM, IgG4 und IgE nach Stimulation mit IL-13 und aktivierten CD4+ T-Zellen nachgewiesen werden (Punnonen and de Vries 1994). Somit kommt IL-13 eine dem Effekt von IL-4 vergleichbare, in der Intensität jedoch geringer ausgeprägte Wirkung auf B-Zellen zu. IL-13 inhibiert die Sekretion proinflammatorischer Zytokine sowie die zytotoxische Aktivität von Monozyten, Makrophagen und NK-Zellen (Hayakawa, Salmeron et al. 1991; Yu, Kirken et al. 1998). Diesbezüglich kommt IL-13 eine antagonistische Wirkung gegenüber IL-10 und IFN-γ zu (Cosentino, Soprana et al. 1995). IL-13 induziert die Expression von MHC II, CD80 und CD86 auf der Monozytenoberfläche, einhergehend mit einer gesteigerten Kapazität der Aktivierung antigenspezifischer T-Zellen (Zurawski and de Vries 1994). Des weiteren wird durch IL-13 die Expression des niedrig affinen IgE-Rezeptors CD23 induziert, welcher durch die Darbietung von Antigen-IgE-Komplexen eine allergenspezifische T-Zellaktivierung vermittelt (de Vries 1998). In Abhängigkeit von IL-5 und Eotaxin hat IL-13 eine chemotaktische Wirkung und einen aktivierenden Effekt auf eosinophile Granulozyten (Pope, Brandt et al. 2001). Darüber hinaus induziert IL-13 über die Stimulation der endothelialen Expression von VCAM-1 die Monozyten- und Eosinophilenadhäsion sowie die nachfolgende Extravasation (Bochner, Klunk et al. 1995). IL-13 reguliert die Freisetzung von Faktoren, die die Kontraktion der glatten Muskulatur der Atemwege beeinflussen. Durch die Inhibition der NO-Synthetase Einleitung 11 erfolgt eine Reduktion der Synthese des bronchodilatatorisch wirksamen NO durch Makrophagen (Doherty, Kastelein et al. 1993). Die IL-13-vermittelte Induktion der Freisetzung von Komplementfaktor C3 durch bronchiale Epithelzellen resultiert nach Spaltung zu C3a ebenfalls in einer Kontraktion der glatten Muskulatur der Atemwege (Bautsch, Hoymann et al. 2000; Humbles, Lu et al. 2000; Wills-Karp 2004). Patienten mit Asthma bronchiale oder allergischer Rhinitis weisen gegenüber Nichtatopikern eine gesteigerten IL-13-Sekretion aus mittels bronchoalveolärer Lavage gewonnenen mononukleären Zellen auf. Allergenexposition führt bei diesen Patienten zu einer signifikanten Induktion der IL-13-Freisetzung (Huang, Xiao et al. 1995). Durch Wong et al. wurde zudem eine erhöhte plasmale IL-13-Konzentration bei Asthmatikern gegenüber der nichtatopischen Kontrollgruppe aufgewiesen (Wong, Ho et al. 2001). 1.2.3. Interferon-γ Interferon-γ ist ein homodimeres Protein, welches als Precursor-Protein synthetisiert wird (Ealick, Cook et al. 1991). Der IFN-γ-Rezeptor ist aus je einer α- und einer β-Kette (IFN-γRα und IFN-γRβ) aufgebaut (Soh, Donnelly et al. 1994). IFN-γ wird vornehmlich durch T-Zellen und NK-Zellen sythetisiert. Antigenspezifische CD8+ zytotoxische T-Zellen setzten nach Exposition gegenüber viralen Antigenen große Mengen IFN-γ frei (Celis, Miller et al. 1986). IFN-γ stimuliert die Ausbildung einer Th1-Immunantwort, während die Proliferation von Th2Zellen inhibiert wird. Th1-Zellen sind durch die Sekretion von IFN-γ, IL-2, IL-3 und TNF-β gekennzeichnet und führen zu einer Aktivierung von Makrophagen (Janeway, C.A. et al. 1999; Nathan and Tsunawaki 1986; Mosmann, Cherwinski et al. 1986). IFN-γ besitzt eine antivirale und antiparasitäre Wirkung. Makrophagen werden durch IFN-γ aktiviert. Diese Aktivierung resultiert in einer Stimulation der Synthese reaktiver Sauerstoffmoleküle und Wasserstoffperoxid, was eine Steigerung der Fähigkeit zur intrazellulären Erregerabtötung von Makrophagen bewirkt (Nathan and Tsunawaki 1986). Weiterhin induziert IFN-γ die NO-Synthetase in Makrophagen, was einen Schlüsselmechanismus der IFN-γ-gesteuerten Inhibition der Virusreplikation darstellen könnte (Karupiah, Xie et al. 1993). Die Induktion der NO-Synthetase könnte daher eine Erklärung für die antivirale, antibakterielle und antiparasitäre Wirkung von IFN-γ darstellen Einleitung 12 (Karupiah, Xie et al. 1993). Die zytotoxische Aktivität von NK-Zellen wird durch IFN-γ, wie auch durch IFN-α und -β, stimuliert. IFN-γ kommt zudem eine regulatorische Wirkung auf die Immunglobulinsynthese zu. Während die Expression von IgG2 durch IFN-γ stimuliert wird, erfolgt eine Hemmung der Synthese von IgG1, IgG2b, IgG3 und IgE (Snapper and Paul 1987). 1.2.4. Interleukin-18 IL-18 ist ein monomeres 18 kDa-Protein, welches als 24 kDa-Precursor-Molekül synthetisiert wird. Die enzymatische Spaltung des Pro-IL-18 zu IL-18 erfolgt vornehmlich durch die intrazelluläre Protease Caspase-1, auch bezeichnet als IL-1β-converting-enzyme (Gu, Kuida et al. 1997; Fantuzzi and Dinarello 1999). NO führt zu einer Inhibition der Caspase-1 und könnte dementsprechend zu einer Protektion vor IL-18- oder IL-1β-vermittelter entzündlicher Gewebsschädigung beitragen (Kim, Talanian et al. 1998). IL-18 zeigt hinsichtlich der Aminosäuresequenz eine Homologie von 15% beziehungsweise 18% mit IL-1α beziehungsweise IL-1β. Aufgrund der Ähnlichkeit der dreidimensionalen Struktur zwischen IL-1β und IL-18 und der daraus resultierenden Rezeptoraffinität gegenüber dem zur IL-1RFamilie gehörigen IL-18R, ist IL-18 als Mitglied der IL-1-Familie zu betrachten (Dinarello 1999). Der IL-18-Rezeptor ist aus zwei Komponenten aufgebaut. Die IL-18-Bindung erfolgt über die α-Untereinheit des IL-18R (IL-1 receptor-related protein, IL-1Rrp) während die Signaltransduktion durch die β-Untereinheit des IL-18R (IL-1 receptor accessory-protein like protein, AcPL) vermittelt wird (Torigoe, Ushio et al. 1997; Born, Thomassen et al. 1998). IL-12 induziert die Expression von IL-18Rα auf naiven T-Zellen, Th1-Zellen und B-Zellen. Demgegenüber stimuliert IL-18 die Expression von IL-12Rβ (Tomura, Maruo et al. 1998; Yoshimoto, Takeda et al. 1998; Chang, Segal et al. 2000). Auf diese Weise wirken IL-18 und IL-12 synergistisch auf die IFN-γ-Synthese von T- und NK-Zellen. Humanes IL-18 binding protein (IL-18 BP) stellt ein lösliches Protein dar, welches durch die Bindung von IL-18 dessen Rezeptorbindung verhindert und somit die Wirkung von freiem IL18 reguliert (Novick, Kim et al. 1999). IL-18 wird durch ein weites Spektrum unterschiedlicher Zellen exprimiert, das unter anderem Makrophagen (Shibata, Foster et al. 1998), Kupffer-Zellen, T-Zellen, B-Zellen, dendritische Zellen (Stoll, Jonuleit et al. 1998), Osteoblasten (Udagawa, Horwood et al. 1997), Einleitung 13 Keratinozyten (Stoll, Muller et al. 1997), Epithelien der Atemwege (Cameron, Taha et al. 1999) und Mikrogliazellen (Prinz and Hanisch 1999) einschließt. Die Wirkung von IL-18 wurde ursprünglich vorwiegend im Zusammenhang mit IL-12 untersucht, wonach IL-18 die Bezeichnung als IFN-γ induzierender Faktor (IGIF) zukam. IL18 induziert die Freisetzung von IFN-γ durch Th1-Zellen, nicht polarisierte T-Zellen, BZellen, NK-Zellen und dendritische Zellen. Für diesen Effekt liegt ein Synergismus mit IL-12 vor (Yoshimoto, Okamura et al. 1997; Okamura, Kashiwamura et al. 1998; Okamura, Tsutsui et al. 1998; Yoshimoto, Takeda et al. 1998). Während die Freisetzung von IFN-γ durch TLymphozyten für gewöhnlich von einer T-Zell-Rezeptor-vermittelten T-Zell-Aktivierung abhängig ist, führen IL-18 und IL-12 synergistisch zu einer T-Zell-Rezeptor unabhängigen Induktion der IFN-γ-Sekretion (Ahn, Maruo et al. 1997; Yoshimoto, Okamura et al. 1997; Yoshimoto, Takeda et al. 1998; Yang, Murphy et al. 1999; Tominaga, Yoshimoto et al. 2000). Diese synergistische Wirkung von IL-18 und IL-12 ist unter anderem auf die Induktion des IL-18Rα auf CD4+ T-Lymphozyten nach Stimulation mit IL-12 zurückzuführen. Die Ligation des IL-18Rα auf T-Zellen führt zu einer vermehrten Sekretion von IFN-γ (Kunikata, Torigoe et al. 1998; Tominaga, Yoshimoto et al. 2000). Obgleich IL-18 eine Stimulation der IFN-γFreisetzung hervorruft ist für IL-18 alleine, im Gegensatz zu IL-12, keine Th1-induzierende Wirkung nachweisbar (Robinson, Shibuya et al. 1997; Okamura, Kashiwamura et al. 1998). Während die Proliferation antigenstimulierter Th1-Zellen durch IL-18 gesteigert wird (Kohno, Kataoka et al. 1997), hat IL-18 auf Th2-Zellen keinen Effekt (Yoshimoto, Takeda et al. 1998). Naive CD45RA+ T-Lymphozyten aus Nabelschnurblut exprimieren den IL-18Rα (Bofill, Almirall et al. 2004). Während der Differenzierung von naiven T-Zellen zu Th1-Zellen erfolgt eine Reduktion der IL-18R-Expression, die zu einer reduzierten Ansprechbarkeit auf IL-18 führt (Yoshimoto, Takeda et al. 1998). Auf der Oberfläche von Th1-Zellen wird der IL-18R demnach weiterhin exprimiert, wohingegen auf der Th2-Zelloberfläche eine vollständige Herunterregulation des IL-18R erfolgt (Xu, Chan et al. 1998). Für IL-18 ist daher keine direkte Wirkung auf Th2-Zellen nachweisbar (Yoshimoto, Takeda et al. 1998). Auf zytotoxischen T-Lymphozyten induziert IL-18 die Expression des Fas-Liganden und steigert auf diese Weise die Fas-vermittelte zytotoxische Aktivität (Dao, Ohashi et al. 1996; Dinarello 1997; Dinarello 1998). IL-18 stimuliert die zytotoxische Aktivität von NK-Zellen durch Induktion der Perforinvermittelten Zytotoxizität und Stimulation der Fas-Ligand-Expression (Tsutsui, Nakanishi et al. 1996; Hyodo, Matsui et al. 1999). NK-Zellen zeigen eine Expression des IL-18R und des IL-12Rβ2. IL-18 und IL-12 führen synergistisch zu einer Induktion der IFN-γ-Sekretion durch Einleitung 14 NK-Zellen (Hunter, Timans et al. 1997). Die Bedeutung von IL-18 und IL-12 für die NKZell-Aktivität zeigt sich besonders in knock-out Mäusen für diese beiden Zytokine, welche eine signifikant niedrigere NK-Zell-Aktivität und IFN-γ-Freisetzung aufweisen (Takeda, Tsutsui et al. 1998). Dementsprechend sind IL-18 und IL-12 für die Entwicklung einer suffizienten NK-Zell-Aktivität von großer Bedeutung (Takeda, Tsutsui et al. 1998). B-Zellen sezernieren IgG1 und IgE nach Stimulation mit anti-CD40 und IL-4. Die Stimulation aktivierter muriner B-Zellen mit IL-12 und IL-18 resultiert in einer Induktion der IFN-γFreisetzung und IgG2-Produktion bei gleichzeitiger Inhibition der IL-4-vermittelten IgE- und IgG1-Synthese (Yoshimoto, Okamura et al. 1997). Basophile Granulozyten sezernieren nach Stimulation mit IL-3 und IL-18 die Zytokine IL-4und IL-13 (Yoshimoto, Tsutsui et al. 1999). Die Stimulation basophiler Granulozyten mit IL12 und IL-18 führt demgegenüber zu einer Induktion der IFN-γ-Freisetzung, welche die IL-4und IL-13-Sekretion basophiler Granulozyten inhibiert (Yoshimoto, Okamura et al. 1997; Yoshimoto, Tsutsui et al. 1999). Makrophagen sezernieren nach LPS-Stimulation IL-12 und IL-18, welche zu einer Induktion der IFN-γ-Freisetzung durch T-Zellen, B-Zellen und NK-Zellen führt (Yoshimoto, Nagai et al. 1998). Dadurch wird die Entstehung einer Th2-Immunreaktion supprimiert. Neben der Th1-induzierenden Wirkung kommt IL-18 unter bestimmten Stimulationsbedingungen auch eine Th2-induzierende Wirkung zu, welche im folgenden erläutert werden soll. Die Stimulation naiver CD4+ T-Zellen mit IL-2 und IL-18 bei gleichzeitiger T-ZellRezeptoraktivierung durch anti-CD3 resultiert in einer Induktion der IL-4-Expression. AntiIL-4-Antikörper führen zu einer vollständigen Inhibition der IL-18-vermittelten IL-4Freisetzung bei gleichzeitiger Induktion der IFN-γ-Sekretion. Dementsprechend führt IL-18 zu einer IL-4-abhängigen Th2-Induktion (Yoshimoto, Mizutani et al. 2000). Naive CD4+ TZellen exprimieren nach Stimulation mit IL-2 und IL-18 CD40L und induzieren die IgESekretion durch B-Zellen (Yoshimoto, Mizutani et al. 2000). Basophile Granulozyten und Mastzellen exprimieren nach Inkubation mit IL-3 den IL-18Rα. Nach Stimulation mit IL-3 und IL-18 setzen basophile Granulozyten große Mengen IL-4 und IL-13 frei, wohingegen Mastzellen bei gleicher Stimulation lediglich geringe Mengen IL-13 sezernieren. IL-12 und IL-18 führen über die Induktion von IFN-γ zu einer Inhibition der Sekretion von IL-4 und IL-13 durch basophile Granulozyten (Yoshimoto, Tsutsui et al. 1999). Histamin, das durch Mastzellen und basophile Granulozyten sezerniert wird, führt zu einer Einleitung 15 Stimulation der IL-18-Expression durch PBMC (Kohka, Nishibori et al. 2000). IL-18 und IL3 stimulieren zudem die Freisetzung von Histamin durch basophile Granulozyten und Mastzellen (Yoshimoto, Tsutsui et al. 1999). Dieser Zusammenhang könnte auf das Vorliegen eines Feedback Mechanismus zwischen IL-18 und Histamin hinweisen. In NK- und T-Zellen führt IL-18 in Kombination mit IL-2 zur Sekretion von IL-13. Die NKund T-Zellen IFN-γ-defizienter Mäuse weisen im Vergleich zu Kontrollmäusen eine signifikant höhere IL-13-Synthese nach Stimulation mit IL-18 und IL-2 auf (Hoshino, Wiltrout et al. 1999). Dies weist auf eine Regulation der IL-18- und IL-2-vermittelten IL-13Sekretion durch IFN-γ hin (Hoshino, Wiltrout et al. 1999). IL-18 induziert zudem die IgE-Produktion durch Induktion der Freisetzung von IL-4 und IL13 sowie Steigerung der CD40 Ligand-Expression auf CD4+ Zellen (Hoshino, Yagita et al. 2000; Yoshimoto, Mizutani et al. 2000). Die gesteigerte IgE-Sekretion nach IL-18Stimulation ist von der Anwesenheit von CD4+ Zellen abhängig und kann durch anti-CD4Antikörper inhibiert werden (Hoshino, Yagita et al. 2000; Yoshimoto, Mizutani et al. 2000). IL-4-defiziente BALB/c Mäuse weisen nach IL-18-Stimulation keine IgE-Sekretion auf. Hingegen resultiert die Inhibition von IL-13 durch löslichen IL-13-Rezeptor (sIL-13Rα2-Fc) in einer unveränderten IgE-Freisetzung. Nach diesen Ergebnissen sind CD4+ T-Zellen und IL4 für die IL-18-vermittelte Induktion der IgE-Expression essentiell (Yoshimoto, Mizutani et al. 2000). Zusammenfassend zeigen die bisher dargestellten Ergebnisse, dass IL-18 in Abhängigkeit des umgebenden Zytokinmilieus eine Th2-induzierenden Wirkung aufweist. Demnach könnte IL18 eine Bedeutung im Rahmen allergischer Reaktionen zukommen. Epithelzellen der Atemwege (Cameron, Taha et al. 1999) und Keratinozyten (Stoll, Muller et al. 1997), die im Rahmen des Asthma bronchiale und der atopischen Dermatitis von zentraler Bedeutung sind, exprimieren IL-18. Die Initiation einer allergischen Entzündungsreaktion könnte durch Induktion von Caspase-1 mit einer gesteigerten Sekretion von IL-18 und einer nachfolgenden IgE-unabhängigen Stimulation der IL-4- und IL-13-Freisetzung in Atemwegen oder Haut einhergehen (Yoshimoto, Mizutani et al. 2000). Durch Tanaka et al. wurde bei Patienten mit akutem Asthma bronchiale eine erhöhte Serum IL-18-Konzentration gegenüber der gesunden Kontrollgruppe nachgewiesen. Nach intravenöser Steroidtherapie konnte bei Patienten mit akutem Asthma bronchiale neben der Besserung der Lungenfunktion ein signifikanter Abfall der Serum-IL-18-Konzentration aufgezeigt werden (Tanaka, Miyazaki et al. 2001). Patienten mit atopischer Dermatitis weisen gegenüber der Kontrollgruppe ebenfalls erhöhte Serum-IL-18-Konzentrationen auf. Die Einleitung 16 Serum-IL-18-Konzentration korreliert hierbei mit der Schwere der Erkrankung und der Eosinophilenzahl im peripheren Blut (Yoshizawa, Nomaguchi et al. 2002). Die in vitro IL-18Sekretion durch PBMC ist bei Patienten mit Asthma bronchiale oder atopischer Dermatitis gegenüber der nichtatopischen Kontrollgruppe signifikant erhöht (El-Mezzein, Matsumoto et al. 2001). Bei Patienten mit allergischer Rhinitis konnten gegenüber der Kontrollgruppe erhöhte IL-18-Konzentrationen im Nasensekret nachgewiesen werden (Verhaeghe, Gevaert et al. 2002). Darüber hinaus konnte für Polymorphismen des IL-18-Gens (11q22.2-22.3) eine signifikante Assoziation mit erhöhtem Serum-IgE, allergischer Rhinitis oder allergenspezifischer Sensibilisierung aufgezeigt werden (Kruse, Kuehr et al. 2003). Im Mausmodell entwickeln Caspase-1 transgene Mäuse mit erhöhter IL-18-Expression spontan eine atopische Dermatitis, begleitet von erhöhten Serum-IgE-Konzentrationen und einer Th2-Deviation der murinen T-Zellen. Durch die Depletion von IL-18 (IL-18-/KCASP1Tg Mäuse) konnte die Entwicklung der atopischen Dermatitis verhindert werden. Diese Zusammenhänge stellen die Bedeutung von IL-18 im Rahmen der atopischen Dermatitis im Mausmodell dar (Tsutsui, Yoshimoto et al. 2004). 1.3. Th1/Th2-Immunität und Schwangerschaft Während der Schwangerschaft ist die mütterliche Immunantwort zugunsten einer Th2vermittelten Immunreaktion ausgerichtet. Schwangere weisen eine reduzierte zellvermittelte Immunität (Weinberg 1984) und eine verminderte Lymphozytenproliferation auf (Matthiesen, Berg et al. 1996). Durch die Plazenta werden grosse Mengen an IL-4, IL-10 (Roth, Corry et al. 1996), PGE2 (Hilkens, Vermeulen et al. 1995) und Progesteron (Piccinni, Giudizi et al. 1995) produziert, wodurch Th2-Immunantworten induziert und Th1-Immunantworten inhibiert werden. Insbesondere IL-10 ist für eine intakte Gravidität von maßgeblicher Bedeutung. IL10 führt zu einer Inhibition der Freisetzung der inflammatorischen Zytokine IFN-γ und TNF-α und supprimiert dadurch die Th1-Immunantwort (Lin, H. et al. 1993). Ein intrauterines Überwiegen der Th1-Immunantwort, gekennzeichnet durch ausgeprägte IFNγ-Sekretion, geht mit einer plazentatoxischen Wirkung einher. Diese kann zum intrauterinen Fruchttod oder zur Frühgeburtlichkeit führen (Wegmann, Lin et al. 1993). Einleitung 1.4. 17 Das neonatale Immunsystem ´ Humane neonatale T-Lymphozyten weisen nach Stimulation mit Antigenen bereits eine Proliferationsantwort sowie eine spezifische Zytokinfreisetzung auf (Taylor and Bryson 1985; Gabrielsson, Soderlund et al. 2001). Zudem ist der Nachweis von Antigen-spezifischem IgE in Nabelschnurblut Hinweis auf eine Interaktion neonataler T- und B-Zellen (King, Malhotra et al. 1998). Dennoch gibt es sowohl qualitative, als auch quantitative Unterschiede zwischen der antigenspezifischen neonatalen Immunantwort und der Immunantwort älterer Kinder oder Erwachsener. Hinsichtlich der Ursachen werden verschiedene Faktoren diskutiert. Diese schliessen das geringe Ausmaß der Antigenexposition, einhergehend mit der verminderten Reifung neonataler antigenpräsentierender Zellen (APC) und einer reduzierten Freisetzung Th1-induzierender Zytokine durch neonatale APC ein (Delespesse, Yang et al. 1998). Weiterhin wird der intrauterinen Exposition gegenüber Progesteron und Zytokinen wie IL-4, welche die Genese einer Th2-Immunantwort stimulieren, diesbezüglich eine Bedeutung beigemessen (Delespesse, Yang et al. 1998). Neonatale mononukleäre Zellen beinhalten überwiegend naive, CD45RA+ T-Lymphozyten, sowie in geringem Ausmaß sensibilisierte, CD45RO+ T-Zellen. CD45RO+ T-Zellen stellen 10% der neonatalen T-Zellpopulation dar, wohingegen T-Zellen adulter Individuen zu etwa 50% CD45RO exprimieren (Harris, Schumacher et al. 1992). Naive neonatale T-Zellen weisen gegenüber aktivierten adulten T-Zellen eine reduzierte Proliferationsneigung und Zytokinproduktion auf. Naive neonatale CD4+ T-Zellen setzen bei der Stimulation durch dendritische Zellen hohe Konzentrationen der Th1-Zytokine IFN-γ und IL-2 sowie geringe Mengen der Th2-Zytokine IL-4 und IL-13 frei. Durch naive CD4+ T-Zellen freigesetzte Zytokine können sowohl autokrin, als auch durch Beeinflussung der Funktion dendritischer Zellen, die Reifung naiver T-Zellen regulieren (Delespesse, Yang et al. 1998). Auf diese Weise kann die Differenzierung von Th0-Zellen sowohl zu Th1-, als auch zu Th2-Zellen stimuliert werden. Die Differenzierung naiver T-Zellen wird beeinflusst durch die Intensität des T-Zellrezeptor vermittelten antigenspezifischen Signals, durch APC-vermittelte kostimulatorische Signale sowie das umgebende hormonelle- und Zytokinmilieu. Insbesondere dem Zytokinmilieu scheint bei der Induktion der T-Zelldifferenzierung eine zentrale Bedeutung zuzukommen (Delespesse, Yang et al. 1998). Einleitung 18 Makrophagen, NK-Zellen und dendritische Zellen führen im Rahmen der unspezifischen Immunität nach Antigenkontakt zu einer frühen Freisetzung von IL-12 und IFN-γ und stimulieren dadurch die Differenzierung naiver CD4+ T-Zellen zu Th1-Zellen (Trinchieri 1995) (Ohshima and Delespesse 1997). Das Ausmaß der IL-12-Freisetzung durch DCs ist von Zytokinmileu und Differenzierungsgrad der dendritischen Zellen abhängig (Koch, Stanzl et al. 1996). Naive CD4+ T-Lyphozyten, die in Anwesenheit von IL-4 und IL-6 aktiviert werden differenzieren zu Th2-Zellen (Janeway, C.A. et al. 1999). CD4+ T-Zellen, welche den Oberflächenmarker NK1.1 exprimieren, produzieren nach Stimulation grosse Mengen IL-4 (Janeway, C.A. et al. 1999). Darüber hinaus setzen naive T-Zellen nach antigenspezifischer Stimulation mittels antigenpräsentierender Zellen IL-4 frei, welches zu einer autokrinen Induktion der Th2-Differenzierung führen kann (Ohshima and Delespesse 1997). Die Freisetzung von IL-4 wird bei der Interaktion zwischen dendritischen Zellen und T-Zellen durch costimulatorische Signale wie B7.1 und B7.2 reguliert (Yang, Demeure et al. 1995). Die durch dendritische Zellen, Makrophagen, NK Zellen, NK 1.1 CD4+ T-Zellen und naive TLymphozyten freigesetzten Zytokine beeinflussen somit das Zytokinmilieu während der Aktivierung naiver T-Lymphozyten und nehmen dadurch Einfluss auf die nachfolgende Entwicklung einer Th1- oder Th2-Immunantwort. Ab der elften Gestationswoche ist die fetale Synthese von IgE nachweisbar (Miller, Hiravonen et al. 1973). Nabelschnurblut weist sehr niedrige Gesamt-IgE-Spiegel auf. Neonatale B-Zellen können nach in vitro-Stimulation mit IL-4 IgE freisetzen. Im Vergleich zu adulten B-Zellen werden jedoch wesentlich höhere Konzentrationen von IL-4 benötigt, um eine IgE-Synthese durch neonatale B-Zellen zu stimulieren (Pastorelli, Rousset et al. 1990). Bei allen Kindern ist, unabhängig von einer späteren Atopieentwicklung, eine Th2Gewichtung der Zytokinsekretion stimulierter CBMC nachweisbar (Holt and Macaubas 1997; Prescott, Macaubas et al. 1998). Innerhalb der ersten Lebensjahre erfolgt die Reifung der Th1Immunantwort, erkennbar an einer zunehmenden IFN-γ-Freisetzung nach polyklonaler Lymphozytenstimulation (Miyawaki, Seki et al. 1985). Bei Kindern mit frühkindlicher Atopieentwicklung kann eine postnatal verminderte Reifung der zellulären Immunität, einhergehend mit einer reduzierten IFN-γ-Freisetzung und dem fortlaufenden Überwiegen der Th2-Immunantwort zugrunde liegen (Tang, Kemp et al. 1994; Warner, Miles et al. 1994; Liao, Liao et al. 1996; Kondo, Kobayashi et al. 1998). Einleitung 19 Nach allergenspezifischer Stimulation von PBMCs resultiert im Vergleich zu CBMCs eine deutlich höhere IFN-γ-Sekretion. Nach Stimulation mit PHA ist hingegen bei CBMCs eine große Anzahl IFN-γ-produzierender Zellen nachweisbar. Als Ursache für die reduzierte IFNγ-Freisetzung nach allergenspezifischer Stimulation kommt ein Defekt neonataler antigenpräsentierender Zellen in Betracht (Taylor and Bryson 1985; Gabrielsson, Soderlund et al. 2001). Antigenpräsentierende Zellen (APC) sind für die Aktivierung von T-Lymphozyten und die Entwicklung einer Th1- beziehungsweise Th2-Immunantwort von zentraler Bedeutung. Dendritische Zellen sind als APC maßgeblich an der Stimulation naiver T-Zellen beteiligt (Banchereau and Steinman 1998). Neben der Vermittlung kostimulatorischer Signale über Oberflächenmoleküle wie CD40/CD40L und CD80/86 setzen APC die Zytokine IL-12, IFN-α und IL-18 frei und beeinflussen dadurch das Zytokinprofil aktivierter T-Zellen. Die Freisetzung des Zytokins IL-12, welches unter anderem die Induktion einer Th1Immunantwort initiert, ist bei neonatalen gegenüber adulten APC reduziert. Neonatale dendritische Zellen (DC) setzen, infolge verminderter IL-12(p35) Genexpression, signifikant niedrigere Mengen des bioaktiven Heterodimers IL-12(p70) frei als adulte DCs. Demzufolge führen neonatale DCs gegenüber adulten DCs zu einer deutlich reduzierten Induktion der IFN-γ-Freisetzung durch naive CD4+ T-Zellen (Goriely, Vincart et al. 2001; Langrish, Buddle et al. 2002). Während die reduzierte IL-12(p70)-Freisetzung der APC für die Neonatalperiode charakteristisch ist, könnte bei Kindern die eine Entwicklung atopischer Erkrankungen aufweisen, ein verstärkter und über die Neonatalperiode hinaus nachweisbarer Defekt der IL12-Sekretion durch APC zugrunde liegen, welcher in einer Th2-gewichteten Immunantwort resultiert (Prescott, Taylor et al. 2003). . Einleitung 1.5. 20 Fragestellung 1. Ist IL-18 im Zellüberstand mononukleärer Nabelschnurblutzellen nachweisbar? 2. Induziert IL-18 die Freisetzung von IL-13 und IFN-γ in den Zellüberstand antigenspezifisch oder polyklonal stimulierter CBMCs? 3. Welche Wirkung haben IL-18 und IL-4 auf die IL-13- und IFN-γ-Konzentration im Zellüberstand antigenspezifisch oder polyklonal stimulierter CBMCs? Können superadditive Effekte der Stimulation mit IL-4 und IL-18 gegenüber der Stimulation mit IL-18 oder IL-4 alleine dargestellt werden? 4. Welche Wirkung haben IL-18 und IL-4 im Rahmen von Präinkubationsversuchen mit CBMCs sowie CD4+ Zellen auf die Zytokinkonzentrationen von IL-13- und IFN-γ im Zellüberstand? Material und Methoden 21 2. Material und Methoden 2.1. Studienpopulation Im Rahmen dieser Arbeit wurden insgesamt 51 Nabelschnurblutproben von gesunden, reifen Neugeborenen mit einer Gestationszeit von 37 bis 42 Schwangerschaftswochen (Median 40. Schwangerschaftswoche) untersucht. Neonaten mit Neugeboreneninfektionen, Stoffwechselerkrankungen oder Organfehlbildungen wurden von der Studie ausgeschlossen. Ausschlusskriterien seitens der Mutter stellten akute oder chronische Infektionserkrankungen, Autoimmunerkrankungen, chronische konsumierende Erkrankungen und Neoplasien dar. Die familiären Atopieanamnese wurde mittels Fragebogen erhoben. Zusätzlich wurde die schriftliche Einverständniserklärung beider Eltern zur Gewinnung und Verarbeitung der Nabelschnurblutprobe eingeholt. Das Studienprotokoll wurde durch die Ethik-Kommission der Universität Freiburg genehmigt. 2.2. Abnahme des Nabelschnurblutes Zunächst erfolgt die Heparinisierung des Abnahmebeutels (ELTEST, Bonn), indem 200 Einheiten Heparin (Canusal, CP Pharmaceuticals, Wrexham, UK) über einen Zuspritzschlauch in den Beutel gegeben werden. Anschließend wird ein Molltontuch auf der Arbeitsfläche ausgebreitet und die Plazenta darauf platziert. Die abgeklemmte Nabelschnur wird unterhalb des Niveaus der Plazenta gehalten. Auf diese Weise fördert die Schwerkraft den Blutstau in die Nabelschnurvene und erleichtert damit deren Lokalisation und Punktion. Mit der Punktion der Nabelschnurvene wird distal begonnen. Meist fließt nach Anlegen des Abnahmebeutels das Nabelschnurblut spontan. Zur Unterstützung des Blutflusses wird die Plazenta gegebenenfalls leicht massiert. Bei Sistieren des Blutflusses kann über eine erneute Punktion proximal der vorherigen Punktionsstelle zusätzliches Blut gewonnen werden. Für die Material und Methoden 22 Dichtezentrifugation, die innerhalb von 12 Stunden erfolgen soll, werden maximal 50 ml Nabelschnurblut verwendet. 2.3. Zur Dichtegradientenzentrifugation Gewinnung mononukleärer Nabelschnurblutzellen (CBMC) mittels Dichtegradientenzentrifugation wird Nabelschnurblut mit sterilem PBS (Gibco, Life Technologies, Karlsruhe) 1:3 verdünnt. Das verwendete PBS soll hierbei Raumtemperatur und einen pH von 7 aufweisen. Anschließend wird die Ficoll-Lösung (Pharmacia Biotech, Freiburg) vorsichtig in ein 50 ml-Falcon-Röhrchen vorgelegt, wobei eine Benetzung der Röhrchenwand zu vermeiden ist. Anschließend erfolgt das langsame Aufschichten des verdünnten Blutes auf die Ficoll-Lösung. Aufgrund der hohen Zytotoxizität der Ficoll-Lösung, sollte keine Vermischung des Ficoll mit dem verdünnten Blut stattfinden. Das Verhältnis von verdünntem Blut zu Ficoll-Flüssigkeit beträgt bei Nabelschnurblut 1:1. Die verschlossenen 50 ml-Röhrchen werden anschließend 40 Minuten ohne Bremse mit einer Drehzahl von 300 g bei Raumtemperatur zentrifugiert. Nach der Zentrifugation stellen sich die CBMC als weiß-trübe Trennschicht zwischen Serum und Ficoll-Flüssigkeit dar. Bevor die mononukleären Zellen abgenommen werden, erfolgt zunächst die Entnahme eines Großteils des Serums oberhalb der Trennschicht. Die daraufhin mittels einer Pasteurpipette abgezogenen mononukleären Zellen werden in ein 15 ml Falcon-Röhrchen gegeben, das anschließend auf 15 ml mit Waschpuffer aufgefüllt und 10 Minuten bei einer Drehzahl von 400 g mit Bremse bei Raumtemperatur zentrifugiert wird (erster Waschschritt). Der verwendete Waschpuffer wird durch Zugabe von 3% FCS (Seromed, Berlin) zu 97% PBS hergestellt. Für die Herstellung von 50 ml Waschpuffer erfolgt entsprechend eine Zugabe von 1,5 ml FCS zu 48,5 ml PBS. Nach erfolgter Zentrifugation wird der Überstand von dem erhaltenen Zellpellet dekantiert und das Pellet in 1 bis 2 ml Waschpuffer resuspendiert indem es mit leichtem Druck über die gelochte Sterilbankplatte gezogen wird. Das sorgfältige Resuspendieren des Zellpellets ist notwendig, um die Bildung von Zellklumpen und damit einhergehenden Zellverlust zu vermeiden. Folgend wird das Röhrchen erneut mit Waschpuffer bis zur 15 ml-Marke aufgefüllt und bei 400 g für 10 min zentrifugiert (zweiter Waschschritt). Nach dem zweiten Waschschritt erfolgt die Zellzählung, wofür das Zellpellet in 3-4 ml UCC resuspendiert wird. Für den dritten Waschschritt wird UCC-Medium Material und Methoden 23 verwendet. Für die Hersellung von UCC-Medium wird Ultra Culture-Medium (Bio Whittaker Europe) unter sterilen Bedingungen jeweils 1 % L-Glutamin (Gibco BRL), Penicillin-Streptomycin (Gibco BRL) und AB-Serum (PAA) zugesetzt. Die Zusätze werden separat in 5 ml-Aliquots bei -20°C aufbewahrt. Das Medium wird maximal 14 Tage verwendet und bei +4°C aufbewahrt. Die Zentrifugation im Rahmen des dritten Waschschrittes erfolgt mit einer Drehzahl von 400 g bei +4°C, da anschließend das Einfrieren der Zellen erfolgt. 2.4. Zell-Zählung Die Resuspension des Zellpellets erfolgt in 3-4 ml UCC-Medium. 50 µl dieser Zellsuspension werden steril entnommen und mit 50 µl 0,5 %iger Essigsäure gemischt, um die Erythrozyten zu lysieren. Von dieser Suspension werden wiederum 50 µl entnommen und in 50 µl Trypanblau (Seromed Biochrom, Berlin) gegeben, welches die Zellwand avitaler Zellen durchdringt und diese so selektiv anfärbt. Vitale Zellen bleiben ungefärbt. Die so entstandene 1:4 Verdünnung wird ebenso wie die Menge der Zellsuspension bei der Konzentrationsberechnung in den Verdünnungsfaktor mit einbezogen. Nach der Färbung wird ein Tropfen in die vorbereitete Neubauer-Zählkammer gegeben und anschließend unter dem Mikroskop mit Hilfe eines Handzählers vier Großquadrate ausgezählt. Die Neubauer-Zählkammer umfasst vier Großquadrate von jeweils sechzehn Kleinquadraten. Jedes Großquadrat schließt ein Volumen von 0,1 mm3 (= 0,1 µl) ein. Um die Zellzahl pro Milliliter (1000 µl) zu ermitteln, muss die im Großquadrat bestimmte Zellzahl daher mit 104 multipliziert werden. Mittels folgender Formel: Zellzahl/Quadrant x 4 x Menge der Zellsuspension (ml) x 104 = Gesamtzellzahl kann die Gesamtzellzahl und damit auch die für die Einstellung auf 1 x 107 Zellen/ml notwendige Menge an Einfriermedium ermittelt werden. Material und Methoden 2.5. 24 Einfrieren von CBMC Da es beim Einfrieren und Auftauen von Zellen infolge der Zytotoxizität des DMSO (Sigma, Taufkirchen) in Abhängigkeit von der Verarbeitungsdauer erfahrungsgemäß zu einem Verlust an vitalen Zellen kommt, ist hierbei zügiges Arbeiten erforderlich. Alle Arbeitsschritte erfolgen auf Eis. Nach dem dritten Waschschritt im Rahmen der Dichtezentrifugation steht ein Zellpellet bekannter Zellzahl zum Einfrieren zur Verfügung. Das Einfriermedium wird aus 90% steril filtriertem FCS und 10% DMSO kurz vor der Verwendung hergestellt und, wie auch die CryoRöhrchen, auf Eis gelagert. Die Zellen werden auf eine Konzentration von 1-1,5 x 107 Zellen/ml Einfriermedium eingestellt (Gesamtzellzahl / 1 x 107 Zellen = Einfriermedium (ml)) und auf 1 ml Aliquots verteilt. Mit den isolierten CBMC erstellte Aliquots werden zunächst in der +4°C kalten Einfrierdose für 24h bei -70°C und anschließend bei -196°C in flüssigem Stickstoff eingefroren. Die Einfrierdose mit Isopropanol wird bis zur Verwendung bei +4°C im Gefrierschrank aufbewahrt. 2.6. Auftauen von CBMC Zunächst wird das UCC unter der Sterilbank vorbereitet. Hierbei werden bei 1 ml aufzutauender Zellsuspension 10 ml UCC in sterile Falcon-Röhrchen pipettiert. Das Wasserbad wird auf 37°C erwärmt und maximal zwei Cryo-Röhrchen aus dem Flüssigstickstofftank entnommen. Zwecks Druckausgleich und Stickstoffentlastung wird der Deckel kurzzeitig locker geschraubt, bevor die Röhrchen unter ständigem Bewegen im Wasserbad aufgetaut werden. Jede aufgetaute Probe wird unter der Sterilbank rasch in das vorbereitete UCC-Medium überführt und mittels Zentrifugation (400 g für 10 Minuten mit Bremse) und anschließendem Dekantieren des Überstandes vom Einfriermedium befreit. Für die Zellzahlbestimmung wird das aufgeschüttelte Zellpellet in 2-3 ml UCC resuspendiert und dann bei bekannter Zellzahl die für die Zellstimulation benötigte Zellkonzentration von 1 x 106 Zellen/ml eingestellt. Für die Anreicherung CD4+ Zellen aus den CBMC mittels Magnetic Activated Cell Sorting (Miltenyi Biotec, Bergisch Gladbach) wird ebenfalls die Zellzahl ermittelt, anschließend erneut zentrifugiert (400 g für 10 min mit Bremse) und dann das Zellpellet verwendet. Material und Methoden 2.7. 25 Magnetic Activated Cell Sorting (MACS) zur Anreicherung CD4+ Zellen Theoretische Grundlagen Das Magnetic Activated Cell Sorting (MACS) wird in diesem Fall verwendet, um Zellen anzureichern die das Glycoprotein CD4 auf ihrer Oberfläche tragen. Hierfür werden die Zellen mittels eines magnetischen Antikörpers gegen CD4 markiert. Die Zellsuspension markierter und nichtmarkierter Zellen wird über eine Säule gegeben, in deren Umgebung sich ein Magnet befindet. Nicht mit dem magnetischen Antikörper Anti-CD4 versehene Zellen werden nachfolgend aus der Säule eluiert, während die gewünschten Zellen aufgrund der magnetischen Anziehungskraft in der Säule verbleiben. Durch Entnahme der Säule aus dem Magneten und Spülen der Säule mit MACSPuffer erfolgt das Eluieren der CD4+ Zellen aus der MACS-Säule in ein separates FalconRöhrchen. Zunächst erfolgt die Vorbereitung der MiniMACS-Säule (Miltenyi Biotec, Bergisch Gladbach). Die zuvor bei +4°C gelagerte MiniMACS-Säule wird in den MiniMACS-Magneten (Miltenyi Biotec, Bergisch Gladbach) eingesetzt. Anschließend wird ein Zellfilter (Miltenyi Biotec, Bergisch Gladbach), der Zellklumpen aus der Zellsuspension entfernt bevor diese die Säule passiert, auf die MiniMACS-Säule aufgesetzt und ein Falcon Röhrchen unter der Säule plaziert. Daraufhin erfolgt das Spülen der Säule mit 2 ml entgastem und auf Eis gelagertem MACS-Puffer. Die Herstellung des MACS-Puffers erfolgt durch Zugabe von 5 mM EDTA (Sigma, Taufkirchen) und 0,5% FCS zu PBS und anschließende Einstellung des pH-Wertes auf 7,2 mittels 1N Salzsäure (HCl) beziehungsweise 1N Natronlauge (NaOH). Das Entgasen des Puffers erfolgt bei leicht losgeschraubtem Deckel für 15 min im Ultraschallbad. Ziel des Entgasens ist die Verhinderung der Bildung kleiner Luftblasen in der MiniMACS-Säule bei der Zellseparation, welche zu einer Störung des Flusses durch die Säule und einer Verschlechterung der Qualität der Zellseparation führen könnten. Im zweiten Arbeitsschritt erfolgt die Vorbereitung der Zellen. Bei jedem dieser Schritte ist auf Arbeiten auf Eis zu achten. Zunächst wird das Zellpellet in 100 µl MACS-Puffer aufgenommen und mit 5 µl CD4+ Micro Beads (Miltenyi Biotec, Bergisch Gladbach) pro 1 x 107 Zellen versetzt. Es erfolgt eine Inkubation für 15 min bei +4°C. Zur Entfernung überschüssiger CD4+ Micro Beads aus der Zellsuspension werden anschließend zwei Waschschritte durchgeführt. Hierbei werden Material und Methoden 26 jeweils 5 ml MACS-Puffer zu der Zellsuspension hinzugegeben. Die Zentrifugation erfolgt dann bei +4°C und 300 g für 10 min mit Bremse. Die Überstände über dem Zellpellet werden jeweils abpipettiert und das verbleibende Pellet durch Ziehen des Falcon-Röhrchens über die Lochplatte der Sterilbank aufgeschüttelt. Nach dem zweiten Waschschritt wird das Pellet in 500 µl MACSPuffer aufgenommen und die markierten Zellen über die Säule gegeben. Anschließend wird die Säule mit 4 x 500 µl MACS-Puffer gespült. Daraufhin wird die Säule aus dem Magneten entfernt, auf ein steriles Falcon-Röhrchen gesetzt und die CD4+ Zellen mit 1 ml MACS-Puffer eluiert. Letzteres muss sehr schnell mit Hilfe eines sterilen Stempels durchgeführt werden. Nun erfolgt die Zellzählung der CD4+ Zellen und des Durchflusses (CD4- Zellen) auf die oben beschriebene Weise. Anschließend stehen die Zellen zur Immunotypisierung mittels Fluorescent Activated Cell Sorting (FACS) und zur Stimulation zur Verfügung. Die Zellsuspension die für die Stimulationsansätze verwendet wird, wird auf 1 x 106 Zellen/ml eingestellt. Material und Methoden 2.8. 27 Durchflusszytometrie mittels Fluorescence Activated Cell Sorter (FACS) Theoretische Grundlagen Die Durchflusszytometrie ermöglicht die Charakterisierung von Einzelzellen anhand von Streuungs- und Fluoreszenzphänomenen. Zellen einer Einzel-Zellsuspension werden nach dem Prinzip der hydrodynamischen Fokussierung in laminarer Strömung hintereinander durch einen Laserstrahl geleitet. Hierbei finden aufgrund von Oberflächenstruktur, Größe und Granulierung der Zelle zellspezifische Streuungsphänomene statt. Als Forward Scatter (FSC) wird die Vorwärtsstreuung entlang des Laserstrahls bezeichnet. Der FSC dokumentiert die Zellgröße (Querschnittsfläche). Als Sideward Scatter (SSC) wird die Streuung im rechten Winkel zum Laserstahl bezeichnet. Sie stellt ein Maß für die Granularität und äußere Form der Zelle dar. Zusätzlich zur Streuung können Fluoreszenzphänome detektiert werden, die der verwendete Argon-Laser (488 nm) an den mit Fluoreszenzfarbstoffen gekoppelten Antikörpern hervorruft. Fluoreszenz ist eine kurzeitige Lichtemission nach Anregung eines Moleküls mit hochenergetischer Strahlung. In Abhängigkeit vom Fluoreszenzfarbstoff entsteht Licht von charakteristischer Wellenlänge. Verwendet wurden die Fluorochrome • Phycoerythrin (PE) mit einem Emissionsmaximum bei 575 nm, gekoppelt an Antikörper gegen CD4. • Fluoresceinisothiocyanat (FITC) mit einem Emissionmaximum bei 525 nm, gekoppelt an Antikörper gegen CD3. Weisen die im FACS untersuchten Zellen die entsprechenden Oberflächenmoleküle auf, so binden die hinzugefügten Antikörper und bei Passage des Laserstrahls kann nicht nur eine Aussage bezüglich Größe und Granularität, sondern auch bezüglich der Oberflächenmerkmale getroffen werden. Zur Immunotypisierung werden sowohl die separierten CD4+ Zellen, als auch der Durchfluss (CD4Zellen) verwendet. Die Zellsuspension CD4+ Zellen weist eine Konzentration von 1 x 106 Zellen/ml auf. Die Konzentration des Durchflusses beträgt bis zu 2 x 106 Zellen/ml. Mit den Zellsuspensionen werden folgende Färbungen durchgeführt: Material und Methoden • 28 Negativkontrolle: Die Färbung erfolgt mittels eines Simultest Control γ1/γ1 Antikörpers (BD Biosciences, Heidelberg), der gegen Keyhole Limpet Haemocyanin (KLH) gerichtet ist, das auf humanen Zellen nicht exprimiert wird. Auf diese Weise erfolgt der Ausschluss unspezifischer Antikörperbindungen. Die Negativkontrolle wird sowohl für die CD4+ Zellen als auch für den Durchfluss angefertigt. • CD4+ Zellen: werden mit den Antikörpern CD4 PE (BD Biosciences, Heidelberg) und CD3 FITC (BD Biosciences, Heidelberg) gefärbt. • CD4- Zellen: Die Färbung des Durchflusses (CD4- Zellen) erfolgt mit CD4 PE Antikörpern (BD Biosciences, Heidelberg). Für die Zellfärbungen werden jeweils 100 µl Zellsuspension mit je 10 µl der oben angegebenen Antikörper gemischt und für 10 min bei +4°C in Dunkelheit inkubiert. Anschließend erfolgt das Entfernen überschüssiger Antikörper durch einmaliges Waschen mit PBS. Hierfür werden je 3 ml PBS auf die gefärbten Zellen gegeben und mit 300 g für 6 min bei +4°C zentrifugiert. Nach Dekantieren des Überstandes wird das Zellpellet resuspendiert und die Zellen bis zur Messung innerhalb von 30 min unter Lichtabschluss im Kühlschrank aufbewahrt. Die durchflusszytometrische Charakterisierung der gefärbten Zellen erfolgt mit dem Durchflusszytometer von Becton Dickinson, FACScan. Zur Auswertung wird die Software Cell Quest 3.1 verwendet. Für die Einstellung der Kompensation werden Negativkontrollen, CD4 PE und CD3 FITC gefärbte Proben verwendet. Die zu Beginn definierte Kompensation wird für die Messung aller Proben beibehalten. Vor jeder Messung werden mit Hilfe der Negativkontrollen die Verstärkerspannungen für FL1 und FL2 so eingestellt, dass sich die Fluoreszenzen FL1 und FL2 der Zellen der Negativkontrolle im Bereich 100 bis 101 darstellen. Bei der anschließenden Messung der Proben erfolgt zunächst eine Darstellung der Streuungseigenschaften der gemessenen Population, wobei in einem Koordinatensystem der Sideward-Scatter (Ordinate) gegen den Forward-Scatter (Abszisse) aufgetragen wird. Durch Markierung der Zielpopulation (mononukleäre Zellen), werden diese im folgenden hinsichtlich der Fluoreszenzeigenschaften charakterisiert. In einem zweiten Koordinatenkreuz erfolgt hierfür die Darstellung der FL2 (CD4 PE, Ordinate) gegenüber der FL1 (CD3 FITC, Abszisse). + - Durch + Einteilung + - des + Koordinatensystems in vier Quadranten, kann zwischen CD4 /CD3 , CD4 /CD3 , CD4 /CD3 und ungefärbten Zellen differenziert werden. Der Anteil der jeweiligen Subpopulation an der Gesamtpopulation wird in Prozent angegeben. Bei der Isolation CD4+ Zellen aus mononukleären Zellen wird bei dieser Versuchsreihe jeweils eine Reinheit von mindestens 90% gefordert . Material und Methoden 2.9. 29 Zellstimulation Verwendete Stimulantien • Phytohämagglutinin (PHA) (Sigma, Taufkirchen): ist ein unspezifisches, mitogenes Lymphozytenstimulanz, das unter sterilen Bedingungen in UC-Medium gelöst, aliquotiert und bis zur Verwendung bei -20°C gelagert wird. Im Stimulationsansatz wird eine Konzentration von 20 µg/ml (4µg/well) verwendet. • Betalactoglobulin (BLG) (Sigma, Taufkirchen): ist ein als Antigen wirksames Kuhmilchprotein, das unter Sterilen Bedingungen in UCC-Medium gelöst, aliquotiert und bis zur Verwendung bei -20°C gelagert wird. Im Stimulationsansatz wird eine Konzentration von 25 µg/ml (5 µg/well) verwendet. • Rekombinantes humanes Interleukin-18 (rhIL-18) (Cell Concepts, Umkirch): wird durch E. coli synthetisiert. Die Reinheit beträgt mindestens 98%, das Endotoxinlevel liegt unter 0,1 ng/µg. IL-18 wird in UC-Medium gelöst, aliquotiert und bei -20°C bis zur Verwendung gelagert. Im Simulationsansatz werden Konzentrationen von 100 ng/ml, 200 ng/ml und 400 ng/ml verwendet. • Rekombinantes humanes Interleukin-4 (rhIL-4) (PromoCell, Heidelberg): wird durch E. coli synthetisiert. Die Reinheit beträgt mindestens 98%, das Endotoxinlevel liegt unter 0,025 ng/µg. IL-4 wird in Bovinem Serum Albumin (BSA) gelöst, aliquotiert und bis zur Verwendung bei -20°C gelagert. Vor Gebrauch erfolgt eine weitere Verdünnung mit UCCMedium. Im Stimulationsansatz wird eine Konzentration von 25 U/ml (5 U/well) verwendet. Für die Zellstimulationen werden sterile 96-well Platten verwendet. Zunächst erfolgt das Vorlegen der jeweiligen Stimulantien und des UCC-Mediums. Anschließend werden pro well 100µl Zellsuspension der Konzentration 1 x 106 Zellen/ml hinzugefügt, so dass schließlich das Volumen pro well in jedem Ansatz 200 µl beträgt. Bei Präinkubationsansätzen mit IL-18, IL-4 oder IL-18 + IL-4 werden als Stimulantien zunächst nur die Zytokine zu den Zellen hinzugefügt. Nach Beendigung der Präinkubationszeit von 48 Stunden erfolgt dann das Abziehen von 40 µl beziehungsweise 50 µl Überstand, welche durch die folgende PHA- beziehungsweise BLG-Zugabe dem Stimulationsansatz wieder zugefügt werden. Die Inkubation der Stimulationsplatten erfolgt im Brutschrank bei 37°C und 5% CO2. Die zellfreien Überstände werden nach dem für das jeweilige Material und Methoden 30 Stimulanz optimalen Zeitraum abgezogen. Bei Stimulation mit PHA erfolgt dies nach 24 h oder 48 h, bei BLG nach 5 Tagen. Abgenommen werden jeweils 130 µl Überstand, die bis zur Zytokinbestimmung bei -20°C gelagert werden. 2.10. Quantitative Zytokinbestimmung mittels ELISA für IFN-γ und IL-13 Material Coating buffer: 0,84 g NaHCO3 und 0,36 g NaCO3 werden in 100 ml destilliertem Wasser gelöst und der pH-Wert auf 9,5 eingestellt. Bis zur Verwendung innerhalb von 7 Tagen wird der Puffer bei +4°C im Kühlschrank aufbewahrt. Phosphat Buffered Saline (PBS): 16,0 g NaCl, 2,32 g Na2HPO4, 0,4 g KH2PO4 und 0,4 g KCl werden in 2,0 l destilliertem Wasser gelöst und der pH-Wert auf 7,0 eingestellt. Bis zur Verwendung innerhalb von 3 Tagen wird das PBS bei +4°C im Kühlschrank aufbewahrt. Waschpuffer: PBS wird mit 0,05% Tween-20 versetzt. Bei 500 ml PBS erfolgt entsprechend eine Zugabe von 250 µl Tween-20. Bis zur Verwendung innerhalb von 3 Tagen wird der Waschpuffer bei +4°C im Kühlschrank aufbewahrt. Stopplösung: 2N H2SO4 wird durch Zugabe von 40 ml 5N H2SO4 zu 60 ml destilliertem Wasser hergestellt und bis zur Verwendung im Kühlschrank aufbewahrt. Ausgangsstandards: 175 ng rekombinantes humanes IFN-γ (Humanes IFN-γ Set, BD Pharmingen, Heidelberg) werden in 1 ml sterilem destilliertem Wasser gelöst, und für 15 min inkubiert. Anschließend erfolgt die Alliquotierung a 50 µl pro Einfrierröhrchen und Lagerung bei -70°C für maximal 6 Monate. Material und Methoden 31 Theoretische Grundlagen: Bei dem verwendeten Enzyme-Linked Immunosorbent Assay (ELISA-Set, BD Pharmingen, Heidelberg) zur Detektion von humanem IFN-γ wird ein Mausantikörper, der gegen humanes IFNγ gerichtet ist, im Überschuss an eine Matrix (96-well Maxisorp, Nunc, Wiesbaden) gebunden. Bei Zugabe des Standards oder der zu untersuchenden Probe bindet das enthaltene IFN-γ an den Antikörper. Je größer die IFN-γ-Konzentration in der Probe, desto mehr an die Matrix des wells gebundene Antikörper gehen eine Bindung mit IFN-γ ein. Anschließend erfolgt die Zugabe eines zweiten Antikörpers. Dieser ist mit einem Enzym (Avidin-horseradish Peroxidasekonjugat) gekoppelt und bindet an den Antikörper-IFN-γ-Komplex. Das Enzym vollführt die Umsetzung eines im folgenden zugegebenen Substrates (Tetramethylbenzindin und Hydrogenperoxid) in einen Farbstoff. Die enzymatische Substratumsetzung wird durch Zugabe von Schwefelsäure gestoppt. Je größer die IFN-γ-Konzentration der Probe, desto größer die Anzahl der gebundenen an Enzym gekoppelten Antikörper und desto ausgeprägter die Substratumsetzung. Im ELISA-Reader wird Licht der Wellenlänge 450 nm durch die Probe geworfen. Das Produkt der Substratumsetzung führt zu einer Lichtabsorption, die sich proportional zur Produktkonzentration verhält. Durch Anlegen einer Standardreihe, die der jeweiligen Absorption eine festgelegte IFN-γ-Konzentration zuordnet, kann in den Proben unbekannter IFN-γ-Konzentration ein Rückschluss von der Absorption auf die jeweilige IFN-γ-Konzentration erfolgen. Für die Durchführung des gesamten ELISAs müssen alle Reagenzien Raumtemperatur aufweisen. Die folgenden Mengenangaben beziehen sich auf die Verwendung einer vollständig belegten 96well Platte. Zunächst erfolgt das Coaten der 96-well Platte mit Capture Antikörper (Mausantikörper gegen humanes IFN-γ). Der verwendete Antikörper wird im Verhältnis 1:250 mit Coating Buffer verdünnt, wobei 48 µl Antikörperlösung mit 11,95 ml Puffer versetzt und gut gemischt werden (vortexen). Anschließend werden 100 µl verdünnter Capture-Antikörper in jedes well pipettiert, die Platte mit Parafilm abgedichtet und bei +4°C über Nacht im Kühlschrank inkubiert. Anschließend erfolgt dreimaliges Waschen mit Waschpuffer, wobei jeweils 300 µl Puffer in jedes well pipettiert und nach 30 Sekunden durch Drehen und Ausklopfen auf saugfähigem Papier wieder entfernt werden. Durch darauf folgende Zugabe von 200 µl Assay Diluent (BD Pharmingen, Heidelberg) pro well und Inkubation bei Raumtemperatur für eine Stunde werden unspezifische Material und Methoden 32 Bindungsstellen blockiert. Während dieser Inkubationszeit wird die Standardverdünnungsreihe angefertigt. Zunächst erfolgt eine 1:657 Verdünnung des Ausgangsstandards, um die höchste Standardkonzentration von 300 pg/ml zu erhalten. Die übrigen Standardkonzentrationen ergeben sich aus einer Verdünnungsreihe mit jeweiliger 1:2 Verdünnung. Zunächst werden 300 µl des höchsten Standards entnommen und mit 300 µl Assay Diluent gemischt (vortexen). Die resultierende Konzentration beträgt 150 pg/ml. Diese 1:2 Verdünnung, bei der 300 µl des niedrigsten Standards der erstellten Verdünnungsreihe mit 300 µl Assay Diluent versetzt werden um den nächst niedrigeren Standard zu erhalten, wird bis zu einer Standardkonzentration von 4,7 pg/ml fortgesetzt. Nach Abschluss der Inkubation mit Assay Diluent erfolgt dreimaliges Waschen der wells entsprechend der obigen Beschreibung. Im folgenden werden jeweils 100 µl Standard- oder Probenlösung nach sorgfältigem Vortexen in jedes well gegeben. Zwei aufeinander folgende wells werden jeweils mit derselben Probe belegt, um eine Doppelbestimmung der Probenkonzentration und damit eine größere Messgenauigkeit zu erhalten. Liegt die Konzentration der zu messenden Probe erfahrungsgemäß oberhalb der höchsten Standardkonzentration, so erfolgt eine entsprechende Verdünnung der Probe, bevor diese auf das well gegeben wird. Die verwendete Verdünnung wird anschließend in die Berechnung der IFN-γ-Konzentration mit einbezogen. Die mit Probenlösung versehenen Platten werden mit Parafilm überzogen und über Nacht bei +4°C im Kühlschrank inkubiert. Nach fünfmaligem Waschen der wells wird 100 µl Working Detector in jedes well pipettiert. Working Detector besteht aus Detection Antikörper (biotinylierter Mausantikörper gegen humanes IFN-γ), der im Verhältnis 1:250 mit Assay Diluent versetzt wird, und Enzymreagenz (Avidinhorseradish Peroxidasekonjugat). Entsprechend erfolgt eine Zugabe von 48 µl Detection Antibody zu 11,90 ml Assay Diluent. Nach sorgfältigem Mischen werden dem verdünnten Antikörper 48 µl Enzym Reagenz zugefügt und wiederum gemischt. Die Inkubation mit dem aufgetragenen Working Detector erfolgt für 1 h bei Raumtemperatur. Die ELISA-Platte wird hierfür mit Parafilm überzogen. Durch anschließendes siebenmaliges Waschen der wells werden überschüssige Antikörper und nicht gebundenes Enzym entfernt. Daraufhin erfolgt das Auftragen von 100 µl Substrat auf jedes well. Die Substratlösung setzt sich aus gleichen Anteilen von Tetramethylbenzidin (TMB) und Hydrogenperoxid zusammen. Das Zusammenführen beider Substratbestandteile erfolgt maximal 10 min vor der Verwendung. Die Aufbewahrung bis zur Verwendung findet unter Lichtabschluss statt. Die Inkubation mit der Substratlösung erfolgt für 30 min ohne Abdeckung bei Raumtemperatur in Dunkelheit. Die enzymatische Substratumsetzung wird durch Zugabe von 50 µl 2N H2SO4 beendet. Anschließend erfolgt innerhalb von 15 min unter Material und Methoden 33 Verwendung der Wellenlänge 450 nm die Bestimmung der Zytokinkonzentration mittes ELISAReader. Die Durchführung des Interleukin-13 ELISAs (IL-13 ELISA-Set, BD Pharmingen, Heidelberg) erfolgt der des IFN-γ ELISAs entsprechend. Verwendet werden jeweils Antikörper gegen humanes IL-13. Der höchste Standard liegt hier bei 200 pg/ml und wird durch eine 1:700 Verdünnung des IL-13-Ausgangsstandards erreicht. Die Standardverdünnungsreihe wird entsprechend der obigen Beschreibung durch eine fortlaufende 1:2 Verdünnung hergestellt, wobei der niedrigste IL-13Standard bei 3,1 pg/ml liegt. Ergebnisse 34 3. Ergebnisse Im Rahmen dieser Studie wurden die Nabelschnurblutproben von n = 51 reifen, gesunden Neonaten mit einer Gestationszeit von 37 bis 42 Schwangerschaftswochen (Median 40. Schwangerschaftswoche) untersucht. Neonaten mit Neugeboreneninfektionen, schweren konsumierenden Erkrankungen oder Organfehlbildungen wurden von der Studie ausgeschlossen. Ausschlusskriterien seitens der Mutter stellten akute oder chronische Infektionserkrankungen, chronische konsumierende Erkrankungen und Neoplasien dar. 3.1. Nachweis der IL-18-Sekretion mononukleärer Nabelschnurblutzellen Die Zielsetzung der folgenden Experimente stellt der Nachweis, dass IL-18 in messbaren Konzentrationen in den Zellüberständen mononukleärer Nabelschnurblutzellen vorhanden ist, dar. In dem folgenden Stimulationsansatz erfolgt daher die Messung der IL-18-Konzentration im Zellüberstand nach allergenspezifischer (BLG) beziehungsweise mitogener (PHA) Stimulation von CBMC. Ergebnisse 35 40 35 30 IL-18 [pg/ml] 25 20 15 10 5 0 Neg PHA BLG Abb.3.1.: IL-18-Konzentration in den Zellüberständen von CBMC. Dargestellt sind die Einzelwerte der in 20 Experimenten ermittelten IL-18-Konzentration im Zellüberstand in pg/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Inkubation der Negativkontrolle erfolgte für 48 Stunden. Die Stimulation mit 20 µg/ml PHA wurde für 48 Stunden, die Stimulation mit 25 µg/ml BLG für fünf Tage durchgeführt. Die Stimulation der CBMC mit PHA führt im Median zu einer IL-18-Freisetzung von 22,1 pg/ml und ist damit der IL-18-Freisetzung der Negativkontrolle von 21,2 pg/ml vergleichbar. Die Stimulation mit BLG für fünf Tage resultiert in einer IL-18-Sekretion von 15,6 pg/ml. Während IL-18 nach der Stimulation mit BLG in allen Stimulationsansätzen nachweisbar war, lag bei 3 Neonaten die IL-18-Konzentration der Negativkontrolle und nach Stimulation mit PHA unter der Nachweisgrenze von 4 pg/ml (siehe Abb. 3.1.). Ergebnisse 3.2. 36 Ermittlung optimaler Stimulationsbedingungen für die Stimulation mononukleärer Zellen mit IL-18 Zielstellung der folgenden Experimente ist die Bestimmung des optimalen Abnahmezeitpunktes der Zellüberstände nach CBMC-Stimulation mit PHA und die Ermittlung der optimalen IL-18-Konzentration im Stimulationsansatz. Hierfür erfolgte die PHA-Stimulation mit Abnahme der Überstände nach 24 Stunden bzw. 48 Stunden. Die verwendeten IL-18-Konzentrationen in den Stimulationsansätzen betrugen, entsprechend der Ergebnisse von Shikano et al. (Shikano, Kato et al. 2001), 100 ng/ml, 200 ng/ml oder 400 ng/ml. In den Überständen wurden die Zytokine IFN-γ und IL-13 bestimmt. Die beschriebenen Stimulationsansätze wurden bei 8 Proben durchgeführt. Ergebnisse 37 50000 45000 40000 35000 IFNg [pg/ml] 30000 25000 20000 15000 10000 5000 0 0 Neg 100 200 PHA 24 h 400 0 100 200 PHA 48 h 400 0 200 400 BLG Abb. 3.2.: IFN-γ-Konzentration in den Zellüberständen von CBMC nach Stimulation mit 100, 200 oder 400 ng/ml IL-18 und PHA oder BLG. Dargestellt sind die Einzelwerte der in 8 Experimenten ermittelten IFN-γ-Konzentrationen im Zellüberstand in pg/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Inkubation der Negativkontrolle erfolgte mit Medium für 24 Stunden. Im Stimulationsansatz PHA 24 wurde die Inkubation mit 20 µg/ml PHA für 24 Stunden, bei PHA 48 für 48 Stunden durchgeführt. Die Stimulation mit 25 µg/ml BLG erfolgte für 5 Tage. Die Zusätze 0, 100, 200 und 400 bezeichnen die im Stimulationsansatz verwendete IL-18 Konzentration in ng/ml. Im Stimulationsansatz mit PHA zeigt sich bei Inkubation für 24 Stunden eine Zunahme der IFN-γ-Konzentration gegenüber der Negativkontrolle von 2,1 pg/ml auf 323,6 pg/ml (siehe Abb. 3.2.). Durch Zugabe von 100 ng/ml IL-18 zu den PHA-stimulierten CBMC konnte die IFN-γ-Konzentration im Median auf 3559,5 pg/ml gesteigert werden. Die Verwendung von 200 oder 400 ng/ml IL-18 führte zu keiner weiteren Steigerung der IFN-γ-Sekretion (200 ng/ml IL-18 + PHA: 3220,5 pg/ml; 400 ng/ml IL-18 + PHA:3159,0 pg/ml). Nach Inkubation der CBMC mit PHA für 48 Stunden resultiert eine höhere IFN-γKonzentration im Zellüberstand als bei Inkubation der CBMC mit PHA für 24 Stunden. Die Ergebnisse 38 Inkubation mit PHA für 48 Stunden steigert die IFN-γ-Konzentration im Zellüberstand gegenüber der Stimulation mit PHA für 24 Stunden von 323,6 pg/ml auf 1835,5 pg/ml. IL-18Zugabe zu PHA-stimulierten CBMC führt zu einem weiteren Anstieg der IFN-γ-Freisetzung. Die Zugabe von 100 ng/ml IL-18 und Stimulation mit PHA für 48 Stunden führt zu einem Anstieg der IFN-γ-Konzentration im Zellüberstand auf 19291,5 pg/ml. Die Verwendung von 200 beziehungsweise 400 ng/ml IL-18 führt zu einer zusätzlichen Steigerung der IFN-γFreisetzung auf 25025,5 pg/ml beziehungsweise 26539,5 pg/ml. Bei der allergenspezifischen Stimulation mit BLG für fünf Tage zeigt die Stimulation mit BLG alleine gegenüber der Negativkontrolle einen Anstieg der IFN-γ-Konzentration von 2,1 pg/ml auf 260,6 pg/ml. Die Stimulation mit IL-18 und BLG führt gegenüber der Stimulation mit BLG alleine zu einer Steigerung der IFN-γ-Sekretion von 260,6 pg/ml auf 1781,5 pg/ml bei Verwendung von 200 ng/ml IL-18, beziehungsweise auf 3369,0 pg/ml bei Verwendung von 400 ng/ml IL-18. Ergebnisse 39 8000 7000 6000 IL-13 [pg/ml] 5000 4000 3000 2000 1000 0 0 Neg 100 200 PHA 24 h 400 0 100 200 PHA 48 h 400 0 200 400 BLG Abb. 3.3.: IL-13-Konzentration in den Zellüberständen von CBMC nach Stimulation mit 100, 200 oder 400 ng/ml IL-18 und PHA oder BLG. Dargestellt sind die Einzelwerte der in 8 Experimenten ermittelten IL-13-Konzentrationen im Zellüberstand in pg/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Inkubation der Negativkontrolle erfolgte mit Medium für 24 Stunden. Im Stimulationsansatz PHA 24 wurde die Inkubation mit 20 µg/ml PHA für 24 Stunden, bei PHA 48 für 48 Stunden durchgeführt. Die Stimulation mit 25 µg/ml BLG erfolgte für 5 Tage. Die Zusätze 0, 100, 200 und 400 bezeichnen die im Stimulationsansatz verwendete IL-18 Konzentration in ng/ml. Die Stimulation mit PHA für 24 Stunden führt gegenüber der Negativkontrolle zu einem Anstieg der IL-13-Konzentration im Zellüberstand von 0,6 pg/ml auf 230,3 pg/ml. Die Zugabe von IL-18 zu CBMC, die für 24 Stunden mit PHA stimuliert werden, hat unabhängig von der verwendeten IL-18-Konzentration keinen Effekt auf die IL-13-Sekretion (100 ng/ml IL-18 + PHA: 246,2 pg/ml; 200 ng/ml IL-18 + PHA: 266,1 pg/ml; 400 ng/ml IL-18 + PHA: 305,5 pg/ml; siehe Abb. 3.3.). Bei Inkubation der CBMC mit PHA für 48 statt für 24 Stunden resultiert eine Steigerung der IL-13-Konzentration von 230,3 pg/ml auf 4804,5 pg/ml. Zusätzliche IL-18-Zugabe zu für 48 Stunden mit PHA stimulierten CBMC führt unabhängig von der verwendeten IL-18- Ergebnisse 40 Konzentration zu keiner Steigerung der IL-13-Sekretion (100 ng/ml IL-18 + PHA: 4530,5 pg/ml; 200 ng/ml IL-18 + PHA: 5043,0 pg/ml; 400 ng/ml IL-18 + PHA: 4922,5 pg/ml). Die IL-13-Konzentration im Zellüberstand steigt bei der Stimulation mit BLG gegenüber der Negativkontrolle von 0,6 pg/ml auf 295,7 pg/ml an. Die Zugabe von IL-18 zu BLGstimulierten Zellen führt insbesondere bei der Stimulation mit 200 ng/ml IL-18 zu einer Reduktion der IL-13-Konzentration im Zellüberstand (BLG: 295,7 pg/ml; 200 ng/ml IL-18 + BLG: 142,4 pg/ml; 400 ng/ml IL-18 + BLG: 208,5 pg/ml). Entsprechend lässt sich zusammenfassen, dass die Stimulation von CBMC mit PHA für 48 Stunden mit höheren Zytokinkonzentrationen im Zellüberstand einhergeht als nach der Stimulation für 24 Stunden. IL-18-Zugabe führt zu einem Effekt auf die IFN-γ- und IL-13Konzentration im Zellüberstand, der insbesondere bei Verwendung von 200 ng/ml IL-18 beobachtet und durch höhere IL-18-Konzentrationen nicht erkennbar gesteigert werden kann. Im folgenden werden CBMC-Stimulationen mit PHA, sofern keine Präinkubation erfolgt, für 48 Stunden durchgeführt und 200 ng/ml IL-18 im Stimulationsansatz verwendet. Ergebnisse 3.3. 41 Wirkung von IL-18 auf die Zytokinfreisetzung BLG- oder PHA-stimulierter CBMCs Zielsetzung der folgenden Experimente ist die Untersuchung des Einflusses von IL-18 auf die IFN-γ- und IL-13-Freisetzung PHA- oder BLG-stimulierter CBMCs anhand einer größeren Population (n = 30) als unter 3.2. dargestellt. Die Stimulation mit 20 µg/ml PHA sowie die Inkubation der Negativkontrolle erfolgten für 48 Stunden. Stimulationen mit 25 µg/ml BLG wurden für fünf Tage durchgeführt. Die Stimulation mit IL-18 alleine wurde in zwei Ansätzen durchgeführt, die sich in der Dauer der Inkubation von 48 Stunden beziehungsweise fünf Tagen unterschieden. Für die Stimulationsansätze mit IL-18 wurde eine IL-18-Konzentration von 200 ng/ml verwendet. Die Ergebnisse der IFN-γ- und IL-13-Sekretion nach Stimulation der CBMC mit PHA oder BLG alleine beziehungsweise unter Zugabe von IL-18 wurden mittels bivariater Statistik analysiert. Hierbei wird die Zytokinantwort der Negativkontrolle mit der Zytokinfreisetzung nach Stimulation mit PHA sowie nach Stimulation mit IL-18 in Bezug gesetzt. In einem zweiten Schritt wird die Zytokinsekretion nach Stimulation mit PHA und IL-18 der Zytokinantwort nach Stimulation mit PHA oder IL-18 alleine gegenüber gestellt. Entsprechendes erfolgt mit den Ergebnissen der Stimulationsansätze mit IL-18, BLG oder BLG und IL-18. Ziel der Auswertung ist der Nachweis superadditiver Effekte der Stimulation von CBMC mit PHA oder BLG in Kombination mit IL-18 gegenüber der Stimulation mit PHA, BLG oder IL-18 alleine. Ergebnisse 42 Negativ PHA IL-18 PHA + IL-18 Median 4,3 6154,5 6,7 13474 * 25.- 75.Perz. 2,9 - 9,2 2354 -10454 4,0 - 87,5 4974 - 22504 5.- 95.Perz. 2,5 - 146,1 842,4-22368 3,0 - 342,1 1781 - 32660 Median 1,8 4357,5 6,4 4026 25.- 75.Perz. 1,2 - 7.5 3636 - 6326 2,0 - 12,3 3176 - 6217 5.- 95.Perz. 0,6 - 43,0 904,6 - 9262 0,8 - 24,8 989 - 9584 IFN-γ [pg/ml] IL-13 [pg/ml] Tab. 3.1: IFN-γ- und IL-13-Konzentrationen in Zellüberständen von CBMC nach Stimulation mit PHA, IL-18 oder PHA und IL-18 für 48 Stunden. Dargestellt ist der Median, die 25. bis 75. Perzentile sowie die 5. bis 95. Perzentile (pg/ml) von 30 Experimenten. Statistische Signifikanz (gegenüber der Stimulation mit PHA alleine) ist durch die Markierung (*) gekennzeichnet (p=0,0001). Median IFN-γ [pg/ml] 25.- 75.Perz. Negativ BLG IL-18 BLG + IL-18 4,3 801,1 102,1 1077 * 2,9 - 9,2 308,6 - 1506 53,5 - 507,2 521,1 - 1926 5.- 95.Perz. 2,5 - 146,1 102,3 - 2201 4,3 - 1652,0 148,1 - 3975 Median 1,8 249,1 44 124 ** IL-13 [pg/ml] 25.- 75.Perz. 1,2 - 7,5 183,8- 328,3 26,3 - 81,0 49,3 - 165,8 5.- 95.Perz. 0,6 - 43,0 54,7 - 431,6 2,5 - 142,1 18,0 - 294,4 Tab. 3.2: IFN-γ- und IL-13-Konzentrationen in Zellüberständen von CBMC nach Stimulation mit BLG, IL-18 oder BLG und IL-18 für fünf Tage. Dargestellt ist der Median, die 25. bis 75. Perzentile sowie die 5. bis 95. Perzentile (pg/ml) von 30 Experimenten. Statistische Signifikanz (gegenüber der Stimulation mit BLG alleine) ist durch die Markierung(*) gekennzeichnet (*p = 0,008; **p = 0,0001). Ergebnisse 43 p = 0,0001 105 IFNg [pg/ml] 104 103 102 101 100 Neg PHA IL-18 PHA + IL-18 Abb. 3.4.: IFN-γ-Konzentration in den Zellüberständen von CBMC nach Stimulation mit PHA, IL-18 oder PHA und IL-18. Die Stimulation erfolgte jeweils für 48 Stunden. Die im Stimulationsansatz verwendete IL-18-Konzentration betrug 200 ng/ml bei einer PHAKonzentration von 20 µg/ml. Die Ergebnisse von 30 Experimenten sind in Form von Boxplotdiagrammen dargestellt. Die Box erstreckt sich von der 25. bis zur 75. Perzentile und schließt den Median (50. Perzentile) mit ein. Die Balken reichen bis zur 5. beziehungsweise 95. Perzentile. Ausreißer, die außerhalb der 5.- 95. Perzentile liegen, sind durch einen Punkt markiert. Für die Darstellung der IFN-γ-Konzentration auf der Ordinate wurde eine log10 Skala verwendet. Nach der Stimulation von CBMC für 48 Stunden ergibt sich im Median für die Negativkontrolle eine IFN-γ-Konzentration von 4,3 pg/ml. Stimulation mit PHA führt zu einem Anstieg der IFN-γ-Freisetzung gegenüber der Negativkontrolle von 4,3 pg/ml auf 6154,5 pg/ml. Die Stimulation mit IL-18 alleine bewirkt eine IFN-γ-Freisetzung von 6,7 pg/ml. Bei der Inkubation von CBMC mit PHA und IL-18 resultiert gegenüber der Stimulation mit PHA alleine eine signifikante Steigerung der IFN-γ-Konzentration im Zellüberstand von 6154,5 pg/ml auf 13474 pg/ml (p=0,0001). Beschrieben sind jeweils die Medianwerte (siehe Tab. 3.1. und Abb. 3.4.). Ergebnisse 44 p = 0,008 104 IFNg [pg/ml] 103 102 101 100 Neg BLG IL-18 BLG + IL-18 Abb. 3.5.: IFN-γ-Konzentration in den Zellüberständen von CBMC nach Stimulation mit BLG, IL-18 oder BLG und IL-18. Die Stimulation mit BLG oder IL-18 erfolgte für fünf Tage. Die Negativkontrolle wurde für 48 Stunden inkubiert. Die im Stimulationsansatz verwendete IL-18-Konzentration betrug 200 ng/ml bei einer BLG-Konzentration von 25 µg/ml. Die Ergebnisse von 30 Experimenten sind in Form von Boxplotdiagrammen dargestellt. Die Box erstreckt sich von der 25. bis zur 75. Perzentile und schließt den Median (50. Perzentile) mit ein. Die Balken reichen bis zur 5. beziehungsweise 95. Perzentile. Ausreißer, die außerhalb der 5.- 95. Perzentile liegen, sind durch einen Punkt markiert. Für die Darstellung der IFN-γ-Konzentration auf der Ordinate wurde eine log10 Skala verwendet. Im Zellüberstand der Negativkontrolle liegt im Median eine IFN-γ-Konzentration von 4,3 pg/ml vor. Stimulation der CBMC mit BLG für fünf Tage führt zu einem signifikanten Anstieg der IFN-γ-Konzentration auf 801,1 pg/ml. Stimulation mit IL-18 für fünf Tage resultiert in einer IFN-γ-Konzentration von 102,1 pg/ml im Zellüberstand. Die Stimulation von CBMC mit BLG und IL-18 führt gegenüber der Stimulation mit BLG alleine zu einem signifikanten Anstieg der IFN-γ-Konzentration im Zellüberstand von 801,1 pg/ml auf 1077 pg/ml (p=0,008). Beschrieben sind jeweils die Medianwerte (siehe Tab. 3.2. und Abb. 3.5.). Ergebnisse 45 104 IL-13 [pg/ml] 103 102 101 100 Neg PHA IL-18 PHA + IL-18 Abb. 3.6.: IL-13-Konzentration in den Zellüberständen von CBMC nach Stimulation mit PHA, IL-18 oder PHA und IL-18. Die Stimulation erfolgte jeweils für 48 Stunden. Die im Stimulationsansatz verwendete IL-18-Konzentration betrug 200 ng/ml bei einer PHAKonzentration von 20 µg/ml. Die Ergebnisse von 30 Experimenten sind in Form von Boxplotdiagrammen dargestellt. Die Box erstreckt sich von der 25. bis zur 75. Perzentile und schließt den Median (50. Perzentile) mit ein. Die Balken reichen bis zur 5. beziehungsweise 95. Perzentile. Ausreißer, die außerhalb der 5.- 95. Perzentile liegen, sind durch einen Punkt markiert. Für die Darstellung der IL-13-Konzentration auf der Ordinate wurde eine log10 Skala verwendet. Die IL-13-Konzentration im Zellüberstand der Negativkontrolle beträgt im Median 1,8 pg/ml. Die Stimulation der CBMC mit PHA für 48 Stunden resultiert in einer IL-13-Konzentration von 4357,5 pg/ml. Bei Stimulation mit IL-18 alleine liegt eine IL-13-Konzentration von 6,4 pg/ml im Zellüberstand vor. Stimulation mit PHA und IL-18 führt gegenüber der Stimulation mit PHA alleine zu einer Verminderung der IL-13-Freisetzung von 4357,5 pg/ml auf 4026 pg/ml. Beschrieben sind jeweils die Medianwerte (siehe Tab. 3.1. und Abb. 3.6.). Ergebnisse p = 0,0001 103 IL-13 [pg/ml] 46 102 101 100 Neg BLG IL-18 BLG + IL-18 Abb. 3.7.: IL-13-Konzentration in den Zellüberständen von CBMC nach Stimulation mit BLG, IL-18 oder BLG und IL-18. Die Stimulation mit BLG oder IL-18 erfolgte für fünf Tage. Die Negativkontrolle wurde für 48 Stunden inkubiert. Die im Stimulationsansatz verwendete IL-18-Konzentration betrug 200 ng/ml bei einer BLG-Konzentration von 25 µg/ml. Die Ergebnisse von 30 Experimenten sind in Form von Boxplotdiagrammen dargestellt. Die Box erstreckt sich von der 25. bis zur 75. Perzentile und schließt den Median (50. Perzentile) mit ein. Die Balken reichen bis zur 5. beziehungsweise 95. Perzentile. Ausreißer, die außerhalb der 5.- 95. Perzentile liegen, sind durch einen Punkt markiert. Für die Darstellung der IL-13-Konzentration auf der Ordinate wurde eine log10 Skala verwendet. Die IL-13-Konzentration im Zellüberstand der Negativkontrolle beträgt im Median 1,8 pg/ml. Bei Stimulation der CBMC mit BLG resultiert eine IL-13-Freisetzung von 249,1 pg/ml. Die Stimulation mit IL-18 alleine führt zu einer IL-13-Freisetzung von 44 pg/ml. Die Stimulation von CBMC mit BLG und IL-18 führt gegenüber der Stimulation mit BLG alleine zu einer signifikanten Verminderung der IL-13-Konzentration von 249,1 pg/ml auf 124 pg/ml (p=0,0001). Beschrieben sind jeweils die Medianwerte (siehe Tab. 3.2. und Abb. 3.7.). Ergebnisse 3.4. 47 Effekt der Präinkubation auf die Zytokinsekretion von CBMC Zielstellung der folgenden Stimulationsansätze ist die Untersuchung des Effektes der Präinkubation von CBMC mit den Zytokinen IL-18, IL-4 oder IL-18 und IL-4 bei nachfolgender Stimulation mit PHA auf die IFN-γ- und IL-13-Feisetzung der mononukleären Nabelschnurblutzellen. In Tab. 3.1 und 3.2 konnte eine IFN-γ-induzierende Wirkung der IL-18-Zugabe zu allergen oder mitogen stimulierten CBMC aufgezeigt werden. Mit Hilfe der folgenden Stimulationsansätze soll festgestellt werden, ob IL-18 in Abhängigkeit von dem umgebenden Zytokinmilieu neben einer Th1-induzierenden Wirkung, erkennbar an einer gesteigerten IFNγ-Freisetzung, auch eine Th2-induzierende Wirkung, nachweisbar durch eine gesteigerte IL13-Freisetzung, zukommen kann. Im folgenden werden die CBMC daher mit IL-18, IL-4 oder IL-18 und IL-4 für 48 Stunden präinkubiert bevor PHA dem Stimulationsansatz zugefügt wird. Im Stimuationsansatz mit PHA alleine wird zunächst eine Inkubation der Zellen mit Medium für 48 Stunden vorgenommen, anschließend erfolgt die Zugabe von 20 µg/ml PHA und eine weitere Inkubation der CBMC für 24 Stunden. Nach insgesamt 72 Stunden werden die Zellüberstände abgezogen. Bei Stimulation mit IL-18 und IL-4 alleine werden die CBMC für 72 Stunden mit den beiden Zytokinen stimuliert. In den Stimulationsansätzen mit IL-18, IL-4 oder IL-18 und IL- 4 in Kombination mit PHA wird jeweils für 48 Stunden eine Inkubation der CBMC mit dem entsprechenden Zytokin oder deren Kombination durchgeführt und anschließend für weitere 24 Stunden PHA dem Stimulationsansatz zugefügt. Nach insgesamt 72 Stunden erfolgt dann ebenfalls die Abnahme der Zellüberstände. Ergebnisse 48 6000 5000 IFNg [pg/ml] 4000 3000 2000 1000 0 IL-18 Neg PHA IL-18+IL-4 IL- 4 IL-18+IL-4 PHA Abb. 3.8.: IFN-γ-Konzentration in den Zellüberständen von CBMC nach Präinkubation mit IL-18, IL4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA. Dargestellt sind die Einzelwerte der in 16 Experimenten ermittelten IFN-γ-Konzentrationen der Zellüberstände in pg/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Konzentrationen der im Stimulationsansatz verwendeten Zytokine betrugen 400 ng/ml IL18 und 25 U/ml IL-4. Die Stimulation mit 20 µg/ml PHA erfolgte nach abgeschlossener Präinkubation für 24 Stunden. Die Stimulation der CBMC mit PHA alleine führt gegenüber der Negativkontrolle zu einer Zunahme der IFN-γ-Produktion von 25,2 pg/ml auf 776,8 pg/ml. Die Inkubation der CBMC mit IL-18 und IL-4 alleine führt gegenüber der Negativkontrolle zu keinem Effekt auf die IFN-γ-Freisetzung (Neg: 25,2 pg/ml; IL-18 + IL-4: 4,7 pg/ml). Die Präinkubation der CBMC mit IL-18 und die anschließende Stimulation mit PHA führt gegenüber der Stimulation mit PHA alleine zu einem Anstieg der IFN-γ-Konzentration von 776,8 pg/ml auf 915,6 pg/ml. Die Präinkubation mit IL-4 führt im Vergleich zu der Stimulation mit PHA zu einer Reduktion der IFN-γ-Konzentration auf 564,6 pg/ml. Präinkubation mit IL-18 und IL-4 führt zu einer IFN-γ-Konzentration 467,8 pg/ml im Zellüberstand. Beschrieben sind die aus 16 Experimenten ermittelten Medianwerte (siehe Abb. 3.8.). Ergebnisse 49 800 700 600 IL-13 [pg/ml] 500 400 300 200 100 0 IL-18 Neg PHA IL-18+IL-4 IL-4 IL-18+IL-4 PHA Abb. 3.9.: IL-13-Konzentration in den Zellüberständen von CBMC nach Präinkubation IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA. Dargestellt sind die Einzelwerte der in 16 Experimenten ermittelten IL-13-Konzentrationen der Zellüberstände in pg/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Konzentrationen der im Stimulationsansatz verwendeten Zytokine betrugen 400 ng/ml IL18 und 25 U/ml IL-4. Die Stimulation mit 20 µg/ml PHA erfolgte nach abgeschlossener Präinkubation für 24 Stunden. Die IL-13-Konzentration im Zellüberstand wird durch Stimulation mit PHA gegenüber der Negativkontrolle von 14,4 pg/ml auf 157,1 pg/ml gesteigert. Die Inkubation der CBMC mit IL-18 und IL-4 alleine zeigt gegenüber der Negativkontrolle keinen Effekt auf die IL-13Freisetzung (Neg.: 14,4 pg/ml; IL-18 + IL-4: 30,8 pg/ml). Die Präinkubation mit IL-18 für 48 Stunden und anschließende PHA-Zugabe führt zu einer der Stimulation mit PHA alleine vergleichbaren IL-13-Freisetzung von 148,6 pg/ml. Präinkubation mit IL-4 und nachfolgende PHA-Stimulation der Zellen führt gegenüber der Stimulation mit PHA alleine zu einem Anstieg der IL-13-Konzentration auf 201,5 pg/ml. Die Präinkubation mit IL-18 und IL-4 Ergebnisse 50 führt gegenüber der Präinkubation mit IL-18 zu einer Steigerung der IL-13-Sekretion von 148,6 pg/ml auf 254,4 pg/ml. Beschrieben sind die aus 16 Experimenten ermittelten Medianwerte (siehe Abb. 3.9.). 3.5. Wirkung von IL-18 auf die Zytokinsekretion stimulierter CD4+ Zellen Durch Hoshino et al. konnte im Mausmodell aufgezeigt werden, dass CD4+ Zellen eine zentrale Bedeutung bei der Induktion einer Th2-Immunantwort durch IL-18 zukommt (Hoshino, Yagita et al. 2000). Im folgenden soll daher die Wirkung von IL-18 auf PHAbeziehungsweise BLG-stimulierte reine CD4+ Zellen untersucht werden. CD4+ Zellen wurden mittels Magnetic Activated Cell Sorting aus den CBMC isoliert. Die Reinheit der isolierten Zellen wurde durch Immunotypisierung dokumentiert. Bei allen Experimenten wurde eine Reinheit von mindestens 84 % (Median 95,2 %) erreicht. Ergebnisse a) Abb. 3.10.: Durchflusszytometrische Immunotypisierung von CBMC mittels FACS. a) Der Forward Scatter (FSC) ist auf der Abszisse, der Sideward Scatter (SSC) auf der Ordinate abgebildet. Die Lymphozyten sind durch das Gate markiert. 51 b) Quadrant UL UR LL LR Events 39 1525 1289 429 %Gated 1,19 46,47 39,27 13,07 %Total 0,78 30,50 25,78 8,58 b) Die in Abb. 3.10.a) durch das Gate markierten Zellen werden entsprechend ihrer Fluoreszenzeigenschaften in den vier Quadranten abgebildet. Die Markierung der Zellen erfolgte mittels PE-markierter Antikörper gegen CD4 und FITC-markierter Antikörper gegen CD3. Die Fluoreszenz 1 (FL1) entspricht der CD3-Markierung, die Fluoreszenz 2 (FL2) stellt die Markierung von CD4 dar. In der Tabelle sind die prozentualen Anteile der Quadranten an der in Abb. 3.10.a) dargestellten Gesamtpopulation bzw. an der durch das Gate markierten Zellpopulation der Lymphozyten dargestellt. Ergebnisse a) Abb. 3.11.: Durchflusszytometrische Immunotypisierung von isolierten CD4+ Zellen mittels FACS. a) Der Forward Scatter (FSC) ist auf der Abszisse, der Sideward Scatter (SSC) auf der Ordinate abgebildet. Die Lymphozyten sind durch das Gate markiert. 52 b) Quadrant UL UR LL LR Events 4 4659 38 9 %Gated 0,08 98,92 0,81 0,19 %Total 0,08 93,18 0,76 0,18 b) Die in Abb. 3.11.a) durch das Gate markierten Zellen werden entsprechend ihrer Fluoreszenzeigenschaften in den vier Quadranten abgebildet. Die Markierung der Zellen erfolgte mittels PE-markierter Antikörper gegen CD4 und FITC-markierter Antikörper gegen CD3. Die Fluoreszenz 1 (FL1) entspricht der CD3-Markierung, die Fluoreszenz 2 (FL2) stellt die Markierung von CD4 dar. In der Tabelle sind die prozentualen Anteile der Quadranten an der in Abb. 3.11.a) dargestellten Gesamtpopulation bzw. an der durch das Gate markierten Zellpopulation der Lymphozyten dargestellt. Im Rahmen der Stimulationsversuche isolierter CD4+ Zellen wurden Zellkulturen durchgeführt, deren Kulturbedingungen denen der Präinkubationsversuche von CBMC entsprachen. Für die Stimulation isolierter CD4+ Zellen mit PHA alleine erfolgte zunächst eine Inkubation der Zellen mit Medium für 48 Stunden, anschließend wurde nach Zugabe von PHA eine weitere Inkubation für 24 Stunden angeschlossen. Nach insgesamt 72 Stunden wurden die Überstände abgezogen. Bei Stimulation mit IL-18, IL-4 oder IL-18 und IL-4 alleine wurden die isolierten CD4+ Zellen für 72 Stunden mit den jeweiligen Zytokinen stimuliert. Die Konzentrationen der im Stimulationsansatz verwendeten Zytokine betrugen 400 ng/ml IL-18 und 25 U/ml IL-4. In den Stimulationsansätzen mit IL-18, IL-4 oder IL-18 und IL- 4 in Kombination mit PHA wurde jeweils für 48 Stunden eine Inkubation der Ergebnisse 53 isolierten CD4+ Zellen mit dem entsprechenden Zytokin oder deren Kombination durchgeführt und anschließend für weitere 24 Stunden PHA dem Stimulationsansatz zugefügt. Nach insgesamt 72 Stunden erfolgte dann ebenfalls die Abnahme der Zellüberstände. In den Stimulationsansätzen mit IL-18, IL-4 oder IL-18 und IL- 4 in Kombination mit BLG erfolgte eine Inkubation der CBMC mit dem entsprechenden Zytokin oder deren Kombination für 48 Stunden, anschließend wurde für weitere fünf Tage BLG dem Stimulationsansatz zugefügt. Nach insgesamt sieben Tagen wurde die Abnahme der Zellüberstände durchgeführt. 4000 IFNg [pg/ml] 3500 2500 2000 1500 1000 500 0 Neg PHA BLG IL-18 IL-4 IL-18+IL-4 IL-18 IL-4 IL-18+IL-4 PHA Abb. 3.12.: IL-18 IL-4 IL-18+IL-4 BLG IFN-γ-Konzentration in den Zellüberständen von CD4+ Zellen nach Präinkubation mit IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA oder BLG. Dargestellt sind die Einzelwerte der in 9 Experimenten ermittelten IFN-γKonzentrationen der jeweiligen Stimulationsansätze in ng/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Konzentrationen der im Stimulationsansatz verwendeten Zytokine betrugen 400 ng/ml IL-18 und 25 U/ml IL4. Die Stimulation mit 20 µg/ml PHA erfolgte nach abgeschlossener Präinkubation für 24 Stunden. Die Stimulation mit 25 µg/ml BLG wurde nach Abschluss der Präinkubation für fünf Tage durchgeführt. Ergebnisse 54 Stimulation von CD4+ Zellen mit PHA führt gegenüber der Negativkontrolle zu einem Anstieg der IFN-γ-Konzentration von 1,2 pg/ml auf 76,3 pg/ml. Die Stimulation von CD4+ Zellen mit IL-18, IL-4 oder IL-18 und IL-4 alleine zeigt im Vergleich zu der Negativkontrolle keinen Effekt auf die IFN-γ-Konzentration im Zellüberstand. Die Stimulation der CD4+ Zellen mit IL-18 und PHA führt gegenüber der Stimulation mit PHA alleine zu einem Anstieg der IFN-γ-Konzentration von 76,3 pg/ml auf 308,5 pg/ml. Die IFN-γ-Konzentration nach Stimulation mit IL-4 und PHA betrug 338,8 pg/ml. Nach Stimulation mit IL-4 und IL-18 und PHA wurde eine IFN-γ-Konzentration von 383,2 pg/ml nachgewiesen. Bei der allergenspezifischen Stimulation mit BLG resultieren durchgehend niedrige IFN-γKonzentrationen in den Zellüberständen. Die Stimulation von CD4+ Zellen mit BLG alleine oder in Kombination mit den entsprechenden Zyokinzusätzen zeigt im Vergleich zur Negativkontrolle keinen Effekt auf die IFN-γ-Konzentration (Neg: 1,2 pg/ml; BLG: 1,1 pg/ml; IL-18 + BLG: 2,6 pg/ml; IL-4 + BLG: 2,4 pg/ml; IL-18 + IL-4 + BLG: 1,5 pg/ml; siehe Abb. 3.12.). Ergebnisse 55 600 IL-13 [pg/ml] 150 100 50 0 Neg PHA BLG IL-18 IL-4 IL-18+IL-4 IL-18 IL-4 IL-18+IL-4 PHA IL-18 IL-4 IL-18+IL-4 BLG Abb. 3.13.: IL-13-Konzentration in den Zellüberständen von CD4+ Zellen nach Präinkubation mit IL-18, IL-4 oder IL-18 und IL-4 und anschließender Stimulation mit PHA oder BLG. Dargestellt sind die Einzelwerte der in 9 Experimenten ermittelten IL-13-Konzentrationen der jeweiligen Stimulationsansätze in ng/ml. Der Median ist durch einen waagerechten Strich gekennzeichnet. Die Konzentrationen der im Stimulationsansatz verwendeten Zytokine betrugen 400 ng/ml IL-18 und 25 U/ml IL-4. Die Stimulation mit 20 µg/ml PHA erfolgte nach abgeschlossener Präinkubation für 24 Stunden. Die Stimulation mit 25 µg/ml BLG wurde nach Abschluss der Präinkubation für fünf Tage durchgeführt. Die Stimulation von CD4+ Zellen mit PHA führt zu einem Anstieg der IL-13-Konzentration von 0,9 pg/ml der Negativkontrolle auf 28,9 pg/ml. Die Inkubation von CD4+ Zellen mit IL18, IL-4 oder IL-18 und IL-4 hat gegenüber der Negativkontrolle keinen Effekt auf die IL-13Konzentration im Zellüberstand (IL-18: 0,8 pg/ml; IL-4: 1,2 pg/ml; IL-18 + IL-4: 2,1 pg/ml). Die Stimulation mit IL-18 und PHA führt gegenüber der Stimulation mit PHA alleine zu einem Anstieg der IL-13-Konzentration im Zellüberstand von 28,9 pg/ml auf 35,2 pg/ml. Ergebnisse 56 Stimulationen mit IL-4 oder IL-18 und IL-4 in Kombination mit PHA führen Vergleich zu der Stimulation mit PHA alleine zu keiner Veränderung der IL-13-Konzentration (IL-4 + PHA: 27,6 pg/ml; IL-18 + IL-4 + PHA 21,2 pg/ml). Die Stimulation von CD4+ Zellen mit BLG alleine oder in Kombination mit den entsprechenden Zyokinzusätzen zeigt im Vergleich zu der Negativkontrolle keinen Effekt auf die IL-13-Konzentration im Zellüberstand (BLG: 0,6 pg/ml; IL-18 + BLG: 0,8 pg/ml; IL-4 + BLG: 2,5 pg/ml; IL-18 + IL-4 + BLG: 2,2 pg/ml; siehe Abb. 3.13.). Diskussion 57 4. Diskussion Das Ziel dieser Arbeit bestand darin, die IL-18-Konzentration im Zellüberstand mononukleärer Nabelschnurblutzellen sowie die Effekte von IL-18 auf die Freisetzung von IFN-γ und IL-13 durch neonatale mononukleäre Zellen in vitro zu untersuchen. Die Konzentrationen der Zytokine IFN-γ und IL-13 sollen modellhaft das Vorliegen einer Th1bzw. Th2-Immunantwort verdeutlichen. IL-18 ist ein neues Mitglied der IL-1-Familie und wurde zunächst als „Interferon-γ inducing factor“ bezeichnet (Okamura, Tsutsi et al. 1995; Okamura, Tsutsui et al. 1998; Dinarello 1999; Fantuzzi and Dinarello 1999). Die Induktion einer IFN-γ-Freisetzung durch IL-18 wurde für Th1-Zellen, nicht polarisierte T-Zellen, B-Zellen, NK-Zellen und dendritische Zellen beschrieben (Yoshimoto, Okamura et al. 1997; Okamura, Kashiwamura et al. 1998; Okamura, Tsutsui et al. 1998; Yoshimoto, Takeda et al. 1998). Bezüglich dieser Th1induzierenden Wirkung liegt ein starker Synergismus von IL-18 mit IL-12 vor. IL-18 führt zu einer Hochregulation der IL-12Rβ-Expression und verstärkt dadurch die IL-12-vermittelte Th1-Induktion. Bei Abwesenheit von IL-12 ist IL-18 nicht in der Lage, die Ausreifung naiver T-Zellen zu Th1-Zellen, erkennbar an der Induktion der IFN-γ-Sekretion, zu stimulieren (Chang, Segal et al. 2000). In Abwesenheit von IL-12 kommt IL-18 sogar eine Th2induzierende Wirkung zu (Nakanishi, Yoshimoto et al. 2001). Im Mausmodell zeigen Stimulationsversuche mit IL-18 in Abwesenheit von IL-12 eine deutliche Induktion der Th2Zytokine IL-4, IL-10 und IL-13 (McKenzie, Emson et al. 1998; Hoshino, Wiltrout et al. 1999; Hoshino, Yagita et al. 2000; Wild, Sigounas et al. 2000). Die IL-18-Sekretion durch LPS-stimulierte PBMC ist bei Patienten mit Asthma bronchiale oder atopischer Dermatitis im Vergleich zu nichtallergischen Kontrollpersonen signifikant erhöht. Zwischen der IL-18-Konzentration im Zellüberstand von PBMC und dem Serum-IgE Spiegel ergab sich bei Patienten mit akutem Asthma bronchiale eine positive Korrelation (ElMezzein, Matsumoto et al. 2001). Bezüglich der Unterschiede zwischen der IL-18Plasmakonzentration von Atopikern und der nichtatopischen Kontrollgruppe liegen widersprüchliche Ergebnisse vor. Während El-Mezzein et al. keinen Unterschied zwischen der Plasma-IL-18-Konzentration von Atopikern und der nichtatopischen Kontrollgruppe aufzeigen konnten (El-Mezzein, Matsumoto et al. 2001), wurde durch Wong et al. und Tanaka Diskussion 58 et al. nachgewiesen, dass die Plasma IL-18-, IL-12-, IL-10- und IL-13-Konzentrationen bei Asthmatikern gegenüber der nichtatopischen Kontrollgruppe signifikant erhöht sind (Tanaka, Miyazaki et al. 2001; Wong, Ho et al. 2001). In einem murinen Modell des allergischen Asthma bronchiale ist IL-18 in der Lage, die allergische Sensibilisierung, die Serum IgE-Spiegel, Th2-Zytokinspiegel und die Eosinophilienzahl in den Atemwegen zu erhöhen (Kumano, Nakao et al. 1999; Wild, Sigounas et al. 2000). Die Erhöhung der Serum-IL-18-Konzentration führt im Mausmodell zu einer gesteigerten Sekretion von IL-4 und IL-13, die bei Anwesenheit von CD4+ Zellen in einer gesteigerten IgE-Freisetzung resultiert (Yoshimoto, Mizutani et al. 2000). Die im Rahmen der genannten Studien zum experimentellen Asthma bronchiale verwendeten BALB/c Mäuse sind durch eine ausgeprägte IL-4-Sekretion und Th2-Induktion gekennzeichnet (Himmelrich, Launois et al. 2000). Aufgrund der guten Induzierbarkeit einer Th2-Immunantwort werden BALB/c Mäuse daher häufig für experimentelle Studien atopischer Erkrankungen verwendet. Wie bereits erwähnt ist IL-18 in Abhängigkeit der Stimulationsbedingungen sowohl zur Induktion einer Th1- als auch einer Th2-Immunantwort in der Lage. Atopiker weisen eine erhöhte Freisetzung von IL-18 durch PBMC (El-Mezzein, Matsumoto et al. 2001) sowie erhöhte Serum-IL-18-Konzentrationen (Tanaka, Miyazaki et al. 2001; Wong, Ho et al. 2001) auf. In diesem Zusammenhang sind Unterschiede des intrauterinen Zytokinmilieus zwischen atopischen und nichtatopischen Müttern denkbar. Die Amnionflüssigkeit atopischer Mütter weist im Vergleich zu nichtatopischen Müttern eine höhere IL-10 Konzentration auf (Warner, Jones et al. 1998). Untersuchungen der IL-18-Konzentration in der Amnionflüssigkeit atopischer Mütter sind bis zu diesem Zeitpunkt nicht erbracht worden. Eine erhöhte amniale IL-18-Konzentration bei nachweisbar erhöhter Plasma-IL-18-Konzentration ist bei Atopikerinnen allerdings nicht ausgeschlossen. Aufgrund der erhöhten Plasma-IL-18-Spiegel könnte IL-18 bei Atopikerinnen bereits intrauterin eine Wirkung auf die Reifung der neonatalen Th1/Th2-Immunantwort zukommen. Um den Einfluss von IL-18 auf das neonatale Th1/Th2-Gleichgewicht sowie die Reifung der kindlichen Immunantwort näher zu charakterisieren, wurde im Rahmen dieser Arbeit untersucht, ob IL-18 im Zellüberstand stimulierter Nabelschnurblutzellen nachweisbar ist, und wie IL-18 unter verschiedenen Stimulationsbedingungen das Th1/Th2-Gleichgewicht neonataler CBMC in vitro beeinflusst. Diskussion 4.1. 59 Nachweis der IL-18-Sekretion durch CBMC IL-18 wird von Monozyten, T-Zellen, B-Zellen und dendritischen Zellen sezerniert (Stoll, Jonuleit et al. 1998), welche Subpopulationen der mononukleären Nabelschnurblutzellen darstellen (Tsegaye, Wolday et al. 2003). Gardella et al. konnten die Expression von pro-IL18 durch LPS-aktivierte dendritische Zellen und Monozyten in vitro aufzeigen. Die Freisetzung von pro-IL-18 in den Zellüberstand erfolgt nach Interaktion der dendritischen Zellen mit T-Lymphozyten (Gardella, Andrei et al. 2000). Durch Kohka et al. konnte in vitro eine dosisabhängige Induktion der IL-18-Freisetzung mononukleärer Zellen durch LPS nachgewiesen werden (Kohka, Iwagaki et al. 1999). In der vorliegenden Arbeit konnte durch Stimulation von CBMC mit Medium alleine, PHA oder BLG nachgewiesen werden, dass IL-18 in messbaren Konzentrationen durch mononukleäre Nabelschnurblutzellen freigesetzt wird. Zwischen der Negativkontrolle und den Stimulationsansätzen mit PHA oder BLG zeigen sich keine signifikanten Unterschiede hinsichtlich der IL-18-Konzentrationen im Zellüberstand. Die IL-18-Sekretion durch CBMC steigt nach Stimulation mit PHA oder BLG gegenüber der Negativkontrolle nicht an (siehe Abb. 3.1.). Somit stellen PHA und BLG keinen potenten Stimulus hinsichtlich der Induktion der IL-18-Sekretion durch neonatale mononukleäre Zellen dar. Es ist daher davon auszugehen, dass in den Stimulationsansätzen eine PHA- oder BLG-vermittelte Induktion der Freisetzung von IL-18 zu vernachlässigen ist. Im Gegensatz zu IL-18 stellen PHA und BLG jedoch potente Stimulantien der IL-13- und IFN-γ-Freisetzung dar. Deshalb sind in dieser Arbeit PHA und BLG eingesetzt worden, um Effekte auf die Freisetzung von IL-13 und IFNγ zu untersuchen. Die gemessenen IL-18-Konzentrationen im Überstand mononukleärer Nabelschnurblutzellen lagen im Median bei 20 pg/ml. Diese Konzentration liegt deutlich unter den Plasmaspiegeln von gesunden und atopischen Erwachsenen. Entsprechend der Ergebnisse von Wong et al. besteht bei Patienten mit allergischem Asthma bronchiale im Vergleich zu der gesunden Kontrollgruppe eine signifikant höhere Plasma IL-18-Konzentration. Bei adulten Atopikern konnte im Median eine Plasma IL-18-Konzentration von 228 pg/ml ermittelt werden. Die IL18 Konzentration der gesunden Kontrollgruppe betrug 139 pg/ml (Wong, Ho et al. 2001). Bei Diskussion 60 dem genannten Vergleich ist jedoch zu beachten, dass in der vorliegenden Arbeit Zytokinspiegel von Zellüberständen in vitro und keine Plasmaspiegel gemessen wurden. Als mögliche Ursachen für die geringen IL-18-Konzentration bei CBMCs kommen zum einen die Unreife der neonatalen mononukleären Nabelschnurblutzellen sowie zum anderen die Sekretion von IL-18 durch Zellpopulationen, die nicht im Stimulationsansatz der CBMC enthalten sind, jedoch durch IL-18-Sekretion die Plasma-IL-18-Konzentration in vivo beeinflussen, in Betracht. 4.2. Einfluss von IL-18 auf das Th1/Th2-Zytokinprofil mononukleärer Nabelschnurblutzellen In weiteren Experimenten wurde der Effekt von IL-18 auf das Zytokinexpressionsmuster von CBMC untersucht. Die Stimulation von CBMC mit IL-18 sowie PHA oder BLG führt in Abhängigkeit von der IL-18-Konzentration und der Stimulationsdauer zu einer deutlichen Induktion der IFN-γ-Freisetzung. Insbesondere bei einer Stimulationsdauer von 48 Stunden und einer IL-18-Konzentration von 200 ng/ml zeigt sich gegenüber der Stimulation mit PHA alleine eine starke Zunahme der IFN-γ-Sekretion. Dass es sich dabei um ein valides Resultat handelt zeigen auch die BLG-Ansätze, bei denen ebenfalls eine signifikante Zunahme der IFN-γ-Konzentration im Zellüberstand nach Stimulation mit IL-18 und BLG gegenüber der Stimulation mit BLG alleine nachgewiesen werden konnte (siehe Abb. 3.2., Tab. 3.1.und Tab. 3.2.). Die in der vorliegenden Arbeit beobachtete IFN-γ-induzierende Wirkung von IL-18 bestätigt Ergebnisse anderer Arbeitsgruppen. IL-18 induziert die IFN-γ-Freisetzung durch Th1-Zellen, nicht polarisierte T-Zellen, B-Zellen, NK-Zellen und dendritische Zellen (Okamura, H., Tsutsui, H. et al. 1998; Yoshimoto, T. et al. 1998). Für diesen Effekt ist ein Synergismus mit IL-12 beschrieben (Yoshimoto, Okamura et al. 1997; Okamura, Kashiwamura et al. 1998; Okamura, Tsutsui et al. 1998; Yoshimoto, Takeda et al. 1998). Dieser Synergismus basiert unter anderem auf der Hochregulation der IL-12Rβ-Expression durch IL-18, und infolge dessen auf einer Verstärkung der IL-12-vermittelten Th1-Induktion (Xu, Chan et al. 1998; Diskussion 61 Chang, Segal et al. 2000). Im Mausmodell konnte zudem eine Stimulation der Expression von IL-18R durch IL-12 aufgezeigt werden (Xu, Chan et al. 1998). Für IL-18 alleine konnte hingegen keine Induktion der Reifung naiver T-Zellen zu Th1-Zellen nachgewiesen werden (Robinson, Shibuya et al. 1997). Durch die Stimulation von CBMC konnte im Rahmen der vorliegenden Arbeit erstmals der IFN-γ-induzierende Effekt von IL-18 auf neonatale mononukleäre Zellen aufgezeigt werden. Während die Zugabe von IL-18 zu PHA- oder BLG-stimulierten CBMC zu einem signifikanten Anstieg der IFN-γ-Freisetzung führt, hat die Stimulation mit IL-18 alleine gegenüber der Negativkontrolle in der Kurzzeitkultur keinen Effekt auf die IFN-γ-Sekretion (siehe Tab. 3.1.und Tab. 3.2.). Diese Ergebnisse werden bestätigt durch Nakanishi et al., die als Voraussetzung für die Induktion der Reifung von Th1- oder Th2-Zellen eine T-ZellRezeptoraktivierung beispielsweise durch anti-CD3 betrachten (Nakanishi 2001). Eine solche T-Zell-Aktivierung wird in den hier durchgeführten Stimulationsansätzen durch BLG und PHA erreicht. Während die IFN-γ-Produktion üblicherweise von einer T-Zellrezeptor-vermittelten Aktivierung der T-Zellen durch Antigen oder anti-CD3 abhängt, wird bei der Kombination von IL-18 und IL-12 im Stimulationansatz eine T-Zellrezeptor-unabhängige Sekretion von IFN-γ induziert (Ahn, Maruo et al. 1997; Yoshimoto, Okamura et al. 1997; Yoshimoto, Takeda et al. 1998; Yang, Murphy et al. 1999; Tominaga, Yoshimoto et al. 2000). Dieser Zusammenhang könnte die Ursache dafür darstellen, dass gegenüber der Stimulation für 48 h nach der Stimulationsdauer von fünf Tagen auch bei Stimulation mit IL-18 alleine eine deutliche Induktion der IFN-γ-Sekretion nachweisbar war (siehe Tab. 3.1.und Tab. 3.2.). Die Anwesenheit weiterer Zytokine, wie beispielsweise IL-12, im Zellüberstand könnte somit für die Th1-induzierende Wirkung des IL-18 von Bedeutung sein. Diese Erklärung bleibt jedoch insofern hypothetisch, da in unseren Zellüberständen nur die Konzentration von IFN-γ gemessen wurde, jedoch nicht die von IL-12. Das Ausmaß der IFN-γ-Freisetzung ist bei allergenspezifischer Stimulation mit BLG wesentlich niedriger als bei der Stimulation mit PHA. Als Ursache für die geringere stimulatorische Wirkung von BLG im Vergleich zu PHA kommt die bei Neonaten unreife Funktion antigenpräsentierender Zellen in Betracht (Taylor and Bryson 1985). Dendritische Zellen sind antigenpräsentierende Zellen, die für die Initiation einer Immunantwort von großer Bedeutung sind (Steinman 1991). Bei neonatalen dendritischen Zellen konnte ein Diskussion 62 Defekt der Expression der p35-Untereinheit von IL-12 gezeigt werden. Dieser resultiert in einer verminderten Sekretion des bioaktiven IL-12(p70)-Heterodimers, einhergehend mit einer reduzierten Induktion der IFN-γ-Produktion durch T-Zellen (Goriely, Vincart et al. 2001). Die reduzierte Fähigkeit neonataler dendritischer Zellen, CD4+ Zellen zu der Freisetzung von IFN-γ zu stimulieren lässt darauf schließen, dass neonatale DCs primär nicht auf die Entwicklung einer Th1-Immunantwort programmiert sind (Langrish, Buddle et al. 2002). Da dendritische Zellen ebenfalls eine Subpopulation der CBMCs darstellen erscheint es plausibel, dass die funktionelle Unreife von neonatale DCs zu einer reduzierten Zytokininduktion nach allergenspezifischer Stimulation mit BLG gegenüber der mitogenen Stimulation mit PHA beitragen kann. Die Differenzierung naiver CD4+ Zellen zu Th1- oder Th2-Zellen scheint maßgeblich von dem umgebenden Zytokinmilieu abzuhängen. Während IL-12 die Differenzierung in Richtung Th1-Immunantwort stimuliert, induzieren IL-4 und IL-13 die Reifung von Th2-Zellen. Nach Xu et al. hat IL-18 eine synergistische Wirkung mit IL-12 hinsichtlich der Th1-Induktion, kann bei Abwesenheit von IL-12 und T-Zell-Rezeptoraktivierung jedoch eine Th2-Induktion von CD4+ T-Zellen hervorrufen. Dieser Effekt der Th2-Induktion ist in An- und Abwesenheit von IL-4 nachweisbar und wird durch IL-12 gehemmt (Xu, Trajkovic et al. 2000). Bei der Stimulation von CBMC mit PHA oder BLG zeigt sich eine deutliche Zunahme der IL13-Sekretion in Abhängigkeit von der Stimulationsdauer (siehe Abb. 3.3.). Die Zugabe von IL-18 und PHA zu CBMC führt jedoch unabhängig von der Stimulationsdauer gegenüber der Stimulation mit PHA alleine zu keinem additiven Effekt auf die IL-13-Sekretion. Bei der allergenspezifischen Stimulation mit BLG führt die Zugabe von 200 ng/ml IL-18 gegenüber der Stimulation mit BLG alleine nicht zu einer Steigerung, sondern zu einer signifikanten Reduktion der IL-13-Konzentration im Zellüberstand (siehe Abb. 3.3., Tab. 3.2. und Abb. 3.7.). Im Rahmen der dargestellten Stimulationsversuche konnte eine signifikante Induktion der IFN-γ-Sekretion bei der Stimulation mit PHA oder BLG durch die Zugabe von IL-18 nachgewiesen werden. Bei der Stimulation mit BLG über fünf Tage wurde diese Induktion der IFN-γ-Sekretion von einer signifikanten Reduktion der IL-13-Sekretion begleitet. Bei der Stimulation mit IL-18 und PHA für 24 oder 48 h konnte demgegenüber kein Effekt auf die IL-13-Konzentration im Zellüberstand nachgewiesen werden. Für IL-18 alleine konnte bislang keine Induktion der Reifung naiver T-Zellen zu Th1-Zellen nachgewiesen werden (Robinson, Shibuya et al. 1997). Obgleich neonatale dendritische Diskussion 63 Zellen durch eine verminderte IL-12(p70)-Sekretion gekennzeichnet sind, wäre bei Vorliegen auch geringer Konzentrationen von IL-12 im Zellüberstand eine Induktion des Th1-Zytokins IFN-γ durch die synergistische Wirkung von IL-12 und IL-18 in der Zellkultur denkbar. IL-12 und IFN-γ führten in diesem Fall zu einer Inhibition des Th2-induzierenden Effektes von IL18. In diesem Zusammenhang lässt sich die signifikante Reduktion der IL-13-Sekretion nach der Zugabe von IL-18 zu BLG-stimulierten CBMC erklären. Die Tatsache, dass dieser Effekt bei der Stimulation von CBMC mit IL-18 und PHA über 24 oder 48 h nicht nachweisbar war, könnte auf die kürzere Stimulationsdauer gegenüber der Stimulation mit BLG für fünf Tage zurückgeführt werden. Zusammenfassend ist im Rahmen der allergenspezifischen und mitogenen Stimulation von CBMC somit eine deutliche Th1-induzierende Wirkung von IL-18 nachweisbar. Ein Th2induzierender Effekt konnte für IL-18 hingegen nicht festgestellt werden. 4.3. Einfluss der Präinkubation auf das Th1/Th2Zytokinprofil mononukleärer Nabelschnurblutzellen Da die Differenzierung naiver CD4+ Zellen maßgeblich von dem umgebenden Zytokinmilieu abhängt, sollte im Rahmen der Präinkubationsversuche von CBMC mit IL-4, IL-18 oder IL-4 und IL-18 und der anschließenden Stimulation mit PHA oder BLG der Effekt des umgebenden Zytokinmilieus auf CBMC näher untersucht werden. Die Präinkubation von CBMC mit IL-18 führt bei anschließender Stimulation mit PHA im Median zu einer Steigerung der IFN-γ-Sekretion gegenüber der Stimulation mit PHA alleine. Demgegenüber erbrachte die Präinkubation von CBMC mit IL-4 bei anschließender Stimulation mit PHA im Median eine Reduktion der IFN-γ-Freisetzung gegenüber der Stimulation mit PHA alleine. Diese Reduktion der IFN-γ-Sekretion wird durch Präinkubation mit IL-4 und IL-18 noch verstärkt (siehe Abb. 3.8.). Hinsichtlich der IL-13-Sekretion durch CBMC sind nach Stimulation mit PHA alleine und nach Präinkubation mit IL-18 und anschließender PHA-Stimulation vergleichbare IL-13Konzentration im Zellüberstand messbar. Die Präinkubation mit IL-4 und nachfolgende PHAStimulation führt gegenüber Stimulation mit PHA alleine zu einer Steigerung der IL-13- Diskussion 64 Freisetzung. Nach Präinkubation mit IL-4 und IL-18 resultiert eine höhere IL-13Konzentration im Zellüberstand als nach Präinkubation mit IL-4 alleine (siehe Abb. 3.9.). Bei den hier beschriebenen Ergebnissen handelt es sich um die Medianwerte aus 16 Experimenten. Die gesteigerte IL-13-Freisetzung nach Präinkubation mit IL-4 und IL-18 gegenüber der Präinkubation mit IL-4 oder IL-18 alleine konnte bei der Einzelfallbetrachtung bei 6 von 16 Experimenten aufgezeigt werden, während bei den übrigen neonatalen Proben kein Effekt erkennbar war. Die beschriebenen Unterschiede sind daher nicht signifikant. Im Rahmen der Stimulationsversuche mit vorheriger Präinkubation der CBMC lässt sich die Th1-induzierende Wirkung von IL-18 nochmals bestätigen. Erkennbar wird die Induktion einer Th1-Immunantwort bei Präinkubation der CBMC mit IL-18 durch eine gesteigerte IFNγ- und eine gleich bleibende IL-13-Konzentration im Zellüberstand. Für IL-4 kann wie erwartet die Induktion einer Th2-Immunantwort nachgewiesen werden. Diese äußert sich in einer Reduktion der IFN-γ-Sekretion und einer Steigerung der IL-13-Freisetzung gegenüber der Stimulation mit PHA alleine. Im Gegensatz zu der Präinkubation mit IL-18 alleine zeigt die Präinkubation mit IL-4 und IL18 einen Th2-induzierenden Effekt. Bei der Präinkubation mit IL-4 und IL-18 kommt es gegenüber der Präinkubation mit IL-18 alleine im Median zu einem Abfall des Th1-Zytokins IFN-γ und einem Anstieg des Th2-Zytokins IL-13 im Zellüberstand. Die durch IL-4 und IL-18 induzierte Zytokinsekretion zeigt zudem eine höhere IL-13-Konzentration im Zellüberstand als nach Präinkubation mit IL-4 alleine (siehe Abb. 3.9). Die vorgestellten Ergebnisse weisen darauf hin, dass IL-18 in Abhängigkeit von dem umgebenden Zytokinmilieu offenbar sowohl eine Th1-, als auch eine Th2-induzierende Wirkung zukommt. Durch Yoshino et al. konnte gezeigt werden, dass naive T-Zellen, die mit IL-2 und IL-18 ohne T-Zellrezeptoraktivierung stimuliert werden, CD40L exprimieren und eine große Menge IL-13 und geringe Mengen an IL-4 produzieren. Diese aktivierten T-Zellen differenzieren zu Th2-Zellen. Die Durchführung der Stimulation mit Zusatz von Anti-IL-4-Antikörpern führt zu der Differenzierung der naiven CD4+-Zellen zu Th1-Zellen. IL-18 führt demnach in Abhängigkeit von IL-4 zu einer Th2-Induktion (Yoshimoto, Mizutani et al. 2000). Die Ergebnisse der vorliegenden Arbeit unterstützen diese Hypothese. Während bei der mitogenen bzw. antigenspezifischen Stimulation in Kombination mit IL-18 der Th1-induzierende Effekt des IL-18 überwiegt, kann durch eine Zugabe von IL-4 zum Stimulationsansatz eine Th2induzierende Wirkung von IL-18 beobachtet werden. Diskussion 65 Wichtig für die Induktion einer Th2-Immunantwort durch IL-18 scheint nach Xu et al. die Abwesenheit von IL-12 im Stimulationsansatz zu sein. In Abwesenheit von IL-12 führt IL-18 zu einer Induktion von IL-4, IL-5 und IL-13 und zeigt daher eine deutliche Th2-induzierende Wirkung, wohingegen die IFN-γ-Sekretion stark reduziert ausfällt (Xu, Trajkovic et al. 2000). Anhand der hier dargestellten Ergebnisse könnte bei Neonaten, unabhängig von der Anwesenheit von IL-12 im Stimulationsansatz, auch das Überwiegen von Th2-Zytokinen im Stimulationsansatz für die Th2-induzierende Wirkung von IL-18 von Bedeutung sein. Deutlich wird dies durch den Th2-induzierenden Effekt der Präinkubation mit IL-4 und IL-18 gegenüber der Th1-induzierenden Wirkung der Präinkubation mit IL-18 alleine. 4.4. Wirkung von IL-18 auf die Zytokinsekretion von CD4+ Zellen Die Th2-induzierende Wirkung von IL-18 wird maßgeblich über CD4+ T-Zellen vermittelt. CD4+ T-Zellen exprimieren nach Stimulation mit IL-2 und IL-18 CD40L und sezernieren IL4 (Yoshimoto, Mizutani et al. 2000). Diese aktivierten T-Zellen differenzieren in Abhänigkeit von IL-4 zu Th2-Zellen. IL-18 induziert somit in Gegenwart von IL-4 die Th2-Polarisation von CD4+ T-Zellen (Yoshimoto, Mizutani et al. 2000). Durch Hoshino et al. wurde die Wirkung von IL-18 als Cofaktor für die Induktion von IL-4, IL-10, IL-13 und IFN-γ sowie die CD40L-induzierende Wirkung auf CD4+ T-Zellen bestätigt (Hoshino, Yagita et al. 2000). Darüber hinaus wurde für die Gabe von IL-18 und IL-2 im Mausmodell die Induktion von IgG1 und IgE nachgewiesen. Die Induktion dieser Immunglobuline, die im Rahmen einer Th2Immunantwort sezerniert werden, kann durch vorherige Verabreichung von anti-CD4Antikörpern gehemmt werden (Hoshino, Yagita et al. 2000). Demnach führt IL-18 zu einer Stimulation der Sekretion Th2-spezifischer Zytokine, sowie einer gesteigerten Expression von CD40L auf CD4+ T-Zellen, welche mit einer Induktion der IgE-Sekretion einhergehen (Hoshino, Yagita et al. 2000). Da für CD4+ T-Zellen bei der Vermittlung der IL-18-induzierten Th2-Immunantwort eine zentrale Rolle beschrieben ist (Yoshimoto, Mizutani et al. 2000), wurde in der vorliegenden Diskussion 66 Arbeit der Einfluss einer Präinkubation mit IL-18, IL-4 sowie IL-4 und IL-18 auf PHAstimulierte isolierte neonatale CD4+ Zellen untersucht. Dabei zeigte sich eine Steigerung der IFN-γ-Freisetzung nach Präinkubation mit IL-18, IL-4 oder IL-4 und IL-18 und anschließender PHA-Stimulation gegenüber der Stimulation mit PHA alleine. Hinsichtlich der IL-13-Sekretion nach Präinkubation neonataler CD4+ T-Zellen mit IL-18 und anschließender PHA-Stimulation zeigt sich im Vergleich zu der Stimulation mit PHA alleine kein Unterschied. Auch die Präinkubation mit IL-4 oder IL-4 und IL-18 hatte keinen Effekt auf die IL-13-Konzentration im Zellüberstand (siehe Abb. 3.12. und Abb.3.13.). Bei der Stimulation mit dem Mitogen PHA wird eine direkte Aktivierung der CD4+ Zellen induziert. Diese Stimulation ist somit unabhängig von der Funktion antigenpräsentierender Zellen. Bei der Stimulation neonataler CD4+ Zellen mit PHA ist nach Präinkubation mit den Zytokinen IL-18, IL-4 oder IL-18 und IL-4 eine Induktion der IFN-γ-Sekretion bei gleich bleibender IL-13-Freisetzung nachweisbar. Im Vergleich zu der Stimulation von CBMC resultiert bei der Stimulation isolierter CD4+ Zellen unter gleichen Stimulationsbedingungen eine deutlich geringere Zytokinsekretion. Durch Xu et al. konnte im Mausmodell nachgewiesen werden, dass naive CD4+ Zellen, die mit IL-18 stimuliert werden, IL-4, IL-5, IL-13 und IFN-γ freisetzen. Die IFN-γ-Freisetzung durch naive CD4+ T-Zellen betrug etwa das Fünffache der freigesetzten IL-13Konzentrationen (Xu, Trajkovic et al. 2000). Im Rahmen der Stimulation neonataler CD4+ Zellen mit vorheriger Präinkubation resultierte in der vorliegenden Arbeit unabhängig von den verwendeten Zytokinen eine jeweils vergleichbare IFN-γ- beziehungsweise IL-13Sekretion. Die IFN-γ-Konzentration betrug etwa das Fünffache der IL-13-Konzentration im Zellüberstand. Diese Beobachtungen führen zu der Annahme, dass nach der Präinkubation von neonatalen CD4+ Zellen mit IL-18, IL-4 oder IL-4 und IL-18 und anschließender PHAStimulation überwiegend naive CD4+ Zellen im Stimulationsansatz vorliegen könnten. Bei der allergenspezifischen Stimulation CD4+ T-Zellen mit BLG resultiert, unabhängig von vorheriger Präinkubation mit IL-18, IL-4 oder IL-4 und IL-18, eine IFN-γ- und IL-13Freisetzung, welche sich nicht von der der Negativkontrolle unterscheiden. Im Rahmen der adaptiven Immunität gilt, dass naive, antigenspezifische Lymphozyten nicht durch Antigene alleine aktiviert werden können. Naive T-Zellen benötigen für ihre Aktivierung ein kostimulierendes Signal von antigenpräsentierenden Zellen (Janeway, C.A.1999). Dendritische Zellen sind antigenpräsentierende Zellen, die T-Helferzellen über ein pathogenspezifisches Signal (MHC I bzw. MHC II), ein kostimulatorisches Signal (z.B. B7) Diskussion 67 (Banchereau and Steinman 1998) sowie über Zytokine wie beispielsweise IL-12 (Trinchieri 1995) aktivieren. Dendritische Zellen können in Abhängigkeit ihrer Reifungsbedingungen die Polarisation naiver T-Zellen in Richtung IFN-γ-produzierender Th1-Zellen oder IL-4-, IL-5und IL-10-sezernierender Th2-Zellen führen (Rissoan, Soumelis et al. 1999). Dabei wird postuliert, dass Negativ-Feedbackmechanismen zwischen unter verschiedenen Bedingungen gereiften DCs u.a. auch das Th1/Th2-Gleichgewicht regulieren (Rissoan, Soumelis et al. 1999). Das Fehlen der Zytokininduktion nach allergenspezifischer Stimulation mit BLG ist somit dadurch begründbar, dass für die Induktion einer allergenvermittelten Immunantwort die Anwesenheit von antigenpräsentierenden Zellen vorausgesetzt wird. Durch die hohe Reinheit der CD4+ Zellen im Stimulationsansatz dürfte jedoch keine ausreichende Anzahl antigenpräsentierender Zellen für die Induktion einer allergenspezifischen Immunantwort vorhanden sein. Die ausbleibende Zytokinsekretion nach Stimulation von CD4+ T-Zellen mit BLG ist damit plausibel. In der vorliegenden Arbeit konnte gezeigt werden, dass bei Stimulation mit IL-18 und PHA oder BLG in der Kurzzeitkultur wie auch bei vorheriger Präinkubation, der Th1-induzierende Effekt auf CBMC und neonatale CD4+ T-Zellen überwiegt. Bei der Präinkubation von CBMC mit IL-18 und anschließender PHA-Stimulation zeigt sich jedoch gegenüber der gleichzeitigen Stimulation mit IL-18 und PHA eine schwächere IL-18-vermittelte IFN-γInduktion. Naive CD45RA+ Nabelschnurblutzellen exprimieren den IL-18Rα (Bofill, Almirall et al. 2004). Im Rahmen der Differenzierung naiver T-Lymphozyten bleibt der IL-18R auf der Oberfläche von Th1-Lymphozyten exprimiert während er bei der Differenzierung zu Th2Zellen auf deren Oberfläche vollständig herunterreguliert wird (Xu, Chan et al. 1998). IL18Rα (IL-1R-related protein) wird somit selektiv auf der Oberfläche von Th1-Zellen, nicht jedoch auf der Oberfläche von Th2-Zellen exprimiert (Xu, Chan et al. 1998). Während der Reifung naiver T-Zellen zu Th1-Zellen erfolgt jedoch eine Reduktion der IL-18R-Expression, die in einer reduzierten Ansprechbarkeit auf IL-18 resultiert (Yoshimoto, Takeda et al. 1998). Geht man davon aus, dass im Rahmen der Präinkubation von CBMC mit IL-18 eine Reifung der naiven T-Zellen zu Th1-Zellen beginnt, so könnte die damit einhergehende Verminderung der IL-18R-Expression die reduzierte Ansprechbarkeit der CBMC auf die Stimulation mit IL18 hervorrufen. Diese resultierte in der nachgewiesenen schwächeren IFN-γ-Induktion nach der Präinkubation mit IL-18 und anschließender PHA-Stimulation im Vergleich zu der gleichzeitigen Stimulation naiver CBMC mit IL-18 und PHA. Diskussion 68 Um die Hypothese der im Rahmen der Präinkubation mit IL-18 beginnenden Differenzierung naiver T-Zellen zu Th1-Zellen zu sichern, sind weitere Experimente erforderlich. CD94 wird auf der Oberfläche von Th1, nicht jedoch auf der Oberfläche von Th2 Zellen exprimiert (Meyers, Ryu et al. 2002). Der Nachweis von CD94 auf der Zelloberfläche CD4+ Zellen könnte somit Th1- gegenüber naiven T-Zellen und Th2-Zellen abgrenzen. Daher erscheint der Versuch eines durchflusszytometrischen Nachweises von CD94 auf CD4+ CBMC sinnvoll. Ein Vergleich der CD94-Expression durch CD4+ Zellen von CBMC, die mit IL-18 präinkubiert und nachfolgend mit PHA stimuliert wurden und CBMC bei denen eine gleichzeitige Stimulation mit IL-18 und PHA erfolgte, könnte die Hypothese einer beginnenden Th1-Differenzierung im Rahmen der Präinkubationsversuche unterstützen. Im Gegensatz zu den Stimulationen mit IL-18 und PHA oder BLG, konnte in der vorliegenden Arbeit bei Stimulation mit IL-4 + IL-18 und PHA ein Th2-induzierender Effekt des IL-18 in Gegenwart von IL-4 aufgezeigt werden. Dieser Th2-induzierende Effekt ist bei der Präinkubation von CBMC mit IL-4 und IL-18 und nachfolgender Stimulation mit dem Mitogen PHA erkennbar und äußert sich in einer Induktion der IL-13-Sekretion und einer Reduktion der IFN-γ-Freisetzung (siehe Abb. 3.8. und Abb.3.9.). Die anhand der Medianwerte aus 16 Experimenten beschriebenen Unterschiede sind jedoch nicht signifikant. Unter den gleichen Stimulationsbedingungen zeigen isolierte neonatale CD4+ Zellen nicht den beschriebenen Effekt. Unabhängig von der Präinkubation CD4+ T-Zellen mit IL-4 oder IL-18 oder deren Kombination und anschließender Zugabe von PHA ist eine geringfügige Induktion der IFN-γ-Sekretion und eine unveränderte IL-13-Freisetzung im Vergleich zu der Stimulation mit PHA alleine nachweisbar (siehe Abb.3.12. und Abb.3.13.). Da die Stimulation von CBMC bei vorheriger Präinkubation mit IL-4 und IL-18 ein Th2spezifisches Zytokinmusters induziert, ist anzunehmen, dass im Rahmen der Präinkubation von CBMC die Reifung naiver CD4+ T-Zellen zu Th2-Zellen einsetzt oder weitere Subpopulationen der CBMC zu der Sekretion des Th2-Zytokins IL-13 angeregt werden. Bei der Verwendung isolierter CD4+ Zellen konnte der beschriebene Effekt nicht reproduziert werden. Unter den gleichen Stimulationsbedingungen resultiert bei Stimulation von CD4+ TZellen vielmehr das Zytokinmuster naiver T-Lymphozyten im Zellüberstand. Naive T-Zellen setzen IL-2, IL-4, IL-13 und IFN-γ und damit eine Kombination der Zytokine frei, die für die Th1- beziehungsweise Th2-Immunantwort charakteristisch sind (Hoshino, Wiltrout et al. 1999). Diskussion 4.5. 69 Neonatale Immunität und Th2-Immunantwort Die Induktion des Th2-Zytokins IL-13, welche bei der Präinkubation von CBMC mit IL-4 und IL-18 bei einigen Neonaten festgestellt werden konnte und unter gleichen + Stimulationsbedingungen bei isolierten neonatalen CD4 Zellen nicht nachweisbar ist, könnte darauf basieren, dass die Induktion einer Th2-Immunantwort nicht alleine über die Wirkung von IL-4 und IL-18 auf CD4+ Zellen, sondern beispielsweise über die Zytokinsekretion oder direkte kostimulatorische Signale weiterer Zellpopulationen der mononukleären Zellen, vermittelt wird. NK-Zellen und dendritische Zellen stellen Subpopulationen der CBMC dar, welche Zytokine sezernieren und kostimulatorische Signale für T-Lymphozyten vermitteln. Dendritische Zellen (DC) sind im Rahmen neonataler Immunreaktionen für das Überwiegen der Th2- gegenüber der Th1-Immunantwort von maßgeblicher Bedeutung. Dendritische Zellen setzen Zytokine frei, die eine polarisierende Wirkung auf naive T-Zellen ausüben können. Das Expressionsmuster der durch dendritische Zellen freigesetzten Zytokine hängt entscheidend von den Bedingungen der ersten Aktivierung der unreifen dendritischen Zellen ab (Vieira, de Jong et al. 2000). So können dendritische Zellen naive T-Zellen sowohl zur Differenzierung zu IFN-γ-produzierenden Th1-Zellen, als auch zu IL-4-, IL-5- und IL-10sezernierenden Th2-Zellen stimulieren (Rissoan, Soumelis et al. 1999). Neonatale dendritische Zellen sezernieren signifikant niedrigere Mengen IL-12(p70) als adulte DCs (Goriely, Vincart et al. 2001). Zudem induzieren sie bei naiven CD4+ Zellen im Vergleich zu adulten DCs eine geringere IFN-γ-Freisetzung (Langrish, Buddle et al. 2002). Die Unreife neonataler dendritischer Zellen und deren reduzierte Fähigkeit CD4+ Zellen zu der Freisetzung von IFNγ zu stimulieren lässt darauf schließen, dass neonatale DCs eine intrinsisch reduzierte Fähigkeit der Th1-Induktion aufweisen (Langrish, Buddle et al. 2002). Die während der Neonatalperiode vorliegende unreife Funktion der APC (Taylor and Bryson 1985) ist über die verminderte Freisetzung pro-Th1-wirkender Zytokine am Überwiegen der Th2-Polarisation beteiligt (Wegmann, Lin et al. 1993). Da dendritische Zellen eine Subpopulation der CBMC darstellen, könnte die reduzierte Th1induzierende Wirkung neonataler DCs insbesondere im Rahmen der Präinkubationsversuche von CBMC mit IL-4 oder IL-4 und IL-18 die Entwicklung einer Th2-Immunantwort stimulieren. Ob durch den Zusatz der Zytokine IL-4 oder IL-4 und IL-18 während der Diskussion 70 Präinkubation bereits eine Polarisation reifender dendritischer Zellen zu präferentiell Th2induzierenden DCs vorliegt, die einen zusätzlichen Stimulus für die Differenzierung naiver TZellen zu Th2-Zellen und die Freisetzung von IL-13 darstellt, ist unklar. Weitere Experimente sind erforderlich, um die dargestellte hypothetische Bedeutung dendritischer Zellen für die Polarisation der T-Zell-Differenzierung zu belegen. Hierfür sollte insbesondere eine Generierung dendritischer Zellen aus CBMC erfolgen. In nachfolgenden Versuchen sollten DC unter Zusatz der Zytokine IL-18, IL-4 bzw. IL-4 und IL-18 stimuliert werden. Zudem sollten mit den gleichen Zytokinzusätzen Präinkubationsversuche unreifer dendritischer Zellen mit anschließender Reifungsinduktion durchgeführt werden. Auf diese Weise könnte der Effekt der Präinkubation gegenüber der gleichzeitigen Stimulation dendritischer Zellen auf die IL-13- und IFN-γ-Konzentration im Zellüberstand untersucht werden. Zudem wäre es interessant, den Effekt einer kombinierten Zugabe von IL-4 und IL18 gegenüber IL-4 oder IL-18 alleine auf die Zytokinsekretion dendritischer Zellen zu untersuchen. In einem zweiten Schritt könnte die Zellkultur von neonatalen DCs mit neonatalen CD4+ Zellen erfolgen. Auf diese Weise wäre es möglich im Präinkubationsversuch die Wirkung von IL-4, IL-18 sowie IL-4 und IL-18 auf die Zytokinsekretion neonataler CD4+ Zellen und dendritischer Zellen im Vergleich zu CD4+ Zellen oder dendritischen Zellen alleine darzustellen. Auf diese Weise könnten Effekte der Zell-Zell-Interaktion auf die Zytokinkonzentrationen im Zellüberstand untersucht werden. Natürliche Killerzellen (NK-Zellen) stellen eine weitere Subpopulation der CBMC dar. Neonaten weisen im Vergleich zu adulten Individuen eine hohe Anzahl an natürlichen Killerzellen auf (Comans-Bitter, de Groot et al. 1997). Unreife, CD161+/ CD56- NK-Zellen produzieren IL-13, TNF-α und GM-CSF sowie in geringem Maße IL-5. Mit zunehmender NK-Zelldifferenzierung ist eine Reduktion der Freisetzung von IL-13 und IL-5 nachweisbar. Zwischen dem Differenzierungsgrad neonataler NK-Zellen und deren Zytokinsekretion besteht also ein Zusammenhang (Loza, M.J. et al. 2002). IL-2 und IL-4 stimulieren die Proliferation unreifer CD161+/ CD56- NK-Zellen. IL-12 führt demgegenüber zu einer Induktion der NK-Zelldifferenzierung, CD56-Expression und IFN-γ-Freisetzung (Hayakawa, Salmeron et al. 1991; Loza, Zamai et al. 2002). Bei der Präinkubation von CBMC mit IL-4 und IL-18 ist das Vorliegen unreifer NK-Zellen im Stimulationsansatz, welche unter anderem durch die Sekretion von IL-13 gekennzeichnet sind, anzunehmen. Da die Stimulation mit IL-4 die Proliferation unreifer CD161+/ CD56- NKZellen induzieren kann, könnte das im Rahmen der Präinkubationsversuche dem Diskussion 71 Stimulationsansatz zugefügte IL-4 zu einer Induktion der Proliferation und IL-13-Sekretion unreifer NK-Zellen geführt haben. Humane und murine NK-Zellen sezernieren IL-13 nach Stimulation mit IL-2. Bei IFN-γknockout Mäusen liegt gegenüber Wildtypmäusen eine signifikant höhere IL-13-Sekretion durch NK- und T-Zellen nach Stimulation mit IL-2 in vitro vor (Hoshino, Winkler-Pickett et al. 1999). Die Stimulation von murinen NK- und T-Zellen mit IL-2 und IL-18 führt im Vergleich zu der Stimulation mit IL-2 alleine zu einer starken Induktion der IL-13Freisetzung. Die NK- und T-Zellen von IFN-γ-knockout Mäusen zeigen im Vergleich zu Wildtypmäusen nach Stimulation mit IL-2 und IL-18 eine signifikant höhere IL-13Expression (Hoshino, Wiltrout et al. 1999). IL-2 wird unter anderem nach der Stimulation neonataler, naiver T-Zellen freigesetzt (Delespesse, Yang et al. 1998). Der IL-2-Freisetzung durch naive neonatale T-Zellen könnte daher im Rahmen der Präinkubation von CBMC mit IL-4 und IL-18, insbesondere im Zusammenhang mit der reduzierten IL-12(p70)-Freisetzung durch neonatale dendritische Zellen, eine stimulatorische Wirkung auf die IL-13-Sekretion durch unreife NK-Zellen zukommen. Nach Peritt et al. differenzieren NK-Zellen in Abhängigkeit des umgebenden Zytokinmilieus in vitro zu NK1- beziehungsweise zu NK2-Zellen. IL-12 stimuliert die Differenzierung von NK1-Zellen, die durch die Freisetzung von IL-10 und IFN-γ gekennzeichnet sind, wohingegen IL-4 die Ausreifung von NK2-Zellen, gekennzeichnet durch die Freisetzung von IL-5 und IL13, induziert. Die Existenz von NK2-Zellen in vivo sowie deren Bedeutung im Rahmen der Th2-Immunantwort ist bislang unklar und bedarf weiterer Untersuchungen. NK2-Zellen könnten über die Sekretion von IL-5 und IL-13 zur Entwicklung einer Th2-Immunreaktion beitragen (Peritt, Robertson et al. 1998). Im Rahmen der Präinkubationsversuche mit IL-4 könnte neben der Stimulation der IL-13-Freisetzung durch unreife NK-Zellen auch die Induktion der Reifung von NK-Zellen zu NK2-Zellen von Bedeutung sein. Um die dargestellten hypothetischen Ansätze zu belegen sind weitere Experimente erforderlich. Hierfür wäre die Isolation neonataler NK-Zellen aus CBMC, beispielsweise durch Negativ-Selektion mittels MACS, erforderlich. Nachfolgend sollten die NK-Zellen unter Zusatz der Zytokine IL-4, IL-18 sowie IL-4 und IL-18 stimuliert werden. Zudem sollten mit den gleichen Zytokinzusätzen Präinkubationsversuche mit nachfolgender unspezifischer Stimulation erfolgen, um den Effekt der Präinkubation gegenüber der gleichzeitigen Stimulation auf die IL-13- und IFN-γ-Konzentration im Zellüberstand darstellen zu können. In einem zweiten Schritt sollte die Stimulation von NK-Zellen und CD4+ Zellen unter Präinkubationsbedingungen erfolgen, um den Effekt der Stimulation von NK- und CD4+ Diskussion 72 Zellen gegenüber der Stimulation von NK-Zellen oder CD4+ Zellen alleine darzustellen. Auf diese Weise könnte der Einfluß der Zell-Zell-Interaktion auf die Zytokinkonzentrationen im Zellüberstand untersucht werden. Um die Zell-Zell-Interaktionen von DCs, NK- und CD4+ Zellen zu untersuchen wäre es möglich, in einem dritten Schritt die gleichzeitige Stimulation der drei Zellreihen unter Präinkubationsbedingungen durchzuführen. Bei 6 von 16 Neonaten konnte im Rahmen der Präinkubationsversuche von CBMC mit IL-4 und IL-18 eine Stimulation der IL-13-Sekretion dargestellt werden. Insbesondere konnte ein Anstieg der IL-13-Konzentration im Zellüberstand nach Präinkubation mit IL-4 und IL-18 gegenüber der Präinkubation mit IL-4 oder IL-18 alleine aufgezeigt werden. Dieser Effekt könnte zum einen mit der reduzierten Sekretion von IL-12 durch neonatale dendritische Zellen zusammenhängen, welche dadurch die Ausbildung einer Th2-Immunantwort favorisieren. Die Zugabe von IL-4 und IL-18 zum Stimulationsansatz könnte diesen Effekt noch verstärkt und eine eventuelle Reifung der dendritischen Zellen zu präferentiell Th2induzierenden DCs induziert haben. Des Weiteren haben IL-4 und IL-18 stimulatorische Wirkung auf unreife NK-Zellen, so dass diese Zytokine zu einer Induktion der Proliferation und IL-13-Sekretion unreifer NK-Zellen geführt haben könnten. Um diese hypothetischen Ansätze zu belegen, ist jedoch die Durchführung weiterer Experimente erforderlich. Zusammenfassung 73 5. Zusammenfassung IL-18 wurde 1989 erstmals als „IFN-γ inducing factor“ beschrieben, welcher die Ausbildung einer Th1-Immunantwort stimuliert. In den letzten Jahren konnte für IL-18 darüber hinaus die Induktion Th2-spezifischer Zytokine aufgezeigt werden. Die Bedeutung von IL-18 für die Entwicklung einer Th1- bzw. Th2-Immunantwort bei Neonaten ist bislang nicht charakterisiert worden. Das Ziel der vorliegenden Arbeit war es daher zu untersuchen, ob IL-18 in den Zellüberständen mitogen oder allergenspezifisch stimulierter CBMC nachweisbar ist, und welcher Effekt IL-18 auf die Zytokinsekretion neonataler mononukleärer - und CD4+ Zellen zukommt. Dafür wurden die CBMC von n = 51 Neonaten mittels Ficoll-Dichtegradientenzentrifugation aus Nabelschnurblut isoliert. Für die Isolation CD4+ Zellen erfolgte die Positiv-Selektion aus CBMC mittels magnetischer Antikörper. Die Reinheit der CD4+ Zellen betrug im Median 95,2%. Zellstimulationen wurden mit IL-4 (25 U/ml), IL-18 (100, 200, oder 400 ng/ml), einem unspezifischen (PHA 20 µg/ml) und einem allergenspezifischen Stimulus (BLG 25 µg/ml) durchgeführt. Die Konzentrationen der Zytokine IL-18, IL-13 und IFN-γ im Zellüberstand wurden mittels ELISA quantifiziert. Bei der in vitro-Stimulation von CBMC ist IL-18 in niedrigen Konzentrationen im Zellüberstand nachweisbar. Zwischen der unstimulierten Kontrolle und der Stimulation mit PHA oder BLG lagen keine signifikanten Unterschiede vor (Neg.: 21,2 pg/ml; PHA: 22,1 pg/ml; BLG: 15,6 pg/ml). Die Untersuchung des Effektes von IL-18 auf das Th1/Th2-Zytokinmilieu zeigte eine signifikante Induktion der IFN-γ-Freisetzung nach IL-18-Zugabe zu PHA- oder BLG-stimulierten CBMC (PHA: 6154,5 pg/ml; PHA + IL-18: 13474 pg/ml, p= 0,0001; BLG: 801,1 pg/ml; BLG + IL-18: 1077 pg/ml, p = 0,008). Demgegenüber führte die Stimulation mit IL-18 und BLG gegenüber der Stimulation mit BLG alleine zu einer signifikanten Reduktion der IL-13-Konzentration (BLG: 249,1 pg/ml; BLG + IL18: 124 pg/ml, p = 0,0001). Bei der Stimulation mit IL-18 und PHA war gegenüber der Stimulation mit PHA alleine kein Effekt auf die IL-13-Konzentration im Zellüberstand nachweisbar (PHA: 4357,5 pg/ml; PHA + IL-18: 4026 pg/ml). Für CBMC konnte im Median bei der Präinkubation mit IL-4 + IL18 gegenüber der Präinkubation mit IL-4 oder IL-18 alleine eine Zunahme der IL-13-Sekretion (IL-18 + PHA: 148,6 pg/ml; IL-4 + PHA: 201,5 pg/ml; IL-18 + IL-4 + PHA: 254,4 pg/ml) und eine Abnahme der IFN-γ-Sekretion (IL-18 + PHA: 915,6 pg/ml; IL-4 + PHA: 564,6 pg/ml; IL-18 + IL-4 + PHA: 467,8 pg/ml) aufgezeigt werden. Die beschriebenen Unterschiede der Präinkubationsversuche sind jedoch nicht signifikant. Isolierte neonatale CD4+ Zellen zeigen nach Präinkubation mit IL-18, IL-4 oder IL-4 und IL-18 und anschließender PHA-Stimulation gegenüber der Stimulation mit PHA alleine eine Steigerung der IFN-γ-Freisetzung (PHA: 76,3 pg/ml; IL-18 + PHA: 308,5 pg/ml; IL-4 + PHA: 338,8 pg/ml; IL-18 + IL-4 + PHA: 383,2 pg/ml) und eine gleich bleibende IL-13-Sekretion (PHA: 28,9 pg/ml; IL-18 + PHA: 35,2 pg/ml; IL-4 + PHA: 27,6 pg/ml; IL-18 + IL-4 + PHA: 21,2 pg/ml). Für IL-18 konnte eine signifikante Induktion der IFN-γ-Freisetzung durch CBMC in vitro aufgezeigt werden. IL-18 hat demnach nicht nur beim Erwachsenen, sondern auch bei Neonaten eine IFN-γinduzierende Wirkung. Daher könnte IL-18 im Rahmen der Reifung des kindlichen Immunsystems für die Induktion der Th1-Immunantwort von Bedeutung sein. Anhang 74 6. Anhang 6.1. Materialübersicht Artikel Bezeichnung Firma 1 Autoklav Getinge Lab164.2 2 Blutabnahme-Beutel 3 Brutschrank 150 ml-Beutel Eltest GmbH, Bonn mit 0,9%iger NaCl-Lösung, LatexZuspritzteil für Heparinzuführung, steril, in Einzel-Aluverpackung Typ BB 6220 Haereus Instruments GmbH 4 Durchflusszytometer FACS Scan 5 Durchflusszytometer Software Cell Quest 3.1 Bestellnr. / Seriennr. 8001160 51007413 Becton Dickinson 6 EDTA EDTA, 2% Solution Sigma, Taufkirchen 285-4 7 Einfrierdose Qualifreeze Cryo-Einfriergerät 8 Einfriermedium-Zusatz DMSO Nalgene, Bender & Hobein, Bruchsal Sigma, Taufkirchen D 2650 9 Einfrierboxen Nalgene Bender & Holbein 479Q5170 10 Einfrierpappschachteln Kryo-Box 13 x 13 x 5 cm Thoma / Neolap 2-2700 11 10 x 10 Fächer Thoma / Neolap 2-2703 12 Eisbehälter + Rastereinsatz Rotilabo Roth, Karlsruhe N 248.1 13 ELISA Assay Diluent Assay Diluent BD Pharmingen Heidelberg 555213 14 ELISA- Platten 96 well Maxisorb NUNC, Wiesbaden 439454 15 ELISA Reader Molecular Devices MWG-Biotech GmbH E 01193 16 ELISA Reader Software E max precision microplate reader Softmax 17 ELISA Substratreagenz Substrate Reagent A BD Pharmingen Heidelberg 2606KC Substrate Reagent B BD Pharmingen Heidelberg 2607KC 18 19 Fein-Waage Sartorius Basic Sartorius AG, Göttingen 21000888 20 Fetales Kälberserum FCS Seromed, Berlin S 0123 21 Fluoreszenzantikörper 22 CD4 PE BD Biosciences, Heidelberg 345769 CD3 FITC BD Biosciences, Heidelberg 349201 Simultest Control γ1/γ1 BD Biosciences, Heidelberg 349526 24 Heparin Vetren ® 200 I.E. / 2 ml Canusal 100 I.E./ml V767 25 Humanes Serum Human Serum AB Zentrallager CPPharmaceuticals,Wrexham, UK PAA 26 Kulturmedium Ultra Culture 27 L-Glutamin Bio Whittaker Europe, Verviers, Belgium Gibco BRL 28 Lysat 0,5%ige Essigsäure Zentrallager 29 Mikroskop Olympus CK2-TR Olympus 30 Mini MACS MACS Multi Stand Miltenyi Biotec GmbH, Bergisch Gladbach Miltenyi Biotec GmbH, Bergisch Gladbach Miltenyi Biotec GmbH, Bergisch Gladbach Miltenyi Biotec GmbH, Bergisch Gladbach 23 31 Mini MACS Separation Unit 32 Pre- Separation Filter 33 MACS Separation Columns L05-021 BE12-725 F 25030-024 004645 421-02 130-041-407 130-402-401 Anhang 34 MACS Micro Beads CD4+ 75 35 Multistep-Pipette Multipette plus Miltenyi Biotec GmbH, Bergisch Gladbach Eppendorf, Hamburg 130-045-101 36 Multistep-Pipetten-Aufsätze Combitips-Plus Standard 1 ml Eppendorf, Hamburg 0030 069.234 37 Combitips-Plus Standard 2,5 ml Eppendorf, Hamburg 0030 069.242 38 Combitips-Plus Standard 5 ml Eppendorf, Hamburg 0030 069.250 39 Combitips-Plus Biopur 1 ml Eppendorf, Hamburg 0030 069.439 40 Combitips-Plus Biopur 2,5 ml Eppendorf, Hamburg 0030 069.447 41 Combitips-Plus Biopur 5 ml Eppendorf, Hamburg 0030 069.455 1.09137 4981 000.019 42 Natronlauge 1N NaOH Merck, Darmstadt 43 Neubauer-Zählkammern Tiefe 0,1 mm Brand 44 OptEIA Humanes IFN-γ Set BD Pharmingen, Heidelberg 555142 Humanes IL-13 Set BD Pharmingen, Heidelberg 558983 Serologische Pipetten, steril 1ml 357521 45 46 Pasteurpipette 51 Penicillin-Streptomycin 1000 IU/ml, steril BD Falcon, BD Biosciences Labware, Heidelberg BD Falcon, BD Biosciences Labware, Heidelberg BD Falcon, BD Biosciences Labware, Heidelberg BD Falcon, BD Biosciences Labware, Heidelberg BD Falcon, BD Biosciences Labware, Heidelberg Gibco BRL 52 Pippetierhilfe Pipetus- Akku Hirschmann Laborgeräte 53 Pipette Eppendorf, Hamburg 4910 000.042 54 Pipette Eppendorf, Hamburg 4910 000.093 55 Pipette Eppendorf, Hamburg 4910 000.069 56 Probenständer Eppendorf Reference, variabel 10-100 µl Eppendorf Reference, variabel 50-200 µl Eppendorf Reference, variabel 100-1000 µl Kombi-Racks 4 in 1 neonblau Roth, Karlsruhe K082.1 57 Reagiergefäße Micro tubes 1,5 ml Sarstedt 72.690 58 Salzsäure 1N HCl Merck, Darmstadt 1.09057 59 Schüttler IKA-Vibrax-VXR Janke & Kunkel Typ VX7 60 Sterilbank Lamin Air HB 2448 Haereus Instruments GmbH 61 Sterile Röhrchen 50 ml Polypropylene Conial Tube, Blue Max 15 ml Polypropylene Conial Tube, Blue Max Jr. 1,8 ml Cryo-Tubes für –20°C Syringe Driven Filter Unit, 0,22 µm Ficoll-Paque plus Falcon, BD Biosciences, Heidelberg Falcon, BD Biosciences, Heidelberg Nunc, Wiesbaden 47 Serologische Pipetten, steril 2ml 48 Serologische Pipetten, steril 5ml 49 Serologische Pipetten, steril 10ml 50 Serologische Pipetten, steril 25ml 62 63 357507 357543 357551 357525 15140-114 352070 352096 375418 64 Sterilfilter 65 Trenn-Flüssigkeit 66 Tween 20 Polysorbate 20 GERBU Biotechnik, Gaiberg # 2001 67 Ultraschallbad T 490 DH Roth, Karlsruhe K 001.1 68 Verschluß-Film Parafilm ’M’ American National Can 69 Vortexer Reax 2000 Heidolph 19444779 70 Waschpuffer PBS 14190 71 Wasserbad Typ HWR Bj.1974 Gibco, Life Technologies, Karlsruhe Daglef Patz KG, Wankendorf K1805 72 Zellfärbungsmittel Seromed, Biochrom, Berlin L6323 73 Zellkulturplatten 0,5%ig,Trypanblau in physiological saline 96 well Microtiterplatten Nunc, Wiesbaden 163320 74 Zell-Stimulanz Betalactoglobulin (BLG), 250 mg Sigma, Taufkirchen L-0130 75 Zell-Stimulanz Phytohämagglutinin (PHA) Sigma, Taufkirchen L4144 76 Zell-Stimulanz Interleukin 18 (IL-18) Cell Concepts, Umkirch C-20018-E 77 Zell-Stimulanz Interleukin 4 (IL-4) Promo Cell, Heidelberg C-61410 78 Zentrifuge Sorvall RT6000B Kühlzentrifuge Dupont Millex, Millipore Corporation, Schwalbach Pharmacia Biotech, Freiburg SLGP033RS Ref.17.1440.03 TM Anhang 6.2. Daten IL-18-Sekretion neonataler mononukleärer Zellen IL-18 [pg/ml] Probe 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Median St.-Abw. (Daten zu Abb. 3.1) Neg PHA BLG 27,0 21,4 23,5 31,7 22,7 22,2 25,8 23,5 24,5 27,7 3,2 3,1 2,7 4,6 5,0 20,4 17,7 20,9 18,4 18,2 21,2 26,6 33,6 23,5 29,3 25,6 25,0 26,6 24,8 25,3 26,9 2,0 3,4 3,4 12,6 17,7 19,9 20,6 20,1 19,1 20,3 22,1 15,2 33,6 20,4 25,3 20,4 19,1 19,4 13,5 24,7 18,2 4,4 4,8 4,4 7,9 6,8 17,2 15,5 10,8 15,2 15,6 15,6 9,2 8,8 7,7 76 Anhang 77 IFN-γ-Sekretion neonataler mononukleärer Zellen IFN-γ [pg/ml] Probe K1 K3 K4 K5 K11 K16 K22 K23 Median St.-Abw. (Daten zu Abb. 3.2) Neg PHA 24 PHA 24+100 PHA 24+200 PHA 24+400 1,7 217,7 2244,0 2943,0 1979,0 0,9 2,2 2,0 2,7 2,0 2,5 2,4 2,1 205,8 954,3 1973,0 429,5 161,2 112,8 900,1 323,6 1434,0 5196,0 12395,0 6992,0 3510,0 2180,0 3609,0 3559,5 1419,0 5549,0 9805,0 10939,0 2588,0 1252,0 3498,0 3220,5 1755,0 5297,0 6938,0 8296,0 3259,0 2385,0 3059,0 3159,0 0,6 639,0 3593,0 3728,9 2444,2 IFN-γ [pg/ml] Probe K1 K3 K4 K5 K11 K16 K22 K23 Median St.-Abw. (Daten zu Abb. 3.2) Neg PHA 48 PHA 48+100 PHA 48+200 PHA 48+400 1,7 1347,0 18227,0 17167,0 13301,0 0,9 1213,0 7021,0 10624,0 11466,0 2,2 2701,0 24351,0 40775,0 45719,0 2,0 2,7 2,0 2,5 2,4 2,1 3451,0 2192,0 1575,0 1736,0 1935,0 1835,5 24678,0 25981,0 20356,0 13555,0 13162,0 19291,5 30340,0 41245,0 19711,0 39170,0 17790,0 25025,5 29445,0 47006,0 27557,0 25522,0 22009,0 26539,5 0,6 749,4 6724,6 12274,6 13139,1 IFN-γ [pg/ml] Probe K1 K3 K4 K5 K11 K16 K22 K23 Median St.-Abw. (Daten zu Abb. 3.2) Neg BLG 5 BLG 5+200 BLG 5+400 1,7 0,9 81,5 267,8 4983,0 673,9 1772,0 1509,0 2,2 2,0 2,7 2,0 2,5 2,4 2,1 1140,0 898,5 253,4 317,8 86,6 218,6 260,6 12647,0 4118,0 1737,0 1157,0 1826,0 1603,0 1781,5 5358,0 29386,0 2925,0 2604,0 3813,0 11078,0 3369,0 0,6 391,7 3949,1 9436,1 Anhang 78 IL-13-Sekretion neonataler mononukleärer Zellen IL-13 [pg/ml] Probe K1 K3 K4 K5 K11 K16 K22 K23 Median St.-Abw. (Daten zu Abb. 3.3) Neg PHA 24 PHA 24+100 PHA 24+200 PHA 24+400 1,1 233,3 185,1 187,5 176,4 0,6 0,9 0,6 0,5 0,3 0,5 0,6 0,6 189,2 407,4 227,3 269,0 196,5 475,3 215,5 230,3 230,9 530,0 327,0 314,7 261,5 214,0 219,9 246,2 221,9 553,8 375,2 364,2 258,5 251,0 273,6 266,1 270,8 574,6 344,0 405,1 314,7 275,1 296,3 305,5 0,2 106,1 110,5 117,6 117,8 IL-13 [pg/ml] Probe K1 K3 K4 K5 K11 K16 K22 K23 Median St.-Abw. (Daten zu Abb. 3.3) Neg PHA 48 PHA 48+100 PHA 48+200 PHA 48+400 1,1 1251,0 969,8 865,3 995,1 0,6 1608,0 2013,0 1908,0 1693,0 0,9 4550,0 5589,0 4890,0 4960,0 0,6 0,5 0,3 0,5 0,6 0,6 5145,0 5352,0 2909,0 7235,0 5059,0 4804,5 4576,0 4991,0 3418,0 6564,0 4485,0 4530,5 5418,0 6466,0 3588,0 6910,0 5196,0 5043,0 5370,0 4630,0 4885,0 6979,0 5464,0 4922,5 0,2 2047,4 1854,4 2132,8 2008,6 IL-13 [pg/ml] Probe K1 K3 K4 K5 K11 K16 K22 K23 Median St.-Abw. (Daten zu Abb. 3.3) Neg BLG 5 BLG 5+200 BLG 5+400 1,1 0,6 49,7 453,3 69,9 193,2 86,4 364,7 0,9 0,6 0,5 0,3 0,5 0,6 0,6 227,1 446,4 159,2 172,0 587,9 364,2 295,7 126,4 147,9 136,8 203,8 300,9 114,7 142,4 200,0 233,2 162,1 217,0 372,0 106,6 208,5 0,2 183,5 70,5 106,0 Anhang 79 IFN-γ-Sekretion neonataler mononukleärer Zellen IFN-γ [pg/ml] Probe Neg PHA IL-18 (48h) PHA+IL-18 K1 11,7 17554,0 314,5 21170,0 K2 146,1 22368,0 246,8 79620,0 K3 29,1 71,0 342,1 28208,0 K4 6,9 8699,0 69,4 26991,0 K5 21,2 13866,0 167,4 28560,0 K6 4,1 10757,0 43,7 13619,0 K7 4,5 24641,0 270,4 32662,0 K8 7,7 6549,0 6,2 6589,0 K11 5,4 5760,0 87,5 23597,0 K14 35,4 4636,0 86,0 5384,0 K15 7,8 7619,0 27,7 10367,0 K16 5,3 2354,0 7,2 8525,0 K17 8,3 2443,0 37,6 4886,0 K18 2,7 10000,0 5,5 13331,0 K19 2,5 5082,0 6,3 20877,0 K26 2,8 3815,0 6,1 8045,0 K27 3,3 1423,0 5,0 3881,0 K28 9,2 18781,0 155,0 31114,0 K29 231,9 9639,0 651,9 17498,0 K30 2,9 688,8 4,8 1781,0 K31 16,5 4204,0 22,5 13097,0 K35 3,4 842,4 3,0 1154,0 K37 2,9 2132,0 3,1 3400,0 K38 3,1 1773,0 3,5 3027,0 K40 2,0 1893,0 2,6 16952,0 K42 3,3 1705,0 4,0 2815,0 K44 3,1 10455,0 3,1 16387,0 K47 2,9 12362,0 4,8 22504,0 K49 4,0 3386,0 4,0 4975,0 K50 2,8 8611,0 3,2 16135,0 Median 4,3 5421,0 6,7 13475,0 St.-Abw. 48,0 6594,4 147,1 15337,7 (Daten zu Tab.1 und 2, Abb. 3.4 und 3.5) BLG IL-18 (5d) BLG+IL-18 1307,0 1603,0 2291,0 2395,0 1655,0 867,2 1599,0 102,3 1138,0 308,6 746,3 319,1 169,4 856,0 385,3 1390,0 175,6 1506,0 1977,0 175,9 371,0 21,8 534,2 169,9 898,0 563,9 618,2 289,6 1341,0 1943,0 801,2 1652,0 1238,0 594,0 507,2 671,2 185,4 776,2 172,8 150,6 83,1 183,2 75,3 174,6 78,3 109,2 214,5 44,6 1717,0 1353,0 73,9 28,3 2,6 6,3 4,3 95,0 42,5 27,4 53,5 55,4 81,3 102,1 2442,0 1275,0 1242,0 2670,0 3288,0 1522,0 5775,0 1081,0 1613,0 634,8 443,0 555,0 657,7 1073,0 1382,0 2082,0 407,2 3975,0 2126,0 148,1 647,5 59,1 1848,0 212,7 558,1 546,2 521,2 412,3 223,0 1926,0 1077,0 706,1 502,5 1279,3 Anhang 80 IL-13-Sekretion neonataler mononukleärer Zellen IL-13 [pg/ml] Probe Neg PHA IL-18 (48h) PHA+IL-18 K1 56,7 3298,0 24,8 3854,0 K2 16,0 4184,0 10,5 3388,0 K3 6,3 3062,0 12,6 2463,0 K4 15,0 3744,0 12,3 4198,0 K5 9,1 3636,0 9,2 2349,0 K6 26,0 2415,0 19,5 3043,0 K7 5,6 9262,0 8,5 9875,0 K8 0,6 11202,0 6,4 9585,0 K11 42,4 6350,0 24,4 6315,0 K14 1,4 3221,0 2,9 3176,0 K15 4,8 4038,0 1,6 3477,0 K16 1,7 2222,0 1,2 2348,0 K17 7,5 7496,0 10,2 6347,0 K18 1,1 5516,0 4,1 6217,0 K19 5,9 4531,0 1,3 4245,0 K26 2,7 7407,0 8,1 8013,0 K27 0,5 5145,0 2,0 5176,0 K28 2,0 6326,0 12,5 5121,0 K29 43,0 5136,0 31,9 5851,0 K30 0,9 3677,0 1,5 3262,0 K31 6,2 3735,0 4,1 3211,0 K35 1,0 904,7 0,7 989,1 K37 1,2 4844,0 13,5 3782,0 K38 0,6 735,5 849,6 K40 1,6 7111,0 3,0 6026,0 K42 1,2 6372,0 1,1 6614,0 K44 0,8 4888,0 2,6 4507,0 K47 1,5 3883,0 0,8 2765,0 K49 1,2 6189,0 2,1 6834,0 K50 1,3 4024,0 12,0 3498,0 Median 1,8 4357,5 6,4 4026,0 St.-Abw. 14,4 2269,1 8,2 2235,9 (Daten zu Tab. 1 und 2, Abb. 3.6 und 3.7) BLG IL-18 (5d) BLG+IL-18 229,4 113,8 233,3 259,7 226,9 572,3 128,9 32,9 342,8 54,7 308,8 139,3 232,0 300,3 238,5 431,6 333,9 342,4 271,8 183,8 225,8 63,5 181,5 212,9 381,1 328,3 290,0 326,8 290,2 344,9 249,1 122,3 37,6 42,9 80,9 150,3 71,8 72,5 2,5 104,5 43,9 50,3 9,5 56,9 44,2 37,9 95,2 41,1 142,1 97,6 2,1 15,1 5,8 42,9 38,5 81,1 72,1 44,0 47,2 18,0 101,0 167,2 250,3 540,2 123,8 26,5 294,4 41,2 162,9 162,7 137,0 122,9 102,4 254,3 131,1 196,8 41,9 124,2 111,3 7,8 135,3 185,1 126,5 165,8 84,8 49,3 33,0 113,9 124,0 115,5 41,4 104,7 14,7 8,6 Anhang 81 Zytokinsekretion präinkubierter neonataler mononukleärer Zellen IFN-γ [pg/ml] Probe Neg N009 6,3 N016 2,7 N018 5,7 N038 22,8 N042 3,5 N044 24,4 N047 29,0 N055 104,6 N057 28,4 N066 150,2 N070 143,9 N078 26,0 N081 1,0 N082 157,5 N084 137,3 K35 14,1 Median 25,2 St.-Abw. 60,9 (Daten zu Abb. 3.8) PHA IL18+IL4 IL18+PHA IL4+PHA IL18+IL4+PHA 807,6 66,6 219,2 746,0 626,8 820,8 935,4 960,5 265,5 4,3 3,9 7,0 4,0 3,5 10,0 5,6 10,5 2,9 974,5 68,0 288,3 1050,0 737,1 709,9 847,2 1343,0 480,2 1440,0 85,8 718,5 991,2 170,6 737,0 597,5 606,4 273,4 688,4 58,4 162,4 390,2 230,2 553,7 1062,0 2672,0 112,4 1023,0 5,9 1133,0 394,4 384,8 1643,0 6,9 980,1 239,2 706,9 710,0 7,5 856,6 217,1 312,6 3,9 4,1 525,0 244,4 359,1 1944,0 1316,0 557,5 776,8 2,9 5,2 3,0 4,7 2656,0 2444,0 1577,0 915,6 5079,0 531,6 1051,0 564,6 4369,0 545,4 587,7 467,8 533,7 2,4 699,5 1190,8 1126,0 IL-13 [pg/ml] Probe Neg N009 8,2 N016 2,3 N018 0,8 N038 30,3 N042 5,5 N044 22,7 N047 13,2 N055 23,0 N057 12,0 N066 41,7 N070 22,7 N078 15,7 N081 0,4 N082 52,2 N084 21,1 K35 8,8 Median 14,4 St.-Abw. 14,6 (Daten zu Abb. 3.9) PHA IL18+IL4 IL18+PHA IL4+PHA IL18+IL4+PHA 96,2 17,4 75,3 187,1 126,5 22,9 4,2 42,9 76,7 52,4 41,0 50,6 138,1 85,1 97,7 252,3 94,7 51,9 16,1 225,3 56,3 183,9 102,4 279,0 136,8 620,1 16,9 601,3 596,5 784,2 126,5 41,0 210,4 189,5 714,4 239,1 147,9 216,8 120,3 166,2 0,9 564,8 231,1 168,6 157,1 91,0 24,8 50,0 23,7 38,4 15,1 17,3 36,7 67,0 30,8 221,4 235,3 144,4 114,0 152,8 43,9 680,6 121,3 279,5 148,6 327,2 117,0 268,9 142,1 236,2 213,4 370,1 234,2 320,1 201,5 340,7 111,0 265,6 157,6 329,8 243,2 479,9 155,7 312,8 254,4 173,1 22,9 183,9 131,7 212,8 Anhang 82 Separation neonataler CD4+ Zellen CD4+ Zellen Probe N018 N038 N047 N057 N066 N078 N081 N082 K35 Median Mittelwert % Gated % Total 95,2 84,4 96,8 86,3 94,8 95,4 85,5 99,0 79,4 67,2 87,2 57,9 81,4 87,1 56,7 91,2 96,7 95,2 86,2 81,4 92,7 77,1 IFN-γ [pg/ml] Probe Neg N018 1,2 N038 0,6 N047 N057 1,5 N066 0,1 N078 1,2 N081 4,7 N082 1,5 K35 0,9 Median 1,2 St.-Abw. 1,4 (Daten zu Abb. 3.12) Probe PHA IL-18 IL-4 126,2 64,7 63,9 380,4 9,7 222,8 611,8 76,3 22,3 76,3 1,6 1,8 1,9 2,1 0,2 1,0 22,6 1,8 1,2 1,8 5,0 4,0 2,2 2,1 3,1 2,5 1,6 3,5 1,9 2,5 4,2 0,8 3,0 3,2 7,9 1,4 1,7 2,3 1,3 2,3 531,5 93,8 62,2 402,1 66,4 381,1 541,1 308,5 36,6 308,5 1940,0 468,0 338,8 693,5 92,1 194,6 2392,0 171,1 111,2 338,8 3893,0 181,0 109,8 498,5 534,7 383,2 1539,0 180,8 108,5 383,2 200,8 7,1 1,1 2,2 207,2 854,0 1233,0 Neg N018 1,2 N038 0,6 N047 N057 1,5 N066 0,1 N078 1,2 N081 4,7 N082 1,5 K35 0,9 Median 1,2 St.-Abw. 1,4 (Daten zu Abb. 3.12) BLG IL18+IL4 IL18+PHA IL4+PHA IL18+IL4+PHA IFN-γ [pg/ml] IL18+BLG IL4+BLG IL18+4+BLG 1,0 0,2 2,4 2,7 0,2 0,9 2,3 2,6 1,1 1,4 3,1 2,2 2,6 7,6 2,2 9,8 2,7 1,8 5,0 3,1 3,4 3,4 2,4 1,1 1,3 2,0 1,1 39,6 3,8 1,5 2,9 1,5 1,1 2,9 1,5 1,2 1,1 2,6 2,4 1,5 1,0 2,9 1,3 12,5 Anhang 83 IL-13 [pg/ml] Probe Neg N018 1,7 N038 0,6 N047 0,9 N057 0,6 N066 0,6 N078 N081 1,4 N082 3,3 K35 Median 0,9 St.-Abw. 1,0 (Daten zu Abb. 3.13) PHA IL-18 IL-4 IL18+IL4 IL18+PHA IL4+PHA IL18+IL4+PHA 28,9 29,8 0,6 0,7 7,9 1,4 17,5 5,1 128,1 35,2 35,4 38,3 35,4 21,2 13,5 55,5 14,5 1,1 0,8 0,6 1,3 1,2 1,0 1,0 1,8 2,1 13,0 74,8 19,8 16,6 33,3 25,6 13,0 27,0 17,4 44,1 0,5 0,5 0,9 43,2 27,6 14,9 22,6 2,5 3,7 5,8 24,7 12,5 33,2 52,9 9,9 1,4 618,0 0,9 0,5 6,0 0,9 55,2 20,6 69,8 21,8 67,9 9,9 28,9 0,8 1,2 2,1 35,2 27,6 21,2 17,1 205,7 2,4 5,3 36,5 16,8 17,8 IL-13 [pg/ml] Probe Neg N018 1,7 N038 0,6 N047 0,9 N057 0,6 N066 0,6 N078 N081 1,4 N082 3,3 K35 Median 0,9 St.-Abw. 1,0 (Daten zu Abb. 3.13) BLG IL18+BLG IL4+BLG IL18+4+BLG 10,6 0,6 4,9 0,8 87,5 4,8 580,6 5,9 0,6 0,8 0,6 0,8 0,6 1,2 1,1 4,9 2,5 1,4 6,7 2,2 0,5 0,7 1,4 1,4 8,6 10,6 10,6 22,6 1,1 0,4 0,8 0,4 1,1 0,6 0,9 1,7 0,6 0,8 2,5 2,2 4,0 3,4 28,2 191,9 Literaturverzeichnis 84 7. Literaturverzeichnis Abdi, K. and S. H. Herrmann (1997). CTL generation in the presence of IL-4 is inhibited by free p40: evidence for early and late IL-12 function. J Immunol 159 7: 3148-55. Ahn, H. J., S. Maruo, et al. (1997). A mechanism underlying synergy between IL-12 and IFNgamma-inducing factor in enhanced production of IFN-gamma. J Immunol 159 5: 2125-31. Banchereau, J. and R. M. Steinman (1998). Dendritic cells and the control of immunity. Nature 392 6673: 245-52. Bautsch, W., H. G. Hoymann, et al. (2000). Cutting edge: guinea pigs with a natural C3areceptor defect exhibit decreased bronchoconstriction in allergic airway disease: evidence for an involvement of the C3a anaphylatoxin in the pathogenesis of asthma. J Immunol 165 10: 5401-5. Beaven, M. A. and H. Metzger (1993). Signal transduction by Fc receptors: the Fc epsilon RI case. Immunol Today 14 5: 222-6. Black, P. N. and S. Sharpe (1997). Dietary fat and asthma: is there a connection? Eur Respir J 10 1: 6-12. Bochner, B. S., D. A. Klunk, et al. (1995). IL-13 selectively induces vascular cell adhesion molecule-1 expression in human endothelial cells. J Immunol 154 2: 799-803. Bodner, C., D. Godden, et al. (1999). Antioxidant intake and adult-onset wheeze: a casecontrol study. Aberdeen WHEASE Study Group. Eur Respir J 13 1: 22-30. Bofill, M., E. Almirall, et al. (2004). Differential expression of the cytokine receptors for human interleukin (IL)-12 and IL-18 on lymphocytes of both CD45RA and CD45RO phenotype from tonsils, cord and adult peripheral blood. Clin Exp Immunol 138 3: 460-5. Born, T. L., E. Thomassen, et al. (1998). Cloning of a novel receptor subunit, AcPL, required for interleukin-18 signaling. J Biol Chem 273 45: 29445-50. Braun-Fahrlander, C., J. Riedler, et al. (2002). Environmental exposure to endotoxin and its relation to asthma in school-age children. N Engl J Med 347 12: 869-77. Burd, P. R., W. C. Thompson, et al. (1995). Activated mast cells produce interleukin 13. J Exp Med 181 4: 1373-80. Callard, R. E., D. J. Matthews, et al. (1996). IL-4 and IL-13 receptors: are they one and the same? Immunol Today 17 3: 108-10. Literaturverzeichnis 85 Cameron, L. A., R. A. Taha, et al. (1999). Airway epithelium expresses interleukin-18. Eur Respir J 14 3: 553-9. Celis, E., R. W. Miller, et al. (1986). Isolation and characterization of human T cell lines and clones reactive to rabies virus: antigen specificity and production of interferongamma. J Immunol 136 2: 692-7. Ceman, S. and A. J. Sant (1995). The function of invariant chain in class II-restricted antigen presentation. Semin Immunol 7 6: 373-87. Chang, J. T., B. M. Segal, et al. (2000). The costimulatory effect of IL-18 on the induction of antigen-specific IFN-gamma production by resting T cells is IL-12 dependent and is mediated by up-regulation of the IL-12 receptor beta2 subunit. Eur J Immunol 30 4: 1113-9. Chaplin, D. D. (2003). 1. Overview of the immune response. J Allergy Clin Immunol 111 2 Suppl: S442-59. Chen, Y., V. K. Kuchroo, et al. (1994). Regulatory T cell clones induced by oral tolerance: suppression of autoimmune encephalomyelitis. Science 265 5176: 1237-40. Comans-Bitter, W. M., R. de Groot, et al. (1997). Immunophenotyping of blood lymphocytes in childhood. Reference values for lymphocyte subpopulations. J Pediatr 130 3: 38893. Corrigan, C. J. (1995). Elevated interleukin-4 secretion by T lymphocytes: a feature of atopy or of asthma? Clin Exp Allergy 25 6: 485-7. Cosentino, G., E. Soprana, et al. (1995). IL-13 down-regulates CD14 expression and TNFalpha secretion in normal human monocytes. J Immunol 155 6: 3145-51. Costa, J. J., P. F. Weller, et al. (1997). The cells of the allergic response: mast cells, basophils, and eosinophils. Jama 278 22: 1815-22. Dao, T., K. Ohashi, et al. (1996). Interferon-gamma-inducing factor, a novel cytokine, enhances Fas ligand-mediated cytotoxicity of murine T helper 1 cells. Cell Immunol 173 2: 230-5. de Jong, E. C., P. L. Vieira, et al. (2002). Microbial compounds selectively induce Th1 cellpromoting or Th2 cell-promoting dendritic cells in vitro with diverse th cell-polarizing signals. J Immunol 168 4: 1704-9. de Marco, R., C. Pattaro, et al. (2004). Influence of early life exposures on incidence and remission of asthma throughout life. J Allergy Clin Immunol 113 5: 845-52. de Vries, J. E. (1996). Molecular and biological characteristics of interleukin-13. Chem Immunol 63 204-18. de Vries, J. E. (1998). The role of IL-13 and its receptor in allergy and inflammatory responses. J Allergy Clin Immunol 102 2: 165-9. de Vries, J. E. and G. Zurawski (1995). Immunoregulatory properties of IL-13: its potential role in atopic disease. Int Arch Allergy Immunol 106 3: 175-9. Literaturverzeichnis 86 de Waal Malefyt, R., J. S. Abrams, et al. (1995). Differential regulation of IL-13 and IL-4 production by human CD8+ and CD4+ Th0, Th1 and Th2 T cell clones and EBVtransformed B cells. Int Immunol 7 9: 1405-16. Defrance, T., P. Carayon, et al. (1994). Interleukin 13 is a B cell stimulating factor. J Exp Med 179 1: 135-43. DeKruyff, R. H., Y. Fang, et al. (1995). IL-4 synthesis by in vivo-primed memory CD4+ T cells: II. Presence of IL-4 is not required for IL-4 synthesis in primed CD4+ T cells. J Clin Immunol 15 2: 105-15. Delespesse, G., L. P. Yang, et al. (1998). Maturation of human neonatal CD4+ and CD8+ T lymphocytes into Th1/Th2 effectors. Vaccine 16 14-15: 1415-9. Devereux, G., R. N. Barker, et al. (2002). Antenatal determinants of neonatal immune responses to allergens. Clin Exp Allergy 32 1: 43-50. Dinarello, C. A. (1997). Role of pro- and anti-inflammatory cytokines during inflammation: experimental and clinical findings. J Biol Regul Homeost Agents 11 3: 91-103. Dinarello, C. A. (1998). Interleukin-1 beta, interleukin-18, and the interleukin-1 beta converting enzyme. Ann N Y Acad Sci 856 1-11. Dinarello, C. A. (1999). IL-18: A TH1-inducing, proinflammatory cytokine and new member of the IL-1 family. J Allergy Clin Immunol 103 1 Pt 1: 11-24. Doherty, T. M., R. Kastelein, et al. (1993). Modulation of murine macrophage function by IL13. J Immunol 151 12: 7151-60. Donovan, C. E. and P. W. Finn (1999). Immune mechanisms of childhood asthma. Thorax 54 10: 938-46. Duhme, H., S. K. Weiland, et al. (1998). Asthma and allergies among children in West and East Germany: a comparison between Munster and Greifswald using the ISAAC phase I protocol. International Study of Asthma and Allergies in Childhood. Eur Respir J 11 4: 840-7. Ealick, S. E., W. J. Cook, et al. (1991). Three-dimensional structure of recombinant human interferon-gamma. Science 252 5006: 698-702. El-Mezzein, R. E., T. Matsumoto, et al. (2001). Increased secretion of IL-18 in vitro by peripheral blood mononuclear cells of patients with bronchial asthma and atopic dermatitis. Clin Exp Immunol 126 2: 193-8. Fantuzzi, G. and C. A. Dinarello (1999). Interleukin-18 and interleukin-1 beta: two cytokine substrates for ICE (caspase-1). J Clin Immunol 19 1: 1-11. Fiorentino, D. F., M. W. Bond, et al. (1989). Two types of mouse T helper cell. IV. Th2 clones secrete a factor that inhibits cytokine production by Th1 clones. J Exp Med 170 6: 2081-95. Literaturverzeichnis 87 Fukaura, H., S. C. Kent, et al. (1996). Induction of circulating myelin basic protein and proteolipid protein-specific transforming growth factor-beta1-secreting Th3 T cells by oral administration of myelin in multiple sclerosis patients. J Clin Invest 98 1: 70-7. Gabrielsson, S., A. Soderlund, et al. (2001). Influence of atopic heredity on IL-4-, IL-12- and IFN-gamma-producing cells in in vitro activated cord blood mononuclear cells. Clin Exp Immunol 126 3: 390-6. Galizzi, J. P., C. E. Zuber, et al. (1990). Molecular cloning of a cDNA encoding the human interleukin 4 receptor. Int Immunol 2 7: 669-75. Gardella, S., C. Andrei, et al. (2000). Control of interleukin-18 secretion by dendritic cells: role of calcium influxes. FEBS Lett 481 3: 245-8. Goriely, S., B. Vincart, et al. (2001). Deficient IL-12(p35) gene expression by dendritic cells derived from neonatal monocytes. J Immunol 166 3: 2141-6. Gu, Y., K. Kuida, et al. (1997). Activation of interferon-gamma inducing factor mediated by interleukin-1beta converting enzyme. Science 275 5297: 206-9. Harris, D. T., M. J. Schumacher, et al. (1992). Phenotypic and functional immaturity of human umbilical cord blood T lymphocytes. Proc Natl Acad Sci U S A 89 21: 1000610. Hayakawa, K., M. A. Salmeron, et al. (1991). The role of IL-4 in proliferation and differentiation of human natural killer cells. Study of an IL-4-dependent versus an IL2-dependent natural killer cell clone. J Immunol 146 7: 2453-60. Hilkens, C. M., H. Vermeulen, et al. (1995). Differential modulation of T helper type 1 (Th1) and T helper type 2 (Th2) cytokine secretion by prostaglandin E2 critically depends on interleukin-2. Eur J Immunol 25 1: 59-63. Hilton, D. J., J. G. Zhang, et al. (1996). Cloning and characterization of a binding subunit of the interleukin 13 receptor that is also a component of the interleukin 4 receptor. Proc Natl Acad Sci U S A 93 1: 497-501. Himmelrich, H., P. Launois, et al. (2000). In BALB/c mice, IL-4 production during the initial phase of infection with Leishmania major is necessary and sufficient to instruct Th2 cell development resulting in progressive disease. J Immunol 164 9: 4819-25. Holt, P. G. and C. A. Jones (2000). The development of the immune system during pregnancy and early life. Allergy 55 8: 688-97. Holt, P. G. and C. Macaubas (1997). Development of long-term tolerance versus sensitisation to environmental allergens during the perinatal period. Curr Opin Immunol 9 6: 782-7. Hoshino, T., R. H. Wiltrout, et al. (1999). IL-18 is a potent coinducer of IL-13 in NK and T cells: a new potential role for IL-18 in modulating the immune response. J Immunol 162 9: 5070-7. Hoshino, T., R. T. Winkler-Pickett, et al. (1999). IL-13 production by NK cells: IL-13producing NK and T cells are present in vivo in the absence of IFN-gamma. J Immunol 162 1: 51-9. Literaturverzeichnis 88 Hoshino, T., H. Yagita, et al. (2000). In vivo administration of IL-18 can induce IgE production through Th2 cytokine induction and up-regulation of CD40 ligand (CD154) expression on CD4+ T cells. Eur J Immunol 30 7: 1998-2006. Huang, S. K., H. Q. Xiao, et al. (1995). IL-13 expression at the sites of allergen challenge in patients with asthma. J Immunol 155 5: 2688-94. Humbles, A. A., B. Lu, et al. (2000). A role for the C3a anaphylatoxin receptor in the effector phase of asthma. Nature 406 6799: 998-1001. Hunter, C. A., J. Timans, et al. (1997). Comparison of the effects of interleukin-1 alpha, interleukin-1 beta and interferon-gamma-inducing factor on the production of interferon-gamma by natural killer. Eur J Immunol 27 11: 2787-92. Hyodo, Y., K. Matsui, et al. (1999). IL-18 up-regulates perforin-mediated NK activity without increasing perforin messenger RNA expression by binding to constitutively expressed IL-18 receptor. J Immunol 162 3: 1662-8. Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (1999) Basic Concepts in Immunology, pp 1-31. In: Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (Eds.) Immunobiology – The Immune System In Health And Disease. 4th edition. Current Biology Publications, Elsevier Science, London, UK. Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (1999) Host Defense Against Infection, pp 363-415. In: Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (Eds.) Immunobiology – The Immune System In Health And Disease. 4th edition. Current Biology Publications, Elsevier Science, London, UK. Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (1999) T-Cell Mediated Immunity, pp 263-305. In: Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (Eds.) Immunobiology – The Immune System In Health And Disease. 4th edition. Current Biology Publications, Elsevier Science, London, UK. Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (1999) The Humoral Immune Response, pp 307-361. In: Janeway, C.A., Travers, P., Walport, M., Capra, J.D. (Eds.) Immunobiology – The Immune System In Health And Disease. 4th edition. Current Biology Publications, Elsevier Science, London, UK. Jones, A. C., E. A. Miles, et al. (1996). Fetal peripheral blood mononuclear cell proliferative responses to mitogenic and allergenic stimuli during gestation. Pediatr Allergy Immunol 7 3: 109-16. Kalliomaki, M., S. Salminen, et al. (2001). Probiotics in primary prevention of atopic disease: a randomised placebo-controlled trial. Lancet 357 9262: 1076-9. Kamogawa, Y., L. A. Minasi, et al. (1993). The relationship of IL-4- and IFN gammaproducing T cells studied by lineage ablation of IL-4-producing cells. Cell 75 5: 98595. Karupiah, G., Q. W. Xie, et al. (1993). Inhibition of viral replication by interferon-gammainduced nitric oxide synthase. Science 261 5127: 1445-8. Literaturverzeichnis 89 Keegan, A. D., J. A. Johnston, et al. (1995). Similarities and differences in signal transduction by interleukin 4 and interleukin 13: analysis of Janus kinase activation. Proc Natl Acad Sci U S A 92 17: 7681-5. Kim, Y. M., R. V. Talanian, et al. (1998). Nitric oxide prevents IL-1beta and IFN-gammainducing factor (IL-18) release from macrophages by inhibiting caspase-1 (IL-1betaconverting enzyme). J Immunol 161 8: 4122-8. Kinet, J. P. (1989). The high-affinity receptor for IgE. Curr Opin Immunol 2 4: 499-505. King, C. L., I. Malhotra, et al. (1998). B cell sensitization to helminthic infection develops in utero in humans. J Immunol 160 7: 3578-84. Koch, F., U. Stanzl, et al. (1996). High level IL-12 production by murine dendritic cells: upregulation via MHC class II and CD40 molecules and downregulation by IL-4 and IL-10. J Exp Med 184 2: 741-6. Kohka, H., H. Iwagaki, et al. (1999). Involvement of interleukin-18 (IL-18) in mixed lymphocyte reactions (MLR). J Interferon Cytokine Res 19 9: 1053-7. Kohka, H., M. Nishibori, et al. (2000). Histamine is a potent inducer of IL-18 and IFNgamma in human peripheral blood mononuclear cells. J Immunol 164 12: 6640-6. Kohno, K., J. Kataoka, et al. (1997). IFN-gamma-inducing factor (IGIF) is a costimulatory factor on the activation of Th1 but not Th2 cells and exerts its effect independently of IL-12. J Immunol 158 4: 1541-50. Komai-Koma, M., F. Y. Liew, et al. (1995). Interactions between IL-4, anti-CD40, and antiimmunoglobulin as activators of locomotion of human B cells. J Immunol 155 3: 1110-6. Kondo, M., T. Takeshita, et al. (1993). Sharing of the interleukin-2 (IL-2) receptor gamma chain between receptors for IL-2 and IL-4. Science 262 5141: 1874-7. Kondo, N., Y. Kobayashi, et al. (1998). Reduced interferon gamma production by antigenstimulated cord blood mononuclear cells is a risk factor of allergic disorders--6-year follow-up study. Clin Exp Allergy 28 11: 1340-4. Konig, R., L. Y. Huang, et al. (1992). MHC class II interaction with CD4 mediated by a region analogous to the MHC class I binding site for CD8. Nature 356 6372: 796-8. Kronenberg, M. and A. Rudensky (2005). Regulation of immunity by self-reactive T cells. Nature 435 7042: 598-604. Kruse, N., T. Lehrnbecher, et al. (1991). Site-directed mutagenesis reveals the importance of disulfide bridges and aromatic residues for structure and proliferative activity of human interleukin-4. FEBS Lett 286 1-2: 58-60. Kruse, S., J. Kuehr, et al. (2003). Polymorphisms in the IL 18 gene are associated with specific sensitization to common allergens and allergic rhinitis. J Allergy Clin Immunol 111 1: 117-22. Literaturverzeichnis 90 Kumano, K., A. Nakao, et al. (1999). Interleukin-18 enhances antigen-induced eosinophil recruitment into the mouse airways. Am J Respir Crit Care Med 160 3: 873-8. Kunikata, T., K. Torigoe, et al. (1998). Constitutive and induced IL-18 receptor expression by various peripheral blood cell subsets as determined by anti-hIL-18R monoclonal antibody. Cell Immunol 189 2: 135-43. Langenkamp, A., M. Messi, et al. (2000). Kinetics of dendritic cell activation: impact on priming of TH1, TH2 and nonpolarized T cells. Nat Immunol 1 4: 311-6. Langrish, C. L., J. C. Buddle, et al. (2002). Neonatal dendritic cells are intrinsically biased against Th-1 immune responses. Clin Exp Immunol 128 1: 118-23. Lenschow, D. J., T. L. Walunas, et al. (1996). CD28/B7 system of T cell costimulation. Annu Rev Immunol 14 233-58. Liao, S. Y., T. N. Liao, et al. (1996). Decreased production of IFN gamma and increased production of IL-6 by cord blood mononuclear cells of newborns with a high risk of allergy. Clin Exp Allergy 26 4: 397-405. Lin, J. X., T. S. Migone, et al. (1995). The role of shared receptor motifs and common Stat proteins in the generation of cytokine pleiotropy and redundancy by IL-2, IL-4, IL-7, IL-13, and IL-15. Immunity 2 4: 331-9. Litonjua, A. A., V. J. Carey, et al. (1998). Parental history and the risk for childhood asthma. Does mother confer more risk than father? Am J Respir Crit Care Med 158 1: 176-81. Llorente, L., F. Mitjavila, et al. (1990). Dual effects of interleukin 4 on antigen-activated human B cells: induction of proliferation and inhibition of interleukin 2-dependent differentiation. Eur J Immunol 20 9: 1887-92. Loza, M. J., L. Zamai, et al. (2002). Expression of type 1 (interferon gamma) and type 2 (interleukin-13, interleukin-5) cytokines at distinct stages of natural killer cell differentiation from progenitor cells. Blood 99 4: 1273-81. Matthiesen, L., G. Berg, et al. (1996). Lymphocyte subsets and mitogen stimulation of blood lymphocytes in normal pregnancy. Am J Reprod Immunol 35 2: 70-9. Maziak, W., T. Behrens, et al. (2003). Are asthma and allergies in children and adolescents increasing? Results from ISAAC phase I and phase III surveys in Munster, Germany. Allergy 58 7: 572-9. McKenzie, G. J., C. L. Emson, et al. (1998). Impaired development of Th2 cells in IL-13deficient mice. Immunity 9 3: 423-32. Mescher, M. F. (1995). Molecular interactions in the activation of effector and precursor cytotoxic T lymphocytes. Immunol Rev 146 177-210. Meyers, J. H., A. Ryu, et al. (2002). Cutting edge: CD94/NKG2 is expressed on Th1 but not Th2 cells and costimulates Th1 effector functions. J Immunol 169 10: 5382-6. Miller, D. L., T. Hiravonen, et al. (1973). Synthesis of IgE by the human conceptus. J Allergy Clin Immunol 52 3: 182-8. Literaturverzeichnis 91 Minty, A., P. Chalon, et al. (1993). Interleukin-13 is a new human lymphokine regulating inflammatory and immune responses. Nature 362 6417: 248-50. Mitchell, L. C., L. S. Davis, et al. (1989). Promotion of human T lymphocyte proliferation by IL-4. J Immunol 142 5: 1548-57. Miyawaki, T., H. Seki, et al. (1985). Dissociated production of interleukin-2 and immune (gamma) interferon by phytohaemagglutinin stimulated lymphocytes in healthy infants. Clin Exp Immunol 59 2: 505-11. Mosmann, T. R., H. Cherwinski, et al. (1986). Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol 136 7: 2348-57. Mosmann, T. R. and R. L. Coffman (1989). TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol 7 145-73. Mosmann, T. R. and S. Sad (1996). The expanding universe of T-cell subsets: Th1, Th2 and more. Immunol Today 17 3: 138-46. Nakanishi, K. (2001). Innate and acquired activation pathways in T cells. Nat Immunol 2 2: 140-2. Nakanishi, K., T. Yoshimoto, et al. (2001). Interleukin-18 regulates both Th1 and Th2 responses. Annu Rev Immunol 19 423-74. Nathan, C. F. and S. Tsunawaki (1986). Secretion of toxic oxygen products by macrophages: regulatory cytokines and their effects on the oxidase. Ciba Found Symp 118 211-30. Netea, M. G., B. J. Kullberg, et al. (2000). Interleukin-18 induces production of proinflammatory cytokines in mice: no intermediate role for the cytokines of the tumor necrosis factor family and interleukin-1beta. Eur J Immunol 30 10: 3057-60. Novick, D., S. H. Kim, et al. (1999). Interleukin-18 binding protein: a novel modulator of the Th1 cytokine response. Immunity 10 1: 127-36. Ohshima, Y. and G. Delespesse (1997). T cell-derived IL-4 and dendritic cell-derived IL-12 regulate the lymphokine-producing phenotype of alloantigen-primed naive human CD4 T cells. J Immunol 158 2: 629-36. Okamura, H., S. Kashiwamura, et al. (1998). Regulation of interferon-gamma production by IL-12 and IL-18. Curr Opin Immunol 10 3: 259-64. Okamura, H., H. Tsutsi, et al. (1995). Cloning of a new cytokine that induces IFN-gamma production by T cells. Nature 378 6552: 88-91. Okamura, H., H. Tsutsui, et al. (1998). Interleukin-18: a novel cytokine that augments both innate and acquired immunity. Adv Immunol 70 281-312. Omran, M. and G. Russell (1996). Continuing increase in respiratory symptoms and atopy in Aberdeen schoolchildren. Bmj 312 7022: 34. Literaturverzeichnis 92 Pastorelli, G., F. Rousset, et al. (1990). Cord blood B cells are mature in their capacity to switch to IgE-producing cells in response to interleukin-4 in vitro. Clin Exp Immunol 82 1: 114-9. Paul, W. E., R. A. Seder, et al. (1993). Lymphokine and cytokine production by Fc epsilon RI+ cells. Adv Immunol 53 1-29. Pene, J., F. Rousset, et al. (1988). IgE production by normal human B cells induced by alloreactive T cell clones is mediated by IL-4 and suppressed by IFN-gamma. J Immunol 141 4: 1218-24. Peritt, D., S. Robertson, et al. (1998). Differentiation of human NK cells into NK1 and NK2 subsets. J Immunol 161 11: 5821-4. Piccinni, M. P., M. G. Giudizi, et al. (1995). Progesterone favors the development of human T helper cells producing Th2-type cytokines and promotes both IL-4 production and membrane CD30 expression in established Th1 cell clones. J Immunol 155 1: 128-33. Pope, S. M., E. B. Brandt, et al. (2001). IL-13 induces eosinophil recruitment into the lung by an IL-5- and eotaxin-dependent mechanism. J Allergy Clin Immunol 108 4: 594-601. Prescott, S. L., C. Macaubas, et al. (1998). Transplacental priming of the human immune system to environmental allergens: universal skewing of initial T cell responses toward the Th2 cytokine profile. J Immunol 160 10: 4730-7. Prescott, S. L., C. Macaubas, et al. (1999). Development of allergen-specific T-cell memory in atopic and normal children. Lancet 353 9148: 196-200. Prescott, S. L., A. Taylor, et al. (2003). Neonatal interleukin-12 capacity is associated with variations in allergen-specific immune responses in the neonatal and postnatal periods. Clin Exp Allergy 33 5: 566-72. Prinz, M. and U. K. Hanisch (1999). Murine microglial cells produce and respond to interleukin-18. J Neurochem 72 5: 2215-8. Punnonen, J., G. Aversa, et al. (1993). Interleukin 13 induces interleukin 4-independent IgG4 and IgE synthesis and CD23 expression by human B cells. Proc Natl Acad Sci U S A 90 8: 3730-4. Punnonen, J. and J. E. de Vries (1994). IL-13 induces proliferation, Ig isotype switching, and Ig synthesis by immature human fetal B cells. J Immunol 152 3: 1094-102. Rissoan, M. C., V. Soumelis, et al. (1999). Reciprocal control of T helper cell and dendritic cell differentiation. Science 283 5405: 1183-6. Robinson, D., K. Shibuya, et al. (1997). IGIF does not drive Th1 development but synergizes with IL-12 for interferon-gamma production and activates IRAK and NFkappaB. Immunity 7 4: 571-81. Robinson, D. S., Q. Hamid, et al. (1992). Predominant TH2-like bronchoalveolar Tlymphocyte population in atopic asthma. N Engl J Med 326 5: 298-304. Literaturverzeichnis 93 Romagnani, S. (1994). Lymphokine production by human T cells in disease states. Annu Rev Immunol 12 227-57. Roth, I., D. B. Corry, et al. (1996). Human placental cytotrophoblasts produce the immunosuppressive cytokine interleukin 10. J Exp Med 184 2: 539-48. Russell, S. M., A. D. Keegan, et al. (1993). Interleukin-2 receptor gamma chain: a functional component of the interleukin-4 receptor. Science 262 5141: 1880-3. Schmid-Grendelmeier, P., F. Altznauer, et al. (2002). Eosinophils express functional IL-13 in eosinophilic inflammatory diseases. J Immunol 169 2: 1021-7. Schultz, C. L., P. Rothman, et al. (1992). T helper cell membranes promote IL-4-independent expression of germ-line C gamma 1 transcripts in B cells. J Immunol 149 1: 60-4. Seder, R. A., J. L. Boulay, et al. (1992). CD8+ T cells can be primed in vitro to produce IL-4. J Immunol 148 6: 1652-6. Shibata, Y., L. A. Foster, et al. (1998). Immunoregulatory roles of IL-10 in innate immunity: IL-10 inhibits macrophage production of IFN-gamma-inducing factors but enhances NK cell production of IFN-gamma. J Immunol 161 8: 4283-8. Shields, J. G., R. J. Armitage, et al. (1989). Increased expression of surface IgM but not IgD or IgG on human B cells in response to IL-4. Immunology 66 2: 224-7. Shikano, H., Z. Kato, et al. (2001). IFN-gamma production in response to IL-18 or IL-12 stimulation by peripheral blood mononuclear cells of atopic patients. Clin Exp Allergy 31 8: 1263-70. Snapper, C. M. and W. E. Paul (1987). Interferon-gamma and B cell stimulatory factor-1 reciprocally regulate Ig isotype production. Science 236 4804: 944-7. Soh, J., R. J. Donnelly, et al. (1994). Identification and sequence of an accessory factor required for activation of the human interferon gamma receptor. Cell 76 5: 793-802. Sornasse, T., P. V. Larenas, et al. (1996). Differentiation and stability of T helper 1 and 2 cells derived from naive human neonatal CD4+ T cells, analyzed at the single-cell level. J Exp Med 184 2: 473-83. Stebbins, C. C., M. E. Peterson, et al. (1996). DM-mediated release of a naturally occurring invariant chain degradation intermediate from MHC class II molecules. J Immunol 157 11: 4892-8. Steinman, R. M. (1991). The dendritic cell system and its role in immunogenicity. Annu Rev Immunol 9 271-96. Stoll, S., H. Jonuleit, et al. (1998). Production of functional IL-18 by different subtypes of murine and human dendritic cells (DC): DC-derived IL-18 enhances IL-12-dependent Th1 development. Eur J Immunol 28 10: 3231-9. Stoll, S., G. Muller, et al. (1997). Production of IL-18 (IFN-gamma-inducing factor) messenger RNA and functional protein by murine keratinocytes. J Immunol 159 1: 298-302. Literaturverzeichnis 94 Szabo, S. J., A. S. Dighe, et al. (1997). Regulation of the interleukin (IL)-12R beta 2 subunit expression in developing T helper 1 (Th1) and Th2 cells. J Exp Med 185 5: 817-24. Takeda, K., H. Tsutsui, et al. (1998). Defective NK cell activity and Th1 response in IL-18deficient mice. Immunity 8 3: 383-90. Tanaka, H., N. Miyazaki, et al. (2001). IL-18 might reflect disease activity in mild and moderate asthma exacerbation. J Allergy Clin Immunol 107 2: 331-6. Tang, M. L., A. S. Kemp, et al. (1994). Reduced interferon-gamma secretion in neonates and subsequent atopy. Lancet 344 8928: 983-5. Taylor, S. and Y. J. Bryson (1985). Impaired production of gamma-interferon by newborn cells in vitro is due to a functionally immature macrophage. J Immunol 134 3: 1493-7. Tominaga, K., T. Yoshimoto, et al. (2000). IL-12 synergizes with IL-18 or IL-1beta for IFNgamma production from human T cells. Int Immunol 12 2: 151-60. Tomura, M., S. Maruo, et al. (1998). Differential capacities of CD4+, CD8+, and CD4-CD8T cell subsets to express IL-18 receptor and produce IFN-gamma in response to IL-18. J Immunol 160 8: 3759-65. Torigoe, K., S. Ushio, et al. (1997). Purification and characterization of the human interleukin-18 receptor. J Biol Chem 272 41: 25737-42. Trinchieri, G. (1995). Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity. Annu Rev Immunol 13 251-76. Trombetta, E. S. and I. Mellman (2005). Cell biology of antigen processing in vitro and in vivo. Annu Rev Immunol 23 975-1028. Tsegaye, A., D. Wolday, et al. (2003). Immunophenotyping of blood lymphocytes at birth, during childhood, and during adulthood in HIV-1-uninfected Ethiopians. Clin Immunol 109 3: 338-46. Tsicopoulos, A., Q. Hamid, et al. (1992). Preferential messenger RNA expression of Th1-type cells (IFN-gamma+, IL-2+) in classical delayed-type (tuberculin) hypersensitivity reactions in human skin. J Immunol 148 7: 2058-61. Tsutsui, H., K. Nakanishi, et al. (1996). IFN-gamma-inducing factor up-regulates Fas ligandmediated cytotoxic activity of murine natural killer cell clones. J Immunol 157 9: 3967-73. Tsutsui, H., T. Yoshimoto, et al. (2004). Induction of allergic inflammation by interleukin-18 in experimental animal models. Immunol Rev 202 115-38. Tunon de Lara, J. M., Y. Okayama, et al. (1994). Release and inactivation of interleukin-4 by mast cells. Ann N Y Acad Sci 725 50-8. Turley, S. J., K. Inaba, et al. (2000). Transport of peptide-MHC class II complexes in developing dendritic cells. Science 288 5465: 522-7. Literaturverzeichnis 95 Udagawa, N., N. J. Horwood, et al. (1997). Interleukin-18 (interferon-gamma-inducing factor) is produced by osteoblasts and acts via granulocyte/macrophage colony-stimulating factor and not via interferon-gamma to inhibit osteoclast formation. J Exp Med 185 6: 1005-12. Van Kooten, C. and J. Banchereau (1996). CD40-CD40 ligand: a multifunctional receptorligand pair. Adv Immunol 61 1-77. Verhaeghe, B., P. Gevaert, et al. (2002). Up-regulation of IL-18 in allergic rhinitis. Allergy 57 9: 825-30. Vieira, P. L., E. C. de Jong, et al. (2000). Development of Th1-inducing capacity in myeloid dendritic cells requires environmental instruction. J Immunol 164 9: 4507-12. Vollmer, W. M., M. L. Osborne, et al. (1998). 20-year trends in the prevalence of asthma and chronic airflow obstruction in an HMO. Am J Respir Crit Care Med 157 4 Pt 1: 107984. Warner, J. A., A. C. Jones, et al. (1997). Prenatal origins of asthma and allergy. Ciba Found Symp 206 220-8. Warner, J. A., C. A. Jones, et al. (1998). Maternal programming in asthma and allergy. Clin Exp Allergy 5 35-8. Warner, J. A., E. A. Miles, et al. (1994). Is deficiency of interferon gamma production by allergen triggered cord blood cells a predictor of atopic eczema? Clin Exp Allergy 24 5: 423-30. Wegmann, T. G., H. Lin, et al. (1993). Bidirectional cytokine interactions in the maternalfetal relationship: is successful pregnancy a TH2 phenomenon? Immunol Today 14 7: 353-6. Weinberg, E. D. (1984). Pregnancy-associated depression of cell-mediated immunity. Rev Infect Dis 6 6: 814-31. Wierenga, E. A., M. Snoek, et al. (1990). Evidence for compartmentalization of functional subsets of CD2+ T lymphocytes in atopic patients. J Immunol 144 12: 4651-6. Wild, J. S., A. Sigounas, et al. (2000). IFN-gamma-inducing factor (IL-18) increases allergic sensitization, serum IgE, Th2 cytokines, and airway eosinophilia in a mouse model of allergic asthma. J Immunol 164 5: 2701-10. Williams, M. E., T. L. Chang, et al. (1991). Activation of functionally distinct subsets of CD4+ T lymphocytes. Res Immunol 142 1: 23-8. Wills-Karp, M. (2004). Interleukin-13 in asthma pathogenesis. Immunol Rev 202 175-90. Wills-Karp, M. and M. Chiaramonte (2003). Interleukin-13 in asthma. Curr Opin Pulm Med 9 1: 21-7. Wills-Karp, M., J. Luyimbazi, et al. (1998). Interleukin-13: central mediator of allergic asthma. Science 282 5397: 2258-61. Literaturverzeichnis 96 Wong, C. K., C. Y. Ho, et al. (2001). Proinflammatory cytokines (IL-17, IL-6, IL-18 and IL12) and Th cytokines (IFN-gamma, IL-4, IL-10 and IL-13) in patients with allergic asthma. Clin Exp Immunol 125 2: 177-83. Xu, D., W. L. Chan, et al. (1998). Selective expression and functions of interleukin 18 receptor on T helper (Th) type 1 but not Th2 cells. J Exp Med 188 8: 1485-92. Xu, D., V. Trajkovic, et al. (2000). IL-18 induces the differentiation of Th1 or Th2 cells depending upon cytokine milieu and genetic background. Eur J Immunol 30 11: 314756. Yamamura, M., K. Uyemura, et al. (1991). Defining protective responses to pathogens: cytokine profiles in leprosy lesions. Science 254 5029: 277-9. Yang, J., T. L. Murphy, et al. (1999). Induction of interferon-gamma production in Th1 CD4+ T cells: evidence for two distinct pathways for promoter activation. Eur J Immunol 29 2: 548-55. Yang, L. P., C. E. Demeure, et al. (1995). Maturation of neonatal human CD4 T cells: III. Role of B7 co-stimulation at priming. Int Immunol 7 12: 1987-93. Yoshimoto, T., H. Mizutani, et al. (2000). IL-18 induction of IgE: dependence on CD4+ T cells, IL-4 and STAT6. Nat Immunol 1 2: 132-7. Yoshimoto, T., N. Nagai, et al. (1998). LPS-stimulated SJL macrophages produce IL-12 and IL-18 that inhibit IgE production in vitro by induction of IFN-gamma production from CD3intIL-2R beta+ T cells. J Immunol 161 3: 1483-92. Yoshimoto, T., H. Okamura, et al. (1997). Interleukin 18 together with interleukin 12 inhibits IgE production by induction of interferon-gamma production from activated B cells. Proc Natl Acad Sci U S A 94 8: 3948-53. Yoshimoto, T., K. Takeda, et al. (1998). IL-12 up-regulates IL-18 receptor expression on T cells, Th1 cells, and B cells: synergism with IL-18 for IFN-gamma production. J Immunol 161 7: 3400-7. Yoshimoto, T., H. Tsutsui, et al. (1999). IL-18, although antiallergic when administered with IL-12, stimulates IL-4 and histamine release by basophils. Proc Natl Acad Sci U S A 96 24: 13962-6. Yoshizawa, Y., H. Nomaguchi, et al. (2002). Serum cytokine levels in atopic dermatitis. Clin Exp Dermatol 27 3: 225-9. Yu, C. R., R. A. Kirken, et al. (1998). Differential regulation of the Janus kinase-STAT pathway and biologic function of IL-13 in primary human NK and T cells: a comparative study with IL-4. J Immunol 161 1: 218-27. Zhang, K., E. A. Clark, et al. (1991). CD40 stimulation provides an IFN-gamma-independent and IL-4-dependent differentiation signal directly to human B cells for IgE production. J Immunol 146 6: 1836-42. Zurawski, G. and J. E. de Vries (1994). Interleukin 13, an interleukin 4-like cytokine that acts on monocytes and B cells, but not on T cells. Immunol Today 15 1: 19-26. Literaturverzeichnis 97 Zurawski, S. M., F. Vega, Jr., et al. (1993). Receptors for interleukin-13 and interleukin-4 are complex and share a novel component that functions in signal transduction. Embo J 12 7: 2663-70. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet (1998) 351 9111: 1225-32. Danksagung Sehr herzlich bedanken möchte ich mich bei meinem Doktorvater, Herrn PD Dr. Kopp, für die Überlassung des Themas sowie die nette und motivierende Betreuung dieser Arbeit. Danken möchte ich ebenfalls Herrn PD Dr. Schempp für die Übernahme des Zweitgutachtens. Außerdem möchte ich mich bei dem gesamten Laborteam ganz herzlich bedanken. Maria Lickert und Eva Engels gilt für die Einarbeitung in die Labormethoden, die immer freundliche Zusammenarbeit und die tatkräftige Hilfsbereitschaft bei der Bewältigung kleiner, alltäglicher Laborprobleme mein herzlicher Dank. Vielen Dank auch an Gonza Ngoumou, Ulrike Reggelin, Stefan Förster und Jost Lange, die zur gleichen Zeit wie ich im Labor arbeiteten und mit denen mir die Zusammenarbeit viel Freude bereitet hat. Ebenfalls danke ich allen Familien, die durch ihr Einverständnis zur Nabelschnurblutentnahme diese Arbeit ermöglicht haben. Auch den Gynäkologen, die die Patientinnen in die Studie einschlossen und den betreuenden Hebammen möchte ich herzlich danken. Mein besonders herzlicher Dank gilt meinen Eltern, ohne die mein Studium in dieser Form nicht möglich gewesen wäre und die mich in der Verwirklichung meiner Pläne und Wünsche stets unterstützt haben. Ein besonderer Dank gilt auch Jan Rohr für seine motivierende Unterstützung und bereichernde fachliche Diskussionen, Johannes Schaefer für seinen Beistand in allen computertechnischen Fragen, sowie allen meinen Freunden, die mich in dieser Zeit unterstützt haben. Dörte Schaefer Nägeleseestraße 28 79102 Freiburg Persönliche Daten: Geburtsdatum: Geburtsort: Staatsangehörigkeit: Familienstand: 21.01.1979 Hannover deutsch ledig Werdegang: 1985 - 1989 1989 - 1991 1991 - 1998 1998 Grundschule Osterwald, Region Hannover Orientierungsstufe Berenbostel, Region Hannover Gymnasium Berenbostel, Region Hannover Abiturprüfung 1998 - 2000 2000 2000 - 2005 2001 2004 2005 Studium der Medizin, Ernst-Moritz-Arndt-Universität Greifswald Ärztliche Vorprüfung Studium der Medizin, Albert-Ludwigs-Universität Freiburg 1. Abschnitt der Ärztlichen Prüfung 2. Abschnitt der Ärztlichen Prüfung 3. Abschnitt der Ärztlichen Prüfung Praktische Tätigkeiten: 1999 1999 2001 2002 2003 2003 2003 2004 2004 2004 2004-2005 Praktikum, Thorax- und Gefäßchirurgie, Krankenhaus Heidehaus Hannover Praktikum, Innere Medizin Onkologie, Krankenhaus Heidehaus Hannover Famulatur, Gynäkologie und Geburtshilfe, Universitätsklinikum Münster Famulatur, Innere Medizin Hämatologie/Onkologie, Allgemeines Krankenhaus der Stadt Wien (Österreich) Famulatur, Radiologie und Nuklearmedizin , Praxis Dr. Weyer/Dr. Reuland, Freiburg Famulatur, Innere Medizin Kardiologie, Portiuncula Hospital, Ballinasloe (Irland) Famulatur, Pädiatrie, Universitätskinderklinik Mainz Praktisches Jahr: Gynäkologie und Geburtshilfe, Ev. Diakoniekrankenhaus Freiburg Praktisches Jahr: Innere Medizin, St. Joseph’s Health Centre, Toronto (Canada) Praktisches Jahr: Innere Medizin, Ev. Diakoniekrankenhaus Freiburg Praktisches Jahr: Chirurgie, Hôpitaux Universitaires de Genève, Genf (Schweiz)