Das Melanom - Prophy Docs
Werbung

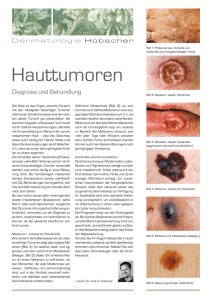
Das Melanom Definition, Inzidenz, Pathogenese Das Melanom wird als bösartiger Tumor der pigmentbildenden Zellen der Haut definiert. Die Ursache für die steigende Inzidenz des Melanoms (in Österreich ist die Gesamthäufigkeit 1020 Neuerkrankungen pro 100.000 Einwohner, damit 3,3% alle bösartigen Tumoren) ist wahrscheinlich auf verschiedene Faktoren, wie v.a. das höhere Durchschnittsalter der Bevölkerung, eine genetische Disposition, spezifische Immunosuppression und Sonnenbestrahlung zurückzuführen. Viele Beobachtungen sprechen für eine kausale Rolle des Sonnenlichtes bei der Entstehung des Melanoms. Melanome resultieren aus einer Akkumulation von Mutationen die in Zellteilung, Zelldifferenzierung und Zelltod involviert sind. In den letzten Jahren hat sich unser Verständnis des Melanoms jedoch durch die moderne Onkogenetik wesentlich gewandelt. Wir sehen das Melanom heute als eine komplexe Krebserkrankung mit mehreren molekulargenetisch definierten Mustern. Die häufigsten somatischen Mutationen in Melanomen betreffen mit 50-60% das BRAF-Gen, insbesonders die Melanome, die durch intermittierende Sonnenbestrahlung hervorgerufen werden. Eine häufig durch Mutation oder Amplifikation pathologisch aktivierter Wachstumsfaktorrezeptoren ist der KIT-Rezeptor bei den akralen und mukosalen Melanomen und bei Melanomen der chronisch lichtexponierten Haut. Klinische Diagnose Ungefähr 95% aller Melanome entstehen in der Haut (oder Schleimhäute und Nägel), von den übrigen entwickelt sich ein Großteil im Auge. Für ein Melanom verdächtig sind pigmentierte Läsionen, die folgende Veränderungen und Symptome aufweisen (sog. ABCDE Regeln): - Größenzunahme Änderung der Farbe (dunklere Pigmentierung, blaue und rote Farbtöne) oder Farbverlust (weiße Areale) oder mehr als 2 Farben in der Läsion Unregelmäßige Begrenzung Entwicklung eines Knotens in eine makulöse Läsion Veränderung an der Oberfläche (Rötung, Erosion, Blutung) Subjektive Symptome (Juckreiz) Durchmesser > 5 mm Diagnose Entscheidend für die definitive Diagnose ist der histopathologische Befund. Sehr wichtig ist die Bestimmung der maximalen Tumordicke nach Breslow. Abbildungen: Histopathologische Bilder von verschiedenen Melanomen Klassifikation - In situ Melanom (non invasiv) Oberflächiges spreitendes Melanom Knotiges (noduläres) Melanom Das lentigo-maligna Melanom Das akral-lentiginöse Melanom Andere Varianten (Schleimhautmelanom; amelanotisches Melanom; polypoides, verruköses, desmoplastisches, spitzoides Melanom) Prognose Die Prognose des Melanoms hat sich entscheidend gebessert. Dies ist auf die verbesserte Frühdiagnostik zurückzuführen (siehe Auflichtmikroskopie). Die chirurgische Exzision des Melanoms im Initialstadium führt zur Heilung. Daher ist vorrangig, Frühformen und Vorläufer des Melanoms zu erkennen und Risikopatienten zu erfassen. Als unabhängiges histologisch-prognostisches Hauptkriterium hat sich die Bestimmung der maximalen Tumordicke nach Breslow bewährt, welche sehr klare prognostische Aussagen gibt. Andere wichtige histopathologische prognostische Kriterien sind die Mitoserate und Ulzeration. Patienten mit einer Tumordicke < 0,76 mm zeigen eine 5-Jahres-Überlebensrate > 95%, während z.B. bei Melanome > 4mm Eindringtiefe die Überlebensrate nach 5 Jahren unter 50% absinkt. Therapie Die Diagnose Melanom war früher mit Unsicherheit, Furcht und Hoffnungslosigkeit verbunden. Moderne Erkenntnisse der Melanom-Forschung haben jedoch zu einer wesentlichen Änderung der Einstellung gegenüber verschiedenen diagnostischen und therapeutischen Problemen geführt. Die großzügige chirurgische Exzision des Tumors ist die wichtigste Behandlungsmaßnahme. Präoperativ ist immer eine Tumorstaging obligatorisch. Bei einer Tumordicke über 1 mm sollte eine Wächterlymphknotenbiopsie durchgeführt werden. Bei Nachweis einer Mikrometastasierung im Wächterlymphknoten wird eine Ausräumung der entsprechenden Lymphknotenstation (radikale Lymphadenektomie) empfohlen. Das maligne Melanom kann sowohl primär lymphogen als auch primär hämatogen metastasieren. Eine adjuvante Therapie mit Interferon-alpha sollte daher allen Patienten mit erhöhtem Metastasierungsrisiko angeboten werden, soweit keine Kontraindikationen bestehen. Satelliten- und In-transit-Metastasen –wenn in geringer Zahl vorhanden – können chirurgisch entfernt werden. Solitäre Lunge- oder Hirnmetastasen können auch chirurgisch exzidiert werden. Bei solitären Hirnmetastasen kann auch eine stereotaktische Einzeitbestrahlung angestrebt werden. Prinzipielle Indikationen zur systemischen Chemotherapie/ Chemoimmuntherapie sind inoperable Rezidivtumore, inoperable regionäre Metastasen sowie Fernmetastasen. Da die Behandlungen überwiegend unter palliativen Gesichtspunkten erfolgen, sind die therapeutischen Bemühungen im Hinblick auf die Erhaltung der Lebensqualität kritisch zu würdigen. Für die systemische Monotherapie des fortgeschrittenen Melanoms stehen mehrere Substanzen zur Verfügung (Dacarbazin, Temozolomid, Fotemustin, Carboplatin, Cisplatin, Vindesin, Interleukin-2, Interferon-alpha), deren klinische Wirksamkeit vergleichbar ist. Ansprechrate liegt zwischen 12%-45%. Die neue molekulargenetische Klassifikation von Tumoren (und auch von Melanomen) ermöglicht den gezielten Einsatz sogenannter „Targeted Therapies“, also von Therapien, die sich gezielt gegen bestimmte mutierte Signalmoleküle bei Krebs richten. Imatinib inhibiert die KIT-Rezeptorkinase beim Melanom. Vemurafenib ist ein selektiver Inhibitor des Onkogens BRAF. Auch Therapeutika gegen mTORsind am weitesten entwickelt. Ipilimumab ist ein Antikörper der CTLa-4 blockiert und dadurch eine Erhöhung der T-Zell Aktivität dazu beiträgt, dass das Immunsystem eine Anti-Tumor-Wirkung ausübt. Literatur 1. Kerl H, Hönigsmann H, Kokoschka EM, Pehamberger, Soyer HP. Das maligne Melanom. Hoffmann La Roche Wien, Wien. 2001 2. Held L, Eigentler TK, Meier F, Held M, Röcken M, Garbe C, Bauer J. Oncogenetics of melanoma: basis for molecular diagnostics and therapy. J DtschDermatolGes. 2011;9:510-6. 3. Garbe C, Schadendorf D, Stolz W, Volkenandt M, Reinhold U, Kortmann RD, Kettelhack C, Frerich B, Keilholz U, Dummer R, Sebastian G, Tilgen W, Schuler G, Mackensen A, Kaufmann R, Hauschild A. Short German guidelines: malignantmelanoma. J DtschDermatol Ges. 2008;6 Suppl 1:S9-S14. 4. Schrama D, Kneitz H, Willmes C, Adam C, Houben R, Becker JC. Lack of correlation between IGFBP7 expression and BRAF mutational status in melanoma. J Invest Dermatol. 2010;130:897-8. 5. Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, Buzaid AC, Cochran AJ, Coit DG, Ding S, Eggermont AM, Flaherty KT, Gimotty PA, Kirkwood JM, McMasters KM, Mihm MC Jr, Morton DL, Ross MI, Sober AJ, Sondak VK. Final version of 2009 AJCC melanoma staging and classification. J ClinOncol. 2009 20;27:6199-206.