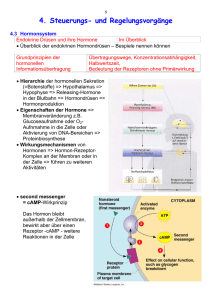
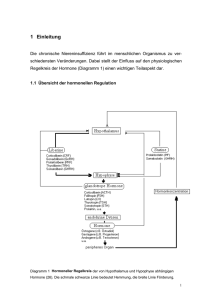
vorlesungsmanuskript biologische psychologie
Werbung

VORLESUNGSMANUSKRIPT BIOLOGISCHE PSYCHOLOGIE (6. überarbeitete Auflage, Oktober 2000) Vorbemerkung zur Arbeit mit diesem Manuskript: Das Manuskript soll lediglich die Mitschrift bestimmter Kapitel der Biologischen Psychologie I (Winter-Semester) während der Vorlesung ersetzen und zugleich die Vorbereitung auf die Prüfung erleichtern. Es ist nicht dazu gedacht, die Vorlesung zu ersetzen, da es lediglich die wichtigsten Fakten in stark komprimierter Form enthält. Auch ist nicht der gesamte Stoff des Winter-Semesters dargestellt, sondern nur solche Kapitel, deren Quelle in verschiedenen, schwerer zugänglichen Büchern liegt oder die aus Lehrbüchern stammen, die für den hier verfolgten Zweck zu umfangreich sind. Definition der Biologischen Psychologie Physiologie: Lehre von den normalen Lebensfunktionen. Biologische Psychologie: Untersuchung der Zusammenhänge zwischen physiologisch-organischen Vorgängen und dem Verhalten bzw. dem subjektiven Erleben. Basiert vorwiegend auf Tierexperimenten und betont neurophysiologische Prozesse. Psychophysiologie: Basiert auf Humanexperimenten. Strebt die psychologisch-physiologische Doppelbetrachtung an. Psychosomatik: Ursprünglich die Doppelbetrachtung psychophysischer Störungen. In Deutschland weitgehend psychoanalytisch orientiert. In der angloamerikanischen Literatur psychophysiologisch orientiert: Psychophysiological disorders statt psychosomatic disorders. In der 10. Revision der International Classification of Diseases (ICD-10, 1994) wurden auch diese Begriffe aufgegeben. Psychosomatische Störungen werden nun unter der Rubrik „F 45 Somatoforme Störungen“ eingeordnet. Diese sind durch die „wiederholte Darbietung körperlicher Symptome trotz wiederholter negativer Ergebnisse und Versicherung der Ärzte, daß die Symptome nicht körperlich begründbar sind, charakterisiert.“ Determinanten des Verhaltens: ZNS-Prozesse (ZNS = Zentralnervensystem), Hormonsystem, Reizsituation (Umwelt), phylogenetische Vergangenheit, Lerngeschichte u.a. 2 Anatomischer Aufbau des menschlichen Organismus Literatur: Faller, A. & Schünke, M. (1999). Der Körper des Menschen. Stuttgart: Thieme. Sobotta-Becher: Atlas der Anatomie des Menschen Bd. I und II. Einteilung der deskriptiven Anatomie: Knochen; Bänder, Muskeln und Schleimbeutel; Gefäße; Eingeweide; Zentralnervensystem; peripheres Nervensystem; Sinnesorgane und Haut. Knochen: Ursprünglich Knorpel. Reste des embryonalen Knorpelskeletts beim Erwachsenen: Z.B. Rippenknorpel, Gelenkknorpel. Setzt sich aus kalkhaltiger Knochensubstanz und Weichteilen (Gelenkknorpel, Knochenhaut = Periost, Knochenmark, Blutgefäße und Nerven) zusammen. Knochensubstanz in zwei Modifikationen: Substantia compacta (zylindrischer Mantel um den Markraum der Röhrenknochen) und Substantia spongiosa (Endstücke der Röhrenknochen, kurze und platte Knochen; Sitz des roten Knochenmarks). Knochenmark: Rotes Knochenmark (Blutbildung) und gelbes Knochenmark (reines Fettgewebe), das sich im Laufe der Entwicklung aus dem roten Mark bildet. Wirbelsäule: Besteht aus 24 freien Wirbeln (7 Hals-, 12 Brust- und 5 Lendenwirbel), Kreuzbein und Steißbein. Wirbelkörper durch Bandscheiben miteinander verbunden. Zwischen je 2 Wirbeln befinden sich die Zwischenwirbellöcher = foramen intervertebrale, die in den Rückenmarkskanal führen (ermöglichen die Verbindung zwischen ZNS und peripheren Nerven). Thorax (Brustkorb): Gebildet aus Brustwirbelsäule, 12 Rippenpaaren und Brustbein. Schädel: Besteht aus Stirnbein, Scheitelbein, Hinterhauptsbein, Schläfenbein, Keilbein, Tränenbein, Siebbein, Jochbein, Nasenbein, Unter- und Oberkiefer. Schädel des Neugeborenen: Vordere Fontanelle (zwischen Stirnnaht, Kranznaht und Pfeilnaht) = große Fontanelle; hintere Fontanelle = kleine Fontanelle; vordere und hintere Seitenfontanellen (paarig). Skelett der oberen Extremität: Schultergürtel (Schlüsselbein und Schulterblatt), freie obere Extremität (Oberarm = Humerus; Unterarm mit Radius = Speiche und Ulna = Elle; Hand mit Handwurzelknochen, Mittelhandknochen und Fingerknochen). Skelett der unteren Extremität: Beckengürtel (zwei Hüftbeine bestehend jeweils aus Darmbein, Schambein und Sitzbein; Kreuzbein); freie untere Extremität (Oberschenkel = Femur; Kniegelenk mit Menisken; Unterschenkel mit Tibia = Schienbein und Fibula = Wadenbein; Fuß mit Fußwurzelknochen, Mittelfußknochen und Zehen). Gelenke: Bestehend aus Kopf, Pfanne und Kapsel, welche die Gelenkhöhle nach außen abschließt. Schleimbeutel befinden sich an Stellen, wo Sehnen über Knochen gleiten, Sehnenscheiden dienen zur Führung der Sehnen über Knochen. Gelenkformen: Kugelgelenk (z.B. Schultergelenk), Eigelenk (z.B. hinteres Handwurzelgelenk), Scharniergelenk (z.B. Kniegelenk), Zapfengelenk (z.B. zwischen erstem und zweitem Halswirbel), Sattelgelenk (z.B. Carpometacarpalgelenk des Daumens = Verbindung zwischen Handwurzel und Mittelhandknochen des Daumens), flaches Gelenk (z.B. Kehlkopf). Muskel: Bestehend aus proximaler Ursprungssehne(näher zum Rumpf liegend), Muskelbauch und distaler Ansatzsehne(entfernter zum Rumpf liegend). Gleichsinnig arbeitende Muskeln = 3 Synergisten, ungleichsinnig arbeitende Muskeln = Antagonisten. Sechs Hauptbewegungen möglich: Beugung (Flexion), Streckung (Extension), Anziehen (Adduktion), Abspreizen (Abduktion), Außenrollung (Exorotation) und Innenrollung (Endorotation). Mundhöhle: Schneidezähne, Mahlzähne und Speicheldrüsen zur Verflüssigung der Nahrung und Beginn der Kohlenhydratverdauung. Am Übergang zwischen Mundhöhle und Pharynx liegen vordere und hintere Gaumenbögen mit Gaumenmandeln = Tonsillen. Pharynx (Schlund): Hier kreuzen sich Atemweg und Speiseweg. Berührung der hinteren Rachenwand löst Schluckreflex aus. Schluckzentrum in der Medulla oblongata (Teil des Gehirns). Oesophagus (Speiseröhre): Verbindet den Pharynx mit dem Magen. Liegt zwischen Luftröhre und Wirbelsäule. Magen: Links im Oberbauch zwischen Leber und Milz. Rechte Magenkante = kleine Curvatur, linke Magenkante = große Curvatur. Oberer Teil des Magens liegt als Magengrund (Fundus) in der linken Zwerchfellkuppel. Magengrund und Magenkörper (Corpus) bilden den verdauenden Magenabschnitt. Am Magenmund (Cardia) mündet die Speiseröhre in den Magen. Der Pförtnermuskel (Pylorus) schließt den Magen gegen den Zwölffingerdarm ab. Zwölffingerdarm (Duodenum): Gestalt eines liegenden nach links offenem U. Umrandet den Kopf der Bauchspeicheldrüse. Jenunum (Leerdarm) und Ileum (Krummdarm): Schließen sich an das Duodenum an. Schlingen des Darmes an Gekröse aufgehängt, das Gefäße, Nerven, Venen und Lymphgefäße führt. Dickdarm (Colon): Besteht aus Blinddarm mit Wurmfortsatz (Appendix), aufsteigendem Dickdarm, Quercolon, absteigendem Dickdarm und Sigmaschleife. Mastdarm (Rectum): Schließt sich an Sigmaschleife an und geht in den Analkanal über, der mit dem After (Anus) endet. Brusthöhle: Enthält die Brusteingeweide: Lungen mit zuführenden Luftwegen (Bronchien), Speiseröhre und Herz mit Venen und Arterien. Der Boden der Brusthöhle wird durch das Zwerchfell gebildet. Embryonaler Kreislauf: Nabelvene leitet das im Placentarkreislauf arterialisierte Blut dem Embryo zu. Diese mündet sowohl direkt in die untere Hohlvene als auch indirekt über das Pfortadersystem. In der unteren Hohlvene mischt sich das arterielle Blut der Nabelvene mit dem venösen Blut der Hohlvene. Aus der unteren Hohlvene gelangt das Blut in den rechten Vorhof. Ab hier zwei Wege: (1) rechter Vorhof ---> linker Vorhof über Foramen ovale ---> linker Ventrikel ---> Aorta ---> Körperkreislauf. (2) rechter Vorhof ---> rechter Ventrikel ---> Lungenarterien ---> Aorta über Ductus arteriosus. Nur 4 % des vom rechten Ventrikel ausgeworfenen Blutes gehen durch die embryonalen Lungen. Mit dem ersten Atemzug nimmt der Widerstand im Lungenkreislauf ab. Blut aus dem rechten Ventrikel fließt nun in die Lungenkapillaren. Druck im linken Vorhof übersteigt Druck im rechten Vorhof, wodurch sich das Foramen ovale schließt. Umkehr der Strömungsrichtung im Ductus arteriosus mit Verengung und Verschluß desselben. Kreislauf nach der Geburt: Linker Ventrikel---> Aorta ---> großer Kreislauf ---> Kapillargebiete ---> Venen ---> rechter Vorhof ---> rechter Ventrikel ---> Lungenarterien ---> Kapillaren der Lunge --> Lungenvenen ---> linker Vorhof ---> linker Ventrikel, etc. 4 Zellen, Gewebe und Organe Literatur: Faller & Schünke Grundeigenschaften der Zelle: Stoffwechsel, Wachstum, Empfindlichkeit (Reizaufnahme aus der Umwelt), Bewegung und Fortpflanzung. Zytoplasma: Kolloid von gelartiger Beschaffenheit, 3/4 Wasser, 1/4 Eiweiß, Lipoide und Kohlenhydrate. Zellorganellen: Endoplasmatisches Reticulum (System von Spalten, in denen rascher Transport gelöster Stoffe im Inneren des Zytoplasmas gewährleistet ist), Ribosomen (sitzen der Außenfläche der Lamellen des endoplasmatischen Reticulums auf; Orte der Eiweißbildung), Golgi-Feld (Lamellensystem; Aufgabe Sekretbildung), Zentrosomen (aus zylindrischen Röhren aufgebaut; für Zellteilung wichtig), Mitochondrien (längliche, von einer Doppelmembran umgebene Gebilde; Träger der Atmungsenzyme, Umwandlung von ADP in ATP), Lysosomen (enthalten Enzyme für den Abbau großer Moleküle). Zellmembran: Besteht aus innerer und äußerer Eiweißschicht mit dazwischenliegender Lipoidschicht. Regelt den Stoffaustausch zwischen Zelle und zwischenzelligem Raum. Die Zelloberfläche verfügt über besondere Rezeptoren, welche die Unterscheidung von körpereigen und körperfremd gestatten. Mit Hilfe auflösender Enzyme (Lysozyme) und Eiweiß verdauender Enzyme (Proteasen), die von der Zellmembran abgegeben werden, zerstört die Zelle fremde Substanzen. Sie kann kleine Partikel umfließen und sie durch Phagozytose in sich aufnehmen. Die Einverleibung kleiner Tröpfchen wird als Pinozytose bezeichnet. Zellkern (Nucleus): Mit Doppelmembran umgeben, deren Spalt mit dem endoplasmatischen Reticulum zusammenhängt. Kernporen gestatten Austausch mit dem Zytoplasma. Im Kern die Kernkörperchen (Nucleolen). Der Kern besteht aus Nucleinsäuren: RNS in den Nucleolen und DNS im übrigen Kernraum. DNS läßt sich anfärben, daher auch als Chromatin bezeichnet. Aus dem Chromatin gehen bei der Zellteilung die Chromosomen hervor. Elektrolyte: Im Wasser gelöste Salze, Säuren und Basen in Form elektrisch geladener Teilchen (Ionen). Filtration: Durchpressen kleinster Teilchen, die in einem Lösungsmittel gelöst sind, durch eine Membran mit entsprechender Porengröße (z.B. Kapillaren, Nieren). Diffusion: Langsame Durchdringung und Mischung von Flüssigkeiten oder Gasen bis zur völligen Durchmischung bei direkter Berührung von Gasen bzw. Flüssigkeiten unterschiedlicher Konzentration (z.B. Durchtreten von Sauerstoff durch die Wände der Lungenbläschen). Osmose: Diffusion durch eine semipermeable Membran. Dabei zieht die höher konzentrierte Lösung Wasser an ---> osmotischer Druck. Der osmotische Druck der Gewebeflüssigkeit hängt vom Eiweiß- und Salzgehalt ab und entspricht etwa einer Lösung von 0,9 % NaCl (= physiologische Kochsalzlösung). Gewebe: Verband gleichartig gebauter Zellen und ihrer Abkömmlinge in Hinblick auf eine oder mehrere gleichartige Funktionen. Epithelgewebe: Auskleidung einer äußeren oder inneren Oberfläche. Funktionen: Schutzfunktion (z.B. Epidermis der Haut), Sekretion (Drüsen; endokrine und exokrine; vom Bau her tubulöse, 5 alveoläre und azinöse Drüsen), Resorption (Epithel der Darmzotten), Reizaufnahme (Sinnesepithelien, z.B. Netzhaut des Auges). Unterscheidung der Epithelien nach der Form: Plattenepithel (z.B. Bauchfell), kubisches Epithel (z.B. Sammelrohre der Nieren), Zylinderepithel (z.B. Darmepithel). Unterscheidung der Epithelien nach der Anordnung: Einschichtiges Epithel (z.B. Darmepithel), mehrschichtiges Epithel (z.B. Epidermis = Oberhaut), mehrstufiges Epithel (z.B. Respirationstrakt; alle Zellen sitzen der Basalmembran auf, erreichen aber nicht alle die Oberfläche), Übergangsepithel (z.B. ableitende Harnwege; sehr dehnbar). Bindegewebe: Funktion: Stützfunktion und Stoffwechselfunktion. Bau: Zellen, zwischenzellige Substanz (Interzellulärsubstanz) und Fasern. Formen: Embryonales Bindegewebe, retikuläres Bindegewebe, Bindegewebe des Erwachsenen, Fettgewebe, Knorpel, Knochen. Embryonales Bindegewebe (Mesenchym): Hiervon stammen alle Stützgewebe ab. Mesenchymzellen bilden einen lockeren Zellschwamm, in den Lücken befindet sich flüssige Zwischensubstanz. Zellen können sich aus dem Verband lösen ---> Wanderzellen (Makrophagen). Retikuläres Bindegewebe: Ähnlich dem embryonalen mit Gitterfasern. Kann geformte Stoffe aufnehmen (Phagozytose) und speichern. Grundlage von Lymphknoten, Milz und Knochenmark. Retikuloendotheliales System (RES): Alle Zellen des Körpers, die phagozytieren und speichern. Zum RES gehören die Retikulumzellen des retikulären Bindegewebes und auch die Endothelzellen (Wandzellen) gewisser Kapillaren z.B. Kupffersche Sternzellen der Leber. Funktion: Abwehrtätigkeit (Bildung von Antikörpern). Bindegewebe der Erwachsenen: Anordnung: Locker (z.B. interstitielles Bindegewebe) oder straff (z.B. Sehnengewebe). Bindegewebszellen teils ortsbeständig (Fibrozyten) teils beweglich (Histiozyten). Fasern: Kollagene und elastische Fasern. Funktion: Bindefunktion, Wundheilung. Fettgewebe: Braunes (zahlreiche kleine Fettröpfchen) und gelbes Fettgewebe (ein einziger großer Tropfen Fett). Funktion: Speicherfett (Brennstoffvorrat), Baufett (z.B. Fettpolster an der Ferse), Isolationsfett (Subkutanfett der Haut zum Wärmeschutz). Knorpelgewebe: Knorpelzellen und Knorpelgrundsubstanz mit Bindegewebsfasern. Formen: Hyaliner Knorpel (z.B. Gelenkflächen), elastischer Knorpel (mit elastischen Fasern, z.B. Ohrknorpel), Faserknorpel (mit kollagenen Fasern, z.B. Bandscheiben). Knochen: Knochenbildungszellen (Osteoblasten) scheiden Knochengrundsubstanz ab, Knochenzellen (Osteozyten) sind vollständig von der Grundsubstanz eingeschlossen und Knochenabbauzellen (Osteoklasten) bauen den Knochen ab. Knochengrundsubstanz: 1/3 Ossein (organisch), 2/3 Mineralsalze; enthält zahlreich kollagene Bindegewebsfasern. Röhrenknochen: Schaft (Diaphyse) und Gelenkenden (Epiphysen). Knochenanbauten für Sehnen = Apophysen. Beim Jugendlichen zwischen Epiphysen und Diaphysen die Epiphysenfugen = Zonen des Längenwachstums. Muskelgewebe: Gekennzeichnet durch Kontraktilität, Reizbarkeit und Leitfähigkeit für den gesetzten Reiz. Formen: Glatte Muskulatur (Hohlorgane, Gefäße; Arbeitsweise langsam, wiederkehrend, unwillkürlich und autonom), quergestreifte Skelettmuskulatur (Arbeitsweise rasch, an keinen Rhythmus gebunden, willkürlich beeinflußbar und dem ZNS unterstellt), Herzmuskulatur (Arbeitsweise rasch, wiederkehrend, unwillkürlich und autonom). 6 Nervengewebe: Funktionen: Erregungsleitung (periphere Nerven mit afferenter und efferenter Leitung) und Reizverarbeitung (nervöse Zentren, vor allem ZNS). Baueinheit: Neuron mit Zelle, Dendriten und Neuriten (Axon). Vorkommen: Graue Substanz von Rückenmark und Gehirn. Formen: Unipolare, bipolare und multipolare Zellen. Im Zellkörper Nissl-Schollen und Neurofibrillen. Tumoren: Treten bei jedem 3. Menschen auf, 2/3 der Erkrankten sterben daran. Maligner Tumor = Ansammlung von Krebszellen. Benigne Tumoren wachsen nur begrenzt. Krebs (Carcinom) kann in jeder Art von Körpergewebe vorkommen. Kennzeichen: Ungehemmtes Wachstum, dadurch Verdrängung des gesunden Gewebes und Beanspruchung großer Nährstoffanteile. Mögliche Ursachen: Mutation (Produktionsfehler bei der täglichen Zellherstellung), Chemikalien (z.B. Teer im Tabak), elektromagnetische Strahlen (ultraviolette, Röntgenstrahlen, radioaktive Strahlen), Viren. Krebsbehandlung: Chirurgisches Entfernen vor Metastasenbildung (wichtig die Vorsorgeuntersuchungen) und Wachstumshemmung (Röntgenstrahlen, Zytostatika, Hormone). Menschliche Ontogenese Literatur: Sadler, T.W. (1998). Medizinische Embryologie. Stuttgart: Thieme (begründet von J. Langman). Ontogenese: Keimesentwicklung des Einzelwesens. Phylogenese: Stammesentwicklung der Menschen und Tiere. Gametogenese: Entwicklung der männlichen (Spermatozyte) und weiblichen Geschlechtszellen (Oozyte) aus den Keimzellen. Chromosomen des Menschen: Die normale Körperzelle enthält 46 Chromosomen: 44 Autosomen und 2 Geschlechtschromosomen. Weibliche Geschlechtschromosomen bestehen aus 2 XChromosomen, männliche aus 1 X- und 1 Y-Chromosom. Jedes Autosom besitzt ein Partnerchromosom mit den gleichen morphologischen Merkmalen, sie bilden jeweils ein Paar von Homologen. Obwohl X- und Y-Chromosom nicht identisch sind, spricht man beim Menschen von 23 Chromosomenpaaren = diploider Chromosomensatz. Mitose: Normale Zellteilung. Phasen: (1) Verdoppelung des DNS-Gehalts in der Zelle, (2) Prophase (Chromosomen werden im Lichtmikroskop sichtbar), (3) Prometaphase (Chromosomen kontrahieren sich. Jedes Chromosom besteht infolge der DNS-Verdoppelung aus zwei Chromatiden, die am Zentromer zusammengehalten werden), (4) Metaphase (Chromosomen ordnen sich in der Äquatorialplatte an), (5) Anaphase (Teilung des Zentromers und Auseinanderrücken der Tochterchromosomen), (6) Telophase (Bildung der Tochterzellen, Durchschnürung des Zytoplasmas). Meiose = Reifeteilungen: Phasen: (1) Verdoppelung der DNS wie bei der Mitose, (2) Prophase (Im Unterschied zur Mitose paaren sich in der sog. 1. Reifeteilung die homologen Chromosomen. Da 7 jedes einzelne Chromosom zwei Chromatiden enthält, bestehen die homologen Chromosomenpaare aus 4 Chromatiden. Es erfolgt der Austausch von Chromatidabschnitten zwischen den gepaarten homologen Chromosomen = Crossing over. Dabei findet ein Austausch von Gengruppen zwischen den homologen Chromosomen statt). Phasen (3) - (6) wie bei Mitose. Am Ende der 1. Reifeteilung enthält jede Tochterzelle eine Hälfte von jedem Chromosomenpaar, wobei jedes Chromosom jedoch aus 2 Chromatiden besteht. Der Gesamtgehalt an DNS in jeder Tochterzelle entspricht also noch dem der übrigen Körperzellen. Im Anschluß an die 1. Reifeteilung treten die Zellen sofort in die 2. Reifeteilung ein. Der 2. Reifeteilung geht keine DNS-Synthese voraus. Phasen: Wie bei Mitose ohne (1). Am Ende der 2. Reifeteilung ist der DNS-Gehalt nur noch halb so groß wie in den normalen Körperzellen (haploider Chromosomensatz). Meiose der weiblichen Keimzelle: Es entstehen 4 Tochterzellen mit je 22 Autosomen und 1 XChromosom. Nur eine Tochterzelle entwickelt sich zur Eizelle, die anderen drei (Polkörperchen) erhalten kaum Zytoplasma und degenerieren. Meiose der männlichen Keimzelle: Es entstehen 2 Tochterzellen mit 22 Autosomen + 1 X-Chromosom und 2 Tochterzellen mit 22 Autosomen + 1 Y-Chromosom. Non-disjunction: Störung bei der 1. Reifeteilung. Trennung eines homologen Chromosomenpaares bleibt aus, und beide Glieder wandern in eine Zelle. Dadurch erhält eine Zelle 24, die andere 22 Chromosomen statt - wie normal - 23 Chromosomen. Wenn bei der Befruchtung ein Gamet mit 23 Chromosomen mit einem Gameten verschmilzt, der 24 oder 22 Chromosomen besitzt, entsteht ein Organismus mit 47 Chromosomen (Trisomie) oder mit 45 Chromosomen (Monosomie). Entwicklung der Oozyte: (1) Urkeimzelle (beim Embryo in der 4. Woche bereits sichtbar), (2) Oogonie (entstehen durch Mitose aus den Urkeimzellen), (3) primäre Oozyte (entstehen aus den Oogonien im 3. Monat. Replikation der DNS und Eintreten in die Prophase der 1. Reifeteilung. Primäre Oozyte mit umgebenden Epithelzellen = Primärfollikel), (4) Ruhestadium (Diktyotänstadium bis zu 40 Jahre), (5) Reifung des Primärfollikels mit Einsetzen der Pubertät ---> Entstehung des Graaf-Follikels (besteht aus: Oozyte mit Zona pellucida und Follikelzellen, Follikelhöhle, Theca interna und Theca externa), (6) Fortsetzung der 1. Reifeteilung ---> sekundäre Oozyte, (7) zweite Reifeteilung mit der Ovulation = Follikelsprung. Entwicklung der Spermatozyte: (1) Urkeimzelle, (2) Spermatogonien (entstehen erst mit der Pubertät aus den Urkeimzellen), (3) primäre Spermatozyten (entstehen durch Mitose aus den Spermatogonien. Replikation der DNS und Eintreten in die Prophase der 1. Reifeteilung), (4) erste Reifeteilung nach 16 Tagen beendet ---> sekundäre Spermatozyten, (5) zweite Reifeteilung mit Bildung der Spermatiden (bestehen aus 23 Chromosomen), (6) Entwicklung des Spermatozoons aus der Spermatide (Gesamtentwicklungsdauer von Spermatogonie bis Spermatozoon 90 Tage). Mißgebildete Gameten: Primärfollikel besitzt statt einer primären Oozyte zwei oder drei. Entstehen von Zwillingen oder Drillingen möglich. Beim Mann mißgebildete Spermatozoen häufig. Beeinträchtigung der Fertilität bei mehr als 25 % mißgebildeten Spermatozoen. Hormonelle Steuerung des Ovarialzyclus: Zyklische Veränderungen gehen vom Hypothalamus mit Beginn der Pubertät aus: Releasing-Faktoren des Hypothalamus ---> Sekretion von Gonadotropinen im Hypophysenvorderlappen (FSH = Follikelstimulierendes Hormon, LH = 8 luteinisierendes Hormon) ---> Wachstum des Primärfollikels unter dem Einfluß von FSH in den ersten Tagen des Ovarialzyklus ---> Vermehrung der Follikelzellen, die Progesteron produzieren und Vermehrung der Zellen der Theca interna, die Östrogene produzieren ---> Östrogenanstieg kurz vor der Ovulation ---> Ausschüttung von LH aus der Hypophyse ---> Ovulation ---> Umwandlung der im Ovar verbleibenden Follikelzellen (Granulosazellen) zum Corpus luteum, das Progesteron erzeugt ---> Überführung der Uterusschleimhaut in die Sekretionsphase ---> bei Nichtbefruchtung aufhören der Progesteronbildung im Corpus luteum ---> Periodenblutung. Bei Befruchtung wird Degeneration des Corpus luteum durch gonadotropes Hormon verhindert, das im Trophoblast des Embryos gebildet wird ---> Corpus luteum graviditatis ---> am Ende des 4. Monats Übernahme der Progesteronproduktion durch die Plazenta. Zeitverhältnisse bei der Ovulation: Ovulation 14 Tage ± 1 Tag vor der nächsten Periodenblutung (konstante Phase). Variable Phase, je nach Zyklusdauer, zwischen Ovulation und vorhergehender Menstruation. Hormonale Kontrazeption: Hemmende Wirkung von mit der Pille zugeführtem Östrogen und Progesteron auf Hypophyse und Hypothalamus. Dadurch wird die zur Ovulationsauslösung notwendige LH-Ausschüttung unterdrückt; Ruhigstellung des Ovars. Entzugsblutung bei Pilleneinnahme nur menstruationsähnlich. Befruchtung: Verschmelzung des männlichen (Spermatozoon) und weiblichen Gameten (Oozyte) im Eileiter. Spermien machen vor Befruchtung Kapazitation im weiblichen Genitaltrakt durch (Entfernung von Hemmfaktoren, die auf der Oberfläche der Spermien sitzen), anschließend erfolgt Akrosomreaktion (dient zur Auflösung der die Oozyte umgebenden Corona radiata). Bei Berührung der Membran der Eizelle durch den Kopf des Spermiums entsteht Reaktion der Zona pellucida, die das Eindringen weiterer Spermien verhindert. Bildung des männlichen und weiblichen Vorkernes, Reduplikation der DNS in jedem Vorkern, Verschmelzung der Vorkerne, Bildung der 2-zelligen Zygote. Furchungsteilungen: Die zweizellige Zygote durchläuft eine Reihe von Mitosen, wodurch die Zellzahl rasch ansteigt. Diese Zellen nennt man Blastomeren. Es entsteht die Morula mit innerer Zellschicht (Gewebe für den Embryo) und äußerer Zellschicht (Trophoblastzellen, die später die Plazenta entwickeln). Nach 60 Stunden ist die Morula im Uterus. Entwicklung der Blastozyste: Interzellularräume der Morula fließen zusammen und bilden die Blastozystenhöhle. Die Zygote heißt jetzt Blastozyste mit Embryoblast (innere Zellschicht) und Trophoblast (äußere Zellschicht). Trophoblastzellen beginnen am 6. Tag in die Uterusschleimhaut einzudringen. Veränderungen der Uterusschleimhaut: Uteruswand aus 3 Schichten gebildet: Endometrium (innere Schleimhautauskleidung), Myometrium (dicke Schicht aus glatter Muskulatur) und Perimetrium (Peritonealüberzug = Bauchfellüberzug auf der Außenfläche). Bei der Implantation der Blastozyste befindet sich Schleimhaut in der Sekretionsphase, die durch das Progesteron des Corpus luteum hervorgerufen wird. Schleimhaut ist aus 3 Schichten aufgebaut: Oberflächliche Zona compacta, lockere Zwischenschicht = Zona spongiosa und Zona basalis. Bei Nichtbefruchtung erfolgt die Abstoßung von Kompakta und Spongiosa im Rahmen der Menstruation. Ausfluß besteht aus Blut, Epithelzellen und Zerfallsprodukten von abgestorbenen Zellen. Die Basalis stellt die Regenerationsschicht dar, aus der die Drüsen und Arterien in der Proliferationsphase wieder aufgebaut werden. 9 Abweichende Implantationsorte: Normalerweise hintere oder vordere Wand des Uterus. Bei Einnistung im Bereich des Muttermundes schwere Blutungen in der 2. Hälfte der Schwangerschaft und bei der Geburt (Plazenta praevia). Ektopische Schwangerschaften (extrauterine Gravidität) in Bauchhöhle, Ovar oder Eileiter. Bei Tubargravidität platzt der Eileiter im 2. Schwangerschaftsmonat mit starker innerer Blutung. Entwicklung zur zweiblättrigen Keimscheibe: Der Trophoblast entwickelt zwei Schichten: Synzytiotrophoblast und Zytotrophoblast. Aus dem Embryoblast entwickeln sich das Ektoderm und Entoderm, die beiden Schichten der zweiblättrigen Keimscheibe. Zwischen Ektoderm und Zytotrophoblast entsteht die Amnionhöhle. Im Synzytiotrophoblast entstehen Hohlräume (Lakunen), die schließlich mit den mütterlichen Sinusoiden (gestaute Kapillaren) in Verbindung treten; es entsteht der utero-plazentare Kreislauf. Die Blastozystenhöhle wird zum primären Dottersack. Aus dem Zytotrophoblast entstehen mesenchymale Zellen (Bindegewebszellen, Mesoderm). In diesem Mesoderm bildet sich die Chorionhöhle bzw. das extraembryonale Zölom. Schließlich ist die zweiblättrige Keimscheibe mit ihrer Amnionhöhle und ihrem Dottersack ganz von der Chorionhöhle umgeben und hat nur noch über den Haftstiel - der späteren Nabelschnur - Verbindung mit dem Trophoblast. Im Verlauf der 3. Entwicklungswoche entsteht die dreiblättrige Keimscheibe, wobei Zellen des Mesoderms zwischen die Zellen des Ektoderms und Entoderms einwandern. Embryonalperiode: Zeitraum zwischen der 4. und 8. Entwicklungswoche. Entwicklung der Organanlagen (Organogenese). Die meisten angeborenen Mißbildungen entstehen in dieser kritischen Entwicklungsperiode. Abkömmlinge des Ektoderm: ZNS, peripheres Nervensystem, Sinnesepithelien, Epidermis einschließlich Haare und Nägel, subkutane Drüsen. Abkömmlinge des Mesoderm: Bindegewebe, Knorpel und Knochen; quergestreifte und glatte Muskulatur; Wandungen des Herzens und der Gefäße; Zellen des Blutes und der Lymphe; Niere und Keimdrüsen; Milz; Rinde der Nebenniere. Abkömmlinge des Entoderm: Magen-Darm-Kanal; epitheliale Auskleidung des Respirationstraktes; Parenchym der Tonsillen, Schilddrüse, Leber und Pankreas; epitheliale Auskleidung der Harnblase und Harnröhre. Fetalperiode: Zeitraum vom Beginn des 3. Monats bis zur Geburt. Schnelles Wachstum des Körpers bei relativer Verlangsamung des Kopfwachstums. Am Ende des 3. Monats lassen sich bei abortierten Feten bereits Reflexe auslösen. Im 5. Monat werden Kindsbewegungen von der Mutter deutlich wahrgenommen. Mit 28 Wochen ist der Fetus im Prinzip lebensfähig (Frühgeburt). Normales Geburtsgewicht 3000 - 3500 g, Scheitel-Fersen-Länge 50 cm. Berechnung des Geburtstermins: Gerechnet vom ersten Tag der letzten Regel beträgt die Schwangerschaftsdauer 280 Tage = 40 Wochen = 10 Lunarmonate = 9 Kalendermonate. Die Berechnung des Geburtstermins ist am genauesten, wenn man vom Tag der Befruchtung ausgeht und 266 Tage oder 38 Wochen hinzurechnet. Funktionen der Plazenta: Austausch von Stoffwechselprodukten und Gasen zwischen mütterlichem und fetalem Blut bei vollständiger Trennung der beiden Kreislaufsysteme (Plazentaschranke); Hormonbildung (Choriongonadotropin, Progesteron, Östrogene); Übertragung von Antikörpern (passive Immunisierung des Kindes). Die Plazentaschranke kann durch Viren (Röteln, Pocken etc.) und Medikamente (z.B. Thalidomid = Contergan, Drogen und Psychopharmaka) überwunden werden, was zu Mißbildungen führt. 10 Zwillinge: Zwillingshäufigkeit zwischen 0,7 - 1,5 % aller Geburten, 70 % sind zweieiige und 30 % eineiige = identische Zwillinge. Eineiige Zwillinge entwickeln sich beide aus einer einzigen befruchteten Eizelle, wobei sich die Zygote im Laufe der Entwicklung durchschnürt. Bei zweieiigen Zwillingen werden zwei Oozyten gleichzeitig ausgestoßen und von zwei verschiedenen Spermatozoen befruchtet (genetisch keine größere Ähnlichkeit als bei üblichen Geschwistern). Angeborene Mißbildungen: Auffallende morphologische Defekte, die zum Zeitpunkt der Geburt vorliegen bei ca. 2 - 3 % aller lebend Geborenen. Ursachen: 10 % Umweltfaktoren, 10 % genetische und chromosomale Faktoren, 80 % Wechselwirkung zwischen genetischen Faktoren und Umwelt. Beispiele für Ursachen: Röteln bei Frauen in der Frühschwangerschaft (Linsentrübungen des Auges, angeborene Taubheit, Mißbildungen des Herzens und der Zähne; Gegenmaßnahme: Aktive Immunisierung der Frauen), Röntgen- oder Radiumstrahlen (Schädelmißbildungen, Blindheit, Gaumenspalten, Mißbildung der Extremitäten, Spina bifida. Eine Dosis, die noch als ungefährlich angesehen werden kann, ist nicht bekannt!), Arzneimittel (Thalidomid = Contergan ---> völliges oder partielles Fehlen der Extremitäten; Zytostatika; Chinin; Antiepileptika; Cortison), Genußmittel (durch Rauchen Minderdurchblutung der Plazenta ---> niedriges Geburtsgewicht. Alkohol ---> geistiger und körperlicher Rückstand der Kinder, Fehlbildungen), Krankheiten der Mutter (bei Diabetes überdurchschnittlich große Kinder mit erhöhter Mißbildungsrate), Hypoxie (= Sauerstoffmangel, große Höhen, Frauen mit Herzkrankheiten). Mongolismus: Trisomie 21 (Down-Syndrom). Bei Müttern bis zu 25 Jahren Häufigkeit 1 : 2000, bei Müttern über 40 Jahre 1 : 100. Non-disjunction während der Oogenese. Breites Gesicht, große Zunge, Mongolenfalte, Affenhand, Schwachsinn, Herzmißbildungen. Trisomie 18: Symptome: Schwachsinn, angeborene Herzfehler, Abknickung der Finger und Hände. Häufigkeit 0,3 : 1000. Kinder sterben meist mit 2 Monaten. Klinefelter-Syndrom: Nur bei Männern, Häufigkeit 1 : 500. Geschlechtschromosomenkombination vom Typus XXY. In 80 % der Fälle ist ein Geschlechtschromatin-Körperchen nachweisbar. Symptome: Sterilität, Hodenatrophie, Gynäkomastie. Turner-Syndrom: Nur bei Frauen, Häufigkeit 1 : 4000. Chromosomensatz 45,XO. Non-disjunction beim männlichen Gameten. Symptome: Flügelhaut, Lymphödem der Extremitäten, Mißbildungen des Skelettsystems, Sterilität. Rh-Inkompatibilität: Erythrozyten des Fetus tragen das Rh-Antigen (Rh-positiv) und die der Mutter nicht (Rh-negativ). Kleine Blutungen an der Oberfläche der Zotten in der Plazenta erzeugen Antikörperbildung bei der Mutter. Antikörper gelangen über die Plazenta in den Fetus und lösen Hämolyse = Blutzerfall aus. Fruchttod, besonders bei der zweiten Schwangerschaft möglich. 11 Grundlagen der Humangenetik und Erbpsychologie Literatur: Merz, F. & Stelzl, I. (1977). Einführung in die Erbpsychologie. Stuttgart: Kohlhammer). Schilcher, F. von (1988). Vererbung des Verhaltens. Stuttgart: Thieme. Abbildungen z.T. aus Kühn, A. (1973). Grundriß der Vererbungslehre. Heidelberg: Quelle & Meyer. Mendel's Methode (1866): Versuchsmaterial verschiedene Erbsensorten (Selbst- und Fremdbefruchtung kann hier leicht kontrolliert werden). Wahrscheinlichkeitstheoretische Modellvorstellung: Empirisch gefundene Zahlenverhältnisse werden auf theoretisch angenommene Elementarfaktoren = Erbfaktoren = Gene zurückgeführt. Gesamtheit der Gene, welche ein Individuum in seinem Erbgut enthält, nennt man seinen Genotypus. Mendel hat den Erbgang von Einzelmerkmalen in aufeinanderfolgenden Generationen verfolgt. Ausgangsrassen = P-Generation (Parental-Generation), Nachkommen = 1. Bastardgeneration = F1-Generation (1. Filial-Generation), Nachkommen der F1-Generation = F2-Generation etc. Rückkreuzung = Kreuzung der F1-Generation mit einer der Ausgangsrassen (R). Monohybriden = Bastarde einer Kreuzung von zwei Rassen, die sich nur in einem Merkmalspaar voneinander unterscheiden (z.B. rot- und weißblühende Rasse einer Pflanze). Di-, Tri- oder Polyhybriden unterscheiden sich in zwei, drei oder vielen Merkmalspaaren. Uniformitäts- oder Reziprozitätsgesetz: Die F1-Bastarde sind gleich (uniform), was bedeutet, daß die männlichen und die weiblichen Gameten für die Übertragung der Mendel'schen Erbfaktoren gleichwertig sind (Reziprozität). Spaltungsgesetz: Die F2-Individuen sind unter sich nicht alle gleich, sondern es spalten verschiedene Phänotypen heraus. Bei intermediärer Merkmalsausbildung (F1-Bastard steht zwischen der PGeneration) erscheint jeder der gegensätzlichen Merkmale der P-Rassen in 1/4 der Fälle neben 2/4 intermediärer Individuen. Bei Dominanz eines Merkmals in F1 spalten in F2 3/4 mit dem dominanten Merkmal und 1/4 mit dem rezessiven Merkmal heraus. Ein Bastard erhält für ein bestimmtes Merkmal (z.B. Blütenfarbe) vom Vater und von der Mutter je eine Erbanlage, ein Gen. Bei der Keimzellenbildung wird dieses Genpaar getrennt, und jede Keimzelle erhält entweder das eine Gen A, oder das andere a. Ein Gamet hat in Bezug auf ein Genpaar nie Bastardnatur (Gesetz der Reinheit der Gameten). Man bezeichnet die einander entsprechenden Gene eines Paares als Allele. Wenn Individuen in dem einen Merkmal zugeordneten Genpaar gleiche Allele besitzen (AA oder aa), nennt man sie reinerbig = homozygot, wenn sie in dem Genpaar verschiedene Allele besitzen (Aa), mischerbig = heterozygot in Bezug auf dieses Merkmal. Gesetz der Neukombination der Gene: Bei Kreuzungen von Rassen, die sich in mehr als einem Merkmal voneinander unterscheiden, werden die Allele verschiedener Paare unabhängig voneinander verteilt (Gesetz der Neukombination oder Unabhängigkeitsgesetz). Hierdurch wird bewiesen, daß die Erbveranlagung, die von einem Elter dem Bastard zugeführt wird, nicht ein unteilbares Ganzes ist, sondern voneinander trennbare Einzelerbfaktoren (Gene) enthält. Modifikationen: Abweichungen des Phänotyps aufgrund verschiedener Umweltbedingungen bei gleichem Genotyp (z.B. Abhängigkeit des Farbmusters bestimmter Blüten von der Außentemperatur, die in einem bestimmten Entwicklungsstadium herrscht). Die phänotypischen Modifikationen bleiben ohne Einfluß auf den Genotyp. Vererbt wird also nicht das Merkmal, 12 sondern die Reaktionsweise einer bestimmten genetischen Konstitution auf bestimmte Umweltbedingungen. Phänokopie: Durch Umweltmodifikationen können Merkmale auftreten, welche bei einem anderen Genotyp genetisch fixiert sind. Reaktionsnorm: Genotyp und Phänotyp stimmen oft nicht überein, sind jedoch gesetzmäßig aufeinander bezogen. Die Gesetzmäßigkeit, welche angibt, welcher Phänotypus unter bestimmten Umweltbedingungen dem vorliegenden Genotypus entspricht, nennt man Reaktionsnorm (Beispiel: Rattenversuch von Tryon). Genkoppelung: Da bei der Meiose die Aufteilung der homologen Chromosomen auf die Gameten zufällig erfolgt, werden alle Merkmale, die auf verschiedenen Chromosomen lokalisiert sind, unabhängig voneinander vererbt (Gesetz der Neukombination). Gene, die auf demselben Chromosom vererbt werden, werden nur dann getrennt, wenn es auf dem Chromosomenabschnitt zwischen den beiden Genloci zu einem crossing-over kommt. Das wird um so seltener der Fall sein, je enger die beiden Genloci nebeneinander liegen (= Genkoppelung). Im Laufe von Generationen ist jedoch zu erwarten, daß auch zwischen eng benachbarten Genloci gelegentlich ein crossing-over stattfindet, daß also die beiden Gene in der genannten Population frei kombiniert werden. Pleiotropie (synonym Polyphänie): Ein Gen wirkt sich zugleich auf mehrere Merkmale aus (genetisch bedingte Korrelation von Merkmalen). Polygenie: Abhängigkeit eines Merkmals von vielen Genen. Selektive Partnerwahl: Homogamie = es bevorzugen sich phänotypisch ähnliche Partner, Heterogamie = es bevorzugen sich phänotypisch unähnliche Partner. Führt zu positiven bzw. negativen Merkmalskorrelationen. Geschlechtsgebundener Erbgang: Merkmale, die auf ein Gen auf dem X-Chromosom zurückgehen, können vom Vater nur an die Tochter, nicht aber an den Sohn, weitergegeben werden (z.B. Leistung beim räumlichen Vorstellen; Ähnlichkeit zwischen Vater und Tochter sowie Mutter und Kindern hoch, zwischen Vater und Sohn gering). Erbpsychologie (Verhaltensgenetik): Anwendung der Erblehre auf Verhaltensmerkmale. Forschungsgebiet zwischen Genetik und Psychologie (angloamerikanisch: Behavioral genetics oder behavior genetics). Selektion: Methode zur Feststellung, ob ein Merkmal eine genetische Komponente enthält. Dabei werden über eine Reihe von Generationen hinweg Tiere gezüchtet, welche das Merkmal besonders ausgeprägt oder besonders schwach zeigen. Unterscheiden sich die beiden gezüchteten Stämme überzufällig, so muß es in der Ausgangspopulation Tiere mit unterschiedlicher genetischer Ausstattung gegeben haben. Inzucht: Methode zur Erforschung des Erbgangs eines Merkmals. Hierzu benötigt man für die Kreuzungsexperimente genetisch gleiche Individuen, die man durch Inzucht, etwa über 30 Generationen, erzeugt. Ein Tier, dessen Eltern hochgradig verwandt sind, erhält von den Eltern dieselbe genetische Information, ist also hinsichtlich aller Merkmale homozygot. Der Grad der Inzucht, der in einer Inzuchtreihe bereits realisiert ist, läßt sich durch Inzuchtkoeffizienten 13 ausdrücken. Er gibt an, mit welcher Wahrscheinlichkeit die beiden Gene eines jeden Genlocus herkunftsgleich sind. Untersuchung von Mutanten: Mutationen führen oft zu sehr auffälligen Änderungen an den Versuchstieren (z.B. Albinismus). Die Weitergabe solcher auffälligen Merkmale läßt sich leicht über die Generationen verfolgen. An ihnen lassen sich pleiotrope Genwirkungen demonstrieren. Da in einem ingezüchteten Stamm alle Gene außer dem mutierten in beiden Linien gleich sind, können alle Unterschiede zwischen ihnen als Wirkungen des mutierten Gens interpretiert werden. Stammbaumanalyse: Man versucht den Erbgang zu bestimmen, indem man darüber einfache Hypothesen bildet, z.B. daß das Merkmal nur von einem Gen abhängt und dominant ist, und dann prüft, ob das Merkmal in den Familienstammbäumen in einer Weise weitergegeben wird, welche den Hypothesen nicht widerspricht. Besondere Stammbaummuster treten auf, wenn ein geschlechtsgebundener Erbgang, also Vererbung auf dem X-Chromosom, besteht. Bei rezessivem geschlechtsgebundenem Erbgang eines Defektes (z.B. Farbenblindheit) kann es scheinbar zu einer Vererbung vom Großvater auf den Enkel kommen: Großvater hat krankes X, Tochter erhält ein gesundes X hinzu, ist dadurch phänotypisch unauffällig; Söhne werden zur Hälfte Merkmalsträger, weil sie von der Mutter das kranke X erhalten haben, vom Vater nur das Y, welches keinen Ausgleich für das kranke Gen liefert, da ihm die homologen Gene fehlen. Die Hypothese eines dominanten geschlechtsgebundenen Erbgangs ist zu verwerfen, wenn ein kranker Vater eine gesunde Tochter hat, oder wenn die gesunde Mutter einen kranken Sohn hat. Quantitative Merkmale: Da nach der genetischen Theorie für jedes Gen nur zwei Allele existieren, scheint eine kontinuierliche Variation (z.B. Körpergröße, Persönlichkeitsmerkmale) unerklärlich zu sein. Die Schwierigkeit läßt sich jedoch beseitigen, wenn man annimmt, daß sehr viele Gene zusammenwirken und so den Ausprägungsgrad eines Merkmals bestimmen können. Schon bei einem einfachen intermediären Mendel'schen Erbgang mit den 3 möglichen Genotypen AA, Aa und aa können drei Grade der Merkmalsausprägung unterschieden werden. Hängt ein Merkmal von sehr vielen Genen ab, so sind auch sehr viele verschiedene Genotypen möglich. Genetisches Gleichgewicht: Gleichbleiben der Häufigkeit für die verschiedenen Genotypen über die Generationen hinweg. Kann durch Homo- oder Heterogamie vorübergehend gestört werden. Bei Zufallspaarung (Panmixie) ist das genetische Gleichgewicht bereits in der 2. Generation erreicht (Hardy-Weinberg-Gesetz). Grad der Erblichkeit (engl. heritability, auch Heritabilität): Relativer Anteil der genetischen Varianz an der Gesamtvarianz eines Merkmals. Erbe-Umwelt-Kovarianz: Individuen verteilen sich auf die verschiedenen Umwelten nicht unabhängig von ihren Genotypen. Erbe-Umwelt-Wechselwirkung: Auf die Umweltunterschiede reagieren die verschiedenen Genotypen unterschiedlich (unterschiedliche Reaktionsnormen). Erbbedingte und umweltbedingte Varianz: Die Aufspaltung der Gesamtvarianz in diese beiden Varianzanteile ist dann nicht hinreichend, wenn Erbe-Umwelt-Kovarianzen und/oder ErbeUmwelt-Wechselwirkungen vorliegen. Erblichkeitsmaße: Versuchen, den genetischen Anteil an der Merkmalsvarianz anzugeben. Beruhen auf Intraclass-Koeffizienten, welche die Korrelationen zwischen Zwillingen (EZ und 14 gleichgeschlechtige ZZ) angeben: r = 1 - Var(in)/ Var (x), wobei Var(in) die Varianz innerhalb der Zwillingspaare, Var(x) die Gesamtvarianz bedeutet. Index von Holzinger: H =(rEZ - rZZ)/ (1 - rZZ). Zwillingsmethode: Grundannahme: Jeder Unterschied zwischen genetisch identischen Paaren (EZ) muß von Umwelteinflüssen herrühren, während Unterschiede bei ZZ sowohl von genetischen als auch Umwelteinflüssen bedingt sein müssen. Einwände gegen diese Grundannahme: (1) Eiigkeitsbestimmungen: Kein Problem, da sehr genau. Falsche Diagnose erniedrigt relativen Anteil erbbedingter Varianz. (2) Genetische Identität der EZ: Gewichtiger Einwand. EZ sind möglicherweise nicht ganz identisch (zytoplasmatische Differenzen, Genmutation oder chromosomale Aberration bei der Mitose). Häufig verschiedene intrauterine Verhältnisse (unterschiedliche Blutversorgung, dadurch verschiedenes Geburtsgewicht). Diese Einflüsse vermindern den relativen Anteil erbbedingter Varianz. (3) Einflüsse von Umweltvariablen: Einerseits wird vermutet, daß gerade die genetische Ähnlichkeit von EZ mit der Zeit zu einer Betonung jeglicher Unterschiede zwischen ihnen führe, andererseits werden EZ im Unterschied zu ZZ von der Umwelt ähnlicher behandelt. Ähnliche Behandlung würde zu einer Verstärkung des relativen Anteils erbbedingter Varianz führen. (4) Generalisierungsprobleme: Üblicherweise wird von Ergebnissen der Zwillingsforschung auf die Gesamtpopulation generalisiert. Jedoch ist nicht sichergestellt, ob die Zwillinge repräsentativ sind. Erblichkeit der Intelligenz: Hängt davon ab, welche Population man in Betracht zieht. Erblichkeit muß groß sein, wenn eine genetisch uneinheitliche Population unter weitgehend übereinstimmenden Umweltbedingungen betrachtet wird; sie muß gering sein, wenn die Population genetisch einheitlich ist oder die Umweltbedingungen für die einzelnen Individuen stark verschieden sind. Aus der Literatur (Newman, Shields, Juel-Nielsen, Burt) ergibt sich eine Schätzung der Erblichkeit der Intelligenzleistungen von 80 %. Meßfehler, Umweltbedingungen und ErbeUmwelt-Wechselwirkungen, wenn man von der Kovarianz absieht, müssen auf die restlichen 20 % aufgeteilt werden. Kritik: Datenfälschungen bei Burt; Zwillinge nicht ganz repräsentativ; Korrelationen, welche bei nichtverwandten Adoptivkindern gefunden wurden, die in der gleichen Familie aufgewachsen sind, sind höher als erwartet (Koeffizienten müßten deutlich unter .20 liegen, tatsächlich .20 .30). Untersuchungen über familiäre Ähnlichkeiten zeigen, daß eine Erblichkeit von 80 % sicher zu hoch gegriffen ist. Vermutlich ist eine Erblichkeit von 50 % realistisch. Erblichkeit morphologischer Merkmale: Körpergröße H = .76 - .93, Körpergewicht H = .38 - .77 (H = Index nach Holzinger = relativer Anteil der Erblichkeit in %, also Körpergröße je nach Untersuchung zu 76 - 93 % erblich bedingt). Erblichkeit physiologischer Merkmale: Deutlich geringer als bei den morphologischen Merkmalen. Systolischer Blutdruck .00 - .56, EEG .76 - .83. Erblichkeit von Persönlichkeitsmerkmalen: Neurotizismus: Eysenck und Prell .81, Young .46; Extraversion (Young) .43; Angst (Gottesman, MMPI) .43. 15 Grundlagen der Verhaltensbiologie Literatur: Franck, D. (1985). Verhaltensbiologie. Stuttgart: Thieme. Abbildungen z.T. aus EiblEibesfeldt, I. (1967). Grundriß der vergleichenden Verhaltensforschung - Ethologie. München: Piper. Verhaltensbiologie: Erforscht tierisches und weiterführend menschliches Verhalten mit biologischen Methoden, auch vergleichende Verhaltensforschung oder Ethologie genannt. Fragestellungen: Physiologische Verursachung, Ontogenese und Evolution des Verhaltens. Verhaltensphysiologie: Fragt nach verursachenden, steuernden und regelnden Mechanismen, die dem Verhalten der Tiere zugrunde liegen. Ethogramm: Qualitative und quantitative Beschreibung der Verhaltensweisen einer Art. Erbkoordination: Formstarre, leicht wiedererkennbare, artspezifische Verhaltensweise, die bei jedem einzelnen Individuum der Art in gleicher Form auslösbar ist. Dies ist für die Ethologie die wichtigste Verhaltenseinheit. Der koordinierte Ablauf der Muskelkontraktionen ist genetisch vorprogrammiert, dadurch extreme Umweltstabilität. Taxiskomponente: Eine im Raum gerichtete Bewegungskomponente, die meist die Erbkoordination überlagert (Beispiel Beutefang des Frosches: Zunächst orientierende Wendung = Taxiskomponente, dann Erbkoordination = eigentliche Beutefanghandlung). Erbkoordination und Taxis zusammen werden häufig als Instinkthandlung bezeichnet. Funktionskreise: Hierzu zählen funktionell zusammengehörige Verhaltensweisen wie Aggressions-, Fortpflanzungs-, Brutpflege- oder Nahrungserwerbshandlungen. Dabei folgen die verschiedenen Erbkoordinationen gesetzmäßig aufeinander. Am Ende solcher Verhaltensfolgen stehen meist Endhandlungen, die das zu dem betreffenden Funktionskreis gehörige Verhalten zu einem vorläufigen Abschluß bringen (z.B. Begattung, Nahrungsaufnahme). Variabilität von Verhaltensfolgen: Bedingt durch Stärke des Auslösereizes und der Handlungsbereitschaft = Motivation. Letztere kann bei konstanten Umweltbedingungen aus der Intensität des Bewegungsablaufes, der Häufigkeit und Dauer der Einzelhandlungen und aus der Latenzzeit (Zeitspanne zwischen dem Beginn der Reizeinwirkung und dem Verhaltensbeginn) erschlossen werden. Doppelte Reaktionskette: Z.B. bei Balzhandlungen. Eine männliche Balzhandlung löst eine Antwort des Weibchens aus, diese wiederum eine des Männchens etc. Energetisches Motivationsmodell: Danach verbrauchen Erbkoordinationen aktionsspezifische Energie. Werden sie längere Zeit nicht ausgelöst, so kommt es zu einer Akkumulation endogen im ZNS produzierter aktionsspezifischer Energie (Triebstauung). Je mehr aktionsspezifische Energie vorhanden ist, um so schwächer können die Auslösereize sein. Im Extremfall können die Auslösereize überflüssig werden (Leerlaufhandlung). Übersprungshandlung: Irrelevante oder deplazierte Verhaltensweisen in einer Konfliktsituation (z.B. unterbrechen Hähne den Kampf und zeigen unvollkommene Pickbewegungen, obwohl keine Nahrung vorhanden ist). Zur Erklärung zwei Hypothesen: (1) Überflußhypothese: Entgegengesetzte Erregungen (Kampf und Flucht) können in der Konfliktsituation nicht abfließen. Entsprechend dem energetischen Triebmodell werden die 16 Erregungen gestaut, fließen über und speisen über eine dritte Bahn die Übersprungsaktivität, die somit fremdbestimmt = allochthon motiviert ist. (2) Enthemmungshypothese: Sie geht von der Beobachtung aus, daß solche Aktivitäten besonders häufig im Übersprung auftreten, die von anderen dominierenden Motivationen sehr leicht gehemmt werden, z.B. Handlungen wie Putzen, Schnabelwetzen etc. Von den beiden am Konflikt beteiligten Motivationen werden solche Aktivitäten normalerweise getrennt unter Hemmung gesetzt. Erreichen diese ein Gleichgewicht, so hemmen sie sich gegenseitig, und ihre hemmenden Einflüsse auf die Übersprungsaktivität werden aufgehoben. Somit wäre für die Übersprungsaktivität eine eigenbestimmte = autochthone Motivation anzunehmen. Umadressiertes Verhalten: Wird ein Tier daran gehindert, z.B. eine aggressive Handlungsbereitschaft abzureagieren, so kann das Aggressionsverhalten gegen ein unbeteiligtes Tier oder auch gegen leblose Gegenstände gerichtet werden. Attrappenversuch: Auslösen von Verhaltensweisen durch Attrappen. Durch Modifikation der Attrappen kann die auslösende Wirksamkeit einzelner Reize bestimmt werden. Dabei wirken die einzelnen Auslösereize einer Attrappe häufig additiv zusammen (Reizsummenphänomen). Übertreiben von Einzelreizen (supernormale Reize) lösen das Verhalten stärker aus als die natürlichen auslösenden Objekte. Angeborener Auslösemechanismus (AAM): Bestimmten Verhaltensweisen zugeordnete neurosensorische Filtermechanismen, die das Ansprechen auf die Auslösereize bestimmen, indem sie alle unwirksamen Reize herausfiltern. Die Auslösereize werden auch als Schlüsselreize bezeichnet, weil sie allein zu dem Auslösemechanismus passen. Von angeborenen Auslösemechanismen spricht man, wenn ein Tier unabhängig von Lernerfahrung auf einen Auslösereiz biologisch sinnvoll reagiert (stammesgeschichtliche Anpassung). Die Auslösemechanismen erwachsener Wirbeltiere sind i.a. komplexer als die AAM. Das Tier lernt im Laufe der Verhaltensontogenese in die AAM hinein (durch Erfahrung modifizierte angeborene Auslösemechanismen EAAM). Angeborenes Verhalten: Verhaltensweisen, deren Anpassung an die Umwelt stammesgeschichtlichen Ursprungs ist (Erbanlagen werden durch natürliche Selektion an die artgemäße Umwelt angepaßt, Artgedächtnis); z.B. können Entenküken sofort schwimmen, sobald sie erstmals mit dem Wasser in Berührung kommen. Erfahrungsentzugsexperiment: Dem Tier wird während der Verhaltensontogenese gezielt diejenige Erfahrungsmöglichkeit entzogen, die eine Anpassung aufgrund von Lernen ermöglichen würde. So wird im Kaspar-Hauser-Experiment die soziale Erfahrung entzogen, indem das Tier sozial isoliert aufgezogen wird. Letzteres führt bei Säugetieren zu tiefgreifenden Störungen des gesamten Verhaltens. Reifen angeborener Verhaltensweisen: Die von Lernvorgängen unabhängige Ontogenese stammesgeschichtlicher Anpassungen des Verhaltens wird als Reifen bezeichnet. Werden Jungtauben in Tonröhren aufgezogen, in denen sie nicht flattern können, so fliegen sie später trotzdem genauso gut wie normal aufgezogene Tiere. Tauben lernen also nicht das Fliegen, sondern das Flugvermögen reift allmählich heran. Angeborene Lerndispositionen: Die Lernfähigkeit einer Art ist ein Ergebnis stammesgeschichtlicher Anpassung. Z.B. lernen Mäuse und Ratten schnell, sich in einem Labyrinth zurechtzufinden, im 17 Gegensatz zu Tieren, die unter natürlichen Bedingungen nicht in Gangsystemen leben. Hier erfolgt das Lernen auf der Grundlage einer angeborenen Lerndisposition. Prägung: Lernprozesse, die an sensible Phasen der Verhaltensontogenese gebunden sind und zu lange anhaltenden, oft irreversiblen Veränderungen des Verhaltens führen. Prägungsprozessen liegen also zeitlich begrenzte Lerndispositionen zugrunde. Beispiele: Nachfolgeprägung (bei Graugänsen wird die Nachfolgereaktion in einem kritischen Alter auf ein bewegtes Objekt fixiert, z.B. den Menschen, das zu dieser Zeit gerade verfügbar ist = Objektfixierung), sexuelle Prägung (Objektfixierung für das sexuelle Verhalten), prägungsähnliche Objektfixierungen (z.B. Aufbau der sozialen Bindung zwischen Mutter und Kind etwa bei Huftieren). Hospitalismus: Weist beim Menschen deutliche Parallelen zu Prägungsvorgängen auf. Hospitalismusschäden (Bewegungsstereotypien, verminderte Aktivität, Rückstände der Intelligenz- und Sprachentwicklung, Störung des sozialen Kontakts) entstehen beim Menschen in einer sensiblen Phase, die mit 3 Monaten beginnt und nach 2 - 3 Jahren abgeschlossen ist. Zu diesen Schäden kommt es, wenn die Kinder ohne feste Bezugsperson aufwachsen (Säuglingsheime). Habituation (Gewöhnung): Abnahme der Handlungsbereitschaft durch wiederholtes Auslösen einer Verhaltensweise durch den gleichen Reiz. Gewöhnung an einen Auslösereiz kann man als einfachsten Lernvorgang auffassen. Beispiel: Stare gewöhnen sich in Kirschplantagen an alle möglichen Abwehrmaßnahmen. Klassische Konditionierung: Bildung einer Assoziation zwischen dem unbedingten Reiz und dem bedingten Reiz (siehe SS). Operante Konditionierung: Auch als instrumentelle Konditionierung bezeichnet (siehe SS). Höhere Lernleistungen: Lernen durch Nachahmung (Imitation) ist nur von Vögeln (Lernen des Gesangs) und Säugetieren bekannt und setzt offenbar eine beträchtliche Leistungsfähigkeit des Gehirns voraus. Junge Schimpansen können z.B. Teile der Zeichensprache für Taubstumme lernen. Auch zeigen sich bei den Primaten Ansätze zu einem Verhalten durch Einsicht (Versuche von W. Köhler an Affen). Evolution: Genetischer Anpassungsprozeß über Generationen hinweg, bedingt durch die Faktoren Mutation und Selektion. Grundlage zur Erforschung der Evolution von Verhaltensweisen bildet der Artenvergleich, der mit der Beschreibung der Erbkoordinationen möglich wurde. Künstliche Selektion: Besonders gut bei Arten mit rascher Generationsfolge durchführbar (z.B. Drosophila = Taufliege, Ratte). Verhaltensänderungen bei Haustieren, sind ebenfalls durch künstliche Selektion bedingt. Homologe Verhaltensweisen: Lassen sich auf einen gemeinsamen stammesgeschichtlichen Ursprung zurückführen (Abstammungsähnlichkeit). Analoge Verhaltensweisen: Ähnliche Verhaltensweisen, die sich auf der Grundlage gleichgerichteter Selektionsdrucke, jedoch stammesgeschichtlich voneinander unabhängig, entwickeln (Anpassungsähnlichkeit). Sozialstrukturen im Tierreich: (1) Tieransammlungen (Aggregationen): Werden nicht durch soziale Attraktion, sondern durch äußere Faktoren wie Nahrung, Feuchtigkeit etc. zusammengeführt; keine echten 18 Tiergesellschaften. (2) Anonyme Verbände: Werden bereits durch soziale Attraktion zusammengehalten. Es handelt sich um offene Verbände, d.h. fremde Tiere können sich anschließen. Stets wird eine Individualdistanz eingehalten. Beispiel für anonymen Verband: Fischschwärme. (3) Individualisierte Verbände: Tiere kennen sich persönlich, Aggressivität ist durch Rangordnung oder Territorialität herabgesetzt. Fremde Tiere werden nur nach längeren aggressiven Auseinandersetzungen in den Verband aufgenommen (halboffene Verbände), z.B. Wolfsrudel. (4) Tierstaaten: Z.B. Insektenstaaten der Hautflügler (Bienen, Wespen, Ameisen) und der Termiten. Sie lassen sich stammesgeschichtlich von einfachen Familienstrukturen ableiten und bilden geschlossene Verbände (Erkennen durch gemeinsamen Geruch). Extreme Rollenverteilung durch Kastenbildung: Königin, Drohnen (männliche Geschlechtstiere), Arbeiterkaste, Soldatenkaste, Kastendifferenzierung durch unterschiedliche Ernährung im Jugendalter bedingt (rein modifikatorisch). Rangordnungsstruktur (soziale Hierarchie): Jedes Tier hat einen festen sozialen Status. An der Spitze steht das Alpha-Tier, am Ende das Omega-Tier. Rangordnungen wirken aggressionsbegrenzend und tragen zum geordneten Zusammenleben bei. Ranghohe Tiere haben Vorrechte (Nahrung, Fortpflanzung), können aber auch Pflichten übernehmen (Verteidigung der Gruppe). Territorialität (Reviere): Aggressiv verteidigte Aktionsräume. Ähnlich wie Rangordnungsverhalten wirkt Territorialität aggressionsbegrenzend. Sobald die Territorien abgegrenzt sind, wird das Aggressionsverhalten stark reduziert (Nahrungs- und Paarungsterritorien). Natürliche Selektion: Im „Kampf ums Dasein“ überleben bevorzugt die erfolgreichsten, bestangepaßten genetischen Varianten, so daß es in der Generationenfolge zu einer immer besseren Anpassung der Art kommt. Dabei ist nicht das Überleben des Individuums entscheidend, sondern sein Beitrag, den es zum Genbestand der nächsten Generation liefert. Der Selektionswert eines Genotyps richtet sich danach, in welchem Umfange er die Fortpflanzungschancen seines Trägers und diejenigen seiner Nachkommen sichert. Den Selektionsvorteilen können Selektionsnachteile gegenüber stehen, so daß die Evolution vielfach zu einem Kompromiß führt. Beispiel: Größe des Hirschgeweihs. Altruistisches Verhalten: Bringt den Artgenossen Vorteile, ist für das Tier selbst aber ohne Bedeutung oder sogar nachteilig, z.B. Aufopferung der Eltern für die eigenen Jungen (evolutionstheoretisch sichert dies das Überleben der eigenen Gene und ist so selektionistisch vorteilhaft). Grundlage der Evolution altruistischer Verhaltensweisen ist die Sippenselektion, wobei das altruistische Verhalten nur den Angehörigen der eigenen Sippe zugute kommt (extremes Beispiel: Insektenstaaten). Angeborene frühkindliche Verhaltensweisen beim Menschen: Suchautomatismus nach der mütterlichen Brust, Saugbewegungen, Schreien (Signal, das die Zuwendung der Mutter auslöst) und Klammerreflexe (Verhaltensrudiment, Säuglinge der Menschenaffen werden ständig von der Mutter im Bauchfell getragen = Tragling). Tier-Mensch-Vergleich: Bei Primaten (zu denen zoologisch auch der Mensch gehört) schwierig, da kaum klar abgrenzbare, formkonstante Verhaltenselemente vorhanden sind. Den Erbkoordinationen kommen die Elemente der menschlichen Mimik am nächsten. Mimik des weinenden Menschen findet sich beim Schimpansen als Übergangsform zwischen „Wimmern“ 19 und „Schreien mit entblößten Zähnen“ wieder. Das menschliche Lächeln läßt sich stammesgeschichtlich vom „Furchtgrinsen“ anderer Primaten ableiten (hat dort Beschwichtigungsfunktion). Dem Menschen angeboren scheint auch der „Augengruß“ beim Flirten zu sein. Evolution geistiger Fähigkeiten: Starke Vergrößerung der Großhirnrinde. Selektionsdruck vermutlich aus der Notwendigkeit sozialen Lernens heraus, da im Primatenverband die Fähigkeit zum sozialen Lernen entscheidend den Fortpflanzungserfolg der Individuen bedingt. Kulturelle Evolution: Wird der biologischen Evolution gegenübergestellt. Es handelt sich um durch individuelle Lernprozesse erworbene Verhaltensanpassungen auf dem Wege der Tradition. Sie hat den Vorteil, daß sie viel schneller zu Verhaltensanpassungen führt, zumal die genetische Anpassung des menschlichen Verhaltens jenen Umweltbedingungen entspricht, denen der Mensch vor etwa 10.000 Jahren ausgesetzt war. Funktion des Blutes Literatur: Für dieses und alle weiteren Kapitel, sofern nicht anders angegeben: Schmidt, R.F. & Thews, G. (Hrsg.) Physiologie des Menschen. Berlin: Springer (jeweils neueste Auflagen). Aufgaben des Blutes: Transportfunktion (Atemgase, Nährstoffe, Stoffwechselprodukte, Wärmeverteilung), Konstanthaltung des inneren Milieus (Konzentration gelöster Stoffe, Temperatur, pH-Wert), Schutz vor Blutverlust (Gerinnung), Abwehrfunktion (Phagozytose, Antikörperbildung). Zusammensetzung: Plasma, in dem Erythrozyten (rote Blutzellen), Leukozyten (weiße Blutzellen) und Thrombozyten (Blutplättchen) suspendiert sind. Volumen beim Erwachsenen 4 - 6 Liter. Anteil der Blutzellen am Blutvolumen wird Hämatokrit genannt, er beträgt ca. 45 Vol% und bestimmt wesentlich die innere Reibung des Blutes (Viscosität). Flüssigkeitsräume des Organismus: Blutgefäßsystem, interstitieller Raum (Zwischenzellraum) und intrazellulärer Raum. Blutplasma: Zusammensetzung ca. 91 % Wasser, 7 % Eiweiß, 2 % kleinmolekulare Substanzen. Elektrolytkonzentrationen im Plasma und interstitieller Flüssigkeit ähnlich, wichtigste Elektrolyte Natrium und Chlorid. Dagegen dominiert im Intrazellularraum anstelle des Natriums das Kalium. Osmotischer Druck im Plasma (bedingt durch die Konzentration gelöster Stoffe) 7,3 atm. Lösungen, die den gleichen osmotischen Druck haben wie Plasma, bezeichnet man als isotonisch. Hypotones Plasma führt zum Wassereinstrom in die Zellen (Ödem), hypertones zur Schrumpfung der Zellen. Funktion der Plasmaproteine (Plasmaeiweiß): Nährfunktion (Zerlegung der Proteine mittels Enzymen in Aminosäuren, die als Bausteine für die Zellen dienen), Vehikelfunktion (zum Transport werden kleinmolekulare Stoffe an Plasmaproteine gebunden), unspezifische Trägerfunktion (bluteigene Elektrolyte, z.B. Calcium, werden z.T. an Plasmaproteine gebunden), Erzeugung des 20 kolloidosmotischen Drucks (Regulierung der Wasserverteilung zwischen Plasma und Interstitium), Pufferfunktion (Plasmaproteine können mit Säuren und Basen Salze bilden, wichtig für konstanten pH-Wert), Schutz vor Blutverlust (Gehalt an Fibrinogen). Erythrozyten: Flache, runde, kernlose Scheiben, wobei die Form eine große Diffusionsfläche für die Atemgase schafft; ca. 5 Mill. im mikrol Blut. Werden im roten Mark der platten Knochen gebildet und im retikuloendothelialen System abgebaut. Reiz für Neubildung (Erythropoese) ist das Absinken des O2-Partialdruckes, wodurch es zur Ausschüttung von Erythropoetin aus der Niere kommt. Erythrozyten haben die Fähigkeit zur reversiblen O2-Bindung. Blutkörperchensenkungsgeschwindigkeit (BSG): Erythrozyten sinken im ungerinnbar gemachten, stehenden Blut langsam ab. Die BSG ist bei Entzündungen und Tumoren erhöht. Ursache ist eine Veränderung der Plasmaproteine, die zu einer verstärkten Agglomerationsneigung der Erythrozyten (Senkungsbeschleunigung) führt. Leukozyten: Sind amöboid beweglich und können phagozytieren. Normal 4.000 - 10.000 im mikrol Blut. Niedrigere Zahlen = Leukopenie, höhere Zahlen = Leukozytose (besonders bei Entzündungen). Man unterscheidet Granulozyten (aus dem Knochenmark), Lymphozyten (aus den Lymphknoten) und Monozyten (aus dem Knochenmark). Granulozyten unterteilt man nach der Anfärbbarkeit in neutrophile (überwiegend im Eiter enthalten), eosinophile (erhöht bei allergischen Reaktionen) und basophile Granulozyten. Granulozyten spielen eine Rolle bei der unspezifischen Abwehr, Lymphozyten bei der spezifischen Abwehr und Monozyten haben eine hohe Phagozytose-Kapazität. Thrombozyten: Flach, unregelmäßig rund, kernlos; normal 150.000 - 300.000. Entstehen im Knochenmark und werden in Leber, Lunge und Milz abgebaut. Funktion: Blutgerinnung und Phagozytose. Blutungsstillung und Gerinnung: Nach Verletzungen stoppt die Blutung nach 1 - 3 Minuten (primäre Hämostase durch Vasokonstriktion und Verschluß durch Thrombozytenpfropf). Danach erst Blutgerinnung (sekundäre Hämostase). Grundschema der Blutgerinnung: Prothrombin wird durch Thrombokinase (entsteht beim Zerfall von Thrombozyten) in Gegenwart von ionisiertem Calcium zu Thrombin umgewandelt. Thrombin bewirkt seinerseits die Umwandlung des gelösten Plasmaeiweißkörpers Fibrinogen zu Fibrin, das das fädige Gerüst der Blutgerinnsel bildet. Das Blut geht dabei aus dem flüssigen in einen gallertartigen Zustand über. Später kommt es zum Zusammenziehen (Retraktion) der Fibrinfäden. Dabei entsteht der halbfeste, rote Blutkuchen und eine klare gelbliche Flüssigkeit, das Serum (= Plasma ohne Fibrinogen). Abwehrfunktion des Blutes: (1) Unspezifische zelluläre Abwehr: Phagozytose durch die Leukozyten. (2) Unspezifische humorale Abwehr: Vorhandensein von Komplement (Gruppe von 9 Plasmafaktoren, die sich gegenseitig aktivieren; unterstützt die Wirkungen der Antikörper), Lysozym (in Leukozyten gebildet; hemmt das Wachstum von Bakterien und Viren), C-reaktivem Protein (aktiviert das Komplementsystem), Interferon (in Leukozyten gebildet; hemmt das Wachstum von Viren) und sog. „natürlichen Antikörpern“, die sich aber vermutlich aus dem frühen Kontakt mit bakteriellen Antigenen aus der Darmflora gebildet haben. (3) spezifische zelluläre Abwehr (Immunreaktion vom verzögerten Typ): Gegen Antigene (= potentiell schädigende Substanzen, z.B. Krankheitserreger, artfremdes Eiweiß) werden vom Organismus Antikörper (Immunglobuline) gebildet, die im Rahmen der Antigen-Antikörper- 21 Reaktion den Antigenen die schädlichen Eigenschaften nehmen. Bei der spezifischen zellulären Abwehr sind die T-Lymphozyten beteiligt, deren Stammzellen im Knochenmark liegen. Nach der immunologischen Prägung im Thymus (= T) wandern sie in die lymphatischen Organe (Lymphknoten, Milz) ein. Beim Kontakt mit einem Antigen werden Tochterzellen von den TLymphozyten gebildet (Primärreaktion), die T-Effectorzellen und die langzeitig im Blut zirkulierenden T-Gedächtniszellen. Bei den T-Effectorzellen kann man mehrere Subpopulationen unterscheiden: Z.B. T-Killerzellen (zerstören das Antigen im Zuge der Antigen-Antikörper-Reaktion), T-Lymphokinzellen (setzen hormonartige Stoffe frei, die Makrophagen aktivieren), T-Suppressorzellen (hemmen die Aktivitäten von T- und BLymphozyten und verhindern so eine überschießende Immunantwort). Beim zweiten Antigenkontakt kommt es durch die Vermittlung der T-Gedächtniszellen zu einer raschen Bildung großer Zahlen von T-Killerzellen (Sekundärreaktion). (4) spezifische humorale Abwehr (Immunreaktion vom Soforttyp): Abwehr ähnlich wie unter (3). Aus immunologisch geprägten B-Lymphozyten werden bei Antigen-Exposition einerseits BGedächtniszellen, andererseits Plasmazellen gebildet, wobei letztere die humoralen Antikörper produzieren. Auch hier erfolgt die Sekundärreaktion bei erneutem Kontakt mit dem Antigen rascher und intensiver. Da diese Immunantwort schneller erfolgt als unter (3) spricht man vom Soforttyp. Aktive-passive Immunisierung: Bei der aktiven Immunisierung (Impfung) nimmt man die Primärreaktion vorweg und führt dem Organismus unschädliche Mengen eines Antigens zu. Bei einer Infektion sind dann schon die spezifischen Antikörper vorhanden. Bei der passiven Immunisierung werden dem Patienten spezifische Antikörper gegen das jeweilige Antigen in Form von Immunglobulinpräparaten zugeführt. Allergie: Bei wiederholter Exposition gegenüber einem Antigen führt die Antigen-AntikörperReaktion zu Überempfindlichkeitserscheinungen. Blutgruppen: An der Zellmembran der Erythrozyten befindet sich eine Anzahl spezifischer Komplexe mit Antigen-Eigenschaften, die man als Agglutinogene bezeichnet. Die spezifischen Antikörper, die mit diesen Agglutinogenen reagieren (z.B. bei falscher Bluttransfusion), sind im Blutplasma gelöst und werden als Agglutinine bezeichnet. Das Blut jedes Menschen ist durch einen bestimmten Satz spezifischer Agglutinogene charakterisiert: A, B, AB und 0. In diesem AB0System richtet sich die Blutgruppenzugehörigkeit also nach den Antigeneigenschaften der Erythrozyten des Trägers. Im Laufe des ersten Lebensjahres werden Antikörper (Agglutinine) gegen diejenigen Antigene entwickelt, die die eigenen Erythrozyten nicht besitzen: Anti-A und Anti-B bei Blutgruppe 0. Anti-B bei Blutgruppe A, Anti-A bei Blutgruppe B und keine Agglutinine bei Blutgruppe AB. Verteilung der Blutgruppen in Mitteleuropa: 42 % A, 40 % 0, 12 % B und 6 % AB. 22 Funktion des Herzens Systole und Diastole: Die Pumpwirkung des Herzens beruht auf der rhythmischen Zusammenziehung (Systole) und Erschlaffung (Diastole) der Herzkammern (Ventrikel). In der Diastole füllen sich die Ventrikel mit Blut. In der Systole werfen sie es in die A. pulmonalis bzw. Aorta aus. Ein Rückstrom wird durch die Herzklappen verhindert. Jeder Herzkammer ist ein Vorhof (Atrium) vorgeschaltet, der das Blut aus den großen Venen (Hohlvenen bzw. Venae pulmonales) aufnimmt. Arterien und Venen: Die Bezeichnung von Blutgefäßen richtet sich nach der Strömungsrichtung und nicht nach der Beschaffenheit des enthaltenen Blutes. Venen führen das Blut dem Herzen zu, Arterien führen es vom Herzen weg. Funktionselemente des Herzens: Arbeitsmuskulatur (Arbeitsmyokard) und Fasern des spezifischen Erregungsbildungs- bzw. Erregungsleitungssystems. Autorhythmie: Die Pulsationen des Herzens werden durch Erregungen ausgelöst, die im Herzen selbst entstehen. Ein aus dem Körper entnommenes Herz schlägt daher weiter. Reihenfolge der Erregungsausbreitung: Sinusknoten (im rechten Vorhof, gibt den Anstoß zu einem Herzschlag mit 70 Pulsen/Min bei Körperruhe) ---> Erregungsausbreitung über Arbeitsmuskulatur der Vorhöfe ---> Überleitung auf die Ventrikel über den Atrioventricularknoten (AV-Knoten) mit einer Verzögerung ---> His-Bündel ---> TawaraSchenkel (rechter und linker) ---> Pukinje-Fäden (Endaufzweigungen des Reizleitungssystems). Hierarchie der Erregungsbildung: Sinusknoten ist der primäre Schrittmacher. Fällt die Erregungsbildung im Sinusknoten aus, so kann ersatzweise der AV-Knoten als sekundäres Erregungsbildungszentrum die Schrittmacher-Funktion übernehmen (AV-Rhythmus 40 60/Min). Im Falle einer kompletten Unterbrechung der Überleitung von den Vorhöfen auf die Ventrikel (totaler Herzblock) kann schließlich ein tertiäres Zentrum im ventrikulären Erregungsleitungs-System als Schrittmacher einspringen (30 - 40/Min.). Aktionspotential: Rasche Umladung vom Wert des Ruhepotentials (-90 mV) bis zum Gipfel der initialen Spitze (+ 30 mV). An diese schnelle Depolarisationsphase (1 - 2 ms), schließt sich ein langdauerndes Plateau (ca. 200 ms) an, bevor die Repolarisation zum Ruhepotential erfolgt. Aktionspotential dauert etwa 100 mal länger als bei der Skelettmuskel- oder Nervenfaser. Langsame diastolische Depolarisation (Schrittmacherpotential): In allen Herzmuskelzellen mit der Fähigkeit zur autorhythmischen Erregungsbildung erfolgt die Depolarisation zum Schwellenpotential, bei dem ein neues Aktionspotential ausgelöst wird, spontan. Es handelt sich dabei um einen lokalen Erregungsvorgang. Normalerweise sind nur wenige Zellen im Sinusknoten tatsächlich für die Erregungsbildung verantwortlich. Alle übrigen Fasern des spezifischen Systems werden von fortgeleiteten Erregungen ergriffen, bevor ihre langsamen diastolischen Depolarisationen das Schwellenpotential erreichen (potentielle Schrittmacher). Refraktärperioden: Während der absoluten Refraktärperiode ist keine Neuerregung der Herzmuskulatur möglich. In der anschließenden relativen Refraktärperiode kehrt die Erregbarkeit allmählich zurück. Durch die langdauernde Refraktärzeit wird die Muskulatur vor einer schnellen Wiedererregung geschützt, die ihre Pumpfunktion beeinträchtigen könnte. Im Unterschied zum 23 Skelettmuskel ist der Herzmuskel nicht in der Lage, eine rasche Folge von Aktionspotentialen mit der Superposition von Einzelkontraktionen zu beantworten (Nicht-Tetanisierbarkeit des Myokards). Parasympathische Innervation: Der Nervus Vagus verbindet die kreislaufregulierenden Zentren in der Medulla oblongata mit dem Herzen. Fasern des rechten Vagus versorgen den Sinusknoten, Fasern des linken den AV-Knoten. Reizung des rechten Vagus führt zur Senkung der Herzfrequenz (negative chronotrope Wirkung) durch Abnahme der Steilheit der diastolischen Depolarisation. Reizung des linken Vagus verlängert die Überleitungszeit (negativ dromotrope Wirkung). Zudem wird unter Vaguseinfluß die Kontraktionsstärke der Vorhöfe vermindert durch Verkürzung der Dauer des Aktionspotentials (negative inotrope Wirkung). Überträgerstoff des Vagus ist Acetylcholin. Keine parasympathische Innervation der Ventrikel! Sympathische Innervation: Verlauf der sympathischen Herznerven: Kreislaufzentren (Medulla oblongata) ---> Umschaltung auf präganglionäre Fasern in den Seitenhörnern des Rückenmarks --> Umschaltung auf postganglionäre Fasern im Grenzstrang ---> Herz. Sympathikus versorgt alle Teile des Herzens. Überträgerstoffe Noradrenalin und Adrenalin. Sympathische Einflüsse können dem Herzen auch durch die im Blut zirkulierenden Katecholamine aus dem Nebennierenmark zufließen. Wirkungen des Sympathikus: Zunahme der Herzfrequenz (positiv chronotrope Wirkung) durch Zunahme der Steilheit der diastolischen Depolarisation, Erhöhung der Kontraktionskraft in Vorhöfen und Ventrikeln (positive inotrope Wirkung), Beschleunigung der Überleitung im AV-Knoten (positive dromotrope Wirkung). Elektrokardiogramm (EKG): Ausdruck der Herzerregung. Im EKG wird der zeitliche Verlauf von elektrischen Spannungen registriert, die als Folge der Erregungsvorgänge im Herzen zwischen definierten Stellen der Körperoberfläche auftreten. Das EKG liefert Anhaltspunkte über Frequenz, Ursprung, Ausbreitung und Rückbildung der Erregung des Herzens. Zacken bzw. Wellen = Ausschläge in positiver und negativer Richtung, mit den Buchstaben P bis T bezeichnet; Strecken = Abstand zwischen zwei Zacken (z.B. PQ-Strecke = Ende P bis Anfang Q); Intervalle = umfassen Zacken und Strecken (z.B. PQ-Intervall = Anfang P bis Anfang Q). P-Welle: Ausdruck der Erregungsausbreitung über beide Vorhöfe. PQ-Strecke: Vorhöfe sind als Ganzes erregt. QRS-Gruppe: Ausdruck der Erregungsausbreitung über beide Ventrikel. ST-Strecke: Zeigt die Totalerregung des Ventrikelmyokards an. T-Welle: Ausdruck der ventrikulären Erregungsrückbildung. PQ-Intervall = Überleitungszeit: Verlängerungen deuten auf Störungen der Erregungsleitung im Bereich des AV-Knotens bzw. des His-Bündels hin. Diagnostisch liefert das EKG folgende Informationen: Frequenz, Ursprung der Erregung (Sinus-, AV-Knoten), Rhythmusstörungen, Leitungsstörungen, Hinweise auf anatomische Herzlage, Hinweise auf extrakardiale Einflüsse (Stoffwechselstörungen, Vergiftungen etc.), Hinweise auf primär kardiale Störungen der Erregung (Koronardurchblutung, Entzündungen) und Myokardinfarkt. Herzklappen: Atrio-Ventrikularklappen zwischen Vorhöfen und Ventrikeln (Mitralklappe links, Tricuspidalklappe rechts) dienen zur Abdichtung der Ventrikel gegen die Vorhöfe während der Systole, auch als Segelklappen bezeichnet. Aorten- und Pulmonalklappen (Taschenklappen oder Semilunarklappen, so genannt wegen ihres Baus) verhindern den Rückstrom von Blut in die 24 Ventrikel während der Diastole. Durch entzündliche Veränderungen an den Klappen kann eine ungenügende Öffnung (Stenose) oder ein undichter Verschluß (Insuffizienz) resultieren. Aktionsphasen des Herzens: (1) Anspannungsphase: Zu Beginn der Kammersystole führt der Anstieg des intraventrikulären Drucks zum Verschluß der AV-Klappen. Da zu diesem Zeitpunkt auch die Semilunarklappen geschlossen sind, spannt sich die Ventrikelmuskulatur um den inkompressiblen Inhalt an und bewirkt weiteren Druckanstieg. (2) Austreibungsphase: Wenn der intraventrikuläre Druck den diastolischen Aortendruck von ca. 80 mmHg übertrifft, öffnen sich die Semilunarklappen und die Austreibung beginnt. Der Ventrikeldruck steigt dabei zunächst noch weiter bis zu einem Maximalwert von ca. 130 mmHg an und fällt gegen Ende der Systole wieder ab, wobei sich die Semilunarklappen schließen. (3) Entspannungsphase: Zunächst sind alle Klappen geschlossen, der intraventrikuläre Druck fällt rasch auf nahezu 0 ab. Beim Unterschreiten des Vorhofdrucks öffnen sich die AV-Klappen. (4) Füllungsphase: Hierbei steigt der Ventrikeldruck nur wenig an. Die Volumenvergrößerung geschieht anfangs schnell, dann langsamer. Bei normaler Herzfrequenz ist die Kammerfüllung z.Zt. der Vorhofkontraktion fast völlig geschlossen. Erst bei höheren Frequenzen wird die Vorhofkontraktion wirksam, da hierbei die Diastolendauer stark verkürzt wird. Ventilebenen-Mechanismus: Während der Austreibungsphase pressen die Ventrikel in einem Arbeitsgang Blut in die großen Arterien aus und saugen gleichzeitig Blut aus den großen Venen in die Vorhöfe hinein. Die Sogwirkung kommt dadurch zustande, daß sich die Ventilebene (= Grenzfläche zwischen Vorhöfen und Kammern), in der die Herzklappen liegen, in Richtung zur Herzspitze verschiebt und die inzwischen erschlafften Vorhöfe dehnt. Am Ende der Austreibungsphase sind die Vorhöfe prall mit Blut gefüllt. Sobald nun die Ventrikelmuskulatur erschlafft, kehrt die Ventilebene bei weit geöffneten AV-Klappen in ihre Ausgangslage zurück und schiebt sich dabei über das Blutvolumen hinweg (= rasche Kammerfüllung). Herztöne: I. Herzton: Anspannungston, hervorgerufen durch die Anspannung des Ventrikelmyokards um den inkompressiblen Inhalt zu Beginn der Systole. II. Herzton: Klappenton, hervorgerufen durch das Zuschlagen der Semilunarklappen zu Beginn der Diastole. Aufzeichnung der Herztöne = Phonokardiogramm. Herzgeräusche = Veränderungen des normalen Herzschalls (Stenose, Insuffizienz der Klappen). Koronare Herzkrankheit: Herzinfarkt (= Myokardinfarkt) und Angina pectoris vera. Beiden liegt eine Koronarinsuffizienz zugrunde, die man als Mißverhältnis zwischen Bedarf und Angebot an Blut zur Versorgung der Herzmuskulatur definieren kann. Beim Herzinfarkt liegt meist eine Sklerose der Herzkranzgefäße (Koronararterien) vor, die über eine Koronarverengung bzw. Koronarverschluß die Durchblutungsstörungen am Herzmuskel hervorruft. Im nicht mehr durchbluteten Herzabschnitt kommt es zum Gewebsuntergang (= Nekrose). Bei der Angina pectoris vera handelt es sich um eine vorübergehende Durchblutungsstörung, mit heftigen Schmerzen hinter dem Brustbein, die meist in den linken Arm ausstrahlen. Hiervon ist die Pseudo-Angina pectoris zu unterscheiden, die nicht auf organischer Grundlage beruht, sondern Ausdruck sog. funktioneller Beschwerden (Somatoforme Störung) ist. - Ist ein größerer Abschnitt des Myokards von der Durchblutungsstörung (Ischämie) betroffen, so kann es zur Herzruptur mit Sekundenherztod kommen. Beim Infarkt können die Schmerzen aber auch fehlen (stummer Infarkt). Diagnose des Infarkts durch EKG und Anstieg bestimmter Enzyme im Serum. 25 Die koronare Herzkrankheit ist multifaktoriell bedingt (Risikofaktoren, z.B. Bluthochdruck, Rauchen). Das Gefäßsystem Aufbau der Gefäßwand: Intima: Innere Schicht des Gefäßes mit Endothelzellen (einschichtiges Pflasterepithel) und elastischen Fasern. Media: Mittlere Schicht mit glatten Muskelzellen (wichtig für die aktive Spannung, den Gefäßtonus) und kollagenen Fasern. Adventitia: Äußere Schicht mit kollagenen Fasern und wenig glatten Muskelzellen. Morphometrie des Gefäßsystems: Aus der Aorta (ca. 50 cm lang) entspringen die Arterien (wenige cm - 50 cm), daran schließen sich die Arteriolen (Länge wenige mm) und am Ende die Kapillaren (0,5 - 1,0 mm) an. Die Venen weisen annähernd gleiche Längen wie die entsprechenden Arterien auf. Druck im Arteriensystem: Maximum der Druckpulskurve während der Systole = systolischer Blutdruck (ca. 120 mmHg) und Minimum während der Diastole = diastolischer Blutdruck (ca. 80 mmHg). In den terminalen Arterienästen sowie in den Arteriolen fällt der Druck wegen des hohen Strömungswiderstandes steil ab. Flüssigkeitsgleichgewicht zwischen intravasalem und interzellulärem Raum: Am arteriellen Ende der Kapillaren beträgt der nach außen gerichtete Druck 37 mmHg (hydrostatischer Druck in den Kapillaren = 32,5 mmHg + kolloidosmotischer Druck des Interstitiums = 4,5 mmHg) und der nach innen gerichtete Druck 28 mmHg (kolloidosmotischer Druck des Plasmas = 25 mmHg + hydrostatischer Druck des Interstitiums = 3 mmHg). Es entsteht somit ein effektiver Filtrationsdruck von 9 mmHg, wobei eine Filtration von Flüssigkeit in den interstitiellen Raum erfolgt. Am venösen Ende der Kapillaren beträgt der nach außen gerichtete Druck 22 mmHg (Abnahme des hydrostatischen Drucks in den Kapillaren auf 17,5 mmHg + kolloidosmotischer Druck des Interstitiums = 4,5 mmHg) und der nach innen gerichtete Druck bleibt konstant bei 28 mmHg. Somit entsteht ein effektiver Reabsorptionsdruck von 6 mmHg, wodurch eine Reabsorption von Flüssigkeit aus dem interstitiellen Raum stattfindet. Da der Reabsorptionsdruck jedoch etwas kleiner als der Filtrationsdruck ist, werden nur 90 % reabsorbiert, die restlichen 10 % werden über die Lymphgefäße abtransportiert. Lymphsystem: Durch die Lymphgefäße, die in das Venensystem münden, wird interstitielle Flüssigkeit in das Blut zurückgeleitet. Die Wände der Lymphkapillaren bestehen aus einschichtigem Endothel, die Wände der größeren Lympfgefäße weisen glatte Muskelfasern und Klappen (zur Verhinderung des Rückstroms) ähnlich wie die Venen auf. In größeren Lymphgefäßen sind Lymphknoten (Filterfunktion) zwischengeschaltet. Periphere Durchblutungsregulation: Durchblutungsänderungen beruhen im wesentlichen auf Änderungen der Gefäßdurchmesser (Abhängigkeit des Strömungswiderstandes von der 4. Potenz des Gefäßradius). Der Gefäßdurchmesser wird vom augenblicklichen Kontraktionszustand der glatten Gefäßmuskulatur bestimmt, welcher der Gefäßwand den Gefäßtonus verleiht. Zunahmen 26 des Kontraktionszustandes = Vasokonstriktion, Abnahmen des Kontraktionszustandes = Vasodilatation. Durch Veränderungen des relativen Widerstandes vor allem in den Arteriolen (= Widerstandsgefäße) wird die Verteilung des Herzzeitvolumens auf die einzelnen parallel geschalteten Organkreisläufe gesteuert. In den Gefäßgebieten mit stark wechselnden funktionellen Anforderungen (Skelettmuskulatur, Gastrointestinaltrakt, Leber, Haut) können die relativ größten Durchblutungsänderungen auftreten. Demgegenüber wird die lebenswichtige Durchblutung des Gehirns und der Nieren weitgehend konstant gehalten. Die Gefäßreaktionen bei der Leistungsanpassung beruhen auf nervösen Einflüssen, humoralen Faktoren und lokalen Mechanismen. Gefäßinnervation: Die nervöse Beeinflussung der Blutgefäße (= vasomotorische Steuerung) erfolgt durch das autonome Nervensystem, überwiegend durch sympathische Anteile. Mit Ausnahme der Kapillaren werden alle Blutgefäße innerviert. Die Intensität der Reaktion der glatten Gefäßmuskulatur hängt direkt von der Frequenz der efferenten Impulse ab. Der Ruhetonus der Gefäße beruht auf einer ständigen Aktivität von 1 - 3 Impulsen/s. Zunahmen der Impulsfrequenz bewirken vasokonstriktorische und Abnahmen dilatatorische Reaktionen. Bei den eben genannten efferenten Nerven handelt es sich um sympathische, adrenerge, vasokonstriktorische Fasern. Parasympathische, cholinerge, vasodilatatorische Fasern innervieren lediglich die Gefäße der äußeren Genitalorgane. Humoral-hormonale Effekte: Die Gefäßwirkungen der vom Nebennierenmark sezernierten Katecholamine (Adrenalin und Noradrenalin) sind komplex. An der Membran der Gefäßmuskulatur befinden sich verschiedene adrenerge Rezeptoren, die α- und ß-Rezeptoren. Durch Erregung der α-Rezeptoren wird eine Kontraktion, durch Erregung der ß-Rezeptoren eine Entspannung der glatten Muskelfasern ausgelöst. Noradrenalin wirkt dabei nur auf die αRezeptoren, Adrenalin auf beide. Im Blut zirkulierendes Adrenalin bewirkt durch seine Wirkungen auf ß-Rezeptoren im allgemeinen Abnahmen des Gesamtwiderstandes, zugleich nimmt das Herzzeitvolumen aufgrund von Steigerungen des Schlagvolumens und der Herzfrequenz zu. Solche Effekte treten bei Muskelarbeit oder psychischer Belastung auf. Noradrenalin verursacht dagegen ausschließlich Erhöhungen des Strömungswiderstandes, der arterielle Druck steigt an. Lokale Durchblutungsregulation: Bei Abnahme des O2-Partialdrucks im Blut kommt es zu vasodilatatorischen Reaktionen. Lokale Erhöhungen des CO2-Partialdrucks oder pHErniedrigung lösen ebenfalls dilatatorische Reaktionen aus. Blutdruck: Indirekte Messung mit Oberarmmanschette nach Riva-Rocci-Korotkow an der A. brachialis. Höhe des individuellen Blutdrucks abhängig von Vererbung, Alter, Geschlecht u.a. Faktoren. Beim jugendlichen Erwachsenen normalerweise 120 mmHg systolisch, 80 mmHg diastolisch. Abnahme beider Werte im Schlaf um ca. 20 mmHg. Hypertonie = Blutdruckwerte oberhalb des Normbereichs, Hypotonie = Blutdruckwerte unterhalb der Norm. WHODeskription für Hypertonie: systolisch über 140 oder diastolisch über 90 mmHg. 27 Atmung Atmung: Gaswechsel zwischen den Zellen und der Umgebung. Am Transport des Sauerstoffs (O2) von der Außenluft zur Zelle sind nacheinander beteiligt: (1) Transport zu den Lungenalveolen durch die Ventilation, (2) Diffusion von den Alveolen in das Lungenkapillarblut (beide Teilprozesse zusammen bezeichnet man als Lungenatmung = äußere Atmung), (3) Transport zu den Gewebekapillaren durch den Blutkreislauf (Atemgastransport des Blutes) und (4) Diffusion von den Gewebekapillaren in die umgebenden Zellen (Gewebsatmung = innere Atmung). Der Abtransport des Kohlendioxyds (CO2), das als gasförmiges Endprodukt des oxydativen Stoffwechsels in den Zellen gebildet wird, setzt sich in analoger Weise aus vier Teilprozessen zusammen. Atmungsbewegungen: Die für den Gasaustausch notwendige Belüftung der Alveolen (= Lungenbläschen) wird durch den rhythmischen Wechsel von Inspiration (Einatmung) und Exspiration (Ausatmung) bewirkt. Die Luftbewegungen kommen durch den Wechsel von Brustraumerweiterung und Brustraumverengung zustande. Für die Erweiterung sind zwei Faktoren maßgebend: Hebung der Rippenbögen (durch Inspirationsmuskeln) und Abflachung des muskulösen Zwerchfells. Die Ausatmung erfolgt durch Erschlaffung der genannten Muskulatur und durch die elastischen Kräfte der Lunge. Intrapleuraler Druck: Die Lungenoberfläche, die der inneren Thoraxwand überall dicht anliegt, folgt den Atmungsbewegungen, obwohl zwischen beiden keine feste Verbindung besteht. Dies ist dadurch möglich, daß der kapilläre Spalt zwischen Pleura visceralis (Lungenfell) und Pleura parietalis (Rippenfell) mit Flüssigkeit gefüllt ist, die nicht ausgedehnt werden kann. Da die Lunge das Bestreben hat, ihre Oberfläche zu verkleinern, besteht eine Druckdifferenz zwischen Interpleuralspalt und Außenluft (= intrapleuraler Druck), -4 cm H2O bei Exspiration und -7 cm H2O bei Inspiration. Ventilation: Lungenbelüftung, abhängig von der Tiefe des einzelnen Atemzugs (Atemzugvolumen) und von der Zahl der Atemzüge in der Zeiteinheit (Atmungsfrequenz). Lungenvolumina: Zusammengesetzte Volumina = Kapazitäten. (1) Atemzugvolumen: Normales In- bzw. Exspirationsvolumen. (2) Inspiratorisches Reservevolumen: Volumen, das nach normaler Inspiration noch zusätzlich eingeatmet werden kann. (3) Exspiratorisches Reservevolumen: Volumen, das nach normaler Exspiration noch zusätzlich ausgeatmet werden kann. (4) Residualvolumen: Volumen, das nach maximaler Exspiration noch in der Lunge zurückbleibt. (5) Vitalkapazität: Volumen, das nach maximaler Inspiration maximal ausgeatmet werden kann, entspricht der Summe aus (1), (2) und (3) und stellt ein Maß für die Ausdehnungsfähigkeit von Lunge und Thorax dar. Abhängig von Alter, Geschlecht, Körpergröße und Trainingszustand. (6) Inspirationskapazität: Volumen, das nach normaler Exspiration maximal eingeatmet werden kann, entspricht Summe aus (1) und (2). (7) Funktionelle Residualkapazität: Volumen, das nach normaler Exspiration noch in der Lunge enthalten ist, entspricht der Summe aus (3) und (4). Hat Bedeutung als Ausgleich der in- und exspiratorischen O2- und CO2-Konzentrationen im Alveolarraum, wodurch die 28 Konzentrationsschwankungen der Alveolarluft verringert werden. (8) Totalkapazität: Volumen, das nach maximaler Inspiration in der Lunge enthalten ist, entspricht der Summe aus (4) und (5). Anatomischer Totraum: Volumina der zuleitenden Luftwege (Trachea, Bronchien, Bronchiolen). Aufgabe: Reinigung, Befeuchtung und Erwärmung der Luft. Funktioneller Totraum: Anatomischer Totraum + Alveolarräume, die zwar belüftet, aber nicht durchblutet sind (beim Gesunden quantitativ gering). Alveoläre Ventilation: Derjenige Teil des Atemzeitvolumens, der der Belüftung der Alveolen zugute kommt. Der restliche Anteil heißt Totraumventilation. Atemzeitvolumen = Atemzugvolumen (in Ruhe ca. 0,5 l) x Atemfrequenz (in Ruhe ca. 14 Züge/Min.). Von der Gesamtventilation in Höhe von 7 l/Min entfallen auf die alveoläre Ventilation 5 l/Min und auf die Totraumventilation 2 l/Min. Totraumanteil bei jedem Atemzug konstant ca. 150 ml. Flache, rasche Atmung (z.B. Atemzugvolumen von 0,2 l und Atemfrequenz von 35 Zügen/Min) sehr ineffektiv, da fast nur Totraumventilation. Entscheidend ist die alveoläre Ventilation! Klinischer Tod: Zeitpunkt, zu dem Atmungs- und Kreislaufstillstand festgestellt werden. Nach 3 - 8 Min infolge von O2-Mangel irreparable Schädigung der Gehirnzellen. In dieser Zeitspanne ist Wiederbelebung möglich. Wiederbelebungsmaßnahmen: Säuberung von Mund- und Rachenraum. Überstrecken des Kopfes und Anheben des Unterkiefers, um Verschluß der Atemwege durch zurückfallende Zunge zu beseitigen. Atemspende (Mund-zu-Nase): Beginn mit 5 - 10 schnellen Lufteinblasungen, später alle 5 Sekunden. Störungen der Atmungsmechanik: (1) Restriktive Funktionsstörungen: Ausdehnungsfähigkeit der Lunge eingeschränkt (z.B. durch Verwachsung der Pleurablätter nach Pleuritis). (2) Obstruktive Funktionsstörungen: Einengung der zuleitenden Atemwege (z.B. bei Asthma bronchiale). Da bei Einengung die Ausatmung ständig gegen einen erhöhten Widerstand erfolgen muß, tritt vielfach eine Überblähung der Lunge auf (Lungenemphysem). Austausch der Atemgase: Der Gasaustausch findet im Alveolarraum zwischen Alveolen und Erythrozyten statt. Atmosphärische Luft enthält 20,9 % Sauerstoff, 0,03 Vol% Kohlendioxyd und 79,1 Vol% Stickstoff; die entsprechenden Konzentrationen in der Alveolarluft sind 14 %, 5,6 % und 80,4 %. Nach dem Dalton'schen Gesetz übt jedes Gas in einem Gasgemisch einen Partialdruck aus, der seinem Anteil am Gesamtvolumen entspricht. Für mittlere Luftdrücke liegt der O2-Partialdruck der atmosphärischen Luft bei 150 mmHg, der CO2-Partialdruck ist praktisch zu vernachlässigen. Die alveolären Werte betragen jedoch 100 mmHg für O2 und 40 mmHg für CO2. Dabei sind die alveolären Partialdrücke vor allem von der alveolären Ventilation abhängig. Das venöse Blut in den Lungenkapillaren hat einen O2-Partialdruck von 40 mmHg und einen CO2-Partialdruck von 46 mmHg. Diese Partialdruckdifferenzen (Alveolen - Blut) stellen die treibenden Kräfte für die O2- und CO2-Diffusion dar. Das Blut, das mit einem O2-Partialdruck von 40 mmHg in die Kapillare eintritt, verläßt diese mit einem O2-Partialdruck von 100 mmHg. Ebenso erfolgt innerhalb der kurzen Diffusionskontaktzeit der Erythrozyten (ca. 0,3 sec) eine Angleichung des CO2-Partialdrucks an den alveolären Wert (40 mmHg). Kennzeichnung veränderter Ventilationszustände: 29 (01) Normoventilation: Normale Ventilation (Partialdrücke 100 und 40 mmHg). (02) Hyperventilation: Steigerung der alveolären Ventilation über die Stoffwechselbedürfnisse (O2-Partialdruck > 100 mmHg, CO2 < 40 mmHg). (03) Hypoventilation: Minderung der alveolären Ventilation unter den Wert, der den Stoffwechselbedürfnissen entspricht (O2 < 100 mmHg, CO2 > 40 mmHg). (04) Eupnoe: Normale Ruheatmung. (05) Hyperpnoe: Vertiefte Atmung mit oder ohne Zunahme der Atemfrequenz. (06) Tachypnoe: Zunahme der Atemfrequenz. (07) Bradypnoe: Abnahme der Atemfrequenz. (08) Apnoe: Atmungsstillstand, bedingt durch Störung der Atemzentren in der Medulla oblongata. (09) Dyspnoe: Erschwerte Atmung, verbunden mit subjektiver Atemnot. (10) Orthopnoe: Starke Dyspnoe bei Stauung des Blutes in den Lungenkapillaren bei Herzinsuffienz. (11) Asphyxie: Atmungsstillstand oder Minderatmung bei Lähmung der Atmungszentren (bei Neugeborenen). Atemgastransport im Blut: Das Hämoglobin (roter Blutfarbstoff) der Erythrozyten besitzt die Fähigkeit, den Sauerstoff in den Lungenkapillaren anzulagern und in den Gewebekapillaren wieder abzugeben. Der umgekehrte Vorgang gilt für das CO2. Die mittlere Hämoglobinkonzentration beträgt ca. 15,5 g%, d.h. in 100 ml Blut sind 15,5 g Hämoglobin enthalten. Ein Absinken dieser Konzentration wird als Anämie bezeichnet. Die O2-Sättigung des Hämoglobins hängt von dem jeweils gegebenen O2-Partialdruck ab. Die O2-Bindungskurve des Hämoglobins hat einen charakteristischen S-förmigen Verlauf. Der flache Verlauf der Kurve im Endteil verhindert bei sinkendem arteriellen O2-Partialdruck einen stärkeren Abfall der O2Sättigung. Für die Sauerstoffabgabe im Gewebe erweist sich dagegen der steile Verlauf im Mittelteil der O2-Bindungskurve als günstig. Energiehaushalt Anabolismus: Aufbau spezifischer, körpereigener Substanzen aus den aufgenommenen Nährstoffen. Katabolismus: Abbau körpereigener Substanzen oder von aufgenommenen Nährstoffen im Rahmen des intermediären Stoffwechsels. Dimension des Energieumsatzes: Kilokalorien (kcal) pro Zeiteinheit (1 kcal = 4187 Joule). Wirkungsgrad: Verhältnis von äußerer Arbeit zu umgesetzter Energie. Beim Gesamtorganismus während Muskelarbeit ca. 25 %, der Rest ist Wärme. Umsatzgrößen der Zelle: Tätigkeitsumsatz (Energieumsatz der aktiven Zelle), Bereitschaftsumsatz (Energieumsatz, den eine Zelle zur Aufrechterhaltung ihrer sofortigen, uneingeschränkten Funktionsbereitschaft benötigt), Erhaltungsumsatz (minimaler Energieumsatz, der für die Erhaltung der Zellstruktur unbedingt notwendig ist). Bei Störungen der Energiezufuhr wird die 30 Zelle nicht sofort geschädigt, da sie über Energiereserven verfügt (Schädigung von Gehirnzellen nach 3 - 8 Min, von Muskelzellen nach 1 - 2 Std.). Grundumsatz: Energieumsatz, der unter folgenden Bedingungen gemessen wird: Morgens, in Ruhe (liegend), nüchtern, bei Indifferenztemperatur. Grundumsatz abhängig von Alter, Geschlecht, Körperlänge und Körpergewicht. In der Regel kann er beim Erwachsenen grob mit 1 kcal/kg x h = 1700 kcal/Tag (bei 70 kg) angesetzt werden. Arbeitsumsatz: Der Freizeitumsatz (Energiebedarf eines nicht körperlich arbeitenden Menschen) beträgt für Männer 2300 kcal/Tag (Schreibtischarbeiter). Bei körperlicher Arbeit kommen Leistungszuschläge hinzu: Leichte Arbeit 500, mäßige 1.000, mittelschwere 1.500, schwere Arbeit 2000 und Schwerstarbeit 2.500 kcal. Bei geistiger Arbeit beobachtet man eine leichte Zunahme des Energieumsatzes, woran aber nicht das Gehirn beteiligt ist (dies ist ständig aktiv, auch im Schlaf), sondern die reflektorisch bedingte Zunahme des Muskeltonus. Indirekte Calorimetrie zur Bestimmung des Energieumsatzes: Dabei wird die vom Organismus aufgenommene Sauerstoffmenge gemessen. Für die Glukose-Verbrennung gilt: C6H12O6 + 6 O2 ---> 6 CO2 + 6 H2O + 675 kcal. Pro Mol Glukose (Mol = Molekulargewicht in Gramm, bei der Glukose 180 g) werden also 675 kcal frei, umgerechnet auf 1 g Glukose also 3,75 kcal = Brennwert der Glukose. Zur Verbrennung von 1 Mol Glukose werden 6 Mol O2 mit einem Volumen von 6 x 22,4 l = 134,4 l benötigt (Mol-Volumen aller Gase bei 0°C und 760 mmHg = 22,4 l). Bezieht man die frei werdende Energie auf den verbrauchten Sauerstoff, entstehen 675 : 134,4 l = 5,02 kcal/l Sauerstoff = kalorisches Äquivalent der Glukose. Respiratorischer Quotient (RQ): Definiert als CO2-Abgabe/O2-Aufnahme. Bei Glukoseverbrennung wird genauso viel CO2 abgegeben wie an O2 aufgenommen wird, daher RQ = 1,0 (gilt auch für andere Kohlenhydrate). Da bei der Fettverbrennung die Fettsäuren pro Atom Kohlenstoff weniger O2 enthalten als die Kohlenhydrate, ergibt sich ein deutlich erniedrigter RQ von 0,7. Bei alleiniger Verbrennung von Nahrungseiweißen findet man einen RQ von 0,81. Da vom RQ das kalorische Äquivalent abhängt, ist seine Messung neben der Bestimmung des aufgenommenen O2 zur Ermittlung des Energieumsatzes wichtig. Wärmehaushalt Homoiotherme Lebewesen: Die Körpertemperatur wird infolge hoher Wärmebildung und zusätzlicher Regelungsmechanismen auf einem Wert konstant gehalten, der erheblich über der Umgebungstemperatur liegt (z.B. Säugetiere, Mensch). Poikilotherme Lebewesen: Körpertemperatur liegt nur wenig über der Umgebungstemperatur und folgt deren Schwankungen (z.B. Fische, Reptilien). RGT-Regel (Reaktions-Geschwindigkeits-Temperatur-Regel): Auch als van't Hoff'sche Regel bezeichnet. Kennzeichnet die Zunahme des Energieumsatzes pro Zeiteinheit mit zunehmender Temperatur. 31 Körpertemperatur homoiothermer Lebewesen: Zwischen 36°C und 39°C unabhängig von den Unterschieden der Körpergröße. Bezogen auf die Gewichtseinheit ist dabei jedoch der Energieumsatz z.B. bei der Maus erheblich größer als der des Elefanten. Bei gegebener Temperaturdifferenz zwischen Körperinnerem und Umgebung ist der Wärmeabstrom pro Gewichtseinheit um so größer, je größer das Oberflächen-Volumen-Verhältnis ist. Dieses nimmt mit zunehmender Körpergröße ab, so daß die Energieumsatzrate/Gewichtseinheit geringer werden kann. Körpertemperatur des Menschen: Die oberflächennahen Teile des Körpers haben eine niedrigere Temperatur als die zentralen. In den Extremitäten bildet sich ein Temperaturgefälle in Längsrichtung aus (z.B. relativ warmer Oberarm und kalte Hände), daneben besteht ein Temperaturgefälle senkrecht zur Oberfläche. Die durch äußere Temperaturänderungen hervorgerufenen Schwankungen der Körpertemperatur sind groß nahe der Körperoberfläche (Körperschale) und gering im Körperinneren (Körperkern). Repräsentative Meßstellen für die Körperkerntemperatur: Rektum (normal ca. 37°C), Mundhöhle unter der Zunge (ca. 0,2 - 0,5°C tiefer als Rektaltemperatur), Axillartemperatur (Größenordnung wie bei Oraltemperatur). Eine absolut feste Körperkerntemperatur gibt es nicht, da diese tagesrhythmischen Schwankungen (ca. 1°C) unterliegt. Bei körperlicher Arbeit kann Kerntemperatur bis zu 2°C ansteigen. Wärmebildung: Thermoregulatorische Wärmebildung wird ausgelöst, sobald die Umgebungstemperatur die untere Grenze der thermischen Indifferenzzone (= 28°C - 32°C) unterschreitet. Mechanismen: (1) aktive Betätigung des Bewegungsapparates, (2) unwillkürliche tonische oder rhythmische Muskelaktivität (Kältezittern), (3) Steigerung von Stoffwechselvorgängen (zitterfreie Wärmebildung). Wärmeabstrom: Wärmetransport vom Körperinneren zur Körperoberfläche (= innerer Wärmestrom) wird durch Veränderung der peripheren Durchblutung geregelt. Der äußere Wärmestrom (= Wärmetransport von der Körperoberfläche zur Umgebung) läßt sich in folgende Teilströme aufgliedern: (1) Wärmeabstrom durch Leitung = Konduktion (z.B. Sitzen auf kalten Steinen), (2) Wärmeabstrom durch Konvektion (Wärmebewegung durch Luftmassentransport), (3) Wärmeabstrom durch Strahlung (abhängig vom Temperaturgefälle zwischen Haut und Umgebung), (4) Wärmeabstrom durch Evaporation = Verdunstung (Schwitzen ist wichtigster Mechanismus. Bei Verdunstung von 1 l Schweiß werden dem Körper 580 kcal entzogen). Steuerung der Wärmebildung und Wärmeabgabe: Im wesentlichen auf nervalem Wege: (1) motorisches Nervensystem (Kältezittern zur Wärmebildung), (2) sympathisches Nervensystem (Steuerung der Durchblutung und damit des inneren Wärmestroms über noradrenerge sympathische Nerven), (3) sympathische Innervation der Schweißdrüsen (Steuerung des äußeren Wärmestroms durch cholinerge (Ausnahme!) sympathische Nervenfasern). Fieber: Zentrale Sollwertverstellung der Körpertemperatur (Hypothalamus), wodurch die Temperatur auf ein erhöhtes Niveau eingeregelt wird. Fieberanstieg durch Steigerung der Wärmebildung (Schüttelfrost) und Drosselung der Wärmeabgabe (Vasokonstriktion der peripheren Gefäße). Fieberabfall durch Schweißsekretion und Vasodilatation (Erhöhung des äußeren und inneren Wärmeabstroms). Fieber wird durch Pyrogene (z.B. Stoffe von Bakterienmembranen) hervorgerufen, die ihrerseits die Leukozyten zur Produktion eines fiebererzeugenden Stoffes (Leukozyten-Pyrogen) anregen. 32 Hyperthermie: Wärmestauung durch Überlastung der Kapazität der Wärmeabgabemechanismen. Temperaturen über 42°C werden nicht überlebt. Dabei kommt es zu Schädigungen des Gehirns mit Desorientiertheit und Krämpfen (umgangssprachlich mit Sonnenstich oder Hitzschlag bezeichnet, zu unterscheiden vom Hitzekollaps, der durch extreme Vasodilatation mit Blutdruckabfall gekennzeichnet ist und eine Kreislaufstörung darstellt). Hypothermie: Abnahme der Kerntemperatur durch Überlastung der Kälteabwehrvorgänge. Bei 26°C 28°C kann der Tod durch Herzflimmern eintreten. Ernährung Bestandteile der Nahrungsmittel: Nährstoffe, Vitamine, Salze, Spurenelemente, Gewürzstoffe, Ballaststoffe und Wasser. Nährstoffe: Energiereiche Stoffgruppen der Eiweiße, Fette und Kohlenhydrate. Sie werden im Stoffwechsel des Organismus zu energieärmeren Substanzen abgebaut und dienen somit als Energiespender. Brennwert der Nährstoffe: Eiweiße 4,1, Kohlenhydrate 4,1 und Fette 9,3 kcal/g. Brennwert von Alkohol 7,1 kcal/g. Spezifisch-dynamische Wirkung: Steigerung des Energieumsatzes nach Nahrungsaufnahme, besonders hoch nach Eiweißzufuhr. Eiweiße: Bestehen aus Aminosäuren und dienen dem Baustoffwechsel. Essentielle Aminosäuren (kann der Körper nicht synthetisieren) müssen aufgenommen werden. Tierisches Eiweiß: Fleisch, Fisch, Milch, Eier. Pflanzliches Eiweiß: Brot und Kartoffeln. Fette: Sind Ester des Glyzerins mit verschiedenen Fettsäuren. Sie dienen dem Betriebsstoffwechsel und als Energiespeicher (Depotfett im Gewebe). Bei den Fettsäuren werden gesättigte und ungesättigte unterschieden, wobei letztere z.T. essentiell sind. Tierische Fette: Fleisch, Fisch, Milch, Eier. Pflanzliche Fette: Pflanzensamen (Nüsse) mit hohen Anteilen an ungesättigten Fettsäuren. Kohlenhydrate: Monosaccharide (Glukose, Fruktose), Disaccharide (Malzzucker = Maltose, Milchzucker = Laktose, Rohrzucker = Saccharose) und Polysaccharide (pflanzliche Stärke). Sie dienen dem Betriebsstoffwechsel und werden im Organismus als Glykogen gespeichert (Muskulatur, Leber). Kohlenhydrate fast ausschließlich pflanzlicher Herkunft: Obst, Gemüse, Kartoffeln, Getreide, etc. Vitamine: Lebenswichtige organische Substanzen, die der Organismus nicht synthetisieren kann. Sie sind häufig Bestandteile von Fermentsystemen. Sie kommen sowohl in Nahrungsmitteln pflanzlicher als auch tierischer Herkunft vor. Vitamingehalt sehr variabel, abhängig von Produktionsbedingungen, Lagerung und Zubereitung. 33 Salze: Dienen zusammen mit Wasser zur Aufrechterhaltung des inneren Milieus. Von besonderer Bedeutung sind die Kationen Natrium, Kalium, Calcium und Magnesium sowie die Anionen Chlorid und Phosphat. Spurenelemente: Elemente, die nur in äußerst geringen Mengen in der Nahrung und im Organismus vorkommen. Drei Gruppen werden unterschieden: (1) Elemente mit bekannter physiologischer Funktion (z.B. Eisen für Hämoglobin, Jod für Schilddrüsenhormone), (2) Elemente mit toxischer Wirkung (z.B. Blei, Cadmium, Quecksilber), (3) Elemente, deren Entbehrlichkeit bewiesen ist (z.B. Aluminium, Silber). Gewürzstoffe: Verschiedene Duft- und Aromasubstanzen, die für den Geruch und Geschmack maßgeblich sind. Ballaststoffe: Unverdauliche Bestandteile der Nahrung, z.B. Zellulose (aus Zellwänden der Pflanzen). Nährstoffbedarf: Zum einen abhängig vom Kalorienbedarf, zum anderen werden Mindestmengen an Eiweißen, Fetten und Kohlenhydraten benötigt. Das funktionelle Eiweißminimum liegt bei 1 g/kg Körpergewicht täglich (Mangel führt zu Ödemen). Mindestbedarf an Fetten beruht auf dem Bedarf an essentiellen Fettsäuren, zudem können die fettlöslichen Vitamine nur bei Anwesenheit von Fett resorbiert werden. Mindestbedarf an Kohlenhydraten durch Gehirnstoffwechsel bedingt, der fast ausschließlich auf Glukose angewiesen ist. Wasserbedarf: Mindestmenge 1750 ml/Tag (bei 70 kg): Trinkmenge 650 ml, Wasseranteil in der festen Nahrung 750 ml und 350 ml Oxydationswasser (wird bei der biologischen Verbrennung erzeugt). Wasserverluste (Dehydration) von mehr als 20 % des Körpergewichts führen zum Tod. Bei Zufuhr großer Mengen hyotoner Lösungen oder größeren Salzverlusten entsteht Wasserintoxikation (Einstrom von Wasser in den intrazellulären Raum ---> Ödeme, Kopfschmerzen, Übelkeit und Krämpfe deuten auf Hirnödem). Siehe auch Niere und Wasserhaushalt. Ausgewogene Kost: Muß 4 Kriterien erfüllen: (1) Brennwert muß dem kalorischen Bedarf entsprechen, (2) Mindestmengen an Eiweißen, Fetten und Kohlenhydraten müssen enthalten sein, (3) Mindestmengen an Vitaminen, Salzen und Spurenelementen müssen vorhanden sein, (4) die toxischen Grenzen (Salze, Vitamine, Spurenelemente) dürfen nicht überschritten werden. Nährstoffrelation für Eiweiß, Fett und Kohlenhydrate = 1 : 1 : 4 (in Gewichtsanteilen). Funktionen des Magen-Darm-Kanals Aufgaben des Gastrointestinaltraktes: Verdauung und Resorption. Durch die Einwirkung von Enzymen und Verdauungssäften werden die Nährstoffe hydrolytisch gespalten und in resorbierbare Bruchstücke zerlegt (Verdauung). Die Endprodukte der Verdauung werden aus dem Darmlumen durch die Darmschleimhaut hindurch in das Blut und die Lymphe aufgenommen (Resorption). Aufbau des Magen-Darm-Kanals: Glatte Muskulatur: Äußere Längsmuskelschicht, mittlere Ringmuskelschicht und Längsmuskelfasern in der Submucosa. Das Innere des Kanals ist durch 34 Schleimhaut (Mucosa) ausgekleidet. Zwischen den Muskelschichten liegen Ganglienzellen, die vom Vagus versorgt werden (Umschaltung von prae- auf postganglionär). Transport der Nahrung geschieht durch Peristaltik (wellenförmige Kontraktion der Ringmuskulatur). Durchmischung des Speisebreis durch Segmentationsbewegungen (Kontraktion der Ringmuskulatur an benachbarten Stellen). Bildung der Verdauungssäfte: Speicheldrüsen, Magendrüsen, Darmdrüsen, Bauchspeicheldrüse, Leberzellen. Innervation hauptsächlich durch den Parasympathikus (Vagus). Weitere Beeinflussung durch gastrointestinale Hormone, deren Freisetzung überwiegend durch Verdauungsprodukte ausgelöst wird. Mundspeichel: Gebildet in den Ohr-, Unterkiefer- und Unterzungenspeicheldrüsen. Funktion: Enthält Amylase zur Kohlenhydratspaltung, Verdünnung der Speisen. Sekretionssteigerung unmittelbar reflektorisch (Erregung von Geruchs-, Geschmacks- und Berührungsrezeptoren) und durch bedingte Reflexe. Schluckreflex: Reflexzentrum in der Medulla oblongata. Auslösung durch Berührung der Gaumenbögen, des Zungengrundes oder der Rachenhinterwand. Die Speisen müssen den Atemweg kreuzen, bevor sie in den Oesophagus (Speiseröhre) gelangen. Dabei wird der NasenRachen-Raum durch das Gaumensegel und die Luftröhre durch den Kehldeckel verschlossen. Magen: Funktion: Reservoir, Durchmischung des Speisebreis mit Magensaft. Die Durchmischung ergibt den Chymus. Regulation der Magenmotorik durch intramurale Ganglien (zwischen den Muskelschichten), Vagus und gastrointestinale Hormone (Gastrin = Steigerung der Motilität, Secretin = Hemmung der Motilität). Magensaft: Die Magendrüsen produzieren 2 - 3 l/Tag. Hauptzellen bilden Pepsinogen (wird durch HCl in Pepsin überführt, das Eiweiße spaltet) und Belegzellen bilden die Salzsäure (HCl). Außerdem enthält der Magensaft Mucin (Magenschleim) und den Intrinsic-Factor (Glykoproteid, das für die Resorption von Vitamin B12 erforderlich ist; bei Fehlen des Faktors perniziöse Anämie). Regulation der Magensaftsekretion: (1) Cephalische Sekretionsphase: Eingeleitet durch bedingte Reflexe (Versuche von Pawlow am Hund). Fortgesetzt durch reflektorische Sekretion (Erregung der Geschmacks- und Geruchsrezeptoren). Bedingte Reflexe und reflektorische Sekretion werden über den Vagus vermittelt, der Acetylcholin freisetzt, das Beleg- und Hauptzellen stimuliert. Außerdem bewirkt Acetylcholin eine Freisetzung von Gastrin aus den G-Zellen des unteren Magenabschnitts, was die Belegzellen über den Blutweg weiter stimuliert. (2) Gastrale Sekretionsphase: Durch Verdauungsprodukte werden Rezeptoren in der Schleimhaut erregt, die ihrerseits die G-Zellen zur Gastrinfreisetzung anregen. (3) Intestinale Sekretionsphase: Tritt noch nicht hinreichend saure Nahrung in das Duodenum (Zwölffingerdarm) über, so kommt es zur Freisetzung des Hormons Entero-Oxyntin im Duodenum, das die Magensaftsekretion anregt. Tritt später saurer Chymus über, so wird die Magensaftsekretion durch Secretin aus der Duodenalschleimhaut gehemmt. Emotionale Erregungen können die Magensaftsekretion beeinflussen: Hypersekretion bei Ärger und Zorn, Hyposekretion bei Angst oder Traurigkeit. 35 Ulkus: Geschwüre im Magen und Duodenum. Gefährlich wegen Blutungsgefahr. Bedingt durch ein Ungleichgewicht zwischen aggressiven Faktoren (HCl, Pepsin) und protektiven Faktoren (Erneuerung des Schleimhautepithels, gute Durchblutung, Schleim). Bei ca. 80 % der Patienten ist eine Infektion mit Helicobacter pylori nachweisbar, welche die protektiven Faktoren schwächt. Dünndarm: Funktion: Durchmischung des sauren Chymus mit den alkalischen Sekreten des Pankreas, der Leber und der Darmdrüsen. Hier wird der Hauptteil der Verdauung bewältigt und die Resorption durchgeführt. Pankreassaft (Bauchspeichel): Vom exokrinen Anteil des Pankreas gebildet, ca. 1,5 - 2,0 l/Tag. Der Bauchspeichel ist durch die hohe Bicarbonatkonzentration alkalisch und enthält folgende Enzyme: Trypsin und Chymotrypsin (Eiweißspaltung), Pankreaslipase (Abbau von Fetten), Pankreasamylase (Abbau von Kohlenhydraten) und Nucleasen (Abbau von Nucleinsäuren). Regulation der Pankreassekretion: Die Sekretion wird während der cephalischen Phase über den Vagus reflektorisch eingeleitet. Der Hauptteil der Sekretion erfolgt nach dem Übertritt von Chymus in das Duodenum durch die Freisetzung der gastrointestinalen Hormone Secretin und Cholecystokinin die in der Schleimhaut des Duodenums gebildet werden und auf dem Blutwege das Pankreas erreichen. Secretin bewirkt ein großes Saftvolumen mit viel Bicarbonat und wenig Enzymen. Cholecystokinin löst Sekretion eines stark enzymhaltigen Saftes aus und bewirkt außerdem eine Entleerung der Gallenblase. Leber: Wichtigstes Stoffwechselorgan des Organismus. Bildet außerdem in den Leberzellen die Galle, die in die Gallenkapillaren sezerniert wird. Die Gallenkapillaren vereinigen sich über immer größer werdende Gänge zum Ductus hepaticus. Von diesem fließt die Galle entweder über den Ductus cysticus in die Gallenblase (Konzentration und Speicherung der Galle) oder unmittelbar in den Ductus choledochus, der in das Duodenum mündet. Die Galle wird kontinuierlich erzeugt (0,5 - 1,0 l/Tag) und enthält Gallensäuren (Verdauung von Fetten) und Gallenfarbstoffe (Abbauprodukte des Hämoglobin). Dickdarm (Colon): Der vom Dünndarm in das Colon weitergegebene Inhalt wird hier durch die Resorption von Wasser eingeengt. Im Colon befinden sich Bakterien (Darmflora). Weiterhin werden hier Elektrolyte und Vitamine resorbiert. Die Farbe des Stuhles wird durch abgebaute Gallenfarbstoffe bestimmt. Mastdarm (Rectum): Füllung des Rectums führt zur Stuhlentleerung. Stuhldrang wird durch die Erregung von Dehnungsrezeptoren vermittelt, deren Impulse in das Reflexzentrum im Sacralmark weitergeleitet werden. Das Reflexzentrum steht etwa ab dem 2. Lebensjahr unter der Kontrolle des Großhirns. Die efferenten Impulse gelangen über den Parasympathikus zum inneren glatten Schließmuskel und vermindern dessen Tonus. Bei der Darmentleerung wird dann auch der äußere quergestreifte Schließmuskel willkürlich entspannt und die Bauchmuskulatur zur Unterstützung des Stuhlgangs kontrahiert (Bauchpresse). Verdauung: Spaltung der Nahrungsbestandteile durch Enzyme der Verdauungssäfte. Dabei entstehen aus den Eiweißen Aminosäuren, aus den Kohlenhydraten Monosaccharide und aus den Fetten Glyzerin und Fettsäuren. Resorption: Bei der Resorption werden Substanzen aus dem Darmlumen in das Körperinnere (Darmepithelzelle, Interstitium, Lymphe und Blut) aufgenommen. Dabei spielen neben passiven 36 Prozessen (Diffusion, Osmose) vor allem auch aktive, energieverbrauchende Transportvorgänge eine Rolle. Dabei scheinen in der äußeren Zellmembran der Enterozyten lokalisierte Trägersysteme (Carrier) eine Rolle zu spielen, indem Carrier-Substratkomplexe gebildet werden und auf der Gegenseite der Membran die Komplexe wieder gelöst werden. Eine andere Form des aktiven Transports ist die Pinozytose (Bläschentransport). Neben diesem aktiven transzellulären Transport spielt der passive, parazelluläre Transport eine noch größere Rolle. Dieser verläuft durch die Tight junctions (Kittleisten) benachbarter Enterozyten. Der Abtransport der resorbierten Substanzen erfolgt über Blut- und Lymphgefäße. Nierenfunktion Aufgabe der Nieren: Ausscheidungsorgan für die Endprodukte des Zellstoffwechsels (Harnstoff, Harnsäure, Kreatinin = alles harnpflichtige Substanzen), aufgenommene Fremdstoffe (z.B. Medikamente) und physiologische Bedarfsstoffe, sofern diese im Überschuß vorhanden sind. Die Nieren bewirken eine Konstanz der ionalen Zusammensetzung, der osmotischen Konzentration und des pH-Wertes der extrazellulären Flüssigkeit. Durch die Bildung von Renin sind die Nieren an der Kontrolle des extrazellulären Flüssigkeitsvolumens und des arteriellen Blutdrucks beteiligt. Nierenanatomie: Morphologische und funktionelle Einheit der Nieren ist das Nephron (ca. 1,2 Million/Niere). Es besteht aus dem Glomerulus (Nierenkörperchen) und dem Tubulus (Nierenkanälchen). Mehrere Tubuli münden in ein Sammelrohr ein. Der Glomerulus wird aus Kapillarschlingen sowie aus der Bowman'schen Kapsel des Tubulusepithels gebildet. Den Tubulus unterteilt man in den proximalen Tubulus, die Henle'sche Schleife und den distalen Tubulus. Letzterer berührt die zuführende Arteriole seines zugehörigen Glomerulus und bildet mit ihr den juxtaglomerulären Apparat (Ort der Reninbildung). Elementarprozesse der Harnbildung: Sie beginnt im Glomerulus, wo der Primärharn durch den glomerulären Filtrationsprozeß aus dem durchfließenden Blutplasma abgetrennt und in den Tubulus geleitet wird. Während der Passage durch den Tubulus und das Sammelrohr wird die Zusammensetzung durch transtubuläre Stofftransporte (Resorption und Sekretion) erheblich verändert. Zur Ausscheidung im Endharn (= Urin) gelangen Stoffe, die glomerulär filtriert und die tubulär sezerniert werden, vermindert um die Mengen, die tubulär resorbiert werden. Mechanismen der Harnbildung: Die glomeruläre Filtration beruht auf physikalischen Kräften (Filtrationsdruck) und den physikalischen Eigenschaften der Moleküle (vor allem Molekülgröße). Tubuläre Stofftransporte umfassen neben passiven Transportvorgängen (Diffusion) vor allem aktive Transportvorgänge, die Energie aus dem Stoffwechsel erfordern (aktive Resorptionsmechanismen für physiologische Bedarfsstoffe wie Natriumionen, Glukose, Aminosäuren etc.; aktiv sezernierte Stoffe, z.B. PAH). Renale Clearance eines Stoffes: Der Clearance-Wert gibt den Teil des renalen Plasmaflusses an, der pro Minute von dem betreffenden Stoff völlig befreit wird. Die Clearance stellt somit eine 37 Volumen-Klärrate (ml/min) dar. Zu ihrer Bestimmung benötigt man die Ausscheidungsrate des Stoffes in den Harn (Produkt aus Stoffkonzentration im Urin und dem Harnzeitvolumen) und seine Konzentration im arteriellen Plasma. Somit ist die Clearance der Ausscheidungsrate proportional und der Plasmakonzentration umgekehrt proportional. Der Nierenplasmafluß stimmt mit der PAH-Clearance (PAH = p-Aminohippursäure) weitgehend überein. Dieser Stoff wird also während einer einzigen Nierenpassage fast vollständig aus dem Plasma eliminiert. Der glomerulären Filtrationsrate entspricht die Inulin-Clearance (ein Polysaccharid). Inulin wird nur durch Filtration ausgeschieden und tubulär weder resorbiert noch sezerniert. Diese Clearance-Werte dienen zur Beurteilung der Nierenfunktion. Nierenkreislauf: Die Durchblutung beider Nieren beträgt etwa 25 % des Herzzeitvolumens in Ruhe. Die Nierendurchblutung kann mit Hilfe der PAH-Clearance (Nierenplasmafluß) und dem Hämatokritwert errechnet werden. An den allgemeinen Kreislaufregulationen nimmt der Nierenkreislauf kaum Teil. Der mittlere arterielle Blutdruck kann zwischen 80 und 180 mmHg schwanken, ohne daß sich die Nierendurchblutung ändert (Autoregulation durch abgestufte Einstellung des Strömungswiderstandes, dadurch konstante glomeruläre Filtrationsrate). Glomerulärer Filtrationsprozeß: Das glomeruläre Filter wird von 20 - 40 Kapillarschlingen und dem sie umkleidenden inneren Blatt der Bowman'schen Kapsel gebildet. Diese Glomerulusmembran besteht aus dem Endothel der Kapillaren, der Basalmembran und dem inneren Blatt. Die Moleküldurchlässigkeit wird im wesentlichen von dem inneren Blatt der Bowman'schen Kapsel, die sog. Filtrationsschlitze aufweist, bestimmt. Unter der glomerulären Filtrationsrate versteht man das pro Zeiteinheit von den Nieren gebildete Filtratvolumen (Primärharn). Sie beträgt ca. 120 ml/min und kann mit der Inulin-Clearance bestimmt werden. Das Filtrat enthält die im Blutplasma gelösten Bestandteile nach Maßgabe ihrer Filtrierbarkeit. Tubuläre Transportprozesse: Die Transporte einzelner Stoffe im Tubulus sind auf bestimmte Abschnitte begrenzt. Im proximalen Tubulus werden Glukose, Aminosäuren, filtriertes Protein, Sulfat- und Phosphationen, Elektrolyte und Wasser resorbiert, sowie organische Säuren (z.B. PAH) sezerniert. Alle Stofftransporte zeichnen sich durch ein tubuläres Transportmaximum aus, d.h., daß von diesen Stoffen in der Zeiteinheit jeweils nur eine definierte Maximalmenge von den Nieren resorbiert oder sezerniert werden kann. Im distalen Tubulus werden lediglich Elektrolyte und Wasser resorbiert sowie Ammoniak und Wasserstoffionen sezerniert. Aldosteron (Mineralocorticoid der Nebennierenrinde) erhöht die tubuläre Natrium-Resorption sowie die Kalium- und Wasserstoffionen-Sekretion. Das ADH (antidiuretisches Hormon syn. Adiuretin, im Hypothalamus gebildet und im Hypophysenhinterlappen freigesetzt) erhöht die Wasserdurchlässigkeit im distalen Tubulus und im Sammelrohr. Dadurch wird der Urinfluß vermindert (Antidiurese) und der Urin hypertonisch. Fehlt ADH (z.B. beim Diabetes insipidus), so ist die Diurese gesteigert, wobei ca. 25 l/Tag hypotonischen Urins ausgeschieden werden können. Resorption der Glukose: Das tubuläre Transportmaximum läßt sich anhand des Glukosetransportes erläutern. Obwohl Glukose glomerulär uneingeschränkt filtriert wird, ist normalerweise der Urin glukosefrei. Demnach wird Glukose tubulär vollständig resorbiert. Glukose erscheint erst im Harn (Glukosurie), wenn im Plasma die Schwellenkonzentration von etwa 180 mg/100 ml überschritten wird (bei Zuckerkrankheit = Diabetes mellitus). 38 Regulation der extrazellulären Flüssigkeit durch die Nieren: (1) Osmotische Konzentration: Wasserverlust = Anstieg der osmotischen Konzentration ---> Registrierung durch Osmorezeptoren im Hypothalamus ---> ADH-Freisetzung und Durstgefühl --> Antidiurese und Trinken. Wasserüberschuß = Abfall der osmotischen Konzentration z.B. durch starkes Trinken ---> Osmorezeptoren ---> Hemmung der ADH-Freisetzung ---> Wasserdiurese. (2) Volumenregulation: Extrazelluläre Flüssigkeit besteht aus interstitieller Flüssigkeit und Blutplasma. Änderungen ihres Volumen führen deshalb auch zu Veränderungen des Blutvolumens und damit zur Umstellung der Kreislaufregulation. Bei vermehrtem Blutvolumen (Hypervolämie) gibt es zwei Mechanismen zur Volumenregulation: (a) Vermehrtes Blutangebot ---> Erhöhung des Herzzeitvolumens ---> Anstieg des arteriellen Blutdrucks ---> Druckdiurese (vermehrte Urinausscheidung durch blutdruckbedingte Zunahme der Nierenmarkdurchblutung mit Beeinträchtigung des Urinkonzentrierungsmechanismus). (b) Vermehrtes Blutangebot ---> Volumenrezeptoren im venösen System ---> Meldung auf nervalem Wege zum Hypothalamus ---> Hemmung der ADH-Freisetzung ---> Wasserdiurese. Bei vermindertem Blutvolumen (Hypovolämie) gibt es - abgesehen von den kreislaufregulatorischen Effekten auf Herz, Gefäße und Nebennierenmark - ebenfalls zwei Mechanismen der Volumenregulation: (a) Vermindertes Blutangebot ---> Erniedrigung des Herzzeitvolumens ---> Abfall des arteriellen Blutdrucks ---> Aktivierung des juxtaglomerulären Apparates (druckempfindlicher Mechanismus) ---> Reninfreisetzung (eiweißspaltendes Enzym) --> Umwandlung von Angiotensinogen in Angiotensin (starke vasokonstriktorische Substanz) ---> Anstieg des arteriellen Blutdrucks. Gleichzeitig durch Angiotensin bedingt ---> Freisetzung von Aldosteron ---> erhöhte Natrium- und damit Wasserresorption ---> positive Flüssigkeitsbilanz (= Renin-Angiotensin-Aldosteron-Mechanismus). (b) Vermindertes Blutangebot ---> Volumenrezeptoren im venösen System ---> Meldung auf nervalem Wege zum Hypothalamus ---> ADH-Freisetzung und Durst ---> Antidiurese und Trinken (sog. Gauer-Henry-Reflex). Niereninsuffizienz: Entsteht durch Schädigung von mehr als 60 % der Nephrone. Dabei können die harnpflichtigen Substanzen nicht mehr ausgeschieden werden (Urämie). Harnkonzentrierung und -verdünnung ist nicht mehr möglich. Ursachen der Niereninsuffizienz: Akutes Nierenversagen durch Schockzustände (Minderung der Nierendurchblutung), Vergiftungen, Transfusionszwischenfälle, etc.; chronisches Nierenversagen durch Nierenentzündungen. Wasserhaushalt: Unter normalen Bedingungen besteht ein Gleichgewicht zwischen Aufnahme und Abgabe. Wasseraufnahme: 1,2 l Trinkmenge + 0,85 l Wasser aus fester Nahrung + 0,35 l Oxydationswasser = 2,4 l/Tag. Wasserabgabe: 1,4 l Urin + 0,1 l Ausscheidung mit dem Stuhl + 0,9 l durch Verdunstung über Atemluft und Haut (Perspiratio insensibilis) = 2,4 l/Tag. 39 Allgemeine Endokrinologie Endokrines System: Eng mit dem Nervensystem verknüpft. Erfüllt seine Funktion mittels Hormonen, die in den endokrinen Drüsen (= Drüsen ohne Ausführungsgang) gebildet und auf dem Blutweg zu den Organen transportiert werden. Hier entfalten die Hormone spezifische Wirkungen (Wirkungen, die von keinem anderen Stoff hervorgerufen werden können) an den Erfolgsorganen. Funktionelle Bedeutung der Hormone: (1) Förderung der körperlichen und geistigen Entwicklung. (2) Leistungsanpassung des Organismus (physiologische Adaptation bei erhöhter Belastung). (3) Homöostatische Funktion (Konstanthaltung bestimmter physiologischer Größen, z.B. osmotischer Druck). Hormone steuern biochemische Prozesse und wirken in sehr kleinen Konzentrationen. Als Glieder von Regelkreisen nehmen sie entweder die Position eines Stellgliedes oder die Position der Regelgröße ein: (1) Hormone als Stellglieder (z.B. osmotischer Druck des Blutes): Regelgröße ist der osmotische Druck, der konstant gehalten werden muß. Kommt es durch Störgrößen (z.B. Wasseraufnahme) zu Abweichungen, so werden diese durch Osmorezeptoren des Hypothalamus (Meßwerk) an den zentralen Regler, der den Sollwert überwacht (ebenfalls Hypothalamus) weitergeleitet. Der Regler setzt nun proportional zur Abweichung vom Sollwert das Hormon Adiuretin frei, das seinerseits als Stellgröße auf das Stellglied (Niere) einwirkt. (2) Hormone als Regelgrößen (z.B. Thyroxin): Regelgröße ist der Thyroxinspiegel, der konstant gehalten werden muß. Vermehrter Thyroxinverbrauch unter Belastung (Störgröße) ---> Thyroxinrezeptoren in der Adenohypophyse (Meßwerk) ---> Regler in Hypophyse bzw. Hypothalamus ---> Ausschüttung von TSH (Stellgröße) ---> vermehrte Thyroxinproduktion in der Schilddrüse (Stellglied). Gruppierung der Hormone nach der Funktionsweise: (1) Effectorische Hormone: Wirken unmittelbar auf Erfolgsorgane ein, z.B. Sexualhormone. (2) Trope oder glandotrope Hormone: Bewirken Bildung und Freisetzung der unter (1) zusammengefaßten Hormone, z.B. TSH (Thyreotropes Hormon). (3) Releasing- und Release-inhibiting Hormone: Werden von den Nervenzellen des Hypothalamus gebildet und steuern die Bildung und Freisetzung der Hormone der Adenohypophyse. Über diese Hormone erfolgt die Ankopplung des endokrinen Systems an das ZNS. Gruppierung der Hormone nach Rezeptortypen: Die Zellen der Erfolgsorgane besitzen spezifische Rezeptoren, die mit dem entsprechenden Hormon einen Hormonrezeptorkomplex bilden. (1) Zytoplasmatische Rezeptoren im Zellinnern für Hormone aus der Lipidgruppe. (2) Rezeptoren an der Zellmembran für Hormone aus der Protein- und Peptidgruppe. (3) Rezeptoren im Zellkern für die Schilddrüsenhormone. Wirkungsmechanismen der Hormone: Da die Hormonrezeptorkomplexe entweder an der Zellmembran oder in der Zelle entstehen, lassen sich zwei Wirkmechanismen unterscheiden. Der intrazelluläre Komplex kann direkt die Expression genetischer Information beeinflussen und somit auf die Syntheseleistung der Zelle (z.B. Proteinsynthese) direkten Einfluß nehmen. Bei einem 40 zellmembranständigen Komplex ist dagegen ein zweiter intrazellulärer Botenstoff (second messenger, z.B. cAMP = cyclisches Adenosinmonophosphat) notwendig, um die Aktivität der Zelle zu beeinflussen. Untersuchungsmethoden: (1) Studium der Ausfallserscheinungen nach Zerstörung eines Organs, in dem man eine Hormonbildung vermutet. (2) Substitutionsexperiment: Zufuhr von Extrakten, die aus dem zerstörten Organ gewonnen wurden. Ausfallserscheinungen müssen - sofern es sich wirklich um ein Hormon handelt danach verschwinden. (3) Überdosierungsexperiment: Zufuhr von Hormonen beim intakten Tier. Wichtig für die Analyse von Funktionsstörungen bei krankhafter Überfunktion einzelner Hormondrüsen. Substitutionstherapie: Im Falle einer unzureichenden Funktion einer endokrinen Drüse müssen die Hormone von außen zugeführt werden. Bei Proteohormonen (Eiweißhormonen) muß die Zufuhr parenteral (also nicht über den Magen-Darm-Trakt) erfolgen, da diese bei peroraler Zufuhr (über den Magen-Darm-Trakt) abgebaut würden (z.B. intravenös, intramuskulär). Da zahlreiche Hormone nicht artspezifisch sind, können Extrakte aus den Drüsen von Tieren verwendet werden. Hypothalamisch-hypophysäres System Gliederung des Systems: (1) Nuclei supraopticus und paraventricularis des Hypothalamus und Neurohypophyse (Hypophysenhinterlappen = HHL). (2) Hypophysiotrope Zone des Hypothalamus und Adenohypophyse (Hypophysenvorderlappen = HVL). Neurohypophyse und zugeordnete Hypothalamuskerne: Die Hormone Adiuretin (syn. Vasopressin) und Oxytocin werden in den Nervenzellen des Nucleus supraopticus und des Nucleus paraventricularis gebildet. Diese Hormone werden in Form von Granula innerhalb der zugehörigen Neuriten der Nervenzellen zu den Kapillaren des HHL geleitet und in die Kapillaren abgegeben. Die Neuriten der neurosekretorischen Zellen bilden den Tractus hypothalamohypophyseus, der einen Teil des Hypophysenstiels darstellt. Zur Freisetzung der Hormone kommt es durch Erregung der neurosekretorischen Zellen. Adiuretin (syn. Vasopressin): Hemmt die Diurese (siehe Niere). Bei Ausfall des Hormons Diabetes insipidus. Dabei können Urinmengen zwischen 5 und 15 l/24 Std. ausgeschieden werden (insipidus = nicht süß schmeckend, im Gegensatz zu mellitus = süß schmeckend). In höheren Konzentrationen hat Adiuretin einen butdrucksteigernden Effekt, der ursprünglich einem eigenen Hormon (Vasopressin) zugeschrieben wurde. Natürlicher Reiz für die Adiuretinsekretion ist die Erregung von Osmorezeptoren im Hypothalamus bei Ansteigen des osmotischen Drucks. 41 Oxytocin: Bewirkt bei Tier und Mensch rhythmische Kontraktionen des Uterus. Gegen Ende der Schwangerschaft wird die Muskulatur des Uterus durch die Wirkung von Östrogen besonders sensibel für Oxytocin. Da der HHL nun vermehrt Oxytocin ausschüttet, kommt es zu Kontraktionen, die den Fetus in Richtung Scheide drücken. Die zunehmende Dehnung der Gewebe führt zur nervalen Rückmeldung an den Hypothalamus und damit zur weiteren Oxytocin-Produktion, wobei sich der Prozeß zur Wehentätigkeit aufschaukelt. Ferner bewirkt das Hormon eine Kontraktion der Milchgänge der Brustdrüse (Milchejektionsreflex). Natürlicher Reiz für die Sekretion ist der Saugreiz an der Brustwarze. Von dieser gehen mechanosensible afferente Bahnen zum Hypothalamus, wo die Verbindung zu den neurosekretorischen Zellen, die das Oxytocin bilden, hergestellt wird (nerval-hormonaler Reflexbogen). Adenohypophyse und hypophysiotrope Zone des Hypothalamus: Von Nervenzellen im Bereich der hypophysiotropen Zone werden die Releasing-Hormone gebildet, die ihrerseits die Sekretion der Adenohypophysen-Hormone steuern. Die Releasing-Hormone gelangen über das Pfortadersystem der Hypophyse (auf dem Blutweg) zu den Hormonbildungszellen der Adenohypophyse. Einteilung der Releasing-Hormone: Stimulierende Releasing-Hormone (RH): (1) TRH = Thyreotropin-RH ---> TSH (2) LHRH = Luteinisierendes Hormon-RH ---> LH und FSH (3) CRH = Corticotropin-RH ---> ACTH (4) GHRH = Growth Hormone-RH ---> GH (syn. STH) (5) PRH = Prolactin-RH ---> PRL (6) MSHRH = Melanocytes Stimulating Hormone-RH ---> MSH Inhibitorische Releasing-Hormone (IH): (1) GHIH = Growth Hormone-IH (Somatostatin) ---> GH (syn. STH) (2) MSHIH = Melanocytes Stimulating Hormone-IH ---> MSH (3) PIH = Prolactin-IH ---> PRL Alle Releasing-Hormone stellen Peptide mit oft geringer Anzahl von Aminosäuren dar, deren Struktur z.T. bereits aufgeklärt ist. Endorphine und Enkephaline: Kürzlich entdeckte Gruppe von Polypeptiden aus dem Hypothalamus bzw. der Hypophyse. Haben eine dem Morphin ähnliche Wirkung. Besetzen Membranrezeptoren von Nervenzellen, über die auch die exogen zugeführten Morphine zur Wirkung kommen („endogene Opiate“). Hormone der Adenohypophyse (Übersicht): Glandotrope Hormone: (1) FSH = Follikelstimulierendes Hormon (2) LH bzw. ICSH = Luteinisierendes Hormon, identisch mit Interstitial Cells Stimulating Hormone (3) TSH = Thyreotropin Stimulating Hormone, syn. Thyreotropes Hormon (4) ACTH = Adrenocorticotropes Hormon Effektorische Hormone: (1) GH (syn. STH) = Growth Hormone (Wachstumshormon), syn. Somatotropes Hormon (2) PRL (syn. LTH) = Prolactin, syn. luteotropes Hormon (3) MSH = Melanocytenstimulierendes Hormon 42 Die glandotropen Hormone entfalten ihre Wirkung durch Beeinflussung der peripheren endokrinen Drüsen. Die Hormone (1) und (2) werden als gonadotrope Hormone bezeichnet und steuern die Entwicklung der Keimdrüsen und der sekundären Geschlechtsmerkmale. FSH und LH (bzw. ICSH) sind bei weiblichen und männlichen Individuen identisch, sie stellen also geschlechtsunspezifische Hormone dar. TSH stimuliert das Wachstum der Schilddrüse und steuert die Bildung und Freisetzung von Schilddrüsenhormonen. ACTH beeinflußt das Wachstum und die Funktionsfähigkeit zweier der drei Schichten der Nebennierenrinde, der Zona fasciculata (Bildung des Cortisols) und der Zona reticularis (Bildung von androgenen Rindenhormonen = männliche Geschlechtshormone). Das Wachstum der dritten Schicht, der Zona glomerulosa (Bildung des Mineralocorticoids Aldosteron), bedarf kaum der Stimulierung durch ACTH (Aldosteron wird durch Angiotensin freigesetzt, siehe Niere). ACTH wird aus einem höhermolekularen sog. Präkursor enzymatisch abgespalten. Als weitere Spaltprodukte ergeben sich dabei ß-Endorphin (ein endogenes Opiat) und MSH (Melanocytenstimulierendes Hormon). Die Zellen, in denen der Präkursor im HVL gebildet wird, bezeichnet man als Proopiomelanocortinzellen (POMC-Zellen). Wachstumshormon (Growth Hormone = GH): Im Gegensatz zu den meisten Hormonen ist es artspezifisch. Zum therapeutischen Einsatz beim Menschen muß daher menschliches GH (aus Leichenhypophysen oder gentechnisch hergestellt) verwendet werden. Die Wachstumswirkung läßt sich auf eine Förderung der Verknöcherung, die die Grundlage des Längenwachstums der Knochen ist, zurückführen. Die Epiphysenfugen werden durch GH verbreitert. Wenn nach Abschluß der Pubertät unter Einwirkung der Androgene eine Verknöcherung der knorpeligen Epiphysenfuge eingetreten ist, hat GH keinen Einfluß mehr auf das Längenwachstum. Die Wirkung des GH auf das Knochenwachstum erfolgt nicht direkt, sondern über die Stimulation von Leberfaktoren, den Somatomedinen. Hypophysärer Riesenwuchs: Überschüssige Produktion von GH im jugendlichen Alter, meist durch Adenom (Geschwulst) der acidophilen Zellen des HVL, in denen GH gebildet wird. Das Wachstum ist proportioniert. Hypophysärer Zwergwuchs: Fehlen des GH im Kindesalter. Körpergröße oft nur 100 cm. Körperproportionen normal, im Gegensatz zum hypothyreotischen Zwergwuchs. Akromegalie: Überproduktion von GH im Erwachsenenalter meist durch Adenom der acidophilen Zellen des HVL. Plumpe Deformierungen und Verdickungen der Knochen, insbesondere Vergrößerung der Nase, des Kinns, der Hände und Füße. Oft auch Schädigung des Sehnerven durch Tumorwachstum. Stoffwechselwirkungen des GH: (1) Mobilisierung von Fettsäuren aus den Fettgeweben zur Energiegewinnung. (2) Insulinähnlicher Effekt als kurzfristige Wirkung: Injektion von GH führt zu einer vorübergehenden Senkung des Glukosespiegels über Somatomedin C (Dauer ca. 1 Stunde). (3) Insulinantagonistischer Effekt als längerfristige Wirkung: Mehrere Stunden nach GHInjektion Steigerung der Glukosekonzentration im Plasma durch Einschmelzen der Glykogendepots und Erschwerung der durch Insulin geförderten Einschleusung von Glukose in die Zelle. Daher bei Zwergwuchs Neigung zu Hypoglykämie, bei Riesenwuchs zu Hyperglykämie (erhöhter Blutzuckerspiegel). 43 Steuerung der GH-Sekretion: Durch GHRH und GHIH (= Somatostatin), deren selektive Freisetzung vom limbischen System gesteuert wird. Die Plasmaspiegel von GH zeigen erhebliche Schwankungen, wobei auch eine endogene (circadiane) Rhythmik besteht. Ein Sekretionsgipfel tritt nachts auf und ist an die Tiefschlafphase (slow wave sleep) gebunden. Durch Senkung der Blutglukosekonzentration kommt es zu einem Anstieg der GH-Sekretion über hypothalamische Glukoserezeptoren. Prolactin: Bewirkt die Ingangsetzung und Aufrechterhaltung der Milchsynthese in der Brustdrüse der Frau. Steuerung der Prolactinsekretion: PIH (= Dopamin) bewirkt eine Inhibition der Synthese, PRH sowie Östrogen eine Förderung der Synthese von Prolactin. Reizung der Mechanorezeptoren in den Mamillen durch den Saugreiz führt nerval zur Ausschüttung von PRH im Hypothalamus. Erhöht sich der Prolactinspiegel im Blut wird vermehrt Dopamin im Hypothalamus produziert, wodurch wiederum die Prolactinsynthese vermindert wird. Dopamin wirkt gleichzeitig auch inhibitorisch an den LHRH-Zellen des Hypothalamus. Hierdurch wird die LH- und FSH-Produktion subnormal, und der Menstruationszyklus kann nicht mehr ablaufen (Lactationsamenorrhoe). Während der Stillzeit kommt es daher in der Regel nicht zu einer Konzeption. Melanocytenstimulierendes Hormon (MSH): Bewirkt Zunahme der Pigmentierung der Haut, die durch Ausbreitung des Melanins innerhalb der Pigmentzellen (Melanocyten) zustande kommt. Hat beim Menschen nur im Rahmen des Morbus Addison (Bronzehautkrankheit) Bedeutung. Dabei ist die Nebennierenrinden-Hormonproduktion durch Zerstörung der Rinde verringert und die ACTH-Produktion entsprechend erhöht. Da bei der ACTH-Produktion MSH äquimolar mit ausgeschüttet wird, erfolgt eine stärkere Pigmentierung. Nebennierenrinde und Glucocorticoide Hormone der Nebennierenrinde (NNR): In der NNR finden sich zahlreiche Steroidderivate (Abkömmlinge des Sterans, einem Molekül aus 4 Ringen; Lipidhormone), die als Corticosteroide bzw. Corticoide bezeichnet werden. Drei Gruppen lassen sich unterscheiden: (1) Glucocorticoide (Cortisol und Corticosteron): Beeinflussen den Stoffwechsel der Proteine, Kohlenhydrate und Lipide (Fette). Werden in der Zona fasciculata gebildet. (2) Mineralocorticoide (Aldosteron): Beeinflussen den Transport von Elektrolyten und damit die Verteilung des Wassers in den Geweben. Bildungsort: Zona glomerulosa. (3) Androgene und Östrogene: Ausprägung sekundärer Geschlechtsmerkmale und Entwicklung der Keimdrüsen. Bildungsort: Zona reticularis. Wirkung der Glucocorticoide (Cortisol): (1) Gluconeogenese (= Bildung von Glukose aus Aminosäuren): Cortisol steigert die Aktivitäten einiger für die Gluconeogenese erforderlichen Enzyme. Der Blutglukosespiegel wird dadurch angehoben. 44 (2) Katabole Wirkung: Die Gluconeogenese bedingt einen verminderten Einbau von Aminosäuren in das Körpereiweiß. (3) Lipolyse. Bei Ausfall von Glucocorticoiden ist die Freisetzung von Fettsäuren aus dem Fettgewebe (Lipolyse) gestört. (4) Kreislauf: Glucocorticoide sensibilisieren die glatte Gefäßmuskulatur gegenüber Noradrenalin, sog. permissive Wirkung (Blutdrucksteigerung). Bei Ausfall der NNR Kreislaufkollaps. (5) Wasserhaushalt: Kennzeichnend für den Ausfall der NNR ist die gestörte Wasserausscheidung. Cortisol bewirkt Steigerung der Glomerulusdurchblutung und der Filtrationsrate als Folge der kreislaufstabilisierenden Wirkung. Weiterhin vermindert Cortisol die Wasserdurchlässigkeit im distalen Tubulus, was zur Wasserausscheidung führt. (6) Skelettmuskulatur: Schwäche der Skelettmuskulatur (Adynamie) bei Cortisolmangel; Wirkungsmechanismus noch unklar. (7) ZNS und Sinnesorgane: Mangel an Cortisol bewirkt erhöhte Krampfanfälligkeit des Gehirns (Glucocorticoidrezeptoren im Gehirn sind nachgewiesen) und Funktionsminderung von Sinnesorganen (Geschmack: Schlechte Unterscheidung von süß und salzig; Gehör: Beeinträchtigung des Verständnisses akustisch dargebotener Worte). (8) Zelluläre und humorale Abwehrvorgänge: Cortisol bewirkt Involution von Thymus und Lymphknoten mit Zerstörung der eingelagerten Lymphocyten. Dadurch Hemmung der Antikörperproduktion (immunsuppressive Wirkung). Bewirkt auch Hemmung von lokalen Entzündungen, was für die Therapie von rheumatischen Erkrankungen ausgenutzt wird. Regelung der Glucocorticoidkonzentration: Konzentration der Glucocorticoide wird im Plasma konstant gehalten. Regelgröße = Cortisolkonzentration. Abnahme der Cortisolkonzentration (Störgröße) ---> Glucocorticoidrezeptoren in der hypophysiotropen Zone des Hypothalamus (Meßwerk) ---> Regler mit Sollwert im limbischen System ---> Ausschüttung von CRH ---> Freisetzung von ACTH in der Adenohypophyse (Stellgröße) ---> Freisetzung von Cortisol in der NNR (Stellglied). Die Cortisolkonzentration steigt bei zahlreichen Belastungen („Stress“) an, was als Sollwertverstellung aufzufassen ist. Diese Sollwertverstellung bewirkt die Leistungsanpassung des Organismus. Stress und Adaptation: Bei Einwirkung verschiedenster Stressoren (z.B. Kältebelastung, Hitzebelastung, Traumen) wird die Glucocorticoidsekretion gesteigert („Alarmreaktion“). Der Reizzustand des Organismus wird nach Selye als Stress bezeichnet, die auslösenden Reize als Stressoren. Bei anhaltender Einwirkung der Stressoren nimmt die Stärke der Stressreaktion mehr und mehr ab. Dies steht in Zusammenhang mit der Ausbildung morphologischer und funktioneller Modifikationen, die eine erhöhte Resistenz gegenüber dem Stressor zur Folge haben (physiologische Adaptation, Leistungsanpassung. „Stadium des Widerstandes“ nach Selye). Die Adaptation ist stressorspezifisch, d.h. die sich einstellenden Modifikationen sind verschieden, je nachdem ob das Individuum Kälte, Hitze etc. ausgesetzt worden ist. Die Alarmreaktion ist dagegen unspezifisch. Die erhöhte Glucocorticoidsekretion scheint für die Ausbildung der spezifischen Modifikationen von Bedeutung zu sein, etwa in dem Sinne, daß durch Enzyminduktion die Ausbildung bestimmter morphologischer Änderungen ermöglicht wird. Sind die Modifikationen einmal ausgebildet, so ist der ursprüngliche Stressor nicht mehr nennenswert belastend für den Organismus. Wirken die Stressoren aber sehr lange ein, geht die erworbene Anpassung wieder verloren („Stadium der Erschöpfung“). 45 Morbus Cushing: Krankheitsbild, das durch eine Überproduktion von Cortisol gekennzeichnet ist. Ursachen: (1) Geschwulst der NNR (Carcinom) mit Überproduktion von Cortisol. ACTH-Konzentration durch negative Rückkoppelung reduziert, daher kontralaterale NNR atrophiert. (2) Überproduktion von ACTH durch Störung der Funktion des HVL oder Hypothalamus. Bedingt Hyperplasie beider NNR mit Steigerung der Cortisolbildung. Klinische Zeichen: Fettsucht (Mondgesicht), erhöhter Blutzuckerspiegel mit Zuckerausscheidung im Harn, vermehrter Eiweißabbau (katabole Wirkung), Hypertonie, Osteoporose (Entkalkung der Knochen). Adrenogenitales Syndrom (AGS-Syndrom): Enzymdefekt, der bewirkt, daß kaum Cortisol gebildet wird, womit die negative Rückkoppelung fehlt und im Hypothalamus vermehrt CRH gebildet wird, was eine entsprechende Stimulation der ACTH-Synthese in der Adenohypophyse hervorruft. Da ACTH auch auf die Zona reticularis wirkt, werden übermäßig Androgene produziert. Das Androgen wirkt bei Mädchen virilisierend (vermännlichend) und ruft bei Knaben vorzeitige Pubertät hervor. Therapie: Cortisolgabe. Morbus Addison: Verminderung aller Hormone der NNR infolge Tumormetastasen der NNR, Tuberkulose, Traumen. Ausfall der Mineralocorticoide beherrscht das Krankheitsbild (Elektrolytstörungen). Klinische Zeichen: Verstärkte Hautpigmentierung („Bronzehautkrankheit“, Folge der erhöhten MSH-Sekretion im Zusammenhang mit der gesteigerten ACTH-Produktion), vorzeitige Ermüdbarkeit, Muskelschwäche, Gewichtsabnahme, Hypotonie, Hypoglykämie, Anämie. Hormone der Schilddrüse Bildung der Hormone: Die Synthese von Thyroxin (= Tetrajodthyronin = T4) und Trijodthyronin (= T3) vollzieht sich in den Follikelzellen der Schilddrüse unter dem Einfluß von TSH in Bindung an ein Glykoprotein, dem Thyreoglobulin. Gebunden an Thyreoglobulin werden T3 und T4 in das Kolloid geleitet und dort gespeichert. Zur Abgabe der Hormone an das Blut muß die Bindung an Thyreoglobulin gelöst werden, was eine erneute Aufnahme in die Follikelzelle erforderlich macht. Im Plasma erfolgt erneut eine Bindung an Plasmaproteine. Nur ein kleiner Teil der Hormone ist ungebunden. Charakteristisch ist der Jodgehalt der Schilddrüsenhormone. Wirkung der Hormone: Beide Hormone haben im wesentlichen die gleiche Wirkung, wobei T3 jedoch viel stärker wirkt und die eigentliche biologisch wirksame Form darstellt, wobei ein Großteil von T3 im Blut durch Dejodierung von Thyroxin entsteht. (1) Stoffwechselwirkungen: Bei Ausfall der Hormone sinkt der Energieumsatz, bei Überproduktion können Steigerungen des Grundumsatzes auf das Doppelte erfolgen. Die Hormone steigern die Eiweißsynthese und fördern den oxydativen Abbau der Fette und Kohlenhydrate. Die Ansprechbarkeit des Organismus auf Catecholamine wird durch die Hormone erhöht. Infolge dieser Grundwirkungen findet man klinisch bei Hormonüberschuß: Tachycardie (Herzfrequenzerhöhung), Erhöhung der Körpertemperatur, Neigung zu 46 Schweißsekretion, zitternde Hände (Tremor), Unruhegefühl, gesteigerte körperliche und geistige Aktivität. Bei Hormonmangel sind die entgegengesetzten Wirkungen zu erwarten. (2) Wachstum und Entwicklung: T3 und T4 sind wichtig für die normale Verknöcherung. Bei Ausfall im jugendlichen Alter bleibt das Wachstum zurück. Da das Dickenwachstum der Knochen im Gegensatz zum Längenwachstum ungestört ist, findet man beim hypothyreotischen Zwergwuchs im Gegensatz zum hypophysären Zwergwuchs einen plumpen und gedrungenen Knochenbau. Auch die geistige Entwicklung ist bei Hormonmangel im jugendlichen Alter gestört, bei Ausfall bereits während der Embryonalentwicklung ist Schwachsinn die Folge. (3) Leistungsanpassung: T3 und T4 sind neben den Glucocorticoiden für die Ausbildung adaptativer Modifikationen (insbesondere Kälteadaptation) von Bedeutung. Regelung der Hormonkonzentration: Wurde bereits im Rahmen der allgemeinen Endokrinologie behandelt. Die Sekretionsrate wird von inneren und äußeren Thermorezeptoren beeinflußt. Es kommt zu einer kälteinduzierten Steigerung des T3- und T4-Umsatzes. Auch andere Stressoren können eine Steigerung der Umsatzrate der Hormone hervorrufen. Allerdings handelt es sich hierbei nicht um eine Sollwertverstellung wie bei den Glucocorticoiden, sondern lediglich um eine Steigerung der Umsatzrate, wobei der Hormonspiegel immer konstant gehalten wird. Hyperthyreose (Morbus Basedow): Produktion eines TSH-ähnlichen Stoffes, der die Bildung der Hormone ungehemmt anregt, da er nicht einer Kontrolle durch negative Rückkopplung unterliegt. Klinische Zeichen: Vergrößerung der Schilddrüse (hyperthyreotischer Kropf), hervortretende Augäpfel („Glotzaugenkrankheit“ durch Fetteinlagerung in die Augenhöhlen), Tachycardie, Tremor, motorische Unruhe, leicht erhöhte Körpertemperatur, Schweißausbrüche, Glanzauge, Abmagerung trotz Heißhunger, erhöhter Grundumsatz, Haarausfall, Muskelschwäche, Herzmuskelschädigung. Hypothyreose: Mangelhafte Sekretionsrate, häufig durch Jodmangel in der Nahrung. Bevorzugt in den Alpenländern (Jodmangel im Gebirgswasser; epidemischer Kropf). Klinisch starke Vergrößerung der Schilddrüse (hypothyreotischer Kropf), der durch Zufuhr von Jodsalzen oder Schilddrüsenhormonen zur Rückbildung gebracht werden kann. Ausfall der Schilddrüsenhormone in der Embryonalperiode: Zurückbleiben der geistigen Entwicklung (Kretinismus), Minderwuchs mit gedrungenem Körper, Hypothermie, Hypoglykämie, Hypotonie, Gewichtszunahme, trockene Haut, große Zunge. Ausfall der Schilddrüsenhormone im Erwachsenenalter: Teigige Verdickung der Haut (Myxödem), Verminderung der körperlichen und geistigen Aktivität, Müdigkeit, Kälteempfindlichkeit, Antriebsarmut. Keimdrüsen und Sexualhormone Bildungsorte der Sexualhormone: Die Sexualhormone sind Steroidhormone (wie Cortisol) und gehören zu den Lipidhormonen. (1) Weibliche Sexualhormone: Östrogene (wichtigster Vertreter Östradiol) und Gestagene (Progesteron) werden im Ovar (Östrogene in den Zellen der Theca interna des Follikels, 47 Progesteron in den Follikelzellen) und in der Plazenta (ab Ende des 4. Schwangerschaftsmonats) gebildet. Geringe Mengen von Androgenen werden in der NNR und auch im Ovar gebildet. (2) Männliche Sexualhormone: Androgenbildung in den Leydig-Zwischenzellen (Testosteron) der Hoden (Testes) und in der NNR. Im Hoden auch geringe Mengen von Östrogenen und Gestagenen. Wirkungen der Sexualhormone: (1) Embryonale Geschlechtsdifferenzierung: Am Ende des 3. Monats wird die männliche Keimdrüse des Fetus aktiv und bildet Testosteron, unter dessen Einfluß die Geschlechtsorgane ihre typisch männliche Ausbildung erfahren. Bleibt die Testosteronproduktion aus, bildet sich bei männlichen Feten ein weibliches Genitale (Pseudohermaphroditismus masculinus). Führt man im Experiment weiblichen Feten Testosteron zu, so bildet sich ein mehr oder weniger vollkommenes männliches Genitale aus (Pseudohermaphroditismus femininus). Ein Hermaphroditismus verus liegt vor, wenn gleichzeitig Ovar- und Testesgewebe unabhängig vom genetischen Geschlecht vorhanden ist. (2) Pubertät: Beim Knaben wird nach der embryonalen Entwicklungsphase die Produktion von Testosteron eingestellt, lebt aber zum Zeitpunkt der Pubertät wieder auf. Beim Mädchen beginnt die Tätigkeit der Keimdrüsen ebenfalls zum Zeitpunkt der Pubertät. Wachstum und Reifung der inneren und äußeren Geschlechtsorgane erfolgt beim Mädchen unter dem Einfluß von Östrogenen und Gestagenen, beim Knaben unter dem Einfluß von Testosteron. Unter dem Einfluß der Sexualhormone kommen zudem die extragenitalen Geschlechtsmerkmale zur Ausbildung: Entwicklung der Brustdrüse, typischer Körperbau, Schambehaarung. (3) Wirkung auf den Uterus: Die Östrogene bewirken die Proliferationsphase; unter dem zusätzlichen Einfluß des Progesterons sondern die Endometriumdrüsen ein Sekret ab (Sekretionsphase). Dadurch werden die Voraussetzungen für die Implantation eines befruchteten Eies geschaffen (vgl. Ontogenese). (4) Extragenitale Wirkungen: Progesteron steigert die Ruhe-Körpertemperatur durch Erhöhung des Grundumsatzes bei gleichzeitiger Sollwertverschiebung (Temperaturerhöhung zum Zeitpunkt der Ovulation um ca. 0,5°C; Methode der Messung der Basaltemperatur nach KnausOgino zur Ermittlung der fruchtbaren und unfruchtbaren Tage der Frau). Progesteron hat zudem einen katabolen, Testosteron einen anabolen Effekt. Unter dem Einfluß der Sexualhormone (Östrogene, Testosteron) kommt es zur Verknöcherung der Epiphysenfugen und damit zum Wachstumsstillstand. Bei Androgenmangel wirkt GH unbehindert weiter ---> eunuchoider oder hypogonadaler Riesenwuchs. (5) Sexualverhalten: Bei weiblichen Säugetieren (ausgenommen Mensch und Primaten) ist die Kopulationsbereitschaft auf bestimmte Zeitabschnitte von wenigen Tagen beschränkt und fällt mit den zyklischen Steigerungen des Sexualhormonspiegels zusammen (Brunst oder Östrus). Bei kastrierten weiblichen Tieren läßt sich die Paarungsbereitschaft durch exogene Zufuhr von Östrogenen fördern, durch Progesteron hemmen. Bei Primaten und beim Menschen, die einen Menstruationszyklus haben, ist die sexuelle Aktivität gegen die Zyklusmitte hin (Ovulation) gesteigert. Menstruationszyklus: Im 2. Drittel des Zyklus steigt der Östrogenspiegel stark an und fällt gegen Ende des Zyklus wieder ab. Mit Verzögerung von einigen Tagen steigt der Progesteronspiegel an, um gegen Ende scharf abzufallen. Die Sekretionsrate beider Ovarialhormone wird durch FSH und LH gesteuert. In den ersten Tagen des Zyklus steigt der FSH-Spiegel an ---> Heranreifung des Primärfollikels und Anstieg des Östrogenspiegels. In der Mitte des Zyklus erfolgt ein steiler 48 Anstieg des LH ---> Ursache der Ovulation und Umwandlung des Follikels zum Corpus luteum (erzeugt Progesteron). Die Steuerung der FSH- und LH-Sekretion aus der Adenohypophyse erfolgt über das ReleasingHormon LHRH aus der hypophysiotropen Zone des Hypothalamus. Bei niedrigen Östradiolkonzentrationen, wie sie zu Beginn des Zyklus bestehen, werden die LH- und FSHproduzierenden Zellen auf einem niedrigen Sensibilitätsniveau für die Wirkung von LHRH gehalten, wodurch die LH- und FSH-Spiegel im Blut niedrig bleiben. Mit zunehmender Reifung des Follikels steigt der Östradiolspiegel im Blut an. Unmittelbar vor der Ovulation wird der Östradiolspiegel so hoch, daß Die LH- und FSH-produzierenden Zellen der Hypophyse plötzlich von ihrer niedrigen auf eine hohe Sensibilität auf LHRH umschalten. Dadurch verstärkt sich die LH- und FSH-Sekretion (positive Rückkoppelung von Östradiol) und es entsteht der LH-Gipfel, der die Ovulation auslöst. Die hohen Östradiol- und Progesteron-Spiegel koppeln nunmehr negativ zur Hypophyse und zum Hypothalamus zurück, so daß die LH- und FSH-Sekretion wieder auf basale Werte absinkt. Bei der Frau, ähnlich wie beim Mann, konnte zudem gezeigt werden, daß die Ausschüttung von LHRH aus den hypothalamischen Neuronen nicht in gleichmäßiger, sondern in pulsatiler Form erfolgt (phasische synchronisierte Aktivität der LHRH-Neurone). Ovulationshemmer: Durch exogene Zufuhr von Östrogen und Gestagen zu Beginn des Zyklus wird infolge der negativen Rückkopplung die LHRH-Sekretion gehemmt. Dabei wird sowohl die Pulsfrequenz der pulsatilen LHRH-Sekretion verlangsamt, als auch vermutlich die Menge des pro Puls sezernierten LHRH reduziert. Die Ovulation bleibt aus, da sich der LH-Gipfel nicht aufbauen kann. (1) Konventionelle Methode (Ein-Phasen-Präparate): Tabletten enthalten eine ÖstrogenGestagen-Kombination. Beginnend mit dem 5. Zyklustag werden 21 Tage lang die Tabletten genommen und 7 Tage lang keine Tabletten eingenommen etc. (2) Sequentialverfahren (Zwei-Phasen-Präparate): Beginnend mit dem 5. Zyklustag 15 Tage lang reine Östrogentabletten, daran anschließend 5 Tage lang Tabletten, die Östrogene und Gestagene enthalten, dann 8 Tage Pause etc. Nebenwirkungen der Ovulationshemmer: Übelkeit, Kopfschmerzen, Gewichtszunahme, Zwischenblutungen. Nach 1 - 1 1/2 Jahren sollte eine Einnahmepause für 2 - 3 Zyklen erfolgen. Gynäkologische Untersuchung im Abstand von 6 Monaten ist anzuraten. Sexuelle Reaktion (Masters & Johnson 1966): (1) Erregungsphase: Erektion von Penis bzw. Klitoris. Beginn des Herzfrequenz- und Blutdruckanstiegs. (2) Plateauphase: Verlängerung und Erweiterung der Vagina, vor allem im hinteren Teil, Verengerung durch Blutanfüllung im vorderen Teil (orgastische Manschette); Verlagerung der Klitoris, Aufrichtung des Uterus. Beim Mann Vergrößerung und Anheben der Hoden. (3) Orgasmusphase: Vagina zeigt unter Beteiligung des Uterus 5 - 12 Kontraktionen. Analog zeigt der Penis 3 - 4 austreibende Kontraktionen. Höhepunkt der Steigerung von Herzfrequenz, Atemfrequenz und Blutdruck. (4) Rückbildungsphase: Beim Mann Abbruch der Plateauphase nach dem Orgasmus, Beginn einer Refraktärzeit; erst nach Ende der Refraktärzeit neuer Orgasmus möglich. Bei der Frau Rückkehr auf die Plateauphase, von hier aus weitere Orgasmen möglich. 49 Schwangerschaft, Geburt und Lactation: Der Untergang des Corpus luteum wird verhindert, sobald sich ein befruchtetes Ei in der Uterusschleimhaut implantiert hat. Vom Trophoblast der Blastozyste (s. Ontogenese) werden folgende Hormone gebildet: (1) Choriongonadotropin (HCG): Ähnliche Wirkungen wie das LH. (2) Human Placental Lactogen (HPL): Entspricht dem Prolactin. Unter dem Einfluß dieser beiden Plazentahormone (gonadotrope Wirkung) steigert das Corpus luteum seine Progesteronproduktion. Dadurch wird die Abstoßung der Uterusschleimhaut verhindert und die Schwangerschaft aufrecht erhalten. Gegen Ende des 4. Schwangerschaftsmonats bildet sich das Corpus luteum zurück. Die Plazenta übernimmt nun selbst die Produktion von Progesteron. Theoretisch könnte nun das Ovar ohne Unterbrechung der Schwangerschaft entfernt werden. Mit zunehmender Schwangerschaftsdauer steigen die Östrogen- und Progesteron-Spiegel im Blut an. Östrogene sensibilisieren den Uterus für die Wirkung von Oxytocin, dem wehenauslösenden Hormon. Hohe Spiegel von Progesteron antagonisieren diese Wirkung. Die Wehentätigkeit und damit die Geburt wird möglicherweise durch einen kurzfristigen Abfall des Progesteron-Spiegels im Blut ausgelöst. Die Brustdrüse entwickelt sich in der Pubertät unter dem Einfluß der Östrogene, erlangt ihre Funktionsfähigkeit aber erst während der Schwangerschaft. Hieran sind beteiligt: Östrogene, Gestagene, Prolactin und HPL. Die Milchfreisetzung erfolgt durch den Saugreiz (weitergeleitet über afferente Nervenfasern zum Hypothalamus), der Oxytocin freisetzt, was eine Kontraktion der Myoepithelien der Brustdrüse bewirkt (Milchejektionsreflex). Zusätzlich wird durch den Saugreiz nerval PRH im Hypothalamus sezerniert und gleichzeitig die Ausschüttung von Dopamin vermindert, womit Prolactin freigesetzt wird, das die Milchsekretion anregt. Die hohen Prolactin-Spiegel bewirken aber andererseits durch Rückkoppelung eine Erhöhung der Dopaminsekretion. Da Dopamin auch hemmend auf die LHRH-Produktion wirkt, kommt es zum Ausbleiben weiterer Ovulationen. Schwangerschaftsnachweis: Durch immunologische Tests, die auf dem Nachweis von HCG im Harn beruhen (Antigen-Antikörper-Reaktion). Positive Ergebnisse sind 35 - 40 Tage nach der letzten Menstruation zu erwarten. Sexualhormonspiegel beim Mann: Das LH (ICSH) stimuliert die Leydig-Zwischenzellen zu vermehrter Testosteronproduktion, die für die Spermatogenese notwendig ist. Ein Anstieg des TestosteronSpiegels hemmt die LH- und LHRH-Sekretion (wird pulsatil ausgeschüttet) durch negative Rückkoppelung. In den Samenkanälchen des Hodens wird durch FSH die Spermatogenese angeregt. Gleichzeitig bilden die dort befindlichen Sertoli-Zellen das Inhibin, welches selektiv die FSH-Sekretion in der Hypophyse inhibiert. Von den Sertoli-Zellen wird weiterhin das Androgenbindende Protein (ABP) produziert, welches Testosteron von den Leydig- zu den Sertoli-Zellen transportiert, wo es zu Östrogen umgewandelt wird. Somit sind Östrogene und Androgene für die Reifung der Spermatocyten notwendig. Danach gelangen die Spermatocyten vom Hoden in den Nebenhoden, wo die weitere Reifung erfolgt. Die Speicherung erfolgt im wesentlichen im Samenleiter und dessen Ampullen. 50 Sympathico-adrenales System Hormone und Hormonbildung: Adrenalin und Noradrenalin, die zur Gruppe der Catecholamine gehören. Bildungsorte: (1) Nebennierenmark (NNM): Bildung in den chromaffinen Zellen (lassen sich mit Dichromsäure anfärben), Anteil des Adrenalin an der NNM-Sekretion 70 - 90 %, Rest Noradrenalin. Beim NNM handelt es sich um ein umgewandeltes sympathisches Ganglion, das aus modifizierten postganglionären Neuronen besteht und durch präganglionäre Axone erregt wird. (2) Sympathische postganglionäre Nervenendigungen: Setzen überwiegend Noradrenalin frei. (3) Gehirn: Noradrenalin wird in verschiedenen Hirngebieten gebildet und wirkt als Transmitter (REM-Schlaf, Belohnungszentren). Die unter (1) und (2) gebildeten Catecholamine können jedoch wegen der Bluthirnschranke nicht in das Gehirn eindringen. Wirkungen von Adrenalin und Noradrenalin: Grundwirkungen: (1) Beeinflussung des Tonus und der Kontraktion der glatten Muskulatur (Gefäße, Bronchien, Magen-Darm-Trakt) und des Herzens. Konstriktorische Effekte auf die glatte Muskulatur werden über α-Rezeptoren vermittelt, Relaxationseffekte über ß-Rezeptoren. Noradrenalin wirkt überwiegend auf die α-Rezeptoren, Adrenalin auf α- und ß-Rezeptoren. Die erregenden Effekte auf den Herzmuskel werden über ß-Rezeptoren vermittelt. (2) Beeinflussung des Kohlenhydrat- und Fettstoffwechsels über ß-Rezeptoren. Wirkungen im einzelnen: (01) Kreislauf: Noradrenalin bewirkt in allen Gefäßgebieten (Ausnahme Koronargefäße und Gehirn) Vasokonstriktion. Adrenalin bewirkt an den Hautgefäßen Vasokonstriktion, an den Skelettmuskelgefäßen Vasodilatation. (02) Herz: Adrenalin hat eine positiv chronotrope, inotrope und dromotrope Wirkung (s. Funktion des Herzens), Noradrenalin bewirkt über eine reflektorische Vaguserregung Bradycardie. (03) Blutdruck: Noradrenalin bewirkt eine Steigerung des systolischen und diastolischen Blutdrucks, Adrenalin bewirkt ebenfalls eine Steigerung des systolischen Druckes bei Konstanz oder Senkung des diastolischen Druckes. (04) Atmung: Noradrenalin und Adrenalin bewirken eine Erschlaffung der Bronchialmuskulatur und Steigerung der Atemtiefe. (05) Magen-Darm-Trakt: Noradrenalin und Adrenalin erregen die Sphincteren (Schließmuskel) und hemmen die übrige glatte Muskulatur. (06) Haut: Erregung der Erectores pilorum mit Aufrichten der Körperbehaarung (Adrenalin und Noradrenalin). (07) Auge: Erweiterung der Pupillen durch Erregung des Dilatator pupillae (Adrenalin und Noradrenalin). (08) Kohlenhydratstoffwechsel: Adrenalin bewirkt Steigerung des Blutglukosespiegels durch Abbau des Leberglykogens (Antagonist des Insulins) und Steigerung der Gluconeogenese. Nur geringe Wirkung des Noradrenalins. Beide Hormone inhibieren die Insulinsekretion. (09) Fettstoffwechsel: Adrenalin und Noradrenalin wirken lipolytisch (Abbau der Fette mit Anstieg der Fettsäuren im Plasma). (10) Energieumsatz: Steigerung durch beide Hormone. 51 (11) ZNS: Adrenalin (Noradrenalin nur in geringem Maße) bewirkt Stimulierung des ARAS (arousal reaction) mit Desynchronisierung des EEG ---> psychische Erregung und Angstzustände. Wegen der Bluthirnschranke handelt es sich wohl nur um indirekte Wirkungen. Steuerung der Sekretion: Sekretion von Adrenalin und Noradrenalin im NNM und von Noradrenalin an den Nervenendigungen in Ruhe gering. Steigerung der Sekretionsrate bei Erregung des sympathischen Nervensystems durch Belastungszustände (Stress) zusammen mit einer gesteigerten Glucocorticoidsekretion (bewirkt ergotrope Einstellung des Organismus). Pankreashormone und Blutzuckerregelung Hormonbildung: In den inselförmig in der Bauchspeicheldrüse (Pankreas) liegenden Langerhans-Inseln werden die Hormone Insulin (B-Zellen), Glucagon (A-Zellen) und Somatostatin (D-Zellen) gebildet. Hinsichtlich der Beeinflussung des Blutglukosespiegels verhalten sich Insulin und Glucagon antagonistisch. Somatostatin inhibiert die Sekretion beider Hormone. Wirkung des Insulins (Senkung des Blutzuckers): (1) Leber: Unter dem Einfluß der kohlenhydratinduzierten Insulinausschüttung wird von den Leberzellen Glukose zu Glykogen umgebaut. Weiterhin inhibiert Insulin die glykogenabbauenden Enzyme. (2) Muskel: Steigerung der Glukosepermeabilität der Zellen. Bei niedrigen Insulinspiegeln ist die Muskelzelle impermeabel für Glukose und deckt ihren Energiebedarf über den Fettsäuremetabolismus. Durch hohe Insulinspiegel wird die Muskelzelle jedoch permeabel für Glukose und kann sie dann verbrauchen. Die Zellmembran von stark beanspruchten Muskelzellen kann jedoch auch insulinunabhängig permeabel für Glukose werden. (3) Nervenzellen: Die Zellen des ZNS decken ihren Energiebedarf ausschließlich durch Glukose, dieser Prozeß ist aber insulinunabhängig. (4) Fettstoffwechsel: Insulin stimuliert die Fettsäurebildung in der Leber und die Aufnahmefähigkeit des Fettgewebes für freie Fettsäuren und deren Speicherung in Form von Triglyceriden (Depotfett). Bei geringer Insulinsekretion werden die Triglyceride wieder gespalten, indem die hemmende Wirkung des Insulins auf eine Lipase wegfällt. (5) Proteinstoffwechsel: Insulin ermöglicht den aktiven Transport von vielen Aminosäuren in die Zellen und so den Proteinaufbau. Wirkung des Glucagons (Erhöhung des Blutzuckers): (1) Abbau des Leberglykogens (Glykogenolyse), damit ein Synergist des Adrenalins. (2) Steigerung der Gluconeogenese. Wirkung des Somatostatins: Die Sekretion wird durch hohe Glukosespiegel, erhöhte Aminosäuren und erhöhte Fettsäuren im Blut stimuliert. Da Somatostatin auf beide Hormone inhibitorisch wirkt, werden überschießende Reaktionen durch Insulin oder Glucagon verhindert. 52 Regelung der Blutzuckerkonzentration: Insulin und Glucagon sind als Stellglieder innerhalb eines Regelkreises zur Konstanthaltung des Blutglukosespiegels aufzufassen. An Störgrößen für den Blutglukosespiegel sind zu nennen: Wechselnde Kohlenhydrataufnahme und körperliche Arbeit (vermehrter Glukoseverbrauch). Glukoserezeptoren im Pankreas messen den Blutzuckerspiegel (normal 80 - 100 mg/dl Blut) und steuern die Sekretionsrate der B-Zellen (Insulin). Darüber hinaus können die B-Zellen noch durch parasympathische Innervation aktiviert und durch sympathische Innervation gehemmt werden. Die Steuerung der Glucagonsekretion wird möglicherweise durch Glukoserezeptoren im Hypothalamus ausgelöst, wobei das Wachstumshormon GH als tropes Hormon für die A-Zellen wirkt. Zudem kann die Glucagonsekretion durch Erregung des Sympathikus gesteigert werden. Bei der Regelung der Blutzuckerkonzentration ist zu beachten, daß außer Glucagon auch das Wachstumshormon selbst sowie das im Rahmen sympathischer Erregung ausgeschüttete Adrenalin eine blutzuckersteigernde Wirkung haben. Darüber hinaus wirken die Glucocorticoide und die Schilddrüsenhormone im Sinne einer Blutzuckererhöhung. Hypoglykämie: Abfall des Blutzuckers unter 50 mg/dl Blut. Bei weiterem Absinken hypoglykämischer Schock mit Bewußtlosigkeit (mangelnde Versorgung der Hirnzellen, für die Glukose der einzige Energielieferant ist). Klinische Zeichen der Hypoglykämie: Schweißsekretion, Tachycardie, Tremor, Heißhunger, Erregung. Therapie: Zufuhr von Traubenzucker (Glukose). Hyperglykämie (Diabetes mellitus): Beruht auf Insulinmangel. Klinische Zeichen: Blutzuckererhöhung, Zuckerausscheidung im Harn (Glukosurie, bei mehr als 180 mg/dl Glukose im Plasma), Durst, große Harnmengen (Polyurie, osmotische Diurese), Gewichtsabnahme, Kraftlosigkeit, Neigung zu Hautkrankheiten, Potenz- und Menstruationsstörungen. Spätfolgen der Zuckerkrankheit: Netzhautveränderungen mit Blutungen im Augenhintergrund (evtl. Erblindung), Nephropathie (Nierenschädigung mit erhöhtem Blutdruck und Urämie), Neuropathie (Schmerzen, Muskelatrophie und Schwäche in den Beinen), Arteriosklerose (Herzinfarkt, Durchblutungsstörungen). Therapie: Insulinsubstitution, in leichten Fällen orale Antidiabetika. Hormonale Regulation des Mineralhaushaltes Beteiligte Hormone: (1) Aldosteron (über Renin und Angiotensin) für Na+, K+ und H+-Ionen. (2) Parathormon und Thyreocalcitonin (syn. Calcitonin) für den Ca++- und Phosphathaushalt. Wirkungen des Aldosterons: Aldosteron wird in der Zona glomerulosa der NNR (Mineralocorticoid) gebildet und hat folgende Wirkungen: (1) Steigerung des aktiven Na+-Transports durch Zellmembranen. (2) In der Niere Reabsorption von Na+ aus dem Tubulussystem und damit auch eine osmotisch bedingte Wasserreabsorption. (3) Ausscheidung von K+- und H+-Ionen in der Niere. (4) Regelung des NaCl-Gehalts im Schweiß, Speichel und Sekreten der Darmdrüsen. 53 Steuerung der Aldosteronsekretion: Drei Bedingungen haben eine Steigerung der Aldosteronsekretion zur Folge: (1) gesteigerte Kaliumzufuhr, (2) negative Na-Bilanz, z.B. verminderte NaCl-Zufuhr in der Nahrung, erhöhte NaCl-Verluste mit dem Schweiß, (3) Verminderung des Plasmavolumens bzw. des extrazellulären Raums durch Blutverlust oder mangelhafte Flüssigkeitszufuhr. Die Steigerung der Aldosteronsekretionsrate wird durch folgende Steuerungsmechanismen bewirkt: (1) Hormonzellen der Zona glomerulosa sprechen direkt auf Änderungen der Na+- und K+Konzentrationen im Plasma an. (2) Aldosteronsekretion wird durch Angiotensin gesteigert, das auf dem Blutweg zur NNR gelangt und so den Charakter eines tropen Hormons für die Aldosteronsekretion hat. Angiotensin entsteht aus Angiotensinogen unter Einwirkung des im juxtaglomerulären Apparates gebildeten Renins (Renin-Angiotensin-Aldosteron-Mechanismus; s. Niere). (3) Aldosteronsekretion wird durch ACTH beeinflußt, jedoch in weit geringerem Maße als die Glucocorticoidsekretion. Pathophysiologie: Störungen des Elektrolyt- und Wasserhaushalts bei Unterfunktion der NNR durch Aldosteronmangel (Addison'sche Krankheit, s. Kapitel NNR). Hyper-Aldosteronismus (vermehrte Bildung von Aldosteron) bei NNR-Tumor mit Hypernatriämie, Hypokaliämie und Ödemen. Hormone des Ca++- und Phosphathaushalts: Parathormon wird in den 4 Epithelkörperchen der Schilddrüse (Nebenschilddrüse) gebildet, Calcitonin in den sog. C-Zellen der Schilddrüse und Vitamin-D-Hormon aus Vitamin-D in der Niere. Die Hormone können als Stellglieder in einem Regelkreis zur Konstanthaltung des Blutcalciumspiegels aufgefaßt werden. Damit verknüpft ist die Erhaltung des Gleichgewichts zwischen Knochenan- und Knochenabbau. Wirkungen des Parathormons: (1) Lösung von Ca++- und Phosphationen aus der Knochensubstanz durch Stimulierung der Osteoklasten. (2) Verhinderung der Bindung des Calciums an Phosphationen durch Förderung der Phosphationenausscheidung in der Niere. (3) Stimulierung eines Enzyms in der Niere, welches das Vitamin-D in das biologisch wirksame Vitamin-D-Hormon überführt. (4) Verminderung der Ausscheidung von Calciumionen in der Niere. Wirkungen des Calcitonins: (1) Verminderte Osteolyse und vermehrten Einbau von Calcium in den Knochen. (2) Verlangsamung von Verdauungsprozessen (Magenentleerung, Sekretion des Pankreas), um Calciumaufnahme zu ermöglichen. Wirkung des Vitamin-D-Hormons: Das mit der Nahrung aufgenommenen Vitamin-D ist ein Prohormon. Bei zu niedrigen Calciumkonzentrationen im Blut wird verstärkt Parathormon ausgeschüttet, wodurch mehr Vitamin-D-Hormon in der Niere gebildet wird. Dieses erhöht am Darmepithel die Calciumresorption. 54 Steuerung von Parathormon und Calcitonin: Die Zellen der Nebenschilddrüse reagieren auf Änderungen der Ca++-Konzentration mit einer Änderung ihrer Parathormonsekretion, wobei die negative Rückkoppelung über das Vitamin-D-Hormon erfolgt. Die Steuerung des Calcitonins erfolgt in ähnlicher Weise. Erhöhung des Ca++-Spiegels stimuliert unmittelbar die Hormonsekretion der C-Zellen. Darüber hinaus werden die C-Zellen nach Nahrungsaufnahme von den gastrointestinalen Hormonen Gastrin und Cholecystokinin stimuliert. Tetanie: Senkungen des Blutcalciumspiegels lösen eine Erhöhung der neuromuskulären Erregbarkeit aus. Schon leichte elektrische oder mechanische Reize (Beklopfen eines motorischen Nerven) bewirken eine Kontraktion der Skelettmuskulatur. Krämpfe können auch spontan auftreten. Tod durch Kontraktion der Atem- und Kehlkopfmuskulatur. Entscheidend für das Auftreten der tetanischen Krämpfe ist die Höhe des ionisierten Ca++ im Blutplasma, das mit dem an Eiweiß gebundenem Ca im Gleichgewicht steht. Dieses Gleichgewicht ist abhängig vom Blut-pH. Bei zunehmendem Blut-pH (Alkalose) nimmt der Anteil von Ca++ ab. Bei latenter Tetanie kann schon eine willkürliche Hyperventilation (Bewirkt Senkung des CO2-Partialdrucks im Blut und damit Alkalose) einen tetanischen Anfall auslösen (Hyperventilationstetanie). Hyperparathyreoidismus: Bei Geschwülsten der Nebenschilddrüse mit Überproduktion von Parathormon entsteht eine Hypercalcämie. Hierbei treten Kalkeinlagerungen in den Gefäßen und in der Niere auf (Nierensteinleiden). Grenzbereiche des endokrinen Systems Enterohormone (syn. gastrointestinale Hormone): Verschiedene Stoffe, die für die Verdauungsfunktion von Bedeutung sind: Gastrin, Secretin, Entero-Oxyntin und Cholecystokinin (s. Funktion des Magen-Darm-Kanals). Gewebshormone: Stoffe, die nicht in speziellen endokrinen Organen, sondern „irgendwo im Gewebe“ gebildet werden. Problematischer Begriff, da scharfe Abgrenzungen zu Enterohormonen und Neurotransmittern nicht möglich sind. Nachfolgend werden einige Stoffe erwähnt, deren Klassifizierung schwierig ist, und die gelegentlich noch als Gewebshormone bezeichnet werden: Prostaglandine: Wurden zunächst in den Samenblasen (produzieren zusammen mit der Prostata die als Träger der Spermien dienende Samenflüssigkeit) gefunden, inzwischen sind sie aber in nahezu allen Organen, so auch im Gehirn, nachgewiesen worden. Vielfältige Wirkungen der Prostaglandine: Z.B. Hemmung der Gelbkörperfunktion, Störung der Thrombozytenverklebung, Hemmung der Magensaftsekretion, Vermittlung der Wirkung von bakteriellen fiebererregenden Stoffen (Pyrogene). Serotonin: Wird an den Nervenendigungen bestimmter Hirnbezirke (Hypothalamus, Raphe-Kerne) freigesetzt. Kommt auch in Thrombozyten vor, wird bei Verletzungen freigesetzt und hat eine vasokonstriktorische Wirkung (Blutstillung). 55 Histamin: Entsteht beim Ablauf von Antigen-Antikörperreaktionen und löst einen Teil der allergischen Reaktionen (Hautrötung, Hautjucken, Quaddelbildung) aus. Auch in Hypophyse und Hypothalamus nachgewiesen (Neurotransmitter?). Bradykinin: Wird zusammen mit dem Schweiß freigesetzt und vermittelt Vasodilatation bestimmter Gefäßgebiete im Rahmen der Thermoregulation. Niere: Erythropoetin wird im juxtaglomerulären Apparat der Niere gebildet und regt die Erythropoese (Erythrozytenneubildung) an. Auf die Hormone Renin und Vitamin-D-Hormon sei nochmals hingewiesen. Thymus: Dieses hinter dem Brustbein gelegene Organ produziert eine Reihe von Peptiden. Man nimmt an, daß diese Peptide bei immunologischen Abwehrmechanismen eine Rolle spielen (vgl. Funktion des Blutes). Epiphyse (Pinealorgan oder Zirbeldrüse): Das Corpus pineale ist eine Ausstülpung des dritten Ventrikels. Produziert Melatonin, das eine Aggregation der Melaningranula in den Melanozyten der Haut bewirkt und so zu einer Entpigmentierung führt; somit Antagonist des in der Hypophyse gebildeten MSH. Melatonin soll auch die LHRH-Freisetzung hemmen und damit die Gonadotropinsekretion und die Aktivität der Keimdrüsen. Dieser Befund ist wichtig für das Verständnis der jahresperiodischen Fruchtbarkeit vieler Säuger. Beim Menschen soll die Sexualentwicklung vor der Pubertät durch Melatonin unterdrückt werden. Epiphysenzerstörung kann bei jugendlichen Menschen zu vorzeitiger Geschlechtsreifung (Pubertas praecox) führen. Gehirnanatomie Literatur: Sobotta-Becher: Atlas der Anatomie des Menschen Bd III. Anatomische Gliederung: 1 Telencephalon = Großhirn 2 Diencephalon = Zwischenhirn 3 Mesencephalon = Mittelhirn 4 Metencephalon = Hinterhirn 5 Medulla oblongata 1 + 2 = Prosencephalon oder Vorderhirn 3 + 4 + 5 = Hirnstamm = Truncus cerebri (physiologisch) 4 + 5 = Rhombencephalon = Rautenhirn Telencephalon (Cerebrum): Hirnmantel, Stammganglien (Nucleus caudatus = Schweifkern und Nucleus lentiformis = Linsenkern, der wiederum aus Putamen und Pallidum besteht; N. caudatus und Putamen zusammen werden oft auch als Striatum bezeichnet), Riechhirn (Rhinencephalon), Balken (Corpus callosum), Gewölbe (Fornix) und Septum. Diese Strukturen zusammen bilden die paarige Großhirnhemisphäre. 56 Diencephalon: Thalamus und Hypothalamus. Mesencephalon: Hirnschenkel (Pedunculi cerebri), Tegmentum (Haube) und Vierhügelplatte (Lamina tecti oder Tectum). Metencephalon: Brücke (Pons) und Kleinhirn (Cerebellum). Medulla oblongata (Myelencephalon): = verlängertes Mark, zwischen Pons und Pyramidenkreuzung gelegen. Geht ohne scharfe Grenze in das Rückenmark über. Limbisches System: Funktionssystem, das sowohl Anteile der Großhirnrinde als auch Stammhirnanteile umfaßt. Wesentliche Strukturen: Gyrus cinguli, Hippocampus, Mandelkerne (Amygdala), Septum, Riechhirn, limbic midbrain area, Fornix, mediales Vorderhirnbündel, Teile des Hypothalamus. Formatio reticularis: Zieht sich durch den ganzen Hirnstamm bis zum Hypothalamus und stellt eine netzförmige, histologisch wenig gegliederte Nervenmasse dar. Stellenweise treten Zellverdichtungen auf, wie z.B. der Nucleus ruber. Es lassen sich vor allem 3 Aufgabengebiete unterscheiden: (1) Die Retikularisformation erhält Impulse über Kollateralen von allen Sinneskanälen, die verstärkt oder gehemmt werden können. Die zur Großhirnrinde oder zum limbischen Kortex weitergeleiteten Erregungen bewirken eine Aktivierung (ARAS = aufsteigendes reticuläres Aktivierungssystem). (2) Durch ihre extrapyramidalen Kerngruppen (z.B. Nucleus ruber und niger) gewinnt die Retikularisformation Einfluß auf die sensomotorischen Systeme des Rückenmarks. Dabei können reflexhemmende und reflexfördernde Areale unterschieden werden, die vornehmlich auf die Gamma-Motoneuronen in den Vorderhörnern einwirken (z.B. Tractus reticulospinalis). (3) In die Retikularisformation des Mittel- und Rautenhirns sind auch zahlreiche vegetative Kerngruppen eingelagert (z.B. Atmungszentrum, Kreislaufzentrum). Einteilung des Hirnmantels: Jede Großhirnhemisphäre unterteilt sich in vier Lappen (Lobus): Stirnlappen (L. frontalis), Scheitellappen (L. parietalis), Schläfenlappen (L. temporalis) und Hinterhauptlappen (L. occipitalis). Die Lappen werden durch Einschnitte (Sulcus) voneinander getrennt. Jeder Lappen besteht aus mehreren Windungen (Gyrus). Ventrikelsystem: Das Gehirn enthält im Innern vier Hohlräume, die Hirnkammern oder Ventrikel. Sie stehen untereinander und mit dem Zentralkanal des Rückenmarks in Verbindung. Zwei Ventrikel gehören dem Großhirn an und liegen paarig als Seitenventrikel in den Großhirnhemisphären. Der dritte Ventrikel ist unpaarig und gehört zum Zwischenhirn. Der vierte Ventrikel ist der Hohlraum des Rautenhirns. Alle Hirnkammern sind mit Flüssigkeit ausgefüllt, dem Liquor. Im Bereich des vierten Ventrikels steht diese Flüssigkeit in Kommunikation mit jener Flüssigkeit, die das Gehirn als ganzes umgibt. Hirnnerven: s. Schmidt, R.F. (Hrsg.) (19855). Grundriß der Sinnesphysiologie. Berlin: Springer (S. 94). Nehmen Sie bitte auch den später folgenden Kommentar zur Literatur zur Kenntnis. Subcorticale vegetative „Zentren“: Inspirationszentrum: Ventral in der Retikularisformation der Medulla oblongata, beeinflußt reziprok des Exspirationszentrum. Exspirationszentrum: Dorsal in der Retikularisformation der Medulla oblongata, beeinflußt reziprok das Inspirationszentrum. 57 Pneumotaktisches Zentrum: Retikularisformation der Pons, beeinflußt beide oben genannten Zentren. Pressorisches Kreislaufzentrum: Laterale Retikularisformation der Medulla oblongata, Reizung führt zu Blutdrucksteigerung. Depressorisches Kreislaufzentrum: Ventral in der Retikularisformation der Medulla oblongata, Reizung führt zu Blutdruckabfall. Schluckzentrum: Rostrales Drittel der Retikularisformation der Medulla oblongata, Koordination der Phasen des Schluckaktes und Erbrechen. Schlafzentrum: Massa intermedia des Thalamus und Retikularisformation des Mittelhirns, Ausfall führt zum Dauerwachzustand. Weckzentrum: Retikularisformation des Mittelhirns und viele andere Stellen des ARAS, Ausfall führt zum Dauerschlaf. Durstzentrum: Vorderer Hypothalamus, Reizung der Osmorezeptoren (durch Erhöhung der Salzkonzentration im Blut bzw. Extrazellulärraum) führt zu Durst und Ausschüttung von Adiuretin. Hungerzentrum: Ventro-lateraler Hypothalamus, Ausfall führt zur Verweigerung der Nahrungsaufnahme und zum Tod durch Verhungern. Sättigungszentrum: Ventro-medialer Hypothalamus, Ausfall führt zu extremer Fettsucht. Thermoregulationszentrum: Hinterer Hypothalamus, Ausfall führt zu Poikilothermie. Sexualzentrum: Medialer Hypothalamus, regelt die Abgabe der Releasing-Hormone für die gonadotropen Hormone aus dem HVL, Ausfall führt zu Hypogenitalismus. Wut-, Aggressions- und Fluchtzentren: Caudaler Hypothalamus; Reizung in diesem Bereich führt im Tierversuch zum Fauchen, Knurren, Bellen etc. mit Angriffen auf den Experimentator oder Fluchtversuch; Ausfall erzeugt Bewegungsunlust, Schlafsucht und Indifferenz im Verhalten; die vegetativen Reaktionen während des Abwehrverhaltens (Blutdruckzunahme, Abnahme der Darmbewegung, etc.) können durch die Änderung der Aktivität des Sympathikus erklärt werden. Bemerkungen zum Begriff „Zentrum“: Der Begriff soll hier nur zur didaktischen Vereinfachung verwendet werden. Es muß darauf hingewiesen werden, daß die lokalisationistische Betrachtungsweise weitgehend überholt ist, d.h. eine eindeutige Zuordnung Funktion - Zentrum nicht haltbar ist. Vielmehr sind ähnliche Reaktionen bzw. Empfindungen häufig von vielen Stellen eines Funktionssystems durch Hirnreizung auslösbar. Wichtige Projektionsfelder der Großhirnrinde („Zentren“): Stirnlappen: Motorisches Projektionsfeld: Gyrus praecentralis, Ursprung der Pyramidenbahn, somatotopisch gegliedert (motorischer Homunkulus). Ausfall: Verlust der Willkürmotorik. Motorisches Sprachzentrum (Broca): Gyrus frontalis inferior. Ausfall: Motorische Aphasie = beim erhaltenen Sprachverständnis sind Spontansprechen und Nachsprechen gestört oder aufgehoben. Schreibzentrum: Gyrus frontalis medialis. Ausfall: Agraphie = Schreibstörung. Tertiäre motorische Rindenfelder: Pol des Frontallappens. Ausfall: Perseverationstendenz bzw. mangelnde Umstellfähigkeit, Zerfall von Verhaltensplänen, starke Auswirkung proaktiver Hemmung. Scheitellappen: Sensorisches Projektionsfeld: Gyrus postcentralis, Ende des Tractus thalamocorticalis (Hinterstrangbahn, lemniscales System), somatotopisch gegliedert (sensorischer Homunculus). Ausfall: Verlust der Oberflächensensibilität (Druck, Berührung, Temperatur). 58 Lesezentrum: Gyrus angularis. Ausfall: Alexie = Leseunfähigkeit. Lesen von geschriebener oder gedruckter Schrift nicht möglich, dagegen können durch Abtasten der Buchstaben mit den Fingern Worte entziffert werden (optisches Sprachzentrum). Gustatorisches Projektionsfeld: Operculum parietale, Ende der Geschmacksbahn. Ausfall: Ageusie = Aufhebung des Geschmackvermögens. Hinterhauptlappen: Optisches Projektionsfeld: Calcarina-Rinde, Ende der Sehbahn. Ausfall: Rindenblindheit. Optische Assoziationsfelder: Gyri occipitalis superior, medialis und inferior. Ausfall: Optische Agnosie = Unfähigkeit, trotz guten Lichtsinns, genügender Sehschärfe, etc. einen optischen Gesamteindruck zu erfassen; gezeigte Gegenstände werden nicht erkannt. Schläfenlappen: Akustisches Projektionsfeld: Heschl'sche Querwindungen, Ende der Hörbahn. Ausfall: Rindentaubheit. Sensorisches Sprachzentrum (Wernicke): Gyrus temporalis superior. Ausfall: Sensorische Aphasie = bei ungestörter Spontansprache Aufhebung des Sprachverständnisses; Gehörtes wird nicht verstanden und kann nicht nachgesprochen werden. Zentrum für Informationsspeicherung (Gedächtnis): Hippocampus. Ausfall: Unfähigkeit, neues Material über mehr als eine Minute zu behalten, starke Auswirkung retroaktiver Hemmung. Olfaktorisches Projektionsfeld: Riechhirn (Hippocampus), Ende der Riechbahn. Ausfall: Anosmie = Aufhebung des Geruchsvermögens. Störungen der Hirnfunktion bei Erkrankungen und Verletzungen des Gehirns Literatur: Spoerri, T. (19758). Kompendium der Psychiatrie. Basel: Karger. Dörner, K. & Plog, U. (1982). Irren ist menschlich oder Lehrbuch der Psychiatrie/Psychotherapie. Rehburg-Loccum: Psychiatrie-Verlag. Weltgesundheitsorganisation (1991). Internationale Klassifikation psychischer Störungen. ICD10, Kapitel V (F). Herausgegeben von H. Dilling, W. Mombour & M.H. Schmidt. Huber: Bern. Vorbemerkung: Mit der ICD-10 wurde die Klassifikation der psychischen Störungen radikal verändert und die frühere Klassifikation aufgegeben. Auf eine Darstellung der Systematik kann hier verzichtet werden. Gleichwohl existieren in der Klinik eine Reihe von Begriffen und Syndromen, die man kennen sollte. Delir: Bewußtseinstrübung, Desorientiertheit, Halluzinationen, wahnhafte Ideen (z.B. Delirium tremens = bei Alkoholismus, Fieberdelirium). Dämmerzustand: traumhafte Bewußtseinseinengung (z.B. epileptischer Dämmerzustand). Benommenheit: Verschiedene Grade von Somnolenz (= krankhafte Schläfrigkeit) bis zum Koma (z.B. Infektionspsychosen). Durchgangssyndrome: kennzeichnen den Beginn bzw. Rückbildung einer hirnorganischen Schädigung (z.B. depressives Syndrom). 59 Apallisches Syndrom: Nimmt eine Sonderstellung unter den Folgezuständen nach Hirntrauma ein. Funktionelle Trennung von Hirnstamm und Hirnmantel (= Pallium), bedeutet Dezerebration. Symptome: Rigor, Spastik, Krämpfe, orale Automatismen (z.B. Leerlaufsaugbewegungen). Körperliche Ursachen von Störungen der Hirnfunktion: Frühkindliche Hirnschäden: Ursachen: Intrauterin (z.B. mangelnde Sauerstoffversorgung), geburtstraumatisch (z.B. Stauung der Hirnnerven unter der Geburt mit Hirnödem), postnatal (meist Infektionskrankheiten). Symptome: Motorische Defekte, Intelligenzdefekte; bei leichtgradigen Schädigungen Stimmungslabilität, Distanzstörungen, Schwererziehbarkeit, Stottern, Enuresis. Leichte Schäden sind oft nur schwer diagnostisch zu sichern. Körperkrankheiten mit Hirnbeteiligung: Infektionskrankheiten (z.B. Pneumonie, Typhus), Herzkrankheiten (bedingen Hypoxie des Gehirns). Hierher gehören auch die endokrinen Psychosyndrome (= psychische Störungen bei Erkrankungen der endokrinen Drüsen, z.B. Hyperthyreose mit Übererregbarkeit, Unruhe und Stimmungsschwankungen). Ernährungsmängel: Hungerdystrophien (aufgrund von Eiweißmangel kommt es zu Ödemen) in Kriegszeiten, etc. können zu einer Funktionsstörung des Gehirns führen. Postoperative Störungen: Meist akut. Ursachen: Blutverlust, Elektrolytstörungen, Infektionen, Narkose, mangelhafte präoperative Vorbereitung (Angst, mangelnde Bearbeitung der Operationsfolgen). Akute und chronische Vergiftungen: Medikamente (z.B. Corticosteroide, Antibiotika, Tuberkulostatika), industrieübliche Lösungsmittel, Schwermetalle (vor allem Blei), Kohlenmonoxid und Leuchtgas, Drogenabhängigkeit, Alkoholismus. Alle genannten Ursachen können zu akuten oder chronischen Störungen der Hirnfunktion führen. Entzündliche Hirnkrankheiten: Früher vor allem die Syphilis (Lues), seit 1943 mit Penicillin gut zu behandeln, Tendenz in jüngster Zeit wieder steigend. Nach dem zeitlichen Ablauf unterscheidet man frühluische Meningitis (wenig auffällige Symptome), Lues cerebrospinalis (3 - 5 Jahre nach Infektion, Erweichungsherde im Gehirn durch Gefäßverschlüsse) und progressive Paralyse (chronische Encephalitis mit Rindenatrophie) oft zusammen mit Tabes dorsalis (Degeneration der Hinterwurzeln des Rückenmarks mit sensiblen Ausfallserscheinungen). - Heute praktisch wichtig die Meningitis (Hirnhautentzündung) oft kombiniert mit Encephalitis (Hirnentzündung). Ursachen: Viren, Bakterien, Mittelohrentzündung, offene Hirnverletzung. Symptome: Nackensteifigkeit, Kopfschmerzen, Bewußtseinstrübung. - Multiple Sklerose: Entmarkungsschäden im gesamten ZNS. Verlauf sehr wechselnd. Folgen: Sehschwäche, Lähmungen, Blasenstörungen. Traumatische Hirnschäden: Bei der Commotio (Hirnerschütterung) anatomisch nicht faßbare Hirnschädigung ohne Dauerfolgen; meist durch stumpfe Gewalteinwirkung. Symptome: Bewußtlosigkeit (kurzdauernd), retrograde und anterograde Amnesie (keine Erinnerung an eine kurze Zeit vor und nach dem Unfall), Übelkeit, Erbrechen, Schwindel, Durchgangssyndrom. Contusio (Hirnquetschung) anatomisch faßbar mit Rindenprellungsherd am Ort der Gewalteinwirkung und am Gegenpol (contre-coup), Hirnödem und Zirkulationsstörungen. Symptome: Längere Bewußtlosigkeit, längere Amnesie, Krämpfe, Blutungen aus Schädelöffnungen, akut-organisches Psychosyndrom („Contusionspsychose“). Als Folge häufig 60 traumatische Epilepsie. Hirnhautblutungen: Beim Epiduralhämatom Blutansammlung zwischen Hirnhaut und Schädelkalotte durch Verletzung der Meningealarterien, beim subduralen Hämatom venöse Sickerblutung (weniger dramatisch). Auslösendes Trauma bei vorgeschädigten Gefäßen oft gering, typisch das sog. „freie Intervall“ nach der Initialsymptomatik, danach schnelle Verschlechterung des Zustandes. Kompression einer Hirnhälfte mit Einklemmen des Hirnstamms durch die Blutung (Kreislauf- und Atemzentrum in der Medulla oblongata!). Therapie: Schädeltrepanation. Hirntumoren: Diese raumfordernden Prozesse bedingen Herdsymptome (unterschiedliche Ausfälle, s. „Großhirnzentren“) bzw. Massenverschiebungen (Einklemmen des Hirnstamms). Symptome: Kopfschmerzen, häufig epileptische Anfälle, Persönlichkeitsveränderungen. Hirngefäßkrankheiten: Synonyme Cerebralsklerose, Hirnarteriosklerose. Häufigste Ursache von Störungen der Hirnfunktion, vor allem im Alter. Es kommt zu Ischämie mit Zerfall von Hirnsubstanz. Symptome: Schwindel, Ohrensausen, Schlafumkehr, Verwirrtheitszustände. Meist erhöhter Blutdruck. In diesem Zusammenhang auch häufig apoplektischer Insult (Schlaganfall). Hirngewebskrankheiten: Hirnatrophische Prozesse verschiedener, hier nicht spezifizierter Ursache. Folge: Präsenile und senile Demenz. Symptome: Merkschwäche (Altgedächtnis intakt), Wortfindungsstörungen, Urteilsschwäche, Desorientiertheit. Epilepsie: Charakterisiert durch wiederholte Anfälle, psychische Veränderungen und pathologische Abläufe im EEG. Zwei Hauptformen: Genuine Epilepsie (erbliche Belastung scheint Hauptursache zu sein) und symptomatische Epilepsie (z.B. Hirntumor, traumatische Hirnschädigung). Kleinere epileptische Anfälle: Bevorzugt in einem bestimmten kindlichen oder jugendlichen Lebensalter, gebunden an verschiedene Reifungsstadien des Gehirns. Z.B. Blitz-Nick-SalaamKrämpfe (BNS, in den ersten 3 Lebensjahren; Vorwärtsbewegung des Kopfes, Einschlagen der Arme; Bewußtseinstrübung; meist als Folge einer frühkindlichen Hirnschädigung) und Pyknolepsie (= Petit Mal, 6. - 10. Lebensjahr; indifferente Absence; kein Hinstürzen; gehört zur genuinen Epilepsie). Großer epileptischer Anfall (= Grand Mal): Häufig durch Aura (halluzinatorische Wahrnehmungen) eingeleitet; Hinstürzen mit Verletzungsgefahr, tonische Krampfstadien gefolgt von rhythmisch klonischen Zuckungen, Terminalschlaf. Allgemeine psychische Veränderungen: Im Denken und Handeln langsam, umständlich, weitschweifig, affektiv monoton mit Neigung zu explosiven Ausbrüchen, Neigung zu überwertigen Ideen. Physiologische Grundlagen von Drogenabhängigkeit und Alkoholismus Literatur: Spoerri (s.o.), Dörner & Plog (s.o.), WHO (s.o.) und Bösel, R. (1981). Physiologische Psychologie. Berlin: de Gruyter. 61 Drogenabhängigkeit (WHO): Zustand periodischer oder chronischer Vergiftung durch ein zentralnervös wirkendes Mittel, der zu seelischer oder seelischer und körperlicher Abhängigkeit von diesem Mittel führt und der das Individuum und/oder die Gesellschaft schädigt. Die ICD-10 listet die folgenden Störungen auf: F 1 Psychische und Verhaltensstörungen durch psychotrope Substanzen F 10 Störungen durch Alkohol F 11 Störungen durch Opioide F 12 Störungen durch Cannabinoide F 13 Störungen durch Sedativa oder Hypnotika F 14 Störungen durch Kokain F 15 Störungen durch andere Stimulantien einschließlich Koffein F 16 Störungen durch Halluzinogene F 17 Störungen durch Tabak F 18 Störungen durch flüchtige Lösungsmittel F 19 Störungen durch multiplen Substanzgebrauch und Konsum anderer psychotroper Substanzen Hier sollen nur ein paar besonders wichtige Störungen genannt werden. Typ Morphin: Opium, gewonnen aus den Kapseln des Schlafmohns, besteht aus einer Mischung verschiedener Opiatsubstanzen. Hauptwirkstoff ist das Morphin. Härteste Droge ist das Heroin, andere Opiate in Hustenmitteln (Kodein). Wirkort: Limbisches System, neuronale Schmerzfilter des Rückenmarks (Afferenzen von Schmerzrezeptoren werden nicht weitergeleitet). Wirkung: Euphorie, nach 1 - 4 Std. Verstimmungszustand. Starke Dosissteigerung erforderlich durch Toleranz (= zelluläre Gewöhnung, beschleunigter Abbau, verzögerte Resorption), starke Entzugssymptome (Bauch- und Gliederschmerzen). Folgen: Beschaffungskriminalität, Hepatitis und AIDS (verunreinigte Spritzen), Infektionsanfälligkeit, Tod durch Überdosierung. Rückfallquote oft 100 %. Chance nur in Therapieketten unter rigoroser Aufsicht. Typ Cocain: Vorkommen in den Blättern des Coca-Strauches. Konsum durch Kauen der Blätter (= Cocaismus, bei peruanischen Indianern; relativ ungefährlich, da nur eine anregende Substanz aufgenommen wird) und Spritzen bzw. Schnupfen (= Cocainismus, hierbei wird Cocain wirksam). Cocain erzeugt starke Abhängigkeit, hohe Dosissteigerung. Anstieg unspezifischer Aktivierung durch die Formatio reticularis. Wirkung: Bei erster Dosis Angstzustand; später anregend mit subjektivem Gefühl der Leistungssteigerung, nach ca. 60 Minuten Mißmut mit Depressionen. Abstinenzsymptome: Schlaflosigkeit, Herzklopfen, Angstsymptome. Typ Cannabis: Vorkommen in den Blütenspitzen von Hanfpflanzen. Harz der Blütenspitzen = Haschisch, getrocknete Blüten und Blätter = Marihuana. Beides kann geraucht werden. Wirkstoff Cannabinol. Wirkung auf das limbische System und die Formatio reticularis. Wahrnehmungseinschränkung mit Übersteigerung einzelner Reize (Illusionen), euphorische Grundstimmung, Dauer des Rauschzustandes ca. 2 Std. Körperliche Gefahren: Entzündung von Mund, Hals und Bindehaut durch Austrocknen, Kreislaufbelastung, hoher Teergehalt der Hanfblätter, Zyklusstörungen, Störungen der Spermienproduktion. Cannabis wird häufig als Einstiegsdroge angesehen. Typ Amphetamin: Alle Weckamine sind mit Amphetamin und dieses wiederum mit Adrenalin chemisch verwandt. Gehandelt werden Weckamine (z.B. Captagon) und Appetitzügler (z.B. Ritalin). Wirkung: Stimulation der Formatio reticularis mit Erregung des Cortex, Unterdrückung 62 der Müdigkeit, Erhöhung der Aufmerksamkeit, Unterdrückung des Hungers. Je nach Dosis Wirkung zwischen 1 - 8 Std., gefolgt von bleierner Müdigkeit. Leistungen quantitativ beeindruckend, qualitativ unterdurchschnittlich. Hohe Toleranz, die starke Dosissteigerungen nötig macht. Mißbrauch führt zu Schlaflosigkeit und Verfolgungsvorstellungen. Typ Barbiturate/Alkohol: Barbiturate, Analgetika und Alkohol haben ähnliche Intoxikations- und Abstinenzsymptome. Alkohol wirkt wie andere Beruhigungsmittel unspezifisch dämpfend im ZNS. An den Neuronen wird durch Hyperpolarisation die Erregungsschwelle heraufgesetzt. Bei geringen Dosen: Hautrötung, aufsteigende Wärme, Wohlbefinden, Störung der Augenmotorik. Bei höheren Dosen: Störungen der Sprachmotorik, motorische Koordinationsstörungen, Aufmerksamkeitsmängel, herabgesetzte Schmerzempfindung. Bei mehr als 2 %o: Reduktion der corticalen Selbstkontrolle, Störung von Atem- und Kreislaufzentren, Koma. Folgen des chronischen Alkoholkonsums: Abbau von Hirnsubstanz durch Einschränkung der O2Versorgung, Leberschäden, Herzschäden, Alkoholpsychosen (Delirium tremens, Alkoholhalluzinose, Korsakow-Syndrom). Delirium tremens: Bewußtseinstrübung, Desorientiertheit, Bewegungsdrang, Halluzinationen („weiße Mäuse“), Tremor; Behandlung mit Distraneurin. Alkoholhalluzinose: Gehörshalluzination bei ungestörtem Bewußtsein. KorsakowSyndrom: Merkfähigkeitsstörungen, Desorientiertheit, Neigung zu Konfabulationen, entwickelt sich aus dem Delirium tremens. Typ Halluzinogene: Chemische Grundstruktur aller Halluzinogene ist der Indolring. Vorkommen: LSD (1943 synthetisiert), Mescalin (mexikanisches Kaktusgift). Wirkung auf das limbische System und die Formatio reticularis. Nach Injektion von LSD bzw. Aufnahme durch den Mund tritt zunächst eine Katerphase mit Brechreiz auf, später tritt der „psychedelische Zustand“ mit Farbund Formvisionen ein. Diese Halluzinationen sind stimmungsabhängig; es handelt sich um eine Neubewertung von Sinneseindrücken. Keine Abstinenzerscheinungen, keine körperliche Abhängigkeit, keine eindeutigen körperlichen Schäden. Allerdings ist die Auslösung psychotischer Phasen (Typ Schizophrenie) möglich. Typ Khat: Vorkommen in der Khat-Pflanze (Äthiopien). Wird als Tee genossen. Pharmakologisch mit den Weckaminen verwandt. Ähnliche Symptomatik wie beim Amphetamin, jedoch schwächer. Physiologisch-biochemische Wirkungen von Psychopharmaka Literatur: Linden, M. & Manns, M. (1977). Psychopharmakologie für Psychologen. Salzburg: Müller. Psychotrope Pharmaka: „Psychopharmaka im weiteren Sinne“. Es handelt sich um Substanzen, die eine obligatorische Wirkung auf die Psyche haben. Die folgende Einteilung entspricht der Hauptwirkung: (01) Analgetika = Schmerzmittel: Schmerzhemmend, entzündungshemmend. 63 (02) Hypnotika = Schlafmittel: In geringen Dosen sedativ-beruhigend, in mittleren Dosen schlaffördernd, in hohen Dosen narkotisch = betäubend. (03) Narkotika = Narkosemittel: Bewirken reversiblen Bewußtseinsverlust, Schmerzfreiheit, Erschlaffung der Muskulatur. (04) Antiemetika = Anti-Brechmittel: Verhindern Erbrechen in Zusammenhang mit Bewegungskrankheiten (Kinetosen). (05) Antiepileptika: Setzen die Krampfschwelle des ZNS herauf. (06) Analeptika: Wirken zentral erregend, z.B. Anregung des Atemzentrums, in höheren Dosen Krampfgifte. (07) Psychoanaleptika: Allgemeine Anregung psychischer Funktionen, z.B. Amphetamin, Coffein. (08) Euphorika: Erhöhen die Stimmungslage. (09) Psychodysleptika = Psychotomimetika = Halluzinogene: Erzeugen psychoseähnliche Zustände mit Halluzinationen (z.B. LSD). (10) Antidepressiva: Zur Therapie bei Depressionen. (11) Neuroleptika = Major tranquilizer: Zur Behandlung psychischer Zustände vorwiegend aus dem schizophrenen Formenkreis. (12) Tranquilizer = Sedativa = Minor tranquilizer: Dämpfung von Angst- und Spannungszuständen. Antidepressiva, Neuroleptika und Tranquilizer bilden die Gruppe der „Psychopharmaka im engeren Sinne“, die vorwiegend in der Psychiatrie eingesetzt werden. Neuroleptika: Beeinflussen schizophrene Zustandsbilder positiv. Substanzklassen: ButyrophenonDerivate (z.B. Haldol, vorrangig antipsychotische Wirkung bei geringer Sedierung) und Phenothiazin-Derivate (z.B. Psyquil; diese Derivate lassen sich in 3 chemische Untergruppen gliedern, die je nach Seitenkette mehr sedierend oder mehr antipsychotisch wirken). Wirkungsmechanismus: Phenothiazine und Butyrophenone führen zu einer Verminderung von Dopamin (Vorstufe von Adrenalin und Noradrenalin, dient selbst auch als Transmitter) an den Dopamin-Rezeptoren der subsynaptischen Membran durch Blockierung der Rezeptoren. Allerdings ist noch offen, ob dieser Mechanismus die psychischen Wirkungen erklären kann. Fest steht jedoch, daß die Neuroleptika die Wirkungen von Psychodysleptika (LSD im Rahmen der sog. Modellpsychose) antagonistisch beeinflussen. Nebenwirkungen: Extrapyramidale Symptome: Störungen des Bewegungsablaufs, Erhöhung des Muskeltonus (neuroleptisch bedingter Parkinsonismus); vegetative Symptome: Blutdrucksenkung, Übelkeit. Antidepressiva: Trizyklische Antidepressiva (chemische Formel besteht aus 3 Ringen, wichtigste Gruppe, Beispiel Laroxyl), tetrazyklische Antidepressiva (4 Ringe, Beispiel Ludiomil), Monoaminooxydase-Hemmer (Beispiel Jatrosom) und Lithiumsalze. Trizyklische und tetrazyklische Antidepressiva haben vor allem stimmungsaufhellende Wirkung (Thymoleptika), MAO-Hemmer wirken vorwiegend antriebssteigernd (Thymeretika). Wirkungsmechanismus: Diskutiert wird die Aminmangel-Hypothese. Antidepressiva verhindern den Abbau der aus den praesynaptischen Speichern freiwerdenden Neurotransmitter. MAOHemmer blockieren dabei die Mono-Amin-Oxydase, die die Neurotransmitter abbaut; die trizyklischen Antidepressiva blockieren den Rücktransport der Neurotransmitter aus dem synaptischen Spalt in die Speicher. Dadurch steigt die Konzentration der Neurotransmitter im synaptischen Spalt. Nebenwirkungen: Psychische Nebenwirkungen: Erhöhung der Suizidalität vor allem bei primär antriebssteigernden Antidepressiva. Vegetative Symptome: Störung der Speichelsekretion. 64 Tranquilizer: Indikation bei neurotischen Störungen mit deutlicher Angstkomponente (z.B. Gespanntheit, Angst, Unruhe, hypochondrische Beschwerden, Phobien etc.). Wichtigste Gruppe die Benzodiazepine (z.B. Librium, Valium). Wirkungsmechanismus: Wirkungsort das limbische System, das für die affektive Färbung des Gesamtverhaltens verantwortlich ist. Spontanaktivität des limbischen Systems bleibt unbeeinflußt, überschießende Erregung wird jedoch abgebremst. Nebenwirkungen: Schwindel, Benommenheit, Übelkeit. Abhängigkeit ist bei chronischer Einnahme möglich. Überblick über den Stoff der Vorlesung im Winter-Semester Entsprechend dem Vorlesungsmanuskript: Definition der Biologischen Psychologie; Anatomischer Aufbau des menschlichen Organismus; Zellen, Gewebe und Organe; Menschliche Ontogenese; Grundlagen der Humangenetik und Erbpsychologie; Grundlagen der Verhaltensbiologie; Funktion des Blutes; Funktion des Herzens; Gefäßsystem; Atmung; Energiehaushalt; Wärmehaushalt; Ernährung; Funktion des Magen-Darm-Kanals; Nierenfunktion Allgemeine Endokrinologie; Hypothalamisch-hypophysäres System; Nebennierenrinde und Glucocorticoide; Hormone der Schilddrüse; Keimdrüsen und Sexualhormone; Sympathico-adrenales System; Pankreashormone und Blutzuckerregelung; Hormonale Regulation des Mineralhaushaltes; Grenzbereiche des endokrinen Systems. Literatur: Schmidt, R.F. (Hrsg.) (19876). Grundriß der Neurophysiologie. Berlin: Springer. Schmidt, R.F. (Hrsg.) (19855) Grundriß der Sinnesphysiologie. Berlin: Springer Beide Bücher sind vergriffen und werden nicht mehr aufgelegt. Ersetzt wurden sie durch: Schmidt, R.F., (Hrsg.) (1998) Neuro- und Sinnesphysiologie. Berlin: Springer. 65 Die alten Bücher sind didaktisch wesentlich besser, vor allem die Abbildungen. Zudem werden grundlegende Tatsachen, z.B. die Hirnnerven, nicht mehr vernünftig abgehandelt. Wer sich die alten Bücher noch besorgen kann, sollte danach lernen. Aufbau des Nervensystems: Die Nervenzellen: Neurone; Synapsen; Effectoren; Rezeptoren. Stütz- und Ernährungsgewebe: Aufgaben der Gliazellen; Interstitium. Die Nerven: Die Nervenfasern; Funktionelle Klassifikation der Nervenfasern; Klassifikation der Nerven; axonaler Transport. Erregung von Nerv und Muskel: Das Ruhepotential: Messung des Membranpotentials; Ursache des Ruhepotentials; Konzentrationsverteilung der Ionen; Die K+-Ionen und das Ruhepotential; Beteiligung der Cl-Ionen am Ruhepotential. Ruhepotential und Na+-Einstrom: Abhängigkeit des Ruhepotentials von der Kaliumkonzentration; Die Membranleitfähigkeit für K+ und Na+; Instabilität des Ruhepotentials bei passiven Ionenstömen. Die Natriumpumpe: Messung des aktiven Transportes; Die gekoppelte Na+-K+-Pumpe; Übersicht über die Ionenströme durch die Membran. Das Aktionspotential: Zeitverlauf der Aktionspotentiale; Auslösung des Aktionspotentials und Erregung; Definition des Aktionspotentials; Die Ionenverschiebungen während des Aktionspotentials; Ionenumsätze während des Aktionspotentials; Das Aktionspotential im Na+Mangel. Kinetik der Erregung: Änderungen der Membranleitfähigkeiten nach einer Depolarisation; Refraktärphasen nach dem Aktionspotential; Der Membrankanal für Na+. Elektrotonus und Reiz: Unter- und überschwellige Reize; Minimaler Reizstrom und Reizzeit. Fortleitung des Aktionspotentials: Leitungsgeschwindigkeit des Aktionspotentials; Mechanismus der Fortleitung; Faktoren die die Leitungsgeschwindigkeit beeinflussen, saltatorische Leitung. Synaptische Übertragung: Die Neuromuskuläre Endplatte: Beispiel einer chemischen Synapse: Bauelemente chemischer Synapsen; Die Endplatte; Nachweis des Endplattenpotentials; Mechanismus der neuromuskulären Übertragung; Die Natur des Endplattenpotentials; Das Schicksal des Acetylcholins; Neuromuskuläre Blockade. Die Quantennatur der chemischen Übertragung: Miniatur-Endplattenpotentiale; Freisetzung in Quanten; Steuerung der Überträgersubstanzfreisetzung durch das praesynaptische Aktionspotential; Beteiligung des Calciums; Verallgemeinerung der Quantenhypothese. Zentrale erregende Synapsen: Erregende postsynaptische Potentiale. EPSP; Ionenmechanismus des EPSP; Die Auslösung des Aktionspotentials; Elektrische Synapsen. Zentralnervöse hemmende Synapsen: Inhibitorische postsynaptische Potentiale im Motoneuron; Ionenmechanismus des IPSP; Hemmende Wirkungen des IPSP; Praesynaptische Hemmung. Überträgerstoffe chemischer Synapsen: Allgemeine Gesichtspunkte; Acetylcholin als Übertägersubstanz im Nervensystem; Adrenerge Überträgersubstanzen; Aminosäuren als Überträgersubstanzen. 66 Überblick über den Stoff der Vorlesung im Sommer-Semester Entsprechend dem Vorlesungsmanuskript: Gehirnanatomie Literatur: Schmidt, R.F. (Hrsg.) (19876) Grundriß der Neurophysiologie. Berlin: Springer (siehe Bemerkung oben). Aufbau des Nervensystems: Der Aufbau des Rückenmarks: Aufbau der Rückenmarkssegmente; Rückenmarkswurzeln. Physiologie kleiner Neuronenverbände, Reflexe: Typische neuronale Verschaltungen: Divergenz; Konvergenz; Zeitliche und räumliche Bahnung; Occlusion; Einfache hemmende Schaltkreise; Fördernde Mechanismen: positive Rückkopplung und synaptische Potenzierung. Der monosynaptische Reflexbogen: Definition des Reflexbegriffs; Die Muskelspindel; Der monosynaptische Dehnungsreflex; Funktion der intrafusalen Muskelfasern. Polysynaptische motorische Reflexe: Beispiele polysynaptischer motorischer Reflexe; Eigenschaften polysynaptischer Reflexe; Motorische und vegetative polysynaptische Reflexe; Angeborene und erworbene Reflexe. Der Muskel: Die Kontraktion des Muskels: Isotonische und isometrische Kontraktion; Zeitverlauf der Einzelzuckung; Feinstruktur des Skelettmuskels; Verschiebungen der Aktin- und Myosinfilamente während der Kontraktion; Molekularer Mechanismus der Kontraktion; Herzmuskulatur und glatte Muskulatur. Abhängigkeit der Muskelkontraktion von Faserlänge und Verkürzungsgeschwindigkeit: Ruhedehnungskurve; Die Kurve der isometrischen Kontraktionsmaxima; Kontraktionskraft und Verkürzungsgeschwindigkeit; Summation von Einzelzuckungen, Tetanus; Mechanismus der Summation. Regulation der Kontraktion eines Muskels: Summation der Kontraktion mehrerer Fasern; Erzeugung der maximalen Muskelkraft; Die motorische Einheit, das Elektromyogramm. Motorische Systeme: Spinale Motorik I: Aufgaben der Muskelspindeln und Sehnenorgane: Aufbau und Lage von Muskelspindel und Sehnenorgan; Entladungsmuster der Muskelspindeln und Sehnenorgane; Dehnungsreflex und reziproke antagonistische Hemmung; Aufgaben der Gamma-Schleife; Segmentale Verschaltung der Ib-Fasern, Aufgaben der Golgi-Organe. Spinale Motorik II: Polysynaptische motorische Reflexe: Flexorreflex und gekreuzter Extensorreflex; Intersegmentale Reflexbögen; Leistungen des isolierten Rückenmarks. Funktionelle Anatomie supramedullärer motorischer Zentren: Supraspinale motorische Zentren, Benennung, Lage im ZNS; Der Tractus cortico-spinalis; Corticale motorische Efferenzen zum Hirnstamm. 67 Reflektorische Kontrolle der Körperstellung im Raum: Anteile des Hirnstammes und ihre Zuflüsse; Querschnittsdurchtrennungen im Hirnstamm; Motorische Leistungen des decerebrierten Tieres, Haltereflexe; Motorische Leistungen des Mittelhirntieres, Stellreflexe; Statische und statokinetische Reflexe. Funktionen der Basalganglien, des Kleinhirns und des motorischen Cortex: Die Rolle der Basalganglien; Die Rolle des Kleinhirns; Pathophysiologie der Basalganglien; Pathophysiologie des Kleinhirns; Die Rolle des motorischen Cortex; Pathophysiologie des motorischen Cortex und seiner Efferenzen; Handlungsantrieb und Bewegungsentwurf. Vegetatives Nervensystem: Funktionelle Anatomie des peripheren vegetativen Nervensystems: Peripherer Sympathicus; Peripherer Parasympathicus; Darmnervensystem; Viscerale Afferenzen. Acetylcholin, Noradrenalin und Adrenalin: Acetylcholin, nicotinerge und muscarinerge Übertragung; Noradrenalin, Adrenalin, α-ß-Rezeptoren-Konzept; Nebennierenmark; Sonstige Überträgersubstanzen im peripheren vegetativen Nervensystem. Glatter Muskel: Myogene Aktivität, Reaktion auf Dehnung, Acetylcholin und Adrenalin: Myogene Aktivität; Zeitverlauf der Kontraktion der glatten Muskulatur; Kraftentwicklung glatter Muskeln auf Dehnung; Neuromuskuläre Übertragung im glatten Muskel. Antagonistische Wirkungen von Sympathicus und Parasympathicus auf vegetative Effectoren: Vegetative Beeinflussung des Herzens; Beeinflussung der Darmmuskulatur durch das vegetative Nervensystem. Zentralnervöse Regulation: Spinaler Reflexbogen, Blasenregulation: Der spinale vegetative Reflexbogen; Segmentale Verschaltung vegetativer Efferenzen mit visceralen und somatischen Afferenzen; Neuronale Regulation der Harnblasenentleerung. Zentralnervöse Regulation: Arterieller Blutdruck, Regulation der Muskeldurchblutung: Regelung des arteriellen Blutdruckes; Regelung der Organdurchblutung während Muskelarbeit. Der Hypothalamus. Die Regulation von Körpertemperatur, Osmolarität des Extracellulärraumes und endokrinen Drüsen: Anatomie des Hypothalamus; Regulation der Körpertemperatur; Regelung der endokrinen Drüsen durch den Hypothalamus; Regelung der Osmolarität (des Wassergehaltes) des Extracellulärraumes. Literatur: Vaitl, D. (1978). Entspannungstechniken. In: L.J. Pongratz (Hrsg.), Klinische Psychologie (= K. Gottschaldt et al. (Hrsg.) Handbuch der Psychologie) Band 8/2 (S. 2104-2143). Göttingen: Hogrefe. VNS und Entspannungstechniken: Folgen einer Stimulation der trophotropen Zonen im Hypothalamus; Physiologische Veränderungen während der Entspannungsreaktion; Physiologische Veränderungen beim autogenen Training (Unterstufen-Übung); Klinische Einsatzmöglichkeiten des autogenen Trainings; Wirkung der transzendentalen Meditation auf das EEG. 68 Literatur: Birbaumer, N. & Schmidt, R.F. (20025). Biologische Psychologie. Berlin: Springer. Methoden der Biologischen Psychologie: Elektro- (EEG) und Magnetenzephalogramm (MEG): Geschichte und Definition; EEG-Rhythmen; Die Regularität der EEG-Wellen; Synchronisation und Spontan-EEG; Postinhibitorische Endladung thalamischer Neurone; Frequenzspektren und Amplitude; Fourier-Analyse; Interpretation des EEGs; Klinisches EEG. Ereigniskorrelierte Hirnpotentiale (EKP): Definition; Mittelungstechnik; Identifikation der Komponenten; Exogene und endogene Komponenten; Skopeutische Verarbeitung; Komponenten und Topographie; Informationsverarbeitung und EKP. Bewußtsein und Aufmerksamkeit: Psychologie der Bewußtseinsformen: Heterogene Bewußtseinsprozesse; Bewußtsein als Schwellenregulation; Bewußtsein und Kurzzeitgedächtnis; Begrenzte Aufmerksamkeit und Bewußtsein; Subliminale Wahrnehmung; Arbeitsgedächtnis; Flaschenhalstheorien; Kritik der Filtertheorie; Orientierung und Habituation; Habituation; Allgemeine Kennzeichen von Habituation; Automatische und kontrollierte Verarbeitung; Willentliche Anstrengung; Ressourcen-Zuordnung. Neuropsychologie der Bewußtseinsformen: Geschichte der Split-brain-Forschung; Aktiver Übertragungsmechanismus; Zwei getrennte Willensimpulse; Zwei Bewußtseinsprozesse; LP und kontrollierte Aufmerksamkeit; Ressourcen-Bereitstellung; LP und die Entstehung bewußter Willenshandlungen. Unspezifische Aktivierungssysteme: Aufsteigendes retikuläres Aktivierungssystem (ARAS); Neurophysiologie tonischer und phasischer Aktivierung; Thalamokortikales „Gating“. Psychophysiologie selektiver Aufmerksamkeit: Anatomie des LCCS; Funktion und Dynamik des LCCS. Literatur: Fahrenberg, J. (19792). Psychophysiologie. In: K.P. Kisker et al. (Hrsg.), Psychiatrie der Gegenwart, Bd. I/1. (S. 109-125). Berlin: Springer. Aktivierungstheorien: Synergismenlehre von Hess; Organismische Aktivations-Theorie von Duffy; Zweifaktorielles Modell der biologischen Basis der Persönlichkeit von Eysenck; Prinzip der richtungsabhängigen funktionalen Fraktionierung von Lacey. Streßtheorien: Streßkonzept von Selye; Notfallfunktion von Cannon; Streß-Schwellenmodell von Cofer und Appley; Kognitives Streßmodell von Lazarus. Spezifitätsproblem: Individualspezifische Reaktionsmuster; Stimulusspezifische Reaktionsmuster. Literatur: Birbaumer, N. & Schmidt, R.F. (19994). Biologische Psychologie. Berlin: Springer. Zirkadiane Periodik, Schlaf und Traum: 69 Schlaf und Traum: Die Klassifikation der Schlafstadien; Verlauf einer Nacht; Tiefschlaf vor Traumschlaf; Augenbewegungen; Motorische Begleiterscheinungen des REM-Schlafes; Weckschwelle und Zustand sensorischer Systeme; Evolution; Ontogenie. Psychophysiologie der Schlafstadien: Schlafdeprivation; REM-Schlaf-Entzug; Psychisches Erleben während REM- und NREM-Schlaf; Traumberichte innerhalb einer Nacht; Methodische Probleme der Schlaf-Gedächtnisforschung; „Lernen im Schlaf“; Lernen im Schlaf beim Menschen; Psychoanalyse. Schlafstörungen: Primäre Schlafstörungen; Idiopathische Insomnia; Verzögertes Einschlafen; DrogenInsomnia; Insomnia bei Verhaltensstörungen; Schlaf-Apnoe; Somnambulismus und andere Störungen des SWS. Plastizität, Lernen, Gedächtnis: Psychologie von Lernen und Gedächtnis: Gedächtnissysteme; Implizites versus explizites Lernen und Gedächtnis; Assoziatives und nicht-assoziatives Lernen; Akquisition (Aneignung) der klassischen Konditionierung; Eigenschaften der klassischen Konditionierung; Ablauf der instrumentellen (operanten) Konditionierung; Primäre Verstärker; Sekundäre Verstärker; Eigenschaften instrumentellen Lernens; Vergleich zwischen klassischer und instrumenteller Konditionierung; Allgemeines Modell des Wissensgedächtnis; Perzeptive Repräsentation im sensorischen Speicher; Elaboriertes Speichern und Erinnern; Merken im Kontext. Entwicklung des Nervensystems: Lernen und Wachstum; Apoptose (Zelltod); Synaptisches Überleben; Physiologische Plastizität. Assoziative neuronale Plastizität: D.O. Hebbs synaptische Theorie spezifischer Gedächtnisinhalte; Reverberatorisches Kreisen; Erregungskreise, Lernen und Wiedergabe von Information; Die Bedeutung von Oszillationen. Zelluläre Korrelate von Lernen: Die Konsolidierungshypothese und Proteine; Hemmung der Proteinbiosynthese (Proteinbiosyntheseinhibition, PSI) und Gedächtnisbildung. Neuropsychologie der Konsolidierung: Korsakoff Syndrom; Der Fall H.M.; Der Hippokampus und Konsolidierung im LZG; Zerebellum und Hippokampus als „Lernmaschinen“; Zwei Formen von Lernen. Motivation: Grundbegriffe der Motivation: Trieb; Homöostatische und nichthomöostatische Triebe; Verstärkung; Charakteristische Eigenschaften von Verstärkung; Interaktion von Trieb und Verstärkung; Anreizmotivation (incentive motivation); Anreize (incentives); Instinktives und motiviertes Verhalten. Durst und Hunger: Bedingungen für das Auftreten einer Durstempfindung; Präresorptive und resorptive Durststillung; Durstschwelle; Die glukostatische Theorie; Konditionierte Nahrungsaufnahme; Thermostatische Hypothese; Lipostatische Hypothese; Faktoren der präresorptiven Sättigung; Faktoren der resorptiven Sättigung; Hypothalamus und Hunger; Hypothalamus und Sättigung. Neurobiologie süchtigen Verhaltens: Intrakranielle Selbstreizung (ICSS) und Belohnung: positive Verstärkung im Tierversuch; Anatomie von ICSS. 70 Emotionen: Psychophysiologie von Gefühlen: Gefühlsdimensionen; Abgrenzung zwischen Gefühlen und Stimmungen; Kommunikative Bedeutung von Gefühlen; Die Rolle motorisch-verhaltensmäßiger Ausdrucksreaktionen für Gefühle; Die Rolle des autonomen Nervensystems für Gefühle: Die James-Lange-Kontroverse; Die Rolle kognitiver Prozesse für Gefühle. Vermeidung (Furcht und Angst): Lernen von Angst; Zwei-Prozeß Theorie der Angstentstehung; Drei Emotionssysteme; Psychopharmaka und das Verhaltenshemmungssystem; Psychologische Therapie der Angst. Trauer - Depression: Trauer; Diagnose der Depression; Soziale und psychologische Faktoren; Genetik der Depression; Zirkadiane Periodik; Biogene Amine; Antidepressiva und die Bewältigung von Angst und Hilflosigkeit; Therapie der Depression. Aggression: Arten von Aggression; Gemeinsamkeiten aggressiven Verhaltens; Sexualhormone; Verhalten von Soziopathen; Psychophysiologie; Soziopathie und septo-hippokampisches Hemmsystem; Prävention und Behandlung. Verhaltensmedizin und Biofeedback: die Anwendung der Gefühlsphysiologie und -psychologie auf Krankheit: Verhaltensmedizin; Verhaltensmedizin der Skoliose; Kurarisierungsversuche Kognitive Prozesse (Denken): Zerebrale Asymmetrie: Das 19. und Anfang des 20. Jahrhunderts; Das 20. Jahrhundert; Ontogenetische Entwicklung von Lateralität; Bedeutung auditorischer Erfahrung; Dominanzanalyse mit dem Wada-Test; Händigkeit; Begabung und Linkshändigkeit; Sensomotorische Funktionen. Evolution und Neurophysiologie der Sprache und ihre Störungen: Evolutionäre Aspekte; Spracherwerb bei nicht-humanen Primaten. Sprechen und Störungen der Sprache: Aphasien und Lateralisation des Gehirns; Broca- und WernickeRegion; Lokalisation der Aphasien; Broca-Aphasie; Wernicke-Aphasie. Die Assoziationsareale des Neocortex: Anatomie; Ideomotorische und konstruktive Apraxie; Visuellräumliche Funktionen; Kontralateraler Neglekt; Neglekt und Aufmerksamkeit; Kurzzeitgedächtnis (KZG); Zeitliche Kontiguität; Handlungspläne und korrolare Entladungen; Der Zerfall von Verhaltensplänen; Psychochirurgie und frontale Leukotomie; Pseudopsychopathie; Funktionen des Temporallappens; Visuelle Unterscheidung; Akustische Unterscheidung und Sprache. Literatur: Schmidt, R.F. (Hrsg.) (19855). Grundriß der Sinnesphysiologie. Berlin: Springer (siehe Bemerkung oben). Allgemeine Sinnesphysiologie, Psychophysik: Grundbegriffe der allgemeinen Sinnesphysiologie: Sinnesorgane; Modalität, Qualität, spezifische Sinnesreize; Quantität, Schwelle; Sinneseindruck, Wahrnehmung; Abbildungsverhältnis von Phänomen und Wahrnehmung, objektive und subjektive Sinnesphysiologie. Messung der Intensität von Empfindungen, Psychophysik: Eigenmetrik; Schätzung des Vielfachen einer Empfindungsintensität; Intermodaler Intensitätsvergleich; Eigenmetrik mit Hilfe von Unterschiedsschwellenschritten. 71 Räumliche, zeitliche und affektive Aspekte der Empfindungen: Raumdimension der Empfindung; Kontrast; Zeitdimension der Empfindung. Neurophysiologie sensorischer Systeme: Transformation von Reizen in Rezeptoren: Der adäquate Reiz, Einteilung der Rezeptoren; Das Rezeptorpotential; Der Transduktionsprozeß, primäre und sekundäre Sinneszellen; Das Rezeptorpotential als Generator für fortgeleitete Aktionspotentiale; Adaptation; Die Transformation von Reizintensität in Entladungsfrequenz. Sensorischen Funktionen des Zentralnervensystems - Übersicht: Periphere Nerven, Spinalnerven, Hinterwurzeln und ihre Innervationsgebiete; Die Gehirnnerven; Zentrale Stationen der Sensorik; Anatomie des spezifischen Systems der Somatosensorik; Anatomie des unspezifischen Systems. Eigenschaften und Arbeitsweise sensorischer Neurone und Neuronenverbände: Laterale Inhibition; Descendierende Hemmung; Das rezeptive Feld; Reizstärke-Reizantwort-Beziehungen, Unterschiedsschwellen. Somatosensorik: Rückenmark, aufsteigende Bahnen und Hirnstamm: Verschaltung der Afferenzen im Hinterhorn; Aufsteigende Bahnen des Rückenmarks; Trigeminuskerne und ihre aufsteigenden Bahnen; Die Formatio reticularis. Somatosensorik: Thalamus und Cortex: Der spezifische Thalamuskern der Somatosensorik; Somatosensorische Projektionsareale des Cortex; Das spezifische thalamo-corticale System und die bewußte Sinneswahrnehmung; Assoziationsfelder des Cortex; Extralemniscales System und bewußte Wahrnehmung. Somatoviscerale Sensibilität: Mechanorezeption: Empfindungsschwelle und Intensitätsfunktion mechanischer Hautreizung; Räumliches Auflösungsvermögen; Druckrezeptoren (Intensitätsdetektoren); Berührungsrezeptoren (Geschwindigkeitsdetektoren); Vibrationsrezeptoren (Beschleunigungsdetektoren); Mechanosensible freie Nervenendigungen der Haut. Tiefensensibilität: Qualitäten der Tiefensensibilität; Rezeptoren der Tiefensensibilität; Zentrale Integration; Körperschema und Körperstellung. Thermorezeption: Statische Temperaturempfindungen; Dynamische Temperaturempfindungen; Kaltund Warmrezeptoren; Rezeptorfunktion und Thermorezeption; Sonderformen der Temperaturempfindung. Viscerale Sensibilität: Cardiovasculäres System; Gastro-Intestinal System; Renales System. Nociception und Schmerz: Schmerzqualitäten und Schmerzkomponenten: Schmerzqualitäten. Neurophysiologie und Psychophysik des Schmerzes: Nociceptoren; Zentrale Weiterleitung und Verarbeitung; Schmerzadaptation. Pathophysiologie des Schmerzes: Spezielle und abnorme Schmerzformen: Projizierter Schmerz; Neuralgie; Kausalgie; Übertragener Schmerz; Störungen der zentralen Schmerzverarbeitung. Schmerzbeeinflussung und Schmerztherapie: Pharmakologische Schmerzbehandlung; Physikalische Schmerzbehandlung; Psychologische Methoden der Schmerzbekämpfung. 72 Physiologie des Sehens: Das Auge: Das optisches System des Auges; Regelprozesse im dioptrischen Apparat; Pupillenreaktionen; Refraktionsanomalien; Die Netzhaut. Psychophysiologie der visuellen Wahrnehmung: Das Eigengrau; Graustufen; Simultankontrast; Der successive Hell-Dunkelkontrast, Nachbilder; Die Sehschärfe; Der blinde Fleck; Photopisches und skotopisches Sehen; Der zeitliche Verlauf der Hell-Dunkeladaptation, Blendung; Die zeitlichen Eigenschaften der visuellen Wahrnehmung; Das Farbensehen; Weiß und Schwarz als Farbe; Binocularsehen; Gestaltwahrnehmung. Neurophysiologie des Sehens: Der photochemische Primärprozeß; Das Rezeptorpotential; Neurophysiologie retinaler Ganglienzellen; Neurophysiologie des Simultankontrastes; Die Reaktion retinaler Ganglienzellen auf farbige Lichtreize; Die Projektion der Netzhaut in das Zentralnervensystem; Die Signalverarbeitung im Corpus geniculatum laterale; Die Neurone des visuellen Cortex. Augenbewegungen und sensorisch-motorische Integration beim Sehen: Konjugierte Augenbewegungen, Vergenzbewegungen; Die zeitlichen Eigenschaften der Augenbewegungen; Die Blickmotorik; Augenbewegungen und visuelle Wahrnehmung, Nystagmus; Augenbewegungen beim freien Sehen. Physiologie des Hörens: Anatomischer Aufbau des Ohres. Die Leistungen des Hörsystems: Physikalische Eigenschaften der Schallreize; Schallereignis und subjektive Hörempfindung: Technische Verfahren zur Beurteilung von Lärm; Akustische Raumorientierung. Die Aufgaben des Mittelohres und des Innenohres: Aufgaben des Mittelohres; Schallaufnahme im Innenohr, Ortstheorie; Reizaufnahme durch die Haarzellen; Unterscheidung zwischen Mittelohrund Innenohrschwerhörigkeit. Der Nervus acusticus und die höheren Stationen der Hörbahn: Erregungsbedingungen der Hörnervenfasern; Verlauf der Hörbahn. Physiologie des Gleichgewichtssinnes: Anatomischer Aufbau und Physiologie des peripheren Organs: Rezeptoren des Gleichgewichtsorgans und ihre Erregungsbedingungen; Aufbau und Aufgaben der Statolithen- und Bogengangsorgane. Die zentralnervösen Verschaltungen und die Leistungen des Gleichgewichtssinnes: Zentrale Verbindungen der Rezeptoren des Gleichgewichtsorgans; Statische und statokinetische Reflexe, Vestibulärer Nystagmus. Entsprechend dem Vorlesungsmanuskript: Störungen der Hirnfunktion bei Erkrankungen und Verletzungen des Gehirns; Physiologische Grundlagen von Drogenabhängigkeit und Alkoholismus; Physiologisch-biochemische Wirkungsmechanismen von Psychopharmaka. 73 Hinweise zur Prüfung: Prüfungsgebiet in der 2 stündigen Klausur ist die Vorlesung im WS und SS. Der Inhalt wurde vorstehend umrissen. Pro Doppelstunde wird im Durchschnitt 1 Frage gestellt, so daß sich für die Gesamtklausur 52 Fragen ergeben. Die Prüfungsfragen verteilen sich in etwa auf den Prüfungsstoff wie folgt: Anatomischer Aufbau des Organismus Zellen, Gewebe und Organe Menschliche Ontogenese Humangenetik und Erbpsychologie Verhaltensbiologie Blut Herz und Gefäßsystem Atmung Energie- und Wärmehaushalt Ernährung und Magen-Darm-Kanal Nierenfunktion und Wasserhaushalt Hormonphysiologie Elektrophysiologie Anatomie des ZNS und Rückenmarks Reflexphysiologie Muskel und motorische Systeme Vegetatives Nervensystem und Entspannungstechniken EEG und EKP Bewußtsein und Aufmerksamkeit Aktivierungs- und Stresstheorien, Spezifitätsproblem Schlaf und Traum Plastizität, Lernen und Gedächtnis Motivation, Emotion und kognitive Prozesse Sinnesphysiologie Störungen der Hirnfunktion, Drogen und Psychopharmaka 1 1 3 2 2 1 3 1 1 2 1 6 3 1 1 3 3 1 2 1 1 2 2 7 1 74 Übungsklausur Biologische Psychologie Aufgabentypen: (1) Einfachauswahl: Auf eine Frage oder unvollständige Aussage folgen 5 mit A - E gekennzeichnete Antworten oder Ergänzungen, von denen eine einzige ausgewählt werden soll, und zwar entweder die einzig richtige oder die beste von mehreren möglichen oder wenn es besonders gekennzeichnet ist, die nicht zutreffende. (2) Zuordnungsaufgaben - Aufgabengruppen mit gemeinsamem Antwortangebot: Jede dieser Aufgabengruppen besteht aus (a) einer Liste mit numerierten Begriffen, Fragen oder Aussagen (Liste 1 = Aufgabengruppe) (b) einer Liste von 5 durch die Buchstaben A - E gekennzeichneten Antwortmöglichkeiten (Liste 2) Zu jeder numerierten Aufgabe der Liste 1 soll aus der Liste 2 die eine Antwort A - E ausgewählt werden, die für zutreffend gehalten wird oder von der man meint, daß sie im engsten Zusammenhang mit dieser Aufgabe steht. Man sollte beachten, daß jede Antwortmöglichkeit A - E auch für mehrere Aufgaben der Liste 1 die Lösung darstellen kann. (3) Kausale Verknüpfung: Dieser Aufgabentyp besteht aus drei Teilen: Teil 1: Aussage 1 Teil 2: Aussage 2 Teil 3: Kausale Verknüpfung (weil) Jede der beiden Aussagen kann unabhängig von der anderen richtig oder falsch sein. Wenn beide Aussagen richtig sind, so kann die Verknüpfung durch „weil“ richtig oder falsch sein. Der richtige Lösungsbuchstabe soll nach Prüfung der einzelnen Teile dem nachfolgenden Lösungsschema entnommen werden. Antwort A B C D E Aussage 1 richtig richtig richtig falsch falsch Aussage 2 richtig richtig falsch richtig falsch Verknüpfung richtig falsch - (4) Aussagenkombinationen: Bei diesem Aufgabentyp werden mehrere durch eingeklammerte Zahlen gekennzeichnete Aussagen gemacht. Die zutreffende Lösung soll unter den 5 vorgegebenen Aussagekombinationen A - E ausgewählt werden. (5) Freie Aufgabenbeantwortung: Schilderung bestimmter Sachverhalte in Stichworten, Aufzählungen, Anfertigung von Diagrammen. 75 (01) Im Serum eines Patienten mit der Blutgruppe 0 agglutinieren die Erythrozyten eines Spenders mit der Blutgruppe (1) A (2) B (3) AB (A) keine der Aussagen ist richtig (B) nur 1 ist richtig (C) nur 2 ist richtig (D) nur 3 ist richtig (E) 1 - 3 = alle sind richtig (02) Welche Aussage trifft zu? Die Wirkung des Parasympathikus am Ventrikelmyocard ist (A) negativ chronotrop (B) negativ dromotrop (C) negativ inotrop (D) negativ bathmotrop (E) physiologisch bedeutungslos (03) Welche der folgenden Summen entspricht dem Lungenvolumen am Ende einer normalen Inspiration? (A) Residualvolumen + Inspirationskapazität (B) Residualvolumen + Atemvolumen (C) Funktionelle Residualkapazität + Atemvolumen (D) Exspiratorisches Reservevolumen + Inspiratorisches Reservevolumen (E) Residualvolumen + Exspiratorisches Reservevolumen (04) Ordnen Sie den in Liste 1 genannten Nährstoffen ihre physiologischen Brennwerte (Liste 2!) zu! Liste 1 Liste 2 1 ..... Kohlenhydrat (A) 4,1 kcal/g (B) 5,6 kcal/g 2 ..... Fett (C) 4,1 cal/g (D) 9,3 kcal/g 3 ..... Eiweiß (E) 9,3 cal/g 76 (05) Die Zusammensetzung des Primärharns unterscheidet sich vom Plasma vor allem durch das Fehlen größerer Eiweißmoleküle, weil im distalen Tubulus Glukose, Aminosäuren und filtriertes Protein fast vollständig resorbiert werden. Antwort A B C D E Aussage 1 richtig richtig richtig falsch falsch Aussage 2 richtig richtig falsch richtig falsch Verknüpfung richtig falsch - (06) Das Ruhemembranpotential einer Nervenmembran (1) ist mit dem K+-Gleichgewichtspotential identisch (2) weicht nur unerheblich vom K+-Gleichgewichtspotential ab (3) hat aktiven Na+-K+-Transport zur Voraussetzung (4) ändert sich periodisch („slow waves“) aufgrund einer elektrogenen Na+Pumpe (5) ist unabhängig von der extrazellulären K+-Konzentration (A) nur 1 ist richtig (B) nur 4 ist richtig (C) nur 2 und 3 sind richtig (D) nur 4 und 5 sind richtig (E) nur 2, 3 und 5 sind richtig (07) Welche Aussage trifft nicht zu? Das Endplattenpotential (EPP) bei der neuromuskulären Erregungsübertragung) (A) wird durch Acetylcholin ausgelöst (B) wird unter Einwirkung von Curare vermindert (C) entsteht nach dem Eintreffen eines Nervenaktionspotentials in der Endplatte (D) wird durch Blockade der Cholinesterase verstärkt (E) ist normalerweise unterschwellig für die Auslösung eines Muskelaktionspotentials (08) Folgende hormonproduzierende Organe sind lebensnotwendig und müssen bei einem Ausfall mittels einer Substitutionstherapie behandelt werden: (1) Nebennierenrinde (2) Nebenschilddrüse (3) Hypophyse (4) Pankreas (5) Hypothalamus (A) nur 5 ist richtig (B) nur 1 und 5 sind richtig (C) nur 1, 3 und 5 sind richtig (D) nur 2, 3 und 4 sind richtig 77 (E) 1 - 5 = alle sind richtig (09) Ordnen Sie den in Liste 1 genannten Hormonen ihre Bildungsorte (Liste 2) zu! Liste 1 Liste 2 1 ... Adiuretin (A) Nebenschilddrüse (B) Nebennierenmark 2 ... ACTH (C) Zona glomerulosa (D) Hypophyse 3 ... Gonadotropine (e) Hypothalamus (10) Welches der folgenden Symptome gehört nicht zum Cushing-Syndrom? (A) Stammfettsucht (B) Striae am Bauch infolge verstärkter Gluconeogenese (C) erhöhte Infektanfälligkeit (D) erhöhter Blutdruck (E) eingeschränkte glomeruläre Filtrationsrate (11) Wie entsteht Riesenwuchs? (1) durch Überproduktion von GH in der Kindheit (2) durch verfrühte Pubertät (3) durch verspäteten Epiphysenschluß (4) durch Überschuß an Parathormon in der fetalen Entwicklung (5) durch Überschuß an Thyroxin (A) nur 1 ist richtig (B) nur 3 ist richtig (C) nur 1 und 3 sind richtig (D) nur 2 und 3 sind richtig (E) 1 - 5 = alle sind richtig (12) Ordnen Sie den in Liste 1 genannten Strukturen des ZNS die entsprechenden Hirnteile zu! Liste 2 Liste 1 1 ..... Kreislaufzentrum (A) Telencephalon (Großhirn) (B) Medulla oblongata (Nachhirn) 2 ..... Hypothalamus (C) Metencephalon (Hinterhirn) (D) Diencephalon (Zwischenhirn) 3 ..... Vierhügelplatte (E) Mesencephalon (Mittelhirn) 78 (13) Welche der folgenden Aussagen trifft für den Flexorreflex zu? (1) reine Reflexzeit von 0,6 sec (2) nicht segmental (mehrere Segmente) (3) monosynaptisch (4) durch Aktivität der Muskelspindel ausgelöst (5) funktioniert nur an den oberen Extremitäten (A) nur 1 ist richtig (B) nur 1, 2 und 3 sind richtig (C) nur 2, 4 und 5 sind richtig (D) nur 2 ist richtig (E) keine Aussage trifft zu (14) Nennen Sie die Überbegriffe für die folgenden Pharmaka und Drogen: (A) Valium(R) .................... (B) Barbiturate .................... (R) (C) Haldol .................... (D) Mescalin .................... (E) Amphetamine .................... (15) Wo werden hohe Schallwellen absorbiert? (1) in der Nähe des ovalen Fensters (2) im Macula-Organ (3) im Corti'schen Organ (4) am Helicotrema (5) in den Bogengängen (A) nur 1 ist richtig (B) nur 1 und 3 sind richtig (C) nur 2, 3 und 4 sind richtig (D) nur 3 und 4 sind richtig (E) 1- 5 = alle sind richtig (16) Wodurch ist das hohe Auflösungsvermögen des Gesichtssinns bedingt? (A) durch die genaue sphärische Krümmung von Linse und Hornhaut (B) durch die Struktur des Glaskörpers (C) durch die Organisation des rezeptiven Feldes in der Retina und das Prinzip der lateralen Hemmung (D) durch die hohe Konvergenz im Bereich der Stäbchen (E) durch den Astigmatismus 79 (17) Welche der folgenden akustischen Skalen ist wirklich eigenmetrisch? (A) die Dezibel-Skala (B) die Schalldruck-Skala (C) die sone-Skala (D) die phon-Skala (E) keine der genannten Skalen (18) Ordnen Sie den in Liste 1 genannten Autoren die entsprechenden Aktivierungstheorien (Liste 2) zu! Liste 1 Liste 2 1 ..... Berlyne (A) Synergismenlehre (ergotrop-trophotrop) (B) organismische Aktivationstheorie 2 ..... Lindsley (C) reticulo-corticale Aktivationstheorie (D) Erregungspotential-Verstärkungs-Funktion 3 ..... Hess (E) Prinzip der richtungsabhängigen funktionalen Fraktionierung (19) Zur Orientierungsreaktion gehören: (1) steigende Atemfrequenz (2) Ansteigen des Hautwiderstandes (3) Senkung der Reizschwelle für ankommende Stimuli (4) Erweiterung der Fingergefäße (5) biphasischer Verlauf der Herzfrequenz (A) nur 1 und 4 sind richtig (B) nur 1, 2 und 5 sind richtig (C) nur 1, 3 und 5 sind richtig (D) nur 2, 3 und 4 sind richtig (E) 1 - 5 = alle sind richtig (20) Welche Aussage für den REM-Schlaf trifft nicht zu? (A) Erniedrigung der Herzfrequenz (B) schnelle, richtungslose Bewegungen des Augapfels (C) Erektion des Penis (D) Erhöhung der Atemfrequenz (E) Erniedrigte Entladung im EMG des Kopfbereichs 80 (21) Vermehrte Sympathikuserregung führt zu (1) Pupillenverengung (2) Konstriktion der Hautgefäße (3) Konstriktion der Bronchialmuskeln (4) vermehrter Salzsäuresekretion im Magen (A) nur 1 ist richtig (B) nur 2 ist richtig (C) nur 1 und 2 sind richtig (D) nur 2 und 4 sind richtig (E) 1 - 4 = alle sind richtig (22) Welche Aussage trifft für das Parkinson-Syndrom nicht zu? (A) Dopaminmangel in den Basalganglien (B) Hypotonus der Muskulatur (C) Ruhetremor (D) Akinese (E) mimische Starre (23) Welche der genannten motivationalen Zustände rechnet man zu den nicht-homöostatischen Triebmechanismen? (1) sexuelle Erregung (2) Durst (3) Explorationsverhalten (4) Schlaf (5) Hunger (A) nur 1 und 3 sind richtig (B) nur 1 und 4 sind richtig (C) nur 1, 3 und 5 sind richtig (D) nur 2, 3 und 5 sind richtig (E) keine Aussage trifft zu (24) Phobisches Verhalten entsteht meist auf der Basis aktiven Vermeidens, weil aktives Vermeiden negativ verstärkt wird. Antwort A B C D E Aussage 1 richtig richtig richtig falsch falsch Aussage 2 richtig richtig falsch richtig falsch Verknüpfung richtig falsch - 81 (25) Eine bedingte Reaktion kann immer nur von ein und demselben Reiz ausgelöst werden, weil die Verbindung nicht auf ähnliche Reize generalisiert. Antwort A B C D E Aussage 1 richtig richtig richtig falsch falsch Aussage 2 richtig richtig falsch richtig falsch Verknüpfung richtig falsch - (26) Das Erlernen des Hebeldrucks ist ein Vorgang (A) des bedingten Reflexes (B) des klassischen Konditionierens (C) des operanten Konditionierens (D) des Lernens von Signalen (E) des mechanischen Lernens Lösungsschlüssel: (01) E (02) E (03) C (04) 1A, 2D, 3A (05) C (06) C (07) E (08) E (09) 1E, 2D, 3D (10) E (11) C (12) 1B, 2D, 3E (13) D (14) (A) Tranquilizer, (B) Hypnotika/Schlafmittel, (C) Neuroleptica (D) Halluzinogene, (E) Psychoanaleptica/Aufputschmittel (15) B (16) C (17) C (18) 1D, 2C, 3A (19) C (20) A (21) B (22) B (23) A (24) D