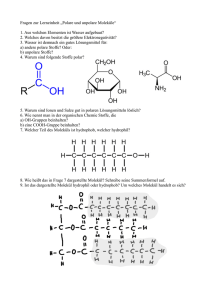
Lösungen
Werbung
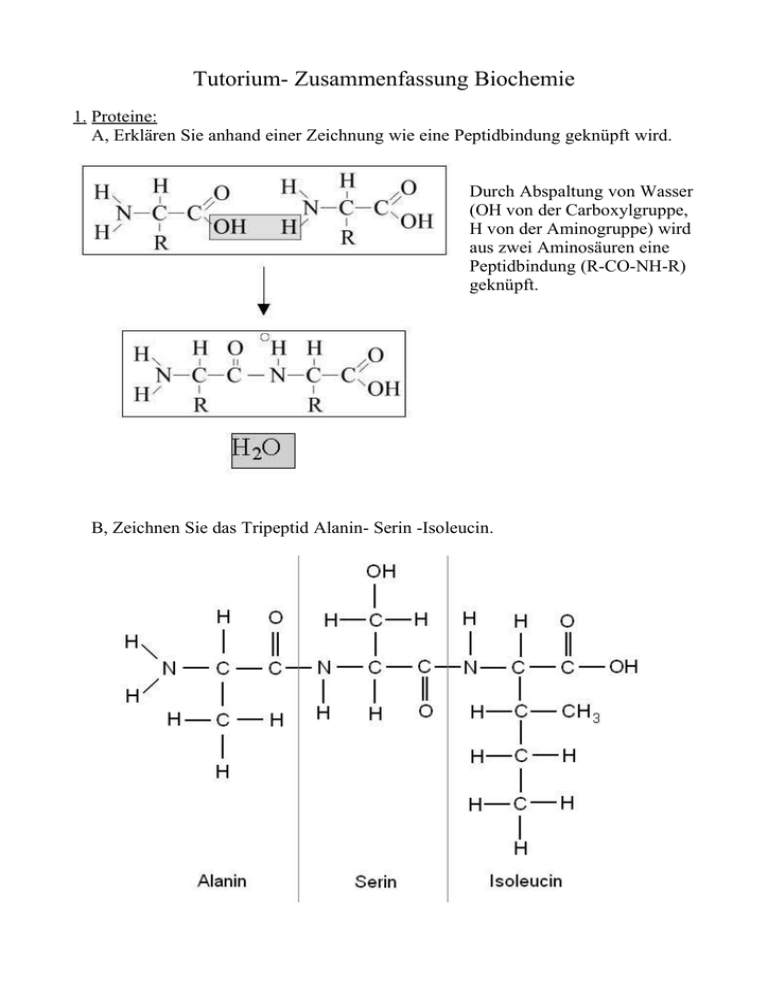
Tutorium- Zusammenfassung Biochemie 1. Proteine: A, Erklären Sie anhand einer Zeichnung wie eine Peptidbindung geknüpft wird. Durch Abspaltung von Wasser (OH von der Carboxylgruppe, H von der Aminogruppe) wird aus zwei Aminosäuren eine Peptidbindung (R-CO-NH-R) geknüpft. B, Zeichnen Sie das Tripeptid Alanin- Serin -Isoleucin. C,Erstellen Sie eine Mindmap zum Thema „Aminosäuren“ Strukturformeln: Abkürzungen, Namen und Besonderheiten: Abk. Voller Name Seitenkettentyp Masse Isoelektr. Punkt 6.11 A Ala Alanin hydrophob 89.09 C Cys Cystein hydrophil 121.16 5.05 D Asp Asparaginsäure sauer 133.10 2.85 E Glu Glutaminsäure sauer 147.13 3.15 F Phe Phenylalanin hydrophob 165.19 5.49 G Gly Glycin hydrophil 75.07 6.06 Bemerkungen "Grundtyp" der meisten Aminosäuren zwei Cysteine können eine Disulfidbindung ausbilden. Reaktionsfolge α-Ketoglutarat Glu Gln ermöglicht spontane Bindung des Zellgifts Ammoniak durch Hydrolyse Reaktion zu Tyrosin durch zwei Wasserstoffatome am α-C-Atom ist Glycin nicht optisch aktiv. H His Histidin basisch 155.16 7.60 I Ile hydrophob 131.17 6.05 K L Lys Lysin Leu Leucin basisch hydrophob 146.19 9.60 131.17 6.01 M Met Methionin hydrophob 149.21 5.74 N Asn Asparagin hydrophil 132.12 5.41 P Pro Prolin hydrophob 115.13 6.30 Q Gln Glutamin hydrophil 146.15 5.65 R Arg Arginin basisch 174.20 10.76 S Ser Serin hydrophil 105.09 5.68 T Thr Threonin hydrophil 119.12 5.60 U Sec Selenocystein hydrophil 169,06 - V Val Valin hydrophob 117.15 6.00 W Trp Tryptophan hydrophob 204.23 5.89 Y Tyr Tyrosin hydrophil 181.19 5.64 Isoleucin pK-Wert im Neutralbereich; ermöglicht Säure/BasenKatalyse; oftmals an enzymatischen Reaktionen beteiligt zusätzliches Chiralitätszentrum in der Seitenkette Methylgruppentransfer der endständigen CH3-Gruppe der Seitenkette durch Thioethergruppe auf andere Moleküle möglich substituierte α-Aminogruppe (Iminosäure), kann Proteinstrukturen wie α-Helices oder β-Faltblätter unterbrechen. cis- oder trans Konformation in Proteinen. Biosynthese aus Glu über Glu-Semialdehyd, Ringschluss und Reduktion universeller NH2-Donor im Stoffwechsel Metabolit im Harnstoffzyklus: Spaltung in Orn und Harnstoff. Kann energiereiches N-Phosphat bilden im Protein phosporylierbar (Kinasesubstrat), besonders kleine polare Seitenkette, oftmals im aktiven Zentrum von Proteasen zusätzliches Chiralitätszentrum in der Seitenkette, im Protein phosporylierbar (Kinasesubstrat) aktives Zentrum von Selenoenzymen (GlutathionPeroxidase, Deiodase) bestimmt (neben Phe und Tyr) das Absorptionsspektrum von Proteinen im Protein phosporylierbar (Substrat von Tyr-Kinasen) D,Erklären Sie die Begriffe Primärstruktur, Sekundärstruktur, Tertiärstruktur und Quartärstruktur anhand des Proteins Hämoglobins. Welche Funktionen erfüllen die jeweiligen Strukturen? Primärstruktur: Die Primärstruktur eines Proteins eintpricht seiner Aminosäurensequenz. Diese Sequenz bestimmt auch die anderen Strukturen. Nur wenn die passenden Aminosäuren an der richtigen Position liegt können sich die richtigen Sekändär- und Tertiärstrukturen ausbilden. Bsp: Hämoglobin: Durch den Austausch einer einzigen Aminosäure kann eine schwere Krankheit, die Sichelzellanämie entstehen: a) Aminosäurensequenz (AS-Sequenz) des normalen Hämoglobins (b-Kette): Val – His – Leu – Thr – Pro – Glu – Glu – Lys b) Aminosäurensequenz (AS-Sequenz) des Sichelzellhämoglobins (b-Kette) : Val – His – Leu – Thr – Pro – Val – Glu – Lys Sekundärstruktur: Die Sekundärstruktur von Proteinen ist durch sich wiederholende Elemente gekennzeichnet. Sie werden über Wasserstoffbrückenbindungen gebildet. Häufige Motive sind: α – Helix β – Faltblatt β – Turn Rondom Coil Bsp: Hämoglobin: Auch im Hämoglobin findet man typische Sekundärstrukturen. Tertiärstruktur: Die Tertiärstruktur stellt die spezifische Faltung eines Proteins dar. Bindungstypen: Disulfidbindung Ionische WW Hydrophobe WW Wasserstoffbrückenbindungen und weitere.... Bsp: Hämoglobin: Jede der 2 Ketten hat eine induviduelle Tertiärstruktur. Quartärstruktur: Bei einer Quartärstruktur handelt es sich um die Assoziierung mehrerer Peptidketten. Dabei können auch Moleküle, die keine Polypeptide sind, mit verknüpft sein. Bsp: Hämoglobin: Tetramer aus zwei verschiedenen Globin- Ketten (2xα- und 2xβ-Kette). Bei jedem Globin ist außerdem eine Häm- Gruppe dabei: F, Erklären Sie die Begriffe Wechselzahl, Michaelis-Menten- Konstante, isoelektrischer Punkt, Chiralität, amphotere Substanzen, Denaturierung, Chaperone. Wechselzahl: Beschreibt die Anzahl an Substrat, die ein Enzym (bei Sättigung mit Substrat) in einer Zeiteinheit umsetzen kann. kcat = Vmax/Enzymkonzentration Katalase: kcat = 10.000.000 mol s-1 RubisCO (Ribulose 1,5- bisphosphat -carboxylase): kcat = 3 mol s-1 Michaelis- Menten-Konstante: Diese Konstante beschreibt die Affinität, die ein Enzym zu seinem Substrat aufweist. Der sogenannte Km- Wert ist die Substratkonzentration, bei der die Halbmaximale Geschwindigkeit erreicht wird. Isolelektrischer Punkt: Dieser Punkt bezeichnet den pH- Wert, bei dem ein Molekül keine Nettoladung aufweist. Chiralität: Moleküle, die sich mit ihrem Spiegelbild nicht decken, sind chiral. Die beiden Formen, die sich wie Bild und Spiegelbild verhalten, nennt man Spiegelbildisomere oder Enantiomere. Amphotere Substanzen: (Ampholyte) Substanzen, die sowohl Protonen abgeben als auch solche aufnehmen können: Beispiele sind Wasser sowie Ammoniak und natürlich Aminosäuren Denaturierung: Bei Proteinen spricht man von Denaturierung, wenn die Tertiärstruktur verändert wird. Diese Veränderung kann reversibel oder irreversibel sein. Mögliche Ursachen: Hohe Salzkonzentration Extreme pH- Werte Hohe Temperaturen Schwermetalle Chaperone: „Anstandsdamen der Proteine“ Diese Proteine helfen den nascierenden Proteinen bei der Faltung. Andere Hilfsproteine sind z. B. Die HitzeSchock- Proteine (HSPs) G, Wie kann man Proteine aufreinigen? – – Selektive Präzipitation (z. B. Ammoniumsulfat, Hitze...) Chromatographische Methoden: – Ionenaustauschchromatographie (Trennung nach Ladung) – Gelfiltration (Trennung nach Größe) – Affinitätschromatographie (Trennung über Bindungseigenschaften – Tags!) 2. Kohlenhydrate: A, Erstellen Sie eine Mindmap zum Thema „Zucker“ (Monosaccheride, Disaccheride, Polysaccheride). B, Erklären Sie die Begriffe Enantiomere, Epimere, Diastereomere, anomeres CAtom. Enantiomere: Spiegelbildliche, chirale Moleküle Epimere: Epimere untscheiden sich in der Konfiguration an einem einzigen CAtom (D-Allose und D-Glucose sind C-3 Epimere) Diastereomere: Isomere die nicht Spiegelbilder sind (z.b.L-Glucose + D-Allose) Anomeres C-Atom: Durch die Bildung des cyclischen Halbacetals entsteht ein zusätzliches chirales C-Atom. Dieses bezeichnet man als anomeres C-Atom, die bei der Cyclisierung gebildete Hydroxylgruppe als anomere OH-Gruppe. C,Nennen Sie einige biologische Funktionen von Kohlenhydraten. – – – – – Speicherstoffe (Stärke, Amylose) Rückgrat der Nukleinsäuren (Ribose bzw. Desoxyribose) Zellwandbestandteile (Cellulose, Chtitin) Energielieferant (Glucoe, Fructose -- Glycolyse ..... 3. Nukleinsäuren: A, Zeichnen Sie die Strukturformel von ATP. B, Nennen Sie Unterschiede zwischen RNA und DNA. DNA RNA Desoxyribose Ribose Thymin Uracil Doppelhelix Einzelsträngig Keine Sekundärstrukturen Sekundärstrukturen Träger der Erbinformation Kopie für Translation C,Wie kann man den Anteil der Basen in der DNA experimentell ermitteln? Durch Denaturierung: Zwischen A und T bilden sich zwei H- Brücken aus, zwischen C und G drei. Je höher der GC- Gehalt in einem DNA- Stück ist, umso schwerer ist es es sie aufzutrennen. D,Erklären Sie mit Hilfe von einer Zeichnung die wichtigsten Aspekte der DNADoppelhelix. Den Doppelstrang der DNA kann man sich als Leiter vorstellen: Die Sprossen entsprechen den Basen und die beiden Stangen dem Rückgrat aus Desoxyribose und Phosphat. Die beiden Stränge laufen antiprallel, also in engegengesetzter Richtung. Einer in 5'→ 3' Richtung, der andere in 3'→ 5' Richtung. Diese „Leiter“ ist nun alle 10 Windungen um die eigene Achse gedreht. Durch die Dreidimensionale Struktur ist die DNA nun über die große und kleine Grube (minor und major grove) von Proteinen zu erreichen. E, Was ist das C- Wert- Paradoxon? Das C- Wert- Paradoxon bezeichnet die Tatsache, dass „niedere“ Organismen einen höheren C- Gehalt (DNA-Gehalt einer vegetativen Zelle) haben können, als „höhere“, komplexere Organismen. F, Erklären Sie das Prinzip der Gelelektrophorese. Bei der Gelelektrophorese können DNA- Fragmente ihrer Größe nach aufgetrennt werden. Aufgrund der negativen Ladung der DNA wandern die Moleküle zur Anode, dabei werden sie durch die Matrix (Agarose) gehindert werden. Große Moleküle werden dabei stärker aufgehalten als kleine. Die Auftrennung erfolgt Logarhithmisch. Um die Größe der DNA zu betimmen wird ein sogenannter Standard aufgetragen, der Banden mit DNA bekannter Größe enthält. Die Banden werden mit Ethidiumbromid gefärbt und unter UV- Licht fotografiert. G, Welche RNA- Klassen gibt es und welche Aufgaben haben sie? – t-RNA: Transferyl RNA, bindet spezifisch eine Aminosäure und kann an das Ribosom andocken. T- RNA stellt den „Adapter“ bei der Übersetzung von Nükleinsäuren in Aminosäuresequenezen dar. – r-RNA: Ribosomale RNA, Bestandteil des Ribosoms. – m-RNA: Messenger RNA, stellt die Abschrift einer Transkriptionseinheit dar, die über Signale (Poly A; 5' Cap)aus dem Kern zu den Ribosomen gebracht werden – snRNA, snoRNA, scRNA: Small nuclear, und small cytoplasmic RNA, oft katalytische Aufgaben H, Übersetzen Sie die folgende Sequenz in RNA und schließlich in ein Oligopeptid: 3'CCTACCGATCAAAACAGTTGATCGGC 5' 5'GGATGGCTAGTTTTGTCAACTAGCCG 3' m-RNA: 5'GGAUGGCUAGUUUUGUCAACUGCCG3' AS: Met – Ala – Ser – Phe – Val – Lys – Stopp (Anmerkung: Auf Start- Codon achten!) 4. Lipide: A, Nennen Sie drei Funktionen von Lipiden. – Energiequelle (Speicherstoffe) – Biologieche Membranen – Biologische Signale B, Was sind die Unterschiede zwischen gesättigten und ungesättigten Fettsäuren (Nomenklatur)? Bei gesättigten Fettsäuren bestehen alle C- C Bindungen aus Einfachbindungen, bei ungesättigten liegt mindestens ein Doppelbindung. Durch die Doppelbindung hat die Säure einen Knick in der Struktur. Deshalb sind die molekularen Wechselwirkung geringer als bei vergleichbaren gesättigten Fettsäuren. Nomenklatur: Gesättigt Ungesättigt Struktur Name Octadecansäure (Stearinsäure) Octadecensäure (Ölsäure) Kurzschreibweise 18;0 18:1Δ 9 (Cis) C,Aus welchen Bestandteilen besteht ein Phospholipid? 1x Glycerin, 2x Fettsäure und 1x polare Gruppe über Phophordiesterbindung: D,Welche Membranlipide gibt es und wie sind sie aufgebaut? – – Phospholipide: Aufbau siehe oben Sphingolipide: Statt Glycerin über den langkettigen Alkohol Sphingosin verknüpft: – Sphingomyeline (Myeline): – – Glycolipide (Cerebroside): Sterole: E, Wie sieht eine biologische Membran aus? (Zeichnung!) F, Warum heißt es Fluid- Mosaic- Modell? Die Lipide, die in einer Schicht liegen haben keine starre Struktur, sie sind vielmehr „flüssig“ und schwimmen ständig umeinander herum. Trotzdem ist die Membran eine Abgrenzung, da ein „flip-flop“, also der Wechsel aus einer in die andere Schicht sehr selten passiert. G, Was ist ein GPI- Anker? Über einen GPI- Anker können Proteine in der Membran verankert werden. Das Carboxylende eines Proteins wird über eine Amidbindung an ein Phosphatidylinositol gebunden. (-> Glycosylphophatidylinositol) H, Wie können Stoffe durch die Membran transportiert werden? Für den Transport geladener, oder großer Moleküle benötigt man im Normalfall Tunnelproteine, die je nach Konzentrationsgefälle eine Energiequelle benötigen.