Synthesis and Characterization of the Precursor - ETH E
Werbung

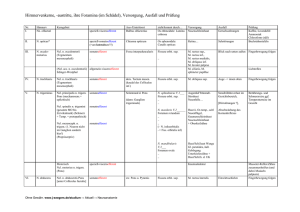
Dissertation ETH No. 15061 Synthesis and Characterization of the Precursor of Neuropeptide Y A dissertation submitted to the Swiss Federal Institute of Technology Zurich for the degree of Doctor of Natural Sciences presented by Regula A,gnes von Eggelkraut-Gottanka Apothekerin Eberhard-Karls Universität Tübingen born February 22, 1974 citizen of Germany accepted on the recommendation of Prof. Dr. G. Folkers, examiner Prof. Dr. A. G. Beck-Sickinger, co-examiner 2003 Summary 10 SUMMARY Similar to many other hormones and neurotransmitters, neuropeptide Y (NPY) is derived from a larger precursor molecule, the 69 amino acid pro-neuropeptide Y (proNPY). Precursor proteins undergo a highly specific conversion process to yield their biologically active products. As part of a finely tuned regulation network, the biosynthesis of hormones and neuropeptides plays a major role in many physiological and pathophysiological processes. Diseases such as diabetes, obesity and diverse sorts of cancer could be associated with dysfunctions in the biosynthetic pathways. The discovery of key steps opens up the possibility to intervene specifically in these processes implying a great potential for the development of novel therapeutic agents. In the past decades, great advances have been made in the understanding of biosynthesis of hormones and its regulation mechanisms (Chapter 1). A family of mammalian proteases, the subtilisin/kexin-like prohormone convertases (PC), could be identified to c1eave precursors at mono- or paired basic sites. The so far known members PC1/3, PC2, furin/PACE, PACE4, PC4, PC5/6 and PC7/SPC7/LPC/PC8 show a high substrate specificity which distinguishes between possible precursor substrates and processing sites. Distinct secondary structure formations of the precursor in the vicinity of the basic cleavage site were found to be important for the enzymatic recognition. ProNPY undergoes c1eavage at a single dibasic site (Lys38_Arg 39) which is preferably carried out by PC1/3. Further trimming by carboxypeptidase B-like enzyme and peptidyl glycine a-amidating monooxygenase (PAM) yields amidated . NPY and the C-terminal flanking peptide of NPY (CPON). NPY has been reported to be involved in diverse biological functions both centrally as weil as in the periphery. CPON is co-Iocalized with NPY, however its importance is so far unknown. To further investigate how prohormone convertases are involved in the proNPY processing and how the characteristics of the proNPY substrate itself contribute to the specific recognition by the enzyme in vivo and in vitra studies are required. Summary 11 The aim of this work was to provide powerful tools for the detailed characterization of proNPY which would include enzymatic cleavage assays, amino acid replacement and structural determination studies. Solid-phase peptide synthesis (SPPS) is the method of choice for the incorporation of chemical modifications Iike fluorescent or biotin tags into a molecule. Such modifications will facilitate to follow the ongoing cleavage process in an enzymatic assay. Furthermore, amino acids can be easily exchanged by i.e. alanine or non canonical amino acids. Altering the protein structure and function could give new insights into structure-activity determinants and the biological role of the NPY precursor. ProNPY with its 69 amino acids, however, is too long for the chemical synthesis in one step by SPPS. In vitro assays have been therefore performed on shortened proNPY analogues revealing that PC1/3 and PC2 are responsible for the proNPY c1eavage whereas PC1/3 is superior to PC2. Particularly arginines within the sequence were found to be crucial for the enzymatic processing (Chapter 2). Nevertheless, since substrate length might discriminate PC c1eavage subsequent studies require full-Iength proNPY. The development of the native chemical Iigation (NCL) method enabled the access to proteins of up to - 100 amino acids. In a chemoselective reaction, a synthetic peptide/protein segment bearing aC-terminal thioester is joined to a second synthetic peptide/protein segment containing an N-terminal cysteine residue. A native peptide bond is obtained at the site of ligation. Up to now only a few strategies for the Fmoc-based (Fmoc=9-fluorenylmethyloxycarbonyl) SPPS of peptide thioesters have been reported because of the susceptibility of the thioester linkage to strong nucleophiles such as piperidine that is used for the removal of Fmoc groups. Moreover, these strategies either applied special agents/linkers or caused undesirable side-reactions. A new fast, efficient and simple preparation method remained to be established. These needs are fulfilled by the method presented here (Chapter 3). The protected peptide acids were synthesized via Fmoc-strategy on commercially available 2-chlorotrityl resin (CI-trityl resin), c1eaved from the resin and the C-terminal carboxylic group was directly converted to the corresponding thioester. After c1eavage of the side-chain protecting groups high amounts of the thioester product were obtained. NCL of this thioester Summary 12 segment and the C-terminal segment containing a carboxyfluorescence (CF) label and the N-terminal cysteine yielded full-Iength proNPY analogues. For structural investigations by means of circular dichroism (CD) and nuclear magnetic resonance (NMR) spectroscopy the full-Iength proNPY was necessary without alterations in the sequence. The IMPACT system (intein-mediated purification with an affinity chitin-binding tag) was applied for the recombinant synthesis of proNPY 1-69 (Chapter 4). The gene encoding proNPY 1-69 was cloned in-frame into an expression vector upstream of a modified intein and a chitin-binding domain (CBD). The fusion protein expressed in E. eoli cells could be selectively loaded onto a chitin-column via the CBD. Fm the cleavage of the fusion protein, the system is based on the self-splicing activity of inteins which can be considered as protein equivalents of the RNA introns. Addition of thiol induced intein-splicing releasing the desired full-Iength proNPY in high purity and quantity. The first CD data indicated that proNPY is less structured than NPY but also contains the a-helix motif. A higher structural flexibility in the part of the rnolecule which includes the PC cleavage site is in good agreement with findings for other precursors. The IMPACT system was furthermore compatible with isotopic labeling of proNPY 1-69 which will be used for subsequent NMR studies. Extraordinary high yields of 15N-labeled proNPY 1-69 could be achieved. In order to increase the availability of various proNPY analogues the method of expressed protein ligation (EPL) was applied (Chapter 5). EPL is based on the principle of NCL but either one or both ligation partners are obtained recombinantly. For the semisynthesis of proNPY analogues, two different ligation sites have been chosen. A cysteine was incorporated instead of the naturally occurring Ser41 or Thr55 to allow the ligation reaction between the thioester and the . cysteine fragment. The thioester fragment was recombinantly synthesized using the IMPACT system. With optimized conditions for the protein purification and isolation high yields of both thioester fragments, proNPY 1-40 and 1-54, could be accomplished. Ligation between the two thioester fragments and their corresponding synthetic C-terminal counterparts resulted in the formation of five full-Iength proNPY analogues. Two of them included a CF label in the synthetic part, one a biotin label and two were without any label. Western blot and dotblot analyses revealed that all five analogues are recognized by antibodies direeted Summary 13 against NPY or against the CPON. The introduced changes disturbed neither the recognition by the antibodies nor the binding of streptavidin demonstrating that none of them influences significantly the protein structure. We could show that EPL is a powerful technique for the semisynthesis of chemically modified proNPY analogues. The assembly of the C-terminal, cysteine-bearing proNPY fragment [C41,K68]proNPY 1-40 by SPPS, which was used for both NCL and EPL, proved to be more difficult than expected (Chapter 5). Various approaches recommended for overcoming difficult peptide sequences have been investigated but only the incorporation of two pseudo-proline derivatives could lead to sufficiently pure amounts of the proNPY fragment. Such secondary amino acid surrogates are known to kink the peptide backbone enabling to disrupt aggregation or secondary structure formations. Since particularly the part of the proNPY sequence adjacent to the cleavage site caused the synthetic problems, the presence of distinct structural features is supposed for this region. The methods of NCL and EPL require both specific N-terminal amino acids at the ligation site (cysteine, selenocysteine, glycine) reducing their general applicability to protein synthesis. A novel Iigation approach was therefore developed, the so called expressed enzymatic ligation (EEL), which combined the advantages of recombinant thioester expression using the IMPACT system with those of the substrate mimetic strategy (Chapter 6). The thioester group of the Nterminal fragment proNPY 1-40 was designed as a protease-specific leaving group (carboxymethyl mercaptan (SCM), carboxypropyl mercaptan (SCP) or mercaptoethanesulfonic acid (MESNA)). The Glu/Asp-specific serine protease VB from Staphylococcus aureus could recognize the thioester group and catalyzed the ligation step of this acyl donor component to various acyl acceptors such as chemically modified derivatives of proNPY 41-69 and several model peptides. The EEL strategy proved to be a novel promising approach for the semisynthesis of chemically modified proteins. It broadens the diversity of techniques which led to the preparation of various proNPY analogues now available for subsequent characterization. Zusammenfassung 14 ZUSAMMENFASSUNG Wie viele andere Hormone und Neurotransmitter leitet sich auch Neuropeptid Y (NPY) von einem größeren Vorläufermolekül ab, dem 69 Aminosäure langen ProNeuropeptid Y (ProNPY). Vorläuferproteine unterliegen einem hochspezifischen Umwandlungsprozess, durch welchen deren biologisch aktive Produkte entstehen. Die Biosynthese von Hormonen und Neuropeptiden ist Teil eines fein abgestimmten Regulationsnetzwerks und spielt daher eine wichtige Rolle bei vielen physiologischen und pathophysiologischen Vorgängen. Krankheiten wie Diabetes, Obesitas und verschiedene Tumorerkrankungen konnten mit Dysfunktionen in biosynthetischen Stoffwechselwegen in Verbindung gebracht werden. Die Entdeckung von Schlüsselschritten eröffnet die Möglichkeit spezifisch in solche Prozesse eingreifen zu können und impliziert daher ein großes Potential für die Entwicklung neuer Therapeutika. In den letzten Jahrzehnten wurden große Fortschritte erzielt in der Aufklärung der Biosynthese der Hormonvorläufer und deren Regulationsmechanismen (Kapitel 1). Eine Familie von Säugetierproteasen, die Subtilisin/Kexin-ähnlichen Prohormon-Convertasen (PC), konnte bestimmt werden, die Vorläuferproteine an mono- oder gepaarten basischen Stellen zu spalten. Die bislang bekannten Mitglieder PC1/3, PC2, furin/PACE, PACE4, PC4, PC5/6 and PC7/SPC7/LPC/PC8 zeigen eine hohe Substratspezifität, die zwischen möglichen Vorläufersubstraten und Prozessierungsstellen unterscheidet. Bestimmte Sekundärstrukturen des Vorläuferproteins in der Umgebung der basischen SpaltsteIle konnten als bedeutend für die Enzymerkennung identifiziert werden. ProNPY wird an einer einzelnen dibasischen Stelle (Lys38_Arg 39) vorzugsweise von PC1/3 gespalten. Weitere Prozessierung durch Carboxypeptidase Bähnlichem Enzym und Peptidylglycin-a.-amidierende Monooxygenase (PAM) resultiert in amidiertem NPY und dem C-terminal flankierenden Peptid von NPY (CPON). NPY besitzt sowohl zentral als auch in der Peripherie vielfältige Funktionen. CPON ist co-lokalisiert mit NPY, seine Bedeutung ist jedoch bislang ungeklärt. Zusammenfassung 15 Um weitreichender zu untersuchen, wie Prohormone-Convertasen an der Prozessierung von ProNPY beteiligt sind und in welcher Weise die Eigenschaften des ProNPY-Substrates selbst zur spezifischen Erkennung durch das Enzym beitragen, sind in vtvo- and in vitra-Studien notwendig. Das Ziel dieser Arbeit war es, geeignete Werkzeuge für die detaillierte Charakterisierung von ProNPY bereitzustellen, die in enzymatischen Spaltassays und Studien mittels Aminosäure-Austausch und zur Strukturaufklärung eingesetzt werden können. Die Peptidfestphasensynthese (SPPS) ist die Methode der Wahl für den Einbau chemischer Modifikationen in ein Molekül, wie z. B. einer Fluoreszenz- oder Biotinmarkierung. Solche Modifikationen werden es erleichtern, in Enzymassays den ablaufenden Spaltungsvorgang leichter verfolgen zu können. Darüber hinaus können Aminosäuren leicht ausgetauscht werden gegen z. B. Alanin oder nicht kanonische Aminosäuren. Das Ändern der Proteinstruktur und -funktion kann neue Einblicke in Struktur-Aktivitäts-Wechselwirkungen geben und helfen, die biologische Funktion des NPY-Vorläufers aufzuklären. ProNPY ist mit seinen 69 Aminosäuren jedoch zu lang für die Synthese in einem Schritt mittels SPPS. In vitra-Assays sind daher an verkürzten ProNPY-Analoga durchgeführt worden. Es konnte dabei gezeigt werden, dass PC1/3 and PC2 für die Spaltung von ProNPY verantwortlich sind, wobei PC1/3 PC2 überlegen ist. Besonders Arginine in der Sequenz waren wichtig für die enzymatische Prozessierung (Kapitel 2). Weiterführende Studien bedürfen jedoch ProNPY in voller Länge, da die Substratlänge eventuell einen Einfluss auf die Umsetzung mit PC hat. Die Entwicklung der Methode der Nativen Chemischen Ligation (NCL, engi.: native chemical ligation) ermöglichte den Zugang zu Proteinen mit bis zu - 100 Aminosäuren. In einer chemoselektiven Reaktion wird ein synthetisches Peptidoder Proteinsegment, das C-terminal eine Thioestergruppe aufweist, mit einem zweiten synthetischen Peptid- oder Proteinsegment mit einem N-terminalen Cysteinrest verknüpft. Eine native Peptidbindung wird an der Ligationsstelle erhalten. Bislang wurden nur wenige SPPS-Strategien für eine Fmoc-basierende (Fmoc=9-fluorenylmethyloxycarbonyl) Herstellung von Peptidthioestern berichtet. Grund hierfür ist die Empfindlichkeit der Thioesterbindung gegenüber starken Nukleophilen wie Piperidin, das zur Abspaltung der Fmoc-Schutzgruppen Zusammenfassung 16 verwendet wird. Weiterhin haben diese Strategien entweder spezielle Agentien oder Linker verwendet oder haben ungewünschte Nebenreaktionen ausgelöst. Eine neue schnelle, effiziente und einfache Herstellungsmethode war demnach notwendig. Diese Bedingungen sind bei der hier präsentierten Methode erfüllt (Kapitel 3). Die geschützten Peptidsäuren werden an einem kommerziell erhältlichen 2-Chlorotrityl-Harz (CI-trityl-Harz) mittels Fmoc-Strategie synthetisiert, vollgeschützt vom Harz abgespalten und die C-terminale Caroxylgruppe direkt zum entsprechenden Thioester umgewandelt. Nach Abspaltung der SeitenkettenSchutzgruppen wird das Thioesterprodukt in hohen Ausbeuten erhalten. NCL an das C-terminale Segment, das eine Carboxyf1uoreszenz (CF)-Markierung und das N-terminale Cystein enthielt, ergab das gesamte ProNPY-Analogon. Für Untersuchungen mittels Circulardichroismus (CD) and Kernmagnetischer Resonanz-Spektroskopie (NMR, eng!.: nuc!ear magnetic resonance) war ProNPY in voller Länge und ohne Veränderungen in der Struktur erforderlich. Das IMPACT-System (intein-mediated purification with an affinity chitin-binding tag) wurde zur rekombinanten Herstellung von ProNPY 1-69 eingesetzt (Kapitel 4). Das für ProNPY 1-69 codierende Gen wurde in einen Expressionsvektor im Leseraster und vorgeschaltet zu einem modifizierten Chitinbindungsdomäne (CBD) kloniert. Das in E. co!i Intein und einer Zellen exprimierte Fusionsprotein konnte über die CBD selektiv auf eine Chitinsäule geladen werden. Zur Spaltung des Fusionsproteins nützt das System die autokatalytische Spaltungsaktivität von Inteinen, die als Äquivalente zu den Introns der RNA betrachtet werden können. Zusatz von Thiol induzierte die Intein-Spaltung und setzte das gewünschte ProNPY in voller Länge mit großer Reinheit und Menge frei. Die ersten CD-Daten lassen erkennen, dass ProNPY weniger strukturiert ist . als NPY, jedoch auch das a-Helix-Motiv enthält. Eine größere strukturelle Flexibilität in dem Molekülteil, in dem sich die PC-Spaltstelle befindet, ist in guter Übereinstimmung mit Daten anderer Vorläuferproteine. Das IMPACT-System war darüber hinaus kompatibel mit der Isotopenmarkierung von ProNPY 1-69, das in nachfolgenden NMR-Studien eingesetzt werden wird. Außerordentlich hohe Ausbeuten an 15N-markiertem ProNPY 1-69 konnten erzielt werden. Um weitere, verschiedenartige ProNPY-Analoga zur Verfügung zu haben, wurde die Methode der exprimierten Proteinligation (EPL, eng!.: expressed protein Zusammenfassung 17 ligation) angewendet (Kapitel 5). EPL basiert auf dem Prinzip der NCL, jedoch wird entweder ein Ligationspartner oder beide rekombinant gewonnen. Für die Semisynthese von ProNPY-Analoga sind zwei verschiedene Ligationsstellen gewählt worden. Ein Cystein wurde anstelle des natürlich vorkommenden Ser41 bzw. Thr55 inkorporiert, um die anschließende Ligationsreaktion zwischen dem Thioester- und dem Cysteinfragment zu ermöglichen. Das Thioesterfragment wurde rekombinant unter Verwendung des IMPACT-Systems hergestellt. Unter optimierten Bedingungen für die Proteinaufreinigung und -isolierung konnten hohe Ausbeuten für beide Thioesterfragmente, ProNPY 1-40 und 1-54, erzielt werden. Durch Ligation zwischen den beiden Thioesterfragmenten mit ihren jeweiligen synthetischen C-terminalen Gegenstücken wurden fünf ProNPY-Analoga in voller Länge gewonnen. Zwei von ihnen enthielten eine CF-Markierung im synthetischen Teil, eines eine Biotin-Markierung und zwei waren ohne Markierung. Western Blotund Dotblot-Analysen zeigten, dass alle fünf Analoga von Antikörpern erkannt werden, die gegen NPY bzw. gegen CPON gerichtet sind. Die eingeführten Änderungen im Molekül störten weder die Erkennung durch die Antikörper noch die Bindung von Streptavidin. Das verdeutlicht, dass keine dieser Änderungen signifikant die Proteinstruktur beeinflusst. Wir konnten zeigen, dass EPL eine geeignete Technik für die Semisynthese von chemisch modifizierten ProNPYAnaloga darstellt. Die Festphasenpeptidsynthese des C-terminalen, Cystein tragenden ProNPYFragments [C41,K68]ProNPY 1-40, das sowohl für NCL als auch für EPL eingesetzt wurde, stellte sich als schwieriger heraus als vermutet (Kapitel 5). Verschiedene Ansätze, die zur Ermöglichung der Synthese schwieriger Peptidsequenzen empfohlen sind, wurden getestet, jedoch erbrachte nur der Einbau von zwei Pseudoprolin-Derivaten ausreichend reine Mengen an ProNPY-Fragment. Ein derartiger sekundärer Aminosäureersatz ist bekannt, das Peptidrückgrat krümmen zu können und dadurch Aggregat- oder Sekundärstrukturbildungen aufzubrechen. Da besonders der Sequenzteil von ProNPY um die SpaltsteIle Probleme bei der Synthese bereitete, können bestimmte strukturelle Eigenschaften für diese Region angenommen werden. Die Methoden der NCL und EPL benötigen beide spezifische N-terminale Aminosäuren an der Ligationsstelle (Cystein, Selenocystein, Glycin), was die Zusammenfassung 18 generelle Anwendbarkeit für die Proteinsynthese verringert. Es wurde daher ein neuer Ligationsansatz entwickelt, die sogenannte Exprimierte Enzymatische Ligation (EEL, eng/.: expressed enzymatic ligation), die die Vorteile der rekombinanten Thioesterherstellung mittels IMPACT-System mit denen der Substratmimetika-Strategie vereinigt (Kapitel 6). Die Thioestergruppe des Nterminalen Fragments ProNPY 1-40 wurde als spezifische Abgangsgruppe für Proteasen konzipiert (Carboxymethylmercaptan (SCM), Carboxypropylmercaptan (SCP), Mercaptoethansulfonsäure (MESNA)). Die Glu/Asp-spezifische Serinprotease V8 aus Staphylococcus aureus konnte die Thioestergruppe erkennen und katalysierte den Ligationsschritt von dieser Acyldonator- Komponente an verschiedene Acylakzeptoren wie die chemisch modifizierten Derivate von ProNPY 41-69 und einige Modellpeptide. Die EEL-Strategie erwies sich als neuer vielversprechender Ansatz für die Semisynthese chemisch modifizierter Proteine. Sie erweiterte die Bandbreite an Techniken, die zur Herstellung von verschiedenen ProNPY-Analoga eingesetzt wurden. Diese stehen nun zur weiteren Charakterisierung zur Verfügung.