Die Biosynthese von Phenazinen The Biosynthesis of Phenazines
Werbung

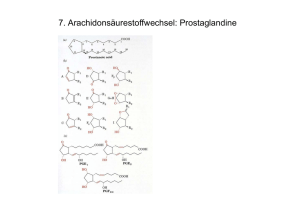
Jahrbuch 2005/2006 | Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. | Die Biosynthese von Phenazinen Die Biosynthese von Phenazinen The Biosynthesis of Phenazines Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. Max-Planck-Institut für molekulare Physiologie, Dortmund Korrespondierender Autor E-Mail: w [email protected] Zusammenfassung Phenazine sind stickstoffhaltige aromatische Verbindungen mit antibiotischer W irkung, die von vielen Bakterien synthetisiert und zur Verteidigung ihres Lebensraums in die Umgebung abgegeben w erden. Die Biosynthese der Phenazine zw eigt von der aromatischen Aminosäurebiosynthese ab und ist im Detail nicht geklärt. W issenschaftler am MPI für molekulare Physiologie in Dortmund haben gezeigt, dass die w ichtige Zw ischenstufe 2,3-Dihydro-3-hydroxyanthranilsäure von einem Enzym mit dem Namen PhzF zu einem Keton isomerisiert w ird. Dieses Produkt dimerisiert und durchläuft anschließend mehrere Oxidations- und eine Decarboxylierungsreaktion, um schließlich als Phenazin-1-Carboxylsäure den Synthesew eg zu verlassen. Die Untersuchungen mit strukturbiologischen und biochemischen Methoden machen klar, w elche Enzyme die jew eiligen Schritte katalysieren, und liefern somit erstmals ein relativ vollständiges Bild dieses interessanten Biosynthesew egs. Summary Phenazines are nitrogen-containing aromatic compounds w ith antibiotic properties that many bacteria synthesize and secrete into their environment to defend themselves against other competing microorganisms. Phenazine biosynthesis branches off the shikimate pathw ay but details remain elusive. Scientists from the MPI for molecular physiology have demonstrated that PhzF, a conserved enzyme of the bacterial phenazine biosynthesis operon, isomerises 2,3-dihydro-3-hydroxo anthranilic acid to a ketone. This product dimerises and subsequently undergoes several oxidation and a decarboxylation reaction to yield phenazine-1-carboxylic acid, the end product of the pathw ay. Using an approach that involves structural and biochemical methods, scientists in Dortmund have obtained evidence for the catalytic role of each of the enzymes of the phz-operon and are able to generate an almost complete structural and mechanistic picture of this interesting pathw ay. Phenazinderivate in pathogenen Keimen Phenazine sind stickstoffhaltige aromatische Verbindungen, die von vielen Bakterien synthetisiert und in das umgebende Medium abgegeben w erden. Sie besitzen antibiotische Aktivität, da sie aufgrund ihrer elektrochemischen Eigenschaften Sauerstoff durch Reduktion aktivieren können und somit eine toxische © 2006 Max-Planck-Gesellschaft w w w .mpg.de 1/6 Jahrbuch 2005/2006 | Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. | Die Biosynthese von Phenazinen W irkung auf empfindliche Zellen besitzen. Die Synthese von Phenazinen verschafft den sie produzierenden Bakterien somit einen kompetitiven Vorteil bei der Besiedlung und Verteidigung ihres Lebensraumes. Zusätzlich spielen einige Phenazin-Derivate eine w ichtige Rolle in bakteriellen Infektionskrankheiten. Ein Beispiel ist das blaue Phenazinpigment Pyocyanin, das von Pseudomonas aeruginosa synthetisiert w ird, einem w ichtigen pathogenen Bakterium, das zu chronischen Lungeninfektionen bei 95 Prozent aller MukoviszidosePatienten führt und eine der Hauptursachen für Krankenhausinfektionen darstellt. Pyocyanin trägt über verschiedene Mechanismen zur Gew ebeschädigung bei. Im Mausmodell konnte gezeigt w erden, dass das Immunsystem P. aeruginosa besser bekämpfen kann, w enn dessen Pyocyanin-Produktion beeinträchtigt ist. Mehr als 50 in der Natur vorkommende Phenazinderivate sind bekannt; eine Ausw ahl ist in Abbildung 1 gezeigt. Einige in de r Na tur vork om m e nde P he na zinde riva te . © Ma x -P la nck -Institut für m ole k ula re P hysiologie /Bla nk e nfe ldt Enzymatik der Phenazin-Biosynthese Obw ohl das Phänomen der bakteriellen Phenazin-Biosynthese erstmals bereits um 1850 in der w issenschaftlichen Literatur beschrieben w urde, sind w esentliche Details nicht aufgeklärt. Das Team um W ulf Blankenfeld hat es sich zur Aufgabe gemacht, diese W issenslücke mit einer Kombination aus biochemischen und strukturbiologischen Methoden zu schließen. Die Biosynthese von Phenazinen ist ein Nebenzw eig der aromatischen Aminosäurebiosynthese. Mit radioaktiv markierten Verbindungen w urde in den 1970er-Jahren gezeigt, dass das Phenazingerüst in einer nicht näher charakterisierten Dimerisierung von zw ei Chorismatmolekülen (Strukturformel siehe Abb. 4)gebildet w ird [1]. Das hierfür verantw ortliche phz-Operon, das in dem verw endeten Modellorganismus Pseudomonas fluorescens 2-79 die sieben Gene phzA-G enthält, w urde schließlich im Jahr 1998 erstmals vollständig sequenziert [2]. Von den Produkten dieser sieben Gene w erden offenbar fünf Reaktionen katalysiert, die Chorismat in Phenazin-1Carboxylat (PCA) umw andeln. PCA stellt w ahrscheinlich die gemeinsame Vorstufe für die w eitere Modifizierung zu stammspezifischen Phenazinderivaten dar. Durch Sequenzvergleiche und Versuche mit Zellextrakten aus E. coli-Bakterien, die Teile des phz-Operons exprimieren, zeigten die Forscher, dass Chorismat von PhzE zu 2-Amino-4-desoxychorismat (ADIC) umgesetzt w ird. PhzE gehört zur Familie der Anthranilatsynthasen, katalysiert aber nicht w ie diese die Weiterumsetzung von ADIC zu Anthranilat. In der Phenazin-Biosynthese w ird ADIC durch PhzD zu 2,3-Dihydro-3- hydroxyanthranilat (DHHA) gespalten. Die Funktion der übrigen Enzyme PhzA, PhzB, PhzF und PhzG w ar zu Beginn der eigenen Untersuchungen nicht geklärt [3]. © 2006 Max-Planck-Gesellschaft w w w .mpg.de 2/6 Jahrbuch 2005/2006 | Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. | Die Biosynthese von Phenazinen Die Dortmunder Arbeitsgruppe hat die Phz-Enzyme aus P. fluorescens 2-79 rekombinant produziert und die Strukturen von PhzA, PhzD, PhzF und PhzG kristallografisch bestimmt (Abb. 2) [4-6]. R öntge nk rista llogra fisch e rm itte lte Struk ture n de r Enzym e P hzA, P hzD, P hzF und P hzG; da rge ste llt in sog. Bä nde rform . © Ma x -P la nck -Institut für m ole k ula re P hysiologie /Bla nk e nfe ldt Zusätzlich zur Strukturbestimmung w urden kernresonanz- und massenspektrometrische Experimente durchgeführt, die zeigen, dass PhzF Isomerasefunktion besitzt und 2,3-Dihydro-3-hydroxyanthranilat durch eine [1,5]-Protonenverschiebung in das korrespondierende Keton 2 überführt. Die Untersuchungen liefern zudem Hinw eise darauf, dass das Keton spontan – w ahrscheinlich unter Bildung einer doppelten Schiff’schen Base – zur Phenazin-Vorstufe 3 dimerisiert. Diese Reaktion könnte ebenfalls durch PhzF unterstützt w erden, indem zw ei Ketonmoleküle nach Verlassen der beiden aktiven Zentren des PhzF-Dimers in einem relativ abgeschlossenen Raum zw ischen den Monomeren zusammengeführt w erden (Abb. 3). R e a k tionsze ntre n im P hzF-Enzym : a ) Da s a k tive Ze ntrum von P hzF im Kom ple x m it de m Substra ta na logon 3Hydrox ya nthra nilsä ure (3O HAA). Die se Struk tur ze igt, da ss die Gluta m insä ure -45 de s P rote ins e in P roton vom Kohle nstoffa tom -3 de s Substra ts 2,3-Dihydro-3hydrox ya nthra nila t (DHHA) e ntfe rnt. b) Mögliche R e a k tionsste lle für die Dim e risie rung de s Ke tons 2 in P hzF. Die se r ha lba bge schlosse ne R a um e ntste ht e rst, we nn P hzF durch Bindung e ine s Liga nde n in die ge schlosse ne Konform a tion übe rführt wird. © Ma x -P la nck -Institut für m ole k ula re P hysiologie /Bla nk e nfe ldt Zur großen Überraschung der Forscher bleibt die Umsetzung von 2,3-Dihydro-3-hydroxyanthranilat auch auf der Stufe des Zw ischenprodukts 3 nicht stehen, sondern es kommt zu einer spontanen oxidativen Decarboxylierung mit einem Produkt, das w ahrscheinlich der Struktur 4 entspricht (Abb. 4). Diese Reaktion könnte durch den mit der teilw eisen Aromatisierung einhergehenden Stabilitätsgew inn angetrieben w erden und liefert einen ersten Hinw eis darauf, w arum in der bakteriellen Phenazinsynthese in der Regel Phenazin-1- © 2006 Max-Planck-Gesellschaft w w w .mpg.de 3/6 Jahrbuch 2005/2006 | Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. | Die Biosynthese von Phenazinen Carboxylsäure und nicht Phenazin-1,6-Dicarboxylsäure als erste stabile Phenazinverbindung erzeugt w ird. Massenspektroskopische Versuche und Experimente zur Bestimmung der Sauerstoffkonzentration zeigen an, dass dieser Schritt auch katalysiert unter Beteiligung von PhzB erfolgen kann und dass Sauerstoff in dieser Reaktion als Elektronenakzeptor fungiert. Dies ist insofern überraschend, als PhzB keinen Cofaktor enthält, der mit Sauerstoff interagieren könnte. Mom e nta ne r Ke nntnissta nd de r Biosynthe se von P he na zin-1C a rbox ylsä ure : Struk ture ll nicht nä he r be stim m te Inte rm e dia te bzw. nicht nä he r cha ra k te risie rte R e a k tionsschritte sind in gra u da rge ste llt. © Ma x -P la nck -Institut für m ole k ula re P hysiologie /Bla nk e nfe ldt Um zur Phenazincarboxylsäure umgew andelt zu w erden, muss das Zw ischenprodukt 4 noch zw ei w eitere Zw ei-Elektronen-Oxidationen durchlaufen. Eine dieser Oxidationen w ird mit Sicherheit von PhzG katalysiert, einem Flavinmononucleotid (FMN)-bindenden Enzym, das mit Pyridoxamin-Oxidase verw andt ist. Die in Dortmund bestimmte Struktur von PhzG im Komplex mit Phenazincarboxylsäure zeigt, dass das Enzym ein tricylisches, phenazinähnliches Substrat am Kohlenstoffatom 1 oxidiert (Abb. 5). Es ist möglich, dass die abschließende Oxidation zur Phenazincarboxylsäure direkt durch Sauerstoff erfolgt, ähnlich der Regeneration des Cofaktors in FMN-abhängigen Enzymen. Für die Phenazin-Biosynthese ergibt sich somit der in Abbildung 4 w iedergegebene Reaktionsw eg. Die W issenschaftler am MPI für molekulare Physiologie w erden ihre Versuche in Zukunft auf die Untersuchung der Biosynthese in denjenigen Spezies ausdehnen, für die Phenazin-1,6-Dicarboxylsäure als erste stabile Phenazinverbindung angenommen w ird. Hierdurch w ollen sie w eitere Einblicke in die ungew öhnliche PhzB-katalysierte Decarboxylierungsreaktion erhalten. © 2006 Max-Planck-Gesellschaft w w w .mpg.de 4/6 Jahrbuch 2005/2006 | Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. | Die Biosynthese von Phenazinen Da s a k tive Ze ntrum von P hzG im Kom ple x m it de m Endproduk t de s Biosynthe se we gs, P he na zin-1-ca rbox ylsä ure (P C A). © Ma x -P la nck -Institut für m ole k ula re P hysiologie /Bla nk e nfe ldt Originalveröffentlichungen Nach Erw eiterungen suchenBilderw eiterungChanneltickerDateilisteHTML- Erw eiterungJobtickerKalendererw eiterungLinkerw eiterungMPG.PuRe-ReferenzMitarbeiter (Employee Editor)Personenerw eiterungPublikationserw eiterungTeaser mit BildTextblockerw eiterungVeranstaltungstickererw eiterungVideoerw eiterungVideolistenerw eiterungYouTubeErw eiterung [1] Hollstein U. und McCamey, D. A.: Biosynthesis of phenazines. II. Incorporation of (6-14C)-D-shikimic acid into phenazine-1-carboxylic acid and iodinin. Journal of Organic Chemistry 38, 3415-3417 (1973). [2] Mavrodi, D. V., Ksenzenko, V. N., Bonsall, R. F., Cook, R. J., Boronin, A. M. and Thomashow, L. S.: A seven-gene locus for synthesis of phenazine-1-carboxylic acid by Pseudomonas fluorescens 2-79. Journal of Bacteriology 180, 2541-2548 (1998). [3] McDonald, M., Mavrodi, D. V., Thomashow, L. S. and Floss, H.G.: Phenazine biosynthesis in Pseudomonas fluorescens: Branchpoint from the primary shikimate biosynthetic pathway and role of phenazine-1,6-dicarboxylic acid. Journal of the American Chemical Society 123, 9459-9460 (2001). [4] Ahuja, E. G., Mavrodi, D. V., Thomashow, L. S. und Blankenfeldt, W.: Overexpression, purification and crystallization of PhzA, the first enzyme of the phenazine biosynthesis pathway of Pseudomonas fluorescens 2-79. Acta Crystallographica D 60, 1129-1131 (2004). © 2006 Max-Planck-Gesellschaft w w w .mpg.de 5/6 Jahrbuch 2005/2006 | Ahuja, Ekta G.; Bayer, Peter; Blankenfeldt, W ulf; Janning, Petra; Herde, Petra; Mavrodi, Dmitri V.; Thomashow , Linda S. | Die Biosynthese von Phenazinen [5] Mavrodi, D. V., Bleimling, N., Thomashow, L. S. and Blankenfeldt, W.: The purification, crystallization and preliminary structural characterization of PhzF, a key enzyme in the phenazine-biosynthesis pathway from Pseudomonas fluorescens 2-79. Acta Crystallographica D 60, 184-186 (2004). [6] Blankenfeldt, W., Kuzin, A. P., Skarina, T., Korniyenko, Y ., Tong, L., Bayer, P., Janning, P., Thomashow, L. S. and Mavrodi, D. V.: Structure and function of the phenazine biosynthesis protein PhzF from Pseudomonas fluorescens. Proceedings of the National Academy of Sciences of the USA 101, 16431-16436 (2004). © 2006 Max-Planck-Gesellschaft w w w .mpg.de 6/6