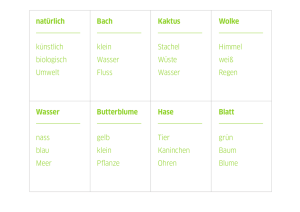
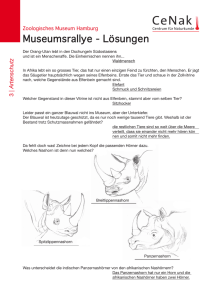
Bestimmung der Virulenz von Virusisolaten der Klassischen
Werbung

Aus dem Institut für Virologie der Tierärztlichen Hochschule Hannover Bestimmung der Virulenz von Virusisolaten der Klassischen Schweinepest INAUGURAL-DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Claudia Bunzenthal aus Kassel Hannover 2003 Wissenschaftliche Betreuung: Apl. Prof. Dr. Irene Greiser-Wilke 1. Gutachter: Apl. Prof. Dr. Irene Greiser-Wilke 2. Gutachter: Prof. Dr. Michael Wendt Tag der mündlichen Prüfung: 24.11.2003 Meiner Familie Inhaltsverzeichnis 1. Einleitung 13 2. Literaturübersicht 15 2.1 VIRUS DER KLASSISCHEN SCHWEINEPEST 15 2.1.1 TAXONOMIE 15 2.1.2 CHARAKTERISIERUNG DES VIRUS 16 2.1.2.1 Morphologie 16 2.1.2.2 Genom 16 2.1.2.3 Virale Proteine 17 2.1.2.4 Kreuzreaktivität 18 2.1.2.5 Tenazität 18 2.1.2.6 Genetische Typisierung von KSPV-Isolaten 19 2.2 KLINIK UND PATHOLOGIE 21 2.2.1 ÜBERTRAGUNG 21 2.2.2 VERLAUFSFORMEN DER KLASSISCHEN SCHWEINEPEST 22 2.2.2.1 Akute Verlaufsformen 22 2.2.2.2 Chronische Verlaufsformen 24 2.2.2.3 Pränatale Infektion 25 2.2.4 PATHOGENESE 26 2.3 VIRULENZ UND WIRTSFAKTOREN 29 2.3.1 VIRULENZ 29 2.3.1.1 Charakterisierung der Virulenz des KSPV aufgrund klinischer Symptome und pathologischer Veränderungen 31 2.3.1.2 Differenzierung der Virulenz des KSPV durch „in-vitro“-Unterschiede 33 2.3.1.3 Genetische Marker für die Virulenz des KSPV 34 2.3.2 WIRTSFAKTOREN 35 3. Eigene Untersuchungen 36 3.1 MATERIAL 36 3.1.1 TIERE UND VERSUCHSAUFBAU 36 3.1.2 GEWINNUNG UND AUFBEREITUNG DER BLUTPROBEN 37 3.1.3 KSP-VIREN 38 3.1.4 ANTIKÖRPER 38 3.1.5 ZELLINIE PORCINE KIDNEY (15) AMSTERDAM (PK(15)A) 39 3.1.6 SONSTIGE MATERIALIEN 39 3.2 METHODEN 40 3.2.1 BESTIMMUNG DES CLINICAL SCORE (CS) 40 3.2.2 BESTIMMUNG DES PATHOLOGICAL SCORE (PS) 43 3.2.3 ZELLKULTURTECHNIK 45 3.2.4 VIRUSVERMEHRUNG UND VIRUSERNTE 46 3.2.5 VIRUSISOLIERUNG AUS DER LEUKOZYTENFRAKTION 46 3.2.5.1 Gewinnung und Reinigung der Leukozyten 47 3.2.5.2 Virusisolierung über zwei Zellpassagen 47 3.2.6 VIRUSTITRATION 48 3.2.7 VIRUSNEUTRALISATIONSTEST 49 3.2.8 DIREKTE IMMUNFÄRBUNG 51 3.2.9 ZÄHLUNG DER LEUKOZYTEN 52 3.2.10 STATISTIK 52 4. Ergebnisse 53 4.1 BESTIMMUNG DER VIRULENZ VON VIER KSPV-FELDISOLATEN 53 4.1.1 BESTIMMUNG DES CLINICAL SCORE (CS) 53 4.1.1.1 CSF 0650 53 4.1.1.2 CSF 0695 54 4.1.1.3 CSF 0634 55 4.1.1.4 CSF 0277 55 4.1.2 BESTIMMUNG DES PATHOLOGICAL SCORE (PS) 62 4.1.2.1 CSF 0650 62 4.1.2.2 CSF 0695 63 4.1.2.3 CSF 0634 63 4.1.2.4 CSF 0277 64 4.1.3 LEUKOZYTENZAHL 67 4.1.3.1 Einbeziehung der Leukozytenzahl in das Schema zur Beurteilung der Virulenz der KSPV-Isolate 70 4.1.4 VIRUSISOLIERUNG AUS DER LEUKOZYTENFRAKTION 71 4.1.5 VIRUSTITER IM SERUM 73 4.1.6 BILDUNG NEUTRALISIERENDER ANTIKÖRPER 74 4.1.6.1 Einbeziehung der Bildung neutralisierender Antikörper in das Schema zur Beurteilung der Virulenz der KSPV-Isolate 4.1.7 77 ERNEUTE BEWERTUNG DER VIRULENZ DER VIER KSPV-FELDISOLATE UNTER BERÜCKSICHTIGUNG ZUSÄTZLICHER PARAMETER 4.2 78 VERGLEICH DES KRANKHEITSVERLAUFES DER KSP VON REINZUCHT-UND KREUZUNGSTIEREN 79 4.2.1 BESTIMMUNG DES CLINICAL SCORE (CS) 79 4.2.1.1 CSF 0277 79 4.2.1.2 CSF 0634 80 4.2.2 BESTIMMUNG DES PATHOLOGICAL SCORE (PS) 86 4.2.2.1 CSF 0277 86 4.2.2.2 CSF 0634 87 4.2.3 LEUKOZYTENZAHL 91 4.2.4 VIRUSISOLIERUNG AUS DER LEUKOZYTENFRAKTION 93 4.2.5 VIRUSTITER IM SERUM 95 4.2.6 BILDUNG NEUTRALISIERENDER ANTIKÖRPER 96 5. Diskussion 99 6. Zusammenfassung 113 7. Literaturverzeichnis 117 8. Anhang 138 8.1 TABELLEN 138 8.2 ZUSAMMENSETZUNG DER VERWENDETEN MEDIEN UND REAGENZIEN 150 8.2.1 ZELLKULTURMEDIEN 150 8.2.2 REAGENZIEN 151 8.2.2.1 Puffer 151 8.2.2.2 Lösungen 152 8.3 SONSTIGE CHEMIKALIEN 153 8.4 GERÄTE UND GEBRAUCHSGEGENSTÄNDE 154 8.5 VERBRAUCHSMITTEL 155 8.6 ABBILDUNGSVERZEICHNIS 157 8.7 TABELLENVERZEICHNIS 159 Verzeichnis der Abkürzungen al. alii, andere AEC 3-Amino-9-Ethylcarbazol Ak Antikörper A. bidest. ster. Aqua bidestillata sterilis, zweifach destilliertes steriles Wasser ATV adjusted trypsin-versen BD Border Disease BDV Border Disease Virus BVD Bovine Virusdiarrhoe BVDV Virus der BVD CS clinical score, klinische Punktzahl CSF Classical Swine Fever, KSP C-Stamm engl. chinese strain d Tag DIF Direkte Immunfärbung DIK disseminierte intravasale Gerinnung DL Deutsche Landrasse Dt. Landrasse Deutsche Landrasse DNA deoxyribonucleic acid, Desoxyribonukleinsäure EDulb EMEM modifiziert nach Dulbecco und Freeman EDTA Ethylendiamintetrazetat-Dinatriumsalz EMEM Earle’ s minimum essential medium EU Europäische Union EURL Europäisches Referenzlabor für KSP Fa. Firma FKS fetales Kälberserum g Erdanziehungs-Konstante G giga (x 109) h Stunde H Hybridschweine IRES Internal Ribosomal Entry Site kb Kilobasen KID50 kulturinfektiöse Dosis 50 % KSP Klassische Schweinepest KSPV Virus der Klassischen Schweinepest l Liter log10 Zehnerlogarithmus µ mikro (x10-6) m milli (x10-3) mAk monoklonale Antikörper min Minute MKS Maul- und Klauenseuche n nano (x10-9) nAk neutralisierende Antikörper ND50 neutralisierende Dosis 50% nm Nanometer nt Nukleotide NTR nichttranslatierte Region NVSL National Veterinary Services Laboratory OIE Office International des Epizooties PBS phosphate buffered saline, phosphatgepufferte Kochsalzlösung PBSM PBS ohne Calcium- und Magnesiumionen pH-Wert negativer dekadischer Logarithmus der Hydroniumionen-Konzentration p.i. post infectionem, nach Infektion PK porcine kidney PLA peroxidase-linked antibody assay PO Peroxidase PS pathological score, pathologische Punktzahl RNA ribonucleic acid, Ribonucleinsäure RNase Ribonuklease Sek Sekunde SPF Spezifisch-Pathogen-Frei T Thymin T (°C) Temperatur (in Grad Celsius) VNT Virusneutralisationstest 1. Einleitung Die Klassische Schweinepest (KSP) wird durch ein Virus des Genus Pestivirus, Familie Flaviviridae, verursacht. Das Virus der Klassischen Schweinepest (KSPV) ist serologisch einheitlich, kann aber durch Sequenzvergleiche bestimmter Genomabschnitte in drei genetische Gruppen und mehrere Subgruppen unterteilt werden. Die natürlichen Wirte dieses behüllten RNA-Virus sind Haus- und Wildschweine (sus scrofa). Die Infektion mit dem KSPV zählt zu den wichtigsten Tierseuchen weltweit und Seuchenzüge verursachen hohe wirtschaftliche Schäden. Die Erkrankung wurde von dem Office international des épizooties (OIE) auf die Liste A gesetzt. Die Bekämpfungsmaßnahmen sind, basierend auf der Richtlinie 2001/89/EC, innerhalb der Europäischen Union (EU) einheitlich geregelt. Sie bestehen in der Tötung aller Tiere eines betroffenen Bestandes und in der Einrichtung von Sperr- und Beobachtungsgebieten. Die prophylaktische Impfung von Hausschweinen ist seit 1992 verboten. Das KSPV zeigt eine große Variationsbreite bezüglich seiner Virulenz. Die Virulenz der KSPV-Stämme wird u. a. für die unterschiedlichen klinischen Verlaufsformen der Erkrankung verantwortlich gemacht. Hoch virulente Virusstämme führen zu akuten Erkrankungen mit hoher Mortalität, während moderat virulente Stämme subakute oder chronische Erkrankungen auslösen können. Infektionen mit schwach virulenten Stämmen werden mit milden oder subklinischen Krankheitsverläufen in Verbindung gebracht. Neben der Virulenz des Erregers beeinflussen auch Wirtsfaktoren, wie Alter, Rasse und Immunstatus der Tiere den Krankheitsverlauf der KSP. Während der Seuchenzüge der Jahre 1993-1995 und 1997/1998 in den Mitgliedsstaaten der EU traten vermehrt „atypische Krankheitsverläufe“ auf, für die Virusisolate von moderater bis schwacher Virulenz verantwortlich gemacht wurden. Neben diesen Beobachtungen ist jedoch über Virulenzfaktoren und über mögliche Ursachen für die unterschiedlich stark ausgeprägten Krankheitsbilder wenig bekannt. 14 Einleitung Ziel der vorliegenden Arbeit war es, ein in der Literatur beschriebenes Untersuchungsschema, das Virusisolate des KSPV anhand einer klinisch ermittelten Punktzahl (Clinical Score) in verschiedene Virulenzkategorien einteilt, auf seine Gültigkeit und Anwendbarkeit zu überprüfen und ggf. durch weitere Parameter zu ergänzen. Um festzustellen, ob es Unterschiede im klinischen Verlauf der KSP und damit in der Bewertung der Virulenz einzelner Virusisolate gibt, wurden Schweine mit jeweils einem von vier verschiedenen Virusisolaten infiziert. Zudem wurde untersucht, ob die Infektion von Reinzucht- und Kreuzungstieren unter gleichen Bedingungen zu einer vergleichbaren Bewertung der Virulenz führt. 2. Literaturübersicht 2.1 Virus der Klassischen Schweinepest 2.1.1 Taxonomie Das Virus der Klassischen Schweinepest (KSPV) gehört zum Genus Pestivirus, Familie Flaviviridae (WESTAWAY et al., 1985, HORZINEK, 1991). Zu diesem Genus gehören weiterhin das Virus der Bovinen Virusdiarrhoe (BVDV) und das Virus der Border Disease (BVD) der Schafe. Das Genus Pestivirus bildet zusammen mit den Genera Flavivirus und Hepacivirus die Familie der Flaviviridae. Das Genus Hepacivirus beinhaltet das humane Hepatitis-C-Virus. Zum Genus Flavivirus gehören u. a. das Gelbfiebervirus und das Frühsommer-Meningoenzephalitis-Virus des Menschen, das Louping-Ill-Virus, das Wesselbron-Disease-Virus der Schafe sowie das Meningoenzephalitis-Virus der Pute (WENGLER et al., 1995). 16 Literaturübersicht 2.1.2 Charakterisierung des Virus 2.1.2.1 Morphologie Pestiviren sind sphärische, behüllte RNA-Viren mit einem Durchmesser von 40 bis 60 nm (MOENNIG u. PLAGEMANN, 1992) und einem ikosaedrischen Nukleokapsid mit einer Größe von etwa 30 nm (HORZINEK et al., 1967). Auf der Oberfläche der Lipidhülle besitzen Pestiviren unregelmäßig gestaltete, 6-8 nm große Projektionen (HORZINEK et al., 1967, ENZMANN u. WEILAND, 1978). 2.1.2.2 Genom Das Genom der Pestiviren besteht aus einem einzelsträngigen, linearen RNAMolekül, das in Plusstrangorientierung vorliegt (MOORMANN et al., 1990). Die RNA hat eine Länge von ca. 12,5 Kilobasen (kb) und besitzt einen einzigen offenen Leserahmen, der die Information für ein Polyprotein von etwa 3900 Aminosäuren enthält (COLLETT et al., 1988, MEYERS et al., 1989, MOORMANN et al., 1990). Der Leserahmen wird am 5´-Ende und am 3´-Ende von nichttranslatierten Regionen (NTR) flankiert (MOORMANN u. HULST, 1988, RÜMENAPF et al., 1989), die beide hochkonserviert sind (MEYERS et al., 1989, MOORMANN et al., 1990). Das 5’NTR bildet die Internal Ribosomal Entry Site (IRES), die für eine cap-unabhängige Bindung an die Ribosomen verantwortlich ist (SIZOWA et al., 1998). Die Funktion der 3’NTR ist bisher nicht geklärt. Literaturübersicht 17 2.1.2.3 Virale Proteine Das Genom der Pestiviren kodiert für ein einziges Polyprotein, dass während und nach der Translation von zellulären und viralen Proteasen prozessiert wird (COLLETT et al., 1988, RÜMENAPF et al., 1993 MEYERS et al., 1996). So entstehen die vier Strukturproteine, zu denen das core-Protein (c) und die Glykoproteine Erns, E1 und E2 gehören sowie die sieben Nichtstrukturproteine, Npro, p7, NS2-3, NS4A, NS4B, NS5A , NS5B (COLLETT et al., 1991). Das Strukturprotein E2 ist im Wesentlichen für die Bildung neutralisierender Antikörper (nAk) verantwortlich (GREISER-WILKE et al., 1990, WEILAND et al., 1990). Antikörper, die gegen das Erns gerichtet sind, besitzen nur schwach neutralisierende Eigenschaften (RÜMENAPF et al., 1991, WEILAND et al., 1992). Das Strukturprotein E2 weist die geringste Homologie in der Aminosäuresequenz innerhalb des KSPV (80%) und innerhalb des Genus Pestivirus (60%) auf. Im Gegensatz dazu ist das Nichtstrukturprotein NS3 mit über 90% das am stärksten konservierte Protein der Pestiviren (MEYERS et al., 1989). Die Genomorganisation ist in Abb. 1 dargestellt. pro N C rns E E1 E2 7 p NS2-3 NS4A NS4B NS5A-B 5’ 3’ Strukturproteine NS2 NS3 NS5A NS5B Abb. 1: Genomorganisation des KSPV (modifiziert nach MEYERS und THIEL, 1996) 18 Literaturübersicht 2.1.2.4 Wirtsspezifität und serologische Verwandtschaft Pestiviren können Speziesbarrieren überwinden (MOENNIG u. PLAGEMANN, 1992). Durch engen Kontakt von Schweinen und Rindern können sich Schweine mit BVDV infizieren. Natürliche Infektionen führen beim Schwein selten zu klinischen Symptomen, die Tiere bilden aber neutralisierende Antikörper (nAk), die auch KSPV neutralisieren (DAHLE et al., 1987a). Experimentell konnten Rinder, Schafe (DAHLE et al., 1987b), Ziegen (SHIMUZU u. KUMAGAI, 1989) und Hirsche (LOAN u. STORM, 1968) mit KSPV infiziert werden, ohne dass jedoch eine natürliche Übertragung nachgewiesen wurde. Die enge serologische Verwandtschaft zwischen KSPV und BVDV wurde erstmals von DARBYSHIRE (1960) mittels Immunodiffussion mit polyklonalem Antiserum erkannt und später durch Kreuzneutralisationstests bestätigt (SNOWDON u. FRENCH, 1968, LIESS et al., 1976, 1977, NEUKIRCH et al., 1980). Mit der Entwicklung monoklonaler Antikörper (mAk) wurde eine sichere Differenzierung zwischen den verschiedenen Pestiviren ermöglicht (WENSVOORT et al., 1986, GREISER-WILKE et al., 1990, MOENNIG u. PLAGEMANN, 1992). Gegen das NS3 gerichtete monoklonale Antikörper sind meist panpestivirus-spezifisch (EDWARDS et al., 1989). Hingegen ermöglichen monoklonale Antikörper, die gegen die Strukturproteine E2 und Erns gerichtet sind, eine Differenzierung zwischen den verschieden Pestiviren und zwischen Virusisolaten einer Spezies (CAY et al., 1989, KOSMIDOU et al., 1995). 2.1.2.5 Tenazität Die Überlebenszeit des Virus in der Umwelt ist sehr variabel und wird von verschiedenen Faktoren beeinflusst. Aufgrund seiner Lipidhülle wird das KSPV durch lipidlösliche Substanzen wie Äther, Chloroform und Detergenzien inaktiviert (KUBIN et al., 1967, MOENNIG, 1988). Die Infektiosität wird durch Hitze (60°C für 10 min.) und durch UV-Strahlung aufgehoben Literaturübersicht 19 (KUBIN et al., 1967). Das Virus ist relativ stabil in einem pH-Bereich von 5-10, pHWerte unter 4 und über 10 führen zu einer Virusschädigung (DEPNER et al., 1992, EDWARDS, 2000). In Fleisch und Fleischprodukten findet das Virus aufgrund des hohen Protein- und Feuchtigkeitsgehaltes gute Überlebensbedingungen. Die Überlebensdauer hängt von der Verarbeitungsform ab. In gefrorenem Schweinefleisch konnte das KSPV noch nach vier Jahren nachgewiesen werden (EDWARDS, 2000), in geräuchertem Fleisch werden Überlebenszeiten von 17 bis 188 Tagen beschrieben (McKERCHER et al., 1978). 2.1.2.6 Genetische Typisierung von KSPV-Isolaten Durch die genetische Typisierung ist es möglich, den Verwandtschaftsgrad zwischen verschiedenen Isolaten des KSPV zu ermitteln. Dies ist hilfreich bei der Klassifizierung der verschiedenen Virusisolate und kann Auskunft über die epidemiologischen Zusammenhänge einzelner Seuchenzüge geben (PATON et al., 2000). Durch Sequenzvergleiche bestimmter Genomabschnitte und anschließende phylogenetische Analyse kann man KSPV genetischen Gruppen zuordnen (HOFMANN et al., 1994, LOWINGS et al., 1996, GREISER-WILKE et al., 1998, PATON et al., 2000). Besonders geeignet für diese vergleichende Analyse sind Genomabschnitte des E2-Glykoproteins bestehend aus 190 Nukleotiden (nt) und die 5´-NTR-Region (150nt), sowie Fragmente des 3’-Endes des Nichtstrukturproteins NS5B (PATON et al., 2000). Aufgrund dieser Untersuchungen wurde das KSPV in drei genetische Gruppen unterteilt, die wiederum mehrere Untergruppen enthalten (PATON et al., 2000). Die Gruppe 1 mit den Untergruppen 1.1, 1.2 und 1.3 beinhaltet Impfvirusstämme, Isolate aus Westeuropa, Großbritannien und den USA aus den 1940er und 1950er Jahren sowie aus Japan aus den 1960er Jahren. Daneben enthält diese Gruppe noch Isolate aus Brasilien und Korea aus den 1980er Jahren und Isolate aus der Ukraine, Kroatien, Mexiko, Thailand, China und der Karibik aus den 1990er Jahren. Die Gruppe 2 ist in die Untergruppen 2.1, 2.2 und 2.3 unterteilt. 20 Literaturübersicht Jede dieser Untergruppen enthält Isolate aus Westeuropa aus den 1980er und 1990er Jahren. In die Untergruppe 2.1 wurden neben Isolaten aus Westeuropa außerdem noch Isolate aus Malaysia (1980er Jahre) und aus Osteuropa aus den 1990er Jahren eingeteilt. Die Untergruppe 2.2 beinhaltet noch zusätzlich Isolate aus Singapur (1980er Jahre) und Thailand (1990er Jahre) und in der Untergruppe 2.3 befinden sich zusätzlich Isolate aus Japan (1970er Jahre) und Osteuropa (1990er Jahre). In der Gruppe 3 (Untergruppen 3.1, 3.2, 3.3, 3.4) befinden sich Isolate aus Großbritannien (1960er Jahre), Korea (1980er und 1990er Jahre), Thailand (1990er Jahre) und Japan (1970er Jahre) und Taiwan (1990er Jahre) (PATON et al., 2000). Die Analyse der Seuchenausbrüche in Europa in den letzten zehn Jahren zeigte, dass die meisten Virusisolate zu einer der Untergruppen der Gruppe 2 gehörten (MOENNIG et al., 2002). Die letzten großen Seuchenzüge in Deutschland, den Niederlanden, Italien, Spanien und Belgien in 1997/1998 (GREISER-WILKE et al., 2000b) und in Großbritannien im Jahre 2000 (SANDVIK et al., 2000) wurden durch Virusisolate der Genogruppe 2.1 verursacht. In Europa scheinen nur in Russland noch Isolate der Gruppe 1 aufzutreten. Viren der Gruppe 1.2 wurden ebenfalls in Kuba entdeckt und Viren der Gruppe 1.3 in der Karibik. Virusisolate der Gruppe 3 beschränken sich derzeit auf Asien (MOENNIG et al., 2002). Literaturübersicht 21 2.2 Klinik und Pathologie 2.2.1 Übertragung Unter natürlichen Bedingungen erfolgt die Übertragung des KSPV oronasal (DUNNE, 1970). Durch direkten Kontakt zwischen infizierten und empfänglichen Tieren, durch Verfütterung von virushaltigen, nicht ausreichend erhitzten Speiseabfällen oder durch mechanische Vektoren, wie z. B. Transportfahrzeuge, Stallgeräte oder Personen, wird das Virus weiterverbreitet (VAN OIRSCHOT, 1999). Auch eine Übertragung durch den Deckakt oder die künstliche Besamung ist möglich, da das Virus im Sperma von infizierten Ebern nachgewiesen werden konnte (DE SMIT et al., 1999, FLOEGEL et al., 2000). Die Virusausscheidung erfolgt über Sekrete und Exkrete, wie Speichel, Konjunktivalflüssigkeit, Urin und Faezes (VAN OIRSCHOT, 1999). Tragende, infizierte Sauen können das Virus auf die Feten übertragen (VAN OIRSCHOT, 1979a,b, MEYERS et al., 1981). Natürliche Wirte des KSPV sind Hausschweine und Wildschweine (DUNNE, 1970, DEPNER et al., 1995, LADDOMADA, 2000). Infizierte Wildschweine können als Erregerreservoir dienen und sind somit eine ständige Infektionsgefahr für die Hausschweinepopulation (MOENNIG, 2000). 22 Literaturübersicht 2.2.2 Verlaufsformen der Klassischen Schweinepest Bei der Infektion mit dem KSPV kann man zwischen der postnatalen und der pränatalen Infektion unterscheiden (VAN OIRSCHOT, 1999). Nach postnataler Infektion sind verschiedene Verlaufsformen möglich: die akutletale, die akut-transiente und die chronische Verlaufsform (DEPNER et al., 1996a, VAN OIRSCHOT, 1999). Diese systematische Einteilung hat primär eine didaktische Bedeutung und besitzt nur eine Gültigkeit bei der Betrachtung einzelner Tiere. Unter Feldbedingungen ist es schwieriger, die klaren, aus Experimenten bekannten Verlaufsformen zu erkennen, da der genaue Infektionszeitpunkt nicht bekannt ist und mehrere Krankheitsbilder gleichzeitig auftreten können (DEPNER et al., 1996a). 2.2.2.1 Akute Verlaufsformen Das erste Anzeichen einer Infektion mit dem Virus der klassischen Schweinepest ist ein Ansteigen der Körpertemperatur auf über 41°C (VAN OIRSCHOT, 1999). Bei der peraktuten Verlaufsform der Erkrankung ist hohes Fieber meist das einzige klinische Symptom, bevor die Schweine plötzlich zwei bis fünf Tage nach der Infektion verenden (DUNNE, 1970). Auch pathologisch-anatomisch lassen sich bei diesem Verlauf oft nur Schocksymptome feststellen (TRAUTWEIN, 1988). Die akut-letale Form ist gekennzeichnet durch Fieber, Apathie und Anorexie, Konjunktivitis, Erbrechen, Verstopfung gefolgt von Durchfall, vergrößerten Lymphknoten und respiratorischen Symptomen. Oft treten neurologische Symptome auf. Die Tiere taumeln und zeigen eine Schwäche in der Hinterhand, bis hin zu einer vollständigen Lähmung. Die klassischen Hautveränderungen in Form von petechialen bis flächenhaften Blutungen treten in der Endphase der Erkrankung auf und sind besonders an den Ohren, dem Unterbauch, der Schulter- und Kreuzregion und den Gliedmaßen zu finden (VAN OIRSCHOT, 1999). Die Tiere verenden 10 bis 20 Tage (akut) oder 20 bis 30 Tage (subakut) nach der Infektion (DUNNE, 1970). Literaturübersicht 23 Im Sektionsbild findet man vor allem Veränderungen an den Lymphknoten, den Nieren und der Milz. Die Lymphknoten sind geschwollen, ödematös und hämorrhagisch. An den Nieren können petechiale bis ekchymale Blutungen auftreten. Petechien kann man auch in der Harnblase, der Epiglottis, dem Herzen sowie dem Brust- und Bauchfell feststellen. Das Auftreten von Milzinfarkten gilt als fast pathognomisch für KSP (VAN OIRSCHOT, 1999). Außerdem kann in vielen Fällen eine nichteitrige Enzephalitis diagnostiziert werden (GRUBER et al., 1995). Überleben die Tiere eine akute Erkrankung, bildet sich nach zwei bis vier Wochen eine effektive Immunantwort aus, mit maximalen Titern nach drei bis vier Monaten. Bei letal verlaufender KSP sind meist nur geringe Mengen neutralisierender Antikörper kurz vor Verenden der Tiere nachweisbar. (BOEHM et al., 1966, RESSANG, 1973, LIESS et al., 1977, DEPNER et al., 1994). Neben dem akuten Verlauf mit hohen Mortalitätsraten treten mildere Verlaufsformen und transiente Infektionen mit vollständiger Genesung auf, die die Diagnose der KSP erschweren. Bei der akut-transienten Verlaufsform kann zwar Virus- bzw. Antigen im Untersuchungsmaterial nachgewiesen werden, aber die klinischen Untersuchungsergebnisse weisen nicht unbedingt auf KSP hin. Das Fieber dauert nur einige Tage an und das Allgemeinbefinden bessert sich rasch wieder. Typische hämorrhagische oder zentralnervöse Störungen treten nicht auf. Deshalb spricht man in diesem Fall auch von einem „atypischen“ Verlauf (DAHLE u. LIESS, 1992, DEPNER et al., 1996a). 24 Literaturübersicht 2.2.2.2 Chronische Verlaufsform Die chronische Form der KSPV-Infektion ist gekennzeichnet durch eine Krankheitsdauer von mehr als 30 Tagen (MENGELING u. PACKER, 1969) und wird möglicherweise durch moderat virulentes Virus hervorgerufen (CABREY et al., 1977, VAN OIRSCHOT, 1999). Chronisch erkrankte Schweine können mehr als 100 Tage überleben, aber die Erkrankung verläuft letztendlich immer letal (MENGELING u. PACKER, 1969, VAN OIRSCHOT, 1999). Diese Form der KSP zeigt einen protrahierten Verlauf. Es kann abwechselnd zu Phasen klinischer Besserung, gefolgt von erneuten Krankheitsschüben kommen (DEPNER et al., 1996a, b). MENGELING und PACKER (1969) haben die chronische Verlaufsform in drei Phasen eingeteilt. In der ersten Phase sind mehr oder weniger ausgeprägte Symptome einer akuten Erkrankung festzustellen, in der zweiten Phase kommt es zu einer kurzfristigen Verbesserung des Gesundheitszustandes der Tiere, die dritte Phase führt mit einem Wiederauftreten der klinischen Symptome zum Tod der Schweine. Die für KSP „typischen“ Symptome fehlen meist, die Tiere zeigen intermittierendes Fieber, Appetitlosigkeit, Durchfall, Alopezie und Dermatitis. Die Schweine kümmern und sind mehr oder weniger deutlich in ihrer Entwicklung gestört (DEPNER et al., 1996a). Chronisch kranke Tiere scheiden permanent Virus aus und sind somit eine ständige Infektionsquelle. Bei Nichterkennen der Infektion können sie eine wichtige Rolle bei der Weiterverbreitung der Seuche spielen (DEPNER et al., 1996b). Neutralisierende Antikörper sind nur kurzfristig in der Phase der klinischen Besserung um die 4. Infektionswoche nachweisbar. Zu diesem Zeitpunkt kann es auch zu einem vorübergehenden Verschwinden der Virämie kommen (MENGELING u. PACKER, 1969, DEPNER et al., 1996b, VAN OIRSCHOT, 1999). Die pathologisch-anatomischen Veränderungen sind weniger ausgeprägt als bei akuter Schweinepest. Auffällig ist eine Depletion der Lymphozyten in den Lymphorganen. Thymusatrophie und eine durch Immunkomplexe hervorgerufene Glomerulonephritis können beobachtet werden. Knopfförmige Ulzerationen Literaturübersicht 25 (engl. button ulcers) in Caecum und Colon sind eine bei chronischer Schweinepest oft anzutreffende pathologische Veränderung (VAN OIRSCHOT, 1999). 2.2.2.3 Pränatale Infektion Bei tragenden Sauen kommt es nach Infektion mit dem KSPV zu einer transplazentaren Virusübertragung (VAN OIRSCHOT u. TERPSTRA, 1977). Die Folgen einer in utero-Infektion hängen im Wesentlichen vom Entwicklungsstadium der Feten zum Zeitpunkt der Infektion ab und von der Virulenz des Erregers (MOENNIG u. PLAGEMANN, 1992). Eine Infektion in der frühen Phase der Gestation (vor dem 41. Tag) führt meist zu Aborten oder Totgeburten, Mumifikationen oder Missbildungen. Erfolgt die Infektion um den 50. bis 70. Tag der Trächtigkeit, kann es zur Geburt persistent virämischer Ferkel kommen (VAN OIRSCHOT u. TERPSTRA, 1977, MEYERS et al., 1981). Nach dem 85. Tag der Trächtigkeit werden nicht-virämische Tiere geboren (MOENNIG u. PLAGEMANN, 1992). Persistent virämische Ferkel können bei der Geburt völlig gesund erscheinen, sie entwickeln aber dann die sogenannte Spätform („late onset“) der KSP und verenden schließlich. Die Tiere fallen durch Wachstumsstörungen, Kümmern, Anorexie, Konjunktivitis, Dermatitis und Bewegungsstörungen auf, wobei die Symptome unterschiedlich stark ausgeprägt sein können. Kongenital infizierte virämische Ferkel sind immuntolerant gegenüber dem KSPV, sie sind jedoch zu einer Immunantwort gegenüber anderen Erregern fähig (VAN OIRSCHOT, 1999). Schweine, die an der Spätform der KSP erkrankt sind, können bis zu 11 Monaten überleben. Sie scheiden konstant große Mengen Virus aus und sind somit eine gefährliche Infektionsquelle und von Bedeutung bei der Weiterverbreitung der KSP (VAN OIRSCHOT u. TERPSTRA, 1977). 26 Literaturübersicht 2.2.4 Pathogenese Unter natürlichen Bedingungen erfolgt die Übertragung des KSPV oronasal. Gelegentlich wurde auch eine Infektion über die Konjunktival – oder Genitalschleimhäute beobachtet (VAN OIRSCHOT, 1999). Die primäre Virusvermehrung findet in den Tonsillen statt (DUNNE, 1959, RESSANG, 1973). Auch nach intramuskulärer und subkutaner Applikation konnte das Virus in hoher Konzentration hier nachgewiesen werden (LIN et al., 1969, MENGELING u. PACKER, 1969). Anfangs infiziert das KSPV die Epithelzellen an der Oberfläche und in den Krypten der Tonsillen, wo das Virus schon nach ungefähr sieben Stunden post infectionem (p.i.) nachgewiesen werden kann. Von hier aus findet die Weiterverbreitung in das umgebende lymphoretikuläre Gewebe und über die Lymphgefäße in die regionären Lymphknoten statt. Nach Virusvermehrung in den regionären Lymphknoten und anschließender Virusausbreitung über das Blutgefäßsystem mit massiver Virämie, kommt es zu einer sekundären Virusvermehrung in der Milz, im Knochenmark, in den viszeralen Lymphknoten und im lymphatischen Gewebe des Darms. Die Virustiter in Lymphorganen sind generell höher als in parenchymatösen Organen (RESSANG, 1973). Die Hauptzielzellen für das KSPV sind Endothelzellen, lymphoretikuläre Zellen, Makrophagen und Epithelzellen (MOENNIG, 2000). Die Virusausbreitung im Organismus ist nach 5-6 Tagen abgeschlossen (RESSANG, 1973). Die Infektion mit dem KSPV verursacht eine schwere Leukopenie und Immunsuppression, die schon vor dem Auftreten von Fieber beobachtet werden kann (TRAUTWEIN, 1988). Das Virus hat eine ausgeprägte Affinität für Zellen der lymphoretikulären Organe, wo es eine schwere Depletion der Lymphozyten verursacht (LIESS, 1987), wobei im Endstadium einer letalen Infektion, sowohl im Lymphgewebe als auch im peripheren Blut, vor allem eine dramatische Verminderung der B-Lymphozyten zu beobachten ist (SUSA et al., 1992). Schon zu Beginn der Erkrankung kommt es zu einer Virusvermehrung in den Keimzentren der Lymphorgane. Zuerst findet eine Virusvermehrung in den B-Follikeln und Epithelzellen der Tonsillen, sowie in den B-Follikeln der regionären Lymphknoten und Literaturübersicht 27 der Peyerschen Platten statt. Erst danach kommt es zu einer Weiterverbreitung des Virus in anderes Lymphgewebe und zu einer Infektion von Endothelzellen und anderen Epithelzellen (SUSA et al., 1992). Obwohl alle Leukozytensubpopulationen durch das KSPV infiziert werden können (SOOS et al., 2000), wurden unreife Granulozyten und Monozyten als Hauptzielzellen für das Virus im peripheren Blut 7-10 Tage p.i. identifiziert (SUMMERFIELD et al., 1998). Unreife Granulozyten, die normalerweise nur im Knochenmark anzutreffen sind, finden sich vermehrt im Blut infizierter Tiere, wobei die Anzahl der reifen Granulozyten vermindert ist. Reife Granulozyten aus dem Blut sind in vitro nicht empfänglich für KSPV, jedoch lassen sich unreife Granulozyten aus dem Knochenmark infizieren. Deshalb wird angenommen, dass in vivo die initiale Infektion unreife Myeloblasten betrifft, die sich dann weiter zu reifen Granulozyten differenzieren und weiterhin virales Antigen enthalten (SUMMERFIELD et al., 1998). Der Beginn der Lymphopenie und der Anstieg der unreifen Granulozyten im peripheren Blut zeigt sich, je nach Virusisolat, deutlich ein bis vier Tage bevor Virus oder virale RNA in den Leukozyten nachgewiesen werden kann. Diese Feststellung führte zu der Hypothese, dass die Leukopenie nicht durch direkte Virusschädigung, sondern indirekt virusinduzierte über Störung Virus-Wirt-Interaktionen der Myeloidzellfunktion hervorgerufen wird als wird. Ursache Eine diskutiert (SUMMERFIELD et al., 2000). Die akute Schweinepest ist in der Endphase der Erkrankung unter anderem durch das Auftreten zahlreicher Blutungen in verschiedenen Organen gekennzeichnet (HEENE et al., 1971). Im Vordergrund der Gerinnungsstörungen steht ein massiver Thrombozytenabfall, der schon ab dem zweiten Tag nach der Infektion deutlich wird. Dies wird zum einen durch eine direkte Thrombozytenschädigung durch das Virus (WEISS et al., 1973) und zum anderen durch eine fortschreitende massive Degeneration der Megakaryozyten erklärt (HOFFMANN et al., 1971b). GOMEZVILLAMANDOS (1998) konnte nachweisen, dass zwei Tage nach der Infektion 2,59% der Megakaryozyten mit dem KSPV infiziert waren, und dass die Plättchenfreisetzung aus den infizierten Megakaryozyten die Verbreitung des Virus unterstützt. 28 Literaturübersicht Das Auftreten von Mikrothromben in verschiedenen Organen zeigt morphologisch das Bild einer disseminierten intravasalen Gerinnung (DIK) (HOFFMANN et al., 1971a). Bei gerinnungsanalytischen Untersuchungen wurden zahlreiche Hämostasedefekte gefunden, die im Sinne einer DIK (Verbrauchskoagulopathie) gedeutet werden können (HEENE, 1971). Bei der akuten Schweinepest erfolgt die Aktivierung der Gerinnungskaskade vor allem durch die Freisetzung prokoagulatorischer Substanzen (Gewebethromboplastine) aus virusgeschädigten Zellen, z.B. lymphatischen Geweben. Außerdem können die bei der KSP auftretenden Endothelläsionen verstärken (HOFFMANN, 1976). die Verbrauchskoagulopathie auslösen oder Literaturübersicht 29 2.3 Virulenz und Wirtsfaktoren 2.3.1 Virulenz Unter der Virulenz eines Erregers versteht man den Grad seiner krankmachenden Eigenschaften. Da die Virulenz innerhalb einer Erregerart sehr stark variieren kann, bezieht sie sich immer auf einen bestimmten Erregerstamm unter definierten Infektions- und Wirtsbedingungen (ROLLE u. MAYR, 1993). Das Virus der Klassischen Schweinepest zeigt eine sehr große Variationsbreite hinsichtlich seiner Virulenz. Es lassen sich avirulente und virulente Stämme voneinander unterscheiden. Die avirulenten Stämme, die meist durch Attenuierung in heterologen Wirten, z.B. Kaninchen, entstanden sind, werden als Impfstämme genutzt (MOENNIG u. PLAGEMANN, 1992). Die virulenten Vertreter des KSPV werden in der Literatur oft in Gruppen von hoher, moderater und schwacher Virulenz eingeteilt. Es wurden mehrfach Studien durchgeführt, um die Virulenz bestimmter KSPV-Stämme zu quantifizieren, wobei jedoch eine klare Definition bisher nicht vorliegt. Es gibt verschiedene Ansätze, die Virulenz des KSPV zu bestimmen. Folgende Kriterien wurden zur Charakterisierung herangezogen: ð Mortalität, klinische Symptome, pathologische Veränderungen (CARBREY et al., 1977, VAN OIRSCHOT, 1988, WOOD et al., 1988, KAMOLSIRIPRICHAIPORN et al., 1992, MITTELHOLZER et al., 2000). ð Wachstumseigenschaften in Zellkulturen (AYNAUD et al., 1972, 1976, VAN OIRSCHOT, 1988, MITTELHOZER et al., 2000). ð Veränderungen auf der Genomebene (MOORMANN et al., 1996, BJORKLUND et al., 1998, MEYERS et al., 1999, MAYER et al., 2002). 30 Literaturübersicht Vor 1980 traten vor allem perakute und akute Verlaufsformen mit hoher Mortalität, möglicherweise ausgelöst durch hochvirulentes Virus, auf. In den letzten Jahrzehnten wurden jedoch vermehrt inapparente oder atypische Formen der KSP beobachtet, die mit Virusisolaten von moderater oder schwacher Virulenz in Verbindung gebracht wurden (PLATEAU et al., 1980, MOENNIG u. PLAGEMANN, 1992, DEPNER et al., 1996b, TERPSTRA et al., 2000). Von 135 Feldisolaten, die in den letzten zehn Jahren vor der KSP-Eradikation in den USA getestet wurden, waren 27% schwach virulent und 22% avirulent (CABREY et al., 1980), wobei allerdings nicht erwähnt wurde, welche Kriterien der Einteilung der Virulenz zugrunde lagen. Die Virulenz des KSPV scheint eine unstabile Eigenschaft zu sein, da sie sich im Verlauf eines Seuchenzuges auch ändern kann (ANON., 1977). Es wurde über eine Virulenzsteigerung nach mehreren Passagen in Schweinen berichtet (KORN et al., 1964). Eine Virulenzminderung konnte durch wiederholte Passagen in Zellkulturen oder in Kaninchen oder Ziegen erreicht werden (VAN OIRSCHOT, 1988). Neben der Virulenz des Erregers sind für den Krankheitsverlauf auch noch andere Faktoren wichtig. Dazu zählen die Virusdosis (DAHLE u. LIESS, 1995), der Infektionsmodus (LIESS et al., 1977), Herkunft und Reinheit des Inokulums (DAHLE u. LIESS, 1995) und zahlreiche Wirtsfaktoren, wie z.B. das Alter der Tiere (DAHLE u. LIESS, 1995, DEPNER et al., 1996a). Deshalb ist es von großer Bedeutung, dass bei der Beurteilung der Virulenz in Tierversuchen standardisierte Bedingungen gewährleistet sind, die die oben genannten Faktoren berücksichtigen (DAHLE u. LIESS, 1995). Literaturübersicht 31 2.3.1.1 Charakterisierung der Virulenz des KSPV aufgrund klinischer Symptome und pathologischer Veränderungen. Üblicherweise basiert die Charakterisierung der Virulenz auf der Beurteilung klinischpathologischer Symptome und der Mortalität. CARBREY et al. (1977) unterteilten KSPV-Isolate in hoch virulent, schwach virulent und avirulent, sowie in Isolate, die persistierende Infektionen auslösten. Hochvirulente Isolate führten zu einer schweren Erkrankung mit letalem Ausgang. Bei der Sektion zeigten sich KSP-typische Veränderungen und das Virus konnte aus Organproben isoliert werden. Schwach virulente Isolate führten nach einem protrahierten Krankheitsverlauf zum Tode der Tiere oder zur Genesung. Pathologische Veränderungen waren schwach ausgeprägt, aber das Virus konnte aus Organproben isoliert werden. Avirulente Isolate lösten keine Erkrankung aus und führten zu einer belastbaren Immunität. Isolate, die eine persistierende Infektion hervorriefen, wurden gesondert aufgeführt. KAMOLSIRIPRICHAIPORN et al. (1992) haben zwei KSPV-Stämme (NSW, WEYBRIDGE) bezüglich ihrer Pathogenität im Tierversuch miteinander verglichen. Der NSW-Stamm zeigte im Vergleich zum WEYBRIDGE-Stamm einen späteren Fieberbeginn, mildere klinische Symptome, eine nicht so ausgeprägte Leukopenie und weniger deutliche pathologische Veränderungen. Aufgrund der Tatsache, dass der WEYBRIDGE-Stamm bei allen Schweinen eine akut-letale Erkrankung auslöste, wurde er als hoch virulent eingestuft. Der NSW-Stamm verursachte nur einen milden Krankheitsverlauf und wurde als schwach virulent charakterisiert. Die Virustiter in den meisten Organproben und dem Blut waren für den WEYBRIDGE-Stamm signifikant höher als bei dem NSW-Stamm. Die Klassifizierung der Virulenz durch VAN OIRSCHOT (1988) berücksichtigte nur die Mortalität, während Faktoren, die den Verlauf der Erkrankung beeinflussen, kaum oder gar nicht erwähnt wurden. Nach seiner Definition töteten hoch virulente Stämme nahezu alle Tiere, unabhängig vom Alter. Bei der akut-letalen Form der KSP, ausgelöst durch ein hoch virulentes Virus, war die Virusausbreitung im Organismus gekennzeichnet durch eine lymphatische, virämische und viszerale Phase. Das Virus 32 Literaturübersicht vermehrte sich zu hohen Titern in den Zielzellen und die Virusausbreitung war in der Regel schon nach 5 bis 6 Tagen abgeschlossen. Es kam zu einer persistierenden Leukopenie, die bis zum Tode der Tiere bestehen blieb. Die Infektion breitete sich schnell in einem Bestand aus. Moderat virulente Stämme verursachten einen subakuten bis chronischen Krankheitsverlauf, der zum Tod oder zur Genesung der Tiere führte. Die Infektion mit moderat virulentem Virus war besonders durch die große Variationsbreite im klinischen Bild gekennzeichnet. Schwach virulentes Virus führte zu keinen oder nur wenigen Krankheitssymptomen, konnte aber nach transplazentarer Übertragung negative Folgen für die Feten haben. Die postnatale Infektion mit schwach virulentem Virus blieb meist auf die lymphatische Phase der Erkrankung beschränkt. Kam es zu einer Virämie, so war diese meist von kurzer Dauer und es wurden nur niedrige Virustiter erreicht. Schweine, die mit schwach virulentem Virus infiziert waren, zeigten eine transiente Leukopenie. Allerdings konnte nach Infektion von Schweinen mit den schwach virulenten Stämmen Bergen, Henken und Zoelen kein signifikanter Abfall der Leukozyten festgestellt werden (STEGEMANN et al., 2000). Im Bestand breitete sich die Infektion nur langsam aus. Avirulente Stämme waren apathogen, dabei handelte es sich meist um attenuierte Impfstämme (VAN OIRSCHOT, 1988). Im Gegensatz zu VAN OIRSCHOT (1988) haben MITTELHOLZER et al. (2000) bei der Einteilung der Virulenz die klinischen Symptome und deren Ausprägungsgrad mit einbezogen. Sie entwickelten ein Untersuchungsschema, das 10 KSP-relevante Symptome berücksichtigt (Untersuchungsschema s. Kapitel 3.2.1). Je nach Ausprägungsgrad wurde jedes Symptom mit 0-3 Punkten beurteilt (0 = kein Symptom, 1 = wenig verändert, 2 = deutliches klinisches Symptom, 3 = schweres KSP-Symptom). Damit konnte eine maximale Punktzahl von 30 pro Tag und Tier erreicht werden. Zusätzlich wurde der Fieberverlauf berücksichtigt. Sieben KSPVStämme wurden untersucht. Hierzu wurden ca. 30 kg schwere spezifisch pathogenfreie Schweine (SPF) mit einer Inokulationsdosis von 106 KID50 intranasal infiziert. KSPV-Stämme, die eine Punktzahl von >15 und Fieber >41 °C erreichten, wurden als hoch virulent klassifiziert (BRESCIA, EYSTRUP, KOSLOV). Stämme, die eine Punktzahl zwischen 5 und 15 und Fieber >40 °C <41 °C erreichten, wurden als Literaturübersicht 33 moderat virulent eingestuft. Zu den moderat virulenten Vertretern gehörten ein gentechnisch hergestellter Klon von Alfort 187, vA187-1 (RUGGLI et al., 1996), und der zytopathogene Vertreter desselben Klons, cp vA187-1 (MITTELHOLZER et al., 1997). Schwach virulente Stämme wurden durch eine Punktzahl < 5 definiert. Bei avirulenten Stämmen beträgt der Clinical Score immer 0. Hierzu zählten der KSPVStamm vA187-ubi, bei dem das Npro-Gen durch ein murines Ubiquitin-Gen ersetzt wurde (TRATSCHIN et al., 1998) und der Stamm CAP, der aus einer persistent infizierten porzinen Zellinie stammt. Die Tatsache, dass der zytopathogene Partner (cp vA187-1) des Klons Alfort (vA187-1) und dieser Klon selbst einen sehr ähnlichen Krankheitsverlauf verursachten, deutet darauf hin, dass Zytopathogenität in vitro nicht mit der Virulenz in vivo korreliert (MITTELHOLZER et al., 2000). 2.3.1.2 Differenzierung der Virulenz des KSPV durch „in-vitro“-Unterschiede Neben der Unterscheidung im Tierversuch wurden auch „in-vitro“-Unterschiede zur Differenzierung der Virulenz der verschiedenen Stämme beschrieben. Hoch virulente Stämme wuchsen optimal bei einer Temperatur zwischen 39°C und 40°C, wohingegen das Temperaturoptimum von schwach virulenten Stämmen zwischen 33°C und 34°C lag. Außerdem zeigten hoch virulente Stämme eine größere Hitzeresistenz bei 56°C (AYNAUD et al., 1976). Virulentes Virus vermehrte sich schneller und zu höheren Titern in Zellkulturen als weniger virulentes Virus (VAN OIRSCHOT, 1988). Im Zellkulturüberstand konnte bei Infektion der Zellen mit hochvirulentem Virus ein höherer Titer nachgewiesen werden als bei Infektion mit schwach virulentem Virus (MITTELHOLZER et al., 2000). Nach der Infektion von PK(15)-Zellen mit hoch virulentem Virus waren bei der Immunfluoreszenztechnik große, stark fluoreszierende Foci sichtbar, während schwach oder moderat virulente Stämme nur kleine, schwach fluoreszierende Foci hervorriefen (VAN OIRSCHOT, 1988). 34 Literaturübersicht 2.3.1.3 Genetische Marker für die Virulenz des KSPV Eine Erklärung für die unterschiedliche Virulenz der KSPV-Stämme auf molekularer Ebene gibt es bisher nicht, ebenso ist der molekulare Mechanismus der Attenuierung noch nicht endgültig geklärt. Diskutiert wird z.Zt. ob eine T-reiche Insertion von ca. 13 Nucleotiden, die in der 3’ nichttranslatierten Region verschiedener Impfstämme (C-Stamm, HCLV u.a.) vorhanden ist, eine Rolle bei der Attenuierung spielt (MOORMANN et al., 1996, WONG et al., 2001, WU et al., 2001). Die Sequenzen der 5’- und 3’-nichttranslatierten Regionen sind von Bedeutung bei der Erkennung der RNA durch die virale Replikase und damit für die Virusreplikation (MOORMANN et al., 1996). Die Insertion führt zu einer Änderung der Sekundärstruktur und war möglicherweise für die verminderte Replikationsrate der Impfstämme verantwortlich. Bisher wurde bei keinem virulenten Stamm eine solche Insertion gefunden (WU et al., 2001). Allerdings war bei einigen der untersuchten Impfstämme diese Insertion ebenfalls nicht vorhanden (BJORKLUND et al., 1998). Es konnte gezeigt werden, dass hoch virulente KSP-Stämme nach Entfernen des Nichtstrukturproteins Npro avirulent wurden. Allerdings kam es nach Austausch des Npro eines hoch virulenten Stammes durch das Npro eines schwach virulenten Stammes zu keiner Virulenzänderung (MAYER et al., 2002). Mutanten des KSPVStammes Alfort/Tübingen, bei denen die RNase-Aktivität des Glykoproteins Erns inaktiviert wurde, waren im Tierversuch apathogen. Der kausale Zusammenhang zwischen der Enzyminaktivierung und der Attenuierung konnte bisher jedoch noch nicht bewiesen werden (MEYERS et al., 1999). Literaturübersicht 35 2.3.2 Wirtsfaktoren Der Krankheitsverlauf der KSP wird nicht nur von der Virulenz des jeweiligen Isolates bestimmt. Wirtsfaktoren, wie Alter, Ernährungszustand, Immunkompetenz und die Genetik der Tiere, haben ebenfalls einen Einfluss auf das Krankheitsgeschehen (VAN OIRSCHOT, 1988, DEPNER et al., 1996a, 1997). Ein wichtiger Faktor, der den Verlauf der Infektion beeinflusst, ist das Alter der Tiere. Die Morbitität und Mortalität sinkt mit zunehmendem Alter. Während Saug- und Absatzferkel schwer erkrankten und die Sterblichkeit hoch war, zeigten adulte Tiere bei Infektion mit dem gleichen Isolat oft nur einen milden bis subklinischen Krankheitsverlauf (DEPNER et al., 1996a). Bei der transplazentaren Infektion sind die Folgen wesentlich vom Zeitpunkt der Infektion und damit von der Entwicklung des Immunsystems des Fetus abhängig. Je nach Trächtigkeitstadium kam es zu Aborten, Totgeburten, Mumifikationen und Missbildungen oder zur Geburt persistent virämischer Ferkel (MEYERS et al., 1981, VAN OIRSCHOT et al., 1999). Aufgrund der Vermutung, dass auch genetische Faktoren für die verschiedenen Krankheitsbilder der KSP verantwortlich sind, wurden fünf halothan-negative Absatzferkel der Deutschen Landrasse (DL) und fünf gleichaltrige halothan-positive Kreuzungstiere (DL x Pietrain) mit der gleichen Virusdosis infiziert (DEPNER et al., 1997). Während die DL-Tiere akut erkrankten, zeigten nur zwei Kreuzungstiere die akute Form der KSP. Bei einem Kreuzungstier konnte die mild-transiente Form der KSP diagnostiziert werden und zwei Tiere erkrankten an der chronischen Form der KSP. Auch beim Vergleich der Körpertemperaturen zwischen diesen beiden Gruppen waren deutliche Unterschiede festzustellen. Diese Ergebnisse deuteten darauf hin, dass die KSPV-Infektion auch von der genetischen Konstitution des Wirtes bestimmt sein könnte (DEPNER et al., 1997). 3. Eigene Untersuchungen 3.1 Material 3.1.1 Tiere und Versuchsaufbau Im Europäischen Referenzlabor für Klassische Schweinepest (EURL) in Hannover wurden zwei Tierversuche (Aktenzeichen: 01A 78) mit folgenden Zielsetzungen durchgeführt: 1. Bestimmung der Virulenz von vier KSPV-Feldisolaten 2. Vergleich des Krankheitsverlaufes der KSP von Reinzucht- und Kreuzungstieren Bei den Tieren des ersten Versuches handelte es sich um Absatzferkel der Deutschen Landrasse (DL), die zu Versuchsbeginn ein Alter von acht Wochen hatten. Sie wurden einmal am Tag mit kommerziell erhältlichem Futter, speziell für ihr Alter, gefüttert. Ein vor Beginn des Versuches durchgeführter serologischer Test auf neutralisierende Antikörper gegen Pestiviren war negativ. Zur Infektion wurden vier verschiedene KSPV-Feldisolate (CSF 0650, CSF 0695, CSF 0634 und CSF 0277) verwendet. Mit jedem Virusisolat wurden jeweils fünf Schweine infiziert, die zusammen in einer Isolierstalleinheit gehalten wurden. Zwischen den einzelnen Isolierstalleinheiten bestand keine Verbindung. Die Schweine wurden mit 5 ml virushaltigem Zellkulturüberstand, der eine Virusdosis von 104 KID50 enthielt, intranasal infiziert. Während des gesamten Versuches wurden die Tiere täglich nach einem vorgegebenen Schema (s. Kap. 3.2.1) klinisch untersucht. Die rektale Körpertemperatur wurde ebenfalls täglich ermittelt. Als Kontrolltiere dienten zwei Schweine, die unter den gleichen Bedingungen gehalten wurden wie die Versuchstiere, jedoch nicht infiziert wurden. Eigene Untersuchungen 37 Im zweiten Tierversuch dienten Schweine der Deutschen Landrasse und Hybridschweine (DL × Pietrain) als Versuchstiere. Die Tiere waren zu Versuchsbeginn acht Wochen alt. Die Haltung der Tiere, die Virusdosis, der Inokulationsweg sowie die klinische und postmortale Untersuchung waren mit den Bedingungen im ersten Tierversuch identisch. Eine vor Beginn des Versuches durchgeführte serologische Untersuchung auf neutralisierende Antikörper gegen Pestiviren war bei allen Schweinen negativ. Im ersten Versuchsdurchgang wurden je fünf Schweine beider Rassen mit dem zuvor als moderat virulent klassifizierten Virusisolat CSF 0277 infiziert. Im zweiten Versuchsdurchgang erhielten je fünf weitere Tiere der Deutschen Landrasse und fünf Hybridschweine das als hoch virulent eingestufte Virusisolat CSF 0634. Bei beiden Versuchsdurchgängen dienten je zwei nicht infizierte Schweine als Kontrolltiere. Bei beiden Tierversuchen richtete sich die Versuchsdauer nach dem Krankheitsverlauf der KSP. Moribunde Tiere wurden aus Gründen des Tierschutzes beim Vorliegen eines CS von mindestens 15 euthanasiert. Die euthanasierten Schweine wurden noch am selben Tag in einer Sektion auf pathologische Veränderungen untersucht. Die Schweine, die sich von der Infektion erholten, wurden nach vollständiger Genesung und Entwicklung einer effektiven Immunantwort gegen das KSPV euthanasiert und ebenfalls einer Sektion unterzogen. 3.1.2 Gewinnung und Aufbereitung der Blutproben Für hämatologische, serologische und virologische Untersuchungen wurden den Schweinen zweimal wöchentlich Blutproben aus der Jugularvene entnommen. Vor Beginn der Versuche fand eine einmalige Blutentnahme statt. Es wurden kommerziell erhältliche Blutentnahmeröhrchen der Fa. KABE® Labortechnik GmbH verwendet. Die Weiterverarbeitung des für virologische und hämatologische Untersuchungen entnommene EDTA-Blutes erfolgte noch am selben Tag. Das zur Serumgewinnung entnommene Blut wurde für 15 Min. bei ca. 1200 x g/min zentrifugiert, in Plastikröhrchen portioniert und bei –80 °C aufbewahrt. 38 Eigene Untersuchungen 3.1.3 KSP-Viren Die KSPV-Isolate stammten aus der Virusbank des Europäischen Referenzlabors für KSP in Hannover und sind in der Datenbank des Referenzlabors registriert (GREISER-WILKE et al., 2000a). Die Datenbank ist im World Wide Web (WWW) unter der Adresse http://viro08.tiho-hannover.de/eg/csf präsentiert. Benutzer erhalten nach Registrierung und Vergabe eines Passwortes Zugang zu der Datenbank. Das CSF-Isolat 0277 wurde 1997 bei einem KSP-Ausbruch in Nordrhein-Westfalen aus einem Hausschwein isoliert. Aufgrund der phylogenetischen Analyse konnte es dem Genotyp 2.1 Paderborn zugeordnet werden (GREISER-WILKE et al., 2000b). Das CSF-Isolat 0634 stammt aus Niedersachsen, wo es 1999 aus einem Hausschwein isoliert wurde. Es wurde in die Genotypgruppe 2.3 Uelzen eingeordnet (WONNEMANN et al., 2001). Dieser Typ zirkuliert auch in der Wildschweinepopulation in Niedersachsen (FRITZEMEIER et al., 2000). Das CSF-Isolat 0695 wurde 1996 aus einem Hausschwein in Russland isoliert. Es wurde dem Genotyp 1.1 zugeordnet, der die in Russland zirkulierenden Virusisolate repräsentiert (VLASOVA et al., 2000). Das CSF-Isolat 0650 aus Guatemala gehört aufgrund der phylogenetischen Analyse dem Genotyp 1.3 an. Es wurde 1999 im National Veterinary Services Laboratory (NVSL), Ames, Iowa, USA aus Organmaterial eines Hausschweines isoliert (FLOEGEL-NIESMANN, persönliche Mitteilung). Die beiden Isolate CSF 0650 und CSF 0695 waren bisher nicht im Tierversuch charakterisiert worden. Der KSPV-Referenzstamm Alfort/187 (DAHLE u. LIESS, 1995) wurde als Positivkontrolle bei der Virusisolierung eingesetzt. Eigene Untersuchungen 39 3.1.4 Antikörper Der Nachweis des KSP-Virus erfolgte mit dem anti-BVD monoklonalen Antikörper (mAk) BVD/C16, der gegen das bei allen Pestiviren stark konservierte Nichtstrukturprotein NS2-3 gerichtet ist (GREISER-WILKE et al., 1992). Er wurde im Institut für Virologie der Tierärztlichen Hochschule Hannover hergestellt (PETERS et al., 1986) und wird in der Schweinepestdiagnostik routinemäßig eingesetzt (FLOEGEL-NIESMANN, persönliche Mitteilung). Der Antikörper lag als Peroxidase (PO)-Konjugat vor. 3.1.5 Zelllinie Porcine Kidney (15) Amsterdam (PK(15)A) Bei der Zelllinie PK(15)A (porcine kidney (15) Amsterdam) handelt es sich um eine permanente epitheloide Zelllinie, die im Europäischen Referenzlabor für KSP in Hannover als Referenzzelllinie für die KSP-Diagnostik und KSPV-Vermehrung eingesetzt wird. Sie wurde 1974 durch Einzelzellklonierung erhalten. Die Klone sind frei von BVDV und Mykoplasmen. Die Kultivierung erfolgte mit EMEM (Earle’s Minimum Essential Medium) unter Zusatz von 5 % fetalem Kälberserum (FKS), welches auf Abwesenheit von BVDV und Antikörpern (Ak) gegen BVDV untersucht wurde (genaue Zusammensetzung unter 8.2.1) 3.1.6 Sonstige Materialien Rezepturen für Zellkulturmedien, Lösungen und Puffer sind im Anhang unter 8.2 zu finden. Zusätzlich verwendete Chemikalien sind in 8.3 zusammengefasst. Die benutzten Geräte und Gebrauchsgegenstände sind in 8.4 aufgeführt. Die verwendeten Verbrauchsmittel sind unter 8.5 zusammengestellt. Eigene Untersuchungen 40 3.2 Methoden 3.2.1 Bestimmung des Clinical Score (nach Mittelholzer et al., 2000) Zur Charakterisierung der Virulenz von KSPV-Isolaten und zum Vergleich des Krankheitsverlaufes bei Tieren verschiedener Rassen wurde ein standardisiertes Untersuchungsschema verwendet, das den Krankheitsverlauf über einen klinischen Schlüssel (Tab. 2) festhält. Dabei wurden neun KSP-relevante klinische Parameter untersucht und je nach Ausprägungsgrad mit einer Punktzahl von 0 bis 3 bewertet. Nach deren Addition ergab sich für jeden Tag die klinische Punktzahl (Clinical Score) eine Tieres. Für jedes Tier wurde die maximal erreichte Punkzahl (CS), die ein Tier im Verlauf der Infektion erreichte, gewertet. Eine maximale Punktzahl von 27 war zu erreichen. Der durchschnittliche Clinical Score (Ø) wurde für jedes KSPV-Isolat berechnet (Summe CS der Einzeltiere/Anzahl der Tiere). Das Untersuchungsschema von MITTELHOLZER et al. (2000) enthält zehn Parameter. Der Parameter „Futter im Trog“ konnte in der vorliegenden Arbeit aufgrund der Tierhaltung nicht bewertet werden. Aus diesem Grund wurde die von MITTELHOLZER et al. (2000) gewählte Grenze für hoch virulente Isolate von >15 auf >14 gesenkt. Die Einteilung der KSP-Viren in die verschiedenen Kategorien der Virulenz erfolgte wie in Tab. 1 beschrieben. Tab. 1: Einteilung der Virulenz Virulenz Clinical Score Fieber in °C Hoch virulent >14 >41 °C Moderat virulent >5 ≤14 >40 °C <40 °C Schwach virulent 0-5 <40 °C Avirulent 0 – Eigene Untersuchungen 41 Tab. 2: Klinischer Schlüssel zur Bestimmung des Clinical Score (CS) nach MITTELHOLZER et al. (2000) Nr. Parameter 1. Lebhaftigkeit 2. 3. 4. 5. Haltung Nährzustand Atmung Gang Ausprägungsgrad CS - aufmerksam, neugierig, steht sofort auf 0 - etwas müde, steht zögernd, aber selbständig auf 1 - müde, steht nur unter Zwang auf, liegt wieder ab 2 - schläfrig, nicht zum Aufstehen zu bewegen 3 - entspannte Haltung, gerader Rücken 0 - beim Aufstehen steif, aufgekrümmter Rücken 1 - aufgekrümmter Rücken, steifer Gang über längere Zeit 2 - stark aufgekrümmter Rücken oder steht nicht auf 3 - voller Bauch, rund 0 - leerer Bauch 1 - leerer Bauch, schwache Bemuskelung 2 - eingefallene Flanken, Wirbeln und Rippen sichtbar 3 - Atemfrequenz 10-15/min 0 - Atemfrequenz > 20/min 1 - Atemfrequenz > 20/min, deutliche Atembewegung 2 - Atemfrequenz > 30/min, Maulatmung 3 - koordinierte Bewegungen ohne Unsicherheiten 0 - unsicherer Gang, korrigiert überkreuzte Beine zögernd 1 - deutliche Ataxie/ Hinterhandschwäche, gehfähig 2 - schwere Lähmungserscheinungen, nicht gehfähig 3 Eigene Untersuchungen 42 6. Haut - gleichmäßig hellrosa, Borsten anliegend 0 - gerötete Hautbereiche 1 - blaurot verfärbte, kalte Hautbereiche, einzelne punktförmige Blutungen 2 - schwarzblaue Verfärbung, keine Sensibilität, 7. Augen/Konjunktiven 8. 9. 10. Appetit Kotabsatz großflächige Hautblutungen 3 - blassrosa 0 - gerötet, klares Sekret 1 - stark gerötet, trübes Sekret 2 - stark gerötet, eitriges Sekret, Gefäßinjektion 3 - gierig auf angebotenes Futter 0 - frißt angebotenes Futter zögernd 1 - frißt angebotenes Futter nicht, schnuppert aber daran 2 - frißt nichts, kein Interesse an Futter 3 - geformter Kot, Menge normal 0 - leichter Durchfall 1 - dünnbreiiger Durchfall 2 - wässriger (blutiger) Durchfall 3 Futter im Trog - Trog leer, sauber ausgefressen 0 (nicht bewertet) - Trog fast leer, wenig Futterreste übrig 1 - Futter nur teilweise gefressen, viel Futter übrig 2 - Trog noch voll, nichts gefressen 3 Eigene Untersuchungen 43 3.2.2 Bestimmung des Pathological Score Analog zur Bestimmung des Clinical Score wurde auch für die postmortale Untersuchung ein standardisiertes Untersuchungsschema verwendet, das die pathologischen Veränderungen über einen pathologischen Schlüssel (Tab. 3) festhält. Dabei wurden zehn KSP-relevante, pathologische Parameter untersucht und je nach Ausprägungsgrad mit einer Punktzahl von 0 bis 3 bewertet. Nach deren Addition ergab sich die pathologische Punktzahl (Pathological Score). Eine maximale Punktzahl von 30 durchschnittliche war zu Pathological erreichen. Score Für (PS) jedes KSPV-Isolat berechnet (Summe wurde PS der der Einzeltiere/Anzahl der Tiere). Bei allen Schweinen wurde eine pathologische Untersuchung durchgeführt. Moribunde Tiere wurden aus Gründen des Tierschutzes beim Vorliegen eines CS von mindestens 15 euthanasiert. Schweine, die sich von der Infektion erholten, wurden nach vollständiger Genesung euthanasiert. Tab. 3: Pathologischer Schlüssel zur Bestimmung des Pathological Score (PS) Nr. Parameter 1. Haut 2. PS - gerötete Hautbereiche 1 - einzelne punktförmige Blutungen 2 - großflächige Hautblutungen 3 - einzelne Petechien 1 - Petechien an mehreren Lokalisationen 2 - multiple Petechien 3 - Schwellung 1 - Schwellung und unregelmäßige Hämorrhagien 2 - Schwellung und generalisierte Hämorrhagien 3 Subkutis und Serosen 3. Ausprägungsgrad Lnn. inguinales Eigene Untersuchungen 44 4. Lnn. mandibulares 5. 7. 8. 9. - Schwellung und unregelmäßige Hämorrhagien 2 - Schwellung und generalisierte Hämorrhagien 3 - Schwellung 1 - Schwellung und unregelmäßige Hämorrhagien 2 - Schwellung und generalisierte Hämorrhagien 3 - Schwellung 1 - Erythem 2 - Nekrose 3 - kleiner Milzinfarkt 1 - deutlicher Milzinfarkt 2 - multiple hämorrhagische Milzinfarkte 3 - einzelne Petechien 1 - Petechien an mehreren Lokalisationen 2 - multiple Petechien 3 - Erythem 1 - Erythem und kleine Nekrose 2 - multiple Nekrosen oder „button ulcer“ 3 - Bronchitis 1 - Bronchopneumonie oder Pleuritis 2 - Bronchopneumonie und Pleuritis 3 Tonsillen Milz Nieren Ileum und Rektum 10. 1 Ln. ileocaecalis 6. - Schwellung Respirationstrakt Eigene Untersuchungen 45 3.2.3 Zellkulturtechnik Die Kultivierung und Vermehrung der PK(15)A-Zelllinie erfolgte in 75 cm2 Plastikzellkulturflaschen unter Verwendung von EMEM-Kulturmedium mit 5 % FKS. Die Inkubation der Zellen erfolgte bei 37 °C im Brutschrank. Nach drei bis vier Tagen war der Zellrasen konfluent. Wurde nur eine Zellpassage pro Woche benötigt, erfolgte nach vier Tagen ein Mediumwechsel. Täglich erfolgte eine makroskopische und mikroskopische Kontrolle der Zellkultur, wobei die Mediumfarbe (pH-Wert), eventuelle Trübungen des Mediums (Kontaminationen) und der Zellrasen selbst beurteilt wurden. Zur Zellpassagierung wurde das Medium abpipettiert und der Zellrasen mit 5 ml ATV (adjusted trypsin-versen)-Lösung ca. 30 Sekunden gewaschen. Nach Entfernung der Waschlösung wurde 2 ml frisches ATV hinzugegeben. Die Inkubation erfolgte bei 37 °C ca. 15 min, bis sich der Zellrasen abgelöst hatte. Nach Zugabe von 8 ml Kulturmedium wurden die Zellen durch mehrmaliges auf- und abpipettieren vereinzelt und so eine homogene Zellsuspension hergestellt. Die Zellzahl wurde mit der Thoma-Zählkammer bestimmt und die entsprechende Menge Zellsuspension (Zellzahl: 1,6 x 106 Zellen) in eine neue Zellkulturflasche pipettiert. Dann wurde 20 ml frisches Kulturmedium hinzugefügt. Bei Zellkulturröhrchen, Makro- und Mikrotiterplatten wurde die ermittelte Menge Zellsuspension zunächst auf das benötigte Gesamtvolumen mit Kulturmedium aufgefüllt, bevor die Kulturgefäße befüllt wurden. 46 Eigene Untersuchungen 3.2.4 Virusvermehrung und Virusernte Die vier verwendeten Virusisolate wurden vermehrt, um einen Vorrat für die Tierversuche und die Virusneutralisationstests anzulegen. Zu einer am Vortag angesetzten Zellkulturflasche (75 cm2) mit PK(15)A-Zellen (Zelleinsaat: 1,6 x 106 Zellen) wurde, nach Entfernen des Mediums, 1 ml der jeweiligen Virussuspension hinzugefügt. Die Kulturflaschen wurden bei 37 °C für 1 bis 2 Stunden inkubiert. Dabei wurden sie alle 15 min geschwenkt, um eine gleichmäßige Virusadsorption zu gewährleisten. Danach wurde frisches Medium (EMEM mit 10% FKS) aufgefüllt. Nach 72 h Inkubation bei 37 °C wurden die Zellkulturflaschen bei –80 °C tiefgefroren. Zur Virusernte wurde das Zell-Virus-Gemisch zügig aufgetaut und bei 4 °C für 15 min bei 800 x g zentrifugiert. Der Zellkulturüberstand wurde portioniert und bei –80 °C gelagert. 3.2.5 Virusisolierung aus der Leukozytenfraktion Die Virusisolierung ist der „Goldstandard“ zum labordiagnostischen Nachweis des KSPV (ANON., 2000). Zur Virusisolierung eignen sich Leukozyten, die aus Blutproben mit Zusatz von Gerinnungshemmern, z.B. EDTA oder Heparin gewonnen werden. Durch den Zusatz von EDTA-Dextran Lösung zu der Blutprobe wurden die roten und weißen Blutzellen voneinander getrennt. Die Erythrozyten sedimentierten und die Leukozyten verbanden sich mit dem Dextran und verblieben im Überstand. Durch die Inokulation der Leukozyten auf PK(15)A-Zellen erfolgte eine Vermehrung des möglicherweise vorhandenen Virus über zwei Passagen. Eigene Untersuchungen 47 3.2.5.1 Gewinnung und Reinigung der Leukozyten Zu ca. 10 ml EDTA-Blut wurden 0,5 ml EDTA-Dextran-Lösung hinzugefügt. Nach vorsichtigem Schwenken wurde dieses Gemisch 1-3 h bei Raumtemperatur inkubiert, bis sich eine deutliche obere weiße Phase abgesetzt hatte. Der weiße leukozytenhaltige Überstand wurde abpipettiert und 10 min bei 450 x g zentrifugiert. Nach der Zentrifugation waren die Leukozyten als weißes Pellet zu sehen. Der Überstand wurde dekantiert und das Leukozytenpellet in 3-5 ml PBSM (engl. phosphate buffered saline minus, phosphatgepufferte Kochsalzlösung ohne Kalzium u. Magnesium) resuspendiert und erneut zentrifugiert. Dieser Waschvorgang wurde noch zweimal wiederholt. Danach wurde das Leukozytenpellet in 2 ml PBSM aufgenommen und bei –80 °C tiefgefroren. 3.2.5.2 Virusisolierung über zwei Zellkulturpassagen Zellkulturröhrchen mit PK(15)A-Zellen (Zelleinsaat: 8,5 x 104 Zellen) wurden 24 h bei 37 °C inkubiert. Das Kulturmedium wurde abgenommen und 200 µl der wieder aufgetauten Leukozytensuspension hinzugefügt. Je Probe wurden zwei Zellkulturröhrchen beimpft. Es folgte eine Inkubation für 1-2 h bei 37 °C. Anschließend wurde jedes Kulturröhrchen zweimal mit 1,5 ml PBSM gewaschen und mit 1 ml Kulturmedium (EMEM mit Antibiotikazusatz (Penicillin/Streptomycin) und 10% FKS) aufgefüllt. Für 72 h wurden die Röhrchen bei 37 °C inkubiert und danach bei –80 °C für mindestens 1 h tiefgefroren. Anschließend wurden die wieder aufgetauten Kulturröhrchen bei 800 x g für 10 min zentrifugiert. Von diesem Überstand wurden 200 µl in eine Vertiefung einer, am Vortag angesetzten, Makrotiterplatte mit PK(15)A-Zellen (Zelleinsaat: 1,6 x 106 Zellen) gegeben. Es folgte eine Inkubation für 1-2 h bei 37 °C im Brutschrank mit Zusatz von 4% CO2. Danach wurden die Vertiefungen mit 1 ml Kulturmedium (EMEM mit Antibiotikazusatz und 5% FKS) befüllt. Nach einer Inkubation von drei Tagen bei 37 °C im 4% CO2-Brutschrank erfolgte der KSPV-Nachweis auf der Makrotiterplatte mit der Direkten Immunfärbung (DIF). Eigene Untersuchungen 48 3.2.6 Virustitration Zur Quantifizierung des Virusgehaltes diente die Virustitration. Hier wurde mittels einer Endpunktverdünnungsmethode der Titer einer Virussuspension oder der Virustiter im Serum bestimmt. Von der zu titrierenden Virussuspension wurde eine Verdünnungsreihe in log10-Stufen von 10-1 bis 10-8 in EDulb-Medium mit Antibiotikazusatz und 5% FKS hergestellt. Von jeder Verdünnungsstufe wurden je 100 µl in 4 Kavitäten einer Mikrotiterplatte gefüllt. Zusätzlich wurden als Zellkontrolle je 100 µl Medium in 4 Kavitäten pipettiert. Anschließend wurde jede Kavität mit 50 µl einer auf 354.000 Zellen pro ml eingestellten Zellsuspension von PK(15)A-Zellen beschickt. Die Mikrotiterplatten wurden für 72 h bei 37 °C im 4% CO2-Brutschrank inkubiert. Das Virusantigen wurde durch die Direkte Immunfärbung nachgewiesen. Die Berechnung des Titers (50% kulturinfektiöse Dosis, KID50 ) erfolgte nach der Formel von KÄRBER (1931): log KID50 = L1,0 – Lint (S-0,5) Dabei sind L1,0 = Logarithmus der höchsten Verdünnung mit der Reaktionsrate (R) 1,0 L int = Logarithmus des Intervalles (int) S = Summe der Reaktionsraten, begonnen bei der letzten Reaktionsrate, die 1,0 beträgt. Eigene Untersuchungen 49 3.2.7 Virusneutralisationstest Der Virusneutralisationstest (VNT) diente dem serologischen Nachweis von spezifischen Antikörpern. Die auf Antikörper gegen das KSPV zu untersuchende Serumprobe wurde mit einer definierten Virusmenge inkubiert. Danach wurden für das KSPV empfängliche Zellen hinzugefügt und der Ansatz kultiviert. Befanden sich homologe Antikörper in der Serumprobe, kam es zu einer Neutralisation der Infektiosität der Viruspartikel, und die empfänglichen Zellen konnten nicht mehr infiziert werden. Durch Anlegen einer Verdünnungsreihe der Serumprobe ließ sich der Antikörpertiter berechnen. Dazu wurde in einer Mikrotiterplatte eine Serumverdünnungsreihe in 2er Stufen von 1:5 bis 1:640 hergestellt. Pro Verdünnungsstufe wurden zwei Kavitäten beschickt. In jede Kavität der Testplatte wurde das gleiche Volumen einer Virussuspension des homologen Virus mit einem Virusgehalt von 100 KID50/50µl hinzugefügt. Die Mikrotiterplatte wurde für 1 h bei 37 °C in einer feuchten Kammer im 4% CO2-Brutschrank inkubiert. Danach wurden in jede Kavität 50 µl einer Zellsuspension von PK(15)A-Zellen (354.000 Zellen/ml) pipettiert und die Mikrotiterplatte für 72 h bei 37 °C in einer feuchten Kammer inkubiert. Der Virusantigennachweis erfolgte durch die Direkte Immunfärbung. Zur Überprüfung des Virustiters der eingesetzten Virussuspension wurde eine Rücktitration durchgeführt. Dabei wurde eine Verdünnungsreihe der Testvirussuspension bis 10-4 titriert (Durchführung wie in Kap. 3.2.5). Eigene Untersuchungen 50 Die Berechnung des Neutralisationstiters (50% Neutralisationsdosis, ND50) erfolgte nach der Formel von KÄRBER (1931): (ND50) = L1,0 – Lint (S-0,5) Dabei ist L1,0 = Logarithmus der höchsten Verdünnung mit der Reaktionsrate (R) 1,0 L int = Logarithmus des Intervalles (int) S = Summe der Reaktionsraten, begonnen bei der letzten Reaktionsrate, die 1,0 beträgt Eigene Untersuchungen 51 3.2.8 Direkte Immunfärbung Der KSP-Virusantigennachweis erfolgte mit dem monoklonalen Antikörper BVD/C16, der pestivirusspezifisch ist und als PO-Konjugat vorlag. Der sich in der Mikro- oder Makrotiterplatte befindende Zellrasen wurde nach Entfernung des Kulturmediums einmal mit 1/3 PBS (engl. phosphate buffered saline, phosphatgepufferte Kochsalzlösung) gewaschen und nach gründlichem Absaugen der Waschlösung mit der Vakuumpumpe für 3 h bei 80 °C hitzefixiert. Nach der Hitzefixation wurde der Zellrasen einmal zum Anfeuchten mit PBS/Tween (Zusatz von 0,01% Tween20) gewaschen. Danach wurde das Konjugat des peroxidasegekoppelten mAk BVD/C16 in der benötigten Gebrauchsverdünnung in die Kavitäten pipettiert. Pro Mikrotiterplattenvertiefung wurden 50 µl und pro Makroplattenvertiefung 200 µl Konjugat benötigt. Nach einer Stunde Inkubation bei 37 °C wurde der Zellrasen dreimal mit PBS/Tween und einmal mit A. bidest. gewaschen. Nach Entfernen der Waschlösung wurden die Kavitäten mit dem chromogenen Substrat 3-Amino-9-Ethylcarbazol (AEC) beschickt (Mikrotiterplatte: 50 µl, Makrotiterplatte: 200 µl). Dieses wurde aus einer AEC-DimethylformamidStammlösung, Natriumazetatpuffer und 3%iger H202 frisch angesetzt. Das Wasserstoffperoxid diente als Substrat der Peroxidase. Die Umsetzung führte zu einem roten Niederschlag im Bereich des Zytoplasmas der fixierten und infizierten Zellen. Nach ca. 10-20 min war das Zytoplasma deutlich gefärbt. Die SubstratLösung wurde abpipettiert und durch zweimaliges Waschen mit A. bidest. vollständig vom Zellrasen entfernt. Die Auswertung der Platten erfolgte lichtmikroskopisch. Eine Kavität galt als positiv, sobald das Zytoplasma einer Zelle gefärbt war. Der Zellkern musste ungefärbt sein. 52 Eigene Untersuchungen 3.2.9 Zählung der Leukozyten Die Bestimmung der Gesamtleukozytenzahl erfolgte mit der Zählkammermethode. In eine trockene Leukozytenpipette wurde vorher gemischtes EDTA-Vollblut bis zur Marke 0,5 aufgezogen. Die Pipettenspitze wurde außen vorsichtig von anhaftendem Blut gereinigt und das Blut etwas hochgezogen, so dass die Spitze blutfrei war. Bis zur Marke 11 wurde zur Lyse der Erythrozyten nun Essigsäure (2%) aufgezogen und die Pipette mit Daumen und Mittelfinger verschlossen und etwa eine Minute gemischt. Die Auszählung der Leukozyten erfolgte in einer Neubauer-Zählkammer. 3.2.10 Statistik Nach der Prüfung der Leukozytenwerte auf Normalverteilung mit dem Shapiro-WilkTest wurden die Messdaten der Hybridschweine und der Schweine der Deutschen Landrasse anhand einer einfaktoriellen Varianzanalyse ausgewertet. Dabei wurden an jedem Messtag die Daten der beiden Gruppen verglichen. 4. Ergebnisse 4.1 Bestimmung der Virulenz von vier KSPV-Feldisolaten 4.1.1 Bestimmung des Clinical Score Neun KSP-relevante klinische Parameter wurden untersucht und je nach Ausprägungsgrad des Symptoms mit einer Punktzahl von 0 bis 3 bewertet. Nach deren Addition ergab sich für jeden Tag die klinische Punktzahl (Clinical Score) eines Tieres. Der unten angegebene Clinical Score (CS) entspricht der maximalen Punktzahl, die ein Tier im Verlauf der Infektion erreichte. Für jedes KSPV-Isolat wurde der durchschnittliche Clinical Score berechnet (Summe des maximalen Clinical Score der Einzeltiere/Anzahl der Tiere). 4.1.1.1 CSF 0650 Die fünf Schweine der ersten Gruppe (Tiere Nr. 80-83 und 102) wurden mit dem Isolat CSF 0650, Genotyp 1.3, infiziert. Die Inkubationszeit (Zeit zwischen Infektion und Anstieg der Körpertemperatur auf ≥ 40 °C) lag zwischen vier und fünf Tagen. Bei drei Schweinen stieg die Körpertemperatur auf über 41 °C an, bei zwei Tieren lag das Temperaturmaximum zwischen 40 °C und 41 °C (Abb. 3 und Tab. 29 im Anhang). Die Tiere wurden apathisch und fraßen kaum bis gar nicht mehr. Bei allen Tieren waren in der zweiten Infektionswoche dünnflüssig-wässriger Durchfall, eine starke Schwellung der Inguinallymphknoten und eine deutliche Konjunktivitis feststellbar. Ein Schwein (Tier 81) erkrankte an der akut-letalen Verlaufsform der KSP und musste 12 dpi euthanasiert werden. In der Endphase der Erkrankung zeigte das Schwein zentralnervöse Störungen. Nach anfänglicher leichter Ataxie kam es zu Ergebnisse 54 einer schlaffen Lähmung der Hintergliedmaßen. Die übrigen vier Schweine erholten sich von der Infektion. Nach 10 bis 14 Tagen konnte kein Fieber mehr festgestellt werden, und das Allgemeinbefinden der Tiere verbesserte sich rasch. Der Clinical Score (CS) lag bei den vier genesenen Tieren zwischen 7 und 10. Das verendete Schwein erreichte einen CS von 16 (Abb. 2 und Tab. 4). Die Mortalität betrug 20% (Abb. 10). Der durchschnittlliche Clinical Score für das Isolat CSF 0650 für die Tage 10,14 und 18 p.i. und der durchschnittliche maximal erreichte CS (CSmax) unter Einbeziehung der Mortalität sind in Tab. 5 dargestellt. 4.1.1.2 CSF 0695 Die Inkubationszeit lag bei den Tieren (Tiere Nr. 84-88), die mit CSF 0695, Genotyp 1.1, infiziert wurden, zwischen 3 und 4 Tagen. Bei vier Tieren kam es zu einem Anstieg der Körpertemperatur auf über 41 °C, bei Schwein 86 lag die maximale Körpertemperatur zwischen 40 °C und 41 °C (Abb. 5 und Tab. 30 im Anhang). Die Schweine waren somnolent und fraßen kaum bis gar nicht mehr. Neben vergrößerten Inguinallymphknoten und Konjunktivitis konnte dünnflüssigwässriger Durchfall beobachtet werden. Zwei Tiere (Tier 85 und Tier 87) erkrankten an der akut-letalen Form der KSP und mussten 11 bzw. 13 dpi euthanasiert werden. Sie entwickelten ausgeprägte neurologische Störungen. Daneben konnten punktförmige bis flächenhafte Hautblutungen festgestellt werden, die sich besonders an den Ohren und am Unterbauch zeigten. Tier 85 zeigte in der Endphase der Erkrankung blutig-wässrigen Durchfall. Die anderen drei Tiere erholten sich von der Infektion. Nach 14 Tagen konnte kein Fieber mehr festgestellt werden, und es trat eine rasche Besserung des Allgemeinbefindens ein. Die zwei verendeten Tiere erreichten einen CS von 17. Bei den drei genesenen Schweinen lag der CS zwischen 10 und 13 (Abb. 4 und Tabelle 4). Die Mortalität betrug 40% (Abb. 10). Der durchschnittlliche Clinical Score für das Isolat CSF 0695 für die Tage 10,14 und 18 p.i. und der durchschnittliche maximal erreichte CS (CSmax) unter Einbeziehung der Mortalität sind in Tab. 5 dargestellt. Ergebnisse 55 4.1.1.3 CSF 0634 Die Tiere (Tiere Nr. 89-93), die mit CSF 0634 infiziert wurden, entwickelten alle die akut-letale Verlaufsform der KSP. Die Inkubationszeit betrug 6-8 Tage. Bei allen Tieren stieg die Körpertemperatur auf über 41 °C (Abb. 7 und Tab. 31 im Anhang). Nach 13-20 Tagen starben die Tiere oder sie mussten euthanasiert werden. Neben Somnolenz, Anorexie, Konjunktivitis und Durchfall zeigten sich in der Endphase der Erkrankung hochgradige neurologische Störungen und Hautblutungen. Der Clinical Score lag zwischen 15 und 22 (Abb. 6 und Tab. 4). Die Mortalität betrug 100% (Abb. 10). Der durchschnittlliche Clinical Score für das Isolat CSF 0634 für die Tage 10,14 und 18 p.i. und der durchschnittliche maximal erreichte CS (CSmax) unter Einbeziehung der Mortalität sind in Tab. 5 dargestellt. 4.1.1.4 CSF 0277 Die Inkubationszeit betrug bei diesem Isolat 6 Tage (Tiere Nr. 94-98). Bei zwei Tieren stieg die Körpertemperatur auf über 41 °C, die übrigen drei Schweine erreichten Werte zwischen 40 °C und 41 °C. (Abb. 9 und Tab. 32 im Anhang). Zwischen dem 11. bis 18. Tag nach der Infektion verendeten drei Tiere (Tier 94, 95 und Tier 98), oder sie mussten euthanasiert werden. Neben Somnolenz, Anorexie, Durchfall und Konjunktivitis fielen neurologische Störungen auf. Zwei Tiere erholten sich von der Infektion. Nach ca. 14 dpi konnte kein Fieber mehr festgestellt werden. Die verendeten Schweine erreichten einen Clinical Score von 6, 14 bzw. 16. Der Clinical Score der zwei genesenen Schweine lag zwischen 6 und 9 (Abb. 8 und Tab. 4). Die Mortalität betrug 60% (Abb. 10). Der durchschnittlliche Clinical Score für das Isolat CSF 0277 für die Tage 10,14 und 18 p.i. und der durchschnittliche maximal erreichte CS (CSmax) unter Einbeziehung der Mortalität sind in Tab. 5 dargestellt. Ergebnisse 56 CSF 0650 (1.3) 18 16 Clinical Score 14 12 10 8 6 4 2 0 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 80 Tier 81 Tier 82 Tier 83 Tier 102 Abb. 2: Clinical Score bei Infektion mit CSF 0650 (Genotyp 1.3) (Tier 81: moribund euthanasiert) CSF 0650 (1.3) 43 T (°C) 42 41 40 39 38 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 80 Tier 81 Tier 82 Tier 83 Abb. 3: Temperaturverlauf bei Infektion mit CSF 650 (Genotyp 1.3) Tier 102 Ergebnisse 57 CSF 0695 (1.1) 18 16 C lin ica l Sc ore 14 12 10 8 6 4 2 0 0 2 4 6 Tier 84 8 10 d pi Tier 85 12 Tier 86 14 16 18 Tier 87 20 Tier 88 Abb. 4: Clinical Score bei Infektion mit CSF 0695 (Genotyp 1.1) (Tiere 85 u. 87: moribund euthanasiert) CSF 0695 (1.1) 43 T (°C) 42 41 40 39 38 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 84 Tier 85 Tier 86 Tier 87 Abb. 5: Temperaturverlauf bei Infektion mit CSF 0695 (Genotyp 1.1) Tier 88 Ergebnisse 58 CSF 0634 (2.3) 24 Clinical Score 22 20 18 16 14 12 10 8 6 4 2 0 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 89 Tier 90 Tier 91 Tier 92 Tier 93 Abb. 6: Clinical Score bei Infektion mit CSF 0634 (Genotyp 2.3) (Tiere 89-93: moribund euthanasiert) CSF 0634 (2.3) 43 T (°C) 42 41 40 39 38 0 2 Tier 89 4 6 Tier 90 8 10 d pi Tier 91 12 14 16 18 Tier 92 Abb. 7: Temperaturverlauf bei Infektion mit CSF 0634 (Genotyp 2.3) 20 Tier 93 Ergebnisse 59 CSF 0277 (2.1) 18 Clinical Score 16 14 12 10 8 6 4 2 0 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 94 Tier 95 Tier 96 Tier 97 Tier 98 Abb. 8: Clinical Score bei Infektion mit CSF 0277 (Genotyp 2.1) (Tiere 94, 95 u. 98: moribund euthanasiert) CSF 0277 (2.1) 43 42 T (°C) 41 40 39 38 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 94 Tier 95 Tier 96 Tier 97 Abb. 9: Temperaturverlauf bei Infektion mit CSF 0277 (Genotyp 2.1) Tier 98 Ergebnisse 60 Tab. 4: Vergleich des Clinical Score (CS) und der Inkubationszeit bei Infektion mit den vier KSPV-Isolaten. Der durchschnittliche CS (Ø) wurde für jedes CSFIsolat berechnet. CSF-Isolat CSF 0650 CSF 0695 CSF 0634 CSF 0277 Tiere Nr. CS 80 10 81 16 82 9 83 8 102 7 84 13 85 17 86 10 87 17 88 10 89 18 90 15 91 22 92 16 93 17 94 6 95 14 96 9 97 6 98 16 CS (Ø) Inkubationszeit (dpi) 10 4-5 13,4 3-4 17,6 6-8 10,2 6 Aufgrund der geringen Tierzahl pro Gruppe war eine statistische Auswertung des Clinical Score nicht möglich. Ergebnisse 61 100 Mortalität (%) 80 60 40 20 0 10 dpi 14 dpi CSF 0650 18 dpi CSF 0695 22 dpi CSF 0634 CSF 0277 Abb. 10: Mortalitätsrate (%) bei Infektion mit den vier KSPV-Isolaten Tab. 5: Vergleich des Clinical Score (CS) der vier KSPV-Isolate an Tag 10, 14 und 18 p.i. mit dem maximal erreichten Clinical Score (CSmax). Bei der Berechnung des CS und des CS(max) wurde die Mortalität berücksichtigt*. KSPV-Isolat CS 10 dpi CS 14 dpi** CS 18 dpi** CSF 0650 9,6 7,6 7,6 11 CSF 0695 12,2 11,8 13,2 14,4 CSF 0634 3 14,8 18,8 20,6 CSF 0277 6 8,6 10 12,2 * Bewertung der Mortalität: 0%: > 0% - 40%: > 40% < 80%: 80% - 100%: CS(max) 0 Punkte 1 Punkt 2 Punkte 3 Punkte ** Bei Tieren, die vor 14 dpi bzw. 18 dpi starben, wurde der CS des Todestages mit in die Berechnung einbezogen. Ergebnisse 62 4.1.2 Bestimmung des Pathological Score (PS) Bei der postmortalen Untersuchung wurden zehn KSP-relevante Parameter untersucht und je nach Ausprägungsgrad mit einer Punktzahl von 0 bis 3 bewertet. Nach deren Addition ergab sich die pathologische Punktzahl (Pathological Score) eines Tieres. Für jedes KSPV-Isolat wurde der durchschnittliche Pathological Score (PS gesamt) berechnet (Summe des PS der Einzeltiere/Anzahl der Tiere). Ferner wurde für jeden Parameter die durchschnittliche Punktzahl berechnet (Summe der Punktzahl der Einzeltiere/Anzahl der Tiere). 4.1.2.1 CSF 0650 Tier 81 erkrankte an der akut-letalen Verlaufsform der KSP und musste 12 dpi euthanasiert werden. Bei der Sektion fielen vor allem stark vergrößerte, hämorrhagische Lymphknoten (Lnn. inguinales, Lnn. mandibulares, Ln. Ileocaecalis) auf. An den Nieren waren einzelne Petechien sichtbar, und an der Milz befand sich ein Randinfarkt. Tier 81 erreichte einen Pathological Score (PS) von 12. Die übrigen vier Schweine erholten sich von der Infektion. Bei der Sektion konnten, außer vergrößerten, teilweise hämorrhagischen Lymphknoten, keine weiteren pathologischen Veränderungen festgestellt werden. Der PS der genesenen Schweine lag zwischen 3 und 5. Der durchschnittliche PS für das Isolat CSF 0650 betrug 5,6. Der PS für die einzelnen Tiere ist in Abb. 11 dargestellt. Die durchschnittliche Punktzahl für jeden der zehn Parameter und für jedes CSF-Isolat (PS gesamt) ist in Tab. 6 aufgeführt. Ergebnisse 63 4.1.2.2 CSF 0695 Tier 85 und Tier 87 erkrankten an der akut-letalen Form der KSP und wurden 11 bzw. 13 dpi euthanasiert. An der äußeren Haut, der Subkutis und den Serosen zeigten sich punktförmige bis flächenhafte Blutungen. Beide Tiere hatten stark vergrößerte, hämorrhagische Lymphknoten (Lnn. inguinales, Lnn. mandibulares, Ln. ileocaecalis). Petechiale Blutungen konnten auch an den Nieren festgestellt werden. Bei Tier 87 befanden sich an den Tonsillen und der Ileocaecalpapille ausgeprägte Nekrosen. Tier 85 erreichte einen PS von 17. Der PS von Tier 87 betrug 24. Die übrigen drei Schweine erholten sich von der Infektion. Die pathologischen Veränderungen beschränkten sich auf die Lymphknoten. Der PS der genesenen Schweine lag zwischen zwei und drei. Der durchschnittliche PS für das Isolat CSF 0695 betrug 9,4. Der PS für die einzelnen Tiere ist in Abb. 12 dargestellt. Die durchschnittliche Punktzahl für jeden der zehn Parameter und für jedes CSF-Isolat (PS gesamt) ist in Tab. 6 aufgeführt. 4.1.2.3 CSF 0634 Die fünf Tiere entwickelten die akut-letale Verlaufsform der KSP. Bei allen Tieren waren unterschiedlich stark ausgeprägte Hämorrhagien an der äußeren Haut, der Subkutis, den Serosen und den Nieren feststellbar. Die Lymphknoten (Lnn. inguinales, Lnn. mandibulares, Ln. ileocaecalis) waren stark vergrößert und hämorrhagisch. Bei zwei Tieren befanden sich an der Milz Randinfarkte. Bei allen Tieren zeigten sich an der Ileocaecalpapille kleine Nekrosen. Bei drei Schweinen lag eine katarrhalisch-eitrige Bronchopneumonie vor. Der durchschnittliche PS für dieses Isolat betrug 15,4. Der PS für die einzelnen Tiere ist in Abb. 13 dargestellt. Die durchschnittliche Punktzahl für jeden der zehn Parameter und für jedes CSF-Isolat (PS gesamt) ist in Tab. 6 aufgeführt. Ergebnisse 64 4.1.2.4 CSF 0277 Drei Tiere entwickelten die akut-letale Form der KSP. Tier 94 zeigte petechiale Blutungen an der äußeren Haut, der Subkutis und den Serosen. Bei allen Tieren waren die Lymphknoten (Lnn. inguinales, Lnn. mandibulares, Ln. ileocaecalis) vergrößert und teilweise hämorrhagisch. Bei Tier 97 war eine deutliche Schwellung der Tonsillen feststellbar und bei Tier 94 zeigten sich Nekrosen an der Ileocaecalpapille. Bei Tier 98 lag eine katarrhalisch-eitrige Bronchopneumonie vor. Der durchschnittliche PS für das Isolat CSF 0277 betrug 5,0. Der PS für die einzelnen Tiere ist in Abb. 14 dargestellt. Die durchschnittliche Punktzahl für jeden der zehn Parameter und für jedes CSF-Isolat (PS gesamt) ist in Tab. 6 aufgeführt. Tab. 6: Pathological Score bei Infektion mit den vier KSPV-Isolaten. Für jeden Parameter wurde die durchschnittliche Punktzahl (0-3) berechnet. CSF 0650 CSF 0695 CSF 0634 CSF 0277 0,2 1,2 2,2 0,4 0 1,0 2,0 0,4 Lnn. inguinales 1,4 1,6 2,4 1,2 Lnn. mandibulares 2,0 1,4 2,4 1,0 Ln. ileocaecalis 1,4 1,4 1,8 0,8 0 1,0 0 0,2 Milz 0,2 0 0,4 0 Nieren 0,2 1,0 0,8 0 Ileum 0 0,8 2,2 0,4 Respirationstrakt 0,2 0 1,2 0,6 PS gesamt 5,6 9,4 15,4 5,0 Haut Subkutis/Serosen Tonsillen Aufgrund der geringen Tierzahl pro Gruppe war eine statistische Auswertung des Pathological Score nicht möglich. Ergebnisse 65 CSF 0650 (1.3) 30 Pathological Score 25 20 15 10 5 0 Tier 80** Tier 81* Tier 82** Tier 83** Tier 102** Abb. 11: Pathological Score bei Infektion mit CSF 0650 (Genotyp 1.3) CSF 0695 (1.1) 30 Pathological Score 25 20 15 10 5 0 Tier 84** Tier 85* Tier 86** Tier 87* Tier 88** Abb. 12: Pathological Score bei Infektion mit CSF 0695 (Genotyp 1.1) * moribund euthanasiert; **rekonvaleszent euthanasiert Ergebnisse 66 CSF 0634 (2.3) 30 Pathological Score 25 20 15 10 5 0 Tier 89* Tier 90* Tier 91* Tier 92* Tier 93* Abb. 13: Pathological Score bei Infektion mit CSF 0634 (Genotyp 2.3) CSF 0277 (2.1) 30 Pathological Score 25 20 15 10 5 0 Tier 94* Tier 95* Tier 96** Tier 97** Tier 98* Abb. 14: Pathological Score bei Infektion mit CSF 0277 (Genotyp 2.1) * moribund euthanasiert; **rekonvaleszent euthanasiert Ergebnisse 67 4.1.3 Leukozytenzahl Die Infektion mit dem KSP-Virus führte bei allen Schweinen zu einem Absinken der Leukozytenzahl unter 10 G/l. Die Tiere, die an der akut-letalen Form der KSP erkrankten, entwickelten eine persistierende Leukopenie. Bei den rekonvaleszenten Tieren normalisierten sich die Leukozytenzahlen wieder (Tab. 33 bis 36 im Anhang). Bei mit Isolat CSF 0650 infizierten Tieren sanken die Leukozyten auf durchschnittlich 8,5 G/l. Die Tiere, die mit Isolat CSF 0695 infiziert worden waren, zeigten einen Abfall der Leukozyten auf durchschnittlich 7,5 G/l und bei mit Isolat CSF 0634 infizierten Tieren sanken die Leukozyten im Mittel auf 5,8 G/l. Die Leukozyten fielen bei mit Isolat CSF 0277 infizierten Tieren auf durchschnittlich 9,4 G/l. Für jedes KSPV-Isolat sind die Leukozytenzahlen unter Angabe des Mittelwertes und der Standardabweichung (MW ± s) in Abb. 15 dargestellt. Aufgrund der großen Streuung der Messwerte zwischen moribunden und rekonvaleszenten Tieren einer Gruppe sind die Leukozytenwerte für jedes Tier in den Abb. 16 bis 19 dargestellt. 30 25 G/l 20 15 10 5 0 0 dpi CSF 0650 4 dpi CSF 0695 7 dpi dpi 11 dpi CSF 0634 14 dpi CSF 0277 Abb. 15: Leukozytenzahlen bei Infektion mit den vier KSPV-Isolaten (MW ± s) Ergebnisse 68 CSF 0650 (1.3) 30 25 G/l 20 15 10 5 0 0 4 7 11 14 18 21 dpi Tier 80 Tier 81 Tier 82 Tier 83 Tier 102 Abb. 16: Leukozytenzahlen bei Infektion mit CSF 0650 (Genotyp 1.3) CSF 0695 (1.1) 30 25 G/l 20 15 10 5 0 0 Tier 84 4 7 Tier 85 11 dpi Tier 86 14 18 21 Tier 87 Abb. 17: Leukozytenzahlen bei Infektion mit CSF 0695 (Genotyp 1.1) Tier 88 Ergebnisse 69 CSF 0634 (2.3) 30 25 G/l 20 15 10 5 0 0 4 7 11 14 18 dpi Tier 89 Tier 90 Tier 91 Tier 92 Tier 93 Abb. 18: Leukozytenzahlen bei Infektion mit CSF 0634 (Genotyp 2.3) CSF 0277 (2.1) 30 25 G/l 20 15 10 5 0 0 Tier 95 4 7 11 dpi Tier 96 14 Tier 97 18 21 Tier 98 Abb. 19: Leukozytenzahlen bei Infektion mit CSF 0277 (Genotyp 2.1); Tier 94: Blutentnahme nicht möglich Ergebnisse 70 4.1.3.1 Einbeziehung der Leukozytenzahl in das Schema zur Beurteilung der Virulenz der KSPV-Isolate. Elf von 20 Schweinen entwickelten die akut-letale Form der KSP. Bei diesen Tieren sanken die Leukozyten unter 6,5 G/l. Bei sieben von neun rekonvaleszenten Tieren lagen die niedrigsten Leukozytenwerte über 6,5 G/l. Zwei rekonvaleszente Schweine zeigten ein vorübergehendes Absinken der Leukozyten unter 6,5 G/l. Folgende Bewertung der Leukozytenzahl wird vorgeschlagen: ≥ 10 G/l: 0 Punkte 8,5 – 9,99 G/l: 1 Punkt 6,5 – 8,49 G/l: 2 Punkte < 6,5 G/l: 3 Punkte Ergebnisse 71 4.1.4 Virusisolierung aus der Leukozytenfraktion Das KSP-Virus konnte bei allen Tieren spätestens 7 Tage nach der Infektion aus der Leukozytenfraktion isoliert werden. Bei drei Tieren, die mit Isolat CSF 0650 infiziert worden waren, war die Virusanzucht bereits 4 dpi positiv. Ebenso war bei allen Schweinen, die Isolat CSF 0695 erhielten, die Virusisolierung 4 dpi möglich. Isolat CSF 0634 konnte erst 7 dpi aus den Leukozyten reisoliert werden und bei Isolat CSF 0277 war nur ein Schwein 4 dpi positiv. Die Virusisolierung aus den Leukozyten war bei den Schweinen, die verendeten oder euthanasiert wurden, während der gesamten Krankheitsdauer positiv. Bei den rekonvaleszenten Schweinen konnte das KSP-Virus nach der Genesung nicht mehr nachgewiesen werden. Die Ergebnisse der Virusisolierung aus den Leukozyten für die vier KSPVIsolate sind in den Tab. 7 bis 10 dargestellt. Tab. 7: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0650 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi Tier 80 neg pos pos pos pos neg Tier 81 neg pos pos pos * * Tier 82 neg neg pos pos neg * Tier 83 neg pos pos pos neg * Tier 102 neg neg pos neg * * neg: Virusisolierung negativ; pos: Virusisolierung positiv * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert Ergebnisse 72 Tab. 8: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0695 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi Tier 84 neg pos pos neg * Tier 85 neg pos pos pos * Tier 86 neg pos pos pos neg Tier 87 neg pos pos pos * Tier 88 neg pos pos neg * neg : Virusisolierung negativ; pos : Virusisolierung positiv Tab. 9: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0634 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi 20 dpi Tier 89 neg neg pos pos pos * * Tier 90 neg neg pos pos pos * * Tier 91 neg neg pos pos pos * * Tier 92 neg neg pos pos pos pos pos Tier 93 neg neg pos pos pos pos * neg : Virusisolierung negativ; pos : Virusisolierung positiv * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert Ergebnisse 73 Tab. 10: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0277 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi 21 dpi Tier 94 neg pos pos pos pos pos * Tier 95 neg neg pos pos * * * Tier 96 neg neg pos pos neg * * Tier 97 neg neg pos pos pos pos neg Tier 98 neg neg pos pos pos * * neg : Virusisolierung negativ; pos : Virusisolierung positiv 4.1.5 Virustiter im Serum Der Virustiter im Serum wurde bei allen Tieren für den Tag 7 p.i. bestimmt. Der Virustiter lag bei den Tieren, die mit den KSPV-Isolaten CSF 0650 und CSF 0277 infiziert worden waren, zwischen 102,7 KID50/ml und 104,5 KID50/ml. Die Schweine, die mit dem KSPV-Isolat 0695 infiziert worden waren, erreichten einen Virustiter zwischen 102 KID50/ml und 104,5 KID50/ml. Bei Infektion mit dem KSPV-Isolat CSF 0634 wurde ein Virustiter zwischen 103 KID50/ml und 104 KID50/ml erreicht (Tab. 11). * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert Ergebnisse 74 Tab. 11: Vergleich der Virustiter (log10 KID50/ml) der vier KSPV-Isolate, die am Tag 7 p.i. im Serum erreicht wurden. Für jedes Virusisolat sind die Virustiter der Einzeltiere und der durchschnittliche Virustiter (Ø) angegeben. CSF-Isolat Titer der Einzeltiere Ø Titer CSF 0650 CSF 0695 CSF 0634 CSF 0277 3,7 4,2 3,5 3,2 4,5 4,5 3,0 4,5 2,7 2,2 3,7 2,7 3,5 4,2 4,0 3,7 3,0 2,0 3,0 3,0 3,5 3,4 3,4 3,4 4.1.5 Bildung neutralisierender Antikörper Die Serumproben wurden auf das Vorhandensein neutralisierender Antikörper (nAk) gegen das jeweilige homologe Virus getestet. Bei moribunden Tieren konnten keine neutralisierenden Antikörper (Titer < 5) oder nur niedrige Titer in der Terminalphase der Erkrankung nachgewiesen werden. Die rekonvaleszenten Tiere entwickelten ab 14 Tagen p.i. Antikörper, nur bei Tier 97 waren die ersten neutralisierenden Antikörper erst an Tag 21 p.i. festzustellen. Bei Infektion mit CSF 0650 lagen die Antikörpertiter zwischen 80 ND50 (21 dpi) und 1600 ND50 (33 dpi). Die Titer bei Isolat CSF 0695 variierten zwischen 40 ND50 (21 dpi) und 160 ND50 (28 dpi). Die Antikörpertiter bei Infektion mit CSF 0277 lagen 28 dpi zwischen 240 und 640 ND50. Bei den Tieren, die mit CSF 0634 infiziert worden waren, konnten keine neutralisierenden Antikörper festgestellt werden (Tab. 12 bis 15). Ergebnisse 75 Tab. 12: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0650 Tiere 11dpi 12dpi 14dpi 18dpi 21dpi 25dpi 28dpi 33dpi 80 <5 n.u. 80 480 640 480 480 1600 81 <5 <5 * * * * * * 82 <5 n.u. 80 240 640 480 480 * 83 <5 n.u. 10 30 30 40 160 160 102 <5 n.u. 30 30 80 * * * Tab. 13: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0695 Tiere 11dpi 13dpi 14dpi 18dpi 21dpi 25dpi 28dpi 84 <5 n.u. 20 30 40 60 160 85 <5 * * * * * * 86 <5 n.u. 15 15 30 40 40 87 <5 40 * * * * * 88 <5 n.u. 40 40 40 * * * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert; kursiv: Tiere moribund euthanasiert n.u.: nicht untersucht Ergebnisse 76 Tab. 14: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0634 Tiere 11dpi 13dpi 14dpi 17dpi 18dpi 20dpi 89 <5 n.u. <5 * * * 90 <5 n.u. <5 * * * 91 <5 <5 * * * * 92 <5 n.u. <5 n.u. <5 <5 93 <5 n.u. <5 <5 * * Tab. 15: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0277 Tiere 11dpi 14dpi 18dpi 21dpi 25dpi 28dpi 94 <5 <5 <5 * * * 95 <5 * * * * * 96 <5 15 240 240 240 240 97 <5 <5 <5 60 120 640 98 <5 <5 * * * * * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert; kursiv: Tiere moribund euthanasiert n.u.: nicht untersucht Ergebnisse 77 4.1.5.1 Einbeziehung der Bildung neutralisierender Antikörper in das Schema zur Beurteilung der Virulenz der KSPV-Isolate. Bei acht der neun rekonvaleszenten Schweine konnten 14 dpi neutralisierende Antikörper nachgewiesen werden. Nur ein Schwein, das an der akut-letalen Form der KSP erkrankt war, zeigte zu diesem Zeitpunkt eine Antikörperbildung (Tab. 16). Folgende Bewertung der Bildung neutralisierender Antikörper (14 dpi) wird vorgeschlagen: nAk < 5: 3 Punkte nAk > 5: 0 Punkte Tab. 16: Vergleich der Bildung neutralisierender Antikörper am Tag 14 p.i.. Für jedes Virusisolat sind die Antikörpertiter (ND50) angegeben. CSF 0650 CSF 0695 CSF 0634 CSF 0277 80* 20* <5 <5 < 5** < 5** <5 < 5** 80* 15* < 5** 15* 10* 40** <5 < 5* 30* 40* <5 <5 * rekonvaleszente Tiere ** Tiere schon vor 14 dpi euthanasiert der Einzeltiere Ergebnisse 78 4.1.6 Erneute Bewertung der Virulenz der vier KSPV-Isolate unter Berücksichtigung zusätzlicher Parameter. Zusätzlich zu den 9 Parametern des Untersuchungsschemas von MITTELHOLZER et al. (2000) wurden die Mortalität (Tab. 5), die Leukozytenzahl (s. Kap. 4.1.3.1) und die Bildung neutralisierender Antikörper (s. Kap. 4.1.5.1) zur Bestimmung des Clinical Score herangezogen. Ein maximaler CS von 36 war zu erreichen. Nach dem modifizierten Bewertungsschema wurden KSPV-Feldisolate, die eine Punktzahl von > 18 erreichten als hoch virulent klassifiziert. Isolate, die eine Punktzahl zwischen 6 und 18 erreichten, wurden als moderat virulent eingestuft. Schwach virulente Isolate wurden durch eine Punktzahl < 6 definiert. Tab. 17: Clinical Score (CS Ø) nach MITTELHOLZER et al. (2000) und nach dem modifizierten Bewertungsschema (CSmod) KSPV-Isolate (CS) (CSmod) Virulenz CSF 0650 10 13,6 moderat CSF 0695 13,4 17,2 moderat CSF 0634 17,6 26,6 hoch CSF 0277 10,2 16,8 moderat Ergebnisse 4.2 Vergleich 79 des Krankheitsverlaufes der KSP von Reinzucht- und Kreuzungstieren 4.2.1 Bestimmung des Clinical Score Neun KSP-relevante klinische Parameter wurden untersucht und je nach Ausprägungsgrad des Symptoms mit einer Punktzahl von 0 bis 3 bewertet. Nach deren Addition ergab sich für jeden Tag die klinische Punktzahl (Clinical Score) eines Tieres. Der unten angegebene Clinical Score entspricht der maximalen Punktzahl, die ein Tier im Verlauf der Infektion erreichte. Für jedes KSPV-Isolat wurde der durchschnittliche Clinical Score berechnet (Summe des maximalen Clinical Score der Einzeltiere/Anzahl der Tiere). Zusätzlich wurde der Clinical Score nach dem modifizierten Bewertungsschema (s. Kap. 4.1.6) bestimmt (CSmod). 4.2.1.1 CSF 0277 Fünf Hybridschweine (Tiere Nr. 134-138) und fünf Schweine der Deutschen Landrasse (Tiere Nr. 129-133) wurden mit der gleichen Virusdosis (104 KID50) des Isolates CSF 0277, Genotyp 2.1 Paderborn, infiziert. Die Inkubationszeit betrug bei den Hybridschweinen 6-8 Tage, bei den Schweinen der Deutschen Landrasse lag sie zwischen 5 und 7 Tagen. Bei allen Tieren blieb die Körpertemperatur unter 41 °C (Abb. 21 u. 23 und Tab. 37 u. 38 im Anhang). Alle zehn Schweine durchliefen eine akut-transiente Form der KSP-Virusinfektion. Die Tiere waren apathisch und fraßen schlecht. Das Fieber dauerte nur einige Tage an, danach trat eine rasche Besserung des Allgemeinbefindens ein. Während der zweiten Infektionswoche war für einige Tage Durchfall feststellbar. Typische hämorrhagische oder zentralnervöse Symptome traten nicht auf. Die Hybridschweine erreichten einen Clinical Score von 5-7. Der Clinical Score der Deutschen Landrasse lag zwischen 5 und 8 (Abb. 20 u. 22 und Tab. 18). Der modifizierte CSmod Ergebnisse 80 (s. Kap. 4.1.6) ist in Tab. 18 dargestellt. Die Mortalität betrug bei beiden Gruppen 0%. 4.2.1.2 CSF 0634 Fünf Hybridschweine (Tiere Nr. 146-150) und fünf Schweine der Deutschen Landrasse (Tiere Nr. 141-145) wurden mit der gleichen Virusdosis (104 KID50) des Isolates CSF 0634 infiziert. Bei beiden Gruppen lag die Inkubationszeit zwischen 5 und 7 Tagen und bei allen Tieren stieg die Körpertemperatur auf > 41 °C (Abb. 25 u. 27 und Tab. 39 u. 40 im Anhang). Die Tiere waren apathisch und fraßen kaum bis gar nicht mehr. Neben einer starken Schwellung der Inguinallymphknoten und Konjunktivitis war in der zweiten Infektionswoche dünnflüssig-wässriger Durchfall feststellbar. Bei allen Tieren zeigten sich neurologische Störungen, die von einer leichten Ataxie bis zur vollständigen Lähmung der Hintergliedmaßen reichten. Alle Tiere der beiden Gruppen entwickelten die akut-letale Form der KSP-Virusinfektion. Die Schweine der Deutschen Landrasse mussten zwischen dem 13. und 25. Tag nach der Infektion euthanasiert werden. Der Clinical Score lag zwischen 15 und 21( Abb. 24 und Tab. 18). Die Hybridschweine mussten zwischen dem 15. und 20. Tag nach der Infektion euthanasiert werden. Der Clinical Score lag zwischen 18 und 20 (Abb. 26 und Tab. 18). Der modifizierte CSmod ist in Tab. 18 dargestellt. Die Mortalität betrug bei beiden Gruppen 100%. Ergebnisse 81 CSF 0277 (Dt. Landrasse) 18 16 Clinical Score 14 12 10 8 6 4 2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 dpi Tier 129 Tier 130 Tier 131 Tier 132 Tier 133 Abb. 20: Clinical Score bei Infektion mit CSF 0277 (Deutsche Landrasse) CSF 0277 (Dt. Landrasse) 43 T (°C) 42 41 40 39 38 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 129 Tier 130 Tier 131 Tier 132 Tier 133 Abb. 21: Temperaturverlauf bei Infektion mit CSF 0277 (Deutsche Landrasse) Ergebnisse 82 CSF 0277 (Hybridschweine) 18 16 Clinical Score 14 12 10 8 6 4 2 0 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 134 Tier 135 Tier 136 Tier 137 Tier 138 Abb. 22: Clinical Score bei Infektion mit CSF 0277 (Hybridschweine) CSF 0277 (Hybridschweine) 43 T (°C) 42 41 40 39 38 0 2 4 6 8 10 12 14 16 18 20 dpi Tier 134 Tier 135 Tier 136 Tier 137 Tier 138 Abb. 23: Temperaturverlauf bei Infektion mit CSF 0277 (Hybridschweine) Ergebnisse 83 CSF 0634 (Dt. Landrasse) 25 Clinical Score 20 15 10 5 0 0 2 4 6 8 10 12 14 16 18 20 22 24 dpi Tier 141 Tier 142 Tier 143 Tier 144 Tier 145 Abb. 24: Clinical Score bei Infektion mit CSF 0634 (Deutsche Landrasse) (Tiere 141-145 moribund euthanasiert) CSF 0634 (Dt. Landrasse) 43 T (°C) 42 41 40 39 38 0 2 4 6 8 10 12 14 16 18 20 22 24 dpi Tier 141 Tier 142 Tier 143 Tier 144 Tier 145 Abb. 25: Temperaturverlauf bei Infektion mit CSF 0634 (Deutsche Landrasse) Ergebnisse 84 CSF 0634 (Hybridschweine) 25 Clinical Score 20 15 10 5 0 0 2 4 6 8 10 12 14 16 18 20 22 24 dpi Tier 146 Tier 147 Tier 148 Tier 149 Tier 150 Abb. 26: Clinical Score bei Infektion mit CSF 0634 (Hybridschweine) (Tiere 146-150 moribund euthanasiert) CSF 0634 (Hybridschweine) 43 T (°C) 42 41 40 39 38 0 2 Tier 146 4 6 Tier 147 8 10 12 dpi Tier 148 14 16 Tier 149 18 20 Tier 150 Abb. 27: Temperaturverlauf bei Infektion mit CSF 0634 (Hybridschweine) Ergebnisse 85 Tab. 18: Vergleich des Clinical Score (CS) und der Inkubationszeit von Hybridschweinen (H) und Schweinen der Dt. Landrasse (DL), die mit CSF 0277 und CSF 0634 infiziert worden waren. Für jede Gruppe wurde der durchschnittliche durchschnittliche CS Clinical (Ø) berechnet. Score nach Zusätzlich dem wurde modifizierten Bewertungsschema bestimmt (CSmod). CSF- Tiere Isolat Nr. CS 129 8 130 5 CSF 0277 131 7 (DL) 132 8 133 5 134 5 135 5 CSF 0277 136 5 (H) 137 7 138 6 141 15 142 15 CSF 0634 143 16 (DL) 144 16 145 21 146 20 147 19 CSF 0634 148 21 (H) 149 18 150 20 Inkubations- CS (Ø) CSmod 6,6 8 5-7 5,6 7,4 6-8 16,6 25,6 5-7 19,6 28 5-7 der zeit (dpi) 86 Ergebnisse 4.2.2 Bestimmung des Pathological Score (PS) Bei der postmortalen Untersuchung wurden zehn KSP-relevante Parameter untersucht und je nach Ausprägungsgrad mit einer Punktzahl von 0 bis 3 bewertet. Nach deren Addition ergab sich die pathologische Punktzahl (Pathological Score) eines Tieres. Für jedes KSPV-Isolat wurde der durchschnittliche Pathological Score (PS gesamt) berechnet (Summe des PS der Einzeltiere/Anzahl der Tiere). Ferner wurde für jeden Parameter die durchschnittliche Punktzahl berechnet (Summe der Punktzahl der Einzeltiere/Anzahl der Tiere). 4.2.2.1 CSF 0277 Die fünf Hybridschweine und die fünf Schweine der Deutschen Landrasse erkrankten an der akut-transienten Verlaufsform der KSP. Die Tiere wurden zwischen dem 21 und 42. Tag p.i. euthanasiert. Bei der Sektion zeigten sich keine KSP-typischen pathologischen Veränderungen. Bei allen Schweinen waren die Inguinallymphknoten und teilweise auch die Mandibularlymphknoten und der Ln. ileocaecalis geringgradig vergrößert. Der PS der Tiere beider Gruppen lag zwischen 1 und 3. Der durchschnittliche PS betrug für die Hybridschweine 1,8 und für die Schweine der Deutschen Landrasse 1,6. Der PS für die einzelnen Tiere ist in den Abb. 28 und 29 dargestellt. Die durchschnittliche Punktzahl pro Tier für jeden der zehn Parameter und für jedes CSF-Isolat ( PS gesamt) ist in Tab. 19 aufgeführt. Ergebnisse 87 4.2.2.2 CSF 0634 Die fünf Schweine der Deutschen Landrasse und die fünf Hybridschweine erkrankten an der akut-letalen Verlaufsform der KSP. Die Tiere entwickelten unterschiedlich stark ausgeprägte Hämorrhagien an der äußeren Haut, der Subkutis, den Serosen und den Nieren. Die Lymphknoten (Lnn. inguinales, Lnn. mandibulares, Ln. ileocaecalis) waren stark vergrößert und hämorrhagisch. Bei einem Schwein zeigten sich an den Tonsillen ausgeprägte Nekrosen. An der Milz eines Tieres war ein Randinfarkt feststellbar. Bei vier Schweinen lag eine geringgradige, akute, katarrhalisch-eitrige Bronchopneumonie vor. Der PS der Deutschen Landrasse lag zwischen 14 und 18 und der PS der Hybridschweine zwischen 12 und 20. Der durchschnittliche PS betrug für die Hybridschweine 15 und für die Schweine der Deutschen Landrasse 15,8. Der PS für die einzelnen Tiere ist in den Abb. 30 und 31 dargestellt. Die durchschnittliche Punktzahl für jeden der zehn Parameter und für jedes CSF-Isolat (PS gesamt) ist in Tab. 19 aufgeführt. Ergebnisse 88 Tab. 19: Vergleich des Pathological Score (PS) von Hybridschweinen (H) und Schweinen der Deutschen Landrasse (DL) bei Infektion mit CSF 0277 und CSF 0634. Für jeden Parameter wurde die durchschnittliche Punktzahl (0-3) berechnet. CSF 0277 CSF 0277 CSF 0634 CSF 0634 (DL) (H) (DL) (H) 0 0 1,6 1,2 0 0 1,2 0,8 Lnn. inguinales 1,0 1,0 3,0 3,0 Lnn. mandibulares 0,4 0,4 3,0 2,6 Ln. ileocaecalis 0,2 0,4 2,4 2,2 Tonsillen 0 0 0,8 0,8 Milz 0 0 0,2 0 Nieren 0 0 2,4 2,6 Ileum 0 0 0,4 1,2 Respirationstrakt 0 0 0,8 0,8 1,6 1,8 15,8 15,0 Haut Subkutis/Serosen PS gesamt Ergebnisse 89 CSF 0277 (Dt. Landrasse) 30 Pathological Score 25 20 15 10 5 0 Tier 129** Tier 130** Tier 131** Tier 132** Tier 133** Abb. 28: Pathological Score bei Infektion mit CSF 0277 (Deutsche Landrasse) CSF 0277 (Hybridschweine) 30 Pathological Score 25 20 15 10 5 0 Tier 134** Tier 135** Tier 136** Tier 137** Tier 138** Abb. 29: Pathological Score bei Infektion mit CSF 0277 (Hybridschweine) **rekonvaleszent euthanasiert Ergebnisse 90 CSF 0634 (Dt. Landrasse) 30 Pathological Score 25 20 15 10 5 0 Tier 141* Tier 142* Tier 143* Tier 144* Tier 145* Abb. 30: Pathological Score bei Infektion mit CSF 0634 (Deutsche Landrasse) CSF 0634 (Hybridschweine) 30 Pathological Score 25 20 15 10 5 0 Tier 146* Tier 147* Tier 148* Tier 149* Tier 150* Abb. 31: Pathological Score bei Infektion mit CSF 0634 (Hybridschweine) * moribund euthanasiert Ergebnisse 91 4.2.3 Leukozytenzahl Es gab keine signifikanten Unterschiede zwischen den Leukozytenzahlen der Hybridschweine und der Deutschen Landrasse (Abb. 33 und 34). Deshalb wurden die Werte der beiden Gruppen für die Isolate CSF 0277 und CSF 0634 unter Angabe des Mittelwertes und der Standardabweichung (MW ± s) zusammengefasst (Abb.32). Die Schweine der Deutschen Landrasse und die Hybridschweine, die mit dem KSPV-Isolat CSF 0277 infiziert wurden, entwickelten zwischen dem 4. und 7. Tag p.i.. eine vorübergehende Leukopenie. Die Werte sanken durchschnittlich bis auf 8,9 G/l. Mit der Besserung des Allgemeinbefindens nach der 2. Infektionswoche normalisierten sich die Leukozytenzahlen wieder (Tab. 41 und 42 im Anhang). Bei den 10 Tieren, die mit dem KSPV-Isolat 0634 infiziert wurden, war ab 4 Tagen p.i. eine persistierende Leukopenie feststellbar. Die Werte sanken durchschnittlich bis auf 5,7 G/l (Tab. 43 und 44 im Anhang). Leukozyten 25 20 G/l 15 10 5 0 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi dpi CSF 0277 CSF 0634 Abb. 32: Leukozytenzahlen bei Infektion mit CSF 0277 und CSF 0634 (MW ± s) Ergebnisse 92 Leukozyten CSF 0277 30 25 G/l 20 15 10 5 0 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi 21 dpi dpi DL H Abb. 33: Leukozytenzahlen der Deutschen Landrasse (DL) und der Hybridschweine (H) bei Infektion mit CSF 0277 (MW ± s)* Leukozyten CSF 0634 30 25 G/l 20 15 10 5 0 0 dpi 4dpi 7dpi 11 dpi 14 dpi 18 dpi dpi DL H Abb. 34: Leukozytenzahlen der Deutschen Landrasse (DL) und der Hybridschweine (H) bei Infektion mit CSF 0634 (MW ± s)* * keine signifikanten Unterschiede zwischen den Leukozytenzahlen der beiden Gruppen Ergebnisse 93 4.2.4 Virusisolierung aus der Leukozytenfraktion Das KSP-Virus konnte bei den fünf Tieren der Deutschen Landrasse und den fünf Hybridschweinen, die mit dem Isolat CSF 0277 infiziert wurden, 7 Tage p.i. aus den Leukozyten isoliert werden. Bei vier Schweinen der Deutschen Landrasse und zwei Hybridschweinen gelang die Virusisolierung bereits 4 dpi. 14 Tage p.i. war in beiden Gruppen nur noch je ein Schwein viruspositiv und 18 Tage p.i. konnte bei keinem der Schweine das KSP-Virus mehr in der Leukozytenfraktion nachgewiesen werden (Tab. 20 und 21). Die Tiere der beiden Gruppen, die mit dem Isolat CSF 0634 infiziert wurden, waren 7 Tage p.i. viruspositiv. Bei allen 10 Schweinen konnte das KSP-Virus während der gesamten Krankheitsdauer aus der Leukozytenfraktion isoliert werden. Bei vier Schweinen der Deutschen Landrasse und drei Hybridschweinen war schon 4 Tage p.i. eine Virusisolierung aus den Leukozyten möglich (Tab. 22 und 23). Tab. 20: Virusisolierung aus der Leukozytenfraktion von Schweinen der Deutschen Landrasse, die mit CSF 0277 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi Tier 129 neg neg pos pos pos neg Tier 130 neg pos pos pos neg neg Tier 131 neg pos pos neg neg neg Tier 132 neg pos pos pos neg neg Tier 133 neg pos pos pos neg neg neg : Virusisolierung negativ; pos : Virusisolierung positiv * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert Ergebnisse 94 Tab. 21: Virusisolierung aus der Leukozytenfraktion von Hybridschweinen, die mit CSF 0277 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi Tier 134 neg pos pos pos neg neg Tier 135 neg neg pos neg neg neg Tier 136 neg pos pos pos pos neg Tier 137 neg neg pos pos neg neg Tier 138 neg neg pos pos neg neg neg : Virusisolierung negativ; pos : Virusisolierung positiv Tab. 22: Virusisolierung aus der Leukozytenfraktion von Schweinen der Deutschen Landrasse, die mit CSF 0634 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi 21 dpi 25 dpi Tier 141 neg pos pos pos pos pos pos pos Tier 142 neg neg pos pos pos pos pos * Tier 143 neg pos pos pos pos pos pos pos Tier 144 neg pos pos pos pos pos pos pos Tier 145 neg pos pos pos * * * * neg : Virusisolierung negativ; pos : Virusisolierung positiv * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert Ergebnisse 95 Tab. 23: Virusisolierung aus der Leukozytenfraktion von Hybridschweinen, die mit CSF 0634 infiziert worden waren. 0 dpi 4 dpi 7 dpi 11 dpi 14 dpi 18 dpi 20 dpi Tier 146 neg neg pos pos pos pos pos Tier 147 neg neg pos pos pos pos * Tier 148 neg pos pos pos pos * * Tier 149 neg pos pos pos pos pos * Tier 150 neg pos pos pos pos pos * neg : Virusisolierung negativ; pos : Virusisolierung positiv 4.2.5 Virustiter im Serum Der Virustiter im Serum wurde für den Tag 7 p. i. ermittelt. Die Virustiter der Deutschen Landrasse (CSF 0277) lagen zwischen 102,7 KID50/ml und 104,2 KID50/ml. Die Hybridschweine (CSF 0277) erreichten einen Virustiter zwischen 103 KID50/ml und 104,2 KID50/ml. Bei Infektion mit dem KSPV-Isolat CSF 0634 lagen die Virustiter der Hybridschweine zwischen 103,2 KID50/ml und 104,2 KID50/ml. Die Tiere der Deutschen Landrasse erreichten einen Virustiter zwischen 103,2 KID50/ml und 104 KID50/ml. Die Virustiter der Einzeltiere und die durchschnittlichen Virustiter für jedes Virusisolat sind in Tab. 24 dargestellt. * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert Ergebnisse 96 Tab. 24: Vergleich der Virustiter (log10 KID50/ml) der Hybridschweine und der Schweine der Deutschen Landrasse, die am Tag 7 p.i. erreicht wurden. Für jedes Virusisolat sind die Virustiter der Einzeltiere und der durchschnittliche Virustiter (Ø) angegeben. CSF-Isolat Titer der Einzeltiere Ø Titer CSF 0277 CSF 0277 CSF 0634 CSF 0634 (DL) (H) (DL) (H) 4,0 3,2 3,2 3,2 3,5 3,0 3,0 3,5 4,2 3,7 3,7 3,7 3,7 4,0 3,7 4,0 2,7 4,2 4,0 4,2 3,6 3,6 3,5 3,7 4.2.6 Bildung neutralisierender Antikörper Die Serumproben wurden auf das Vorhandensein neutralisierender Antikörper (nAk) gegen das jeweilige homologe Virus getestet. Drei Tiere der Deutschen Landrasse und drei Hybridschweine, die mit dem CSF-Isolat 0634 infiziert worden waren, entwickelten keine Antikörper (Titer < 5). Die übrigen Tiere dieser beiden Gruppen zeigten in der Terminalphase der Erkrankung ab Tag 18 p.i. eine Antikörperentwicklung. Nur bei einem Tier konnten schon 14 dpi neutralisierende Antikörper nachgewiesen werden (Tab. 25 und 26). Bei Infektion mit CSF 0277 erholten sich alle 10 Schweine von der KSP-Infektion. Die rekonvaleszenten Tiere entwickelten ab 14 dpi unterschiedlich hohe Antikörpertiter. Die Antikörpertiter der Hybridschweine lagen 25 dpi zwischen 80 ND50 und 480 ND50. Die Schweine der Deutschen Landrasse hatten 25 dpi einen Titer zwischen 30 ND50 und 160 ND50 (Tab. 27 und 28). Ergebnisse 97 Tab. 25: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0634 (Deutsche Landrasse) Tiere 11dpi 13dpi 14 dpi 18 dpi 21 dpi 25 dpi 141 <5 n.u. 40 120 480 480 142 <5 n.u. <5 <5 <5 * 143 <5 n.u. <5 15 20 20 144 <5 n.u. <5 <5 <5 <5 145 <5 <5 * * * * Tab. 26: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0634 (Hybridschweine) Tiere 11dpi 14 dpi 16dpi 18 dpi 20 dpi 146 <5 <5 n.u. 40 60 147 <5 <5 n.u. 80 120 148 <5 <5 * * * 149 <5 <5 n.u. <5 * 150 <5 <5 <5 * * * fehlende Werte in den Tabellen: Tiere bereits verstorben/euthanasiert; kursiv: Tiere moribund euthanasiert n.u.: nicht untersucht Ergebnisse 98 Tab. 27: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0277 (Deutsche Landrasse) Tiere 11dpi 14 dpi 18 dpi 21 dpi 25 dpi 129 <5 7,5 60 60 60 130 <5 7,5 20 40 40 131 <5 7,5 60 60 80 132 <5 15 30 30 30 133 <5 10 40 120 160 Tab. 28: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0277 (Hybridschweine) Tiere 11dpi 14 dpi 18 dpi 21 dpi 25 dpi 134 <5 15 30 80 80 135 <5 7,5 80 120 320 136 <5 15 60 160 320 137 <5 15 120 320 480 138 <5 15 160 320 480 5. Diskussion Die Infektion mit dem Virus der Klassischen Schweinepest kann zu sehr unterschiedlichen Krankheitsverläufen führen. Neben der akut-letalen Form treten mildere akut-transiente, inapparente und chronische Verlaufsformen auf (DEPNER et al., 1996a). Außerdem kann das Virus bei tragenden Tieren die Plazentaschranke überwinden (VAN OIRSCHOT u. TERPSTRA, 1977). Der Verlauf einer Infektion mit dem KSPV wird durch verschiedene Faktoren bestimmt. Neben der Virulenz des jeweiligen Virusisolates beeinflussen auch Wirtsfaktoren, wie z.B. Alter sowie Konstitution und Kondition der Tiere, den Verlauf der Erkrankung (DAHLE u. LIESS, 1995, DEPNER et al., 1997). Spezifische Virulenzfaktoren sind bisher nicht bekannt. Die Einteilung der Viren in hoch, moderat und schwach virulent beruht einerseits auf Beobachtungen in Tierbeständen nach einem KSP-Ausbruch (ELBERS et al., 1999). Andererseits wurde eine kleine Anzahl von Isolaten aufgrund ihres Verhaltens in der Zellkultur (AYNAUD et al., 1976, VAN OIRSCHOT, 1988, MITTELHOLZER et al., 2000) und anhand einer klinisch ermittelten Punktzahl (Clinical Score) in verschiedene Virulenzkategorien eingeteilt (MITTELHOLZER et al., 2000). Ziel der vorliegenden Arbeit war es, dieses Untersuchungsschema von Mittelholzer et al. (2000) auf seine Gültigkeit und Anwendbarkeit zu überprüfen. Dazu wurden vier KSPV-Feldisolate, die unterschiedlichen genetischen Typen angehören, im Tierversuch getestet und entsprechend dem oben genannten Schema klassifiziert. Darüber hinaus wurde die Eignung weiterer Parameter für eine Charakterisierung der Virulenz überprüft. Hierzu zählten die Inkubationszeit, die Mortalitätsrate, die Bestimmung der Leukozytenzahl, der Beginn und die Dauer der Virämie und die Höhe des Virustiters im Serum sowie die Bildung neutralisierender Antikörper. Ferner wurde ein neu entwickelter Pathological Score auf seine Anwendbarkeit für die Charakterisierung der Virulenz getestet. Zudem sollte ermittelt werden, ob es Unterschiede im klinischen Verlauf der KSP und damit in der Bewertung der Virulenz einzelner Virusisolate gibt, wenn man unter gleichen Bedingungen Reinzucht- und Kreuzungstiere infiziert. 100 Diskussion 5.1 Auswahl der Virusisolate und der Versuchstiere Bei der Auswahl der Virusisolate wurde berücksichtigt, dass Primärausbrüche bei Hausschweinen häufig durch direkten oder indirekten Kontakt zu infizierten Wildschweinen oder durch illegale Verfütterung von Speiseabfällen hervorgerufen werden (FRITZEMEIER et al., 2000). Die Isolate CSF 0277 (Genotyp 2.1 Paderborn) und CSF 0634 (Genotyp 2.3 Uelzen) wurden bei KSP-Ausbrüchen in Deutschland Ende der 1990er Jahre aus Hausschweinen isoliert. Der KSP-Virustyp 2.3 Uelzen zirkuliert seit 1992 in der Wildschweinepopulation in Niedersachsen (FRITZEMEIER et al., 2000). Die beiden Virusisolate des Genotyps 1 repräsentieren KSP-Epidemien außerhalb der EU. Das Isolat CSF 0650 (Genotyp 1.2) stammt aus Mittelamerika und das Isolat CSF 0695 (Genotyp 1.1) aus Russland. Beide KSPV-Isolate wurden Ende der 1990er Jahre aus Hausschweinen isoliert. Sie wurden bisher noch nicht im Tierversuch charakterisiert. Es besteht auch bei der KSP die Gefahr der Neueinschleppung des Virus in die Mitgliedsstaaten der EU, wie bei dem Maul- und Klauenseuche (MKS)-Ausbruch 2001 in Großbritannien geschehen (DAVIES et al., 2002). Da das Alter der Tiere einen großen Einfluss auf den Krankheitsverlauf hat (DEPNER et al., 1996a), wurden Schweine einer Altersgruppe (ca. 8 Wochen) infiziert. Im ersten Tierversuch, in dem die vier Virusisolate getestet wurden, dienten Schweine der Deutschen Landrasse (DL) als Versuchstiere. Im zweiten Tierversuch wurden zum Vergleich des Krankheitsverlaufes von Reinzucht- und Kreuzungstieren Hybridschweine (DL x Pietrain) und DL-Schweine mit zwei der zuvor verwendeten Virusisolate, die als hoch bzw. moderat virulent klassifiziert wurden, infiziert. Es wurde der Vergleich zwischen Kreuzungs- und Reinzuchttieren gewählt, da Kreuzungstiere gegenüber Reinzuchttieren eine Überlegenheit in verschiedenen Parametern der immunologischen Abwehr, z.B. Zahl der Blutleukozyten, SerumImmunglobulinkonzentration an IgG, IgM und IgA, Phagozytosefähigkeit peripherer Granulozyten aufweisen (BUSCHMANN et al., 1985). Diskussion 101 Neben dem Alter kann auch die Virusdosis den Verlauf der Erkrankung beeinflussen. Für den KSP-Stamm Alfort/187 (CSF 0902) konnte gezeigt werden, dass der klinische Verlauf von der Höhe der applizierten Virusdosis abhing (DAHLE u. LIESS, 1995). Allerdings wurde in weiteren Infektionsversuchen deutlich, dass die Infektionsdosis eine weniger bedeutende Rolle spielt als das Alter. Ferkel erkrankten und starben trotz minimaler Virusdosen, während ältere Tiere auch nach Infektion mit sehr hohen Dosen an infektiösem Virus klinisch inapparente oder milde Infektionen durchliefen (DEPNER et al., 1996a). Zur Vergleichbarkeit der Ergebnisse wurden die Schweine in der vorliegenden Arbeit mit der gleichen Virusdosis infiziert. Als Infektionsweg wurde die intranasale Inokulation gewählt, da die oronasale Infektion den natürlichen Übertragungsweg darstellt (VAN OIRSCHOT, 1999). 5.2 Beurteilung des Untersuchungsschemas von MITTELHOLZER et al. (2000) Zur Charakterisierung Untersuchungsschema, Ausprägungsgrad der das bewertet Virulenz klinische und einen diente Symptome Vergleich ein der semiquantitatives KSP zwischen und deren verschiedenen Tierexperimenten erlauben soll. Anhand des Schemas kann des weiteren der Verlauf der Erkrankung verfolgt werden, und Unterschiede in der Bewertung der klinischen Symptome durch verschiedene Untersucher werden minimiert. Dieses von MITTELHOLZER et al. (2000) vorgeschlagene Untersuchungsschema beruht auf der Beurteilung von Einzeltieren und enthält 10 KSP-relevante Parameter (Lebhaftigkeit, Haltung, Nährzustand, Atmung, Gang, Haut, Konjunktiven, Appetit, Kotabsatz, Futter im Trog), die je nach Schwere des Symptoms mit 0-3 Punkten beurteilt werden können. Damit kann eine maximale klinische Punktzahl (Clinical Score) von 30 pro Tag und Tier erreicht werden. In der vorliegenden Arbeit wurden nur neun der zehn Parameter beurteilt. Der im Untersuchungsschema aufgeführte Parameter „Futter im Trog“, der die im Trog zurückgelassene Futtermenge bewertet, ist nur zufriedenstellend zu beurteilen, wenn die Schweine einzeln gehalten werden. In den hier durchgeführten Tierversuchen Diskussion 102 war dies nicht möglich, da je fünf Schweine gemeinsam in einer Isolierstalleinheit untergebracht waren. Abgesehen davon wird das Fressverhalten der Tiere schon durch den Parameter „Appetit“ abgedeckt. Die Doppelbewertung der Futteraufnahme rechtfertigt das Herausnehmen Untersuchungsschema, da des dieser Punktes „Futter im Trog“ aus dem Parameter sonst unverhältnismäßig stark berücksichtigt würde. Die Parameter Lebhaftigkeit, Haltung und Gang beinhalten alle bei der Vergabe von 3 Punkten das Symptom „Festliegen“. Trotz der starken Bewertung dieses Symptoms wurden keine Veränderungen der drei Parameter vorgenommen, da sie jeweils unterschiedliche Krankheitsmerkmale beurteilen (Allgemeinbefinden, neurologische Störungen). Der maximal erreichbare Clinical Score lag somit bei 27. In Anlehnung an MITTELHOLZER et al. (2000) wurden KSPVirusisolate, die einen Clinical Score von > 14 erreichten, als hoch virulent klassifiziert. Isolate, bei denen der maximale Clinical Score zwischen 5 und 14 lag, wurden als moderat virulent eingestuft und schwach virulente Isolate wurden durch eine Punktzahl von < 5 definiert. Vier KSPV-Feldisolate wurden anhand des Bewertungsschemas im ersten Tierversuch klassifiziert. Für jedes Virusisolat wurde der durchschnittliche Clinical Score berechnet. Zur Berechnung des Mittelwertes wurde der maximale Clinical Score eines jeden Tieres herangezogen, auch wenn dieser an unterschiedlichen Tagen p.i. (post infectionem) erreicht wurde. Eine Bewertung des Clinical Score zu einem bestimmten Zeitpunkt, z.B. 10, 14 oder 18 dpi führte zu einem verfälschten Ergebnis, da es die Tiere, die zwischen diesen Zeitpunkten die stärksten Krankheitserscheinungen zeigten, nicht berücksichtigen würde. Dies war besonders dann der Fall, wenn Schweine sich von der Infektion erholten. Das KSPV-Feldisolat CSF 0634 (Genotyp 2.3 Uelzen) erreichte einen durchschnittlichen Clinical Score von 17,6 und wurde als hoch virulent klassifiziert. Das Isolat CSF 0277 (Genotyp 2.1. Paderborn) erreichte einen durchschnittlichen Clinical Score von 10,2 und wurde als moderat virulent eingestuft. Dieses Isolat wurde auch in anderen Untersuchungen als moderat (STEGEMANN et al., 2000, UTTENTHAL et al., 2001, 2003). virulent klassifiziert Diskussion 103 Bei Infektion mit dem Isolat CSF 0695 (Genotyp 1.3) konnte ein durchschnittlicher Clinical Score von 13,4 ermittelt werden. Dieses Isolat wurde daraufhin ebenfalls als moderat virulent eingestuft. Das KSP-Feldisolat CSF 0650 (Genotyp 1.1) erreichte einen durchschnittlichen Clinical Score von 10, und es gilt damit ebenfalls als moderat virulent. Eine eindeutige Zuordnung zu einer Virulenzkategorie war nur bei dem KSPV-Isolat CSF 0634 für alle Tiere möglich. Dieses Isolat wurde als hoch virulent eingestuft, denn sowohl im ersten als auch im zweiten Tierversuch erreichten alle 15 Schweine einen Clinical Score > 14 (hoch virulent). Die anderen drei Isolate wurden aufgrund des durchschnittlichen Clinical Score als moderat virulent eingestuft. Allerdings erreichten hier die Tiere, die einen letalen Krankheitsverlauf entwickelten, einen Clinical Score, der größer war als 14. Würde man die Tiere mit letalen Krankheitsverläufen isoliert betrachten, so müsste man auch diese Isolate als hoch virulent einstufen. Bei den genesenen Tieren lag der Clinical Score zwischen 5 und 14 (moderat virulent). Die Klassifizierung dieser Isolate als moderat virulent ist gerechtfertigt, da ein Isolat, bei dem mehr als 20% der Tiere die Infektion überleben, nicht als hoch virulent eingestuft werden kann. Die Beobachtung, dass ein KSPVirusisolat zu sehr unterschiedlichen Krankheitsverläufen führen kann, obwohl die infizierten Tiere das gleiche Alter hatten, der gleichen Rasse angehörten und mit der gleichen Virusdosis infiziert worden waren, stimmt mit Ergebnissen früherer Infektionsversuche im EURL überein (FLOEGEL-NIESMANN, persönliche Mitteilung). Dies wird besonders beim Vergleich des Clinical Score und der Mortalität der Tiergruppen deutlich, die mit dem Isolat CSF 0277 infiziert wurden. Im ersten Tierversuch lag der Clinical Score für dieses Isolat bei 10,2 und die Mortalität betrug 60%. Die zwei Gruppen, die im zweiten Tierversuch mit dem gleichen Isolat infiziert wurden, zeigten einen deutlich milderen Krankheitsverlauf. Hier lag der Clinical Score zwischen 5,6 und 6,6 und die Mortalität betrug 0%. In beiden Tierversuchen wurde das Virusisolat als moderat virulent eingestuft. Es zeigte sich aber hier sehr deutlich, dass die Variationsbreite im Krankheitsverlauf bei moderat virulenten Virusisolaten sehr groß sein kann. Aufgrund dessen ist die von MITTELHOLZER et al. (2000) gewählte Tierzahl von zwei Tieren pro Isolat zu gering, um reproduzierbare 104 Diskussion Ergebnisse zu erhalten. Die Tierzahl ist in einem Tierversuch immer limitiert (Tierschutz, Praktikabilität usw.), aber die Infektion von zwei Tieren pro Isolat lässt keine statistisch signifikanten Aussagen zu. Die geringe Tierzahl ist eine mögliche Erklärung dafür, dass bei den Untersuchungen von MITTELHOLZER et al. (2000) eine einheitliche Zuordnung zu einer Virulenzkategorie auch bei moderat virulentem Virus für alle Tiere möglich war. Zum anderen wurden in dieser Studie zum überwiegenden Teil gentechnisch klonierte Virusstämme verwendet, während in der vorliegenden Arbeit Feldisolate untersucht wurden. Diese Isolate können Mutanten verschiedener Pathogenität enthalten oder defekte interferierende Viruspartikel, die möglicherweise den Verlauf der Erkrankung beeinflussen (DAHLE u. LIESS, 1995). Außerdem stammten die von MITTELHOLZER et al. (2000) infizierten Tiere aus einer SPF-Zucht, während die im EURL verwendeten Schweine aus einer konventionellen Haltung stammten und damit der mikrobielle Status der Tiere nicht definiert war. Nicht-SPF-Tiere entwickelten eine schwerere klinische Verlaufsform der KSP im Vergleich zu SPF-Tieren, wenn sie unter gleichen Bedingungen infiziert wurden (RUGGLI, persönliche Mitteilung). Das von MITTELHOLZER et al. (2000) vorgeschlagene Untersuchungsschema ist zur Beurteilung der Virulenz des KSPV in Tierversuchen geeignet, mit der Einschränkung, dass eine ausreichende Zahl von Probanden pro Virusisolat infiziert werden muss. Eine Anzahl von mindestens fünf Tieren wird empfohlen, um den großen Unterschieden im Krankheitsverlauf mit moderat virulenten Virusisolaten Rechnung zu tragen. Außerdem sollte der durchschnittliche Clinical Score (CS) aus den Maximalwerten der einzelnen Tiere berechnet werden (Summe maximaler CS der Einzeltiere/Anzahl der Tiere), um auch bei moderat virulentem Virus eine Klassifizierung zu ermöglichen. Das Schema kann helfen, die Klassifizierung des KSPV in hoch, moderat und schwach virulente Isolate zwischen verschiedenen Labors vergleichbar zu machen. Für die Beurteilung der Virulenz eines KSPV-Isolates in einem Bestand ist das Untersuchungsschema nicht geeignet, da Infektionszeitpunkt und Verlauf der Infektion nicht bekannt sind. Die Bewertung würde hier nur eine Momentaufnahme darstellen, und der maximale Clinical Score könnte somit nicht bestimmt werden. Diskussion 5.3 Vergleich 105 des Krankheitsverlaufes der KSP von Reinzucht- und Kreuzungstieren Ein weiteres Ziel der vorliegenden Arbeit lag darin zu untersuchen, ob es Unterschiede in der Bewertung der Virulenz eines Virusisolates gibt, wenn man unter gleichen Bedingungen Reinzucht- und Kreuzungstiere infiziert. Da ein Virusisolat auch unter möglichst gleichen Infektionsbedingungen in einem Tierversuch zu unterschiedlichen Krankheitsverläufen führen kann, wurde gefolgert, dass der Infektionsverlauf der KSP auch von Wirtsfaktoren wie Alter, Rasse und Immunstatus abhängig sein muss (DEPNER, 1996a, b). In einer Studie fielen Unterschiede in den Krankheitsverläufen bei Infektion von je fünf Hybridschweinen (DL x Pietrain) und DL-Schweinen mit dem Isolat Visbek/Han95 (CSF 0123) auf (DEPNER et al., 1997). Die fünf DL-Schweine entwickelten die akute Verlaufsform der KSP, während dies nur bei zwei Hybridschweinen der Fall war. Ein Hybridschwein erholte sich von der Infektion und zwei Tiere durchliefen die chronische Form der KSP. Würde man die Virulenz des in diesem Versuch eingesetzten Virus aufgrund der Ergebnisse mit den DL-Schweinen beurteilen, so müsste man das Virus als hoch virulent einstufen. Die Ergebnisse der Kreuzungstiere andererseits würden auf schwächere Virulenz des Virus schließen lassen (DEPNER et al., 1997). Im hier durchgeführten zweiten Tierversuch wurden je fünf Hybridschweine und DLSchweine intranasal mit der gleichen Virusdosis der KSPV-Isolate CSF 0277 und CSF 0634 infiziert. Es wurden je ein hoch bzw. moderat virulentes Virusisolat gewählt, um den Einfluss der Virulenz beim Vergleich des Krankheitsverlaufes von Reinzucht- und Kreuzungstieren zu berücksichtigen. Bei Infektion mit dem zuvor als moderat virulent eingestuftem Isolat CSF 0277 durchliefen alle 10 Schweine eine transiente Verlaufsform der KSP. Die Mortalität betrug bei beiden Gruppen 0%. Die Hybridschweine erreichten einen Clinical Score von 5,6 und die DL-Schweine von 6,6. In beiden Fällen wurde das Virusisolat CSF 0277 als moderat virulent eingestuft. Die Tiere beider Gruppen, die mit dem zuvor als hoch virulent charakterisierten Isolat CSF 0634 infiziert wurden, erkrankten alle an der akut-letalen Form der KSP. Die Diskussion 106 Mortalität betrug in beiden Gruppen 100%. Die DL-Schweine erreichten einen Clinical Score von 16,6 und die Hybridschweine von 19,6. Das Virusisolat CSF 0634 konnte in beiden Gruppen jeweils als hoch virulent charakterisiert werden. Unterschiede in der klinischen Verlaufsform der KSP zwischen den Kreuzungstieren und den Reinzuchttieren, wie für das Isolat Visbek/Han95 (CSF 0123) beschrieben, konnten bei den beiden hier verwendeten Isolaten nicht festgestellt werden. Auch beim Vergleich der pathologischen Veränderungen, dem Beginn und der Dauer der Virämie, der Höhe des Virustiter im Serum (7 dpi) und der Bildung neutralisierender Antikörper waren keine signifikanten Unterschiede zwischen den Hybridschweinen und den DL-Schweinen festzustellen. Mit dem Isolat Visbek/Han95, das als moderat virulent gilt, konnten alle bekannten Krankheitsverläufe der KSP-Virusinfektion (akutletal, akut-transient, chronisch) auch in DL-Schweinen induziert werden (DEPNER et al., 1996b). Aufgrund dessen und der Ergebnisse dieses Tierversuches kann gefolgert werden, dass allein Faktoren, die in dem Unterschied zwischen Reinzuchtund Kreuzungstieren begründet liegen, nicht die stark variierenden Krankheitsverläufe der KSP erklären können. Welchen Einfluss Wirtsfaktoren wie z.B. die Rasse auf den Verlauf der Erkrankung haben, bleibt weiterhin ungeklärt. Das Alter und der Immunstatus der Schweine spielen möglicherweise eine größere Rolle für den Verlauf der KSP-Virusinfektion als die Rasse. Diskussion 107 5.4 Eignung weiterer Parameter für Charakterisierung der Virulenz des KSPV Zusätzlich zu den im Untersuchungsschema von MITTELHOLZER et al. (2000) aufgeführten Merkmalen wurde die Eignung weiterer Parameter für die Bestimmung der Virulenz von KSPV-Isolaten untersucht. Es wurde geprüft, ob die Inkubationszeit und die Mortalitätsrate, die Bestimmung der Leukozytenzahl, der Beginn und die Dauer der Virämie und die Höhe des Virustiters im Serum sowie die Bildung neutralisierender Antikörper eine sinnvolle Ergänzung zum Clinical Score darstellen. Des weiteren wurde ein neu entwickelter Pathological Score (PS) auf seine Anwendbarkeit für die Charakterisierung der Virulenz überprüft. 5.4.1 Pathological Score Für die postmortale Untersuchung (Sektion) wurde ein Untersuchungsschema entwickelt, das ausgewählte pathologische Veränderungen beinhaltet und angelehnt an den Clinical Score mit Punkten bewertet. Zehn KSP-relevante Parameter wurden untersucht und je nach Ausprägungsgrad der Veränderung mit einer Punktzahl von 0-3 bewertet. Nach deren Addition ergab sich eine pathologische Punktzahl (Pathological Score) von maximal 30 pro Tier. Es wurde überprüft, ob eine Einteilung der getesteten Virusisolate in hoch (PS > 15), moderat (PS 5-15) und schwach (PS < 5) in Anlehnung an den Clinical Score möglich war. Bei der postmortalen Untersuchung wurde deutlich, dass die oft in der Literatur beschriebenen pathologischen Veränderungen für die KSP, wie z.B. Nekrosen an den Tonsillen oder Randinfarkte der Milz (DUNNE, 1970, VAN OIRSCHOT, 1999) bei den hier verwendeten KSPV-Isolaten eine untergeordnete Rolle spielten. Nur bei den Tieren, die mit dem Isolat CSF 0634 infiziert worden waren und bei zwei Tieren, die das Isolat CSF 0695 erhielten, zeigte sich das hämorrhagische Krankheitsbild der KSP (DUNNE, 1970, VAN OIRSCHOT, 1999). Bei allen Isolaten waren jedoch die Lymphknoten (Lnn. inguinales, Lnn. mandibulares, Ln. Ileocaecalis) die am stärksten betroffenen Organe. Diese Ergebnisse verdeutlichen, dass bei vergrößerten, Diskussion 108 hämorrhagischen Lymphknoten auch KSP als Differentialdiagnose berücksichtigt werden sollte. Eine Einteilung der KSPV-Isolate in hoch, moderat und schwach virulent analog zum Clinical Score war nicht möglich. Besonders bei Tieren, die zwar deutliche klinische Symptome zeigten, sich jedoch von der Infektion erholten, waren nach der Genesung zum Zeitpunkt der Sektion kaum pathologische Veränderungen festzustellen. Dies wurde besonders im zweiten Tierversuch deutlich, wo das Isolat CSF 0277, das nach dem Clinical Score als moderat virulent eingestuft wurde, im Pathological Score nur einen Wert < 5 (schwach virulent) erreichte. Kaum ausgeprägte pathologische Veränderungen wurde ebenfalls auch für perakut verendete Tiere beschrieben (TRAUTWEIN, 1988). Im Gegensatz zum Clinical Score kann beim Pathological Score der Zeitpunkt der ausgeprägtesten Veränderungen nicht ermittelt werden. Eine Möglichkeit wäre, alle Tiere zu einem festgesetzten Tag p.i. zu euthanasieren, um vergleichbare Ergebnisse zu erhalten. Dies ist jedoch nicht sinnvoll, da so der Verlauf der Erkrankung (Genesung oder letaler Verlauf) nicht mehr beurteilt werden kann. Aufgrund der oben genannten Punkte ist der Pathological Score für die Charakterisierung der Virulenz nicht geeignet, er gibt jedoch einen Hinweis darauf, welche Organveränderungen bei den einzelnen Virusisolaten besonders auffällig sind. 5.4.2 Inkubationszeit, Virämie und Virustiter im Serum Die Dauer der Inkubationszeit, die Höhe des Virustiters im Blut und der Beginn der Virämie werden auch als Hinweise auf die Virulenz eines KSPV-Isolates gewertet. So zeigten hoch virulente Isolate im Allgemeinen eine kürzerer Inkubationszeit, einen höheren Virustiter im Blut und einen früheren Beginn der Virämie als moderat oder schwach virulente Isolate (VAN OIRSCHOT, 1988, KAMOLSIRIPRICHAIPORN et al., 1992). In der vorliegenden Arbeit konnte dieser Zusammenhang für die hier eingesetzten Virusisolate nicht bestätigt werden. Das als hoch virulent Diskussion 109 charakterisierte Isolat CSF 0634 zeigte im ersten Tierversuch sogar eine um 2-3 Tage längere Inkubationszeit als die drei als moderat virulent eingestuften Isolate. Auch die Virusisolierung aus den Leukozyten und die Höhe des Virustiters im Serum an Tag 7 p.i. erlaubten keine Differenzierung der Virulenz. Im ersten Tierversuch war bei dem Isolat CSF 0634 die Virusisolierung aus den Leukozyten bei allen Tieren erst 7 dpi möglich, während bei einigen Tieren, die mit den Isolaten CSF 0277, CSF 0650 und CSF 0695 infiziert worden waren, bereits 4 dpi eine Virusanzucht aus den Leukozyten gelang. Auch in der Höhe des Virustiters im Serum zeigten sich keine Unterschiede zwischen dem als hoch virulent klassifizierten Isolat CSF 0634 und den moderat virulenten Isolaten CSF 0650, 0695 und 0277. Für die Bestimmung des Virustiters im Serum wurde der Tag 7 p.i. gewählt, da zu diesem Zeitpunkt alle Schweine viruspositiv waren, jedoch noch kein Tier verendet war. Aufgrund der oben genannten Ergebnisse wurden die Inkubationszeit, die Virämie und der Virustiter im Serum nicht in das Schema zur Beurteilung der Virulenz der KSPV-Isolate einbezogen. 5.4.3 Bestimmung der Leukozytenzahl Die Infektion mit dem KSPV verursacht eine schwere Leukopenie, die schon vor dem Auftreten von Fieber beobachtet werden kann (TRAUTWEIN, 1988). Alle infizierten Schweine der beiden Tierversuche entwickelten eine deutliche Leukopenie. Die Leukozytenzahl wurde in das Schema zur Beurteilung der Virulenz der KSPV-Isolate einbezogen (vgl. S. 70). Im ersten Tierversuch erkrankten elf von 20 Schweinen an der akut-letalen Verlaufsform der KSP. Der Clinical Score dieser Schweine war > 14 (hoch virulent). Bei allen elf Tieren sanken die Leukozyten unter 6,5 G/l. Deshalb wurde eine Leukozytenzahl < 6,5 mit drei Punkten bewertet. Im Gegensatz dazu lagen bei sieben der neun rekonvaleszenten Tiere, die niedrigsten Leukozytenwerte über 6,5 G/l. Nur zwei der genesenen Schweine zeigten ein vorübergehendes Absinken der Leukozyten unter 6,5 G/l. Der Clinical Score dieser Tiere lag zwischen 5 und 14 Diskussion 110 (moderat virulent). Der Referenzbereich der Leukozyten beim Schwein liegt zwischen 10 und 22 G/l (BICKHARDT, 1992). Aus diesem Grund wurde eine Leukozytenzahl von ≥ 10 G/l mit 0 Punkten bewertet, um nicht Tiere mit einer niedrigen physiologischen Leukozytenzahl schon vor der Infektion zu erfassen. Diese aufgrund der Ergebnisse des ersten Tierversuches getroffene Einteilung wurde im zweiten Tierversuch überprüft. Da es keine signifikanten Unterschiede zwischen der Leukozytenzahl der Hybridschweine und der der DL-Schweine gab, wurden die Werte der beiden Gruppen für die Isolate CSF 0277 und CSF 0634 zusammengefasst. Bei Tieren, die mit dem hoch virulenten Isolat CSF 0634 infiziert worden waren, sanken die Leukozyten auf durchschnittlich 5,7 G/l, während es bei Infektion mit dem moderat virulenten Isolat zu einem Abfall der Leukozyten auf durchschnittlich 8,9 G/l kam. 5.4.4 Bildung neutralisierender Antikörper Die Bildung neutralisierender Antikörper (nAk) wurde ebenfalls in die Bewertung der Virulenz einbezogen (vgl. S 77), denn die Fähigkeit eines Schweins, nAk gegen das KSPV zu entwickeln, bestimmt in hohem Maße den weiteren Krankheitsverlauf. Im ersten Tierversuch zeigten acht von neun rekonvaleszenten Schweinen 14 dpi eine Antikörperbildung (nAk > 5), während nur bei einem Schwein, das an der akut-letalen Form der KSP erkrankte, zu diesem Zeitpunkt neutralisierende Antikörper nachgewiesen werden konnten. Die Höhe des Antikörpertiters ließ sich nicht bewerten, da Tiere, die mit dem gleichen Isolat infiziert wurden, eine zu große Variationsbreite in der Höhe des Antikörpertiters zeigten. Für die Bestimmung des Antikörpertiters wurde Tag 14 p.i. gewählt, da auch moribunde Tiere in der Terminalphase der Erkrankung neutralisierende Antikörper entwickeln können. Bei einer Bewertung der Antikörperbildung zu einem späteren Zeitpunkt würden auch diese Tiere mit null Punkten bewertet. Die getroffene Einteilung wurde im zweiten Tierversuch überprüft. Alle Schweine, die mit dem moderat virulenten Isolat CSF 0277 infiziert worden waren, zeigten 14 dpi eine Diskussion 111 Antikörperbildung. Nur bei einem Schwein, das mit dem Isolat CSF 0634 infiziert worden war, konnten zu diesem Zeitpunkt neutralisierende Antikörper nachgewiesen werden. 5.4.5 Mortalitätsrate Für die Beurteilung der Virulenz des KSPV stellt die Mortalität ein wichtiges Kriterium dar (VAN OIRSCHOT, 1988). In dem von MITTELHOLZER et al. (2000) vorgeschlagenen Bewertungsschema wurde sie jedoch nicht berücksichtigt, deshalb wurde sie in das modifizierte Untersuchungsschema neu aufgenommen (vgl. S. 61). Die Mortalitätsrate kann nicht wie die anderen Parameter für das Einzeltier bestimmt werden, sondern nur für eine Tiergruppe. Auch aus diesem Grund ist es wichtig, eine ausreichend große Tierzahl für die Bestimmung der Virulenz eines Virusisolates zu infizieren. In der vorliegenden Arbeit wurden moribunde Schweine aus Tierschutzgründen beim Vorliegen eines Clinical Score von mindestens 15 euthanasiert. 5.4.6 Einbeziehung geeigneter Parameter in das Untersuchungsschema von MITTELHOLZER et al. (2000) Die Mortalitätsrate, die Leukozytenzahl und die Bildung neutralisierender Antikörper sind geeignete Parameter zur Bestimmung der Virulenz, während die anderen oben genannten Parameter keine Zuordnung der vier getesteten KSPV-Isolate in eine Virulenzkategorie erlaubten. Der Clinical Score wurde unter Einbeziehung der oben genannten 3 Parameter neu bestimmt. Da nun zwölf Parameter mit je 0-3 Punkten beurteilt wurden, konnte ein modifizierter Clinical Score von maximal 36 erreicht werden. Virusisolate, die einen Clinical Score von > 18 erreichten, wurden als hoch virulent eingestuft. Virusisolate, bei denen der maximale Clinical Score zwischen 6 und 18 lag, wurden als moderat 112 Diskussion virulent bewertet und schwach virulente Isolate wurde durch eine Punkzahl < 6 definiert. Damit die einzelnen Parameter des Untersuchungsschemas nicht unterschiedlich stark gewertet werden, wurde auch hier die Unterteilung in 0 bis 3 Punkte beibehalten. Aufgrund der individuell sehr verschieden ausgeprägten Symptome der KSP, wäre eine unterschiedlich starke Wertung der einzelnen Parameter nicht gerechtfertigt. Bezüglich der Einordnung der Virulenz der vier Virusisolate hat die Einbeziehung der drei Parameter zu keiner Veränderung geführt. Das Isolat CSF 0634 wurde auch nach dem modifizierten Bewertungsschema als hoch virulent eingestuft während die Isolate CSF 0650, 0695 und 0277 als moderat virulent beurteilt wurden. Die drei Parameter stellen somit eine gute Ergänzung zu dem Clinical Score von MITTELHOZER et al. (2000) dar, vor allem unterliegen sie nicht der subjektiven Beurteilung durch den Untersucher. Ihre Gültigkeit sollte aber noch durch die Testung weiterer Virusisolate überprüft werden. 6. Zusammenfassung Claudia Bunzenthal Bestimmung der Virulenz von Virusisolaten der Klassischen Schweinepest Die Klassische Schweinepest wird durch ein Pestivirus (KSPV) aus der Familie der Flaviviridae verursacht. Seit ihrer Erstbeschreibung 1833 in Ohio (USA) wurden perakute bis chronische Verlaufsformen beschrieben. Für die unterschiedlichen klinischen Bilder der KSP werden neben der Virulenz des Erregers auch Wirtsfaktoren, wie Alter, Rasse und Immunstatus der Tiere postuliert. Bei den Seuchenausbrüchen der letzten Jahrzehnte entstand der Eindruck, dass vermehrt protrahierte und klinisch inapparente oder „atypische“ Krankheitsverläufe auftraten, die durch Infektion mit Virusisolaten von moderater bis schwacher Virulenz erklärt wurden. Es wurden mehrfach Studien durchgeführt, um die Virulenz bestimmter KSPV-Stämme zu quantifizieren, wobei jedoch keine einheitliche Definition gefunden wurde. In einem dieser Ansätze wurde ein Schema erstellt, dass die Virulenz von KSPVIsolaten über die Bestimmung einer klinischen Punktzahl (Clinical Score, CS) ermittelt (Mittelholzer et al., Vet. Microbiol., 2000; 74: 293-308). Ziel der vorliegenden Arbeit war, die Gültigkeit und Anwendbarkeit dieses Schemas zu überprüfen. Vier KSPV-Feldisolate wurden im Tierversuch daraufhin untersucht, ob sie sich anhand des Bewertungsschemas als hoch, moderat oder schwach virulent einordnen lassen. Dabei wurden je fünf Schweine mit einem Isolat infiziert. Eine eindeutige Zuordnung zu einer Virulenzkategorie war nur bei dem als hoch virulent eingestuften Isolat CSF 0634 möglich. Bei den Isolaten CSF 0650, 0695 und 0277 waren die Krankheitsverläufe bei den einzelnen Tieren einer Gruppe sehr verschieden. Sie reichten von schweren akuten Erkrankungen mit letalem Ausgang bis hin zu milderen transienten Verläufen mit vollständiger Genesung der Tiere und Entwicklung einer effektiven Immunantwort. Diese Virusisolate wurden aufgrund des durchschnittlichen Clinical Score als moderat virulent klassifiziert. Zusammenfassung 114 Im zweiten Teil dieser Arbeit wurde der Krankheitsverlauf der Klassischen Schweinepest von Hybridschweinen (DL x Pietrain) und Schweinen der Deutschen Landrasse verglichen. Die Tiere wurden mit den Isolaten CSF 0277 bzw. CSF 0634 infiziert. Im Gegensatz zu früheren Beobachtungen konnten keine Unterschiede im Krankheitsverlauf zwischen Kreuzungs- und Reinzuchttieren für die hier verwendeten Isolate festgestellt werden. Möglicherweise spielen Alter und Immunstatus der Tiere eine größere Rolle als die Rasse. Die Versuche zeigten, dass das Untersuchungsschema zur Ermittlung der Virulenz einzelner KSPV-Isolate zumindest im Tierversuch geeignet ist, jedoch mit der Einschränkung, dass eine ausreichende Zahl von Probanden infiziert werden muss, um die stark variierenden Krankheitsverläufe bei Infektion mit moderat virulenten Virusisolaten zu berücksichtigen. Zur Feststellung der Virulenz des KSPV in einem Bestand ist es nicht zu empfehlen, da hier Infektionszeitpunkt und Krankheitsverlauf nicht bekannt sind. Weitere Parameter wurden auf ihre Eignung für die Charakterisierung der Virulenz des KSPV untersucht. Der Pathological Score, die Inkubationszeit, Beginn und Dauer der Virämie und die Höhe des Virustiters im Serum waren nicht geeignet für die Einteilung der Virulenz. Die Bestimmung der Leukozytenzahl, die Bildung neutralisierender ergänzende Antikörper Parameter und dar. die Sie Untersuchungsschema einbezogen. Mortalität wurden in stellen das dagegen oben geeignete beschriebene Summary Claudia Bunzenthal Determination of the virulence of Classical Swine Fever Virus isolates Classical Swine Fever (CSF) is caused by a Pestivirus (CSFV) within the family Flaviviridae. Since the disease was first recognized 1833 in Ohio, USA, peracute to chronic forms have been described. It has been postulated that the changing clinical picture of CSF may be determined by the virulence of the virus itself, or due to host factors, as are age, breed and immune status of the animals. During the outbreaks of CSF in the last decades it was observed that more and more inapparent or “atypical” courses of the disease occured. This was attributed to the appearance of CSF viruses of moderate to low virulence. Several studies have been performed to categorize the virulence of CSFV strains, but up to date no feasible parameters have been defined. In one of these studies virulence of CSFV strains was determined by using a clinical score system (Mittelholzer et al., Vet. Microbiol., 2000; 74: 293-308). The aim of this work was to test this approach for its applicability. For this, four recent CSFV isolates were selected and each virus was used for infection of five pigs of the same age and breed. Only one isolate (CSF 0634) could be clearly assigned as highly virulent. Pigs infected with the other three isolates (CSF 0650, CSF 0695 and CSF 0277) developed differing clinical courses ranging from mild transient forms to the acute lethal form of CSF. These three CSFV isolates could be classified as moderately virulent by using the average clinical score. In the second part of this work an attempt was made to analyse the influence of the pig breed on the course of CSF. Pigs of the German landrace and crossbred weaners (DL x Pietrain) were infected with two of the isolates used in the first experiment (CSF 0277 and CSF 0634). In contrast to previously published findings, 116 Summary no differences in the course of the disease were observed, thus indicating that age and immune status of the pigs seem to be more relevant than the breed. In summary, it was found that the determination of the clinical score is suitable for classifying the virulence of CSFV isolates under experimental conditions only. In the field, this is not possible as the time of infection is unknown. In addition, due to the different clinical signs within one group of pigs, a sufficiently high number of animals has to be included. To find whether further parameters are adequate to supplement the clinical score determination scheme, the leucocyte count, the development of neutralising antibodies and the mortality rate were determined and found to be suitable. On the contrary incubation period, viraemia and the pathological score and the level of virus in the serum were not suitable. 7. Literaturverzeichnis ANONYMUS (1977): Characteristics of swine fever. In: Studies on the epidemiology and economics of swine fever eradication in the EEC. Commi. Europ. Commu., EUR 5738 e, S. 26-37 ANONYMUS (2001): Council Directive 2001/89/EC of 23. October 2001 on community measures for the control of classical swine fever. Official Journal of the European Communities , L 316/5-L 316/35 ANONYMUS (2000): List A diseases, Chapter 2.1.13: Classical swine fever, A. Diagnostic techniques. In: OFFICE INTERNATIONAL DES EPIZOOTIES (Hrsg.): Manual of Standards for Diagnostic Tests and Vaccines, 4th Edition. Off. Int. Epiz., Paris, 200-212 AYNAUD, J.-M., C. GALICHER, J. LOMBARD, C. BIBARD u. M. MIERZEJEWSKA (1972) : Peste porcine classique: les facteurs d’identification in vitro (marqueurs génétiques) du virus en relation avec le pourvoir pathogène pour le porc. Ann. Rech. Vét. 3, 209-235 AYNAUD, J.-M., u. B. Larenaudie (1976): Diagnosis of subclinical or atypical forms of swine fever. Demonstration of low virulent strains in tissue culture and detection of neutralising antibodies. In: Diagnosis and Epizootiology of classical swine fever Commi. Europ. Commu., EUR 5486, S.13-16 118 Literaturverzeichnis BICKHARDT, K. (1992): Tabellen der Referenzwerte. In: Kompendium der Allgemeinen Inneren Medizin und Pathophysiologie für Tierärzte. Verlag Paul Parey, Berlin, Hamburg, S. 193 BJORKLUND, H. V., T. STADEJEK, S. VILCEK u. S. BELAK (1998): Molecular characterization of the 3’ noncoding region of classical swine fever virus vaccine strains. Virus Genes 16, 307-312 BOEHM, K. H., I. S. ABDALLAH U. u. REUSS (1966): Vergleichender Antigen- und Antikörpernachweis bei der Schweinepest mittels der Agargelpräzipitation. Arch. Exp. Vet. Med. 20, 927-933 BUSCHMANN, H., H. KRÄUSSLICH, H. HERRMANN, J. MEYER u. A. KLEINSCHMIDT (1985): Quantitative immunological parameters in pigs – experiences with the evaluation of an immunocompetence profile. Z. Tierzüchtg. Züchtgsbiol. 102, 189-199 CARBREY, E. A., W. C. STEWARD, J. I. KRESSE u. M. L. SNYDER (1977): Inapparent hog cholera infection following the inoculation of field isolates. In: LIESS, B. (Hrsg.): Agricultural research seminar on Hog Cholera/Classical Swine Fever and African Swine Fever. Commi. Europ. Commu., EUR 5904, S. 214-230 CARBREY, E. A., W. C. STEWARD, J. I. KRESSE u. M. L. SNYDER (1980): Persistent hog cholera infection detected during virulence typing of 135 field isolates. Am. J. Vet. Res. 41, 946-949 Literaturverzeichnis 119 CAY, B., G. CHAPPUIS, C. O. Z. COULIBALY, Z. DINTER, S. EDWARDS, I. GREISER-WILKE, M. GUNN, P. HAVE, G. HESS, N. JUNTI, B. LIESS, A. MATEO, P. MCHUGH, V. MOENNIG, P. NETTLETON u. G. WENSVOORT (1989): Comparative analysis of monoclonal antibodies against pestiviruses: report of an international workshop. Vet. Microbiol. 20, 123-129 COLLETT, M. S., R. LARSON, C. GOLD, D. STRICK, D. K. ANDERSON u. A. F. PURCHIO (1988): Molecular cloning and nucleotid sequence of the pestivirus bovine viral diarrhoea virus. Virology 165, 191-199 COLLETT, M. S., M. A. WISKERCHEN, E. WELNIAK u. S. K. BELZER (1991): Bovine viral diarrhoea virus genomic organisation. In: LIESS, B., V. MOENNIG, J. POHLENZ u. G. TRAUTWEIN (Hrsg.): Ruminant pestivirus infections. Arch. Virol. (Suppl. 3), 19-27 DAHLE, J., B. LIESS u. H.-R. FREY (1987a): In: J. W. Harkness (Hrsg.): Pestivirus Infections of Ruminants. Commi. Europ. Commu. (Rep.), EUR-10238 EN, S. 195-211 DAHLE, J., B. LIESS u. H.-R. FREY (1987b): Übertragung von Pestiviren zwischen Tierarten: Experimentelle Infektion von Schweinen mit dem Virus der Bovinen Virus-Diarrhoe (BVD) und von Rindern mit dem Virus der Europäischen Schweinepest (ESP). Dtsch. Tierärztl. Wochenschr. 94, 590-594 120 Literaturverzeichnis DAHLE, J. u. B. LIESS (1992): A review on classical swine fever infections in pigs: epizootiology, clinical disease and pathology. Comp. Immun. Microbiol. Infect. Dis. 15, 203-211 DAHLE, J. u., B. LIESS (1995): Comparative study with cloned classical swine fever virus strain ALFORT and GLENTORF: clinical, pathological, virological and serological findings in weaner pigs. Wien. Tierärztl. Monatsschr. 82, 232-238 DARBYSHIRE, J. H. (1960): Serological relationship between swine fever and mucosal disease of cattle. Vet. Rec. 72, 331. DAVIES, G. (2002) : The foot and mouth disease (FMD) epidemic in the United Kingdom 2001. Comp. Immun. Microbiol. Infect. Dis. 25, 331-343 DEPNER , K. R., A. GRUBER u. B. LIESS (1992): Thermal and pH-stability of pestiviruses. Rev. Sci. Tech. Off. Int. Epiz. 11, 885-893 DEPNER , K. R., A. GRUBER u. B. LIESS (1994): Experimental infection of weaner pigs with a field isolate of Hog Cholera Classical Swine Fever Virus derived from a recent outbreak in Lower Saxony. I: Clinical, virological and serological findings. Wien. Tierärztl. Monatsschr. 81, 370-373 Literaturverzeichnis 121 DEPNER, K. R., A. MÜLLER, A. GRUBER, A. RODRIGQUEZ, K. BICKHARDT u. B. LIESS (1995): Classical swine fever in wild boar (Sus scrofa) – experimental infections and viral persistance. Dtsch. Tierärztl. Wochenschr. 102, 381-384 DEPNER, K. R., V. MOENNIG u. B. LIESS (1996a): Epidemiologische Betrachtungen zur „typischen“ und „atypischen“ Schweinepest. Amtstierärztlicher Dienst und Lebendmittelkontrolle IV, 335-342 DEPNER, K. R., A. RODRIQUEZ, J. POHLENZ u. B. LIESS ( 1996b) : Persistent classical swine fever virus infection in pigs infected after weaning with a virus isolated during 1995 epidemic in Germany : Clinical, virological, serological and pathological findings. Europ. J. Vet. Pathol. 2, 61-66 DEPNER, K. R., U. HINRICHS, K. BICKHARDT, I. GREISER-WILKE, J. POHLENZ, V. MOENNIG u. B. LIESS (1997): Influence of breed-related factors on the course of classical swine fever virus infection. Vet. Rec. 140, 506-507 DE SMIT, A. J., A. BOUMA, C. TERPSTRA u. J. T. VAN OIRSCHOT (1999) : Transmission of classical swine fever virus by artificial insemination. Vet. Microbiol. 67, 239-249 DUNNE, H. W., J. F. HOKANSON u. A. J. LUEDKE (1959): The pathogenesis of hog cholera. I. Route of entrance of the virus into the animal body. Am. J. Vet. Res. 20, 615-618 122 Literaturverzeichnis DUNNE, H. W. (1970): Hog Cholera. In: H. W. DUNNE (Hrsg.): Diseases of swine. Iowa State University Press, Ames, Iowa, U.S.A., 3rd Ed., S. 177-239 EDWARDS, S., J. J. SANDS u. J. W. HARKNESS (1989): The application of monoclonal antibody panels to characterize pestivirus isolates from ruminants in Great Britain. Arch. Virol. 102, 197-206 EDWARDS, S. (2000): Survival and inactivation of classical swine fever virus. Vet. Microbiol. 73, 175-181 ELBERS, A., A. STEGEMANN, H. MOSER, H. M. EKKER, J. A. SMAK u. F. H. PLUIMERS (1999): The classical swine fever epidemic 1997-1998 in the Netherlands: descriptive epidemiology. Prev. Vet. Med. 42, 157-184 ENZMANN, P. J., u. F. WEILAND (1978): Structural similarities of hog cholera virus with togaviruses. Arch. Virol. 57, 339-348 FLOEGEL-NIESMANN, G., A. WEHREND, K. R. DEPNER, J. FRITZEMEIER, D. WABERSKI u. V. MOENNIG (2000): Detection of classical swine fever virus in semen of infected boars. Vet. Microbiol. 77, 109-116 FLOEGEL-NIESMANN, G. (2002): Persönliche Mitteilung am 22. 04. 2002 Literaturverzeichnis 123 FRITZEMEIER, J., J. TEUFFERT, I. GREISER-WILKE, C. STAUBACH, H. SCHLÜTER u. V. MOENNIG (2000): Epidemiology of classical swine fever in Germany in the nineties. Vet. Microbiol. 77, 29-41 GOMEZ-VILLAMANDOS, E. RUIZ-VILLAMOR, F. J. SALGUERO, M. J. BAUTISTA, L. CARRASCO, C. SANCHEZ, M. QUEZADA u. M. A. SIERRA (1998): Immunohistochemical and ultrastructural evidence of Hog Cholera Virus infection of megacaryocytes in bone marrow and spleen. J. Comp. Path. 119, 111-119 GREISER- WILKE, I., V. MOENNIG, C. O. Z. COULIBALY, J. DAHLE. L. LEDER u. B. LIESS (1990): Identification of conserved epitopes on a hog cholera virus protein. Arch. Virol. 111, 213-225 GREISER-WILKE, I., K. E. DITTMAR, B. LIESS u. V. MOENNIG (1992): Heterogenous expression of the non-structural protein p80/125 in cells infected with different pestiviruses. J. Gen. Virol. 73, 47-52 GREISER-WILKE, I., K. R. DEPNER, J. FRITZEMEIER, L. HAAS u. V. MOENNIG (1998): Application of a computer program for genetic typing of classical swine fever virus isolates from Germany. J. Virol. Meth. 75, 141-150 124 Literaturverzeichnis GREISER-WILKE, I., B. ZIMMERMANN, J. FRITZEMEIER, G. FLOEGEL u. V. MOENNIG (2000 a): Structure and presentation of a World Wide Web database of CSF virus isolates held at the EU reference laboratory. Vet. Microbiol. 73, 131-136 GREISER-WILKE, I., J. FRITZEMEIER, F. KOENEN, H. VANDERHALLEN, D. RUTILI, G.-M. DE MIA, L. ROMERO, R. ROSELL, J. M. SANCHEZ-VIZCAINO u. A. SAN GABRIEL (2000 b): Molecular epidemiology of a large classical swine fever epidemic in the European Union in 1997-1998. Vet. Microbiol. 77, 17-27 GRUBER, A., K. R. DEPNER u. B. LIESS (1995): Experimental infection of weaner pigs with a field isolate of Hog Cholera Classical Swine Fever Virus derived from a recent outbreak in Lower Saxony. II. Pathological findings. Wien. Tierärztl. Monatsschr. 82, 179-184 HEENE, D., G. HOFFMANN-FEZER, R. HOFFMANN, E. WEISS, G. MÜLLERBERGHAUS u. H. G. LASCH (1971): Gerinnungsstörungen bei akuter Schweinepest. Beitr. Path. Bd. 144, 259-271 HOFFMANN, R., G. HOFFMANN-FEZER, B. KIMETO u. E. WEISS (1971): Mikrothromben als morphologischer Ausdruck einer Verbrauchskoagulopathie bei akuter Schweinepest. Zentralbl. Veterinärmed. B 18, 710-718 Literaturverzeichnis 125 HOFFMANN, R., G. HOFFMANN-FEZER u. E. WEISS (1971): Knochenmarksveränderungen bei akuter Schweinepest mit besonderer Berücksichtigung der thrombopoetischen Zellen. Berl. Münch. Tierärzt. Wochenschr. 84 (16), 301-305 HOFFMANN, R. (1976): Syndrome disseminierter intravasaler Gerinnung (Verbrauchskoagulopathie) bei Haustieren. Verlag Paul Parey, Berlin, Hamburg (Fortschr. Veterinärmed. 24) HOFMANN, M. A., K. BRECHTBÜHL u. N. STÄUBER (1994): Rapid characterization of new pestivirus strains by direct sequencing of PCRamplified c-DNA from the 5´-noncoding region. Arch. Virol. 139, 217-219 HORZINEK, M. C., E. RECZKO u. K. PETZOLD (1967): On the morphology of hog cholera virus. Arch. Ges. Virusforsch. 21, 475-478 HORZINEK, M. C. (1991): Pestiviruses – taxonomic perspectives Arch. Virol. [Suppl. 3], 1-5 KAMOLSIRIPRICHAIPORN, S., P. T. HOOPER, C. J. MORRISSY u. H. A. WESTBURY (1992): A comparison of the pathogenicity of two strains of hog cholera virus. 1. Clinical and pathological studies. 2. Virological studies. Aust. Vet. J. 69, 240-248 Literaturverzeichnis 126 KÄRBER, G. (1931): Beitrag zur kollektiven Behandlung pharmakologischer Reihenversuche. Arch. Exp. Pathol. Pharmakol. 162, 480 KORN, G., u. F. HACKE (1964): Nachweis eines sehr schwach virulenten nicht immunisierenden Schweinepestvirus nach Virulenzsteigerung im Verlaufe von Tierpassagen. Zentralbl. Veterinärmed. B 11, 40-49 KOSMIDOU, A. (1995): Differenzierung und Charakterisierung von Isolaten und Mutanten des Schweinepestvirus mittels monoklonaler Antikörper. Hannover, Tierärztl. Hochsch., Diss. KUBIN, G. (1967): In vitro Merkmale des Schweinepestvirus. Zentralbl. Veterinärmed. B 14, 543-552 LADDOMADA, A. (2000): Incidence and control of CSF in wild boar in Europe. Vet. Microbiol. 73, 121-130 LIESS, B., H.-R. FREY, U. BUKSCH, B. ROEDER u. J. FROST (1976): Hog cholera viral antigens and some resent results on the relationship to envelop antigens of bovine viral diarrhea-mucosal disease virions. Commi. Europ. Commu., EUR 5451, S. 333-346 LIESS, B., H.-R. FREY u. D. PRAGER (1977): Antibody response of pigs following experimental infections with strains of hog cholera and bovine viral diarrhea virus. Comm. Europ. Commun. Publ. No. EUR 5904, 23-33 Literaturverzeichnis 127 LIESS, B. (1987): Pathogenesis and Epidemiology of Hog Cholera. Ann. Rech. Vet. 18, 139-145 LIN, T. C., Y. SHIMIZU, T. KUMAGAI u. J. SAHARA (1969): Pathogenesis of hog cholera infection in experimentally inoculated swine. Nat. Inst. Anim. Quart. 9, 20-27 LOAN, R. W. u., M. M. STORM (1968): Propagation and transmission of hog cholera virus in non-porcine hosts. Am. J. Vet. Res. 29, 807-811 LOWINGS J. P., D. J. PATON, J. J. SANDS, G. M. DE MIA u. D. RUTILI (1994): Classical swine fever: genetic detection and analysis of differences between virus isolates. J. Gen. Virol. 75, 3461-3468 LOWINGS J. P., G. IBATA, J. NEEDHAM u. D. PATON (1996): Classical swine fever virus diversity and evolution. J. Gen. Virol. 77, 1311-1321 MAYER, D., M. A. HOFMANN u. J.-D. TRATSCHIN (2002): The presence but not the origin of the viral auto-protease Npro is essential for virulence in CSFV. In: 5th Pestivirus Symposium; St. Johns College, Cambridge, UK, 26th-29th August, S. 18 McKERCHER, P. D., W. R. HESS u. F. HAMDY (1978): Residual viruses in pork products. Appl. Environ. Microbiol. 35, 142 128 Literaturverzeichnis MENGELING, W. L. u., R. A. PACKER (1969): Pathogenesis of chronic hog cholera: Host response. Am. J. Vet. Res. 30, 409-417 MEYERS, H., B. LIESS, H. R. FREY, W. HERMANNS u. G. TRAUTWEIN (1981): Experimental transplancental transmission of hog cholera virus in pigs. IV. Virological and serological studies in newborn piglets. J. Vet. Med. B 28, 659-668 MEYERS, G., T. RÜMENAPF u. H. J. THIEL (1989): Molecular cloning and nucleotide sequence of the genome of hog cholera virus. Virology 171, 555-567 MEYERS, G. u., H. J. THIEL (1996): Molecular characterization of pestiviruses. Adv. Virus Res. 47, 53-118 MEYERS, G., A. SAALMÜLLER u. M. BÜTTNER (1999): Mutations abrogating the Rnase activity in glycoprotein Erns of the pestivirus classical swine fever virus lead to virus attenuation. J. Virol. 73, 10224-10235 MITTELHOLZER, C., C. MOSER, J.-D. TRATSCHIN u. M. A. HOFMANN (1997): Generation of cytopathogenic subgenomic RNA of classical swine fever virus in persistently infected porcine cell lines. Virus Res. 51, 125-137 MITTELHOLZER, C., C. MOSER, J.-D. TRATSCHIN u. M. A. HOFMANN (2000): Analysis of classical swine fever virus replication kinetics allows differentiation of highly virulent from avirulent strains. Vet. Microbiol. 74, 293-308 Literaturverzeichnis 129 MOENNIG, V. (1988): Characteristics of the virus. In: LIESS, B. (Ed.): Classical swine fever and related infections. Martinus Nijhoff, Boston, Dordrecht, Lancaster, 55-80 MOENNIG, V. u., P. G. W. Plagemann (1992): The pestivirus. Adv. Virus Res. 41, 53-98 MOENNIG, V. (2000): Introduction to classical swine fever: virus, disease and control policy Vet. Microbiol. 73, 93-102 MOENNIG, V., G. FLOEGEL-NIESMANN u. I. GREISER-WILKE (2002): Clinical Signs and Epidemiology of Classical Swine Fever: A Review of New Knowledge. Vet. J. 161, 1-10 MOORMANN, R. u., M. M. HULST (1988): Hog cholera virus: identification and characterization of the virus-specific RNA synthesized in infected swine kidney cells. Virus Res. 11, 281-291 MOORMANN, R., P. M. WARMEDAM, B. VON DER MEER, W. M. M. SCHAAPERG, G. WENSVOORT u. M. M. HULST (1990): Molecular cloning and nucleotide sequence of hog cholera virus strain Brescia and mapping of the genomic region encoding envelope protein E1. Virology 167, 184-198 130 Literaturverzeichnis MOORMANN, R. J. M., H. G. P. VAN GENNIP, G. K. W. MIEDEMA, M. M. HULST u. P. A. VAN RIJN (1996): Infectious RNA transcribed from an engineered full-length cDNA template of the genome of a pestivirus. J. Virol. 70 (2), 763-770 NEUKIRCH, M., B. LIESS, H.-R. FREY u. D. PRAGER (1980): Serologische Beziehungen zwischen Stämmen des Europäischen Schweinepestvirus und dem Virus der Bovinen Virusdiarrhoe. Fortschr. Veterinärmed. 30, 148-153 PATON D. J., A. McGOLDRICK, I. GREISER-WILKE, S. PARCHARIYANON, J. Y. SONG, P. P. LIOU, T. STADEJEK, J. P. LOWINGS, H. BJORKLUND u. S. BELAK (2000): Genetic typing of classical swine fever virus. Vet. Microbiol. 73, 137-157 PETERS, W., I. GREISER-WILKE, V. MOENNIG, u. B. LIESS (1986): Preliminary serological characterization of bovine viral diarrhea virus strains using monoclonal antibodies. Vet. Microbiol. 12, 195-200 PLATEAU, E., P. VANNIER u. J. P. TILLON (1980): Experimental study of a mild virulence strain of Hog Cholera: individual variations and horizontal transmission. Zentralbl. Veterinärmed. B 27, 650-657 RESSANG, A. A. (1973): Studies on the pathogenesis of hog cholera. I. Demonstration of hog cholera virus subsequent to oral exposure. Zentralbl. Veterinärmed. B 20, 256-271 Literaturverzeichnis 131 RESSANG, A. A. (1973): Studies on the pathogenesis of hog cholera. II. Virus distribution in tissue and the morphology of immune response. Zentralbl. Veterinärmed. B 20, 272-288 ROLLE u., MAYR (1993): Definitionen. In: MAYR, A. (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. Ferdinand Enke Verlag, Stuttgart, 6. Auflage, S. 5 RUGGLI, N., J.-D. TRATSCHIN, C. MITTELHOLZER, u. M. A. HOFMANN (1996): Nucleotide sequence of classical swine fever virus strain Alfort/187 and transcription of infectious RNA from stably cloned full-length cDNA. J. Virol. 70, 3478-3487 RUGGLI, N. (2002): Persönliche Mitteilung am 15.11.2002 RÜMENAPF, T., G. MEYERS, R. STARK u. H.-J. THIEL (1989): Hog cholera virus – characterization of specific antiserum and identification of cDNA clones. Virology 171, 18-27 RÜMENAPF, T., G. MEYERS, R. STARK u. H.-J. THIEL (1991): Structural proteins of hog cholera virus expressed by vaccina virus: further characterization and induction of protective immunity. J. Virol. 65, 589-597 RÜMENAPF, T., G. UNGER, J. H. STRAUSS u. H.-J. THIEL (1993): Processing of the envelope glycoproteins of pestiviruses. J. Virol. 67, 3288-3294 132 Literaturverzeichnis SANDVIK, T., T. DREW u. D. PATON (2000): CSF virus in East Anglia: where from? Vet. Rec. 147, 251 SHIMUZU, M. u., T. KUMAGAI (1989): Experimental infection of pregnant goats with swine fever virus. Vet. Microbiol. 20, 207-214 SIZOWA, D. V., V. G. KOLUPAEVA, T. V. PESTOVA, I. N. SHATSKY u. C. U. T. HELLEN (1998): Specific interaction of eukaryotic translation inition factor 3 with the 5’ nontranslated regions of hepatitis C virus and classical swine fever virus. J. Virol. 72, 4775-4782 SNOWDON, W. A. u., E. L. FRENCH (1968): The bovine mucosal-disease swine-fever virus complex. Aust. Vet. J. 44, 179-184 SOOS, P., H. J. SCHUBERT u. K. R. DEPNER (2000): Effects of classical swine fever virus infection on the porcine leucocyte subsets. Acta vet. hung. 48 (1), 35-42 STEGEMANN, J. A., A. BOURMA, A. R. W. ELBERS u. J. H. M. VERHEIJDEN (2000): The white blood cell count is a valuable parameter for detecting classical swine fever. Tijdschr. Diergeneeskd. 125, 511-518 SUMMERFIELD, A., M. A. HOFMAN u. K. C. McCULLOUGH (1998): Low density blood granulocytic cells induced during classical swine fever are targets for virus infection. Vet. Immun. Immunopathol. 63, 289-301 Literaturverzeichnis 133 SUMMERFIELD, A., S. M. KNOETIG, R. TSCHUDIN u. K. C. McCULLOUGH (2000): Pathogenesis of granulocytopenia and bone marrow atrophy during classical swine fever involves apoptosis and necrosis of uninfected cells. Virology 272, 50-60 SUSA, M., M. KÖNIG, A. SAALMÜLLER, M. J. REDDEHASE u. H.-J. THIEL (1992): Pathogenesis of classical swine fever: B-Lymphocyte deficiency caused by hog cholera virus. J. Virol. 66, 1171-1175 TERPSTRA, C. u., A. J. SMIT (2000): The 1997/1998 epizootic of swine fever in the Netherlands: control strategies under a non-vaccination regimen. Vet. Microbiol. 77, 3-15 TRATSCHIN, J.-D, C. MOSER, N. RUGGLI u. M. A. HOFMANN (1998): Classical swine fever virus leader proteinase Npro is not required for viral replication in cell culture. J. Virol. 72, 7681-7684 TRAUTWEIN, G. (1988): Pathology and pathogenesis of the disease. In: B. LIESS (Ed.): Classical Swine Fever and Related Viral Infections. Martinus Nijhoff Publishing, Boston/Dordrecht/Lancaster, 27-54 UTTENTHAL, A., M.-F. Le POTIER, L. ROMERO, G. M. De MIA, G. FLOEGELNIESMANN (2001): Classical swine fever (CSF) marker vaccine. Trial I: Challenge studies in weaner pigs. Vet. Microbiol. 83, 85-106 134 Literaturverzeichnis UTTENTHAL, A., T. STORGAARD, M. B. OLEKSIEWICZ, K. DE STRICKER (2003): Experimental infection with the Paderborn isolate of classical swine fever virus in 10week-old pigs: determination of viral replication kinetics by quantitative RT-PCR, virus isolation and antigen ELISA. Vet. Microbiol. 92, 197-212 VAN OIRSCHOT, J. T. u., C. TERPSTRA (1977): A congential persistent swine fever infection. I. Clinical and virological observations. Vet. Microbiol. 2,121-132 VAN OIRSCHOT, J. T. (1979a): Experimental production of congenital persistent swine fever infections. I. Clinical, pathological and virological observations. Vet. Microbiol. 4, 117-132 VAN OIRSCHOT, J. T. (1979b): Experimental production of congenital persistent swine fever infections II. Effects on functions of immune system. Vet. Microbiol. 4, 133-147 VAN OIRSCHOT, J. T. (1988): Description of the virus infection. In: LIESS, B. (Hrsg.): Classical Swine Fever and Related Viral Infections. Martinus Nijhoff Publishing, Boston/Dordrecht/Lancaster, S.1-25 VAN OIRSCHOT, J. T. (1999): Classical swine fever (Hog cholera). In: W. L. MENGELING (Hrsg.): Diseases of swine. Iowa State University Press, Ames, Iowa, U.S.A., 8th Ed., S. 159-172 Literaturverzeichnis 135 VLASOVA, A., T. GREBENIKOVA, A. D. ZABEREZHNY, I. GREISER-WILKE, G. FLOEGEL-NIESMANN, V. KURINNOV, S. TSYBANOV, T. ALIPER u. E. NEPOKLONOV (2000): Molecular epidemiological study of classical swine fever virus field isolates from Russian Federation. In: Proceedings of the 5th International Congress, European Society for Veterinary Virology, Brescia, Italy, S. 431-432 WEILAND, E., R. STARK, B. HAAS, T. RÜMENAPF, G. MEYERS u. H.-J. THIEL (1990): Pestivirus glycoprotein with induces neutralizing antibodies form a part of a disulfidlinked heterodimer. J. Virol. 64, 3563-3569 WEILAND, E., R. AHL, R. STARK, F. WEILAND u. H.-J. THIEL (1992): A second envelope glycoprotein mediates neutralization of a pestivirus, hog cholera virus. J. Virol. 66, 3677-3682 WEISS, E., A. TERDEDESAI, R. HOFFMANN u. G. HOFFMANN-FEZER (1973): Volume distribution and ultrastructure of platelets in acute hog cholera. Thrombos. Diathes. Haemorrh. 30, 371-380 WENGLER, G., D. W. BRADLEY, M. S. COLLETT, F. X. HEINZ, R. W. SCHLESINGER u. J. H. STRAUSS (1995): Family Flaviviridae. In: MURPHY F. A., C. M. FAUQUET, D. H. L. BISHOP, S. A. GHABRIAL, A. W. JARVIS, G. P. MARTELLI, M. A. MAYO u. M. D. SUMMERS (Hrsg.): Virus Taxonomy. Sixth report of the International Committee on taxonomy of viruses. Springer Verlag, Wien, New York, S. 415-427 136 Literaturverzeichnis WENSVOORT, G., C. TERPSTRA, J. BOONSTRA, M. BLOEMRAAD, D. VAN ZAANE (1986): Production of monoclonal antibodies against swine fever virus and their use in laboratory diagnosis. Vet. Microbiol. 12, 101-108 WESTAWAY, E. G., M. A. BRINTON, S. Y. A. GAIDAMOVICH, M. C. HORZINEK, A. IGARACHI, L. KÄÄRIÄINEN, D. K. LVOV, J. S. PORTERFIELD, P. K. RUSSEL u. D. W. TRENT (1985): Flaviviridae. Intervirology 24, 183-192 WONG, M.-L., B.-Y. PENG, J.-J. LIU u. T.-J. CHANG (2001): Cloning and Sequencing of Full-Length cDNA of Classical Swine Fever Virus LPC Strain. Virus Genes 23 (2), 187-192 WONNEMANN, H., G. FLOEGEL-NIESMANN, V. MOENNIG u. I. GREISER-WILKE (2001): Genetic typing of classical swine fever isolates from Germany. Dtsch. Tierärztl. Wochenschr. 108, 252-256 WOOD, L., S. BROCKMANN, J. W. HARKNESS u. S. EDWARDS (1988): Classical swine fever: virulence and tissue distribution of a 1986 English isolate in pigs. Vet. Rec. 122, 391-394 Literaturverzeichnis 137 WU, H. X., J. F. WANG, C. Y. ZHANG, L. Z. FU, Z. S. PAN, N. WANG, P. W. ZHANG u. W. G. ZHAO (2001): Attenuated lapinized chinese strain of classical swine fever virus: complete nucleotide sequence and character of 3’ noncoding region. Virus Genes 23 (1), 69-76 8. Anhang 8.1 Tabellen Tab. 29: Körpertemperatur in °C bei Infektion mit CSF 0650 DPI TIER 80 TIER 81 TIER 82 TIER 83 TIER 102 0 39,4 39,3 39,5 39,3 38,8 1 39,6 39,3 39,7 38,9 39,1 2 39,7 39,1 39,3 39,5 38,9 3 39,6 39,5 39,5 39,2 39,3 4 41,6 41,5 40,3 39,9 39,9 5 41,7 41,8 40,6 40,3 41 6 40,9 41,3 40,7 40,2 40,7 7 41,2 41,7 39,8 40,6 40,7 8 40,2 42,0 40,0 40,0 40,7 9 41,1 41,5 39,9 39,3 39,8 10 40,8 41,4 39,9 39,5 39,2 11 40,5 41,4 39,8 39,5 39,2 12 39,6 40,7 † 39,6 39,3 39,3 13 39,7 39,7 38,7 39,3 14 39,5 39,5 38,7 38,7 15 39,4 39,8 39,1 38,9 16 39,5 39,2 38,8 38,6 17 39,3 39,2 38,6 38,7 18 38,9 39,7 39,0 39,0 19 38,8 39,6 39,1 38,6 20 39,2 39,5 38,8 38,5 Anhang 139 Tab. 30: Körpertemperatur in °C bei Infektion mit CSF 0695 DPI TIER 84 TIER 85 TIER 86 TIER 87 TIER 88 0 39,4 39,3 39,1 39,2 39,4 1 39,0 39,2 39,6 39,1 39,2 2 39,3 38,9 39,1 39,2 39,0 3 39,9 40,3 39,7 40,3 40 4 41,0 41,8 40,7 41,4 41,5 5 41,5 40,9 40,7 40,8 40,5 6 40,7 41,2 40,2 40,9 41,0 7 39,6 41,4 39,9 40,8 39,8 8 39,5 40,8 39,4 39,9 39,6 9 39,7 40,5 39,5 40,9 39,2 10 39,4 40,8 39,6 40,6 39,7 11 39,2 40,3 † 39,4 41,5 39,5 12 39,1 39,3 42,2 39,6 13 38,7 39,0 38,5 † 39,1 14 38,7 39,3 39,5 15 39,2 39,5 39,7 16 38,8 39,2 39,4 17 38,6 39,1 39,2 18 38,7 38,8 38,9 19 38,6 39,0 39,0 20 38,7 38,6 38,8 Anhang 140 Tab. 31: Körpertemperatur in °C bei Infektion mit CSF 0634 DPI TIER 89 TIER 90 TIER 91 TIER 92 TIER 93 0 39,5 39,7 39,3 39,5 39,5 1 39,4 39,6 39,5 39,4 39,6 2 39,7 39,5 39,4 39,6 39,4 3 39,2 39,1 39,9 39,4 39,3 4 38,7 39,3 39,5 39,1 38,8 5 39,6 41,4 40,8 40,1 39,5 6 41,0 41,0 41,5 40,8 39,8 7 41,7 41,6 41,4 40,4 39,9 8 41,9 41,4 41,5 40,2 40,6 9 40,5 41,7 41,1 40,3 40,7 10 40,3 41,0 41,4 41,0 40,6 11 42,2 42,4 41,8 40,1 41,4 12 41,0 41,0 41,0 40,5 40,9 13 41,6 40,3 38,0 † 41,2 41,0 14 41,0 40,0 † 40,3 41,0 15 41,0 † 41,0 40,9 16 41,4 40,3 17 40,8 40,1 † 18 40,2 19 40,6 20 41,5 † Anhang 141 Tab. 32: Körpertemperatur in °C bei Infektion mit CSF 0277 DPI TIER 94 TIER 95 TIER 96 TIER 97 TIER 98 0 39,0 39,5 39,4 39,4 39,3 1 39,7 39,5 39,5 39,4 39,6 2 39,7 39,6 39,7 39,5 39,5 3 39,3 39,7 39,5 39,6 39,5 4 39,5 39,9 39,4 39,5 39,7 5 39,6 39,7 39,8 39,6 39,7 6 40,2 41,2 40,0 40,5 40,0 7 40,6 40,7 41,0 40,0 40,2 8 40,8 41,0 41,7 40,2 40,4 9 40,2 40,8 41,5 40,5 40,9 10 40,3 40,8 41,1 40,1 40,6 11 40,3 41,8 † 41,0 40,1 41,0 12 42,0 40,7 40,5 41,7 13 40,2 40,7 39,7 41,2 14 40,0 40,5 39,6 41,0 15 39,7 39,2 39,0 40,8 16 40,3 39,4 39,5 40,3 † 17 40,6 38,5 39,7 18 40,8 † 39,0 39,1 19 39,1 38,4 20 39,5 38,9 Anhang 142 Tab. 33: Leukozytenzahlen in G/l bei Infektion mit CSF 0650 DPI TIER 80 TIER 81 TIER 82 TIER 83 TIER 102 0 23,9 15,2 16,8 16,4 16,3 4 12,7 9,4 9,1 10,6 14,2 7 7,3 6,2 12,8 6,5 9 11 4,9 9 15,2 10 14,2 14 7,7 15,4 15,2 17,7 18 11 18,3 18,8 14,4 21 14,3 18,5 17,7 24 18,3 17,8 18,8 Tab. 34: Leukozytenzahlen in G/l bei Infektion mit CSF 0695 DPI TIER 84 TIER 85 TIER 86 TIER 87 TIER 88 0 20,2 17,3 22,8 21,1 18,9 4 4,4 4,6 8,5 11,7 11,4 7 4,4 4,9 10,2 6,2 9,7 11 6,3 2,0 18,8 2,3 13,4 14 9,7 17,4 2,6 15,0 18 9,9 19,3 15,4 21 14,2 14 14,0 24 16,2 14,4 Anhang 143 Tab. 35: Leukozytenzahlen in G/l bei Infektion mit CSF 0634 DPI TIER 89 TIER 90 TIER 91 TIER 92 TIER 93 0 14,5 16,8 18,6 18,9 28,5 4 11,3 14,7 9,4 22,1 11,6 7 6,0 10,2 10,0 9,1 7,4 11 5,1 6,4 6,2 6,0 5,2 14 9,2 6,7 8,8 12,3 10,0 4,2 18 Tab. 36: Leukozytenzahlen in G/l bei Infektion mit CSF 0277 DPI TIER 95 TIER 96 TIER 97 TIER 98 0 19,9 22,6 16,1 18,3 4 4,7 12,2 9,7 16,9 7 9,1 9,2 8,8 8,4 11 5,7 17,6 8,3 5,9 14 16,2 12,4 7,2 18 15,7 14,7 21 19,5 13,8 25 18,7 15,1 Anhang 144 Tab. 37: Körpertemperatur in °C bei Infektion mit CSF 0277 (Deutsche Landrasse) DPI TIER 129 TIER 130 TIER 131 TIER 132 TIER 133 0 38,8 38,9 38,7 38,6 38,8 1 38,7 38,7 38,8 38,9 38,9 2 38,7 39,1 39,0 38,9 39,2 3 38,6 39,1 38,8 38,8 39,0 4 38,9 39,2 39,4 39,2 39,8 5 39,0 39,3 39,6 39,6 40,3 6 39,8 39,9 39,8 40,0 40,0 7 40,4 39,6 39,7 39,6 39,8 8 39,7 39,7 39,2 39,7 39,8 9 40,4 39,5 39,0 39,0 39,7 10 39,6 39,3 39,3 39,3 39,8 11 39,3 39,3 39,2 39,2 39,0 12 39,3 39,0 38,7 38,6 39,3 13 39,0 39,2 39,0 39,2 39,8 14 39,2 39,0 39,2 39,1 38,9 15 38,9 39,0 38,8 38,8 39,3 16 38,6 39,0 38,7 38,9 39,0 17 39,6 39,3 39,0 38,9 39,3 18 39,3 39,5 39,1 39,3 39,0 19 38,8 39,2 39,0 39,2 39,0 20 38,6 39,1 38,8 38,9 39,2 Anhang 145 Tab. 38: Körpertemperatur in °C bei Infektion mit CSF 0277 (Hybridschweine) DPI TIER 134 TIER 135 TIER 136 TIER 137 TIER 138 0 38,9 39,3 39,0 39,0 38,8 1 38,8 38,7 39,3 38,9 38,8 2 38,7 38,9 39,2 39,3 39,3 3 39,0 39,3 39,2 39,3 39,3 4 38,9 39,6 39,6 39,6 39,8 5 39,2 39,3 39,6 39,8 39,7 6 39,6 39,7 39,8 40,5 40,1 7 39,8 39,8 39,8 40,3 40,5 8 40,4 40,2 40,3 40,3 40,6 9 40,2 40,2 40,0 40,0 39,8 10 39,7 40,3 40,8 39,8 39,7 11 40,5 40,0 39,8 39,5 39,5 12 39,5 39,0 39,3 39,7 39,2 13 39,6 39,3 39,8 39,2 39,3 14 39,5 39,5 39,8 39,5 39,7 15 39,5 39,2 39,3 39,3 39,1 16 38,6 39,1 39,2 39,5 39,2 17 38,7 39,1 39,3 39,4 39,2 18 38,7 39,4 39,5 39,4 39,0 19 39,3 39,0 39,4 39,0 38,9 20 39,2 39,0 39,5 38,8 39,0 Anhang 146 Tab. 39: Körpertemperatur in °C bei Infektion mit CSF 0634 (Deutsche Landrasse) DPI TIER 141 TIER 142 TIER 143 TIER 144 TIER 145 0 39,1 38,7 38,7 38,9 38,5 1 38,8 38,7 38,9 38,6 38,7 2 39,2 39,2 39,6 39,8 39,3 3 38,9 39,3 39,4 39,4 39,1 4 39,0 39,1 39,6 39,2 39,1 5 39,4 39,5 40,0 39,0 39,6 6 40,2 40,0 40,0 40,2 40,0 7 40,7 39,7 39,8 40,0 40,6 8 40,8 40,3 40,6 40,5 41,0 9 41,3 40,5 40,3 40,0 41,2 10 40,8 41,6 41,0 40,7 41,0 11 40,0 40,9 39,9 41,0 40,8 12 41,0 41,0 40,6 41,0 40,9 13 40,3 41,6 40,5 40,6 39,8 † 14 40,6 40,4 40,2 41,1 15 40,3 40,7 41,0 41,2 16 40,5 41,3 41,0 40,8 17 40,3 41,2 41,0 40,7 18 39,8 40,9 40,1 41,0 19 41,7 41,2 40,9 41,0 20 40,4 41,2 41,1 40,9 21 39,9 39,9 39,1 39,9 22 40,4 40,4 39,9 40,7 23 40,3 40,0 40,0 39,9 24 39,7 37,5 † 39,1 39,5 25 38,1 † 39,1 † 39,2 † Anhang 147 Tab. 40: Körpertemperatur in °C bei Infektion mit CSF 0634 (Hybridschweine) DPI TIER 146 TIER 147 TIER 148 TIER 149 TIER 150 0 38,8 38,7 39,4 38,6 38,9 1 38,9 39,3 39,2 38,6 38,8 2 38,8 39,3 39,2 39,3 39,2 3 39,2 39,2 39,4 38,9 39,2 4 39,4 39,3 39,7 39,7 39,5 5 39,3 39,8 41,0 39,9 40,0 6 39,6 40,6 40,8 40,2 40,3 7 40,0 40,0 41,1 40,7 40,3 8 40,4 40,4 41,2 40,3 41,0 9 40,8 40,6 40,3 40,5 41,0 10 41,0 41,0 41,3 40,8 41,0 11 41,2 41,6 41,0 41,0 41,5 12 41,6 41,4 41,6 41,8 41,7 13 41,3 41,5 41,8 40,0 41,6 14 41,0 40,9 42,0 41,2 40,8 15 41,0 41,0 40,6 † 41,3 40,0 16 41,0 40,9 41,7 38,7 † 17 40,8 41,0 41,0 18 40,2 40,8 38,5 † 19 40,0 41,1 20 40,3 † 40,7 † Anhang 148 Tab. 41: Leukozytenzahlen in G/l bei Infektion mit CSF 0277 (Deutsche Landrasse) DPI TIER 129 TIER 130 TIER 131 TIER 132 TIER 133 0 15,8 16,1 19,3 16,2 16,8 4 10,4 8,9 8,9 6,8 11,5 7 7,6 10,9 13,4 7,4 9,7 11 9,6 16,2 15,8 15,8 21,3 14 17,7 17,2 16,2 17,6 20,6 18 19,5 14,4 16,7 17,2 18,4 21 20,2 13,8 14,6 15,6 15,4 25 19,4 14,1 15,6 18,0 19,9 Tab. 42: Leukozytenzahlen in G/l bei Infektion mit CSF 0277 (Hybridschweine) DPI TIER 134 TIER 135 TIER 136 TIER 137 TIER 138 0 21,1 17,7 19,9 17,0 15,6 4 7,6 17,5 12,0 16,2 7,6 7 6,7 7,4 6,9 9,8 9,0 11 13,9 15,7 17,9 22,5 8,1 14 17,8 12,6 16,3 23,2 15,0 18 19,4 14,5 13,1 19,6 15,5 21 16,3 14,8 15,2 18,8 16,6 25 17,5 11,5 16,4 19,3 14,9 Anhang 149 Tab. 43: Leukozytenzahlen in G/l bei Infektion mit CSF 0634 (Deutsche Landrasse) DPI TIER 141 TIER 142 TIER 143 TIER 144 TIER 145 0 13,7 14,4 25,4 17,4 18,4 4 8,7 9,6 12,0 10,3 6,9 7 5,8 6,6 11,3 8,1 10,8 11 3,2 5,1 5,0 8,6 2,8 14 3,5 6,6 8,0 9,4 1,7 18 4,0 3,5 5,3 7,1 21 1,7 3,5 3,7 5,6 25 2,4 4,2 7,2 Tab. 44: Leukozytenzahlen in G/l bei Infektion mit CSF 0634 (Hybridschweine) DPI TIER 146 TIER 147 TIER 148 TIER 149 TIER 150 0 22,5 13,9 19,7 20,7 18,7 4 10,7 5,3 9,0 11,1 13,4 7 7,3 3,7 6,0 10,6 12,2 11 7,6 3,5 8,2 12,3 10,5 14 4,2 4,2 1,6 11,0 5,4 18 7,4 3,4 21 6,2 5,4 1,2 Anhang 150 8.2 Zusammensetzung der verwendeten Medien und Reagenzien 8.2.1 Zellkulturmedien MEM (minimum essential medium)-Earle (Medium für die Zelllinie Niere/PK(15)A) MEM-Earle-Fertigpulver1 9,60 g NaHCO3 2,20 g Aqua bidest. ster. ad 1000,00 ml Fetales Kälberserum2 50 ml Der pH-Wert wurde durch CO2-Begasung auf 7,0 eingestellt. EDulb (EMEM [Eagle’s minimum essential medium], modifiziert nach DULBECCO und FREEMAN [1959]) (Medium für Virustitration, Virusneutralisationstest und Virusisolierung) EDulb-Pulvermedium3 13,53 g 2,20 g NaHCO3 Penicillin G4 Streptomycin Sulfat 0,06 g 5 Aqua bidest. ster. 0,05 g ad 1000,00 ml Der pH-Wert wurde durch CO2-Begasung auf 6,9 eingestellt. 1 Fa. Gibco, BRL, Eggenheim, Kat.-Nr. 61100-087 2 Fa. Biochrom, Berlin, Kat.-Nr. 0115 3 Fa. Serva, Heidelberg, Art.-Nr. 47303 4 Fa. Sigma-Aldrich Chemie GmbH, Deisenhofen, Prod.-Nr. P 3032 5 Fa. Sigma-Aldrich Chemie GmbH, Deisenhofen, Prod.-Nr. S 9137 Anhang 151 8.2.2 Reagenzien 8.2.2.1 Puffer PBS (Phosphatpuffer pH 7,0-7,2; DULBECCO u. VOGT (1954)) NaCl 8,00 g KCl 0,20 g NaHPO4 x 12 H2O 2,37 g KH2PO4 0,20 g CaCl2 x 2 H2O 0,13 g MgCl2 x 6 H2O 0,10 g Aqua bidest. ster. ad 1000,00 ml PBS/Tween PBS Tween® 206 1000,00 ml 100,00 µl PBSM (Phosphatpuffer ohne Kalzium und Magnesium mit Phenolrot und Dextrose, pH 7,3) NaCl 8,00 g KCl 0,20 g NaHPO4 x 12 H2O 2,37 g KH2PO4 0,20 g Dextrose 1,00 g Phenolrot 0,016 g Aqua bidest. ster. 6 Fa. Merck, Darmstadt, Art.-Nr. 109280 ad 1000,00 ml Anhang 152 8.2.2.2 Lösungen ATV (adjusted trypsin-versen)-Lösung NaCl 8,00 g KCl 0,40 g NaHCO3 0,58 g Dextrose 1,00 g Trypsin (3U/mg)7 0,50 g EDTA (Versen) 0,20 g Aqua bidest. ster. ad 1000,00 ml Lagerung bei –20 °C, nach dem Auftauen nicht erneut einfrieren. AEC-Lösung 3-Amino-9-Ethylcarbazol (AEC)8 Dimethylformamid Natriumazetat-Puffer H2O2 (3%) 20,00 mg 3,00 ml ad 50,00 ml 0,40 ml 1000 mg 3-Amino-9-Ethylcarbazol und 150 ml Dimethylformamid wurden für 3 Monate bei 4 °C gelagert. Dextranlösung 5%ig Dextransulfat-Na-Salz 5g EDTA-Lösung (1,5%) ad 100 ml Auflösen im Wasserbad bei 45 °C und anschließend autoklavieren. 7 Fa. Serva, Heidelberg, Art.-Nr. 37290 8 Fa. Sigma-Aldrich Chemie GmbH, Deisenhofen, Prod.-Nr. A5754 Anhang 153 8.3 Sonstige Chemikalien Calciumchlorid Merck, Darmstadt 102083 Dextrose Riedel-de Haen, Seelze 16325 Dimethylformamid Merck, Darmstadt 103053 EDTA Merck, Darmstadt 108418 Glycin Jürgens, Hannover 4201.1000 Kaliumchlorid Merck, Darmstadt 104934 Kaliumdihydrogenphosphat Merck, Darmstadt 112034 (Di)Kaliumhydrogenphosphat Merck, Darmstadt 105109 Magnesiumchlorid Merck, Darmstadt 814733 Natriumazetat Merck, Darmstadt 101539 Natriumchlorid Merck, Darmstadt 1.06404.5004 Natriumdodecylsulfat (SDS) Carl Roth, Karlsruhe 2326.2 Natriumhydrogencarbonat Merck, Darmstadt 106329 Natriumhydrogenphosphat Merck, Darmstadt 106352 Tris(hydroxmethyl)aminomethan p. A. Merck, Darmstadt 1.08382 Wasserstoffperoxid 30% Merck, Darmstadt 107209 Anhang 154 8.4 Geräte und Gebrauchsgegenstände Autoklaven Autoklav 17 Melag, Berlin Inkubator CO2-Inkubator Typ B 5060 EK/CO2 Heraeus, Hanau Inkubator Typ BB 6220 CU Heraeus, Hanau Ständer für Einfrierröhrchen Kryo Vials® Support Rack Greiner, Nürtingen Mikroskope Inverses Mikroskop (715075) Leitz, Wetzlar pH-Meter Calimatic 766 H. Jürgens, Hannover Pipetten Pipetman, P20, P100, P200, P1000 ABIMED Analysen Technik GmbH, Langenfeld Digitale 12-Kanal Pipette Finland Labsystems for Flow Laboratories Pipettierhilfen pipetus® -standard Hirschmann Laborgeräte Pipetboy plus® Tecnomara AG, Wallisellen, Schweiz Sicherheitswerkbänke NUAIRE™ Klasse II Typ A/B3 NUAIRE, Plymouth, Minnesota, USA Microflow ABS/200 A Astec Microflow, North Somerset, UK Anhang 155 Zählkammer Neubauer improved Landgraf Laborgeräte, Langenhagen Thoma H. Jürgens, Hannover Trockenschrank (80 °C) Ehret, Emmerdingen Waagen 1213 MP Satorius, GmbH, Göttingen Wasserbäder Type 1003 Gesellschaft f. Labortechnik m.b.H., Burgwedel Zentrifugen Lobofuge 400R Heraeus-Christ GmbH, Osterode/Harz 8.5 Verbrauchsmittel Blutentnahmeröhrchen Kabavette G (S 79 G 7,5) KABE® Labortechnik, Nürmbrecht-Elsenroth Kabavette G (E 79 G 7,5) 102600 KABE® Labortechnik, Nürmbrecht-Elsenroth 102200 Greiner, Nürtingen 126563 Einfrierröhrchen Kryo-Vials® 2 ml Anhang 156 Gewebekulturflaschen Gewebekulturflaschen 50 ml Greiner, Nürtingen 690160 Gewebekulturflaschen 250 ml Greiner, Nürtingen 658170 Gewebekulturröhrchen Greiner, Nürtingen 163160 Volumen bis 1000 MBT Brand, Gießen 1478025 Volumen bis 200 ratiolab, Dreilich 2100601 Mikrotiterplatten Greiner, Nürtingen 653190 Makrotiterplatten Greiner, Nürtingen 662160 Pipettenspitzen Polysterolmikrotiterplatten Anhang 157 8.6 Abbildungsverzeichnis Abb. 1: Genomorganisation des KSPV 17 Abb. 2: Clinical Score bei Infektion mit CSF 0650 (Genotyp 1.3) 56 Abb. 3: Temperaturverlauf bei Infektion mit CSF 0650 (Genotyp 1.3) 56 Abb. 4: Clinical Score bei Infektion mit CSF 0695 (Genotyp 1.1) 57 Abb. 5: Temperaturverlauf bei Infektion mit CSF 0695 (Genotyp 1.1) 57 Abb. 6: Clinical Score bei Infektion mit CSF 0634 (Genotyp 2.3) 58 Abb. 7: Temperaturverlauf bei Infektion mit CSF 0634 (Genotyp 2.3) 58 Abb. 8: Clinical Score bei Infektion mit CSF 0277 (Genotyp 2.1) 59 Abb. 9: Temperaturverlauf bei Infektion mit CSF 0277 (Genotyp 2.1) 59 Abb. 10: Mortalitätrate (%) bei Infektion mit den vier KSPV-Isolaten 61 Abb. 11: Pathological Score bei Infektion mit CSF 0650 (Genotyp 1.3) 65 Abb. 12: Pathological Score bei Infektion mit CSF 0695 (Genotyp 1.1) 65 Abb. 13: Pathological Score bei Infektion mit CSF 0634 (Genotyp 2.3) 66 Abb. 14: Pathological Score bei Infektion mit CSF 0277 (Genotyp 2.1) 66 Abb. 15: Leukozytenzahlen bei Infektion mit den vier KSPV-Isolaten 67 Abb. 16: Leukozytenzahlen bei Infektion mit CSF 0650 (Genotyp 1.3) 68 Abb. 17: Leukozytenzahlen bei Infektion mit CSF 0695 (Genotyp 1.1) 68 Abb. 18: Leukozytenzahlen bei Infektion mit CSF 0634 (Genotyp 2.3) 69 Abb. 19: Leukozytenzahlen bei Infektion mit CSF 0277 (Genotyp 2.1) 69 Abb. 20: Clinical Score bei Infektion mit CSF 0277 (Dt. Landrasse) 81 Abb. 21: Temperaturverlauf bei Infektion mit CSF 0277 (Dt. Landrasse) 81 Abb. 22: Clinical Score bei Infektion mit CSF 0277 (Hybridschweine) 82 Abb. 23: Temperaturverlauf bei Infektion mit CSF 0277 (Hybridschweine) 82 Abb. 24: Clinical Score bei Infektion mit CSF 0634 (Dt. Landrasse) 83 Abb. 25: Temperaturverlauf bei Infektion mit CSF 0634 (Dt. Landrasse) 83 Abb. 26: Clinical Score bei Infektion mit CSF 0634 (Hybridschweine) 84 Abb. 27: Temperaturverlauf bei Infektion mit CSF 0634 (Hybridschweine) 84 Abb. 28: Pathological Score bei Infektion mit CSF 0277 (Dt. Landrasse) 89 Abb. 29: Pathological Score bei Infektion mit CSF 0277 (Hybridschweine) 89 Anhang 158 Abb. 30: Pathological Score bei Infektion mit CSF 0634 (Dt. Landrasse) 90 Abb. 31: Pathological Score bei Infektion mit CSF 0634 (Hybridschweine) 90 Abb. 32: Leukozytenzahlen bei Infektion mit CSF 0277 und CSF 0634 91 Abb. 33: Leukozytenzahlen der Dt. Landrasse (DL) und der Hybridschweine (H) bei Infektion mit CSF 0277 92 Abb. 34: Leukozytenzahlen der Dt. Landrasse (DL) und der Hybridschweine (H) bei Infektion mit CSF 0634 92 Anhang 159 8.7 Tabellenverzeichnis Tab. 1: Einteilung der Virulenz 40 Tab. 2: Klinischer Schlüssel zur Bestimmung des Clinical Score 41 Tab. 3: Pathologischer Schlüssel zur Bestimmung des Pathological Score 43 Tab. 4: Vergleich des Clinical Score (CS) und der Inkubationszeit bei Infektion mit den vier KSPV-Isolaten. Tab. 5: 60 Vergleich des Clinical Score (CS) der vier KSPV-Isolate an Tag 10, 14 und 18 p.i. mit dem maximalen CS (CSmax) 61 Tab. 6: Pathological Score bei Infektion mit den vier KSPV-Isolaten 64 Tab. 7: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0650 infiziert worden waren. Tab. 8: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0695 infiziert worden waren. Tab. 9: 71 72 Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0634 infiziert worden waren. 72 Tab. 10: Virusisolierung aus der Leukozytenfraktion von Schweinen, die mit CSF 0277 infiziert worden waren. 73 Tab. 11: Vergleich der Virustiter (log10 KID50/ml) der vier KSPV-Isolate, die am Tag 7 p.i. im Serum erreicht wurden. 74 Tab. 12: Titer der neutralisierenden Antikörper bei Infektion mit CSF 0650 75 Tab. 13: Titer der neutralisierenden Antikörper bei Infektion mit CSF 0695 75 Tab. 14: Titer der neutralisierenden Antikörper bei Infektion mit CSF 0634 76 Tab. 15: Titer der neutralisierenden Antikörper bei Infektion mit CSF 0277 76 Tab. 16: Vergleich der Bildung neutralisierender Antikörper am Tag 14 p.i. 77 Tab. 17: Clinical Score (CS) nach MITTELHOLZER et al. (2000) und nach dem modifizierten Bewertungsschema (CSmod) 78 Tab. 18: Vergleich des Clinical Score (CS) und der Inkubationszeit von Hybridschweinen (H) und Schweinen der Deutschen Landrasse (DL), die mit CSF 0277 und CSF 0634 infiziert worden waren. 85 Anhang 160 Tab. 19: Vergleich des Pathological Score (PS) von Hybridschweinen (H) und Schweinen der Deutschen Landrasse (DL) bei Infektion mit CSF 0277 und CSF 0634. 88 Tab. 20: Virusisolierung aus der Leukozytenfraktion von Schweinen der Deutschen Landrasse, die mit CSF 0277 infiziert worden waren. 93 Tab. 21: Virusisolierung aus der Leukozytenfraktion von Hybridschweinen, die mit CSF 0277 infiziert worden waren. 94 Tab. 22: Virusisolierung aus der Leukozytenfraktion von Schweinen der Deutschen Landrasse, die mit CSF 0634 infiziert worden waren. 94 Tab. 23: Virusisolierung aus der Leukozytenfraktion von Hybridschweinen, die mit CSF 0634 infiziert worden waren. 95 Tab. 24: Vergleich der Virustiter (log10 KID50/ml) der Hybridschweine und der Schweine der Deutschen Landrasse, die am Tag 7 p.i. erreicht wurden. 96 Tab. 25: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0634 (Deutsche Landrasse) 97 Tab. 26: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0634 (Hybridschweine) 97 Tab. 27: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0277 (Deutsche Landrasse) 98 Tab. 28: Titer der neutralisierenden Antikörper (ND50) bei Infektion mit CSF 0277 (Hybridschweine) 98 Tab. 29: Körpertemperatur in °C bei Infektion mit CSF 0650 138 Tab. 30: Körpertemperatur in °C bei Infektion mit CSF 0695 139 Tab. 31: Körpertemperatur in °C bei Infektion mit CSF 0634 140 Tab. 32: Körpertemperatur in °C bei Infektion mit CSF 0277 141 Tab. 33: Leukozytenzahlen in G/l bei Infektion mit CSF 0650 142 Tab. 34: Leukozytenzahlen in G/l bei Infektion mit CSF 0695 142 Tab. 35: Leukozytenzahlen in G/l bei Infektion mit CSF 0634 143 Tab. 36: Leukozytenzahlen in G/l bei Infektion mit CSF 0277 143 Tab. 37: Körpertemperatur in °C bei Infektion mit CSF 0277 (Dt. Landrasse) 144 Anhang 161 Tab. 38: Körpertemperatur in °C bei Infektion mit CSF 0277 (Hybridschweine) 145 Tab. 39: Körpertemperatur in °C bei Infektion mit CSF 0634 (Dt. Landrasse) 146 Tab. 40: Körpertemperatur in °C bei Infektion mit CSF 0634 (Hybridschweine) 147 Tab. 41: Leukozytenzahlen in G/l bei Infektion mit CSF 0277 (Dt. Landrasse) 148 Tab. 42: Leukozytenzahlen in G/l bei Infektion mit CSF 0277 (Hybridschweine) 148 Tab. 43: Leukozytenzahlen in G/l bei Infektion mit CSF 0634 (Dt. Landrasse) 149 Tab. 44: Leukozytenzahlen in G/l bei Infektion mit CSF 0634 (Hybridschweine) 149 Veröffentlichungen Teile der vorliegenden Arbeit wurden bereits vorab veröffentlicht: FLOEGEL-NIESMANN, G., C. BUNZENTHAL, S. FISCHER and V. MOENNIG (2003): Virulence of Recent and Former Classical Swine Fever Virus Isolates Evaluated by their Clinical and Pathological Signs. J. Vet. Med. B 50, 214-220 5th Pestivirus Symposium, St. John’s College, Cambridge, UK, 26.-29.08.2002 Poster: Assessment of the virulence of recent Classical Swine Fever Virus isolates. BUNZENTHAL, C., G. FLOEGEL-NIESMANN and I. GREISER-WILKE Danksagung Frau Prof. Dr. I. Greiser-Wilke danke ich für die Überlassung des interessanten Themas sowie für die engagierte wissenschaftliche Betreuung und gute Zusammenarbeit. Herrn Prof. Dr. V. Moennig danke ich für die freundliche Aufnahme im Institut für Virologie. Frau Dr. G. Floegel-Niesmann und Frau Dr. A. Meindl-Böhmer möchte ich für die fachlichen Diskussionen und vielfältigen Hilfestellungen danken. Frau G. Müller möchte ich für ihre freundschaftliche Unterstützung und gute Zusammenarbeit sowie für die vielen persönlichen Gespräche danken. Für die zuverlässige Versorgung der Tiere danke ich Frau M. Berg, Frau D. Lichterfeld und Herrn G. Thiem sowie Herrn H. Schulz. Sehr herzlich danke ich allen Mitarbeitern des Instituts für Virologie, insbesondere Frau I. Betsch, Frau R. Neth, Frau J. Pipereit, Frau S. Oetjens und Frau M. Giesecke für ihre freundliche Aufnahme und Hilfsbereitschaft sowie allen „Mit-Doktoranden“.