Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat
Werbung
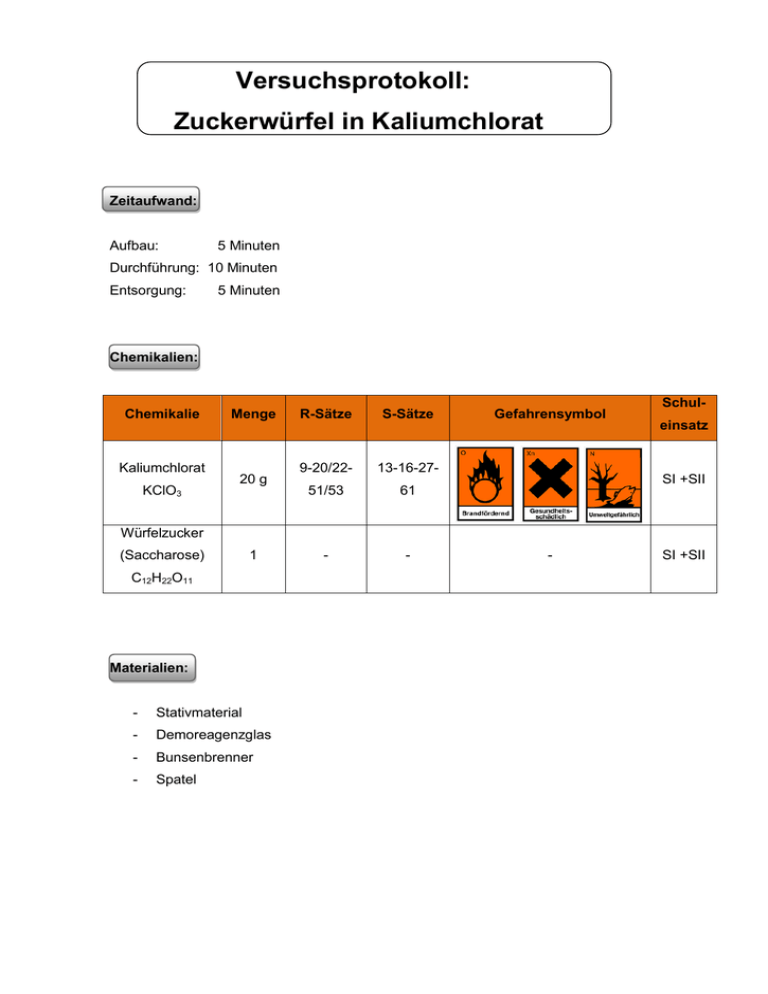
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Kaliumchlorat KClO3 Menge 20 g R-Sätze S-Sätze 9-20/22- 13-16-27- 51/53 61 - - Gefahrensymbol Schuleinsatz SI +SII Würfelzucker (Saccharose) 1 C12H22O11 Materialien: - Stativmaterial - Demoreagenzglas - Bunsenbrenner - Spatel - SI +SII Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Versuchsaufbau: 2. Zugabe Würfelzucker Würfelzucker Kaliumchlorat 1. Schmelzen des Kaliumchlorats Abb.1 Versuchsaufbau Durchführung:1 !! Arbeiten im Abzug !! 1. In ein Demoreagenzglas werden 20 g Kaliumchlorat eingewogen. 2. Dieses Reagenzglas wird fest in eine Reagenzglasklammer eingespannt (Vorsicht, starke Hitzeentwicklung! Stoffmaterial an den Klemmen kann schmelzen und somit das Reagenzglas abrutschen!!!). 3. Das Kaliumchlorat wird nun mit dem Bunsenbrenner geschmolzen. 4. Wenn sich das komplette Salz verflüssigt hat, kann man ein Stück Würfelzucker2 hinzugeben und den Abzug schließen. Unter das Reagenzglas sollte eine Schale mit Sand gestellt werden, um beim eventuellen Platzen des Reagenzglases auslaufendes, flüssiges Kaliumchlorat aufzufangen. Je nach Untergrund lohnt es sich diesen mit Alufolie auszukleiden, da eventuell heiße Flüssigkeit aus dem Reagenzglas spritzt. 1 2 Nach: Brandl, H. (2006) S.25f. Anstatt Würfelzucker kann auch ein Gummibärchen oder anderes organisches Material zugegeben werden. 2 Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Beobachtung: Durch das Erwärmen mit dem Bunsenbrenner schmilzt das Kaliumchlorat. Nach der Zugabe des Würfelzuckers zur Kaliumchlorat-Schmelze verbrennt der Zuckerwürfel in einer sehr heftigen Reaktion mit einer intensiv rötlichen Flamme. Entsorgung: Das restliche Kaliumchlorat wird in Wasser gelöst, mit Salzsäure angesäuert und mit Eisenoder Zinkpulver zu Kaliumchlorid reduziert. Nach Neutralisation der Lösung wird diese in dem anorganischen Abfall entsorgt. 3 Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Auswertung: Kaliumchlorat, ein Salz der Chlorsäure (HClO3), ist ein weißes Pulver mit einem Schmelzpunkt von 370 °C.3 Bei Temperaturen oberhalb des Schmelzpunktes verliert das Kaliumchlorat zunächst ein Drittel seines Sauerstoffs unter Bildung von Kaliumperchlorat, das im weiteren Reaktionsverlauf bei Temperaturen über 550 °C zu Kaliumchlorid und Sauerstoff zerfällt:4 2 KClO3 (s) KClO4 (l) KClO4 (l) + KCl (l) + O2 (g) 2 O2 (g) + KCl (l) Wie an den Reaktionsgleichungen zu erkennen ist, entsteht bei der Zersetzung von Kaliumchlorat eine große Menge an Sauerstoff. In der sich im Reagenzglas gebildeten heißen Sauerstoffatmosphäre entzündet sich der Würfelzucker und wird in einer heftigen Reaktion verbrannt: C12H22O11 (s) + 12 O2 (g) 12 CO2 (g) + 11 H2O (g) Wie in dieser Reaktion am Beispiel Zucker gezeigt, reagieren Chlorate mit allen organischen Verbindungen. So wurden 1788 von Claude-Louis Graf von Berthollet erstmals Chlorate als Schießpulver, seit 1865 dann auch als sogenannte Chlorat-Sprengstoffe (Chloratite, Cheddite) verwendet. Diese Sprengstoffe fanden früher viel Verwendung, wobei sich die explosiven Gemische aus Chloraten der Erdalkalimetalle mit kohlenstoffreichen Verbindungen, wie Holzmehl, Fette oder Öle verbanden. Diese Gemische setzten sich dann in etwa aus 80-90 % Kalium- bzw. Natriumchlorat und 5-12 % Kohlenwasserstoff zusammen, wobei dem Gemisch noch Holzmehl zugesetzt wurde. In Deutschland wurden die Chloratsprengstoffe vorwiegend im Kali- und Salzbergbau eingesetzt, wobei sie ab 1962 nach und nach durch ANCSprengstoffe ersetzt wurden. Die Fähigkeit der Chlorate Sauerstoff abzugeben findet auch heute noch Verwendung. So dient festes Chlorat (meistens Natriumchlorat) in sogenannten Chlorat-Kerzen zur Sauerstoffversorgung in U-Booten, Flugzeugen, der Raumfahrt und Atemmasken. Kaliumchlorat findet seine Verwendung zur Herstellung von Zündhölzern, der Feuerwerkerei und der Sprengstoffindustrie. In der Medizin wird es als Antiseptikum in Gurgel- und Mundwassern verwendet, wobei die Aufnahme von größeren Mengen (>1 g) Kaliumchlorat giftig ist.5 3 RÖMPP Online, Stichwort „Kaliumchlorat” (letzter Zugriff: 06.04.2010) Holleman, A.F. & Wiberg, E. (1995) S.480 5 RÖMPP Online, Stichwort „Kaliumchlorat“ (letzter Zugriff: 06.04.2010) 4 4 Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Didaktische Auswertung: Einordnung in den Lehrplan: Im Lehrplan kann dieser Versuch in der Qualifikationsphase im Bereich „Kohlenstoffchemie II: Technisch und biologisch wichtige Kohlenstoffverbindungen“ eingeordnet werden. In diesem Bereich ist das Thema Kohlenhydrate ein genannter Schwerpunkt. Eine weitere Anwendung kann dieser Versuch in der Einführungsphase im Bereich Redoxreaktionen finden. Einordnung des Versuchs: Dieser Versuch hat einen geringen apparativen Aufwand und die eingesetzte Chemikalie Kaliumchlorat sollte an der Schule vorhanden sein. Alle eingesetzten Chemikalien dürfen laut „HessGiss“-Datenbank uneingeschränkt von Schülern der Sekundarstufe SI und SII verwendet werden. Trotzdem sollte dieser Versuch nur als Demonstrationsversuch durch den Lehrer durchgeführt werden, da die Reaktion sehr heftig ist. Dieser Versuch ist spektakulär und sollte dadurch das Interesse der Schüler wecken. Anhand dieses Versuchs kann die stark oxidative Wirkung des Kaliumchlorats besprochen werden, wodurch dieser Versuch zum Thema Redoxchemie gezeigt wird. Eine weitere Möglichkeit wäre das Besprechen von Oxidation des Zuckermoleküls, wodurch man diesen Versuch der Kohlenhydratchemie zuordnen würde. Literaturverzeichnis: Holleman A.F. & Wiberg E. (1995). Lehrbuch der Anorganischen Chemie (101. Auflage). Berlin: Walter de Gruyter & Co. Brandl, H. (2006). Trickkiste Chemie (2. Auflage). Köln: Aulis-Verlag Deubner Elektronische Quellen: Hessisches Gefahrstoffinfomationssystem Schule „HessGISS“- 2008/2009, Version 13.0 „RÖMPP Online“, Version 3.2, verfügbar unter http://www.roempp.com/prod/index1.html (lizenzpflichtig, zuletzt abgerufen am 06.04.2010) Abbildungsverzeichnis: Alle Abbildungen wurden selbst angefertigt. 5











