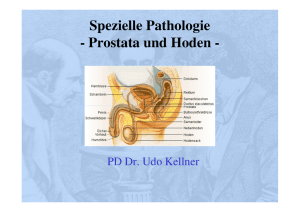
TIN - Ruhr-Universität Bochum
Werbung

Ruhr-Universit€t Bochum Prof. Dr. med. Peter-J•rg Funke Dienstort: Jung-Stilling-Krankenhaus Siegen Urologische Klinik Klinik und Therapie der Keimzelltumoren unter besonderer Ber€cksichtigung der Testikul•ren Intraepithelialen Neoplasie (TIN) Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakult€t der Ruhr-Universit€t Bochum vorgelegt von Roland Strunk aus Kirchen/Sieg 2006 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. P.-J. Funke Korreferent: Prof. Dr. med. J. Pannek Tag der m‚ndlichen Pr‚fung: 24.5.2007 Inhaltsverzeichnis Verzeichnis der Abk‚rzungen ............................................................ 5 1. Einleitung __________________________ 7 1.1. Begriffsbestimmung und Synonyme ...................................... 8 1.2. Die Historie der Erkenntnisse zur TIN .................................. 10 1.3. Epidemiologie.......................................................................... 20 1.4. Pathogenese............................................................................ 32 1.5. Anatomie .................................................................................. 37 1.5.1. Makroskopisch ....................................................................... 37 1.5.2. Histologie................................................................................ 38 1.6. Histopathologie ....................................................................... 41 1.6.1. TIN.......................................................................................... 41 1.6.2. Seminom ................................................................................ 44 1.6.3. Spermatozytisches Seminom ................................................ 45 1.6.4. Embryonales Karzinom .......................................................... 45 1.6.5. Dottersacktumor..................................................................... 46 1.6.6. Teratom .................................................................................. 47 1.6.7. Chorionkarzinom .................................................................... 48 1.6.8. Polyembryom ......................................................................... 48 1.7. Diagnostik ................................................................................ 50 1.7.1. Nichtinvasive Verfahren ......................................................... 50 1.7.2. Labordiagnostik / Tumormarker............................................. 56 1.7.3. Invasive Methoden ................................................................. 60 1.7.4. Staginguntersuchungen ......................................................... 61 1.7.5. Tumorstadien ......................................................................... 64 1.8. Therapie ................................................................................... 72 1.8.1. Allgemein................................................................................ 72 1.8.2. Spezielle Therapie ................................................................. 80 2. Methodik__________________________ 90 2.1. Das Patientenkollektiv............................................................ 90 2.2. Auswertungsmethoden .......................................................... 91 3. Hauptteil __________________________ 95 3.1. Darstellung der Ergebnisse ................................................... 95 3.2. Kollektiv ................................................................................... 96 3.2.1. Alter zum Zeitpunkt der Diagnose ....................................... 100 3.2.2. K•rpergr•ƒe und BMI .......................................................... 102 3.2.3. Eigenanamnese ................................................................... 103 3.2.4. Prim€rtherapie...................................................................... 105 3.2.5. Histologie.............................................................................. 107 3.2.6. TIN........................................................................................ 110 3.2.7. Stadien ................................................................................. 113 3.2.8. Klassifikationen .................................................................... 118 3.2.9. Response ............................................................................. 124 4. Diskussion _______________________ 126 4.1. Allgemein ............................................................................... 126 4.2. Begriffbestimmung ............................................................... 128 4.3. Anamnese / Risikofaktoren.................................................. 129 4.4. Diagnosealter ........................................................................ 130 4.5. K‚rperstatur .......................................................................... 131 4.6. Histologie ............................................................................... 132 4.7. TIN........................................................................................... 133 4.8. Stadieneinteilungen .............................................................. 134 4.9. Response ............................................................................... 137 5. Zusammenfassung ________________ 139 6. Literaturverzeichnis _______________ 142 7. Danksagung______________________ 167 8. Lebenslauf _______________________ 168 5 Verzeichnis der Abk€rzungen A Arteria Abb. Abbildung(en) AJCC American Joint Committee on Cancer AUO Arbeitsgemeinschaft Urologische Onkologie Bds. beiderseits BMI Body Mass Index ƒ-HCG Beta-Seitenkette des Humanen Chorion-Gonadotropin CIN Zervikale Intraepitheliale Neoplasie CCT Computertomographie Sch€del CS Klinisches Stadium CT Computertomographie d Tag(e) DNA Desoxyribonukleins€ure E„ Ereignisfreies „berleben FDG [18F]2-Flouro-D-Deoxyglukose (PET-Tracer) G„ Gesamt‚berleben Gy Gray GTCSG German Testicular Cancer Study Group h Stunde(n) HWZ Halbwertszeit IGCNU Intratubular Germ Cell Neoplasia, Unclassified inf. inferior KZT Keimzelltumor LDH Lactatdehydrogenase LK Lymphknoten NS Nichtseminom OP Oberpol 6 PD Progressive disease Pe Probenentnahme (Hodenbiopsie) PE Polychemotherapieschema mit Cis-Platin und Etoposid PEB Polychemotherapieschema mit Cis-Platin, Etoposid und Bleomycin PEI Polychemotherapieschema mit Cis-Platin, Etoposid und Ifosfamid PET Positronen-Emissions-Tomographie PIN Prostatische Intraepitheliale Neoplasie PLAP Plazentare Alkalische Phosphatase PVB Polychemotherapieschema mit Cis-Platin, Vinblastin und Bleomycin RKI Robert-Koch-Institut RLA Retroperitoneale Lymphadenektomie RF Risikofaktoren S Seminom sup. Superior Tab. Tabelle TESE TEstikul€re Spermatozoen-Extraktion TGCT Testicular Germ Cell Tumour TIN Testikul€re Intraepitheliale Neoplasie TM Testikul€re Mikrolithiasis UICC Union Internationale Contre Cancer UP Unterpol V Vena VAIN Vaginale Intraepitheliale Neoplasie VIN Vulv€re Intraepitheliale Neoplasie 7 1.Einleitung Der Nachweis des Carcinoma in situ des Hodens wurde erstmals 1972 von Skakkebaek beschrieben. So oder €hnlich beginnen viele Arbeiten zum vorliegenden Thema. Skakkebaek hat allerdings die Bedeutung der Zellen als Pr€kanzerose erkannt. Tats€chlich werden die beschriebenen Zellen bereits im 19. Jahrhundert von Wilms und D•rr erw€hnt. Die im Kapitel „Die Historie der Erkenntnisse zur TIN“ aufgef‚hrten Zitate k•nnten inhaltlich aktueller Literatur entstammen. So beschreibt Wilms bereits 1896, dass eine, aus einer gest•rten Entwicklung hervorgegangene Anlage, nach langer Latenzzeit erst unter dem Einfluss der „Mannbarkeit“ tumor•s zu wachsen beginnt. Die vorliegende Arbeit befasst sich mit der Testiku€ren Intraepithelialen Neoplasie (TIN) und ihrer wissenschaftlichen Entstehung. Die Bearbeitung des Themas als Pr€kanzerose ist jedoch ohne gleichzeitige Betrachtung der Keimzelltumoren nicht m•glich. Testikul€re Keimzelltumore des Hodens bilden bei M€nnern unter 45 Jahren die h€ufigste maligne Erkrankung; insgesamt liegen Keimzelltumoren an 11. Stelle im Vergleich zu anderen Krebserkrankungen (Dieckmann, 2003). Die Angaben zur Inzidenz in Deutschland gehen von sechs bis acht, zum Teil sogar bis 12 Neuerkrankungen auf 100.000 M€nner im Jahr, entsprechend ca. 4.000 M€nner, aus (Winter et al., 2005). Ein stetiger Anstieg der Inzidenz zeigt sich vor allem in den letzten 20 Jahren. Bei sehr hohen Heilungsquoten liegt die Mortalit€tsrate unter 1/100.000 M€nner. Demzufolge erliegen damit ungef€hr 200 vorwiegend junge M€nner dieser Krankheit (Pottek et al., 2005). 8 1.1. Begriffsbestimmung und Synonyme TIN wurde erstmals als sichere Pr€kanzerose 1972 von Skakkebaek (Skakkebaek, 1972) beschrieben, der die beobachteten Tumorzellen seinerzeit als Carcinoma in situ des Hodens bezeichnete. Dieckmann et al. (2005) legt sich f‚r den deutschsprachigen Raum auf den Begriff TIN (Testikul€re Intraepitheliale Neoplasie) fest und betont, dass diese Formulierung sich auch zunehmend international durchsetzen w‚rde. Sinnvoll erscheint die von Loy gepr€gte Bezeichnung der TIN (Dieckmann, 2000) aufgrund der Anlehnung an andere Pr€kanzerosen des Genitaltraktes. Eine „bersicht zeigt Tab. 1.1-1. Tab. 1.1-1: Intraepitheliale Neoplasien und Lokalisationen Abk€rzung Lokalisation TIN Hoden VIN Vulva VAIN Vagina CIN Cervix uteri PIN Prostata Tats€chlich existieren jedoch viele Synonyme f‚r die als Pr€kanzerose der Keimzelltumoren anerkannte Erkrankung. Folgende Ausdr‚cke werden zur Beschreibung der TIN in der Literatur verwendet: Carcinoma in situ (Skakkebaek, 1972) CIS germ cell (Skakkebaek, 1975) CIS gonocyte (abgelehnt von Holstein in der Diskussion der Arbeit von Skakkebaek, 1987) 9 Intratubular Germ Cell Neoplasia, Unclassified (IGCNU) Intratubular malignant germ cells (ITMGC) (von Mostofi 1988) Intratubular preinvasive tumour Gonocytoma in situ Testicular intraepithelial neoplasia Intratubular atypical germ cells Die Diskussionen um den richtigen Namen sind seit Jahren zu verfolgen. Der Name „CIS gonocyte“ wird von Holstein abgelehnt, weil nur in einem echten Epithel Karzinome entstehen k•nnten. Folglich k•nne es sich auch nicht um ein Carcinoma in situ handeln. Die Herkunft der betreffenden Zellverb€nde auf der Basalmembran der Tubuli stehe mit den Gonocyten fest. Es handele sich zwar um €hnlich aufgebaute Zellen, allerdings g€be es einige Unterschiede am Zellkern und an anderen Organellen (Holstein, 1987). “The association to testicular germ cell tumours is very strong and very specific”. (“Die Zusammengeh•rigkeit zu den Keimzelltumoren ist sehr stark und spezifisch“) (Moller, 1993). Damit wird der vor allem im angloamerikanischen Raum verwendete Begriff der Intratubular Germ Cell Neoplasia, Unclassified (IGCNU) begr‚ndet. Nach Dieckmann (2000) etabliert sich der Begriff TIN zunehmend in der internationalen Literatur. 10 1.2. Die Historie der Erkenntnisse zur TIN „Nat•rlich ist es bei dieser Complication von vielleicht secund‚rer Wucherung im Bindegewebe mit intensiv sich vermehrender Mesodermanlage ‚usserst schwierig zu beurtheilen, wo die Grenze zu ziehen ist zwischen einer gutartigen Wucherung von embryonalem Bindegewebe und einer malignen, sarcomatƒsen Degeneration. Diese Frage, die ich hier noch nicht erƒrtern will, kƒnnte, wie mir scheint, f•r unsere Geschwulstlehre von weittragender Bedeutung sein. Sie spitzt sich, wie ich sp‚ter noch ausf•hren werde, wohl dahin zu, – sind die Zellen der teratoiden Bildungen von vornherein als embryonale Zellen maligner Natur aufzufassen, oder werden sie nur unter besonderen Umst‚nden maligne, und worin zeigt sich dann die Malignit‚t, mit anderen Worten, besteht ein Unterschied zwischen den zum Bindegewebsapparat der teratoiden Geschwulst sich entwickelnden, embryonalen Bindegewebszellen und den Sarcomzellen?“ (Wilms, 1896) Mit diesen sehr eindrucksvollen S‚tzen hat Wilms bereits im Jahre 1896 entscheidende Hinweise auf „embryonale Zellen“ gegeben, welche die Potenz haben, sich zu manifesten, bƒsartigen Geschw•lsten zu wandeln. Er gibt sogar Hinweise darauf, dass auch andere Wissenschaftler bereits Beobachtungen in diese Richtung beschrieben haben: „...; ich muss mich vielmehr mit wenigen, eclatanten F‚llen und mit der Besprechung der grossen Werke •ber den vorliegenden Gegenstand begn•gen und die Best‚tigung meiner ganzen Auffassung von dem g e m e i n s a m e n U r s p r u n g a l l e r d i e s e r G e b i l d e der kommenden Literatur •berlassen, welche die Berechtigung eines solchen Gedankens an neuen Pr‚paraten sch‚rfer zu beurtheilen im Stande sein wird.“ (Wilms, 1896); Verweis auf: (Billroth, 1855; Virchow, 1855; Waldeyer, 1868). 11 Der Angelegenheit im Sinne der heutigen Auffassung kam 1894 D‚rr im Rahmen seiner Dissertation etwas n€her: „Ob man auch die bisher beschriebenen Adenome und Cystome des Hoden als Bildungen ansehen darf, welche auf St•rungen der Hodenentwicklung zur‚ckzuf‚hren sind, dar‚ber wagt der Autor ein Urteil nicht abzugeben. Da die Geschw‚lste meistens erst in sp€teren Lebensjahren zur Beobachtung gelangen, so wird man, nach seiner Meinung, eher geneigt sein, anzunehmen, dass sie in einem Hoden, der normal ausgebildet war, entstanden sind.“ (Wilms, 1896) ‚ber (D‚rr, 1894) Und w•rtlich liest es sich in der Arbeit von D‚rr (1894): „Es w€re aber auch sehr wohl m•glich, ... ,dass aus einer gest•rten Entwicklung hervorgegangene Anlagen zu solchen Tumoren oft lange latent bleiben und erst in der Zeit der Mannbarkeit und der Th€tigkeit des Hodens anfangen zu wachsen.“ (Wilms, 1896 zitiert D‚rr, 1894) Dass Keimzellen sich ver€ndern k•nnen, war seither bekannt. Immer wieder tauchen in den folgenden Jahrzehnten entsprechende Ver•ffentlichungen auf wie z.B. Hartmann et al. (1922), Bell (1925), Peyron (1936), von Albertini (1943), Banzer (1943), Schnyder (1951+1952) und Azzopardi et al. (1961). Im Jahr 1907 erschienen die Untersuchungen von Askanazy, der wahrscheinlich als erster die Theorie publizierte, dass durch die Metamorphose absolut undifferenzierter Zellen die Teratogenese gef•rdert wird. Das Teratom k•nne sich entweder aus einer singul€ren oder einer Gruppe von totipotenten Zellen entwickeln oder differenzieren. Budde schrieb 1926, dass die Entstehung eines Teratoms nach seiner Auffassung durch eine fehlgeleitete Aktion des 12 „embryonalen Organisators“ verursacht w‚rde, und dass das Teratom von Zellen stamme, die bereits in einem primitiven Entwicklungsstadium von der normalen Entfaltung abgekoppelt seien. Andere sehen die Entwicklung durch ein fr‚hzeitiges Abspalten und Verschieben von Blastomeren bestimmt, die sich auf diese Weise dem Einfluss der „Organizer“ entziehen (Willis, 1967; Collins and Pugh, 1964). Schlieƒlich schreiben Mark und Hedinger (1965) in ihrer englischsprachigen Arbeit (Abschnitt ‚bersetzt vom Autor dieser Arbeit): „Atypical germ cells: Ver€nderungen der Keimzellen in der unmittelbaren Nachbarschaft eines Teratoms sind von zahlreichen Autoren berichtet und beschrieben worden. In Anlehnung an diese Ver•ffentlichungen haben wir die folgenden Kriterien f‚r die Definition des Vorhandenseins dieser atypischen Zellen ‚bernommen: Die Zellen liegen in einer oder mehreren kontinuierlichen Reihen auf der Basalmembran ohne Interposition von SertoliZellen. Die Sertoli-Zellen sind in Richtung auf das Lumen hin verschoben, so dass die Lichtung durch Sertoli-Zellen oder auch atypische Keimzellen verschlossen sein kann. Die Zellkerne sind regelrecht, verdichtet und hyper- chromatisch. Das Cytoplasma ist klar und vergleichsweise reichlich. Die Zellmembran ist deutlicher sichtbar als der Saum des Cytoplasmas. In dem speziellen Tubulus sind keine h•heren Entwicklungsstadien der Spermatogenese zu erkennen.“ 13 Die oben genannten Autoren beschrieben „bergangszonen und Entwicklungsstufen von der normalen Keimzelle bis zu den manifesten b•sartigen Zellen des Seminoms. Allerdings fanden sie diese Seminomknoten immer in der Umgebung eines prim€ren Teratoms gelegen. Die Vorstellung kam auf, dass diese atypischen Keimzellen einen Zwischenschritt zu einem Mechanismus darstellen, der zu dem relativ h€ufigen simultanen Vorkommen dieser an sich selten beobachteten Tumorarten gez€hlt werden muss. In der Vorstellung entstand prim€r das in allen F€llen gr•ƒere Teratom, das Seminom entwickelte sich sekund€r und erheblich kleiner. Zu dieser Zeit waren die epidemiologischen bzw. €tiologischen Hintergr‚nde noch weniger klar als zur heutigen Zeit: Man vermutete mechanische Faktoren oder eine chronische, nicht n€her definierte Irritation des Gewebes. Dixon und Moore (1952) beobachteten, beschrieben und fotografierten im Rete testis gelegene atypische Keimzellen. Sie interpretierten diese als intralumin€re Metastasen, die sich entlang der Basalmembran entwickeln und das nat‚rliche Keimgewebe anheben und unterminieren. Mark und Hedinger (1965) ist es gelungen, in einem Bild nebeneinander in unterschiedlichen, benachbarten Tubuli einerseits manifestes Seminom und andererseits eine im „bergang befindliche Reihe darzustellen, die noch die atypischen Keimzellen im unmittelbaren „bergang zum Seminomgewebe aufweist. Damit war der Beweis erbracht, dass die nachgewiesenen atypischen Keimzellen als Pr€kanzerose bzw. als „precursor lesion“ nach angels€chsischem Sprachgebrauch anzusehen waren. Mark und Hedinger (1965) zweifelten die bis dahin geltende These an, dass mechanische Faktoren oder andere chronische Irritationen kausal f‚r die Entstehung der atypischen Keimzellen in Frage k€- 14 men. Vielmehr vermuteten sie einen Einfluss hormonaler Faktoren, die als „Organisatoren“ f‚r diese Entwicklung anzusehen sind. So hat Mostofi (1973) einige Abweichungen von der Normalit€t in den Wechselwirkungen zwischen endokrinen Dr‚sen und der testikul€ren Onkogenese beschrieben: Die Induktion von Hodentumoren im Tierversuch (hier Gefl‚gel) durch Injektion von Zinksalzen gelingt nur, wenn die Hypophyse maximal Gonadotropin aussch‚ttet. Beim Menschen beobachtet man die h•chste Inzidenz von Hodentumoren in der Phase der gr•ƒten Androgen-Aktivit€t. In einer Reihe von Hodentumoren werden Chorion-Gonadotropin und ˆstrogene produziert. Einige Patienten mit Hodentumor zeigen einen erh•hten Wert von Hypophysen-Gonadotropin, der auch nach Orchiektomie persistiert, unabh€ngig von Metastasen. Das Hormon kann auch nicht aus Tumor- oder Metastasengewebe extrahiert werden (Hamburger, 1958). In Gewebekulturen beschleunigt Androsteron das Wachstum von gewissen Hodentumoren. Der Tumortyp €ndert sich mit dem Reifegrad des Hodens. Volpe et al. (1968) vermuten, dass die erh•hte Inzidenz f‚r Hodentumoren bei Kryptorchismus-Patienten durch eine St•rung der endokrinen Funktion zu erkl€ren ist. Nach ihrer Auffassung ist die Hypophyse gegen‚ber den im Blut zirkulierenden Androgenen, die aus einem nicht deszendierten Hoden stammen, nicht sensitiv. Dadurch kommt es zu einer exzessiven „bersekretion von Hypo- 15 physen-Gonadotropin, zu einer „berstimulation der Gonaden und durch den chronischen „berreiz zur Seminombildung. Zahlreiche Untersucher haben in dieser Zeit versucht, eine allgemeing‚ltige Klassifizierung der Hodentumoren zu erarbeiten, um eine weltweite Standardisierung zu bewirken, damit man einheitlich ‚ber das Thema diskutieren kann. Eine weltweite Einigung war nicht zu erzielen. Immerhin l€sst sich die globale Vielfalt auf zwei gebr€uchliche Nomenklaturen zusammenfassen. Im Auftrag der Weltgesundheitsorganisation (WHO) haben Mostofi und Sobin im Jahre 1977 eine Nomenklatur herausgegeben, die weitgehend der amerikanischen Einteilung von Mostofi und Price aus dem Jahre 1973 entspricht. Diese wiederum beruht im wesentlichen auf der Nomenklatur von Friedmann und Moore (1946), denen es immerhin gelungen war, bei der Auswertung von 922 F€llen von Hodentumoren f‚r das Armed Forces Institute of Pathology 96% denselben vier Typen oder ihren Kombinationen zuzuordnen: Seminom (Germinom) Embryonales Karzinom mit der Untergruppe des Chorionepithelioms Teratom Teratokarzinom Das britische „Testicular Tumor Panel and Registry“ (TTPR) basiert auf den Arbeiten von Collins und Pugh (1964) und Pugh (1976). Es gab weitere Versuche, einfachere und der Abstammung der Hodentumore besser angepasste Gliederungen zu schaffen. Dies ist letztlich nicht gelungen. Auch die im deutschsprachigen Raum von v. Albertini ver•ffentlichten Arbeiten, die in seinem Buch „Histo- 16 logische Geschwulstdiagnostik“ 1955 und 1974 zusammengefasst sind, haben keine weltweite Anerkennung gefunden. In der WHO-Klassifikation (Fritz et al., 2000) findet man an erster Stelle die „TIN“ (Testikul€re Intraepitheliale Neoplasie) oder f‚r den angels€chsischen Sprachbereich die „IGCNU“ (Intratubular germ cell neoplasia, unclassified). In der UICC-TNM-Klassifikation maligner Hodentumoren 1997 (Wittekind und Wagner, 1997) wird die gleiche Ver€nderung als „Intratubul€re Keimzellneoplasie (Carcinoma in situ)“ bezeichnet. Die folgenden Darstellungen zur geschichtlichen Entwicklung beziehen sich ausschlieƒlich auf diesen Themenbereich. Hedinger (1979) unterscheidet in seinem Beitrag „Fr‚he neoplastische Ver€nderungen des Hodens“ die Pr€kanzerose im weiteren Sinne, auch pr€kanzer•se Krankheit (precancerous condition) von den Pr€kanzerosen im engeren Sinne, pr€kanzer•se Gewebsver€nderungen (precancerous lesions). Er bedient sich hierbei des Pr€kanzerosebegriffes, wie er 1972 von einer Expertenkommission der WHO vorgeschlagen wurde. Diese Aufteilung hat Hamperl (1974) in seinem Handbuch der allgemeinen Pathologie ‚bernommen: „Der Begriff der Pr€kanzerose wird in eine Pr€kanzerose im weiteren Sinne, eine pr€kanzer•se Krankheit, eine ‰precancerous conditionŠ und eine Pr€kanzerose im engeren Sinne, eine pr€kanzer•se Gewebsver€nderung, eine ‰precancerous lesionŠ unterteilt.“ (Hedinger, 1979) Zur ersten Gruppe werden in erster Linie Gonadenmissbildungen gerechnet, insbesondere der Kryptorchismus, aber auch Zust€nde abnormer Geschlechtsdifferenzierung. Die Wahrscheinlichkeit der 17 Tumorentwicklung ist bei Kryptorchismus-Patienten je nach Berechnung 15 bis 50 mal h•her als bei M€nnern mit normal gelagerten Hoden (Scorer und Farrington, 1971; Whitaker, 1970; Wurster, 1976). Die Tumorentstehung scheint unabh€ngig davon zu verlaufen, ob der Kryptorchismus behoben wird oder nicht. Die Frage, ob der Grad der Hodenretention f‚r die Tumoranf€lligkeit eine Rolle spielt, wird unterschiedlich beantwortet: Campbell (1942) und Grove (1954) sprechen sich daf‚r aus, Gilbert und Hamilton (1940) lehnen einen derartigen Zusammenhang ab. Die zweite Gruppe, Pr€kanzerosen im engeren Sinne, umfasst manifeste Alterationen, eigentliche pr€kanzer•se Gewebsver- €nderungen. Hiermit sind die bereits beschriebenen atypischen intratubul€r gelegenen Keimzellen gemeint, atypische Spermatogonien, die durchaus der Struktur der Seminomzellen gleichen. Die Erstbeschreibung geht, wie bereits erw€hnt, auf Wilms, Billroth und Virchow zur‚ck, aber auch zahlreiche weitere Autoren haben sich mit diesen atypischen Keimzellen besch€ftigt. In diese Reihe geh•ren neben Skakkebaek (1972) auch Holstein und K•rner (1974), Schulze (1977) sowie Schulze et al. (1978). Die letztgenannten Untersucher haben sowohl licht- als auch elektronenmikroskopisch intratubul€re Wucherungen von atypischen Keimzellen verfolgen k•nnen; alle „bergangsstufen bis zu den extratubul€ren Tumorherden wurden dargestellt. Auch bei nichtseminomat•sen Geschw‚lsten wurden intratubul€re Wucherungen beobachtet (Mostofi und Price, 1973). Klinische Bedeutung im Sinne einer pr€kanzer•sen Gewebsver€nderung (precancerous lesion, Pr€kanzerose im engeren Sinne) haben derartige Befunde vor allem durch die Arbeiten von Skakkebaek (1972, 1978) sowie von Nielsen et al. (1974) erlangt. Sie 18 hatten im Zusammenhang mit Sterilit€tsuntersuchungen bei sechs Patienten im Hodenbiopsie-Material intratubul€r gelegene atypische Spermatogonien gefunden, bei vieren davon entwickelten sich innerhalb von 1-4‹ Jahren typische Keimzellgeschw‚lste. Das gleiche Ph€nomen sahen auch N‚esch-Bachmann und Hedinger (1977); bei 5 von 9 Patienten mit atypischen Spermatogonien entwickelten sich innerhalb von maximal sechs Jahren Hodentumoren verschiedener Histologien. Die restlichen vier Patienten sind tumorfrei geblieben. Heute gilt die Testikul€re Intraepitheliale Neoplasie (TIN) als obligate Pr€kanzerose aller Keimzelltumoren des Hodens (Dieckmann et al., 1999; Dieckmann et al., 2005). Bei systematischer Untersuchung findet man atypische Keimzellen in bis zu 99% der Keimzelltumoren (Sigg und Hedinger, 1980; Jacobsen et al., 1981). Eine Ausnahme bilden die spermatocyt€ren Seminome (M‚ller et al., 1987) und die Dottersacktumoren bei Kindern (Guinand und Hedinger, 1981; Manivel et al., 1988). In fr‚heren Publikationen wurden die atypischen Keimzellen als Zellreaktion auf einen bereits bestehenden Keimzelltumor angesehen (Hedinger und Dhom, 1991). Es ist das Verdienst von Skakkebaek (1972), der diese Keimzellen in Hodenbiopsien eindeutig als Vorl€ufer erst sp€ter in Erscheinung tretender Keimzelltumoren erkannt hat. Seither werden sie nicht mehr als Reaktion auf Keimzelltumoren in deren Umgebung, also als sekund€r entstanden aufgefasst, sondern als deren Ursprungszellen. So kam Skakkebaek zu der heute umstrittenen bzw. schon ‚berholten Bezeichnung des Carcinoma in situ (CIS). Atypische Keimzellen werden nicht nur in erkrankten, in der Regel bereits einen manifesten Tumor tragenden Hoden gefunden, sondern auch etwa bei jedem 20. Fall (5 bis 5,4%) (von der Maase 19 et al., 1986 und 1987; Kleinschmidt et al., 1989) im scheinbar gesunden Hoden der Gegenseite. Tats€chlich wurde auch in einem Viertel der beobachteten F€lle innerhalb von 88 Monaten die Entstehung einer b•sartigen Geschwulst der Gegenseite beobachtet; umgekehrt blieb ein €hnlich groƒer Anteil, bei dem wegen des Prim€rtumors eine intensive Chemotherapie durchgef‚hrt wurde, tumorfrei (von der Maase et al. 1987). Bei den prim€r extragonadalen Keimzelltumor-Manifestationen wie zum Beispiel dem Mediastinum sind sowohl in der Tumorumgebung als auch in den Hoden keine atypischen Keimzellen zu finden (Hedinger und Dhom, 1991). Hailemariam et al. (1998) berichtet aber ‚ber den seltenen Fall eines Keimzell-Mediastinaltumors mit atypischen Spermatogonien in den Hoden und betrachtet diese Beobachtung als weiteren Beweis f‚r den Zusammenhang zwischen IGCNU und manifestem Keimzelltumor. Besteht die Kombination aus testikul€ren atypischen Keimzellen und einer ungew•hnlichen extragonadalen Tumorlokalisation, m‚ssen die Hoden ganz besonders sorgf€ltig exploriert werden, weil von einem Metastasierungsprozess ausgegangen werden muss (Daugaard et al., 1987). Bei retroperitonealen Keimzelltumoren werden in 42% der F€lle atypische Keimzellen in den Hoden gefunden (Bohle et al., 1986; Daugaard et al., 1992; Hofmann et al., 1989). Zur Prognose ist Folgendes festzustellen: Innerhalb von 5 Jahren nach nachgewiesener TIN wachsen 50% der F€lle zum manifesten Tumor aus, 90% innerhalb von 7 Jahren (Bettocchi, 1994; von der Maase et al., 1986). Nur wenige F€lle unterliegen nicht dem Progress (Burke und Mostofi, 1988; Giwercman et al., 1993; Pryor et al., 1983; Skakkebaek et al., 1982). 20 1.3. Epidemiologie Der Begriff Epidemiologie hat im Laufe der Jahre einen wesentlichen Wandel erfahren. W€hrend er im „Pschyrembel“ des Jahres 1969 noch ausschlieƒlich als „Seuchenlehre“ definiert ist, in der Brockhaus Enzyklop€die des Jahres 1988 immerhin eine Bedeutung f‚r Medizin (Lehre von der statistischen H€ufigkeit und Verteilung von ansteckenden Krankheiten usw.) und Psychologie (Forschungsrichtung, die sich mit der Verbreitung psychischer St•rungen und deren Zusammenhang mit bestimmten Merkmalen usw. besch€ftigt) unterschieden wird, hat die WHO den Begriff neu definiert: „Epidemiologie umfasst die Untersuchung der topographischen und zeitlichen Verteilung von Krankheiten und der sozialen Krankheitsfolgen in menschlichen Bev•lkerungsgruppen sowie die Untersuchung von Faktoren, die diese Verteilung beeinflussen.“ (zitiert nach Dieckmann und Pichlmeier, 2003) Wesentliches Ziel ist die Erkennung von m•glichen internen Krankheitsursachen und eventuellen Zusammenh€ngen mit €uƒeren Noxen. Die Methodik der Epidemiologie besteht in der Betrachtung von definierten Menschengruppen wie „Kollektiven“ oder „Populationen“ durch Beobachtungsstudien mit systematischer Erfassung der Beobachtungen und statistischer Analyse der Ergebnisse. Hierzu muss eine ausreichend groƒe Beobachtungsgruppe gegeben sein, was bei der Inzidenz der besprochenen Erkrankung im Rahmen einer einzigen Klinik eher nicht m•glich ist. In der Methodik werden deskriptive und analytische epidemiologische Studien voneinander unterschieden (Adami, 2002). De- 21 skriptive Studien befassen sich mit dem zeitlichen Verlauf und mit geographischen Unterschieden von Inzidenz und Mortalit€t bestimmter Krankheiten. Hierzu geh•ren sogenannte Registerstudien, Querschnittstudien, allgemeine Beobachtungsstudien und •kologische Studien. Diese Untersuchungen sind rein deskriptiv, beschreibend sowie explorativ und bereiten die Voraussetzungen f‚r weitergehende Studien. Sie dienen der Generierung und Formulierung von Forschungsans€tzen und Hypothesen zu Krankheitsursachen und –merkmalen. Als Beispiel f‚r den deskriptiven Studientyp sei die geographische Inzidenzverteilung z. B. des Prostatakarzinoms erw€hnt. Aus der hohen Inzidenz dieses Tumors in der westlichen Welt und der vergleichbar niedrigen Inzidenz in asiatischen L€ndern wurde die Hypothese generiert, dass m•glicherweise Ern€hrungsfaktoren einen Einfluss auf die Pathogenese Blickwinkel des Prostatakarzinoms werden Ern€hrungsgewohnheiten die haben. westlichen respektive Unter bzw. diesem asiatischen –Unterschiede gegen‚bergestellt und statistischen Auswertungen unterzogen. Analytische Studien basieren darauf, dass vorformulierte Hypothesen zur •tiologie von Krankheiten bewiesen, mindestens aber wahrscheinlich gemacht werden m‚ssen mit Hilfe definierter Studienpl€ne. Hier bestehen flieƒende „berg€nge zur klinischen Epidemiologie, weil Untersuchungen und Auswertungen von Patientendaten vorgenommen werden. Wesentliches Merkmal der klinischen Epidemiologie ist die Anwendung von Methoden der analytischen Epidemiologie auf klinische Fragestellungen. Deshalb wird dieser Zweig der Forschung auch als Basiswissenschaft der klinischen Medizin bezeichnet. Fallkontrollstudien und Kohorten- 22 studien mit entsprechenden statistischen Auswertungen stellen das wichtigste Handwerkszeug dar (Tamimi, 2002). Daten auf der Basis gesicherter Studien mit entsprechender statistisch ‚berpr‚fter und nachgewiesener Signifikanz lassen mehr oder weniger fundamentalisierte R‚ckschl‚sse zu. Dies stellt die Grundlage der Evidenzbasierten Medizin (EBM) dar. Hieraus lassen sich entsprechende Aussagen treffen, die Wertigkeit ist mit der Levelangabe nachvollziehbar (s. Tab. 1.3-1). Tab. 1.3-1: Leveldefinitionen der Evidenz Basierten Medizin Level Ia Definition Mehrere randomisierte, kontrollierte Studien beziehungsweise deren Metaanalyse Ib Einzelne randomisierte, kontrollierte Studie IIa Gut geplante nichtrandomisierte, kontrollierte Studie IIb Gut geplante experimentelle Studie III Gut geplante nichtexperimentelle Studie, VergleichsStudie, Korrelations- oder Fall-Kontroll-Studie IV Nicht evidenzbasierte Expertenmeinung Die epidemiologische Wissenschaft hatte in der medizinischen Forschung und Lehre in Deutschland bisher nur eine untergeordnete Rolle gespielt. Dieckmann und Pichlmeier haben das Thema „Hodentumor“ in ihrer Arbeit aus dem Jahre 2003 erstmals unter epidemiologischen Gesichtspunkten dargestellt (Dieckmann und Pichlmeier, 2003). Die deskriptive Epidemiologie befasst sich mit der Mortalit€t und der Inzidenz des Hodentumors. In Deutschland sch€tzt man die 23 Rate an Neuerkrankungen an Hodenkrebs auf 3280 F€lle pro Jahr. Mit einer Inzidenz von 7,6 Neuerkrankungen pro Jahr (bezogen auf 100.000 M€nner) geh•rt das Hodenkarzinom zu den seltenen Erkrankungen. Allerdings liegen in Deutschland keine exakten Statistiken vor, weil es kein bundesweites Krebsregister gibt. Aus den Zahlen der Bundesl€nder Hamburg und Saarland, die ‚ber ein funktionierendes Krebsregister verf‚gen, ermittelt das Robert-KochInstitut in Berlin durch Hochrechnung auf die Gesamtbev•lkerung die bundesrepublikanischen Fallzahlen. Betroffen sind ‚berwiegend junge M€nner unter 45 Jahren, in diesem Altersabschnitt stehen die verschiedenen Hodentumore mit 2,8 Tausend F€llen auf Position 1 der b•sartigen Erkrankungen. Ber‚cksichtigt man M€nner aller Altersgruppen in Bezug auf b•sartige Neuerkrankungen, dann verschiebt sich der Hodentumor mit 3,3 tausend F€llen auf Position 11 (Dieckmann, 2003). Diese Zahlen stammen aus dem Jahre 1998. Die neuesten Zahlen des RKI zeigen den deutlichen Anstieg der Inzidenz mit Inzidenzzunahme 4350 bei Neuerkrankungen. gleichzeitiger Die Trends der Mortalit€tsratenabnahme setzen sich unver€ndert fort (Krebs in Deutschland, 2006). Interessant ist der Vergleich mit anderen L€ndern: Hinter D€nemark liegt Deutschland an zweiter Stelle (Schnaidt et al., 1992; Albers und Weissbach, 2003). Zwischen den Kontinenten sind ganz gravierende Unterschiede festzustellen; in Europa und Nordamerika ist eine hohe Inzidenz zu verzeichnen, w€hrend in Asien, Lateinamerika und Afrika eine nur verschwindend geringe H€ufigkeit zu beobachten ist (Chinda, 1983). Eine Ausnahme bilden die weiƒen Einwohner Australiens und die Maoris, Ureinwohner Neuseelands, die etwa 7,9 Neuerkrankungen pro Jahr 24 und 100 000 M€nner aufweisen (Schnaidt et al., 1992; Albers und Weissbach, 2003). Abb. 1.3-1 Inzidenz von Hodentumoren auf 100.000 M€nner pro Jahr in einzelnen L€ndern/Regionen und ethnischen Gruppen (Ulbright et al.,1999) Nach dieser Zusammenstellung in einem amerikanischen Lehrbuch, die auf Daten von Muir beruht, f‚hrt die Schweiz die Liste mit maximal 9,3/100.000 M€nnern und Jahr an (Muir et al., 1987). Zum Teil existieren groƒe Unterschiede zwischen einzelnen Kantonen. Besonders bemerkenswert ist auch, dass die weiƒen M€nner der USA im vorderen Drittel der Tab. zu finden sind, 25 w€hrend die Farbigen die vorletzte Position einnehmen. Geht man davon aus, dass beide Gruppen gleichen Umwelt- und Ern€hrungsbedingungen unterliegen, kommen hier wohl in erster Linie genetische Faktoren zum Tragen. Chinesen und Japaner sind bei der Inzidenz in den unteren Regionen der Weltstatistiken zu finden (Inzidenz 1,0), w€hrend sie sich nach Einwanderung in die USA etwa in eine mittlere Position zwischen Heimat- und Gastland einordnen (Inzidenz 2,0). Bei farbigen M€nnern ergibt sich dieser Wandel bei Ver€nderung durch Migration nicht. Die Inzidenz in unseren Breiten steigt seit vielen Jahrzehnten kontinuierlich, w€hrend der letzten f‚nf Jahrzehnte insgesamt um das Dreifache. Zuletzt hat sich die Trendkurve etwas abgeflacht. Lediglich in den Jahren w€hrend und nach dem zweiten Weltkrieg war eine Abnahme zu beobachten (M•ller, 1993). Aus den deskriptiven Patientendaten sind verschiedenste Hypothesen zur •tiologie und Pathogenese abgeleitet worden. Der ‚berwiegende Befall junger M€nner weist auf pathogenetisch wirksame Faktoren hin, die im fr‚hen Kindesalter oder gar im vorgeburtlichen Entwicklungsstadium aktiv sind (Buetow, 1995). Die ungleiche geographische H€ufigkeitsverteilung legt den Verdacht nahe, dass genetische Faktoren bedeutsam sein k•nnten. Bei der kontinuierlich steigenden Inzidenz liegt die Vermutung nahe, dass Umwelteinfl‚sse zum Beispiel die globale Umweltverschmutzung eine entscheidende Rolle spielen. In den reichen Industriel€ndern mit ihren entsprechenden Umweltver€nderungen, ist in 10 Jahren ein Anstieg der Inzidenz von 5,5/100.000 der m€nnlichen Bev•lkerung (1992) auf 7,5 (2002) zu verzeichnen (Schweyer, 2005). Zuletzt wurden 12/100.000 M€nner angegeben (Winter et al., 2005). 26 Die Inzidenzver€nderung in den Jahren w€hrend und nach dem Zweiten Weltkrieg, als eine gewisse Mangelern€hrung weit verbreitet war, induziert die Hypothese, dass die fr‚hkindliche Ern€hrung einen wesentlichen Einfluss nehmen k•nnte. Die Mortalit€t durch testikul€re Keimzelltumore (Anzahl der j€hrlich an dieser Erkrankung versterbenden M€nner bezogen auf 100.000 m€nnliche Einwohner) liegt bei 0,8 F€llen pro 100.000 und Jahr. Die analytische, klinische Epidemiologie exploriert klinische Merkmale, die kausal mit der Erkrankung verkn‚pft sein k•nnten. Durch kontrollierte Beobachtungsstudien werden sogenannte „Assoziationen“ aufgestellt, deren wahrscheinliche Verkn‚pfung mit der Erkrankung durch statistische Analyse beziffert werden (Dieckmann et al., 2003; Adami und Trichopoulos, 2002). Die gepr‚ften Merkmale oder Faktoren stammen einerseits aus retrospektiven Fallserien, andererseits aus Einzelbeobachtungen sowie aus Hypothesen, die in der deskriptiven Epidemiologie generiert werden. Eine groƒe Anzahl von klinischen Merkmalen ist auf eine m•gliche €tiologische Assoziation mit dem Hodentumor untersucht worden. Entsprechend hoch und un‚berschaubar ist die Anzahl der Publikationen. Das Spektrum reicht von Einzelfallbeobachtungen bis zu klassischen Fallkontrollstudien. Die Datenlage ist entsprechend heterogen, nur wenige Merkmale wurden als weitgehend gesichert angesehen, insbesondere wenn die Ergebnisse nach den Grunds€tzen der evidenzbasierten Medizin erfasst wurden. Die meisten Hodenkrebs-assoziierten Faktoren erreichen nur den Evidenz-Level III – IV; entweder lassen widerspr‚chliche Studienergebnisse Untersuchungsmethoden bestimmte oder Faktoren m•gliche, aber noch unklare Assoziation einstufen. minderwertige allenfalls als 27 Drei (+eins) Merkmale sind auf h•chstem Evidenzniveau als gesicherte Risikofaktoren f‚r Hodenkrebs anzusehen (Dieckmann et al., 2003). W€hrend der Maldeszensus, der kontralaterale Tumor und das Karzinom bei einem Verwandten ersten Grades als gesichert gilt, k•nnen die Intersex-Genitalfehlbildungen aufgrund der geringen Fallzahlen kein h•heres Niveau erreichen. Zu diesen Fehlbildungen geh•ren gewisse Formen von gonadaler Dysgenesie sowie von echtem Hermaphroditismus und der m€nnliche Pseudohermaphroditismus durch Androgen-Rezeptormangel (androgen insensitivity syndrome) (Rutgers et al., 1987; 1991). Tab. 1.3-2: Evidenzniveau der gesicherten Risikofaktoren des KZT (Forman et al., 1990 ; Buetow, 1995; Dieckmann et al. , 2003) EBM-Level Level I Level II Level III Level IV Merkmal Maldeszensus testis Kontralateraler TIN / Hodentumor Hodenkrebs-positive Familienanamnese Intersex-Genitalfehlbildungen (wegen geringer Fallzahlen kein h•heres Niveau erreichbar) Infertilit€t Zwillingsstatus Hodenatrophie Skrotal-Trauma Inguinale Hernie Atopie Anamnestisch Infektionskrankheiten Mumpsorchitis Hodentorsion Erh•hte skrotale Temperatur (Unterhosen-Typ) Varikozele Fr‚her Pubert€tseintritt Sportliche Bet€tigung Akne-Anamnese Androgene Alopezie H•here soziale Klasse HIV-Infektion 28 Der Maldeszensus gilt heute als der am besten abgesicherte Risikofaktor (United Kingdom, 1994). 3,5 – 14,5 % aller Patienten mit Kryptorchismus je nach Studie (Dow und Mostofi, 1967; Gilbert und Hamilton, 1940; Giwercman et al., 1987, 1988, 1989) entwickeln einen malignen Keimzelltumor, unabh€ngig von der Tatsache, ob die Dystopie des Hodens operativ beseitigt wurde oder nicht. Neuere Studien sehen das Risiko nur 3,5 bis 5 mal h•her, €ltere 10-14 mal h•her als bei einer gesunden Kontrollgruppe (Giwercman et al., 1987; Pottern et al., 1985, Prener et al., 1996). Es ist nur eine Studie publiziert, in der die Autoren keine signifikante Steigerung durch die Fehllage finden (Schottenfeld et al., 1980). Eine Oligospermie in Begleitung eines einseitigen Kryptorchismus wird in 15 – 25 % der F€lle beobachtet (Bar-Maor et al., 1979). Bei exakter klinischer Exploration werden geh€uft weitere Anomalien des Urogenital-Traktes gefunden wie Ureter duplex, Ureter-Ektopie, Hypospadie und ektope Nieren (Sakashita et al., 1980; Swerdlow et al., 1982; Prener et al., 1996). Die Autoren ziehen daraus den R‚ckschluss, dass Patienten mit Kryptorchismus einen generalisierten Defekt in der urogenitalen Embryogenese mit beidseitigen dysgenetischen Gonaden aufweisen, die f‚r ein Neoplasma pr€disponieren (Fram et al., 1982). Selbst f‚r den kontralateralen, orthotopen Hoden ist das Risiko deutlich erh•ht (Gilbert und Hamilton, 1940; Johnson et al., 1968; Prener et al., 1996; Pottern et al., 1985). Ob die operative Behandlung des Maldeszensus das Karzinomrisiko vermindert oder gar beseitigt ist noch unklar, aber eher unwahrscheinlich. Die Fehllage ist nicht die eigentliche onkogene Noxe, weshalb man von der Annahme ausgehen kann, dass die Operation das Risiko nicht 29 ver€ndert (Batata et al., 1982). Je h•her im Zuge der Entwicklung der Deszensus des Hodens sistiert, desto gr•ƒer ist das Risiko der Entartung (Gilbert et al., 1940; Johnson et al., 1968). Der Anteil der Seminome an der Zahl der Keimzelltumoren insgesamt bei Patienten mit Kryptorchismus wird mit 50 % angegeben (Jacobsen et al., 1984), in den abdominal liegenden Hoden entstehen zu 89 %, in den Leistenhoden zu 78 % Seminome (Halme et al., 1989). Patienten mit einseitiger Hodentumorerkrankung tragen ein 25-fach erh•htes Erkrankungsrisiko auf der kontralateralen, bisher gesunden Seite. Der Nachweis dieses Faktors ergab sich aus drei Krebsregister-basierten Pr€valenzstudien (Level II), die 1990 von Forman et al. und 1995 von Buetow et al. ver•ffentlicht wurden. Dieser Risikofaktor wurde biologisch-klinisch nachhaltig durch den Nachweis der kontralateralen TIN gest‚tzt (Dieckmann, 2003). Die famili€re Disposition gilt als gut gesichert (Level II). Zwar geh•ren nur 2 % der Patienten mit Hodentumor in diese Serie, aber Br‚der eines Erkrankten tragen ein f‚nf- bis sechsfach erh•htes Risiko, S•hne von erkrankten V€tern ein zwei- bis vierfach erh•htes Erkrankungsrisiko (Swerdlow, 1998). Die Infertilit€t z€hlt zu den Risikofaktoren mit mittlerem Evidenzgrad (weitgehend gesichert bzw. wahrscheinlich). In diesem Zusammenhang sind Patienten mit Kryptorchismus oder Gonaden-Dysgenesie von Interesse. Bei 22 % der Patienten mit Kryptorchismus war als Ursache f‚r eine Infertilit€t eine TIN festzustellen. Es zeigte sich eine Verdr€ngung der Spermiogenesezellen durch sich ausbreitende TIN-Zellen (Skakkebaek et al 1981). Swerdlow registrierte, dass Infertilit€t ohne Kryptorchismus keine erh•hte Rate an Keimzelltumoren nach sich zieht (Swerdlow et al., 1989). Giwercman beschrieb eine IGCNU-Rate bei subfertilen M€nnern 30 von 0,4 bis 1,1 % (Giwercman et al., 1987), Gondos von 0,5 bis 1 % (Gondos und Migliozzi, 1987). Einer besonderen Erw€hnung bedarf das Trauma des Skrotums, das neben dem Maldeszensus den am h€ufigsten angef‚hrten Risikofaktor darstellt. Der Zusammenhang ist statistisch jedoch nicht nachzuweisen (Merzenich et al., 2000). Immer wieder werden bestimmte berufsbedingte Noxen auf ihre Relevanz beim Hodenkrebsrisiko untersucht. So wurde ‚ber H€ufungen mechanikern bei Feuerwehrm€nnern, (Pearce, 1987) Landwirten, und Angeh•rigen Flugzeuganderer Berufszweige berichtet (Albers et al., 2003; McDowell, 1986). Verschiedene Studien haben das erh•hte Erkrankungsrisiko bei Mitgliedern sozio•konomisch h•her stehender Bev•lkerungsanteile, sowie bei ausgebildeten gegen‚ber weniger qualifizierten M€nnern nachweisen wollen (Graham et al., 1977; Davis et al., 1981; McDowell, 1986; Akre et al., 1996). Die Nachpr‚fung der Daten ergab aber keine gesicherte Zuordnung zu dem einen oder anderen Berufsbild. Eine weitere Studie hatte sich damit besch€ftigt, eine Beziehung zu Viruserkrankungen, hier insbesondere dem Epstein-Barr-Virus herzustellen (Algood et al., 1988). Immunhistochemisch war allerdings in den Tumoren kein Hinweis auf die Virus€tiologie zu finden. Eine ansteigende Zahl von Erkrankungen wurde, charakteristischerweise in geringerem Durchschnittsalter, bei AIDSPatienten (Wilson, 1992; Leibovitch et al., 1996) sowie bei anderen Formen einer Immunsuppression gefunden (Leibovitch et al., 1996). Lange Zeit wurden, historisch bedingt, weitere Faktoren als Risiko f‚r die Entstehung eines Hodentumors angesehen (Forman et al., 31 1990). Inzwischen ist aber klar, dass eine entsprechende Assoziation nicht existiert. F‚r die fehlende Relevanz dieser in Tab I.3-3 dargestellten Merkmale gilt der Evidenz-Level II. Tab. 1.3-3: Ausgeschlossene Risikofaktoren f‚r Keimzelltumore EBM RF Level II Adipositas Vasektomie, Zirkumzision Rauchen, Alkoholkonsum Hydrozele, Varikozele Tonsillektomie Appendektomie 32 1.4. Pathogenese Zur Entstehung der TIN und der invasiven Keimzelltumoren sind viele Theorien und Hypothesen aufgestellt worden. Hierbei wurde sowohl das WIE als auch der Zeitpunkt der Ursache vielf€ltig durchleuchtet. Heute bevorzugt die Hodentumorforschung zur Darstellung der Pathogenese die ˆstrogen‚berschuss-Theorie (Forman et al., 1990; Moller, 1993; Bokemeyer et al., 1992). Diese Theorie geht davon aus, dass Hodenkrebs bereits w€hrend der Schwangerschaft, also w€hrend der embryonalen Entwicklung des sp€teren Patienten gebahnt wird. Ein relativer „berschuss an ˆstrogenen in der Fr‚hschwangerschaft soll die Entwicklung der Gonaden entscheidend beeinflussen (Tamimi, 2002). Die normale Entwicklung der primordialen Keimzellen stagniert unter dem Hormoneinfluss der Mutter und f‚hrt zum Wandel in TIN-Zellen, den Vorl€uferzellen des sp€teren Hodentumors. Diese TIN-Zellen verharren w€hrend der Kindheit in einem Ruhezustand und wandeln sich erst unter der ver€nderten Hormoneinwirkung der Pubert€t sowie dem Einfluss weiterer, bisher noch unbekannter Kofaktoren um, so dass sie den definitiven malignen Charakter erhalten. Es bestehen „berlegungen, dass die programmierte Apoptose (Zelltod) durch den Einfluss von p53 gest•rt sei. Der Transkriptionsfaktor p53 ist ein Protein, das sich im Falle eines nicht reparierten DNA-Defektes im Kern anreichert und den Zelltod zum Schutz des Gesamtorganismus einleitet. Ist dieser Mechanismus inaktiviert oder im Ablauf gest•rt, kann es zur Kodierung defekten DNA-Materials f‚hren (Schweyer, 2005). Die Abstammung der Keimzell-Tumoren von der TIN ist durch pathologisch-klinische Untersuchungen zweifelsfrei gesichert. Die pathogenetische Bedeutung des ˆstrogen‚berschusses konnte nur in- 33 direkt durch epidemiologische Untersuchungen belegt werden. Tats€chlich aber wurde in den USA durch vier Fallkontrollstudien belegt, dass eine Hormontherapie in der Schwangerschaft zu einem signifikant erh•hten Hodenkrebsrisiko bei m€nnlichen Nachkommen f‚hrt (Dieckmann, 2003). Diese Studien wurden nicht unwidersprochen hingenommen, zumal bei weitem nicht alle M‚tter von Hodenkrebspatienten w€hrend der Schwangerschaft Hormone zu sich genommen hatten. Daher wandte sich die Forschung Indikatoren des endogenen ˆstrogen‚berschusses zu („SurrogatParameter“) (Swerdlow, 1998). Groƒe ethnische Unterschiede in der Hodenkrebsinzidenz wurden mit hormonalen Faktoren erkl€rt. Endokrinologische Studien haben gezeigt, dass schwarzafrikanische gegen‚ber weiƒen Frauen w€hrend der Schwangerschaft h•here Androgenspiegel aufweisen, demzufolge w€ren ˆstrogene in einem relativ geringeren Maƒ vorhanden. Dies w‚rde im Sinne der ˆstrogen‚berschuss-Theorie erkl€ren, warum der Hodenkrebs bei schwarzafrikanischen M€nnern deutlich seltener auftritt als bei Weiƒen (Dieckmann, 2003). Auƒerdem ist aus endokrinologischen Untersuchungen bekannt, dass der maternale ˆstrogenspiegel bei Primiparae h•her ist als bei Mehrgeb€renden der maternale ˆstrogenspiegel bei €lteren Geb€renden (>30 Jahre) ebenfalls h•her ist ein relativ h•herer ˆstrogenspiegel h€ufig ein geringes Geburtsgewicht bedingt ein relativ h•herer ˆstrogenspiegel bei der Entstehung von Brustkrebs eine Rolle spielt 34 Zur St‚tzung dieser ˆstrogen‚berschuss-Theorie m‚ssen Hinweiszeichen f‚r einen erh•hten maternalen ˆstrogenspiegel bei Hodenkrebspatienten gesucht werden. Zu erwarten w€re also, dass Hodenkrebspatienten h€ufiger Erstgeborene einer Familie sind sie h€ufiger Einzelkinder sind von M‚ttern stammen, die bei der Geburt des Sohnes €lter als 30 Jahre waren M‚tter haben, die h€ufiger an Mamma-Karzinomen erkranken als Kinder ein niedriges Geburtsgewicht haben Dieckmann et al. (2003) haben die Studien zu diesem und anderen Themen ausgewertet und sind zu dem Ergebnis gekommen, dass die Datenlage alles andere als eindeutig ist. „Zusammenfassend kann zur ˆstrogen‚berschuss-Theorie festgestellt werden, dass sie mit den heute bekannten Pathogenese-Wegen der Hodentumoren gut kompatibel ist und daher vom biologischen Ansatz her einen hohen Wahrscheinlichkeitswert hat.“ (Dieckmann et al., 2003). In der Hodentumor-Pathogenese sind zwei Faktoren bekannt, einerseits die Identifizierung der Vorstufe TIN, andererseits die bekannten genetischen Faktoren. Die ˆstrogen-Theorie passt gut dazu, ist aber bis heute nicht definitiv bewiesen. Eine weitere Theorie kommt hinzu: die hochkalorische kindliche Ern€hrung. Diese soll den in utero entstandenen Vorl€uferzellen (TIN) postnatal die maligne Pr€gung aufzwingen. Dies l€sst sich damit begr‚nden, dass die Hodenkrebsinzidenz seit Beginn des 20. Jahrhunderts weltweit ansteigend ist, dass aber ein deutlicher R‚ckgang der Inzidenz in den Geburtsjahrg€ngen im und nach dem 2. Weltkrieg zu verzeichnen war, der in den f‚nfziger Jahren wieder aus- 35 geglichen wurde. Da dieser Verlauf nur durch exogene Einfl‚sse zu erkl€ren ist, bietet sich die Ern€hrungstheorie an. Das Auftreten der Hodentumoren im fr‚hen Erwachsenenalter legt die Vermutung nahe, dass die fr‚hkindliche Ern€hrung wegbereitend f‚r diese Krankheit sein k•nnte. Hierzu existieren zwei Fallkontrollstudien, die eine positive Assoziation von Hodenkrebs mit hochkalorischer kindlicher Ern€hrung bzw. mit milchprodukthaltiger Ern€hrung festgestellt haben (Dieckmann, 2003). Ein Surrogat-Parameter f‚r die kindliche Ern€hrung ist die sp€ter erreichte K•rpergr•ƒe, die zwar auch von genetischen Faktoren abh€ngig ist, jedoch kommt der fr‚hkindlichen Ern€hrung eine ganz besondere Bedeutung zu. Im Sinne der Ern€hrungstheorie w€ren unter den Hodentumorpatienten mehr groƒe M€nner zu erwarten als in einem Vergleichskollektiv. Zehn Fallkontrollstudien wurden durchgef‚hrt (Dieckmann, 2002); vier Studien st‚tzten die These, sechs Studien waren in keiner Weise signifikant. Zur Zeit l€uft in Deutschland unter der Schirmherrschaft der AUO (Arbeitsgemeinschaft Urologische Onkologie) eine multizentrische Studie zur Pr‚fung des Zusammenhanges zwischen K•rperstatur unter Ber‚cksichtigung der K•rpergr•ƒe bzw. dem BMI (Body Mass Index) und Hodentumor. Die Ern€hrungstheorie ist interessant, weil die geographischen Unterschiede in der Inzidenz dadurch zu erkl€ren w€ren. In volkswirtschaftlich armen L€ndern wie Asien und Afrika ist die Zahl der Hodentumorerkrankungen vergleichsweise gering. Umgekehrt w‚rde eine verbesserte Ern€hrungssituation eine ansteigende Inzidenz erwarten lassen, wie dies aus der Situation in der westlichen Welt abzulesen ist. Eine endg‚ltige Entscheidung ‚ber den 36 Sinn und die Bedeutung der verschiedenen Theorien ist heute noch nicht zu treffen, Ans€tze deuten sich aber an. 37 1.5. Anatomie 1.5.1. Makroskopisch Im Zuge der intrauterinen Entwicklung deszendieren die beiden Hoden aus der Bauchh•hle via Leistenkanal nach skrotal. Zum Zeitpunkt der Geburt ist dieser Vorgang abgeschlossen und der Prozessus vaginalis engt sich so weit ein, dass eine Retention nicht m•glich ist. Kommt es zu einer St•rung oder Verz•gerung, stagniert unter Umst€nden dieser Vorgang und es stellt sich eine Hodenektopie ein. Die Position des Hodens kann komplett intraabdominal, intracanalicul€r oder hochskrotal sein. Der Pendelhoden ist hiervon zu unterscheiden. Hier hat ein kompletter Deszensus stattgefunden, bei persistierend weitem Prozessus vaginalis ist es jedoch m•glich, dass der Hoden in den Leistenkanal rutschen kann. Die Blutversorgung erfolgt durch die Arteria testicularis, die aus der Aorta abdominalis abzweigt. Diese verbindet eine Anastomose mit der A. ductus deferentis und A. cremasterica. Im Hoden treten die Gef€ƒe durch das Rete testis ein und aus. Das ven•se Blut l€uft von hier ‚ber den Plexus pampiniformis in die Vena testicularis. Rechts m‚ndet diese direkt im spitzen Winkel in die Vena cava inferior, links erfolgt der Umweg ‚ber die Vena renalis in die Hohlvene. Aufgrund des rechtwinkligen und damit str•mungsung‚nstigen Abflusses der V. testicularis in die V. renalis kann es hier bei hohen Druckverh€ltnissen zur Ausbildung einer Varicocele kommen. Die Lymphabflusswege folgen dem ven•sen Abfluss. Hieraus erkl€rt sich, dass zum einen die ersten Lymphknotenstationen paraaortal be- ziehungsweise paracaval liegen und zum zweiten eine lymphogene Aussaat eher von rechts nach links als anders herum stattfinden kann. Zusammen mit den Gef€ƒen l€uft der Ductus deferens vom 38 Nebenhoden durch den Leistenkanal. Am Anulus inguinalis internus verl€sst er die Gef€ƒe und zieht an der Beckenwand nach caudal, um in der Prostata in die prostatische Harnr•hre zu m‚nden. Abb. 1.5-1: Anatomische Strukturen des Hodens Das Hodengewebe wird von der derben bindegewebigen Tunica albuginea eingeh‚llt. Innen liegen die Tubuli seminiferi, welche von dem Rete ausgehen. Der Nebenhoden liegt dem Hoden kappenf•rmig auf und besteht aus einem Kopf- und Schwanzanteil. 1.5.2. Histologie Der Tubulus seminiferus zeigt sich im Schnitt meist als runde Struktur, tats€chlich handelt es sich um R•hrchen, die innen mit dem Keimepithel ausgekleidet sind. Der Durchmesser liegt bei 180280 Žm. 39 Abb. 1.5-2: Histologisches Bild (HE-F€rbung): Physiologisches Hodengewebe (L = Leydigsche Zwischenzelle, B = Basalmembran) Quelle: • PathoPic (ID 3319) Abb. 1.5-3: Histologisches Bild (HE-F€rbung): Unauff€lliges Hodenparenchym mit ausreifender Spermiogenese in den Tubuli, Leydigzellen im Interstitium. Quelle: • PathoPic (ID 4122) Die Spermatogenese findet unter dem Einfluss von Testosteron und dem Follikel stimulierenden Hormon (FSH) statt. Sie beginnt an der Basalmembran mit den Spermatogonien als Stammzellen. Diese teilen sich in die Spermatozyten 1. Ordnung, woraus nach einer Reifeteilung die Spermatozyten 2. Ordnung resultieren. Die Spermiogenese beginnt mit einer weiteren Reifeteilung der Spermatozyten 2. Ordnung in die Spermatiden. Am Ende stehen die Spermatozoen, die im Lumen des Tubulus liegen. Die graphische Darstellung ist in Abb. 1.5-4 dargestellt. 40 Abb. 1.5-4: Keimepithel: 1 Basalmembran; 2 Sertolizelle; 3 Spermatogonie; 4 Spermatozyte I.Ordnung; 5 Interzellularbr‚cke; 6 Spermatide ; 7 Differenzierungsstufen Spermatide zur Samenzelle (nach Donner, 2003) 41 1.6. Histopathologie 1.6.1. TIN Die intraepithelialen glykogenreichen Neoplasien sind Seminomzellen €hnlich, sie enthalten ebenso plazentare alkalische Phosphatase und liegen im Bereich der Sertolizellen im Keimepithel. Die Abgrenzung zu Spermatogonien ist durch die deutlich dickere Membran und die gr•ƒeren Zellen m•glich (Montironi, 2002). Hierbei wird die Spermiogenese h€ufig gest•rt und der Hoden weist eine Atrophie auf. Eine eindeutige Kausalit€t besteht hier jedoch nicht. Der das Keimepithel verdr€ngende Prozess bei der Entstehung der TIN-Zellen auf der Basalmembran w‚rde eine St•rung der Spermienreifung allerdings erkl€ren. Die TIN-Zellen sind in der Umgebung aller Keimzelltumoren nachweisbar (Wittekind, 1998). Inzwischen gilt es als gesichert, dass aus einer TIN Seminome wie Nichtseminome entstehen, die Ausnahme bildet das sehr seltene spermatozytische Seminom (Wittekind, 2003; Dieckmann, 2005). Die Diagnose wird durch skrotal gewonnene Probebiopsien gestellt. Hierbei gilt es, einige Punkte zu beachten. Bei der Entnahme sollte das Gewebe nicht gequetscht werden und die entnommenen Biopsien d‚rfen nicht in Formalin fixiert sein, da hierbei die Feinarchitektur des Gewebes verzerrt wird. Es sollte die Bouin•sche oder Stieve•sche L•sung verwendet werden. TIN-Zellen lassen sich mit mehreren Anf€rbetechniken histopathologisch darstellen; die Zellen erscheinen aufgrund des hohen Glykogenanteils optisch leer, immunhistochemisch ist die Darstellung jedoch sehr gut m•glich. Der Nachweis von Plazentarer alkalischer Phosphatase (PLAP) gilt als beweisend f‚r die TIN. 42 Die vorliegenden Bilder einer TIN in Gegenwart eines Seminoms stammen aus dem eigenen Patientengut (Patient 4: pT1 N0 M0 S0 ; CS IA). Die Vorstellung in unserer Klinik erfolgte 2001, die Anamnese bez‚glich Risikofaktoren f‚r eine Hodenneoplasie war leer. Bei palpatorischem Tumorverdacht zeigte sich sonographisch ein abgrenzbarer Tumor sowie das klassische Bild einer Mikrolithiasis (Sternenhimmel). Die Gegenseite war sonographisch unauff€llig. Nach Tumornachweis und Ablatio testis wurde der Patient einer Radiatio der retroperitonealen Lymphknoten zugef‚hrt. Die Biopsien der Gegenseite wiesen keine TIN auf. Abb. 1.6-1: Histologisches Pr€parat (HE): Seminom mit TIN-Zellen in benachbartem Hodenkan€lchen. (S = Seminomzellen, T = TIN-Zellen) Bei der in Abb. 1.6-1 verwendeten HE-F€rbung (H€matoxylin- Eosin) zeigen sich die Nukleolen violettfarben, die Hodenkan€le rosa bewandet. Das S markiert die Zellen des Seminoms mit ihren groƒen Zellkernen. Die schaumigen intratubul€ren atypischen Zellen der TIN sind mit einem T markiert. Eine Spermiogenese ist hier nicht mehr nachweisbar. 43 Aufgrund des hohen Anteils von Glykogen sind die TIN-Zellen mit der PAS-F€rbung (Periodic Acid Schiff Reaktion) gut darstellbar. In Abb. 1.6-2 sieht man die Zellen deutlich an der Basis der Tubuli hervorgehoben. Abb. 1.6-2: Histologisches Pr€parat (PAS): Intratubul€re TIN-Zellen Der Goldstandard der Nachweismethoden einer TIN ist jedoch die Nutzung der plazentaren alkalischen Phosphatase (PLAP). Hier heben sich die Zellen deutlich br€unlich von den ‚brigen blaugr‚n eingef€rbten Zellen ab. Dar‚ber hinaus werden nur TIN-Zellen gef€rbt, welches einen sicheren Nachweis bietet (s. Abb. 1.6-3). Abb. 1.6-3: Histologisches Pr€parat (PLAP): TIN-Zellen durch PLAP-F€rbung br€unlich eingef€rbt 44 1.6.2. Seminom Das Seminom kann einzeln oder in mehrknotiger Form auftreten und w€chst invasiv und destruierend; vorkommende beta-HCGpositiven Synzytiotrophoblasten k•nnen Ursache f‚r erh•hte Serumspiegel von ƒ-HCG sein. Die Differenzierung zum Seminom ist durch den Anteil PLAP-postiver Zellen gegeben, welcher beim Seminom deutlich h•her ist. Abb. 1.6-4: Makroskopisches Bild eines Seminoms Quelle: • PathoPic (ID 4080) Abb. 1.6-5: Mikroskopisches Bild eines Seminoms (HE-F€rbung) Deutlich zu erkennen sind die monomorphen Tumorzellen mit einem zentralen prominenten eosinophilen Nukleolus und groƒen runden 45 Kernen. Auch dieses Bild entstammt dem eigenen Patientengut (Patient Nr. 4). 1.6.3. Spermatozytisches Seminom Neben seminom€hnlichen und kleinen lymphozyten€hnlichen Zellen zeigen sich groƒe spermatozyten€hnliche mehrkernige Riesenzellen. Eine TIN als Vorstufe kommt aufgrund des unterschiedlichen Ursprungs nicht in Frage (siehe Abb.1.6-6). Die TIN und die resultierenden Keimzelltumore entstammen den Gonocyten, w€hrend das sehr seltene spermatozytische Seminom aus den Prospermatogonien entsteht. Auch als Part eines Mischtumors ist das spermatozytische Seminom ausgeschlossen, wenn es nicht als Zweitmalignom im gleichen Hoden vorliegt. Abb. 1.6-6: Histogenese der germinalen Keimzelltumoren (Quelle: Dieckmann, 2005) 1.6.4. Embryonales Karzinom Aufgrund des pseudoglandul€ren Erscheinungsbildes ist die Unterscheidung zum Seminom schwierig. Die sichere Differenzierung er- 46 folgt durch die Immunhistochemie: Wie beim Seminom liegen betaHCG-positive Riesenzellen und vereinzelt PLAP-positive Zellen vor. Allerdings sind fast durchweg CD-30-Antigen und Zytokeratine nachweisbar, welches die sichere Differenzierung zum Seminom erm•glicht. Abb. 1.6-7: Histologische Darstellung eines Embryonalkarzinoms (HE-F€rbung) Mitose (M) ; Apoptose (A) , Blutgef€ƒ (B) Quelle: • PathoPic (ID 4688) Der Nachweis von vielen Mitosen, Apoptosen und Blutgef€ƒen zeugt von schnellem Tumorwachstum. Die trabekul€r angeordneten Tumorzellen weisen groƒe ausgepr€gt polymorphe, entrundete und hyperchromatische Zellkerne auf (Abb. 1.6-7). 1.6.5. Dottersacktumor Histologisch zeigen sich myxoide Zellen, die einem Adenokarzinom gleichen. Selten sind leber€hnliche Strukturen zu sehen. Der Name entspringt jedoch dem €hnlich netzartigen Ger‚st des Dottersackgewebes; auffallend sind glomeruloide Strukturen (Schiller-DuvalKorpuskel) mit lockerem Bindegewebe innen und einer €uƒeren Epithelschicht (Abb. 1.6-8). 47 Abb. 1.6-8: Dottersacktumor mit Schiller-Duval-Korpuskel (Pfeil) (Quelle: Riede, 1993) 1.6.6. Teratom Das Teratom ist durch den Anteil aller drei Keimbl€tter gekennzeichnet. Die h€ufig verwendete Bezeichnung zwischen reif und unreif spielt prognostisch und therapeutisch keine Rolle, eine Malignit€t liegt praktisch immer vor. Beim erwachsenen Mann sind immer unreife Anteile nachweisbar. Bedeutung erh€lt die Unterscheidung nach erfolgter Chemotherapie, da hier reife Anteile zur‚ckbleiben k•nnen, die chemotherapieresistent sind. Abb. 1.6-9: Histologische Darstellung eines Teratoms Quelle: • PathoPic (ID 3084) 48 Histologisch kommen glandul€re Strukturen in lockerem Stroma zur Darstellung. H€ufig sind muskul€re, knorpelartige und dr‚senartige Strukturen nebeneinander zu erkennen (Abb. 1.6-9). 1.6.7. Chorionkarzinom Histologisch zeigen sich mononukleare, zytotrophoblasten€hnliche und trophoblast€re Riesenzellen nebeneinander; h€ufig bestehen ausgedehnte Parenchymblutungen mit randst€ndigen Tumorzellen. Der Tumor ist aus zwei verschiedenen Zelltypen aufgebaut. Gruppen von kleineren zytotrophoblast€ren Zellen mit deutlichen Zellgrenzen werden an der Invasionsfront kappenartig bedeckt von synzytiotrophoblast€ren mehrkernigen Riesenzellen. Die Tumorzellen liegen auf einem h€morrhagischen Hintergrund (Abb. 1.6-10). Abb. 1.6-10: Histologische Darstellung eines Chorionkarzinoms Quelle: • PathoPic (ID 3083) 1.6.8. Polyembryom Beim Polyembryom handelt es sich um eine seltene Tumorart, makroskopisch zeigt sich der Tumor mit einer bunten Schnittfl€che sowie Zysten und Einblutungen. 49 Abb. 1.6-11: Histologische Darstellung eines Polyembryoms. Seminomat•ser und nicht-seminomat•ser Mischtumor (Polyembryom 80%, Seminom 20%) Quelle: • PathoPic (ID 3085) 50 1.7. Diagnostik Die Diagnostik der TIN unterscheidet sich nicht von der Hodentumordiagnostik, dabei lassen sich invasive von nichtinvasiven Methoden unterscheiden. Die Labordiagnostik mit Entnahme der Tumormarker ist obligat. 1.7.1. Nichtinvasive Verfahren Neben der ausf‚hrlichen Anamnese sind insbesondere die bekannten Risikofaktoren f‚r Hodentumorerkrankungen zu erfragen (Kliesch, 2004). Hierzu z€hlen: Hodenhochstand (Maldescensus testis), kontralateraler Hodentumor, Verwandte ersten Grades (Vater, Bruder) mit Hodentumorerkrankung Die „ Guidelines on Testicular Cancer“ der European Association of Urology schlieƒen noch das Klinefelter-Syndrom mit ein. Das Stellen sogenannter offener Fragen bei der Anamneseerhebung (Hatten sie Voroperationen?) birgt das Risiko, entsprechende Raumforderung zu ‚bersehen. Handelt es sich doch f‚r die meist jungen Patienten um ein tabuisiertes Gebiet. Nicht selten kommen diese mit fortgeschrittenen Krankheitsbildern in die Klinik und geben an, dass ihnen am Hoden nichts aufgefallen sei. Neben Verdr€ngung spielt die Scham eine nicht unerhebliche Rolle. H€ufig zeigen sich erst durch Narben Hinweise darauf, dass eventuell ein Zustand nach Funikulolyse wegen eines Kryptorchismus besteht. Darauf angesprochen, erinnert sich der 51 Patient dann doch an eine solche Operation und hatte dies einfach vergessen oder der Operationszeitpunkt lag in der fr‚hesten Kindheit. Die klinische Untersuchung steht unter besonderer Beachtung des Hodens. Das Vorliegen eines „paarigen Organs“ erleichtert in der Regel die Beurteilbarkeit, da ein Vergleich mit der Gegenseite m•glich ist. Ein wichtiger Aspekt ist die Lokalisation. Einem Leistenoder Pendelhoden kommt eine wesentliche klinische Bedeutung zu. Bei inguinaler Lage des Hodens ist die Palpation oft kaum m•glich. Eine Hodenagenesie ist selten und aufwendig zu diagnostizieren. Aus Traumen (auch iatrogen: Leistenhernienoperation) oder Entz‚ndungen k•nnen Atrophien resultieren. Die Palpation der Hoden beinhaltet die Gr•ƒe, Mobilit€t im Skrotalfach und Konsistenz. W€hrend beim Hodentumor meist eine Vergr•ƒerung und Induration zu tasten ist, zeigt sich die TIN palpatorisch unauff€llig. Wichtig ist auch der Lymphknotenstatus, insbesondere supraclavikul€r (vor allem links) sind Lymphome auszuschlieƒen. Eine Gyn€komastie wird in der Literatur (European Guidelines) mit einer H€ufigkeit von 7% angegeben und ist zumeist mit nicht-seminomat•sen Tumoren vergesellschaftet. Die Eingrenzung der Diagnose erfolgt vor allem durch die Ultraschalluntersuchung. Unter Verwendung eines 7,5 oder 10 MHzSchallkopfes steht auch hier die (seiten-)vergleichende Untersuchung im Vordergrund. Die Sensitivit€t liegt bei ann€hernd 97%. Grundlage der Untersuchung ist die Bestimmung der Lage und Gr•ƒe des Hodens sowie die Homogenit€t des Parenchyms. Auff€llig bez‚glich eines Hodentumors sind hypodense Areale und generelle Inhomogenit€ten des Parenchyms (s. Abb. 1.7-1). 52 Abb. 1.7-1: Sonographiebild eines Hodentumors (Quelle: Kliesch, 2004) Ein h€ufiger Ultraschallbefundbefund ist das „Schneegest•ber“ oder der „Sternenhimmel“. Die Erkl€rung liegt in der Testikul€ren Mikrolithiasis (TM) des Hodens mit multiplen echogenen 2-3 mm messenden Herden ohne Schallschatten. Beweisend f‚r eine TIN ist dies jedoch nicht; eine Assoziation mit einer TIN besteht wohl nur bei beidseitigem Befund. Eine Rotterdammer Arbeitsgruppe hat in einer Studie einen signifikanten Unterschied beim Vorliegen einer beidseitigen TM und gleichzeitigem pathologischen Nachweis einer TIN aufzeigen k•nnen. Hier waren bei insgesamt 263 Patienten mit einem Keimzelltumor in 53 F€llen (20%) eine TM nachgewiesen worden. Dabei waren 23 Patienten einseitig und 30 bilateral betroffen. Bei den einseitigen TM-Befunden fand sich keine TIN, w€hrend bei sechs von den 30 bilateralen Nachweisen tats€chlich eine TIN gesichert werden konnte (de Gouveia Brazao et al., 2004). Bez‚glich einer m•glichen Pr€valenz f‚r das Vorliegen einer TIN wird die Hodenatrophie, die beidseitige TM und das Diagnosealter unter 30 Jahre angegeben. Die folgende Ultraschallaufnahme zeigt einen solchen Befund. Dopplersonographisch kommen intraparenchymale Arterien sowie der Venenplexus am Oberpol (rechts im Bild) zur Darstellung (Abb. 1.7-2). 53 Abb. 1.7-2: (Doppler-)Sonographisches Bild einer TIN (Schaper et. al., 2003) Das histologische Korrelat besteht in einer intratubul€r gelegenen Kalzifikation im Lumen der Tubuli seminiferi. Abb. 1.7-3: Intrabulul€r gelegene Mikrolithiasis (Schweyer und Fayyazi, 2005) Erg€nzend zur Skrotalsonographie folgt die Untersuchung des Abdomens. Hierbei sollte neben der Organbeurteilung auf das Vorliegen retroperitonealer Raumforderungen in unmittelbarer Nachbarschaft von Vena cava und Aorta abdominalis geachtet werden. Normalerweise lassen sich Lymphknoten erst ab einer Gr•ƒenordnung von 5-10 mm nachweisen (Rassweiler et al., 1997). 54 Abb. 1.7-4: Sonographischer L€ngsschnitt ‚ber der Aorta (1 = Leber, 2 = Pfortader€ste, 3 = Aorta, 4 = Truncus coeliacus, 5 = A. mesenterica superior, 6 = V. lienalis) Abb. 1.7-5: Sonographischer Pankreas-Transversalschnitt (1 = Leber, 2 = Pankreas, 3 = V. lienalis, 4 = A. mesenterica sup., 5 = V. cava inf., 6 = Aorta, 7 = V. renalis sinistra). (Quelle: ˆGUM-Leitlinien, 2005) Die Abb. 1.7-4 und 1.7-5 zeigen das Abdomen mit physiologischen Verh€ltnissen. Pathologische Vergr•ƒerungen der Lymph-knoten w€ren hier gut darstellbar. Als der Sonographie ‚berlegen in Sensitivit€t und Spezifit€t zeigt die Kernspintomographie hervorragende Bild-Qualit€t. Im Gegensatz zur Ultraschalluntersuchung ist es jedoch ein sehr kostenintensives Verfahren. Auƒerdem reicht die Ultraschalluntersuchung v•llig aus, um die Indikation zur Hodenfreilegung und eigentlichen Diagnosesicherung zu stellen. Im Folgenden ist die bildgebende Diagnostik 55 am Beispiel eines 16-j€hrigen Jungen mit einem Leydigzelltumor im Ultraschallbild (13MHz-Schallkopf) und MRT gegen‚bergestellt. Abb. 1.7-6: Ultraschall, rechter Hoden l€ngs, intratestikul€re, gering echoarme, glatt begrenzte Raumforderung mit geringer Hyperperfusion im Randbereich. Abb. 1.7-7: Ultraschall, rechter Hoden quer im Seitenvergleich, intratestikul€re, gering echoarme, glatt begrenzte Raumforderung mit Hyperperfusion im Randbereich. Abb. 1.7-8: MRT, T1-Wichtung vor KM-Gabe: homogene, nativ kaum abgrenzbare Raumforderung im rechten Hoden 56 Abb. 1.7-9: MRT, T1-Wichtung nach KM-Gabe. Homogene, glatt begrenzte Raumforderung mit deutlichem KontrastmittelEnhancement Abb. 1.7-10: MRT, T2-Wichtung transversal: homogene, glatt begrenzte Raumforderung mit Signalabsenkung (Quelle der Abb. 1.7-6 - 1.7-10: Weber et al., 2004) 1.7.2. Labordiagnostik / Tumormarker Auch hier ist die gleiche Labordiagnostik wie bei Hodentumoren durchzuf‚hren. W€hrend allgemeine Laborparameter nur sehr unspezifisch bez‚glich der Entwicklung eines Hodentumors sind, stellen sie doch die M•glichkeit der Erfassung von Komplikationsfolgen. Ein erh•hter Kreatininwert k•nnte Folge eines fortgeschrittenen Stadiums mit Bulky disease und resultierenden Harnstauungsnieren beidseits sein. Der erniedrigte H€moglobinwert verweist auf eine Tumoran€mie und indirekt auf einen schnell wachsenden Tumor mit entsprechender Auszehrung des Patienten. Die sogenannten Tumormarker stellen bei der Labordiagnostik des Hodenkarzinoms zumeist die wichtigste S€ule dar. Es handelt sich um Eiweiƒe, die entweder vom Tumor produziert werden oder in 57 Abbauprozessen entstehen (Klinikleitfaden Labordiagnostik, 2000). Dabei gibt es nicht den idealen Marker zu jedem Tumor. Zumeist geht eine b•sartige Erkrankung mit einer Kombination von Markern einher, f‚r das Hodenkarzinom sind das die Lactatdehydrogenase (LDH), das Alphafetoprotein (AFP) und das Humane Choriongonadotropin (HCG). Die Plazentare Alkalische Phosphatase (PLAP) hat sich als valider Tumormarker nicht bew€hrt, die Abnahme wird als fakultativ empfohlen (Winter, 2005). Tumormarker sollten allerdings nicht als Screeningverfahren, sondern vielmehr als Therapiekontrolle krebsoperierter Patienten dienen. Besser geeignet sind sie zur Verlaufskontrolle und Fr‚herkennung von Rezidiven (Schumpelick et al., 2004). AFP Bei einer Referenzobergrenze von 15 Žg/l gilt eine Erh•hung als Hinweis auf eine benigne Lebererkrankung oder andere Malignome (zum Beispiel bili€re oder hepatozellul€re, Kolon-, Lungen- oder Pankreaskarzinome), am h€ufigsten jedoch auf einen Keimzelltumor. Nach Orchiektomie betr€gt die Serumhalbwertzeit 4-5 Tage. HCG (ƒ-HCG) Normalerweise wird HCG in den Synzytiotrophoblasten der Plazenta gebildet. Extrem hohe Werte findet man bei einer Molenschwangerschaft und beim Chorionkarzinom. Moderate Erh•hungen liegen bei Tumoren des Dick- und D‚nndarms, Adenokarzinomen des Pankreas, Magen-, Lungen-, Ovarial-, Mamma- und Nierenzellkarzinomen vor. HCG besteht aus dem eigentlichen Eiweiƒmolek‚l mit einer sogenannten beta-Untereinheit; diese gibt dem beta-HCG seinen 58 Namen. Das Nachweisverfahren muss zwingend beide Anteile erfassen, weil viele Tumoren nur die beta-Einheit produzieren. Der Normbereich bei M€nnern und pr€menopausalen Frauen wird mit weniger als 5 U/l, bei postmenopausalen Frauen ca. 10 U/l an- gegeben. Die Serumhalbwertzeit betr€gt 16-24 Stunden. PLAP Auch die PLAP wird von Synzytiotrophoblasten der Plazenta gebildet. Sie ist ein Isoenzym der Alkalischen Phosphatase und kann in geringen Konzentrationen im gesunden Hoden, in der Zervix, im Thymus und in der Lunge nachgewiesen werden. Neben Seminomen zeigt die PLAP auch bei Nichtseminomen, Ovarial- und Lungentumoren einen Anstieg der Konzentration im Serum. W€hrend vor einigen Jahren viel Hoffnung in die PLAP gesetzt wurde, ist man sich inzwischen einig, dass diese Erwartungen nicht erf‚llt werden k•nnen. Dies liegt unter anderem daran, dass bei Rauchern ein bis zu 10-fach h•herer Wert zu finden ist. Dar‚ber hinaus zeigen sich ausgepr€gte individuelle Schwankungen ‚ber den Referenzwert von 100 U/l hinaus. Die Halbwertzeit im Serum wird mit 0,6-2,8 Tagen angegeben. LDH Die Lactatdehydrogenase wird neben der Herz- und Skelettmuskulatur in vielen Organen gebildet. Es existieren f‚nf Isoformen, wobei das LDH-1-Isoenzym in malignen Keimzelltumoren nachweisbar ist. Erh•hte Blutspiegel findet man jedoch auch beim Myokardinfarkt, der pernizi•sen An€mie, Leuk€mie, Thalass€mie und Lungenembolie. Bei geringerer Spezifit€t als AFP und HCG ist die Sensitivit€t der LDH insbesondere bei Seminomen doch so gut 59 (80%), dass sie als guter Verlaufsparameter zur Verf‚gung steht (Lamerz, 1999). Tab. 1.7-1: Serumtumormarker beim Keimzelltumor (modifiziert nach: European Group on Tumor Markers) Referenzwert LDH HWZ 120-240 Monitoring v.a. Lymphome [U/l] AFP < 15 Spezifit•t 5-7 d Diagnose, Prognose/Monitoring von Keimzell- und prim€ren [Žg/l] HCG hepatozellul€ren Karzinomen M: 0-100J < 5 F: 0-50J 24 h <5 non-seminomat•ser Keimzell- F: 50-100J <10 tumoren, Chorionkarzinome, Seminome, Blasenmolen [U/l] PLAP 100 0,6-2,8 d Monitoring von Keimzelltumoren [U/l] Legende: U/l h F Diagnose, Prognose/Monitoring Units/Liter Stunden Frauen (Seminome) d M J Tag M€nner Jahre Die Bestimmung muss pr€operativ und m•glichst am 5. postoperativen Tag erfolgen. Den Hintergrund stellen die Halbwertszeiten (HWZ) dar: W€hrend das ƒ-HCG eine HWZ von 24h hat, liegt diese beim AFP bei 5 Tagen. Man erwartet also zu diesem Zeitpunkt die Halbierung des AFP und vier bis f‚nfmalige Halbierung des ƒHCG. Diese Werte werden in der Serumtumorklassifikation ber‚cksichtigt. Vorausgesetzt es existieren keine weiteren Tumormassen in Form von Metastasen, sollte ein entsprechend deutlicher Abfall der Werte 60 zu verzeichnen sein. Bei markerpositivem Tumor ist eine Absch€tzung der Resttumorlast nach Entfernung des Tumors m•glich, insbesondere die LDH kann hier als gute Verlaufskontrollm•glichkeit dienen. Dies gestattet jedoch nicht den umgekehrten Schluss, dass bei ad€quatem Abfall der Werte keine Metastasen zu erwarten sind. Im weiteren Therapieverlauf sollte vor jedem Chemotherapiezyklus eine erneute Bestimmung erfolgen, um ein Ansprechen der Therapie beurteilen zu k•nnen. Zur Vermeidung systembedingter Fehler sollte die Analyse immer im gleichen Labor erfolgen. 1.7.3. Invasive Methoden Die invasiven Methoden sind die einzig belegenden Kriterien. Hierauf baut die lokale Therapie auf. Der Hodentumor ist durch die inguinale Freilegung und Probenentnahme aus dem entsprechenden Areal zu sichern. „ber das Verhindern der Aussaat von Tumorzellen via Blut- und Lymphbahnen bei der Manipulation am Hoden durch Abklemmen des Funikels existieren unterschiedliche Meinungen. In unserer Klinik wird der Funikel nach proximal gewebeschonend abgeklemmt. Die TIN ist durch die Entnahme von Hoden-Probebiopsien zu diagnostizieren. Zumeist erfolgt die Entnahme einzeitig mit einer Ablatio testis bei Tumor der anderen Seite. Insbesondere bei Patienten unter 30 Jahren mit einem Hodenvolumen unter 12 ml ist die Biopsie indiziert, da hier das Auftreten einer TIN mit einer Wahrscheinlichkeit von 34% angegeben wird (Kliesch, 2004). In unserer Klinik geh•rt generell die Probenentnahme aus der Gegenseite bei Hodentumorpatienten zum Standard. 61 Trotz der diffusen Verteilung der TIN-Zellen im Hoden ist man sich einig, dass eine einzelne Probe nicht ausreicht. Dieckmann (2003) zeigte die Notwendigkeit der Entnahme von zwei Biopsien in einer multizentrischen AUO-Studie auf, um ein falsch negatives Ergebnis m•glichst zu umgehen. Bei einem Drittel aller Patienten mit dem Nachweis einer kontralateralen TIN war nur eine von zwei Proben positiv. Die entsprechenden Zahlen sind in Tab. 1.7-2 farbig hervorgehoben. Tab. 1.7-2: Nachweis von TIN-Zellen (absolut und relativ) [TIN-2-Studie, Dieckmann und Loy, 2003] n % TIN in 2 Biopsien 83 3.41 TIN in nur 1 Biopsie 39 1,6 Gesamt TIN 122 5,01 Gesamt 2428 100 Ein deutlicher Unterschied zeigte sich im Zusammenhang zwischen einem TIN-Befall und der Hodenatrophie. Das Durchschnittsalter der TIN-postiven Patienten war mit 32,5 Jahren signifikant niedriger als bei den ‚brigen Probanden (36,2 Jahre) (Dieckmann et al., 2003). 1.7.4. Staginguntersuchungen Nach erfolgtem Nachweis eines malignen Hodentumors ist die Ausbreitungsdiagnostik anzuschlieƒen. Hierzu sind Computertomographien von Thorax und Abdomen indiziert. Die CT besitzt eine Sensitivit€t von 80%, aufgrund der Nachweisgrenze von 10-20 mm ist die Stadiengrenze zwischen IIA und B (entsprechend kleiner oder 62 gr•ƒer 2 cm groƒen Lymphknoten) schwierig. Hier sinkt die Sensitivit€t auf 71%. Die Abb. 1.7-11 zeigt computertomographisch einen ausgedehnten Lymphknotenbefall in H•he des Nierenhilus links. MM Abb. 1.7-11: Retroperitoneale Lymphknotenmetastase in H•he Nierenstiel links (Schefer et al, 2003) Die Positronenemissionstomographie (PET) bietet zum heutigen Zeitpunkt in der Bildaufl•sung wenig Vorteile gegen‚ber der CT; die sehr hohen Kosten verwehren den routinem€ƒigen Einsatz. Der Nachweis von Metastasen eines Keimzelltumors erfolgt ‚ber den Glucoseverbrauch der Zellen mit dem Tracer FDG, reife Teratome sind allerdings so nicht nachweisbar und werden im PET nicht dargestellt. Der Vorteil liegt jedoch in der M•glichkeit, vitales von nekrotisch zerfallendem Gewebe zu unterscheiden. Beim Restaging nach erfolgter Chemotherapie bietet sich so eine Entscheidungshilfe bei der Indikation zur Retroperitonealen Lymphadenektomie (RLA) an (Stattaus et al., 2005). Die Abb. 1.7-12 und 1.7-13 zeigen einen solchen Fall. Im Bereich der Bifurkation kommt eine vitale Lymphknotenmetastase eines Nichtseminoms nach voraus- gegangener Chemotherapie zur Darstellung, die im CT nicht oder nur sehr schwer nachweisbar ist. Der Vorteil des m•glichen 63 Vitalit€tsnachweises, der sich durch die Einlagerung von FDG zeigt, bleibt dem Diagnostiker in der CT verwehrt. PET PET/CT-Fusion CT Abb. 1.7-12: Ganzk•rper-PET/CT, koronar: Stoffwechselaktiver, vergr•ƒerter Lymphknoten an der Bifurkation PET PET/CT-Fusion CT Abb. 1.7-13: Ganzk•rper-PET/CT, axial: Stoffwechselaktiver, vergr•ƒerter Lymphknoten an der Bifurkation (Stattaus et al., 2005) Im Falle einer h€matogenen Aussaat wird in Abh€ngigkeit der Tumorausdehnung zus€tzlich die Durchf‚hrung einer Knochenszintigraphie sowie eine Sch€del-CT empfohlen. Trotz modernster bildgebender Verfahren wird die Rate der Metastasierung trotz negativem Stagingbefund mit 20-25% angegeben (Kuzyk, 2005). Das Staging wird durch die Eingruppierung in ein Stadium abgeschlossen, nach dem die Therapie gesteuert werden kann. 64 1.7.5. Tumorstadien Stadieneinteilungen dienen der Standardisierung von Tumortherapien. Im allgemeinen wird bei Malignomen die TNM-Nomenklatur verwendet. Der Nachteil beim Hodenkarzinom liegt jedoch im m€ƒigen klinischen Bezug. Es wird zwar die prim€re L€sion beschrieben, nach eingeleiteter Therapie ist die Einteilung jedoch unbrauchbar. Die Tab. 1.7-3 f‚r das Hodenkarzinom ist unten aufgef‚hrt, Abb1.7-14 stellt das lokale Tumorstadium graphisch dar. Abb. 1.7-14: Graphische Darstellung T-Stadien T1-4 65 Tab. 1.7-3: TNM-Klassifikation der Union Internationale Contre Cancer (UICC) und dem American Joint Committee on Cancer (AJCC) TNM-Klassifikation (UICC/AJCC) pT0 Histologische Narbe oder kein Anhalt f‚r Prim€rtumor pTis TIN entsprechend Carcinoma in situ pT1 pT2 Tumor begrenzt auf den Hoden (einschlieƒlich Rete testis) ohne Lymph- oder Blutgef€ƒinvasion Tumor infiltriert jenseits der Tunica albuginea oder in den Nebenhoden, Lymph- oder Blutgef€ƒinvasion pT3 Tumor infiltriert den Samenstrang pT4 Tumor infiltriert Skrotum N0 Keine region€ren Lymphknotenmetastasen N1 Metastase in solit€rem LK, < 2 cm (max. 5 LK) N2 Metastase in solit€rem LK, > 2 cm, aber < 5 cm oder in multiplen LK, keiner > 5 cm. N3 Metastasen in LK > 5 cm Mx Fernmetastasen nicht beurteilbar M0 keine Fernmetastasen M1a distale Lymphknoten- oder Lungenmetastasen M1b alle anderen Metastasenlokalisationen Das Hodenkarzinom bildet hier eine Besonderheit unter den Neoplasien. Man erstellte Einteilungssysteme, die sich an Behandlungsfolgen bzw. Strategien orientierten. W€hrend sich in Europa die Lugano-Klassifikation durchsetzte, wurde insbesondere in den USA vorwiegend die Indiana-Klassifikation verwendet. 66 Tab. 1.7-4: Stadieneinteilung bei Hodentumoren des Workshop for Staging and Treatment of Testicular Cancer (Lugano 1979) (nach Souchon und Schmidberger,1998) Lugano-Klassifikation I Keine Metastasen nachweisbar IA Tumor auf Hoden und Nebenorgane beschr€nkt IB Tumor im kryptorchen Hoden oder Samenstranginfiltrat IC Skrotalhautinfiltration oder skrotal operiert II Lymphknotenmetastasen unterhalb des Zwerchfells IIA Alle LK < 2 cm IIB Mindestens 1 LK 2–5 cm IIC Retroperitoneale LK > 5 cm oder Tumorinvasion der Venen; IID nach Lymphadenektomie makroskopisch kein Resttumor Makroskopischer Resttumor nach Lymphadenektomie; fixierte inguinale Lymphknoten; tastbarer inoperabler Abdominaltumor III 0 Positive Tumormarker ohne sichtbare Metastasen III Metastasen oberhalb des Zwerchfells IIIA Supraklavikul€rer oder mediastinaler Lymphknotenbefall ohne Organmetastasen IIIB Nur Lungenmetastasen Minimal < 5 Herde in jeder Lunge, < 2 cm Advanced > 5 Herde in jeder Lunge oder ein Herd > 2 cm oder Pleuraerguƒ IIIC H€matogene Metastasen auƒerhalb der Lungen 67 Abb. 1.7-15: Schematische Darstellung der Lugano-Klassifikation (aus Beyer und Bokemeyer, 2004) Der Vollst€ndigkeit halber sei die Indiana-Klassifikation aufgef‚hrt. Tab. 1.7-5: Indiana-Klassifikation beim metastasierten Hodentumor Indiana-Klassifikation Minimal Nur HCG und/oder AFP erh•ht Knoten zervikal (+/- nicht tastbare retroperitoneale Knoten) Nichtresezierbare, aber nichttastbare retroperitoneale Erkrankung Minimale pulmonale Metastasen – weniger als 5 pro Lungenfeld und < 2 cm (+/- nicht tastbare abdominale Erkrankung Moderat Tastbarer abdominaler Tumor als einzige anatomische Erkrankung Moderate pulmonale Metastasen 5–10 pro Lungenfeld und < 3 cm oder mediastinaler Tumor (< 50 % des intrathorakalen Durchmessers) oder solit€re pulmonale Metastase jeder Gr•ƒe > 2 cm (+/nichttastbare abdominale Erkrankung) 68 Fortgeschritten Fortgeschrittene pulm. Metastasierung, mediastinaler (advanced Tumor > 50 % des intrathorakalen Durchmessers disease, oder ”bulky”) mehr als 10 pulmonale Metastasen pro Lungenfeld oder multiple pulmonale Metastasen > 3 cm (+/- nichttastbare abdominale Erkrankung) Tastbare abdominale Tumormasse + pulmonale Metastasen Minimal pulmonal Moderat pulmonal Leber-, Knochen- oder ZNS-Metastasen. Die Einteilung zur Prognoseabsch€tzung bei fortgeschrittenen bzw. metastasierten Keimzelltumoren wurde 1995 von der International Germ Cell Cancer Collaborative Group (IGCCCG) erarbeitet. Sie umfasst neben der Metastasenlokalisation noch die Unterteilung in Seminom und Nicht-Seminom und nimmt den Faktor Tumormarker mit auf. Die Prognoseeinsch€tzung zur gesamten „berlebenswahrscheinlichkeit (G„) in Prozent und dem ereignisfreien „berleben (E„) ist zu entnehmen. Als Ereignis wird das Auftreten eines Rezidivs oder neuer Metastasen verstanden. Das Seminom ist auƒer bei einer pulmonalen Metastasierung generell mit einer guten Prognose zu vereinbaren. 69 Tab. 1.7-6: Prognose-Definition IGCCCG-Klassifikation (Modifiziert nach Klinikleitfaden Urologie, 2000 und Albers, 2002) Good prognosis (ca. 56% der Patienten) E… 89 % Nichtseminom Hoden/prim€rer retro- Niedrige Marker G… 92% peritonealer Tumor und AFP < 1.000 ng/ml und „niedrige“ Marker und keine HCG < 1.000 ng/ml und nicht pulmonalen viszeralen LDH < 1,5 x Normalwert Metastasen Seminom Jede Prim€rlokalisation und jede Markerh•he und keine nicht pulmonalen Metastasen Intermediate prognosis (ca. 28% der Pat.) E… 75% G… 80% Nichtseminom Hoden/prim€rer retro- Intermedi€re Marker peritonealer Tumor und „inter- AFP < 1.000–10.000 ng/ml medi€re“ Marker und keine oder nicht pulmonalen viszeralen HCG < 1.000–10.000 ng/ml Metastasen Seminom (5.000–50.000 IU/l) Jede Prim€rlokalisation und oder jede Markerh•he und nicht LDH < 1,5–10 x Normalwert pulmonale Metastasen (Leber, Skelett, ZNS) Poor prognosis (ca. 16% der Patienten) E… 41% Nichtseminom Prim€r mediastinaler Keim- Hohe Marker G… 48% zelltumor oder Hoden- AFP > 10.000 ng/ml /retroperitonealer Tumor mit oder nicht-pulmonalen viszeralen HCG > 60.000 ng/ml Metastasen (Leber, Skelett, (50.000 IU/l) ZNS, Intestinum) oder „hohem“ oder Marker LDH < 10 x Normalwert Zur Gruppierung der Tumormarkererh•hung wurde eine Serummarker-Klassifikation entwickelt. Nach der Ablatio testis werden die 70 Tumormarker am f‚nften postoperativen Tag kontrolliert und in die Serumklassifikation eingebracht. Einige Autoren geben auch den dritten Tag als Maƒstab an. Die Einteilung ist in der folgenden Tab. einzusehen. Tab. 1.7-7: Serum-Tumormarker Hodenkarzinom (N = Normwert) Serum-Tumormarker LDH ƒ-HCG (IU/l) AFP (ng/ml) SX Werte nicht verf‚gbar S0 normwertig N und <5 und < 10 S1 erh‚ht < 1,5 * N und 5000 und < 1000 S2 1,5-10 * N oder 5000-50000 oder 1000 -10000 > 50000 oder > 10000 S3 > 10 * N oder Zur Planung einer einheitlichen Therapie, die sich an den wichtigsten die Prognose beeinflussenden Parametern orientiert, dient die Einteilung in die Klinische Stadieneinteilung (CS). Sie basiert auf der Lugano-Klassifikation und bezieht die neueste TNMund Serummarkerklassifikation (S) mit ein. Die Einteilung ist in Tab. 1.7-8 dargestellt. 71 Tab. 1.7-8: Klinisches Stadium Hodentumor Klinische Stadieneinteilung (CS) Stadium 0 pTis N0 M0 SX Stadium I pT1 –4 N0 M0 SX IA pT1 S0 IB pT2 –4 S0 IC jedes pT/TX S1 –3 Stadium II jedes pT/TX N1 –3 M0 SX IIA N1 S0, 1 IIB N2 S0, 1 IIC N3 S0, 1 Stadium III jedes pT/TX jedes N M1, 1a SX IIIA jedes N M1,1a S0, 1 IIIB N1 –3 M0 S2 jedes N M1,1a S2 IIIC N1 –3 M0 S3 jedes N M1,1a S3 jedes N M1b jedes S 72 1.8. Therapie 1.8.1. Allgemein Operative Therapie Inguinale Ablatio testis Die prim€re Therapie stellt zugleich die wegweisende Diagnostik dar. In der Regel ist die hohe inguinale Ablatio testis indiziert und sollte unter Mitnahme des Samenstranges und der Gef€ƒe bis in den Bereich der peritonealen Umschlagsfalte erfolgen. Zur Vermeidung einer lymphatischen Streuung bei der Manipulation, empfiehlt es sich, den Funikel mit einer Darmklemme nach zentral hin vorsichtig abzuklemmen (Kliesch, 2004). Abb. 1.8-1: Groƒer Hodentumor rechts mit Skrotalwandbeteiligung vor und w€hrend operativer inguinaler Entfernung Nach Abschluss der Beobachtungszeit und Niederschrift dieser Arbeit stellte sich ein Patient mit einem nahezu 20 cm groƒen Hodentumor rechts in unserer Klinik vor. Die Skrotalwand drohte zu bersten, so dass, nach inguinaler Freilegung und Ligatur des 73 Funikels, der Hoden samt Skrotalwand reseziert wurde. Es handelte sich um ein Seminom mit Bulky disease und pulmonaler Metastasierung. Aufgrund des eindrucksvollen Bildmaterials (siehe Abb. 1.8-1) war die Aufnahme in die Darstellung von Keimzelltumoren unumg€nglich. In der Statistik der Arbeit fand der Patient jedoch keine Ber‚cksichtigung. Probebiopsie der Gegenseite Die Entnahme von Probebiopsien des Hodens auf der Gegenseite geh•rt inzwischen zum Standard. Dieckmann und Loy haben mit ihrer TIN-II-Studie die Notwendigkeit der Entnahme von zwei Stellen des Hodens zum sicheren Ausschluss der diffus vorkommenden TIN nachgewiesen. Der immunhistochemische Nachweis der PLAP gilt als Nachweis einer TIN. Tumorenukleation Die Organerhaltende Tumorenukleation sollte Patienten mit einem Einzelhoden, einem synchronem oder metachronem Tumor der Gegenseite vorbehalten sein (Heidenreich, 2004). Hierbei wird der Tumor mit einem Sicherheitsabstand ausgesch€lt, das restliche Parenchym wird belassen. Metastasenentfernung Pulmonale oder intracranielle Metastasen k•nnen bei peripherer Lage entfernt werden, in der Regel erfolgt ein solcher Eingriff erst bei Persistenz nach Chemotherapie. Die histopathologische Differenzierung, das lokale Tumorwachstum und die Ausbreitungsdiagnostik sind die St‚tzpfeiler der folgenden Therapie. 74 Retroperitoneale Lymphadenektomie Eine weitergehende operative Therapie im fortgeschrittenen Stadium der Nichtseminome oder Rezidivtumore nach Radiatio stellt die modifizierte retroperitoneale Lymph-Adenektomie (RLA) dar. In den letzten Jahren sind die Indikationen zur RLA immer weiter eingeschr€nkt worden und zunehmend durch die Chemotherapie ersetzt worden. Die GTCSG weist in der EBM-gest‚tzen Leitlinie die operative Therapie (RLA) in den geringgradig metastasierten Stadien noch als gleichwertig zur Chemotherapie aus, auf europ€ischer Ebene geht man bereits einen Schritt weiter. Zuk‚nftig wird dieser Eingriff wohl nur noch nach prim€rer Chemotherapie zur Residualtumorresektion (RTR) und beim Growing-teratoma- Syndrom durchgef‚hrt (Pottek, 2005). Durch eine mediane Laparotomie erfolgt der transperitoneale Zugang zu den Lymphknoten neben Aorta abdominalis bzw. Vena cava inferior. Das Ausmaƒ der Lymphadenektomie ist von der Tumorseite abh€ngig. Abb. 1-8.2 a und b beschreibt graphisch die prozentuale Verteilung der Lymphknotenmetastasen bei rechtsbzw. linkseitigen Tumoren. Die Daten stammen einer von Weiƒbach und Boedefeld 1987 ver•ffentlichten Studie und geben bis in die Gegenwart die Resektionsgrenzen vor (Jocham und Miller, 2003). Die laterale Grenze ist durch den Harnleiter vorgegeben, dieser ist jedoch nicht eingezeichnet. Neben allgemeinen Minor- und Major-Komplikationen (z. Bsp. Gef€ƒ- und Darmverletzung) nimmt bei den meist jungen Patienten die Komplikation der retrograden Ejakulation einen besonderen Stellenwert ein. Urs€chlich ist eine iatrogene Verletzung der postganglion€ren sympathischen Grenzstrangfasern w€hrend der Operation. Die Innervation des inneren Schlieƒmuskels am 75 Blasenhals verhindert die Entleerung des Ejakulats in die Blase. Bei der „nerve-sparing“-Technik kann in 98% der F€lle die retrograde Ejakulation verhindert werden (Pottek, 2002). a b Abb. 1.8-2a,b: Prozentuale Verteilung der solit€ren Metastasen bei rechts- (a) bzw. linksseitigem Tumor (b) (Jocham und Miller, 2003) Chemotherapie Die verschiedenen Medikamente greifen in unterschiedlichen Phasen der Zellteilung ein. Durch verschiedene Angriffspunkte der Zellteilung kommt die cytostatische Wirkung zur Geltung. Es gilt die Faustregel: Je schneller die Zellteilung, desto wirkungsvoller die Chemotherapie. Im Rahmen einer Polychemotherapie des Hodenkarzinoms wird Cisplatin mit Etoposid und Bleomycin kombiniert (PEB). 76 Ein Durchbruch in der Therapie war mit der Einf‚hrung durch Lawrence Einhorn und Zulassung des Cisplatins 1979 erreicht (TRM 1998; Arndt, 2005). Dieser Substanz wird die heutige groƒe Heilungsrate zugeordnet, die zu Recht als Meilenstein der Therapie von Hodentumoren beschrieben wird. antitumoralen Potenz war allerdings Die Entdeckung der Zufall: Der Amerikaner Rosenberg entdeckte die Wirkung in den 1960er Jahren bei Versuchen mit Einwirkung von Strom auf Escherichia Coli-St€mme. Es zeigte sich das unerwartete Sistieren der Zellteilung, ohne dass die Bakterien abget•tet wurden. Bei der Verwendung von Platinelektroden stellte sich erst nach intensiver Suche heraus, dass durch Oxidation winzige Platinanteile gel•st wurden und hierf‚r verantwortlich waren (Arndt, 2005). Abb. 1.8-3: cis-Diammin(dichloro)platin (“Cisplatin”) Cisplatin geh•rt zur Gruppe der DNA-alkylierenden Agentien und verhindert eine Zellteilung durch Bindung an DNA-Bestandteile. Eine Anpassung der Dosis an die Kreatinin-Clearance sowie die K•rperoberfl€che ist unumg€nglich. Die unerw‚nschten Wirkungen reichen von Reizungen des Gastrointestinalbereichs (Nausea, Emesis) ‚ber periphere Myelotoxizit€t, Nephrotoxizit€t, Ototoxizit€t Neuropathien. Seit Einf‚hrung des und PEB-Schemas (CisPlatin / Etoposid / Bleomycin) Ende der 1980er Jahre sind die Oto- und Neurotoxizit€ten stark zur‚ck gegangen. Die Vorteile eines Therapieintervalls von 21 Tagen sind in vielen Studien dargestellt 77 worden (Bokemeyer et al., 2005). Unter der Kombination mit Vinblastin (PVB) waren st€rkergradige Komplikationen noch sehr h€ufig. Das dem Cisplatin eng verwandte Carboplatin bietet aufgrund der deutlich geringeren Vaso- und Nephrotoxizit€t Vorteile, ist zur Zeit jedoch als Chemotherapeutikum beim Keimzelltumor noch nicht zugelassen. Entscheidend ist die M•glichkeit der peripheren intraven•sen Gabe, die unter ambulanten Bedingungen erfolgen kann. In Studien erfolgen vielversprechende Therapieans€tze mit unterschiedlichen Protokollen, die Daten haben zur Zeit jedoch noch kein l€ngeres Follow-up als vier Jahre. Bez‚glich Rezidivrate, Rezidivzeitpunkt und „berlebensrate bestanden im Vergleich zu etablierten Verfahren keine signifikanten Unterschiede (Krege, 2005b). Bleomycin ist ein aus der Gruppe der Antibiotika stammendes Zytostatikum. Die Hauptnebenwirkung besteht in der sogenannten Bleomycin-Lunge, die einer Lungenfibrose entspricht (Pottek et. al., 2005). Durch Gabe in Form einer Kurzinfusion scheint dieses Risiko verringert zu sein. Bei Personengruppen, die auf eine 100%ige Lungenfunktion angewiesen sind, wie zum Beispiel Spitzensportler und Berufstaucher, sollte auf die Gabe verzichtet werden und stattdessen Ifosfamid verabreicht werden (PEI). Dieses geh•rt zu den Alkylanzien, zu den Hauptnebenwirkungen z€hlen die Nephround Myelotoxizit€t. Aufgrund der m•glichen Fruchtsch€digung wird eine Kontrazeption f‚r 3 Jahre empfohlen. 78 Bestrahlung Die Strahlensensibilit€t vor allem des Seminoms wurde bereits 1907 von Beclere ver•ffentlicht; hier wurden Einfl‚sse der Radiotherapie auf Zellteilung in Tumoren beschrieben (Scherer, 1992). 1925 untersuchte Nemenow die biologische Wirkung von Strahlung auf Spermatogonien sowie Seminome (Scherer, 1992). Eine erste Richtlinie wurde 1937 von Schinz und Zuppinger formuliert. Hier ist festgehalten, dass das Therapiefeld nicht nur lokoregion€r, sondern ‚ber die „Teilungsstelle“ der Aorta hinaus, zu erweitern sei. Neben der Zielsetzung, lokale und region€re Rezidive zu verhindern, wird auch die erfolgreiche Behandlung von Lymphknotenmetastasen erfasst. Auch die besondere Strahlensensibilit€t des Seminoms im Vergleich zu den anderen Keimzelltumoren war bereits erkannt worden (Scherer, 1992). Aufgrund einer Ver•ffentlichung von Cabot und Berkson im New England Journal of Medicine im Jahr 1939 erfolgte die endg‚ltige Aufnahme der Radiatio in das Therapieregime bei Keimzelltumoren. Die Studie umfasste 363 Seminompatienten, die nach Prim€r- und Strahlentherapie zum Teil „berlebenszeiten von ‚ber 25 Jahren aufwiesen (Souchon, 2004). W€hrend die Anf€nge der Behandlung noch sehr groƒe Kolalateralsch€den an den Nachbarorganen mit sich brachten, wurde die Technik zunehmend verbessert. Erste Verbesserungen der Therapie und die Minimierung unerw‚nschter Nebenwirkungen brachten die ab 1951 eingesetzten Telekobalt- und Telec€siumGer€te. Heutzutage werden mittels Linearbeschleuniger aktivierte Photonen oder Elektronen verwendet. Die computergesteuerten Therapiefelder ausgerichtet, sind dass so bei mit beweglichen minimalen Strahlenquellen Kolalateralbelastungen die 79 gew‚nschte Dosis im Zielgebiet appliziert wird (Souchon et. al., 2004). Es handelt sich immer um eine Gratwanderung zwischen Verminderung der unerw‚nschten erw‚nschten Gewebseinwirkung. und Optimierung der 80 1.8.2. Spezielle Therapie TIN Die Therapie der TIN unterscheidet sich deutlich von der der soliden Keimzelltumoren. Eine dringende Therapie ist weniger gefordert, da hier „nur“ eine Pr€kanzerose vorliegt. Die einzelnen Optionen sind im Folgenden aufgef‚hrt. Surveillance Die sogenannte Surveillancetherapie (engl. „berwachung, Aufsicht) verfolgt eine „wait-and-see-Strategie“. Hier wird auf eine weitere Therapie verzichtet, der Patient wird allerdings engmaschig fach€rztlich kontrolliert. Sie setzt eine sehr gute Compliance des Patienten voraus. Man versucht auf diese Weise eine „bertherapie mit den entsprechenden Nebenwirkungen zu vermeiden. Ein weiterer groƒer Vorteil ist die unbeeinflusste Fertilit€t. Zumeist ist die Familienplanung noch nicht abgeschlossen und eine SpermaKryokonservierung stellt eine nicht unerhebliche finanzielle Belastung dar, insbesondere wenn die Einlagerungszeit mehrere Jahre betragen wird. Generell ist eine solche Therapie dem Patienten meist schwer zu vermitteln und sie stellt eine starke psychische Belastung dar. Oft wird seitens des Patienten eine Therapie gefordert, bevor eine Progredienz auftreten k•nnte. Radiatio Die Radiatio gilt als Goldstandard bei der TIN. Dabei werden 20 Gray in 10 Sitzungen appliziert. Bei dieser Dosis ist eine sichere Eradikation der TIN-Zellen gew€hrleistet. Versuche, die Dosis zu 81 reduzieren, um die Leydigzellen zu schonen und damit eine sp€tere Substitutionspflicht von Testosteron zu vermeiden, wurden abgebrochen. Trotz einer Dosisreduktion auf 14 Gy entwickelte fast die H€lfte der Patienten innerhalb der n€chsten f‚nf Jahre einen iatrogenen Hypogonadismus. Auƒerdem hat sich gezeigt, dass nicht immer alle TIN-Zellen zerst•rt waren. Mit dem Patienten ist die in jedem Fall entstehende Infertilit€t zu besprechen und ggf. eine Kryokonservierung einzuleiten. Im Falle einer bereits vorliegenden Azoospermie besteht die M•glichkeit der TESE (TEstikul€re SpermienExtraktion) zur Durchf‚hrung einer „assistierten Fertilisation“ (Albers, 2002). Operation Eine Teilresektion oder Tumorenukleation kommt aufgrund des diffusen Auftretens der Zellen nicht in Frage. Die Ablatio testis stellt bei der TIN wohl eher eine „bertherapie dar. Insbesondere nach Vorliegen eines Hodentumors der Gegenseite und erfolgter Ablatio ist an die anschlieƒende lebenslang notwendige TestosteronSubstitution zu denken Chemotherapie Eine prim€re Chemotherapie kommt definitiv nicht in Frage. Sollte aufgrund eines Hodentumors eine Stadium-orientierte Chemotherapie erfolgt sein, so ist bei nachgewiesener TIN der Gegenseite unter Umst€nden keine weitere Therapie notwendig. Die Empfehlungen besagen, dass vor einer eigens eingeleiteten Therapie (zum Beispiel Radiatio) zun€chst eine Kontrollbiopsie nach 6 Monaten erfolgen sollte (Kliesch, 2004). 82 Keimzelltumor Die Therapie der KZT ist nicht nur vom Stadium sondern auch von der Histologie und der Gef€ƒinvasion abh€ngig. Prinzipiell werden Seminom und Nichtseminom unterschieden, basierend auf der Strahlensensibilit€t des Seminoms. Die Prognose des Seminoms ist auch in fortgeschrittenen dementsprechend kann die Stadien Therapie deutlich etwas g‚nstiger, konservativer durchgef‚hrt werden. Die Tatsache, dass selbst ein Rezidiv oder eine Progredienz in hohem Maƒe heilbar ist, er•ffnet die M•glichkeit der “wait and see“-Strategie. Die folgenden Therapieschemata basieren auf der „Leitlinie und Therapie von Hodentumoren auf Grundlage evidenzbasierter Medizin“ der German Testicular Cancer Study Group (2002), aktuelle •nderungen auf europ€ischer Basis wurden ber‚cksichtigt. Seminom Tab. 1.8-1: Therapieoptionen Seminom bei CS I und II Stadium Therapieoptionen CS I Surveillance Radiatio 20Gy CS IIA Radiatio 30 Gy CS IIB Radiatio 36 Gy CS I Seminom Trotz einer Metastasierungsrate von ca. 29% sind die Heilungsraten ann€hernd 100%. Hierbei gelten Prognosefaktoren wie die Tumorgr•ƒe (>4 cm) oder Invasion ins Rete testis als valide 83 Parameter. In multivariaten und multizentrischen Analysen zeigten sich diese Faktoren als signifikant f‚r ein h•heres Rezidivrisiko (Albers, 2002). Somit kann man eine low- und high-risk-Gruppe differenzieren, die Gef€ƒinvasion konnte hier allerdings nicht als signifikant ung‚nstiger Faktor eingestuft werden (Heidenreich, 2004). F‚r die low-risk-Patienten wird inzwischen die SurveillanceTherapie empfohlen, dem steht die Radiatio der Lymphabfluƒwege mit 20 Gy bei der high-risk-Gruppe gegen‚ber. Das Bestrahlungsfeld umfasst die infradiaphragmalen, ipsilateralen, paraaortalen oder paracavalen Lymphabflussregionen (Heidenreich, 2004). In Phase-II-Studien werden auch alternativ adjuvante CarboplatinMonotherapien durchgef‚hrt. Beim Stadium I hatte sich diese als ebenb‚rtige Therapieoption zur Radiatio ergeben (Krege, 2005). Dies geh•rt jedoch aktuell nicht zum Standard. Die Vor- und Nachteile der Strategien werden in den letzten Jahren intensiv diskutiert. Bedeutet doch die Radiatio im CS I eines Seminoms in 80% der F€lle eine „bertherapie (Krege, 2005). Der Therapieerfolg ist bei moderaten Nebenwirkungen zwar gegeben, allerdings besteht das Risiko eines strahleninduzierten Zweitmalignoms. Die Surveillance bietet bei der erforderlichen Compliance und psychischen Stabilit€t des Patienten eine M•glichkeit der Therapieeinschr€nkung. Die Nachsorge ist jedoch intensiver und verantwortungsvoller, dar‚ber hinaus ist im Falle eines Rezidivs zumeist eine h•herdosierte Radiatio oder Chemotherapie notwendig. 84 CS IIA/B Seminom Die Standardtherapie besteht in der Radiatio mit 30 Gy beim Stadium IIA und 36 Gy bei IIB. Das Zielvolumen sind die retroperitonealen, paraaortalen und ipsilateralen iliacalen Lymph- knotenstationen. In Abb. 1.8-4 b und c sind die iliacalen Areale der jeweiligen Seite markiert, behandelt werden nur die ipsilateralen Lymphknoten. Beim Stadium IIB ist das Feld den vergr•ƒerten Lymphomen mit einem Abstand von ca. 1,5 cm anzupassen. a b c Abb. 1.8-4 a-c: Bestrahlungsfelder beim Seminom a Stadium I (reduziertes Feld in laufenden Studien) b Stadium II bei Seminom rechts c Stadium II bei Seminom links (modifiziert nach: Heidenreich, 2004) Als Alternativtherapie, zum Beispiel bei Ablehnen einer Radiatio seitens des Patienten, wird die Chemotherapie mit einer Anzahl von drei Zyklen PEB oder vier Zyklen ohne Bleomycin angegeben. Eine Carboplatin-Monotherapie hat sich in diesem Stadium aufgrund signifikant h•herer Rezidivraten in Studien nicht bew€hrt (Albers, 2002). 85 H•hergradige Stadien bed‚rfen generell der Chemotherapie. Die Entscheidung der Zyklusanzahl wird durch die Einsch€tzung nach IGCCCG vorgegeben: ein Patient mit g‚nstiger Prognose braucht drei, intermedi€r eingestufte Patienten sollten vier Zyklen PEB erhalten (Beyer und Bokemeyer, 2004). 86 Nichtseminom Tab. 1.8-2: Therapieoptionen des Nichtseminoms im Stadium I und II Stadium Therapieoptionen CS I Surveillance Chemotherapie (RLA) CS II A/B prim€re nervschonende Lymphadenektomie prim€re nervschonende Lymphadenektomie und Chemotherapie prim€re Chemotherapie und Residualtumorresektion CS I Nichtseminom Bei einer Metastasierungsrate von 17-30% (lymphogen) bzw. 9% (pulmonal) besteht immer noch eine Heilungsrate von 99% (Heidenreich, 2005). Die Metastasierungsquote steigt jedoch deutlich und signifikant mit einer lokalen vaskul€ren Invasion. Hier hat fast jeder zweite Patient eine okkulte Metastase. Den Goldstandard stellt gem€ƒ den aktuellsten Leitlinien die Chemotherapie dar. Die prim€re RLA bietet zwar den Vorteil der histopathologischen Sicherung des Befundes, allerdings sind auch hier 70-80% der Patienten ‚bertherapiert. Deshalb einigte man sich darauf, die RLA nur bei den Patienten durchzuf‚hren, bei denen eine Chemotherapie kontraindiziert ist oder seitens des Patienten abgelehnt wird. Komplikationen wie die retrograde Ejakulation bei Grenzstrangverletzung werden sogar in Zentren mit 2% angegeben. Insgesamt d‚rfte diese Rate jedoch h•her einzusch€tzen sein. Bei 87 8-10% treten trotz einer Therapie pulmonale Metastasen oder retroperitoneale Rezidive auf, welches eine Chemotherapie zur Folge hat (GTCSG, 2002). Beim risikoadaptierten Vorgehen wird entsprechend der Risikofaktoren entweder eine Surveillance-Strategie oder Chemotherapie durchgef‚hrt. Bei der „low-risk“-Gruppe ohne vaskul€re Invasion ist mit einer Wahrscheinlichkeit von 14-22% mit einer retroperitonealen bzw. pulmonalen Metastasierung zu rechnen. Der Vorteil der abwartenden Therapie gegen‚ber einer RLA liegt darin, dass 7886% der Patienten nach der Ablatio keiner weiteren Therapie bed‚rfen. Im Falle einer sp€teren Metastasierung ben•tigen jedoch mehr Patienten (14-22%) eine Chemotherapie als nach RLA (810%). Auch hier ist eine intensivere Nachsorge mit entsprechender Strahlenbelastung (CT) erforderlich (GTCSG, 2002). F‚r eine Metastasierung liegt das Risiko bei der „high-risk“-Gruppe bei 48%, nach adjuvanter Chemotherapie mit zwei Zyklen PEB sinkt die Rate auf 3%. Auch hier weiƒ man um 52% der Patienten, die eine „bertherapie, mit entsprechend h•herer Wahrscheinlichkeit von Auftreten unerw‚nschter Nebenwirkungen, erfahren. Zu diesen z€hlen: Ototoxizit€t, Nausea, Emesis, periphere Neurotoxizit€t, Raynaud-Ph€nomen. Ein wichtiger Faktor f‚r den zumeist jungen Patienten ist auch die notwendige Kontrazeption f‚r mindestens ein Jahr nach Therapieabschluss (GTCSG, 2002). 88 CS II A/B Nichtseminom Hier werden drei Strategien favorisiert, welche die gleiche Heilungsrate von 98% bieten. 1) prim€re nervschonende Lymphadenektomie 2) prim€re nervschonende Lymphadenektomie und Chemotherapie 3) prim€re Chemotherapie und Residualtumorresektion Die Vor- und Nachteile sind vielf€ltig, generell ist die deutlich gesteigerte Morbidit€t bei kombinierten Therapien wie in zwei und drei einleuchtend. Im Falle der singul€ren RLA ist bei Auftreten von Rezidiven wiederum eine h•herdosierte Chemotherapie durchzuf‚hren. Die Therapieoption drei bietet den Vorteil, dass ein groƒer Teil beim Restaging eine komplette Remission zeigt und keiner weiteren Therapie bedarf(Albers, 2002). Fortgeschrittene Stadien Die Chemotherapie-Dosis wird durch die Prognose-Klassifikation der IGCCCG bestimmt. W€hrend bei den Patienten der goodprognosis-Gruppe die Standardtherapie aus drei Zyklen PEB (alternativ vier Zyklen PE bei Kontraindikation gegen Bleomycin) besteht, sollten bei der intermediate-Gruppe vier Zyklen appliziert werden. F‚r Patienten der poor-Kategorie sind vier Zyklen PEB oder PEI (Ifosfamid statt Bleomycin) als Goldstandard anzusehen. Diese Patienten sollten allerdings in Zentren ‚berwiesen werden. Hirnmetastasen Zerebrale Metastasen zeigen sich bei ca. 10% der Patienten in fortgeschrittenem Stadium. Die „berlebenswahrscheinlichkeit liegt 89 dann bei 30-40%, die Prognose ist vom Zeitpunkt der Metastasierung abh€ngig (GTCSG, 2002). Prognostisch ung‚nstig ist nicht nur ein multifokales sondern auch ein sp€tes Auftreten unter laufender Chemotherapie einzusch€tzen. Die Therapie besteht prim€r in einer Radiochemotherapie, ggf. gefolgt von einer Residuenresektion. 90 2. Methodik 2.1. Das Patientenkollektiv Ber‚cksichtigt wurden alle im Zeitraum vom 1.1.2000 bis 30.6.2005 behandelten Patienten mit Hodenkarzinomen, die in unserer Klinik vorstellig wurden. Dabei handelte es sich insgesamt um 84 Patienten. Bei drei Patienten, die aufgrund einer malignen Raumforderung des Hodens abladiert wurden, fand sich jedoch kein Hodenkarzinom, sondern die Metastasierung bzw. Manifestation eines der Lymphoms. Diese wurden aus Beobachtung ausgeschlossen. Somit wurden 81 Patientenverl€ufe bearbeitet. Die Altersverteilung zum Zeitpunkt der Diagnose lag zwischen 18 und 67 Jahren mit einem Altersdurchschnitt von 37,46 Jahren. 78 Patienten wurden in unserer Klinik diagnostiziert und abladiert. Drei Patienten kamen nach ausw€rtiger Diagnosestellung und Hodenentfernung zur adjuvanten Therapie (1 Retroperitoneale Lymphadenektomie, 2 Polychemotherapien). Eine Besonderheit bot ein Patient, bei dem ausw€rtig per Biopsie aus einer groƒen retroperitonealen Raumforderung die Metastase eines Hodenmalignoms diagnostiziert wurde. Die Vorstellung in unserer Klinik erfolgte dann zur Entfernung des prim€ren Tumors und zur weiteren Therapie. 91 2.2. Auswertungsmethoden Die Patientendaten wurden retrospektiv mittels Studium der Patientenakten analysiert. Hierzu wurde ein Fragebogen erstellt und bei der Aktendurchsicht bearbeitet. Tab. 2.2-1: Parameter des Fragebogens zur Datenauswertung: Parameter Erkl€rung / Anmerkung Individualdaten Patientennummer Name wurde zur Auswertung anonymisiert Geburtsdatum Sterbedatum gem€ƒ Angaben des Tumorregisters Siegen Diagnose-Alter Gr•ƒe Gewicht Body mass index Formel: BMI= Gewicht[kg] / Gr•ƒe[m] ‘ Anamnese Eigenanamnese Familienanamnese (Hoden-)Tumor? Maldeszensus? Genitale Fehlbildung? Tumor? Hodentumor? Klinische Befunde Sono Hoden bds. Hypodense Areale? Mikrolithiasis? Sono Abdomen Lymphome Laborparameter Leukozyten H€moglobin Kreatinin Tumormarker LDH ƒHCG AFP PLAP pr€operativ, 5. postoperativer Tag und jeweils zu Chemozyklusbeginn 92 Prim•rtherapie Operation Datum Eingriff Tumorseite Anzahl Biopsien Biopsie Gegenseite Ort Pe Ober- / Unterpol Histologie Befund Tumorklassifikation /-anteile Tumorgr•ƒe in cm pT lokale Tumorausdehnung cN klinischer Lymphknotenbefall (Ausbreitungsdiagnostik) pN histopathologischer Lymphknotenbefall M Vorliegen von Metastasen L Einbruch in Lymphgef€ƒe V Einbruch in Blutgef€ƒe R Randbildung Tumor TIN Tumorseite Vorliegen einer TIN auf der Tumorseite TIN Gegenseite Vorliegen einer TIN auf der Gegenseite Stadieneinteilungen Lugano IGCCCG International Germ Cell Cancer Collaborative Group CS Klinisches Stadium Staginguntersuchungen CT-Abdomen CT-Thorax CCT 93 Adjuvante Therapie Art Radiatio? Chemotherapie? RLA? Nachsorge Response komplette / partielle Remission? Progression? In 77 von 81 F€llen erfolgte die prim€re Vorstellung zur Diagnosestellung und Therapieeinleitung in unserer Klinik. Zumeist wurde vom niedergelassenen Urologen mit dem klinischen Verdacht auf einen Hodentumor zugewiesen. Die Ablatio testis erfolgte nahezu in allen F€llen nach Schnellschnittuntersuchung, anschlieƒend wurden intraoperativ zumeist zwei Biopsien aus dem anderen Hoden entnommen. Das Ablationspr€parat wurde durch das unserer Klinik angegliederte Pathologische Institut bearbeitet. Die Tumorgegenseite wurde mittels Hodenbiopsien untersucht. Hierbei wurden bis auf Ausnahmef€lle Proben jeweils vom Oberund Unterpol entnommen. Die Begutachtung der Gegenseite erfolgte zum groƒen Teil durch Prof. Dr. Loy (Klinikum Am Urban, Berlin) im Rahmen der multizentrischen testikul€ren „Studie zur intraepithelialen Diagnostik Neoplasie der (TIN) kontralateralen bei germinalen Hodentumoren: Wertigkeit einer systematischen Doppelbiopsie“ (Studienleiter: Prof. Dr. Dieckmann, Albertinen-Krankenhaus, Hamburg). Nach Abschluss der Studie wurden die Proben weiterhin ‚berwiegend bei Prof. Dr. Loy bearbeitet. Bei der retrospektiven Aktendurchsicht wurde der TIN in der histopathologischen Begutachtung besondere Beachtung ge- schenkt. Dabei wurde nicht nur auf die Tumorgegenseite geachtet, 94 sondern explizit auf die Angabe des Vorliegens Intraepithelialer Neoplasien in der Tumorumgebung. 95 3.Hauptteil 3.1. Darstellung der Ergebnisse Die Anzahl der Patienten l€sst ersehen, dass sich keine statistische Signifikanz verfolgen l€sst. Die deskriptive Statistik dient lediglich dem Vergleich mit den Angaben in der Literatur (s. Kapitel „Diskussion“). Die Tumornachsorge erfolgte in den ‚berwiegenden F€llen durch den niedergelassenen Urologen, vereinzelt auch durch den Hausarzt. Einige Patienten (zum Beispiel diese mit besonderen Risiken) blieben, wenn auch nur zum Teil, in unserer eigenen Betreuung. Nach abgeschlossener Therapie wurden die Patienten ‚ber den Onkologischen Schwerpunkt Siegen beim Krebsregister NRW registriert. Hierdurch wurde eine regelm€ƒige Tumornachsorge gesichert und regelm€ƒige Daten-Updates von den niedergelassenen Kollegen erfragt. Bis auf wenige F€lle ist somit ein Follow-up bis August 2005 gegeben. Die Ausnahmen bildeten aus dem Einzugsbereich verzogene Patienten oder mangelnde Mitarbeit durch die betreuenden Kollegen. 96 3.2. Kollektiv Im Zeitraum vom 1.1.2000 bis 30.6.2005 stellten sich insgesamt 84 Patienten wegen eines Hodentumors vor. Aus den genannten Gr‚nden (s. Kapitel „Methodik“) wurden drei Patienten von der Studie ausgeschlossen, so dass letztlich 81 Patienten verblieben. Die nachfolgende Tab. gibt eine „bersicht ‚ber die Daten der Studie des eigenen Patientenguts. Neben Diagnosedatum und –alter sind alle Tumorstadien dargestellt. Der Nachweis von TIN-Zellen auf Tumor- und Gegenseite ist ebenfalls zu entnehmen. Tab. 3.2-1: Patientendaten eigenes Kollektiv Legende am Ende der Tab.) Nr. BiopsieDatum Alter Histologie TIN pT cN pN M L (Erkl€rung: s. V Lugano S CS IGCCCG 1 14.07.2005 32 Embryonal T2 N0 M0 1 1 IB 0 IB 2 05.06.2001 38 Embryonal T1 N0 M1a 0 0 III A 0 III A I 3 20.03.2002 40 Seminom Seminom G T2 N0 M0 1 IA 0 IB G 4 12.09.2001 31 Seminom T T1 N0 M0 IA 0 IA G 5 19.02.2001 31 Seminom T2 N0 M0 1 IB 1 IC G 6 29.01.2002 21 Seminom T2 N2 M1b 1 1 III C 2 III C P 7 11.10.2001 42 Embryonal M0 1 1 II A 0 II A G 8 11.09.2001 28 0 0 IA 0 IB G 9 21.03.2001 38 0 0 II A 0 II A G 10 12.03.2002 37 Embryonal T T2 N0 N0 M0 Dottersack Teratom unreif Embryonal T1 N1 N1 M0 Teratom reif Seminom T2 N0 M0 1 1 IA 0 IB G 11 21.06.2001 49 Seminom T2 N0 M0 0 0 IA 0 IB G 12 20.07.2001 24 13 20.06.2001 36 Seminom Seminom T2 N1 T2 N0 M0 M0 1 0 1 1 II A IB 0 II A 0 IB G G 14 10.12.2001 60 Seminom T2 N0 M0 1 1 IB 1 IC G 15 17.04.2001 19 Embryonal Dottersack Teratom unreif Dottersack Chorion T2 N0 N1 M0 1 1 II A 0 II A G T2 N0 0 0 IB 2 IC I 16 10.06.2005 23 G T2 N1 M0 0 G 97 Nr. BiopsieDatum Alter 17 19.09.2000 57 Histologie TIN pT cN pN M L V Lugano S CS IGCCCG T2 N0 N0 M0 1 1 IB 2 IC G T2 N0 M0 1 0 IA 2 IC G T3 Nx M1a 1 1 III B 1 III A I 20 01.08.2000 46 Seminom Embryonal Dottersack Seminom Dottersack Teratom reif Seminom Embryonal Teratom reif Seminom T T2 N0 M0 0 1 IA 0 IB G 21 09.04.2001 29 Embryonal T1 N0 N0 M0 0 0 IA 0 IB G 22 31.01.2002 67 Dottersack 23 23.03.2001 32 18 18.09.2001 38 19 18.08.2000 48 T T2 N0 M0 0 0 IB 0 IB G Seminom T2 N0 M0 1 1 IA 0 IB G 24 26.11.2001 30 Seminom T2 N0 M0 1 0 IB 0 IB G 25 06.12.2001 53 Seminom Embryonal Dottersack Embryonal Dottersack Teratom unreif Seminom Teratom maligne Transformation Embryonal Embryonal Chorion Embryonal Dottersack Teratom reif Seminom T2 N0 N0 M0 0 1 IB 1 IC I M1a 0 0 III A 1 III A I 32 20.12.2004 40 Embryonal Chorion Seminom 33 15.08.2002 51 26 19.06.2001 30 27 08.11.2001 27 T2 N2 T2 N0 N0 M0 0 1 IB 2 IC I T2 N1 M0 1 1 II A 1 II A I T2 N0 N0 M0 1 0 III A 2 IC I T1 N0 M0 0 0 IA 0 IB G T2 N0 M1a 1 1 III B 2 III B P T T1 N0 M0 0 0 IA 0 IA Seminom T1 N3 M0 0 0 II C 2 III B G 34 04.11.2003 43 Embryonal T2 N0 Mx 1 0 IA 1 IC G 35 15.10.2003 21 T1 N0 M0 0 0 IB 1 IC G 36 11.11.2002 40 Seminom Embryonal Teratom reif Seminom T2 N1 Mx 0 1 II A 1 II A G 37 26.06.2000 38 Embryonal 1 III B 0 III B I 38 15.01.2003 29 0 II A 1 II A G 39 22.07.2003 40 Seminom Embryonal Seminom T3 Bul M1a 1 ky T2 N0 N1 M0 1 G T2 N0 M0 0 1 IB 2 IC G 40 18.04.2000 36 Embryonal T2 N0 M0 1 1 IA 0 IB G 41 06.03.2002 44 Seminom M0 1 1 II C 2 III B G 42 10.12.2001 36 Seminom T2 Bul ky T T2 N0 1 IA 0 IB 28 06.09.2000 36 29 29.09.2000 22 30 31.08.2000 37 31 01.03.2004 37 M0 G G 98 Nr. BiopsieDatum Alter Histologie TIN pT cN pN M L V Lugano S CS IGCCCG 43 15.09.2004 64 Seminom T2 N0 M0 1 1 IB 0 IB G 44 03.03.2005 44 T2 N0 M0 0 1 IB 1 IC G 45 26.04.2004 44 Seminom Embryonal Teratom unreif Seminom T2 N1 M0 1 1 II A 2 III B G 46 10.08.2004 46 Seminom T1 N0 M0 0 0 IA 0 IA G 47 15.05.2005 40 Seminom T2 N0 M0 0 1 IA 0 IB G 48 12.01.2000 43 Seminom T1 N0 M0 0 0 IA 0 IB G 49 03.05.2001 40 T2 N0 N0 M0 1 1 IB 0 IB G 50 06.09.2004 55 Seminom Dottersack Seminom T2 N0 M0 1 1 IB 0 IB G 51 07.01.2002 32 Seminom T2 N3 M0 0 0 II C 2 III B G 52 02.05.2003 35 Seminom Embryonal Seminom T2 N1 M0 1 0 II A 1 II A G T1 N0 M0 0 0 IB 1 IC G Seminom B T2 Nx Teratom reif Chorion Seminom T2 N0 M1a 1 1 III A 1 III A I M0 0 1 IA 1 IC G T T2 Nx M0 1 0 IA 0 IB G 57 27.01.2005 37 Seminom TIN Embryonal T2 N0 M0 0 1 IB 1 IC G 58 29.04.2004 60 Seminom 0 III A 2 III B G 59 21.01.2001 45 Seminom Dottersack Embryonal Teratom reif Seminom T1 Bul M1a 0 ky T2 N3 N3 M1b 0 0 II C 2 III B I T2 N0 N0 M0 1 1 II A 0 II A G T3 N0 M0 1 1 IB 1 IC G T2 N0 M1a 0 1 III B 2 III B G 63 14.11.2003 35 Seminom Chorion Embryonal Teratom reif T3 N2 Mx 1 1 II C 2 III B G 64 28.10.2002 28 Seminom T2 N3 M0 0 0 II C 2 III B G 65 13.01.2005 37 Seminom T2 N0 M0 1 0 IB 3 IC 66 26.06.2003 24 Teratom reif T2 N2 N3 M0 1 1 II C 2 III B I 67 20.11.2002 32 Embryonal T2 N1 M0 1 1 II A 1 II A G 68 08.07.2004 30 Seminom T2 N0 M0 0 1 IB 2 IC G 69 15.07.2003 31 T1 N0 N0 M0 0 0 IB 1 IC G T1 N1 M0 0 0 II A 0 II A I 71 14.11.2003 34 Embryonal Teratom unreif Embryonal Teratom reif Seminom T1 Nx M0 0 0 IA 1 IC G 72 27.09.2004 41 Seminom T2 Nx M0 1 1 IB 1 IC G 73 03.02.2003 38 Seminom T1 N0 M0 0 0 IA 0 IA G 53 04.11.2003 29 54 30.01.2001 22 55 01.03.2005 41 56 18.05.2004 39 60 14.01.2000 45 61 19.03.2003 43 62 27.12.2001 39 70 07.12.2004 26 G 99 Nr. BiopsieDatum Alter 74 24.06.2003 29 Histologie TIN pT cN pN M L V Lugano S CS IGCCCG T2 N0 N0 M1a 0 0 III A 2 III B I T2 N0 N0 M0 0 0 IB 0 IB G T2 N0 N1 M0 1 1 II A 1 II A I T1 N0 N0 M0 0 0 IA 0 IA G 78 05.01.2003 32 Embryonal Seminom Embryonal Dottersack Teratom unreif Teratom reif Seminom Embryonal Teratom reif Seminom T2 N2 M1b 1 1 III A 2 III A G 79 23.09.2003 43 Embryonal T3 N0 M0 1 1 IB 0 IC G 80 15.05.2003 43 Seminom T2 N0 M0 0 1 IB 0 IB G 81 18.06.2004 45 Seminom T1 N0 M0 0 0 IA 0 IA G 75 15.12.2000 40 76 29.02.2000 18 77 10.05.2004 29 Legende zu Tab. 3.2-1: TIN TIN-Nachweis pT cN pN M L V Lugano S CS IGCCCG T=Tumorseite, G=Gegenseite, B=beiderseits Lokale Tumorausdehnung Lymphknotenstatus (klinisch) Lymphknotenstatus (histopathologisch) Metastasennachweis Lymphgef€ƒinvasion 1=ja, 0=nein Blutgef€ƒinvasion 1=ja, 0=nein Luganoklassifikation Serumtumormarkerklassifikation Klinisches Stadium G=good, I=intermediate, P=poor prognosis 100 3.2.1. Alter zum Zeitpunkt der Diagnose Die Altersverteilung des gesamten Kollektivs lag zwischen 18 und 67 Jahren, der Mittelwert bei 37,46 Jahren. H•ufigkeit Mittelwert =37,46 Std.-Abw. =10,13 N =81 10 20 30 40 50 60 70 Abb. 3.2-1: Das Alter zum Zeitpunkt der Diagnose aller Patienten mit Verteilungskurve, Mittelwert und Standardabweichung Betrachtet man das Patientenkollektiv nach der Unterteilung von Seminom und Nichtseminom, so zeigt sich ein deutlich niedrigeres Durchschnittsalter bei den Nichtseminomen mit 34,32 zu 39,73 Jahren bei den Seminomen. Patienten mit Mischtumoren, die Seminomanteile hatten, waren im Durchschnitt 35,50 Jahre alt. Tab. 3.2-2: Durchschnittliches Diagnosealter und Anzahl der Patienten nach Seminom / Nichtseminom unterteilt N Diagnose-Alter Seminom 40 39,73 Mischtumor mit Seminom 7 35,50 Nichtseminom 32 34,32 Gesamt 81 37,46 101 39,73 37,46 35,5 34,32 Sem inom Mischtum or m it Nichtsem inom Sem inom Gesam t Abb. 3.2-2: Durchschnittliches Diagnosealter der Patienten nach Seminom / Nichtseminom unterteilt Das Durchschnittsalter der vier Patienten mit Nachweis von TINZellen auf der kontralateralen Seite lag bei 36 Jahren (22-40-40-42). Tab. 3.2-3: Durchschnittliches Diagnosealter und Anzahl der Patienten mit TIN-Nachweis Gegenseite und Gesamtgut N Durchschnitts-Alter TIN der Gegenseite 4 36,0 Gesamt 81 37,46 37,46 36 TIN Gesamt Abb. 3.2-3: Durchschnittliches Diagnosealter der Patienten mit TINNachweis Gegenseite und Gesamtgut 102 3.2.2. K‚rpergr‚ƒe und BMI Eine Studie von Dieckmann (2003) besch€ftigt sich mit dem Zusammenhang zwischen K•rpergr•ƒe und –statur der Patienten mit Keimzelltumoren. Im eigenen Kollektiv ergab die mittlere K•rpergr•ƒe einen Mittelwert von 179,9 cm, der BMI (Body Mass Index= K•rpergewicht [kg] / K•rpergr•ƒe‘ [m]) lag im Mittel bei 26,56. Ein Wert zwischen 20 und 25 entspricht bei M€nnern dem Normalgewicht. 1 4 1 2 H•ufigkeit 1 0 Mittelwert =179,98 cm Std.-Abw. =6,573 N =81 8 6 4 2 0 1 6 0 1 7 0 1 8 0 1 9 0 2 0 0 K ‚ rp e rg r‚ ƒ e Abb. 3.2-4: H€ufigkeitsverteilung der K•rpergr•ƒe in cm im Kollektiv 14 12 H•ufigkeit 10 8 6 Mittelwert =26,55 Std.-Abw. =3,77 N =81 4 2 0 18 21 24 27 30 33 36 BM Abb. 3.2-5: Absolute Verteilung des BMI der Patienten im Kollektiv 103 3.2.3. Eigenanamnese Die Betrachtung der durchgef‚hrten Anamnese war bez‚glich der Erfassung bekannter Risikofaktoren von Interesse. 86,4 % der Patienten wiesen eine leere Anamnese auf. Bei rund 10 % der Patienten zeigte sich ein Kryptorchismus in der Vorgeschichte. Dreimal (3,7%) bestand ein beidseitiger Hodenhochstand, bei sechs Patienten (7,4%) war nur die Tumorseite betroffen. Ein isolierter Hochstand der Gegenseite fiel nicht auf. Zwei Patienten (2,5 %) wiesen einen Hodentumor der Gegenseite auf. Ein Rezidiv nach vorheriger Tumorenukleation war nicht im Kollektiv vertreten. Tab. 3.2-4: Absolutes und relatives Vorkommen von Risikofaktoren in der Anamnese H•ufigkeit Prozent Keine Vorgeschichte 70 86,4 Kryptorchismus bds. 3 3,7 Kryptorchismus Tumorseite 6 7,4 Kryptorchismus Gegenseite 0 0 Tumor kontralateral 2 2,5 Gesamt 81 100,0 104 100 90 86,4 80 70 60 50 40 30 20 7,4 3,7 10 0 2,5 0 kein RF Krypt. bds. Krypt. Krypt. Tumor Tumorseite Gegenseite kontralateral Abb. 3.2-6: Relatives Auftreten Risikofaktoren in der Eigenanamnese Bez‚glich der Familienanamnese zeigten vier Patienten (4,9 %) einen Hodentumor bei Verwandten 1. Grades, weitere vier berichteten ‚ber andere Tumorerkrankungen in der Familie. (Tab. 3.25 , Abb. 3.2-7) Tab. 3.2-5: Vorkommen von Malignomen in Familienanamnese H•ufigkeit Prozent keine Vorerkrankung 73 90,1 Hodentumor 4 4,9 sonstiger Tumor 4 4,9 Gesamt 81 100,0 105 4 ,9 9 0 ,1 Prozent 4 ,9 4 ,9 0 K e in e V o r g e s c h ic h te H o d e n tu m o r s o n s tig e r Tum or Abb. 3.2-7: Relatives Auftreten von Malignomen in FamilienAnamnese 3.2.4. Prim•rtherapie Bei dem gr•ƒten Teil der Patienten erfolgte die Sicherung der Diagnose durch die inguinale Ablatio testis nach Schnellschnitt in unserer Klinik. Bei einem Patienten wurde bei Zustand nach tumorbedingter Ablatio testis der Gegenseite eine Organ erhaltende Tumorenukleation durchgef‚hrt. Bei drei Patienten war bei Vorstellung in unserer Klinik bereits ausw€rtig die Ablatio in Belegabteilungen erfolgt, die die Patienten in zwei F€llen zur adjuvanten Chemotherapie und einen Patienten zur RLA vorstellten. (Tab. 3.2-6) Tab. 3.2-6: Prim€rtherapie Patientengut keine RLA bei ausw€rtiger Ablatio Ablatio testis Tumorexzision Gesamt H•ufigkeit 2 1 77 1 81 Prozent 2,5 1,2 95,1 1,2 100,0 106 95,1 2,5 1,2 keine RLA bei ausw•rtiger Ablatio 1,2 Ablatio testis Tumorexzision Abb. 3.2-8: Relative Verteilung Prim€rtherapie des Kolektivs Der ‚berwiegende Anteil der Patienten wurde im Rahmen der Prim€rtherapie auf der Gegenseite zum Ausschluss einer TIN biopsiert. Aufgrund der Teilnahme unserer Abteilung an der multizentrischen TIN-2-Studie von Dieckmann und Loy wurden zumeist Biopsien vom Ober- und Unterpol entnommen. Die f‚nf angegebenen Patienten ohne Proben-Entnahme (Pe) waren zum Teil nicht in unserer Klinik abladiert worden, zwei Patienten hatten einen Einzelhoden. Allen Patienten, die in unserer Klinik einer Prim€rtherapie unterzogen wurden, wurden Proben der Gegenseite entnommen. Betrachtet man die Relation der Biopsienanzahl isoliert, so wurden bei 64 von 76 Patienten (84,2%) eine Doppelbiopsie entnommen. Im gesamten Kollektiv fand sich kein Patient, der die Pe ablehnte. Komplikationen gr•ƒerer Kategorie traten nicht auf, kleinere H€matome waren vereinzelt zu verzeichnen. Eine Revision war nie erforderlich. 107 Tab. 3.2-7: Probebiopsien Gegenseite (OberPol, UnterPol) H•ufigkeit Prozent 5 12 64 81 6,2 14,8 79,0 100,0 keine OP OP+UP Gesamt 7 9 ,0 1 4 ,8 6 ,2 OP k e in e O P+UP Abb. 3.2-9: Relative Verteilung (in Prozent) der Probebiopsie auf der Gegenseite 3.2.5. Histologie Die einfachste und f‚r die Therapie €uƒerst wichtige Einteilung unterscheidet das reine Seminom vom Nichtseminom. 40 der 81 Patienten (49,4%) hatten ein reines Seminom, entsprechend lagen bei 56,8% ein Nichtseminom bzw. ein Mischtumor mit Seminomanteil vor. (Tab. 3.2-8, Abb. 3.2-10) Tab. 3.2-8: Verteilung Seminome und Nichtseminome im Kollektiv Anzahl Prozent Seminom 40 49,4 Nichtseminom 41 50,6 Gesamt 81 100 108 50,6 49,4 Seminom Nichtseminom Abb. 3.2-10: Relative Verteilung Seminome / Nichtseminome Betrachtet man die Verteilung aller Mischtumore mit Seminomanteilen, so zeigt sich kein signifikanter Unterschied. Zu beobachten ist eine homogene Durchmischung fast aller Subtypen. Allerdings gab es keine Kombination mit einem Chorionkarzinom oder Teratom. (Tab. 3.2-9) Tab. 3.2-9: Seminomvorkommen (Reinform und Mischtumore) Vorkommen Seminom N Rein 40 Dottersack 2 Embryonal 4 Chorion 0 Teratom 0 TIN 4 Dottersack / Embryonal 2 Dottersack / Teratom 1 Dottersack / Chorion 0 Embryonal / Teratom 6 Teratom / Chorion 1 109 40 4 4 0 6 2 1 0 1 D ot te r sa ck TI D /E ot N m te br rs yo ac na D k ot /T l te er rs at Em ack o /C m br yo ho na rio l n /T Te er ra at to o m /C m ho rio n 0 R ei D n ot te rs ac Em k br yo na l C ho rio n Te ra to m 2 Abb. 3.2-11: Absolutes Vorkommen Seminom als Rein- und Mischform In Tab. 3.2-10 ist das absolute und relative Auftreten der einzelnen Subtypen dargestellt. Da nicht nur Befunde mit singul€rem Histologietyp sondern auch Mischtumoren ber‚cksichtigt wurden, ist die absolute Gesamtzahl gr•ƒer als 81 (122). Die prozentualen Angaben beziehen sich jedoch auf die Patientenanzahl. So l€sst sich eine Aussage ‚ber das relative Vorkommen der Subtypen bezogen auf das Gesamtkollektiv treffen. 110 Tab. 3.2-10: Tumorarten gesamt (Rein- und Mischtumor) H•ufigkeit Prozent Seminom 46 56,8 Embryonal 32 39,5 Teratom reif 12 14,8 Dottersack 12 14,8 TIN 8 9,9 Teratom unreif 6 4,92 Teratom maligne Transformation 1 1,23 Chorion 5 6,17 (122) 56,8 39,5 6,17 Chorion 1,23 malignes Teratom 4,92 Teratom unreif 9,9 TIN Dottersack 14,8 Teratom reif Embryonal Seminom 14,8 Abb. 3.2-12: Relativer Anteil Tumorarten an Gesamtauftreten 3.2.6. TIN Bei acht Patienten wurden TIN-Zellen im Tumor tragenden Hoden nachgewiesen, vier Patienten wiesen eine kontralaterale TIN auf. Bei Pat Nr. 54 bestand beiderseits ein positiver Befund. Dementsprechend kann man auch sagen, dass sieben Patienten auf der Tumorseite, drei Patienten auf der kontralateralen Seite und ein 111 Patient beiderseits betroffen waren. Insgesamt lag bei elf Patienten des Kollektivs (8,4%) ein positiver TIN-Nachweis vor. Bei f‚nf Patienten des Kollektivs waren keine Probebiopsien in unserer Klinik entnommen worden. Daraus erkl€rt sich die Anzahl von 76 Patienten als 100%. Aufgrund des doppelseitigen Vorliegens von TIN-Zellen bei einem Patienten (Nr. 54) ergeben sich in Tab. 3.2-11 insgesamt zw•lf Nachweise bei elf Patienten. Tab. 3.2-11: Nachweis von TIN-Zellen Tumor- und Gegenseite Tumorseite Gegenseite H•ufigkeit Prozent H•ufigkeit Prozent ja 8 10,5 4 5,3 nein 68 89,5 72 94,7 Gesamt 76 100,0 76 100,0 Tumorseite 89,5 94,7 10,5 5,3 Gegenseite Abb. 3.2-13: Anteiliger Nachweis von TIN-Zellen auf Tumor- und Gegenseite in Prozent Die TIN-Zellen waren neben sechs Seminomen, einem Dottersacktumor und einem Mischtumor nachgewiesen worden. F‚r die Patienten mit TIN-Zellen im Biopsienachweis auf der Gegenseite bestand eine €hnliche Dominanz zugunsten eines Seminoms. Auch bei TIN-Nachweis der Gegenseite zeigte sich vorwiegend das 112 Seminom sowie das Embryonalkarzinom. (Tab. 3.2-12 und -13, Abb. 3.2-14 und -15) Tab. 3.2-12: Vorkommende Tumorarten mit gleichzeitigem TINNachweis TIN Tumorseite Seminom 6 Embryonal/ Dottersack/ unreifes Teratom Dottersack 1 1 6 1 Seminom Embryonal/ Dottersack/ unreifesTeratom 1 Dottersack Abb. 3.2-14: Tumorarten Tumorseite bei parallelem TIN-Nachweis Tab. 3.2-13: Vorkommende Tumorarten mit TIN-Nachweis Gegenseite TIN (Gegenseite) Seminom 3 Embryonal 1 Gesamt 4 113 3 1 Seminom Embryonal Abb. 3.2-15: Tumorarten bei TIN-Nachweis der Gegenseite 3.2.7. Stadien Im Folgenden sind die Tumorstadien des Kollektivs dargestellt. Die Daten beschreiben den pathologischen Befund (pT); bei den Lymphknoten wird in cN und pN unterschieden. Mit cN (klinisch) wird die Ausbreitungsdiagnostik eingestuft, pN ergibt sich aus dem histopathologischen Befund, kann also nur nach erfolgter RLA oder wie in einem Fall nach Biopsie eines Bulky disease vorliegen. T (Tumorausdehnung) Bez‚glich der TNM-Nomenklatur zeigt sich mit T2 das dominierende Auftreten in der Einteilung. Tumoren mit Skrotuminfiltration (T4) waren nicht vertreten. Das Gros der Patienten hatte also einen auf den Hoden begrenzten Tumor. (Tab. 3.2-14, Abb. 3.2-16) Tab. 3.2-14: Absolute und relative Verteilung T-Stadium (TNM) H•ufigkeit Prozent T1 18 22,2 T2 58 71,6 T3 5 6,2 T4 0 0 Gesamt 81 100,0 114 71,6 80 70 60 50 40 30 22,2 20 6,2 10 0 0 T1 T2 T3 T4 Abb. 3.2-16: Relative Verteilung T-Stadium cN (Nodus, klinisch) Beim Lymphknotenstatus zeigt sich, dass nahezu 70 % der Patienten keine darstellbaren Metastasen der Lymphkotenstationen aufweisen. Die f‚nf Patienten mit Nx zeigten zum Teil unklare bzw. grenzwertige Befunde in der Computertomographie. (Tab. 3.2-15, Abb. 3.1-17) Tab. 3.2-15: Absolute und relative Verteilung cN-Stadium (TNM) H•ufigkeit Prozent Nx 5 6,2 cN0 55 67,9 cN1 9 11,1 cN2 5 6,2 cN3 4 4,9 Bulky 3 3,7 Gesamt 81 100,0 115 80 67,9 70 60 50 40 30 20 10 11,1 6,2 6,2 4,9 3,7 N2 N3 Bulky 0 Nx N0 N1 Abb. 3.2-17: Relative Verteilung cN-Stadium (TNM) pN (Nodus, histologisch gesichert) Bei 18 der 81 Patienten wurde eine RLA durchgef‚hrt. Rund zwei Drittel der Patienten wiesen seitens der entnommenen Lymphknoten keine Malignit€t auf. In allen diesen F€llen war eine Polychemotherapie vorausgegangen, vitales Residualgewebe, zum Beispiel im Sinne eines Growing-teratoma-Syndroms, war in keinem Fall nachgewiesen worden. Bei vier Patienten (4,9%) waren Lymphknotenmetastasen unter einer Gr•ƒe von 2 cm entfernt worden (entsprechend pT1), bei zwei Patienten (2,5%) wurden Lymphknoten mit mehr als 5 cm Ausdehnung exstirpiert. (Tab. 3.2-16, Abb.3.2-18) Tab. 3.2-16: Absolute und relative Verteilung pN-Stadium (TNM) H•ufigkeit Prozent Kein pN 63 77,8 pN0 12 14,8 pN1 4 4,9 PN2 0 0 pN3 2 2,5 Gesamt 81 100,0 116 90 80 77,8 70 60 50 40 30 14,8 20 4,9 10 0 2,5 pN2 pN3 0 Kein pN pN0 pN1 Abb. 3.2-18: Relative Verteilung pN-Stadium (TNM) 117 M (Metastasen) Die Dokumentation der Metastasen im bearbeiteten Kollektiv beruht allein auf klinischer Diagnostik. Die Nomenklatur wurde zwischenzeitlich modifiziert, alle Patienten waren deshalb neu einzustufen. Nach der sechsten Fassung der UICC 2003 (EGCCCG, 2004) wird zwischen M1a (pulmonalen Metastasen) und M1b (andere Metastasen auƒer LK und pulmonal) differenziert. Die Unterscheidung beruht auf den unterschiedlichen Prognoseeinfl‚ssen der Lokalisation. W€hrend die pulmonalen Metastasen noch relativ h€ufig sind (11,1%), waren nur eine cerebrale und zwei mediastinale Metastasen im Patientengut nachweisbar(s. Tab. 3.2-17, Abb. 3.2-19). Tab. 3.2-17: Absolute und relative Verteilung Metastasennachweis H•ufigkeit Prozent Mx 3 3,7 M0 66 81,5 M Ia (pul) 9 11,1 M Ib (sonstige) 3 3,7 Gesamt 81 100,0 81,5 11,1 3,7 Mx M0 M Ia (pul) 3,7 M Ib (sonstige) Abb. 3.2-19: Relative Verteilung Metastasennachweis 118 Gef•ƒinvasion Die Frage nach der Invasion von Blut- und Lymphgef€ƒen spielt bei der Therapiefindung eine gewichtige Rolle. Lediglich bei 35,8% bestand keine Invasion der Gef€ƒe. Zumeist sind sowohl Blut- als auch Lymphgef€ƒe gleichzeitig betroffen. (Tab. 3.2-18, Abb. 3.2-20) Tab. 3.2-18: Absoluter und relativer Anteil von Blut- und Lymphgef€ƒinvasion Absolut Relativ L1 8 9,9 V1 15 18,5 L1+V1 29 35,8 Gesamt 52 64,2 64,2% 52 35,8% 29 8 9,9% 18,5% 15 L1 V1 L1V1 Gesamt Abb. 3.2-20: Absoluter und relativer Anteil Blut- und Lymphgef€ƒinvasion 3.2.8. Klassifikationen Die Einteilung in die jeweiligen Stadien ist nach dem aktuellen Stand erfolgt. W€hrend zun€chst nur die Lugano-Einteilung Be- 119 r‚cksichtigung fand, wurde in den letzten Jahren zus€tzlich die IGCCCG-Prognoseeinteilung f‚r fortgeschrittene Stadien eingef‚hrt. Der Vollst€ndigkeit halber sind s€mtliche Einteilungen auƒer der Indiana-Klassifikation ber‚cksichtigt. (Tab. 3.2-19, Abb. 3.2-21) Lugano Es zeigt sich, dass mehr als die H€lfte der Patienten dem Stadium I zuzuordnen sind. Das Stadium II ist relativ wenig vertreten, w€hrend rund 15% der Patienten Absiedelungen oberhalb des Zwerchfells aufweisen. Tab. 3.2-19: Absolute und relative Verteilung Tumorstadien (Lugano-Klassifikation) Lugano H•ufigkeit Prozent IA 23 28,4 IB 26 32,1 IC 0 0 II A 12 14,8 II B 0 0 II C 7 8,6 III A 7 8,6 III B 4 4,9 III C 1 1,2 Gesamt 81 100,0 120 32,1 28,4 14,8 8,6 8,6 4,9 0 IA IB 1,2 0 IC II A II B II C III A III B III C Abb. 3.2-21: Relative Verteilung Tumorstadien (LuganoKlassifikation) CS Das Klinische Stadium unterscheidet sich zur Lugano-Klassifikation durch die Ber‚cksichtigung der Serumparameter. Hier fallen rund 75% der Patienten in die Stadien I-II A. Die Stadien II B/C sind gar nicht, das Stadium IIIB ist mit 16,1% recht stark vertreten. Tab. 3.2-20: Absolute und relative Verteilung klinisches Stadium (CS) H•ufigkeit Prozent IA IB IC IIA IIB IIC IIIA IIIB IIIC Gesamt 6 22 22 12 0 0 5 13 1 81 7,4 27,2 27,2 14,8 0 0 6,2 16,1 1,2 100,0 121 27,2 27,2 16,1 14,8 7,4 IA 6,2 IB IC IIA 0 0 IIB IIC 1,2 IIIA IIIB IIIC Abb. 3.2-22: Relative Verteilung klinisches Stadium (CS) IGCCCG-Klassifikation Die neueste der Keimzelltumor-Einteilungen wurde zur Klassifikation fortgeschrittener Tumorstadien entwickelt. Dementsprechend finden nur diese Patienten des Kollektivs Ber‚cksichtigung. Im Kollektiv waren 31 der 81 Patienten (38,3%) im Stadium II oder III. Die H€lfte der Patienten in fortgeschrittenen Stadien war der good prognosis zuzuordnen, 35,5% waren in der intermediate-Gruppe (entsprechend 13,6% des Gesamtkollektivs) und 9,7% entfielen auf die poor-prognosis-Gruppe (3,7% des Gesamtkollektivs). (Tab. 3.221 und 3.2-22, Abb. 3.2-23 und 3.2-24) Tab. 3.2-21: Relative Verteilung IGCCCG-Klassifikation Prognosis good Prozent Gesamtgut 21 intermediate 13,6 poor 3,7 Gesamt 38,3 122 38,3 21 13,6 3,7 good intermediate poor Gesamt Abb. 3.2-23: Relative Verteilung IGCCCG-Klassifikation Tab. 3.2-22: Absolute und relative Verteilung IGCCCG-Klassifikation H•ufigkeit Prozent fortgeschr. Stadien good prognosis intermediate prognosis poor prognosis Gesamt 17 54,8 11 35,5 3 9,7 31 100,0 54,4 35,5 9,7 good intermediate poor Abb. 3.2-24: Relative Verteilung Tumorstadien (IGCCCG) 123 Serumklassifikation Ein Blick auf die Serumtumormarker zeigt, dass bei mehr als der H€lfte der Patienten erh•hte Werte vorlagen und entsprechend Einfluss auf das klinische Stadium und damit auf die Therapie nahm. Zur Ber‚cksichtigung kommen hierbei nur die postoperativen , also nach erfolgter Prim€rtherapie bestimmten Werte. Bei 43% des Kollektivs lag ein markernegativer Tumor vor oder die Werte waren postoperativ auf Referenzniveau abgesunken. Bei 46 Patienten (56,8%) nahmen also die Serumwerte Einfluss auf Stadieneinteilungen. (Tab. 3.2-23, Abb. 3.2-25) Tab. 3.2-23: Absolute und relative Verteilung SerummarkerKlassifikation H•ufigkeit Prozent S0 35 43,2 S1 22 27,2 S2 22 27,2 S3 2 2,4 Gesamt 81 100,0 27,2 27,2 43,2 2,4 S0 S1 S2 S3 Abb. 3.2-25: Relative Verteilung Serum-Klassifikation die 124 High und low-risk-Patienten Zur Abw€gung des Risikos und Planung einer Surveillance- versus adjuvanter Therapie k•nnen Patienten mit Seminom im Klinischen Stadium CS I als high- und low-risk-Patienten eingruppiert werden (Heidenreich, 2004). Prognostisch ung‚nstige Unterschiede machen dabei die Tumorgr•ƒe (> 4 cm) und der positive Nachweis der Blutoder Lymphgef€ƒinvasion aus. Tab. 3.2-24: Patienten mit Seminom und CS I Risikofaktor Anzahl Prozent (Kollektiv) > 4cm 8 9,9 < 4 cm 14 17,3 V1 15 18,5 V0 10 12,3 L1 9 11,1 L0 16 19,75 < 4 cm, V0, L0 7 8,6 In unserer Klinik wurde hier generell eine Radiatio empfohlen, eine Surveillance-Strategie wurde bisher bei keinem Patienten verfolgt. Bei sieben (8,6%) Patienten h€tte die M•glichkeit einer Zuordnung zur low-risk-Gruppe und damit die Empfehlung einer SurveillanceTherapie bestanden. 3.2.9. Response Die Responseangaben gehen vom „berleben der Patienten aus. Hier zeigten sich zwei partielle Remissionen beim Restage nach 125 erfolgter Therapie, ein Patient zeigte ein Fortschreiten der Erkrankung unter der Therapie. Tab. 3.2-25: Absolute und relative Verteilung Response H•ufigkeit Prozent CR (complete response) 78 96,3 PD (progressive disease) 1 1,2 PR (partial response) 2 2,5 Gesamt 81 100,0 78 100 Prozent 80 60 40 20 1 2 0 C R PD PR Abb. 3.2-26: Prozentuale Verteilung des Response im Kollektiv Von zwei Patienten ist bekannt, dass sie verstorben sind. W€hrend bei Patient Nr. 79 die Ursache unbekannt ist, verstarb Patient Nr. 6 an den Folgen einer Sepsis. Zur kompletten Remission konnten 96,3% der Patienten gebracht werden. 126 4.Diskussion 4.1. Allgemein Die Einf‚hrung der Cisplatin-basierten Chemotherapie 1979 hat die Heilungsraten des Keimzelltumors auf ein sehr hohes Niveau gebracht und stellte einen massiven Schritt dar. In Deutschland erkrankten im Jahr 2001 3.300 M€nner an einem Keimzelltumor. Statistisch handelt es sich bei den unter 50-j€hrigen um die h€ufigste Krebserkrankung. Entsprechend einer Mortalit€tsrate von 0,33/100.000 Einwohner verstarben im gleichen Jahr 179 Patienten an dieser Erkrankung. Zugleich gingen Patienten mit einem Keimzelltumor 6.100 Lebensjahre verloren. In Relation zu den 97.400 Lebensjahren, die Prostatakrebs-Patienten im gleichen Zeitraum entgingen, erscheint das zun€chst wenig. Die deutlich geringeren Gesamtzahlen und das noch junge Alter bei Auftreten der Erkrankung sollten allerdings alarmieren. In Zahlen ausgedr‚ckt sind dies pro Kopf acht Lebensjahre, w€hrend ein ProstatakarzinomPatient statistisch gesehen drei Lebensjahre einb‚ƒt (Schrader et al. 2004). Diese Werte und die stetig ansteigenden Inzidenzen in den letzten Jahrzehnten verbieten ein Ausruhen aufgrund vermeintlich hoher Heilungsraten. Im Interesse der vorwiegend jungen Patienten sollte auch weiterhin am Ziel der 100% -Heilungsquote gearbeitet werden. Hierzu ist sicherlich auch die intensive Verfolgung der TINErforschung hilfreich. Das urspr‚ngliche Ziel der Arbeit war, das Aufkommen von TINZellen im Hoden bei nachgewiesenem Keimzelltumor zu betrachten und die vorhandene Literatur zu sichten. Schon im Ansatz zeigte 127 sich, dass dies nicht ohne eine gleichzeitige Bearbeitung der Keimzelltumore m•glich ist. Der Nachteil der hier durchgef‚hrten retrospektiven gegen‚ber einer prospektiven Auswertung liegt darin, dass man lediglich die Variablen erfassen kann, die zum Analysezeitpunkt vorliegen. Ein Spielraum zum individuellen Beleuchten in der Literatur beschriebener Hypothesen bleibt nicht. So konnte man hier zum Beispiel nicht auf Daten wie das Alter der Mutter zum Geburtszeitpunkt, das Geburtsgewicht oder die Geschwisteranzahl zur‚ckgreifen. F‚r eine prospektive Studie w€re zum Beispiel die Verfolgung der ˆstrogen‚berschuss-Theorie (Forman et al., 1990; M•ller, 1993; Bokemeyer et al., 1992) m•glich und interessant. Ein weiteres statistisches Problem liegt in der Seltenheit der Erkrankung, die mit 7,6 Neuerkrankungen pro Jahr und 100.000 M€nnern lediglich bei multizentrischen Studien valide Auswertungen ergeben kann. Verst€rkt wird das Problem, dass nur etwa 5% der Keimzelltumorpatienten zus€tzlich eine TIN aufweisen. Die Betonung der vorliegenden Arbeit liegt daher deutlich zugunsten der Historie und Zusammenfassung der bisher ver•ffentlichten Kenntnisse. Die Auswertung der eigenen Zahlen tragen nur unterst‚tzenden Charakter. Trotzdem weisen die eigenen Ergebnisse „bereinstimmungen zu den Angaben in der Literatur auf, nur vereinzelt sind „Ausreiƒer“ zu verzeichnen. Im Folgenden werden die Daten mit den Ergebnissen der in der Literatur angegebenen Studien verglichen. 128 4.2. Begriffbestimmung Die einheitliche Begriffsfindung f‚r die Pr€kanzerose des Hodenkarzinoms ist international noch nicht abgeschlossen. Es finden sich immer noch diverse Bezeichnungen, vor allem der anglo- amerikanische Raum scheint an einer eigenen Bezeichnung festhalten zu wollen. Hier ist ‚berwiegend der Terminus Intratubular Germ Cell Neoplasia, Unclassified (IGCNU) in Gebrauch. Laut Dieckmann (2000 und 2005) sei eine internationale Manifestation der Bezeichnung TIN erkennbar. Diese seit Jahren aufgestellte Behauptung, ist jedoch gerade im angloamerikanischen Raum nicht nachzuvollziehen. Dabei ist der Begriff TIN jedoch €uƒerst treffend. Erstens beschreibt er sehr genau Entstehungsortes die betroffene (intraepithelial) anatomische und zweitens Struktur des erscheint die phonetische •hnlichkeit zu Bezeichnungen wie PIN, VIN, CIN und so weiter sinnvoll. 129 4.3. Anamnese / Risikofaktoren Entsprechend den Angaben in der Literatur fand sich bei 10% der Patienten ein Kryptorchismus der Tumorseite oder beiderseits. Die Dunkelziffer ist sicherlich hoch, da dieser Punkt in der Anamnese nicht immer genau zu dokumentieren war. Gleiches gilt auch f‚r die Erfassung der Familienanamnese, trotzdem fanden sich rund 5% der Patienten, die einen Hodentumor bei Verwandten ersten Grades angaben. Ein Tumor der Gegenseite lag bei zwei Patienten vor. Andere Risikofaktoren wie Ern€hrungsgewohnheiten in der Kindheit, Alter der Mutter bei Geburt, Erstgeborenenstatus und so weiter fanden keine Ber‚cksichtigung bei der Anamnese. 130 4.4. Diagnosealter Es ist allgemein bekannt, dass die Patienten mit Seminom durchschnittlich etwa zehn Jahre €lter sind als die mit Nichtseminomen. W€hrend beim Seminom der Altersgipfel in der 4. Lebensdekade angegeben wird, sind die Patienten mit nichtseminomat•sen Tumoren zumeist zwischen 20 und 30 Jahren (Heidenreich, 2004). Hier waren die eigenen Zahlen kongruent zur Literatur. Die Seminompatienten waren mit 39,73 Jahren deutlich €lter als die mit Nichtseminomen (34,32). Im Vergleich zu Zahlen von Albers ist das Kollektiv insgesamt noch €lter, gibt er die Altersgipfel doch mit 26 beziehungsweise 36 Jahren an (Albers, 2002). Wittekind hat das Alter bei Diagnose in Bezug auf die Tumorklassifikation mit 27 Jahren bei Seminomen und 36 Jahren bei Nicht-Seminomen beobachtet (Wittekind, 2003). Neben der Atrophie (Volumen <12 ml) gilt das Alter unter 30 Jahren bei Diagnose eines Keimzelltumors des Hodens als Risikofaktor f‚r eine TIN auf der Gegenseite (Albers, 2002). Umgekehrt bedeutet dies, dass diese Patienten j‚nger als der Rest des Kollektivs sein m‚ssten. Tats€chlich bestand jedoch in unserem Kollektiv ein Durchschnittsalter von 36 Jahren. Es handelte sich allerdings nur um vier Patienten, die Altersverteilung war 22, 40, 40 und 42 Jahre. Die Zahlen liegen also weit auseinander; eine Wertung ist somit nicht m•glich. 131 4.5. K‚rperstatur Eine laufende Studie von Dieckmann untersucht die Fragestellung, ob Keimzelltumorpatienten durchschnittlich gr•ƒer und schlanker als gesunde M€nner sind (Dieckmann, 2003). Basis dieser Annahme ist die zuvor bereits beschriebene Theorie der hochkalorischen Ern€hrung im Kleinkindalter. Die Vorstellung entspricht dem Bild eines Leptosomen in der Konstitutionslehre nach Kretschmer. Auf der Suche nach solchen Merkmalen erhofft man sich, weitere Risikofaktoren zu ermitteln, die zuk‚nftig eine pr€ventive Bedeutung bekommen k•nnten. Unsere Patienten waren im Mittel 179,98 cm groƒ, der BMI war 26,56. Laut Statistischem Bundesamt liegt die durchschnittliche K•rpergr•ƒe aller M€nner ‚ber 18 Jahre in Deutschland bei 177 cm, das BMI-Mittel liegt bei 26,0 (Statistisches Bundesamt Deutschland, 2005). Damit zeigte sich, dass die Patienten zwar gr•ƒer, allerdings auch kr€ftiger waren als der deutsche Durchschnitt. Folgt man dem Modell der besonders fettreichen fr‚hkindlichen Ern€hrung (s. Kapitel Epidemiologie), so ist eine k•rperlich gr•ƒere und kr€ftigere Statur kein Widerspruch. Dieckmann (2003) stellte jedoch auch fest, dass Patienten mit Keimzelltumoren im Schnitt eher einen niedrigeren BMI als ein vergleichbares Kollektiv besaƒen. 132 4.6. Histologie Die Einteilung nach der histologischen Klassifikation der WHO 1977 zeigt folgende Verteilung. Tab. 4.6-1: Vergleich Histologie eigenes Kollektiv mit Literaturangaben (Quelle: AKH-Consilium, 2006 und Gerl et al., 2003) Klassifikation Literatur [%] Eigenes Kollektiv Relativ [%] Absolut Seminome (Reinform) 40-55 49,4 40 Seminome (Mischtumor) 10-20 8,64 14 Nicht-Seminome 40-60 50,6 32 Teratokarzinom 15-25 21,0 19 Embryonalkarzinom 10-20 39,5 32 Dottersacktumor 2-6 14,8 12 Chorionkarzinom 15-20 6,17 5 Die angegebenen Prozentzahlen beziehen sich auf den Anteil einer Tumorentit€t am Gesamtkrankengut. Da die in Mischtumoren vorkommenden Subtypen einzeln betrachtet wurden, ist die Summe entsprechend h•her als 100%. Auff€llig ist der sehr hohe Anteil von Embryonalkarzinomen und Dottersacktumoren, die fast doppelt so oft vorkamen wie in der Literatur angegeben. Dagegen zeigen die Chorionkarzinome ein deutlich geringeren Anteil. Eine sinnvolle Erkl€rung ist nicht ersichtlich, f‚r statistische Schwankungen erscheinen die Werte zu abweichend. 133 4.7. TIN Mit dem viermaligen Nachweis von TIN-Zellen der Gegenseite per Probebiopsie entsprechen die 5,3% den Angaben von Dieckmann und Loy (2004) in der TIN-II-Studie. Hier wurde bei jedem Patient ein gezielter Nachweis durchgef‚hrt. Auch in fr‚heren Studien wie der von Cookson und Sarosdy (1995) hatten sich €hnliche Ergebnisse (4,5%) gezeigt In Studien hat man kumuliert bei 82-96% der F€lle in scheinbar gesundem Gewebe TIN-Zellen im tumortragenden Hoden nachgewiesen (Dieckmann et al., 2005). In unserem Patientengut konzentrierte sich die histopathologische Beobachtung des abladierten Hodens auf die Tumorbestimmung und –klassifikation. Die TIN-Zellen neben dem Tumor, die nahezu synchron bei jedem Seminom und bei vielen anderen Tumorentit€ten zu erwarten sind, sind lediglich in acht F€llen nachgewiesen worden. Dies ist nur dadurch zu erkl€ren, dass wegen fehlender therapeutischer Konsequenz auf den arbeitsintensiven histochemischen Nachweis verzichtet wurde. Gr‚nde hierf‚r liegen im vermehrten Zeit- und Kostenaufwand f‚r den aufwendigen immunhistochemischen Nachweis der PLAP-positiven TIN-Zellen. Die Dominanz der Seminome mit 37% TIN-Zellen in der Umgebung war zu erwarten; zum einen, weil in der Umgebung von Seminomen h€ufiger TINZellen als bei anderen Entit€ten beobachtet werden und zum anderen, weil bei der H€lfte der Patienten ein Seminom vorlag. 134 4.8. Stadieneinteilungen TNM-Klassifikation Bei der Sichtung der Stadienverteilung fiel eine sehr hohe Rate an T2-Tumoren auf. Dies lag zum groƒen Teil am recht hohen Anteil der Lymph- und / oder Blutgef€ƒinvasionen. Insgesamt war bei 64% der Patienten eine Lymph- und/oder Gef€ƒinvasion beobachtet worden. Mit dem Nachweis ist generell eine h•here Metastasenexistenz verbunden. Der Einfluss auf die Therapie ist auch hier relativ hoch. Die wenigsten Tumore wurden wegen Ihrer AlbugineaInvasion in diese Gruppe eingeteilt. Ein T4-Tumor, also mit einer Skrotumbeteiligung, war nicht im Kollektiv vorhanden. Die Betrachtung der Lymphknotenmetastasierung im klinischen Staging ergab zun€chst eine Diskrepanz. W€hrend klinisch f‚nf Patienten mit cN2 vorkamen, bildete sich dieses nicht in den Stadieneinteilungen entsprechend ab. N€her betrachtet ergab sich jeweils eine Erkl€rung. Ein Patient wies eine pulmonale, zwei Patienten jeweils eine extrapulmonale Metastasierung auf, alle drei wurden entsprechend h•her als IIC eingestuft. Ein Patient hatte einen grenzwertigen Befund bez‚glich einer Metastasierung und wurde nicht zuletzt wegen der S2-Konfiguration ebenfalls hochgestuft. Ein Patient mit einem reifen Teratom wies histopathologisch (pN) gr•ƒere Tumormassen in der RLA auf als zuvor im Staging nachgewiesen wurden. Entsprechend dem pN3 stieg der Patient retrospektiv in die IIC-Gruppe gem€ƒ Lugano-Klassifikation. In der Klinischen Stadieneinteilung wurde der Patient nach IIIB verschoben, da ein S2-Befund vorlag. Dies zeigt den Einfluss der 135 Serumtumormarker auf die neuere CS-Einteilung und erkl€rt die fehlende IIB-Gruppe in Lugano- und CS-Klassifikation. Tab. 4.8-1: Patienten mit cN2 und dem Einfluss von Metastasen sowie Serumwert auf die Stadieneinteilung nach Lugano und CS Histologische Tumor- Klassifikation gr‚ƒe pT cN pN Seminom 1,7 T2 N2 M1b III A 2 III A good Teratom reif 5,5 T3 N2 Mx II C 2 III B good Teratom unreif 3 T2 N2 M1a III A 1 III A intermediate Seminom 4 T2 N2 M1b III C 2 III C Teratom reif 4 T2 N2 pN3 M0 II C 2 III B intermediate M Lugano S CS IGCCCG Embryonal, Dottersack poor Insgesamt zeigte sich im Vergleich zur Literatur kein Unterschied bei der Lymphknotenmetastasierung. 70% Prozent der Patienten waren ohne Nachweis von Lymphknotenvergr•ƒerungen beim Staging, 11% hatten Lymphknotenvergr•ƒerungen bis 2 cm und weitere 6,2% zwischen 2 und 5 cm. Bei drei Patienten (3,7%) zeigte sich ein Bulky disease. Umgesetzt in die jeweilige Klassifikation entspricht das Verh€ltnis den Angaben in der Literatur (Albers, 2002). Die Fernmetastasenrate ergibt ein ‚bliches Bild. Rund 80% wiesen keine Fernabsiedelung auf. Die meisten Metastasen waren pulmonal nachweisbar gewesen, lediglich drei Patienten hatten eine anderweitige Metastasierung aufzuweisen. Diese Unterscheidung wurde retrospektiv ermittelt, da diese zu Beginn des beobachteten Abschnitts (1.1.2000) noch keine Beachtung fand. Klinisch relevant ist diese Differenzierung aufgrund der abweichenden Therapie. 136 Hirnmetastasen m‚ssen zum Beispiel operativ saniert werden, da eine Chemotherapie bei intakter Blut-Hirn-Schranke keine ausreichende Therapie darstellt. Die Einteilung der IGCCCG ist zur Standardisierung der Therapie von metastasierten Keimzelltumoren aufgrund klinisch ermittelter beziehungsweise mathematisch ermittelter Werte an einem sehr groƒen Kollektiv entwickelt worden. Von den 31 Patienten kamen 54,8 % in die good-, 35,5% in die intermediate- und 9,7% in die poor-prognosis-Klassifikation. In der Literatur sind die Werte sehr €hnlich (56%,28%,16%). Die intermediate-Gruppe war etwas st€rker vertreten. Serum-Klassifikation Bei fast 46% der Patienten waren die Tumormarker erh•ht und nahmen dementsprechend Einfluss auf die Klinische Einteilung. Prim€r war der Anteil h•her, bedingt durch die Definition der Serumklassifikation blieben jedoch nur 22 Patienten ‚brig, bei denen auch postoperativ eine Tumormarkererh•hung vorlag. Dabei waren fast die H€lfte der S2-Klassifikation und zwei Patienten der S3Klassifikation zuzuordnen. Damit wird der Patient bei gleichzeitigem Nodusnachweis in CS IIIB oder IIIC bei gleichzeitigem Metastasennachweis gef‚hrt. Insgesamt sind also 30% der Patienten mit nachgewiesenen Metastasen beziehungsweise Lymphknotenver- gr•ƒerungen deutlich h•her in der CS als in der LuganoKlassifikation eingeordnet. 137 4.9. Response Mit einer Complete Response-Rate von 96,3% wird ein guter Wert im Vergleich zu den Literaturangaben erreicht (Pottek, 2002; Albers, 2002; Heidenreich, 2005). Allerdings ist dabei zu beachten, dass die Nachsorgezeit maximal 5,5 Jahre betrug und nur indirekt ‚ber das Tumorregister und die niedergelassenen Kollegen erfasst wurde. Drei Patienten zeigten eine Progredienz beziehungsweise stable disease: Bei Patient Nr. 54 (Seminom, reifes Teratom, Chorionkarzinom, pT2NxM1aS1; CS IIIB) zeigte sich radiologisch eine persistierende pulmonale Metastasierung nach erfolgter Chemotherapie. Patient Nr. 28 (Embryonal- und Chorionkarzinom, pT2N1M0S1; CS IIA) wies eine AFP-Persistenz nach prim€rer und adjuvanter Therapie auf. Nach der Ablatio testis folgten zwei Zyklen PEB mit anschlieƒender retroperitonealer Lymphadenektomie. Aufgrund des Neuanstiegs des AFPs und erneuten grenzwertig vergr•ƒerten retroperitonealen Raumforderungen in der bildgebenden Diagnostik erfolgte ein Jahr nach Prim€rtherapie eine erneute RLA ( pN0). Der AFP-Wert blieb postoperativ bei 11 ng/ml. Patient Nr. 6 (Seminom, pT2N2M1b CS IIIC ) zeigte unter laufender Chemotherapie ein Fortschreiten der Erkrankung (PD) und entwickelte schwerste Komplikationen (Sepsis), welche letztlich zum Tode f‚hrten. Bereits bei der station€ren Aufnahme zeigten sich in der R•ntgenaufnahme des Thorax multiple Metastasen sowie ein Spontanpneumothorax. Im Rahmen der Ablatio testis wurde eine Thoraxdrainage eingelegt, die Chemotherapie erfolgte ohne Verz•gerung. Bei inad€quatem Serummarkerabfall wurde der Patient in die Uniklinik Bonn zur Durchf‚hrung einer high-dose-Chemotherapie verlegt. Hier verstarb der Patient unter dem Bild einer fulminanten 138 Sepsis aufgrund einer Pneumonie mit intubationspflichtiger Ateminsuffizienz sowie eines infizierten Ports. 139 5.Zusammenfassung Maligne Keimzelltumoren des Hodens (testicular germ cell tumours, TGCT) machen 1% aller Neoplasien aus, repr€sentieren aber mit 23% der b•sartigen Neubildungen das h€uftigste Tumorleiden bei M€nnern zwischen dem 20. und 40. Lebensjahr. Testikul€re intraepitheliale Keimzellneoplasien (TIN) gelten als Vorl€uferl€sion invasiver Keimzelltumoren. Diese bereits im 19. Jahrhundert von Wilms und D•rr beschriebenen Zellen wurden von Skakkebaek 1972 erstmals als echte Pr€kanzerose beschrieben. W€hrend Skakkebaek diese Precursorzellen als "Carcinoma in situ" klassifiziert, hat Bezeichnung sich "germ im cell angloamerikanischen neoplasia, Raum unclassified" die (GCNU) durchgesetzt. Dagegen hat sich in der deutschsprachigen Literatur der von Dieckmann und Loy - in Anlehnung an diverse Pr€kanzerosen des Urogenitaltraktes (PIN, VIN, VAIN, CIN) - der Terminus Testikul€re Intraepitheliale Neoplasie (TIN) etabliert. TINZellen als Vorl€ufer nahezu aller testikul€ren Keimzelltumoren - mit Ausnahme des spermatozytischen Seminoms - befinden sich innerhalb der Hodentubuli entlang der Basalmembran. Mit Penetration der Tubuli seminiferi und Infiltration des Stroma entwickeln sich invasive seminomat•se und/oder nichtseminomat•se Keimzelltumore (embryonale Karzinome, Teratome, Dottersacktumore und Chorionkarzinome). Die Herkunft der TIN-Zellen von pluripotenten primordialen Stammzellen/Gonozyten erkl€rt die Vorl€uferrolle verschiedener Keimzelltumoren. Das hohe Differenzierungspotential der TIN-Zellen wird unterschiedlich stigmatisiert. Neben epigenetischen Modifikationen 140 scheinen Hormone, wie der ˆstrogen‚berschuss in der Fr‚hschwangerschaft, aber auch auto- bzw. parakrine Faktoren in der Pathogenese der TIN eine Rolle zu spielen. Die zunehmende Inzidenz von TGCT in den letzten Jahrzehnten und auff€llige geographische zus€tzlich daraufhin, und dass ethnische aliment€re Unterschiede und deuten umweltbedingte Risikofaktoren implementiert sind. Die Erkenntnismerkmale Dieckmann und Loy der TIN wurden charakterisiert und vornehmlich von induzieren die systematische Suche nach dieser Pr€kanzerose in Hodenbiopsien als Fr‚herkennung von kontralateralen Tumoren bei Patienten mit Hodenkrebs, bei prim€r retoperitonealen Keimzelltumoren, bei organerhaltenden Hodentumorexzisionen und bei Formen der Mikrolithiasis des Hodens. Dieckmann und Loy konnten zeigen, dass TIN-Zellen diffus im Hoden nachweisbar sind und reiskorngroƒe Probebiopsien eine 99%ige Trefferquote aufweisen. Die TIN-II-Studie zeigte, dass erst die Entnahme von zwei Biopsien falsch-negative Ergebnisse sicher ausschlieƒt. Dieses Verfahren der simultanen 2-fach-Biopsieentnahme wurde in der urologischen Abteilung des Jung-Stilling-Krankenhauses seit dem Jahr 2000 konsequent durchgef‚hrt. Keimzelltumoren erfolgte Parallel das zur Ablatio Gewebssampling testis bei aus dem kontralateralen Hoden mit Entnahme von zwei Keilexzidaten durch einen kleinen skrotalen Schnitt. Das Gewebe wurde in Stieve•scher L•sung fixiert und immunhistochemisch aufgearbeitet, wobei als diagnostischer Beweis f‚r die TIN der Nachweis des zytoplastischen Enzyms plazentare alkalische Phosphatase (PLAP) galt. Dabei wurde von uns ein positiver TIN-Nachweis auf der Gegenseite in einer Rate von 5,3% bestimmt. Diese Inzidenz entspricht den 141 Ergebnissen der von Dieckmann durchgef‚hrten groƒen multizentrischen Studie (5,01%). Der geringe Nachweis von TINZellen neben dem Tumorgewebe (10,5%) ist nicht valide, da durch einen Systemfehler in den meisten F€llen beim abladierten Hoden mangels klinischer Konsequenz auf den immunhistochemischen Nachweis verzichtet wurde. Mit Nachweis einer TIN erfolgt die Bestrahlung des betroffenen Hodens mit 20 Gy. Diese Dosis f‚hrt zur Eradikation der TIN-Zellen, erh€lt jedoch die Leydig-Zellfunktion und vermeidet zumeist einen substitutionspflichtigen iatrogenen Testosteronmangel. Mit der vorliegenden Arbeit konnte belegt werden, dass bei 5,3% der Patienten mit einem Keimzelltumor im gesunden kontralateralen Hoden, eine testikul€re intraepitheliale Neoplasie (TIN) als Pr€kanzerose nachweisbar und rechtzeitig erfolgreich durch eine Strahlentherapie behandelt werden konnte. 142 6.Literaturverzeichnis Adami, H. O., Trichopoulos, D. (2002): Concepts in Cancer epidemiology and etiology. Textbook of Cancer Epidemiology. University Press, Oxford, 87-112 Akre, O., Ekbom, A., Hsieh, C.C., Trichopoulos, D., Adami, H.O. (1996) Testicular nonseminoma and seminoma in relation to perinatal charcteristics. JNCI 88, 883-889 Albers, P. (2002). Diagnostik und Therapie von Hodentumoren, Urologe A 41, 374–387 Albers, P., Weissbach, L. (2003) Jocham, D., Miller, K. (Hrsg) Praxis der Urologie, 2. Auflage Thieme, Stuttgart, 225-254 Albertini, A. v. (1943) Zur Histogenese der Seminome. Schweiz med Wschr 73, 1091-1092 Albertini, A. v. (1955) Histologische Geschwulstdiagnostik. Thieme, Stuttgart Albertini, A. v., Roulet, F. C. (1974) Histologische Geschwulstdiagnostik. 2. Aufl. Thieme, Stuttgart Algood, C.B., Newell, G.R., Johnson, D.E. (1988) Viral etiology of testicular tumors. J Urol 139, 308-310 143 AKH-Consilium (Redaktion: der Medizinischen Georgopoulos, A., Universit€t Scherzer, W.) Wien (2006) Zugriff vom 14.12.2005, URL.: http://akh-consilium.at/pdf/AKH-Consilium%20%20Hodentumoren.pdf Arbeitsgemeinschaft Bev•lkerungsbezogener Krebsregister in Deutschland (2002) Krebs in Deutschland, H€ufigkeiten und Trends. 3. erweiterte, aktualisierte Auflage, Saarbr‚cken, Statistisches Landesamt Saarland Arndt, M (2005) Synthese und Testung von antitumoraktiven Porphyrin-Platin(II)-Komplexen; Einsatz klassischer Abgangsgruppen mit neuartiger Zielsetzung. (Zugriff vom 10.12.2005) URL: http://ourworld.compuserve.com/Homepages/Markus_Arndt/ einleitu.htm Askanazy, M. (1907) Die Teratome nach ihrem Bau, ihrem Verlauf, ihrer Genese und im Vergleich zum experimentellen Teratoid. Verhandl. d. deutsch. path. Gesellsch. 11, 39-82 Azzopardi, J.G., Mostofi F.K., Theiss E.A. (1961) Lesions of testes observed in certain patients with widespread choriocarcinoma and related tumors. Amer J Path 38, 207-225 Banzer, A. (1943) Zur Histogenese der Seminome des Hodens. Schweiz Z allg Path 6, 1-19 144 Bar-Maor, J.A., Nissan, S., Lernau, O.Z., Oren, M., Levy, E. (1979) Orchidopexy in cryptorchidism assessed by clinical, histologic and sperm examinations. Surg Gynecol Obstet 118, 855-859 Batata, M.A., Chu, F.C., Hilaris, B.S., Whitmore, W.F., Golbey, R.B. (1982) Testicular cancer in cryptorchids. Cancer 49, 1023-1030 Bell, F.G. (1925) Tumours of the testicle: The spermatocytoma group. Brit J Surg 13, 282-301 Bettocchi, C., Coker, C.B., Deacon, J., Parkinson, C., Pryor, J.P. (1994) A review of testicular intubular germ cell neoplasia in infertile men. J Androl 15 Suppl: 14S-16S Beyer, J., Bokemeyer, C. (2004) Chemotherapie von Keimzelltumoren, Urologe A 43, 1507 - 1513 Billroth, Th. (1855a) Zur Entwicklungsgeschichte und chir. Bedeutung des Hodencystoid. Virch Arch VIII, 268 Billroth, Th. (1855b) Ein Hodencystoid mit quergestreiften Muskelfasern. Virch Arch VIII, 433 Birkeland, S.A., Storm, H.H., Lamm, L., Barlow, L., Blohme, I., Forsberg, B., Eklund, B., Fjeldborg, O., Friedberg, M., Frodin, L., Glattre, E., Halvorsen, S., Holm, N.V., Jakobsen, A., Jorgensen, H.E., Ladefoged, J., Lindholm, T., Lundgren, G., Pullala, E. (1995) Cancer risk after renal transplantation in the Nordic countries, 19641986. Int J Cancer 60, 183-189 145 Bohle, A., Studer, U.E., Sonntag, R.W., Scheidegger, J.R. (1986) Primara or secondary extragonadal germ cell tumors? J Urol 135, 939-943 Bokemeyer, C., Harstrick, A., Sch•ffski, P., Schmoll, H.J., Poliwoda, H. (1992) Keimzelltumoren des Hodens. Epidemiologische und €tiologische Aspekte. Dtsch Med Wochenschr 117, 1532-1537 Bokemeyer, C.,Beyer, J.,Heidenreich, A. (2005) Behandlung von Patienten mit metastasierten Hodentumoren, Dtsch Arztebl 102 47, A 3271–3275 Budde, M. (1926) Origin of fetal inclusions, complicated dermoids and teratomas and their interrelations. Monatsschr. f. Geburtsh. u. Gyn€k. 74, 276-283 Buetow, S.A. (1995) Epidemiology of testicular cancer. Epidemiol Rev 17, 433-449 Burke, A.P. and Mostofi, F.K. (1988) Intratubular malignant germ cells in testicular biopsies: clinical course and identification by staining for placental alkaline phosphatse. Mod Pthol 1, 475-479 Campbell, H.E. (1942) Incidence of malignant growth of the undescended testicle. Arch. Surg. 44, 353-369 146 Chinda, K., Dhom, G., Merkel, K.H.H., Jilg, R. (1983) Zur geographischen Pathologie der malignen Hodentumoren Pathologe 4, 44-50 Collins, D.H., Pugh, R.C.B. (1964) The Pathology of Testicular Tumours. E.&S. Livingstone Ltd., Edinburgh and London Cookson, M. S., Sarosdy, M. F. (1995) Treatment of intratubular germ-cell neoplasia and low-stage testicular cancer, Urology 5, 255259 Daugaard, G., Maase, H. von der, Olsen, J., Rǿrth, M., Skakkebaek, N.E. (1987) Carcinoma-in-situ testis in patients with assumed extragonadal germ-cell tumours. Lancet, 2, 528-529 Daugaard, G., Rǿrth, M., Maase, H. von der, Skakkebaek, N.E. (1992) Management of extragonadal germ-cell tumors and the Significance of bilateral testicular biopsies. Ann Oncol 3, 283-289 Davies, J.M. (1981) Testicular cancer in England and Wales: some epidemiological aspects. Lancet 1, 928-932 Davis, S., Di Martino N.A., Schneider, G. (1981) Malignant interstitial cell carcinoma of the testis. Cancer 47, 425-431 Dieckmann, K.-P., Skakkebaek, N.E. (1999) Carcinoma in situ of the testis: A review of biological and clinical features. Int J Cancer 83, 815-822 147 Dieckmann, K.-P. (2000) Die kontralaterale Hodenbiopsie beim Hodentumor Ein Pl€doyer daf‚r. Urologe A 39, 260-266 Dieckmann, K.-P., Loy, V. (2000) Diagnostik der kontralateralen testikul€ren intraepithelialen Neoplasie (TIN) bei germinalen Hodentumoren: Wertigkeit einer systematischen Doppelbiopsie. (TIN - 2 Studie) (Zugriff vom 10.12.2005) URL: http://www.auo-online.de/pdf/AH_07_00.pdf Dieckmann, K.-P., Endsin, G., Pichlmeier, U. (2001) How valid is the Prenatal Estrogen Excess Hypothesis of Testicular Germ Cell Cancer? A case control study on hormone-related factors. Eur Urol 40, 677-684 Dieckmann, K.-P., Pichlmeier, U. (2002) Is risk of testicular cancer related to body size? Eur Urol 42, 564-569 Dieckmann, K.-P. (2003). Epidemiologie der testikul€ren Keimzelltumoren, Onkologe 9, 943 - 954 Dieckmann, K.-P., Loy, V. (2004) False-negative biopsies for the diagnosis of testicular intraepithelial neoplasia (TIN) – an update. European Journal of Urology 43, 516–521 Dieckmann, K.-P., Claƒen, J., Loy, V. (2005) Pr€kanzerose der Hodentumoren: Testikul€re intraepitheliale Neoplasie. Dtsch Arztebl 102 45, A 3106–3109 148 Dixon, F.J., Moore, R.A. (1952) Tumors of the male sex organs. A.F.I.P. Atlas of tumor pathology VIII, 31b and 32. Washington, D.C.: Armed Forces Institute of Pathology. Donner, J. (2003) Immunhistochemische Untersuchungen ‚ber die Entwicklung vom testikul€ren Carcinoma in situ zum Seminom, VVB Laufersweiler Verlag, ISBN 3-89687-634-1 Dow, J.A., Mostofi, F.K. (1967) Testicular tumors following Orchiopexy South Med J 60, 193-195 D‚rr (1894) „ber das Cystoma testis. Inaug-Diss., Freiburg Eble, J.N., Sauter, G., Epstein, J.I., Sesterhenn, I.A. (2004) World Health Organization Classification of Tumours, Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs; IARCPress, Lyon: 217-278 EGCCCG (2004) Guidelines on Testicular Cancer, European consensus on diagnosis and treatment of germ cell cancer: a report of the European Germ Cell Cancer Consensus Group (EGCCCG) URL: http://hodenkrebs.de/arzt/Konsensus_Annals_2004.pdf Eichenauer, R., Vanherpe, H. (1996). Klinikleitfaden Urologie, 2. Auflage, Fischer-Verlag, 487 European Group on Tumor Markers (EGTM). (1999). Anticancer Research 19, 2785-2820 149 Forman, D., Gallagher, R., M•ller, H., Swerdlow, T. (1990) Aetiology and epidemiology of testicular cancer: Report of consensus group Progr Clin Biol Res 357, 245-253 Fram, R.J., Garnick, M.B., Retik, A. (1982) The spectrum of genitourinary abnormalities in patients with cryptorchidism, with emphasis on Testicular carcinoma. Cancer 50, 2243-2245 Friedmann, N.B., Moore, R.A. (1946) Tumors of the testis. Military Surgeon 99, 573-593 Fritz, A., Percy, C., Jack, A., Shanmugaratnam, K., Sobin, L., Parkin, D.M., Whelan, S. (2000) International Classification of Diseases for Oncology. 3rd Edition. WHO: Geneva. Gerl, A.; Barba, M.; Weiss, M.; Liedl, B.; Zimmermann, F.; Clemm, Ch. (2003) Manual Urogenitale Tumoren, Hodentumoren (Zugriff vom 10.12.05) URL: http://www.krebsinfo.de/ki/empfehlung/uro/820-4-Gerl.pdf German Testicular Cancer Study Group (2002) Leitlinie zur Diagnostik und Therapie von Hodentumoren auf Grundlage evidenzbasierter Medizin (EBM), Herausgegeben von R. Souchon, H.-J. Schmoll, S .Krege (Zugriff vom 27.06.2006) URL: http://www.krebsgesellschaft.de/download/leitlinie_zur _diagnostik _und_therapie_von_hodentumoren.pdf 150 Gilbert, J.B., Hamilton, J.B. (1940) Studies in malignant testi tumors: III – incidende and nature of tumors in ectopic testes. Surg Gynecol Obstet 71, 731-743 Giwercman, A., Berthelsen, J.G., M‚ller, J., von der Maase, H., Skakkebaek, N.E. (1987) Screening for carcinoma-in-situ of the testis. Int J Androl 10, 173-180 Giwercman, A., Grindsted, J., Hansen, B., Jensen, O.M., Skakkebaek, N.E. (1987) Testcular cancer risk in boys with maldescended Testis: a cohort study. J Urol 138, 1214-1216 Giwercman, A., Muller, J., Skakkebaek, N.E. (1988) Carcinoma in situ of the undescended testis. Semin Urol 6, 110-119 Giwercman, A., Bruun, E., Frimodt-Moller, C., Skakkebaek, N.E. (1989) Prevalence of Carcinom-in-situ and other histopathologic abnormalities in testes of men with a history of cryptorchidism. J Urol 142, 998-1002 Giwercman, A., Maase, H. von der, Skakkebaek, N.E. (1993) Epidemiological and clinical aspects of carcinoma in situ of the testis. Eur Urol 23, 104-110 Goedert J.J., Cote T.R., Virgo P., Scoppa S.M., Kingma D.W., Gail M.H., Jaffe E.S., Biggar R.J. (1998) Spectrum of AIDS-associated malignant disorders. Lancet 351, 1833-1839 151 Gondos, B., Migliozzi, J.A. (1987) Intratubular germ cell neoplasia. Semin Diagn Pathol 4, 38-41 de Gouveia Brazao, C.A. , Pierik,F.H., Oosterhuis, J.W., Dohle, G. R., Looijenga, L.H.J., Weber, R.F.A. (2004) Bilateral Testicular Microlithiasis Predicts the Presence of the Pecursor Of Germ Cell Tumors In Subfertile Men, Journal of Urology 171, 158-160 Graham, S., Gibson, R., West, D., Swanson, M., Burnett, W., Dayal, H. (1977) Epidemiology of cancer of the testis in upstate New York. JNCI 58, 1255-1261 Grove, S.J. (1954) The cryptorchid problem. J. Urol. (Baltimore) 71, 735-741 GTCSG (2002) Leitlinie zur Diagnostik und Therapie von Hodentumoren auf Grundlage evidenzbasierter Medizin (EBM) (2002), Herausgegeben von R.Souchon, H.-J.Schmoll, S.Krege f‚r die German Testicular Cancer Study Group, W. ZuckerschwerdtVerlag, M‚nchen, Bern, Wien, New York URL: http://www.hodenkrebs.de/arzt/leitlinie_hodentumor_2002.pdf Guinand, S., Hedinger, C.E. (1981) Cellules germinales atypiques intratubulaires et tumeurs germinales testiculaires de l’enfant. Ann. Pathol. 4, 251-257 152 Hailemariam, S., Engeler, D.S., Bannwart, F. (1998) Primary mediastinal germ cell tumor with intratubular germ cell neoplasia of the testis – further support for germ cell origin of these tumors: A case report. Cancer 79, 1031-1036 Halme, A., Kellokumpu-Lehtinen, P., Lhtonen, T., Teppo, I. (1989) Morphology of testcular germ cell tumours in treated and untreated cryptorchidism. Br J Urol 64, 78-83 Hamburger, C. (1958) Gonadotrophins, Androgens, and Oestrogens in Cases of Malignant Tumours of the Testis. Seite 200 in: Hormone Production in Endocrine Tumours, Vol. 12, Ciba Foundation Colloquia on Endocrinology. Hg. Wolstenholme GEW, and O’Connor M, Little, Brown and Company, Boston Hamperl, H. (1960), Lehrbuch der Allgemeinen Pathologie und der Pathologischen Anatomie, 628, Springer, Berlin G•ttingen Heidelberg Hamperl, H. (1974) Praecancerose und Carcinoma in situ. In: Grundmann, E. (Ed.): Handbuch der allgemeinen Pathologie, 6. Band, 5. Teil, 351-415, Geschw‚lste I, Springer, Berlin Heidelberg New York Hartmann, Menetrier, Peyron, Isch-Wall (1922) Coexistance de deux types n”oplasique distincts: Choriome et ”pith”lioma s”minif•re sur la m–me testicule. Bulletin de l’Association Fran—aise pour l’Etude du Cancer 11, 319-344 153 Hedinger, Chr. (1979) Fr‚he neoplastische Ver€nderungen des Hodens. Precancerous and early cancerous changes of the testicle. Verhandlungen der Deutschen Gesellschaft f‚r Pathologie 63, 231241 Hedinger, C.E. und Dhom, G. (1991) Pathologie des m€nnlichen Genitale, Hoden Prostata Samenblasen, in: Doerr, Seifert, Uehlinger: Spezielle pathologische Anatomie Band 21, Springer Berlin Heidelberg New York Heidenreich, A. (2004) Therapieoptionen des Seminoms im klinischen Stadium I–IIA/B, Urologe A 43, 435–1445 Heidenreich, A. (2005) Diagnostik und Therapie testikul€rer Keimzelltumoren, Blickpunkt der Mann 2005; 3 (3-4)5-12 (Zugriff am13.12.2005) URL: http://www.kup.at/kup/pdf/5547.pdf Henderson, B.E., Benton, B., Jing, J., Yu, M.C., Pike, M.C. (1979) Risk factors for cancer of the testis in young men. Int J Cancer 23, 598-602 Hofmann, M.C., Jeltsch, W., Brecher, J., Walt, H. (1989) Alkaline phopsphatase isozymes in human testicular gem cell tumors, their precancerous stage, and three related cell lines. Cancer Res 49, 4696-4700 Holstein, A.F., K•rner, F. (1974) Light and electron microscopical analysis of cell types in human seminoma. Virchows Arch. A Path. Anat. and Histol. 363, 97-112 154 Holstein, A.F., Sch‚tte, B., Becker, H., Hartmann, M. (1987) Morphology of normal and malignant germ cells. Int J Androl 10, 1-17 Jacobsen, G.K., Henriksen, O.B., Maase, H. von der (1981) Carcinoma in situ of testicular tissueadjacent to malignant germ-cell tumors. Cancer 47, 2660-2662 Jacobsen, G.K., Barlebo, H., Olsen, J., et al. (1984) Testicular germ cell tumours in Denmark 1976-1980: pathology of 1058 consecutive cases. Acta Roadiol Oncol 23, 239-247 Jacobsen, R., Bostofte, E., Engholm, G., Hansen, J., Olsen, J.H., Skakkebaek, N.E., Moller, H. (2000) Risk of testicular cancer in men with abnormal semen characteristics: cohort study. BMJ 321, 789-792 Jocham, D., Miller, K. (2002) Praxis der Urologie, 2. ‚berarbeitete Auflage, Thieme Verlag Johnson, D.E., Woodhead, D.M., Pohl, D.R., Robison, D.R. (1968) Cryptorchidism and testicular tumorigenesis. Surgery 63, 919-922 Kleinschmidt, K., Kemper, J., Holstein, A.F. (1989a) Carcinoma in situ of the testis in the presence of contralateral germ cell tumor. Eur Urol 16, 74-77 155 Kleinschmidt, K., Weissbach, L., Holstein, A.F. (1989b) Fr‚herkennung des kontralateralen Zweitkarzinoms bei Hodentumorpatienten durch das Carcinoma in situ testis. Urologe A 28, 281-284 Kliesch, S., (2004) Diagnostik und Prim€rtherapie des Hodentumors, Urologe A 43, 1494 – 1499 Klinikleitfaden Urologie Online, (Zugriff vom 28.10.05) http://info.multimedica.de/public/html/gufischer/KLF/URFBI000F/ 0012/0005/URFBI012FXXFF00501.html Kocher (1887) Die Krankheiten der m€nnlichen Geschlechtsorgane. (Histologischer Theil von LANGHANS), Deutsche Chirurgie 50b Krebs in Deutschland (2006) 5. ‚berarbeitete, aktualisierte Ausgabe. Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. und das RKI. Saarbr‚cken Krege, S. (2005) Studienlandschaft Hodentumor, Urologe A 44, 1439-1443 Krege, S., Albers, P., Schmidberger, H. (2005) Behandlung von nicht und m€ƒig metastasierten Hodentumoren, Dtsch Arztebl 46 102, A 3191–3194 Kuzyk, M. (2005) Aktuelle Aspekte zur Therapie testikul€rer Keimzelltumoren Prognose gut, Nebenwirkungen Verbesserungsw‚rdig, Uro News 4 2005, 38-42 156 Lamerz, R. et al. (1999) Tumour Markers in Germ Cell Cancer: EGTM Recommendations. Anticancer Res. 19, 2795-2798, (Zugriff vom 26.11.05) http://www.dpc-biermann.de/aktuelles/literatur/onkologie/ 0800_02.htm Leibovitch, I., Baniel, J., Rowland, R.G., Smith, E.R. Jr, Ludlow, J.K., Donohue, J.P. (1996) Malignant testicular neoplasms in immunsuppressed patients. J Urol 155, 1938-42 Maase, H. von der, Rǿrth, M., Walbom-Jǿrgensen, S., Sǿrensen, B.L., Christophersen, I.S., Hald, T., Jakobsen, G.K., Berthelsen, J.G., Skakkebaek, N.E. (1986) Carcinoma in situ of contralateral testis in patients with testicular germ cell cancer: study of 27 cases in 500 patients. Br Med J 293, 1398-1401 Maase, H. von der, Giwercman, A., M‚ller, J., Skakkebaek, N.E. (1987) Management of carcinoma-in-situ of the testis. Int J Androl 10, 209-220 Manivel, J.C., Simonton, S., Wold, L.E., Dehner, L.P. (1988) Absence of intratubular germ cell neoplasia in testicular yolk sac tumors in children. Arch Pathol Lab Med 112, 641-645 Mark, G.J., Hedinger, Chr. (1965) Changes in Remaining Tumorfree Testicular Tissue in Cases of Seminoma and Teratoma. Virch Arch path Anat 340, 84-92 157 McDowell, M.E., Balarajan, R., (1986) Testicular cancer mortality in England and Wales 1971-80: variations by occupation. J Epidemiol Comm Health 40, 26-29 Merzenich, H., Ahrens, W., Stang, A., Baumgardt-Elms, C., Jahn, I., Stegmaier, C. (2000) Sorting the hype from the facts in testicular cancer: Is testicular cancer related to trauma? J Urol 164, 21432144 Moller, H. (1993) Clues to the aetiology of testicular germ cell tumours from descriptive epidemiology. Eur Urol 23, 8-13 Moller, H., Skakkebaek, N.E. (1999) Risk of testicular cancer in subfertile men: case-control study. BMJ 318, 559-562 Montironi, R. (2002) Intratubular Germ Cell Neoplasia of the Testis: Testicular Intraepithelial Neoplasia, European Urology 41, 651-654 Mostofi, F.K., Price jr., E.B. (1973) Atlas of Tumor Pathology, Second Series, Tumors of the Male Genital System, 9, Published by: Armed Forces Institute of Pathology, Washington, D.C. Mostofi, F.K., Sobin, L.H. (1977) Histological typing of testis tumours. World Health Organization, Geneva Muir, C., Waterhouse, J., Mack, T., Powell, J., Whelan, S. (1987) Cancer incidence in five continents. Vol 5, Lyon, France: International Agency for Research on Cancer 158 M‚ller, J., Skakkebaek, N.E., Parkinson, M.C. (1987) The spermatocytic seminoma: views on pathogenesis. Int J Androl 10, 147-156 Nielsen, H., Nielsen, M., Skakkebaek, N.E. (1974) The fine structure of a possible carcinoma-insitu in the seminiferous tubules in the testis of four infertile men. Acta path. microbiol.scand. A 82, 235-248 N‚esch-Bachmann, I.H., Hedinger, Chr. (1977) Atypische Spermatogonien als Pr€kanzerose. Schweiz. Med. Wschr. 107, 795-801 ˆGUM-Leitlinien zur Standarddokumentation des Oberbauchs, der Nieren und des Retroperitoneums. (Zugriff vom 29.10.05) URL: http://www.thieme.de/fz/ultraschall/01_01/oegum_02.html † PathoPic, Pathologie – Bilddatenbank (Zugriff vom 18.11.2005), URL: http://alf3.urz.unibas.ch/pathopic Pearce, N., Sheppard, R.A., Howard, J.K., Fraser, J., Lilley, B.M. (1987) Time trends and occupational differences in cancer of the testis in New Zealand. Cancer 56, 83-85 Peyron, A (1936) Sur la coexistance de l’embryome et du s•minome sur la m–me testicule. Bull Cancer 25, 422-426 159 Pottek, T. (2002) „ber den Wert der Halbwertszeitkinetik des AlfaFetoproteins und des Humanen Chorion-Gonadotropins bei Hodentumoren als Risikofaktor im klinischen Stadium I der UICCKlassifikation Hamburg, bei (Zugriff Patienten vom des Bundeswehrkrankenhauses 03.12.2005) http://deposit.ddb.de/cgi- bin/dokserv?idn=975507869&dok_var=d1&dok_ext=pdf&filename=9 75507869.pdf Pottek, T., Hartmann, M., Bokemeyer, C. (2005) Nachsorge und Sp€ttoxizit€ten bei Hodentumoren, Dtsch Arztebl 102 48, A 3342– 3348 Pottern, L.M., Brown, L.M., Hoover, R.N. et al. (1985) Testicular cancer risk among young men: role of cryptorchidism and inguinal hernia. JNCI 74, 377-381 Prener, A., Engholm, G., Jensen, O.M. (1996) Genital anomalies and risk for testicular cancer for danish men. Epidemiology 7, 14-19 Pryor, J.P., Cameron, K.M., Chilton, C.P., Ford, T.F., Parkinson, M.C., Sinokrot, J., Westwood, C.A. (1983) Carcinoma in situ in testicular biopsies from men presenting with infertility. Br J Urol 55, 780-784 Pugh, R.C.B. (1976) Pathology of the testis. Blackwell Scientific, Oxford London Edinburgh Melbourne Rassweiler und Merkle. (1997) Ultraschall in der Urologie, Thieme Verlag , 89 160 Richiardi, L., Akre, O., Bellocco, R., Ekbom, A. (2002) Perinatal determinants of germ-cell testicular cancer in relation to histological subtypes. Br J Cancer 87, 545-550 Riede,U.-N., Schaefer, H.-E. (1993) Allgemeine und spezielle Pathologie, 3. Auflage, Thieme Verlag, 908 Rutgers, J.L. (1991) Advances in the pathology of intersex syndromes. Hum Pathol 22, 884-891 Rutgers, J.L., Scully, R.E. (1987) Pathology of the testis in intersex syndromes. Semin Diagnost Pathol 4, 275-291 Rutgers, J.L., Scully, R.E. (1991) The androgen insensitivity syndrome (testicular feminization): a clinicopathologic study of 43 cases. Int J Gynecol Pathol 10, 126-145 Sabroe, S., Olsen, J. (1998) Perinatal coorelates of specific histological types of testicular cancer in patients below 35 years of age: a case cohort-study based on midwives‘ records in Denmark. Int J Cancer 78, 140-143 Sakashita, S., Koyanagi, T., Tsuji, I., Arikado, K., Matsuno, T. (1980) Congenital anomalies in children with testicular germ cell tumor. J Urol 124, 889-891 Schaper, D., Hofmann, V. (2003) (Zugriff vom 30.10.05) URL: www.Kinderradiologie-online.de/?search=20030222173416 161 Schefer, H., Sch•pfer, A., Arnold, W., Mattmanna, S., Thum, P., Stuckie, P-M. (2003) Hodentumore, Schweiz Med Forum 40 1, 950 Scherer, E. (1992) Chronik der Strahlentherapie 1900–1960, Bd 1, 1900–1925. Strahlenther Onkol,Sonderband 83, 153-158 Scherer, E. (1994) Chronik der Strahlentherapie 1900–1960, Bd 3, 1937–1960. Strahlenther Onkol, Sonderband 85, 7, 296 Schnaidt, U., M‚ller, U., Stegmaier, C. (1992) Epidemiologie germinaler Hodentumoren im Saarland Pathologe 13, 73-77 Schnyder, U.W. (1951) Beitr€ge zur Lehre der chorialen Carcinome des Hodens. Schweiz Z allg Path 14, 298-322 Schnyder, U.W. (1952) Zur Frage der Seminome und Pseudoseminome des Hodens. Schweiz Z allg Path 15, 331-353 Schottenfeld, D., Warshauer, M.E., Sherlock, Z., Zauber, A.G., Leder, M., Payne, R. (1980) The epidemiology of testicular cancer in young adults. Am J Epidemiol 112, 232-246 Schrader, M., Weiƒbach, L., Miller, K. (2004) Therapie von Hodentumoren: Illusion oder Realit€t – €ndern Leitlinien die Versorgungsergebnisse? Deutsches •rzteblatt 101, 39 Seite A-2612 Schulze, C., Holstein, A.F. (1977) On the histology of human seminoma. Development of the solid tumor from intratubular seminoma cells. Cancer 39, 1090-1100 162 Schulze, C, Holstein, AF, Selberg, W und K•rner, F (1978) Beitrag zur formalen Pathogenese des klassischen Seminoms. Fr‚hdiagnose aus Hodenbiopsien? Schweiz. Med. Wschr. 108, 1119-1126 Schumpelick, V., Bleese, M., Mommsen, U. (2004) Chirurgie 6. Auflage, 177, Thieme Verlag Schweyer, St., Fayyazi, A. (2005) Pathogenese maligner Keimzelltumoren des Hodens, Deutsches •rzteblatt 36, 2024-2027 Scorer, C.G. und Farrington, G.H. (1971) Congenital deformities of the testis and epididymis. Butterworths London Sharpe, R.M., Skakkebaek, N.E. (1993) Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract? Lancet 341, 1392-1395 Sigg, C., Hedinger, C.E. (1980) Keimzelltumoren des Hodens und atypische Keimzellen. Schweiz. Med. Wochenschr. 110, 801-806 Sigg, C., Hedinger, C.E. (1983) Zur Bedeutung der sogenannten atypischen Keimzellen des Hodens. Zentralbl. Haut 148, 1027-1033 Skakkebaek, N.E. (1972) Abnormal morphology of germ cells in two infertile men. Acta path. microbiol.scand. A 80, 374-378 Skakkebaek, N.E. (1972) Possible carcinoma-in-situ of the testis. Lancet II, 516-517 163 Skakkebaek, N.E. (1975) Atypical germ cells in the adjacent ‰normalŠ tissue of testicular tumours. Acta path. microbiol.scand. A 83, 127-130 Skakkebaek, N.E., Berthelsen, J.G. (1978) Carcinoma-in-situ of the testis and orchiectomy. Letter to the editor. Lancet II, 204 Skakkebaek, N.E., Berthelsen, J.G., Muller, J. (1982) Carcinoma in situ and the undescended testis. Urol Clin North Am 9, 377-385 Skakkebaek, N.E., Berthelsen, J.G., Visfeldt, J. (1981) Clinical aspects of testicular carcinoma-in-situ. Int J Androl 4 (Suppl), 153-162 Souchon, R., Schmidberger, H. (1998) Diagnostische Maƒnahmen zur Definition des klinischen Stadiums. Onkologe 4, 494–500 Statistisches Bundesamt Deutschland (2003) (Zugriff vom 29.10.05) URL: http://www.destatis.de/basis/d/gesu/gesutab8.php Souchon, R., Claƒen, J., Schmidberger, H. (2004) EbM-basierte Indikationen zur Radiotherapie von testikul€ren Keimzell- malignomen, Urologe 43, 1500-1506 Stattaus, J., Bockisch, A., Forsting, M., M‚ller, S. P. (2005). Wertigkeit der Bildgebung f‚r die Lymphknotenmetastasierung beim Nierenzell-, Blasen-, Prostata- und Peniskarzinom so wie dem Hodentumor, Urologe 44, 614–624 164 Swerdlow, A.J., Stiller, C.A., Wilson, L.M. (1982) Prenatal factors in aetiology of testcular cancer: an epidemiological study of childhood testicular cancer deaths in Great Britain, 1953 – 1973. J Epidemiol Comm Health 36, 96-101 Swerdlow, A.J., Huttly, S.R., Smith, P.G. (1989) Testis cancer: postnatal hormonal factors, sexual behaviour and fertility. Int J Cancer 43, 549-553 Swerdlow, A.J. (1998) New research in testicular cancer epidemiology. In: Jones, W.G., Appleyard, I., Harnden, P., Joffe, J.K. (Hrsg) Germ Cell Tumours IV: The Proceedings of the Fourth Germ Cell Tumour Conference. Leeds, November 1997. John Libbey und Company, London, 3-8 Tamimi, R., Adami, H. O.(2002): Testicular Cancer. In: Textbook of Cancer Epidemiology. University Press, Oxford, 429-445 Ulbright, Th.M., Amun, M.B., Young, R.H.: Atlas of Tumor Pathology, Tumors of the Testis, Adnexa, Spermatic Cord and Scrotum, Universities associated for Research and Education in Pathology; Inc. Bethesda, Maryland (1999) Tumorregister M‚nchen (TRM) (1998) Vom Datengrab zum InfoManagement . (Zugriff vom 10.12.2005) URL: http://trm.web.med.uni-muenchen.de/datzuinf.html 165 United Kingdom Testicular Cancer Study Group. Aetiology of testicular cancer (1994): association wih congenital abnormalities, age at puberty, infertility, and exercise. Br Med J 308, 1393-1399 Virchow, R. (1855) Fibrocystoid des Hoden mit Cholesteatomperlen und Enchondrom. Virch Arch VIII, 399 Volpe, R., Knowlton, T.G., Foster, A.D., Conen, P.E. (1968) Testicular Feminization: A study of two cases, one with a seminoma. Can. Med. Assoc. J. 98, 438-445 Waldeyer, H.W.G. (1868) Myxo-chondro-sarcoma kystomatosum Virch Arch 44, 83 Wanderas, E.H., Grotmol, F., Fossa, S.D., Tretli, S. (1998) Maternal health and pre- and perinatal characteristics in the etiology of testicular cancer: a prospective population- and register-based study on Norwegian males born between 1967 and 1995. Cancer Causes Control 9, 475-486 Weber, D., Krohmer, S. (Zugriff vom 29.10.05) Kinderradiologieonline.de, URL: www.radio.logie.info/radiologie/20040507132131.shtml#a1 Weiƒbach, Lothar (2004) Testikul€re Mikrolithiasis und Hodenkarzinome - Bilaterale Kalzifikationen gehen mit erh•htem CISRisiko einher (Kommentar), Akt Urol 35, 367-369 Whitaker, R.H. (1970) Management of the undescended testis. Brit. J. Hosp. Med. 4, 25-37 166 Willis, R.A. (1967) The unusual in tumour pathology. Can med. Assoc. J. 97, 1466-1479 Wilms, M. (1896) Die teratoiden Geschw‚lste des Hoden, mit Einschluss der sog. Cystoide und Enchondrome. Beitr€ge zur pathologischen Anatomie und zur allgemeinen Pathologie 19, 233-366 Winter, E., Kliesch, S., Souchon, R., de Witt, M. (2005) Diagnostik des Hodentumors, Dtsch Arzteb 102 44, A 3021–3025 Wittekind, C., Wagner, G. (1997) UICC. TNM-Klassifikation maligner Tumoren. (Hrsg Wittekind,C., Wagner, G.), 5. Aufl. Berlin– Heidelberg–New York: Springer, 1997. Wittekind, C., Neid, M. (2003) Hodentumoren, Onkologe 9, 937-942 Wurster, K. (1976) Klassifizierung testikul€rer Keimzellgeschw‚lste. Neue Gesichtspunkte auf Grund morphogenetischer Studien. Heft 31, Normale und pathologische Anatomie, Monographien in zwangloser Folge, herausgegeben von Bargmann, W und Doerr, W, G. Thieme, Stuttgart 167 7.Danksagung Zuerst m•chte ich mich bei meinem Chef Herrn Prof. Dr. med. Peter-J•rg Funke f‚r die „berlassung des interessanten Themas sowie die Betreuung und Motivation w€hrend der Bearbeitung bedanken. Den Mitarbeitern unserer Klinik danke ich f‚r die Erfassung der Patientendaten bei der Anamnese. Mein gr•ƒter Dank gilt meiner Familie, insbesondere meiner Frau, die w€hrend der Verfassung dieser Arbeit nicht nur immer f‚r unsere Kinder gesorgt, sondern auch noch mich unterst‚tzt, positiv verst€rkt und mit allen Stimmungsschwankungen ertragen hat. Meinen Eltern danke ich f‚r die Unterst‚tzung und F•rderung, begonnen in der Schul- und Universit€tszeit bis zum heutigen Tage. 8.Lebenslauf Pers‚nliche Daten Name: Strunk Vorname: Roland Familienstand: verheiratet, 2 Kinder Geburtsdatum: 15.08.1968 Geburtsort: Kirchen / Sieg Beruflicher Werdegang Abitur: Gymnasium am Rosterberg Siegen, 1989 Zivildienst: Pflegediensthelfer St.-Vinzenz-Hospital K•ln 6/1989-10/1990 Studium: Justus-Liebig-Universit€t Gieƒen WS 90/91-WS 97/98 Praktisches Jahr: Innere Medizin und Chirurgie, Ev. Krankenhaus Gieƒen 1997-98 Urologie, Krankenhaus Wetzlar, 1998 Abschluss: 3. Staatsexamen 4/1998, Weiterbildungszeit: Chirurgie, Arzt im Praktikum Ev. Krankenhaus Gieƒen, 5/1998-11/1999 Urologie, Assistenzarzt Krankenhaus Maria-Hilf Krefeld, 12/1999-3/2000 Urologie, Assistenzarzt Jung-Stilling-Krankenhaus Siegen 4/2000-1/2006 Facharzt f‚r Urologie 5/2004 Chirurgie, Assistenzarzt Marienkrankenhaus Siegen seit 2/2006