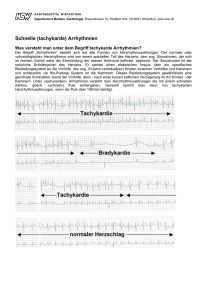
Ventrikuläre Tachyarrhythmien und der plötzliche Herztod bei
Werbung

Aus der Medizinischen Universitätsklinik, Abteilung Innere Medizin III, Kardiologie und Angiologie, Ärztlicher Direktor Prof. Dr. med. Ch. Bode der Albert-Ludwigs-Universität Freiburg i.Br. Ventrikuläre Tachyarrhythmien und der plötzliche Herztod bei Patienten nach Herzschrittmacherimplantation INAUGURAL - DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i.Br. Vorgelegt 2004 von Robert Gradinger geboren in Würzburg Dekan Prof. Dr. med. J. Zentner 1. Gutachter PD Dr. med. T. Faber 2. Gutachter PD Dr. med. J. Martin Jahr der Promotion 2004 Danksagung An erster Stelle möchte ich mich bei Hr. Prof. Dr. med. Manfred Zehender und Hr. PD Dr. med. Thomas Faber für die Überlassung des interessanten Themas und die kontinuierliche Betreuung während meiner Doktorarbeit bedanken. Darüber hinaus möchte ich besonders Fr. Dr. med. Christine Hummel erwähnen, die mir vor allem zu Beginn der Arbeit mit grossem Zeitwand und Engagement zur Seite gestanden hat. Hr. Dr. med. Sven Treusch und Hr. Dr. rer. nat. Karsten Morkel von Guidant möchte ich für die Unterstützung bei der Auswertung der EVENTS-Studie danken. Fr. Gunzenhauser und Fr. Bendrich aus der Schrittmacherambulanz haben mir durch ihre Hilfsbereitschaft das Erstellen dieser Arbeit vielfach entscheidend erleichtert. Zuletzt möchte ich mich noch bei meinen Eltern bedanken, die mir den Weg in die Medizin gewiesen haben und mich während des Studiums stets unterstützt und bestärkt haben. 1 EINLEITUNG ............................................................................................ 1 1.1 Die Herzschrittmachertherapie ................................................................. 2 1.1.1 Entwicklung der Herzschrittmachertherapie ............................................. 2 1.1.2 Einfluss der Herzschrittmachertherapie auf Prognose und Lebensqualität3 1.1.3 Fehlfunktionen während der Herzschrittmachertherapie .......................... 4 1.2 Der plötzliche Herztod .............................................................................. 6 1.2.1 Definition des plötzlichen Herztodes......................................................... 6 1.2.2 Epidemiologie des plötzlichen Herztodes ................................................. 6 1.2.3 Risikofaktoren des plötzlichen Herztodes ................................................. 7 1.3 Zielsetzung ............................................................................................... 8 2 MATERIAL UND METHODEN ............................................................... 11 2.1 Das Patientenkollektiv der Untersuchung ............................................... 11 2.1.1 Indikationen zur Herzschrittmachertherapie ........................................... 11 2.1.2 Funktionsweise des Schrittmachersystems ............................................ 12 2.2 Semi-qualitative Erfassung der Häufigkeit des plötzlichen Herztodes in den Jahren 2000 und 2001 bei Patienten mit permanenter Herzschrittmachertherapie...................................................................... 13 2.3 Dokumentation und Analyse der Mechanismen lebensbedrohlicher ventrikulärer Tachyarrhythmien während Stimulation mit einem Herzschrittmacher................................................................................... 14 2.4 Prospektive Langzeitstudie zur Erfassung ventrikulärer Tachykardien bei Schrittmacherpatienten (EVENTS) ......................................................... 14 2.4.1 Studiendesign ......................................................................................... 14 2.4.2 Studienzentren ....................................................................................... 15 2.4.3 Patientenkollektiv.................................................................................... 16 2.4.4 Durchführung .......................................................................................... 17 2.4.5 Schrittmachermodelle und Funktionen ................................................... 18 2.4.5.1 Arrhyhmie-Logbuch und EGM-Speicherung ........................................... 18 2.4.5.2 Histogramme .......................................................................................... 20 2.4.5.3 Zähler ..................................................................................................... 20 2.4.6 Elektrogrammauswertung....................................................................... 20 3 ERGEBNISSE ........................................................................................ 24 3.1 Semiqualitative Erfassung des plötzlichen Herztodes in den Jahren 2000 und 2001 bei Patienten mit permanenter Herzschrittmachertherapie ..... 24 3.2 Lebensbedrohliche ventrikuläre Arrhythmien während permanenter Herzschrittmachertherapie...................................................................... 26 3.2.1 Mechanismen der Arrhythmieentstehung und –aggravation bei ventrikulär stimulierendem System: Kurz-lang-kurz-Sequenzen („short-long-short“, SLS) und Lang-kurz-lang-Sequenzen (long-short-long“, LSL) als Auslöser einer ventrikulären Tachykardie.............................................................. 26 3.2.2 Mechanismen der Arrhythmieentstehung und –aggravation bei atrial stimulierendem System .......................................................................... 29 3.2.3 Mechanismen der Arrhythmieentstehung und –aggravation bei atrioventrikulär stimulierendem System ......................................................... 30 3.2.3.1 Mangelnde Wahrnehmung ventrikulärer Ektopien durch den Herzschrittmacher als Auslöser einer ventrikulären Tachykardie ........... 31 3.2.3.2 Kurz-lang-kurz- und Lang-kurz-lang-Sequenzen als Auslöser einer ventrikulären Tachykardie....................................................................... 32 3.2.3.3 Physiologisches Undersensing (Blanking) als Ursache für die Auslösung einer ventrikulären Tachykardie.............................................................. 36 3.2.3.4 Stimulationsunabhängige Arrhythmieentstehung ................................... 38 3.2.3.5 Stimulationsassoziierte Arrhythmieentstehung ....................................... 38 3.3 Studie zur Erfassung ventrikulärer Tachykardien bei Schrittmacherpatienten (EVENTS) ............................................................................... 44 3.3.1 Patientenkollektiv.................................................................................... 44 3.3.1.1 Alters- und Geschlechtsverteilung .......................................................... 44 3.3.1.2 Ejektionsfraktion ..................................................................................... 44 3.3.1.3 Implantationsindikationen ....................................................................... 44 3.3.1.4 Grunderkrankungen................................................................................ 45 3.3.1.5 Medikation .............................................................................................. 49 3.3.2 Analyse der in den Herzschrittmacheraggregaten gespeicherten Informationen.......................................................................................... 50 3.3.2.1 Auswertung der Elektrogramme ............................................................. 50 3.3.2.2 Histogramme und Zähler ........................................................................ 54 3.3.3 Patienten mit erwiesenen ventrikulären Tachykardien............................ 55 3.3.3.1 Alters- und Geschlechtsverteilung .......................................................... 55 3.3.3.2 Ejektionsfraktion ..................................................................................... 55 3.3.3.3 Implantationsindikationen ....................................................................... 55 3.3.3.4 Grunderkrankungen................................................................................ 56 3.3.3.5 Medikation .............................................................................................. 58 3.3.3.6 Verteilung der 135 dokumentierten ventrikulären Tachykardien ............. 59 4 DISKUSSION ......................................................................................... 60 4.1 Häufigkeit des plötzlichen Herztodes unter Herzschrittmachertherapie.. 61 4.2 Studie zur Erfassung ventrikulärer Tachykardien bei Herzschritt- macherpatienten (EVENTS) ................................................................... 63 4.2.1 Häufigkeit ventrikulärer Tachykardien im Patientenkollektiv der EVENTSStudie ..................................................................................................... 63 4.2.2 Charakterisierung und Interpretation der dokumentierten Herz- rhythmusstörungen ................................................................................. 64 4.2.2.1 Analyse der dokumentierten ventrikulären Tachykardien ....................... 64 4.2.2.2 Einschränkungen der diagnostischen Fähigkeiten der Herzschritt- machermodelle ....................................................................................... 65 4.2.3 Herzschrittmacherpatientenkollektiv mit erwiesenen ventrikulären Tachykardien .......................................................................................... 67 4.3 Interaktionen zwischen Herzschrittmacher und ventrikulären Ektopien .. 70 4.3.1 Komplikationen durch die Interaktion des Herzschrittmachers mit spontaner Myokarderregung................................................................... 71 4.3.1.1 Wechselnde Ankopplungsintervalle der Kammerkomplexe als Ursache für die Arrhythmieentstehung....................................................................... 72 4.3.1.2 Physiologisches Undersensing als Ursache für die Auslösung einer ventrikulären Tachykardie....................................................................... 75 4.3.1.3 Schrittmacherassozierte und stimulationsunabhängige Arrhythmie- entstehung .............................................................................................. 76 4.4 Konsequenzen aus den vorliegenden Ergebnissen................................ 77 5 ZUSAMMENFASSUNG ......................................................................... 79 6 ABKÜRZUNGSVERZEICHNIS .............................................................. 80 7 LITERATUR ........................................................................................... 81 1 Einleitung 1 Einleitung Als Herzrhythmusstörungen werden Unregelmäßigkeiten in der regulären Schlagfolge des Herzens bezeichnet. Oftmals sind sie die Folge einer organischen Herzerkrankung wie z. B. koronare Herzkrankheit, Kardiomyopathie oder Myokarditis. Es werden bradykarde und tachykarde Herzrhythmusstörungen unterschieden. Die gefährlichste Folge von Herzrhythmusstörungen für den Patienten ist der plötzliche Herztod. Über 75% aller Kreislaufstillstände werden durch Rhythmusstörungen des Herzens verursacht, wobei ventrikuläre Tachykardien und Kammerflimmern die häufigsten Ursachen sind. Bradykarde Herzrhythmusstörungen und Asystolie sowie mechanische Ursachen (z. B. Herzbeuteltamponade, fulminante Lungenembolie, Papillarmuskelabriss bei Myokardinfarkt) können ebenso einen Sekundenherztod verursachen. Durch einen akuten Herztod besonders stark bedroht sind Patienten mit koronarer Herzerkrankung und komplexen ventrikulären Extrasystolen. Auch andere kardiale Grunderkrankungen mit linksventrikulärer Funktionsstörung (Kardiomyopathie, Herzinsuffizienz, Herzklappenfehler) erhöhen das Risiko für einen plötzlichen Herztod. Kammerflimmern entsteht entweder direkt oder über eine Degeneration ventrikulärer Tachykardien. Als auslösende Mechanismen finden sich früh (R-auf-TPhänomen) und spät einfallende Extrasystolen, Kurz-lang-kurz-Sequenzen sowie Torsade de pointes Tachykardien. Der Begriff Torsade de pointes Tachykardien bezeichnet eine Sonderform ventrikulärer Tachykardien, die eng mit einer Verlängerung der QT-Zeit im EKG verknüpft ist. Als Ursachen kommen genetische Veranlagung (Romano-Ward-Syndrom, Jerwell-Lange-Nielsen-Syndrom), Elektrolytstörungen (Hypokaliämie, Hypomagnesämie) und Pharmaka (Chinidin, Sotalol, Amiodaron, Phenotiazine, trizyklische Antidepressiva) in Frage. Eine eher seltenere Ursache für einen plötzlichen Herztod ist die Therapie bradykarder Herzrhythmusstörungen mit einem künstlichen Herzschrittmacher. Untersuchungen zeigen, dass ca. 20% aller Herzschrittmacherpatienten plötzlich und unerwartet versterben. Die allgemein angegebene Häufigkeit liegt den Daten der neunziger Jahre zufolge zwischen 13% und 24% [Mattioli AV et al., 1995; Shen WK et al., 1994; Tung RT et al., 1994; Zehender M et al., 1992]. 2 Einleitung 1.1 Die Herzschrittmachertherapie 1.1.1 Entwicklung der Herzschrittmachertherapie Die Herzschrittmachertherapie ist bei der Behandlung von bradykarden Herzrhythmusstörungen auf der Basis schwerer Erkrankungen des Erregungsleitungsund -bildungssystems ein seit vielen Jahren bewährtes Therapieprinzip [Bernstein AD et al., 1996; Bloomfield P et al., 1990; Ector H et al., 2000; Lamas GA et al., 1995; Shen WK et al., 1994; Tung RT et al., 1994]. Bereits in der ersten Hälfte des zwanzigsten Jahrhunderts gelang dem Arzt von Marmorstein (1927) die erste erfolgreiche transvenöse Elektrostimulation des rechten Vorhofs [Schechter DC, 1972]. Dies fand lange Zeit wenig Beachtung und wurde erst in den 50er Jahren von Furman wieder aufgegriffen. Er stimulierte 1958 erstmals während einer Operation einen Patienten transvenös mit einem externen Herzschrittmacher über fünf Stunden. Ein weiterer Patient konnte mit transvenöser externer Stimulation über dreizehn Wochen stimuliert werden [Furman S et al., 1958; Furman S et al., 1959]. Ebenfalls 1958 wurde von den Schweden Elmquist und Senning der erste Herzschrittmacher implantiert [Elmquist H et al., 1960]. Allerdings musste dessen Batterie noch von außen aufgeladen werden. Der erste implantierbare Herzschrittmacher, der nicht mehr von außen aufgeladen werden musste, wurde 1960 von Chardack eingesetzt [Chardack WM et al., 1960]. Mit der Einführung des Bedarfsherzschrittmachers 1963 war die Grundlage für die moderne Herzschrittmachertherapie geschaffen [Castellanos A et al., 1964; Sykosch J et al., 1963]. Jährlich werden heute in Deutschland ca. 70.000 Erstimplantationen durchgeführt. 2001 wurden 3% Vorhof-Schrittmacher, 37% Kammer-Aggregate und 60% atrio-ventrikuläre Systeme implantiert. 27% der Herzschrittmacher wurden wegen einer Sinusknotenerkrankung, 12% wegen eines AV-Blockes II. Grades, 23% wegen eines AV-Blockes III. Grades, 2% aufgrund eines Sick-Sinus-Syndroms in Kombination mit einem AV-Block, 24% aufgrund bradykarden Vorhofflatterns –bzw. flimmerns und 12% wegen Bradykardie-Tachykardie implantiert [Markewitz A, 2002]. Auffällig ist die zunehmende Verwendung von Zweikammersystemen: 1993 wurden in Deutschland 30% atrio-ventrikuläre Systeme implantiert [Irnich W et al., 1994], 2001 betrug deren Anteil 60% [Markewitz A, 2002]. Zahlen des Dänischen Herzschrittmacherregisters 1999 belegen den Trend zur zunehmenden Verwendung 3 Einleitung von DDD-Systemen. So wurden 1999 in Dänemark in 61% DDD-Herzschrittmacher erstimplantiert [2000]. In den USA wurden schon 1993 bei 67% aller Erstimplantationen Zweikammersysteme verwendet [Bernstein AD et al., 1996]. 1.1.2 Einfluss der Herzschrittmachertherapie auf Prognose und Lebensqualität Nach den o. g. Aussagen stellt sich nun die Frage, welchen Einfluss die Therapie mit einem Herzschrittmacher auf die Lebensqualität und Prognose der Patienten hat. Eine Verbesserung der Lebensqualität durch die Herzschrittmachertherapie wird aufgrund der Verminderung von Symptomen wie Synkopen oder Schwindel allgemein anerkannt [Kalusche D, 1996b]. Aussagen über die Verbesserung der Überlebensrate unter Herz- schrittmachertherapie müssen differenzierter gemacht werden. Die Prognosen unterscheiden sich für die verschiedenen Grunderkrankungen. Studien in den 70er Jahren zeigten eine Steigerung der Fünfjahresüberlebensrate von 30% auf über 60% für Patienten mit Herzschrittmachertherapie bei Adam-Stokes-Anfällen aufgrund plötzlicher hochgradiger AV-Block-Bilder im Vergleich zu Patienten mit rein medikamentöser Therapie [Edhag O et al., 1976; Simon AB et al., 1978]. Alt et al. untersuchten die Überlebensraten von 2007 Herzschrittmacherpatienten als Gesamtkollektiv und separat für die jeweilige Implantationsindikation [Alt E et al., 1983]. Die 10-Jahresüberlebensrate für alle Herzschrittmacherpatienten lag mit 35% um 10% niedriger als bei einer vergleichbaren Normalbevölkerung (44,4%). Da diese Divergenz sich bereits in den ersten Jahren herausbildete und dann konstant blieb, kann man sie als das krankheitsbedingte Sterblichkeitsrisiko der Herzschrittmacherpatientenpopulation bezeichnen. Betrachtet man nun die Prognose für die einzelnen Implantationsindikationen, so zeigten sich gravierende Unterschiede in Abhängigkeit der verschiedenen Grunderkrankungen. Die Prognose war für Patienten mit Sinusknoten-Syndrom signifikant besser als für Patienten mit AV-Block oder Bradyarrhythmie. Im Vergleich zur entsprechenden Normalbevölkerung lag die Überlebensrate bei Patienten mit Sinusknoten-Syndrom nur 2% unter der Prognose für die Normalbevölkerung. Bei Patienten mit AV-Block lag sie 15,6% darunter, bei Patienten mit Bradyarrhythmie sogar 23,1%. Diese Unterschiede sind signifikant [Alt E et al., 1983]. Die schlechte 4 Einleitung Prognose für Patienten mit Bradyarrhythmia absoluta erklärt sich durch die zugrunde liegende Herzerkrankung. In den meisten Fällen ist sie die Folge einer Kardiomyopathie [Büchner C et al., 1983]. Ausgeprägte Blockbilder sind in der Regel durch eine umfassende Myokardschädigung bedingt. Es wird deutlich, dass das Ausmaß der kardialen Grunderkrankung die Lebenserwartung der Herzschrittmacherpatienten bestimmt. Allerdings muss darauf hingewiesen werden, dass die Vergleiche zwischen den verschiedenen Implantationsindikationen im Hinblick auf die Prognose problematisch sind. Die Therapie mit einem Herzschrittmacher ist primär symptomatisch. Die Zielsetzung ist nicht kurativ. Daher beziehen sich die Unterschiede bezüglich der Prognose bei den verschiedenen Implantations- indikationen vor allem auf die zugrundeliegende Erkrankung und weniger auf den Einfluss der Herzschrittmachertherapie. 1.1.3 Fehlfunktionen während der Herzschrittmachertherapie Obwohl die Therapie der oben beschriebenen Herzrhythmusstörungen mittels eines Herzschrittmachers in aller Regel die Lebensqualität und Prognose der Patienten unter Berücksichtigung der Grunderkrankung verbessert, bleibt ein geringes Restrisiko dieser Therapie bestehen. Irnich et al. untersuchten die Ursachen von 29.000 Todesfällen bei Herzschrittmacherpatienten in den alten Bundesländern zwischen 1987 und 1997. Die Daten stammen aus dem deutschen Herzschrittmacherregister [Irnich W, 1999]. Bei 190 Patienten (0,66%) war ein direkter Zusammenhang zwischen der Todesursache und einer Herzschrittmacherfehlfunktion oder einem Defekt der Elektrode nachzuweisen. Bei 2,3% der Todesfälle wurde die Diagnose plötzlicher Herztod gestellt, wobei ein technischer Defekt als Ursache nicht ausgeschlossen werden konnte. Allerdings wurden keine genaueren Angaben zu den näheren Umständen gemacht. Ergänzt wurden diese Angaben durch Funktionsprüfungen von Herzschrittmachern verstorbener Patienten. 0,52% der Herzschrittmacher zeigten in diesen Untersuchungen eine Betriebsstörung, aufgrund derer keine stimulierte Herzaktion mehr erzeugt werden konnte. Betrachtet man die Summe aller Defekte (Herzschrittmacher, Sensing, Elektrode), so trat bei einem von 260 Patienten eine Funktionsstörung auf. Da nur 29% der Defekte erkannt werden, stirbt jährlich einer von 376 Herzschrittmacherpatienten mit einem unerkannten technischen Mangel des Herz- schrittmachersystems. In Anbetracht der mittleren Überlebenszeit eines Herzschritt- 5 Einleitung macherpatienten von sechs Jahren verstirbt einer von 62 Herzschrittmacherpatienten mit oder aufgrund eines technischen Defektes. Setzt man die Summe der unerkannten Defekte von Herzschrittmacher, Elektrode und Sensing (insgesamt 241 Fälle pro Jahr) ins Verhältnis mit der Anzahl der jährlichen plötzlichen Todesfälle bei Herzschrittmacherpatienten (667 Fälle pro Jahr), so stellt sich die Frage, ob nicht etwa ein Drittel aller plötzlichen Todesfälle bei Herzschrittmacherpatienten durch Fehlfunktionen des Herzschrittmachersytems bedingt sind [Irnich W, 1999]. Schäden bzw. Probleme am Herzschrittmacheraggregat und an den Elektroden können die Übertragung der Herzschrittmacherimpulse auf das Myokard negativ beeinflussen. Darüber hinaus können auch transistorische Herz- schrittmacherfehlfunktionen auftreten. Diese werden durch Interferenzen von Aggregat und Organismus verursacht. Mittels Langzeit-EKG-Registrierung können diese Störungen in verschiedene Gruppen eingeteilt und quantifiziert werden. Die Studie von Brandes et al. zeigte bei 83% der untersuchten Patienten Herzschrittmacherfehlfunktionen. Es wurden Patienten mit Symptomen wie Schwindel oder Synkopen und Patienten ohne solche Beschwerden mit einer 24-Stunden-LangzeitEKG-Untersuchung erfasst. Insgesamt wurden 6609 Fehlfunktionen detektiert. Darunter waren 5104 Sensingdefekte und 1505 unangemessene Herzschrittmacherinhibitionen. Es wurden keine Exit-Blockierungen nachgewiesen. Die unangemessenen Inhibitionen wurden ausschließlich durch Myopotentiale ausgelöst. Die Sensingdefekte zeigten vielfältige Ursachen [Brandes A et al., 1996]. Andere Studien fanden zwischen 35% und 69% unangemessene Herzschrittmacherinhibitionen als vorrangige Herzschrittmacherfehlfunktionen im 24Stunden-Langzeit-EKG [Breivik K et al., 1980; Janosik DL et al., 1987; Oka Y et al., 1985]. Sensingdefekte treten zwar nicht so häufig, aber keineswegs selten auf. Oka et al. konnten 704 Sensingdefekte bei 5 Patienten nachweisen [Oka Y et al., 1985]. Brandes et al. detektierten 5104 Sensingdefekte bei 77 Patienten [Brandes A et al., 1996]. Exitblockierungen zeigten sich bei 8% bis 10% der Herzschrittmacherpatienten [Gross-Fengels W et al., 1982; Janosik DL et al., 1987; Murray A et al., 1981]. 6 Einleitung Auch durch äussere Einflüsse wie Mobiltelefone, Diebstahlsicherungsanlagen, Kernspintomographie und andere elektromagnetische Störungen kann es zu Herzschrittmacherdysfunktionen kommen [Wilke A et al., 1997]. Grundsätzlich bleibt festzustellen, dass Herzschrittmacherfehlfunktionen sowohl bei symptomatischen wie asymptomatischen Patienten auftreteten. Sie sind häufiger als es Symptome wie Schwindel und Synkopen während der Herzschrittmachertherapie vermuten lassen [Brandes A et al., 1996]. 1.2 Der plötzliche Herztod 1.2.1 Definition des plötzlichen Herztodes Beim plötzlichen Herztod handelt es sich um einen natürlichen, unerwarteten Tod, der nach Symptombeginn rasch eintritt. Die Angaben über das zeitliche Intervall zwischen Beginn der Symptomatik und dem Eintritt des Todes variieren zwischen einer Stunde, sechs Stunden oder vierundzwanzig Stunden. Die Voraussetzung für die Diagnose „plötzlicher Herztod“ ist per Definitionem ein Herz-Kreislaufstillstand, der rhythmogen bedingt ist. Andere Ursachen wie Lungenembolie, akute Perikardtamponade oder Aortenruptur sollten ausgeschlossen werden [1979; Kuller LH, 1980; Lengfelder W et al., 1990]. Grundsätzlich unterscheidet man, ob der plötzliche Herztod in direkter zeitlicher Verbindung mit einem akuten Herzinfarkt auftritt oder nicht direkt mit einem akuten Ereignis in Zusammenhang steht. Ca. 75% der Patienten erliegen einem primär arrhythmischen Tod, wobei kein akuter Herzinfarkt vorliegt. Allerdings besteht in den meisten Fällen eine chronische koronare Herzkrankheit mit alten Infarktnarben [Lengfelder W et al., 1990]. Ungefähr ein Viertel der Patienten verstirbt an Kammerflimmern aufgrund eines akuten Herzinfarktes bzw. Reinfarktes [Lown B, 1980; Lown B et al., 1971]. 1.2.2 Epidemiologie des plötzlichen Herztodes Es wird vermutet, dass ungefähr 15% bis 20% aller natürlichen Todesfälle in den westlichen Industriestaaten dem plötzlichen Herztod zuzuordnen sind [Kalusche D, 1996a]. In der Bundesrepublik Deutschland versterben ungefähr 90.000 Menschen pro Jahr daran [Andresen D et al., 1993; Hombach V et al., 1984; Lengfelder W et al., 1990]. Andere Schätzungen gehen von ca. 150.000 plötzlichen 7 Einleitung Todesfällen in der Bundesrepublik Deutschland aus [Wehr M, 2001]. Nimmt man Zahlen aus den USA zum Vergleich, die 200.000 bis 400.000 plötzliche Todesfälle pro Jahr veranschlagen [Gillum RF, 1989; Gordon T et al., 1971; Josephson ME, 1986; Kuller L et al., 1966; Kuller LH et al., 1989], so scheinen ca. 90.000 plötzliche Todesfälle pro Jahr in Deutschland ein realistischer Wert zu sein. 1.2.3 Risikofaktoren des plötzlichen Herztodes Folgende Tabelle zeigt die Risikofaktoren des plötzlichen Herztodes: Ursachen des plötzlichen Herztodes Koronare Herzerkrankung Idiopathische dilatative Kardiomyopathie Hypertrophe Kardiomyopathie Rechtsventrikuläre Dysplasie Verlängerung der QT-Zeit Proarrhythmische Wirkung von Antiarrhythmika Elektrolytstörungen Angeborene Herzerkrankungen Herzklappenfehler Akute Myokarditis Kokainkonsum Sarkoidose Amyloidose Kardiale Tumoren WPW-Syndrom Bangungut, oder nächtlicher plötzlicher Herztod bei Süd-Ost-Asiaten Thyreotoxikose Linksventrikulärere Divertikel Tab. 1-1 Ursachen des plötzlichen Herztodes [Poole JE et al., 1995] Es besteht eine sehr enge Korrelation zwischen der Koronararteriensklerose und dem plötzlichen Herztod. Bei 80% der plötzlichen Todesfälle liegt eine hochgradige koronare Herzerkrankung vor, gefolgt von der idiopathischen dilatativen Kardiomyopathie bei 10% der Fälle des plötzlichen Herztodes [Myerburg RJ et al., 1987; Perper JA et al., 1975]. Daher sind die Risikofaktoren für die Entwicklung einer koronaren Herzerkrankung (Zigarettenkonsum, arterieller Hypertonus und Hypercholesterinämie) auch als Risikofaktoren für das Auftreten des plötzlichen Herztodes anzusehen. Außerdem weisen Linksherzhypertrophiezeichen und Q- 8 Einleitung Zacken im Ruhe-EKG auf ein gesteigertes Risiko für einen plötzlichen Herztod hin [Lengfelder W et al., 1990]. Untersuchungen von Patienten, die einen plötzlichen Herztod überlebten, untermauern die Verbindung von koronarer Herzerkrankung und plötzlichem Herztod. So zeigten koronarangiographische Untersuchungen bei erfolgreich reanimierten Patienten mit plötzlichem Herzkreislaufstillstand nur in 20% bis 40% einen akuten Myokardinfarkt. Allerdings wiesen 94% der Überlebenden eine chronische koronare Herzerkrankung auf, bei 70% lagen Wandbewegungsstörungen vor, bei einem Drittel eine schwere koronare Dreigefäßerkrankung [Weaver WD et al., 1976]. Der typische Überlebende eines akuten Herz-Kreislaufstillstandes zeigt folgende Merkmale: ein 64jähriger Mann (81%) mit koronarer Herzerkrankung (78%) und einem abgelaufenen Myokardinfarkt in der Anamnese (45%) [Cobb LA et al., 1992]. Neben einem abgelaufenem Myokardinfarkt erhöhen eine reduzierte linksventrikuläre Ejektionsfraktion, häufige bzw. komplexe ventrikuläre Extrasystolen und Spätpotentiale im 24-Stunden-Langzeit-EKG das Risiko für den plötzlichen Herztod [Bigger JT, Jr. et al., 1984; Breithardt G et al., 1987; Cobb LA et al., 1986; Mukharji J et al., 1984]. Die mit einem Herzschrittmacher versorgten Patienten stellen ein per se von kardialen Grunderkrankungen betroffenes Patientenkollektiv dar und sind überproportional häufig von einem plötzlichen Herztod betroffen. Der größte Anteil der plötzlichen Todesfälle unter Herzschrittmacherpatienten wird dem Fortschreiten der kardialen Grunderkrankung angelastet. Dennoch zeigen einzelne Untersuchungen einen Zusammenhang zwischen Herzschrittmacherfehlfunktionen oder Interaktion von Herzschrittmacherimpulsen und Herzeigenaktionen als Ursache für den plötzlichen Herztod unter Schrittmachertherapie des Herzens [Zehender M et al., 1994]. 1.3 Zielsetzung Ziel der Dissertationsarbeit war es, die Häufigkeit und Ursachen des plötzlichen Herztodes unter Herzschrittmachertherapie anhand dokumentierter Beispiele aufzuarbeiten. In der Herzschrittmacherambulanz des Universitätsklinikums Freiburg wurden in den vergangenen fünfzehn Jahren zahlreiche Fallbeispiele von tachykarden ventrikulären Rhythmusstörungen bei Herzschrittmacherpatienten 9 mittels Langzeit-EKG-Aufnahmen Einleitung dokumentiert. Diese Beispiele wurden in Abhängigkeit der Auslösemechanismen der Rhythmusstörungen in verschiedene Gruppen eingeteilt. Von besonderem Interesse war eine mögliche Beteiligung des Herzschrittmacheraggregates an der Auslösung und/oder Aggravation lebensbedrohlicher ventrikulärer Rhythmusstörungen. Die bei der Analyse der dokumentierten Beispiele gefundenen Ergebnisse wurden mit in der Literatur beschriebenen Fällen ventrikulärer Rhythmusstörungen unter Herzschrittmacherbeteiligung verglichen. Ergänzt wurde diese Dokumentation durch eine prospektive Studie zur Häufigkeit ventrikulärer Tachyarrhythmien bei Herzschrittmacherpatienten (EVENTSStudie), welche auf der Basis einer neuen Generation von Herzschrittmachern der Firma Guidant Corp. durchgeführt wurde. Diese Herzschrittmachermodelle erlauben es erstmals, ventrikuläre Tachyarrhyhtmien in entsprechenden EKG-Speichern zu erfassen. Zusammen mit der semiqualitativen Erfassung des plötzlichen Herztodes unter Herzschrittmacherpatienten des Universitätsklinikums Freiburg wurden so Erkenntnisse über die Häufigkeit ventrikulärer Tachyarrhythmien und des plötzlichen Herztodes unter Herzschrittmachertherapie gewonnen. Entsprechend der dargestellten Zielsetzung unterteilt sich die Dissertation in folgende drei Abschnitte: 1. Semiqualitative Erfassung der Häufigkeit des plötzlichen Herztodes in den Jahren 2000 und 2001 bei einem Patientenkollektiv mit permanentem Herzschrittmacher. 2. Analyse der Mechanismen dokumentierter lebensbedrohlicher ventrikulärer Tachyarrhythmien mit entsprechender Herzschrittmacherinteraktion. 3. Prospektive Langzeitstudie zur Häufigkeit spontaner und Herzschritt- macherinteraktiv ausgelöster und aggravierter ventrikulärer Tachyarrhythmien bei Herzschrittmacherpatienten mit intrakardialer EKG-Speicherung (EVENTS). Die aus diesen 3 Teilen gewonnenen qualitativen und quantitativen Ergebnisse zum plötzlichen Herztod bei Patienten mit permanenter Herzschrittmachertherapie wurden mit epidemiologischen Studien zur Prävalenz ventrikulärer Rhythmusstörungen, des plötzlichen Herztodes und dessen Risikofaktoren in der Bevölkerung 10 Einleitung verglichen. Es stellt sich die Frage, ob der Herzschrittmacher das Risiko für einen plötzlichen Herztod erhöht. Ebenso kann das Herzschrittmacherpatientengut per se durch die zur Herzschrittmacherimplantation führenden kardialen Grunder- krankungen einer Gruppe mit gesteigertem Risiko für den plötzlichen Herztod angehören. Es wurde versucht, die Bedeutung des Herzschrittmachers bei der Auslösung des plötzlichen Herztodes zu bewerten und die Pathomechanismen der Arrhythmieentstehung zu beschreiben. 11 Material und Methoden 2 Material und Methoden 2.1 Das Patientenkollektiv der Untersuchung Gegenstand der Untersuchungen Herzschrittmacher. im sind Im Zusammenhang ausschließlich Folgenden mit dieser Patienten werden die Dissertation mit zur einem geführten implantierten Schrittmacherimplantation führenden bradykarden Rhythmusstörungen aufgeführt und die verschiedenen Schrittmacherbetriebsarten erläutert. 2.1.1 Indikationen zur Herzschrittmachertherapie Die Indikationen zur permanenten Herzschrittmachertherapie lassen sich wie folgt einteilen [Kalusche D, 1996b]: Symptomatische Bradykardie: - Sinusknotensyndrom, - Bradyarrhythmia absoluta, - AV-Block II. und III. Grades. Morgagni-Adam-Stokes-Anfälle (Schwindel, Synkopen, Präsynkopen): - Sinusknotensyndrom (plötzliche SA-Blockierungen oder Sinusarrest, Tachykardie-Bradykardie-Syndrom), - paroxysmale AV-Blockierungen höheren Grades, - Carotissinussyndrom. Prophylaktische Indikationen: - Trifaszikulärer Block, - asymptomatische oder wenig symptomatische Sinusknotenerkrankung beim älteren Menschen. 12 Material und Methoden 2.1.2 Funktionsweise des Schrittmachersystems Die Funktionsweise eines Herzschrittmachers wird über einen Buchstabencode beschrieben, der früher drei Positionen, heute fünf Positionen umfasst: 1. Positon: Ort der Stimulation 2. Position: Ort der Detektion 3. Position: Arbeitsweise A = Atrium V = Ventrikel D=A+V 0 = keine Funktion A = Atrium V = Ventrikel D=A+V 0 = keine Funktion I = inhibiert T = getriggert D=I+T 0 = keine Funktion Tab. 2-1 Schrittmachercode Die Angabe der vierten und fünften Position ist fakultativ, nicht obligatorisch. An Position vier wird angegeben, ob ein frequenzadaptives System vorliegt. Ist dies der Fall wird die vierte Position mit R gekennzeichnet. Die fünfte Position gibt spezielle antitachykarde Funktionen an. Nach diesem Buchstabencode werden ventrikuläre und atriale Einkammerschrittmacher als VVI- bzw. AAI-Schrittmacher bezeichnet. Ein DDD-Schrittmacher ist ein Zweikammerschrittmacher. AAI-Funktion: Ein Vorhofdemandschrittmacher gibt einen Stimulus ab, sobald die Vorhoffrequenz die programmierte Interventionsfrequenz unterschreitet. Durch Vorhofextrasystolen wird der Schrittmacher inhibiert. Implantationsindikation zur AAIStimulation ist vor allem das Sinusknotensyndrom, insbesondere im Falle einer symptomatischen Sinusbradykardie, die nicht durch eine AV-Knotenstörung kompliziert wird. VVI-Funktion: Ventrikeldemandschrittmacher werden durch Kammerdepolarisationen inhibiert. Sie waren lange Zeit die am häufigsten implantierten Schrittmachertypen, z. B. bei Bradyarrhythmie. Ein Nachteil ist die unphysiologische Stimulation, durch die bei VVI-Schrittmacherpatienten ein sog. Schrittmachersyndrom ausgelöst werden kann. Dies bedeutet, dass die Kammerstimulation bei erhaltenem Sinusrhythmus zu einer retrograden Vorhoferregung und Vorhofkontraktion gegen die geschlossene Blutdruckabfall und AV-Klappe führt. Dadurch Schwindelerscheinungen kann es kommen. zu Die reflektorischem Inzidenz des Schrittmachersyndroms wird auf 7% geschätzt [Cohen SI et al., 1982]. Zusätzlich wirkt sich der Verlust der Vorhofsystole bei vorbestehender Herzinsuffizienz ungünstig auf die Auswurfleistung des Herzens aus. 13 Material und Methoden DDD-Funktion: DDD-Schrittmacher sind an zwei Elektroden angeschlossen, von denen eine im rechten Vorhof und eine in der rechten Kammer liegt. DDDSchrittmacher können sowohl AV-sequentiell stimulieren als auch die Sinusknotenfrequenz auf die Kammer überleiten. Die physiologische VorhofKammer-Synchronisation verbessert die Auswurfleistung des Herzens. Somit ist sie für Patienten mit Herzinsuffizienz von Bedeutung. Die wichtigste Indikation zur Implantation eines Zweikammerschrittmachers ist der AV-Block II. und III. Grades mit erhaltener Sinusknotenfunktion. Weitere Indikationen sind das Schrittmachersyndrom unter Stimulation mit einem VVI-Schrittmacher sowie die pathologische Sinusbradykardie bei der Sinusknotenerkrankung mit gleichzeitig erhaltener AVKnotenleitung. 2.2 Semi-qualitative Erfassung der Häufigkeit des plötzlichen Herztodes in den Jahren 2000 und 2001 bei Patienten mit permanenter Herzschrittmachertherapie Alle Patienten, die in der Schrittmacherambulanz des Universitätsklinikums Freiburg nach Implantation kontrolliert wurden, waren Gegenstand dieser Erhebung. Im Rahmen der Studie wurden alle Patienten gesondert erfasst, die nicht zur entsprechend vorgesehenen Kontrolluntersuchung in den Jahren 2000 und 2001 erschienen sind. Bei diesen Patienten erfolgte eine unmittelbare Abklärung für den Grund des Nichterscheinens in Form eines standardisierten Fragebogens unter Einbeziehung des Patienten bzw. dessen Angehörigen oder des Hausarztes. Im Todesfalle folgte eine telefonische Abklärung der Art des Todeseintrittes (plötzlich oder nicht plötzlich) und soweit möglich der Umstände des Todeseintrittes. Ziel dieses Dissertationsteiles war es, die Häufigkeit plötzlicher Todesfälle semiqualitativ zu erfassen und mit den Ergebnissen entsprechender Studien zu vergleichen. 14 Material und Methoden 2.3 Dokumentation und Analyse der Mechanismen lebensbedrohlicher ventrikulärer Tachyarrhythmien während Stimulation mit einem Herzschrittmacher In den vergangenen fünfzehn Jahren wurden in der Schrittmacherambulanz des Universitätsklinikums Freiburg zahlreiche Beispiele des Auftretens lebens- bedrohlicher tachykarder Herzrhythmusstörungen bei Schrittmacherpatienten mittels Langzeit-EKG-Aufzeichnung dokumentiert. Diese Beispiele wurden im Rahmen der Dissertation im Hinblick auf die genaue Identifikation der Mechanismen und Umstände der Interaktion von Tachyarrhythmien und Schrittmacheraktionen aufgearbeitet. Im einzelnen wurden die Beispiele hierzu nach den Auslösemechanismen sortiert, katalogisiert und bewertet. Des weiteren wurden alle relevanten Beispiele mit einem Scanner erfasst und in einer veröffentlichungsfähigen Form gespeichert. 2.4 Prospektive Langzeitstudie zur Erfassung ventrikulärer Tachykardien bei Schrittmacherpatienten (EVENTS) 2.4.1 Studiendesign In der prospektiven multizentrischen EVENTS-Studie, basierend auf ZweiKammerschrittmachern der Firma Guidant Corp. soll die Art, Häufigkeit und Schwere ventrikulärer Rhythmusstörungen bei Schrittmacherpatienten bestimmt werden. Hierzu wurden von September 1998 bis November 2000 in dreiundzwanzig deutschen Studienzentren 231 Patienten mit medizinischer Indikation zur permanenten Herzschrittmachertherapie in die Studie eingeschlossen und über einen Zeitraum von 15 Monaten nach der Implantation beobachtet. 15 Material und Methoden 2.4.2 Studienzentren Teilnehmende Zentren: Investigator: Medizinische Universitätsklinik und Poliklinik der AlbertLudwigs-Universität Freiburg Prof. Dr.med. M. Zehender, Dr.med. T.S. Faber Zentralkrankenhaus Reinkenheide, Bremerhaven Dr. med. Dissmann, Dr. med. Appel Landkrankenhaus Coburg, Akad. Lehrkrankenhaus der Universität Würzburg Prof. Dr. med. Brachmann Universität Erlangen-Nürnberg, Medizinische Klinik II Prof. Dr. med. Daniel, Frau Dr. med. Kuly Martin-Luther-Universität Halle, Medizinische Klinik Prof. Dr. med. Werdan, OA Dr. med.Prondzinsky Gemeinschaftspraxis für Kardiologie, Hamburg Dres .med. Zahorsky, Schmidt, Breuer St. Vincentius-Krankenhaus Karlsruhe Akad. Lehrkrankenhaus Prof. Dr.med. Gonska, Frau Dr. med. Müller Klinikum Rosenheim OA Dr.med. Morgenstern Kardiologische Gemeinschaftspraxis, Berlin Dres. med. Dingerkus, Hennig Herzzentrum Leipzig, Kardiologie Dres. med. Hindricks, Kottkamp Kardiologische Gemeinschaftspraxis, Kiel Dres. med. Schröder, Lutz Kardiologische Gemeinschaftspraxis, Hamburg Prof. Dr. med. Matthey, Prof. Dr. med. Schofer, Dr. med. Geiger Städtisches Klinikum Brandenburg, Kardiologie Prof. Dr. med. Oeff, OÄ Frau Dr. med. Schäfer, OA Dr. med. Huber Evangelisches Krankenhaus, Bad Gandersheim CA Dr. med. Zahn Kreiskrankenhaus Klinik am Eichert, Göppingen Dr. med. Hofgärtner Klinikum Süd Nürnberg, Kardiologie OA Dr. med. Göhl Kardiologische Gemeinschaftspraxis, Chemnitz Dres. med. Dänschel, Kleinertz Klinikum der Friedrich-Schiller-Universität Jena, Innere Medizin III OA PD Dr. med. Kühnert, Dr. med. Pohl Johannes-Gutenberg-Universität Mainz, Kardiologie PD Dr. med. Himmrich, Dr. med. Nowak, Dr. med. Liebrich Spreewaldklinik Lübben CA Dr. med. Reinhold, OA Dr. med. Scholz Justus-Liebig-Universität Gießen, Klinik für Herz- und Gefäßchirurgie OA Dr. med. Stertmann Ernst-Moritz-Arndt Universität Greifswald, Innere Abteilung OA Dr. med. Möx Kardiologische Praxis, Chemnitz Dr. med. Kaltofen Tab. 2-2 Studienzentren und Investigators der EVENTS-Studie 16 Material und Methoden Es wurden 231 Patienten eingeschlossen, die sich wie folgt auf die verschiedenen Studienzentren verteilten: GesamtCode Stadt Klinik Einschluss 14 Bad Gandersheim Evang. Krankenhaus 18 9 Berlin Praxis Dingerkus/Hennig 2 2 Bremerhaven ZK Reinkenheide 7 17 Chemnitz I Praxis Kleinertz/Dänschel 7 23 Chemnitz II Praxis Kaltofen/Schubert/Gerner 21 3 Coburg Landkrankenhaus 19 4 Erlangen Uni 24 1 Freiburg Uni 49 21 Gießen Uni 5 15 Göppingen KKH Klinik am Eichert 5 22 Greifswald Uni 6 5 Halle Uni 3 12 Hamburg I Praxis Mathey, Schofer 0 6 Hamburg II Praxis Schmidt 19 18 Jena Uni 6 11 Kiel Praxis Schröder 7 10 Leipzig Herzzentrum Leipzig 13 20 Lübben Spreewaldklinik 1 19 Mainz Uni 2 16 Nürnberg, Süd Klinikum Süd 6 8 Rosenheim Klinikum Rosenheim 11 Tab. 2-3 Verteilung der Patienten auf die Zentren der EVENTSStudie 2.4.3 Patientenkollektiv In die Studie wurden insgesamt 231 Patienten eingeschlossen, von denn 58% männlich und 42% weiblich waren. Einschlusskriterien: - Jeder Patient mit einem Pulsar oder Discovery Zweikammer-Schrittmachersystem der Firma Guidant - Patienten, die in der Lage sind, Sinn und Ablauf der Studie zu verstehen - Patienten, die mindestens 18 Jahre alt sind 17 Material und Methoden Ausschlusskriterien: - Patienten mit chronischem Vorhofflimmern - Patienten, die nicht für ein Follow up verfügbar sind - Patientinnen, bei denen eine Schwangerschaft vorliegt Endpunkte der Studie: Primärer Endpunkt: Auftreten von gemäss den ACC/AHA-Guidlines behandlungsbedürftigen ventrikulären Tachykardien, die mittels Schrittmacheraufzeichnung oder EKG zu dokumentieren sind. Sekundärer Endpunkt: Abhängigkeit tachyarrhythmischer Ereignisse von Medikation und kardialer Grunderkrankung. 2.4.4 Durchführung Am Tag der Schrittmacherimplantation wurden auf einem standardisierten Erfassungsbogen neben Alter, Geschlecht und Implantationsdatum die Schrittmacherindikation und Begleiterkrankungen der Patienten erfasst. Auf einem standardisierten Formular wurden bei der Entlassungsuntersuchung ebenso die Ejektionsfraktion des Patienten, sowie deren Bestimmungsart, Angaben zur kardialen Medikation (Klasse-I-Antiarrrhythmikum, Beta-Blocker, Sotalol, Amiodaron) und die kardiale Zwischenanamnese festgehalten. Der Schrittmacher wurde wie unten beschrieben zur Arrhythmieerkennung –und Diagnostik programmiert. Zu den Follow-up-Untersuchungen wurden die Patienten 3, 9 und 15 Monate nach der Schrittmacherimplantation in das Studienzentrum einbestellt. Dabei wurden die vom Schrittmacher gespeicherten Elektrogramme (EGM), das ArryhthmieLogbuch, die Histogramme und die Zähler vom Speicher des Schrittmachers abgerufen und ausgedruckt. Auf dem Follow-Up-Formular waren vom Untersucher Angaben zur kardialen Medikation und Zwischenanamnese (Synkope, Infarkt, intermittierendes machen. Ebenso Vorhofflimmern/flattern, wurde die supraventrikuläre Programmierung der Tachykardien) diagnostischen zu Schritt- macherfunktionen sowie die Vollständigkeit der ausgedruckten Elektrogramme und des Arryhthmie-Logbuchs vermerkt. 18 Material und Methoden Zusätzlich zu diesen Daten wurden bei der Follow-Up-Untersuchung nach 15 Monaten am Studienende noch einmal die Ejektionsfraktion bestimmt, vermerkt ob der Patient während der Studie verstorben war und eine Zusammenfassung über die Vollständigkeit der vorangegangenen Follow-Up-Untersuchungen erstellt. Nachdem der Dateneingang abgeschlossen war und die Daten bei Guidant Corp. in Giessen vorlagen, wurde in Zusammenarbeit von Hr. Dr. Treusch und Hr. Dr. Morkel von Guidant und Hr. Gradinger von der Universität Freiburg eine Microsoft-Acces-Datenbank erstellt und die Auswertung der Daten durchgeführt. 2.4.5 Schrittmachermodelle und Funktionen Abb. 2-1 Das in der EVENTS-Studie verwendete Herzschrittmachermodell Discovery DR, Giudant 2.4.5.1 Arrhyhmie-Logbuch und EGM-Speicherung Die implantierten 2-Kammerschrittmachermodelle Pulsar oder Discovery (Guidant Corp., St. Paul, MN, USA) verfügen über Funktionen, die die Dokumentation und Analyse von Arrhythmien ermöglichen. Die Aufzeichnung der Arrhythmien im Arrhythmielogbuch kann durch fünf verschiedene Ereignistypen ausgelöst werden. In der EVENTS-Studie wurde die Programmierung der Speicherfunktion des Arrhythmielogbuchs auf rezidivierende 19 Material und Methoden ventrikuläre Extrasystolen (VES) und ventrikuläre Tachykardien (VT) oder nur auf ventrikuläre Tachykardien eingestellt. Eine ventrikuläre Tachykardie wird aufgezeichnet, wenn der Schrittmacher in einer ventrikulären Detektionsbetriebsart arbeitet und die ventrikuläre Frequenz eine programmierbare „ventrikuläre Detektionsfrequenz“ über eine programmierbare „ventrikuläre Detektionsdauer“ hinaus überschreitet. Zusätzlich muss die Frequenz, die im Ventrikel registriert wurde, schneller sein als die im Vorhof gemessene Frequenz (V > A Kriterium). Um die ventrikuläre Frequenz zu bestimmen, werden detektierte ventrikuläre Ereignisse sowohl innerhalb als auch außerhalb der ventrikulären Refraktärzeiten herangezogen. In dieser Studie wurden als Grenze für die VT-Erkennung mindestens vier ventrikuläre Zyklen mit einer Frequenz von mehr als 120 Schlägen pro Minute festgelegt. Dies geschah in Anlehnung an die MADIT-I Kriterien, die bei mindestens drei ventrikulären Schlägen mit einer Frequenz von mehr als 120 Schläge pro Minute die Grenze zur VT-Definition zogen [Moss AJ et al., 1996]. Die in der Studie verwendeten Schrittmachermodelle sind in der Lage bis zu vierzig Sekunden lang intrakardiale Elektrogramme (EGM) zu speichern. In den Zweikammersystemen werden Vorhof- und Kammer- EGM simultan aufgezeichnet und auf zwei verschiedenen Kanälen abgebildet. Die Aufzeichnungsoptionen wurden so eingestellt, dass bei einem Speicher von vierzig Sekunden maximal acht Elektrogramme a fünf Sekunden gespeichert werden konnten. Die Aufzeichnung eines EGM beginnt mit dem Herzzyklus, der demjenigen Zyklus folgt, der das Ereignis ausgelöst hat. Die ersten vier VES, die zur Aktivierung der EGM-Aufzeichnung geführt haben, sind somit nicht dokumentiert. Wenn der gesamte verfügbare Speicherplatz verbraucht ist, überschreibt das neueste Ereignis das älteste Ereignis im Schrittmacherspeicher. Ausserdem zeichnet der Schrittmacher fünf PMT-Ereignisse auf. Diese Arrhythmieform steht für Schrittmacher-induzierte Tachykardie. Ein PMT-Ereignis, das nach dem fünften PMT-Ereignis stattfindet, überschreibt das älteste PMTEreignis im Schrittmacherspeicher. 20 Material und Methoden 2.4.5.2 Histogramme Die Frequenzhistogramme erlauben es dem Untersucher, atrial und ventrikulär stimulierte und detektierte Ereignisse, die während der Aufzeichnungsperiode gesammelt wurden, grafisch darzustellen. Diese Periode beginnt mit der letzten Rückstellung durch den Arzt und endet, wenn die Daten per Telemetrie vom Schrittmacher abgerufen werden. Die Frequenzbereiche werden bei Frequenzen zwischen 30 min-1 und 180 min-1 in 10 min-1-breite Abschnitte eingeteilt und in einzelnen Abschnitten für Frequenzen über 180 min-1. 2.4.5.3 Zähler Die Ereigniszähler zeichnen die Anzahl der intrinsischen und schrittmacherbezogenen Ereignisse auf, die während einer Aufzeichnungsperiode auftreten. Diese Periode beginnt mit dem Zeitpunkt, an dem die Zähler zum letzten Mal vom Arzt zurückgestellt wurden, und endet, wenn die Daten per Telemetrie aus dem Schrittmacher abgerufen werden. Weder ein Zugriff auf die Daten noch Veränderungen der programmierten Parameter stellen den Zähler zurück. Im Rahmen der EVENTS-Studie wurden folgende Ereignisse gezählt: - Gesamtanzahl an ATR-Umschaltungen - Die prozentuale Verteilung von ventrikulärer Stimulation und Detektion - Die Summe einzelner VES und Couplets - Die Summe von drei oder mehr aufeinander folgender VES - Die Summe der detektierten ventrikulären Tachykardien Die Anzahl von einzelnen ventrikulären Extrasystolen oder Couplets, nichtanhaltenden ventrikulären Tachykardien und anhaltenden ventrikulären Tachykardien werden auf diese Art im Zähler der Schrittmachermodelle registriert. 2.4.6 Elektrogrammauswertung Alle gespeicherten EGM, von denen ein Ausdruck vorlag, wurden durch PD Dr. med. Th. Faber vom Universitätsklinikum Freiburg und Hr. Dr. med. S. Treusch von Guidant in Giessen bewertet. Die EGM wurden aufgrund der Diagnosen in die folgenden Gruppen eingeteilt: 21 Material und Methoden Eine ventrikuläre Tachykardie wurde als bewiesen angesehen, wenn auf dem EGM mindestens drei schnelle ventrikuläre Zyklen ohne vorhergehende Vorhofaktionen zu sehen waren. Dies wurde in Verbindung mit den nicht gespeicherten, die Aufzeichnung triggernden vier ventrikulären Schlägen als ventrikuläre Tachykardie gewertet. Abb. 2-2 Ventrikuläre Tachykardie Als wahrscheinliche aber nicht bewiesene ventrikuläre Tachykardie wurden Arrhythmien gewertet, wenn das EGM nur zwei oder drei vorzeitige ventrikuläre Schläge entsprechend mit einem oder zwei schnellen Intervallen am Anfang der EGM-Speicherung zeigte. (VT only with onset). Von einer VT kann man in diesem Fall nur ausgehen, wenn man die vier Trigger-VES mit einbezieht. Abb. 2-3 Ventrikuläre Tachykardie nur mit Onset 22 Material und Methoden Wenn Vorhofflattern oder Vorhofflimmern der Grund für eine schnelle ventrikuläre Antwort war, die die EGM-Speicherung auslöste, so konnte dies im Vorhofkanal des EGMs identifiziert werden und in die entsprechende eingeteilt werden. Abb. 2-4 Vorhofflimmern Abb. 2-5 Vorhofflattern Gruppe 23 Material und Methoden Vorhoffrequenzen von mehr als 120 min-1 mit 1:1-Überleitung wurden als supraventrikuläre Tachykardien klassifiziert. Abb. 2-6 Supraventrikuläre Tachykardie Ebenso wurde atriales Undersensing und ventrikuläres Oversensing anhand der EGM erkannt und entsprechend gewertet. Ein atriales Undersensing liegt vor, wenn die vom Schrittmacher gemessene Amplitude der Vorhoferregung unter der programmierten Empfindlichkeit des Aggregates liegt. Der Schrittmacher kann die atrialen Ereignisse nicht detektieren und interpretiert deshalb die ventrikulären Ereignisse als VES. Umgekehrt bedeutet ventrikuläres Oversensing, dass vom Schrittmacher Ereignisse im Ventrikel detektiert werden, die in der Form nicht vorhanden sind. Der Schrittmacher reagiert aufgrund einer zu hohen Empfindlichkeit des Aggregates auf inadäquate Reize im Ventrikel, die er für VES hält. Lag ein AV-synchroner Herzzyklus mit Frequenzen unter 120 min-1 nach EGMAufzeichnung vor, so wurde ein normaler Sinusrhythmus postuliert. 24 Ergebnisse 3 Ergebnisse 3.1 Semiqualitative Erfassung des plötzlichen Herztodes in den Jahren 2000 und 2001 bei Patienten mit permanenter Herzschrittmachertherapie Bei allen Patienten, die in den Jahren 2000 und 2001 nicht zur vereinbarten Kontrolluntersuchung in der Schrittmacherambulanz des Universitätsklinikums Freiburg erschienen, wurde die Ursache für das Fernbleiben geklärt. Im Beobachtungszeitraum verstarben insgesamt 109 Patienten. Bei 13 konnte ein plötzlicher Herztod durch den Hausarzt bestätigt werden, die restlichen 96 Patienten erlagen anderen Grundleiden, oder aber es konnten keine näheren Angaben zur Todesursache in Erfahrung gebracht werden. 96 13 andere Todesursache plötzlicher Herztod Abb. 3-1 Anteil plötzlicher Tode bei 109 verstorbenen Herzschrittmacherpatienten Setzt man die nachgewiesenen plötzlichen Todesfälle ins Verhältnis zu der Gesamtanzahl an verstorbenen Schrittmacherpatienten, so kann festgestellt werden, dass ein Anteil von 12% plötzlich verstorben ist. Unter den dreizehn plötzlich verstorbenen Patienten befanden sich zehn Männer (77%) und drei Frauen (23%). Das Durchschnittsalter lag bei 73,2 Jahren. Der jüngste Patient war 20 Jahre alt, der älteste 89 Jahre. 25 Ergebnisse AV-Block II° 15% andere 31% AV-Block III° 31% Brady-AA bei VHF 23% Abb. 3-2 Implantationsindikationen bei 13 plötzlich verstorbenen Herzschrittmacherpatienten Die Implantationsindikationen verteilten sich wie folgt: AV-Block II°: 2 Patienten (15%) AV-Block III°: 4 Patienten (31%) Bradyarrhythmie bei Vorhofflimmern: 3 Patienten (23%) Andere: 4 Patienten (31%) Bei vier Patienten war ein Infarkt in der Anamnese bekannt. Die Behandlungsdauer variierte zwischen neun Jahren und weniger als einem Jahr. 40% der plötzliche verstorbenen Patienten wurden mit einem Zweikammersystem stimuliert, 60% mit einem Einkammersystem. Eine Vorhofstimulation fand bei keinem der Patienten statt. 26 Ergebnisse 3.2 Lebensbedrohliche ventrikuläre Arrhythmien während permanenter Herzschrittmachertherapie In den vergangenen fünfzehn Jahren wurden in der Schrittmacherambulanz des Universitätsklinikums Freiburg mittels 24-Stunden-Langzeit-EKG-Registrierung Fallbeispiele tachykarder ventrikulärer Rhythmusstörungen bei Schrittmacherpatienten dokumentiert. Im Folgenden sollen diese Fallbeispiele im Hinblick auf die auslösenden Mechanismen und eine eventuelle Schrittmacherbeteiligung untersucht und in Gruppen mit auf ähnliche Weise getriggerten ventrikulären Tachykardien eingeteilt werden. 3.2.1 Mechanismen der Arrhythmieentstehung und –aggravation bei ventrikulär stimulierendem System: Kurz-lang-kurz-Sequenzen („short-long-short“, SLS) und Lang-kurz-lang-Sequenzen (longshort-long“, LSL) als Auslöser einer ventrikulären Tachykardie Kurz-lang-Sequenzen mit involvierter Kammerstimulation des EinkammerHerzschrittmachers als Auslöser ventrikulärer Tachykardien wurden schon Ende der 80er Jahre als Auslöser ventrikulärer Tachykardien beschrieben [Karbenn U et al., 1989]. In den 90er Jahren veröffentlichte die Arbeitsgruppe um Böhm [Böhm A et al., 1998] ein Fallsbeispiel, das die Auslösung einer Torsade de pointes Tachykardie aufgrund einer Kurz-lang-Sequenz mit Schrittmacherbeteiligung dokumentierte. Bei Einkammersystemen können LSL- bzw. SLS-Sequenzen durch ventrikuläre Extrasystolen während VVI-programmierter Stimulation entstehen. Das erste lange Intervall wird hierbei durch zwei selbständige Herzaktionen ohne Schrittmacherbeteiligung gebildet. Früh auf den zweiten regulären QRS-Komplex folgt eine ventrikuläre Extrasystole, die das kurze Intervall begrenzt. In der darauffolgenden postextrasystolischen Pause wird keine selbständige Herzerregung initiiert, so dass eine Schrittmacheraktion folgt, die das zweite lange Intervall limitiert. Darauf folgt die tachykarde Rhythmusstörung direkt im Anschluss an die schrittmacherinduzierte Erregung. Die Lang-kurz-lang-Sequenz als Auslöser einer ventrikulären Tachykardie kann ebenso aus einer Periode heraus entstehen, in der der Einkammerschrittmacher regelmäßig stimuliert. Die Zeitspanne zwischen den regelrechten Herzschrittmacheraktionen bildet ein langes Intervall. Eine früh einfallende ventrikuläre Extrasystole 27 Ergebnisse bestimmt das darauf folgende kurze Intervall. Bei diesem Auslösemechanismus ist auffällig, dass bei einzelnen Beispielen nach der postextrasystolischen Pause zusätzlich zum arrhythmogenen Potential der Lang-kurz-lang-Sequenz noch eine Fusion einer ventrikulären Extrasystole mit einer Herzschrittmacheraktion besteht, die eine ventrikuläre Tachykardie einleitet. Abb. 3-3 Das erste lange Intervall der LSL-Sequenz ist von zwei selbständigen Herzaktionen begrenzt, an das sich - limitiert durch eine ventrikuläre Extrasystole (VES) - ein kurzes Intervall anschließt. Auf die VES folgt während der postextrasystolischen Pause keine selbstständige Herzaktion (langes Intervall). Mit Aktivierung des Schrittmachers und Abgabe eines Kammerstimulus (V) beginnt eine ventrikuläre Tachykardie (VT). Abb. 3-4 Das erste lange Intervall der LSL-Sequenz besteht zwischen zwei eigenständigen Herzaktionen. Durch eine ventrikuläre Extrasystole (VES) wird das kurze Intervall begrenzt. Wegen der fehlenden Eigenerregung in der postextrasystolischen Pause wird der Schrittmacher aktiviert (V) und somit das lange Intervall limitiert; es kommt zu einer ventrikulären Tachykardie (VT). 28 Ergebnisse Schrittmacherinduzierte ventrikuläre Tachykardie bei implantierbarem Cardioverter Defibrillator (ICD): Abb. 3-5 SLS-Sequenz aufgrund einer ventrikulären Extrasystole (VES) mit Herzschrittmacherbeteiligung. Im Vorfeld der SLS-Sequenz besteht ein eigenständiger Herzrhythmus. Auf eine VES folgt aufgrund der postextrasystolischen Pause keine Herzaktion (langes Intervall), so dass die antibradykarde Funktion des ICD (V) aktiviert wird. Direkt im Anschluss an die stimulierte Herzaktion beginnt eine ventrikuläre Tachykardie. Abb. 3-6 SL-Sequenz aufgrund einer ventrikulären Extrasystole (VES) mit Herzschrittmacherbeteiligung, mit oder ohne Fusionsschlag. Auf eine reguläre Schrittmacheraktion folgt eine VES (kurzes Intervall). Bei diesem Beispiel handelt es sich bei der der postextraystolischen Pause folgenden Erregung um einen Fusionsschlag (Fusion) einer VES mit einer Schrittmacheraktion, dem eine ventrikuläre Tachykardie (VT) folgt. 29 Ergebnisse Abb. 3-7 SL-Sequenz aufgrund einer ventrikulären Extrasystole (VES) mit Herzschrittmacherbeteiligung, mit oder ohne Fusionsschlag. Auf eine reguläre Herzschrittmacheraktion folgt eine VES (kurzes Intervall). Bei diesem Beispiel handelt es sich bei der der postextrasystolischen Pause folgenden Erregung um einen Fusionsschlag (Fusion) einer VES mit einer Herzschrittmacheraktion, dem eine ventrikuläre Tachykardie (VT) folgt. 3.2.2 Mechanismen der Arrhythmieentstehung und –aggravation bei atrial stimulierendem System Aufgrund der Tatsache, dass bei Vorhofschrittmachern die Stimulation im Atrium und nicht im Ventrikel erfolgt, kann durch diese kaum eine ventrikuläre Tachykardie ausgelöst werden. Unter dem Begriff „Pseudo-Auslösung“ ventrikulärer Tachykardien durch atriale Stimulation wird die Tatsache beschrieben, dass der Herzschrittmacherstimulus die Arrhythmieentstehung nur scheinbar bedingt. In Wirklichkeit handelt es sich aber um eine spontane ventrikuläre Tachykardie auf die der Herzschrittmacher keinen Einfluss hat. Ein Beispiel für dieses Phänomen wurde nicht dokumentiert. Im Gegensatz dazu können bei Zweikammerschrittmachern durch eine Vorhoferregung aufgrund supraventrikulärer Extrasystolen ventrikuläre Tachykardien ausgelöst werden. Der Herzschrittmacher nimmt die supraventrikuläre Extrasystole im Atrium war und überträgt diese auf den Ventrikel. Dort kann die vorzeitige Erregung über Lang-kurz-Sequenzen an der Auslösung ventrikulärer Tachykardien beteiligt sein. Die Fallbeispiele 3-14 und 3-15 zeigen die Beteiligung von supraventrikulären Extrasystolen an der Auslösung ventrikulärer Tachykardien bei atrio-ventrikulär stimulierenden Systemen. 30 Ergebnisse War wie im folgenden Beispiel ein AAI-programmierter Schrittmacher in die Entstehung einer ventrikulären Tachykardie aufgrund einer Kurz-lang-Sequenz involviert, so konnte eine aktive Beteiligung des Schrittmachers an der Entstehung der Rhythmusstörung in dem vorliegenden Fallbeispiel ausgeschlossen werden. Abb. 3-8 SL-Sequenz ohne direkte Herzschrittmacherbeteiligung bei AAI-programmierten Einkammersystem. Zwischen zwei eigenständigen Herzaktionen liegt das kurze Intervall. Da darauf keine weitere eigenständige Vorhoferregung erfolgt, wird der AAI-Schrittmacher aktiviert (A). Noch bevor die Erregung auf die Kammern übertragen wird, eröffnet eine ventrikuläre Extrasystole (VES) die ventrikuläre Tachykardie (VT). Daher ist der Herzschrittmacher an deren Entstehung nicht ursächlich beteiligt. Da der AAI-programmierte Schrittmacher die VES nicht wahrnehmen kann, stimuliert er während der VT weiter. 3.2.3 Mechanismen der Arrhythmieentstehung und –aggravation bei atrio-ventrikulär stimulierendem System Die Triggerung ventrikulärer Tachykardien bei Patienten mit ZweikammerHerzschrittmachern durch supraventrikuläre wie ventrikuläre Extrasystolen wurde in den 90er Jahren von Zehender et al. [Zehender M et al., 1999] beschrieben. Bei der Analyse der vorliegenden Beispiele konnten bestimmte Pathomechanismen, die zur Auslösung ventrikulärer tachykarder Rhythmusstörungen führten, wiederholt beobachtet werden. Auf dieser Grundlage wurden die Ereignisse bei implantierten Zweikammersytemen in Untergruppen gegliedert. 31 Ergebnisse 3.2.3.1 Mangelnde Wahrnehmung ventrikulärer Ektopien durch den Herzschrittmacher als Auslöser einer ventrikulären Tachykardie Fehlfunktionen des Herzschrittmachers kommen als potentielle Auslöser ventrikulärer Tachykardien in Frage. Herzschrittmacherfehlfunktionen können folgendermaßen eingeteilt werden: Fehlfunktion Mögliche Ursachen Reizschwellenanstieg mit Verlust der Stimulation - Undersensing - Oversensing - Sondendislokation Sondenbruch Isolationsdefekt der Sonden Adaptionsprobleme zwischen Sonde und Aggregat Batterieerschöpfung schlechte Sondenplatzierung bei Implantation Sondendislokation Alterung der Sonde inadäquate Programmierung von Sensitivität und Blanking-Periode Hypokaliämie Antiarrhythmika Kardioversion bzw. Defibrillation Dislokation der Kammersonde (Vorhofaktionen werden von der Kammersonde registriert) Isolationsdefekt Kabelbruch Adapterprobleme T-Wellen-Sensing Artefakte Myopotentiale Tabelle 3-1 Herzschrittmacherfehlfunktionen [Werdan K. et al., 2003] Vor allem bei Sensing-Problemen kann es durch das Wahrnehmungsdefizit zu Interaktionen zwischen ventrikulären Ektopien und Herzschrittmacherstimulationen kommen. Beschrieben sind Wahrnehmungsstörungen ventrikulärer Ektopien während Phasen akuter Ischämien, bei Vorliegen von Erregungsausbreitungsstörungen und im Zusammenhang mit ventrikulären Extrasystolen bzw. Tachykardien. [Vera Z et al., 1975; Zehender M et al., 1994]. Potentielle Auslöser ventrikulärer Arrhythmien bei vorliegenden Sensingdefekten sind ein R-auf-TPhänomen durch eine Herzschrittmacherstimulation in die vulnerable Phase einer ventrikulären Extrasystole, Kurz-lang-Sequenzen und Fusionsschläge Im folgenden Fallbeispiel wird die ventrikuläre Tachykardie durch eine Kurzlang-Sequenz und möglicherweise zusätzlich durch einen Fusionsschlag induziert. 32 Ergebnisse Auffällig ist, dass im Vorfeld der ventrikulären Tachykardie eine Steigerung von einer ventrikulären Extrasystole über ein Couplet und Triplett bis hin zur ventrikulären Tachykardie zu beobachten ist. Abb. 3-9 1. 2. Vor der ventrikulären Tachykardie (VT) entsteht durch das Undersensing (US) der dritten Extrasystole des Tripletts ein verkürztes Intervall zur nächsten herzschrittmacherinduzierten Aktion, der ein normal langer zeitlicher Abstand bis zur nächsten Herzschrittmacheraktion folgt. So geht der Rhythmusstörung eine SLSequenz voraus, die als Ursache für die Entstehung einer ventrikuklären Tachykardie in Frage kommt. Hinzu kommt ein Fusionsschlag durch Undersensing der ersten Extrasystole der VT. Welcher der beiden Mechanismen (SL-Sequenz oder Fusionsschlag) allein für die Entstehung der VT verantwortlich ist oder ob gerade diese Kombination die Rhythmusstörung bedingt, ist nicht sicher zu eruieren. Das erste Couplet des Beispiels entsteht direkt im Anschluss an eine SLS-Sequenz, die durch eine VES bedingt ist. Auffällig ist die Steigerung von VES über Couplet und Triplett bis hin zur VT. Dies kann als Beispiel einer Aggravation der Rhythmusstörungen angesehen werden, an deren Ende eine VT ensteht. 3.2.3.2 Kurz-lang-kurz- und Lang-kurz-lang-Sequenzen als Auslöser einer ventrikulären Tachykardie Sehr oft entstehen die genannten Sequenzen durch interponierte ventrikuläre Extrasystolen. Durch den frühzeitigen Einfall einer ventrikulären Extrasystole nach einer regulären Eigenaktion oder nach einem schrittmacherinduzierten QRS-Komplex entsteht zunächst ein kurzes Intervall; durch die postextrasystolische Pause folgt ein langes Intervall, an das sich eine ventrikuläre Tachykardie unmittelbar anschließt. Das Intervall zwischen zwei regelrechten Herzaktionen, das der ventrikulären 33 Ergebnisse Extrasystole vorausgeht, ist dabei in der Regel das erste lange Intervall einer Langkurz-lang-Sequenz. Abb. 3-10 Der konstante zeitliche Abstand zwischen zwei regulären Herzschrittmacheraktionen wird als langer Teil der Sequenz betrachtet. Auf eine korrekte Herzschrittmacheraktion folgt eine früh einfallende ventrikuläre Extrasystole (VES); dieses Intervall wird als kurzer Teil der Sequenz definiert. Die nächste Herzschrittmacherstimulation folgt im selben zeitlichen Abstand, wie er zwischen zwei Herzschrittmacheraktionen festgelegt ist (langes Intervall). Direkt im Anschluss an den Schrittmacherspike (V) beginnt eine ventrikuläre Tachykardie (VT). Abb. 3-11 SLS2-Sequenz, ausgelöst durch eine ventrikuläre Extrasystole (VES) mit Herzschrittmacherbeteiligung. Im Anschluß an eine regelrechte Herzschrittmacheraktion entsteht das kurze Intervall durch eine früh einfallende VES. Der lange Abschnitt der Sequenz besteht während der postextrasystolischen Pause bis zur nächsten herzschrittmacherinduzierten Herzaktion. Das folgende Intervall ist durch eine korrekt stimulierte Herzschrittmacheraktion begrenzt, worauf eine ventrikuläre Tachykardie beginnt. 34 Ergebnisse Abb. 3-12 SLS-Sequenz mit ventrikulärer Extrasystole (VES). Zunächst erfolgt durch den DDD-Herzschrittmacher eine Ventrikelstimulation (V). Danach entsteht aufgrund fehlender eigener Vorhofaktivität ein langes Intervall, so dass der Herzschrittmacher sowohl Vorhof (A) als auch Kammer (V) erregt. Kurz darauf eröffnet eine VES (kurzes Intervall) die ventrikuläre Tachykardie. Während der Tachykardie kann man Stimulationen des Herzschrittmachers erkennen, die durch ein Wahrnehmungsdefizit des Herzschrittmachers bedingt sind. Dies erhöht die Gefahr für eine sekundäre Auslösung von Kammerflimmern. Abb. 3-13 SLS-Sequenz durch ventrikuläre Extrasystole (VES) mit Herzschrittmacherbeteiligung. Auf eine reguläre Herzschrittmacheraktion (V) folgt eine VES (kurzes Intervall), darauf ist durch die postextrasystolische Pause ein langes Intervall zu erkennen, das durch eine Herzschrittmacher-stimulierte Aktion begrenzt wird. Durch eine weitere VES schließt sich ein kurzes Intervall an, das ein ventrikuläres Triplett auslöst. Der kausale Zusammenhang zwischen Herzschrittmacheraktion und Entstehung der VT besteht in diesem Beispiel darin, dass die stimulierte Herzaktion in die SLS-Sequenz eingebunden ist, auch wenn die beiden VES als Hauptursache der Arrhythmogenese angesehen werden müssen. 35 Ergebnisse Auch supraventrikuläre Extrasystolen sind an der Entstehung von Lang-kurzlang- bzw. Kurz-lang-kurz-Sequenzen beteiligt, wie die folgenden Beispiele zeigen: Abb. 3-14 LS-Sequenz durch eine supraventrikuläre Extrasystole (SVES) mit Herzschrittmacherbeteiligung. Das lange Intervall bildet der Zeitraum zwischen den beiden letzten Herzschrittmacheraktionen vor der SVES. Direkt im Anschluss an das kurze Intervall zwischen dem letzten herzschrittmacherinduziertem Herzschlag und der SVES beginnt eine ventrikuläre Tachykardie (VT), nachdem der Herzschrittmacher auf die P-Welle mit einer Kammererregung (V) reagiert hat. Die SVES, die mit der vorzeitigen Vorhoferregung (P) beginnt, kann spontan oder retrograd bedingt sein. Es entsteht in der Folge eine VT. Abb. 3-15 LS-Sequenz aufgrund einer vorzeitigen Vorhoferregung, die der Herzschrittmacher auf die Kammern überträgt. Die ersten drei Herzaktionen des Beispiels werden durch eine korrekte Stimulation von Vorhof und Kammer durch den Herzschrittmacher bestimmt. Das lange Intervall besteht zwischen den letzten beiden korrekten Herzschrittmacheraktionen. Eine frühzeitige selbstständige Vorhoferregung (P) mit darauffolgender Kammererregung durch den Herzschrittmacher bildet das kurze Intervall, auf welches eine ventrikuläre Tachykardie (VT) folgt. Das Ankopplungsintervall zwischen der Vorhoferregung (P) und der Stimulation durch den Herzschrittmacher erscheint sehr kurz für eine Übertragung. Da der zeitliche Abstand zwischen den vorhergehenden Herzschrittmacheraktionen länger ist als zwischen der letzten regulär stimulierten Aktion und dem der VT vorausgehenden Kammerspike, ist dennoch eine Übertragung der Vorhoferregung durch den Herzschrittmacher auf die Kammer anzunehmen. 36 Ergebnisse Im folgenden Beispiel eines Patienten mit absoluter Arrhythmie bei Vorhofflimmern ist der auslösende Mechanismus der ventrikulären Tachykardie nicht sicher zu klären. Abb. 3-16 LS-Sequenz bei Vorhofflimmern mit Herzschrittmacherbeteiligung. Es handelt sich hier um einen DDD-Herzschrittmacher ohne Mode-Switch mit wechselnder Vorhoferkennung. Abb. 3-17 SL-Sequenz bei Vorhofflimmern mit Herzschrittmacherbeteiligung. Auch hier ein DDDHerzschrittmacher ohne Mode-Switch mit wechselnder Vorhoferkennung. 3.2.3.3 Physiologisches Undersensing (Blanking) als Ursache für die Auslösung einer ventrikulären Tachykardie Ein typischer Auslösemechanismus für ventrikuläre Tachyarrhythmien bei Zweikammerschrittmachern besteht darin, dass ventrikuläre Extrasystolen exakt in die ventrikuläre Blankingzeit des Schrittmachers fallen. Nachdem der Schrittmacher einen Vorhofspike (A) abgegeben hat, ist der ventrikuläre Eingang für ca. 13 bis 40 msec blind geschaltet (Blankingzeit). Fällt in diese Phase eine ventrikuläre Extrasystole, so kann der Schrittmacher sie nicht registrieren, und die Kammerstimulation (V) erfolgt während der Erregungsrückbildung der Extrasystole. Wird hierbei in den aufsteigenden Teil der T-Welle (vulnerable Phase) stimuliert, so kann eine ventrikuläre Tachykardie entstehen. 37 Ergebnisse Die folgenden vier Beispiele verdeutlichen diesen Mechanismus: Abb. 3-18 Ventrikuläre Extrasystole (VES) während der Blankingzeit des Zweikammerschrittmachers als Ursache für die Entstehung der ventrikulären Tachykardie (VT). Abb. 3-19 Ventrikuläre Extrasystole (VES) während der Blankingzeit des Zweikammerschrittmachers als Ursache für die Entstehung der ventrikulären Tachykardie (VT). Abb. 3-20 Ventrikuläre Extrasystole (VES) während der Blankingzeit des Zweikammerschrittmachers als Ursache für die Entstehung der ventrikulären Tachykardie (VT). Möglicherweise liegt hier allerdings auch ein Fusionsschlag zwischen der VES und der Herzschrittmacheraktion als Auslöser der VT vor. 38 Ergebnisse Abb. 3-21 Ventrikuläre Extrasystole (VES) während der Blankingzeit des Zweikammerschrittmachers als Ursache für die Entstehung der ventrikulären Tachykardie (VT). 3.2.3.4 Stimulationsunabhängige Arrhythmieentstehung Abb. 3-22 Bei diesem Beispiel eines Herzschrittmacherpatienten mit absoluter Arrhythmie bei Vorhofflattern entsteht die ventrikuläre Tachykardie (VT) durch eine früh einfallende ventrikuläre Extrasystole (VES), ohne dass der Herzschrittmacher hier zur Entstehung beiträgt (keine Herzschrittmacheraktion erkennbar). Als Auslösemechanismus ist neben der früh einfallenden VES auch eine SLS-Sequenz, die aufgrund der absoluten Arrhythmie entsteht, denkbar. 3.2.3.5 Stimulationsassoziierte Arrhythmieentstehung Unter dem Begriff „stimulationsassoziierte Arrhythmieentstehung“ werden Mechanismen beschrieben, aufgrund derer ohne direkten Einfluss des Herzschrittmachers eine ventrikuläre Tachykardie auslöst wird. In den folgenden Fallbeispielen liegt bis zum Beginn der Rhythmusstörung keine Fehlfunktion des Schrittmachers vor. In Tabelle 3-1 sind die verschiedenen Schrittmacherfehlfunktionen zusammengefasst. Als typische Fehlfunktionen der Herzschrittmacheraggregate werden Wahrnehmungsdefizite (Undersensing, Oversensing), unangemessene Herzschritt- 39 Ergebnisse macherhemmungen v.a. durch Myopotentiale und Exitblockierungen bezeichnet. Andere Pathomechanismen, die unabhängig von der Tätigkeit des Schrittmachers auftreten, können ebenso zur Entstehung von ventrikulären Tachykardien führen. In diesen Situationen ist der Herzschrittmacher nicht ursächlich an der Entstehung der Arrhythmie beteiligt. Häufig konnten früh einfallende ventrikuläre Extrasystolen in den vorliegenden Fallbeispielen dokumentiert werden, durch die ventrikuläre Tachykardien ausgelöst wurden. Abb. 3-23 Der Zweikammerschrittmacher stimuliert regelgerecht. Durch eine früh einfallende ventrikuläre Extrasystole (VES) wird eine ventrikuläre Tachykardie (VT)ausgelöst. Abb. 3-24 Der Herzschrittmacher stimuliert korrekt. Nach der letzten Vorhofstimulation fällt eine ventrikuläre Extrasystole (VES) ein. Vom Herzschrittmacher wird im weiteren Verlauf keine Kammererregung abgegeben; die ventrikuläre Tachykardie (VT) beginnt direkt mit einer VES. Bei der zweiten im Bild sichtbaren Herzaktion ist ein Fusionsschlag zu erkennen, der allerdings vermutlich keinen direkten Einfluss auf die zwei Schläge später beginnende ventrikuläre Tachykardie (VT) hat. 40 Ergebnisse Abb. 3-25 Regelrechte Aktion des Zweikammerschrittmachers. Durch eine früh einfallende ventrikuläre Extrasystole (VES) wird die ventrikuläre Tachykardie (VT) ausgelöst. Bereits zwei Herzschrittmacheraktionen zuvor findet sich ein ventrikuläres Couplet. Abb. 3-26 Wieder wird die ventrikuläre Tachykardie (VT) durch eine früh einfallende ventrikuläre Extrasystole (VES) ausgelöst; die Herzschrittmacherfunktion ist bis dahin korrekt. Bei diesem Fallbeispiel handelt es sich um eine Langzeit-EKG-Dokumentation des gleichen Patienten wie in Abb. 3-25; die DDD-Programmierung wurde in eine AAI-Einstellung geändert. Da der AAI-programmierte Schrittmacher die VES nicht erkennt, stimuliert er auch während der VT weiter (A). 41 Ergebnisse Abb. 3-27 Korrekte Funktion des Zweikammerschrittmachers. Auslösung der ventrikulären Tachykardie (VT) durch eine früh einfallende ventrikuläre Extrasystole (VES). Abb. 3-28 In diesem Beispiel (Variante von Abb. 3-27) funktioniert der Zweikammerschrittmacher regelrecht, bis eine früh einfallende ventrikuläre Extrasystole (VES) die ventrikulären Tachykardie (VT) auslöst. Abb. 3-29 In diesem Beispiel (Variante von Abb. 3-27) liegt eine korrekte Herzschrittmacherfunktion bis zur Einleitung einer ventrikulären Tachykardie (VT) durch eine ventrikukäre Extrasystole (VES) vor. 42 Ergebnisse Abb. 3-30 Der Herzschrittmacher reagiert auf die eigenständigen Vorhoferregungen mit Kammerspikes. Bei nun fehlender Vorhofaktion fällt dabei der DDD-Schrittmacher zurück auf die Grundfrequenz. Bevor jedoch eine Zweikammerstimulation erfolgen kann, fällt eine ventrikuläre Extrasystole (VES) ein, mit der die ventrikuläre Tachykardie (VT) beginnt. Die Ursache liegt in der durch die Pause entstandenen SLSequenz. Abb. 3-31 In diesem Bespiel ist eine nicht korrekte Herzschrittmacherfunktion anzunehmen, da im Vorfeld der Tachykardie wiederholt Exit Blocks auftreten. Allerdings haben diese in Bezug auf die Entstehung der ventrikulären Tachykardie (VT) keine Bedeutung. Die Rhythmusstörung beginnt ohne Einwirkung des Herzschrittmachers mit einer früh einfallenden ventrikulären Extrasystole (VES). 43 Ergebnisse Abb. 3-32 Eine früh einfallende ventrikuläre Extrasystole (VES) löst die ventrikuläre Tachykardie (VT) aus. Der Herzschrittmacher stimuliert korrekt vor und nach der VT und hat keinen Einfluss auf die Entstehung der Rhythmusstörung. 44 Ergebnisse 3.3 Studie zur Erfassung ventrikulärer Tachykardien bei Schrittmacherpatienten (EVENTS) 3.3.1 Patientenkollektiv 3.3.1.1 Alters- und Geschlechtsverteilung Von den 231 in die Studie eingeschlossenen Patienten wurde bei 210 Patienten mindestens eine Follow-up-Untersuchung durchgeführt. Die für die Auswertung relevante Patientengruppe bestand aus diesen 210 Patienten. Die folgenden Zahlen beziehen sich auf dieses Patientenkollektiv. Hier war die Geschlechtsverteilung 58% männlich (121) und 42% weiblich (89). Das Durchschnittliche Alter in der Gruppe betrug 72,08 (+/- 10,11) Jahre. Das mittlere Follow-up-Intervall betrug 12,8 (+/- 4,9) Monate. Patienten-Zahl 151 31 28 210 Pat. mit >15 M -FU Pat. mit > 9 M -FU Pat. mit > 3 M -FU GESAMT Durchschnitts-FU Dauer 459,6 285,9 87,0 384,3 Tab. 3-2 Anzahl der Patienten bezogen auf die durchgeführten FUs und auf die durchschnittliche Beobachungsdauer in Tagen 3.3.1.2 Ejektionsfraktion Bei 194 Patienten wurde die Ejektionsfraktion entweder echokardiographisch oder angiographisch bestimmt. 9% der Patienten hatten eine reduzierte Ejektionsfraktion unter 35%, bei 91% war die Ejektionsfraktion größer als 35%. Der Mittelwert der Ejektionsfraktionen betrug 55,29% (+/- 15,32). 3.3.1.3 Implantationsindikationen Die Indikationen zur Herzschrittmacherimplantation waren folgendermaßen verteilt: Eine AV-Knotenerkrankung lag bei 84 Patienten (40%) vor. Unter dem Begriff Sinusknotenerkrankung werden das Sick-Sinus-Syndrom, der sinuatriale Block, ein Sinusarrest, chronotrope Inkompetenz und Bradykardie zusammengefasst. Dieses Krankheitsbild lag als Schrittmacherindikation bei 79 Personen (38%) vor. Eine 45 Kombination aus AV-Knotenerkrankung Ergebnisse und Sinusknotendefekt lag bei 30 Probanden (14%) vor. 17 Patienten (8%) ließen sich nicht einer dieser Gruppen zuteilen: Bei 2 Patienten (1%) wurden keine Angaben zum Rhythmus gemacht, 2 (1%) hatten einen normalen Sinusrhythmus, bei 8 Patienten (4%) wurde der Herzschrittmacher wegen Bradykardie/Tachykardie implantiert, Bradykardie/Tachykardie in Kombination mit Flattern/Flimmern war in 2 Fällen (1%) Indikation, bei 2 Patienten (1%) war Flattern/Flimmern der Grund und bei einem Patienten (0,5%) wurde sowohl Flattern/Flimmern als auch Sinusrhythmus angegeben. Insgesamt 30 der in die Studie aufgenommenen Patienten (14%) zeigten Schenkelbockbilder. 13 Patienten (6%) hatten einen Linksschenkelblock, 10 (5%) einen Rechtschenkelbock. Bei 5 Patienten (2%) war ein Rechtsschenkelblock in Kombination mit einem linksanteriorem Hemiblock (LAHB) bekannt. Ein isolierter LAHB lag bei 2 Patienten (1%) vor. AV- und Sinusandere Knoten8% Erkrankung 14% AV-KnotenErkrankung 40% Sinus-KnotenErkrankung 38% Abb. 3-33 Verteilung der Schrittmacherindikationen im Patientenkollektiv der EVENTS-Studie 3.3.1.4 Grunderkrankungen Die in der Anamnese bei Studieneinschluss registrierten Vorerkrankungen der Patienten verteilten sich wie folgt: 33 der 210 Patienten (16%), die mindestens eine FU durchlaufen haben, hatten keine Begleiterkrankungen. Koronare Herzerkrankung: Bei 78 Patienten (37%) wurde die Diagnose koronare Herzerkrankung (KHK) vermerkt. 32 Patienten (15%) hatten in der Anamnese einen manifesten Infarkt. Bei 4 Patienten war die Lokalisation unbekannt, 11 hatten einen isolierten 46 Ergebnisse Vorderwandinfarkt, 10 einen isolierten Hinterwandinfarkt, 3 Patienten hatten eine Kombination von VWI und HWI, 2 einen HWI in Kombination mit einem lateralen Infarkt, 1 Patient hatte einen anteroseptalen Infarkt. 19 Patienten (9%) wurden mit Angina Pectoris ohne vorangegangenen Infarkt in die Studie aufgenommen. Insgesamt wurde die Diagnose Angina Pectoris bei 27 Patienten gestellt, bei 6 zusätzlich mit einem VWI, bei je einem mit VWI/HWI und HWI. 25 der 78 KHK-Patienten (32%) wurden mit einem Beta-Blocker behandelt. Vorhofarrhythmien: Chronische Vorhofarrhythmien in der Anamnese waren als Ausschlusskriterium der EVENTS-Studie festgelegt. Vorhoftachykardien mit schneller ventrikulärer Antwort können ein Grund für sog. falsch-postitive EGM-Speicherungen sein. Der Herzschrittmacher kann eine Vorhoftachykardie mit schneller ventrikulärer Antwort bei Vorliegen eines atrialen Undersensings nicht von einer ventrikulären Tachykardie unterscheiden und triggert die EGM-Aufzeichnung [Nowak B, 1999; Nowak B, 2002]. Im Rahmen der EVENTS-Studie lag die Problematik im begrenzten Speicher der Herzschrittmacheraggregate. Durch die falsche Triggerung der EGMSpeicherung aufgrund von Vorhofarrhythmien wäre der Speicher des Herzschrittmachers gefüllt worden, so dass potentiell aufgetretene ventrikuläre Tachykardien zugunsten der falsch diagnostizierten atrialen Tachykardien gelöscht worden wären und der weiteren Analyse nicht in Form von EGM zur Verfügung gestanden wären. Intermittierendes Vorhofflattern bzw. Vorhofflimmern war bei einigen Patienten des Studienkollektivs im Vorfeld bekannt oder trat im Verlauf des Beobachtungszeitraums auf. Im Gegensatz zu den chronischen Verlaufsformen wurden die Patienten mit intermittierenden Vorhofarrhythmien in die Studie eingeschlossen. Die atrialen Rhythmusstörungen traten zum einen nur zeitlich begrenzt auf. Zum anderen konnten fälschlicherweise als ventrikuläre Tachykardien gespeicherte EGM durch die Analyse als Vorhoftachykardien diagnostiziert werden. Bei 23 Patienten (11 %) waren intermittierendes Vorhofflattern bzw. -flimmern anamnestisch vor Studieneinschluss bekannt. Bei 53 Patienten (25%) wurde während der Nachsorge intermittierendes/ permanentes Vorhofflattern bzw. -flimmern im EGM nachgewiesen. Bei 40 von diesen war dies beim Einschluss nicht bekannt gewesen. Bei 29 von diesen wurde 47 Ergebnisse Vorhofflattern/flimmern im EGM nachgewiesen, aber in keiner Zwischenanamnese erwähnt (6x bei 3 FUs, 7x bei 2 FUs, 16x bei 1 FU). Bei weiteren 20 Patienten (10%) kam es laut Zwischenanamnese während der Nachsorge zu neu aufgetretenem intermittierendem/permanentem Vorhofflattern bzw. -flimmern. Bei FU1 hatten 20 Patienten Vorhofflattern/flimmern ohne Erwähnung in der Zwischenanamnese, bei FU2 17, bei FU3 20. Bradykarde Rhythmusstörungen in der Anamnese: Bei 8 Patienten (4%) wurden bradykarde Rhythmusstörungen in der Anamnese als Begleiterkrankung angegeben, wobei nur bei einem Patienten dies die einzige Begleiterkrankung war. 7 hatten zusätzlich einen Hypertonus, 2 von diesen mit KHK, einer mit KHK und ventrikulären Tachykardien. Ventrikuläre Tachykardien: 10 Patienten (5%) litten unter ventrikulären Tachykardien in der Anamnese als Begleiterkrankung. Bei diesen handelte es sich ausnahmslos um nicht anhaltende ventrikuläre Tachykardien. Bei 7 von diesen Patienten lag eine bekannte koronare Herzerkrankung vor. Arterielle Hypertonie: 101 Patienten (48%) mit arterieller Hypertonie wurden in die Studie eingeschlossen. Davon litten 34 zusätzlich unter einer koronaren Herzerkrankung, 3 an einer koronaren Herzerkrankung und an einer Kardiomyopathie. 2 Patienten hatten zusätzlich zur arteriellen Hypertonie eine Kardiomyopathie. Arteriosklerose: 24 der 210 Patienten (11%), die in die Studie eingeschlossen wurden, hatten als Begleiterkrankung eine Arteriosklerose. 17 von diesen litten zusätzlich an arterieller Hypertonie, davon 10 in Kombination mit einer koronaren Herzerkrankung. Arteriosklerose und koronaren Herzerkrankung ohne Hypertonie kam als Grunderkrankung in 3 Fällen vor. 48 Ergebnisse Kardiomyopathie: 14 Patienten (7%) mit einer Kardiomyopathie als Vorerkrankung nahmen an der Studie Teil. Darunter waren 2 Patienten mit einer koronaren Herzerkrankung, 3 mit koronarer Herzerkrankung und Hypertonie, sowie 2 mit Hypertonie ohne koronare Herzerkrankung. 7 der Patienten mit Kardiomyopathie hatten eine Ejektionsfraktion von kleiner/gleich 35%, 2 davon zusätzlich mit koronarer Herzerkrankung. Bei 3 Patienten lag eine Kardiomyopathie ohne koronare Herzerkrankung, Hypertonus oder einer Ejektionsfraktion von weniger als 35% vor. Kongestive Herzerkrankung: 8 Patienten (4%) mit einer kongestiven Herzerkrankung wurden in die Studie aufgenommen. Zerebrovaskuläre Erkrankung: 15 Patienten (7%) litten an einer zerebrovaskulären Erkrankung, davon 5 zusätzlich an einer koronaren Herzerkrankung und Hypertonie, 2 an einer koronaren Herzerkrankung und 5 an Hypertonie. Diabetes mellitus: 30 Patienten (14%) mit der Diagnose Diabetes mellitus wurden in die Studie aufgenommen. MADIT-I-Risikofaktoren: Zustand nach Infarkt, nicht anhaltende ventrikuläre Tachykardien und eine Ejektionsfraktion von kleiner/gleich 35% sind laut der MADIT I Studie Risikofaktoren für die Entwicklung von malignen ventrikulären Tachykardien [Moss AJ et al., 1996]. Insgesamt wurden 52 Patienten (25%) in die EVENTS-Studie aufgenommen, bei denen eine oder mehrere der o.g. Risikofaktoren als Begleiterkrankung bekannt waren. Das Auftreten der einzelnen Risikofaktoren oder deren Kombination verdeutlicht das folgende Diagramm. Bei 4 Patienten (2%) lag das Risikoprofil komplett vor. 49 Ergebnisse 180 158 160 140 120 100 80 60 40 21 17 20 3 4 Z.n.Inf. + nsVT Z.n.Inf. + nsVT + EF<=35% 0 Z.n.Inf. 3 0 nsVT + EF<=35% EF<=35% nsVT 4 Z.n.Inf. + EF<=35% keine Risikofaktoren Abb. 3-34 Verteilung der MADIT-I-Risikofaktoren im Patientenkollektiv der EVENTS-Studie 3.3.1.5 Medikation Im Studienprotokoll erfasst wurden nur die kardial bedeutsamen Wirkstoffe: Klasse-I-Antiarrhythmika, Beta-Blocker, Sotalol und Amiodaron.123 Patienten (59%) erhielten keine kardial relevante Medikation. 41 Patienten (20%) wurden mit einem Beta-Blocker therapiert, 9 Patienten (4%) mit Amiodaron, 5 Patienten (2%) sowohl mit einem Beta-Blocker und mit Amiodaron. Sotalol alleine nahmen 20 Patienten (10%) ein, 2 Patienten (1%) erhielten Sotalol in Kombination mit einem Klasse IAntiarrhythmikum. 50 Ergebnisse 140 123 120 100 80 60 41 40 20 20 9 5 2 0 keine Medikation ß-Blocker Sotalol Amiodaron Amiodaron + Sotalol + Kl.Iß-Blocker AA Abb. 3-35 Kardiale Medikation im Patientenkollektiv der EVENTS-Studie 3.3.2 Analyse der in den Herzschrittmacheraggregaten gespeicherten Informationen Die in der EVENTS-Studie verwendeten Herzschrittmachermodelle konnten maximal acht intrakardiale EGM zu je fünf Sekunden aufzeichnen. Neben den Informationen, die aus der Analyse der EGM gewonnen wurden, stand noch die Speicherfunktion der Histogramme und Zähler für die Zugangsspeicherdatenauswertung zur Verfügung. 3.3.2.1 Auswertung der Elektrogramme In einem mittleren Follow-up-Zeitraum von 12,8 +/- 4,9 Monaten wurden insgesamt 3263 Elektrogramme (EGM) dokumentiert. Von 342 EGM lag kein verwertbarer Ausdruck mehr vor und auf 401 EGM fanden sich Artefakte. 2520 EGM wurden in Hinblick auf die bestehende Rhythmusstörung untersucht. Eine VT wurde als bewiesen klassifiziert, wenn im EGM mindestens 3 schnelle ventrikuläre Zyklen ohne vorausgehende Vorhofaktionen zu sehen waren. Zusammen mit den 4 TriggerVES, die die EGM-Aufzeichnung auslösten, galt die Diagnose VT als gesichert. Die 51 Ergebnisse folgende Abbildung stellt die diagnostizierten Befunde der 2520 analysierten EGM dar: V oversensing 0,8% PMT 0,0% A undersensing V.a. VT VT without Onset 0,6% 5,4% 0,0% AF 17,3% VT with Onset 2,7% PVC/Couplets 5,2% SVT 24,5% without diagnostic finding 43,6% Abb. 3-36 Diagnosen bei 2520 analysierten Elektrogrammen Insgesamt wurden 1098 EGM (44%) aufgezeichnet, auf denen keine diagnostischen Befunde zu finden waren. Bei 617 EGM (25%) waren supraventrikuläre Tachykardien der Trigger zur EGM-Speicherung. Vorhofflattern lag in 437 Fällen (17%) vor. Ventrikuläres Oversensing fand sich in 20 EGM (1%), für atriales Undersensing und PMT (pacemaker mediated tachycardia) gab es keine Beispiele. 16 EGM (1%) wurden als Verdacht auf eine ventrikuläre Tachykardie (VT) klassifiziert. 135 EGM (5%) waren dokumentierte VT ohne Onset. In 67 Fällen (3%) lag die Einschränkung VT nur mit Onset (VT unter Einbezug der 4 Trigger VES) vor. Einzelne vorzeitige ventrikuläre Extrasystolen (VES) sowie Couplets fanden sich 130 mal (5%). Die 135 VT, die auch ohne den Onset als solche bewiesen sind, wurden im Hinblick auf Dauer und Frequenz in 4 Gruppen eingeteilt. VT mit 3 bis 10 Zyklen sowie mit mehr als 10 Zyklen wurden zusammengefasst. Die Frequenzbereiche wurden von 120 bis 180 Schläge min-1und schneller als 180 Schläge min-1 festgelegt. Es fanden sich 57 VT (42%) mit einer Frequenz zwischen 120 und 180 Schlägen min-1 und einer Länge von 3 bis 10 Zyklen und 45 VT (33%) mit derselben Frequenz 52 Ergebnisse und einer Dauer von mehr als 10 Schlägen. Bei den erwiesenen VT ohne Onset mit Frequenzen von über 180 Zyklen min-1 fanden sich 12 Fälle (9%) mit 3 bis 10 Zyklen und 21 Fälle (16 %) mit mehr als 10 Schlägen. 60 57 50 45 Number of VTs [n] 40 30 21 20 12 10 0 3-10 Cycles, 120-180/min >10 Cycles, 120-180/min 3-10 Cycles, >=180/min >10 Cycles, >=180/min VT rate, duration Abb. 3-37 Einteilung der 135 VT ohne Onset nach Frequenz und Dauer Die folgenden Abbildungen zeigen Elektrogramme, die in der EVENTS-Studie aufgezeichnet und ausgewertet wurden: Abb. 3-38 nicht anhaltende ventrikuläre Tachykardie 53 Ergebnisse In Abbildung 3.38 erkennt man am Anfang der Aufzeichnung in der unteren Ableitung fünf schnelle ventrikuläre Extrasystolen (VES), die nicht an die Vorhofaktionen (obere Ableitung) gekoppelt sind. Die darauf folgenden vier Kammerkomplexe sind wieder vom Vorhof gesteuert. Daher sind die Aktionen in der unteren Ableitung im Vergleich zu den Vorhoferregungen zeitlich leicht verzögert. In der Abbildung sind alle Aktionspotentiale vom Herzen selbst erzeugt und vom Herzschrittmacher nur detektiert. Im vorliegenden Beispiel ist keine Herzschrittmacherstimulation zu sehen. Vom Herzschrittmacher stimulierte Aktionen haben im Gegensatz zu den hier sichtbaren großen Ausschlägen sehr flache Amplituden in intrakardial aufgezeichneten EGM (Siehe Abbildung 3.40). Abb. 3-39 anhaltende ventrikuläre Tachykardie In diesem Elektrogramm (Abbildung 3.39) ist in der Kammerableitung eine ununterbrochene Reihe von schrittmacherdetektierten ventrikulären Extrasystolen (VES) zu sehen. Der Vorhof schlägt regelmäßig selbstständig, der Herzschrittmacher übt wie in Abbildung 3.38 rein detektive Aufgaben aus. Abb. 3-40 4er-Salve 54 Ergebnisse Die ersten vier sichtbaren Kammerkomplexe (untere Ableitung) in Abbildung 3.40 zeigen keine zeitliche Bindung an die Aktionen des Vorhofs (obere Ableitung) und sind daher als ventrikuläre Extrasystolen zu werten. Sowohl die drei Vorhof- als auch die vier Kammerkomplexe zeigen große Ausschläge und sind somit vom Herzschrittmacher detektiert. Im Anschluss an diese Episode wird der erste kleine Kammerkomplex zeitlich an den dritten Vorhofschlag angekoppelt. Hier detektiert der Herzschrittmacher die Vorhofaktion und stimuliert in der Kammer. Die darauffolgenden Vorhof- und Kammerschläge mit kleinen Ausschlägen sind herzschrittmachergesteuert. Im Gegensatz zu den beiden oben beschriebenen Beispielen übt der Herzschrittmacher hier nach der ventrikulären Tachykardie seine antibradykarde Funktion aus. 3.3.2.2 Histogramme und Zähler Aus den Histogrammen und Zählern des Schrittmacherspeichers kann man den Anteil an ventrikulär stimulierten Schrittmacheraktionen (Vpace) ablesen. Bei den FUs mit nachgewiesenen ventrikulären Tachykardien betrug der Anteil ventrikulärer Stimulation im Schnitt 88%, bei den FUs ohne VT im Schnitt 85%. 89% der Patienten hatten VT-Detektionen in den Zählern des Schrittmachers. Bei 41% wurden 0 bis 100 VT gezählt , bei 29% 100 bis 1000 VT und bei 19% waren mehr als 1000 VT im Speicher. Bei FUs, in denen durch die EGM-Analyse VT nachgewiesenen wurden, fanden sich im Schnitt 837 VT-Detektionen pro FU in den Zählern. Bei FUs ohne VT (in denen die EGM-Analyse negativ ausfiel) waren im Schnitt 1048 VT-Detektionen in den Zählern. Die Auswertung konnte nur für die FUs durchgeführt werden, von denen ein Ausdruck der Histogramme und Zähler vorlag. 55 Ergebnisse 3.3.3 Patienten mit erwiesenen ventrikulären Tachykardien 3.3.3.1 Alters- und Geschlechtsverteilung Bei 54 Patienten der 210 Patienten des Studienkollektivs (26%), die mindestens eine FU durchlaufen haben, konnte anhand der gespeicherten Elektrogramme eine oder mehrere Episoden einer ventrikulären Tachykardie nachgewiesen werden. Von diesen 54 Patienten waren 19 Patienten (35%) weiblich, 35 (65%) männlich. Der Altersdurchschnitt lag bei 73,6 Jahren. 3.3.3.2 Ejektionsfraktion Bei 4 Patienten von 54 Patienten mit erwiesenen ventrikulären Tachykardien (7%) wurde die Ejektionsfraktion nicht bestimmt. 3 Patienten (6%) hatten eine reduzierte linksventrikuläre Pumpfunktion kleiner/gleich 35%. Bei 47 Patienten (94%) war die Ejektionsfraktion grösser 35%. Die durchschnittliche Ejektionsfraktion lag bei 58,20% (+/- 15,04%). EF nicht best. 7% EF<=35% 6% EF>35% 87% Abb. 3-41 Darstellung der Ejektionsfraktionen bei den Patienten mit erwiesenen ventrikulären Tachykardien im Hinblick auf die MADIT-I-Kriterien (>= 35%). 3.3.3.3 Implantationsindikationen Von den 54 Patienten mit erwiesenen ventrikulären Tachykardien erhielten 29 Patienten (53%) den Herzschrittmacher aufgrund einer AV-Knotenerkrankung und 14 Patienten (26%) wegen einer Sinus-Knotenerkrankung. Bei 8 Patienten (15%) lag eine Kombination von AV- und Sinus-Knotenerkrankung vor. 3 Patienten (6%) wiesen andere Herzschrittmacherindikationen auf. Je einer zeigte Flattern/Flimmern in Kombination mit Bradykardie/Tachykardie, ein trifaszikuläres Blockbild (LAHB + RSB) sowie einen normalen Sinusrhythmus. 56 Ergebnisse Insgesamt 9 Patienten (17%) wiesen Schenkelblockbilder auf. Bei je 3 Patienten (6%) lag ein Links- bzw. Rechtschenkelblock oder ein Rechtsschenkelblock in Kombination mit einem linksanteriorem Hemiblock vor. Sinus-KnotenErkrankung 26% AV- und SinusKnotenErkrankung 15% andere 6% AV-KnotenErkrankung 53% Abb. 3-42 Verteilung der Schrittmacherindikationen bei Patienten mit erwiesenen ventrikulären Tachykardien 3.3.3.4 Grunderkrankungen 8 Patienten (15%) aus der Gruppe mit erwiesenen ventrikulären Tachykardien (54 Patienten) hatten keine Begleiterkrankungen in der Anamnese. Koronare Herzerkrankung: 17 der 54 Patienten (32%) mit erwiesenen ventrikulären Tachykardien hatten eine bekannte koronare Herzerkrankung . Bei 6 Patienten (11%) war ein Infarkt in der Vorgeschichte bekannt. 3 Patienten hatten einen isolierten Vorderwandinfarkt erlitten, 2 einen isolierten Hinterwandinfarkt und ein Patient wies sowohl einen Vorderwandinfarkt als auch einen Hinterwandinfarkt in der Anamnese auf. Neben 2 Infarktpatienten gaben noch 7 weitere Angina Pectoris als Beschwerde an. Ventrikuläre Tachykardien: 3 von 54 Patienten (6%) wiesen nicht anhaltende ventrikuläre Tachykardien in der Anamnese auf, 2 von diesen mit bekanntem Infarkt in der Vorgeschichte. Arterielle Hypertonie: Von den 54 Patienten mit erwiesenen ventrikulären Tachykardien in den gespeicherten Elektrogrammen war bei 28 Patienten (52%) ein arterieller Hypertonus bekannt. 57 Ergebnisse Weitere Nebenerkrankungen: Desweiteren fanden sich in der Gruppe mit erwiesenen ventrikulären Tachykardien (54 Patienten) 2 Patienten (4%) mit bradykarden Rhythmusstörungen, 7 Personen (13%) mit Arteriosklerose, 2 Patienten (4%) mit Kardiomyopathie, 1 Patient (2%) mit kongestiver Herzerkrankung, 7 Patienten (13%) mit einer zerebrovaskulären Erkrankung und 9 Patienten (17%) mit Diabetes mellitus. MADIT-I-Risikofaktoren: Zu den MADIT-I-Risikofaktoren zählen, wie oben beschrieben, Zustand nach Infarkt, eine linksventrikuläre Ejektionsfraktion unter 35% und nicht anhaltende ventrikuläre Tachykardien [Moss AJ et al., 1996]. Von den 54 Patienten mit erwiesenen ventrikulären Tachykardien (nsVT) hatten 45 (83%) keinen Infarkt in der Vorgeschichte, eine Ejektionsfraktion von größer 35% und keine bekannten nicht anhaltenden ventrikulären Tachykardien in der Anamnese. 1 Patient (2%) hatte sowohl einen Zustand nach Infarkt als auch eine reduzierte linksventrikuläre Pumpfunktion, zwei (4%) eine Ejektionsfraktion kleiner/gleich 35% ohne Zustand nach Infarkt und ohne nsVTs. 3 Patienten (6%) hatten eine gute Pumpfunktion kombiniert mit Zustand nach Infarkt ohne nsVTs. 2 Patienten (4%) litten bei guter Pumpfunktion des Ventrikels sowohl an nsVTs und hatten in der Vorgeschichte einen Infarkt durchgemacht. Bei 1 Patienten (2%) lagen von den bekannten Risikofaktoren nur nsVts vor. Das gesamte Risikoprofil mit allen 3 Faktoren fand sich bei keinem der Patienten mit erwiesenen ventrikulären Tachykardien. 58 Ergebnisse 50 45 45 40 35 30 25 20 15 10 5 3 2 1 2 1 0 T ns V VT f.+ ns VT ns 35 % +Z . n. In Z. n. In f.+ Z. n. In f. 5% =3 EF < EF In f. + EF <= Z. n. ke in e R is ik o fa k <= 35 % to re n 0 Abb. 3-43 Verteilung der MADIT-I-Risikofaktoren bei Patienten mit erwiesenen ventrikulären Tachykardien 3.3.3.5 Medikation Von den 54 Patienten, bei denen in der Studie ventrikuläre Tachykardien nachgewiesen werden konnten, wurden 12 Patienten (22%) mit einem Beta-Blocker behandelt, 7 von diesen wiesen eine Erkrankung der Herzkranzgefässe auf. 8 Patienten (15%) erhielten Sotalol, von denen für 2 in der Anamnese eine koronare Herzerkrankung angegeben wurde. Sotalol 15% ß-Blocker 22% keine Medikation 63% Abb. 3-44 Kardiale Medikation bei Patienten mit erwiesenen ventrikulären Tachykardien 59 Ergebnisse 3.3.3.6 Verteilung der 135 dokumentierten ventrikulären Tachykardien Die folgende Abbildung zeigt die Verteilung der dokumentierten ventrikulären Tachykardien auf die 54 Patienten, bei denen VT nachgewiesen wurden: 25 23 20 15 12 10 6 5 5 4 1 0 1 Ereignis 2 0 1 2 3 4 5 6 7 8 9 Ereignisse Ereignisse Ereignisse Ereignisse Ereignisse Ereignisse Ereignisse Ereignisse Abb. 3-45 Anzahl der dokumentierten ventrikulären Tachykardien pro Patient Bei 14 Patienten der 54 Patienten (26%) wurden 4 oder mehr Episoden ventrikulärer Tachykardien nachgewiesen. 40 Patienten (74%) zeigten maximal 3 Ereignisse, die als ventrikuläre Tachykardien verifiziert wurden. Die folgende Tabelle zeigt die Aufnahmebefunde der in höherem Maße (mehr als 3 Ereignisse, schnelle VT mit mehr als 10 Zyklen) von ventrikulären Tachykardien betroffenen Patienten. alle Patienten Geschlecht Alter EF Patienten mit Patienten mit Patienten mit VTmind. 1 dok. VT mehr als 3 dok. Frequenzen über VT 180 min-1 und mehr als 10 Zyklen männlich: 58% männlich: 65% männlich 79% männlich 60% 72,08 Jahre (+/73,6 Jahre (+/72,29 Jahre (+/74,84 Jahre (+/10,11) 8,51) 9,00) 9,18) 55,29% (+/- 15,32) 58,20% (+/- 15,04) 55,92% (+/- 13,80) 57,24% (+/- 15,61) AV-Block SSS beides andere 40% 38% 14% 8% 53% 26% 15% 6% 57% 14% 29% 0% 50% 25% 20% 5% KHK Z.n. Infarkt VT bekannt Hypertonus Kardiomyopathie 37% 15% 5% 48% 7% 32% 11% 6% 52% 4% 43% 14% 14% 36% 0% 20% 5% 0,5% 60% 0,5% Tabelle 3-3 Patienten der EVENTS-Studie 60 Diskussion 4 Diskussion Der plötzliche Herztod während Herzschrittmachertherapie ist ein seit langem bekanntes Problem bei der Behandlung bradykarder Herzrhythmusstörungen und gehört noch immer zu den Haupttodesursachen der Patienten mit implantiertem Herzschrittmacher [Jordaens L, 1995]. Ein Großteil der plötzlichen Todesfälle unter Herzschrittmachertherapie wird auf das Fortschreiten der kardialen Grunderkrankung der Patienten zurückgeführt. Darüber hinaus gibt es in der Literatur dokumentierte Beispiele einer Interaktion von Herzeigenaktionen und Schrittmacherstimulationen, die zur Entstehung ventrikulärer Tachykardien führen können [Böhm A et al., 1998; Eberle F et al., 1979; Kalmar P et al., 1975; Karbenn U et al., 1989; Lew WY et al., 1989; Madsen GM et al., 1989; Maendely R et al., 1987; Oupadia P et al., 1998; Scheibelhofer W et al., 1982b; Scheibelhofer W et al., 1982a; Zehender M et al., 1992; Zehender M et al., 1994; Zehender M et al., 1999]. Da diese Interaktionen potentiell vermeidbare Ursachen des plötzlichen Herztodes während Schrittmachertherapie darstellen, sind Erkenntnisse über die Häufigkeit des plötzlichen Herztodes und das Auftreten ventrikulärer Tachykardien bei Herzschrittmacherpatienten ebenso wie die Charakterisierung bestimmter Auslösemechanismen der Arrhythmieentstehung unter Elektrostimulation des Herzens von besonderem Interesse. In Rahmen der vorliegenden Arbeit wurde versucht, sich der Fragestellung des plötzlichen Herztodes während permanenter Schrittmachertherapie des Herzens mit drei verschiedenen Ansätzen zu nähern: 1. Quantitative Erfassung des plötzlichen Herztodes im Patientenkollektiv der Herzschrittmacherambulanz des Universitätsklinikums Freiburg in den Jahren 2000 und 2001 2. Analyse der Auslösemechanismen dokumentierter ventrikulärer Tachyarrhythmien unter Herzschrittmachertherapie 3. Prospektive Langzeitstudie zur Häufigkeit ventrikulärer Tachyarrhythmien bei Herzschrittmacherpatienten (EVENTS) mit intrakardialer EKG-Speicherung 61 Diskussion 4.1 Häufigkeit des plötzlichen Herztodes unter Herzschrittmachertherapie Seit den siebziger Jahren des zwanzigsten Jahrhunderts wurden in der Literatur zahlreiche Untersuchungen zur Häufigkeit des plötzlichen Herztodes unter Herzschrittmachertherapie veröffentlicht [Billoret A et al., 1978; Breivik K et al., 1980; Fauchier JP et al., 1971; Geddes JS et al., 1978; Hager W, 1974; Hua G et al., 1970; Mattioli AV et al., 1995; Moser T, 1987; Permutti B et al., 1976; Seipel L et al., 1977; Shen WK et al., 1994; Siddons H, 1974; Simon AB et al., 1982; Steinbach K et al., 1978; Steinbach K et al., 1995; Strata G et al., 1979; Tung RT et al., 1994; Zehender M et al., 1992]. Die folgende Tabelle gibt eine Übersicht über die Ergebnisse dieser Erhebungen: Literatur Häufigkeit plötzlicher Tode Hua et al. 1970 31% Fauchier et al. 1971 26% Hager et al. 1974 20% Siddons 1974 23% Permutti et al. 1976 20% Seipel et al. 1977 12% Steinbach et al. 1978 14% Billoret et al. 1978 17% Strata et al. 1979 18% Geddes et al. 1979 19% Breivik et al. 1980 20% Simon et al. 1982 21% Moser 1987 20% Zehender et al. 1992 23% Mattioli et al. 1992 19% Tung et al. 1994 18 %DDD 21% VVI Shen et al. 1994 13% Steinbach et al. 1995 8-10% Tab. 4-1 Studien zur Häufigkeit plötzlicher Todesfälle unter Herzschrittmachertherapie Entsprechend diesen Untersuchungen liegt die Wahrscheinlichkeit, während der Behandlung mit einem Herzschrittmacher an einem plötzlichen Herztod zu versterben, zwischen 10% und 31%. Mit einem Anteil von 12% plötzlichen Herztoden unter den in den Jahren 2000 und 2001 verstorbenen Patienten der Herz- 62 Diskussion schrittmacherambulanz des Universitätsklinikums Freiburg liegt das Ergebnis durchaus im Erwartungsspektrum, wenn auch im unteren Bereich der Ergebnisse bereits vorliegender Studien. Moser wies in seiner Dissertation, bei der in gleicher Weise vorgegangen wurde wie in der vorliegenden Arbeit, einen Anteil von 20% plötzlicher Tode unter 242 verstorbenen Herzschrittmacherpatienten nach [Moser T, 1987]. Die im Vergleich zu den vorliegenden Studien geringere Häufigkeit plötzlicher Todesfälle unter Herzschrittmachertherapie bei den Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg könnte durch technische Weiterentwicklungen in der Schrittmachertechnologie bedingt sein: In den neunziger Jahren hat sich die Verwendung von Zweikammersystemen zunehmend durchgesetzt. Wurden 1993 in Deutschland noch bei 30% der Herzschrittmacherimplantationen Zweikammersysteme eingesetzt [Irnich W et al., 1994], so betrug deren Anteil 2001 60% [Markewitz A, 2002]. 40% der plötzlich verstorbenen Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg in den Jahren 2000 und 2001 waren mit einem DDDHerzschrittmachersystem versorgt. In der Arbeit von Moser aus dem Jahr 1987 waren es 4% [Moser T, 1987]. Zehender et al. hatten einen Anteil von 6% DDDHerzschrittmacherpatienten in ihrer Studie [Zehender M et al., 1992]. Der im Vergleich zu Moser (20% plötzliche Todesfälle unter Herzschrittmachertherapie) und Zehender et al. (23% plötzliche Todesfälle unter Herzschrittmachertherapie) geringere Anteil plötzlicher Todesfälle unter Herzschrittmachertherapie bei Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg in den Jahren 2000 und 2001 (12%) könnte zu der Vermutung Anlass geben, dass die häufigere Verwendung von Zweikammersystemen hierfür von Bedeutung ist. Dem widersprechen zwei in den letzten Jahren veröffentlichten Studien, die die Zweikammerstimulation mit ventrikulärer Stimulation verglichen: Die CTOPP-Studie konnte keinen Vorteil der physiologischen Stimulation (AAI, DDD) gegenüber der ventrikulären Stimulation (VVI) im Hinblick auf Tod durch kardiovaskuläre Ursachen nachweisen [Connolly SJ et al., 2000]. Ebenso zeigte sich in der DAVID-Studie kein klinischer Vorteil der Zweikammerstimulation gegenüber der ventrikulären Stimulation bei Patienten mit einem implantierbaren Kardioverter Defibrillator bezüglich der Lebenserwartung [Wilkoff BL et al., 2002]. Allerdings könnte der beschriebene geringere Anteil plötzlicher Todesfälle im Rahmen der Herzschrittmachertherapie 63 Diskussion unabhängig vom Stimulationsort durch technische Weiterentwicklungen in der Herzschrittmachertechnik (Sensing, Elektroden) bedingt sein. Hinweise auf mögliche Ursachen der plötzlichen Todesfälle unter permanenter Schrittmachertherapie des Herzens konnten durch zwei Ansätze gewonnen werden: 1. Analyse des Risikopatientenkollektivs 2. Charakterisierung der arrhythmieauslösenden Mechanismen Die Analyse des Herzschrittmacherpatientenkollektivs, das von ventrikulären Tachykardien und dem plötzlichen Herztod betroffen ist, kann Aufschluss über prädisponierende Faktoren geben. Im Rahmen dieser Arbeit wurden die Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg, die in den Jahren 2000 und 2001 am plötzlichen Herztod verstorben sind, untersucht. Hinzu kam die Analyse und Auswertung der EVENTS-Studie mit von ventrikulären Tachykardien betroffenen Herzschrittmacherpatienten. Durch die Charakterisierung mittels Langzeit-EKG dokumentierter Fallbeispiele ventrikulärer Arrhythmien unter Herzschrittmachertherapie konnten verschiedene Auslösemechanismen der Arrhythmogenese dargestellt werden. 4.2 Studie zur Erfassung ventrikulärer Tachykardien bei Herzschrittmacherpatienten (EVENTS) Die Studie zur Erfassung ventrikulärer Tachykardien bei Herzschrittmacherpatienten (EVENTS), als Bestandteil der im Rahmen dieser Arbeit durchgeführten Untersuchungen, ermöglichte es, das Auftreten ventrikulärer Rhythmusstörungen in einem Kollektiv von Patienten mit permanenter Herzschrittmachertherapie quantitativ zu erfassen. Darüber hinaus wurden die Arrhythmien anhand gespeicherter intrakardialer Elektrogramme analysiert. 4.2.1 Häufigkeit ventrikulärer Tachykardien im Patientenkollektiv der EVENTS-Studie Bei 54 von 210 in der EVENTS-Studie untersuchten Patienten (26%) wurden ventrikuläre Tachykardien anhand der gespeicherten intrakardialen EGM nach- 64 Diskussion gewiesen. Diese Beobachtung deckt sich mit den Ergebnissen der Studie von Brandes et al. zur Spontanvariabilität ventrikulärer Rhythmusstörungen bei Herzschrittmacherpatienten. Dort wurden bei 24% der untersuchten Patienten ventrikuläre Arrhythmien der Lown-Klasse IVB (ventrikuläre Salven) mittels Langzeit-EKG nachgewiesen [Brandes A et al., 1996]. Untersuchungen zur Spontanvariabilität ventrikulärer Arrhythmien bei herzgesunden Patienten zeigten, dass ventrikuläre Salven und Tachykardien bei 4% bis 5% der gesunden Bevölkerung beobachtet werden können [Bethge K-P, 1982; Meinertz T et al., 1983]. Demnach treten ventrikuläre Tachykardien im Herzschrittmacherpatientenkollektiv deutlich häufiger als bei Herzgesunden auf. 4.2.2 Charakterisierung und Interpretation der dokumentierten Herzrhythmusstörungen Die EVENTS-Studie basierte auf der Analyse von intrakardialen Elektrogrammen, die von den Herzschrittmachern gespeichert wurden. Die Charakterisierung intrakardialer Elektrogramme lässt keine morphologischen Interpretationen zu. Ventrikuläre Tachykardien können anhand von Elektrogrammen diagnostiziert und bezüglich Dauer und Frequenz bewertet werden. Im Rahmen der Auswertung der Ergebnisse der EVENTS-Studie müssen auch die diagnostischen Fähigkeiten der verwendeten Herzschrittmacher diskutiert werden. 4.2.2.1 Analyse der dokumentierten ventrikulären Tachykardien 135 von insgesamt 2520 analysierten EGM konnten als bewiesene ventrikuläre Tachykardien klassifiziert werden. Somit erfüllten 5% der von den Herzschrittmachern als ventrikuläre Tachykardien eingeordneten Rhythmus- störungen die Kriterien für die Diagnose VT ohne Onset (mindestens drei schnelle ventrikuläre Zyklen ohne vorhergehende Vorhofaktionen im dokumentierten ventrikulären Tachykardien wurden im Hinblick auf Frequenz in vier Gruppen eingeteilt: EGM). Die Dauer und 65 I. Diskussion VT mit 3 bis 10 Zyklen und einer Frequenz zwischen 120 und 180 min-1 II. VT mit mehr als 10 Zyklen und einer Frequenz zwischen 120 und 180 min-1 III. VT mit 3 bis 10 Zyklen und einer Frequenz größer/gleich 180 min-1 IV. VT mit mehr als 10 Zyklen und einer Frequenz größer/gleich 180 min-1 III 9% IV 16% I 42% II 33% Abb. 4-1 Verteilung der VT ohne Onset nach Frequenz und Dauer Die Gruppen IV beinhaltet schnelle anhaltende Formen ventrikulärer Tachykardien, die als potentiell maligne angesehen werden können. 20 Patienten der 54 Patienten mit erwiesenen ventrikulären Tachykardien (37%) zeigten gefährliche Formen ventrikulärer Tachykardien. Ihr Anteil am Gesamtkollektiv der Studie betrug 10%. 4.2.2.2 Einschränkungen der diagnostischen Fähigkeiten der Herzschrittmachermodelle Die Verwendung diagnostischer Funktionen wie der Elektrogramm- Speicherung bei neueren Generationen von Herzschrittmachern hat sich in der Praxis bewährt [Huikuri H, 2000; Israel CW et al., 2000; Nowak B, 1999]. Dennoch bestehen Einschränkungen in Bezug auf die diagnostischen Aussagemöglichkeiten vor allem bei Herzschrittmachern ohne die Möglichkeit zu Onset-Aufzeichnung und Marker-Beschriftungen. Diese Funktionen stehen bei 66 Diskussion neuesten Herzschrittmachermodellen zur Verfügung. Besonders die Beurteilung gespeicherter Elektrogramme wird dadurch verbessert. Nowak et al. zeigten, dass diese Funktionen für eine optimale Analyse der gespeicherten Elektrogramme notwendig sind. Nur 30% der in ihrer Studie gespeicherten Elektrogramme konnten ohne Onset-Aufzeichnung und Marker-Beschriftungen bezüglich der vom Herzschrittmacher gestellten Diagnose bestätigt werden. Bei 61% der Elektrogramme, die ohne diese Funktionen keinen diagnostischen Befund zeigten, wurde mit Hilfe von OnsetAufzeichnung und Marker-Beschriftungen die zugrundeliegende Arrhythmie identifiziert [Nowak B et al., 2003]. Diese Beobachtungen sind für die Bewertung der Ergebnisse der EVENTSStudie von Bedeutung, da die verwendeten Schrittmachermodelle Pulsar und Discovery nicht über die Fähigkeit zu Onset-Aufzeichnungen und Markerbeschriftungen verfügten. Bei 44% der in der EVENTS-Studie aufgezeichneten Elektrogramme fand sich kein diagnostischer Befund. Welche Mechanismen die ElektrogrammSpeicherung triggerten, konnte ohne das Onset nicht festgestellt werden. Es besteht die Möglichkeit, dass hierfür Arrhythmien verantwortlich waren, die aufgrund des fehlenden Onsets nicht analysiert werden konnten. Ebenso ist bekannt, dass ein Herzschrittmacher Vorhofarrhythmien mit schneller Überleitung auf den Ventrikel bei atrialem Undersensing nicht von ventrikulären Tachykardien unterscheiden kann [Nowak B, 1999; Nowak B, 2002]. 25% der in der EVENTS-Studie gespeicherten EGM waren durch supraventrikuläre Tachykardien getriggert und bei 17% lag Vorhofflattern vor. Obwohl chronisches Vorhofflimmern ein Ausschlusskriterium der EVENTS-Studie darstellte, wurden insgesamt 42% der gespeicherten Elektrogramme durch atriale Arrhythmien getriggert. Ventrikuläres Oversensing fand sich in 20 EGM (1%). Die Speicherkapazität der in der EVENTS-Studie verwendeten Herzschrittmacheraggregate war begrenzt. Insgesamt konnten 8 Elektrogramme vom Aggregat gespeichert werden. Ältere Ereignisse wurden zugunsten neu aufgetretener Ereignisse aus dem Speicher gelöscht. Es besteht Grund zu der Annahme, dass möglicherweise früher aufgetretene ventrikuläre Tachykardien zugunsten falsch positiver Trigger (Vorhofarrhythmien, ventrikuläres Oversensing) aus dem Speicher entfernt wurden oder aufgrund des nicht vorhandenen Onsets nicht diagnostiziert werden konnten. 67 Diskussion 4.2.3 Herzschrittmacherpatientenkollektiv mit erwiesenen ventrikulären Tachykardien Im folgenden soll durch die Analyse der Daten der Patienten mit dokumentierten ventrikulären Tachykardien dargestellt werden, welche Faktoren die durch ventrikuläre Tachykardien betroffenen Patienten eines Herzschrittmacherpatientenkollektivs charakterisieren. Die Tabelle 3.3 des Ergebnisteils stellt das Gesamtkollektiv der Studie den Patienten mit dokumentierten ventrikulären Tachykardien gegenüber. Im Hinblick auf das Geschlecht zeigte sich in der vorliegenden Arbeit ein Anteil von Patienten männlichen Geschlechts von 58% (Gesamtkollektiv) gegenüber 65% im Kollektiv mit dokumentierten ventrikulären Tachykardien. Der Anteil männlicher Patienten im Kollektiv mit mehr als drei dokumentierten Ereignissen betrug 79% und bei den Patienten mit hochgradigen Formen ventrikulärer Tachykardien 60%. Dies bestätigte die Ergebnisse vorangegangener Untersuchungen: Männer haben im Vergleich zu Frauen, wie aus vorangegangenen epidemiologischen Studien bekannt ist, ein erhöhtes Risiko, am plötzlichen Herztod zu versterben [Kuller LH, 1980; Lown B, 1979; Myerburg RJ, 1986; Vuori I et al., 1978]. In verschiedenen Arbeiten zeigte sich, dass während Therapie mit einem Herzschrittmacher Männer ein höheres Risiko haben, zu versterben, als Frauen [Fitzgerald WR et al., 1979; Otterstad JE et al., 1981]. Eine 1,7fach höhere Mortalität bezüglich des plötzlichen Herztodes unter Herzschrittmachertherapie für das männliche Geschlecht gegenüber weiblichen Patienten beschrieben auch Zehender et al. [Zehender M et al., 1992; Zehender M et al., 1994]. Auch die im Rahmen dieser Arbeit vorgelegte Untersuchung der Todesursache der Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg, die 2000 und 2001 verstarben, zeigte einen erhöhten Anteil plötzlicher Herztode unter männlichen Patienten. Männer hatten ein deutlich höheres Risiko, unerwartet zu versterben (männlich : weiblich 3,33 : 1). Damit konnte übereinstimmend mit vorausgehenden Arbeiten festgestellt werden, dass das männliche Geschlecht ein bedeutender Risikofaktor für den plötzlichen Herztod unter Herzschrittmachertherapie ist. 68 Diskussion Betrachtet man die Indikationen für die Herzschrittmachertherapie, so konnte folgende Beobachtung gemacht werden: Von besonderer Bedeutung für das Auftreten des plötzlichen Herztodes während Herzschrittmachertherapie sind Implantationsindikationen wie AV-Blockierungen und intraventrikuläre Leitungsblockierungen. Eine mögliche Erklärung ist, dass der AV-Block Ausdruck einer schwerwiegenden myokardialen Vorerkrankung (z.B. Myokardinfarkt, koronare Herzerkrankung, Kardiomyopathie) ist [Otterstad JE et al., 1981; Zehender M et al., 1994]. Zehender et al. fanden in der 1992 veröffentlichten Studie einen engen Zusammenhang zwischen dem Ausmaß der myokardialen Schädigung und der Häufigkeit plötzlicher Todesfälle. So war das Risiko, an einem plötzlichen Herztod zu versterben, für Patienten mit bi- oder trifaszikulären Schenkelblockierungen, schweren AV-Blockierungen oder Vorhofflimmern erhöht. Jeder dritte Patient mit einem trifaszikulären Schenkelblock verstarb plötzlich. Eine mögliche Ursache für das erhöhte Auftreten arrhythmischer Ereignisse in diesen Patientengruppen ergibt sich aus der Beobachtung, dass bei Vorliegen von AV- bzw. intraventrikulären Leitungsblockierungen vermehrt fehlende Wahrnehmungen ventrikulärer Extrasystolen durch den Herzschrittmacher vorkommen. Dies kann zu Wechselwirkungen von spontanen ventrikulären Herzaktionen und Herzschrittmacherstimulationen führen (R-auf-T-Phänomen, Kurz-lang-Sequenzen, Fusionsschläge) [Vera Z et al., 1975; Zehender M et al., 1992; Zehender M et al., 1994]. Die im Rahmen dieser Arbeit erhobenen Daten aus der EVENTS-Studie und die Ergebnisse der Untersuchung der Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg, die 2000 und 2001 verstarben, sowie vorausgegangene Studien, konnten bestätigen, dass die Häufigkeit plötzlicher Todesfälle bzw. das Auftreten ventrikulärer Tachykardien bei Herzschrittmacherpatienten mit AV-Blockierungen oder anderen Leitungsstörungen erhöht ist. Die Auswertung der EVENTS-Studie zeigte einen erhöhten Anteil an AV-Blockierungen bei den Patienten mit dokumentierten ventrikulären Tachykardien im Vergleich zum Gesamtkollektiv. 40% der in die Studie eingeschlossenen Patienten erhielten einen Herzschrittmacher wegen eines AV-Blocks. Bei den Patienten mit dokumentierten ventrikulären Tachykardien lag der Anteil der AV-Blockierungen bei 53%, bei den Patienten mit mehr als drei dokumentierten ventrikulären Tachykardien bei 57% und bei den Patienten mit hochgradigen Formen ventrikulärer Tachykardien bei 50%. 69 Diskussion Auch bei der Untersuchung der Todesursachen der Patienten der Herzschrittmacherambulanz des Universitätsklinikums Freiburg, die 2000 oder 2001 an einem plötzlichen Herztod verstarben, steht der Herzblock (AV-Block zweiten und dritten Grades) an erster Stelle der Implantationsindikationen. Ein erhöhtes Vorkommen plötzlicher Todesfälle bei Herzschrittmacherpatienten mit AV-Blockierungen gegenüber Sinusknotenerkankungen wiesen verschiedene Studien nach [Mattioli AV et al., 1995; Moser T, 1987; Simon AB et al., 1982; Zehender M et al., 1992]. Auffällig war die Beobachtung, dass das Risiko für den plötzlichen Herztod und das Auftreten ventrikulärer Tachykardien während Herzschrittmachertherapie nicht mit den bekannten Risikofaktoren korrelierte: Folgende Risikogruppen für den plötzlichen Herztod sind bekannt [Huikuri HV et al., 2001]: 1. hohes koronares Risikoprofil 2. abgelaufener Infarkt in der Anamnese 3. linksventrikuläre Ejektionsfraktion unter 35% 4. Herz-Kreislaufstillstand in der Anamnese 5. Kombination aus reduzierter Ejektionsfraktion, abgelaufenem Myokardinfarkt und ventrikulären Tachykardien Im Patientenkollektiv der EVENTS-Studie war der Anteil an Patienten mit koronarer Herzerkrankung oder reduzierter Ejektionsfraktion bei der Gruppe mit nachgewiesenen ventrikulären Tachykardien geringer als im Gesamtkollektiv. Nur in der Gruppe mit mehr als drei dokumentierten ventrikulären Tachykardien lag der Anteil an Patienten mit koronarer Herzerkrankung mit 43% über dem des Gesamtkollektivs (37%). Der Anteil an Patienten mit einem bekannten Myokardinfarkt in der Anamnese lag jedoch auch hier mit 14% unter dem des Gesamtkollektivs (15%). Übereinstimmend mit diesen Beobachtungen beschrieben Zehender et al. eine geringere Häufigkeit abgelaufener Myokardinfarkte bei Herzschritt- macherpatienten, die einem plötzlichen Herztod erlegen waren, und stellten fest, dass eine reduzierte linksventrikuläre Ejektionsfraktion von geringem Vorhersagewert für den plötzlichen Herztod unter Herzschrittmachertherapie ist [Zehender M et al., 1992; Zehender M et al., 1994]. 70 Diskussion 4.3 Interaktionen zwischen Herzschrittmacher und ventrikulären Ektopien In der Literatur sind verschiedene Situationen beschrieben, in denen ein Herzschrittmacherpatient durch Fehlfunktionen oder Interaktionen des Aggregates mit Erregungen des Herzens potentiell gefährdet ist: 1. Versagen der elektrischen Steuerkomponenten des Herzschrittmachersystems 2. Störung der Herzschrittmacherfunktion durch äußere Einflüsse 3. Interaktionen des Herzschrittmachers mit Herzeigenaktionen Das Versagen der elektrischen Steuerkomponenten des Herzschrittmachers kann zu einem Ausfall der stimulierenden Wirkung des Herzschrittmachers auf das Myokard führen. Der Herzschrittmacherpatient ist in diesem Fall durch bradykarde Rhythmusstörungen bis hin zum Adam-Stokes-Anfall gefährdet. Die Störung kann das Herzschrittmacheraggregat betreffen [Bohm A et al., 2000; Tegtmeyer CJ et al., 1981; Vijayaraman P et al., 2002; Wallace WA et al., 1970] oder durch Defekte der Elektrode bedingt sein [Alonso C et al., 2001; Glikson M et al., 1994a; Glikson M et al., 1994b; Kawanishi DT et al., 1996; Kazama S et al., 1993; Ohm OJ, 1980; Parsonnet V et al., 1981]. Als Schrittmacher-Twiddler-Syndrom wird die ineffektive Impulsgabe durch den Herzschrittmacher bezeichnet, wenn diese durch multifaktorielle Rotation des Aggregates oder Isolationsschäden an der Elektrode aufgrund von Knickbildungen oder Längstorsion bedingt ist [Ellringmann U et al., 1977; Gialafos J et al., 1995; Lal RB et al., 1990; Young KR et al., 2002]. Die Beeinflussung der Herzschrittmacherfunktion durch galvanische, magnetische, elektrische und elektromagnetische Kräfte im direkten Umfeld der Herzschrittmacherpatienten ist in der Literatur beschrieben. Im privaten Bereich betrifft dies Mobiltelefone und elektronische Artikelsicherungsanlagen [Barbaro V et al., 1995; Dodinot B et al., 1993; Hofgartner F et al., 1996; Mugica J et al., 2000; Trappe HJ, 1996; Wilke A et al., 1996; Wilke A et al., 1997]. In der Klinik können Defibrillatoren, Lithotripsie, Kernspintomographie, Strahlentherapie und Elektrokauter Fehlsteuerungen des Herzschrittmachers verursachen [Delhumeau A et al., 1988; Holmes DR, Jr. et al., 1986; Irnich W, 1992; Lauck G et al., 1995; Quertermous T et 71 Diskussion al., 1983; Souliman SK et al., 1994; Venselaar JL et al., 1987; Wilke A et al., 1997; Wilke A et al., 2000]. Im Zusammenhang mit dem Auftreten des plötzlichen Herztodes unter Herzschrittmachertherapie stellt die Interaktion zwischen spontanen Herzeigenaktionen und Herzschrittmacherimpulsen einen besonders relevanten Aspekt der Arrhythmogenese unter Herzschrittmachertherapie dar. Für die Untersuchungen im Rahmen dieser Arbeit ist dies von besonderem Interesse, da das Auftreten ventrikulärer Tachykardien unter Herzschrittmachertherapie Gegenstand der EVENTS-Studie war. Die Erkenntnisse über die Auslösung ventrikulärer Tachykardien bei Herzschrittmacherpatienten, die anhand von Langzeit-EKG-Auf- zeichnungen gewonnen wurden, werden nachfolgend diskutiert. 4.3.1 Komplikationen durch die Interaktion des Herzschrittmachers mit spontaner Myokarderregung Bei Herzschrittmacherpatienten besteht ein erhöhtes Risiko für den plötzlichen Herztod und, wie unter Gliederungspunkt 4.2.1 beschrieben, eine höhere Spontanvariabilität ventrikulärer Rhythmusstörungen der höheren Lown-Klassifikationen (multiforme ventrikuläre Extrasystolen, Bigemini, Couplets, Salven, R-auf-TPhänomen) als in der herzgesunden Normalbevölkerung. In der EVENTS-Studie zeigten 26% der Herzschrittmacherpatienten ventrikuläre Tachykardien. Daher ist die Interaktion ventrikulärer Extrasystolen mit den Herzschrittmacherimpulsen für die Entstehung ventrikulärer Arrhythmien unter permanenter Herzschrittmachertherapie besonders von Interesse. Untersuchungen zur Häufigkeit von Schrittmacherfehlfunktionen belegten, dass die fehlende Wahrnehmung elektrischer Aktivität des Herzens (Sensingdefekte) die vorherrschende Schrittmacherfehlfunktion ist [Brandes A et al., 1996; Kamke W et al., 2002; Zehender M et al., 1994; Zehender M et al., 1999]. Diese Wahrnehmungsdefizite treten während akuter Ischämien, bei Erregungsausbreitungsstörungen und während ventrikulärer Tachykardien gehäuft auf. Folgende Komplikationen können dann zur Auslösung gefährlicher Arrhythmien führen: 72 1. Diskussion Der Herzschrittmacher stimuliert in die vulnerable Phase der ventrikulären Extrasystole (R-auf-T-Phänomen) 2. Wechselnde Ankopplungsintervalle der RR-Abstände lösen über Kurzlang Sequenzen Arrhythmien aus 3. Der Herzschrittmacher stimuliert während der ventrikulären Tachykardie weiter und löst dadurch Kammerflimmern aus 4. Fusionsschläge zwischen ventrikulären Extrasystolen und Herzschrittmacherstimulationen induzieren die Arrhythmie Auch die im Rahmen dieser Arbeit durchgeführte Analyse dokumentierter ventrikulärer Tachykardien unter Herzschrittmachertherapie konnte die Interaktionen ventrikulärer Extrasystolen mit Herzschrittmacheraktionen als häufige Ursache für die Auslösung ventrikulärer Tachykardien nachweisen. Bei der Analyse der LangzeitEKG-Beispiele konnten die o.g. Mechanismen dargestellt werden. 4.3.1.1 Wechselnde Ankopplungsintervalle der Kammerkomplexe als Ursache für die Arrhythmieentstehung Der häufigste Auslösemechanismus für ventrikuläre Tachyarrhythmien mit Herzschrittmacherbeteiligung in den vorliegenden Fallbeispielen ließ sich auf wechselnde Ankopplungsintervalle der Kammerkomplexe im Sinne von Kurz-langSequenzen mit involvierter Kammerstimulation durch den Schrittmacher zurückführen. Bei allen dokumentierten Beispielen war das Auftreten ventrikulärer Extrasystolen in Kombination mit der Herzschrittmacherstimulation ausschlaggebend für die Entstehung der ventrikulären Arrhythmie: 73 Diskussion Abb. 4-2 Entspricht Abb. 3-4 des Ergebnisteils Diese Mechanismen der Arrhythmieauslösung mit Schrittmacherbeteiligung wurden in der Vergangenheit wiederholt beobachtet. Durch eine niedrige Stimulationsfrequenz wurde mit dem Einsetzen der Kammerstimulation eine monomorphe ventrikuläre Tachykardie ausgelöst [Karbenn U et al., 1989]. In den 90er Jahren veröffentlichte die Arbeitsgruppe um Böhm [Böhm A et al., 1998] ein Fallbeispiel, das die Auslösung einer Torsade de pointes Tachykardie aufgrund einer Kurz-lang-Sequenz mit Schrittmacherbeteiligung dokumentierte. Um den spontanen Ersatzrhythmus einer Patientin mit AV-Block zu bestimmen, wurde der VVI-Schrittmacher auf eine Frequenz von 30 Schlägen pro Minute eingestellt. Auf einen stimulierten Kammerkomplex folgte ein junktionaler Ersatzschlag mit einem Kopplungsintervall von 1480 ms. Der nächste stimulierte Kammerkomplex kam 480 ms danach. Dieses typische Lang-kurz-Intervall der RR-Abstände triggerte die Entstehung der Torsade de Pointes Tachykardie. Die Umprogrammierung des Schrittmachers auf eine Frequenz von 100 Schlägen pro Minute verhinderte die Entstehung von weiteren Torsade de Pointes Tachykardien. In den Beispielen der Abbildungen 3-6 und 3-7 konnten neben den wechselnden Ankopplungsintervallen auch Fusionsschläge ventrikulärer Extrasystolen mit Schrittmacherstimulationen am Beginn der ventrikulären Tachykardien dokumentiert werden. Dieser Mechanismus der Arrhythmogenese bei VVI-Schrittmachern ist in der Literatur beschrieben [Lefroy DC et al., 1994]. Ob die Rhythmusstörung allein durch 74 Diskussion die wechselnden Ankopplungsintervalle oder die Fusionsschläge ausgelöst wurde, der ob die Kombination aus beidem ausschlaggebend war, bleibt offen. Auch die Beispiele ventrikulärer Tachykardien bei Patienten mit Zweikammerschrittmachern wurden durch Kurz-lang-Sequenzen geprägt. Die Ursache für deren Entstehung waren entweder eine Schrittmacherfehlfunktion im Sinne eines Wahrnehmungsfehlers (Abbildung 3-9) oder eine interponierte Extrasystole (ventrikulär oder supraventrikulär), wie in den Abbildungen 3-10 bis 3-15 deutlich wird. Ektope Vorhoferregungen können dann zu wechselnden Ankopplungsintervallen der Kammerkomplexe führen, wenn sie durch die AV-sequentielle Stimulation bei Zweikammerschrittmachern auf den Ventrikel übertragen werden [Zehender M et al., 1999]. Die Tachykardie konnte sowohl durch eine Extrasystole als auch durch eine vom Schrittmacher stimulierte Herzaktion ausgelöst werden. Entscheidender Faktor für den Beginn der Tachykardie waren die typischen wechselnden Ankopplungsintervalle zwischen den stimulierten und ektopen Herzaktionen. Es war unerheblich, ob durch eine postextrasystolische Pause nach einer VES bis zur nächsten Schrittmacheraktion ein langes Intervall entstand oder ob aufgrund eines Undersensings einer VES die Stimulation durch den Schrittmacher innerhalb eines zu kurzen Intervalls erfolgte. In einem Fall stimulierte der Herzschrittmacher während der ventrikulären Tachykardie weiter. Dies kann zur sekundären Auslösung von Kammerflimmern führen [Zehender M et al., 1994]. Die Bedeutung der fehlenden Wahrnehmung ventrikulärer Extrasystolen durch den Herzschrittmacher für die Entstehung ventrikulärer Arrhythmien wird in der Literatur beschrieben. Die Wahrnehmungsfunktion des Herzschrittmachers bei verzögerter ventrikulärer Leitungsausbreitung durch intraventrikuläre Blockierungen und bei ventrikulären Extrasystolen ist stark herabgesetzt [Vera Z et al., 1975]. Die Erkennung von ventrikulären Extrasystolen oder regulären Herzaktionen durch den Herzschrittmacher erfolgt über die Anstiegssteilheit des QRS-Komplexes. Vor allem bei ventrikulären Extrasystolen und intraventrikulären Leitungs- blockierungen ist die Anstiegssteilheit der Kammerkomplexe reduziert. In der Studie von Zehehnder et al. [Zehender M et al., 1992] zeigte sich ein stark erhöhtes Risiko für den plötzlichen Herztod bei Schrittmacherpatienten mit bi- oder trifaszikulären Schenkkelblockbildern. Analog dazu wurde ein Anteil von weniger als 1% fehlender 75 Diskussion Erkennung ventrikulärer Extrasystolen bei Patienten ohne Schenkelblock oder mit linksanteriorem Hemiblock beobachtet. Bei vorliegendem Rechtsschenkelblock stieg der Anteil der nichterkannten ventrikulären Extrasystolen auf 1%, bei Linksschenkelblock auf 6% und bei bifszikulären Blockbildern auf 14%. Obwohl in den vorliegenden dokumentierten ventrikulären Arrhythmien unter Herzschrittmachertherapie keine Fallbeispiele für unangemessene Herzschrittmacherhemmungen durch Myopotentiale dokumentiert wurden, ist dies ein in der Literatur oft beschriebenes Phänomen [Breivik K et al., 1980; Gialafos J et al., 1985; Wirtzfeld A et al., 1972]. Es kann neben dem Ausfall des Herzschrittmachers für die Zeit der myopotentialinduzierten Hemmung auch zu einer fehlenden Wahrnehmung ventrikulärer Extrasystolen und zur Entstehung ventrikulärer Tachykardien kommen [Breivik K et al., 1980; Iesaka Y et al., 1982; Seipel L et al., 1976; van Cleve RB et al., 1978]. Neben der Entstehung von Lang-kurz-lang- bzw. Kurz-lang-kurz Sequenzen durch Herrschrittmacherstimulation und ventrikuläre Extrasystolen konnte in den Langzeit-EKG-Beispielen ein weiterer Mechanismus beschrieben werden, der den Einfluss ventrikulärer Extrasystolen in Verbindung mit der Herzschrittmacherfunktion für die Entstehung ventrikulärer Tachykardien unter Therapie mit einem Herzschrittmacher unterstreicht. 4.3.1.2 Physiologisches Undersensing als Ursache für die Auslösung einer ventrikulären Tachykardie Durch den Herzschrittmacher ausgelöste ventrikuläre Arrhythmien bis hin zum Kammerflimmern durch ein R-auf-T-Phänomen mit Herzschrittmacherbeteiligung sind in der Literatur beschrieben [Preston TA, 1973; Preston TA, 1975; Wilke A et al., 2000]. Eine Sonderform des R-auf-T-Phänomens unter Herzschrittmachertherapie sind ventrikuläre Extrasystolen, die in die Blankingzeit eines Zweikammerschrittmachers fallen. Sie sind eine bekannte Komplikation der Therapie mit DDDbzw. DDI-Schrittmachern [Barnay C et al., 1998; Berman ND et al., 1987; Bertuso J et al., 1986; Erlebacher JA et al., 1986; Irwin M et al., 1994; Lamas GA et al., 1985; Pieterse MG et al., 1994; Quintal R et al., 1984; Schibgilla V et al., 1998]. In den beschriebenen Fallbeispielen 3-18 bis 3-21 konnte dieser Auslösemachanismus dokumentiert werden. 76 Diskussion Nachdem der Herzschrittmacher einen Vorhofspike (A) abgegeben hat, ist der ventrikuläre Eingang für ca. 13 bis 40 msec blind geschaltet (Blankingzeit). Fällt in diese Phase eine ventrikuläre Extrasystole, so kann der Schrittmacher sie nicht registrieren, und die Kammerstimulation (V) erfolgt während der Erregungsrückbildung der Extrasystole. Wird hierbei in den aufsteigenden Teil der T-Welle (vulnerable Phase) stimuliert, kann eine ventrikuläre Tachykardie entstehen. In Abbildung 4-3 ist dieser Mechanismus dokumentiert. Abb. 4-3 Entspricht Abb. 3-21 des Ergebnisteils Normalerweise ist der Schrittmacherimpuls nicht ausreichend, um bei einem Einfall in die vulnerable Phase Arrhythmien auszulösen. Eine Ausnahme bildet die Phase nach einem akuten Myokardinfarkt [Burgess MJ et al., 1970; Chardack WM et al., 1969; Chatterjee K et al., 1969; Jones M et al., 1977; Koch R et al., 1971a; Koch R et al., 1971b; Oupadia P et al., 1998]. Auch bei der Schrittmacherstimulation in die vulnerable Phase ventrikulärer Extrasystolen ist die Flimmerschwelle in Bereiche gesenkt, in denen durch den Herzschrittmacherstimulus ventrikuläre Tachyarrhythmien ausgelöst werden können [Richter-von Arnauld HP et al., 1974]. In der Literatur ist Kammerflimmern nach einem Schrittmacherstimulus-auf-T-Phänomen bei vorangegangener ventrikulärer Extrasystolie beschrieben [Castellanos A, Jr. et al., 1966; Castellanos A, Jr. et al., 1973; Seipel L et al., 1975; Seipel L et al., 1976]. Durch die Reduktion der Blankingzeit bei der Schrittmacherprogrammierung kann die Häufigkeit derartiger Komplikationen unter Elektrotherapie des Herzens reduziert werden [Irwin M et al., 1994]. 4.3.1.3 Schrittmacherassozierte und stimulationsunabhängige Arrhythmieentstehung Neben den Beispielen mit direkter Beteiligung des Herzschrittmachers an der Entstehung ventrikulärer Tachyarrhythmien wurden die Rhythmusstörungen bei einer Vielzahl der dokumentierten Fallbeispiele ohne Herzschrittmacherinteraktion ausgelöst. Der vorherrschende Mechanismus bei der Entstehung der ventrikulären 77 Diskussion Tachykardien ist durch früh einfallende Extrasystolen bedingt (Abbildungen 3-22 bis 3-32). Die vorzeitigen Kammerkomplexe treffen in die vulnerable Phase der Erregungsrückbildung der schrittmachergestützten Herzaktionen. Ein direkter Zusammenhang mit der Schrittmachertherapie konnte nicht nachgewiesen werden. 4.4 Konsequenzen aus den vorliegenden Ergebnissen Der plötzliche Herztod zählt zu den häufigsten Todesursachen während permanenter Schrittmachertherapie des Herzens. Dies wird zum Großteil durch das Fortschreiten der kardialen Grunderkrankung bedingt. Dennoch spielt auch die Interaktion des Schrittmacheraggregats mit ventrikulären Ektopien eine Rolle bei der Auslösung maligner ventrikulärer Arrhythmien bei Herzschrittmacherpatienten. Die im Rahmen der vorgelegten Arbeit durchgeführte EVENTS-Studie konnte das Auftreten ventrikulärer Tachykardien während Herzschrittmachertherapie belegen. Durch die Analyse von Langzeit-EKG-Dokumentationen ventrikulärer Tachykardien im Zusammenhang mit der Elektrostimulation des Herzens wurden Mechanismen der Arrhythmogenese veranschaulicht. Übereinstimmend mit Beispielen aus der Literatur konnte die Bedeutung von Wahrnehmungsdefiziten der Herzschrittmacher bei ventrikulären Arrhythmien festgestellt werden. Besonders gefährdet sind Patienten mit hochgradigen AV-Blockierungen und intraventrikulären Erregungsausbreitungsstörungen. Bei diesen Patienten ist ebenso wie bei durch Symptome (Schwindel, Synkopen) auffälligen Herzschrittmacherträgern eine intensive Diagnostik angezeigt. Schrittmacherfehlfunktionen und Arrhythmien können anhand von Langzeit-EKG und modernen Herzschrittmachern (Onset-Recording) nachgewiesen werden [Brandes A et al., 1998; Nowak B et al., 2003]. Eine besonders exakte Programmierung des Aggregates ist bei Risikopatienten unbedingt notwendig. Durch eine hohe Empfindlichkeit des Herzschrittmachers bei der Wahrnehmung ventrikulärer Extrasystolen kann ebenso wie durch die Programmierung einer kurzen Blankingzeit die Häufigkeit gefährlicher Interaktionen zwischen Herzeigenaktionen und Schrittmacherstimulationen reduziert werden. Eine Option bei besonders gefährdeten Patienten wäre die Therapie mit einem implantierbaren Kardioverter Defibrillator (ICD). Der ICD hat sich in der Prävention des plötzlichen Herztodes bei bestimmten Risikogruppen (koronare Herzerkrankung, reduzierte Ejektionsfraktion, ventrikuläre Tachykardien) in 78 Diskussion verschiedenen Studien bewährt [Buxton AE et al., 1999; Moss AJ et al., 1996; Moss AJ et al., 2002]. Gleichzeitig besteht die Möglichkeit der antibradykarden Herzschrittmachertherapie durch den ICD. Die Ergebnisse der vorgelegten Arbeit lassen sich in den folgenden drei Feststellungen zusammenfassen: 1. Der plötzliche Herztod ist eine ernste und häufige Komplikation der Herzschrittmachertherapie. 2. Ventrikuläre Tachykardien treten bei Herzschrittmacherpatienten gehäuft auf. 3. Bei der Auslösung ventrikulärer Arrhythmien unter Herzschrittmachertherapie spielt die Interaktion von Schrittmacheraggregat und spontanen Herzeigenaktionen eine herausragende Rolle. Deshalb sind in Zukunft weiterführende Studien zu Auftreten und Ursache des plötzlichen Herztodes unter Herzschrittmachertherapie klinisch von Bedeutung. Mit Hilfe von in ihren diagnostischen Funktionen weiterentwickelten Schrittmacheraggregaten können in Zukunft weitere Erkenntnisse über Auslösung und Häufigkeit ventrikulärer Arrhythmien gewonnen werden und dazu beitragen, das Verständnis für die zugrundeliegenden Mechanismen zu verbessern. Weiterführende Studien sind wichtig, um diese etablierte Therapieform für die Patienten noch sicherer zu gestalten. 79 Zusammenfassung 5 Zusammenfassung Der plötzliche Herztod zählt zu den häufigsten Todesursachen während permanenter Schrittmachertherapie des Herzens und tritt mit einer Häufigkeit von 10% bis 31% auf. Im Rahmen der vorgelegten Arbeit durchgeführte Untersuchungen zeigten einen Anteil von 12% plötzlichen Herztoden unter den Patienten der Schrittmacherambulanz des Universitätsklinikums Freiburg, die 2000 und 2001 verstorben waren. Die EVENTS-Studie als weiterer Bestandteil dieser Arbeit konnte das Vorkommen ventrikulärer Tachykardien bei Herzschrittmacherpatienten quantitativ und qualitativ belegen. Bei 26% der untersuchten Patienten wurden ventrikuläre Tachykardien in gespeicherten intrakardialen Elektrogrammen nachgewiesen. 10% der Patienten zeigten potentiell maligne Formen ventrikulärer Arrhythmien (anhaltende Tachykardien mit Frequenzen über 180 min-1). Die Analyse von ventrikulären Tachykardien bei Herzschrittmacherpatienten, die mittels Langzeit-EKG dokumentiert wurden, veranschaulichte als dritter Teil dieser Arbeit die Bedeutung der Interaktion von ventrikulären Ektopien und Schrittmacherstimulationen für die Arrhythmogenese. Verschiedene Mechanismen konnten dargestellt werden. Häufig beruhten sie auf Wahrnehmungsdefiziten der Herzschrittmacher bezüglich ventrikulärer Extrasystolen. Es ist bekannt, das AV-Blockierungen und Erregungsausbreitungsstörungen ebenso wie akute Ischämien und ventrikuläre Tachykardien diese Wahrnehmungsstörungen bedingen können. Damit übereinstimmend zeigten die Untersuchungen im Rahmen dieser Arbeit , dass der AV-Block die führende Implantationsindikation bei den plötzlich verstorbenen Patienten des Universitätsklinikums Freiburg war. Der Anteil an AVBlockierungen bei den Patienten mit nachgewiesenen ventrikulären Tachykardien der EVENTS-Studie war im Vergleich zum Gesamtkollektiv ebenfalls erhöht. Für die Zukunft sind weiterführende klinische Studien mit modernsten Herzschrittmachermodellen, die über hochentwickelte diagnostische Möglichkeiten verfügen, von Bedeutung. So kann das Verständnis für die Risikofaktoren und Mechanismen des plötzlichen Herztodes während Herzschrittmachertherapie weiter verbessert werden. Der implantierbare Kardioverter Defibrillator kann als therapeutische Option bei Hochrisikopatienten in Erwägung gezogen werden, da er antitachykarde Funktionen mit antibradykarder Stimulation vereint. 80 6 Abkürzungsverzeichnis AA absolute Arrhythmie AP Angina Pectoris EGM Elektrogramm EKG Elektrokardiogramm FU Follow-up-Untersuchung HWI Hinterwandinfarkt ICD implantierbarer Cardioverter Defibrillator KHK Koronare Herzerkrankung LAHB Linksanteriorer Hemiblock LPHB Linksposteriorer Hemiblock LSB Linksschenkelblock LSL Lang-kurz-lag LZ-EKG Langzeitelektrokardiogramm nsVT nicht anhaltende ventrikuläre Tachykardie RSB Rechtsschenkelblock SLS Kurz-lang-kurz SVES supraventrikuläre Extrasystole VES ventrikuläre Extrasystole VT ventrikuläre Tachykardie VWI Vorderwandinfarkt EPU elektrophysiologische Untersuchung Abkürzungsverzeichnis 81 Literatur 7 Literatur (1979) Nomenclature and criteria for diagnosis of ischemic heart disease. Report of the Joint International Society and Federation of Cardiology/World Health Organization task force on standardization of clinical nomenclature. Circulation 59: 607-609 (2000) Danish pacemaker and ICD register. 1999. Pacing Clin Electrophysiol 23: S193 Alonso C, Leclercq C, d'Allonnes FR, Pavin D, Victor F, Mabo P, Daubert JC (2001) Six year experience of transvenous left ventricular lead implantation for permanent biventricular pacing in patients with advanced heart failure: technical aspects. Heart 86: 405-410 Alt E, Dechand E, Wirtzfeld A, Ulm K (1983) Überlebenszeit und Verlauf nach Schrittmacherimplantation. Dtsch Med Wochenschr 108: 331-335 Andresen D, Behrens S, Arntz R, Bruggemann T (1993) Prävention des plötzlichen (rhythmusbedingten) Herztodes. Internist (Berl) 34: 423-435 Barbaro V, Bartolini P, Donato A, Militello C, Altamura G, Ammirati F, Santini M (1995) Do European GSM mobile cellular phones pose a potential risk to pacemaker patients? Pacing Clin Electrophysiol 18: 1218-1224 Barnay C, Foltzer E, Tarlet JM, Coste A, Rahal Y, Lasseri C (1998) [Rhythmic pitfalls in cardiac pacing]. Arch Mal Coeur Vaiss 91 Spec No 1: 61-69 Berman ND, George CA, Duxbury GB (1987) Apparent pacemaker malfunction due to ventricular blanking. Can J Cardiol 3: 63-65 Bernstein AD and Parsonnet V (1996) Survey of cardiac pacing and defibrillation in the United States in 1993. Am J Cardiol 78: 187-196 82 Literatur Bertuso J, Kapoor AS, Schafer J (1986) A case of ventricular undersensing in the DDI mode: cause and correction. Pacing Clin Electrophysiol 9: 685-689 Bethge K-P (1982) Langzeit-Elektrokardiographie bei Gesunden und bei Patienten mit koronarer Herzerkrankung. 1. Aufl. Springer, Berlin; Heidelberg; New York Bigger JT, Jr., Fleiss JL, Kleiger R, Miller JP, Rolnitzky LM (1984) The relationships among ventricular arrhythmias, left ventricular dysfunction, and mortality in the 2 years after myocardial infarction. Circulation 69: 250-258 Billoret A, Queney JP, Dodinot B (1978) La mort subite chez le porteur de stimulateur cardiaque. Stimucoeur 6: 22 Bloomfield P and Miller HC (1990) Permanent pacing. Br Med J 295: 741-744 Bohm A, Hajdu L, Pinter A, Duray G, Preda I (2000) Runaway pacemaker syndrome and intermittent nonoutput as manifestations of end of life of a VVI pacemaker. Pacing Clin Electrophysiol 23: 2143-2144 Böhm A, Pinter A, Préda I (1998) Pacemaker induced torsades de pointes tachycardia. Heart 80 (5): 466 Brandes A, Bethge KP, Gonska BD, Diederich KW (1996) Transistorische Schrittmacherfehlfunktion und spontane Arrhythmien bei symptomatischen und asymptomatischen Patienten mit Kammerbedarfsschrittmachern. Z Kardiol 85: 237-247 Brandes A, Potratz J, Bethge K-P (1998) Die Bedeutung des Langzeit-EKG für die Schrittmacherambulanz. Herzschr Elektrophys 9: 30-36 Breithardt G, Borggreve M, Haerten K, Schwarzmaier J, Karbenn U, Podczeck A (1987) Prognostische Bedeutung ventrikulärer Spätpotentiale bei Postinfarktpatienten mit stabiler koronarer Herzkrankheit. In: Steinbeck, G.: Lebensbedrohliche ventrikuläre Rhythmusstörungen. 1. Aufl. Steinkopff Verlag, Darmstadt. S. 93-100 83 Literatur Breivik K and Ohm OJ (1980) Myopotential inhibition of unipolar QRS-inhibited (VVI) pacemakers, assessed by ambulatory Holter monitoring of the electrocardiogram. Pacing Clin Electrophysiol 3: 470-478 Büchner C and Thierfelder K (1983) Letalität unter Schrittmachertherapie. Herzschrittmacher 3: 34-39 Burgess MJ, Grossman M, Abildskov JA (1970) Fibrillation threshold of a patient with myocardial infarction treated with a fixed-rate pacemaker: case report. Am Heart J 80: 112-115 Buxton AE, Lee KL, Fisher JD, Josephson ME, Prystowsky EN, Hafley G (1999) A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med 341: 1882-1890 Castellanos A, Jr. and Lemberg L (1973) Cardiac arrhythmias. 6. Pacemaker arrhythmias and electrocardiographic recognition of pacemaker. Circulation 47: 1382-1391 Castellanos A, Lemberg L, Berkovits BV (1964) The demand cardiac pacemaker: a new instrument of the treatment of av-conduction disturbances. Inter Am Coll Cardiol Meeting, Montreal Castellanos A, Jr., Lemberg L, Jude JR, Berkovits BV (1966) Repetitive firing occurring during synchronized electrical stimulation of the heart. J Thorac Cardiovasc Surg 51: 334-340 Chardack WM, Gage AD, Greatbatch W (1960) A transistorized selfcontained, implantable pacemaker for the long term correction of heart block. Surgery 48: 643 Chardack WM, Ishikawa H, Fochler FJ, Souther S, Gage AA (1969) Pacing and ventricular fibrillation. Ann N Y Acad Sci 167: 919-933 84 Literatur Chatterjee K, Harris A, Leatham A (1969) The risk of pacing after infarction, and current recommendations. Lancet 2: 1061-1063 Cobb LA, Weaver WD, Fahrenbruch CE, Hallstrom AP, Copass MK (1992) Community-based interventions for sudden cardiac death. Impact, limitations, and changes. Circulation 85: I98-102 Cobb LA and Werner JA (1986) Predictors an prevention of sudden cardiac death. In: Hurst, J. W.: The heart. 1. Aufl. McGraw Hill, New York. S. 538-546 Cohen SI and Frank HA (1982) Preservation of active atrial transport; an important clinical consideration in cardiac pacing. Chest 81: 51-54 Connolly SJ, Kerr CR, Gent M, Roberts RS, Yusuf S, Gillis AM, Sami MH, Talajic M, Tang AS, Klein GJ, Lau C, Newman DM (2000) Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. Canadian Trial of Physiologic Pacing Investigators. N Engl J Med 342: 1385-1391 Delhumeau A, Ronceray S, Moreau X, Cottineau C, Cavellat M (1988) [Final arrest of a pacemaker after use of electrocautery]. Ann Fr Anesth Reanim 7: 162-164 Dodinot B, Godenir JP, Costa AB (1993) Electronic article surveillance: a possible danger for pacemaker patients. Pacing Clin Electrophysiol 16: 46-53 Eberle F, Schmitt C.G., Köhler F (1979) Kammerflimmern während der Funktionsprüfung eines Demand-Schrittmachers. Herz Kreislauf 11: 585-589 Ector H, Rickards AF, Kappenberger L, Vardas P, Oto A, Santini M, Sutton R (2000) The registry of the European Working Group on Cardiac Pacing (EWGCP). A working group of the European Society of Cardiology. Europace 2: 251-255 Edhag O and Swahn A (1976) Prognosis of patients with complete heart block or arrhythmic syncope who were not treated with artificial pacemakers. A longterm follow-up study of 101 patients. Acta Med Scand 200: 457-463 85 Literatur Ellringmann U and Schmitt CG (1977) Das sogenannte Pacemaker-TwiddlerSyndrom bei transvenös implantierten Schrittmachersystemen. Z Kardiol 66: 728-734 Elmquist H and Senning A (1960) Implantable pacemaker for the heart. In: Smith, C. N.: Medical electronics, Proc. Sec. Int. Conf. on Medical Electronics, Paris, June 1959. 1. Aufl. Hiffe, London Erlebacher JA and Stelzer P (1986) Inappropriate ventricular blanking in a DDI pacemaker. Pacing Clin Electrophysiol 9: 519-521 Fauchier JP, Raynaud Ph, Brochier M, Raynaud R (1971) Fréquence et causes de la mort subite chez les malades soumis à une stimulation cardiaque permanente. Ann Cardiol Angéiol 20: 323 Fitzgerald WR, Graham IM, Cole T, Evans DW (1979) Age, sex, and ischaemic heart disease as prognostic indicators in long-term cardiac pacing. Br Heart J 42: 57-60 Furman S and Robinson G (1958) The use of an intracardiac pacemaker in the correction of total heart block. Surg Forum 9: 245 Furman S and Schwedel JB (1959) An intracardiac pacemaker for Stokes-Adams seizures. N Engl J Med 261: 943 Geddes JS and Anderson J (1978) Telemetric rhythm monitor based on a cardiac pacemaker. In: Meere, C.: Proceedings of the VIth world symposium an cardiac pacing, Montreal. Gialafos J, Maillis A, Kalogeropoulos C, Kalikazaros J, Basiakos L, Avgoustakis D (1985) Inhibition of demand pacemakers by myopotentials. Am Heart J 109: 984-991 Gialafos J, Siamas G, Kandilas J, Gatzoulis K, Toutouzas P (1995) Spontaneous twisting of an implanted pacemaker electrode in three cases. Pacing Clin Electrophysiol 18: 1068-1071 86 Literatur Gillum RF (1989) Sudden coronary death in the United States: 1980-1985. Circulation 79: 756-765 Glikson M, Von Feldt LK, Suman VJ, Hayes DL (1994a) Clinical surveillance of an active fixation, bipolar, polyurethane insulated pacing lead, Part I: The atrial lead. Pacing Clin Electrophysiol 17: 1399-1404 Glikson M, Von Feldt LK, Suman VJ, Hayes DL (1994b) Clinical surveillance of an active fixation, bipolar, polyurethane insulated pacing lead, Part II: The ventricular lead. Pacing Clin Electrophysiol 17: 1499-1502 Gordon T and Kannel WB (1971) Premature mortality from coronary heart disease. The Framingham study. JAMA 215: 1617-1625 Gross-Fengels W, Schilling G, Neumann G, Funke HD, Simon H (1982) Ambulantes 24-Stunden-EKG bei symptomatischen Schrittmacherpatienten. Herz/Kreisl 14: 404-408 Hager W (1974) Spätergebnisse nach Herzschrittmacherimplantation. Dtsch Med Wochenschr 99: 1345-1349 Hofgartner F, Muller T, Sigel H (1996) Können Mobiltelefone im C- und D-Netz Herzschrittmacherpatienten gefährden? Dtsch Med Wochenschr 121: 646-652 Holmes DR, Jr., Hayes DL, Gray JE, Merideth J (1986) The effects of magnetic resonance imaging on implantable pulse generators. Pacing Clin Electrophysiol 9: 360-370 Hombach V, Hopp HW, Osterspey A, Winter U, Deutsch H, Hilger HH (1984) Die Erkennung von Risikopatienten für den plötzlichen Herztod aus dem LangzeitEKG. Herz 9: 6-25 Hua G, Dodinot B, Polu JM, Faivre G (1970) La mortalité et ses causes chez les porteurs de pacemakers. Ann Cardiol Angéiol 19: 217 87 Literatur Huikuri H (2000) Effect of stored electrograms on management in the paced patient. Am J Cardiol 86: K101-K103 Huikuri HV, Castellanos A, Myerburg RJ (2001) Sudden death due to cardiac arrhythmias. N Engl J Med 345: 1473-1482 Iesaka Y, Pinakatt T, Gosselin AJ, Lister JW (1982) Bradycardia dependent ventricular tachycardia facilitated by myopotential inhibition of a VVI pacemaker. Pacing Clin Electrophysiol 5: 23-29 Irnich W (1992) Störmöglichkeiten durch medizintechnische Behandlungsverfahren. Dtsch Ärztebl 89: 3026-3030 Irnich W (1999) Pacemaker-related patient mortality. Pacing Clin Electrophysiol 22: 1279-1283 Irnich W and Batz L (1994) Jahresbericht 1993 des Deutschen Zentralregisters Herzschrittmacher. Herzschritttmacher by MZV Verlag 14: 239 Irwin M, Harris L, Cameron D, Louis C, Radvanszky E, Goldman B (1994) DDI pacing: indications, expectations, and follow-up. Pacing Clin Electrophysiol 17: 274-279 Israel CW, Gascon D, Nowak B, Campanale G, Pascotto P, Hartung W, Lellouche D (2000) Diagnostic value of stored electrograms in single-lead VDD systems. Pacing Clin Electrophysiol 23: 1801-1803 Janosik DL, Redd RM, Buckingham TA, Blum RI, Wiens RD, Kennedy HL (1987) Utility of ambulatory electrocardiography in detecting pacemaker dysfunction in the early postimplantation period. Am J Cardiol 60: 1030-1035 Jones M and Geddes LA (1977) Strength-duration curves for cardiac pacemaking and ventricular fibrillation. Cardiovasc Res Cent Bull 15: 101-112 88 Literatur Jordaens L (1995) Cardiac Arrhythmias and the Interaction with Pacemakers. In: van Hemel, N. M., Wittkampf, F. H. M., and Ector, H.: The Pacemaker Clinic of the 90´s. Essentials in Brady-Pacing. 1. Aufl. Kluwer Academic Publishers, Dordrecht, Boston, London. S. 167-183 Josephson ME (1986) Treatment of ventricular arrhythmias after myocardial infarction. Circulation 74: 653-658 Kalmar P, von Bally K, Bleese N, Kitzing J, Krebber HJ, Pinich P, Polonius MJ (1975) Clinical complications due to pacemaker system failures and their management. In: Schaldack, M. and Furman, S.: Engineering in Medicine 1: Advance in Pacemaker Technology. 1. Aufl. Springer, Berlin, Heidelberg, New York. S. 153Kalusche D (1996a) Plötzlicher Herztod. In: Roskamm, H and Reindell, H.: Herzkrankheiten: Pathophysiologie, Diagnostik, Therapie. 4. Aufl. Springer, Berlin, Heidelberg. S. 571-583 Kalusche D (1996b) Therapie der Erregungsbildungs- und Leitungsstörungen. In: Roskamm, H. and Reindell, H.: Herzkrankheiten: Pathophysiologie, Diagnostik, Therapie. 4. Aufl. Springer, Berlin, Heidelberg. S. 1214-1277 Kamke W, Breitkreuz B, Jereczek M, Dovifat C, Völler H (2002) Nachweis und Bedeutung von permanenten und transistorischen Schrittmacherfunktionsstörungen bei 180 Patienten mit Ein- und ZweiKammer-Aggregaten. Herzschr Elektrophys 13: 233-241 Karbenn U, Borggrefe M, Breithardt G (1989) Pacemaker-induced ventricular tachycardia in normally functioning ventricular demand pacemakers. Am J Cardiol 63: 120-122 89 Literatur Kawanishi DT, Song S, Furman S, Parsonnet V, Pioger G, Petitot JC, Godin JF (1996) Failure rates of leads, pulse generators, and programmers have not diminished over the last 20 years: formal monitoring of performance is still needed. BILITCH Registry and STIMAREC. Pacing Clin Electrophysiol 19: 1819-1823 Kazama S, Nishiyama K, Machii M, Tanaka K, Amano T, Nomura T, Ohuchi M, Kasahara S, Nie M, Ishihara A (1993) Long-term follow up of ventricular endocardial pacing leads. Complications, electrical performance, and longevity of 561 right ventricular leads. Jpn Heart J 34: 193-200 Koch R and Wiessmann B (1971a) Kammerflimmern durch Herzschrittmacher. Z Kreislaufforsch 60: 842-850 Koch R and Wiessmann B (1971b) Parasystolie bei Herzschrittmachern. Bemerkungen zur vulnerablen Phase. Z Kreislaufforsch 60: 50-55 Kuller L, Lilienfeld A, Fisher R (1966) Epidemiological study of sudden and unexpected deaths due to arteriosclerotic heart disease. Circulation 34: 10561068 Kuller LH (1980) Sudden death--definition and epidemiologic considerations. Prog Cardiovasc Dis 23: 1-12 Kuller LH, Traven ND, Rutan GH, Perper JA, Ives DG (1989) Marked decline of coronary heart disease mortality in 35-44-year-old white men in Allegheny County, Pennsylvania. Circulation 80: 261-266 Lal RB and Avery RD (1990) Aggressive pacemaker twiddler's syndrome. Dislodgement of an active fixation ventricular pacing electrode. Chest 97: 756757 Lamas GA and Antman EM (1985) Pacemaker-mediated tachycardia initiated by coincident P-wave undersensing and ventricular blanking period. Pacing Clin Electrophysiol 8: 436-439 90 Literatur Lamas GA, Pashos CL, Normand SL, McNeil B (1995) Permanent pacemaker selection and subsequent survival in elderly Medicare pacemaker recipients. Circulation 91: 1063-1069 Lauck G, von Smekal A, Wolke S, Seelos KC, Jung W, Manz M, Luderitz B (1995) Effects of nuclear magnetic resonance imaging on cardiac pacemakers. Pacing Clin Electrophysiol 18: 1549-1555 Lefroy DC, Crake T, Davies DW (1994) Ventricular tachycardia: an unusual pacemaker-mediated tachycardia. Br Heart J 71: 481-483 Lengfelder W and Senges J (1990) Langzeit-EKG bei plötzlichem Herztod. In: Schuster, H. P.: Langzeitelektrokardiographie: Grundlagen und Praxis. 1. Aufl. Gustav Fischer Verlag, Stuttgart, New York. S. 190-201 Lew WY and Goldberger AL (1989) Torsade de pointe and sudden death in a patient with a permanent pacemaker. Can J Cardiol 2: 86-87 Lown B (1979) Sudden cardiac death: the major challenge confronting contemporary cardiology. Am J Cardiol 43: 313-328 Lown B (1980) Cardiovascular collapse and sudden cadiac death. In: Braunwald, E.: Heart disease. 1. Aufl. Saunders, Philadelphia. S. 778-817 Lown B and Wolf M (1971) Approaches to sudden death from coronary heart disease. Circulation 44: 130-142 Madsen GM and Andersen C (1989) Pacemaker-induced tachycardia during general anaesthesia: a case report. Br J Anaesth 63: 360-361 Maendely R, Aldakar M, d´Hautefeuille B, Fontaine G, Linarez-Cruz E, Frank R, Tonet JL, Grosgogeat Y (1987) Sudden death in a patient with a pacemaker caused by heart rupture in a "cloisonne" pericardium. Ann Cardiol Angéiol 36: 355-359 91 Literatur Markewitz A (2002) Jahresbericht 2000/2001 des Deutschen Zentralregisters Herzschrittmacher. Herzschr Elektrophys 13: 242-257 Mattioli AV, Rossi R, Annicchiarico E, Mattioli G (1995) Causes of death in patients with unipolar single chamber ventricular pacing: prevalence and circumstances in dependence on arrhythmias leading to pacemaker implantation. Pacing Clin Electrophysiol 18: 11-17 Meinertz T, Kasper W, Schmitt B, Treese N, Ruckel A, Zehender M, Hofmann T, Schuster HP, Pop T (1983) Herzrhythmusstörungen bei Herzgesunden. Dtsch Med Wochenschr 108: 527-531 Moser T (1987) Der akute Tod unter Schrittmachertherapie. Moss AJ, Hall WJ, Cannom DS, Daubert JP, Higgins SL, Klein H, Levine JH, Saksena S, Waldo AL, Wilber D, Brown MW, Heo M (1996) Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med 335: 1933-1940 Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, Daubert JP, Higgins SL, Brown MW, Andrews ML (2002) Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 346: 877-883 Mugica J, Henry L, Podeur H (2000) Study of interactions between permanent pacemakers and electronic antitheft surveillance systems. Pacing Clin Electrophysiol 23: 333-337 Mukharji J, Rude RE, Poole WK, Gustafson N, Thomas LJ, Jr., Strauss HW, Jaffe AS, Muller JE, Roberts R, Raabe DS, Jr., . (1984) Risk factors for sudden death after acute myocardial infarction: two-year follow-up. Am J Cardiol 54: 31-36 92 Literatur Murray A, Jordan RS, Gold RG (1981) Pacemaker assessment in the ambulant patient. Br Heart J 46: 531-538 Myerburg RJ (1986) Epidemiology of ventricular tachycardia/ventricular fibrillation and sudden cardiac death. Pacing Clin Electrophysiol 9: 1334-1338 Myerburg RJ and Castellanos A (1987) Cardiac arrest and sudden cardiac death. In: Braunwald, E.: Heart disease. 1. Aufl. Saunders, Philadelphia. S. 742-777 Nowak B (1999) Taking advantage of sophisticated pacemaker diagnostics. Am J Cardiol 83: 172D-179D Nowak B (2002) Pacemaker stored electrograms: teaching us what is really going on in our patients. Pacing Clin Electrophysiol 25: 838-849 Nowak B, Sperzel J, Rauscha F, Mont L, Alzueta J, Senden PJ, Meyer J (2003) Diagnostic value of onset-recordings and marker annotations in dual chamber pacemaker stored electrograms. Europace 5: 103-109 Ohm OJ (1980) Demand failures occurring during permanent pacing in patients with serious heart disease. Pacing Clin Electrophysiol 3: 44-55 Oka Y, Ito T, Sada T, Sekine I, Naito A, Okabe F, Matsumoto S (1985) Ambulatory electrocardiograms obtained by Holter monitoring system in patients with permanent demand pacemakers. Jpn Heart J 26: 23-32 Otterstad JE, Selmer R, Strom O (1981) Prognosis in cardiac pacing. A comparison between patients with atrioventricular block and sick sinus syndrome. Acta Med Scand 210: 47-52 Oupadia P and Ramaswamy K (1998) Images in clinical medicine. "R-on-T" phenomenon. N Engl J Med 338: 1812 Parsonnet V, Villanueva A, Driller J, Bernstein AD (1981) Corrosion of pacemaker electrodes. Pacing Clin Electrophysiol 4: 289-296 93 Literatur Permutti B, Mongiat R, Cardin G, Dalla VS (1976) [Longitudinal study on the morbidity and mortality of patients with artificial pacemakers]. Boll Soc Ital Cardiol 21: 417-424 Perper JA, Kuller LH, Cooper M (1975) Arteriosclerosis of coronary arteries in sudden, unexpected deaths. Circulation 52: III27-III33 Pieterse MG, den Dulk K, van Gelder BM, van Mechelen R, Wellens HJ (1994) Programming a long paced atrioventricular interval may be risky in DDDR pacing. Pacing Clin Electrophysiol 17: 252-257 Poole JE and Bardy GH (1995) Sudden cardiac death. In: Zipes, D. P.: Cardiac electrophysiology: from cell to bedside. 2. Aufl. Saunders, Philadelphia, London. S. 812-832 Preston TA (1973) Anodal stimulation as a cause of pacemaker-induced ventricular fibrillation. Am Heart J 86: 366-372 Preston TA (1975) Pacer-induced ventricular tachycardia. In: Furman, S. and Escher D.J.W.: Modern cardiac pacing. 1. Aufl. Charles Press, Bowie, MD Quertermous T, Megahy MS, Das Gupta DS, Griem ML (1983) Pacemaker failure resulting from radiation damage. Radiology 148: 257-258 Quintal R, Dhurandhar RW, Jain RK (1984) Pseudo failure of sensing in patients with universal pacemakers and junctional rhythms. J Electrocardiol 17: 205-208 Richter-von Arnauld HP, Thiem AE, Westermann KW (1974) Interferenzprobleme bei der Schrittmacherbehandlung. Med Klin 69: 1500-1505 Schechter DC (1972) Background of clinical cardiac electrostimulation. N Y State J Med 72: 271 Scheibelhofer W, Glogar D, Probst P, Milczoch J, Kaindl F (1982a) Induction of ventricular tachycardia Electrophysiol 5: 587-592 by pacemaker programming. Pacing Clin 94 Scheibelhofer W, Kaliman J, Elektrokardiographische Literatur Laczkovics A, Befunde Mayr H, bei Probst der P (1982b) physiologischen Schrittmachertherapie. Acta Med Austriaca 9: 72-77 Schibgilla V, Nossen J, Kuhn I, Bachmann K (1998) [Anti-bradycardia ventricle stimulation during the vulnerable phase of the heart cycle in ICD system with DDD cardiac pacemaker function]. Z Kardiol 87: 640-643 Seipel L, Bub E, Driwas S (1975) Kammerflimmern bei Funktionsprüfung eines Demand-Schrittmachers. Dtsch Med Wochenschr 100: 2439-2442 Seipel L, Bub E, Loogen F (1976) Ventricular fibrillation induced by a unipolar implanted pacemaker (cathodal stimulation). Am Heart J 92: 810-811 Seipel L, Pietrek G, Korfer R, Loogen F (1977) Prognose nach Schrittmacherimplantation. Internist (Berl) 18: 21-24 Shen WK, Hammill SC, Hayes DL, Packer DL, Bailey KR, Ballard DJ, Gersh BJ (1994) Long-term survival after pacemaker implantation for heart block in patients > or = 65 years. Am J Cardiol 74: 560-564 Siddons H (1974) Deaths in long-term paced patients. Br Heart J 36: 1201-1209 Simon AB and Janz N (1982) Symptomatic bradyarrhythmias in the adult: natural history following ventricular pacemaker implantation. Pacing Clin Electrophysiol 5: 372-383 Simon AB and Zloto AE (1978) Atrioventricular block: natural history after permanent ventricular pacing. Am J Cardiol 41: 500-507 Souliman SK and Christie J (1994) Pacemaker failure induced by radiotherapy. Pacing Clin Electrophysiol 17: 270-273 Steinbach K, Laczkovics A, Mohl W (1978) Schrittmacherpatienten. Acta Med Austriaca 5: 1-5 Plötzlicher Herztod bei 95 Literatur Steinbach K, Nürnberg M, Rymarz P, Jakl G (1995) Source of error in the calculation of sudden death rate in pacemaker patients. Cor Europaeum 4: 140-142 Strata G, Pauletti M, Contini C (1979) [Incidence of sudden death in 652 patients with pacemakers]. Boll Soc Ital Cardiol 24: 735-740 Sykosch J, Effert S, Pulver KJ, Zacouto F (1963) Zur Therapie mit elektrischen Schrittmachern. Ein implantierbarer, induktiv ausschaltbarer elektrischer Schrittmacher. Elektromedizin 8: 139 Tegtmeyer CJ, Bezirdjian DR, Irani FA, Landis JD (1981) Cardiac pacemaker failure: a complication of trauma. South Med J 74: 378-379 Trappe HJ (1996) Können Mobiltelefone im C- und D-Netz Herzschrittmacherpatienten gefährden? Dtsch Med Wochenschr 121: 645 Tung RT, Shen WK, Hayes DL, Hammill SC, Bailey KR, Gersh BJ (1994) Long-term survival after permanent pacemaker implantation for sick sinus syndrome. Am J Cardiol 74: 1016-1020 van Cleve RB, Sung RJ, Maytin O, Castellanos A (1978) Notes on ventricular tachycardia occurring during magnet waving and on the function of the OmniEctocor pacemaker. Eur J Cardiol 8: 543-551 Venselaar JL, Van Kerkoerle HL, Vet AJ (1987) Radiation damage to pacemakers from radiotherapy. Pacing Clin Electrophysiol 10: 538-542 Vera Z, Mason DT, Awan NA, Hiliard G, Massumi RA (1975) Lack of sensing by demand pacemakers due to intraventricular conduction defects. Circulation 51: 815-822 Vijayaraman P, Vaidya K, Kim SG, Gross JN, Ferrick KJ, Palma E, Furman S, Fisher JD (2002) Runaway pulse generator malfunction resulting from undetected battery depletion. Pacing Clin Electrophysiol 25: 220-222 96 Literatur Vuori I, Makarainen M, Jaskelainen A (1978) Sudden death and physical activity. Cardiology 63: 287-304 Wallace WA, Abelmann WH, Norman JC (1970) Runaway demand pacemaker: report, in vitro reproduction, and review. Ann Thorac Surg 9: 209-220 Weaver WD, Lorch GS, Alvarez HA, Cobb LA (1976) Angiographic findigs and prognostic indicators in patients resuscitated from sudden cardiac death. Circulation 54: 895-900 Wehr M (2001) Praktische Arrhythmiediagnostik und -therapie: Ein Leitfaden für Studenten und Ärzte in Klinik und Praxis. 1. Aufl. Steinkopff, Darmstadt Werdan K., Trappe H.-J., Zerkowski H.-R. (2003) Das Herzbuch. Praktische Herzkreislaufmedizin. 1. Aufl. Urban und Fischer Verlag, München, Jena Wilke A, Grimm W, Funck R, Maisch B (1996) Influence of D-net (European GSMStandard) cellular phones on pacemaker function in 50 patients with permanent pacemakers. Pacing Clin Electrophysiol 19: 1456-1458 Wilke A, Kruse T, Funck R, Maisch B (1997) Störbeeinflussung von Herzschrittmachern. Dtsch Med Wochenschr 122: 517-522 Wilke A, Noll B, Maisch B (2000) Rezidivierendes Kammerflimmern nach Defibrillation bei einem Schrittmacherpatienten. Med Klin 95: 523-526 Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, Kutalek SP, Sharma A (2002) Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 288: 3115-3123 Wirtzfeld A, Lampadius M, Ruprecht EO (1972) Unterdrückung von DemandSchrittmachern durch Myopotentiale. Dtsch Med Wochenschr 97: 61-66 Young KR and Bailey WM (2002) Twiddler's syndrome: an unusual cause of pacemaker malfunction. J La State Med Soc 154: 152-153 97 Literatur Zehender M, Brunner M, Grom A, Faber T, Büchner C (1999) Stellenwert und Pathogenese des plötzlichen Herztodes bei Patienten nach Schrittmacherimplantation. Herzschrittmachertherapie und Elektrophysiologie 10: II/69-II/77 Zehender M, Büchner C, Faber T, Meinertz T, Just H (1994) Plötzlicher Herztod während permanenter Herzschrittmachertherapie. Herzschrittmachertherapie und Elektrophysiologie 5: 59-66 Zehender M, Buchner C, Meinertz T, Just H (1992) Prevalence, circumstances, mechanisms, and risk stratification of sudden cardiac death in unipolar singlechamber ventricular pacing. Circulation 85: 596-605 98 Literatur