Toxikologie für Chemiker und andere Naturwissenschaftler
Werbung

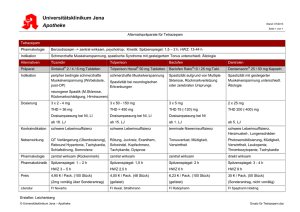
Block 3 Toxikologie für Chemiker und andere Naturwissenschaftler Kennwort für Skript: Tox_N260 Die Vorlesungsunterlagen wurden nach bestem Wissen und Gewissen zusammengestellt, erheben aber nicht den Anspruch auf Vollständigkeit. Keine Gewähr für eventuelle Fehler! Stand: 04.02.10 PD Dr. Gunter P. Eckert Pharmakologisches Institut für Naturwissenschaftler Universität Frankfurt [email protected] Toxikokinetik Toxikokinetische Parameter !! Quantitative Untersuchungen zur Invasion eines Stoffes und toxikologisch relevanter Metabolite und Zeitgang seiner Elimination !! Anhand toxikokinetischer Daten wird die innere Belastung mit dem ultimal wirksamen Stoff ermittelt !! Messung von Konzentrations-Zeit-Verläufen der applizierten Substanz und relevanter Metaboliten in Körperflüssigkeiten, Organen und Exkrementen Toxikokinetische Parameter Bioverfügbarkeit !! Bioverfügbarkeit (F): Anteil eines Pharmakons/Toxikons, der unverändert ins systemische Blut, d.h. in den großen Blutkreislauf gelangt !! i.v. Applikation = 100% !! absolute Bioverfügbarkeit: F = AUC / AUC i.v. !! relative Bioverfügbarkeit: F = AUC A / AUC B Toxikokinetische Parameter Verteilungsvolumen !! Verteilungsvolumen (V): ist ein Proportionalitätsfaktor zwischen der im Organismus vorhandenen Menge (M) eines Stoffes und seiner Plasmakonzentration (C) !! V=M/C Toxikokinetische Parameter !! Verteilungsvolumen (V): V=M/C !! Bei bekanntem V einer Substanz lässt sich die Menge berechnen, die notwendig ist um eine bestimmte Plasmakonzentration zu erreichen. Scheinbares Verteilungsvolumen Scheinbares Verteilungsvolumen Toxikokinetische Parameter Clearance !! Clearance (CL): Maß für die Fähigkeit eines Organismus einen Fremdstoff zu eliminieren !! totale CL (Gesamtkörperclearence): Summe aus renaler (CLR) und extrarenaler (CLNR) Clearance. > gibt die Geschwindigkeit an, mit der ein Fremdstoff bei einer bestimmten Plasmakonzentration eliminiert wird! !! CL = M / AUC (M = im Organismus vorh. Stoffmenge, AUC = area under curve der Konzentrations-Zeit-Kurve) Toxikokinetische Parameter Halbwertszeit !! Halbwertzeit (HWZ) entspricht der Zeit, in der die Konzentration einer Substanz auf 50% des Ausgangswertes abgesunken ist. Toxikokinetische Parameter Halbwertszeit !! Halbwertszeit (HWZ): Die HWZ ist die Zeitspanne, in der die Konzentration des Pharmakons / Toxikons im Organismus um die Hälfte abnimmt !! terminale HWZ (HWZ des langsamsten Prozesses) !! HWZ umso länger, je größer Bioverfügbarkeit !! HWZ umso kürzer, je größer Clearence !! HWZ = ln2 x Vd/Cl (Vd = Verteilungsvolumen, Cl= Clearence*) *Vd=M/C Cl=M/AUC Toxikokinetische Parameter Halbwertszeit !! Kinetik 1. Ordnung liegt vor, bei Elimination mit konstanter Clearance = Abhängig von Konzentration des Stoffes! !! Kinetik 0. Ordnung liegt vor, wenn pro Zeitintervall nur eine gleichbleibende Stoffmenge eliminiert werden kann; also die Eliminationsgeschwindigkeit konstant ist. (Bsp. Enzym arbeitet am Maximum: Alkoholdeyhdrogenase > Alkoholkontrolle) Toxikokinetik Wiederholte Exposition !! in der Praxis liegt häufig eine wiederholte, oft regelmäßige Exposition gegenüber einem chemischen Stoff vor, z.B. am Arbeitsplatz !! meist bei der zweiten Exposition noch Restkonzentration der ersten Stoffaufnahme im Plasma vorhanden, abh. von HWZ und Zeitraum zwischen 1. und 2. Exposition !! Plateauausbildung !! c = (1,44 x t1/2 x D) / (V x T) Denke an Kumulation! (c :mean Plasmaconc., t1/2: HWZ, D: aufgenommene Dosis pro Exp., V: Verteilungsvolumen, T: Zeitabstand zwischen den Expositionen) Toxikologische Prüfmethoden "! Anforderungen "! Akute Toxizitätsprüfung "! Chronische Toxizitätsprüfung "! Genotoxizität Toxikologische Prüfmethoden !! Toxikologische Untersuchungen gefordert bei: !! behördliche Zulassung von Arzneimittel !! behördliche Zulassung von Pflanzenschutzmitteln !! Anmeldung neuer Chemikalien !! Registrierung von Lebensmittelzusatzstoffen !! Registrierung von Kosmetika !! Problematik: erhebliche Unterschiede in den Anforderungen nationaler Behörden Toxikologische Prüfmethoden !! OECD (Organization for Economic Co-Operation and Development): Ziel ist die Harmonisierung toxikologischer Prüfmethoden !! Gute Laborpraxis (GLP) !! Tierschutzgesetz und Tierversuche !!Anzeigepflicht wenn Tierversuch gesetzlich vorgeschrieben (Ausnahme der Genehmigungspflicht von Tierversuchen) !!verboten bei Tabak, Kosmetika, Waschmittel !!Ersatz durch „Methoden an schmerzfreier Materie“ Toxizitätsuntersuchungen Spezielle Tests zur Charakterisierung der Toxizität: •! •! •! •! •! •! •! Akute Toxizität (z.B. LD50) Chronische Toxizität Prüfung auf Unbedenklichkeit (z.B. NOEL) Mutagenität (z.B. Ames-Test) Kanzerogenität Reproduktionstoxizität (z.B. Embryo-Stammzell Test) Organtoxizität Applikations- und Resorptionsformen !! Applikationswege bei Versuchstieren: !!i.v., intravasal (i.d.R. intravenös) !!s.c., subkutan (ins Unterhautgewebe) !!i.m., intramuskulär (in die Muskulatur) !!i.p., intraperitoneal (in die Bauchhöhle) !!oral (Sondierung, Futter) !!inhalativ !!dermal Akute Toxizitätsprüfung !! nicht identisch mit LD50 - geht viel weiter !! aus der sorgfältigen Prüfung der akuten Toxizität lassen sich folgende Informationen erhalten: !!Vergiftungssymptome !!Zeitverlauf (Beginn, Abklingen, Reversibilität, verzögerter Verlauf) !!Dosis-Wirkungsbeziehung !!geschlechtsspezifische Unterschiede !!betroffene Organe, Gewebe, Funktion !!Wirkungsweise !!höchste nicht toxische (NOAEL), niedrigste toxische Dosis !!mittlere tödliche Dosis (LD50) Akute Toxizitätsprüfung !! Einmaldosis, zumeist Nager !! Wahl des Applikationsweges - Exposition des Menschen !! Je nach behördlicher Anforderung !!Dosierungen, die zu deutlichen klinischen Schädigungen ohne Tod führen !!für Einstufung von Chemikalien und Pflanzenschutzmitteln LD50: Dosis im letalen Bereich (mg/kg KG) dient der Einteilung in Giftklassen: <25 sehr giftig 25-200 giftig 200-2000 mindergiftig >2000 nicht giftig Akute Toxizitätsprüfung Acute Toxic Class-Test !! Klassifizierung chemischer Stoffe in die Giftklassen der EU mit verminderter Tierzahl (Ersatz für LD50) !! Vorteil: 25 Tiere auf 7,5 Tiere im Mittel reduziert !! Einstufung mittels ATC vs. LD50-Methode: 88% Übereinstimmung !! international validiert und von OECD akzeptiert Akute Toxizitätsprüfung: Draize-Test Augenreizung !! Identifizierung von Reizstoffen (Irritationstest) !! Kaninchen (hohe Empfindlichkeit vs. Mensch) !! Haut - Bindehautsack (100!l - extreme Bedingung) !! Rötung, Quaddeln, Nekrose, Hornhauttrübung, Tränenproduktion !! Beurteilung: 5 Schweregrade nicht - leicht - mäßig - stark - extrem reizend !! Resultate nicht unmittelbar auf Mensch übertragbar !! Ersatztest: Hühnereitest (HET-CAM) Weitere Toxizitätsprüfungen wiederholte tägliche Applikation !! Prüfung auf subakute Toxizität (28-Tage-Test) !! Prüfung auf subchronische Toxizität (90-TageTest) ! NOAEL, Kumulation !! Prüfung auf chronische Toxizität (Langzeitversuch) - Kanzerogenitätsstudien MTT-Test: In vitro! Genotoxizität !! Ziel von Gen(o)toxizitätsprüfungen !!Erfassung des Risikos vererbbarer Schäden für die folgenden Generationen !!Hinweise auf kanzerogene Eigenschaften !! Chemische und physikalische Noxen können das Erbgut von Zellen / Organismen schädigen !!Mutationen !!Indikatoren (Hinweise auf mögliche Auslösung genetischer Veränderungen) Genotoxizität !! Genmutationen (z.B. AMES- / Salmonella-Mutagenitätstest) !!Veränderungen der DNA !!lichtmikroskopisch nicht sichtbar !!Punktmutationen !!Deletionen / Insertionen größerer DNA-Bereiche !!Zustand eines Gens (Allele): wild-type (wt) - Mutation !!wt-Allel ! Mutation: Vorwärtsmutation !!umgekehrt Rückmutation Ames Test Ermittlung der potenziellen genmutierenden Wirkung einer Testsubstanz Durch Einsatz unterschiedlicher Stämme lassen sich verschiedene mutagene Meachanismen nachweisen: z.B. mit TA 100 Basenaustausch oder mit TA 98 Rasterverschiebung der DNA •! Einmalige Applikation mehrerer Dosierungen auf histidinfreie Agarplatten mit speziellen Salmonella –typhimurium-Bakterienestämmen > wachsen im Gegensatz zum Wildtyp nicht ohne Histidin. •! [Kontrolle, Positivstandard (z.B. "-Naphtylamin), Testsubstanz)] + Aktivator (Lebermikrosomen). •! Durch Mutation erhalten Bakterien die Fähigkeit des Wildtyps zurück > Revertanten > Kolonienwachstum auf histidinfreien Agarplatten. Genotoxizität !! Chromosomenmutationen (Schwesterchromatiden- Austausch-Test) !!Abberationen im Lichtmikroskop erkennbar (Abweichung in Zahl 46 und Gestalt) !!Chemikalien-induziert meist in DNA-Synthesephase (S-Phase) Genotoxizität !! Genommutationen !!Aneuploidie (z.B. Nullisomie oder Trisomie) !! Indikatoren für genotoxische Effekte !!gehen Mutation meist voraus !!kovalente Bindung von Stoffen an DNA !!induzierte DNA-Doppelstrangbrüche Prüfung auf Mutagenität und Kanzerogenität !! einzelne Testsysteme keine sichere Aussage über gentoxische Wirkungen am Menschen !! Testbatterie !!Genmutationstest an Bakterien !!Genmutationstest an Säugerzellen (Kultur) !!Chromosomenaberrationstest an Säugerzellen (Kultur) !!Zelltransformationstests an Säugerzellen (Kultur) Erbgutverändernde Stoffe !! Stoff mit guter systemischer Verfügbarkeit und In-vitro-Mutagenität ist mit hoher Wahrscheinlichkeit auch in-vivo mutagen und kann Gonaden erreichen ! Keimzellmutationen !! nach EG-Richtlinie: 3 Kategorien !!Kategorie 1: bekannte erbgutverändernde Wirkung am Menschen !!Kategorie 2: Annahme einer erbgutverändernden Wirkung am Menschen (Tierversuche, relevante Informationen) !!Kategorie 3: kein Verdacht auf erbgutverändernde Wirkung am Menschen Reproduktions- und Embryotoxizität !! Reproduktionstoxizität: !! Schädigung des Reproduktionsvorganges, !! die die Libido (Verpaarungsverhalten), den Ovulationszyklus, die Gonadenfunktion und die Fertilität (Nachkommenschaft) umfasst (Generationsstudien) !! und im weiteren Sinn auch die Embryonal- und !! Fetalphase und die peri- und postnatale Entwicklung umfasst (Embryotoxizität, Teratogenität (Mißbildungen), Mutagenität) Reproduktions- und Embryotoxizität !! Teratogenität: die Eigenschaft eines Stoffes, die während der Entwicklung des Keimes von der befruchteten Eizelle zum Embryo zu Störungen führen kann !! Embryotoxizität: Schädigung des Embryos während der Organogenese (Absterben, Organdysfunktion, Mißbildung) !! Fetotoxizität: Schädigende Wirkung auf den Fetus (ab 12. Woche) nach Abschluß der Organogenese Thalidomit (Contergan®) Molekularer Mechanismus: Verminderung der Expression von Adhäsionsrezeptoren (z.B. Integrinen). Wichtig für Zell- Zell – Kontakte.Sehr geringe Toxizität Kritische Phase: 24-35 Tage nach Konzeption Testing requirements for the notification of new chemical substances in the EU Volume marketed in EU Toxicity studies Acute Toxicity (rat, oral or inhalative) Acute Toxicity (rat, 2nd route) Skin Irritation Eye Irritation Skin Sensitisation Mutagenicity (bacterial) Mutagenicity (in vitro, non-bacterial) Subacute Toxicity (rat, 28 d) Ecotoxicity studies Fish: Acute Toxicity (96h) Daphnia: Acute immobilisation (48h) Algae: Growth inhibition (72h) Bacteria: Respiration inhibition Ready biodegradation 10 - <100 kg x 100 - <1000 kg 1000 kg - <100 t x x x x x x x x x x x x x x x x x x x x Gewerbetoxikologie !! Krankheiten hervorgerufen durch schädliche Stoffe am Arbeitsplatz ! Präventivmaßnahmen !! Aufstellung maximaler Arbeitsplatzkonzentrationen (MAK-Werte): Höchstzulässige Konzentration eines Arbeitsstoffes in der Luft (Gas/Aerosol), bei deren Einhaltung in 8-Stunden-Schichten, an 5 Tagen / Woche die Gesundheit ein Arbeitsleben lang nicht beeinträchtigt wird (festgelegt von Kommission der DFG) !! BAT-Wert (Biologischer Arbeitsstoff-Toleranzwert): Kontrolle der Schadstoffaufnahme durch Analysen im biologischen Material (Harn, Blut, Kot, Exhalationsluft). Höchstzulässige Quantität eines Arbeitsstoffes /Metabolit, die die Gesundheit des Beschäftigten nicht beeinträchtigt ADI-Wert !! ADI-Wert (acceptable daily intake): Dosis eines Schadstoffes, die nach dem gegenwärtigen Kenntnisstand bei lebenslanger täglicher Aufnahme nicht zu Gesundheitsstörungen führt !! festgelegt von WHO !! Grenzwertdosis errechnet durch Division des NO(A)EL aus Tierexperiment mit einem Sicherheitsfaktor (meist SF 10-100) NOEL Wirkungsschwelle Effekt Maximaldosis 100 50 Grenzwert NOEL 0 Sicherheitsfaktor Dosis








![Benzodiazepin [Kompatibilitätsmodus]](http://s1.studylibde.com/store/data/002629917_1-a28c6e2e51dfaa5beeede6d883f3aab2-300x300.png)
