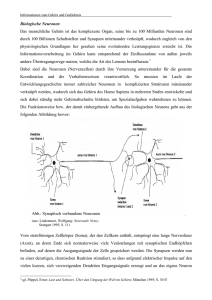
Neurobiologie
Werbung

Zusammenfassung Bio 143 Frühlingssemester 09 Neurobiologie Einführung VL1 Geschichte der Neurobiologie In der Antike galten noch zwei Thesen, die Kardiozentrische These (Aristoteles) und die Zephalozentrische These. In der Renaissance waren Leonardo da Vinci (Wachsabdrücke von Hohlräumen) und Descartes (Dualismus) vorherrschend. Später entwickelte Franz Joseph Gall (1758-1828) die Phrenologie. Seine Theorie besagte, dass das Gehirn aus verschiedenen Funktionsmodulen besteht und diese auch verschieden Grössen haben können. Wenn z.B. jemand schlau sei, hätte er auch ein grosses Modul für Wissen (Schädelvermessungen auf Intelligenz schliessen). In der Hirnanatomie forschten vor allem Carl Wernicke (1848 – 1905, Wernickeareal), Paul Broca ( 1824 – 1905, Broca-Areal) und Korbinian Brodmann (1868 – 1918, Brodmannkarten). Zu Beginn des 20. Jahrhunderts entwickelte Camillo Golgi (1843 – 1926) eine Theorie die besagte, dass das Gehirn eine einzelne grosse Zelle sei. Ramon y Cajal (1852 -1943) widerlegte diese Theorie, es seien verschiedene Nervenzellen, welche die zelluläre Struktur beschreiben. Bernard Eccles (1903 – 1997), Bernard Katz (1911 – 2003), Stephen Kuffler (1913 -1980) und Charles Sherrington (1857 – 1952) arbeiteten in der Neurophysiologie (elektrische Stösse, Spannung). Im Bereich der Cortexorganisation machten sich David Hubel und Torsten Wiesel einen Namen. Zellen des Nervensystems Neuronen Grosse Vielfalt Gliazellen Astrozyten(trophische Unterstützung, NTAufnahme) Mikroglia (Entst. im Mesoderm, Phagozytose) Oligodendrozyten (Myelinisierung im ZNS) Schwannsche Zellen (Myelinisierung im PNS) 1 100Mia im menschlichen Gehirn, davon jede 1000 Synapsen 10 Gliazellen auf ein Neuron Transportmechanismen Langsamer axonaler Transport: 1mm/Tag, anterograd, v.a. Zytoskelettelemente, lösliche Substanzen Schneller axonaler Transport: 250-400mm/Tag, anterograd (Membranvesikel) und retrograd (Neurotrophine) Gliazellen sind wichtige Partner der Neurone (Astrozyten beseitigen Neurotransmitter aus der Synapse) Astrozyten (Glykolyse) und Neuronen (Atmungskette) kooperieren bei der Energieversorgung. Anatomie und Funktion des Nervensystems VL2 Begründer der anatomischen Neurowissenschaft ist Andreas Vesalius. Die Frage war immer, wie kommt man von der Struktur zur Funktion? Methoden, um die Struktur des Gehirns zu sehen: Sektion, Schnitte, Färbung, Tracing, genetische Markierungsmethode, durch Antikörper sichtbar machen Aktivitäten des Gehirns: Interaktionen mit der Umwelt Aktivitäten, die die Körperfunktionen regulieren Geistige Aktivitäten Zusammenfassung Bio 143 Frühlingssemester 09 Funktionelle Einheiten/Systeme: Sensorisches System Sehen, Hören, Riechen, Geschmack, somatische Eindrücke Motorisches System Reflexe, Planung, Koordination und Initiation von Bewegungen Assoziative Systeme Verbindet sensorisch und motorische Systeme, „higher order“ functions Reproduktion, Appetit, Salz- und Wasserhaushalt, Schlaf, Aufmerksamkeit Interne Regulationsmechanismen Rezeptoren in Haut und Muskulatur, Relais- Zellen im Rückenmark und im Thalamus, Cortex Muskulatur, Motoneuronen im Rückenmark, Kleinhirn, Basalganglien, Motorischer Cortex, Thalamus Hypothalamus, Hypophyse, Medulla, Pons, Cortex Bildgebende Verfahren: PET, fMRI, Aktivitäsmessungen, EEG, Elektrophysiologie Um Gene zu untersuchen, werden Tiermodelle verwendet. Einfacher Reflex-Kreislauf 2 Zusammenfassung Bio 143 Frühlingssemester 09 ZNS: Hirn und Rückenmark (Zellkörper) PNS: Hirnnerven und Rückenmarksnerven Vorderhirnstruktur: Frontallappen, Parietallappen, Temporallappen, Occipitallappen Elektrische Eigenschaften von Nervenzellen VL 3 Ruhemembranpotenzial Wenn eine Mikroelektrode in eine Neurone eingeführt wird, kann damit ein negatives Potenzial gemessen werden. Also haben Neurone eine konstante Spannung, wenn sie im Ruhezustand sind dies ist das Ruhemembranpotenzial (-40 bis -90mV) Synaptisches Potenzial Elektrische Signale, welche von Neuronen produziert werden, erfolgen durch Stimuli, welche dann das Ruhemembranpotenzial verändern. Ein weiteres elektrisches Signal gibt es bei der Kommunikation zwischen Neuronen durch synaptische Kontakte. Wenn die Synapsen aktiviert werden, generiert dies ein synaptisches Potenzial. 3 Aktionspotenzial Axone sind eigentlich keine guten elektrische Leiter. Um dies zu kompensieren, haben Neurone ein „booster system“ entwickelt, um elektrische Signale über grössere Distanzen zu senden. Diese elektrischen Signale nennt man Aktionspotenziale. Um ein Aktionspotenzial zu messen, kann man elektrischen Strom durch eine zweite Elektrode und anschliessen einer Batterie durchschicken. Wenn nun das Membranpotenzial negativer wird, gibt es eine Hyperpolarisation. Spannender ist es jedoch, wenn umgekehrte Polarität gesendet wird. Das Membranpotenzial wird positiver als das Ruhepotenzial (Depolarisation). Auf einem gewissen Level, beim Threshold potential geschieht nun das Aktionspotenzial. Es ist eine aktive Antwort des Neurons, ein kurzer Wechsel von negativ zu positiv im Transmembranpotenzial. Ionentransporter und Ionenkanäle sind verantwortlich für die Ionenbewegung durch die Membran Zwischen den Membranen der Nervenzellen gibt es unterschiedliche Konzentrationen und die Membrane sind selektiv durchlässig. Der Ionen-Konzentrationsgradient ist bestehend aus Proteinen, den Active Transporter, welche aktiv Ionen raus oder in die Zelle rein gegen den Konzentrations-Gradienten transportieren. Die selektive Permeabilität kommt durch die Ionenkanäle zustande. Dies sind Proteine, welche nur gewissen Ionen erlauben die Membran in Richtung ihres Konzentrationgradienten zu passieren. So arbeiten Ionenkanäle und Transporter gegeneinander und generieren alle elektrischen Impulse, welche von den Neuronen kommen. Beispiel: Membran, welche nur für Kaliumionen durchlässig ist. Wenn die Konzentration von K+ auf beiden Seiten gleich ist, ist kein elektrisches Potenzial messbar. Falls sie aber nicht gleich ist, wird ein elektrisches Potenzial generiert. Wenn die Konzentration von K auf einer Seite (Kammer 1) 10mal höher ist als auf der anderen Seite (Kammer 2), dann wird das elektrische Potenzial in Kammer 1 negativ sein. Dieser Unterschied entsteht, da Kaliumionen nach ihrem Konzentrationsgradienten fliessen und die positive Ladung mitnehmen. In diesem hypothetischen Fall wäre sehr schnell ein Equilibrium erreicht. Wenn sich K von Kammer 1 zu Kammer 2 bewegt, entsteht ein Potenzial, welches den Fluss von K+ hemmt (der Potenzialgradient weist die K-Ionen ab, welche sonst durch die Membran gehen würden). Wenn nun Kammer 1 positiver wird, wird sie zugleich weniger attraktiv für die für die positiv geladenen K-Ionen. Die Durchflussmenge von K wird an dem Punkt stoppen, wo der Potenzialwechsel genau den Konzentrationsgradienten entlastet. Bei diesem elektrochemischen Gleichgewicht herrscht exakte Balance zwischen den folgenden Kräften: 1) dem Konzentrationsgradienten, welches K von 1 nach 2 wandern lässt und dem entgegengesetzten 2) elektrischen Gradienten, welcher K hemmt zu fliessen. Zusammenfassung Bio 143 Frühlingssemester 09 Das Equilibriumpotenzial kann durch die Nernstgleichung errechnet werden. 𝐸(𝑥) = 𝑅𝑇 𝑐𝑋2 𝑙𝑛 𝑧𝐹 𝑐𝑋1 Ex ist das Gleichgewichtspotenzial irgendeines Ions X. R = Gaskonstante (8,31447 J mol−1 K−1) T = absolute Temperatur F = Faradaysche Zahl (96485,34 C mol−1) z = Ladung cX = Konzentration von X Weil es einfacher ist mit Raumtemperaturen zu rechnen und mit 10er Logarithmen wird die Formel umgewandelt: 𝐸(𝑥) = cK cNa cCl innen (i) 140 10 10 58 𝑐𝑋𝑎 𝑙𝑜𝑔 𝑧 𝑐𝑋𝑖 aussen (a) 5 150 100 mM Die Zahlen können nun einfach eingesetzt werden: 4 𝐸 𝐾 = 58 5 𝑙𝑜𝑔 = −84 𝑚𝑉 𝑧 140 Wenn die Konzentration von K innen höher ist als aussen, ergibt es innen ein negatives Membranpotenzial (Gleichgewichtspotenzial) = Umkehrpotenzial 𝐸 𝑁𝑎 = 58 150 𝑙𝑜𝑔 = +68𝑚𝑉 𝑧 10 Beispiel mit der Batterie: Wenn die Batterie nicht eingeschaltet ist, fliesst z.B. K von 1 zu 2 und es entsteht ein negatives Membranpotenzial. Wenn nun die Batterie die Kammer 1 negativer macht, wird weniger K fliessen, da das negative Potenzial K zurückhalten wird. Es muss nun -58mV werden damit kein K mehr fliesst. Wenn nun Kammer 1 negativer als -58mV wird, fliessen K-Ionen von 2 nach Zusammenfassung Bio 143 Frühlingssemester 09 1. Es zeigt, dass Richtung und Ionenflussmenge vom Membranpotenzial abhängen. Das elektrische Potenzial kann zum ionischen Konzentrationsgradienten werden. Ionen folgen Konzentrationsgefälle 5 kein Netto-Ionenfluss Ionen fliessen gegen Konzentrationsgefälle Goldmanngleichung Da ja mehrere verschiedene Ionen in einer Zelle vorkommen und Membrane auch für verschiedene Ionen durchlässig sein können, wird die Gleichung komplizierter. Die relativer Permeabilität muss nun auch mit einberechnet werden. E= Elektrizität der Membran P= relative Permeabilität 𝐸 𝑍𝑒𝑙𝑙𝑒 = 58 𝑙𝑜𝑔 relative Permeabilität P(Na)= 1 P(K) = 20 P(Cl) = 0.1 𝑃 𝐾 𝑐𝐾𝑎 + 𝑃 𝑁𝑎 𝑐𝑁𝑎 𝑎 + 𝑃 𝐶𝑙 𝑐𝐶𝑙 𝑖 𝑃 𝐾 𝑐𝐾𝑖 + 𝑃 𝑁𝑎 𝑐𝑁𝑎 𝑖 + 𝑃 𝐶𝑙 𝑐𝐶𝑙 𝑎 𝐸 𝑍𝑒𝑙𝑙𝑒 = 58 𝑙𝑜𝑔 100 + 150 + 1 = −61𝑚𝑉 2800 + 10 + 10 Dies ist nun das berechnete Ruhepotenzial der Zelle, es ist nahe beim Umkehrpotenzial. In Ruhe haben die neuronalen Membrane mehr Permeabilität für K+ als z.B. für Na+. Das Ruhemembranpotenzial ist negativ und nähert sich dem Gleichgewichtspotenzial für K+, EK. Während eines Aktionspotenzial, wird die Membran sehr durchlässig für Na+; das Membranpotenzial wird positiv nähert sich dem Gleichgewichtspotenzial von Na+, ENa. Die Erhöhung der Na-Permeabilität ist kurzlebig., so wird die Membran vor allem wieder durchlässig für K+, verursachend, dass das Potenzial wieder zu seinem negativen Ruhewert zurückkehrt. Siehe Bild: Zusammenfassung Bio 143 Frühlingssemester 09 Wie beeinflusst die äussere Konzentration von K+ das Ruhemembranpotenzial? An einem lebenden Tintenfisch wurden Experimente gemacht. Das Ruhemembranpotenzial variierte wie vorhergesagt mit dem Logarithmus von K+. z.B: wird das Ruhemembranpotenzial weniger negativ, wenn die äussere K-Konzentration erhöht wurde. Wenn die äussere Konzentration gleich hoch war, wie die Innere, nämlich das Gleichgewichtspotenzial von 0mV, zeigte auch das Ruhemembranpotenzial 0mV. 6 Zytosolische Kaliumkonzentration ist höher als extrazellulär Ionenpumpen erhalten dieses Konzentrationsgefälle Ruhepotential wird primär durch die Kaliumleitfähigkeit der Membran bestimmt Ein ähnliches Experiment zum Aktionspotenzial Es wurde die Rolle des Natriums beim Aktionspotential untersucht, indem getestet wurde, was passiert, wenn die Natriumkonzentration von der extrazellulären Flüssigkeit verringert wird. Man fand heraus, dass mit Verringern des Na, die Rate des Anstiegs des Aktionspotenzial und auch die Amplitudenspitze verringert wurde. Es hatte aber keinen Einfluss auf das Ruhemembranpotenzial. Denn die Membran ist in der Ruhephase nur wenig durchlässig für Na, aber während der Anstiegsphase und Überschreitung des Aktionspotenzial sehr permeabel für Na. Erklärung: die Erhöhung der Membranpermeabilität für Na geschieht durch die Na-selektivenKanäle, welche im Ruhezustand geschlossen sind. Membranpumpen haben einen grossen elektrochemischen Gradient für Na+ und aussen eine höhere Konzentration als innen. Wenn nun die Kanäle öffnen, fliesst Natrium ins Neuron, welches das Membranpotenzial depolarisiert und sich dem ENa nähert. Diese Phase des Oveshoots ist sehr kurz, auch die Erhöhung der Na-Permeabilität ist sehr kurzlebig. Sehr schnell findet die Repolarisation zum Ruhepotential statt und es folgt ein flüchtiger Undershoot. Während des Undershoots ist das Membranpotenzial kurz hyperpolarisiert weil die K-Permeabilität grösser wird als sie im Ruhezustand ist. Das Aktionspotenzial endet, wenn diese Phase der erhöhten K-Permeabilität abklingt und das Membranpotenzial wieder zum Ruhelevel zurück kehrt. Aktionspotenziale werden nur ausgelöst, wenn das Membranpotenzial positiver als der Threshold level (Schwellewert) ist. Die Voltage Clamp Methode Es war nicht möglich Aktionspotenziale zu verstehen, bis diese Methode entdeckt wurde. Sie erlaubte den Forschern Membranpotenziale zu kontrollieren und die Durchlässigkeit der Membran zu messen (Alan Hodgkin und Andrew Huxley). Zusammenfassung Bio 143 Frühlingssemester 09 Es zeigte auch dass die Membranpermeabilität des Axons spannunsabhängig ist. Die Experimente zeigten aber nicht, wie viele verschieden Arten von Permeabilität existiert und welche Ionen involviert waren. Da man bei dieser Methode das Potenzial änderen und gleichzeitig den Ionenstrom zu messen. Hodgkin und Huxley wollten sie auch die Ionenpermeabiltät bestimmen, indem sie erforschten, wie die Eigenschaften des frühen einwärts und des späten Auswärtsfluss änderte, wenn das Membranpotenzial variiert wurde. Es fliesst kein Strom, wenn das Membranpotenzial bei +52mV geklemmt wird. 7 Der Einwärtsstrom kehrt etwa bei +55mV um. Beim Squid-Neuron sagt die Nernst-Gleichung voraus, dass das Gleichgewichtspotenzial von Natrium (ENa) bei +55mV liegt. Wenn dieses Gleichgewicht besteht, gibt es keinen Na-Netto-Fluss mehr, auch wenn die Permeabilität hoch ist. Das Experiment zeigte keinen Fluss mehr Indikation, dass der frühe Einwärtsstrom natriumabhängig ist. Die Tatsache, dass der frühe Einwärtsstrom seine Richtung bei höheren Potenzialen als das ENa zeigt auch, dass es Natriumabhängig ist. Ein anderes Experiment zu testen, ob es Natriumabhängig ist: Was passiert, wenn die externe Natriumkonzentration verändert wird? Wenn externes Natrium verringert wird, wird ENa negativer, was bewirkt, das der Elektrochemische Gradient von Na umgekehrt wird und der Strom rausfliesst. Zwei verschiedene Ionen-Permeabilitätsmechanismen sind aktiv bei Wechsel des Membranpotenzials. Dies zeigten auch Tests mit Drogen, wie Tetrodotoxin (TTX) und Tetraethylammonium ions. TTX kommt in Fischen und Fröschen vor und blockiert den Na-Fluss, während Tetraethylammonium den K-Fluss blockiert. Reizweiterleitung VL 4 Axone sind schlechte Leiter. Die Stromleitung in Kabel und Neuronen in der Abwesenheit von Aktionspotenzialen nennt man passiven Stromfluss. Die passiven elektrischen Eigenschaften einer Nervenzelle können bestimmt werden, indem die Spannungsänderungen gemessen werden, wenn ein Stromimpuls durch die Axonenmembran fliesst. Wenn dieser Stromimpuls nicht hoch genug ist, um ein Aktionspotential auszulösen, nimmt das Potenzial exponentiell mit der Distanz zur Injektion ab. Passive Membraneigenschaften Der passive Fluss des elektrischen Stroms spielt z.B. eine zentrale Rolle bei der synaptischen Übertragung und der Ausbreitung des Aktionspotenzials. Beispiel zylindrisches Axon: unter Schwellwert liegender Strom wird in einen Teil des Axons injeziert und breitet sich passiv entlang des Axons aus, bis der Strom ausläuft. Die Abnahme des Flusses mit der Distanz wird durch folgende Formel beschrieben: Vx = V0 e-x/λ Zusammenfassung Bio 143 Frühlingssemester 09 Vx ist die Spannungsresonanz bei einer Distanz X entlang des Axons. V0 ist die Spannungsänderung beim Punkt der Injektion. e ist die Basis des natürlichen Logarithmus und λ ist die Längenkonstante des Axons. Die Längenkonstante ist die Distanz, bei der die Initial-Spannungsresonanz (V0) zu 1/e abfällt (oder 37%) Die Längenkonstante ist also das Mass, welches angibt, wie weit sich der Stromfluss ausbreitet bis er ausläuft. Undichtere Axone haben kürzere Längenkonstanten. Die Längenkonstante hängt von den physischen Eigenschaften des Axons ab, also von der relativen Dichte der Plasmamembran r m, der intrazellulären axoplasma ri, und dem extrazellulären Medium r0. Um den passiven Fluss nachzumessen, sollte die Dichte der Plasmamembran möglichst hoch sein und die anderen beiden tief. 8 Bei einer Zelle, bei der Membranpotenzial uniform ist, kann der Wechsel des Membranpotenzials zu jeder Zeit Vt nach dem Beginn des Stroms, wie folgt beschrieben werden: Vt = V∞(1-e-t/τ) V∞ ist der stabile Zustand des Membranpotentialwechsels, t ist die Zeit nach dem der Strom beginnt , und τ ist die Membran-Zeitkonstante. Die Zeitkonstante ist die Zeit, wenn die Spannungsresonanz Vt sich bis 1-(1/e) oder 63% des V∞ erhöht. Wenn der Impuls endet, ändert das Membranpotenzial, es kehrt zu 1/e von V∞ zurück. Vt = V∞ e-t/τ Die Zeitkonstante zeigt wie schnell ein Stromfluss das Potenzial ändert und sie hängt ab vom Widerstand der Membran (rm) und der Membrankapazität (cm) Zusammenfassung Bio 143 Frühlingssemester 09 Zusammenfassung Membraneigenschaften Die Längenkonstante λ ist ein Mass für die Effizienz der elektrotonischen Ausbreitung. Grosses λ (dickes Axon) bedingt schnellere und verlustfreiere Weiterleitung. Passive Membraneingenschaften spielen eine Schlüsselrolle bei der dendritischen Integra-tion. Die passive Ausbreitung von Strömen ist praktisch verzögerungsfrei. Zusammenfassung Fortleitung der Aktionspotenzialen: Die aktive Erregungsweiterleitung im Axon ist verzögert (Leitungsgeschwindigkeit). Fortleitung der APs benötigt aktiven und passiven Stromfluss. Die Depolarisation öffnet die Na+ Kanäle lokal und produziert ein Aktionspotenzial. Der resultierende Einwärtsstrom fliesst passiv entlang des Axons und depolarisiert die angrenzende Region. Zum späteren Zeitpunkt hat die Depolarisation der angrenzenden Region dort die Na Kanäle geöffnet, es kommt zu einem AP und der Einstrom breitet sich passiv aus zu angrenzenden Regionen, dort wird später wieder ein AP ausgelöst usw. Hinweis: während das AP sich ausbreitet, repolarisiert das Membranpotenzial weil sich die Kaliumkanäle öffnen und die Natriumkanäle inaktiviert werden, so dass die APs nicht zurück fliessen können. Myelinisierung Die Myelinisierung führt zu einer erhöhten Leitungsgeschwindigkeit. Die Myelinisierung ge-schieht durch Oligodendrozyten im zentralen Nervensystem und den Schwannschen Zellen im peripheren Nervensystem. Ionenkanäle VL 4 9 Übersicht Die elektrischen Signale in Neuronen benötigen Plasmamembranen, welche Konzentrationsgradienten für spezifische Ionen herstellen und auch dass die Membrane schnelle und selektive Wechsel in ihrer Durchlässigkeit durchleben. Die Membranproteine, welche Ionengradienten kreieren und erhalten, sind die Aktive Transporter (wichtigste: Natriumpumpe, welche ATP hydrolisiert, um intrazelluläre Konzentration von Na und K reguliert). Andere Proteine, Ionenkanäle verursachen Wechsel der selektiven Ionenpermeabilität. Ionenkanäle sind Transmembranproteine, welche eine Pore besitzen, durch die Ionen die Membran passieren können. Einige dieser Kanäle besitzen Strukturen, welche das elektrische Membranpotenzial erkennen. Solche Spannungsabhängige Kanäle öffnen oder schliessen auf Grund des Ausmasses des Potenzials, was erlaubt die Permeabilität durch das Potenzial zu steuern. Andere Kanäle werden durch extrazelluläre chemische Signale (Neurotransmitter) und andere durch intrazelluläre Signale (second messenger) gesteuert. Andere Kanäle reagieren auf Mechanische Stimuli, Temperaturänderung oder eine Kombination mehrerer Stimuli. Pharmakologische Untersuchung von Ionenkanälen Es wird z.B. das Gift von den Kegelschnecken untersucht, welche ein komplexes Gemisch an neuroaktiven Peptiden in ihre Beute spritzen. Diese Gifte inaktivieren verschiedene Ionenkanäle. Die Patchclamp Methode Eine Glaspipette mit sehr kleiner wird gebraucht um einen sehr engen Kontakt zur Membran herzustellen. Nach kurzem Ansaugen wird der Abstand so eng, dass keine Ionen mehr raus fliessen können. Es fliessen also nun alle Ionen in die Pipette hinein, wenn ein Kanal öffnet. Dieser kleine elektrische Strom kann mit einer ultrasensitiven Elektrode gemessen werden, welche an der Pipette angebracht ist. Diese Methode nennt man Cell attached recording. Zusammenfassung Bio 143 Frühlingssemester 09 Wenn nun der Membranfleck durch festes Ansaugen zerreisst, wird das innere der Zelle durchgängig mit dem Pipetteninnern. Somit kann man die ganze Zelle messen = Whole cell recording. Eine andere Möglichkeit ist, wenn kleiner Stücke der Membran losgelöst werden ohne die Dichtung zu zur Pipette zu verringern. Nun wird der Teil in die Luft gehalten. Dies ist das Inside-out recording. Es erlaubt die Messung von Einzel-Kanäl-Ströme und auch die intrazelluäre Flüssigkeit kann gewechselt werden und Einflüsse von intrazellulären Molekülen beobachtet werden. Oder der Membranfleck wird so prepariert, dass seine extrazelluläre Oberfläche ausgesetzt ist Outside-out recording. So können die Neurotransmitteraktivitäten gemessen werden. Spannungsabhängige Kanäle: Die Gates von beiden Kanälen sind geschlossen, wenn das Membranpotenzial hyperpolarisiert ist. Wenn das Potenzial depolarisiert, erlauben Spannungssensoren (mit + gekennzeichnet) die Kanalpforten zu öffnen – zuerst die Na+ Kanäle und dann die K+ Kanäle. Na-Kanäle inaktivieren auch während während voranschreitender Depolarisation, während viele K-Kanäle dies nicht tun. 10 Ionenkanäle lassen sich in vier funktionelle Gruppen einteilen: 1. Ligandengesteuerte Kanäle (Postsynaptische Potentiale) 2. Spannungsabhängige Kanäle (Ruhe-und Aktionspotentiale) 3. Spannungs-und Ligandengesteuerte Kanäle (NMDA Rezeptor >Lernen und Gedächtnis) 4.Temperatur-und Dehnungsabhängige Kanäle (Rezeptorpotentiale) Synapsen VL 5 Es gibt zwei verschiedene Synapsen: elektrische und chemische Synapsen. Elektrische Synapsen sind in der Minderheit, werden aber in allen Nervensystemen gefunden und erlauben einen direkten, passiven Fluss von elektrischem Strom von einem Neuron zum andern. Sie übertragen Informationen in Form von Ionenströmen. Elektrische Synapsen Das upstream Neuron, welches die Quelle des Stroms ist, ist das präsynaptische Neuron und das downstream Neuron das postsynaptische Neuron. Die Membranen der beiden Neuronen sind sehr nahe und mit einer Gap Junction verbunden. Diese Gap Junctions enthalten präzise angepasste Paarkanäle in der post- und präsynaptischen Membran. Jeder Paarkanal formt eine Pore, die grösser ist als die Pore des Spannungsabhängigen Ionenkanals. Somit können auch grössere Substanzen einfach diffundieren. Die Transmission ist bidirektional und wird durch Aktionspotenziale gesteuert. Die Übermittlung ist sehr schnell. Ein weiterer Zweck der elektrischen Synapsen ist es, die elektrische Aktivität über die Neuronenpopulation zu synchronisieren. Zusammenfassung Bio 143 Frühlingssemester 09 Sie lassen grosse Moleküle, wie ATP und Second Messenger durch und koordinieren somit auch die intrazelluläre Signalwirkung und Metabolismus von verbundenen Zellen. Loewi’s Experiment Dieses Experiment wurde gemacht, um herauszufinden, ob auch durch chemische Signalisierung Information von Zelle zu Zelle transferiert werden kann. Loewi prüfte, dass elektrische Stimulation des Vagus Nervs die Herzrate durch ein chemisches Signal verlangsamt. Er isolierte zwei Froschherzen, durchschwemmte sie und überwachte die Herzraten. Die Flüssigkeit leitete er vom einen Herz zum zweiten. Wenn der Vagusnerv das erste Herz stimulierte und verlangsamte, verlangsamte auch das zweite Herz seinen Schlag etwas zeitverzögert. Dieses Resultat zeigt, dass der Vagusnerv die Herzrate reguliert, indem er eine Chemikalie (ACh) freigibt, die sich in der Flüssigkeit anreichert. Chemische Synapsen 11 Der Spalt zwischen prä-und postsynaptischen Neuronen heisst synaptischer Spalt. Bei den chemischen Synapsen gibt es kleine membranumhüllte Organellen im präsynaptischen Terminal, genannt Vesikel. Diese sind gefüllt mit Neurotransmitter, welche als Messenger zwischen zwei kommunizierenden Neuronen agieren. Der Prozess beginnt auch hier mit einem Aktionspotenzial. Das veränderte Membranpotenzial führt zur Öffnung von spannungsabhängigen Kalziumkanälen in der präsynaptischen Membran. Wegen dem steilen Konzentrationsgradienten von Kalzium, verursacht das Öffnen dieser Kanäle einen schnellen Einfluss von Kalzium in den präsynaptischen Terminal, mit dem Resultat, dass die Kalziumkonzentration vom Cytoplasma im Terminal immer mehr ansteigt. Die Erhöhung der präsynaptischen Kalziumkonzentration wiederum, erlaubt den Vesikeln sich mit der Membran zu verbinden und die Neurotransmitter in den Spalt zu entleeren. Bei der Exocytose diffundieren die Transmitter entlang des synaptischen Spalts und binden an spezifische Rezeptoren der Membran der Postsynapse. Das Binden an Rezeptoren öffnet die Kanäle, was die Fähigkeit des Fliessens der Ionen verändert. Der NT-induzierte Stromfluss ändert die Leitfähigkeit und meistens auch das Membranpotenzial des postsynaptischen Neurons. Exzitatorische Synapsen sitzen meist auf dendritischen Spines. Elektrische Synapsen sind nur exzitatorisch während chemische Synapsen auch noch inhibitorisch wirken können. Neurotransmitter Es gibt mehr als 100 verschiedene NT, die nach oben genannten Kriterien identifiziert wurden. Sie werden in zwei Kategorien eingeteilt: small-molecule NT und Neuropeptide. Mit mehr NT steigt die Diversität des physiologischen Repertoires der Zelle. Sie kann einerseits gehemmt und andererseits angeregt werden. Auch die Schnelligkeit der postsynaptischen Reflexe wird durch NT variiert. Die small-molecule NT führen schnell synaptische Aktionen herbei, während die Neuropeptide weniger schnell modulieren. Zusammenfassung Bio 143 Frühlingssemester 09 Einige Neuronen synthetisieren zwei oder mehrere NT. Wenn mehr als ein NT in der synaptischen Endigung vorhanden ist, spricht man von Co-Transmitter. Wenn nun small-molecule NT und Neuropeptide im selben Neuron vorhanden sind, werden sie verschieden freigesetzt je nach synaptischer Aktivität. Low-Frequency Aktivität setzt oft nur kleine NT frei, während die HighFrequency Aktivität die Neuropeptide freisetzt. So variiert die chemische Signalisierung je nach Aktivitätsrate. Kriterien für Neurotransmitterdefinition 1. Die Substanz muss im präsynaptischen Neuron vorhanden sein. 2. Die Substanz wird aufgrund präsynaptischer Depolarisation freigesetzt und die Freisetzung ist kalziumabhängig. 3. Spezifische Rezeptoren für die Substanz müssen bei der postsynaptischen Zelle vorhanden sein. (Kann z.B. mit Agonisten/Antagonisten nachgewiesen werden) Effektive synaptische Übermittlung Die Übermittlung benötigt genaue Kontrolle der NT-Konzentration im synaptischen Spalt. Deshalb haben Neuronen ein System entwickelt, welches die Synthese, das Einpacken, das Freisetzen und den Abbau der NTs reguliert, um den gewünschten Level zu erreichen. Small-molecule Transmitter Die Synthese dieser NT findet lokal in der präsynaptischen Endigung statt. Die dafür benötigten Enzyme werden im Zellkörper hergestellt und zum Nervenendigungcytoplasma transportiert (0.5 5mm/Tag) langsamer axonaler Transport Die synthetisierten NT werden dann in Vesikel (small clear-core Vesikel) geladen mit Hilfe von Transporter aus der vesicular Membran. 12 Neuropeptide Neuropeptide werden im Zellkörper synthetisiert (weite Distanz). Mit Peptiden gefüllte Vesikel (large dense-core Vesikel) werden entlang des Axons auf Mikrotubuli zur synaptischen Endigung transportiert (400mm/Tag) schneller axonaler Transport Abbau Die Beseitgung der NT ist wichtig, damit wieder neue Übermittlung stattfinden kann. Sie diffundieren von den Rezeptoren und werden wieder in die Nervenendigung oder von umgebenden Gliazellen aufgenommen. Auch können sie durch Enzyme abgebaut werden. Spezifische Transporter Proteine nehmen die meisten small-molecule NT vom synaptischen Spalt und bringen sie in die präsynaptische Endigung zur Wiederverwendung zurück. (A) small-molecule NT (C) Neuropeptide Der Typ des ausgeschütteten ist abhängig vom Aktivitätsmuster der Zelle. Bei einer Low-Frequency werden vor allem small-molecule Transmitter und bei einer High-Frequency beide Typen ausgeschüttet. Zusammenfassung Bio 143 Frühlingssemester 09 Neurotransmitter werden in Quanten ausgeschüttet. Die Synapsen zwischen den spinal Motorneuronen und den Skelettmuskelzellen sind einfach, gross und peripher. Also gut geeignet, um damit zu experimentieren (Bernard Katz, 1950/60). Diese Synapsen kommen bei den Endplatten vor. Wenn eine intrazelluläre Mikroelektrode verwendet wird, um das Membranpotenzial einer Muskelzelle aufzunehmen, wird ein Aktionspotenzial im präsynaptischen Motorneuron festgestellt, welches eine flüchtige Depolarisation in der postsynaptischen Muskelfaser auslöst. Dieser Wechsel im Membranpotenzial wird Endplattenpotenzial (EPP) genannt und ist normalerweise gross genug, um das Potenzial über den Schwellwert zu bringen (weiteres AP). Das Postsynaptische AP bringt den Muskel zur Kontraktion (mit kleiner zeitlicher Verzögerung, typisch für chemische Synapsen). Katz und Fatt haben 1951 rausgefunden, dass es auch spontane Wechsel im Muskelmembranpotenzial gibt, ohne vorausgehende Stimulation. Diese Wechsel sehen gleich aus wie EPPs sind aber viel kleiner (miniature end plate potentials=MEPP). Doch beide reagieren auf Pharmakologische Mittel, welche die postsynaptischen Acetylcholinrezeptoren blockieren (z.B. Curare). Im Experiment wurde die Ca- Konzentration so manipuliert, dass möglichst wenig NT ausgeschüttet. Die kleinste gemessene Einheit war ein Quante, was etwa dem MEPP entspricht. Die Forscher haben festgestellt, dass ein EPP aus mehreren MEPPs besteht. 13 Local Recycling of synaptic vesicels Experiment: Horseradish Peroxidase (Meerrettich) wird in den synaptischen Spalt gegeben. Die Endozytose kann beobachtet werden, das HRP in die Nervenendigung aufgenommen wird. Die Endocytose wurde durch APs stimuliert und HRP wurde kurz darauf in den coated Vesikeln gefunden. Ein paar Minuten später waren diese Vesikel verschwunden und das HRP war im Endosom. Nochmals später wurde das Reaktionsprodukt von HRP in synaptischen Vesikeln gefunden. Dieses Experiment zeigt, dass synaptische Vesikelmembran in einem Kreislauf rezikliert wird. Das ganze dauert nur ca. 1 min. Zusammenfassung Bio 143 Frühlingssemester 09 Molekulare Mechanismen der Exocytose während der NT-Freisetzung Synaptische Vesikel entleeren ihren Inhalt durch Fusion mit der präsynaptischen Membran. Das SNARE-Protein vom Vesikel (Synaptobrevin) formt einen helikalen Komplex mit den SNAREs der Plasmamembran (syntaxin und SNAP-25). Synaptotagmin ist ein vesiuläres Ca-binding Protein. Calcium strömt ein und bindet an Synaptotagmin und dieses katalysiert die Membranfusion. 14 Bei der Endocytose bindet sich Clathrin an die vesikuläre Membran. Durch die Polymerisation von Clathrin bringt die Membran dazu sich zu biegen und ein Vesikel zu bilden, Clathrin umhüllt es ganz. Dynamin schneidet den Vesikel vom Rest der Membran ab. Danach wird durch eine ATP-ase das Clathrin weggemacht und das Vesikel ist nicht mehr umhüllt und jetzt ein Synaptisches Vesikel. Toxine welche die SNARE-Proteine angreifen bewirken, dass es gar keine Infoübertragung mehr gibt. Zwei Arten von postsynaptischen Rezeptoren Das Öffnen oder Schliessen von Ionenkanälen geschieht auf verschiedene Art und Weise abhängig von den Rezeptorproteinen. Die Ionotropen Rezeptoren sind direkt mit den Kanälen verlinkt. Sie haben eine extrazelluläre Seite, welche NT bindet und eine Membrandurchspannende Seite, welche den Kanal bildet. Diese Rezeptoren sind auch bekannt als Ligand gebundene Ionenkanäle. Sie sind Multimere und bestehen aus 4 oder 5 Proteinsubunits. Die Metabotropen Rezeptoren haben keinen Kanal, aber sie beeinflussen Kanäle durch die Aktivierung von G-Proteinen. Sie werden auch G-Protein-coupled Rezeptoren genannt. Diese Rezeptoren sind monomerische Proteine mit einer extrazellulären Domäne, welche NT bindet und eine Intrazelluläre Seite, welche G-Proteine bindet. Wenn ein NT an diesen Rezeptor bindet, wird ein G-Protein aktiviert, welches sich darauf hin vom Rezeptor löst und direkt mit dem Ionenkanal interagiert oder an andere Effektorproteine bindet (z.B. Enzyme), welche Messenger herstellen, die dann den Kanal öffnen oder schliessen. Acetylcholin Sie war die erste Substanz, welche als NT entdeckt wurde. ACh agiert bei den Skelett-neuromuskulären Junctions, bei der neuromuskulären Synapse zwischen dem Vagus und den Herzmuskelfasern, bei den Synapsen der Ganglien des Viszeralmotorsystems und an verschiedenen Seiten des Zentralen Nervensystems. ACh wird in den Nervenendigungen aus aus Acetyl Coenzym A (acetyl CoA wird aus Glucose gemacht) und Cholin synthetisiert. Dies geschieht mit einer Reaktion katalysiert durch Cholin-Acetyltransferase (CAT). Choline ist im Plasma in hoher Konzentration vorhanden und wird in die cholinergischen Zusammenfassung Bio 143 Frühlingssemester 09 Neuronen aufgenommen (hohe Affinität Na+/choline Transporter). Nach der Synthese im Cytoplasma lädt ein vesikulärer ACh Transporter ca 10000 Moleküle in jedes einzelne cholinerge Vesikel. Nachdem ACh gewirkt hat wird es nicht wieder aufgenommen, sondern durch Acetylcholinesterase (AChe) aufgelöst. Dieses Enzym befindet sich im synaptischen Spalt und hydrolisiert ACh in Acetat und Cholin. Das Cholin wird wieder zurück in die Nervenendigung transportiert und dort wiederverwendet um ACh herzustellen. Nikotinischer Acetylcholinrezeptor (nAChR) Nikotinische Rezeptoren sind die meist untersuchten ionotropischen Neurotransmitterrezeptoren. Viele biologische Toxine binden an und blockieren die nikotinischen Rezeptoren. Beide ACh binding Sites müssen besetzt sein, um den Kanal zu öffnen, somit braucht es eine ziemlich hohe Konzentration des NT, um die Kanäle zu aktivieren. Diese subunits binden auch andere Liganden, wie Nikotin und α-Bungarotoxin. Die neuronalen nAChR unterscheiden sich von den muskulären Rezeptoren und sind z.B. nicht α-Bungarotoxin sensitiv. 15 Muskarinischer ACh-Rezeptor (mAChR) mAChRs sind metabotropisch und leiten die meisten Effekte von ACh im Gehirn. Sie kommen sehr oft im Striatum und in vielen anderen Vorderhirngegenden vor, wo sie einen inhibitorischen Einfluss auf die Dopamin-vermittelten Motoreffekte haben. Die Rezeptoren findet man auch in den Ganglien des PNS. Sie führen periphere cholinergische Reaktionen der autonomischen Effektororganen, wie das Herz, glatte Muskeln und die exokrinen Drüsen und sind auch verantwortlich für die Hemmung der Herzrate durch den Vagusnerv. Amanita muscaria und Bungarus multicintus Die toxischen Pflanzenalkaloide aktivieren nikotinische und muscarinische ACh-Rezeptoren. Nikotin kommt aus den getrockneten Blättern der Tabakpflanze und Muscarin vom giftigen Fliegenpilz (Amanita muscaria). Beide Gifte sind Stimulantien und verursachen Übelkeit, Erbrechen, Geistes- Zusammenfassung Bio 143 Frühlingssemester 09 verwirrung und Krämpfe. Eine muskarinische Vergiftung kann zudem zu einem Kreislauf-kollaps, Koma und Tod führen. Das Gift α-Bungarotoxin von der Bungarus multicintus (Gebändeter Krait, Schlange) blockiert die Übermittlung an der neuromuskulären Junction (neuromuskulären Endplatte) und wird von der Schlange gebraucht, um die Beute zu lähmen. Es bindet irreversibel an die nikotinischen AChRezeptoren und hindert ACh die postsynaptischen Ionenkanäle zu öffnen und Skelettmuskeln werden nicht mehr durch die Motoneuronen aktiviert Lähmung. Glutamat, der wichtigste exzitatorische Neurotransmitter im Gehirn Beinahe alle excitatorischen Neuronen im ZNS sind glutamatergisch. Wenn die Konzentration des extrazellulären Glutamats erhöht ist, z.B. durch eine Hirnverletzung, wirkt sich das toxisch für die Neuronen aus. Glutamat ist eine Aminosäure, welche nicht die Bluthirnschranke durchquert und wird deshalb im Neuron synthetisiert. Für die Synthese wird Glutamine gebraucht, welches von den Gliazellen freigegeben wird. Einmal ausgeschüttet wird es in die präsynaptische Endigung aufgenommen und zu Glutamat metabolisiert mit Hilfe des Enzyms Glutaminase. (Es kann aber auch durch die Transamination von 2-oxoglutarate, einem Zwischenglied des tricaboxyilic acid cycle hergestellt werden. Dazu wird Glucose gebraucht) Das synthetisierte Glutamat wird mit Hilfe von VGLUT-Transporter in Vesikel gepackt und wenn es dann ausgeschüttet wurde, wird es aus dem synaptischen Spalt durch die exzitatorischen amino acid Transporter (EAAT) beseitigt. 16 3 ionotropische Glutamatrezptoren NMDA-Rezeptoren, AMPA-Rezeptoren und Kainat-Rezeptoren sind Glutamat-Rezeptoren und nach ihren Agonisten, welche sie aktivieren benannt: N-methyl-D-Aspartat, α-amino-3-hydroxyl-5-methyl4-isoxazole-propionate und Kainic acid. All diese Rezeptoren sind nicht selektive Kationen-Kanäle (ähnlich dem nAChR) und erlauben den Durchfluss von Na und K und manchmal auch kleine Mengen von Ca. Sie rufen dementsprechend auch exzitatorische postsynaptische Reaktionen hervor. (EPSP=exziatorische postsynaptisches Potenzial) NMDA-Rezeptoren Sie haben spezielle Eigenschaften. Sie erlauben den Eintritt von Ca2+ in Ergänzung zu den monovalenten Kationen wie Na+ und K+. EPSP welche durch NMDA-Rezeptoren produziert werden können Ca-Konzentration innerhalb des Neurons erhöhen. Der Wechsel der Ca-Konzentration wirkt als second messenger, um intrazelluläre Signalkaskaden zu aktivieren. Eine weitere Eigenschaft ist, dass sie extrazelluläres Mg2+ binden. Beim hyperpolarisierten Membranpotenzial, blockieren diese Ionen die Pore des NMDA Kanals. Die Depolarisation drückt die Mg2+ aus der Pore und erlaubt anderen Kationen zu fliessen. Nur während der Depolarisation der postsynaptischen Zelle passieren also Kationen (meist Ca). Man denkt dies sei die Basis für einige Formen der synaptischen Plastizität. Eine weitere ungewöhnliche Eigenschaft ist, dass ein Co-Agonist benötigt wird, um den Kanal zu öffnen, nämlich Glycin. Neurotransmitter mit inhibitorischer Wirkung Dazu zählen GABA (γ-Amino-Buttersäure) und Glycin. GABA wird lokal durch Glutaminsäure Decar-boxylase (GAD) aus Glutamat synthetisiert. Es gibt drei Rezeptoren, welche GABA als NT haben: GABAA, GABAB, GABAC. GABAA und GABAC sind ionotropische Rezeptoren, während die GABAB metabotropische Rezeptoren sind. Die GABA Rezeptoren sind meistens inhibitorisch weil ihre assoziierten Kanäle Cl—durchlässig sind. Das Umkehrpotenzial von Cl- ist meistens negativer als der Schwellwert fürs neuronale Feuern, Zusammenfassung Bio 143 Frühlingssemester 09 wegen der Aktion der K+/Cl- Cotransporter, welche die intrazelluläre Cl-Konzentration tief halten. Der resultierende Einfluss von negativ geladenen Cl- durch die ionotropischen GABA Rezeptoren hemmt die postsynaptische Zelle. Auch metabotropische GABA Rezeptoren (GABAB) wirken hemmend. Diese Hemmung wird durch die Aktivierung der K-Kanäle erreicht. Ein zweiter Mechanismus für die Hemmung ist das Blockieren von Ca2+, was zur Hyperpolarisation der postsynaptischen Zellen. Im ausgereiften Gehirn wirkt GABA normalerweise als inhibitorischer Neurotransmitter. Aber im sich entwickelnden Hirn wirkt GABA aktivierend. Diese Umkehrung der Aktivität kommt vom Entwicklungswechsel in der intrazellulären Cl-Homeostase. Glycin Die Hälfte der inhibitorischen Synapsen im Rückenmark nutzen Glycin. Synthetisiert wird es aus Serine durch die mitochondriale Isoform von Serin hydroxymethyltransferase. Biogene Amine Diese Klasse von Neurotransmitter regulieren viele Hirnfunktionen und sind auch im PNS aktiv. Es gibt 3 Katecholamine: Dopamin, Norepinephrin (Noradrenalin), Epinephrin (Adrenalin). Und noch Histamin und Serotonin. Alle Katecholamine werden aus Tyrosin hergestellt. Der erste Schritt in der Synthese wird katalysiert durch die Tyrosin hydroxylase in einer Reaktion, die Sauerstoff als Co-Substrat benötigt und Tetrahydrobiopterin als CoFaktor zum Dihydroxyphenylalanin (DOPA). 17 Dopamin Dopamin wird produziert durch die Aktivität von DOPA decarboxylase an DOPA. Bei der Freisetzung von Dopamin aktiviert es G-Protein-bindende Rezeptoren. Es ist in vielen Hirnregionen präsent, aber vor allem im Corpus Striatum und Substantia Nigra. Es spielt eine wichtige Rolle in der Koordination von Bewegungen. Man glaubt auch dass es Einfluss auf Motivation, Belohnung und Bestärkung nimmt. Viele Drogen wirken aufs dopaminerge System. Norepinephrin Norepinephrin wird als NT im locus coeruleus (Hirnstamm-Kern) gebraucht und z.B. Schlaf, Wachheit, Aufmerksamkeit und die Nahrungsaufnahme beeinflusst. Zusammenfassung Bio 143 Frühlingssemester 09 Epinephrine Dieser NT wird in tieferen Konzentrationen als die anderen gefunden. Neurone, welche Epinephrin enthalten sind vor allem im lateralen Tegmentumsystem und in der Medulla und reichen bis zum Hypothalamus und Thalamus. Epinephrin bindet an metabotrope Rezeptoren. Histamin Histamin wird in Neuronen im Hypothalamus gefunden, welche sich in fast alle Hirnregionen erstrecken. Es ist fürs Wecken und Aufmerksamkeit zuständig, auch kontrolliert es die Reaktivität vom vestibulären System. Allergische Reaktionen oder Gewebeschäden lösen die Freisetzung von Histamin von den Mastzellen im Blutstrom aus. Serotonin Dieser NT wird vor allem in Neuronen der Pons und oberen Hirnstamm gefunden, welche weitgehende Projektionen bis ins Vorderhirn haben und Schlaf und Wachheit regulieren. Serotonin ist prominent in der Neuropharmakologie, da viele Antipsychotische Drogen sehr nützlich in der Behandlung von Depressionen und Angstzuständen sind und auf dem serotonergischen Pathway agieren. Neuropeptide 18 Neuropeptide, auch bekannt als Hormone agieren auch als NT. Einige Peptide Transmitter modulieren Emotionen. Andere, wie die Substanz P und die opioid Peptide sind involviert in die Wahrnehmung von Schmerz. Endorphine regulieren komplexe Reaktionen auf Stress. Die Synthese und das Einpacken dieser NT ist völlig anders, als bei den small-molecule NTs. Peptid ausschüttende Neuronen synthetisieren Polypeptide in ihren Zellkörpern, welche viel grösser sind als das mature Peptid. Das Processing dieser Pre-propeptid findet durch viele Reaktionen in einigen intrazellulären Organellen statt. Pre-Propeptide werden im rauen endoplasmatischen Retikulum synthetisiert, wo die Signalsequenz der Aminosäure entfernt wird. Das übrigbleibende Propeptid durchquert den Golgiapparat und wird in Vesikel gepackt im Trans-Golgi Netzwerk. Danach findet noch eine CLeavage und Modifizierung der Enden, Glykosilierung und Phosphorilierung und eine Disulfidbindung statt. Unkonventioneller NT Diese NT sind unkonventionell, da sie nicht in synaptischen Vesikeln aufbewahrt werden und nicht durch den exozytotischen Mechanismus vom Präsynaptischen Terminal freigesetzt werden. Endocannabinoide Sie wirken als retrograde Signale, regulieren die GABA-Freisetzung an inhibitorischen Synapsen. Was bewirken NT in der postsynaptischen Zelle? - Kurzzeitige Veränderungen (Physiologie): Öffnen und Schliessen eines Kanals, damit ev. ein AP entsteht, es verändert die Leitfähigkeit Längerfristige Veränderung (Geneexpression): z.B. Phosphorilierung, oder bei metabotropen Kanälen gibt es durch eine Kaskade neue Proteine, oder mehr werden exprimiert Molekulare Signalisierung zwischen Neuronen Amplifikation im Signalübertragungsweg Die Aktivierung von einem einzelnen Rezeptor durch ein Signalmolekül, wie der NT Norepinephrin kann zur Aktivierung von vielen G-Proteinen innerhalb der Zelle führen. Die aktivierten G-Proteine können an weitere Signalmoleküle binden, wie z.B. das Enzym Adenylyl Cyclase. Jedes aktivierte Enzymmolekül generiert eine grosse Zahl an cAMP-Molekülen. Diese binden und aktivieren eine andere Familie von Enzymen, die Proteinkinasen, welche viele Targetproteine phosphorilieren Zusammenfassung Bio 143 Frühlingssemester 09 können. Obwohl nicht jeder Schritt in diesem Signalübertragungsweg Amplifikation einschliesst, resultiert die Kaskade in einer gewaltigen Erhöhung des Initialsignals. Verschiedene Rezeptortypen 1. Signal bindet 1. Signal bindet 2. Enzym aktiviert 19 2. Kanal öffnet 3. Ionen fliessen durch die Membran 3. Enzym generiert ein Produkt 1. Signal bindet 1. Signal bindet 2. G-Protein bindet 2. Akivierter Rezeptor steuert Transkription 3. G-Protein aktiviert Verschieden Typen von G-Proteinen: Heterotrimeric-G-Protein (mit 3 subunits) und das Monomeric G-Protein. G-Protein gekoppelte Rezeptoren können verschiedene Wirkungen haben. Zusammenfassung Bio 143 Frühlingssemester 09 Second Messengers Calcium ist auch ein wichtiger second Messenger. Es strömt durch Pumpen und Kanäle ein. Proteine, welche involviert sind im Liefern von Calcium zum Cytoplasma und im Entfernen: 20 CREB CREB ist ein ubiquitärer transcriptional activator. CREB ist normalerweise an die DNA gebunden. In nicht stimulierten Zellen ist CREB nicht phosphoriliert und hat wenig oder keine transkriptionale Aktivität. Phosphorilierung von CREB potenziert die Transkription. Es gibt viele Signalwege, um CREB zu phosphorilieren. Transkriptionregulierung durch CREB: Multiple Signalwege konvergieren durch die Aktivierung von Kinasen, welche CREB phosphorilieren. Das beinhaltet PKS, Ca2+/Calmodulin Kinase IV und MAP Kinase. Die Phosphorilierung von CREB erlaubt ihm an Co-Aktivatoren zu binden (nicht im Bild), was dann die RNA polymerase stimuliert um die Synthese von RNA zu beginnen. Zusammenfassung Bio 143 Frühlingssemester 09 Die Entwicklung des Nervensystems VL 6 Die frühe Entwicklung des Nervensystems wird vor allem durch die Synapsenbildung dominiert und ist deshalb meist von elektrischer Aktivität unabhängig. Das primitive Nervensystem wird im Embryo gebildet, die Erstgeneration von Neuronen und undifferenzierten Vorläuferzellen entstehen. Die Entstehung der Grosshirnregionen und die Migrationen der Neuronen zu ihrem Bestimmungsort finden statt. Die Initialformation des Nervensystems: Gastrulation und Neurulation Die Zellen, aus welchen später das Nervensystem entsteht werden schon im frühen Embryonalstadium dazu bestimmt. Auch die elementaren Körperachsen werden gebildet (anterior-posterior, dorsal-ventral und medial-lateral) Kritisch bei dieser frühen Grundstruktur ist die Gastrulation. Die Gastrulation beginnt als lokale Einstülpung von ausgewählten Zellen im Embryo. Wenn die Einstülpung komplett ist, besteht der Embryo aus drei primitiven Zellschichten oder Stammschichten: äusseres Ectoderm, mittleres Mesoderm und inneres Endoderm. Basierend auf der Position der einstülpenden Mesoderm und Endoderm, definiert die Gastrulation die Mittellinie, anteriorposteriore und dorsal-ventrale Achse aller vertebraten Embryos. Zentral ist die Bildung des Notochords, da er essentiell für die weitere Entwicklung des Nervensystems ist. Er ist ein ausgeprägter Zylinder aus Mesodermzellen, welcher sich bei der Mittellinie des Mesoderms verdichtet und sich von der mid-anterior bis zur posterioren Seite erstreckt. Das Ectoderm, welches direkt über dem Notochord liegt, heisst Neuroectoderm und verursacht das ganze Nervensystem. Der Notochord selbst verschwindet wieder, wenn die Entwicklung komplett ist. 21 Der Notochord sendet induktive Signale zum darüberliegenden Ectoderm, welches eine Teilmenge der Neuroectodermalzellen dazu bringt sich zu neuralen Vorläuferzellen zu differenzieren. Dieser Prozess heisst Neurulation. Während dieser Phase verdicken sich die Vorläuferzelle in der Mittellinie zur neuralen Platte. Die Seitenränder der Neuralen Platte falten sich dann nach innen und formen schliesslich eine Röhre. Diese Neuralröhre wird dann später das Gehirn und das Rückenmark. Die Vorläuferzellen der Neuralen Röhre sind teilende Neuralstammzellen, welche wieder mehr Vorläuferzellen bilden (alle mit der Kapazität Neuronen, Astrozyten und Oligodendrozyten zu werden). Schliesslich wird ein Teil der Neuralen Vorläuferzellen nicht teilende Neuroblasten generieren, welche sich zu Neuronen differenzieren. Nicht alle Zellen der Neuralröhre sind Neuralvorläuferzellen. Die Zellen in der ventralen Mittellinie differenzieren zu speziellen Zellen, der Floorplate. Die Floorplate verteilt molekulare Signale, welche die Neuroblasten spezifizieren. Die Position der Floorplate bei der ventralen Mittellinie definiert die dorsoventrale Polarität des Neuralrohrs und beeinflusst die Differenzierung von Neuralvorläuferzellen. Die Induktiven Signale des Notochords und der Floorplate führen zur Differenzierung von Zellen in der ventralen Teilbereich der Röhre, welche schliesslich zu Wirbelsäulen- und HinterhirnMotorneuronen werden. Im dorsalen Teil der Neuralröhre wird die Roofplate gebildet. Dort wo die Enden der gefalteten Neuralplatte zusammen kommen bilden sich Vorläuferzellen zum Neuralleiste. Die Neuralleistenzellen migrieren weg von der Neuralröhre durch lose gepackte Mesenchymalzellen, welche den Platz zwischen der Neuralröhre, der embryonal Epidermis und den Somiten füllt. Aus den Neuralleistenzellen werden verschiedene Nachkommen gebildet: z.B. die Neuronen und Gliazellen des sensorischen und visceralen Motor Ganglien, die neurosekretorischen Zellen der Nebenniere. Zusammenfassung Bio 143 Frühlingssemester 09 Die Molekulare Basis der Neuralinduktion Das erste induktive Signal, welches entdeckt wurde, ist die retinoic acid, ein Derivat aus Vitamin A. Die Retinoicsäure aktiviert eine einzelne Klasse von Transkriptionsfaktoren, die Retinoid Rezeptoren, welche die Expression von vielen Targetgenen modulieren. Peptidhormone bilden eine andere Klasse von induktiven Signale, dazu gehört der FGF (fibroblast growth factor) und der TGF (transforming growth factor). Zur TGF-Familie gehört auch die BMPs (Bone morphogenetic proteins. Sie sind wichtig für die Neuralinduktion und Differenzierung. Ein weiteres wichtiges Neuropeptid für die Induktion ist das Sonic hedgehog (Shh). Differenzierung 22 Die Anfangsdifferenzierung der Neuronen und Gliazellen beginnt nachdem das rudimentäre Gehirn und Wirbelsäule entwickelt wurden. Das erwachsene Gehirn enthält 100 Milliarden Neuronen und viel mehr Gliazellen, alle innerhalb von einigen Monaten aus einer kleinen Population Vorläuferzelle entstanden. Die Vorläuferzellen befinden sich in der ventrikulären Zone. Das ist die innerste Zellschicht, welche das Lumen des Neuralrohrs umgibt. Die sich teilenden Vorläuferzellen durchleben ein stereotypisches Muster von Zellbewegungen während sie sich im mitotischen Kreislauf befinden, welcher zur Formung anderer Stammzellen oder postmitotischen Neuroblasten führt. Die Zellproliferation findet in der ventrikulären Zone, der subventrikulären Zone und dem External Germinal Layer (Kleinhirn) statt. Neue Stammzellen entstehen durch symmetrische Teilung der Neuroectdormalen Zellen. Diese Zellen teilen sich relativ langsam und können sich unbegrenzt erneuern. Überraschenderweise scheinen neurale Stammzellen die gleichen molekularen Charakteristiken wie Gliazellen aufzuweisen. Deshalb sind im sich entwickelnden Gehirn einige multipotente neurale Vorläufer nicht von radialen Gliazellen zu unterscheiden. Hingegen entstehen Neuroblasten aus Zellen, die sich asymmetrisch teilen. Eine der Tochterzellen wird zur Neuroblaste und die andere wieder in den Zellzyklus eintritt und wieder eine asymmetrische Teilung macht. Die asymmetrische Zellteilung wird vermittelt durch die asymmetrische Verteilung von molekularen Determinanten, Proteine wie z.B. numb welches durch notch moduliert wird. Wenn die Zellen postmitotisch werden, verlassen sie die ventrikuläre Zone und wandern zu ihrem Zielort. Die laterale Inhibition bestimmt die Verhältnis von neuronalen zu epidermalen Zellen. Patterning Die Homeotic oder Homeobox Gene bei Drosophila leiten die Differenzierung vom Embryo in bestimmte Segmente, welche dann zum Kopf, Thorax und Abdomen werden. Die Homeoboxgene kodieren für DNA-binding Proteine, welche die Expression von anderen Genen modulieren. Auch der Mensch besitzt solche Gene, die Hox-Gene. Sie definieren Regionen des Nervensystems entlang der antero-posterioren Achse. Ein integriertes Netzwerk von Signalen von der ventralen und dorsalen Rückenmarks spezifizieren sensorische Relais-Neuronen, Interneuronen und Motoneuronen. Interaktionen zwischen Shh, Noggin/Chordin, BMP, RA und FGF führen entweder zur Expression oder Repression eines Sets von Transkriptionsfaktoren, welche verschiedene Vorläufer unterscheiden. Diese ausgeprägten Vorläufer, werden, basierend auf ihrer dorsal-ventral Position im Rückenmark, zu Sensorischen RelaisNeuronen (dorsal), Interneuronen (intermediate) und Motoneuronen (ventral). So geschieht das Festlegen der Zelltypen entlang der dorsoventralen Achse. Shh und BMP bilden gegenläufige Zusammenfassung Bio 143 Frühlingssemester 09 Gradienten mit dorsalisierender, bzw. ventralisierender Wirkung. Die Konzentration von Shh bestimmt den Zelltyp der induziert wird. Zellwanderung 23 Im Cortex Es gibt die radiale Zellwanderung bei der Entstehung der Cortex-Schichten. Die Neuroblasten folgen dabei den langen Fortsätzen der radialen Gliazellen. Neben der radialen spielt auch die tangentielle Zellwanderung eine Rolle in der Entstehung des Cortex. Im Cerebellum Die Zellproliferation im Cerebellum findet im Gegensatz zum Cortex nicht nur in der ventrikulären Zone statt. Körnerzellen im Cerbellum werden in der externen Körnerzellschicht geboren. Im Peripheren Nervensystem Zelldifferenzierung und Wanderung sind auch im peripheren Nervensystem eng gekoppelt. Wenn die Neuralleistenzellen auf den Weg gehen, tragen sie mit sich die Information über ihren Ursprungsort, inklusive der Expression der ausgeprägten Hoxgene, welche auf diverse Rückenmarks- und Rautenhirndomänen limitiert sind. Egal woher die Zellen kommen, sie müssen alle einen essentiellen Wechsel durchmachen bevor sie mit der Migration beginnen. Sie beginnen alle als Neuroepithelzelle und haben dementsprechend Verbindungen und adhesive Interaktionen, welche sie an Ort und Stelle behalten. Nun müssen sie die Expression dieser adhesiven Gene runter regulieren und einen Wechsel zur Mesenchymal Zelle durchmachen. Diese können leichter migrieren. Die Neuralleistenzellen werden weitgehend entlang klarer Wanderwege geführt. Gebildet durch die nicht neural peripheren Strukturen wie den Somiten und anderen rudimentären muskuloskelettalen oder visceralen Geweben. Die Signale entlang dieser Wege können sekretierte Moleküle, Zelloberflächen-Liganden und Rezeptoren oder extrazelluläre Matrix Moleküle sein. Die abgesonderten Signale beinhalten neurotrophische Moleküle und könnten die Richtung und Bewegungsbahn der Neuralleistenzellenmigration beeinflussen. (Tropische Moleküle=leiten wachsende Axone zu einer Quelle, Trophische Moleküle=unterstützen das Überleben und Wachstum von Neuronen und ihren Prozessen, wenn ein passendes Zielobjekt kontaktiert wurde) Die caudale Hälfte der Somiten ist repulsiv und erlaubt weder Zellwanderung noch Axonwachstum. Neuralleistenzellen wandern nur durch die anteriore Hälfte der Somiten. Zellsignalisierung während der Migration der Neuralleistenzellen beeinflusst die Vorläuferidentität und die Enddifferenzierung. Jedes Signal ist abkömmlich entlang einer spezifischen Wanderroute, welche von Teilmengen der Neuralleistenzellen genommen wird. Zusammenfassung Bio 143 Frühlingssemester 09 Programmierter Zelltod – Apoptose Die langzeit Abhängigkeit zwischen Neuronen und ihren Zielobjekten heisst trophische Interaktion. Trophisch kommt aus dem Griechischen und bedeutet trophé ungefähr „Nahrung“. Die Nahrung, welche an die Neuronen durch die trophische Interaktion abgegeben wird, ist nicht die Glucose und ATP. Eher kommt die Abhängigkeit von den spezifischen Signalmolekülen, den neurotrophischen Faktoren oder Neurotrophinen. Eine Strategie bei den Wirbeltieren, ist es, einen Überschuss an Nervenzellen zu bilden. Diejenigen, welche nicht mit Erfolg interagieren, sterben ab und so wird die Endpopulation gebildet. Die Eliminierung der überzähligen Neuronen, besonders die Einleitung der Apoptose (hoch regulierter Prozess, welcher im Zelltod endet) geschieht durch die Neurotrophine. In einigen Studie wurde ersichtlich, dass vor allem das Zielobjekt eine grosse Rolle spielt, wie gross die Zellpopulation wird. Denn dieses produziert neurotrophische Faktoren. Wenn die Neuronen keine trophische Unterstützung erhalte, sterben sie ab. So kam die Idee, dass viele Neuronen, welche eigentlich sterben würden, gerettet werden können, indem man die Menge der Targets (Zielobjekte) erhöht. So gibt es mehr trophische Unterstützung. Im Experiment wurde ein extra Körperglied angebracht, welches von gleichen Rückenmarksegmenten angeregt wurde, wie das echte Körperglied. Es zeigte sich, dass die Extrazellen nicht von neuem erzeugt wurden, sondern sie wurden gerettet von einer Population, welche überproduziert war und normalerweise aussortiert worden wäre. 24 Der Effekt des Neurotrophin auf den Auswuchs von Neuriten und das Überleben von Neuronen ist gross. NGF ist sehr wichtig für das Überleben der Neuronen. Es stimuliert den Auswuchs. NGF ist nur ein Teil einer Familie von verwandten trophischen Molekülen, den Neurotrophinen. Es gibt noch weitere 3, welche bekannt sind: brain-derived neurotrophic factor (BDNF), neurotrophin-3 (NT-3), neurotrophin 4/5 (NT-4/5). Neurotrophine werden von eindeutigen Genen hergestellt und sind sehr verschieden in ihrer Spezifität. Z.B: NGF unterstützt das Überleben von sympathetischen Neuronen. BDNF kann das nicht, unterstützt aber das Überleben der sensorischen Ganglienneuronen, welche einen anderen embryonischen Ursprung haben. NT-3 unterstützt beide Arten. Neurotrophin Rezeptoren und ihre Spezifität für die Neurotrophine Neurotrophine haben eindeutige Effekte auf verschiedene Zielneuronen. Spezifischer Einfluss: Die Klassen von peripheren somatosensorischen Rezeptoren und die dorsal root ganglion Zellen, welche zu sensorischen Enden führen hängen von verschiedenen trophischen Faktoren ab, welche in spezifischen Target-Geweben sind. Neurobiologie FS 2009 Entwicklung des Nervensystems 2 VL 7 Neural Circuit Formation 1. Axon-Wachstum Der Wachstumskegel (Growth Cone) zeigt eine schnelle, kontrollierte Reorganisation der Zytoskelettelemente. Er beinhaltet Moleküle wie Aktin, welches den Wechsel der lamellopodialen und filopodialen Form für gerichtetes Wachstum steuert. Das Mikrotubuli-Zytoskelett ist verantwortlich für die Verlängerung des Axon selbst. Die molekulare Komposition des Aktin und MikrotubuliZytoskeletts ändert sich in den unterschiedlichen Regionen des wachsenden Axons. Aktin bildet ein Netzwerk von Filamenten, welche in Lamellipodia und Filopodia gefunden werden. Tubulin hingegen bildet die Mikrotubuli, welche parallel zur Axonachse verlaufen. Aktin und Tubulin findet man im Wachstumskegel und im Axon. Sie kommen als freie Monomere im Zytoplasma vor, bilden aber auch Filamente (Aktin) und Mikrotubuli (Tubulin). Das dynamische De/polimerisieren des Aktin bei der Membran des Lamellipodiums und innerhalb des Filopodiums bestimmt die Richtung der Wachstumskegelbewegung. Ähnlich bei der De/polimerisation des Tubulin in den Mikrotubuli: es stärkt die Richtung der Bewegung, indem der Axonschaft stabilisiert wird. Das Zusammenspiel von Aktin und Mikrotubuli ist wichtig um die Balance zwischen aktivem Wachstum und Stabilität in einem wachsenden Axon herzustellen. 1 Das F-Actin (rot) wird Aktin genannt, welches Filamente bildet (Lamellopodium und Filopodia). Tyrosinierte Mikrotubuli (grün) bilden vor allem die lamellare Region und acetylierte Mikrotubuli (blau) bilden das Axon selbst. Die Verteilung und Dynamik der cytoskelettalen Elemente im Growth Cone Globuläres Aktin wird zu F-Actin beim Leading Edge. Repulsive Signale unterstützen den Abbau und den retrograden Fluss des G-Aktin zum Lamellipodium . Organisierte Mikrotubuli machen den zytoskelettalen Kern des Axons aus. Actin- und Tubulin-Binding-Proteine regulieren den Auf- und Abbau der Filamente und Tubuli. Dieser Prozess wird durch Kalzium beeinflusst über die spannungsabhängigen Kalziumkanäle und Rezeptorkanäle. Neurobiologie FS 2009 2. Axonale Wegfindung/Axonal Guidance Axone werden durch eine Kombination von positiven und negativen Führungssignalen gesteuert. Die positiven Signale ziehen den Growth Cone an und die negativen vermeiden das Wachstum in eine bestimmte Richtung. Tropische Moleküle führen das wachsende Axon zu einer Quelle und trophische Mokelüle unterstützen das Überleben und Wachstum der Neurone und deren Prozesse, wenn sie mit einer Zielzelle in Verbindung getreten sind. Target recognition Leider ist darüber noch nichts bekannt. Synapsenbildung Wenn das Axon bei seinem Ziel angekommen ist, wird es: Synaptische Kontakte herstellen, sich zurück ziehen und wieder zu einem anderen Ziel hinwachsen, oder fehlschlagen (was in Zelltod enden kann). Weil dies alles sehr komplex ist, wurde es vor allem im peripheren Nervensystem studiert, besonders in den Muskelgeweben und bei den autonomen Ganglionzellen der Rückenmark-Motorneuronen. Entstehung der Neuromuskulären Endplatte 2 1. 2. 3. 4. 5. Ein Growth Cone nähert sich einem Muskelgewebe Der Wachstumskegel formt einen Kontakt mit der Oberfläche des Muskelgewebes Die Endigung differenziert sich, Die Basallamina erscheint im Spalt Multiple Axone nähern sich an Alle Axone die hindern, werden eliminiert. Das Axon entwickelt eine Myelinschicht Synapsenelimination Zunächst wird jede Targetzelle von Axonen verschiedener Nervenzellen innerviert (polyneuronal innervation). In diesen Fällen gehen Inputs schrittweise verloren (während der frühen postnatalen Entwicklung) solange, bis nur noch einer übrigbleibt. Dieser Prozess des Verlust wird Synapsenelimination genannt. Diese Elimination bedeutet eine Reduzierung der Anzahl verschiedener axonaler Inputs zur Zielzelle, und nicht eine Reduktion der gesamten Anzahl Synapsen zu den postsynaptischen Zellen. Denn die Gesamtzahl der Synapsen im peripheren Nervensystem erhöht sich ständig während der Entwicklung. Jedes Axon elaboriert mehr und mehr Endzweige bei der Zielzelle, welche es innerviert. Eine Vielzahl Experimente hat gezeigt, dass die Elimination einiger Initialinputs bei Muskel- und Ganglionzellen ein Prozess ist, bei dem die Synapsen verschiedener Neurone um den Besitz der Zielzelle kämpfen. Man glaubt, dass Muster in der elektrischen Aktivität der Prä- und Postsynapse diesen Wettbewerb steuern. z.B. werden die Acetylcholinrezeptoren bei der Neuromuskulären Endplatte durch Curare blockiert, besteht die polyneuronale Innervation weiter. Werden präsynaptische AP im Motoneuronenaxon blockiert, hindert dies auch die Reduktion von polyneuronaler Innervation. Jeff Lichtmann und Kollegen haben während mehrerer Tage, Wochen die gleiche Neuromuskuläre Endplatte beobachtet. Sie haben festgestellt, dass der Wettbewerb zwischen Neuronen nicht die aktive Ablösung des „verlierenden“ Inputs durch den „Gewinner“ beinhaltet. Es scheint aber so, dass die Inputs beider Wettstreiter zuerst eine Subregion der werdenden postsynaptischen Spezialisierung besetzen und dann schrittweise weiter segregieren (trennen). Das verlierende Axon verkümmert eventuell und zieht sich zurück, während auch der Teil der postsynaptischen Spezialsierung, welche Neurobiologie FS 2009 mit diesem Axon verbunden war verloren geht. Zudem gehen auch die Neurotransmitterrezeptoren, welche in der Nähe dieser Endzweige waren verloren. Dies geschieht bevor sich die Nervenendigung zurück gezogen hat, aber dadurch geht die Stärke des Inputs zurück, was wiederum zum Verlust der Rezeptoren führt, wodurch weiter die Inputstärke abnimmt, was schliesslich in der Rücknahme des präsynaptischen Terminals führt. Die bleibende Endigung aber beginnt sich auszubreiten und zu stärken, wo sich die Endplattenregion während des postnatalen Muskelwachstums vergrössert. Synapsen im ZNS Die Molekularen Mechanismen, welche bei der Synapsenbildung involviert sind 2 Moleküle sind sehr wichtig bei diesen Ereignissen: das Neurexin, ein Adhesionsmolekül (kommt in der präsynaptischen Membran vor) und der binding partner Neuroligin, ein Adhesionsmo-lekül (postsynaptische Membran). Diese zwei Moleküle binden aneinander und können so die Adhäsion zwischen der prä- und postsynaptischen Membran bewirken. Der Beginn einer Synapse hängt zentral von der lokalen Erkennung der mutmasslichen prä- und postsynaptischen Membrane ab. Geführt wird das Ganze durch Members der Cadherin und Protocadherin Familie von Ca2+ Zelladhesionsmolekülen. Die lokale Erkennung wird begleitet durch die anfängliche Anhäufung von synaptischen Vesikeln als auch Transportvesikeln, welche molekulare Komponenten enthalten, die bei der präsynaptischen aktiven Zone mitwirken. 3 Wenn die Anfangsspezialisierung besteht, werden weitere Adhesionsmoleküle rekrutiert, wie SynCAM (Synaptic Cell adhesion molecules), Neurexin und Neuroligin und EphrinB Liganden und deren EphBR-Rezeptoren. Adhesive Signalisierung dieser verschiedenen Moleküle initiiert die Differenzierung der Präsynaptischen aktiven Zone und der postsynaptischen Density Neurobiologie FS 2009 Die Interaktion von Neurexin und Neuroligin ist zentral für das Rekrutieren und beibehalten der zytoskelettalen Elemente, welche die synaptischen Vesikel zum präsynaptischen Terminal örtlich festlegen und deren Fusion einleiten. Neurexin ist wichtig um die spannungsabhängigen Kalziumkanäle zu lokalisieren und die lokale Vesikelfreigabe zu sichern. Neuroligin gebunden an Neurexin, ist essentiell um die NT-Rezeptoren und die Postsynaptischen Proteine bei der postsynaptischen Spezialisierung örtlich festzulegen. Es interagiert mit Proteinen und fördert so das Clustering von Rezeptoren und Kanälen. 4 Zusammenfassung Bio 143 Frühlingssemester 2009 Sensorische Neurobiologie VL 8 1. Generelle Prinzipien Sinne des Menschen: Klassische 5 Sinne: Sehen, Hören, Riechen, Schmecken, Fühlen (Vision, Auditorik, Olfaktorik, Gustatorik, Haptik) andere Sinne: Vestibulärsinn, Schmerz, Temperatur .... Exterozeption: Enterozeption: Wahrnehmung der Umwelt Eingeweideschmerzen, Blutdruck, Blutzucker etc. Rezeptoren: Kontakt von Organismus zur Aussenwelt Rezeptoren sind: - eingangsspezifisch (Modalität) mit Submodalitäten (rot, blau, grün) - verschiedenen embryonalen Ursprungs - nicht-zufällig angeordnet - Generatorpotential produzierend nach Stimulation - oftmals Teil eines Sinnesorgans - mit Ganglienzellen verbunden (oder selber „Ganglienzellen“) - zeigen Konvergenz und Divergenz 1 Konvergenz: Mehrere Rezeptoren sprechen eine Ganglienzelle an (Bsp. Fotorezeptoren im Auge) Divergenz: Ein Rezeptor spricht viele Ganglienzellen an - Grundprinzipien der sensorischen Verarbeitung 1.Prinzip der spezifischen Energie („labeled line“) Aktivierung eines speziellen Rezeptors löst immer gleiche Empfindung aus. →postsynaptische Verbindungen sind spezifisch. 2.Kodierungsprinzip Analoges(amplitudenmoduliertes) Signal wird in digitales (frequenzmoduliertes) Signal umgewandelt. Bsp.: Hören: Frequenz reizt bestimmte Rezeptoren Aktionspotenzial 3.Prinzip der lateralen Inhibition Laterale Hemmungsmechanismen werden häufig verwendet, um Sensitivität und Kontrast zu verstärken. (Bsp.: Kontrastverstärkung in Retina) Horizontalzellen 4.Relayprinzip Sensorische Information überquert immer die Mittellinie und wird im Thalamus umgeschaltet (Ausnahme olfaktorisches System). 5.Prinzip der Topographie Benachbarte Rezeptoren projizieren zu benachbarten Neuronen im Gehirn. 6.Prinzip der parallelen Verarbeitung Sensorische Modalitäten werden oft in Submodalitäten geteilt und getrennt verarbeitet. (Bsp.: Dekonstruktion des Seheindrucks) Form, Farbe und Bewegung wird parallel verarbeitet. Zusammenfassung Bio 143 Frühlingssemester 2009 Sensorische Bahnen kreuzen die Mittellinie und werden im Thalamus umgeschaltet. 2. Die chemischen Sinne: Gustatorik und Olfaktorik 2 Das olfaktorische System ist das meist studierte der chemosensorischen der Triade (gustatorisch, olfaktorisch, trigeminal). Aromastoffe interagieren mit den olfaktorischen Rezeptorneuronen, welche in einem Epithelsheet vorkommen, im olfaktorischen Epithelium, welches das innere der Nase auskleidet (schleimig, damit sich die Duftmoleküle lösen können). Die Axone, welche von den Rezeptorzellen kommen, ragen geradewegs in den olfactory bulb (Riechkolben) hinein. Dieser sendet Projektionen zum pyriformen Cortex im Temporallappen und auch in andere Hirnstrukturen des Vorderhirns via dem olfactory tract. Der Olfactory tract projektiert direkt zu einer Anzahl anderer Vorderhirnregionen, darunter zu dem Hypothalamus und der Amygdala. Durch die Luft übertragene (airborne) chemische Aromastoffe (Odorants) werden von Rezeptoren übertragen und in elektrische Signale enkodiert, welche dann an höhere Order Center weiter gegeben werden. Dies sind die peripheren und zentralen Komponenten des primären Olfaktorischen Pathways. Zusammenfassung Bio 143 Frühlingssemester 2009 Olfaktorische Rezeptorgene sind die grösste Genfamilie im Metazoen -Genom Jedes Gen codiert für ein Rezeptorprotein, welches dann ein besonderes Set von Geruchsmolekülen erkennen kann. Der Mensch hat ca 400 verschiedene Geruchsrezeptoren. Genetische und Zellbiologische Analysen haben ergeben, dass jedes Olfaktorische Rezeptor-Neuron nur eines oder wenige Geruchsrezeptorgene exprimiert wird Molekulare Mechanismen der Geruchstransduktion Geruchsmoleküle im binden im Mucus direkt (oder durch Bindingproteins) an eines von vielen Rezeptormolekülen, welche in der Membran der Zilia sind. Diese Bindung führt zur Aktivierung eines Geruchsspezifischen G-Protein, welches eine Adenylate-Cyclase aktiviert, was zur Bildung von cAMP führt. Eine Aufgabe des cAMP ist es an einen Kationen-selektiven Kanal zu binden, welcher, wenn geöffnet, den Einfluss von Na+ und Ca2+ in die Zilia hinein erlaubt, was zur Depolarisation führt. Die darauffolgende Erhöhung des intrazellulären Ca2+ öffnet die Kalziumgebundenen Cl—Kanäle, welche das meiste der Depolarisation der Olfaktorischen Rezeptorpotenzial liefert. Das Rezeptorpotenzial wird in seinem Ausmass reduziert, wenn das cAMP durch spezifische Phosphodiesterasen aufgelöst wird, um die Konzentration zu verringern. Zur gleichen Zeit verbindet sich Kalzium mit Calmodulin (Ca2+-CAM) und bindet an Kanäle, was dann ihre Affinität für cAMP verringert. Schliesslich wird Kalzium durch den Kalzium/Natrium AustauschPathway rausgedrückt. 3 Die Axone der olfactory receptor cells machen Synapsen mit den mitral cells, den an der Spitze liegenden dendritic tufts und den periglomerular Zellfortsätzen innerhalb der glomeruli Zusammenfassung Bio 143 Frühlingssemester 2009 Zentralnervöse Verschaltung der Riechbahn Das olfaktorische System ist einzigartig innerhalb der sensorischen Systeme, da es keine Thalamusverschaltung von Primärrezeptoren zu einer Neokortikalen Region gibt. Die Neokortikale Region verarbeitet sensorische Information. Der Pyriforme Kortex ist ein dreischichtiger Archikortex. Es ist eine spezialisierte kortikale Region, dem Geruchssinn zugeordnet, die als älter als der sechs-schichtige Neokortex angesehen wird. Obwohl der Initial-pathway für die olfaktorische Information den Thalamus umgeht, spielt der Thalamus eine wichtige Rolle. Die Olfaktorische Information vom pyriformen Kortex wird mit dem Thalamus verschaltet auf dem Weg zu Associationareas im Neocortex, wo weitere Verarbeitung stattfindet. Der pyriforme Cortex und die Association areas sind wichtig für die bewusste Einschätzung der Gerüche und deren Assoziationen mit anderen Umgebungsstimuli. Der olfaktorische Tract projiziert direkt zu anderen Vorderhirnregionen, wie Hypothalamus und Amygdala. Die neurale Berechnung die dort erfolgt, beeinflusst motorische, viszerale und emotionale Reaktionen auf olfaktorische Reize, vor allem diese, welcher relevant sind für Ernährung, Fortpflanzung und aggressive Verhalten. 4 Das Vomeronasalorgan (Jakobsche Organ) Olfactorische Projektion –das Vomeronasalorgan Neben dem olfaktorischen System gibt es ein weiteres eng verwandtes Riechorgan(Vomeronasales Organ). Dies ist primär für Sexuallockstoffe (Pheromone) sensitiv. Beim Mensch: nur noch ein kleiner Teil dieses Organs übrig, jedoch nicht in Kontakt mit Luft. Und dennoch gibt es beim Menschen Verhaltensreaktion, welche auf Pheromone oder Pheromonartige Reize zurückzuführen sind. Z.B: der Angleich des Menstruationszyklus bei zusammen lebenden Frauen. Der menschliche Geschmackssinn Geschmackszellen verbinden sich mit primären sensorischen Axone, welche in die chorda tympani und grössere superior petrosal Verzweigungen des facial Nervs führen (cranial nerve VII), und in die linguale Verzweigung des glossopharyngeal Nervs ( cranial nerve IX) und die obere laryngeal Verzweigung des Vagusnervs (cranial nerve X) um die Geschmacksknospen in der Zunge, Gaumen, Kehle und Speiseröhre zu innervieren. Zusammenfassung Bio 143 Frühlingssemester 2009 Gustatorik - Geschmackssinn Die Verteilung der Geschmackspapillen auf der dorsalen Oberfläche der Zunge: 5 Verschiedene Reaktionen auf Süss, salzig, sauer und bittere Geschmäcke, aufgenommen in die 3 cranial Nerven, welche die Zunge und Kehle innervieren Das auditorische System Der physiologische Reiz des Hörsinns sind lokale Luftdruckschwankungen(Schall). Das Bild zeigt das Verhalten von Luftmolekülen in der Nähe einer Stimmgabel welche Sinusförmig vibriert. Die vibrierenden Zinken produzieren lokale Verschiebungen der umgebenden Moleküle; so dass wenn die Zinke sich in eine Richtung bewegt, dort eine molekulare Kondensation (Verdichtung) geschieht; wenn sie in die andere Richtung geht eine Verdünnung. Zusammenfassung Bio 143 Frühlingssemester 2009 Diese Wechsel in der Luftmoleküldichte entsprechen dem lokalen Wechsel des Luftdrucks. Ohren nehmen Schallwellen war –lokale Druckschwankungen der Luft. Frequenz = Tonhöhe (menschlicher Hörbereich 10 –20‘000 Hz) Schalldruck = Lautstärke (0 –130 db) Exkurs: Musik Obertöne definieren die Klangfarbe. Subjektives Tonempfinden ist objektivierbar: z.B. Gleiche Töne mit Oktavunterschied entsprechen Verdopplung der Schallfrequenz. Konsonante Akkorde lassen sich als ganzzahlige Brüche darstellen; dissonante nicht. 6 Aufbau des menschlichen Ohrs Das äussere Ohr mit Ohrmuschel und äusserem Gehörgang sammelt Geräuschenergie und fokussiert sie im Trommelfell. Malleus=Hammer, Incus=Amboss, Stapes=Steigbügel Die Geräusche treffen durch die Luft auf die Ohrmuschel auf. Zusammenfassung Bio 143 Frühlingssemester 2009 Die Umgebung im Inneren Ohr, wo die Geräuscherzeugenden Vibrationen in neuronale Impulse umgewandelt werden, ist wässrig. Die Hauptaufgabe des Mittelohrs ist es, die relativ tiefwiderständigen luftübertragenen Geräusche mit dem hohen Widerstand der Flüssigkeit auszugleichen. Normalerweise, wenn Geräuschwellen von einem Medium mit wenig Widerstand (Luft) zu einem Medium mit höherem Widerstand (Wasser) kommen, wird beinahe die ganze Akustische Energie reflektiert. Das Mittelohr behebt dieses Problem und sichert die Übermittlung der Geräuschenergie durch die Luft-fluide Grenze, indem es den Druck erhöht. Die Übersetzung der Luftschwingung in neuronale Signale findet in der Cochlea statt. 7 Ein Akustischer Reiz initiiert eine wandernde Welle der gleichen Frequenz in der Kochlea, welche sich auf der Basilarmembran ausbreitet. Die Bewegung der wandernden Welle initiiert sensorische Transduktion durch verlagern der Haarzellen welche auf der Basilarmembran sitzen. Weil diese Strukturen an verschiedenen Positionen verankert sind, wird die vertikale Komponente der Welle in eine Scherbewegung zwischen der Basilarmembran und der tectorial Membran umgewandelt. Diese Bewegung biegt die Stereocilien. Der Pivot Point (gelber Punkt, Bild unten) der Basilarmembran ist verschoben zum Pivot point der tectorial Membran, so dass wenn die Basilarmembran in Bewegung kommt, bewegt sich die Tectorial Membran über die Spitzen der Haarzellen und biegt die Stereocilia. Zusammenfassung Bio 143 Frühlingssemester 2009 8 Depolarisation und Repolarisation der Haarzellen geschieht durch Kalium. Die Stereozilien der Haarzellen ragen in die Endolymphe, welche hoch an Kalium ist und ein elektrisches Potenzial von +80mV relativ zur Perilymphe aufweist. Dieses Endocochleare Potenzial treibt Kalium in offene Transduktionskanäle, welche sich beim apikalen Ende der Stereozilien befinden. Die daraus resultierende Depolarisation der Haarzellenkörper öffnet somatische K+-Kanäle. Das negative Ruhepotenzial der Haarzellen und die niedrige Kalium-Konzentration in der umgebenden Perilymphe führt zu einem Auswärtsfluss von Kalium durch die somatischen Kaliumkanäle. Zusammenfassung Bio 143 Frühlingssemester 2009 Mechanoelektrische Transduktion der Haarsinneszellen Wenn die Haarbündel in die Richtung des grössten Stereociliums ausgelenkt sind, öffnen sich Kationen-selektive Kanäle in der Nähe der Stereozilienspitze, Kalium fliesst in die Haarzelle rein nach ihrem elektrochemischen Gradienten. Die resultierende Depolarisation der Haarzelle öffnet spannungs-abhängige Calciumkanäle im Zellkörper, Ca tritt ein und setzt Neurotransmitter in die Nervendendigungen des Hörnervs frei. Dies ist der einzige mechanisch zu öffnender Kanal. Das Konzentrationsverhältnis ist umgekehrt, anstelle von Natrium depolarisiert Kalium die Zelle. Wandernde Wellen entlang der Cochlea 9 Eine Welle wird gezeigt, die gerade entlang der Cochlea wandert, welche hier aufgerollt gezeigt wird. Rechts zeigen die Graphen die Amplitude der wandernden Welle entlang der Basilarmembran mit unterschiedlichen Frequenzen. Die Position (1 bis 7) wo die Amplitude ihr Maximum erreicht, variiert direkt mit der Frequenz der Stimulation, mit höherer Frequenz geht’s auf den Grund und mit tieferer Frequenz zum Gipfel. Zusammenfassung Bio 143 Frühlingssemester 2009 Das visuelle System Das Auge im nicht akkomodierten und akkomodierten Zustand. Akkomodation für Fokusierung von nahen Objekten, beinhaltet die Kontraktion der Ziliarmuskeln, welche die Spannung in den Zonulafasern vermindert und erlaubt der Elastizität der Linse ihre Krümmung zu verstärken. 10 Emmetropie = Normalsichtigkeit: Wenn der Ziliarmuskel relaxed ist, wird das Bild von einem fernen Objekt auf der Retina abgebildet Myopie = Kurzsichtigkeit: Das Objekt wird vor der Retina abgebildet. Hyperopie = Weitsichtigkeit: Das Objekt wird hinter der Retina abgebildet. Struktur der Retina (Netzhaut) Bild A zeigt die retinalen Schichten. Bild B ist ein Diagramm des elementaren Kreislaufs der Retina. Eine 3-Neuronen-Kette (Photorezeptoren, Bipolarzellen und Ganglienzellen) bildet die direkteste Route um visuelle Info zum Hirn zu übermitteln. Horizontalzellen und Amacrinzellen leiten seitliche Interaktionen in die äussere und innere Plexyformschichten. Es wird wegen ihrer Distanz zum Augenzentrum „innere“ und „äussere“ genannt. Zusammenfassung Bio 143 Frühlingssemester 2009 Generell sehen sich Stäbchen und Zapfen in ihrer Struktur ähnlich. Sie unterscheiden sich aber in Grösse und Form und im Arrangement ihrer Membrandisks im äusseren Segment. Stäbchen (Rod) sind lichtempfindlicher als Zapfen (cone). Stäbchen Sehr lichtempfindlich, skotopisch, enthält viel Photopigment hoch verstärkend (1 Photon ausreichend) Niedrige zeitliche Auflösung räumliche Auflösung monochromatisch 11 Zapfen wenig lichtempfindlich photopisch enthält weniger Photopigment niedrig verstärkend hohe zeitliche Auflösung niedrige hohe räumliche Auflösung trichromatisch Farbsehen Die Absorbierungsspektrum und Verteilung der Zapfen-Opsine. Zusammenfassung Bio 143 Frühlingssemester 2009 Lichtabsorbierungsspektrum der vier Photopigmente in einer normalen menschlichen Retina. Die durchgezogenen Linien zeigen die 3 Zapfenopsine und die durchgestrichelte Linie zeigt StäbchenRhodopsin zum Vergleich. Short- blau, medium- grün, und long-wave-length rot Bereich der Luminanz in welchem das visuelle System funtkioniert Beim tiefsten Belichtungslevel sind nur die Stäbchen aktiviert. Die Zapfen beginnen bei der Wahrnehmung mitzuwirken, wenn etwa Sternenlicht vorhanden ist und sie sind die einzigen Rezeptoren, welche unter relativ hellen Konditionen funktionieren. Eine intrazelluläre Aufnahme eines einzelnen Zapfen, mit unterschiedlichen Lichtmengen stimuliert 12 Jede Linie repräsentiert die Antwort auf einen kurzen Blitz, welcher in der Intensität variiert wurde. Beim höchsten Lichtlevel ist die Amplitude gesättigt, bei ca. -65mV Die hyperpolarisierende Antwort ist charakteristisch für Wirbeltier-Photorezeptoren. Interessanterweise gibt es einige Invertebraten, deren Photorezeptoren bei Licht depolarisieren. Rhodopsin ist in der Diskmembran des Aussensegments des Photo-rezeptors. Die sieben Transmembrandomänen des OpsinMoleküls umgeben das lichtsensitive Retinal-Molekül. Zusammenfassung Bio 143 Frühlingssemester 2009 Die Second-Messenger Kaskade der Phototransduktion Licht aktiviert Photopigment (11cis Retinal wird zu all-trans Retinal) Rhodopsin aktiviert Transduzin (trimeres G-Protein) Aktiviertes Transduzin aktiviert cGMP Phosphodiesterase (PDE) PDE hydrolysiert cGMP, was zur Verminderung der cGMP-Konzentration führt, dadurch schliessen cGMP gekoppelte Kanäle 13 Zelle hyperpolarisiert und schüttet weniger Neurotransmitter aus Photorezptorkanäle öffnen sich cGMP-abhängig Im Dunkeln Der cGMP-Level im äusseren Segment ist hoch. cGMP bindet an die Na-durchlässigen Kanäle in der Membran, hält diese geöffnet und Natrium kann einfliessen und die Zelle depolarisiert. Zusammenfassung Bio 143 Frühlingssemester 2009 Im Hellen Die Absorbierung von Photonen führt zu einer Abnahme des cGMP-Levels. Die Kationen-Kanäle werden geschlossen und es resultiert eine Rezeptor-Hyperpolarisation. Zentrale Projektionen des Visuellen Systems 14 „Abbildungssehen“ „Nicht-Abbildungssehen“ Neuronen der primären Sehrinde reagieren orientierungsselektiv Dies wurde in Tierexperimenten nachgewiesen, wo die Neuronalen Antworten auf visuelle Reize aufgenommen wurde. Neuronen im primären visuellen Kortex reagieren typischerweise energisch auf einen Lichtstreifen in einem spezifischen Winkel angeordnet und viel weniger stark oder gar nicht auf einen Streifen mit anderer Orientierung. Optische Messungen zeigen „windradartige“ Organisation von Orientierungskolumnen. Zusammenfassung Bio 143 Frühlingssemester 2009 Nach dem primären Cortex spaltet sich die Sehverarbeitung grob in zwei Pfade auf •DorsalerPfad–Wo?–Bewegung, Ort •VentralerPfad–Was?–Form, Farbe Sehinformation wird dekonstruiert und parallel verarbeitet 15 Zusammenfassung Bio 143 Frühlingsemester 2009 Motorik VL 9 Overall organization of neural structures involved in the control of movement. Der neurale Kreislauf, welcher die Bewegung kontrolliert, kann in vier Subsysteme geteilt werden. Das erste Subsystem beinhaltet die graue Substanz des Rückenmarks und das Tegmentum der Hirnstamms. Die relevanten Zellen sind die lower motor neurons (von welchen die Axone die Skelettmuskeln des Kopfes und Körpers innervieren) und die local circuit neurons (welche die grösste Quelle der synaptischen Inputs zu den lower motor neurons bilden). Alle Bewegungskommandos werden durch die Motorneuronen an die Muskeln weitergeleitet. Die local circuit neurons bekommen sensorische Inputs und Inputs aus höheren Zentren. Das zweite Subsystem beinhaltet die upper motor neurons (deren Zellkörper liegen im Hirnstamm oder im Zerebralcortex). Ihre Axone nehmen Verbindung auf mit den local circuit neurons und selten auch mit den lower motor neurons. Initiierung von willentlichen Bewegungen und raumzeitliche Sequenzen geschickter Bewegungen Das dritte (Cerebellum) und vierte Subsystem (Basalganglien) sind komplexe Kreisläufe mit Output Pathways, welche keinen direkten Zugang zu den local circuit neurons oder den lower motor neurons. Das Cerebellum agiert via die efferenten Pathways zu den upper motor neurons als ein Servosystem, welches die Motorerrors aufspürt (zwischen den Beabsichtigten und ausgeführten Bewegungen). Die Basalganglien unterdrücken die ungewollten Bewegungen und primen die upper motor Neurons für die Initiierung von Bewegung. 1 Die Motorneuronen liegen im ventralen Horn des Rückenmarks. Die somatotopische Organisation der Motorneuronen auf Cervicaler Höhe des Rückenmarks zeigt, dass Motorneuronen welche axiale Muskulatur innervieren medial liegen und jene, welche distale Muskulatur innervieren liegen mehr lateral im ventralen Horn. Auch Flexoren liegen immer mehr dorsal als die Extensoren. Motor unit Jedes α-Motorneuron verbindet sich mit Mehrfachfasern innerhalb des Muskels. Das α-Motorneuron und die Muskelfasern definieren die Motor Unit. Ein Querschnitt zeigt die relativ diffuse Verteilung von Muskelfasern (rot) welche von einem einzelnen Motorneuron kontaktiert werden. Zusammenfassung Bio 143 Frühlingsemester 2009 Comparison of the force and fatigability of the three different types of motor units. 2 Motor Units und α-Motorneuronen unterscheiden sich in ihrer Grösse. Kleine α-Motorneuronen innervieren relativ wenig Muskelfasern und bilden so eine Motor unit, welche kleine Kräfte generiert. Grösser α-Motorneuronen innervieren auch grössere Motor Units. Motor Units unterscheiden sich durch die Art der Muskelfasern. In der meisten Skelettmuskulatur beinhalten die kleineren Motor Units kleine rote Muskelfasern, welche langsam kontraktieren und relativ kleine Kräfte generieren, aber wegen ihrem reichen Myoglobingehalt, reichlichen Mitochondrien und reichen Kapillarenbett, sind diese kleinen roten Fasern resistent gegenüber Ermüdung. Sie heissen slow (S) motor units (braucht man um Aufrechtstehen zu bleiben, haben deshalb auch tiefere Thresholds). Die grösseren Motorneurone innervieren grössere, blasse Muskelfasern, welche mehr Kraft generieren. Diese Fasern haben wenig Mitochondrien und sind schnell ermüdet und heissen deshalb fast fatigable (FF) motor units (für kurze Anspannungen: Rennen, Springen – Threshold wird nur bei schnellen Bewegungen, welche viel Kraft benötigen erreicht). Dann gibt es noch die fast fatigue-resistant (FR) motor units. Sie sind etwas zwischen den anderen beiden. Nicht so schnell wie die FF, aber generieren doppelt so viel Kraft wie die S und sind Ermüdungsresistent (Laufen, Gehen) Das Bild A zeigt den Wechsel in Muskelkontraktion in Erwiderung auf ein einzelnes Aktionspotenzial. Bild B zeigt Kontraktion in Erwiderung auf eine repetitive Stimulation. Bild C zeigt die Erwiderung auf eine wiederholte Stimulation auf einem Level, welcher zuerst eine Maximalkontraktion evoziert. Zusammenfassung Bio 143 Frühlingsemester 2009 Der Effekt der Stimulationsrate auf die Muskelkontraktion Die Erhöhung der Kraft, welche bei erhöhter Feuerungsrate vorkommt, widerspiegelt die Summation von fortlaufender Muskelkontraktion. Bei niedriger Stimulations-Frequenz, resultiert jedes AP im Motorneuron in einer einzelnen Zuckung des entsprechenden Muskels (single muscle twitches). Bei höherer Frequenz summieren sich die Zuckungen, um eine grössere Kraft zu generieren (temporal summation). Bei noch höherer Frequenz der Stimulation, wird die Kraft noch grösser, aber die einzelnen Zuckungen sind noch zu erkennen (unfused Tetanus). Bei der höchsten Aktivierungsrate, sind einzelne Zuckungen nicht mehr wahrnehmbar (fused Tetanus). Streckreflexkreislauf Die Muskelspindel ist der sensorische Rezeptor welcher den Streckreflex initiiert. Wenn eine Muskelspindel gestreckt wird, führt es zu einer gesteigerten Aktivität in den afferenten Axone und einem Abfall der Aktivität des α-Motorneurons, welches denselben Muskel innerviert. Die afferenten Axone reizen auch die Motorneurone, welche synergistische Muskeln innervieren und hemmen so indirekt die Motorneuronen, welche Antagonisten innervieren. Der Streckreflex agiert als negativer Feedbackloop beim Regulieren der Muskellänge. 3 Die kleineren γ Motorneuronen kontrollieren die funktionalen Charakteristiken der Muskelspindel indem sie den Level der Reizbarkeit modulieren. Wenn der Muskel gedehnt ist, ist die Spindel auch gedehnt und die Entladungsrate in den Afferenzen ist gesteigert. Wenn nun der Muskel sich verkürzt, wird die Spindel spannungsentlastet, oder ungeladen, und man könnte meinen, dass die sensorischen Axone still werden, während der Kontraktion. Aber dem ist nicht so. Sie bleiben nämlich aktiv. Die γ Motorneuronen enden bei den kontraktilen Polen der inneren Muskelfasern und die Aktivierung dieses Neurons löst eine innere Fasernkontraktion aus, was zur Spannungsbeibehaltung der inneren Fasern führt. So erlaubt die Co-Aktivierung von α und γ-Neurone dass die Spindeln bei allen Muskellängen während Bewegungen funktionieren. Comparison of the function of muscle spindles and Golgi tendon organs Golgi tendon organs (Golgi Sehnen-Organe?) sind in Serie mit Muskelfasern arrangiert, da sie zwischen Muskel und Sehne liegen. Die zwei Muskelrezeptortypen, Muskelspindeln und GTO haben verschiedene Reaktionen auf passive Muskeldehnung und aktive Muskelkontraktion. Beide Afferenzen entlasten sich bei passiver Streckung des Muskels (die Entlastung des GTO ist weniger als die der Spindel). Wenn die extrafusalen Muskelfibern durch die Stimulation des α Motorneurons kontraktieren, ist die Spindel ungeladen und wird ruhig, während die GTO Feuerungsrate steigt. Zusammenfassung Bio 143 4 Frühlingsemester 2009 Zusammenfassung Bio 143 Frühlingsemester 2009 Negative Feedback Regulation der Muskelspannung durch GTO Die afferenten Neurone der GTO verbinden sich mit inhibitorischen Interneuronen, was die Aktivität von α Motorneuronen im selben Muskel senkt. Die Inhibitorischen Interneuronen erhalten auch Inputs von anderen sensorischen Fasern und auch von absteigenden Pathways. Dieses Arrangement verhindert eine exzessive Muskelspannung. Spinal cord circuitry responsible fort he flexion reflex (Beugungsreflex) Stimulierung der Hautrezeptoren am Fuss (wenn man z.B. auf eine Nadel tritt) führt zu einer Aktivierung der Rückenmarks-Lokalkreislaufs. Dieser dient dem Zurückziehen (beugen) des stimulierten Körperteils, aber auch dem Ausdehnen der anderen Extremität um kompensatorische Unterstützung zu leisten. Auf der einen Seite wird der Flexor aktiviert, auf der anderen Seite der Extensor. Spinal cord Circuitry and Locomotion Die lokalen Kreisläufe im Rückenmark (central pattern generators), sind fähig das Timing und die Koordination von Komplexen Bewegungsmustern zu kontrollieren. Ein gutes Beispiel dafür ist Lokomotion (gehen, rennen…) Die Bewegung eines einzelnen Gliedes kann als Zyklus mit zwei Phasen betrachtet werden: stance phase (Extension: Stellung, Haltung auf dem Boden) und swing phase (Flexion: Schwung, berührt den Boden nicht) Das Gehirn wird dazu nicht gebraucht. Es reicht das Rückenmark, wo alle Infos enthalten sind. Regulation von Bewegung durch übergeordnete Motoneurone Die Lokation von absteigenden Projektionen vom Motorkortex in der lateralen Weissen Substanz und vom Hirnstamm in der anterior-medialen weissen Substanz sind abgebildet. 5 Die medialen ventralen Hörner enthalten lower motor neurons welche die Körperhaltung, die Balance und die Orientierung des Kopfes und Halses während Blickfeldverschiebungen regulieren. Diese medialen Motorneuronen erhalten absteigende Inputs von Pathways, welche aus dem Hirnstamm kommen, durch die anterior-mediale weisse Substanz des Rückenmarks gelangen und bilateral enden. Das lateral ventrale Horn enthält enthält lower motor neurons, welche die Expression von willentlichen Bewegungen der distalen Extremitäten leiten. Diese lateralen Motorneuronen erhalten hauptsächlich absteigende Projektionen von dem kontralateralen Motorkortex via der Hauptaufteilung des kortikospinalen Trakts, welche in die laterale weisse Substanz des Rückenmarks führt. Einfachheitshalber wird hier nur die eine Seite des Hirnstamms, Motorkortex und lateralen ventralen Horns gezeigt und der minor anterior kortikopinale Tract wurde weggelassen. Zusammenfassung Bio 143 Frühlingsemester 2009 Vorausschauende Aufrechterhaltung der Körperhaltung Der Körper hält sich in stabiler Position, wenn man z.B. mit der Hand an etwas zieht, gleichen die Beine die Bewegung aus. Die Bewegung wird im Voraus ausgerechnet. Feedforward und Feedback Mechanismus der Körperhaltung: Die Feedforward Haltungs-Antworten sind vorprogrammiert und führen typischerweise den Anfang einer Gliederbewegung. FeedbackAntworten werden durch sensorische Inputs initiiert welche Haltungsinstabilität feststellen. So wird das Gleichgewicht wieder hergestellt und eingestellt. Der motorische Kortex enthält eine topographische Karte der Muskulatur des Körpers Homunculus 6 The Babinski sign Wenn man jemandem über die Fusssohle streichelt, sollten sich die Zehen zusammen ziehen. Es ist bei einem Erwachsenen nicht normal, wenn sich dabei die Zehen auseinander spreizen Babinski Sign, Schaden beim absteigenden corticospinalen Pathway (Bei einem Kleinkind ist es normal) Zusammenfassung Bio 143 Frühlingsemester 2009 Motor components of the human basal ganglia and Anatomical organization of the inputs to the basal ganglia. Medium Spiny Neurone im Caudate sind sehr wichtig. Es hat sehr viele Fortsätze (Aufnahme der Infos). Die Axone laufen im Globus Pallidus zusammen, im internen und externen, oder auch in der substantia nigra. 7 Das Arrangement dieser Synapsen zeigt, dass die Antwort der medium spiny Neurone durch Dopamin und die Input der lokalen Circuit Neurone moduliert werden kann. Der primäre Output der medium spiny Zellen führt zu pallidal Neuronen im Globus pallidus und der Substantia Nigra Pars Reticulata. Inhibitorisches Signal wird inhibiert Bewegung ausgelöst Globus pallidus internal: dauernd aktiv, auch im Ruhezustand. Einfluss von aussen führt zur Inaktivierung der Hemmung Zusammenfassung Bio 143 Frühlingsemester 2009 Disinhibition im direkten und indirekten Pathway durch die Basalganglien 8 D= dopaminerge Rezeptoren D1 zyklisches AMP aktiviert D2 zyklische AMP inhibiert Parkinson Substantia Nigra schwindet Zusätzliche Regulation: Signal genau umkehren Zusammenfassung Bio 143 Frühlingsemester 2009 Morbus Huntington Putamen und Caudatus gehen verloren Das Kleinhirn, Cerebellum Ist zentral für die Kontrolle. Die Areale des Cerebellums sind für verschiedene Funktionen zuständig. Medial: steuern die Bewegung an Mittellinien Lateral: steuert aussenliegende Bewegung Inputs kommen hier von der gleichen Seite (ist eine grosse Ausnahme) 9 Funktionelle Organisation der Cerebellumoutputs Die 3 Hauptfunktionsaufteilung der Kleinhirnhemisphären projizieren zu korrespondierenden tiefen Kleinhirnkerne und Vestibulärkerne, welche wiederum Inputs zu Neuralen Kreisläufen liefern, welche verschiedene Aspekte der Motorkontrolle lenken. Bei den Hauptoutputs welche die upper Motorneurone beeinflussen: Die Axone des deep cerebellar nuclei kreuzen im Mittelhirn im superior cerebellar Peduncle bevor sie den Thalamus erreichen. Neuronen und Circuits des Cerebellums Purkinjezellen sammeln Infos und geben sie raus. Zusammenfassung Bio 143 Frühlingsemester 2009 Der exzitatorische Input von den Mossy Fasern und den kletternden Fasern zu den Purkinje-Zellen und deep nuclear cells ist grundsätzlich derselbe. Zusätzlich konvergierende Inputs zu den Purkinjezellen von local circuit Neuronen und anderen Purkinjezellen bilden eine Basis für den Vergleich von laufender Bewegung und sensorischem Feedback, welches von ihr kommt. 10 Vestibulo-ocular-Reflex Normalerweise arbeitet dieser Reflex um die Augen zu bewegen, wenn der Kopf sich bewegt, um die retinale Abbildung stabil zu halten. Wenn ein Versuchstier durch minimierende Brillengläser schaut, bewegt sich das Auge zuerst zu weit bezüglich des Abbildes auf der Retina. Nach einer Weile, wird der Nutzen des VOR ist wieder abgeglichen und das Auge bewegt sich in angebrachter Distanz bezüglich der Kopfbewegung (Kompensation der geänderten Grösse des visuellen Abbildes). Pathologische Änderungen Chronischer Alkoholkonsum verursacht Degenerierung des anterior vermis, während andere Teile des Cerebellums intakt bleiben. Der Patient hatte Mühe zu gehen, aber konnte immer noch gut die Arme bewegen oder sprechen.