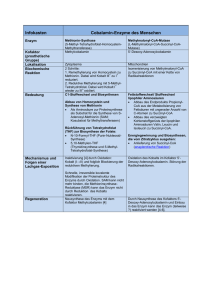
Cobalamin-Enzyme des Menschen
Werbung

Cobalamin-Enzyme des Menschen Enzym Kofaktor (prosthetische Gruppe) Zelluläre Lokalisation Biochemische Reaktionen Methionin-Synthase (5-Methyl-Tetrahydrofolat-HomocysteinMethyltransferase) Methylcobalamin Methylmalonyl-CoA-Mutase (L-Methylmalonyl-CoA-Succinyl-CoA-Mutase) Zytoplasma Mitochondrien Methylierung von Homocystein (Hcy) zu Methionin: 2 Schritte (nukleophile Substitutionen) Isomerisierung von Methylmalonyl-CoA zu Succiniyl-CoA: 3+ Das Enzym reduziert das Co seines Kofaktors 5‘2+ Desoxy-Adenosylcobalamin zu Co , indem es die Elektronenpaarbindung zwischen der 5‘-CH2-Gruppe 3+ und Co homolytisch spaltet. Dabei entsteht aus der 5‘-Methylgruppe des 5‘-Desoxy-Adenosylcobalamins ein Radikal (ein ungebundenes Elektron). Das Radikal entzieht der Methylgruppe des MethylMalonyl-CoA ein Wasserstoffatom (mit seinem Elektron). Das führt zur Bildung eines Methyl-MalonylCoA-Radikals. Die CO-S-CoA-Gruppe und das ungepaarte Elektron tauschen dann ihre Position. Damit ist die CO-S-CoA an die Methylgruppe des Moleküls gebunden und ein Succinyl-CoA-Radikal entstanden. Dessen ungepaartes Elektron entzieht der 5‘-Methylgruppe des 5‘-DesoxyAdenosylcobalamins ein Wasserstoffatom (mit seinem Elektron), woraufhin wieder ein 5’-Desoxy2+ Adenosylradikal entsteht. Das entzieht dem Co ein 3+ Elektron, so dass wieder Co entsteht. Damit kann der Zyklus von vorn beginnen. Der gesamte Prozess wird von einer „Chaperone“, also einer GTPase, („Chaperone“) „betreut“. Die GTP-Hydrolyse liefert auch die Energie für die Redaktionen Das 5‘-Desoxy-Adenosylcobalamin-Radikal verliert gelegentlich den 5‘-Desoxy-Adenosylrest. Die Mutase 2+ mit Co -Cobalamin ist dann inaktiv. Sie kann wieder 2+ reaktiviert werden, indem das Co -Cobalamin aus dem Enzym entfernt wird. Auch dies wird von o. g. GTPase gesteuert. Anschließend wird von der Adenosyltransferase neu 3+ synthetisiertes 5‘-Desoxy-Co Adenosylcobalamin in das Enzym Methylmalonyl-CoA-Mutase eingebaut. Die Adenosyltransferase katalysiert die Synthese des Kofaktors 5‘-Desoxy-Adenosylcobalamin und den Einbau in das Enzym in Kooperation mit der o. g. GTPase. Fettstoffwechsel 3+ 1. Die Bindung zwischen Co und der Methylgruppe, des Methylcobalamins wird hetereolytisch gespalten (beide Elektronen 3+ werden dem Cobalt zugeordnet, Co wird also zu + Co reduziert. Das Prinzip ist ein nukleophiler Angriff des Homocystein-Thiolats (–S ) auf die an Cobalt gebundene Methylgruppe. + 2. Reduktive Methylierung des Co mit der Methylgruppe des mit 5-Methyl-Tetrahydrofolats. + 3+ Dabei wird das Co wieder zu Co oxidiert. Damit ist die Methioninsynthase wieder bereit für die Methylierung von Homocystein. Tetrahydrofolat wird in den Folatstoffwechsel zurückgeführt + Regeneration des Kofaktors Co des Cobalamins, das nach der Synthese des Methionins vorliegt, ist oxidationsempfindlich und 2+ oxidiert spontan zu Cobalt . Das Enzym Methioninsynthase-Reduktase reduziert das 2+ Cobalt des Cobalamins mit Hilfe von NADPH + und S-Adenosyl-Methionin, wobei Co -Cobalamin und S-Adenosyl-Homocystein entstehen Bedeutung C1-Stoffwechsel und Biosynthesen Synthese von Methionin als Aminosäure für Proteinsynthese und zum Abbau von Homocystein als Substrat für die Synthese von S-AdenosylMethionin (SAM; Kosubstrat für Methyltransferasen) Rückführung von Tetrahydrofolat (THF) zur Biosynthese der Folate: N-10-Formyl-THF (Purin-Nukleosid-Synthese) 5,10-Methylen-THF (Thymidinsynthese und 5Methyl-THF-Synthese) 5‘-Desoxy-Adenosylcobalamin (AdoCbl) Umwandlung des Endprodukts Propionyl-CoA aus der Metabolisierung von Fettsäuren mit ungerader Anzahl von C-Atomen zu Succinyl-CoA Abbau des verzweigten Kohlenstoffgerüsts der lipophilen Aminosäuren Valin, Leucin und Isoleucin zu Succinyl-CoA. Biosynthesen und Energiegewinnung ausgehend vom Zitratzyklus: Zulieferung von Succinyl-CoA an den Zitratzyklus (anaplerotische Reaktion)