Infokasten Cobalamin-Enzyme des Menschen
Werbung
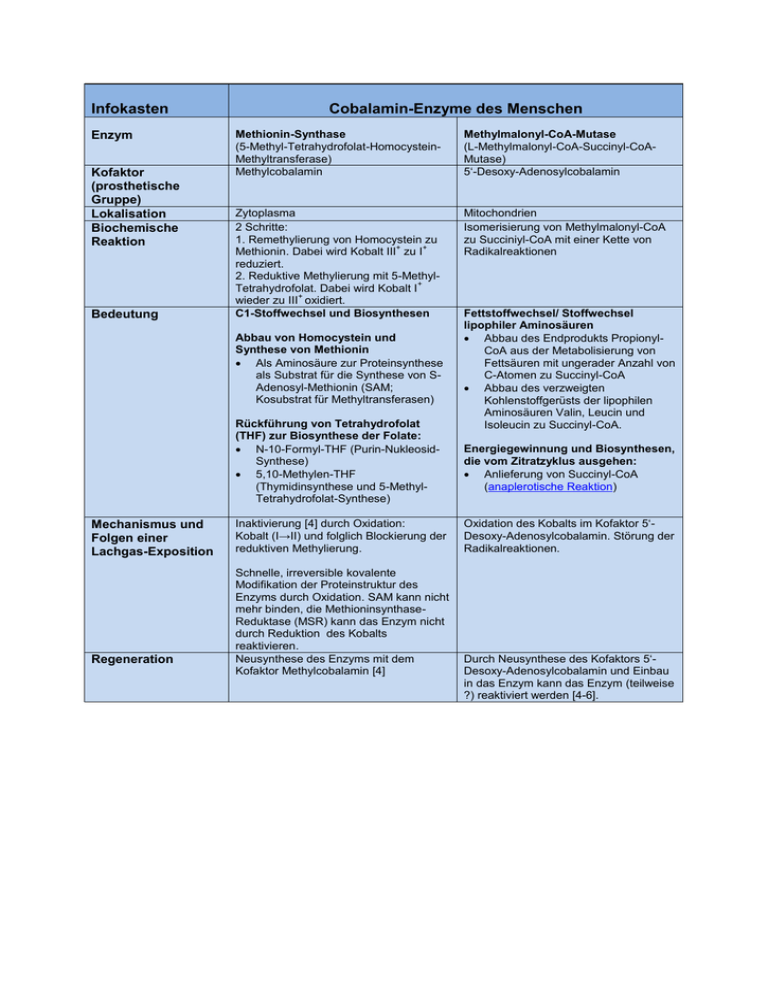
Infokasten Enzym Kofaktor (prosthetische Gruppe) Lokalisation Biochemische Reaktion Bedeutung Cobalamin-Enzyme des Menschen Methionin-Synthase (5-Methyl-Tetrahydrofolat-HomocysteinMethyltransferase) Methylcobalamin Methylmalonyl-CoA-Mutase (L-Methylmalonyl-CoA-Succinyl-CoAMutase) 5‘-Desoxy-Adenosylcobalamin Zytoplasma 2 Schritte: 1. Remethylierung von Homocystein zu + + Methionin. Dabei wird Kobalt III zu I reduziert. 2. Reduktive Methylierung mit 5-Methyl+ Tetrahydrofolat. Dabei wird Kobalt I + wieder zu III oxidiert. C1-Stoffwechsel und Biosynthesen Mitochondrien Isomerisierung von Methylmalonyl-CoA zu Succiniyl-CoA mit einer Kette von Radikalreaktionen Abbau von Homocystein und Synthese von Methionin Als Aminosäure zur Proteinsynthese als Substrat für die Synthese von SAdenosyl-Methionin (SAM; Kosubstrat für Methyltransferasen) Rückführung von Tetrahydrofolat (THF) zur Biosynthese der Folate: N-10-Formyl-THF (Purin-NukleosidSynthese) 5,10-Methylen-THF (Thymidinsynthese und 5-MethylTetrahydrofolat-Synthese) Mechanismus und Folgen einer Lachgas-Exposition Regeneration Inaktivierung [4] durch Oxidation: Kobalt (I→II) und folglich Blockierung der reduktiven Methylierung. Schnelle, irreversible kovalente Modifikation der Proteinstruktur des Enzyms durch Oxidation. SAM kann nicht mehr binden, die MethioninsynthaseReduktase (MSR) kann das Enzym nicht durch Reduktion des Kobalts reaktivieren. Neusynthese des Enzyms mit dem Kofaktor Methylcobalamin [4] Fettstoffwechsel/ Stoffwechsel lipophiler Aminosäuren Abbau des Endprodukts PropionylCoA aus der Metabolisierung von Fettsäuren mit ungerader Anzahl von C-Atomen zu Succinyl-CoA Abbau des verzweigten Kohlenstoffgerüsts der lipophilen Aminosäuren Valin, Leucin und Isoleucin zu Succinyl-CoA. Energiegewinnung und Biosynthesen, die vom Zitratzyklus ausgehen: Anlieferung von Succinyl-CoA (anaplerotische Reaktion) Oxidation des Kobalts im Kofaktor 5‘Desoxy-Adenosylcobalamin. Störung der Radikalreaktionen. Durch Neusynthese des Kofaktors 5‘Desoxy-Adenosylcobalamin und Einbau in das Enzym kann das Enzym (teilweise ?) reaktiviert werden [4-6].