MEMO Teil 1
Werbung
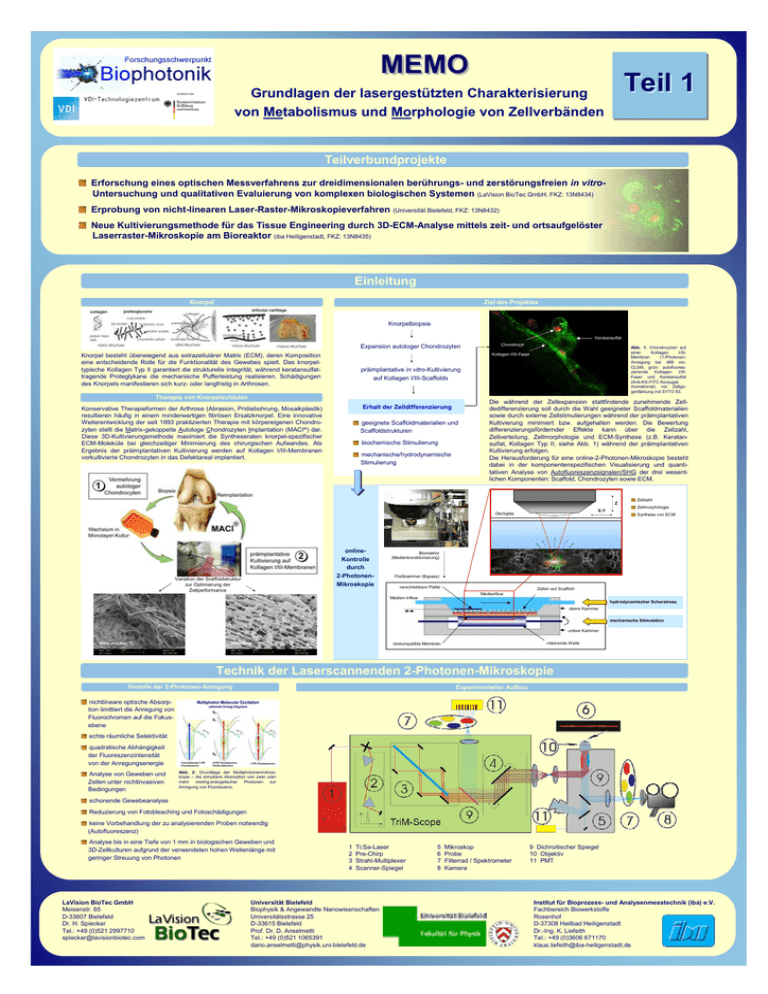
MEMO Teil 1 Grundlagen der lasergestützten Charakterisierung von Metabolismus und Morphologie von Zellverbänden Teilverbundprojekte Erforschung eines optischen Messverfahrens zur dreidimensionalen berührungs- und zerstörungsfreien in vitroUntersuchung und qualitativen Evaluierung von komplexen biologischen Systemen (LaVision BioTec GmbH, FKZ: 13N8434) Erprobung von nicht-linearen Laser-Raster-Mikroskopieverfahren (Universität Bielefeld, FKZ: 13N8432) Neue Kultivierungsmethode für das Tissue Engineering durch 3D-ECM-Analyse mittels zeit- und ortsaufgelöster Laserraster-Mikroskopie am Bioreaktor (iba Heiligenstadt, FKZ: 13N8435) Einleitung Knorpel Ziel des Projektes Knorpelbiopsie Keratansulfat Expansion autologer Chondrozyten Chondrozyt Abb. 1: Chondrozyten auf einer Kollagen I/IIIMembran (1-PhotonenAnregung bei 488 nm, CLSM, grün: autofluoreszierende Kollagen I/IIIFaser und Keratansulfat (Anti-KS-FITC-Konjugat, monoklonal), rot: Zellgegenfärbung mit SYTO 83. Kollagen I/III-Faser Knorpel besteht überwiegend aus extrazellulärer Matrix (ECM), deren Komposition eine entscheidende Rolle für die Funktionalität des Gewebes spielt. Das knorpeltypische Kollagen Typ II garantiert die strukturelle Integrität, während keratansulfattragende Proteglykane die mechanische Pufferleistung realisieren. Schädigungen des Knorpels manifestieren sich kurz- oder langfristig in Arthrosen. präimplantative in vitro-Kultivierung auf Kollagen I/III-Scaffolds Therapie von Knorpelschäden Erhalt der Zelldifferenzierung Konservative Therapieformen der Arthrose (Abrasion, Pridiebohrung, Mosaikplastik) resultieren häufig in einem minderwertigen fibrösen Ersatzknorpel. Eine innovative Weiterentwicklung der seit 1993 praktizierten Therapie mit körpereigenen Chondrozyten stellt die Matrix-gekoppelte Autologe Chondrozyten Implantation (MACI®) dar. Diese 3D-Kultivierungsmethode maximiert die Syntheseraten knorpel-spezifischer ECM-Moleküle bei gleichzeitiger Minimierung des chirurgischen Aufwandes. Als Ergebnis der präimplantativen Kultivierung werden auf Kollagen I/III-Membranen vorkultivierte Chondrozyten in das Defektareal implantiert. geeignete Scaffoldmaterialien und Scaffoldstrukturen biochemische Stimulierung mechanische/hydrodynamische Stimulierung Die während der Zellexpansion stattfindende zunehmende Zelldedifferenzierung soll durch die Wahl geeigneter Scaffoldmaterialien sowie durch externe Zellstimulierungen während der präimplantativen Kultivierung minimiert bzw. aufgehalten werden. Die Bewertung differenzierungsfördernder Effekte kann über die Zellzahl, Zellverteilung, Zellmorphologie und ECM-Synthese (z.B. Keratansulfat, Kollagen Typ II; siehe Abb. 1) während der präimplantativen Kultivierung erfolgen. Die Herausforderung für eine online-2-Photonen-Mikroskopie besteht dabei in der komponentenspezifischen Visualisierung und quantitativen Analyse von Autofluoreszenzsignalen/SHG der drei wesentlichen Komponenten: Scaffold, Chondrozyten sowie ECM. Z X-Y Deckglas onlineKontrolle durch 2-PhotonenMikroskopie Variation der Scaffoldstruktur zur Optimierung der Zellperformance Zellzahl Zellmorphologie Synthese von ECM Bioreaktor (Medienkonditionierung) Fließkammer (Bypass) verschiebbare Platte Zellen auf Scaffold Medienflow Medien-Inflow hydrodynamischer Scherstress obere Kammer mechanische Stimulation untere Kammer Vlies (ACI-MaixTM) Schwamm rotierende Welle biokompatible Membran Technik der Laserscannenden 2-Photonen-Mikroskopie Vorteile der 2-Photonen-Anregung Experimenteller Aufbau nichtlineare optische Absorption limittiert die Anregung von Fluorochromen auf die Fokusebene echte räumliche Selektivität quadratische Abhängigkeit der Fluoreszenzintensität von der Anregungsenergie Analyse von Geweben und Zellen unter nichtinvasiven Bedingungen Abb. 2: Grundlage der Multiphotonenmikroskopie – die simultane Absorption von zwei oder mehr niedrig-energetischer Photonen zur Anregung von Fluoreszenz. schonende Gewebeanalyse Reduzierung von Fotobleaching und Fotoschädigungen keine Vorbehandlung der zu analysierenden Proben notwendig (Autofluoreszenz) Analyse bis in eine Tiefe von 1 mm in biologischen Geweben und 3D-Zellkulturen aufgrund der verwendeten hohen Wellenlänge mit geringer Streuung von Photonen LaVision BioTec GmbH Meisenstr. 65 D-33607 Bielefeld Dr. H. Spiecker Tel.: +49 (0)521 2997710 [email protected] 1 2 3 4 Ti:Sa-Laser Pre-Chirp Strahl-Multiplexer Scanner-Spiegel Universität Bielefeld Biophysik & Angewandte Nanowisenschaften Universitätsstrasse 25 D-33615 Bielefeld Prof. Dr. D. Anselmetti Tel.: +49 (0)521 1065391 [email protected] 5 6 7 8 Mikroskop Probe Filterrad / Spektrometer Kamera 9 Dichroitischer Spiegel 10 Objektiv 11 PMT Institut für Bioprozess- und Analysenmesstechnik (iba) e.V. Fachbereich Biowerkstoffe Rosenhof D-37308 Heilbad Heiligenstadt Dr.-Ing. K. Liefeith Tel.: +49 (0)3606 671170 [email protected]
![Biopad PP 3 2013 [Kompatibilitätsmodus]](http://s1.studylibde.com/store/data/002972973_1-38ca65717fb65355dfc1d46717c7d136-300x300.png)