13. Carbonyl-Verbindungen 13.1. Struktur der Carbonyl
Werbung

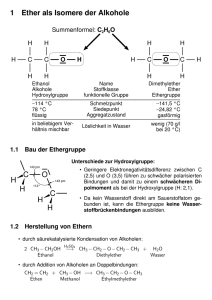
13. Carbonyl -Verbindungen 13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 13.2.2 Nomenklatur Darstellungen Oxidationen Reaktionen Additionen an der C=O Acetale und Halbacetale Reaktionen am α-C Aldol-Reaktion besondere Reaktionen Wittig-Reaktion Reduktionen der Carbonylgruppe 13.2.3 13.3. Carbonsäure und Derivate 13.3.1 Carbonsäuren Eigenschaften, Nomenklatur Vorkommen, Darstellung Salze Carbonsäurechloride und Anhydride Carbonsäureester Darstellung, Nomenklatur Fruchtaromen, Fette, Wachse Carbonsäureamide Darstellung, H-Brücken Polyamide 13.3.2 13.3.3 13.3.4 Achtung: unvollständige Version 13.1. Die Carbonyl-Gruppe Elektronische Struktur Tafelbild: AOs, MOs, Energie-Schemas O- und C-Atom sind sp 2 - hydridisiert σ + π - Bindung, energiereiche n-Elektronen am O Geometrische Struktur planar, 120° am C-Atom Substituenten der Carbonylgruppe Y-CO-X Häufigste Substituenten Y,X = H, R = O, N, (S) = Cl Aldehyde: Y = R, X = H Ketone: Y = R, X = R (bzw. Y = H, X = X) Polarität der Carbonylgruppe Der Sauerstoff ist stärker elektronegativ als der Kohlenstoff. Zusätzlich lassen sich auch mesomere Grenzstrukturen zeichnen, die die negative Ladung am Sauerstoff lokalisieren: X O O C C+ Y X O ≡ Y X C δδ+ Y → starkes Dipolmoment (ca. 9 x 10-30 Cm) → hohe Polarität → kurzkettige Derivate sind mischbar mit Wasser (C ≤ 6, z.B. Aceton) → hohe Siedepunkte Formel Name Siedepunkt [°C] HCOH Methanal (Formaldehyd) Ethanal (Acetaldehyd) Propanal (Propionaldehyd) Propanon (Aceton) -21 CH3-CHO CH3-CH2-CHO CH3-CO-CH3 21 49 56 Tafelbild: Vergleich unterschiedlicher ungesättigter Systeme Alkene: elektrophile Angriffe auf das π-Orbital, Additionen Aromaten: elektrophile Angriffe auf die π-Orbale, Substitutionen Carbonyl: elektrophile Angriffe auf die n-Orbitale; nukleophile Angriffe auf den Kohlenstoff Addition, oft gefolgt von Eliminierungen Reaktionsmöglichkeiten der Carbonylgruppe E+ |Nu δ- O δ+ C H X C B- Angriff einer Base auf das α-C erzeugt ein Mesomerie-stabilisiertes Anion: O X C O C- X C C Reprotonierung kann zu zwei verschiedenen Strukturen führen: O X C O H C H X C C → Keto-Enol-Tautomerie Mesomerie: zwei gedachte Grenzstrukturen (niemals trennbar) Tautomerie: zwei isomere Verbindungen, die durch Verschiebung von σ- und πBindungen entstehen und in einem Gleichgewichtszustand stehen. Meistens wird dabei die Position eines Protons verschoben. Tautomere können trennbar sein (z.B. im Kristall) 13.2.1.1 Nomenklatur der Aldehyde Extrafolien 13.2.1.2 Nomenklatur der Ketone Bei einer ältern, aber sehr gebräuchlichen Nomenklatur (nicht IUPAC) der Ketone werden zunächst die beiden Substituenten der Carbonylgruppe benannt mit der Endung 'yl' und dann die Endung "keton" hinzugefügt. O H3 C C CH3 Dimethylketon ("Aceton") O H3 C C CH2 CH3 Ethylmethylketon O H3 C CH2 C CH2 CH3 Diethylketon Das Dimethylketon wird üblicherweise mit seinem Trivialnamen "Aceton" bezeichnet. Die systematischen Namen der Ketone (IUPAC-Namen) leiten sich von denen der Alkane durch Anhängen der Endung "-on" ab. Die Position der Carbonylgruppe wird durch eine vorangestellte Positionszahl definiert, wenn nötig. O H3 C C CH3 Propanon (Dimethylketon, Aceton) (2-Propanon) O H3 C CH2 CH2 C CH2 CH3 3-Hexanon Bei cyclischen Ketonen beginnt die Nummerierung der Position mit der Carbonylgruppe: O 2,2-Dimethylcyclopentanon Br O 4-Bromcyclohexanon Wenn ranghöhere Funktionalitäten anwesend sind, werden Carbonylgruppen mit der Vorsilbe "oxo-" gekennzeichnet. Die Rangfolge: Aldehyd < Keton < Carbonsäure O O 3-Oxobutanal O HO O 4-Oxobutansäure Hinweis: Silbe "oxa" bezeichnet den Ersetzung eines Kohlenstoffes durch Sauerstoff 13.2.2 Darstellung von Aldehyden und Ketonen Die wichtigsten Methoden zur Darstellung von Carbonylverbindungen sind: - Oxidationen von Alkoholen - oxidative Spaltungen von Alkenen - Addition von Kohlenmonoxid an Alkene - Hydratisierung von Alkinen Oxidation von Alkoholen (siehe dort) primäre Alkohole → Aldehyde → Säure sekundäre Alkohole → Ketone tertiäre Alkohole Da die Oxidation von Aldehyden zu Säuren oft schneller und leichter erfolgt, als die Oxidation von Alkoholen zu Aldehyden, erfordert die selektive Oxidation primärer Alkohole zu Aldehyden besondere Reaktionsbedingungen (Wasserfreiheit, Rausdestillieren des Aldehyds, besondere Reaktionsmechanismen, etc.) Ozonolyse von Alkenen (siehe dort) Besondere Aldehyde Der einfachste Aldehyde ist Formaldehyd. Als einziger Aldehyd hat er zwei Wasserstoffe als Substituenten der Carbonylgruppe. Er ist besonders reaktiv und ein viel genutztes Synthesezwischenprodukt. Jährlich werden ca. 500.000 Tonnen Methanol zu Methanal oxidiert: H O2 / Ag / 600-650C CH3 OH HCHO ≡ C O H Anwendungen: - Desinfektions- und Konservierungsmittel wässrige Lösung = "Formalin" - Herstellung von Phenolharzen und anderen Polymeren Die Verwendung von Methanal in Spanplatten hat zu großen öffentlichen Diskussionen geführt: Formaldehyd kann Allergien und Hautreizungen auslösen. Butanal wird technisch durch die Hydroformylierung von Propen mit Synthesegas (CO + H2) hergestellt: CH3-CH=CH2 + CO + H2 → CH3-CH2-CH2-CHO Katalytisch (Co oder Rh) und unter Druck Aldehyde auch durch Oxidation von Alkenen darstellen. Im Wacker-HoechstVerfahren wird so Ethen mit Luftsauerstoff zu Acetaldehyd (Ethanal) oxidiert: O [PdCl2 /CuCl2] H2 C CH 2 + 1/2 O2 H 3C C H Aldehyde lassen sich auch durch Addition von Wasser an Alkine darstellen. Das sich zunächst bildende Enol tautomerisiert sofort zur Carbonylverbindung: OH [Hg 2 +] R C C H + H 2O R C O CH 2 R C CH3 13.2.3 Reaktionen der Carbonyl-Verbindungen Additionen an die C=O Bindungen Addition von Wasser: Hydratisierung Addition von Alkoholen Acetale und Halbacetale saure + basische Katalyse Addition von Thiolen Schutzgruppen Umpolung Addition von Aminen Addition von Grignard-Verbindungen Reaktionen am α-C Aldol-Reaktion Reduktion von Carbonylverbindungen Reduktionen mit Natriumborhydrid Oxidationen von Carbonylverbindungen besondere Reaktionen Wittig-Reaktion Additionen an die C=O Doppelbindung Carbonyl können aufgrund ihres starken Dipolmomentes sowohl nukleophil als auch elektrophil angegriffen werden: X O O C C+ Y X δ- O ≡ Y X δ+ C Y Eine Additions von Methanol an Aceton sieht formal so aus: O H3 C C δ- H δ+ + CH 3 O δ+ (= E) O δ- (= Nu) CH3 H 3C C H O CH3 CH3 Die Reaktion ist aber sehr langsam. Sie läßt sich katalysieren, indem man die Nukleophile oder die Elektrophilie einer Reaktionspartner erhöht. Die Elektrophile der Carbonyl-Komponente kann durch Protonierung (→ katalystische Säuren) stark erhöht werden: H O δ+ (= E) H C + H3 C CH3 + δ- (= Nu) CH3 O H H C O CH3 + CH3 O H3C O + -H H H 3C C O CH3 CH3 Die Nukleophilie der nicht-Carbonyl-Komponente kann durch Deprotonierung (→ katalytische Base) stark erhöht werden: O H3C C δδ+ CH3 O + O CH3 H3C C - O + H+ O CH3 CH3 → Allgemeine Säure/Base Katalyse von Carbonylreaktionen Achtung: Es gibt einige Sonderfälle, siehe Acetale H3C H C O CH3 CH3 Tafelbilder Addition von Wasser: Hydratisierung Addition von Alkoholen Acetale und Halbacetale saure + basische Katalyse Addition von Thiolen Schutzgruppen Umpolung Addition von Aminen Addition von Grignard-Verbindungen Reaktionen am α-C Aldol-Reaktion saure Katalyse basische Katalyse Reduktion von Carbonylverbindungen Reduktionen mit Natriumborhydrid Wittig-Reaktion 13.3. Carbonsäuren und ihre Derivate 13.3.1. Carbonsäure Eigenschaften H-Brücken, Dimere Schmelz-/Siedepunkte Acidität Salze Nomenklatur Vorkommen und Darstellungen Ameisensäure, Essigsäure Carbonsäure-Derivate Säurechloride, Anhydride Ester Fruchtaroma Fette und Wachse Amide Darstellung H-Brücken ε-Caprolactam Resonanzstruktur der Carbonsäure-Gruppe: O- O R C OH O- C R + OH R C OH + Der -I-Effekt des zweiten Sauerstoffs wird durch den +M-Effekt überkompensiert → Geringer Ladung am Kohlenstoff, geringer Carbonylreaktivität Azide Protonen, stärker sauer als Alkohole polare Verbindungen, wasserlöslich bei kleiner Molmasse Carbonsäuren bilden leicht Wasserstoffbrücken aus. Darauf beruhen viele katalytische Wirkungen der Enzyme. Alleine dimerisieren sie leicht: 2 R-COOH R C O H O O O H C R → hohe Siedepunkte, hohe Schmelzpunkte Übersicht über die Carbonsäure-Derivate R-CO-X X -OH -O-O-R -S-R -N... -Cl -O-CO-R #### weitere Folien Name Carbonsäure Carboxylat-Anion, Carbonsäure-Salze Carbonsäure-Ester Sonderfall: Lactone, (im Ring) ... Thioester ... Amide Sonderfall: Lactame (im Ring) ... Chloride ... Anhydride


![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)