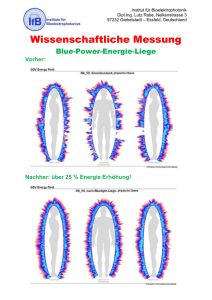
Hirnparenchym-Sonographie bei bipolarer Störung
Werbung

Ruhr-Universität Bochum PD Dr. Hans-Jörg Assion Dienstort: Gemeindepsychiatrisches Zentrum Detmold Abteilung für Psychiatrie, Psychotherapie und Psychosomatik Hirnparenchym-Sonographie bei bipolarer Störung Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Kija Maria Mikelsons geborene Hoffmann aus Essen 2010 Dekan: Referent: Korreferent: Prof. Dr. med. K. Überla PD Dr. med. H.-J. Assion Prof. Dr. med. K.-J. Bär Tag der Mündlichen Prüfung: 19.04.2012 Abstract Mikelsons, geborene Hoffmann Kija Maria Hirnparenchymsonographie bei bipolarer Störung Problem: Die transkranielle Hirnparenchym-Sonographie (TCS) wird zur Diagnostik extrapyramidal bedingter Bewegungsstörungen eingesetzt, insbesondere zur Differenzierung von Parkinson-Syndromen. Zudem konnte in einigen Untersuchungen eine verminderte Echogenität der Hirnstamm-Raphe bei Patienten mit einer Major Depression und bei depressiven Patienten mit einer Parkinson Erkrankung nachgewiesen werden. In bisher nur einer Studie wurde die Raphe-Echogenität bei Patienten mit bipolarer Störung untersucht, mit dem Ergebnis, dass überwiegend normale und leicht erhöhte Raphe-Echogenitäten evaluiert wurden. Die unterschiedlichen Erkrankungsepisoden (depressiv, manisch, remittiert) der bipolaren Patienten wurden dabei jedoch nicht berücksichtigt. Daraus resultiert die Frage, ob sich die HirnstammRaphe in Abhängigkeit von der Erkrankungsphase der bipolaren Störung unterschiedlich darstellen lässt. Methode: Um die Echogenität der Hirnstamm-Raphe mittels TCS bei insgesamt 36 Patienten mit BipolarI-Störung in unterschiedlichen Erkrankungsphasen zu untersuchen, wurden depressive sowie manische Episoden anhand von standardisierten psychometrischen Testverfahren (HAM-D, YMRS, MINI-SKID) und Selbstbeurteilungsbögen (BDI, MSS) erfasst. Das Gesamtkollektiv wurde in drei Gruppen eingeteilt: Patienten in remittiertem Zustand (n=14), Patienten mit bipolarer Depression (n=14) und Patienten mit manischer Episode (n=8). Zum Vergleich wurde eine gesunde Kontrollgruppe (n=15) untersucht. Die sonographische Beurteilung des Hirnparenchyms wurde mithilfe eines etablierten Untersuchungsprotokolls in standardisierten Untersuchungsebenen durchgeführt. Die Raphe-Region wurde dabei durch eine 3-stufige Raphe-Skalierung bewertet. In der statistischen Analyse wurden die Ergebnisse der RapheUntersuchungen des Gesamtkollektivs mit denen der Kontrollgruppe verglichen und ebenso die einzelnen Subgruppen untereinander. Ergebnis: Insgesamt zeigten sich keine statistisch signifikanten Unterschiede in der Häufigkeit des Nachweises einer pathologischen Raphe-Echogenität zwischen der Vergleichsgruppe der bipolaren Patienten und der Kontrollgruppe und auch nicht zwischen den einzelnen Untersuchungsgruppen. Jedoch ergaben sich signifikante Korrelationen zwischen der angewandten Raphe-Skalierung und den HAM-D- und MADRS-Scores in der Gruppe der bipolar-depressiven Patienten. Es ging somit eine pathologische Raphe-Echogenität signifikant häufig mit einem hohen Grad an Depressivität einher. Je depressiver die Probanden in dieser Gruppe waren, desto pathologischer stellte sich ihre Raphe-Region dar. Diskussion: Dem Ergebnis zufolge könnte man annehmen, dass Menschen mit einer bipolaren Störung in Kombination mit einer pathologischen Raphe-Echogenität in der TCS (und einer damit möglicherweise schwach strukturierten Raphe-Region) zu einer stärker ausgeprägten depressiven Symptomatik neigen als bipolar-depressiv Erkrankte ohne diese pathologische Raphe-Darstellung. An dieser Stelle besteht weiterhin Forschungsbedarf, auch in Bezug auf die noch ausstehende Interpretation der RapheHypoechogenität in der TCS, welche sowohl unter pathophysiologischen als auch morphologischen Gesichtspunkten zu klären wäre. In Zukunft könnten sich daraus gegebenenfalls auch klinischpharmakologische Konsequenzen im Hinblick auf den klinischen Alltag ergeben. Meinen Patienten Inhaltsverzeichnis I. Einleitung ................................................................................... 6 1.1 Bipolar affektive Störung........................................................................... 6 1.1.1 Historischer Hintergrund .................................................................... 6 1.1.2 Symptomatik ...................................................................................... 8 1.1.3 Diagnose und Einteilung .................................................................. 10 1.1.4 Bildgebung ....................................................................................... 12 1.1.5 Häufigkeit ......................................................................................... 13 1.1.6 Ätiologie ........................................................................................... 14 1.1.7 Therapie ........................................................................................... 17 1.2 Raphekerne im Hirnstamm ..................................................................... 18 1.3 Transkranielle Hirnparenchym-Sonographie (TCS) ................................ 19 II. Zielsetzung .............................................................................. 23 III. Patienten und Methodik ........................................................... 24 3.1 Studiendesign ......................................................................................... 24 3.1.1 Probanden ....................................................................................... 24 3.1.2 Aufklärung und Einwilligung der Probanden .................................... 25 3.1.3 Ethik ................................................................................................. 25 3.2 Untersuchungsablauf .............................................................................. 26 3.2.1 Allgemeine personenbezogene Datenerhebung .............................. 26 3.2.2 Psychometrische Testverfahren ....................................................... 27 3.2.3 Transkranielle Hirnparenchym-Sonographie (TCS) ......................... 31 3.3 Statistische Analysen.............................................................................. 34 IV. Ergebnisse ............................................................................... 36 4.1 Demographische Charakteristiken der Probanden ................................. 36 4.2 Klinische Charakteristiken der Probanden .............................................. 38 1 4.3 Häufigkeit normaler und pathologischer Raphe-Darstellungen............... 38 4.4 Zusammenhang zwischen Raphe-Skalierung und klinischen Variablen . 40 4.5 Übereinstimmung von Selbst- und Fremdbeurteilungsskalen................. 41 V. Diskussion ............................................................................ 44 VI. Zusammenfassung ............................................................... 52 VII. Literaturverzeichnis ............................................................... 54 VIII. Anhang ................................................................................. 64 8.1 Patientenaufklärungsbogen ............................................................... 64 8.2 Anamnesebogen Bipolare Störung .................................................... 67 8.3 Beck Depression Inventar (BDI) ........................................................ 69 8.4 Manie-Selbstbeurteilungsskala (MSS) ............................................... 71 8.5 Hamilton Depression Rating Scale (HAM-D) ..................................... 74 8.6 Montgomery Asberg Depression Rating Scale (MADRS) .................. 78 8.7 Young Mania Rating Scale (YMRS) ................................................... 80 8.8 Global Assessment of Functioning Scale (GAF) ................................ 82 8.9 Clinical Global Impression Scale (CGI) .............................................. 83 Danksagung Lebenslauf 2 Verzeichnis der Abkürzungen BR Brainstem raphe CGI Clinical Global Impression Scale DSM Diagnostic and Statistical Manual of Mental Disorders ECA Epidemiological Catchment Area Study GAF Global Assessment of Functioning Scale HAM-D Hamilton Depression Rating Scale ICD-10 International Classification of Diseases, 10.Revision ICH International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use MRT Magnetresonanztomographie PET Positronen-Emissions-Tomographie SD Standardabweichung SN Substantia nigra SPSS Statistical Package for Social Sciences WHO World Health Organisation YMRS Young Mania Rating Scale 3 Verzeichnis der Tabellen Tabelle 1: Demographische und klinische Charakteristiken der Untersuchungsgruppen ................................................................. 37 Tabelle 2: Rangkorrelation (Spearman) zwischen dichotomer RapheSkalierung und klinischen Variablen separat nach Krankheitsphasen .......................................................................... 41 Tabelle 3: Korrelation nach Pearson zwischen Hamilton Depression Rating Scale (HAM-D) bzw. Montgomery Asberg Depression Rating Scale (MADRS) und dem Beck Depression Inventar (BDI) ..................... 42 Tabelle 4: Korrelation nach Pearson zwischen Young Mania Rating Scale (YMRS) und der Manie-Selbstbeurteilungsskala (MSS) ................ 43 4 Verzeichnis der Abbildungen Abbildung 1: Schematische Darstellung des Gehirns mit den im Hirnstamm befindlichen Raphekernen und den davon ausgehenden serotoninergen Projektionen in das Großhirn und in das Rückenmark................................................................................ 18 Abbildung 2: Schematische Darstellung der transkraniellen Sonographie durch das temporale Knochenfenster mit Veranschaulichung der drei standardisierten axialen Schnittebenen. Im Vergleich jeweils die korrespondierenden kernspintomographischen Bilder (Becker et al., 2001; Behnke et al., 2007) .................................................... 33 Abbildung 3: Sonographische Darstellung der axialen Mittelhirnschnittebene bei drei Patienten mit bipolarer Störung. Das Mittelhirn ist in der Darstellung zur besseren Visualisierung schmetterlingsförmg umrandet. Die schwarze Sternstruktur markiert jeweils den Aquädukt. Die Pfeilspitzen verweisen auf die untersuchte Hirnstammrapheregion. .............................................................. 34 Abbildung 4: Häufigkeit pathologischer und normaler Raphe-Darstellungen nach Gruppen in Prozent ............................................................ 39 5 I. Einleitung 1.1 Bipolar affektive Störung 1.1.1 Historischer Hintergrund „…Himmelhoch jauchzend, Zu Tode betrübt…“ (Goethe 1788) Wohl kaum ein anderes literarisches Zitat dient noch heute der Beschreibung der bipolaren Erkrankung so eindrücklich wie das Lied Clärchens aus dem Trauerspiel „Egmont“ von Johann Wolfgang von Goethe. Doch schon in der Antike kreierten die Philosophen Sokrates (470-399 v. Chr.), Platon (427-347 v. Chr.) und Aristoteles (384-322 v. Chr.) sowie die Ärzte Hippokrates (460-370 v. Chr.) und Aretaeus (81-138) Begriffe und Darlegungen seelischer Zustände und bemühten sich um das Verständnis von Gefühlsstörungen. Bevor jedoch das Bild einer seelischen Erkrankung im bipolaren Sinne, also extremen Gefühlsschwankungen zwischen zwei entgegen gesetzten Polen beschrieben wurde, entstanden Begriffe wie „Manie“ und „Melancholie“. Ein wichtiges Fundament zum Verständnis der damaligen Auffassung zur Entstehung seelischer Krankheiten ist die „Vier-Säfte-Lehre“ nach Hippokrates (460-370 v. Chr.). Diese Jahrhunderte vorherrschende Theorie nahm für die Entstehung seelischer sowie körperlicher Erkrankung ein bestehendes Ungleichgewicht der vier Körpersäfte „Blut“ (sanguis), „gelbe Galle“ (cholé), „schwarze Galle“ (melas cholé) und „Schleim“ (phlegma) im erkrankten Menschen an. Und noch heute werden Begriffe wie Sanguiniker, Choleriker, Melancholiker und Phlegmatiker zumindest für die umgangssprachliche Bezeichnung von Temperamenten verwendet (Brieger 2004). Die „Melancholie“ (griechisch: μελαγχολια von μελας, melas = „schwarz“ + χολη, cholé = „Galle“) war demzufolge auf einen Überschuss an „schwarzer Galle“ zurückzuführen, welche von einer organisch erkrankten Milz ausginge, über das Blut in das Gehirn eindringe und somit Schwermut verursa6 che. Ebenso wurde der Begriff „Mania“ (Manie) bereits von Hippokrates genannt (griechisch: μανία manía = Raserei), um einen von Unruhe, Aufregung und Toben begleiteten ekstatischen Gefühlszustand zu beschreiben. Bei Sokrates (470-399 v. Chr.) war das Wort „Manie“ ein allgemeiner Begriff für Geisteskrankheit. Die Bezeichnung „Melancholie“ wurde auch von Platon (427-347 v. Chr.) verwendet und von Aristoteles als Krankheitsbegriff festgelegt. Erste Beschreibungen einer bipolaren Erkrankung, im Sinne eines angenommenen Zusammenhanges zwischen einer Melancholie und einer Manie, sind neben Galenus (129-199) auf den Arzt Aretaeus von Kappadokien (81-138) zurückzuführen. Auch wenn sein Verständnis psychischer Erkrankung weiterhin auf der „Vier-Säfte-Lehre“ von Hippokrates beruhte, begriff er die Manie nicht mehr als ein für sich bestehendes Krankheitsbild, sondern als eine Steigerung der Melancholie. Dies wird in folgendem Zitat des Aretaeus anschaulich erklärt: „Meiner Ansicht nach ist die Melancholie ohne Zweifel Anfang oder sogar Teil der Krankheit, die Manie genannt wird. Die Entwicklung einer Manie ist vielmehr eine Zunahme der Krankheit als ein Wechsel in eine andere Krankheit.“ (Marneros, 1999). Auf die Beschreibungen Aretaeus gründet das heute gültige Erklärungsmodell der bipolaren Störung. An sein Krankheitskonzept konnte jedoch erst im 19. Jahrhundert angeknüpft werden, da im Mittelalter der Einfluss der katholischen Kirche rationale Forschungsbemühungen verhinderte. Psychisch erkrankte Menschen wurden zu dieser Zeit als „Besessene“ verfolgt, wobei die Ursache der Erkrankungen Dämonen und Hexen zugeschrieben wurde. Zu Beginn des 19. Jahrhunderts befürwortete der französische Psychiater Philippe Pinel (1745-1826) einen humaneren Umgang mit psychisch erkrankten Menschen und bemühte sich um ein wissenschaftlich orientiertes Verständnis. Dessen Schüler Jean E.D. Esquirol (1772-1840) unterschied bereits eine „période maniaque“ von einer „période mélancholique“ im Sinne einer bipolaren Störung (Esquirol, 1838). Von den Werken Pinels und Esquirols inspiriert beobachtete der Psychiater Jean-Pierre Falret (1794-1870) Betroffene über einen längeren Zeitraum, bis er wiederkehrende wechselnd affektive Krankheitsbilder als eine eigenständige Erkrankung verstand und unter der Bezeichnung „folie circulaire“, das „zirkuläre Irresein“ (Falret, 1851), veröffentlichte. Er beschrieb ebenfalls symptomfreie, stimmungsneutrale Phasen und kam damit dem heuti7 gen Verständnis bipolarer Erkrankungen bereits sehr nah. Jules Baillarger (1809-1890) veröffentlichte in etwa zur selben Zeit seine Beobachtungen und Fallberichte bezüglich wechselnder affektiver Zustände unter der Bezeichnung „De la folie à double forme“ (Baillarger, 1854), wobei er aber symptomfreien Intervallen keine Bedeutung beimaß. Auch in Deutschland beschäftigte man sich zu Beginn des 19. Jahrhunderts mit dem Zusammenhang von Manie und Depression. Karl Ludwig Kahlbaum (18281899) führte den von seinem Schüler Ewald Hecker (1843-1909) kreierten Begriff der „Cyklothymie“ für leichte affektive Schwankungen ein (Kahlbaum, 1882). Der deutsche Psychiater Emil Kraepelin (1856-1926) hingegen erkannte später in dem Wechsel zwischen Manie und Depression ein eigenes Krankheitsbild und nannte es „manisch-depressives Irresein“ (Kraepelin, 1913). Die „Cyklothymie“ stellte für Kraepelin nur eine leichtere Verlaufsform des „manischdepressiven Irreseins“ dar. Im Gegensatz dazu vertraten Carl Wernicke (18481905) und dessen Schüler Karl Kleist (1879-1960) die Auffassung, dass auch die Melancholie sowie die Depression an sich als eigenständige Krankheitsbilder anzusehen seien (Wernicke, 1906; Kleist, 1928). Dieses Krankheitskonzept griff Karl Leonhard (1904-1988) auf und entwickelte daraus die Annahme, dass sich „reine“ monopolar phasische Krankheitsbilder, also eine reine Melancholie und eine reine Manie, von „vielgestaltigen“ phasischen Formen wie der manisch-depressiven Krankheit unterscheide (Leonhard, 1957). Durch spätere erbbiologische Untersuchungen und Verlaufsbeobachtungen konnten die Annahmen Leonhards bestätigt werden und es erfolgte eine klare Trennung der monopolaren Depressionen von den bipolaren (manischdepressiven) Erkrankungen (Neele, 1949; Angst, 1966; Perris, 1966). 1.1.2 Symptomatik Die bipolar affektive oder manisch-depressive Störung ist durch einen wiederholten, deutlich gestörten Wechsel der Stimmung und Aktivität der von dieser Krankheit betroffenen Personen charakterisiert. Neben Phasen mit auffällig gehobener Stimmung sowie Antriebs- und Aktivitätssteigerung (Manie oder Hypomanie), kommt es zu meist darauf folgenden Phasen der Stimmungssenkung 8 bis hin zu starker depressiver Verstimmung mit Antriebs- und Aktivitätsminderung (Depression). Diese so genannten manischen und depressiven Episoden können zeitweise auch eine jeweils mildere Ausprägung zeigen und werden dann dementsprechend als subdepressiv oder hypomanisch bezeichnet. In den Phasen zwischen den Episoden kommt es zu einer vollständigen Beschwerdefreiheit, die Remission genannt wird. Es können auch Phasen auftreten, die beide Stimmungszustände in Form einer gemischten Episode vereinen. Depressive Episoden sind in der gängigen Literatur nach ICD-10 (F31) und DSM-IV-TR (Saß et al., 2003) als mindestens zwei Wochen anhaltende Phasen beschrieben, in denen die betroffenen Personen neben einer niedergedrückten Stimmung oder einem nahezu vollständigen Interessenverlust fünf oder mehr der folgenden psychischen und/oder körperlichen Symptome erleben: Durchgehend depressive Verstimmung Nahezu vollständiger Interessenverlust Gewichtsverlust oder Gewichtszunahme Schlaflosigkeit oder vermehrtes Schlafen Psychomotorische Unruhe oder Verlangsamung Müdigkeit oder Energieverlust Gefühle von Wertlosigkeit und Gefühllosigkeit Unverhältnismäßige Schuldgefühle Konzentrationsstörungen Entscheidungsschwierigkeiten Gedanken an den Tod und Suizidgedanken In manischen Episoden hingegen sind die Betroffenen den Kriterien des ICD-10 (F31) und denen des DSM-IV-TR (Saß et al., 2003) zufolge von vollkommen entgegengesetzten Symptomen mit gehobener, expansiver und/oder gereizter 9 Stimmung betroffen. Dabei sind definitionsgemäß drei oder mehr der folgenden Gefühls-, Gedächtnis- und Verhaltensauffälligkeiten zu erkennen: Übersteigertes Selbstwertgefühl und/oder Größenphantasien Vermindertes Schlafbedürfnis (zum Beispiel nur drei Stunden Schlaf) vermehrter Antrieb Rededrang und erhöhte Redegeschwindigkeit Ideenflucht (Gedankenrasen) Erhöhte Ablenkbarkeit Psychomotorische Unruhe Aktivitäten mit möglichen nachteiligen Konsequenzen (zum Beispiel hohe Geldinvestitionen, Verlust sozialer Hemmungen, riskantes Autofahren) In schweren Fällen Wahnvorstellungen (zum Beispiel Größenphantasien und religiöse sowie sexuelle Verfolgungsthemen) In der Regel treten depressive Episoden häufiger auf als manische Episoden. Die Kriterien für eine gemischte Episode (Mischzustand) divergieren. Nach den ICD-10-Kriterien handelt es sich um eine gemischte Episode, wenn es zu einem raschen, innerhalb weniger Stunden stattfindenden, Wechsel (hypo)manischer und depressiver Symptome im Zeitverlauf von zwei Wochen kommt. Nach DSM-IV-TR-Kriterien (Saß et al., 2003) hingegen werden Symptome einer manischen und einer depressiven Episode gleichermaßen, fast jeden Tag im raschen Wechsel, innerhalb einer Woche gefordert. 1.1.3 Diagnose und Einteilung Im klinischen Alltag erfolgt die Diagnosestellung der bipolaren Störung durch die Erhebung des psychopathologischen Befundes und durch den Krankheitsverlauf. Um den individuellen Verlauf der Erkrankung objektivieren zu können, werden die Patienten in regelmäßigen zeitlichen Abständen, anhand von stan10 dardisierten psychometrischen Testverfahren, befragt. Auch Angehörige können in das diagnostische Procedere miteinbezogen werden. Mögliche körperlich-organische Ursachen der Symptome werden zuvor mithilfe von Laboruntersuchungen und bildgebenden Verfahren (wie zum Beispiel CT oder MRT) ausgeschlossen. Im klinischen Alltag wird zwischen einer Bipolar I Störung und einer Bipolar II Störung unterschieden. Diese Einteilung begründet sich durch die unterschiedlichen Verlaufsformen der bipolaren Störung (Dunner et al., 1976), die im Folgenden dargelegt werden. Bei der Bipolar I Störung sind im Krankheitsverlauf mindestens eine depressive und eine manische oder gemischte Episode vorgekommen. Voraussetzung für die Diagnosestellung der Bipolar I Störung sind zudem der Ausschluss anderer Krankheitsursachen sowie das Vorhandensein starker Beeinträchtigungen im sozialen oder beruflichen Umfeld. Der Begriff der Bipolar I Störung wird nur im DSM-IV verwendet, im ICD-10 gilt hingegen die Bezeichnung der bipolar affektiven Störung. Bei der Bipolar II Störung stehen die depressive Episoden im Vordergrund, welche von mindestens einer schwächer ausgeprägten hypomanischen Phase begleitet werden. Auch die Bipolar II Störung ist ausschließlich im DSM-IV aufgeführt. Der ICD-10 klassifiziert lediglich die hypomanische Episode. Bei der Bipolar I und der Bipolar II Störung kann es darüber hinaus im Krankheitsverlauf zu einem so genannten „Rapid Cycling“ kommen. Das „Rapid Cycling“ beschreibt einen raschen Phasenwechsel der bipolaren Erkrankung von mindestens vier abgrenzbaren Episoden innerhalb eines Jahres. Abschließend ist auch die Zyklothymia zu nennen. Diese ist durch eine über mindestens zwei Jahre anhaltende Instabilität der Stimmung gekennzeichnet. Die dabei vorkommenden (sub)depressiven und hypomanischen Episoden entsprechen jedoch nicht dem Schweregrad und/oder der Dauer der Episoden bei bipolar affektiver Störung. Oftmals gehen auch andere psychische Erkrankungen mit einer Zyklothymia einher (Hantouche et al., 2003). 11 1.1.4 Bildgebung Der diagnostische Einsatz von bildgebenden Verfahren bei bipolarer Erkrankung und auch anderen psychiatrischen Erkrankungen beschränkt sich in Deutschland derzeit primär auf die Ausschlussmöglichkeit von anderen organischen Erkrankungen des Gehirns, wie zum Beispiel Tumoren, Infarkten, Blutungen, Zysten und Hirnatrophieprozessen. Zudem dienen bildgebende Verfahren bei neurologischer Symptomatik der Ursachenklärung und werden zunehmend in der Forschung eingesetzt, um mögliche morphologische Korrelate im Zusammenhang mit psychiatrischen Erkrankungen zu untersuchen. Zur Anwendung kommen dabei die der strukturellen Bildgebung dienende Computertomografie (CT), sowie die Magnetresonanztomografie (MRT). Zu Forschungszwecken werden insbesondere auch funktionelle Bildgebungsmethoden, wie die Single Photonen Emissions-CT (SPECT), das funktionelle MRT (fMRT) und die Positronenemissionstomographie (PET), eingesetzt. Der derzeit erforschte Einsatz der transkraniellen Hirnparenchymsonographie (TCS) bei unipolarer Depression und bipolarer Erkrankung wird im Kapitel 1.3 „Transkranielle Hirnparenchym-Sonographie (TCS)“ gesondert thematisiert. Die aktuelle Studienlage bezüglich neuroradiologischer Befunde bei bipolarer Störung lässt zum Teil widersprüchliche Ergebnisse erkennen. In einer MetaAnalyse (Hoge et al., 1999) konnte jedoch festgestellt werden, dass das Gesamthirnvolumen bei bipolar Erkrankten keinen Unterschied zu gesunden Kontrollpersonen aufweist. Lediglich bei Patienten mit multiplen Episoden wird eine geringe Gehirnvolumenminderung, sowie eine Vergrößerung der lateralen Ventrikelräume vermutet (Strakowski et al., 2002). Auch die Untersuchung der Volumina der präfrontalen Kortexareale hat in einer MRI-Studie keine signifikanten Unterschiede zwischen Gesunden und bipolar Erkrankten ergeben (Brambilla et al., 2002). Jedoch weist eine Studie bezogen auf die dorsolateralen frontalen Hirnrindenareale, insbesondere die dort lokalisierte graue Substanz, eine Volumenverminderung der genannten Strukturen bei bipolar Erkrankten nach (Lopez-Larson et al., 2002). Weitere Studien haben eine beidseitige bzw. linksseitige Amygdala-Vergrößerung bei bipolar Erkrankten beschrieben (Strakowski et al., 1999, Brambilla et al., 2003). Möglicherweise ist die Pathophysiologie der 12 bipolaren Störung auch auf eine pathologische Interaktion zwischen Amygdala und präfrontalen Kortexarealen zurückzuführen (Haldane and Frangou, 2004). Durch die funktionelle Bildgebung, vor allem SPECT und fMRT, konnte in Bezug auf Depressionen eine Beteiligung der frontalen und limbischen Strukturen erkannt werden (Geller et al., 1996). Wie bei den Studien zur strukturellen Bildgebung bei bipolarer Störung schon beschrieben, kommen Studien mit dem Einsatz funktioneller Bildgebungsmethoden ebenfalls zu dem Ergebnis, dass bei bipolar erkrankten Menschen insbesondere der dorsolaterale präfrontale Kortex, hier in Form einer Aktivitätsminderung, wesentlich am Krankheitsgeschehen beteiligt ist (Soares, 2003; Yurgelun-Todd et al., 2000). In der Amygdala hingegen wurde eine Aktivitätszunahme in Zusammenhang mit einer Aktivitätsabnahme im dorsolateralen präfrontalen Kortex bei entsprechenden Stimuli beobachtet (Yurgelun-Todd et al., 2000). Eine fMRT-Studie unter Anwendung des Stroop-Tests bei bipolar manischen, depressiven und remittierten Patienten konnte zeigen, dass im Vergleich zu den remittierten Patienten eine Aktivitätserhöhung im linken Präfrontalkortex (Signalanhebung) bei depressiven Patienten und eine Aktivitätsminderung (Signalminderung) im rechten Präfrontalkortex bei manischen Patienten zu erkennen war (Blumberg et al., 2003). In PET-Studien wird mithilfe von radioaktiven Markern, sogenannten „Tracern“, der zerebrale Blutfluss in verschiedenen Regionen des Gehirns untersucht und somit versucht zu ermitteln, welche Hirnregionen an der Regulation von Stimmungszuständen beteiligt sein könnten. Es wird vermutet, dass vor allem limbische sowie paralimbische Hirnstrukturen und der präfrontale Kortex möglicherweise von Bedeutung sind (Schneider et al., 1995; Gemar et al., 1996; Drevets, 1999). In einer der wenigen PET-Studien bei bipolarer Erkrankung war eine verminderte Aktivierung der rechten orbitofrontalen Hirnrindenareale bei Worterkennungs- und Buchstabierübungen manischer Patienten zu erkennen (Blumberg et al., 1999). 1.1.5 Häufigkeit Im Durchschnitt liegt das Alter bei Erstmanifestation der bipolar affektiven Störung zwischen dem 17. und 27. Lebensjahr (Kessler et al., 1994; Weissman et 13 al., 1996). Das konstante Auftreten der Erkrankung in bestimmten geographisch-kulturellen Regionen deutet auf einen Einfluss genetischer Faktoren in der Entstehung der bipolaren Störung hin. Dementsprechend konnte in Familienstudien gezeigt werden, dass ein höheres Erkrankungsrisiko für Angehörige bipolar Erkrankter besteht (Craddock and Jones, 1999), auch wenn bisher keine mit der Erkrankung assoziierte Genlokation ausfindig gemacht werden konnte (Craddock and Sklar, 2009). Umweltfaktoren hingegen, wie zum Beispiel Schulbildung, Berufstätigkeit, Sozialkontakte und traumatische Erlebnisse, scheinen nicht den Ausbruch der Erkrankung an sich zu bedingen, sondern vielmehr einen Einfluss auf den Verlauf der Erkrankung und die Episodenzahl zu nehmen (Robins and Regier, 1991; Lish et al., 1994). So zeigte sich in einer Untersuchung zu diesem Thema, dass Patienten mit einer bipolaren Störung und einer komorbiden Posttraumatischen Belastungsstörung häufig von einer schwerer ausgeprägten Symptomatik betroffen sind (Assion et al., 2009). Es existieren zahlreiche epidemiologische Erhebungen zur Häufigkeit der bipolaren Erkrankung. Zu nennen ist eine umfangreiche Studie des „National Institute of Mental Health“, in welcher zu Beginn der 1980er Jahre mehr als 20.000 Personen untersucht wurden. Die Lebenszeitprävalenz beträgt demnach 0,9% für das Auftreten der bipolaren Erkrankung (Robins and Regier, 1991). In einer folgenden Studie, in der zwischen den Jahren 1990 bis 1992 Daten von ca. 8100 Personen erhoben wurden, konnte eine Lebenszeitprävalenz von 1,6% für manische Episoden ermittelt werden, wobei diesbezüglich kein Unterschied zwischen Frauen und Männern zu erkennen war (Kessler et al., 1994). Den Studien zufolge sind Männer und Frauen gleichermaßen von der bipolaren Störung betroffen. 1.1.6 Ätiologie Dem Auftreten einer bipolaren Störung liegt aus heutiger Sicht ein multifaktorielles Geschehen zugrunde. Das Wissen über die Ursachen dieser Erkrankung ist begrenzt und noch nicht ausreichend erforscht. Eine entscheidende Rolle in der Entstehung der bipolaren Störung kommt nach heutigem Wissensstand, neben dem Einfluss von Umweltfaktoren, der Genetik zu. Die klinische Genetik untersucht den Einfluss genetischer Faktoren anhand von Familien-, Zwillings-, 14 Adoptionsstudien und Untersuchungen zum Erbgang. Die molekulare Genetik untersucht hingegen anhand von Assoziations- und Kopplungsstudien. Zudem wird in der Neurobiologie nach pathophysiologischen Ursachen für die Entstehung der bipolaren Störung gesucht. In einigen Familienuntersuchungen ergab sich für Angehörige ersten Grades eines bipolaren Patienten ein siebenfach höheres Erkrankungsrisiko, ebenfalls an einer bipolaren Störung zu erkranken (Craddock et al., 1995). Auch für klinisch ähnlich verlaufende Erkrankungen wie der Zyklothymie, der Hypomanie und der schizoaffektiven Störung ist das Lebenszeitrisiko nachweislich erhöht (Maier et al., 1998). Hierbei ist jedoch zu bedenken, dass auch der Einfluss von sozialen Faktoren und Traumatisierungen innerhalb einer Familie für alle Angehörigen ähnlich stark ausgeprägt sein kann und die Ergebnisse somit nicht unbedingt nur durch die Vererbung ausgelöst werden können. Die Ergebnisse der erwähnten Studien werden auch durch Zwillings- und Adoptionsstudien unterstützt. Demzufolge erkranken eineiige Zwillinge viermal häufiger als zweieiige Zwillinge an einer bipolaren Störung, wobei bei eineiigen Zwillingen die Konkordanzrate bei 62% lag (Bertelsen et al., 1977). Das bedeutet, dass ein eineiiger Zwilling eines bipolar Erkrankten ein etwa 60-fach erhöhtes Erkrankungsrisiko für das Auftreten einer bipolaren Störung im Vergleich zur Allgemeinbevölkerung aufweist. In weiteren Zwillingsstudien wurden Konkordanzraten von 38,5% (Kendler et al., 1995) und 44% (Cardno et al., 1999) bei eineiigen Zwillingen ermittelt. Dies spricht definitiv für eine bedeutende Rolle der Genetik im Entstehungsprozess der bipolaren Störung, lässt jedoch auch auf einen zusätzlichen Einfluss von Umweltfaktoren schließen, da eineiige Zwillinge zwar ein fast 100%ig gleiches Genom besitzen, die Heritabilität der Erkrankung bei ihnen jedoch geringer ist. Auch in Adoptionsstudien wurde ein höheres Erkrankungsrisiko für die biologischen Angehörigen von adoptierten erkrankten Kindern ermittelt (31%) als für die Adoptivangehörigen (12%) und unterstreicht somit die Bedeutung genetischer Einflussfaktoren (Mendlewicz and Rainer, 1977, Wender et al., 1986). In den Untersuchungen zum Erbgang konnte kein bestimmtes Vererbungsmuster, welches den Mendelschen Gesetzen folgt, ausfindig gemacht werden. Dies 15 spricht somit für ein komplexeres Vererbungsmuster unter Beteiligung multipler Gene, welche als „Vulnerabilitäts- und Risikogene“ bezeichnet wurden (Potash and DePaulo, 2000). Auch in molekulargenetischen Kopplungsuntersuchungen, die bestimmte Varianten genetischer Merkmale bei gesunden und kranken Familienangehörigen vergleichen, konnte ein Zusammenwirken mehrerer Gene erkannt werden. In Assoziationsuntersuchungen, die die Häufigkeit des Auftretens definierter Varianten eines „Kandidatengens“ zwischen Patienten- und Kontrollgruppen vergleichen, wurden mehrfach positive Assoziationen gefunden, unter anderem für Polymorphismen in den Genen des Serotonin-, Tyrosin-, Monoaminoxidaseund Dopamin-Stoffwechsels. Zudem wurden in zuvor definierten Kopplungsregionen „positioneller Kandidatengene“ Assoziationen mit Genen auf den Chromosomen 18 und 22 ausfindig gemacht (Barrett et al., 2003, Washizuka et al., 2003, Sjøholt et al., 2004). Auch die Bedeutung genetischer Variationen, zum Beispiel der Promoter Region (5-HTTLPR) des Serotonin-Transporters (5-HTT), wird derzeit in Bezug auf die Entwicklung depressiver Episoden erforscht, um gegebenenfalls medikamentös gezielter therapieren zu können. Somit könnten in Zukunft bestimmte pharmakogenetische Testungen langjährig depressiv erkrankter Patienten möglicherweise zu einer Optimierung des medikamentösen Therapieerfolgs eingesetzt werden (Luddington et al., 2009). Ebenso wie die Genetik, kann auch die Neurobiologie derzeit noch keine hinreichenden Erklärungen für die Entstehung der bipolaren Störung geben. Durch pharmakologische Wirkmechanismen geht man jedoch von einer veränderten neuronalen Signaltransduktion aus. Es konnte dementsprechend in einer Studie gezeigt werden, dass bei unipolar depressiven Patienten sowie bei bipolar depressiven Patienten die Verfügbarkeit der Neurotransmitter Serotonin und Noradrenalin vermindert ist und die Dichte serotoninerger und noradrenerger Rezeptoren im Vergleich zu Gesunden variiert (Maes and Meltzer, 1995). Diese Ergebnisse können dennoch nicht das komplexe Krankheitsbild der bipolaren Störung ausreichend erklären. Nach heutigem Wissenstand wird lediglich angenommen, dass den Neurotransmittern Serotonin und Noradrenalin eine bedeutende Rolle in der Entwicklung depressiver Phasen zukommt, wo hingegen manische Phasen eher auf eine Fehlregulation des Neurotransmitters Dopamin 16 zurückgeführt werden, was wiederum durch die Wirkung der Neuroleptika bei manischer Symptomatik angenommen wird. Letztlich sind die genauen neurophysiologischen Ursachen der bipolaren Störung derzeit noch ungeklärt. 1.1.7 Therapie Für die medikamentöse Behandlung der bipolaren Erkrankung stehen im klinischen Alltag verschiedene Psychopharmaka zur Verfügung. In Gebrauch sind derzeit Antidepressiva, Neuroleptika und Benzodiazepine, sowie die Stimmungsstabilisatoren Lithium, Valproinsäure und Lamotrigin (Aktories et al., 2006). Im Folgenden wird der derzeitige Kenntnisstand bezüglich der Wirkweise der genannten Psychopharmaka erläutert. Antidepressiva werden eingesetzt, um eine pathologisch gesenkte Grundstimmung zu heben sowie Angstsymptome zu mildern. Die Wirkweise der Antidepressiva beruht auf einer Modulation der neuronalen (synaptischen) Erregungsübertragung durch Monoamine (Neurotransmitter), wie Serotonin und Noradrenalin, im Gehirn. Da ein Monoaminmangel bei depressiven Erkrankungen angenommen wird, gilt es die Konzentration der genannten Transmitter im synaptischen Spalt zu normalisieren, um einen antidepressiven Effekt zu erzielen (Maes and Meltzer, 1995). Dies kann zum einen durch eine Interaktion der Antidepressiva mit Rezeptoren erzielt werden, die die Ausschüttung von Noradrenalin und Serotonin regulieren (α2-Adrenozeptorantagonisten) oder durch eine Hemmung der (Wieder)-aufnahme der genannten Neurotransmitter in das entsprechende (präsynaptische) Neuron veranlasst werden (Monoamin- Rückaufnahme-Inhibitoren). Einen anderen Wirkmechanismus stellt die enzymatische Hemmung der Monoaminoxidase dar, welche den Abbau der erwähnten Botenstoffe reguliert (Monoaminoxidaseinhibitoren) (Assion and Vollmoeller, 2006; López-Muñoz and Alamo, 2009). Neuroleptika werden vor allem zur Behandlung produktiver psychotischer Symptome (zum Beispiel Schuld- oder Verarmungswahn) sowie psychomotorischer Erregungszustände und affektiver Spannungen eingesetzt. Für die Entstehung von psychotischen Symptomen wird eine Überaktivität dopaminerger Neuronensysteme angenommen. Neuroleptika beeinflussen somit im Wesentli17 chen das dopaminerge System, indem sie die Übertragung des Neurotransmitters Dopamin an verschiedenen Rezeptoren im Gehirn hemmen (Reinbold and Assion, 2006). Die Stimmungsstabilisatoren dienen speziell der Behandlung bipolarer Störungen und bewirken eine Dämpfung extremer Stimmungsschwankungen sowie eine Minderung der Affektlabilität während und zwischen den Episoden. Ebenso wird durch deren Einsatz versucht, die Episodenhäufigkeit zu beeinflussen und eine Langzeitprävention zu erzielen (Hatzinger, 2009). Eine wichtige Zielstruktur von Lithium scheinen dabei die G-Proteine zu sein (Manji et al., 1995, Manji et al, 2001). Des Weiteren wird angenommen, dass die für die intrazelluläre Signalübertragung verantwortlichen Botenstoffe, wie zum Beispiel cAMP und cGMP, ebenso in den Wirkmechanismus von Stimmungsstabilisieren involviert sind (Manji et al., 1995, 2001). 1.2 Raphekerne im Hirnstamm Abbildung 1: Schematische Darstellung des Gehirns mit den im Hirnstamm befindlichen Raphekernen und den davon ausgehenden serotoninergen Projektionen in das Großhirn und in das Rückenmark 18 Der Hirnstamm setzt sich zusammen aus dem Mittelhirn (Mesencephalon), der Brücke (Pons) und dem verlängerten Mark (Medulla oblongata). Durch den gesamten Hirnstamm zieht ein Netz (lat. rete) von Nervenzellen bis ins Rückenmark, welches Formatio reticularis (FR) genannt wird. Die FR bildet vor allem in der Mitte des Hirnstammes ineinander übergehende Kernsysteme, die die Fasertrakte und Hirnnervenkerne des Gehirns umgeben. Ein gut abgrenzbares Kerngebiet bilden hierbei die in der medianen Längszone der FR gelegenen Raphekerne (siehe Abbildung 1). Diese Raphekerne bestehen aus serotoninergen Zellgruppen, welche in das gesamte zentrale Nervensystem (ZNS) und besonders in das limbische System projizieren. Mit Hilfe ihres Neurotransmitters Serotonin können sie somit im Rückenmark die Weiterleitung sensibler Impulse, zum Beispiel die Übertragung von Schmerzimpulsen, hemmen und im limbischen System emotionale Vorgänge beeinflussen. Daher wird vermutet, dass die serotoninergen Neurone der Raphekerne auch an der Pathogenese depressiver Erkrankungen beteiligt sind (Trepel, 2004). 1.3 Transkranielle Hirnparenchym-Sonographie (TCS) Ein neues bildgebendes Verfahren des Gehirns stellt die transkranielle Sonographie (TCS) des Hirnparenchyms dar. Mithilfe dieser nicht invasiven, bildgebenden Methode lässt sich ein zweidimensionales Bild des Gehirns darstellen und zwar durch die unterschiedliche Reflexion der Ultraschallwellen an den verschiedenen Grenzflächen der dort befindlichen Hirngewebestrukturen (Behnke und Becker, 2002; Walter et al., 2004). Häufig untersuchte Hirnstrukturen sind zum Beispiel die im Mittelhirn lokalisierte Substantia nigra (SN) (Berg et al., 1999 a) und die Hirnstammraphe (brainstem raphe = BR). Durch die TCS ist es möglich, Veränderungen der Darstellbarkeit dieser Hirnstrukturen, in Form von Änderungen des Schallechos (Echogenitäten), zu erkennen. Dies erlaubt bisher nur hypothetische Rückschlüsse auf möglicherweise einhergehende morphologische oder pathophysiologische Änderungen dieser Strukturen bei bestimmten Erkrankungen. Aufgrund der geringen Belastung für die Patienten, der schnellen und beliebigen Wiederholbarkeit der Untersuchungen, sowie der Kostengünstigkeit hat dieses Verfahren ein hohes Potential (Walter et al., 2004) und 19 kann die gängigen konventionellen bildgebenden Verfahren des Gehirn ergänzen. In der Forschung werden die diagnostischen Möglichkeiten der TCS derzeit untersucht. Bisher wurde die TCS vornehmlich zur Verlaufsbeobachtung von Hirntumoren (Becker et al., 1995 a) und Hirnblutungen (Seidel et al., 1993) verwendet, sowie für Messungen von Ventrikelweiten (Seidel et al., 1995) und Mittellinienverlagerung des Gehirns genutzt (Gerriets et al., 1999). Aktueller Forschungsgegenstand ist vorwiegend die Diagnostik extrapyramidal bedingter Bewegungsstörungen, insbesondere die Differenzierung von ParkinsonSyndromen (Becker et al., 1995 b; Berg et al., 1999 b; Walter et al., 2003; Berg et al., 2008; Krogias et al., 2009; Vlaar et al., 2009). Mittlerweile wird übereinstimmend davon ausgegangen, dass die Parkinson Erkrankung oftmals mit einer veränderten Darstellbarkeit, hier einer Vergrößerung des Schallechos (Hyperechogenität), der Substantia nigra (SN) einhergeht. In Zukunft könnte ein derartiger Befund bei gesunden Patienten möglicherweise einen Risikofaktor für die Entwicklung einer Parkinson-Erkrankung darstellen, beziehungsweise eine Früh- und Differentialdiagnostik von Parkinson-Syndromen ermöglichen (Walter et al., 2004). Auch bei anderen Krankheiten mit Bewegungsstörungen wird der Einsatz der TCS erforscht, wie zum Beispiel bei Chorea Huntington (Postert et al., 1999). In einer Studie korrelierte eine Hyperechogenität der Substantia nigra bei Patienten mit Chorea Huntignton mit einem höheren Schweregrad der klinischen Symptomatik und einer größeren Anzahl an Wiederholungen derselben Basensequenz, der CAG-Triplets, in dem für die Erkrankung verantwortlichen Gen (Krogias et al., 2010). Die diagnostischen Möglichkeiten der TCS in Bezug auf die Major Depression und depressive Syndrome (Becker et al., 1995 c; 2001; Walter et al., 2007 a) werden ebenso fortlaufend erforscht. In einer Pilotstudie zu diesem Thema wurde die Hirnstammraphe (BR) bei 20 Patienten mit einer Major Depression und 20 gesunden Kontrollpersonen mittels TCS untersucht. Dabei war eine signifikante Abnahme der Echogenität der Hirnstammraphe (BR) bei den unipolar depressiv erkrankten Probanden im Vergleich zu den gesunden Kontrollprobanden zu verzeichnen (Becker et al., 1994). Dieses Ergebnis wurde in einer darauf folgenden Studie von Becker (1995 c), die 40 Probanden mit Major De20 pression untersucht hat, nochmals bestätigt. Um die Fragestellung zu erweitern, wurden auch Patienten mit anderen psychiatrischen Erkrankungen, 40 Probanden mit Schizophrenie und 40 Probanden mit bipolarer Störung, miteinbezogen. Dies ist bisher die einzige Studie über Untersuchungen bei Patienten mit bipolarer Störung. In der Gruppe der Patienten mit einer Major Depression wurde wiederum eine hoch signifikante Reduktion der Raphe-Echogenität im Vergleich zu den anderen Untersuchungsgruppen nachgewiesen. In der Gruppe der bipolar Depressiven war solch eine Hypoechogenität nicht beobachtet worden. Es ergaben sich sogar Hinweise für eine leichtgradig erhöhte Raphe-Echogenität im Vergleich zur gesunden Kontrollgruppe. In der Gruppe der schizophrenen Patienten konnte ebenso kein signifikanter Unterschied der Raphe-Echogenität im Vergleich zur gesunden Kontrollgruppe ausfindig gemacht werden. Somit scheint die Reduktion der Raphe-Echogenität zunächst spezifisch für die Gruppe der unipolar depressiv erkrankten Menschen zu sein. Möglicherweise geht diese veränderte Echogenität der Rapheregion bei Major Depressiven auch mit einer strukturellen Veränderung der dort befindlichen Mikroarchitektur einher, zum Beispiel in Form einer Modifikation der Zelldichte in dieser Geweberegion (Becker et al., 1995 c; 2001). Becker und Mitarbeiter (1998) untersuchten auch die Reproduzierbarkeit seiner Ergebnisse in einer retrospektiven MRI-Studie. Dabei wurde ebenso eine signifikant reduzierte Signalintensität der Rapheregion im MRI bei den 19 Probanden mit Major Depression, im Vergleich zu den 140 gesunden Kontrollpersonen, ermittelt. In diesem Zusammenhang vermuten Becker und Mitarbeiter (2001) eine Veränderung des basalen limbischen Systems und halten dies als eine bedeutende Komponente in der Entstehung der Major Depression für möglich. Nachdem die erwähnten Studien die reduzierte Echogenität der Rapheregion im Hirnstamm bei Major Depression mehrmals übereinstimmend belegt haben, untersuchte Walter (2007 a), ob die TCS eventuell auch eine Unterscheidung unterschiedlicher Verlaufstypen einer Major Depression sowie einer Anpassungsstörung mit reaktiver Depression erlaubt. Hierzu wurden 15 Patienten mit nur einer erlebten depressiven Episode, 22 Patienten mit wiederkehrenden depressiven Episoden, 15 Patienten mit einer reaktiven Depression in Form einer Anpassungsstörung und 50 gesunde Kontrollpersonen untersucht. Es zeigte 21 sich in den Untersuchungsgruppen, im Gegensatz zur gesunden Kontrollgruppe, ein nahezu gleich häufiges Auftreten einer reduzierten Raphe-Echogenität in der TCS. Das Ergebnis der Studie von Walter (2007 a) lässt somit darauf schließen, dass die TCS nicht spezifisch für eine bestimmte Form der Major Depression beziehungsweise für eine Anpassungsstörung mit depressiver Symptomatik ist. Jedoch konnte in einer weiteren Studie zu diesem Thema gezeigt werden, dass bei Patienten mit Major Depression und einer Hypoechogenität der Raphe-Region in der TCS häufiger suizidale Absichten oder Ideen beobachtet werden als bei Patienten ohne eine veränderte Darstellbarkeit der Raphe (Budisic et al., 2010). Da die Parkinson Erkrankung häufig von depressiven Symptomen begleitet wird, wurde auch in diesem Zusammenhang früh ein Fokus auf möglicherweise ähnliche morphologische Veränderungen erwähnter Hirnstrukturen bei diesen Erkrankungen gelegt (Becker et al., 1997; Walter et al., 2007 a). Und in der Tat haben Becker und Mitarbeiter (1997) in einer TCS-Studie aufzeigen können, dass bei Patienten mit Parkinson Erkrankung und begleitender Depression, im Vergleich zu Patienten mit Parkinson Erkrankung ohne depressive Symptome sowie den gesunden Kontrollpersonen, eine signifikante Reduktion der RapheEchogenität in der TCS zu erkennen ist. Dies lässt auf eine ähnliche morphologische Veränderung der Hirnstammraphe und somit einer Beteiligung des basalen limbischen Systems bei Major Depression und bei depressiven Patienten mit Parkinson Erkrankung schließen. Zusammenfassend ist die reduzierte Raphe-Echogenität in der TCS ein charakteristisches Merkmal bei Major Depression und begleitender Depression bei Parkinson Erkrankung und normalerweise nicht bei Gesunden, bei bipolarer Störung, bei Schizophrenie und bei Patienten mit Parkinson Erkrankung ohne begleitende Depression zu finden (Mijajlovic, 2010). Bezogen auf die bipolare Störung existiert derzeit jedoch nur eine bereits erwähnte TCS-Studie von Becker (1995 c), welche bei bipolaren Patienten eine normale oder leichtgradig erhöhte Hirnstammraphe-Echogenität evaluierte. 22 II. Zielsetzung Die transkranielle Hirnparenchym-Sonographie (TCS) ist ein neues und in Hinsicht auf veschiedene neurologische und psychiatrische Krankheitsbilder viel versprechendes bildgebendes Untersuchungsverfahren. Besonders in der psychiatrischen Forschung werden in zunehmendem Maße mögliche morphologisch-organische Veränderungen in bestimmten Hirnarealen im Rahmen psychiatrischer Krankheiten diskutiert. Die TCS bietet diesbezüglich eine für den Patienten gut erträgliche, nicht invasive, schnell durchführbare und ebenso kostensparsame Methode, welche die standardmäßig verwendeten bildgebenden Verfahren gut ergänzt und erweitert. In Zukunft könnte die TCS bei bestimmten Fragestellungen vielleicht sogar isoliert und gezielt eingesetzt werden. Um die Hirnparenchym-Sonographie jedoch zu etablieren und in den neurologischen und psychiatrischen Klinikalltag integrieren zu können, sollten bereits gewonnene und zuvor beschriebene Forschungsergebnisse konkretisiert sowie weitere Fragestellungen untersucht werden. In diesem Sinne versucht diese Arbeit an die bisher einzige TCS-Studie (Becker et al., 1995 c) anzuknüpfen, die die Hirnstammraphe-Echogenität nicht nur bei Patienten mit Major Depression, sondern auch bei bipolar depressiven Probanden untersucht hat. Dem Ergebnis dieser bisher einzigen Studie zufolge, ist eine pathologische HirnstammrapheEchogenität spezifisch für die Major Depression, aber nicht für die bipolare Störung. Hierbei wurden jedoch nicht die unterschiedlichen Erkrankungsphasen (depressiv, manisch, remittiert) der bipolaren Störung berücksichtigt. Somit stellt sich die Frage, ob vielleicht in den verschiedenen Krankheitsphasen der bipolaren Störung Echogenitätsunterschiede der Hirnstammraphe feststellbar sind. Das Studienziel ist daher zu untersuchen, ob sich die Echogenität der mesenzephalen Raphe bei bipolaren Patienten in Abhängigkeit von der aktuellen Erkrankungsepisode zueinander und auch im Vergleich zu einer gesunden Kontrollgruppe unterscheidet. Da bisher in keiner TCS-Studie ein Fokus auf die Untersuchung der bipolaren Störung separat nach Krankheitsphasen gelegt worden ist, stellt die Fragestellung dieser Studie einen innovativen Ansatz dar. 23 III. Patienten und Methodik 3.1 Studiendesign 3.1.1 Probanden In die Studie wurden Patienten eingeschlossen, bei denen 1) die diagnostischen Kriterien einer Bipolar-I-Störung (ICD-10 F31x) und 2) eine transkranielle Schallbarkeit vorlagen. Das Gesamtkollektiv wurde entsprechend der Indexepisode in drei Gruppen unterteilt: Patienten in Remission, Patienten mit aktuell depressiver Episode und Patienten mit aktuell manischer Episode. Ziel war eine Patientenrekrutierung von jeweils 15 Patienten je Gruppe zu erreichen. Als Kontrollgruppe wurden 15 gesunde Probanden untersucht. Alle Patienten und Probanden wiesen ein Alter zwischen 18 und 80 Jahren auf. Ausschlusskriterien waren 1) die Ablehnung der Teilnahme seitens der Patienten und/oder 2) ein ausgeprägter Schweregrad der bipolaren Erkrankung (wie z. B. Suizidalität). Die Rekrutierung der Patienten erfolgte über die LWL-Universitätsklinik der Ruhr-Universität Bochum, wobei stationäre, teilstationäre und ambulante Patienten einbezogen wurden, sowie Patienten, die Mitglieder der Selbsthilfegruppe für bipolare Störungen (Stimmungsumschwünge e. V.) in Essen waren, und Probanden aus dem Bekanntenkreis der Promovendin, sowie Pflegepersonal der LWL-Universitätsklinik Bochum und des St.-Josef-Hospitals Bochum, Klinik der Ruhr-Universität Bochum. Damit eine klare Klassifizierung der Untersuchungsgruppen gewährleistet werden konnte, wurde jeder Proband zu einem circa 60-minütigen Gespräch gebeten. Bestehende depressive sowie manische Episoden wurden mittels der standardisierten Fremdbeurteilungsskalen „Hamilton Depression Rating Scale“ (HAM-D) (Hamilton, 1960), „Montgomery Asberg Depression Rating Scale“ (MADRS) (Montgomery and Asberg, 1979) und „Young Mania Rating Scale“ (YMRS) (Young et al., 1978) erfasst beziehungsweise ausgeschlossen. Zudem wurden die Selbstbeurteilungsskalen „Beck-Depressions-Inventar“ (BDI) (Beck et al., 1961) und „Manie-Selbstbeurteilungsskala“ (MSS) (Krüger et al., 1997) 24 eingesetzt. Ergänzend erfolgte eine Klassifizierung anhand des international verwendeten „Strukturierten Klinischen Interviews“ (MINI-SKID nach DSM-IV). Zur Beurteilung des Gesamteindrucks der Probanden dienten das „Global Assessment of Functioning Scale“ (GAF) (Endicott et al., 1976) und die klinische Einschätzung anhand der „Clinical Global Impression Rating Scale“ (CGI-BP) (Guy, 1976). 3.1.2 Aufklärung und Einwilligung der Probanden Die Aufklärung der Probanden über die Art, den Aufbau und den Ablauf der Studie, sowie deren klinische Bedeutung, erfolgte anhand eines Aufklärungsbogens. Dieser informierte die Probanden ebenfalls über die Aufzeichnung und Archivierung der zu erhebenden Krankheitsdaten innerhalb der LWLUniversitätsklinik Bochum und über das Recht, jederzeit ohne Angabe von Gründen von der Untersuchung zurücktreten zu können. Dabei wurde betont, dass im Falle einer Zurücknahme der Einwilligung bezüglich der Studienteilnahme, dieses keinen Einfluss auf die weitere oder zukünftige Behandlung durch die LWL-Universitätsklinik Bochum habe. Hervorgehoben wurde ebenso der persönliche Nutzen durch die zusätzlich für die Pobanden durchgeführte sonographische Untersuchung des Gefäßstatus der Hals- und Kopfregion der Probanden und die daraufhin mögliche Benennung des individuellen Schlaganfallrisikos. Vor Beginn der Untersuchung musste eine schriftliche Einwilligung der Studienteilnehmenden auf einem Einverständnisbogen geleistet werden. 3.1.3 Ethik In Anlehnung an die Deklaration von Helsinki und die aktuellen ICH-Good Clinical Practice-Richtlinien (GCP) wurde die Einhaltung ethischer Grundsätze im Rahmen der Studie gewahrt. Das Einverständnis der Ethikkommission der Ruhr-Universität Bochum wurde vor Beginn der Studie eingeholt. 25 3.2 Untersuchungsablauf 3.2.1 Allgemeine personenbezogene Datenerhebung Anhand eines zweiseitigen Anamnesebogens wurden personenbezogene Basisdaten und krankheitsrelevante Daten erhoben. Bezüglich der Basisdaten wurden allgemeine Angaben zur Person, wie zum Beispiel Name, Alter, Nationalität und Herkunft, zur Biographie (Schulbildung, Beruf/Ausbildung) und zur sozialen Situation (Familienstand, Partnerschaft, Kinder, psychische Erkrankungen in der Familie) erfasst. Des Weiteren wurde nach einer Alkoholabhängigkeit der Eltern und/oder deren Trennung als auch nach einer möglichen Vernachlässigung oder körperlichen Gewalt in der Erziehung gefragt. Bei den krankheitsbezogenen Fragen wurde besonderer Wert auf die Erfassung des Krankheitsverlaufs gelegt. Dabei wurden zum einen manische beziehungsweise depressive Episoden, die psychiatrische Erstdiagnose und das Jahr der Diagnosestellung der bipolaren Erkrankung ermittelt und zum anderen die Anzahl der bisherigen Klinikaufenthalte mit jeweiliger Aufenthaltsdauer erfasst. Daraufhin wurden die Themen psychiatrische Komorbidität, Drogenmissbrauch und Suizidalität angesprochen, welche zusätzliche Hinweise auf die momentane Schwere der Erkrankung geben sollten. Neben der aktuell eingenommenen psychiatrischen Medikation wurden auch das Einnahmeverhalten und die Überzeugung bezüglich der Wirksamkeit der Medikamente erörtert. Dies gab Hinweise auf das Complianceverhalten der Patienten. Darüber hinaus wurde nach weiteren Therapieansätzen durch eine Psychotherapie und/oder Elektrokrampftherapie gefragt. Ergänzend erfolgte die Anamnese somatischer Störungen durch Fragen nach hirnorganischen Erkrankungen und Stoffwechselerkrankungen, sowie nach Suchtmittelkonsum in Form von Nikotin, Alkohol und Drogen. 26 3.2.2 Psychometrische Testverfahren Beck Depression Inventar (BDI) Das von Aron Beck (1961) entwickelte „Beck Depression Inventar“ (BDI) ist ein Instrument zur Selbstbeurteilung von depressiven Zuständen. Dieses ermöglicht eine Einschätzung des Schweregrades und des Verlaufs von depressiven Episoden. Dabei wird eine Einteilung von 21 Items vorgenommen, welche jeweils zwischen 0 und 3 Punkten bewertet werden. Null steht dabei für klinisch unauffällig und 3 für klinisch stark auffällig. Es handelt sich um folgende Themen: Stimmung, Minderwertigkeit, Selbstanklage, Körperbild, Hypochondrie, Versagens-, Schuld- und Beeinträchtigungserleben, Antriebsverhalten, Suizidalität, Anspannung, Interesselosigkeit, sozialer Rückzug, Arbeitsunfähigkeit, Ambivalenz, Schlafverhalten und Libido. Die Punkte der einzelnen Items werden anschließend addiert. Bei bis zu 11 Punkten gilt der BDI als unauffällig, 12 bis 17 Punkte entsprechen einer leichten bis mäßigen Depression, ab 18 Punkten ist von einem klinisch relevanten depressiven Zustand auszugehen. Die Testdurchführung dauert 5 bis 10 Minuten. Manie-Selbstbeurteilungsskala (MSS) Bei der „Manie-Selbstbeurteilungsskala“ (Krüger et al., 1997) werden 48 Aussagen bezüglich manischer Symptomatik von Betroffenen mit „ja“ oder „nein“ beantwortet. Die Antwort soll sich auf den vorherigen Monat beziehen. Diese Skala kann bei Patienten ohne Krankheitseinsicht eingesetzt werden und erfasst zudem auch hypomanische Zustände. Es lassen sich Schweregrad und Verlauf der Symptome somit gut dokumentieren. Die Bearbeitungsdauer beträgt maximal 15 Minuten. 27 Hamilton Depression Rating Scale (HAM-D) Die von Hamilton (1960) veröffentlichte „Hamilton Depression Rating Scale“ (HAM-D) ist die derzeit am häufigsten verwendete psychometrische Bewertungsskala für depressive Syndrome und wird auch in klinischen Studien sehr häufig eingesetzt. Die Skala hat 17 (in neueren Versionen mittlerweile 21 bzw. 24) Items, bei denen der Untersucher jeweils auf einer Punkteskala von 0 bis 2 bei 8 Items beziehungsweise von 0 bis 4 bei 9 Items beurteilt, wie schwer ein bestimmtes Symptom ausgeprägt ist. Diese werden durch den Untersucher unter Berücksichtigung von eigen- und fremdanamnestischen Angaben sowie des klinischen Eindrucks bewertet. Die Einschätzung soll sich dabei auf die vorangegangene Woche beziehen. Die vergebenen Punkte werden anschließend addiert. Bei bis zu 8 Punkten ist von keinem Krankheitswert auszugehen. Ein Punktwert von 8 bis 15 Punkten weist auf eine remittierte oder leichte Depression hin. Ein Resultat von 15 bis 18 Punkten wird als milde bis mittelschwere Depression gewertet. Bei einem Score von mehr als 25 Punkten liegt eine schwere Depression vor. Insgesamt liegt der höchste zu erreichende Wert bei 52 Punkten. An dieser Stelle ist zu erwähnen, dass die angewandten Bewertungsgrenzen leicht variieren können. In dieser Untersuchung wurde ein Cut-off-Wert von 16 Punkten gewählt, da auch schon eine milde depressive Symptomatik der bipolar erkrankten Probanden als Kriterium für die Zuteilung in die Gruppe der Patienten mit aktueller Depression ausreichend war. Die Untersuchungsdauer liegt bei ungefähr 15 Minuten. Montgomery Asberg Depression Rating Scale (MADRS) Die „Montgomery Asberg Depression Rating Scale“ (Montgomery und Asberg, 1979) wird zur Einschätzung des Verlaufs einer depressiven Episode verwendet. Sie beinhaltet 10 Bewertungsbereiche zu folgenden Themen: offensichtliche Traurigkeit, berichtete Traurigkeit, Anspannung, Appetit, Schlaf, Konzentration, Antrieb, Gefühllosigkeit, pessimistische Gedanken und suizidale Gedanken. Die Items werden jeweils anhand einer Punkteskala von 0 bis 6 bewertet, 28 wobei nach anschließender Addition ein Wert unter 9 Punkten als unauffällig zu betrachten ist. Der Test dauert insgesamt circa 15 Minuten. Young Mania Rating Scale (YMRS) Die „Young Mania Rating Scale“ (YMRS) wurde 1978 von R.C. Young zur Bewertung manischer Zustände entwickelt (Young et al., 1978). Die Skala gilt derzeit als Goldstandard und wird sehr häufig in klinischen Studien zur bipolaren Erkrankung eingesetzt. Der Untersucher nimmt 11 Bewertungen vor und vergibt pro Item jeweils eine Punktzahl von 0 bis 4 beziehungsweise 8 Punkten. Bei den Items handelt es sich um folgende Themenbereiche: gehobene Stimmung, motorische Aktivität, sexuelle Aktivität, Schlafverhalten, formaler Gedankengang, Irritabilität, Sprechweise, Denkinhalte, Anspannung, äußeres Erscheinungsbild und Krankheitseinsicht. Maximal können 60 Punkte vergeben werden. Ab einem Punktwert von 20 ist von einer manischen Symptomatik auszugehen. Mithilfe dieser Skala konnten somit die betroffenen Probanden ab einem Punktwert von 16 der Gruppe der Patienten mit aktuell manischer Episode zugeordnet werden. Die Testdauer beträgt circa 10 bis 20 Minuten. Mini International Neuropsychiatric Interview For Bipolar Disorder Studies (M.I.N.I.) In der vorliegenden Untersuchung wurde ergänzend die international verwendete 5. Version des verkürzten „Strukturierten Klinischen Interviews“ (M.I.N.I.SKID English Version 5.0.0), 2004 konzipiert von Sheehan und Lecrubier für Studien bezüglich der bipolaren Erkrankung nach DSM-IV und ICD-10, angewendet. Die hohe Validität und Reliabilität des „M.I.N.I.“ wurde in mehreren Studien belegt, in denen dieser mit dem „Strukturierten Klinischen Interview nach DSM-IIIR“ (Sheehan et al., 1997) und dem von der Weltgesundheitsorganisation (1990) entwickelten „Composite International Diagnostic Interview“ nach ICD-10 und 29 DSM-IV (Lecrubier et al., 1997; Amorim et al., 1998) verglichen wurde. Eine weitere Studie untersuchte die Entwicklung und die Validität des „M.I.N.I.“ (Sheehan et al., 1998). Der Test ist in verschiedene Module unterteilt, die Daten zu folgenden Krankheitsbildern eruieren: Depression, Suizidalität, Manie, Panikstörung, Agoraphobie, Sozialphobie, Zwangsstörung, Posttraumatische Belastungsstörung, Alkoholabhängigkeit, Drogenmissbrauch, Psychotische Störungen, Anorexie, Bulimie, generalisierte Angststörung, antisoziale Persönlichkeitsstörung. Jedes Diagnostikmodul beginnt mit Screeningfragen entsprechend der Hauptkriterien des jeweiligen Krankheitsbildes. Diese sind mit „ja“ oder „nein“ zu beantworten. Sind die Hauptkriterien erfüllt, folgen detailliertere Fragen bezüglich des Erkrankungsbildes. An dieser Stelle ist zu erwähnen, dass dieses Testverfahren ins Deutsche übersetzt wurde, da nicht alle Studienteilnehmer über ausreichende Englischkenntnisse verfügten. Der „M.I.N.I.“ diente im Rahmen der Studie als zusätzliches Untersuchungsverfahren, um die Diagnose der bipolaren Erkrankung zu bestätigen und eventuelle Komorbiditäten zu erfassen. Global Assessment of Functioning Scale (GAF) - Globale Erfassung des allgemeinen Funktionsniveaus Die GAF-Skala (Endicott et al., 1976) dient der Beurteilung der psychosozialen Funktionsfähigkeit und bezieht sich auf die Achse V des DSM-IV. Bewertet werden somit nur die psychischen, sozialen und beruflichen Funktionsbereiche, wobei Beeinträchtigungen aufgrund von körperlichen oder umgebungsbedingten Einschränkungen nicht einbezogen werden sollen. Die psychosoziale Funktionsfähigkeit der Probanden (zum Zeitpunkt der Befragung) wurde nach dem klinischen Interview und nach Einblick in die Krankenakte auf einer Skala von 100 (hervorragende Leistungsfähigkeit) bis 1 Punkt (schwerste Beeinträchtigung) eingeschätzt. Dabei wird von einem hypotheti- 30 schen Kontinuum von psychischer Gesundheit bis hin zu schwerer Störung ausgegangen. Clinical Global Impression Rating Scale (CGI) Die „Clinical Global Impression Rating Scale“ (CGI) (Guy, 1976) ermöglicht die Einschätzung des Schweregrades der Erkrankung des Patienten zum Zeitpunkt der Untersuchung. Auf einer 7-stufigen Skala steht der Punktwert 1 für eine Symptomfreiheit und der Punktwert 7 für einen extrem kranken Zustand. 3.2.3 Transkranielle Hirnparenchym-Sonographie (TCS) Die transkranielle Hirnparenchym-Sonographie (TCS) ermöglicht eine nichtinvasive, schnelle und somit patientenfreundliche Darstellung verschiedener Schnittebenen und Strukturen des Gehirns. Neben der intrakraniellen Gefäßdarstellung wird die TCS seit ungefähr 15 Jahren auch für die Untersuchung weiterer Hirnstrukturen angewandt (Schoning et al., 1989). Durch charakteristische Echogenitätsmuster der Hirnstrukturen sind insbesondere der Hirnstamm mit der im Wesentlichen untersuchten echoreichen Hirnstammrapheregion im Mesencephalon, das Ventrikelsystem und die Basalganglien darstellbar. Veränderungen der Echogenitätsmuster sprechen für Änderungen der Gewebeimpedanz, möglicherweise hervorgerufen durch gliale Reaktionen, Änderung der Zelldichte und des Zelleisengehaltes (Vlaar et al., 2009; Becker et al., 1995; Berg et al., 2002). Der Querschnitt des Mesencephalons stellt sich insgesamt als echoarme, homogene, schmetterlingsförmige Struktur dar, die durch die umliegenden stark echogenen Basalzisternen gut abgrenzbar ist. Neben der auf Mittelhirnebene bilateral sichtbaren normalerweise schwach echogenen Substantia nigra (SN), die im Normfall eine echogene Fläche < 0,20 cm² aufweist, und dem ebenfalls bilateral vorkommenden schwach bis deutlich echogenen Nucleus ruber, stellt sich die deutlich echogene Rapheregion (BR) gut sichtbar als mediane Achse des Mesencephalonquerschnitts dar. 31 Die Patienten wurden am selben Tag des klinischen Untersuchungsgesprächs mittels transkranieller Sonographie des Hirnparenchyms (TCS) im neurosonologischen Labor der Neurologischen Klinik im St. Josef-Hospital Bochum, Klinikum der Ruhr-Universität, untersucht. Der erfahrene Untersucher war zu keinem Zeitpunkt über den psychischen Gesundheitszustand der Probanden aufgeklärt. Für die durchgeführten Untersuchungen wurde ein „Phased-Array“-2,5MHz-Schallkopf präaurikulär auf das temporale Knochenfenster in der OrbitoMeatal-Ebene platziert, um das „Schallfenster“ aufsuchen und somit die intrakraniellen Strukturen sichtbar machen zu können. Bei 10-15 % der Probanden verhindert erfahrungsgemäß ein nicht vorhandenes oder nur teilweise bestehendes „Schallfenster“ eine Untersuchung beziehungsweise ist diese nur eingeschränkt möglich (Walter et al., 2004). Zur Anwendung kam das Ultraschallgerät Siemens Sonoline Elegra (Erlangen, Deutschland), welches in zuvor publizierten Studien bereits überwiegend eingesetzt wurde (Walter et al., 2004; Walter et al., 2007). Die am Gerät eingestellten Parameter betrugen eine Bildtiefe von 15 cm bis gegebenenfalls 16 cm und einen dynamischen Bereich von 45 dB. Somit war jeweils auch die kontralaterale Seite des Gehirns einsehbar. Die Beurteilung der Untersuchung erfolgte anhand standardisierter Schnittebenen (siehe Abbildung 2). Die oberste Schnittebene erlaubt die Beurteilung der Seitenventrikel, die mittlere Untersuchungsebene nennt sich Thalamusebene und die unterste Mittelhirnebene. Dabei wurden zum einen die Intensität des Schallechos und zum anderen die Fläche der darstellbaren Hirnstrukturen dokumentiert. Die Echogenität wurde im Vergleich zum umliegenden Hirnstammgewebe bewertet, als hyperechogen wurden dabei Strukturen mit abnorm erhöhter Schallechointensität bezeichnet. 32 Abbildung 2: Schematische Darstellung der transkraniellen Sonographie durch das temporale Knochenfenster mit Veranschaulichung der drei standardisierten axialen Schnittebenen. Im Vergleich jeweils die korrespondierenden kernspintomographischen Bilder (Becker et al., 2001; Behnke et al., 2007) Bei der Beurteilung der Echogenität und Durchgängigkeit der Hirnstammraphe (BR= brainstem raphe) diente der Nucleus ruber als Referenzstruktur, wobei sich im Normalfall beide Strukturen in gleicher Echogenität darstellen. Die Untersuchungsbefunde der Hirnstammraphe wurden in drei Skalierungsstufen eingeteilt (siehe Abbildung 3). Bei den Einteilungsgraden 1 bis 2 handelt es sich hierbei um pathologische Raphedarstellungen, wobei Grad 1 eine nicht sichtbare Hirnstammraphe kennzeichnet und bei Grad 2 sich diese allenfalls schwach beziehungsweise reduziert darstellen lässt. Grad 3 stellt den Normalfall mit normo- bis hyperechogener Hirnstammraphestruktur dar (Walter et al., 2007 a). 33 A B * C * * Abbildung 3: Sonographische Darstellung der axialen Mittelhirnschnittebene bei drei Patienten mit bipolarer Störung. Das Mittelhirn ist in der Darstellung zur besseren Visualisierung schmetterlingsförmg umrandet. Die schwarze Sternstruktur markiert jeweils den Aquädukt. Die Pfeilspitzen verweisen auf die untersuchte Hirnstammrapheregion. (A)Grad 1: Raphestruktur nicht sichtbar (pathologisch). (B)Grad 2: Raphestruktur schwach erkennbar (pathologisch). (C)Grad 3: Raphestruktur mit normaler Echogenität (normal). In der Abbildung (B) ist zusätzlich die bei diesem Patienten bilateral gut sichtbare Substantia nigra durch Pfeile markiert. Die echogene Fläche der rechten Substantia nigra wurde zu einer computergesteuerten Flächenberechnung umrandet. Für die spätere statistische Auswertung wurden jedoch die Skalenwerte 1 und 2 zu einer Kategorie „pathologische Echogenität“ zusammengefasst, da andernfalls in den Subgruppen (bipolar manisch, -depressiv-, remittiert) eine zu geringe Stichprobengröße vorhanden gewesen wäre. Da das Verfahren der TCS weltweit derzeit noch nicht etabliert ist, existieren keine gültigen Referenzwerte, jedoch mehrere Studien, die an größeren Normalkollektiven vorläufige Referenzwerte entwickelt und veröffentlicht haben (Berg et al., 1999 b; Berg et al., 2001; Walter et al., 2002; Walter et al. 2007 b). Aus diesem Grund wurde in der vorliegenden Untersuchung das Kontrollkollektiv gebildet und parallel zum Patientenkollektiv untersucht. 3.3 Statistische Analysen Bei sämtlichen Analysen wurden als Testvoraussetzung die Normalverteilung und Varianzhomogenität der Residuen mittels Kolmogorov-Smirnov bzw. Leve34 ne-Test überprüft. Da diese Voraussetzungen für parametrische Tests vielfach verletzt waren, wurden für die Auswertung der Daten mit Ausnahme der Pearson-Korrelation zwischen den psychometrischen Skalen nur nicht- parametrische Verfahren verwendet. Demographische und klinische Variablen wurden zwischen den drei bipolaren Subgruppen und der Kontrollgruppe durch den Kruskal-Wallis-H-Test verglichen (siehe Tabelle 1). Die Geschlechterverteilung wurde als einzige kategoriale Variable mit dem Chi-Quadrat-Test überprüft. Zunächst wurde der Anteil an Probanden mit pathologischer Raphe-Darstellung in den drei bipolaren Subgruppen sowie der Kontrollgruppe miteinander mittels Chi-Quadrat-Test verglichen (siehe Tabelle 1). Anschließend wurden die Probanden mit einer pathologischen und normalen Raphe-Darstellung ebenfalls separat für die drei bipolaren Subgruppen und die Kontrollgruppe auf verschiedenen klinischen Variablen gegenübergestellt. Hierfür wurde Spearman’s Rangkorrelation zwischen der dichotomen Raphe-Skalierung (pathologisch normal) und den klinischen Variablen berechnet (siehe Tabelle 2). Diese Korrelation fungiert hier gleichzeitig als Effektstärke, die das Ausmaß des Unterschiedes zwischen den Probanden mit normaler und pathologischer RapheDarstellung auf den klinischen Variablen anzeigt. Ebenso wurde mit Spearman’s Rangkorrelation der Zusammenhang zwischen der Summe aus der links- und rechtsseitigen Substantia nigra sowie verschiedenen klinischen Variablen berechnet. Die Übereinstimmung zwischen den Selbstbeurteilungsskalen (BDI und MSS) und den Fremdbeurteilungsskalen (HAMD, MADRS und YMRS) wurde durch eine Produkt-Moment-Korrelation nach Pearson untersucht (siehe Tabelle 3;4). Es wurden ausschließlich zweiseitige Signifikanztests durchgeführt, da a-priori keine Hypothesen über die Richtung der Unterschiede in den Subgruppen aufgestellt wurden. 35 IV. Ergebnisse 4.1 Demographische Charakteristiken der Probanden Im Zeitraum April 2008 bis Februar 2009 wurden insgesamt 51 Studienteilnehmer untersucht, davon 36 Probanden mit Diagnose einer Bipolar-I-Störung (ICD-10 F31x) (Vergleichsgruppe) und 15 gesunde Probanden (Kontrollgruppe), die alle die genannten Einschlusskriterien erfüllten. Die demographischen und klinischen Charakteristiken der einzelnen Untersuchungsgruppen sind in Tabelle 1 zusammenfassend dargestellt. In den verschiedenen Gruppen zeigten sich keine signifikanten Alters- oder Geschlechtsunterschiede (siehe Tabelle 1). Die Vergleichsgruppe setzte sich aus 16 Frauen (44,4%) und 20 Männern (55,6%) mit einer Altersspanne von 23 Jahren bis 69 Jahren zusammen. Davon befanden sich 14 Probanden zum Untersuchungszeitpunkt in einer depressiven Episode, acht Probanden in einer manischen Episode und 14 Probanden waren remittiert. Das Durchschnittsalter in der depressiven Gruppe, davon sieben Frauen (50%) und sieben Männer (50%), lag bei 40,43 (±14,17) Jahren. In der manischen Gruppe, davon drei Frauen (38%) und fünf Männer (63%), bei 48,12 Jahren (±17,55) und in der remittierten Gruppe, davon sechs Frauen (43%) und acht Männer (57%), bei 44,93 Jahren (±11,17). Das Durchschnittsalter der Kontrollgruppe, davon acht Frauen (53%) und sieben Männer (47%), lag bei 39,13 Jahren (±13,96) mit einer Altersspanne von 24 bis 67 Jahren ( siehe Tabelle 1). Fünf weitere Patienten konnten sonographisch nicht untersucht werden, da bei diesen jeweils ein anatomisch zu kleines Knochenfenster vorlag. Sie wurden als Drop-outs eingestuft, so dass sonstige erhobene Daten nicht in die statistische Bewertung miteinbezogen wurden. 36 Tabelle 1: Demographische und klinische Charakteristiken der Untersuchungsgruppen Variablen Bipolar Bipolar Bipolar depressiv manisch remittiert (n= 14) (n = 8) (n = 14) Kontrollgruppe d.f. H P (n = 15) MW s MW s MW s MW s Alter 40,43 14,17 48,12 17,55 44,93 11,17 39,13 13,96 2,88 3 0,41 KA 6,86 7,52 6,50 2,45 4,86 4,04 - - 2,12 2 0,35 DPE 11,07 10,53 26,00 13,70 13,50 8,27 - - 7,17 2 0,03 ME 7,58 9,10 8,00 6,19 10,86 7,04 - - 2,29 2 0,32 DE 17,54 26,48 15,57 12,66 14,57 16,48 - - 0,43 2 0,81 Episoden 24,08 34,92 23,57 13,87 25,43 22,14 - - 1,34 2 0,51 BDI 37,21 12,53 14,14 6,04 10,14 8,59 3,80 4,06 19,74 3 <0,01 MSS 12,29 8,61 17,57 11,41 8,43 8,32 1,73 2,87 19,57 3 <0,01 HAMD 21,79 3,83 10,12 4,16 7,57 5,72 1,93 1,71 38,25 3 <0,01 MADRS 29,21 6,67 8,50 5,35 8,36 6,12 1,53 1,81 37,29 3 <0,01 YMRS 3,86 3,84 22,75 4,77 6,71 5,34 ,40 ,74 31,13 3 <0,01 GAF 49,29 9,38 40,00 14,14 68,57 14,99 85,00 ,00 36,74 3 <0,01 CGI 4,71 0,73 5,25 1,28 2,36 1,34 1,00 ,00 38,84 3 <0,01 n % n % n % n % χ 7/7 50/50 3/5 38/63 6/8 43/57 8/7 53/47 0,68 Gender 2 d.f. P 0,88 3 (F/M) MW = Mittelwert; s = Standardabweichung; H = Kruskal-Wallis-Test; KA = Klinikaufenthalte gesamt; DPE = Erkrankungsdauer seit psychiatrischer Erstdiagnose; ME = manische Episoden; DE = depressive Episoden; Episoden = Episoden insgesamt; BDI = Beck-Depressions-Inventar; MSS = Manie-Selbstbeurteilungsskala; HAMD = Hamilton Depression Rating Scale; MADRS = Montgomery Asberg Depression Rating Scale; YMRS = Young Mania Rating Scale; GAF = Global Assessment of Functioning Scale; CGI = Clinical Gobal Impression Scale 37 4.2 Klinische Charakteristiken der Probanden Bei den Mittelwerten der Ergebnisse der psychometrischen Testverfahren (siehe Tabelle 1) waren signifikante Unterschiede feststellbar, welche durch die verschiedenen gesundheitlichen beziehungsweise psychiatrischen Zustände der Teilnehmer zum Untersuchungszeitpunkt bedingt waren. Bei den Testverfahren, die eine depressive Symptomatik erfassen (BDI, HAM-D und MADRS), ließen sich signifikante Unterschiede in den einzelnen Gruppen erkennen. Beim HAM-D, der im Wesentlichen zur Bewertung des Schweregrades der Depressivität zum Untersuchungszeitpunkt dient, lag der Mittelwert in der depressiven Gruppe bei 21,79 (±3,83), in der manischen Gruppe bei 10,12 (±4,16), in der remittierten Gruppe bei 7,57 (±5,72) und in der gesunden Kontrollgruppe bei 1,93 (±1,17). Ebenso zeigten die verwendeten Messinstrumente zur Erfassung manischer Symptomatik (MSS und YMRS) statistische Unterschiede in den Untersuchungsergebnissen. Bei der vorrangig zur Bewertung der manischen Symptomatik dienenden YMRS lag der Mittelwert in der depressiven Gruppe bei 3,86 (±3,84), in der manischen Gruppe bei 22,75 (±4,77), in der remittierten Gruppe bei 6,71 (±5,34) und in der gesunden Kontrollgruppe bei 0,40 (±0,74). Auch in Bezug auf die Indikatoren zur Einschätzung des Schweregrades der Erkrankung beziehungsweise der klinischen Gesundheit der Probanden im Allgemeinen (GAF und CGI) waren signifikante statistische Unterschiede vorhanden. Weitere erhobene klinische Daten bezüglich des Verlaufs der bipolaren Erkrankung, wie die Anzahl der insgesamt erlebten Episoden, die Anzahl der Krankenhausaufenthalte und die Dauer der Erkrankung seit Erstdiagnose, zeigten sich nur signifikant statistische Unterschiede in Bezug auf die Dauer der Erkrankung seit Erstdiagnose zwischen den einzelnen Subgruppen (p=0,03). 4.3 Häufigkeit normaler und pathologischer Raphe-Darstellungen Die Verteilung der normalen und pathologischen Raphe-Darstellungen in den einzelnen Subgruppen und der Kontrollgruppe ist in der Abbildung 4 zusammenfassend dargestellt. In der Gruppe der aktuell depressiven Patienten (n=14) war bei sechs von 14 Probanden eine pathologische Raphe-Darstellung zu erkennen. Dies entsprach 43 % der Probanden in dieser Gruppe. In der Gruppe 38 der aktuell manischen Patienten (n=8) wiesen drei von acht Probanden eine pathologische Raphe-Darstellung auf, was 38% der in dieser Gruppe untersuchten Probanden entsprach. In der Gruppe der bipolar remittierten Patienten (n=14) war bei vier von 14 Probanden eine pathologische Raphe-Darstellung zu erkennen, also bei 29% der Probanden in dieser Untersuchungsgruppe. Bei der Vergleichsgruppe aller bipolar erkrankten Probanden (n=36) stellte sich bei 13 von 36 Probanden, und somit 36% der bipolar erkrankten Probanden, eine pathologische Raphe-Echogenität dar. In der Kontrollgruppe (n=15) fanden sich drei von 15 Probanden, also 20% der Gesunden, mit einer pathologischen Raphe-Darstellung. Insgesamt zeigten sich keine statistisch signifikanten Unterschiede in der Häufigkeit einer pathologischen Raphe-Darstellung, wenn man die Vergleichsgruppe mit der Kontrollgruppe vergleicht und auch nicht wenn man einzelne Subgruppen, wie die der bipolar depressiven Probanden, mit der Kontrollgruppe vergleicht. pathologisch normal 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Bipolar Depressiv Bipolar Manisch (n=14) (n=8) Bipolar Remittiert (n=14) Bipolar Gesamt (n=36) Kontrolle (n=15) Abbildung 4: Häufigkeit pathologischer und normaler Raphe-Darstellungen nach Gruppen in Prozent 39 4.4 Zusammenhang zwischen Raphe-Skalierung und klinischen Variablen Im Vergleich der durchgeführten Rangkorrelationen nach Spearman (siehe Tabelle 2) zwischen der dichotomen Raphe-Skalierung und bestimmten klinischen Variablen, jeweils separat für die unterschiedlichen Untersuchungsgruppen aufgeführt, korrelierten in der Gruppe der derzeit bipolar depressiv erkrankten Probanden HAM-D-Werte (rho=0,60; p<0,05) sowie MADRS-Werte (rho=0,65; p<0,05) signifikant mit Raphe-Werten, d. h. dass in dieser Gruppe hohe Depressivität mit pathologischen Raphe-Darstellungen korreliert. In der Gruppe der derzeit bipolar manischen Probanden waren alle Korrelationen bezogen auf die Raphe-Skalierung durchgängig nicht signifikant. Bei den derzeit bipolar remittierten Probanden war ebenso kein Zusammenhang zwischen HAM-D, MADRS, sonstigen klinischen Tests und den Raphe-Scores feststellbar. Auch in der Vergleichsgruppe aller bipolar erkrankten Probanden zeigten sich keine signifikanten Korrelationen zwischen der Raphe-Skalierung und den klinischen Tests. Bei den Selbstbeurteilungsbögen (BDI und MSS) waren in allen Gruppen keine signifikanten Korrelationen zu der Raphe-Skalierung zu erkennen. Bei den Skalen zur Einschätzung des Schweregrades der Erkrankung (der CGIund der GAF-Skala) ergaben sich nur in der Gruppe der derzeit depressiven Probanden signifikante Korrelationen bezüglich der CGI-Skala (rho=0,55; p<0,05). Auch bei den krankheitsspezifischen Parametern, wie zum Beispiel der erlebten Episodenanzahl, der Erkrankungsdauer oder der Anzahl der erlebten Klinikaufenthalte, konnten ebenfalls nur in der Gruppe der derzeit depressiven Probanden signifikante Korrelationen zu der Raphe-Skalierung bei der Erkrankungsdauer seit psychiatrischer Erstdiagnose (DPE) (rho=0,61; p<0,05) und dem Alter der Probanden (rho=0,61; p<0,05) ermittelt werden. 40 Tabelle 2: Rangkorrelation (Spearman) zwischen dichotomer Raphe-Skalierung und klinischen Variablen separat nach Krankheitsphasen Gruppe Bipolar Bipolar Bipolar Bipolar Kontrolle depressiv manisch remittiert gesamt (n = 15) (n= 14) (n = 8) (n = 14) (n = 36) BDI ,29 ,14 ,26 ,20 ,14 MSS -,23 ,29 -,06 -,02 ,21 HAM-D *,60 ,47 ,26 ,32 ,06 MADRS *,65 ,46 ,16 ,28 ,06 YMRS -,22 ,17 -,04 -,03 ,45 GAF -,38 -,23 -,17 -,23 - CGI *,55 ,23 ,04 ,25 - KA ,22 ,39 ,30 ,29 - DPE *,61 ,17 ,12 ,27 - Alter *,61 ,17 -,04 ,23 ,04 Manien ,10 ,44 -,02 ,10 - Depressionen ,21 ,07 -,20 ,05 - ,10 ,00 -,08 ,04 - Episoden gesamt BDI = Beck-Depressions-Inventar; MSS = Manie-Selbstbeurteilungsskala; HAMD = Hamilton Depression Rating Scale; MADRS = Montgomery Asberg Depression Rating Scale; YMRS = Young Mania Rating Scale; GAF = Global Assessment of Functioning Scale; CGI = Clinical Global Impression Scale; KA = Klinikaufenthalte gesamt; DPE = Erkrankungsdauer seit psychiatrischer Erstdiagnose; * = Korrelation ist zweiseitig signifikant auf dem 5%-Niveau; ** = Korrelation signifikant auf dem 1%-Niveau 4.5 Übereinstimmung von Selbst- und Fremdbeurteilungsskalen Aufgrund der verschiedenen Ergebnisse bei Selbst- und Fremdbeurteilung in der Korrelationstabelle nach Spearman (Tabelle 2) (signifikante Korrelationen 41 zwischen HAMD-D- bzw. MADRS-Werten und Raphe-Scores, jedoch nicht zwischen BDI-Werten und Raphe-Scores) wurde eine Pearson-Korrelation zwischen diesen Skalen durchgeführt (siehe Tabelle 3). Hierbei fanden sich signifikante Korrelationen in allen Patientengruppen zwischen HAM-D und BDI (vergleiche Tabelle 3), mit Ausnahme der Gruppe der derzeit bipolar manischen Probanden. Wurde jedoch ein Proband aus der manischen Gruppe (der im BDI eine Punktzahl von 22 angab und im MADRS lediglich einen Wert von 4 Punkten und im HAM-D ebenso einen Wert von nur 6 Punkten erreichte) aus der Berechnung der Korrelation zwischen MADRS beziehungsweise HAM-D und BDI ausgeschlossen, so ergab sich eine Korrelation von r=0,85 (p<0,05) beziehungsweise r=0,72 (p=0,11). Außerdem war hierbei die geringe Stichprobengröße in den einzelnen Gruppen zu berücksichtigen und zu beachten, dass in der Vergleichsgruppe aller bipolar erkrankten Probanden eine insgesamt hochsignifikante Korrelation von r=0,84 (p<0,01) zwischen Selbst- und Fremdbeurteilung erkennbar war. Tabelle 3: Korrelation nach Pearson zwischen Hamilton Depression Rating Scale (HAMD) bzw. Montgomery Asberg Depression Rating Scale (MADRS) und dem Beck Depression Inventar (BDI) Bipolar Bipolar Bipolar Bipolar Kontrolle depressiv manisch remittiert gesamt (n = 15) (n= 14) (n = 8) (n = 14) (n = 36) HAM-D †,48 ,22 **,74 **,84 **,72 MADRS *,57 ,40 **,69 **,86 **,68 HAMD = Hamilton Depression Rating Scale; MADRS = Montgomery Asberg Depression Rating Scale; † = Korrelation signifikant auf dem 10%-Niveau; * = Korrelation ist zweiseitig signifikant auf dem 5%-Niveau; ** = Korrelation signifikant auf dem 1%-Niveau Ergänzend wurden auch die Korrelationen nach Pearson für die YMRS und die MSS berechnet (siehe Tabelle 4). Dabei ergaben sich in allen Gruppen signifikante Korrelationen, wobei in der remittierten Gruppe (0,81; p<0,01), in der Vergleichsgruppe aller bipolar erkrankten Probanden (0,59; p<0,01) und in der 42 gesunden Kontrollgruppe (0,7; p<0,01) sogar hochsignifikante Korrelationen zwischen Selbst- und Fremdbeurteilung zu verzeichnen waren. Tabelle 4: Korrelation nach Pearson zwischen Young Mania Rating Scale (YMRS) und der Manie-Selbstbeurteilungsskala (MSS) YMRS Bipolar Bipolar Bipolar Bipolar Kontrolle depressiv manisch remittiert gesamt (n = 15) (n= 14) (n = 8) (n = 14) (n = 36) *,65 †,70 **,81 **,59 **,70 YMRS = Young Mania Rating Scale; † = Korrelation signifikant auf dem 10%-Niveau; * = Korrelation ist zweiseitig signifikant auf dem 5%-Niveau; ** = Korrelation signifikant auf dem 1%-Niveau 43 V. Diskussion Ein Ziel dieser Arbeit besteht in dem Vergleich der Raphe-Untersuchungen in der TCS zwischen der Vergleichsgruppe der bipolar erkrankten Patienten gegenüber dem gesunden Kontrollkollektiv. Darüber hinaus wird erstmals versucht die Frage zu beantworten, ob unterschiedliche Raphe-Darstellungen in Abhängigkeit von den verschiedenen Erkrankungsepisoden bipolar erkrankter Patienten (depressiv, manisch, remittiert) nachgewiesen werden können. In bisher nur einer TCS-Studie (Becker et al., 1995 c) wurden neben Patienten mit einer Major Depression auch bipolar depressive Probanden untersucht. Demzufolge weisen Menschen mit einer Major Depression signifikant häufiger hypoechogene Veränderungen der Raphe-Region im Vergleich zu Gesunden auf. Bei bipolar erkrankten Menschen waren solche Hypoechogenitäten jedoch nicht häufiger zu erheben als in der gesunden Kontrollgruppe. In der vorliegenden Arbeit wurde an die Studie von Becker angeknüpft, um nochmals die Raphe-Echogenität bei bipolaren Patienten zu untersuchen und über diese Fragestellung hinaus zu eruieren, ob Unterschiede in der Raphe-Darstellung in den jeweiligen Erkrankungsphasen der bipolaren Störung nachgewiesen werden können. Das Studienkonzept ist angelehnt an eine TCS-Studie (Walter et al., 2007 a), in der verschiedene Verlaufsformen beziehungsweise Subgruppen der unipolaren Depression im Vergleich zu einer gesunden Kontrollgruppe untersucht wurden. Die depressiv erkrankten Patienten wurden dafür in folgende Untersuchungsgruppen unterteilt: Patienten mit nur einer depressiven Episode, Patienten mit mehreren depressiven Episoden und Patienten mit einer Anpassungsstörung. Dem Ergebnis jener Studie zufolge ist die reduzierte RapheEchogenität bei unipolarer Depression nicht spezifisch für eine bestimmte depressive Subgruppe. In gleicher Vorgehensweise wurden in dieser Studie nun bipolar erkrankte Patienten je nach Erkrankungsphase in Subgruppen eingeteilt und hirnparenchymsonographisch untersucht. Um eine angemessene Zuteilung in die Gruppen zu gewährleisten, wurden die Probanden jeweils in einem ca. 60-minütigen Gespräch mittels Selbstbeurteilungsbögen und standardisierten psychometrischen Testverfahren befragt. Schwierigkeiten ergaben sich dabei zum einen in Bezug auf die Angaben zu Medikamentendosierungen bei den 44 Probanden aus der Selbsthilfegruppe für bipolare Störungen (Stimmungsumschwünge e.V.) und zum anderen konnten von einem stationären Patienten die Selbstbeurteilungsbögen aufgrund von Konzentrationsproblemen sowie sprachlichen Schwierigkeiten nicht ausgefüllt werden. Ansonsten ließ sich das methodische Konzept der Studie wie geplant umsetzen. Bevor die Ergebnisse dieser Studie weiter diskutiert werden, ist es von Bedeutung, die Patienteneinteilung genauer zu beschreiben. Hierbei ist die Übereinstimmung von Selbst- und Fremdbeurteilung als ein wichtiger Validitätsfaktor für die berechneten Studienergebnisse zu verstehen. Aufgrund dessen wurde eine Pearson-Korrelation (siehe Tabelle 3) zwischen den HAM-D- beziehungsweise MADRS-Werten (Fremdbeurteilung) und den BDI-Werten (Selbstbeurteilung) in allen Untersuchungsgruppen durchgeführt. Hierbei finden sich mit Ausnahme der manischen Gruppe signifikante Korrelationen zwischen den erwähnten Skalen. Die nicht signifikante Übereinstimmung in der manischen Gruppe ist möglicherweise auf die geringe Fallzahl in dieser Probandengruppe zurückzuführen. Des Weiteren ist zu bedenken, dass sich die Selbstbeurteilung bei den Patienten mit aktuell manischer Symptomatik möglicherweise schwieriger gestaltet als in den anderen Untersuchungsgruppen. In Anbetracht der Unstimmigkeit zwischen Selbst- und Fremdbeurteilung in der manischen Untersuchungsgruppe wurde ein manischer Proband von der Korrelationsberechnung ausgeschlossen, da nach Analyse eine große Diskrepanz zwischen Selbst- und Fremdbeurteilung bestand. In diesem Fall ergab der BDI einen Wert von 22 und der HAMD lediglich ein Wert von 6 Punkten sowie der MADRS 4 Punkte. Betrachtete man diesen Patienten als Ausreißer bei der Berechnung der Korrelation zwischen MADRS beziehungsweise HAM-D und BDI, resultierte eine Korrelation von r=0,85 (p<0,05) beziehungsweise r=0,72 (p=0,11) für Selbst- und Fremdbeurteilung in der manischen Untersuchungsgruppe. Somit ergab sich letztlich für alle Gruppen ein kongruentes Bild zwischen Selbst- und Fremdbeurteilungsskalen bezüglich depressiver Symptomatik, auch oder vor allem wenn man die Testwerte aller Gruppen korrelierte. In gleicher Weise wurden auch die Werte der Selbst- und Fremdbeurteilung (MSS, YMRS) in Bezug auf die manische Symptomatik analysiert, wobei sich hier in allen Untersuchungsgruppen signifikante Korrelationen ergaben (Tabelle 4). 45 Zusammenfassend ist von einer angemessenen Einteilung der Untersuchungsgruppen auszugehen, welche die Grundlage für die statistischen Berechnungen darstellt. In Bezug auf die transkranielle Hirnparenchym-Sonographie (TCS) ist zu erwähnen, dass derzeit noch keine allgemein gültigen Referenzwerte existieren und wir uns somit an den Referenzwerten früherer Studien zu diesem Thema orientieren mussten (Berg et al., 1999; Berg et al., 2001; Walter et al., 2002; Walter et al., 2007 b). Aufgrund dessen wurde zum Vergleich ein Kontrollkollektiv gebildet, um laborinterne Referenzwerte von gesunden Probanden ermitteln zu können. Es wurden insgesamt 36 Probanden mit der Diagnose der Bipolar-I-Störung (ICD-10 F31x) (Vergleichsgruppe) und 15 gesunde Probanden (Kontrollgruppe) interviewt und hirnparenchymsonographisch an der Raphe-Region untersucht. In den verschiedenen Untersuchungsgruppen (depressive Gruppe (n=14), manische Gruppe (n=8), remittierte Gruppe (n=14) und gesunde Gruppe (n=15)) zeigten sich wie gewünscht keine demographischen Differenzen bezüglich Alter und Geschlecht (vgl. Tabelle 1). Aufgrund der bis hierher dargestellten Einteilung und demographischen Verteilung der Gruppen, lässt sich zusammenfassen, dass alle Vorbedingungen für eine repräsentative Datenerhebung erfüllt waren und im Folgenden die Ergebnisse der vorliegenden Arbeit systematisch anhand der Gliederung des Kapitels III („Ergebnisse“) dargestellt werden. Bezüglich der klinischen Charakteristika der Probanden (Erkrankungsdauer, Episodenhäufigkeit und Klinikaufenthalte), zeigte sich nur in Bezug auf die Erkrankungsdauer seit Erstdiagnose eine leicht signifikante statistische Differenz zwischen den einzelnen Untersuchungsgruppen. Dabei ist zu berücksichtigen, dass viele Patienten angaben, die Symptome der bipolaren Erkrankung schon lange vor der ersten Diagnosestellung der bipolaren Störung erlebt zu haben. Deshalb ist die Erkrankungsdauer in unserem Probandenkollektiv nur ein Näherungswert. Ansonsten ergaben sich keine statistisch signifikanten Unterschiede zwischen den Probanden beziehungsweise zwischen den einzelnen Untersuchungsgruppen in Bezug auf klinische Charakteristika der bipolaren Erkrankung 46 (siehe Tabelle 1). Es ließen sich jedoch in Bezug auf die durchgeführten klinischen Tests statistisch signifikante Unterschiede zwischen den einzelnen Gruppen nachweisen. Dies lässt sich durch die je nach aktueller Episode der Probanden gebildeten Untersuchungsgruppen (depressiv, manisch, remittiert, gesund) erklären. Daher ist es leicht nachzuvollziehen, dass die Mittelwerte der erreichten Punktwerte der Skalen, die der Einschätzung des Schweregrades der Depressivität zum Untersuchungszeitpunkt dienten, in der depressiven Untersuchungsgruppe auch am höchsten lagen. Die Ergebnisse zeigen, dass zum Beispiel beim HAM-D der Mittelwert in der depressiven Gruppe am höchsten liegt. Ebenso zeigte sich diese Abstufung auch bei der vorrangig zur Bewertung der manischen Symptomatik dienenden YMRS, wobei der Mittelwert in der manischen Gruppe wiederum am höchsten lag. Im Hinblick auf die Raphe-Region und damit auf die Fragestellung dieser Arbeit, zeigten sich keine statistisch signifikanten Unterschiede in der Häufigkeit einer pathologischen, also verminderten oder nur unterbrochen darstellbaren, RapheEchogenität zwischen der Vergleichsgruppe der bipolar erkrankten Probanden (n=36) und der gesunden Kontrollgruppe (n=15). Auch zwischen den einzelnen Subgruppen und der gesunden Kontrollgruppe waren keine statistisch signifikanten Unterschiede der Raphe-Darstellungen feststellbar (Abbildung 4). Dies entspricht den Befunden von Becker (1995 c), welche besagen, dass eine pathologische Raphe-Echogenität, also eine Raphe-Hypoechogenität, spezifisch für die Major Depression ist, nicht jedoch für die bipolare Störung. In der Studie von Becker wurde sogar eine leichtgradig erhöhte Raphe-Echogenität bei bipolaren Patienten beschrieben, wobei jedoch eine 4-stufige Bewertungsskala zur Klassifikation der Raphe-Region (nicht sichtbar, vermindert, normal und verstärkt) verwendet wurde. Wie schon im Kapitel II „Patienten und Methodik“ beschrieben, verwendeten wir in vorliegender Arbeit eine 3-stufige Bewertungsskala (nicht sichtbar, reduziert, normal) der Raphe-Echogenität. Die Ergebnisse von Becker et al. sind mit den Befunden der vorliegenden Arbeit somit nicht vollständig vergleichbar. Bezüglich der pathophysiologischen Bedeutung der Raphe-Hypoechogenität besteht in der Forschung bisher kein Konsens. In einigen Studien wird vermutet, dass eine Raphe-Hypoechogenität, welche signifikant häufig bei Patienten mit einer Major Depression (Walter et al., 1995 c) und 47 bei Patienten mit einer Depression im Rahmen einer Parkinson Erkrankung beobachtet wird (Berg et al., 1999 b; Walter et al., 2007 c), möglicherweise einen strukturellen Defekt der Hirnstammraphe und somit eine Beeinträchtigung der serotoninergen Innervation darstellt (Becker et al., 1995 c; Becker et al., 2001). An dieser Stelle ist in die Diskussion miteinzubeziehen, dass bei etwa 10 % der gesunden Allgemeinbevölkerung eine Raphe-Hypoechogenität, also eine vermindert oder nicht sichtbare Raphe-Region in der TCS, vorliegen kann (Becker et al., 2001). In dieser Arbeit ist den Prozentangaben über die Häufigkeit der pathologischen Hypoechogenität der Raphe-Struktur zu entnehmen, dass es in jeder der vier Untersuchungsgruppen Probanden gab, die eine pathologische Raphe-Hypoechogenität aufwiesen. Auch in der gesunden Kontrollgruppe finden sich drei von 15 Probanden mit einer pathologischen Raphe-Darstellung. Zusammenfassend gibt es in dieser Studie also ebenfalls keinen signifikanten Hinweis auf eine pathologische Raphe-Echogenität bei bipolarer Störung. Folglich ist für die bipolare Störung weniger ein struktureller Defekt der Hirnstammraphe anzunehmen, wie es im Rahmen der Major Depression vermutet wird, sondern es stellt sich vielmehr die Frage nach einer möglichen funktionellen Störung der Raphe-Region. In dieser Überlegung ist die Tatsache zu bedenken, dass eine pathologische Raphe-Hypoechogenität und damit eine mögliche strukturelle Schwäche dieser Region, auch bei unterschiedlichen depressiven Syndromen wie zum Beispiel einer Anpassungsstörung (Walter et al., 2007 a) sowie bei einer Depression im Rahmen einer Parkinson Erkrankung (Berg et al., 1999 b) statistisch signifikant häufig vorkommt. Dies lässt vermuten, dass eine Raphe-Hypoechogenität eventuell eine Anfälligkeit für depressive Reaktionen bedeuten könnte (Walter et al., 2007 a). Überträgt man diese Hypothese auf die Ergebnisse dieser Arbeit, würde dies jedoch für die bipolaren und gesunden Probanden gleichermaßen zutreffen, da die bipolar erkrankten Probanden die Raphe-Hypoechogenität nicht signifikant häufiger als die gesunden Probanden aufwiesen. Interessanterweise ergaben sich jedoch Zusammenhänge zwischen der angewendeten Raphe-Skalierung und den klinischen Variablen, wie zum Beispiel den klinischen Testergebnissen. In der Gruppe der aktuell bipolar depressiv erkrankten Probanden korrelierten HAM-D- und MADRS signifikant mit Raphe48 Werten. Das bedeutet, dass in dieser Gruppe ein hoher Grad an Depressivität, also ein hoher Punktwert in HAM-D und MADRS, mit einer pathologischen Raphe-Darstellung einhergeht. Je depressiver die Probanden in dieser Gruppe waren, desto pathologischer stellte sich die Raphe-Region in der TCS dar. Diese Korrelation widerspricht jedoch den Ergebnissen von Walter (2007 a), welche keinen Zusammenhang zwischen Raphe-Echogenität und dem (ebenso durch HAM-D und MADRS gemessenen) Schweregrad der Depressivität in verschiedenen Gruppen unipolar depressiver Patienten erkennen ließen. Wurden jedoch alle depressiven Gruppen zusammengeschlossen, wiesen Patienten mit reduzierter Raphe-Echogenität niedrigere Depressionswerte im HAM-D und MARDS auf als Patienten ohne erkennbare Raphe-Pathologie. Auch wenn sich diese Assoziation in der vorliegenden Studie in der bipolar depressiven Gruppe genau entgegengesetzt darstellt, also hohe Depressionswerte mit RapheHypoechogenität korrelieren, ist zu bedenken, dass es sich in der Studie von Walter ausschließlich um Patienten mit verschiedenen Verlaufsformen einer Depression handelte. Die Diskrepanz erfordert weitere Forschung, um dieses Phänomen zu überprüfen. Da bereits bekannt ist, dass eine Raphe-Pathologie bei einer Major Depression statistisch signifikant häufiger vorkommt als bei Gesunden, könnte vermutet werden, dass sich dieses Phänomen auch bei leichter depressiver Symptomatik zeigt, also auch nicht unbedingt mit dem Schweregrad der Depressivität zusammenhängt. Bei den bipolar erkrankten Patienten hingegen könnte man annehmen, dass bei einer Raphe-Pathologie die depressive Symptomatik ausgeprägter ist. Es könnte sein, dass Patienten mit einer bipolaren Störung in Kombination mit einer Raphe-Hypoechogenität, also einer möglicherweise strukturell schwachen Raphe-Region, zu schwereren depressiven Verläufen neigen. Auch in Bezug auf gesunde Probanden mit einer RaphePathologie wird derzeit spekuliert, ob dies ein Vulnerabilitätsfaktor für die Entwicklung einer depressiven Erkrankung ist (Walter et al., 2007 a). In der Gruppe der manischen Patienten konnten keine Korrelationen zwischen der Raphe-Skalierung und den klinischen Variablen gefunden werden. Dies ist eventuell auf die geringe Stichprobengröße (8 Patienten) zurückzuführen. Auch in der Gruppe der remittierten Patienten ergab sich keine statistisch signifikante Korrelation zwischen den Raphe-Werten und den klinischen Tests. Es stellt sich 49 die Frage, ob die statistisch signifikanten Ergebnisse aufgrund einer Varianzeinschränkung durch die Kategorisierung der Gruppen zu erklären ist. Ein solches statistisches Artefakt ist jedoch weitgehend auszuschließen, da alle Untersuchungsgruppen kategorisiert wurden. Auch in der Vergleichsgruppe aller bipolar erkrankten Probanden konnten keine statistisch relevanten Korrelationen diesbezüglich berechnet werden. Bei den Selbstbeurteilungsbögen (BDI, MSS) sind ebenfalls in allen Gruppen keine signifikanten Korrelationen in Bezug auf die Raphe-Skalierung zu erkennen. Aufgrund dessen, dass die Fremdbeurteilungsskalen (HAM-D, MADRS), nicht jedoch der Selbstbeurteilungsbogen BDI zur Erfassung depressiver Symptomatik, mit pathologischen Raphe-Scores korrelierte, wurde die oben bereits erwähnte Pearson-Korrelation zwischen diesen Tests durchgeführt. Dabei ergab sich wie zuvor genauer beschrieben nach Ausschluss eines Ausreißers ein übereinstimmendes Bild zwischen Selbst- und Fremdbeurteilung. Somit relativiert sich die Nichtsignifikanz der Korrelation zwischen BDI und Raphe-Scores. Des Weiteren konnten nur noch in der Gruppe der bipolar depressiv erkrankten Probanden signifikante Korrelationen zwischen Raphe-Scores und der CGI-Skala zur Einschätzung des Schweregrades der Erkrankung, sowie dem Alter der Probanden und der Erkrankungsdauer seit Erstdiagnose der bipolaren Störung ermittelt werden. Die Korrelation der CGISkala und den Raphe-Werten in der bipolar depressiven Gruppe ist als eine weitere Bestätigung des bereits gewonnenen Ergebnisses zu sehen, dass eine schwere depressive Symptomatik in dieser Gruppe signifikant häufig mit pathologischen Raphe-Scores einherging. Das Alter und die Erkrankungsdauer der depressiven Patienten in dieser Gruppe könnten ebenso zusätzliche Faktoren für eine ausgeprägte Intensität der depressiven Symptomatik darstellen. Dies ist in diesem Fall jedoch rein spekulativ und könnte weiter untersucht werden. In Bezug auf die Fehlermöglichkeiten der statistischen Berechnungen, ist nochmals die geringe Fallzahl dieser Studie zu erwähnen. Da es sich jedoch um eine Pilotstudie handelt, sollen die Ergebnisse zunächst vielmehr eine Grundlage für weitere Untersuchungen darstellen. Die geringe Fallzahl ließ zudem einen Gruppenvergleich bezüglich der Medikation statistisch nicht sinnvoll erscheinen. 50 Zusammenfassend ist das wesentliche Ergebnis dieser Studie, das eine in der TCS pathologisch darstellbare Raphe-Region, die auch bei 10-15 % der Allgemeinbevölkerung vorkommen kann, bei den bipolar depressiven Patienten mit einer stärker ausgeprägten depressiven Symptomatik einherging. Es bietet sich an, in weiteren Studien mit größeren Fallzahlen zu untersuchen, ob sich das Ergebnis dieser Studie in einem größeren Rahmen replizieren lässt. Ein neuer Ansatz wäre darüber hinaus, die zum Untersuchungszeitpunkt manischen Patienten dieser Studie mit einer pathologischen Raphe-Echogenität in einer depressiven Episode zu untersuchen, um festzustellen, ob sich auch in diesen Fällen eine pathologische Raphe-Region erfassen ließe. An dieser Stelle ist zu erwähnen, dass eine Probandin dieser Studie zweimal, in einer manischen und in einer depressiven Episode, untersucht wurde. Hierbei stellte sich bei der Patientin zunächst in der manischen Phase eine pathologische Raphe-Region in der TCS dar. Als diese Patientin in einer depressiven Episode ein zweites Mal mittels TCS untersucht wurde, stellte sich die Raphe-Region nach wie vor unterbrochen dar und interessanterweise zeigten sich in den Depressionsskalen hohe Werte von 26 Punkten (HAM-D) und 32 Punkten (MADRS), also eine stark ausgeprägte Symptomatik im Vergleich zu den anderen bipolar depressiven Patienten. Inwieweit die gewonnenen Ergebnisse auch zu klinischen Konsequenzen führen, wäre wichtig zu untersuchen. Hierfür ist weitergehend zu klären, was im neurophysiologischen Sinne eine pathologische Raphe-Echogenität bedeutet (Becker et al., 2001) und ob diese veränderte Raphe-Darstellbarkeit möglicherweise auch Einfluss auf das Ansprechen auf bestimmte psychopharmakologische Medikation nimmt. Oder eine langjährige Medikation gegebenenfalls zu einer Veränderung der Raphe-Region führen kann. Abgesehen von der bipolaren Erkrankung ist auch der teilweise bei Gesunden feststellbare pathologische Raphe-Befund im Hinblick auf einen möglichen Vulnerabilitätsfaktor für depressive Symptome im Lebensverlauf ein ebenfalls möglicher Ansatz für weitere Studien. 51 VI. Zusammenfassung In der vorliegenden Arbeit geht es um die Untersuchung der bildgebenden diagnostischen Möglichkeiten der transkraniellen Hirnparenchym-Sonographie (TCS) bei bipolarer Störung. Der Forschungsschwerpunkt ist hierbei die Untersuchung der Echogenität der mesencephalen Raphe-Region mittels TCS bei bipolar affektiven Patienten in Abhängigkeit vom aktuellen Zustandsbild. In verschiedenen TCS-Studien konnte eine verminderte oder unterbrochene RapheEchogenität bei Patienten mit einer Major Depression nachgewiesen werden. In bisher nur einer Studie wurde die Raphe-Echogenität auch bei bipolardepressiven Patienten untersucht mit dem Ergebnis, dass bipolare Patienten insgesamt regelrechte Raphe-Echogenitäten aufwiesen. Die unterschiedlichen Zustände, also Episoden (depressiv, manisch, remittiert) der bipolar Erkrankten, wurden dabei jedoch nicht berücksichtigt. Somit stellt sich die Frage, ob sich das Bild der Raphe-Echogenität in der TCS möglicherweise in den verschiedenen Erkrankungsphasen der bipolaren Störung unterschiedlich darstellt. Um eine klare Klassifizierung des aktuellen Zustandbildes der Probanden sowie die Einhaltung der Ein- und Ausschlusskriterien zu gewährleisten, wurden depressive sowie manische Episoden mittels standardisierter psychometrischer Testverfahren (HAM-D, YMRS, MINI-SKID) und Selbstbeurteilungsbögen (BDI, MSS) erfasst beziehungsweise ausgeschlossen. Demographische und somatische Basisdaten wurden anhand eines Anamnesebogens erhoben. Die sonographische Beurteilung des Hirnparenchyms erfolgte anhand eines etablierten Untersuchungsprotokolls in standardisierten Untersuchungsebenen. Die RapheRegion wurde dabei durch eine 3-stufige Raphe-Skalierung bewertet. Zur statistischen Analyse der gesammelten Daten wurde das Gesamtkollektiv in drei Gruppen eingeteilt: Patienten in Remission (n=14), mit depressiver Episode (n=14) und manischer Episode (n=8). Zum Vergleich wurde eine gesunde Kontrollgruppe (n=15) untersucht. Mit Blick auf die Ergebnisse zeigten sich keine statistisch signifikanten Unterschiede in der Häufigkeit des Nachweises einer pathologischen RapheEchogenität zwischen der Vergleichsgruppe der bipolaren Patienten und der 52 Kontrollgruppe und auch nicht zwischen den einzelnen Untersuchungsgruppen der bipolaren Patienten. Es ergaben sich signifikante Korrelationen zwischen der angewandten RapheSkalierung und den HAM-D- und MADRS-Scores in der Gruppe der bipolardepressiven Patienten. Somit ging eine pathologische (verminderte oder nur unterbrochen darstellbare) Raphe-Echogenität signifikant häufig mit einem hohen Grad an Depressivität einher. Je depressiver die Probanden dieser Gruppe waren, desto pathologischer stellte sich ihre Raphe-Region in der TCS dar. Das wesentliche Ergebnis dieser Studie ist somit, dass bipolar-depressive Patienten mit einer pathologischen Raphe-Echogenität in der TCS (die auch bei 10 % der Allgemeinbevölkerung vorkommen kann) signifikant häufig eine stärker ausgeprägte depressive Symptomatik im Vergleich zu den weiteren untersuchten bipolar-depressiven Patienten aufwiesen. Es könnte also sein, dass Menschen mit einer bipolaren Erkrankung in Kombination mit einer pathologischen Raphe-Echogenität in der TCS und damit möglicherweise schwach strukturierten Raphe-Region, zu einer stärker ausgeprägten depressiven Symptomatik neigen als bipolar-depressiv Erkrankte ohne diese pathologische RapheDarstellung. An dieser Stelle besteht weiterhin Forschungsbedarf auch in Bezug auf die noch ausstehende pathophysiologisch und morphologisch klärende Interpretation der Raphe-Hypoechogenität in der TCS. In Zukunft könnten sich daraus möglicherweise auch klinisch-pharmakologische Konsequenzen im Hinblick auf den klinischen Alltag ergeben. 53 VII. Literaturverzeichnis Aktories, K., Förstermann, U., Hofmann, F. B. and Starke, K. (2006). Repetitorium. Allgemeine und spezielle Pharmakologie und Toxikologie. Elsevier München Amorim, P., Lecrubier Y., Weiller, E., Hergueta, T. and Sheehan, D. (1998). DSM-III-R Psychotic Disorders: procedural validity of the Mini International Neuropsychiatric Interview (M.I.N.I.). Concordance and causes for discordance with the CIDI. European Psychiatry 13, 26-34 Angst, J. (1966). Zur Ätiologie und Nosologie endogener depressiver Psychosen. Eine genetische, soziologische und klinische Studie. Springer Berlin Assion, H. J. and Vollmoeller, W. (2006). Handbuch bipolare Störungen. Kohlhammer Stuttgart Assion, H. J. and Reinbold, H. (2007). Bipolaricum. PsychoGen Verlag Dortmund Assion, H.J., Brune, N., Schmidt, N., Aubel, T., Edel, M.A., Basilowski, M., Juckel, G. and Frommberger, U. (2009). Trauma exposure and post-traumatic stress disorder in bipolar disorder. Soc Psychiatry Psychiatr Epidemiol 44 (12), 1041-1049 Baillarger, J. (1854). De la folie à double forme. Lecons faites à la Salpêtriere dans le semestre d’été de 1854. Ann Med Psychol 6, 369-391 Barrett, T. B., Hauger, R. L., Kennedy, J. L., Sadovnick, A. D., Remick, R. A., Keck, P. E., McElroy, S. L., Alexander, M., Shaw, S. H. and Kelsoe, J. R. (2003). Evidence that a single nucleotide polymorphism in the promoter of the G protein receptor kinase 3 gene is associated with bipolar disorder. Mol Psychiatry 8 (5), 546-557 Beck, A. T., Ward, C. H., Mendelson, M., Mock, J. and Erbaugh, J. (1961). An inventory of measuring depression. Arch Gen Psychiatry 4, 561-571 Becker, G., Struck, M., Bogdahn, U. and Becker, T. (1994). Echogenicity of the brainstem raphe in patients with major depression. Psychiatry Res 55 (2), 75-84 54 Becker, G., Krone, A., Schmitt, K., Woydt, M., Hofmann, E., Lindner, A., Bogdahn, U., Gahn, G. and Roosen, K. (1995 a). Preoperative and postoperative follow-up in high-grade gliomas: comparison of transcranial color-coded real-time sonography and computed tomography findings. Ultrasound Med Biol 21 (9), 1123-1135 Becker, G., Seufert, J., Bogdahn, U., Reichmann, H. and Reiners, K. (1995 b). Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography. Neurology 45 (1), 182-184 Becker, G., Becker, T., Struck, M., Lindner, A., Burzer, K., Retz, W., Bogdahn, U. and Beckmann, H. (1995 c). Reduced echogenicity of brainstem raphe specific to unipolar depression: a transcranial color-coded real time sonography study. Biol Psychiatry 38 (3), 180-184 Becker, T., Becker, G., Seufert, J., Hofmann, E., Lange, K. W., Naumann, M., Lindner, A., Reichmann, H., Riederer, P., Beckmann, H. and Reiners, K. (1997). Parkinson’s disease and depression: evidence for alteration of the basal limbic system detected by transcranial sonography. J Neurol Neurosurg Psychiatry 63 (5), 590-595 Becker, G. and Griewing, B. (1998). Examination techniques. In: Bogdahn, U., Becker, G., Schlachetzki, F. (Hrsg.). Echoenhancers and transcranial color coded duplex sonography. Blackwell, Berlin, 219-231 Becker, G., Berg, D., Lesch, K. P. and Becker, T. (2001). Basal limbic system alteration in major depression: a hypothesis supported by transcranial sonography and MRI findings. International Journal of Neuropsychopharmacology 4, 2131 Behnke, S. and Becker, G. (2002). Sonographic imaging of the brain parenchyma. Eur J Ultrasound 16 (1-2), 73-80 Behnke, S., Wollenweber, F., Günther, V., Schröder, U., Schmidt, S., Spiegel, J. and Dillmann, U. (2007). Arbeitsgruppe Hirnparenchymsonographie. http://www.uniklinikum-saarland.de/einrichtungen/ kliniken_institute/neurologie_und_psychiatrie/neurologie/forschung/ag_neurosonolo gie/ Berg, D., Becker, D., Zeiler, B., Tucha, O., Hofmann, E., Preier, M., Benz, P., Jost, W., Reiners, K. and Lange, K. W. (1999 a). Vulnerability of the nigrostriatal system as detected by transcranial ultrasound. Neurology 53 (5), 1026-1031 55 Berg, D., Supprian, T., Hofmann, E., Zeiler, B., Jäger, A., Lange, K. W., Reiners, K., Becker, T. and Becker, G. (1999 b). Depression in Parkinson’s disease: brainstem midline alteration on transcranial sonography and magnetic resonance imaging. J Neurol 246 (12), 1186-1193 Berg, D., Siefker, C., Ruprecht-Dorfler, P. and Becker, G. (2001). Relationship of substantia nigra echogenicity and motor function in elderly subjects. Neurology 56 (1), 13-17 Berg, D., Roggendorf, W., Schröder, U., Klein, R., Tatschner, T., Benz, P., Tucha, O., Preier, M., Lange, K. W., Reiners, K., Gerlach, M. and Becker, G. (2002). Echogenicity of the substantia nigra: association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 59 (6), 999-1005 Berg, D., Godau, J. and Walter, U. (2008). Transcranial sonography in movement disorders. Lancet Neurol 7 (11), 1044-1055 Bertelsen, A., Harvald, B. and Hauge, M. (1977). A Danish twin study of manicdepressive disorders. Br J Psychiatry 130, 330-351 Blumberg, H. P., Stern, E., Ricketts, S., Martinez, D., de Asis, J., White, T., Epstein, J., Isenberg, N., McBride, P. A., Kemperman, I., Dhawan, V., Eidelberg, D., Kocsis, J. H. and Silbersweig, D. A. (1999). Rostral and orbital prefrontal cortex dysfunction in the manic state of bipolar disorder. Am J Psychiatry 156 (12), 1986-1988 Blumberg, H. P., Leung, H. C., Skudlarski, P., Lacadie, C. M., Fredericks, C. A., Harris, B. C., Charney, D. S., Gore, J. C., Krystal, J. H. and Peterson, B. S. (2003). A functional magnetic resonance imaging study of bipolar disorder: state- and trait-related dysfunction in ventral prefrontal cortices. Arch Gen Psychiatry 60 (6), 601-609 Brambilla, P., Nicoletti, M. A., Harenski, K., Sassi, R. B., Mallinger, A. G., Frank, E., Kupfer, D. J., Keshavan, M. S. and Soares, J. C. (2002). Anatomical MRI study of subgenual prefrontal cortex in bipolar and unipolar subjects. Neuropsychopharmacology 27 (5), 792-799 Brambilla, P., Harenski, K., Nicoletti, M., Sassi, R. B., Mallinger, A. G., Frank, E., Kupfer, D. J., Keshavan, M. S. and Soares, J. C. (2003). MRI investigation of temporal lobe structures in bipolar patients. J Psychiatr Res 37 (4), 287-295 56 Brieger, P. (2004). Komorbidität. In: Marneros, A. (Hrsg.). Das Neue Handbuch der Bipolaren und Depressiven Erkrankungen. Thieme, Stuttgart New York, 499-534 Budisic, M., Karlovic, D., Trkanjec, Z., Lovrencic-Huzjan, A., Vukovic, V., Bosnjak, J. and Demarin, V. (2010). Brainstem raphe lesion in patients with major depressive disorder and in patients with suicidal ideation recorded on transcranial sonography. Eur Arch Psychiatry Clin Neurosci 260 (3), 203-208 Cardno, A. G., Marshall, E. J., Coid, B., Macdonald, A. M., Ribchester, T. R., Davies, N. J., Venturi, P., Jones, L. A., Lewis, S. W., Sham, P. C., Gottesman, I. I., Farmer, A. E., McGuffin, P., Reveley, A. M. and Murray, R. M. (1999). Heritability estimates for psychotic disorders: the Maudsley twin psychosis series. Arch Gen Psychiatry 56 (2), 162-168 Craddock, N., Khodel, V., Van Eerdewegh, P. and Reich, T. (1995). Mathematical limits of multilocus models: the genetic transmission of bipolar disorder. Am J Hum Genet 57 (3), 690-702 Craddock, N. and Jones, I. (1999). Genetics of bipolar disorder. J Med Genet 36 (8), 585-594 Craddock, N. and Sklar, P. (2009). Genetics of bipolar disorder: successful start to a long journey. Trends Genet 25 (2), 99-105 Diagnostisches und statistisches Manual Psychischer Störungen, DSM-IV (1996). Dt. Bearbeitung von Sass, H., Wittchen, H.-U. and Zaudig, Hogrefe Göttingen Drevets, W. C. (1999). Prefrontal cortical-amygdalar metabolism in major depression. Ann N Y Acad Sci 877, 614-637 Dunner, D. L., Gershon, E. S. and Goodwin, F. K. (1976). Heritable factors in the severity of affective illness. Biol Psychiatry 11 (1), 31-42 Endicott, J., Spitzer, R.L., Fleiss, J.L. and Cohen, J. (1976). The Global Assessment Scale: A procedure for measuring overall severity of psychiatric disturbance. Arch Gen Psychiatry 33, 766-771 Esquirol J. E. D. (1838). Des maladies mentale. Baillière Paris 57 Falret, J. P. (1851). Marche de la folie. Gaz Hopitaux 24, 18-19 Gemar, M. C., Kapur, S., Segal, Z. V., Brown, G. M. and Houle, S. (1996). Effects of self-generated sad mood on regional cerebral activity: a PET study in normal subjects. Depression 4 (2), 81-88 Gerriets, T., Stolz, E., Modrau, B., Fiss, I., Seidel, G. and Kaps, M. (1999). Sonographic monitoring of midline shift in hemispheric infarcations. Neurology 52 (1), 45-49 Goethe, J. W. (1788). Egmont. Ein Trauerspiel in fünf Aufzügen. (3. Aufzug, 82). Göschen Leipzig Guy, W. (1976). Clinical Global Impressions (CGI). In: ECDEU Assessment Manual for Psychopharmacology. US Department of Health and Human Services, Public Health Service, Alcohol Drug Abuse and Mental Health Administration, NIMH Psychopharmacology Research branch, 218-222 Haldane, M. and Frangou, S. (2004). New insights help define the pathophysiology of bipolar affective disorder: neuroimaging and neuropathology findings. Prog Neuro-Psychopharmacol Biol Psychiatry 28, 943-960 Hamilton, M. (1960). A rating scale for depression. J Neurol Neurosurg Psychiatry 23, 56-62 Hantouche, E. G., Angst, J. and Akiskal, H. S. (2003). Factor structure of hypomania: interrelationships with cyclothymia and the soft bipolar spectrum. J Affect Disord 73 (1-2), 39-47 Hatzinger, M. (2009). Mood stabilizers. Ther Umsch 66 (6), 413-424 Hoge, E. A., Friedman, L. and Schulz, S. C. (1999). Meta-analysis of brain size in bipolar disorder. Schizophr Res 37 (2), 177-181 Kendler, K. S., Pedersen, N. L., Neale, M. C. and Mathé, A. A. (1995). A pilot Swedish twin study of affective illness including hospital- and populationascertained subsamples: results of model fitting. Behav Genet 25 (3), 217-232 Kessler, R. C., McGonagle, K. A., Zhao, S., Nelson, C. B., Hughes, M., Eshleman, S., Wittchen, H. U. and Kendler, K. S. (1994). Lifetime and 12-month 58 prevalence of DSM-III-R psychiatric disorders in the United States. Results from the National Comorbidity Survey. Arch Gen Psychiatry 51 (1), 8-19 Kleist, K. (1928). Über zykloide, paranoide und epileptoide Psychosen und über die Frage der Degenerationspsychosen. Arch Neurol Psychiatr 23, 3-37 Kraepelin, E. (1913). Psychiatrie. Ein Lehrbuch für Studierende und Ärzte. 8. Auflage. J.A. Barth Leipzig Krogias, C., Meves, S., Schoellhammer, M., Gold, R. and Andrich, J. (2009). Sonographic detection of bilateral striopallidodentate calcinosis. J Neurol 256 (2), 266-267 Krogias, C., Eyding, J. and Postert, T. (2010). Transcranial sonography in Huntington’s disease. Int Rev Neurobiol 90, 237-257 Krüger, S., Bräunig, P. and Shugar, G. (1997). Manie-Selbstbeurteilungsskala (MSS). Deutsche Bearbeitung des Self-Report Manic Inventory. Beltz Göttingen Lecrubier, Y., Sheehan, D., Weiller, E., Amorim, P., Bonora, I., Sheehan, K., Janavs, J. and Dunbar, G. (1997). The MINI International Neuropsychiatric Interview (M.I.N.I.) A short Diagnostic Structured Interview: Reliability and Validity According to the CIDI. European Psychiatry 12, 224-231 Leonhard, K. (1957). Aufteilung der endogenen Psychosen. Akademie Verlag Berlin Lish, J. D., Dime-Meenan, S., Whybrow, P. C., Price, R. A. and Hirschfeld, R. M. (1994). The National Depressive and Manic-depressive Association (DMDA) survey of bipolar members. J Affect Disord 31 (4), 281-294 Lopez-Larson, M. P., DelBello, M. P., Zimmermann, M. E., Schwiers, M. L. and Strakowski, S. M. (2002). Regional prefrontal gray and white matter abnormalities in bipolar disorder. Biol Psychiatry 52 (2), 93-100 López-Muñoz, F. and Alamo, C. (2009). Monoaminergic neurotransmission: the history of the discovery of antidepressants from 1950s until today. Curr Pharm Des 15 (14), 1563-1586 59 Luddington, N. S., Mandadapu, A., Husk, M. and El-Mallakh, R. S. (2009). Clinical implications of genetic variation in the serotonin transporter promoter region: a review. Prim Care Companion J Clin Psychiatry 11 (3), 93-102 Maes, M. and Meltzer, H. Y. (1995). The serotonin hypothesis of major depression. In: Bloom, F. E., Kupfer, D. J. (Hrsg.). Psychopharmacology. The fourth generation of progress. Raven Press New York Maier, W., Schwab, S. and Rietschel, M. (1998). Genetik affektiver Störungen. In: Helmchen, H., Henn, F., Lauter, H., Sartorius, N. (Hrsg). Psychiatrie der Gegenwart. Springer Heidelberg Manji, H. K., Chen, G., Shimon, H., Hsiao, J. K., Potter, W. Z. and Belmaker, R. H. (1995). Guanine nucleotide-binding proteins in bipolar affective disorder. Effects of long-term lithium treatment. Arch Gen Psychiatry 52 (2), 135-144 Manji, H. K., Moore, G. J. and Chen, G. (2001). Bipolar disorder: leads from the molecular and cellular mechanisms of action of mood stabilisers. Br J Psychiatry 178 (41), 107-119 Marneros, A. (Hrsg.). (1999). Handbuch der unipolaren und bipolaren Erkrankungen. Thieme Stuttgart Mendlewicz, J. and Rainer, J. D. (1977). Adoption study supporting genetic transmission in manic-depressive illness. Nature 268, 327-329 Mijajlovic, M.D. (2010). Transcranial sonography in depression. Int Rev Neurobiol 90, 259-272 Montgomery, S. A. and Asberg, M. (1979). A new depression scale designed to be sensitive to change. Br J Psychiatry 134, 382-389 Neele, E. (1949). Die phasischen Psychosen nach ihrem Erscheinungs- und Erbbild. J.A. Barth Leipzig Perris, C. (1966). A study of bipolar (manic-depressive) and unipolar recurrent depressive psychoses. Acta Psychiatr Scand Suppl 194, 9-14 Postert, T., Lack, B., Kuhn, W., Jergas, M., Audrich, J., Braun, B., Przuntek, H., Sprengelmeyer, R., Agelink, M. and Büttner, T. (1999). Basal ganglia alterations 60 and brain atrophy in Huntigton’s disease depicted by transcranial real time sonography. J Neurol Neurosurg Psychiatry 67 (4), 457-462 Potash, J. B. and DePaulo, J. R., Jr. (2000). Searching high and low: a review of the genetics of bipolar disorder. Bipolar Disord 2 (1), 8-26 Reinbold, H. and Assion, H. J. (2006). Psychogenicum. Biochemie der Psychopharmaka. Differenzierter Umgang mit Antipsychotika. Geschlechtsspezifische Besonderheiten in der Psychopharmakotherapie. Psycho Gen Dortmund Reinbold, H. and Assion, H. J. (2007). Antidepressiva. Pharmakologische und klinische Aspekte. Psycho Gen Dortmund Robins, L. N. and Regier, D. A. (1991). Psychiatric Disorders in America: The Epidemiologic Catchment Area Study. Free Press New York Schneider, F., Gur, R. E., Mozley, L. H., Smith, R. J., Mozley, P. D., Censits, D. M., Alavi, A. and Gur, R. C. (1995). Mood effects on limbic blood flow correlate with emotional self-rating: a PET study with O15-labeled water. Psychiatry Res 61, 265-283 Schoning, M., Grunert, D. and Stier, B. (1989). Transcranial duplex sonography through intact bone: a new diagnostic procedure. Ultraschall Med 10 (2), 66-71 Seidel, G., Kaps, M. and Dorndorf, W. (1993). Transcranial color-coded duplex sonography of intracerebral hematomas in adults. Stroke 24 (10), 1519-1527 Seidel, G., Kaps, M., Gerriets, T. and Hutzelmann, A. (1995). Evaluation of the ventricular system in adults by transcranial duplex sonography. J Neuroimaging 5 (2), 105-108 Sheehan, D. V., Lecrubier Y., Harnett-Sheehan, K., Janavs, J., Weiller, E., Bonara, L. I., Keskiner, A., Schinka, J., Knapp, E., Sheehan, M. F. and Dunbar G. C. (1997). Reliability and Validity of the MINI International Neuropsychiatric Interview (M.I.N.I.) (According to the SCID-P and its reliability). European Psychiatry 12, 232-241 Sheehan, D. V., Lecrubier Y., Sheehan, K. H., Amorim, P., Janavs, J., Weiller, E., Hergueta, T., Baker, R. and Dunbar, G. C. (1998). The Mini-International Neuropsychiatric Interview (M.I.N.I.) (the development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10). J Clin Psychiatry 59 Suppl 20, 22-33; quiz 34-57 61 Sjøholt, G., Ebstein, R. P., Lie, R. T., Berle, J. Ø., Mallet, J., Deleuze, J. F., Levinson, D. F., Laurent, C., Mujahed, M., Bannoura, I., Murad, I., Molven, A. and Steen, V. M. (2004). Examination of IMPA1 and IMPA2 genes in manicdepressive patients: association between IMPA2 promoter polymorphisms and bipolar disorder. Mol Psychiatry 9 (6), 621-629 Soares, J. C. (2003). Contributions from brain imaging to the elucidation of pathophysiology of bipolar disorder. Int J Neuropsychopharmacol 6 (2), 171-180 Strakowski, S. M., DelBello, M. P., Sax, K. W., Zimmermann, M. E., Shear, P. K., Hawkins, J. M. and Larson, E. R. (1999). Brain magnetic resonance imaging of structural abnormalities in bipolar disorder. Arch Gen Psychiatry 56 (3), 254260 Strakowski, S. M., DelBello, M. P., Zimmermann, M. E., Getz, G. E., Mills, N. P., Ret, J., Shear, P. and Adler, C. M. (2002). Ventricular and periventricular structural volumes in first- versus multiple-episode bipolar disorder. Am J Psychiatry 159 (11), 1841-1847 Trepel, M. (2004). Neuroanatomie. Struktur und Funktion. Elsevier München Vlaar, A. M., Bouwmans, A., Mess, W. H., Tromp, S. C. and Weber, W. E. (2009). Transcranial duplex in the differential diagnosis of parkinsonian syndromes.A systematic review. J Neurol 256 (4), 530-538 Walter, U., Wittstock, M., Benecke, R. and Dressler, D. (2002). Substantia nigra echogenicity is normal in non-extrapyramidal cerebral disorders but increased in Parkinson’s disease. J Neural Transm 109 (2), 191-196 Walter, U., Niehaus, L., Probst, T., Benecke, R., Meyer, B. U. and Dressler, D. (2003). Brain parenchyma sonography discriminates Parkinson’s disease and atypical parkinsonian syndromes. Neurology 60 (1), 74-77 Walter, U., Dressler, D. and Benecke, R. (2004). Hirnparenchym-Sonographie zur Früh- und Differenzialdiagnostik der Parkinson-Krankheit. Akt Neurol 31, 325-332 Walter, U., Prudente-Morrissey, L., Herpertz, S. C., Benecke, R. and Hoeppner, J. (2007 a). Relationship of brainstem raphe echogenicity and clinical findings in depressive states. Psychiatry Res 155 (1), 67-73 62 Walter, U., Behnke, S., Eyding, J., Niehaus,L., Postert, T., Seidel, G. and Berg, D. (2007 b). Transcranial brain parenchyma sonography in movement disorders: state of the art. Ultrasound Med Biol 33 (1), 15-25 Walter, U., Hoeppner, J., Prudente-Morrisey, L., Horowski, S., Herpertz, S. C. and Benecke, R. (2007 c). Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain 130, 1799-1807 Washizuka, S., Kakiuchi, C., Mori, K., Kunugi, H., Tajima, O., Akiyama, T., Nanko, S. and Kato, T. (2003). Association of mitochondrial complex I subunit gene NDUFV2 at 18p11 with bipolar disorder. Am J Med Genet B Neuropsychiatr Genet 120 (1), 72-78 Weissman, M. M., Bland, R. C., Canino, G. J., Faravelli, C., Greenwald, S., Hwu, H. G., Joyce, P. R., Karam, E. G., Lee, C. K., Lellouch, J., Lépine, J. P., Newman, S. C., Rubio-Stipec, M., Wells, J. E., Wickramaratne, P. J., Wittchen, H. and Yeh, E. K. (1996). Cross-national epidemiology of major depression and bipolar disorder. Jama 276 (4), 293-299 Wender, P. H., Kety, S. S., Rosenthal, D., Schulsinger, F., Ortmann, J. and Lunde, I. (1986). Psychiatric disorders in the biological and adoptive families of adopted individuals with affective disorders. Arch Gen Psychiatry 43 (10), 923929 Wernicke, C. (1906). Grundrisse der Psychiatrie in klinischen Vorlesungen. Thieme Leipzig Young, R. C., Biggs, J. T., Ziegler, V. E. and Meyer, D. A. (1978). A rating scale for mania: reliability, validity and sensitivity. Br J Psychiatry 133, 429-435 Yurgelun-Todd, D. A., Gruber, S. A., Kanayama, G., Killgore, W. D., Baird, A. A. and Young, A. D. (2000). fMRI during discrimination in bipolar affective disorder. Bipolar Disord 2, 237-248 63 VIII. Anhang 8.1 Patientenaufklärungsbogen 64 65 66 8.2 Anamnesebogen Bipolare Störung I. Personendaten Name: Vorname: Geschlecht: m w Adresse: Telefon: Geburtsdatum: Geburtsort: Alter: Nationalität: deutsch andere: Herkunft: Deutschland andere: II. Biographie, soziale Situation Schulabschluss: keiner Sonderschule Hauptschule Realschule FH Abitur Beruf/Ausbildung: Derzeitige Tätigkeit, Arbeitsstelle: Familienstand: ledig verheiratet Partnerschaft: ja nein Kinder: nein ja geschieden verwitwet Anzahl: Berufe der Eltern: Vater: Mutter: Geschwister: Brüder:_______ Schwestern:_______ Psychische Erkrankungen in der Familie: nein ja, bei: Mutter Vater Geschwister andere Alkoholabhängigkeit der Eltern: Mutter Vater Scheidung/Trennung der Eltern: ja nein Aufgewachsen bei: Eltern anderen Familienmitgliedern Heim anderes: Körperliche Gewalt in der Erziehung: ja nein Vernachlässigung durch die Eltern: ja nein III. Diagnose und Krankheitsverlauf Diagnose: Bipolar I Bipolar II Rapid Cycling Letzte Episode: Manie Depression Gemischt Dauer (Tage):_________ Anzahl Episoden bis heute: Manien:_____ Depressionen:_____ Psychiatrische Erstdiagnose: ______________________________________ Jahr:____ 67 Diagnose Bipolare Störung (Jahr):_____________ Klinikaufenthalte (Psych.): Jahr __________ Dauer _______ Jahr __________ Dauer _______ Jahr __________ Dauer _______ Jahr __________ Dauer _______ Jahr __________ Dauer _______ Anzahl insgesamt _______ Ambulante Behandlung: seit (Jahr): ________________ Weitere psychiatrische Erkrankungen: Diagnose: ____________________Jahr:____ Diagnose: ____________________Jahr:____ Suizidversuch: keiner einmal Drogenmissbrauch in der Vorgeschichte: mehrfach: _______ mal nein ja, Substanzen: ____________ IV. Somatische Störungen Hirnorganische Erkrankungen: nein ja, Diagnose: __ Stoffwechselerkrankungen: nein ja, Diagnose: __ Andere Erkrankungen: nein ja, Diagnose(n): __ Größe(cm): ___________ Gewicht(kg): ___________ Nikotinabusus: nein ja, Menge und Dauer: __ Alkohol: nein ja, Menge und Dauer: __ Drogen aktuell: nein ja, Substanz und Dosis: __ V. Therapie Aktuelle psychiatrische Medikation: Substanz 1: __________________________________ Substanz 2: __________________________________ Substanz 3: __________________________________ Substanz 4: __________________________________ Substanz 5: __________________________________ Psychotherapie: nein ja, Dauer: ____________ Elektrokrampftherapie (ECT): nein ja Regelmäßige Medikamenteneinnahme?: ja nein Überzeugt von Wirksamkeit der Medikation?: ja nein 68 8.3 Beck Depression Inventar (BDI) 69 70 8.4 Manie-Selbstbeurteilungsskala (MSS) 71 72 73 8.5 Hamilton Depression Rating Scale (HAM-D) 74 75 76 77 8.6 Montgomery Asberg Depression Rating Scale (MADRS) 78 79 8.7 Young Mania Rating Scale (YMRS) 80 81 8.8 Global Assessment of Functioning Scale (GAF) 82 8.9 Clinical Global Impression Scale (CGI) 83 Danksagung Hiermit möchte ich mich bei allen bedanken, die zur Realisation der Studie beigetragen haben. Zuallererst danke ich Herrn PD Dr. H.-J. Assion für die Überlassung dieses interessanten Themas und die stets engagierte und kontinuierliche Betreuung. Herrn Dr. C. Krogias danke ich für die gute Zusammenarbeit, wodurch eine interdisziplinäre Arbeit überhaupt möglich wurde. Besonderer Dank gilt allen Patienten, die vertrauensvoll und interessiert an der Studie teilgenommen haben. An dieser Stelle ist auch die Selbsthilfegruppe für bipolar Erkrankte und Angehörige „Change of Moods“ zu nennen. Danken möchte ich auch den Mitarbeitern der LWLUniversitätsklinik Bochum für ihre Freundlichkeit und Hilfsbereitschaft in vielen organisatorischen Fragen. Dirk Scheele möchte ich danken für eine motivierende Einführung in die statistischen Analysen und Geduld bei vielen statistischen Fragen. Zu guter Letzt danke ich Herrn Michael Cronrath und Herrn Ulrich Mischke für das Korrekturlesen und meiner Mutter für ihre beständige Unterstützung während des Studiums. Lebenslauf Name: Kija Maria Mikelsons, geborene Hoffmann Geboren: 09.10.1983 in Essen Familienstand: ledig Staatsangehörigkeit: deutsch Schulausbildung 1990-1992 Grundschule Muhrenkamp, Mülheim 1992-1994 Grundschule Ludgerus, Essen-Werden 1994-2003 Gymnasium Essen-Werden 2003 Allgemeine Hochschulreife Universitärer Werdegang Oktober 2003 Beginn des Studiums der Humanmedizin an der Ruhr-Universität Bochum im Modellstudiengang Juni 2006 1. Ärztliche Prüfung Mai 2011 2. Ärztliche Prüfung 2004, 2005, 2008 Allgemeinmedizinische Praxis, Siegen zweiwöchige Hospitationen März 2006 Pädiatrische Praxis, Bochum Hospitation Juli 2006 Westfälische Klinik Dortmund Famulatur in der Abteilung für Psychosomatische Medizin und Psychotherapie April 2007 Kliniken Essen-Süd Famulatur in der Abteilung für Gynäkologie und Geburtshilfe August 2009-August 2010 Praktisches Jahr 1. Tertial: Chirurgie, Allgemeines Krankenhaus Hagen 2. Tertial: Psychosomatik, Berner Klinik, Schweiz 3. Tertial: Innere Medizin, Allgemeines Krankenhaus Hagen November 2009 Lehrreich-Preis der Ruhr-Universität Bochum für die Mitarbeit in dem Projekt „Das schwierige Gespräch“