1 Tw
Werbung

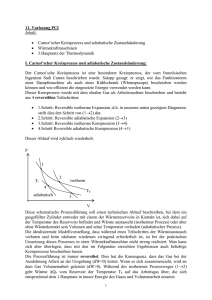
ENTROPIE ____________________________________________________________________ Problem: 1. HS beschreibt die Änderung der Inneren Energie eines Systems beim Übergang zwischen zwei Zuständen. Allerdings beschreibt der 1. HS nicht die Richtung, in die sich das System freiwillig bewegt (also wenn man es sich selbst überläßt). Viele Prozesse sind irreversibel, haben also eine ganz klare Richtungsabhängigkeit (Ausgleichsprozesse: Expansion ins Vakuum => Joule’scher Versuch, Wärmefluss der Wärme von warm nach kalt, Mischvorgänge; auch Reibung führt bekanntlich zu irreversiblem Energieverlust). Unter Einführung der Entropie kann die Richtungsabhängigkeit nun klar bestimmt werden. Der 2. HS besagt dann, dass ein sich selbst überlassener Prozess so ablaufen wird, dass die Gesamt-Entropie zunimmt. Definition ENTROPIE dS = dQ T Reversible Entropieänderung bei Phasenübergang ΔS = Qtrans Δ trans H = Ttrans Ttrans Reversible Entropieänderung bei isothermer Wärmezufuhr: dS = dQrev ó T dS =dQrev T Reversibel heißt so langsam, dass immer thermisches Gleichgewicht zwischen System und Reservoir besteht (also unendlich langsame isothermische Expansion, bei welcher der Gasdruck immer dem externen Druck entspricht). Realiter: isothermische Expansion läuft nie ideal reversibel ab, d.h. das System leistet weniger Arbeit, und entnimmt dem Reservoir wegen 1. HS damit weniger Wärme dQirr < dQrev . Erhöhung der Gesamtentropie durch (irreversiblen) Wärmeübertragung von warmen auf kalten Körper: Wärmemenge dQ wird aus dem warmen Körper (Tw) abgezogen und von kaltem Körper aufgenommen (Tk <Tw). Die Entropieabnahme des warmen Körpers ist betragsmäßig geringer als die Entropieaufnahme des kalten Körpers, folglich erhöht sich die Gesamtentropie. dS = S ab + S zu = "1 1% − dQ dQ + = dQ $ − ' > 0 Tw Tk # Tk Tw & 2. HS: Bei irreversiblen (unumkehrbaren) Prozessen nimmt die Gesamt-Entropie zu. Es ist unmöglich, dass Nettowärme vom kalten Körper zum warmen Körper fließt. Wärme fließt immer von warm nach kalt (Ausgleichsprozess). Äquivalente Formulierung des 2. Hauptsatzes: Es ist nicht möglich, Wärme komplett in Nutzarbeit umzuwandeln. Ein Teil der Wärme, die einem warmen Reservoir entnommen wird, um damit Arbeit zu verrichten, wird als Abwärme an ein kaltes Reservoir abgegeben. => Eine Maschine, die einen Wirkungsgrad von 100% hätte, ließe sich nur konstruieren, wenn das kalte Reservoir am absoluten Nullpunkt wäre. Dieser läßt sich jedoch nicht erreichen. Carnot Prozess (isoth. Exp. bei Twarm von VA nach VB, isoth. Komp. bei Tkalt von VC nach VD, dazwischen reversible Adiabaten (isentrop), d.h. QC-B und QD-A =0. VB VA V V V = nRTk ln D = nRTk ln A = −nRTk ln B VC VB VA QwB−A = nRTw ln QkD−C Qwauf / Qkab = QwB−A / QkD−A = −Tw / Tk Bei der 2. Gleichung wurde die Relation VA/VB=VD/VC benutzt, die sich durch die Adiabatengleichungen ergibt. Wirkungsgrad: Bei isoth. Exp. bei Twarm von VA nach VB leistet das System die folg. Arbeit : Wout = −QwB−A Bei isoth. Kompression am System bei Tkalt von VC nach VD wird am System die folg. Arbeit geleistet: Win = QkD−C = −QwB−A Tk Tw Die Netto-Arbeit in Relation zur aufgenommenen Wärme ist also: Wout − Win −QwB−A " Tk % " Tk % = $1− ' = − $1− ' Qaufgenommen QwB−A # Tw & # Tw & Der Wirkungsgrad: Wout − Win " Tk % = $1− ' Qaufgenommen # Tw & 2. HS (Carnot Prozess) Es ist nicht möglich, eine Maschine zu konstruieren, die einem Reservoir sämtliche Wärme entzieht und diese in Arbeit umwandelt. Es ist bestenfalls möglich, die Differenzwärme zw. warmem und kaltem Reservoir in Arbeit umzuwandeln.