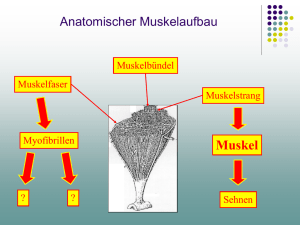
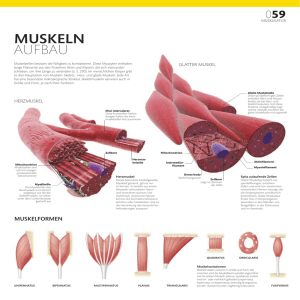
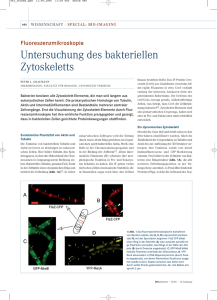
DIE ENZYMATISCHE UND CHEMISCHE VERNETZUNG VON
Werbung

DIE ENZYMATISCHE UND CHEMISCHE VERNETZUNG VON THYMOSIN β4 MIT PROTEINEN Charakterisierung der Vernetzung und Auswirkung auf die biologischen Funktionen von Thymosin β4 Der Naturwissenschaftlichen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades Dr. rer. nat. vorgelegt von Jana Knop aus Jena Als Dissertation genehmigt von der Naturwissenschaftlichen Fakultät der FriedrichAlexander-Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 06.06.2013 Vorsitzender der Promotionsorgans: Prof. Dr. Johannes Barth Gutachter/in: Prof. Dr. E. Hannappel Prof. Dr. M. Pischetsrieder ERKLÄRUNG Ich versichere, dass ich die Arbeit ohne fremde Hilfe und ohne Benutzung anderer als der angegebenen Quellen angefertigt habe und dass die Arbeit in gleicher oder ähnlicher Form noch keiner anderen Prüfungsbehörde vorgelegen hat und von dieser als Teil einer Prüfungsleistung angenommen wurde. Alle Ausführungen, die wörtlich oder sinngemäß übernommen wurden, sind als solche gekennzeichnet. Erlangen, den 25.02.2013 Jana Knop ZUSAMMENFASSUNG Im Rahmen dieser Arbeit wurden intrazelluläre und extrazelluläre Interaktionsmöglichkeiten von Thymosin β4 (Tβ4) untersucht. Die intrazelluläre Interaktion zwischen Tβ4 und Aktin ist in der Literatur bereits vielfach beschrieben wurden. Durch chemische Vernetzung mit 1-Ethyl3-(3-dimethylaminopropyl)carbodiimid (EDC) und HPLC-ESI-MS konnte in dieser Arbeit die Interaktion lokalisiert werden: Tβ4 maskiert G-Aktin in einer gestreckten Konformation an den Subdomänen 1 bis 3. Die Untersuchungen von extrazellulären Interaktionen von Tβ4 setzten dessen Freisetzung aus Zellen voraus. Der Freisetzungsmechanismus wurde an Jurkatzellen nach Zellmembranschädigung durch verschiedene Noxen untersucht. Durch gleichzeitige Bestimmung der Freisetzung von Lactatdehydrogenase als Marker für Zelltoxizität konnte nachgewiesen werden, dass Tβ4 erst nach Verlust der Integrität der Zellmembran freigesetzt wird. Ein bekannter extrazellulärer Interaktionspartner von Tβ4 ist Faktor XIIIa (Transglutaminase), der Tβ4 im Rahmen der Blutgerinnungskaskade an Fibrin binden kann. Mittels eines modifizierten ELISAs wurde nach weiteren Substratpartnern für diese enzymatische Vernetzungsreaktion gesucht. Neben Kollagen, Fibrinogen und Fibrin konnte zusätzlich Fibronektin als neuer Substratpartner zur Vernetzung von Tβ4 mittels Transglutaminase identifiziert werden. Die Vernetzungsreaktionen wurden dabei mit einer mikrobiellen Transglutaminase (mTGA) durchgeführt. Durch HPLC-ESI-MS-Analyse der Vernetzungsprodukte konnte Tβ4 sowohl als Glutaminyl-, als auch als Lysylsubstrat der mTGA identifiziert werden. Sowohl die lysinreiche zentrale Region als auch Q39 in der Cterminalen Region von Tβ4 waren an der enzymatischen Vernetzungsreaktion beteiligt. Die Auswirkung der enzymatischen Vernetzung auf die biologischen Effekte von Tβ4 wurde in einem Wundheilungs-Assay mit hepatischen Sternzellen bestimmt. Die Vernetzung von Tβ4 führte dabei zum Verlust seiner inhibitorischen Wirkung auf die PDGF-induzierte Migration der Zellen. Aus dieser Erkenntnis heraus wurde eine mögliche extrazelluläre Interaktion zwischen Tβ4 und PDGF untersucht. Durch chemische Vernetzung mit EDC konnte diese bestätigt werden. PDGF ist damit ein potentieller extrazellulärer Interaktionspartner von Tβ4. -I- ABSTRACT Investigations on putative intracellular and extracellular interaction partners of thymosin β4 were carried out within this thesis. While the intracellular interaction between thymosin β4 and G-actin is well established, it was possible to localize the interaction site using the cross linker 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide (EDC) and HPLC-ESI-MS: Thymosin β4 binds in an extended conformation to the subdomains 1 to 3 of G-actin. After the release of thymosin β4 from cells, extracellular interactions are also possible. To analyze the release mechanism in more detail, the membranes of Jurkat cells were challenged with different harmful stimuli. The concomitant release of thymosin β4 and lactate dehydrogenase indentified cell death as prerequisite for the release of thymosin β4. One extracellular interaction partner of thymosin β4 is factor XIIIa (transglutaminase), which is known to catalyze the crosslinking reaction of thymosin β4 to fibrin. To identify further candidates for the crosslinking of thymosin β4 a modified ELISA was used. Apart from the known substrates collagen, fibrin and fibrinogen another protein, fibronectin, was found to react with thymosin β4 catalyzed by transglutaminase. The crosslinking reactions were carried out using a microbial transglutaminase. HPLC-ESI-MS-analyses identified thymosin β4 both as glutaminyl and amine substrate of the microbial transglutaminase. The lysine-rich central part as well as Q39 in the C-terminal region of thymosin β4 were involved in the crosslinking reaction. The effect of the crosslinking of thymosin β4 on its biological activities was analyzed in a wound healing assay using hepatic stellate cells. The crosslinking of thymosin β4 led to the loss of its inhibitory activity on PDGF-induced migration of the cells. Based on this finding, the interaction between thymosin β4 and PDGF was further investigated. Chemical crosslinking using EDC confirmed the interaction and identified PDGF as a new putative extracellular interaction partner of thymosin β4. - II - INHALTSVERZEICHNIS 1 EINLEITUNG UND PROBLEMSTELLUNG .................................................................. 10 1.1 β-Thymosine................................................................................................................10 1.2 Thymosin β4.................................................................................................................11 1.3 Biologische Funktionen von Thymosin β4 ...............................................................12 1.4 Die Interaktion von Thymosin β4 und Aktin..............................................................14 1.5 Weitere Interaktionspartner von Thymosin β4 .........................................................15 1.6 Thymosin β4 als Substrat der Transglutaminase.....................................................17 1.7 Thymosin β4 in klinischen Studien............................................................................18 1.8 Problemstellung ..........................................................................................................20 2 MATERIAL .......................................................................................................... 21 2.1 Chemikalien und Reagenzien ....................................................................................21 2.2 Spezielle Reagenzien..................................................................................................22 2.3 Material und Geräte ....................................................................................................23 2.4 Zellen............................................................................................................................24 2.5 Antikörper ....................................................................................................................24 2.6 Proteinmarker..............................................................................................................24 2.7 Puffer............................................................................................................................25 2.8 Verwendete Software und Programme .....................................................................25 3 METHODEN ........................................................................................................ 26 3.1 Biochemische Methoden............................................................................................26 3.1.1 Gelelektrophorese ....................................................................................................................... 26 3.1.1.1 Diskontinuierliche SDS-PAGE ................................................................................ 26 3.1.1.2 Coomassieblau-Färbung......................................................................................... 27 3.1.1.3 Silberfärbung........................................................................................................... 27 3.1.2 Proteintransfer mit Immunodetektion .......................................................................................... 28 3.1.2.1 Semi-dry Western Blot ............................................................................................ 28 3.1.2.2 Chemilumineszenzdetektion ................................................................................... 29 3.1.3 Modifizierter ELISA...................................................................................................................... 29 - III - 3.1.4 Zytotoxizitätstest.......................................................................................................................... 30 3.1.5 TGA-Enzymaktivitätstest............................................................................................................. 32 3.2 Bioanalytische Methoden...........................................................................................33 3.2.1 RP-HPLC mit Nachsäulenderivatisierung ................................................................................... 33 3.2.2 Aminosäureanalyse..................................................................................................................... 35 3.2.3 Proteinverdau und massenanalytische Bestimmung .................................................................. 37 3.3 3.2.3.1 Trypsin-In-Gel-Verdau............................................................................................. 37 3.2.3.2 HPLC-ESI-MS ......................................................................................................... 38 3.2.3.3 Auswertung der MS- und MS/MS-Spektren............................................................ 39 Zellbiologische Methoden ..........................................................................................40 3.3.1 Jurkatzellen ................................................................................................................................. 40 3.3.1.1 Zellkultur.................................................................................................................. 40 3.3.1.2 Zellzählung mit Trypanblau..................................................................................... 40 3.3.1.3 Schädigung der Zellmembran................................................................................. 41 3.3.2 Humane HSC .............................................................................................................................. 42 3.4 3.3.2.1 Zellkultur.................................................................................................................. 42 3.3.2.2 Wundheilungs-Assay .............................................................................................. 42 Weitere Methoden .......................................................................................................44 3.4.1 Aktinpräparation .......................................................................................................................... 44 3.4.2 Kugelfallviskosimetrie.................................................................................................................. 45 3.4.3 Vernetzung von Thymosin β4 ...................................................................................................... 46 3.4.3.1 Chemische Vernetzung mit EDC ............................................................................ 46 3.4.3.2 Enzymatische Vernetzung mit mikrobieller Transglutaminase ............................... 46 4 ERGEBNISSE ...................................................................................................... 47 4.1 Isolation und Charakterisierung von G-Aktin...........................................................47 4.1.1 Reinheit des G-Aktins ................................................................................................................. 47 4.1.2 Konzentrationsbestimmung der G-Aktinlösung........................................................................... 48 4.1.3 Polymerisation des isolierten G-Aktins........................................................................................ 49 4.1.4 Identifizierung der Aktin-Isoform ................................................................................................. 50 4.2 Der Aktin-Thymosin β4-Komplex ...............................................................................52 4.2.1 Nachweis der Komplexierung durch EDC-Vernetzung ............................................................... 52 4.2.2 Identifizierung der Vernetzungsstellen ........................................................................................ 53 4.2.2.1 Ausschluss der intramolekularen Vernetzung von Aktin......................................... 54 4.2.2.2 Vernetzungsstellen im Aktin –Thymosin β4-Komplex durch EDC........................... 55 - IV - 4.3 Freisetzungsmechanismus von intrazellulärem Thymosin β4 ................................61 4.4 Thymosin β4 als Substrat der mikrobiellen Transglutaminase...............................63 4.4.1 Charakterisierung der mTGA ...................................................................................................... 63 4.4.2 Substrate zur Vernetzung von Thymosin β4 mit Transglutaminase............................................ 65 4.4.3 Enzymatische Vernetzung von Aktin und Thymosin β4 mittels mTGA ...................................... 67 4.4.4 Vernetzungsstellen des Aktin-Thymosin β4-Addukts durch mTGA............................................. 68 4.5 Einfluss der Vernetzung von Tβ4 auf seine Inhibition der PDGF-induzierten Migration von HSC ......................................................................................................75 4.6 Interaktion zwischen Tβ4 und PDGF..........................................................................77 5 DISKUSSION ....................................................................................................... 79 5.1 Intrazelluläres Thymosin β4 und seine Interaktion mit Aktin ..................................79 5.2 Identifizierung der Vernetzungsstellen im Aktin-Tβ4-Komplex...............................79 5.3 Freisetzung von intrazellulärem Thymosin β4 ..........................................................85 5.4 Extrazelluläres Thymosin β4 ......................................................................................87 5.4.1 Substratpartner von Thymosin β4 zur enzymatischen Vernetzung............................................. 88 5.4.2 Identifizierung der Vernetzungsstellen nach Behandlung mit mTGA ......................................... 89 5.4.3 Einfluss der enzymatischen Vernetzung von Thymosin β4 auf seine antifibrotische Wirkung.... 92 5.4.4 Identifizierung von PDGF als neuen Interaktionspartner für Thymosin β4 .................................. 93 LITERATURVERZEICHNIS .............................................................................................. 95 ANHANG ...................................................................................................................101 -V- ABBILDUNGSVERZEICHNIS Abb. 1-1. Aminosäuresequenz ausgewählter β-Thymosine. ................................................................................. 10 Abb. 1-2. Darstellung der Multifunktionalität von Tβ4............................................................................................. 13 Abb. 1-3. Schematische Darstellung der Sequestrierung von G-Aktin durch Tβ4 während der Tretmühlenphase. 14 Abb. 1-4. Schematische Darstellung des Wundheilungsprozesses, verändert nach Goldstein et. al [47] ............. 18 Abb. 1-5. Stand der klinischen Studien mit Tβ4 der Firma RegeneRx. .................................................................. 19 Abb. 3-1. Schematische Darstellung des modifizierten ELISAs............................................................................. 30 Abb. 3-2. Schematische Darstellung der HPLC mit Nachsäulenderivatisierung. ................................................... 34 Abb. 3-3. Schematische Darstellung der RP-HPLC mit Vorsäulenderivatisierung................................................. 35 Abb. 3-4. Schematische Darstellung des LTQ-Orbitrap-XL Apparates (nach Thermo Scientific). ......................... 39 Abb. 4-1. Reinheit des isolierten Aktins. ................................................................................................................ 47 Abb. 4-2. Bestimmung der Aktinpolymerisation durch Kugelfallviskosimetrie........................................................ 49 Abb. 4-3. Vergleich der Aminosäuresequenzen der bovinen Isoformen des Aktins. ............................................. 51 Abb. 4-4. Nachweis der Komplexbildung zwischen Aktin und Tβ4 durch EDC-Vernetzung................................... 52 Abb. 4-5. Sequenzabdeckung durch HPLC-ESI-MS-Analyse. .............................................................................. 55 Abb. 4-6. RP-HPLC-Chromatogramme von Aktin und Aktin x Tβ4 nach EDC-Vernetzung.................................... 56 Abb. 4-7. Der C-Terminus von Tβ4 wird mittels EDC an Aktin H40 quervernetzt................................................... 58 Abb. 4-8. Der N-Terminus von Aktin wird durch EDC mit Tβ4 K18/19 quervernetzt............................................... 59 Abb. 4-9. EDC führt zur Quervernetzung zwischen Aktin E167 und Tβ4 K3.......................................................... 60 Abb. 4-10. Quantifizierung der Freisetzung von Thymosin β4 mittels RP-HPLC.................................................... 62 Abb. 4-11. Zusammenhang von Tβ4- und LDH-Freisetzung aus Jurkatzellen. ...................................................... 63 Abb. 4-12. Aktivitätsbestimmung der mikrobiellen Transglutaminase.................................................................... 64 Abb. 4-13. Reaktionsgeschwindigkeit der mTGA in Abhängigkeit vom Puffersystem. .......................................... 65 Abb. 4-14. Identifizierung neuer Substrate der mTGA zur Vernetzung von Tβ4. ................................................... 66 Abb. 4-15. Vernetzung zwischen Aktin und Tβ4 durch mikrobielle Transglutaminase. .......................................... 67 Abb. 4-16. RP-HPLC-Chromatogramme von Aktin und Aktin x Tβ4 nach mTGA-Vernetzung. .............................. 68 Abb. 4-17. mTGA führt zur Vernetzung von K61 von Aktin und Q39 von Tβ4. ...................................................... 70 Abb. 4-18. Q41 von Aktin kann durch mTGA mit K19 von Tβ4 vernetzt werden.................................................... 71 Abb. 4-19. Vernetzungsprodukt höherer Ordnung zwischen Aktin und Tβ4 durch mTGA . ................................... 73 Abb. 4-20. Verhinderung der PDGF-induzierten Migration von HSC..................................................................... 76 Abb. 4-21. Tβ4 wird spezifisch an PDGF durch EDC vernetzt. .............................................................................. 77 Abb. 4-22. Tβ10 verdrängt Tβ4 aus Interaktion mit PDGF. ...................................................................................... 78 Abb. 5-1. Reaktionsmechanismus der chemischen Vernetzung durch EDC ......................................................... 81 Abb. 5-3. 3D-Darstellung des Aktin-Tβ4-Komplexes.............................................................................................. 82 Abb. 5-4. Maskierung des G-Aktins durch Tβ4 verhindert die Polymerisation zu F-Aktin. ..................................... 84 Abb. 5-5. Strukturverwandtschaft zwischen Digitonin und Cholesterin.................................................................. 86 Abb. 5-6. Lokalisation der an der enzymatischen Vernetzung beteiligten Aminosäurereste von Aktin und Tβ4..... 91 - VI - TABELLENVERZEICHNIS Tab. 4-1. Vergleich experimentell ermittelter Aminosäureanzahl von α-cardiac muscle-Aktin durch Aminosäureanalyse mit theoretischer Anzahl. ........................................................................................... 48 Tab. 4-2. Identifizierte tryptische Fragmente des Aktin-Tβ4-Addukts durch EDC. ................................................. 57 Tab. 4-3. Zusammenfassung der EDC-Vernetzungsstellen des Aktin-Tβ4-Komplexes. ........................................ 61 Tab. 4-4. Identifizierte tryptische Fragmente des Aktin-Tβ4-Addukts durch mTGA................................................ 69 Tab. 4-5. Bewertung der identifizierten mTGA-Vernetzungsstellen des Aktin x Tβ4-Addukts mittels der Software MS Tag (ProteinProspector v 5.10.2). ........................................................................................................ 74 - VII - ABKÜRZUNGSVERZEICHNIS Dieses Kapitel enthält die in dieser Dissertation verwendeten Abkürzungen und Akronyme. In der folgenden Liste nicht aufgeführt sind Einheiten und Präfixe des Système international d‘unités (SI) sowie Symbole und Nomenklatur chemischer Verbindungen nach der International Union of Pure and Applied Chemistry (IUPAC). AbP Aktin-bindendes Protein ACN Acetonitril Akt Proteinkinase B APS Ammoniumperoxodisulfat AS Aminosäure ATP Adenosintriphosphat BSA Rinderserumalbumin DMEM Dulbecco´s Modified Eagle Medium ECL enhanced chemiluminescence EDC 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid EDTA Ethylendiamintetraacetat ESI Elektronensprayionisation et al. und andere (et altera) F-Aktin filamentöses Aktin FBS fötales Kälberserum (fetal bovine serum) FM Fließmittel GABA γ-Aminobuttersäure G-Aktin globuläres Aktin, monomeres Aktin HPLC High performance liquid chromatography HRP Meerrettichperoxidase HSC hepatische Sternzellen ILK Integrin-linked Kinase KD Dissoziationskonstante LDH Lactatdehydrogenase - VIII - M [M+H] molare Masse + Masse des einfach geladenen Molekülions m/z Masse-zu-Ladungs-Verhältnis MES 2-(N-Morpholino)ethansulfonsäure MM Molekülmasse mRNA messenger RNA MS Massenspektrometrie mTGA mikrobielle Transglutaminase n.s. nicht signifikant OPA ortho-Phtaldialdehyd PAGE Polyacrylamidgelelektrophorese PCA Perchloressigsäure PDGF Platelet-Derived Growth Factor PINCH Particularly interesting new Cys-His rich protein PVA Polyvinylalkohol RP Umkehrphase (reversed phase) RT Raumtemperatur scr Tβ4 scrambled Thymosin β4 SDS Natriumdodecylsulfat TEMED Tetramethylethylendiamin TFA Trifluoressigsäure TGA Transglutaminase THF Tetrahydrofuran Tβ4 Thymosin β4 TMB 3,3',5,5'-Tetramethylbenzidin Tris Tris(hydroxymethyl)-aminomethan Tβ4 Thymosin β4 v/v Volumenprozent pro Gesamtvolumen w/v Masseprozent pro Gesamtvolumen w/w Masseprozent pro Gesamtmasse σ Standardabweichung x arithmetischer Mittelwert - IX - Einleitung und Problemstellung 1 Einleitung und Problemstellung 1.1 β-Thymosine Die Geschichte der Thymosine begann 1964 im Labor von A. White mit der Untersuchung von Thymusextrakten [1]. Dabei wurde erstmals der Begriff „Thymosine“ für eine Polypeptidfamilie mit hormonähnlichen Eigenschaften und dramatischem Einfluss auf das Immunsystem geprägt. In den 1970ern wurde im Labor von A. Goldstein die Isolierung der Thymosine aus dem Kälberthymus optimiert (Thymosin Fraktion V) und es folgte eine Untergliederung der inhomogenen Polypeptide nach ihren pI-Werten. Polypeptide mit einem pI-Wert unter 5 wurden als α-Thymosine, mit einem pI-Wert zwischen 5 und 7 als βThymosine und mit einem pI-Wert über 7 als γ-Thymosine bezeichnet. Durch weitere Fraktionierung und Isolierung konnten einzelne biologisch aktive Polypeptide aus der Fraktion definiert werden. Anhand der chronologischen Isolierung der einzelnen Thymosine wurde zusätzlich eine tiefgestellte arabische Ziffer angefügt. Thymosin β4 (Tβ4) ist damit das vierte isolierte Peptid aus Thymosin Fraktion V mit einem pI-Wert zwischen 5 und 7. Abb. 1-1. Aminosäuresequenz ausgewählter β-Thymosine. Aminosäurereste, die sich von Tβ4 unterscheiden, sind schwarz hervorgehoben. Die Sequenzen der β-Thymosine wurden der UniProt-Datenbank entnommen. Nur die βThymosine wurden berücksichtigt, deren Existenz auf Proteinebene nachgewiesen wurde. Die Abbildung wurde mit Geneious (R6) von Biomatters erstellt (http://www.geneious.com). Nach der anfänglichen Klassifizierung durch den pI-Wert werden β-Thymosine heute nach ihrer hohen Sequenzhomologie definiert. Alle β-Thymosine bestehen aus 40 bis 44 Aminosäuren, was einer Molekülmasse von etwa 5 kDa entspricht. Die Aminosäuresequenz - 10 - Einleitung und Problemstellung ist hoch konserviert und unterscheidet sich nur in wenigen Aminosäuren vorwiegend in der N- und C-terminalen Region der Peptide (vergl. Abb. 1-1). Dabei ist der N-Terminus jedoch stets acetyliert. β-Thymosine sind sowohl in Vertebraten (Säugetiere, Fische, Frösche) als auch in Invertebraten (Seeigel) anwesend [2-7]. Lediglich in Hefen und Prokaryoten sind keine βThymosine nachweisbar [8]. Genomische Analysen zeigten, dass Invertebraten nur ein einzelnes β-Thymosin, während Vertebraten bis zu drei verschiedene β-Thymosine exprimieren [9]: Bei Landwirbeltieren handelt es sich um Tβ4, Tβ10 und Tβ15 bzw. das sehr ähnliche Tβ9. In Vögeln und Reptilien ist dabei Tβ10 durch ein differierendes β-Thymosin mit der Bezeichnung 6F ersetzt, da sich an Position 6 ein Phenylalanin befindet. Die humanen Thymosine Tβ4, Tβ10 und Tβ15 werden durch die Gene TMSB4X, TMSB10, TMSB15A und TMSB15B kodiert. Die drei Thymosine werden abhängig vom Entwicklungsstatus unterschiedlich exprimiert, wobei Tβ4 eine Hauptrolle einnimmt. 1.2 Thymosin β4 Tβ4 wurde 1981 aus einem Thymusextrakt (Thymosin Fraktion V) isoliert und sequenziert [10]. Es besteht aus 43 Aminosäuren, wovon 31 polare Aminosäuren sind. Das erklärt die gute Wasserlöslichkeit von bis zu 100 mg/ml [11]. Die Molekülmasse beträgt 4964,5 Da. Überraschenderweise zeigten neuere Messungen einen pI-Wert von 4,6 für Tβ4, obwohl βThymosine mit einem pI-Wert zwischen 5 und 7 definiert wurden [11]. Das N-terminale Serin ist acetyliert. Das Methionin an Position 6 kann zum Sulfoxid und Sulfon oxidiert werden. In wässrigem Milieu kann für Tβ4 keine räumliche Struktur definiert werden. Erst bei Zugabe von Trifluorethanol oder bei niedrigen Temperaturen bilden sich in den Abschnitten zwischen D5 und K16 sowie zwischen K31 und Q39 α-Helices aus [12-13]. Die Konformation von Tβ4 ist flexibel und ändert sich bei Bindung an Interaktionspartner. NMR-Studien belegen eine Sekundärstruktur für Tβ4 erst in Anwesenheit von G-Aktin [14]. Monomeres G-Aktin ist ein viel beschriebener Interaktionspartner von Tβ4. Tβ4 wurde in verschiedenen Säugetieren (Mensch, Rind, Schwein, Kaninchen, Ratte) nachgewiesen [8]. Es ist in allen untersuchten Geweben und Zelltypen anwesend mit der Ausnahme von Erythrozyten [15]. Die höchsten Konzentrationen wurden in polymorphkernigen Leukozyten mit 400 fg/Zelle ermittelt [16]. Neben seinem intrazellulären Vorkommen ist Tβ4 auch in extrazellulären Flüssigkeiten, wie Plasma, Tränen- und - 11 - Einleitung und Problemstellung Sulkusfluid, anwesend [17-19]. Das Gen für Tβ4 codiert keine Signalsequenz. Der Freisetzungsmechanismus aus der Zelle ist noch nicht geklärt. Es wird vermutet, dass extrazelluläres Tβ4 eine Folge von Zelltod und der damit verbundenen Freisetzung intrazellulärer Verbindungen ist [20]. Safer et al. konnten 1991 nachweisen, dass Tβ4 in humanen Thrombozyten das wichtigste G-Aktin-sequestrierende Peptid ist [21]. Diese intrazelluläre Funktion von Tβ4 wurde intensiv untersucht und konnte nachträglich auch bei allen weiteren Vertretern der β-ThymosinFamilie nachgewiesen werden. 1.3 Biologische Funktionen von Thymosin β4 Neben der intrazellulären Aktin-sequestrierenden Wirkung von Tβ4 sind eine Vielzahl von extrazellulären Effekte beschrieben wurden. Zusammengefasst spielt Tβ4 eine multifunktionale Rolle während der Regeneration und Neubildung von verletztem Gewebe (Abb. 1-2). Extrazelluläre Gaben von Tβ4 fördern die Migration von Endothel- und Myokardzellen sowie Keratinozyten und die Bildung von neuen Blutgefäßen [22-24]. Tβ4 reduziert die Narbenbildung und verhindert dadurch den Funktionsverlust von Gewebe [23]. Durch seine antiapoptotische Wirkung erhöht Tβ4 die Überlebensrate von Zellen [25]. Außerdem fördert Tβ4 die Migration und Differenzierung von Vorläuferstammzellen zu ausgereiften Zellen [24, 26-27]. Tβ4 wirkt antientzündlich durch die Herabregulation von Entzündungsmediatoren wie NFκB [28], die Reduktion der Einwanderung von Leukozyten in das verletzte Gewebe [29] sowie die Verhinderung von Infektionen durch seine antimikrobielle Wirkung [30]. Durch diese Effekte konnte Tβ4 in Tiermodellen die Regeneration und Neubildung von Gewebe und damit die Wundheilung nach oberflächlichen dermalen [31] und okularen Wunden [32] sowie nach Herzinfarkt [23, 26] und Schlaganfall [27] verbessern. In verschiedenen Tierversuchen an Ratten konnte die wundheilungsfördernde Wirkung von Tβ4 in vivo bestätigt werden. Mit Tβ4 behandelte dermale Wunden sind sowohl nach topischer als auch nach intraperitonealer Applikation schneller ausgeheilt [31]. Ebenso konnte ein positiver Effekt auf die Wundheilung der Hornhaut des Auges bei topischer Applikation nachgewiesen werden [32]. - 12 - Einleitung und Problemstellung In einem Mausmodell konnte nach induziertem Myokardinfarkt die Überlebensrate von Herzmyozytenzellen und die kardiale Funktionen durch Applikation von Tβ4 verbessert werden [23]. Die Regeneration von zerstörtem Myokardgewebe wird außerdem durch die Tβ4-stimulierte Differenzierung von epikardialen Vorläuferzellen in glatte Muskel- und Endothelzellen unterstützt [26]. Die Gabe von Tβ4 innerhalb von 24 h nach einem induzierten Schlaganfall im Tiermodell an Ratten verbesserte die neurologischen Funktionen. Es konnte eine verstärkte Myelinisierung der Axone, Remyelinisierung und Gefäßdichte nachgewiesen werden [27]. Abb. 1-2. Darstellung der Multifunktionalität von Tβ4. Die Abbildung ist verändert und erweitert nach Goldstein et al. [33]. Quelle für Grafiken: http://image.zcool.com.cn/img2/cover/21/21/1339245800572.jpg (Zugriff: 13.02.2013). Neueste Untersuchungen zu Lebererkrankungen ergaben, dass Tβ4 antifibrotisch wirkt [34]. Bei Erkrankungen der Leber werden hauptsächlich die hepatischen Sternzellen aktiviert. Diese proliferieren, migrieren in das erkrankte Lebergebiet ein und produzieren vermehrt extrazelluläre Matrix, die zur Vernarbung des Lebergewebes führt. Diese Vernarbung kann zur Leberfibrose oder letztlich zur Leberzirrhose führen. Durch die Verminderung der Proliferation und Migration der hepatischen Sternzellen durch Tβ4 kann die Vernarbung des Lebergewebes verringert und so einem Fortschreiten der Leberfibrose vorgebeugt werden [34]. - 13 - Einleitung und Problemstellung 1.4 Die Interaktion von Thymosin β4 und Aktin Aktin ist als Strukturprotein in allen eukaryotischen Zellen vorhanden und ein essentieller Bestandteil des Zytoskeletts. Das Zytoskelett ist verantwortlich für die mechanische Stabilität und äußere Form der Zellen, intrazelluläre Transporte und Fortbewegung. Eine Voraussetzung für diese Aufgaben ist die dynamische De- und Repolymerisierbarkeit von Aktin. Dabei besitzen Aktinfilamente einen (+)-Pol und einen (-)-Pol. Der (+)-Pol (engl. barbed end) ist durch die Anlagerung von monomerem Aktin (G-Aktin) und der (-)-Pol (eng. pointed end) durch die Dissoziation von G-Aktin gekennzeichnet. Dabei spielt das Aktingebundene Nukleotid eine große Rolle: G-Aktin bindet bevorzugt ATP, was die Anlagerung am Filament induziert. Im Filament findet die Hydrolyse des gebundenen ATPs zu ADP statt. Die Hydrolyse des Nukleotids schwächt die Bindungsstärke des Aktins im Filament. Am (-)Pol des Filaments dominiert durch Hydrolyse des Nukleotids die Dissoziation des G-Aktins. Das gebundene ADP der dissoziierten Monomere wird durch ATP ausgetauscht. ATPgebundenes G-Aktin steht anschließend wieder zum Einbau am (+)-Pol zur Verfügung. Dieser Prozess wird auch als Tretmühlenphase (engl. treadmilling) bezeichnet. Abb. 1-3. Schematische Darstellung der Sequestrierung von G-Aktin durch Tβ4 während der Tretmühlenphase. Nach dem Einbau des G-Aktins hydrolysiert das gebundene ATP zu ADP und induziert dadurch die Depolymerisation am (-)-Pol. Das gebundene ADP der dissoziierten Monomere wird durch ATP ausgetauscht. ATP-gebundenes G-Aktin steht anschließend wieder zum Einbau am (+)-Pol zur Verfügung. Tβ4 maskiert G-Aktin durch Bildung eines stöchiometrischen 1:1-Komplexes und verhindert dessen Polymerisation. Die Konzentration an polymerisierbarem G-Aktin wird durch die Maskierung verringert, sodass die kritische Konzentration zur Assoziation neuer Monomere am (+)-Pol nicht erreicht wird. Die De- und Repolymerisierung zwischen G-Aktin und F-Aktin wird durch eine Vielzahl von Aktin-bindenden Protein (AbP) gesteuert. Für das dynamische Verhalten des Aktin-Filaments - 14 - Einleitung und Problemstellung ist ein Vorrat an monomerem Aktin (G-Aktin) notwendig, der bei Bedarf sofort zu Filamenten (F-Aktin) polymerisiert werden kann. Dieser notwendige Vorrat an polymerisierbarem G-Aktin wird auch als kritische Konzentration bezeichnet. Unter den gegebenen intrazellulären Salzbedingungen würde die kritische Konzentration an G-Aktin-Monomeren erst unterschritten werden, wenn 90 % des G-Aktins zum F-Aktin polymerisiert sind. In vivo sind lediglich 50 % des Aktins zu Filamenten polymerisiert, 50 % liegen als monomeres G-Aktin vor. Dieser hohe Anteil an monomerem G-Aktin ist durch AbPs zu erklären, die G-Aktin komplexieren bzw. maskieren. Maskiertes G-Aktin steht dem Prozess der Tretmühlenphase nicht zur Verfügung und die kritische Konzentration an polymerisierbarem G-Aktin wird nicht erreicht. Diese Eigenschaft der Komplexierung und Maskierung von G-Aktin wurde 1991 von Safer et al. für Tβ4 beschrieben [21]. Tβ4 komplexiert G-Aktin in einem stöchiometrischen Verhältnis von 1:1 und verhindert dadurch die Polymerisation zu F-Aktin (Abb. 1-3). Die Dissoziationskonstante (KD-Wert) für den Tβ4-Komplex mit ATP-gebundenem Aktin liegt zwischen 0,5 und 2,5 µM [35-36]. Für ADP-gebundenes Aktin beträgt die Dissoziationskonstante 50 µM [35-36]. Durch Oxidation des Methionins an Position 6 im Tβ4 wird der Komplex um den Faktor 20 instabiler [37]. Tβ4 bindet in einer gestreckten Konformation an die Subdomänen 1 bis 3 des Aktins [35, 38]. 1.5 Weitere Interaktionspartner von Thymosin β4 Die Interaktion zwischen Tβ4 und Aktin ist vielfach untersucht und charakterisiert wurden. Durch Sequestrierung des G-Aktins spielt Tβ4 eine entscheidende Rolle in der Dynamik des Zytoskeletts von Zellen. Der genaue Mechanismus für die vielen weiteren zellulären Effekte von Tβ4 ist bisher unbekannt. Es ist nicht geklärt, ob die Effekte von Tβ4 extrazellulär oder intrazellulär vermittelt werden. In der Literatur sind neben G-Aktin bisher nur wenige weitere mögliche intrazelluläre Interaktionspartner beschrieben wurden: ATP-Synthase [39], ILK und PINCH [23, 40], Ku80 [40], hMLH1 [41] und Stabilin-2 [42]. Durch pulldown-Experimente mit biotinyliertem Tβ4 konnte die F1-F0-ATP-Synthase als Rezeptor für Tβ4 identifiziert werden [39]. Die KD-Wert Bestimmung für die Interaktion erfolgte durch Oberflächen-Plasmon-Resonanzspektroskopie. Der KD-Wert von Tβ4 und der αUntereinheit der ATP-Synthase betrug 1,1 µM und ist damit vergleichbar zum Tβ4-AktinKomplex. Die Interaktion zwischen Tβ4 und der β-Untereinheit der ATP-Synthase mit einem KD-Wert von 12 nM ist um den Faktor 100.000 niedriger und liegt im Bereich weiterer - 15 - Einleitung und Problemstellung bekannter Interaktionspartner der ATPase, wie Angiostatin (KD 28 nM) und IF1 (KD 170 nM) [39]. Bock-Marquette et al. konnten durch Immunpräzipitation transfizierter Zellen die trimere Interaktion zwischen Tβ4 und den intrazellulären Proteinen PINCH (Particularly interesting new Cysteine-Histidine rich Protein) und ILK (Integrin-linked Kinase) nachweisen [23]. Tβ4 präzipitierte mit beiden Proteinen auch in heterodimerer Form, wobei die Bindung zu ILK im Vergleich schwächer ausfiel. Die Bindungsstelle konnte zwischen der vierten und fünften LIM-Domäne von PINCH und der N-terminalen Ankyrindomäne von ILK lokalisiert werden [23]. Für die schwächere Interaktion zwischen Tβ4 und ILK wurde von Fan et al. später ein KD-Wert bestimmt. Chimeres ILK mit einem myc- und His-tag bindet mit einem KD-Wert von 18,7 µM an immobilisiertes Tβ4 [43]. Der PINCH/ILK-Komplex ist an der Regulation des Zytoskeletts und der Hemmung der Apoptose beteiligt. Dabei ist v.a. die Phosphorylierung der Proteinkinase B (Akt) an S473 durch den PINCH/ILK-Komplex von Bedeutung. Extrazelluläre Gaben von Tβ4 zu Cardiomyozyten und Endothelzellen führten zu einer erhöhten Phosphorylierungsrate der Akt [23]. Dies könnte eine Erklärung für die beobachtete Erhöhung der Migrationsrate und Lebensfähigkeit der Cardiomyozyten und Endothelzellen nach extrazellulären Tβ4-Gaben sein [23]. Die Untereinheit Ku80 der ATP-abhängigen DNA-Helikase II wurde durch Proteomanalyse nach Immunpräzipitation als Interaktionspartner von Tβ4 identifiziert. Das in den Experimenten eingesetzte rekombinante Tβ4 war um einen His-Tag mit 12 AminosäureResten C-terminal erweitert und zusätzlich biotinyliert. Durch Ku80-Mutanten konnte die Interaktion an der dritten Domäne (460-580) lokalisiert werden [40]. Ku80 dimerisiert mit einer weiteren Untereinheit Ku70. Das Heterodimer Ku80/Ku70 ist am Erhalt der Integrität der Chromosomen und der Überlebensfähigkeit von Zellen, durch seine wichtige Rolle während der Reparatur von Doppelstrangbrüchen und dem Erhalt der Telomer-Struktur, beteiligt. Durch ein bakterielles two-hybrid-screening und Immunpräzipitation konnte von Brieger et al. die Interaktion zwischen hMLH-1 und Tβ4 nachgewiesen werden [41]. hMLH-1 ist ein Schlüsselenzym während der DNA-mismatch-Reparatur. Durch die Interaktion mit hMLH-1 werden die Expression und der nukleäre Transport von Tβ4 reguliert. Der Verlust von hMLH1 führte zu einem Mangel an Tβ4 und einer Verringerung der Migration von Zellen [41]. Stabilin-2 ist ein Transmembranprotein das eine Rolle während der Angiogenese, Zelladhäsion und vor allem als Scavengerrezeptor spielt. Durch letztere Funktion wird die - 16 - Einleitung und Problemstellung Endozytose und damit Entfernung von Liganden wie LDL (low densitiy lipoproteins), bakteriellen Biopartikeln und AGE (advanced glycation endproducts) vermittelt. Durch ein Yeast-Two-Hybrid-Verfahren und Immunpräzipitation wurde Tβ4 als Interaktionspartner der zytoplasmatischen Domäne von Stabilin-2 identifiziert [42]. Die Aminosäurereste 2504-2514 von Stabilin-2 waren essentiell für diese Interaktion. Die Rolle von Tβ4 während der Stabilin2-vermittelten Phagozytose von apoptotischen Zellen ist allerdings noch nicht eindeutig geklärt. 1.6 Thymosin β4 als Substrat der Transglutaminase Transglutaminasen (EC 2.3.2.13) katalysieren die Bildung von intra- und intermolekularen Isopeptidbindungen zwischen der γ-Säureamidgruppe eines Glutaminylrestes (Acyl-Donor) und einer Reihe von primären Aminen (Acyl-Akzeptor). Alle Transglutaminasen besitzen eine hohe Substratspezifität zum Acyl-Donor, die die unmittelbare Umgebung des Glutamins einbezieht. Die Spezifität zum Acyl-Akzeptor ist sehr gering und spielt eine untergeordnete Rolle [44]. Die kovalente Vernetzung dient vor allem der Erhöhung der Widerstandsfähigkeit von Gewebe gegenüber chemischen, enzymatischen und mechanischen Einflüssen. Ein Vertreter der Enzymklasse der Transglutaminasen ist Faktor XIIIa, der durch Vernetzung einzelner Fibrinmoleküle zur Ausbildung eines stabilen Gerinnsels während der Blutgerinnungskaskade beiträgt. Darüber hinaus baut Faktor XIIIa auch weitere biologisch aktive Proteine in die Fibrinmatrix ein. Beispielsweise wird durch Vernetzung von α2Antiplasmin die Resistenz vor Fibrinolyse verbessert und durch Einbau von Fibronektin die Zellmigration und –adhäsion erhöht [45]. Huff et al. konnten 2002 Tβ4 als ein weiteres Substrat von Faktor XIIIa identifizieren, das in vitro an Fibrin, Aktin und Kollagen vernetzt werden kann [46]. Während der Blutgerinnung werden Thrombozyten aktiviert und setzen Faktor XIIIa und Tβ4 frei. Durch Faktor XIIIa wird Tβ4 bevorzugt an die αC-Domäne des Fibrins vernetzt [45]. Diese Vernetzung ist in Abb. 1-4 dargestellt. Sie wird als möglicher Mechanismus zur lokalen Fixierung von Tβ4 am Ort der Verletzung postuliert und könnte zu einem verbesserten Wundheilungsprozess beitragen [46]. Ein weiterer Vertreter dieser Enzymklasse ist die Gewebetransglutaminase, die im Zytoplasma vieler Zellen vorkommt. Tβ4 konnte als Glutaminyl-Substrat der Gewebetransglutaminase identifiziert werden. Von den im Tβ4 enthaltenen Glutaminresten reagierten die zwei Glutamine an den Positionen 23 und 36 wesentlich schneller als der dritte Glutaminrest an Position 39 [48]. - 17 - Einleitung und Problemstellung Abb. 1-4. Schematische Darstellung des Wundheilungsprozesses, verändert nach Goldstein et. al [47] Während der Blutgerinnungskaskade wird Fibrinogen durch Thrombin zu Fibrin gespalten. Letzteres wird durch Faktor XIIIa zu einem stabilen Gerinnsel quervernetzt. Faktor XIIIa führt gleichzeitig zum Einbau von Tβ4 bevorzugt an die αC-Domäne des Fibrins. 1.7 Thymosin β4 in klinischen Studien Die multifunktionale Rolle von Tβ4 während der Regeneration und Neubildung von Gewebe führte zur Durchführung einer Reihe von klinischen Studien, deren Parameter und Ergebnisse unter http://www.clinicaltrials.gov nachvollzogen werden können (Abb. 1-5). Die Formulierung RGN-352 enthält Tβ4 zur Injektion zur Behandlung der kardialen Gewebezerstörung nach Myokardinfarkt. Im Oktober 2009 konnte eine klinische Phase-IStudie an 80 Freiwilligen mit pharmakologischen Tβ4-Dosen (42 bis 420 mg Bolusinjektion) erfolgreich abgeschlossen werden. RGN-259 ist eine Formulierung von Tβ4 in sterilen Augentropfen zur verbesserten Wundheilung der Hornhaut des Auges. Eine klinische Phase-II-Studie, an diabetischen Patienten, die sich einer Vitrektomie unterzogen, wurde abgebrochen (2007 bis 2012). Eine folgende klinische Phase-II-Studie (2011 bis 2012) zur Behandlung des trockenen Auges wurde mit nicht signifikantem Ausgang beendet. Eine weitere klinische Phase-II-Studie zur Behandlung der Symptome des stark trockenen Auges befindet sich seit 2011 in der Rekrutierungsphase. - 18 - Einleitung und Problemstellung Abb. 1-5. Stand der klinischen Studien mit Tβ4 der Firma RegeneRx. Die Daten wurden der Seite „ClinicalTrials.gov“ des U.S. National Institutes of Health entnommen [49]. Die topische Formulierung eines Gels mit Tβ4 wird unter der Bezeichnung RGN-137 in der Behandlung chronischer dermaler Wunden untersucht. In einer klinischen Phase-I-Studie (2004) an gesunden Freiwilligen konnte die Sicherheit und Verträglichkeit der Formulierung nachgewiesen werden. In zwei folgenden klinischen Phase-II-Studien zur Behandlung von Ulcus cruris und Dekubitus konnte kein signifikanter Vorteil gegenüber Placebo bei der Behandlung festgestellt werden. Eine weitere klinische Phase-II-Studie zur Untersuchung der Wirkung von RGN-137 bei Epidermolysis bullosa (Schmetterlingskrankheit) wurde wegen einer zu geringen Patientenzahl abgebrochen. RGN-457 ist eine Formulierung zur Inhalation von Tβ4 bei Mukoviszidose und Bronchiektasie. Bisher wurde nur in präklinischen Studien die Wirksamkeit von RGN-457 zur Reduktion der Viskosität des Sputums durch Verhinderung der Aktin-Polymerisierung belegt. - 19 - Einleitung und Problemstellung 1.8 Problemstellung Tβ4 ist ein multifunktionales Peptid und trägt vor allem zu einer beschleunigten Wundheilung und verbesserten Regeneration der verschiedensten Gewebe bei. Ein genauer Wirkmechanismus ist bisher unbekannt. In den Arbeiten von Huff et al. wurde nachgewiesen, dass von Thrombozyten freigesetztes Tβ4 durch Faktor XIIIa an extrazelluläre Proteine gebunden werden kann. In der Literatur wurde daraufhin vielfach postuliert, dass diese Vernetzungsreaktion ein Mechanismus zur lokalen Fixierung von Tβ4 sei, um dessen wundheilungsfördernde Effekte vor allem in verletzten Arealen zu verbessern. Um dieser Hypothese nachzugehen musste zuvor geklärt werden, wie intrazelluläres Tβ4 freigesetzt wird, um für die extrazelluläre Vernetzungsreaktion zur Verfügung zu stehen. Zur Beantwortung dieser Frage sollten zellbiologische Experimente mit verschiedenen zellmembranschädigenden Noxen etabliert werden. Im Anschluss sollten für die Vernetzungsreaktion von Tβ4 mit Transglutaminase mögliche Substratpartner identifiziert werden. Hierfür musste die Methodik des ELISAs modifiziert werden, da viele Proteine der extrazellulären Matrix wegen ihrer Molekülgröße einer Analyse durch SDS-PAGE nicht zugänglich sind. Für die Lokalisierung der Vernetzungsstellen erwiesen sich massenspektrometrische Methoden als geeignet. In diesem Zusammenhang sollten zusätzlich die Vernetzungsstellen im Tβ4-Aktin-Komplex nach chemischer Vernetzung identifiziert werden. Abschließend konnte der Einfluss der enzymatischen Vernetzungsreaktionen von Tβ4 auf seine biologischen Effekte untersucht werden, um die anfängliche Hypothese zu klären. Dafür war es notwendig in einem geeigneten zellbiologischen Experiment die Wirkung von Tβ4 zu reproduzieren und eine Methode zur Untersuchung des vernetzten Tβ4 zu entwickeln. - 20 - Material 2 Material Gebräuchliche Chemikalien und Reagenzien die nicht in den folgenden Listen aufgeführt sind, wurden von den Firmen Sigma Aldrich, Roth oder Merck bezogen. Verbrauchsmaterialen, Reaktions- und Kulturgefäße wurden von den Firmen Sarstedt, greiner bio-one oder TPP bezogen. 2.1 Chemikalien und Reagenzien Substanz Reinheit, Spezifikation 3-Mercaptopropionsäure Bezugsquelle Sigma Aldrich Acetonitril Gradient Grade J.T.Baker Ammoniumpersulfat ≥98 % (w/w) Roth ATP, Natriumsalz Bis-Acrylamid Serva 30 % (w/v) Brilliantblau R Collagen Type I Serva Sigma Aldrich purified bovine collagen solution Digitonin nutacon Merck EDC protein sequence grade Sigma Aldrich Essigsäure 100 % VWR Fibrinogen aus humanem Plasma Sigma Aldrich Fibronektin aus humanem Plasma BD Biosciences Ficoll Fluka Fluorescamin analytical grade Serva Formaldehyd 35 %, reinst Merck Gelatine aus Rinderhaut Sigma Aldrich Lactalbumin Sigma Aldrich Lactatdehydrogenase Typ L Aus Muskel vom Schwein Roche Magermilchpulver Saliter NADH Sigma Aldrich Natrium-EDTA Sigma Aldrich Nicht-essentielle Aminosäuren Cellgro - 21 - Material ortho-Phtaldialdehyd mind. 99 %, HPLC Sigma Aldrich Penicillin/Steptomycin-Lösung 100 fach konzentriert Gibco; Invitrogen Polyvinylalkohol Molekülmasse 70.000 bis 100.000 (LALLS) Sigma Aldrich Pyruvat Sigma Aldrich Rinderserumalbumin Sigma Aldrich Salzsäure-Lösung (6M) for amino acid analyses Silbernitrat Fluka Johnson Matthey TEMED 99 %, für die Elektrophorese Roth Trifluoressigsäure für die Spektroskopie Merck Trypanblaulösung 0,4 % für die Zellkultur Sigma Aldrich Trypsin-EDTA-Lösung 0,25 % Gibco; Invitrogen Tween® 20 Roth 2.2 Spezielle Reagenzien Substanz Bezugsquelle Bestellnummer DMEM Gibco; Invitrogen 11885084 Fibrin Prof. Hannappel, isoliert aus Schweineblut 1 Fötales Rinderserum Gibco; Invitrogen mikrobielle Transglutaminase Prof. Pietzsch, MLU, Halle-Wittenberg PDGF-BB human Sigma Aldrich P3201 scrambled Thymosin β4 PolyPeptideLaboratories 0710-071 10082147 Prof. Hannappel, isoliert aus Kaninchenmilz analog der Thymosin β10 beschriebenen Methode für Tβ9Met (1) Thymosin β4 RegeneRx Trypsin, proteomics grade Sigma Aldrich 1 T6667 Geronnenes Schweinevollblut wurde 24 h mit Wasser durch Mull gespült. Gestockte Blutreste im Rückstand wurden entfernt. Zurückgebliebenes Fibrin wurde nochmals 5 h in Wasser gerührt, bis es eine weiße Farbe angenommen hat. Anschließend wurden Fibrinflocken für 48 h bei 50 °C getrocknet. - 22 - Material 2.3 Material und Geräte Zellkultur Bezugsquelle Autoklav tuttnauer Autoclave-Steam Sterilizer 2540 EL biomedis Inkubator HERA cell Thermo Scientific Mikroskop Axiovert 25 Zeiss Mikroskop IX 51 Olympus Sterilbank HERA SAFE KS Thermo Scientific Controller L 5000 LC Merk Hitachi Detektor LF Detector L-7480 Merk Hitachi Interface D-7000 Merk Hitachi Probengeber AS-2000 Merk Hitachi Pumpe 655A-12 Liquid Chromatograph Merk Hitachi Pumpe PN 1011 Solvent Delivery System postnova Trennsäule Ultrasphere ODS 4,6mmx25cm Beckmann Couter TM RP-HPLC SDS-PAGE, Western Blot und ELISA Blotkammer Blottingpapier Fastblot B43 Biometra ® Roti labo Roth TM BD FalconTM Mikrotiterplatte Microstest Nitrocellulosemembran Hybond ThermoScientific PAGE Protean® Tetra System BIO-Rad Spannungsgeber Power Pack 25 Biometra CELLCOAT Collagen Typ I, 96-Well Plate greiner bio-one Detektor LTQ Orbitrap XL ThermoFisher Flow manager FLM-3000-Flow manager Dionex HPLC Ultimate 3000 Micro HPLC Dionex Trennsäule Zorbax C18 Säule (3 µm x 1,0 i.d. x 15 cm) Agilent Technologies Vorsäule SecurityGuard™ Phenomenex Fluorimeter SFM 25 Kontron Analytical Photometer LKB-Ultrospec Plus Spectrophotometer Pharmacia Ultrazentrifuge Ultrazentrifuge L-70 Beckmann Coulter Vakuumkonzentrator speed vac concentrator BACHOFER 96-Well ELISA Plate, clear HPLC-ESI-MS weitere Laborgeräte - 23 - Material Zentrifuge Centrifuge 5417, 5417R, 5702 Eppendorf Fluoreszenzdetektor F-1050 Merck Hitachi Gradientenpumpe L-6200 Merck Hitachi Interface D-6000A Aminosäureanalyse Trennsäule 2.4 Merck Hitachi ® LiChrospher 100 RP-18e (5µm) Zellen Zelllinie Bezugsquelle humane HSC Prof. Rojkind, GWU, Washington DC Jurkatzellen Prof. Ogilvie, FAU, Erlangen 2.5 Merck Antikörper Primärantikörper Verdünnung Antigen Wirt Bezugsquelle Anti-Thymosin β4 Rabbit pAb 1:4000 aa1-14 Kaninchen Calbiochem Sekundärantikörper Verdünnung Wirt Bezugsquelle Protein A-HRP 1:3000 Staphylococcus aureus Zymed Laboratories anti-Kaninchen IgG-HRP 1:4000 Ziege KPL 2.6 Proteinmarker Prestained Protein Marker, SeeBlue® Broad Range (7-175 kDa) Pre-Stained Standard New England Biolabs Novex® 7, 17, 25, 30, 46, 58, 80, 175 kDa 3, 6, 14, 17, 28, 38, 49, 62, 98, 188 kDa - 24 - Material 2.7 Puffer PBS 10 mM Na2HPO4 TBS 7,7 mM Tris/HCl, pH 8.0 1,8 mM KH2PO4 150 mM NaCl 137 mM NaCl 2,7 mM KCl pH 7.3 2.8 PBST PBS + 1 % Tween TBST TBS + 1 % Tween Phosphatpuffer 50 mM Na2HPO4/50 mM KH2PO4, pH 8.0 TGA-Puffer 50 mM Tris/HCl, pH 7.8 15 mM CaCl2 Verwendete Software und Programme Bezeichnung Bezugsquelle Image Lab Bio-Rad Chromatography Data Station Software D-7000 Merck Xcalibur 2.0.7 SP1 Thermo Scientific MS Digest (ProteinProspector v 5.10.2) MS Tag (ProteinProspector v 5.10.2) Proteindatenbank University of California, San Francisco (http://prospector.ucsf.edu/prospector/mshome.htm) University of California, San Francisco (http://prospector.ucsf.edu/prospector/mshome.htm) UniProt (http://www.uniprot.org/uniprot/) - 25 - Methoden 3 Methoden 3.1 Biochemische Methoden 3.1.1 Gelelektrophorese 3.1.1.1 Diskontinuierliche SDS-PAGE Die Auftrennung von Proteinen erfolgte durch diskontinuierliche SDS-PAGE (Natriumdodecylsulfat-Polyacrylamidgelelektrophorese) unter reduzierenden Bedingungen nach Laemmli [50]. Dabei wurden die Proben 1:1 (v/v) mit Auftragspuffer versetzt und fünf Minuten bei 95 °C inkubiert. Dies ermöglicht die Denaturierung von Proteinen. Im Auftragspuffer enthaltenes β-Mercaptoethanol führt zusätzlich zur Reduktion von Disulfidbrücken. SDS im Auftragspuffer lagert sich an Proteine der Probe an, überdeckt deren Eigenladung und gewährleistet dadurch eine reine Auftrennung nach Molekülgröße. Sammelgel (4 %) Trenngel 8% 12 % 15 % Acrylamide/Bis 30 % 2,7 ml 4,0 ml 5,0 ml Trenngelpuffer 2,6 ml 2,6 ml 2,6 ml 4,7 ml 3,4 ml 2,4 ml Sammelgelpuffer 5 ml H2O APS (10 %) 25 µl 50 µl 50 µl 50 µl TEMED 5 µl 5 µl 5 µl 5 µl Sammelgelpuffer 0,5 M Tris/HCl, pH 6.8 0,4 % (w/v) SDS Trenngelpuffer 1,5 M Tris/HCl, pH 8.8 0,4 % (w/v) SDS Laufpuffer 25 mM Tris Base, pH 8.3 186 mM Glycin 1 % (w/v) SDS Auftragspuffer 2x 125 mM Tris/HCl, pH 6.8 4 % (w/v) SDS 20 % (v/v) Glycerol 10 % (v/v) β-Mercaptoethanol 0,01 % (w/v) Bromphenolblau - 26 - Methoden Die Proben wurden anschließend auf ein Gel aufgetragen, das aus einem grobporigen Sammelgel und darunter einem feinporigen Trenngel bestand. Dabei wurden die Proteine zunächst im Sammelgel aufkonzentriert und im Trenngel nach Molekülgröße separiert. Sammelgel und Trenngel bestanden aus polymerisiertem Acrylamid. Die Porengröße ist dabei abhängig von der prozentual eingesetzten Menge an Acrylamid/Bisacrylamid. Es wurden verschieden porige Trenngele verwendet. Für die Auftrennung von Proteinen zwischen 10- 50 kDa, 30-80 kDa und 70-150 kDa wurden jeweils 8 %, 12 % bzw. 15 % Gele eingesetzt. Die elektrophoretische Auftrennung erfolgte im Mini Protean System der Firma Bio-Rad durch das Anlegen einer Spannung von anfangs 130 V und 180 V nach Einlaufen der Probe in das Trenngel. Da die verschiedenen Proteine gleichmäßig mit negativ geladenen SDSMolekülen beladen sind, erfolgt die Trennung im elektrischen Feld durch das Trenngel nach Molekülgröße. Die Molekülmasse der Proteine konnte durch Auftragen eines kommerziellen Proteinstandards bestimmt werden. 3.1.1.2 Coomassieblau-Färbung Zur Detektion der Proteinbanden nach der SDS-PAGE wurden die Gele für 30 Minuten in Coomassie-Färbelösung agitiert. Ungebundener Farbstoff wurde durch Schütteln in Entfärbelösung ausgewaschen. Coomassie-Färbelösung 0,25 % (w/v) Brilliant Blau R-250 7,5 % (v/v) Essigsäure 25 % (v/v) Methanol Entfärbelösung 10 % (v/v) Essigsäure 25 % (v/v) Methanol 3.1.1.3 Silberfärbung Die Silberfärbung von Proteinen ist sensitiver im Vergleich zur Coomassie-Färbung und wurde bei Gelen mit Proteinmengen unter 1 µg pro Bande angewendet. Das Prinzip beruht auf der Anlagerung von Silberionen an negativ geladene Proteinstrukturen und der anschließenden Reduktion zu metallischem Silber. Dadurch werden Proteine als braune Banden sichtbar. Die Silberfärbung von Gelen nach SDS-PAGE erfolgte nach einem modifizierten Protokoll von M. Swain et al. [51] mit folgenden Schritten: - 27 - Methoden Arbeitsschritt Zusammensetzung der Lösung (v/v) Inkubationszeit Fixierung 40 % Ethanol/ 10 % Essigsäure 10 min Waschen H20 10 min Fixierung/Sensitivierung 0,05 % Glutaraldehyd/ 0,037 % Formaldehyd/ 40 % Ethanol 5 min Waschen 40 % (v/v) Ethanol 20 min Waschen H2O 20 min Sensitivierung 0,8 mM NaS2O3 1 min Waschen H2O 2x 1 min Silberlösung 11,8 mM AgNO3/ 0,02 % Formaldehyd 20 min Waschen H2O 2x 1 min Entwickeln 566 mM NaCO3/ 0,02 mM NaS2O3/ 0,02 % (v/v) Formaldehyd Nach Bedarf Stoppen 5 % (v/v) Essigsäure 10 min 3.1.2 Proteintransfer mit Immunodetektion 3.1.2.1 Semi-dry Western Blot Durch den Western Blot werden die zuvor durch SDS-PAGE aufgetrennten Proteine aus dem Gel auf eine Nitrocellulosemembran transferiert. Die Methode des Semi-dry-Verfahrens wurde erstmals von Bittner et al. [52] beschrieben. Auf einen Korpus (Anode) wurden ein mit Anodenpuffer getränktes Blottingpapier, die Nitrocellulosemembran und anschließend das Gel luftblasenfrei aufgelegt. Den Abschluss bildeten ein in Kathodenpuffer getränktes Blottingpapier sowie ein Deckel (Kathode). Der Transfer erfolgte nach Anlegen einer konstanten Stromstärke von 200 mA für 30 min. Die Nitrocellulosemembran wurde anschließend der Reihe nach mit 5 % Milchpulver in TBST, zur Absättigung unspezifischer Bindestellen, mit dem Primärantikörper gegen Tβ4 und anschließend mit einem HRP-gekoppeltem Sekundärantikörper für jeweils eine Stunde bei Raumtemperatur inkubiert. Zwischen den einzelnen Inkubationsschritten wurde die Membran mehrfach mit TBST gewaschen. Anodenpuffer 50 mM Borsäure/NaOH, pH 9.0 10 % (v/v) Methanol 0,04 % (w/v) SDS Kathodenpuffer 50 mM Borsäure/NaOH, pH 9.0 5 % (v/v) Methanol 0,04 % (w/v) SDS - 28 - Methoden 3.1.2.2 Chemilumineszenzdetektion Der Nachweis der Proteine auf der Nitrocellulosemembran nach dem Western Blot erfolgte durch Reaktion der HRP, die an den Sekundärantikörper gekoppelt war. HRP katalysiert die Oxidation von Luminol in Anwesenheit von Wasserstoffperoxid. Das oxidierte Luminol zerfällt unter Emission von Licht. Für die Chemilumineszenzreaktion wurde das Immun-Star WesternC™ Chemiluminescence Kit der Firma Bio-Rad nach Herstellerangaben verwendet. Die Lichtemission auf der Nitrocellulosemembran wurde in einem bildgebenden Analysesystem (ChemiDoc XRS Imaging system) der Firma Bio-Rad detektiert und mit der Software Image Lab ausgewertet. 3.1.3 Modifizierter ELISA Die Vernetzung von Tβ4 durch mikrobielle Transglutaminase (mTGA) mit verschiedenen Proteinen wurde mittels eines modifizierten ELISAs untersucht. Dabei wurde nicht wie beim ELISA üblich eine Mikrotiterplatte zuerst mit Antigen oder Antikörper beschichtet, sondern in diesem Fall mit dem zu untersuchenden Proteinen. Mit Kollagen vorbeschichtete Mikrotiterplatten wurden kommerziell erworben (greiner bio one). Die Beschichtung von Mikrotiterplatten mit Proteinen erfolgte durch Inkubation von 0,1 % (w/v) Proteinlösungen für 1 h bei 37 °C. Dabei adsorbieren die Proteine durch hydrophobe Wechselwirkungen an die Plastikoberfläche. Ungebundenes Protein wurde durch mehrfaches Waschen der Mikrotiterplatte mit PBST entfernt. Die Sättigung unspezifischer Bindestellen erfolgte mit 1 %iger PVA-Lösung (0,1 g/l PVA in PBS). Herkömmliche Blockierlösungen, die Proteine wie BSA oder Milchpulver enthalten, sind in diesem Experiment nicht geeignet, da diese Proteine ebenfalls als Substrate der mTGA agieren könnten. Bei PVA handelt es sich um ein Polymer, an das kein Tβ4 mittels Transglutaminase gebunden werden kann. In einem nächsten Schritt wurden die Vertiefungen der beschichteten Mikrotiterplatte mit 5 µg Tβ4 und 5 mU mTGA mit Phosphatpuffer zu 100 µl Gesamtvolumen ergänzt und für 1 h bei 37 °C inkubiert. Ungebundene Bestandteile der Probe wurden anschließend durch mehrfaches Waschen der Mikrotiterplatte mit PBST eliminiert, nur an beschichtetes Protein vernetztes Tβ4 bleibt zurück. Der spezifische Nachweis von Tβ4 erfolgte mit dem Primaräntikörper Anti-Tβ4-KaninchenpAb (Calbiochem). Dieser Antikörper wurde 1:4000 in PBS mit 5 % (w/v) Milchpulver - 29 - Methoden verdünnt und für 1 h bei RT inkubiert. Ungebundener Antikörper wurde durch mehrfaches Waschen mit PBST entfernt. Es folgte die Behandlung mit HRP-gekoppeltem Sekundärantikörper (KPL) für 1 h bei RT (1:4000, in PBS mit 5 % Milchpulver). Der Sekundärantikörper bindet spezifisch an den Primärantikörper und ermöglicht durch die Kopplung mit HRP eine Farbdetektion. Dafür wurde nach mehrfachem Waschen mit PBST TMB-Lösung zugegeben. HRP katalysiert die Reaktion von TMB (3,3',5,5'- Tetramethylbenzidin) zu 3,3',5,5'-Tetramethylbenzidindiimin, einem blauen Farbstoff. Die Messung der Absorption erfolgte bei 620 nm im Biotrak II Visible Plate Reader (GE Healthcare). Testansätze ohne Proteinbeschichtung oder ohne Zugabe von mikrobieller Transglutaminase dienten als Negativkontrollen. Abb. 3-1. Schematische Darstellung des modifizierten ELISAs. X zu untersuchendes Protein (beschichtet), T Thymosin β4 (durch mTGA an X vernetzt), 1. AK Thymosin β4-Antikörper, 2. AK HRP-gekoppelter Sekundärantikörper, S Substrat, P Farbstoff. 3.1.4 Zytotoxizitätstest Zur Bestimmung der Zellmembranschädigung wurde die Aktivität der freigesetzten Lactatdehydrogenase (LDH) gemessen. LDH ist ein zytosolisches Enzym aus der Klasse der Oxidoreduktasen. Die Freisetzung dieses hochmolekularen, tetrameren Enzyms kann nur nach starker Membranschädigung erfolgen und wird als Maß für den Zelltod herangezogen. LDH katalysiert die Reduktion von Pyruvat zu Lactat. Dabei wird NADH zu NAD+ oxidiert. Die Abnahme der Absorption von NADH ist direkt proportional zur Aktivität der LDH und kann bei einer Wellenlänge von 340 nm photometrisch bestimmt werden. Nach der Schädigung der Zellmembran von Jurkatzellen (siehe 3.3.1.3) wurden die Zellen vom umgebenden Medium durch Zentrifugation (90 x g, 3 min) separiert. Die Bestimmung - 30 - Methoden der freigesetzten LDH erfolgte direkt im Medium (Überstand A). Zur Berechnung des prozentualen Anteils toter Zellen wurde zusätzlich der in intakten Zellen verbliebene Anteil der LDH bestimmt. Dafür wurde das Zellpellet durch Zugabe von 500 µl H2O lysiert. Durch die hypotone Lösung platzen die Zellen und LDH wird freigesetzt. Zelltrümmer wurden abzentrifugiert (90 x g, 3 min) und der Überstand (B) analysiert. Für den Testansatz wurden in eine Küvette 940 µl Tris-NaCl-Puffer (80 mM Tris/HCl, pH 7.5, 200 mM NaCl), 10 µl NADH-Reagenz (15 mM in Tris-NaCl-Puffer) und 40 µl Überstand (A) oder (B) pipettiert und vermischt. Die Zugabe von 10 µl Pyruvat-Reagenz (25 mM in TrisNaCl-Puffer) führte zum Start der Reaktion. Bei einer Wellenlänge von 340 nm wurde die Extinktion zu den Zeitpunkten 1, 2, 3 und 4 min photometrisch bestimmt und die Extinktionsänderung pro Minute gemittelt. Wenn die Extinktionsänderung den Wert von 0,1 min-1 überschritt, wurde die Probe zusätzlich verdünnt. Bestandteile Endkonzentration im Testansatz Tris/HCl, pH 7.5 80 mM NaCl 200 mM Pyruvat 0,25 mM NADH 0,15 mM Die Extinktionsänderung wurde anschließend für das Gesamtvolumen der jeweiligen Probe berechnet. Das Volumen von Überstand A betrug 100 µl, von Überstand B 500 µl. Da jeweils nur 40 µl der Überstände für die Messung eingesetzt wurden, war eine Multiplikation der Reaktionsgeschwindigkeiten mit den Faktoren 2,5 (entsprechend 100 µl/40 µl) für Überstand (A) und 12,5 (entsprechend 500 µl/40 µl) für Überstand (B) notwendig. Daraus ergab sich für die Berechnung des prozentual freigesetzten Anteils an LDH aus den Reaktionsgeschwindigkeiten v [min-1] folgende Formel: LDH frei [%] = v A × 2,5 × 100% (v A × 2,5) + (vB × 12,5) Der prozentuale Anteil an freigesetzter LDH berechnete sich aus dem Verhältnis der Aktivität im Medium (Überstand A) zur Gesamtaktivität, die sich aus der Summe der LDH-Aktivitäten in den Zellen (B) und im Medium (A) zusammensetzt. - 31 - Methoden 3.1.5 TGA-Enzymaktivitätstest Die rekombinante mikrobielle Transglutaminase aus dem Stamm Streptomyces mobaraensis für die Experimente dieser Arbeit wurde von Prof. Dr. M. Pietzsch der Martin-LutherUniversität in Halle zur Verfügung gestellt. Gewebetransglutaminase aus der Meerschweinchenleber wurde kommerziell erworben (Zedira). Die Aktivität wurde in einem Enzymaktivitätstest nach der Methode von Lorand et al. [53] bestimmt. Dabei katalysiert Transglutaminase die Vernetzung von Monodansylcadaverin mit verschiedenen Proteinen, z. B. α-Casein. Die Fluoreszenz von Monodansylcadaverin wird durch diese Reaktion hypsochrom, zu niedrigeren Wellenlängen, verschoben und gleichzeitig intensiviert. Für den Testansatz wurden 1 bis 10 µl einer Transglutaminase-Lösung in einem Reaktionspuffer (50 mM Tris/HCl; pH 7.5; 6 mM NaCl; 2,5 mM CaCl2) ad 90 µl verdünnt und mit 10 µl einer α-Casein-Lösung (0,22 mM in 0,02 M NaOH) und 10 µl einer Monodansylcadaverin-Lösung (0,375 mM in 0,02 M HCl) versetzt. Bestandteile Endkonzentration im Testansatz Tris/HCl, pH 7.5 40 mM NaCl 5 mM CaCl2 2 mM α-Casein 0,02 mM Monodansylcadaverin 0,034 mM Die zeitliche Änderung der Fluoreszenz wurde an einem Fluorimeter der Firma Kontroll Analytical abgelesen. Die Anregungswellenlänge betrug 360 nm, die Emissionswellenlänge 500 nm. Die Emission wurde jede Minute über einen Zeitraum von 10 min bestimmt und die Emissionsänderung pro Minute gemittelt. Da bei Emissionsänderungen über 3,0 min-1 keine Linearität über den Zeitraum von 10 min zu beobachten war, wurde in diesen Fällen die Enzymlösung verdünnt und der Versuch wiederholt. - 32 - Methoden 3.2 Bioanalytische Methoden 3.2.1 RP-HPLC mit Nachsäulenderivatisierung Die Umkehrphasen-Hochleistungsflüssigchromatographie (RP-HPLC) diente zur Quantifizierung der Freisetzung von Tβ4 aus Jurkatzellen. Zur Vorbereitung der Proben wurden Zellen und Inkubationsmedium durch Zentrifugation (90 x g, 3 min) separiert. Das Zellpellet wurde mit 100 µl einer 0,4 M und der Überstand mit 10 µl einer 4 M Perchlorsäure (PCA) versetzt und für eine Stunde auf Eis inkubiert. PCA führt zur Präzipitation von Proteinen, die anschließend mit Zelltrümmern sowie DNA durch Zentrifugation (14 000 x g, 5 min, 4 °C) abgetrennt werden konnten. Tβ4 wird durch PCA nicht ausgefällt und verbleibt im Überstand. Die Überstände aus dem Medium (Überstand A) und dem Zellpellet (Überstand B) wurden in Probengefäße überführt und im automatischen Probennehmer platziert. Die Auftrennung des Substanzgemisches der Überstände A und B erfolgte mittels RP-HPLC durch einen Fließmittelgradient. Dabei wurden je 50 µl der Überstände mittels eines automatischen Probennehmers in Fließmittel (A) in eine Trennsäule (Beckmann Ultrasphere ODS) mit unpolarem Trägermaterial gepumpt. Das Trägermaterial besteht aus Octadecylmodifiziertem Kieselgel. Unpolare Bestandteile des Überstandes binden sich über hydrophobe Wechselwirkungen an die unpolaren Octadecyl-Seitenketten und werden stärker als hydrophilere Komponenten retardiert. Die mobile Phase setzte sich aus Fließmittel A (0,1 % TFA) und B (50 % ACN, 0,1 % TFA) zusammen. Der Anteil von Fließmittel B wurde über 30 min linear von 0 auf 100 % erhöht. Durch den Anstieg der Acetonitrilkonzentration sinkt die Polarität der mobilen Phase. Durch die folgende Abschwächung der Wechselwirkungen zwischen unpolaren Bestandteilen und dem Trägermaterial, werden diese schließlich von der Trennsäule eluiert. Zeit FM B [%] Aktion 0 0 Start Detektion 0,1 0 Start Nachsäulenderivatisierung 30 100 Stopp Detektion, Stopp Nachsäulenderivatisierung 35 100 Waschvorgang 40 0 Waschvorgang 55 0 Äquilibrierung - 33 - Methoden Die Detektion erfolgte durch Nachsäulenderivatisierung. Dabei wurden die eluierten Bestandteile in einem Kreuz-Verbindungsstück mit Boratpuffer (0,4 M H3BO3/LiOH, pH 9.3) und Fluorescamin (0,7 mM Fluorescamin in Aceton) versetzt. Fluorescamin (Fluram) reagiert im alkalischen Milieu mit freien Aminogruppen zu fluoreszierenden Derivaten, welche im Fluoreszenzdetektor bei einer Exzitationswellenlänge von 380 nm angeregt und bei einer Emissionswellenlänge von 475 nm nachgewiesen werden. Die Auswertung der HPLCChromatogramme erfolgte mit der Chromatography Data Station Software D-7000. Abb. 3-2. Schematische Darstellung der HPLC mit Nachsäulenderivatisierung. A Fließmittel (0,1 % TFA) , B Fließmittel (50 % ACN in 0,1 % TFA) , P Pumpe, F Fluramlösung, BP Boratpuffer. Nachsäulenderivatisierung: Primäre Amine reagieren mit Fluram zu fluoreszierenden Derivaten. Zur Identifizierung und Quantifizierung von Tβ4 wurde ein Standard (200 ng Tβ4 in 50 µl Probevolumen) mitgeführt. Tβ4 in den Überständen A und B wurde über seine Retentionszeit identifiziert und durch Integration der Peakflächen (F) quantifiziert. Die Menge an freigesetztem Tβ4 im Medium (Überstand A) wurde prozentual zur Gesamtmenge berechnet, die sich aus der Summe der Peakflächen von Tβ4 im Zellpellet (Überstand B) und im Medium zusammensetzt: Tβ 4 frei [%] = FMedium × 100% FMedium + FZellen - 34 - Methoden 3.2.2 Aminosäureanalyse Die Konzentrationsbestimmung des isolierten Aktins erfolgte durch Aminosäureanalyse. Dafür wurde Aktin hydrolytisch durch HCl in seine Aminosäuren gespalten. In ein Reaktionsgefäß wurden 45 µl konzentrierte HCl mit 2,5 µl GABA-Lösung (3 mM in 0,1 % TFA) und 2,5 µl der zu untersuchenden Aktinlösung pipettiert und für 5 h bei 70 °C inkubiert. In diesem ersten Inkubationsschritt erfolgt eine partielle Hydrolyse des Aktins, die notwendig ist, um die Löslichkeit zu verbessern. Anschließend wurden je 20 µl des Reaktionsgemisches in zwei Glaskapillaren aufgezogen. Die Glaskapillaren wurden an beiden Enden zugeschmolzen und für 1 h bei 155 °C im Glycerinbad inkubiert. Die saure Hydrolyse führt zur Spaltung der Peptidbindungen und es entstehen die freien Aminosäuren. Peptidbindungen zwischen Isoleucin und Valin sind jedoch sehr stabil, sodass in diesem Fall keine vollständige Spaltung stattfindet. Methionin und Tryptophan werden unter diesen Bedingungen oxidiert. Asparagin und Glutamin werden durch saure Hydrolyse zu Asparaginsäure und Glutaminsäure hydrolysiert und werden als Asx bzw. Glx zusammengefasst. Abb. 3-3. Schematische Darstellung der RP-HPLC mit Vorsäulenderivatisierung. A: Puffer A, B: Puffer B, P: Pumpe. Vorsäulenderivatisierung: Primäre Amine reagieren mit ortho-Phthaldialdehyd in Anwesenheit von Mercaptopropionsäure zu fluoreszierenden Isoindol-Derivaten. Die Auftrennung der einzelnen Aminosäuren gelang nach Vorsäulenderivatisierung durch RP-HPLC. Dafür wurde das Reaktionsgemisch nach der sauren Hydrolyse über Nacht unter - 35 - Methoden Vakuum im Exsikkator getrocknet und in 50 µl Boratpuffer (1 M H3BO3/LiOH, pH 9.3) gelöst. Von dieser Lösung wurden 10 µl mit 5 µl einer ortho-Phtaldialdehyd-Lösung (10 g/l in Methanol, 1% Mercaptopropionsäure) für 2,5 min bei RT inkubiert. Die Derivatisierungsreaktion wurde durch Zugabe von 200 µl Puffer A gestoppt. OrthoPhthaldialdehyd (OPA) reagiert mit primären Aminen in Anwesenheit von Thiolen zu einem fluoreszierenden Isoindolderivat (vergl. Abb. 3-3). Prolin enthält keine primäre Aminogruppe und ist daher mit dieser Methode nicht zu quantifizieren. Die Auftrennung der derivatisierten Aminosäuren in der RP-HPLC erfolgte in einer Trennsäule (LiChrospher) durch einen linearen Gradienten der Fließmittel (Puffer A und B). Der Anteil an Puffer B wurde in 18 min von 0 auf 100 % bei einer Flussrate von 1,2 ml/min erhöht. Das Auftragsvolumen der Probe betrug 20 µl. Die Detektion erfolgte im Fluoreszenzdetektor bei einer Exzitationswellenlänge von 340 nm und einer Emissionswellenlänge von 455 nm. Das Chromatogramm wurde mit der Chromatography Data Station Software D-7000 ausgewertet. Puffer A 12,5mM Na2HPO4/NaH2PO4, pH 7.2 3 % ACN 2 % THF Puffer B 8,75mM Na2HPO4/NaH2PO4, pH 7.2 30 % ACN Die Quantifizierung von Aktin erfolgte sowohl durch einen internen als auch einen externen Standard. Der externe Standard enthielt die verschiedenen Aminosäuren in einer Konzentration von 50 pmol/µl. Die Vorsäulenderivatisierung und Auftrennung erfolgte identisch zur Probe. Als interner Standard wurde zu jeder Probe und dem externen Standard γ-Aminobuttersäure (GABA) zugesetzt. Im Falle der Probe erfolgte die Zugabe vor der sauren Hydrolyse. Für die Auswertung wurden alle Standardaminosäuren außer Cystein, Tryptophan und Prolin herangezogen. Die Flächen der einzelnen Aminosäuren wurden mit dem inneren Standard korrigiert. Die korrigierte Peakfläche jeder Aminosäure ergab sich aus der Multiplikation der Peakfläche der Aminosäure in der Probe mit der Peakfläche von GABA im externen Standard dividiert durch die Peakfläche von GABA in der Probe: A korr AS Pr obe Std AAS × AGABA = Pr obe AGABA - 36 - Methoden Der externe Standard diente zur Berechnung der Stoffmenge der Aminosäuren in der Probe über die Peakfläche. Dabei ergab sich die Stoffmenge der Aminosäure (n) aus der korrigierten Peakfläche (Akorr) der Aminosäure multipliziert mit der injizierten Stoffmenge im externen Standard (nStd) und dividiert durch die Peakfläche der Aminosäure im externen Standard (AStd): Pr obe n AS = korr Std AAS × n AS Std AAS Die Konzentration der Aktinlösung berechnete sich aus der Summe der Stoffmengen der Aminosäuren in der Probe dividiert durch die bekannte Anzahl der ausgewerteten Aminosäuren (z) im Aktinmolekül unter Berücksichtigung des aufgetragenen Probevolumens (V) und des Verdünnungsfaktors (F) sowie der molaren Masse (M): Pr obe c Aktin = 3.2.3 n Pr obe AS z × M Aktin V ×F Proteinverdau und massenanalytische Bestimmung 3.2.3.1 Trypsin-In-Gel-Verdau Um Proteine der späteren Analyse mit HPLC-ESI-MS zugänglich zu machen, war eine Fragmentierung in kleinere Peptide notwendig, die durch einen Trypsin-In-Gel-Verdau erreicht wurde. Für den Verdau wurden SDS-Gele nach Coomassie-Färbung für 15 h bei RT in H2O zum Quellen gelegt. Die zu identifizierenden Proteinbanden wurden anschließend mit einem Skalpell ausgeschnitten, jeweils in ein Reaktionsgefäß überführt und in ca. 1 mm3 umfassende Stücke zerkleinert. Das Volumen der folgenden Lösungen wurde in allen Inkubationsschritten an die Gelstücke angepasst, sodass diese gerade mit Flüssigkeit bedeckt waren. Die Entfärbung der Gelstücke erfolgte durch die aufeinanderfolgende Behandlung mit Waschlösung, Dehydrierungslösung und Rehydrierungslösung für jeweils 30 min bei 37 °C. Zwischen den einzelnen Schritten wurden die Proben zentrifugiert und die Überstände verworfen. Das in den Lösungen enthaltene Acetonitril (ACN) schwächt die hydrophoben, NH4HCO3 die elektrostatischen Wechselwirkungen zwischen Coomassie und den Proteinen. Nach erneutem Entfernen des Überstandes folgte das vollständige Dehydrieren der Gelstücke in 100 % ACN für ca. 10 min. Die Gelstücke schrumpfen dabei zu weißen - 37 - Methoden Plättchen zusammen. Überstehendes ACN wurde entfernt und die Gelstücke auf Eis zunächst mit 20 µl Trypsinlösung für 1 h rehydriert. Anschließend wurde je nach Bedarf Trypsinlösung bis zum vollständigen Bedecken aller Gelstücke zugegeben. Der Verdau erfolgte bei 37 °C für 20 h. Waschlösung 200 mM NH4HCO3 Dehydrierungslösung 80 mM NH4HCO3 60 % ACN Rehydrierungslösung 50 mM NH4HCO3 Trypsinlösung 20 µg/ml Trypsin 28 mM NH4HCO3 10 % ACN 3.2.3.2 HPLC-ESI-MS Alle HPLC-ESI-MS Experimente wurden in Zusammenarbeit mit der Arbeitsgruppe von Prof. Castagnola während eines Aufenthalts in seinem Labor in Rom durchgeführt. Die Auftrennung der Peptidgemische sowie die Fragmentierung und massenanalytische Bestimmung erfolgte durch ein Ultimate 3000 Micro HPLC-System gekoppelt an ein LTQ Orbitrap XL Apparat. Die Probe wurde durch einen automatischen Probennehmer in eine Probenschleife injiziert und über eine Vorsäule (Phenomenex) in die eigentliche Trennsäule (Zorbax C18) transportiert. Die Vorsäule ist notwendig um hochmolekulare Bestandteile und Salze von der Trennsäule und dem Massenspektrometer zurückzuhalten. Die Elution des Peptidgemisches der Probe von der Trennsäule erfolgte mit einem Gradienten der Fließmittel A (0,1 % Ameisensäure) und B (0,1 % Ameisensäure/ 80 % ACN) bei einer Flussrate von 80 µl/min. Fließmittel B wurde nach 2 min über 38 min von 5 % auf 55 % und nach weiteren 2 min auf 100 % erhöht. Anschließend wurde die Konzentration von Fließmittel B wieder auf 5 % zurückgefahren und die Säule für weitere 9 min äquilibriert. Über eine Kapillare wurden die eluierten Peptide zur Ionisationsquelle geführt. Bei der Elektrosprayionisation wird eine Spannung zwischen einer Elektrospraynadel und einer Gegenelektrode angelegt. Diese führt zur Bildung von ionisierten Flüssigkeitströpfchen, die zur Gegenelektrode beschleunigt werden. Über eine beheizte Transferkapillare gelingt die Desolvatation der ionisierten Tröpfchen. Es entstehen geladene Ionen, die über elektrostatische Linsen in das Massenspektrometer LTQ Orbitrap XL geführt werden. Die Linsenspannung bestimmt den Massenbereich der Ionen, die in das Massenspektrometer weitergeleitet werden. Die Spannung der Elektrospraynadel betrug 2,4 kV, die Linsenspannung 245 V und die Temperatur der Transferkapillare 250 °C. - 38 - Methoden Das Massenspektrometer besteht aus einer linearen Ionenfalle (LTQ XL), in der die Ionen entweder fragmentiert oder in eine weitere Ionenfalle (C-Trap) geleitet werden. Die C-Trap konzentriert die Ionen und stößt sie gleichzeitig in die Orbitrap zur hochauflösenden Massenanalyse aus. Abb. 3-4. Schematische Darstellung des LTQ-Orbitrap-XL Apparates (nach Thermo Scientific). Nach Ionisierung der Probe durch Elektrosprayionisation (ESI) werden die Ionen zur linearen Ionenfalle geleitet (LTQ XL). In einem datenabhängigen Modus werden Full Scanund MS/MS-Spektren der drei intensivsten Ionen generiert und detektiert. Die Ionen werden anschließend in der C-Trap akkumuliert und gespeichert, sodass diese pulsartig in den Orbitrap-Massenanalysator ausgestoßen werden können. Der OrbitrapMassenanalysator ermöglicht eine hochauflösende Detektion des Masse-LadungsVerhältnisses. In einem datenabhängigen Modus wurden in der Orbitrap vollständige Massenspektren im m/z-Bereich zwischen 350 und 2000 aufgenommen und die drei intensivsten Ionen zusätzlich in der linearen Ionenfalle (LTQ) fragmentiert. Die Fragmentierung der Ionen erfolgte durch Kollision mit Stickstoff als Stoßgas (CID, collision-induced dissociation). Die relative Kollisionsenergie betrug 35 %. 3.2.3.3 Auswertung der MS- und MS/MS-Spektren Die Analyse der Daten erfolgte mit der Software Xcalibur 2.0.7 SP1 im Modus Qual Browser. Die ermittelten Massen (MH+) der Fragmente eines Proteins wurden mit dem theoretischen Fragmentmuster verglichen, das mit dem Programm MS Digest (ProteinProspector v5.10.2) erstellt wurde. Die Aminosäuresequenzen wurden der Datenbank UniProt entnommen. Zur - 39 - Methoden Identifizierung unbekannter Massen hoher Intensität wurde zusätzlich das MS/MSFragmentierungsmuster ausgewertet. Hypothesen für Modifizierungen der Fragmente ließen sich mit dem Programm MS Tag (ProteinProspector v5.10.2) bewerten. 3.3 Zellbiologische Methoden Die Kultivierung der Zellen sowie der Wundheilungs-Assay fanden unter sterilen Bedingungen statt. Fötales Rinderserum (FBS) wurde durch Erhitzen auf 60 °C für 30 min inaktiviert. Die Inkubation der Zellen erfolgte bei 37 °C und 5 % CO2. 3.3.1 Jurkatzellen Jurkatzellen entstammen einer humanen T-Zelllinie, die 1977 am Universitätsklinikum Erlangen-Nürnberg gewonnen und etabliert wurde [54]. Die Konzentration von Tβ4 in Jurkatzellen ist im Vergleich zu anderen Blutzellen sehr hoch, sie beträgt ca. 300 fg/Zelle [16] und ermöglicht dadurch Untersuchungen zur Freisetzung von Tβ4. 3.3.1.1 Zellkultur Jurkatzellen wurden in 10 cm-Zellkulturschalen in Zellkulturmedium (RPMI 1640, 10 % (v/v) FBS, 2 mM L-Glutamin, 100 U Penicillin, 100 µg/ml Streptomycin) kultiviert. Die Zellsuspension wurde alle 2 bis 3 Tage je nach Zelldichte 1:4 bis 1:10 subkultiviert. 3.3.1.2 Zellzählung mit Trypanblau Trypanblau ist ein anionischer Farbstoff, der zur Testung der Vitalität von Zellen eingesetzt wird. Der Farbstoff kann die Zellmembran von vitalen Zellen nicht passieren, daher erscheinen diese im Mikroskop weiß auf blauem Hintergrund. Tote Zellen erscheinen im Mikroskop blau, da der Farbstoff durch Poren die Zellmembran passiert und sich an intrazelluläre Proteine bindet. Die Zellsuspension wurde 1:1 mit Trypanblaulösung (0,4 % Sigma Aldrich) versetzt. Die Auszählung von vitalen und toten Zellen erfolgte in einer FuchsRosenthal-Zählkammer. - 40 - Methoden 3.3.1.3 Schädigung der Zellmembran Zur Untersuchung der Freisetzung von Tβ4 aus Zellen wurde die Zellmembran durch Zusatz von Digitonin oder hypoosmotische Medien geschädigt. Dazu wurde zunächst eine Suspension mit Jurkatzellen für 3 min bei 90 x g zentrifugiert und der Überstand verworfen. Die Bestimmung der Zellzahl erfolgte mit Trypanblau (vergl. 3.3.1.2) nach Resuspension des Zellpellets in 10 ml PBS. Anschließend wurden die Zellen wiederum für 3 min bei 90 x g zentrifugiert und mit PBS auf eine Zellzahl von 30 bis 40 Mio. Zellen/ml eingestellt. Die Inkubation mit verschiedenen zelltoxischen Medien fand in 1,5 ml Reaktionsgefäßen mit je 1,5 bis 2 Mio. Zellen statt. Digitonin ist ein Steroid-Glycosid des Fingerhuts Digitalis purpurea und führt zur Permeabilisierung von Zellmembranen. Die Permeabilisierung der Zellmembran erfolgte sowohl zeit- als auch konzentrationsabhängig. Zur Untersuchung der zeitabhängigen Schädigung der Zellmembran wurden zu 50 µl der Zellsuspension (entsprechend 1,5 bis 2 Mio. Zellen) PBS und Digitoninlösung (0,5 g/l) ad 100 µl pipettiert, sodass sich in den Zellproben eine Endkonzentration von 10 oder 25 µg/ml Digitonin einstellte. Die Proben wurden für 20 min, 1 h oder 3 h inkubiert. Als Kontrolle diente ein Ansatz ohne Zugabe von Digitonin, der für 3 h inkubiert wurde. Die konzentrationsabhängige Schädigung der Zellmembran erfolgte durch Inkubation der Zellproben für jeweils 1 h bei Endkonzentrationen von 10, 20, 40 oder 100 µg/l Digitonin bzw. als Negativkontrolle in Abwesenheit von Digitonin. In einem weiteren Versuch erfolgte die Schädigung der Zellmembranen durch hypoosmotische Medien. Dafür wurden die 50 µl Zellsuspension zentrifugiert (90 x g, 3 min) und das Zellpellet in 100, 70, 60, 45, 40 oder 30 µl PBS resuspendiert. Anschließend wurde mit H2O ad 100 µl ergänzt und für 1 h inkubiert. Nach Inkubation der Zellen wurden alle Proben zentrifugiert (90 x g, 3 min) und der Überstand in ein neues Reaktionsgefäß überführt. Die Bestimmung der Zellschädigung erfolgte mittels Zytotoxizitätstest (vergl. 3.1.4). Die Quantifizierung der Freisetzung von Tβ4 erfolgt durch RP-HPLC (vergl. 3.2.1). - 41 - Methoden 3.3.2 Humane HSC Hepatische Sternzellen (HSC) dienen als Model der Fibrosierung der Leber. Die Experimente wurden mit humanen HSC durchgeführt, die nach der Methode von Nakamura et al. [55] aus Leberbiopsien isoliert wurden. Die Leberbiopsien wurden Patienten mit morbider Adipositas, die sich einer Bypassoperation unterzogen nach einem genehmigten Protokoll (IRB 070701) entnommen. Alle Experimente mit humanen HSC wurden in Zusammenarbeit mit der Arbeitsgruppe von Prof. Marcos Rojkind während eines dreimonatigem Aufenthalts in seinem Labor in Washington, D.C. durchgeführt. 3.3.2.1 Zellkultur Humane HSC wurden in 160 ml Zellkulturflaschen in Medium (DMEM, 10 % (v/v) FBS, 1 % (v/v) Aminosäuren, 100 U Penicillin, 100 µg/ml Streptomycin) kultiviert. Der Wechsel des Mediums erfolgte alle 2 bis 3 Tage. Sobald die Zellen eine Konfluenz von 80 bis 90 % erreicht hatten, wurden sie neu ausgesät. Dafür wurde das Medium entfernt und die Zellen mit PBS gewaschen. Die Zugabe von 3 ml Trypsin/EDTA (0,25 %) führte zum Ablösen der Zellen innerhalb von 3 min. Die abgelösten Zellen wurden in 10 ml Medium aufgenommen und zentrifugiert (200 x g, 5min, 4 °C). Das Zellpellet wurde in 6 ml frischem Medium resuspendiert und je 2 ml der Zellsuspension in eine neue Zellkulturflasche mit 10 ml Medium ausgebracht. 3.3.2.2 Wundheilungs-Assay Die Migration der Zellen wurde in vitro in einem Wundheilungs-Assay getestet. Die Zellen wandern dabei aus einem konfluenten Bereich in einen Bereich, indem Zellen durch mechanische Belastung entfernt wurden. Zur Vorbereitung wurden die Vertiefungen von 6-Well-Zellkulturtestplatten mit steriler Gelatinelösung bei 37 °C für 2 h beschichtet. Ungebundene Gelatine wurde durch zweimaliges Waschen mit PBS entfernt. Zur Bestimmung der Zellmigration in Anwesenheit von vernetztem Tβ4 wurden die beschichteten Zellkulturtestplatten speziell behandelt: In die Vertiefungen wurden jeweils 4,5 mU mTGA sowie 50 µg Tβ4 zu 2 ml Phosphatpuffer gegeben. Durch mTGA wird Tβ4 mit Gelatine kovalent vernetzt. Die Inkubation erfolgte für - 42 - Methoden 1 h bei 37 °C unter leichtem Schwenken. Anschließend wurden ungebundene Reagenzien durch zweimaliges Waschen mit PBS entfernt. An Gelatine gebundenes Tβ4 verbleibt in den Vertiefungen. Als Kontrolle diente scrambled Tβ4 (scrTβ4). Dabei handelt es sich um ein chemisch synthetisiertes Peptid mit der gleichen Aminosäurezusammensetzung wie Tβ4, jedoch in einer zufälligen Reihenfolge. Die Vernetzung von scrTβ4 an beschichtete Zellkulturplatten erfolgte analog zur Vernetzung von Tβ4. Die Zellen aus konfluenten Zellkulturflaschen wurden gleichmäßig in die Vertiefungen der Zellkulturtestplatten gesät. Bei einer Konfluenz von 90 bis 100 % wurden die Zellen über Nacht in einem serumreduzierten Medium (DMEM, 0,1 % (v/v) FBS, 1 % Aminosäuren, 100 U Penicillin, 100 µg/ml Streptomycin) gehalten, um die Proliferation der Zellen im anschließenden Wundheilungs-Assay zu minimieren. Zur Imitation einer Schürfwunde wurde eine 1000-µl-Pipettenspitze über den konfluenten Zellrasen gezogen und hinterließ eine zellfreie Spalte definierter Breite. Abgelöste Zellen wurden durch Abnehmen des Mediums und zweimaliges Waschen mit je 1 ml PBS entfernt. Anschließend wurden die Zellen in je 2 ml serumreduziertem Medium mit verschiedenen Stimuli inkubiert. Jede Stimulation erfolgte in Triplikaten. Die Zellen wanderten abhängig von der Zeit und den zugesetzten Stimuli unterschiedlich schnell in die zellfreie Spalte ein, wodurch die Spaltfläche verkleinert wurde. Für eine Negativkontrolle wurden die Zellen mit serumreduzierten Medium ohne Zusätze und für eine Positivkontrolle mit 50 ng/ml PDGF versetzt. PDGF ist ein Wachstumsfaktor und stimuliert unter anderem die Migration von humanen HSC. Des Weiteren wurden 10 ng/ml Tβ4 und 10 ng/ml scrTβ4 jeweils ohne und mit Zugabe von 50 ng/ml PDGF getestet. Der Einfluss von immobilisiertem Tβ4 und scrTβ4 in Ab- und Anwesenheit von PDGF auf die Zellmigration wurde in den zuvor speziell behandelten Zellkulturplatten getestet. Diese Zellen wurden mit serumreduzierten Medium ohne und mit Zusatz von 50 ng/ml PDGF behandelt. Sofort nach Zugabe der verschiedenen Media sowie nach weiteren 24 h wurde die Wundschließung dokumentiert. Dafür wurden je Vertiefung 5 Aufnahmen der zellfreien Spalte an unterschiedlichen Stellen unter einem Mikroskop aufgenommen und mit der Software Image J ausgewertet. Dabei wurde die zellfreie Wundfläche gemessen. Die Wundflächen wurden für jede Stimulierung gemittelt und die prozentuale Abnahme der Wundfläche nach 24 h berechnet. - 43 - Methoden 3.4 Weitere Methoden 3.4.1 Aktinpräparation Die Isolierung von Aktin erfolgte aus einem Rinderherz nach einer modifizierten Methode von Pardee und Spudich [56]. Dazu wurde ein Rinderherz unter ständiger Kühlung weitgehend von Sehnen, Fett, Bindegewebe sowie größeren Blutgefäßen präparativ befreit. Die Zerkleinerung des geschnittenen Rinderherzens erfolgte in einem vorgekühlten Fleischwolf. Das zerkleinerte Herzmuskelfleisch wurde für jeweils 10 min bei 4 °C nacheinander in den Lösungen 1 bis 3 gerührt. Vor jedem Wechsel des Puffers wurde das Herzmuskelfleisch durch Verbandsmull ausgepresst und dadurch von überschüssiger Pufferlösung befreit. Anschließend erfolgte ein Waschschritt, bei dem das Herzmuskelfleisch zwei Mal mit je 1 l H2O bei 4 °C gerührt und erneut durch Verbandmull gepresst wurde. Die Filtrate wurden verworfen und das Herzmuskelfleisch in 4 °C kaltem Aceton bis zum Erreichen der Raumtemperatur gerührt. Daraufhin erfolgte die Behandlung mit jeweils zwei Mal Aceton und zwei Mal destilliertem Aceton unter stetigem Rühren. Vor jeder neuen Zugabe von Aceton wurde das Herzmuskelfleisch durch Verbandsmull gepresst. Im Herzmuskelfleisch enthaltene Fette lösen sich in Aceton und werden dadurch entfernt. Abschließend wurde das Herzmuskelfleisch im Exsikkator getrocknet. Die Lagerung des entstandenen Acetonpulvers des Herzmuskels erfolgte bei -20 °C. Lösung 1 0,15 M KH2PO4/KOH, pH 6.5 0,10 M KCl Lösung 2 50 mM NaHCO3 Lösung 3 1 mM Na-EDTA Aktin wurde aus 5 g des Acetonpulvers des Herzmuskels durch Inkubation für 30 min in 100 ml G-Puffer im Eisbad unter Rühren extrahiert. Aktin liegt unter diesen Niedrigsalzbedingungen in monomerer Form in Lösung vor. Der Extrakt wurde durch Verbandsmull filtriert und zentrifugiert (41.000 x g, 4 °C, 1 h), um ungelöste Bestandteile zu entfernen. Der Überstand wurde abgenommen und mit 10 x Polymerisationslösung 10:1 verdünnt. Die Inkubation in Polymerisationslösung erfolgte über Nacht im Eisbad und induziert die Polymerisation von G-Aktin zu F-Aktin, das präzipitiert. Die Elimination von Tropomyosin fand unter Hochsalzbedingungen statt. Dazu wurde die Konzentration von KCl im Überstand von 50 mM auf 600 mM erhöht und 30 min im Eisbad - 44 - Methoden gerührt. Tropomyosin geht dabei in Lösung und kann durch Zentrifugation (108 000 x g, 4 °C, 3 h) abgetrennt werden. Das Pellet wurde in Waschpuffer aufgenommen und erneut zentrifugiert (108 000 x g, 4 °C, 2 h). Dadurch wird restliches Tropomyosin gelöst und entfernt. F-Aktin im Pellet wurde mit G-Puffer resuspendiert und über Nacht gegen G-Puffer dialysiert. F-Aktin depolymerisiert unter diesen Bedingungen wieder zu G-Aktin. Abschließend wurde zentrifugiert (230 000 x g, 4 °C, 1 h) und der Überstand im Eisbad aufbewahrt. Die Konzentrationsbestimmung der Aktinlösung erfolgte durch Aminosäureanalyse (vergl. 3.2.2), die Bestimmung der biologischen Aktivität mittels Kugelfallviskosimetrie (vergl. 3.4.2). G-Puffer 2 mM Tris/HCl, pH 8 0,2 mM Na2ATP 0,2 mM CaCl2 3.4.2 10x Polymerisationslösung 500 mM KCl 20 mM MgCl2 8 mM Na2ATP pH 8 mit KOH Waschpuffer 600 mM KCl 2 mM MgCl2 1 mM Na2ATP In G-Puffer pH 8 mit KOH Kugelfallviskosimetrie Die biologische Aktivität (Polymerisation von G-Aktin zu F-Aktin) des isolierten Aktins wurde im Kugelfallviskosimeter, angelehnt an die Methode von MacLean-Fletcher und Pollard [57], geprüft. Dazu wurde die isolierte G-Aktinlösung 1:25 mit G-Puffer verdünnt. Von dieser Verdünnung wurden 50 µl mit 2 µl MgCl2-Lösung (100 mM) und entweder 5 µl G-Puffer, Tβ4Lösung oder scrTβ4-Lösung versetzt und in eine Glaskapillare (50 µl, Innendurchmesser: 0,5 mm) aufgezogen. Die Zugabe von Tβ4 und scrTβ4 erfolgte in einem molaren Verhältnis von 1:1 zu Aktin. MgCl2 induziert die Polymerisation von G-Aktin zu F-Aktin, wodurch die Viskosität der Lösung steigt. Das untere Ende der Glaskapillare wurde im Bunsenbrenner durch Schmelzen verschlossen. Nach 4 h Inkubation wurde die Glaskapillare in einem Winkel von 30° zur Horizontalen befestigt und die Zeit gemessen, die eine Metallkugel (Durchmesser 0,4 mm) zum Durchlaufen einer Strecke von 4,5 cm in der Flüssigkeitssäule benötigt. - 45 - Methoden 3.4.3 Vernetzung von Thymosin β4 Die Vernetzungsreaktion von Tβ4 mit verschiedenen Proteinen gelang entweder chemisch mittels EDC oder enzymatisch durch mTGA. 3.4.3.1 Chemische Vernetzung mit EDC Transiente Interaktionen zwischen Proteinen oder Peptiden können durch eine chemische Vernetzung mit EDC in kovalente Bindungszustände überführt werden. EDC ist ein Carbodiimid und führt zur Ausbildung von Isopeptidbindungen zwischen freien Amino- und Carboxylgruppen, wenn sich diese in unmittelbarer Nähe zueinander befinden. Die Reaktionsansätze enthielten jeweils verschiedene Proteine und Tβ4 im molaren Verhältnis von 1:2 in MES-Puffer (5 mM MES/HCl, pH 6). Die Proteinkonzentration in der Reaktionslösung betrug zwischen 1 und 3 g/l. Nach einer Inkubationszeit von 15 min bei RT wurde EDC im 1,5 fachen molaren Überschuss bezogen auf die Gesamtproteinmenge zugegeben. Die Reaktion erfolgte für 20 h bei RT. 3.4.3.2 Enzymatische Vernetzung mit mikrobieller Transglutaminase Die mikrobielle Transglutaminase (mTGA) führt zur Vernetzung von Proteinen und Peptiden indem sie ihr zugängliche Glutamin- und Lysinseitenketten kovalent miteinander verbindet. Dafür wurde zu verschiedenen Proteinen Tβ4 im zweifachen molaren Überschuss zugegeben. Die eingesetzte Menge an mikrobieller Transglutaminase betrug 1 mU pro 100 µg Protein. Die Reaktion erfolgte in Phosphatpuffer (50 mM Na2HPO4/NaH2PO4, pH 8.0) bei einer Proteinkonzentration zwischen 1 und 3 g/l für 1 h bei 37 °C. - 46 - Ergebnisse 4 Ergebnisse 4.1 Isolation und Charakterisierung von G-Aktin Das in dieser Arbeit verwendete G-Aktin wurde aus einem Rinderherz nach der Methode von Pardee und Spudich [56] isoliert (vergl. 3.4.1) und in einem Puffer unter Zusatz von ATP auf Eiswasser gelagert. Die Haltbarkeit betrug bis zu drei Monate. Zur Charakterisierung der isolierten Aktinlösung wurde die Reinheit, Konzentration und Polymerisierbarkeit bestimmt. Da G-Aktin in verschiedenen Isoformen vorliegt, konnte zusätzlich durch Massenspektrometrie die vorherrschende Isoform bestimmt werden. 4.1.1 Reinheit des G-Aktins Die Überprüfung der Reinheit erfolgte durch SDS-PAGE. Dafür wurde 1 µl der isolierten Aktinlösung mit 10 µl Auftragspuffer versetzt und in einem 10 % SDS-Gel aufgetrennt (vergl. 3.1.1.1). Die Visualisierung der Proteine erfolgte durch Coomassie-Färbung (vergl. 3.1.1.2). G-Aktin besitzt eine Molekülmasse von 42 kDa und ist als einzelne Bande im SDS-Gel sichtbar (Abb. 4-1). Die Gesamtintensität weiterer Banden bei höheren oder niederen Molekülmassen beträgt 1,3 %, sodass die isolierte G-Aktinlösung eine Reinheit von 98,7 % aufweist. Abb. 4-1. Reinheit des isolierten Aktins. Intensität der Coomassie-Färbung in Abhängigkeit der Molekülmassen (MM) nach Auftrennung von 1 µl der isolierten Aktinlösung im 10 % SDS-Gel. Relative Intensität von Aktin bei 42 kDa beträgt 98,7 %.Relative Intensität der Verunreinigungen bei 117 kDa, 109 kDa und 15 kDa betragen 0,3 %, 0,5 % und 0,5 %. - 47 - Ergebnisse 4.1.2 Konzentrationsbestimmung der G-Aktinlösung Die Konzentrationsbestimmung der G-Aktinlösung erfolgte durch Aminosäureanalyse (vergl. 3.2.2). Eine Standardbestimmung der Proteinkonzentration mittels UV-Spektroskopie oder Bradford ist wegen der hohen Variabilität oder einem unzureichendem Detektionslimit nicht durchführbar. Zur Konzentrationsbestimmung von Aktin wird bei der Aminosäureanalyse lediglich 1 µg Protein benötigt. Da bei der Aminosäureanalyse die Anzahl der einzelnen Aminosäuren im Protein bestimmt wird, wurde durch Vergleich mit der theoretischen Aminosäurezusammensetzung nachgewiesen, dass es sich bei dem isolierten Protein um GAktin handelt. Tab. 4-1. Vergleich experimentell ermittelter Aminosäureanzahl von α-cardiac muscle-Aktin durch Aminosäureanalyse mit theoretischer Anzahl. Aminosäure x Asx 36 ± 2 34 Glx 46 ± 0 39 Ser 22 ± 1 24 His 11 ± 1 9 Gly 32 ± 1 28 Thr 26 ± 1 26 Arg 18 ± 1 18 Ala 29 ± 1 29 Tyr 14 ± 1 16 Val 20 ± 1 21 Met 9±3 15 Ile 26 ± 0 30 Phe 11 ± 1 12 Leu 27 ± 1 27 Lys 19 ± 1 19 ±σ Gesamt Theorie 347 Die Aminosäuren Cystein, Tryptophan und Prolin können über diese Methode nicht quantifiziert werden. Die Anzahl der verbliebenen Aminosäuren des α-cardiac muscle-Aktins beträgt in der Theorie 347. Tab. 4-1 zeigt den Vergleich der theoretischen und experimentellen Aminosäurezahlen. Die triplikate Bestimmung ergab eine Konzentration von 8,13 ± 0,67 g/l für G-Aktin in der isolierten Lösung. - 48 - Ergebnisse 4.1.3 Polymerisation des isolierten G-Aktins Monomeres Aktin (G-Aktin) wird in der Zelle zu filamentösem Aktin (F-Aktin) polymerisiert (aggregiert) und wieder depolymerisiert. Dies ist ein wichtiger Vorgang während Zellverformung und Zellbewegung. Das Polymerisationsverhalten des isolierten Aktins wurde durch Kugelfallviskosimetrie untersucht (vergl. 3.4.2). Die Bestimmung der Fallzeit einer Kugel erfolgte nach salzinduzierter Polymerisation von G-Aktin durch MgCl2. Zudem wurde die Aktin-sequestrierende Wirkung von Tβ4 untersucht. Als Negativkontrolle wurde scrTβ4 verwendet. Dabei handelt es sich um ein synthetisches Peptid mit der gleichen Aminosäurezusammensetzung wie Tβ4, allerdings in einer randomisierten Reihenfolge. Abb. 4-2. Bestimmung der Aktinpolymerisation durch Kugelfallviskosimetrie. Fallzeit (s) der Kugel durch die Kapillare nach Polymerisation von Aktin durch MgCl2 in Abwesenheit oder Anwesenheit von Tβ4 und scrTβ4. Die Konzentration von Aktin betrug 8 mM. Tβ4 und scrTβ4 wurden jeweils im molaren Verhältnis von 1:1 bezogen auf Aktin eingesetzt. x ± σ, n=3 Die Fallzeiten sind in Abb. 4-2 graphisch dargestellt. Das isolierte G-Aktin polymerisierte in Anwesenheit von MgCl2. Dadurch erhöhte sich die Viskosität der Lösung und die Fallzeit der Kugel durch die Flüssigkeitssäule stieg von 6 s für nicht-MgCl2-behandeltes Aktin auf 17 s an. In Anwesenheit von Tβ4 wird diese salzinduzierte Polymerisation inhibiert. Die Fallzeit entsprach 7 s und war damit vergleichbar niedrig wie in reinem Puffer. ScrTβ4 inhibiert die Aktinpolymerisation nicht, die Fallzeit betrug 18 s. Das isolierte G-Aktin ist somit nachweislich zu F-Aktin polymerisierbar und diese Polymerisierung kann durch Tβ4, nicht jedoch durch scrTβ4 inhibiert werden. - 49 - Ergebnisse 4.1.4 Identifizierung der Aktin-Isoform In Vertebraten werden die verschiedenen Isoformen des Aktins in drei Hauptgruppen unterteilt: α-, β- und γ-Aktin. Im Herzmuskel wird vorwiegend α-cardiac muscle-Aktin exprimiert. Die Bestimmung der Anteile weiterer Isoformen in der isolierten G-Aktinlösung erfolgte durch Vergleich der Intensität von spezifischen tryptischen Fragmenten, die sich zwischen den Isoformen unterscheiden (Abb. 4-3). Für die Experimente zur Identifizierung der Vernetzungsstellen zwischen Tβ4 und Aktin mittels Trypsin-In-Gel-Verdau und anschließender HPLC-ESI-MS-Analyse wurde auch unbehandeltes Aktin untersucht. Aus diesen Daten konnte die Isoform des G-Aktins in der isolierten Lösung bestimmt werden. Dafür wurden 3 µl der G-Aktinlösung in einem 10 % SDS-Gel mittels SDS-PAGE aufgetrennt und mit Coomassie gefärbt (vergl. 3.1.1.1 und 3.1.1.2). Die gefärbte Aktin-Bande bei 42 kDa wurde einem Trypsin-In-Gel-Verdau unterzogen (vergl. 3.2.3.1) und die Massen der tryptischen Fragmente mittels HPLC-ESI-MS (vergl. 3.2.3.2) bestimmt. Es konnten keine spezifischen Fragmente der Isoformen α2-aortic smooth muscle und γenteric smooth muscle nachgewiesen werden. Für die Isoformen β-cytoplasmic 1, γcytoplasmic 2 wurden zwei spezifische Fragmente (AS 148-177 und 292-312) identifiziert, deren Intensität im Vergleich zu den korrespondierenden Fragmenten der α-cardiac muscleIsoform 0,2 bzw. 0,6 % entsprach. Für die Isoform α-skeletal muscle konnte ein spezifisches Fragment (AS 292-312) identifiziert werden, dessen Intensität 2,3 % des entsprechenden Fragmentes der α-cardiac muscle-Isoform entsprach. Der Anteil der Isoform α-cardiac muscle in der isolierten Aktinlösung beträgt somit über 95 % im Vergleich zu den anderen bovinen Isoformen. Daneben konnten geringe Mengen an αcardiac muscle-Aktin und α-skeletal muscle-Aktin nachgewiesen werden. - 50 - Ergebnisse Abb. 4-3. Vergleich der Aminosäuresequenzen der bovinen Isoformen des Aktins. α-cardiac muscle (α-cm), α-skeletal muscle (α-sm), α-aortic smooth muscle (α-am), βcytoplasmic 1 (β–c1), γ-cytoplasmic 2 (γ-c2), γ-enteric smooth muscle (γ-em). Sequenzänderungen bezogen auf α-cm sind hervorgehoben. Tryptische Fragmente, die sich in ihrer Masse von α-cm unterscheiden sind eingerahmt, davon nachgewiesene Fragmente sind rot eingerahmt. - 51 - Ergebnisse 4.2 Der Aktin-Thymosin β4-Komplex 4.2.1 Nachweis der Komplexierung durch EDC-Vernetzung Aktin ist ein vielfach untersuchter Interaktionspartner von Tβ4. Nach der Isolierung und Charakterisierung von G-Aktin konnte nun die Interaktion mit Tβ4 durch EDC nachgewiesen werden. EDC ist ein Null-Längen-Crosslinker und führt zur Bildung von kovalenten Bindungen zwischen freien Amino- und Carboxylgruppen, die sich in unmittelbarer Nähe zueinander befinden. Abb. 4-4. Nachweis der Komplexbildung zwischen Aktin und Tβ4 durch EDC-Vernetzung. Aktin (10 µM) und Tβ4 (20 µM) wurden wie beschrieben mit EDC vernetzt. Nach 24 h Inkubation wurden je 10 µl Mit Probenpuffer versetzt und durch SDS-PAGE (12 % Gel, Coomassie-Färbung) analysiert. Als Negativkontrolle wurde BSA mit Tβ4 und EDC behandelt (6+7). (1) Aktin, (2) Aktin+EDC, (3) Aktin+ Tβ4+EDC, (4) Tβ4+EDC, (5) Tβ4, (6) BSA+ Tβ4+EDC, (7) BSA. Links: Molekülmassen des Proteinstandards Aktin, Tβ4 sowie ein Gemisch im molaren Verhältnis von 1:2 wurden unter Zugabe von EDC bei Raumtemperatur für 20 h inkubiert (vergl. 3.4.3.1). Als Vergleich dienten je eine Probe GAktin und Tβ4, die nicht mit EDC inkubiert worden waren. Die Proteine wurden mittels SDSPAGE (vergl. 3.1.1.1) in einem 12 %-Gel aufgetrennt und die Proteinbanden mit Coomassie gefärbt (vergl. 3.1.1.2). - 52 - Ergebnisse Unbehandeltes Aktin und Tβ4 werden durch eine einzelne Bande entsprechend ihrer Molekulargewichte von 42 kDa und 5 kDa repräsentiert (Abb. 4-4, 1+5). Die Zugabe von EDC zu Aktin führt zur Ausbildung von intermolekularen Vernetzungen (Abb. 4-4, 2). Dies ist für Aktin an den zusätzlichen Banden bei 80 kDa und 120 kDa zu erkennen und spricht für eine Vernetzung zwischen 2 und 3 Aktinmolekülen. Die Intensität dieser Banden wurde densitometrisch mit dem Programm Image Lab bestimmt. Demnach sind insgesamt 12 % des Aktins intermolekular vernetzt. EDC führt zur Ausbildung von kovalenten Bindungen im Aktin-Tβ4-Komplex. Die Molekülmasse des Komplexes setzt sich aus Aktin (42 kDa) und Tβ4 (5 kDa) zusammen und läuft daher in der SDS-PAGE als Bande oberhalb des monomeren G-Aktins (Abb. 4-4, 3). Die Intensitäten der Banden betrugen für unvernetztes Aktin 52 % im Vergleich zum Vernetzungsprodukt mit 48 %. Die Vernetzungsreaktion durch EDC ist spezifisch für Aktin und Tβ4. Dies wurde durch das Ausbleiben einer Vernetzungsreaktion zwischen Tβ4 und BSA nach Zugabe von EDC nachgewiesen (Abb. 4-4, 6+7). 4.2.2 Identifizierung der Vernetzungsstellen Zur genaueren Untersuchung der Vernetzung zwischen Aktin und Tβ4 wurden im Folgenden die Vernetzungsstellen identifiziert. Dafür wurden die Vernetzungsansätze in einem 10 %SDS-Gel aufgetrennt, um die Trennleistung zwischen den Banden bei 42 kDa (Aktin) und 47 kDa (Aktin x Tβ4) zu optimieren. Die ausgeschnittenen Banden für unbehandeltes Aktin, EDC-behandeltes Aktin und Aktin x Tβ4 wurden einem Trypsin-In-Gel-Verdau unterzogen (vergl. 3.2.3.1) und die tryptischen Fragmente mittels HPLC-ESI-MS analysiert (vergl. 3.2.1). Die experimentellen Signale der Massenspektren (m/z) wurden computergestützt dekonvuliert (ladungsbereinigt), sodass im Folgenden m/z jeweils den monoisotopischen Massen [M+H]+ der einfach geladenen Ionen entspricht. Die tryptischen Fragmente des Aktins nach EDC-Vernetzung unterscheiden sich nur von unbehandeltem Aktin, wenn intramolekulare Vernetzungen durch EDC ausgebildet werden würden. Dagegen unterscheiden sich die tryptischen Fragmente nach EDC-Vernetzung von Aktin und dem Aktin-Tβ4-Addukt nur unter folgenden Bedingungen voneinander: - 53 - Ergebnisse 1. Das tryptische Fragment enthält eine Vernetzungsstelle zwischen einem Aktin- und einem Tβ4-Fragment. 2. Bei dem tryptischen Fragment handelt es sich um ein Tβ4-Fragment. 3. Das tryptische Fragment enthält Vernetzungsstellen höherer Ordnung, indem mindestens zwei kovalente Bindungen innerhalb von mindestens zwei Fragmenten ausgebildet werden. In allen Fällen ist eine Identifizierung des tryptischen Fragments über seine monoisotopische Masse möglich. Wenn es sich um ein tryptisches Fragment mit Vernetzungsstelle handelt, setzt sich die Masse aus der Summe der einzelnen monoisotopischen Massen der vernetzten Fragmente vermindert um die Masse der abgespaltenen Gruppe zusammen. So muss bei der chemischen Vernetzung mit EDC eine Masse von 19,019 Da für die Abspaltung von H3O+ abgezogen werden. Die theoretischen monoisotopischen Massen der tryptischen Fragmente von Aktin und Tβ4 wurden mit dem Programm MS Digest erstellt. Zur Identifizierung der an der Vernetzung beteiligten Aminosäuren dienten weiterhin die MS/MS Daten aus der zusätzlichen Fragmentierung durch CID im Massenanalysator. Dabei werden N-terminal und C-terminal charakteristische b- und y-Ionenserien abgespalten, die zur Identifizierung der genauen Aminosäuresequenz dienen und damit Hinweise auf die Vernetzungsstelle liefern. Das theoretische MS/MS-Fragmentierungsmuster einzelner tryptischer Fragmente wurde mit dem Programm MS Product erstellt. Die Übereinstimmung von theoretischen und experimentellen Fragmentierungsmustern der Vernetzungsfragmente wurde mit dem Programm MS Tag überprüft. 4.2.2.1 Ausschluss der intramolekularen Vernetzung von Aktin Vor der Identifizierung der Vernetzungsstellen zwischen Aktin und Tβ4, wurden zunächst unbehandeltes Aktin und mögliche intramolekulare Vernetzungen nach Behandlung mit EDC untersucht. Aktin wird durch Trypsin theoretisch in 37 Fragmente gespalten. Von diesen Fragmenten konnten 25 durch HPLC-ESI-MS in beiden Aktin-Proben nachgewiesen werden. Abb. 4-5 A zeigt die Aminosäuresequenz des bovinen α-cardiac muscle-Aktins sowie die identifizierten tryptischen Fragmente. Die Sequenzabdeckung der nachgewiesenen Fragmente betrug 93 %. Lediglich Fragmente mit einer Molekülmasse unter 500 Da waren nicht nachweisbar. - 54 - Ergebnisse Die Auswertung der HPLC-Chromatogramme, der Massenspektren sowie der MS/MSSpektren zwischen unbehandeltem Aktin und dem mit EDC behandeltem Aktin lieferte keine Hinweise auf spezifische Fragmente, die durch intramolekulare Vernetzungsreaktionen entstanden wären. Abb. 4-5. Sequenzabdeckung durch HPLC-ESI-MS-Analyse. Aminosäure-Sequenz und tryptische Fragmentierung von (A) Aktin (UniProt KB Q3ZC07) und (B) Thymosin β4 (UniProt KB P62328). Zahlen über der Sequenz geben die Aminosäureposition an. Balken kennzeichnen durch HPLC-ESI-MS identifizierte Fragmente. 4.2.2.2 Vernetzungsstellen im Aktin –Thymosin β4-Komplex durch EDC Bei der Vernetzung von Aktin und Tβ4 durch EDC entsteht ein Vernetzungsprodukt (vergl. Abb. 4-4, 3), welches mit 47 kDa der Masse von einem Aktin und einem Tβ4 Molekül entspricht (Aktin x Tβ4). EDC führt zur Ausbildung von Isopeptidbindungen zwischen Aminound Carboxylgruppen unter Abspaltung von H3O+. Die HPLC-ESI-MS Analyse der tryptischen Fragmente von Aktin und seinem Tβ4-Addukt ergab die in Abb. 4-6 dargestellten HPLC-Chromatogramme. Im Vergleich zu Aktin wurden bei Aktin x Tβ4 neun zusätzliche Fragmentmassen detektiert, die im Zusammenhang mit der Vernetzung stehen. Sechs dieser spezifischen Fragmentmassen konnten Fragmenten von Tβ4 zugeordnet werden (T). Diese Zuordnung erfolgte zunächst durch Vergleich der spezifischen Fragmentmassen mit dem theoretischen Fragmentierungsmuster von Tβ4. Die - 55 - Ergebnisse Richtigkeit der Zuordnung wurde anschließend durch Auswertung der MS/MS-Daten zu diesen Massen bestätigt. Die Abdeckung der Sequenz von Tβ4 durch die identifizierten Fragmentmassen ist in Abb. 4-5 dargestellt. Die Sequenzabdeckung der identifizierten Fragmente des Aktins im Addukt ist identisch mit der Sequenzabdeckung des unvernetzten Aktins. Abb. 4-6. RP-HPLC-Chromatogramme von Aktin und Aktin x Tβ4 nach EDC-Vernetzung. Reaktionsansätze wurden durch SDS-PAGE aufgetrennt und nach Trypsin-In-Gel-Verdau durch HPLC-ESI-MS analysiert. Linearer Gradient zwischen 2 und 55 min von 4 % auf 55 % ACN. (T) Tryptische Fragmente von Tβ4, (X1-X3) Tryptische Fragmente der Vernetzungsstellen zwischen Aktin und Tβ4. Drei weitere spezifische Massen wurden als Vernetzungsfragmente (X1-X3) identifiziert. In Tab. 4-2 sind korrespondierend zum HPLC-Chromatogramm des Trypsin-Verdaus von Aktin x Tβ4, den Retentionszeiten die entsprechenden Fragmente und ihre monoisotopischen Massen zugeordnet. - 56 - Ergebnisse Tab. 4-2. Identifizierte tryptische Fragmente des Aktin-Tβ4-Addukts durch EDC. Vernetzungsreaktion mit EDC erfolgte in einem molaren Verhältnis von 1:2 für 20h bei RT. Reaktionsansatz wurde durch SDS-PAGE aufgetrennt, die Bande des Aktin-Tβ4-Addukts einem Trypsin-Verdau unterzogen und mittels HPLC-ESI-MS analysiert. Rt in min 5.2 6.2 9.6 10.1 11.0 11.0 12.3 12.3 13.4 14.2 14.5 14.6 14.8 15.6 16.3 16.8 19.2 19.7 20.4 20.9 20.9 21.5 22.1 22.2 23.0 24.9 25.6 26.1 27.7 28.4 31.4 46.9 (T) (T) (T) (X1) (T) (T) (X2) (T) (X3) Trypsin-Fragment Intensität A207-210 T32-38 T26-31 A192-196 A51-61 A285-290 T20-31 A329-336 A19-28 A329-335 A178-183 A40-50 A40-50+T39-43X T26-38 A360-372 T1-11A A197-206 A316-326 A85-95 A63-68 A1-18+T17-19X,P T1-14A A29-39 A1-18A,P A96-113 A184-191 A239-254 A69-84H A148-177+T1-11X A148-177 A257-284P A119-147 0.41 0.65 1.73 4.78 31.34 3.21 1.94 0.38 32.43 21.78 27.23 17.83 4.77 26.63 36.84 33.78 46.90 41.10 28.07 8.29 2.98 70.37 34.98 14.38 210.36 35.91 168.39 141.37 1.18 75.55 0.97 4.31 m/z theoretisch experimentell 516.314 516.315 876.431 876.433 655.377 655.379 631.377 631.378 1198.522 1198.526 734.350 734.333 1371.711 1371.714 923.567 923.569 976.448 976.451 795.472 795.474 644.373 644.373 1171.571 1171.573 1643.772 1643.765 1512.790 1512.794 1500.708 1500.713 1304.604 1304.606 1130.548 1130.551 1161.618 1161.622 1515.749 1515.754 644.434 644.435 2349.152 2349.159 1694.794 1694.801 1198.706 1198.707 1978.891 1978.893 1956.044 1956.051 998.486 998.489 1790.892 1790.895 1974.919 1974.935 4482.203 4482.210 3196.610 3196.625 3202.489 3202.497 3251.630 3251.632 δm/m in ppm 1.94 2.40 2.44 0.95 3.17 -23.42 1.90 1.84 2.77 2.14 0.62 1.62 -4.26 2.38 3.53 1.61 2.92 3.10 3.17 1.40 2.94 4.01 1.25 1.06 3.73 2.70 1.73 8.24 1.58 4.82 2.40 0.55 X. Vernetzungsstellen A. Acetylierung am Protein-N-Terminus P. Propionamid-Modifizierung am Cystein H. Methylhistidin δm/m. (m/z experimentell – m/z theoretisch) / (m/z theoretisch) Die Massen der Vernetzungsfragmente wurden durch MS/MS zusätzlich fragmentiert und konnten so den entsprechenden tryptischen Fragmenten von Aktin und Tβ4 zugeordnet werden. Das MS/MS-Spektrum des Fragmentes X1 mit der monoisotopischen Masse von 1643,765 Da ist in Abb. 4-7 dargestellt. Die b- und y-Serien im MS/MS-Spektrum stimmen - 57 - Ergebnisse mit den Produkt-Ionen der Peptide Tβ4 39-43 und Aktin 40-50 überein. Durch die Detektion der Ionen y11 und y12 konnte die Vernetzungsstelle zwischen der C-terminalen Carboxylgruppe von Tβ4 an S43 und einem der beiden Stickstoffe des Imidazolrings von H40 im Aktinmolekül lokalisiert werden. Abb. 4-7. Der C-Terminus von Tβ4 wird mittels EDC an Aktin H40 quervernetzt. MS/MS-Spektrum und Sequenz des Vernetzungsfragments mit [M+H]+ von 1643,765 Da. Das Spektrum entspricht dem Vernetzungsprodukt der tryptischen Fragmente von Aktin (AS 40-50, schwarz) und Tβ4 (AS 39-43, blau) und einer Vernetzung durch Bildung einer Isopeptidbindung zwischen der C-terminalen Carboxylgruppe S43 von Tβ4 und dem Imidazolring von H40 des Aktins. Ein weiteres spezifisches tryptisches Fragment X2 des Aktin-Tβ4-Adduktes, mit der Masse von 2349,159 Da, konnte einer Vernetzung der Peptide Tβ4 17-19 und Aktin 1-18 zugeordnet werden (Abb. 4-8). Dabei wurden zwei zusätzliche Modifikationen identifiziert: 1. Die Addition von Propionamid an C10 des Aktins durch nicht polymerisiertes Acrylamid während der SDS-PAGE führt zu einer Erhöhung der Masse um 71,037 Da. 2. Die Deamidierung an N12 des Aktins führt zu einer Massenzunahme um 0,984 Da. - 58 - Ergebnisse Die Vernetzung und Modifizierung wurde durch die Übereinstimmung der Produkt-Ionen der Peptide mit Teilen der b- und y-Serien im MS/MS-Spektrum bestätigt. Die Vernetzungsstelle konnte nicht exakt lokalisiert werden. Die Detektion des Ions b6 bei m/z 771,4 weist auf eine Vernetzung zwischen der ε-Aminogruppe von Tβ4 K18 oder K19 und der freien Carboxylgruppe an einer der Aminosäuren 1 bis 3 (DDE) des Aktins hin. Abb. 4-8. Der N-Terminus von Aktin wird durch EDC mit Tβ4 K18/19 quervernetzt. MS/MS-Spektrum und Sequenz des Vernetzungsfragments mit [M+H]+ 2349,159 Da. (a) Propionamid-Modifizierung von +71,039 Da am Cystein, (d) Deamidierung +0,98 Da an Asparagin. Das Spektrum korrespondiert mit dem Vernetzungsprodukt der tryptischen Fragmente von Aktin (AS 1-18, acetyliert am N-Terminus, schwarz) und Tβ4 (AS 17-19, blau) und einer Vernetzung durch Bildung einer Isopeptidbindung zwischen der Carboxylgruppe einer der 3 N-terminalen Aminosäuren von Aktin und den LysinSeitenketten an K18 oder K19 von Tβ4. Eine dritte Vernetzungsstelle zwischen Aktin und Tβ4 nach Behandlung mit EDC konnte der spezifischen Masse [M+H]+ 4482,210 Da zugeordnet werden. Das N-terminale Peptid von Tβ4 1-11 ist mit Aktin 148-177 vernetzt (Abb. 4-9). Die Produkt-Ionen des MS/MS-Spektrums - 59 - Ergebnisse korrespondieren mit Teilen der b- und y-Serien dieser Peptide. Durch die Detektion des Ions y*8 bei m/z 932,4 (Abb. 4-9) konnte eine Vernetzung über E8, E10 oder K11 des Tβ4-Peptids ausgeschlossen werden. Das Ion y*9 bei m/z 4238,1 enthält zusätzlich die Masse des Peptids Aktin 148-177. Damit kommt nur K3 des Tβ4-Peptids als Amin-Reaktant in Frage. Die Detektion der Ionen b16 und y10 führt zur Identifizierung von E167 des Aktins als Carboxyl-Reaktant. Abb. 4-9. EDC führt zur Quervernetzung zwischen Aktin E167 und Tβ4 K3. MS/MS-Spektrum und Sequenz des Vernetzungsfragments mit [M+H]+ von 4482,210 Da. Tryptisches Fragment von Aktin (AS 148-177, schwarz), tryptisches Fragment von Tβ4 (AS 1-11, Acetylierung am N-Terminus, blau). Das Spektrum entspricht einer Vernetzung zwischen der Carboxylgruppe von E167 des Aktins und der ε-Aminogruppe von L3 von Tβ4. Mit dem Programm MS-Tag konnten die experimentell ermittelten Vernetzungsstellen zwischen Aktin und Tβ4 nach EDC-Vernetzung durch Vergleich mit dem theoretischen MS/MS-Fragmentierungsmuster zusätzlich verglichen und bewertet werden. Die Auswertungen zu den drei spezifischen Trypsin-Fragmenten mit Vernetzungsstelle ist in Tab. - 60 - Ergebnisse 4-3 zusammengefasst. In das Programm wurden die MS/MS-Daten, die Sequenz des jeweiligen Aktin-Fragments sowie die Masse des vernetzten Tβ4-Fragments eingefügt. Die Wahrscheinlichkeit der Vernetzungsstelle wurde anhand eines MS-Tag Scores wiedergegeben. Je höher die Übereinstimmung zwischen experimentellen m/z-Werten und theoretischen Massen der Produkt-Ionen, umso höher der MS-Tag Score. Für die theoretische Vernetzung im Programm wurden alle Aminosäuren zugelassen. Die Auswertung ergab in allen drei Fällen den höchsten MS-Tag Score für die hier beschriebenen Vernetzungsstellen. Dabei betrug die von MS-Tag ermittelte Massenübereinstimmung zwischen experimentellen m/z-Werten und theoretischen ProduktIonen 50-69 %. Die Abweichung zwischen experimentell ermittelter und theoretischer Masse betrug nicht mehr als 4,5 ppm. Tab. 4-3. Zusammenfassung der EDC-Vernetzungsstellen des Aktin-Tβ4-Komplexes. X1 X2 X3 Aktin-Vernetzungsstelle DDE 1-3 H 40 E 167 Tβ4- Vernetzungsstelle K 18 oder K19 S 43 K3 m/z (experimentell) 1643,765 2349,159 4482,210 m/z (theoretisch) 1643,763 2349,148 4482,192 δm/m [ppm] 1,32 3,36 4,42 MS-Tag Score 55,1 54,5 46,5 Massenübereinstimmung 69,1 % 55,1 % 50,0 % δm/m. (m/z experimentell – m/z theoretisch) / (m/z theoretisch) Zusammenfassend konnten durch Behandlung mit EDC drei Vernetzungsstellen zwischen Aktin und Tβ4 identifiziert werden: H40 von Aktin und S43 von Tβ4, eine der Aminosäuren 1-3 (DDE) von Aktin und K18 oder K19 von Tβ4 sowie E167 von Aktin und K3 von Tβ4. 4.3 Freisetzungsmechanismus von intrazellulärem Thymosin β4 Nachdem die intrazelluläre Interaktion zwischen Aktin und Tβ4 untersucht worden war, stellte sich für die folgenden Experimente zunächst die Frage nach der Freisetzung von Tβ4 in extrazelluläre Bereiche. In diesem Experiment wurde untersucht, inwieweit eine Permeabilisierung der Zellmembran zur Freisetzung von Tβ4 führt. - 61 - Ergebnisse Die Freisetzung wurde am Beispiel von Jurkatzellen untersucht. Die Zellmembran der Jurkatzellen wurde durch Digitonin oder hypoosmotische Medien geschädigt (3.3.1.3). Anschließend erfolgte die Quantifizierung des freigesetzten Anteils an Tβ4 im Medium im Vergleich zum Anteil, der in den Zellen verblieb, mittels RP-HPLC (3.2.1). Die Identifizierung von Tβ4 im Chromatogramm erfolgte über seine Retentionszeit. Dafür wurde vor jedem Experiment eine Standardlösung injiziert, die 200 ng Tβ4 enthielt. Die Retentionszeit beträgt 22 min. Die Schädigung der Zellmembran durch Digitonin oder hypoosmotische Medien (Abb. 4-10) führt zur Freisetzung von Tβ4 aus den Zellen ins Medium. Abb. 4-10. Quantifizierung der Freisetzung von Thymosin β4 mittels RP-HPLC. HPLC-Chromatogramme nach PCA-Fällung von Zelllysat (oberes Chromatogramm) und Medium (unteres Chromatogramm) nach Inkubation von Jurkatzellen (je 1,5 Mio.) für 1 h in (A) isotonem (313 mOsm/l) oder (B) hypotonem (94 mOsm/l) Medium. Tβ4 eluierte bei 22 min durch einen linearen Gradienten von 0-50 % Acetonitril in 0,1 % TFA in 30 min (gestrichelte Gerade). Detektion erfolgte durch Nachsäulenderivatisierung mit Fluram. Unter isotonen Bedingungen wird Tβ4 hauptsächlich im Zelllysat, unter hypotonen Bedingungen im Medium detektiert. Zur Beurteilung der Zellschädigung wurde zusätzlich LDH im Zytotoxizitätstest (3.1.4) bestimmt. Diese wird erst nach dem Zelltod freigesetzt und ist somit ein Marker für den Zelltod. Freigesetzte LDH wurde wie Tβ4 im Medium bestimmt und im Vergleich zu dem Anteil berechnet, der sich in noch intakten Zellen befand. Der direkte Vergleich der Freisetzung von Tβ4 und LDH ist in Abb. 4-11 dargestellt. Nach Schädigung der Zellmembran durch Digitonin (A) oder hypoosmotische Medien (B) verlaufen die Freisetzungskurven von Tβ4 und LDH parallel. Trotz Permeabilisierung der Membran mit Digitonin oder durch hypoosmotischen Stress der Zellen wird Tβ4 erst mit dem Einsetzen des Zelltodes freigesetzt. - 62 - Ergebnisse Abb. 4-11. Zusammenhang von Tβ4- und LDH-Freisetzung aus Jurkatzellen. Bestimmung der Freisetzung von Tβ4 bzw. LDH aus Jurkatzellen nach Behandlung mit (A) Digitonin (0,01 g/l) oder (B) Medien verschiedener Osmolarität. Tβ4 wurde mittels RPHPLC und LDH mittels Zytotoxizitätstest im Zelllysat und Medium bestimmt. Freigesetztes Tβ4 bzw. LDH berechnete sich aus der prozentualen Menge im Medium zur Gesamtmenge, die sich aus der Summe aus Zelllysat und Medium ergibt. Mittelwert aus drei Experimenten ± Standardabweichung. 4.4 Thymosin β4 als Substrat der mikrobiellen Transglutaminase 4.4.1 Charakterisierung der mTGA Für die folgenden Vernetzungsreaktionen wurde eine mikrobielle Transglutaminase (mTGA) aus dem Stamm Streptomyces mobaraensis verwendet. Die Bestimmung der Aktivität der verwendeten mTGA-Lösung gelang durch den Vergleich mit einer kommerziellen Gewebetransglutaminase aus dem Meerschweinchen (gpTGA) bekannter Aktivität im TGAAktivitätstest (vergl. 3.1.5). Abb. 4-12 zeigt die ermittelten Regressionsgeraden der Reaktionsgeschwindigkeiten in Abhängigkeit des Volumens der eingesetzten mTGA (A) und der Aktivität der gpTGA (B). - 63 - Ergebnisse Abb. 4-12. Aktivitätsbestimmung der mikrobiellen Transglutaminase. TGA-Aktivitätstest zur Bestimmung der Reaktionsgeschwindigkeit (A) in Abhängigkeit des eingesetzten Volumens (µl) mTGA oder (B) in Abhängigkeit der bekannten Aktivität der kommerziellen gpTGA (Zedira). Aktivität der mTGA berechnet sich aus angegebenen Regressionsgleichungen: AmTGA (mU)=0,2997*VmTGA (µl)/0,1338. Aus den Gleichungen der Regressionsgeraden ließ sich nun die Volumenaktivität (A/V) der mTGA über die bekannte Aktivität (A) der gpTGA berechnen: y = 0,2997 × V [µl ] (1) und y = 0,1338 × A[mU ] 0,2997 × V [µl ] = 0,1338 × A[mU ] (2) A mU U = 2,24 = 2,24 = Volumenaktivität V µl ml (3) Die beiden Gleichungen werden zusammengefasst (1), umgeformt (2) und ergeben für die mTGA eine Volumenaktivität von 2,24 U/ml. Im Gegensatz zur gpTGA ist die mTGA nicht Ca2+-abhängig, es wurden daher verschiedene Puffersysteme zur Optimierung der Reaktionsbedingungen überprüft. In einem weiteren TGA-Aktivitätstest wurde der TGAPuffer durch Phosphatpuffer oder TBS ersetzt. Abb. 4-13 zeigt eine erhöhte Reaktionsgeschwindigkeit der mTGA bei Verwendung des Phosphatpuffers an. Daher wurden die Vernetzungsreaktionen mit mTGA in Phosphatpuffer durchgeführt. - 64 - Ergebnisse Abb. 4-13. Reaktionsgeschwindigkeit der mTGA in Abhängigkeit vom Puffersystem. TGA-Aktivitätstest mit 2µl mTGA in 1ml Testansatz. Die Aktivität der mTGA ist in Phosphatpuffer am höchsten. 4.4.2 Substrate zur Vernetzung von Thymosin β4 mit Transglutaminase Die Suche nach Substratpartnern für die enzymatische Vernetzung von Tβ4 mittels mTGA gelang durch einen modifizierten ELISA (vergl.3.1.3). Untersucht wurden als Vertreter der extrazellulären Matrix Fibronektin, Kollagen und seine denaturierte Form Gelatine. Als Bestandteile der Blutgerinnungskaskade und bereits beschriebene Substrate der Gewebetransglutaminase Faktor XIIIa wurden Fibrinogen und Fibrin untersucht [46]. LDH und BSA dienten als Negativkontrolle. Alle Ansätze wurden in 3 Experimenten jeweils in Triplikaten durchgeführt. Die Funktionalität der Blockierlösung konnte durch das Ausbleiben einer Farbentwicklung nach Zugabe von Tβ4 und mTGA zu blockierten Vertiefungen bestätigt werden. Ein weiterer Ansatz ohne Zusatz der mTGA wurde durchgeführt, um zu zeigen, dass die Vernetzung von Tβ4 an das Protein ausschließlich durch das Enzym entsteht. Abb. 4-14 zeigt eine Zusammenfassung der ELISA-Experimente. Dargestellt ist die Absorption in Abhängigkeit vom beschichteten Protein. Sowohl Fibronektin, als auch Kollagen und Gelatine konnten durch mTGA mit Tβ4 vernetzt werden. Außerdem konnte eine Vernetzung an Fibrinogen und Fibrin bestätigt werden. Die Spezifität dieser enzymatischen Vernetzung konnte durch das Ausbleiben einer Reaktion für BSA und LDH gezeigt werden. - 65 - Ergebnisse Abb. 4-14. Identifizierung neuer Substrate der mTGA zur Vernetzung von Tβ4. Modifizierter ELISA, Mittelwerte aus Triplikaten ± Standardabweichung. Vernetzungsreaktion von Tβ4 mit (mittlerer Balken) / ohne (rechter Balken) mTGA an zuvor beschichtetes Protein und ohne Beschichtung (linker Balken). Kollagen-beschichtete Platten wurden kommerziell erworben, daher gibt es keine Kontrolle ohne Proteinbeschichtung. Die weißen Balken repräsentieren die Ansätze der Kontrollen ohne Proteinbeschichtung und zeigen unterschiedliche Absorptionen. Dies ist auf die Effizienz der Blocklösung zurückzuführen. Standard-Blocklösungen mit BSA oder Milchpulver konnten im Rahmen dieses Experiments nicht verwendet werden, da die hohen Proteinmengen zu unspezifischen Vernetzungsreaktionen von Tβ4 führten. Stattdessen wurde eine PVA-Lösung verwendet, deren blockierende Funktion unspezifischer Bindestellen jedoch eine hohe Varianz aufwies. Die Farbentwicklung bei positiver Vernetzungsreaktion ist jedoch so deutlich, dass die Varianz durch die PVA-Lösung vernachlässigt werden kann. Zusammenfassend konnte gezeigt werden, dass für eine Vernetzungsreaktion von Tβ4 durch mTGA verschiedene Proteine der extrazellulären Matrix wie Fibronektin und Kollagen bzw. Gelatine sowie als Bestandteile der Blutgerinnungskaskade Fibrinogen und Fibrin zur Verfügung stehen. Im Folgenden wird die enzymatische Vernetzungsreaktion durch mTGA genauer charakterisiert und der mögliche Einfluss der Vernetzung von Tβ4 auf seine Wirkung untersucht. - 66 - Ergebnisse 4.4.3 Enzymatische Vernetzung von Aktin und Thymosin β4 mittels mTGA Nachdem verschiedene Substratpartner zur enzymatischen Vernetzung von Tβ4 identifiziert werden konnten, wurden im Folgenden die an der Vernetzungsreaktion beteiligten Aminosäureseitenketten im Tβ4 identifiziert. Da Substratpartner wie Gelatine, Fibronektin (Heterodimer, 230 kDa) und Fibrin(ogen) (Heterohexamer, 50-90 kDa) komplexe Proteinstrukturen aufweisen, wurde Tβ4 mit Aktin (Monomer, 42 kDa) vernetzt. Die Vernetzung von Aktin und Tβ4 erfolgte enzymatisch durch mTGA (vergl. 3.4.3.2). Anschließend wurde analog zur EDC-Vernetzung verfahren: Die Vernetzungsprodukte wurden mittels SDS-PAGE (vergl. 3.1.1.1) in einem 12 %-Gel aufgetrennt und die Proteinbanden mit Coomassie gefärbt (vergl. 3.1.1.2). Abb. 4-15. Vernetzung zwischen Aktin und Tβ4 durch mikrobielle Transglutaminase. 12 % SDS-Gel, Coomassie gefärbt. (1) Aktin, (2) mTGA, (3) Tβ4, (4) Aktin+mTGA, (5) Tβ4+mTGA, (6) Aktin+Tβ4+mTGA. Aktin und mTGA werden durch jeweils eine Bande bei 42 kDa und 38 kDa repräsentiert (Abb. 4-15, 1-3). Aktin wird durch mTGA nicht intermolekular vernetzt (4), was durch die Abwesenheit zusätzlicher Banden bei Vielfachen seiner Molekülmasse gezeigt wird. Dagegen wird Tβ4 bei Behandlung mit mTGA nahezu vollständig umgesetzt (5). Dabei entstehen keine distinkten Banden von Vernetzungsprodukten, sondern eine diffuse Proteinfärbung, die von 10 bis 30 kDa reicht. - 67 - Ergebnisse Die enzymatische Vernetzung von Aktin und Tβ4 mit mTGA führte zu variablen Vernetzungsprodukten (6). Im SDS-Gel ist ein charakteristisches Bandenmuster zu erkennen: Ausgehend von der 42 kDa-Bande, die Aktin repräsentiert, sind in jeweils 5 kDaAbständen die Banden der Vernetzungsprodukte sichtbar. Wobei mit steigender Molekülmasse die Intensität der Bande sinkt. 4.4.4 Vernetzungsstellen des Aktin-Thymosin β4-Addukts durch mTGA Die Vernetzung zwischen Aktin und Tβ4 durch mTGA sowie die erfolgte Auftrennung im SDS-Gel ermöglichte die Analyse der Vernetzungsstellen nach tryptischen Verdau und HPLC-ESI-MS analog Kapitel 4.2.2. mit dem Unterschied, dass bei der enzymatischen Vernetzung NH4+ abgespalten wird, wodurch sich die Gesamtmasse um 18,035 Da verringert. Zur Analyse wurden die korrespondierenden Banden von Aktin, Aktin x Tβ4 sowie Aktin x 2Tβ4 herangezogen. Abb. 4-16. RP-HPLC-Chromatogramme von Aktin und Aktin x Tβ4 nach mTGAVernetzung. HPLC-ESI-MS des Trypsin-In-Gel-Verdaus nach Auftrennung der Vernetzungsprodukte mittels SDS-PAGE. Linearer Gradient zwischen 2 und 55 min von 4 % auf 55 % ACN. (T) Tryptische Fragmente von Tβ4, (Xa-Xc) Tryptische Fragmente der Vernetzungsstellen zwischen Aktin und Tβ4. - 68 - Ergebnisse Tab. 4-4. Identifizierte tryptische Fragmente des Aktin-Tβ4-Addukts durch mTGA. Vernetzungsreaktion mit mTGA erfolgte in einem molaren Verhältnis von 1:2 für 1 h bei RT. Reaktionsansatz wurde durch SDS-PAGE aufgetrennt und die Bande des Aktin-Tβ4-Addukts einem Trypsin-Verdau unterzogen und mittels HPLC-ESI-MS analysiert. Rt in min 5.3 6.2 9.7 10.2 11.0 11.0 12.2 12.5 12.7 13.2 13.4 14.2 14.5 14.9 14.9 15.5 16.1 16.8 19.2 19.6 20.4 21.0 21.5 22.1 22.9 23.0 24.8 25.5 26.1 26.1 28.4 31.1 31.5 45.5 46.8 T T T X(a) X(b) X(c) T T T Trypsin-Fragment Intensität A207-210 T32-38 T26-31 A192-196 A51-61 A285-290 T20-31 A329-336 A51-62+T39-43X A40-50+T19-25X A19-28 A329-335 A178-183 A40-50+T39-43X A40-50 T26-38 A360-372 T1-11A A197-206 A316-326 A85-95 A63-68 T1-14A A29-39 A1-18A,P,D A96-113 A184-191 A239-254 A69-84H A292-312 A148-177 A216-238P A257-284P A337-359 A119-147 1.03 0.61 1.14 6.51 20.23 2.46 0.40 0.42 0.76 4.32 44.39 31.51 47.97 3.00 2.31 4.84 46.68 20.29 54.91 48.68 29.42 11.83 48.45 32.28 28.28 174.65 52.75 182.56 137.20 72.29 79.53 0.50 2.17 0.36 4.24 m/z theoretisch experimentell 516.314 516.315 876.431 876.432 655.377 655.378 631.377 631.378 1198.522 1198.524 734.350 734.332 1371.711 1371.714 923.567 923.569 1827.798 1827.801 2016.983 2016.987 976.448 976.451 795.472 795.474 644.373 644.373 2230.130 2230.133 1171.571 1171.572 1512.790 1512.792 1500.708 1500.712 1304.604 1304.606 1130.548 1130.549 1161.618 1161.621 1515.749 1515.753 644.434 644.435 1694.794 1694.800 1198.706 1198.706 1979.871 1979.882 1956.044 1956.050 998.486 998.489 1790.892 1790.893 1974.919 1974.934 2228.065 2228.068 3196.610 3196.623 2550.174 2550.179 3202.489 3202.495 2602.337 2602.341 3251.630 3251.632 δm/m in ppm 1.94 1.26 0.92 0.95 1.50 -24.78 1.90 1.84 1.70 1.98 2.77 2.14 0.62 1.57 0.77 1.06 2.87 1.61 1.15 2.24 2.51 1.40 3.42 0.42 5.61 3.22 2.70 0.61 7.74 1.26 4.19 2.08 1.78 1.38 0.55 X. Vernetzungsstellen A. Acetylierung am Protein-N-Terminus P. Propionamid-Modifizierung am Cystein H. Methylhistidin δm/m. (m/z experimentell – m/z theoretisch) / (m/z theoretisch) Im Vergleich zu Aktin wurden bei Aktin x Tβ4 und Aktin x 2Tβ4 neun spezifische Fragmentmassen detektiert (Abb. 4-16). Sechs dieser spezifischen Fragmentmassen - 69 - Ergebnisse konnten Tβ4 zugeordnet werden (T). Die drei weiteren spezifischen Massen wurden als Vernetzungsfragmente (Xa-Xc) identifiziert. In Tab. 4-4 sind korrespondierend zum HPLC-Chromatogramm des tryptischen Verdaus von Aktin x Tβ4 den Retentionszeiten die entsprechenden Fragmente und monoisotopischen Massen zugeordnet. Obwohl sich die Addukte Aktin x Tβ4 und Aktin x 2Tβ4 durch die Vernetzung eines weiteren Moleküls Tβ4 unterscheiden, konnte durch Auswertung der HPLC-ESI-MS Daten kein zusätzliches spezifisches Fragment identifiziert werden. Daher wird im Folgenden nur auf die Auswertung des einfach vernetzten Addukts eingegangen, dessen spezifische Fragmente analog auch im Addukt Aktin x 2Tβ4 detektiert werden konnten. Abb. 4-17. mTGA führt zur Vernetzung von K61 von Aktin und Q39 von Tβ4. MS/MS-Spektrum und Sequenz des Vernetzungsfragments mit [M+H]+ von 1827,801 Da. (A) Tryptisches Fragment von Aktin (AS 51-62, schwarz), (T) tryptisches Fragment von Tβ4 (AS 39-43, blau). Das Spektrum entspricht einer Vernetzung zwischen der Carbamoylgruppe des Q39 von Tβ4 und der ε-Aminogruppe des K61 von Aktin. - 70 - Ergebnisse Die spezifische Masse von 1827,798 Da konnte einer Vernetzung der tryptischen Fragmente 51-62 von Aktin und 39-43 von Tβ4 zugeordnet werden. Diese Vernetzung wurde durch das MS/MS-Spektrum (Abb. 4-17) bestätigt, welches zeigt, dass die Produkt-Ionen des VorläuferIons bei 1827,798 Da sowohl mit Teilen der b- und y-Serien des tryptischen Fragments 5162 von Aktin, als auch mit 39-43 von Tβ4 übereinstimmen. Da die Vernetzungsreaktion durch mikrobielle Transglutaminase nur zwischen ε-Aminogruppen und γ-Carbamoylgruppen von Lysin- bzw. Glutaminseitenketten stattfindet, können nur Q39 des Tβ4 mit K61 des Aktins vernetzt worden sein. Dies wird durch die Detektion von b*2 bei m/z 1536,7 und y3 bei m/z 863,4 bestätigt. Dabei ist die Masse des Produkt-Ions b*2 des Tβ4-Fragments um das Fragment 51-62 von Aktin erweitert. Das Produkt-Ion y3 des Aktin-Fragments enthält zusätzlich das tryptische Peptid 39-43 von Tβ4. Abb. 4-18. Q41 von Aktin kann durch mTGA mit K19 von Tβ4 vernetzt werden. MS/MS-Spektrum und Sequenz für spezifisches Fragment mit [M+H]+ von 2016,987 Da. (A) Tryptisches Fragment von Aktin (AS 40-50, schwarz), (T) tryptisches Fragment von Tβ4 (AS 19-25, blau). Das Spektrum entspricht einer Vernetzung zwischen der Carbamoylgruppe des Q41 von Aktin und der ε-Aminogruppe des K19 von Tβ4. - 71 - Ergebnisse Das zweite spezifische Fragment mit der Masse von 2016,983 Da konnte einer Vernetzung der tryptischen Fragmente 40-50 von Aktin und 19-25 von Tβ4 zugewiesen werden. Die Vernetzung wurde durch die Übereinstimmung zwischen den Produkt-Ionen des MS/MSSpektrums (Abb. 4-18) mit Teilen der b- und y-Serien dieser tryptischen Fragmente verifiziert. Sowohl das Tβ4- als auch das Aktin-Fragment enthalten Lysine und Glutamine, die potentiell an der Vernetzungsreaktion durch mTGA beteiligt sein könnten. Die Detektion der Ionen y*6 bei m/z 735,4 (siehe Abb. 4-18) und b2 bei m/z 1111,5 weist jedoch eindeutig auf eine Vernetzungsreaktion zwischen Aktin Q41 und Tβ4 K19 hin. Dabei besteht y*6 nur aus Tβ4 20-25, sodass eine Vernetzung an weiter C-terminal gelegenen Aminosäuren, wie Q23 oder K25 von Tβ4, ausgeschlossen werden konnte. Dagegen ist das b2 bereits um die Masse von Tβ4 19-25 erhöht. Dadurch konnte auch eine Vernetzung an die weiter C-terminal gelegene Aminosäure Q49 von Aktin ausgeschlossen werden. Eine dritte Vernetzungsstelle konnte der spezifischen Masse von 2230,130 Da zugeordnet werden. Dabei handelt es sich um eine Vernetzung höherer Ordnung. Das Fragment Aktin 40-50 ist sowohl mit dem Fragment Tβ4 15-19 als auch mit Tβ4 39-43 vernetzt. Die ProduktIonen des MS/MS-Spektrums (Abb. 4-19) korrespondieren dabei mit Teilen der b-und ySerien der Fragmente Aktin 40-50 und Tβ4 39-43. Für das Fragment Tβ4 15-19 wurden keine b- oder y-Ionen detektiert. Jedoch sind die y-Serie von Aktin 40-50 sowie die b*-Serie von Tβ4 39-43 genau um die Masse des 2 fach-vernetzten Fragments Tβ4 15-19 verschoben. Die Detektion des Ions y9 weist auf eine Vernetzung an Q41 von Aktin hin und schließt eine Vernetzung an Q49 oder K50 von Aktin aus. Da das Fragment Tβ4 39-43 kein entsprechendes Lysin enthält, muss Aktin Q41 mit einem der drei Lysine des Fragmentes Tβ4 15-19 vernetzt sein. Weiterhin ist die einzige vernetzungsrelevante Aminosäure von Tβ4 39-43 das Q39. Die Detektion der Ionen b*2 bis b*4 (siehe Abb. 1-1) bestätigen eine Vernetzung von Tβ4 Q39 mit einem der drei Lysine 16, 18 oder 19 von Tβ4. - 72 - Ergebnisse Abb. 4-19. Vernetzungsprodukt höherer Ordnung zwischen Aktin und Tβ4 durch mTGA . MS/MS-Spektrum und Sequenz des Vernetzungsfragments mit [M+H]+ von 2230,133 Da. (A) Tryptisches Fragment von Aktin (AS 40-50, schwarz), (B) tryptisches Fragment von Tβ4 (SKLKK, AS 15-19, blau), (C) tryptisches Fragment von Tβ4 (QAGES, AS 39-43, blau). Das Spektrum entspricht einer Vernetzung zwischen der Carbamoylgruppe des Q41 von Aktin und einer der ε-Aminogruppen des K16/18/19 von Tβ4, sowie einer zusätzlichen intramolekularen Vernetzung zwischen der Carbamoylgruppe des Q39 von Tβ4 und der εAminogruppe des K16/18/19 von Tβ4. Die experimentell ermittelten Vernetzungsstellen zwischen Aktin und Tβ4 durch mTGA wurden mit dem Programm MS Tag bewertet. Die Auswertungen zu den drei spezifischen Trypsin-Fragmenten mit Vernetzungsstelle ist in Tab. 4-5 zusammengefasst. In das Programm wurden die MS/MS-Daten, die Sequenz des jeweiligen Aktin-Fragments sowie die Masse des vernetzten Tβ4-Fragmentes eingefügt. Für die theoretische Vernetzung im Programm wurden alle Aminosäuren zugelassen. Die beschriebenen Vernetzungsstellen waren in allen drei Fällen mit dem höchsten MS-Tag Score bewertet. Dies bedeutet, dass die experimentellen m/z-Werte mit den theoretischen Massen der Fragmente mit den postulierten Vernetzungsstellen die höchste Übereinstimmung haben im Gegensatz zu den - 73 - Ergebnisse ausgeschlossenen Vernetzungsmöglichkeiten. Die Massenübereinstimmung zwischen experimentellen m/z-Werten und theoretischen Produkt-Ionen betrug zwischen 53-73 %. Die Abweichung zwischen experimentell ermittelter und theoretischer Masse betrug maximal 1,78 ppm. Tab. 4-5. Bewertung der identifizierten mTGA-Vernetzungsstellen des Aktin x Tβ4-Addukts mittels der Software MS Tag (ProteinProspector v 5.10.2). X(a) X(b) X(c) Aktin-Vernetzungsstelle K 61 Q 41 Q 41 Tβ4-Vernetzungsstelle Q 39 K 19 K (16, 18 oder 19) + Q 39 m/z (experimentell) 1827,801 2016,987 2230,133 m/z (berechnet) 1827,798 2016,983 2230,130 δm/m 1,48 1,78 1,21 MS-Tag Score 34,1 37,9 25,1 Massenübereinstimmung 72,7 % 53,4 % 52,6 % δm/m. (m/z experimentell – m/z theoretisch) / (m/z theoretisch) Zusammenfassend konnte nachgewiesen werden, dass Aktin und Tβ4 durch mTGA miteinander vernetzt werden. Dabei entstehen mehrere Vernetzungsprodukte, die sich in der Anzahl der vernetzten Tβ4-Moleküle an Aktin unterscheiden. Es konnten drei Vernetzungsstellen identifiziert werden: Zwischen K61 von Aktin und Q39 von Tβ4, Q41 von Aktin und K19 von Tβ4 sowie eine Vernetzungsstelle höherer Ordnung, bei der Q41 von Aktin über das Fragment 15-19 von Tβ4 mit Q39 von Tβ4 verknüpft ist. Es konnte keine weitere Vernetzungsstelle für das Produkt mit zwei vernetzten Tβ4-Molekülen identifiziert werden, sodass unklar bleibt, ob die Vernetzung weiterer Tβ4-Moleküle direkt am Aktin oder an bereits vernetztem Tβ4 erfolgt. Tβ4 agiert bei der hier beschriebenen enzymatischen Vernetzung durch mTGA gleichzeitig als Glutaminyl- und Lysylsubstrat. - 74 - Ergebnisse 4.5 Einfluss der Vernetzung von Tβ4 auf seine Inhibition der PDGFinduzierten Migration von HSC Um nun den Einfluss der enzymatischen Vernetzung von Tβ4 auf seine Wirkung zu untersuchen, wurde ein Experiment mit hepatischen Sternzellen (HSC) durchgeführt. Die PDGF-induzierte Migration dieser Zellen wird durch Tβ4 inhibiert [34]. Die Wirkung von Tβ4 und vernetztem Tβ4 wurde in einem Wundheilungs-Assay untersucht (vergl. 3.3.2.2). Zellen wurden dafür auf Zellkulturtestplatten ausgesät, die mit Gelatine beschichtet oder zusätzlich mit Tβ4 oder scrambled Tβ4 mittels mTGA vernetzt waren. Dabei wurden die Zellen aus einem definierten Areal eines konfluenten Zellrasens durch eine Pipettenspitze entfernt. Die Einwanderung der Zellen in das zellfreie Areal wurde nach 24 h analysiert. Wie in Abb. 4-20 B gezeigt, beträgt die offene Wundfläche der unbehandelten HSC nach 24 h noch 58,5 ± 1,6 %. Dies war vergleichbar mit den Wundflächen nach Behandlung mit Tβ4 (58,5 ± 4,3 %), vernetztem Tβ4 (49,5 ± 4,4 %), scrambled Tβ4 (62,8 ± 7,5 %) und vernetztem scrambled Tβ4 (51,6 ± 3,0 %). Nach Behandlung der Zellen mit PDGF dagegen waren nach 24 h lediglich 14,8 ± 4,9 % der Wundfläche noch zellfrei. Diese verbesserte Wundschließung konnte auch für die Zellen beobachtet werden, die mit vernetztem Tβ4+PDGF (7,6 ± 1,3 %), scrambled Tβ4+PDGF (14,6 ± 4,2 %) und vernetztem scrambled Tβ4+PDGF (6,0 ± 1,3 %) behandelt wurden. Dagegen war nach Behandlung der Zellen mit Tβ4+PDGF noch 50,9 ± 3,0 % der Wundfläche zellfrei. Die korrespondierenden Zellaufnahmen der Wundflächen zu Beginn und nach 24 stündiger Behandlung sind in Abb. 4-20 A dargestellt. Damit lässt sich zusammenfassen, dass scrambled Tβ4 keinen Einfluss auf die PDGFinduzierte Migration der Zellen hat. Dagegen inhibiert freies Tβ4 die Wirkung von PDGF signifikant. Die enzymatische Vernetzung von Tβ4 an Gelatine führt zum Verlust seines inhibitorischen Effekts. Aufgrund dieser Ergebnisse wurde im Folgenden die Möglichkeit einer direkten Interaktion zwischen Tβ4 und PDGF untersucht. - 75 - Ergebnisse Abb. 4-20. Verhinderung der PDGF-induzierten Migration von HSC. Zellmigration wurde nach mechanischer Verwundung eines konfluenten Zellrasens und Messung der zellfreien Fläche nach 0 und 24 h bestimmt. Nur Tβ4 konnte die PDGFinduzierte Migration der HSC verhindern, nicht aber vernetztes Tβ4 (XTβ4). (A) Balken entspricht 100 µm. (B) Statistische Auswertung der prozentualen Verringerung der Wundfläche nach 24 h. Mittelwert des Triplikats ± Standardabweichung. (*) ANOVABonferroni Signifikanztest p=0,05. - 76 - Ergebnisse 4.6 Interaktion zwischen Tβ4 und PDGF Der Platelet-derived growth factor (PDGF) gehört zur Klasse der Wachstumsfaktoren und besteht aus zwei identischen Aminosäureketten mit einer Masse von 12 kDa, die durch eine Disulfidbrücke miteinander verknüpft sind. Der Nachweis der Interaktion von Tβ4 und PDGF erfolgte mit EDC. PDGF wurde mit dem dreifachen molaren Überschuss an Tβ4 nach Zugabe von EDC inkubiert (vergl. 3.4.3.1). Anschließend wurde der Reaktionsansatz mittels SDS-PAGE (vergl. 3.1.1.1) in einem 15 %Gel aufgetrennt. Die Proteine im SDS-Gel wurden entweder durch Silberfärbung (vergl. 3.1.1.3) sichtbar gemacht oder in einem Western Blot auf eine Membran transferiert und Tβ4 durch Antikörper detektiert (vergl. 3.1.2.1). EDC führt zur Vernetzung von Tβ4 mit PDGF. Die Masse des entstandenen Vernetzungsproduktes ist gegenüber unvernetztem PDGF um 5 kDa erhöht. Diese Massenverschiebung ist im SDS-Gel sichtbar (Abb. 4-21). PDGF wird durch eine Bande bei 12 kDa repräsentiert (2), nach Vernetzung mit Tβ4 durch EDC entsteht eine zusätzliche Bande bei 17 kDa (1) die dem Vernetzungsprodukt PDGF x Tβ4 entspricht. Im Western Blot wird nur für diese Bande ein Signal detektiert. Die Spezifität der Vernetzungsreaktion wurde mit Lactalbumin, welches mit 14 kDa eine vergleichbare Masse wie PDGF besitzt, untersucht. Lactalbumin wurde analog zu PDGF mit Tβ4 und EDC behandelt. Im SDS-Gel ist jedoch keine zusätzliche Bande in der Vernetzungsprobe (4) im Vergleich zu unbehandeltem Lactalbumin (5) sichtbar. Auch im Western Blot wurde kein Signal detektiert. Abb. 4-21. Tβ4 wird spezifisch an PDGF durch EDC vernetzt. SDS-PAGE und Western Blot der Vernetzung von PDGF bzw. Lactalbumin mit Tβ4 durch EDC in Lösung. (1) PDGF (12kDa)+Tβ4 (5kDa)+EDC, (2) PDGF+EDC, (3) Tβ4+EDC, (4) Lactalbumin (12kDa) +Tβ4 (5 kDa)+EDC, (5) Lactalbumin+EDC. Berechnete Masse des Vernetzungsproduktes aus PDGF und Tβ4 beträgt 17 kDa. Links: Molekülmassen des Proteinstandards. (α-Tβ4) Antikörper gegen Tβ4. - 77 - Ergebnisse In einem nächsten Experiment wurde untersucht, ob auch weitere Vertreter der β-Thymosine mit PDGF vernetzt werden können. Dafür wurde in einem weiteren EDC-Ansatz von Tβ4 und PDGF zusätzlich ein 10fach molarer Überschuss an Tβ10 zugegeben. Abb. 4-22. Tβ10 verdrängt Tβ4 aus Interaktion mit PDGF. SDS-PAGE und Western Blot (anti-Tβ4) der EDC-Vernetzung von PDGF mit Tβ4 in Abwesenheit (2) und Anwesenheit (3) von Tβ10. Rechts: Molekülmassen des Proteinstandards. (1) PDGF(12kDa)+EDC, (2) PDGF+EDC+ Tβ4 (5kDa), (3) PDGF+EDC+ Tβ4+ 10fach molaren Überschuss Tβ10 (5kDa). Abb. 4-22 zeigt die Ausschnitte aus dem 15 %-SDS-Gel und darunter die zugehörigen Ausschnitte des Western Blots. PDGF läuft im SDS-Gel in einer einzelnen Bande bei 12 kDa (1). Die Vernetzung von PDGF mit Tβ4 durch EDC führt zur Bildung eines Vernetzungsproduktes mit einer Masse von 17 kDa (2). Die korrespondierende Bande konnte erwartungsgemäß im Western Blot mit Tβ4-Antikörpern nachgewiesen werden. Bei gleichzeitiger Anwesenheit eines 10fach molaren Überschusses an Tβ10 (3) wurde die Intensität der Bande des Vernetzungsproduktes im SDS-Gel erhöht. Mit steigendem Anteil an β-Thymosin steigt auch der Anteil an Vernetzungsprodukt. Da durch den 10fach molaren Überschuss statistisch mehr Tβ10 als Tβ4 mit PDGF vernetzt wird, ist das Signal im Western Blot abgeschwächt. Tβ4-Antikörper reagieren nicht mit Tβ10. Daraus lässt sich ableiten, dass analog zur Aktin-Komplexierung auch die PDGF-Komplexierung eine Eigenschaft der βThymosin-Familie ist. - 78 - Diskussion 5 Diskussion 5.1 Intrazelluläres Thymosin β4 und seine Interaktion mit Aktin Tβ4 ist in Thrombozyten das wichtigste Aktin-sequestrierende Peptid [21]. Durch die Bindung von Tβ4 an Aktin wird dessen Polymerisation sterisch behindert [38]. Der KD-Wert dieses Komplexes beträgt 0,5-2,5 µM [35-36]. Durch Inkubation mit dem Null-Längen-Crosslinker EDC lässt sich die Interaktion in eine kovalente Bindungen überführen und nachweisen. Bei dieser Vernetzung entsteht ein 1:1 Vernetzungsprodukt mit einer Umsetzungsrate von 50 %. Dies entspricht den publizierten Daten von Ballweber et al., die unter vergleichbaren experimentellen Bedingungen, aber einer kürzeren Reaktionszeit 40 % des G-Aktins mit Tβ4 vernetzen konnten [58]. Safer et al. erlangten eine Umsetzungsrate von 20 bis 30 %, allerdings unter anderen Pufferbedingungen und ebenfalls einer kürzeren Reaktionszeit [38]. Eine Vernetzung des Aktin-Tβ4-Komplexes mit EDC ist dabei nur möglich, wenn sich Aminound Carboxylgruppen in direkter Nachbarschaft zueinander befinden. Durch Identifizierung der Vernetzungsstellen lassen sich Aussagen zur räumlichen Struktur des Komplexes treffen. 5.2 Identifizierung der Vernetzungsstellen im Aktin-Tβ4-Komplex Die massenspektrometrische Bestimmung des tryptischen Verdaus des Aktin-Tβ4-Komplex nach EDC-Vernetzung ergab drei Vernetzungsstellen: Eine der ersten drei Aminosäuren (DDE) des Aktins wurde mit dem Lysylrest 18 von Tβ4 verknüpft. Das Histidin an Position 40 des Aktins wurde mit der freien Carboxylgruppe des C-Terminus von Tβ4 kovalent verbunden. Die dritte Vernetzungsstelle konnte zwischen der Glutaminsäure an Position 167 des Aktins und dem Lysin an Position 3 in der N-terminalen Region des Tβ4 identifiziert werden. Neben diesen Fragmenten mit Vernetzungsstellen, konnten gleichzeitig die entsprechenden unvernetzten Fragmente des Aktins nachgewiesen werden. Daraus folgt zwangsläufig, dass die drei Vernetzungsstellen nicht in jedem Komplex simultan ausgebildet werden. Die Ergebnisse sprechen viel mehr dafür, dass es sich bei dem Aktin-Tβ4-Komplex nach EDCVernetzung um verschieden vernetzte Produkte handelt, die sich lediglich darin gleichen, dass genau ein Molekül Tβ4 an ein Molekül Aktin gebunden ist. - 79 - Diskussion Für diese variablen Vernetzungen spricht auch die jeweils geringe Intensität der drei in dieser Arbeit identifizierten Vernetzungsfragmente nach chromatographischer Auftrennung. Bei einer einheitlichen Vernetzung würde man eine starke Abnahme der Intensität eines Aktin-Fragments und die starke Zunahme der Intensität eines Vernetzungsfragmentes erwarten. In diesem Fall betrug die Intensität der Vernetzungsfragmente im Vergleich zu den entsprechenden Aktin-Fragmenten jedoch nur zwischen 1,5 und 21 %. Durch Auftrennung des Reaktionsansatzes mittels SDS-PAGE und der Analyse der einzelnen Vernetzungsbande muss jedoch von einer 100 %igen Vernetzung in der Probe ausgegangen werden. Daraus lässt sich schließen, dass noch weitere nicht identifizierte Vernetzungsstellen vorliegen, die sich durch noch geringere Intensitäten dem Nachweis entziehen. Aktin wird entsprechend seiner räumlichen Struktur in 4 Subdomänen unterteilt. Die drei Vernetzungsstellen umfassen dabei die Subdomänen 1 bis 3. Zwei der Vernetzungsstellen zwischen den Aminosäuren 1 bis 3 von Aktin und K18 von Tβ4 sowie E167 von Aktin (Subdomäne 3) und K3 von Tβ4 stimmen mit den bereits publizierten Daten von Safer et al. überein [38]. Darüber hinaus bezogen Safer et al. die identifizierte Vernetzungsstelle nach enzymatischer Vernetzung durch Gewebetransglutaminase zwischen Q41 von Aktin und K38 von Tβ4 in ihrer Theorie zum Modell des Komplexes ein. Die hier durchgeführten Untersuchungen mit EDC belegen die Theorie von Safer et al. zur Interaktion zwischen dem C-Terminus von Tβ4 und der Subdomäne 2 des Aktins: Es konnte eine Vernetzung zwischen dem C-Terminus von Tβ4 (S 43) und dem Histidin an Position 40 des Aktins direkt nachgewiesen werden. Diese dritte Vernetzungsstelle bestätigt außerdem die von Safer et al. angenommene gestreckte Konformation des Tβ4 während der Komplexierung des Aktins. Die nachgewiesene Vernetzung am H40 des Aktins nimmt eine besondere Stellung ein, da es sich nicht um eine primäre Aminogruppe handelt. Der angenommene Reaktionsmechanismus zur Bildung des Imidazolamids durch EDC ist in Abb. 5-1 dargestellt. Die Imidazolgruppe des Histidins als Amin-Reaktante der chemischen Vernetzung durch EDC ist in der mir zugänglichen Literatur bisher noch nicht beschrieben worden. Das molare Verhältnis der Imidazol-Tautomere zueinander ist stark abhängig von den umgebenden Strukturen im Protein und vom pH-Wert des Reaktionsansatzes [59-60]. Es kann daher keine Aussage getroffen werden, an welchem der beiden Stickstoffe im Imidazolring die Reaktion bevorzugt stattfindet. - 80 - Diskussion Abb. 5-1. Reaktionsmechanismus der chemischen Vernetzung durch EDC EDC bildet mit Carboxylaten instabile O-Acylisoharnstoffe, die in Anwesenheit von primären Aminen zu Amiden reagieren. Diese Reaktion ist auch an einem der beiden Stickstoffe des Imidazolrings des Histidins möglich. Dabei entstehen Imidazolamide. Durch molekulare Modellierung konnte der Aktin-Tβ4-Komplex anhand der identifizierten Vernetzungsstellen nachgestellt werden (vergl. Anhang A). Abb. 5-2 zeigt die gestreckte Konformation von Tβ4 entlang der Subdomänen 1 bis 3 des Aktinmoleküls. Die Modellierung beweist, dass die Interaktion zwischen Tβ4 und Aktin an allen drei Vernetzungsstellen gleichzeitig sterisch möglich ist. Dabei ist sowohl der C-terminale Abschnitt von Tβ4 zwischen den Aminosäuren 19 und 42 als auch die N-terminale Region zwischen den Aminosäuren 4 und 17 länger, als für den Abstand zwischen dem N-Terminus und H40 des Aktins notwendig wäre. Diese Beobachtung lässt die Ausbildung von Sekundärstrukturen in diesen Bereichen von Tβ4 zu. Dies steht im Einklang mit den NMR-Untersuchungen von Domanski et al., die eine Ausbildung von Helices zwischen den Aminosäuren 6 bis 13 und 31 bis 40 von Tβ4 während der Bindung an Aktin beobachten konnten [14]. - 81 - Diskussion Abb. 5-2. 3D-Darstellung des Aktin-Tβ4-Komplexes. Molekulare Modellierung des Komplexes aus Aktin (grau) und Tβ4 (blau) unter Berücksichtigung der identifizierten Vernetzungsstellen durch EDC nach A. Horn (vergl. Anhang A). Vernetzte Aminosäuren sind hervorgehoben und beschriftet. - 82 - Diskussion Reichert et al. analysierten die Bindung zwischen Tβ4 und Aktin mit Hilfe bifunktionaler Thiolreagenzien verschiedener Länge [61]. Die Bildung einer Disulfidbrücke zwischen Aktin und den Cysteinseitenketten verschiedener Mutanten von Tβ4 gelang zwischen Position 6 des C6Tβ4 und C374 von Aktin mit einer Spacer-Länge von 18 Ǻ, sowie zwischen Position 17 und 28 von C17Tβ4 bzw. C28Tβ4 jeweils mit dem ATP-Analogon mit einer Spacer-Länge von 9 und 18 Ǻ. Der Abstand zwischen C374 von Aktin und M6 von Tβ4 im Komplex nach molekularer Modellierung beträgt 19 Ǻ und ist vergleichbar mit der ermittelten Spacer-Länge von Reichert et al. von 18 Ǻ. Für die weiteren Vernetzungen mit dem ATP-Analogon betragen die Abstände im eigenen Modell jedoch 27 bis 35 Ǻ. Eine Vernetzung durch Spacer-Längen von 9 und 18 Ǻ kann damit nicht erklärt werden. Wie zu Beginn bereits erwähnt, sind die drei in dieser Arbeit identifizierten Vernetzungsstellen im Komplex jedoch nicht zwingend gleichzeitig ausgebildet. Dadurch erhöht sich die Flexibilität von Tβ4 und könnte die Interaktion mit weiteren nahegelegenen Bereichen im Aktinmolekül ermöglichen, wie z. B. der ATP-Bindestelle im Zentrum des Aktins. Die Komplexierung von Tβ4 verhindert die Polymerisation von monomerem G-Aktin zu filamentösem F-Aktin. Der Mechanismus besteht in der Maskierung der Aktinbereiche, die für intermolekulare Interaktionen während der Polymerisierung notwendig sind. Diese Bereiche im Aktinmolekül sind vielfach untersucht und definiert worden. Das erste Atommodell für FAktin wurde von Holmes et al. veröffentlicht [62]. Eine Erweiterung dieses Modells erfolgte fast 20 Jahre später von Oda et al. [63]. Die Kontaktbereiche zwischen den Aktinmolekülen im F-Aktin überschneiden sich in beiden Modellen, wobei im Letzteren detaillierter zwischen den Kontaktpunkten innerhalb einer Polymerisationskette und den Kontaktpunkten zwischen zwei Polymerisationsketten unterschieden wird. Im Bezug auf die drei identifizierten Vernetzungsstellen zwischen Aktin und Tβ4 gibt es zwei Überschneidungen: K3 von Tβ4 bindet an E167 von Aktin, welches nach dem Modell von Holmes et al. im Abschnitt der Aminosäuren 166-169 liegt, welcher maßgeblich an Interaktionen im F-Aktin beteiligt ist (siehe Abb. 5-3). Der C-Terminus von Tβ4 bindet an Histidin an Position 40 von G-Aktin, welches sowohl nach Holmes et al. mit 39-45, als auch nach Oda et al. mit 38-49 als Kontaktbereich im F-Aktin identifiziert wurde (siehe Abb. 5-3). Nach Oda et al. ist der Bereich 39-42 außerdem in die Interaktion zwischen zwei Polymerisationsketten involviert. - 83 - Diskussion Abb. 5-3. Maskierung des G-Aktins durch Tβ4 verhindert die Polymerisation zu F-Aktin. 3D-Darstellung des Aktin-Tβ4-Komplexes nach molekularer Modellierung. Grüne Markierung der G-Aktinbereiche, die im F-Aktin miteinander interagieren nach zwei Modellen: (A) Modell nach Holmes et al. (1990), (B) Modell nach Oda et al. (2009). Aktin: grau, Tβ4: blau, identifizierte Vernetzungsstellen: rot. Die identifizierte Vernetzungsstelle am Histidin 40 im Aktinmolekül liegt außerdem im Bereich der von Kabsch et al. lokalisierten DNase I-Bindestelle [64-65]. Diese umfasst neben dem übereinstimmenden Abschnitt 39 bis 45 zusätzlich die Positionen 61 bis 63 der Subdomäne 1 sowie 207 bis 203 der Subdomäne 4 des Aktins. DNase I führt zur Depolymerisation von filamentösem Aktin durch die Ausbildung stabiler DNase-Aktin-Komplexe. DNase I verliert dabei jedoch ihre enzymatische Aktivität [65-66]. Durch Konkurrenz um die gleiche Bindestelle könnte DNase I durch Tβ4 aus seinem Komplex mit Aktin verdrängt werden. Dies ist von pharmakologischer Relevanz bei Betrachtung der Therapie der Mukoviszidose mit rekombinanter DNase. Der Verlust der enzymatischen Aktivität der DNase I durch Bindung an Aktin im Sputum kann durch Tβ4 aufgehoben werden. Gleichzeitig verhindert Tβ4 durch Komplexierung des Aktins seine Polymerisation und kann neben der DNase I zu einer zusätzlichen Verringerung der Viskosität des Sputums beitragen [67]. Dieser Annahme widersprechen jedoch Untersuchungen von Reichert et al., in denen die Aktivität der DNase I in Anwesenheit des chemisch vernetzten Aktin-Tβ4-Komplexes gegenüber Aktin nicht erhöht war. In diesen Untersuchungen wurde die Mutante C6Tβ4 über einen bifunktionalen Thiol-Crosslinker mit Aktin vernetzt. Es ist möglich, dass dies die Konformation des komplexierten Tβ4 beeinflusst und Tβ4 dadurch nicht an der DNase IBindestelle bindet, wie in den eigenen Untersuchungen gezeigt wurde. - 84 - Diskussion In Untersuchungen von Ballweber et al. wurde gezeigt, dass Aktin nicht simultan mit Tβ4 und Profilin chemisch vernetzt werden kann. Im Gegensatz dazu kann durch chemische Vernetzung ein ternärer Komplex bestehend aus Aktin, DNase I und Profilin gebildet werden [68]. Diese Beobachtungen lassen sich durch die identifizierten Bindestellen von Tβ4 an Aktin wie folgt erklären: Profilin bindet an die Subdomänen 1 und 3 des Aktins [69]. Diese Bindung überschneidet die von Tβ4, welches an die Subdomänen 1, 2 und 3 bindet. Ein ternärer Komplex ist damit nicht möglich. Die Bindestelle für DNase I befindet sich an der Subdomäne 2 des Aktins, außerhalb der Bindestelle für Profilin. Daher ist die Ausbildung eines ternären Komplexes aus Aktin, DNase I und Profilin möglich. Zusammenfassend konnten drei Vernetzungsstellen im Aktin-Tβ4-Komplex identifiziert werden, die eine gestreckte Konformation des Tβ4 über die Subdomänen 1, 2 und 3 des Aktins bestätigen. Die Vernetzungsstelle zwischen H40 des Aktins und dem C-terminalen S43 von Tβ4 liegt sowohl im Bereich der DNase I-Bindestelle als auch im Kontaktbereich der Aktinmoleküle im Filament [62-63, 65]. Dabei ist eine Vernetzung an einem der beiden Stickstoffe des Imidazolringes nach meiner Kenntnis in dieser Arbeit erstmals beschrieben worden. Die gelungene Identifizierung der Vernetzungsstellen im Aktin-Tβ4-Komplex weist eine Möglichkeit auf weitere Interaktionspartner für Tβ4 durch EDC-Vernetzung zu identifizieren und die Interaktion durch HPLC-ESI-MS-Analyse zu lokalisieren. 5.3 Freisetzung von intrazellulärem Thymosin β4 Extrazelluläres Tβ4 wurde sowohl in Serum, Tränen- und Sulkusflüssigkeit, als auch in zellfreier Wundflüssigkeit nach Operation nachgewiesen [17-19]. Studien belegen verschiedenste extrazelluläre Effekte von Tβ4. Als Beispiele seien hier die Förderung der Wundheilung durch Steigerung der Zellmigration und Angiogenese [31, 70], sowie die Unterstützung anti-entzündlicher Prozesse durch Herabregulierung verschiedener Entzündungsmediatoren und die Reduktion entzündlicher Zellinfiltrate genannt [29, 31, 71]. Diese verschiedenen extrazellulären Funktionen setzten die Freisetzung von intrazellulärem Tβ4 aus den Zellen voraus. Der Freisetzungsmechanismus von Tβ4 aus den Zellen in die Umgebung ist bis heute nicht vollständig geklärt [72]. Tβ4 besitzt kein Signalpeptid [73-74], eine Sekretion erscheint damit unwahrscheinlich. Hannappel et al. [75] untersuchten bereits 1985 die Sekretion von Tβ4 aus Eppstein-Barr-Virus-transformierten B-Lymphozyten und - 85 - Diskussion konnten keine Freisetzung von Tβ4 in das Medium nachweisen. Gomez-Marquez et al. [75] schlussfolgerten aus der Abwesenheit einer Signalsequenz und der fehlenden Sekretion aus B-Lymphozyten, dass Tβ4 im Plasma durch Freisetzung aus geschädigten oder abgestorbenen Lymphozyten zu erklären sei. Diese Hypothese wurde in der vorliegenden Arbeit genauer untersucht. Der Ansatz zu den Untersuchungen war die Permeabilisierung von Zellmembranen zur erleichterten Freisetzung des nur 5 kDa umfassenden Peptids Tβ4. Bei den verwendeten Jurkatzellen handelt es sich um eine immortalisierte Zelllinie von T-Lymphozyten mit einem hohen Gehalt an Tβ4 (300 fg/Zelle) im Vergleich zu anderen Zelllinien [16]. Die Permeabilisierung der Zellen gelang entweder durch Digitonin oder hypoosmotische Medien. Digitonin ist ein Detergenz mit sterischer Homologie zu Cholesterin (Abb. 5-4). Dadurch kann Digitonin in Zellmembranen eingebaut werden, es bilden sich Poren, durch die Makromoleküle passieren können [76]. Bei niedrigen Digitonin-Konzentrationen (bis 10 µg/ml) wird so die Zellpermeabilität erhöht, bei höheren Konzentrationen wird die Lyse der Zellen induziert. Abb. 5-4. Strukturverwandtschaft zwischen Digitonin und Cholesterin. Hypotoner Stress führt zu erhöhter Permeabilität der Zellmembran durch Zellschwellung sowie irreversibler Zellmembranschädigung sobald das Zellvolumen einen kritischen Punkt übersteigt. Die eigenen Messungen zeigen, dass die Permeabilisierung der Zellen durch Digitonin oder hypoosmotische Medien zu einer Freisetzung von Tβ4 in das umgebende Medium führt. In welchem Maße die Permeabilisierung der Zellen gleichzeitig zum Verlust der Lebensfähigkeit der Zellen führte, wurde durch die Freisetzung des zytosolischen Enzyms - 86 - Diskussion Lactatdehydrogenase (LDH) untersucht. Es zeigte sich, dass die Freisetzung von Tβ4 und LDH parallel verlaufen. Daraus lässt sich schließen, dass die Freisetzung von intrazellulärem Tβ4 aus Zellen hauptsächlich durch den Zelltod bedingt ist. Diese These steht im Einklang mit den Ergebnissen zur Freisetzung von Tβ4 aus aktivierten Makrophagen von Kannan et al. [20]. Dabei wurde gezeigt, dass trotz der Erhöhung der sekretorischen Aktivität von Makrophagen durch toll-like-Rezeptoragonisten die Sekretion von Tβ4 erst mit dem Zelltod einsetzt. Zellzerstörung und Zelltod können eine Erklärung für die Konzentrationen an Tβ4 in humanem Plasma (0,13 mg/l) und Serum (0,45 bis 1,1 mg/l) sein [15, 77]. Die hohe Konzentration an Tβ4 in zellfreier Wundflüssigkeit nach Operation von 20 mg/l [17] kann durch massive Gewebezerstörung, Infiltration von Leukozyten sowie einhergehende Zelllyse erklärt werden. Die Konzentration von Tβ4 in Sulkusflüssigkeit beträgt 100 mg/l [19, 78] und ist damit 5fach höher als in zellfreiem Wundfluid. Diese auffällig hohe Konzentration an extrazellulärem Tβ4 in Sulkusflüssigkeit ist wahrscheinlich nicht ausschließlich durch Zelltod oder Zellzerstörung zu erklären. 5.4 Extrazelluläres Thymosin β4 Die Anwesenheit von Tβ4 in extrazellulären Flüssigkeiten und die verschiedenen nachgewiesenen extrazellulären Effekte lassen weitere Interaktionspartner neben Aktin vermuten. So sehr die intrazelluläre Interaktion zwischen Tβ4 und Aktin bereits untersucht ist, so wenig ist über die Wirkmechanismen des extrazellulären Tβ4 bekannt. Einen neuen Ansatz für die Funktion von extrazellulärem Tβ4 brachten Huff et al. ein: Aus aktivierten Thrombozyten freigesetztes Tβ4 kann durch Faktor XIIIa an extrazelluläre Proteine wie Fibrin und Kollagen vernetzt werden [46]. Sie stellten die Hypothese auf, dass diese Vernetzungsreaktion eine Möglichkeit ist, die Konzentration von Tβ4 lokal zu erhöhen um dadurch Wundheilungsprozesse zu verbessern. Um dieser Hypothese nachzugehen, wurde zunächst nach geeigneten Reaktionspartnern für die enzymatische Vernetzung von Tβ4 gesucht. Im Anschluss wurden die Vernetzungsstellen näher charakterisiert und der Einfluss dieser Vernetzung von Tβ4 auf seine zellulären Effekte untersucht. - 87 - Diskussion 5.4.1 Substratpartner von Thymosin β4 zur enzymatischen Vernetzung Die enzymatische Vernetzung gelang durch mTGA. Diese wird aus dem Bakterienstamm Streptomyces mobaraensis gewonnen. Im Gegensatz zu Faktor XIIIa aus den Arbeiten von Huff et al. ist die mTGA nicht Ca2+-abhängig. Daraus resultiert ein breiteres Anwendungsspektrum der mTGA, da Ca2+ zur Polymerisation oder Ausfällung einiger Proteine führen kann. Durch die Produktion der mTGA im Bakterienstamm sowie anschließender Sekretion erhält man eine hohe Ausbeute mit nur geringen Produktionskosten [79]. Die mTGA gehört wie Faktor XIIIa zur Enzymklasse der ProteinGlutamin γ-Glutamyltransferasen (EC 2.3.2.13). Bereits identifizierte Substrate sind in einer Datenbank zusammengefasst (http://genomics.dote.hu/wiki/index.php/Main_Page). Im Rahmen dieser Arbeit konnten als Vertreter der extrazellulären Matrix Kollagen Typ I, Gelatine und Fibronektin sowie als Faktoren der Blutgerinnungskaskade Fibrinogen und Fibrin als Substrate der mTGA und Reaktionspartner zur enzymatischen Vernetzung mit Tβ4 identifiziert werden. Die Vernetzung zwischen Tβ4 mit den Substraten Kollagen, Fibrinogen und Fibrin konnte schon von Huff et al. demonstriert werden, allerdings unter Verwendung der Gewebetransglutaminase Faktor XIIIa [46]. Fibronektin ist nach meiner Kenntnis in dieser Arbeit erstmals erfolgreich mit Tβ4 vernetzt worden. Als Bestandteil der extrazellulären Matrix spielt Fibronektin eine wichtige Rolle während der Zelladhäsion, -migration, -differenzierung und -wachstum [80]. In der zugänglichen Literatur ist bisher nur an einer Stelle von einem Zusammenhang zwischen Tβ4 und Fibronektin berichtet worden: Reyes-Gordillo et al. konnten zeigen, dass Tβ4 u.a. die Expression von Fibronektin-mRNA in der Tetrachlorkohlenstoff-geschädigten Rattenleber verhindert [81]. Tβ4 verhindert auch die Hochregulation der Kollagen-mRNA [81]. Kollagen konnte analog zu Fibronektin in dieser Arbeit ebenfalls mit Tβ4 vernetzt werden. Es gibt also verschiedene Berührungspunkte zwischen Tβ4 und Komponenten der extrazellulären Matrix wie Kollagen und Fibronektin. Die enzymatische Vernetzung zwischen Fibrin(ogen) und Tβ4 wurde nach den Arbeiten von Huff et al. in weiteren Untersuchungen von Makogonenko et al. näher charakterisiert [45]. Sie konnten zeigen, dass 0,2 und 0,4 mol Tβ4 in 1 mol Fibrinogen und Fibrin durch Faktor XIIIa eingebaut wurden. Aus diesem hohen Anteil der Inkorporation schlossen sie auf eine physiologische Rolle dieser Vernetzungsreaktion während der Wundheilung. - 88 - Diskussion Die nachgewiesene enzymatische Vernetzung von Tβ4 an verschiedene Proteine der extrazellulären Matrix durch mTGA ermöglicht die Untersuchung der Wirkung von vernetztem Tβ4 in Zellkulturen. 5.4.2 Identifizierung der Vernetzungsstellen nach Behandlung mit mTGA Zur näheren Charakterisierung dieser mTGA-katalysierten Vernetzungsreaktion wurden analog zur EDC-Vernetzung die Vernetzungsstellen identifiziert. Die extrazellulären Komponenten Kollagen, Fibrin und Fibronektin weisen komplexe Strukturen auf. Sie bestehen jeweils aus heterogenen Aminosäureketten zwischen 50 und 230 kDa, die sich zu multimeren Komplexen zusammenlagern. Zur Analyse der Vernetzungsstellen wurde daher G-Aktin, welches in monomerer Form mit einer Molekülmasse von 42 kDa vorliegt, als ein Modellpartner für die Vernetzung mit Tβ4 eingesetzt. Aktin ist ein intrazelluläres Protein, das erst nach eintreten des Zelltodes in den Extrazellularraum freigesetzt wird [82]. Es konnte nachgewiesen werden, dass Aktin während der Blutgerinnungskaskade durch Transglutaminasen in das Fibringerinnsel eingebaut wird [83]. Aktin ist somit ein natürliches Substrat der Transglutaminase. Daraus ergibt sich die Möglichkeit, dass Tβ4 auch in vivo durch Transglutaminasen mit Aktin vernetzt wird. Dies könnte auch ein Mechanismus darstellen um die Toxizität des polymerisierbaren G-Aktins im Extrazellularraum zu verringern. Die Gemeinsamkeiten der Vernetzungsreaktion zwischen EDC und mTGA sind die Ausbildung einer Isopeptidbindung sowie als Vorraussetzung die sehr enge räumliche Nähe zwischen den Substraten bzw. Reaktanten. Nach massenspektrometrischer Analyse des tryptischen Verdaus des Tβ4-Aktin-Addukts sowie des 2Tβ4-Aktin-Addukts nach enzymatischer Vernetzung konnten drei verschiedene Vernetzungen identifiziert werden: Der Lysinrest an Position 61 des Aktins wurde mit dem Glutaminrest an Position 39 des Tβ4 vernetzt. Der Glutaminrest an Position 41 des Aktins wurde mit dem Lysinrest an Position 19 des Tβ4 vernetzt. Die dritte Vernetzung enthielt gleichzeitig zwei Vernetzungsstellen zwischen den Glutaminresten an Postition 41 des Aktins und 39 des Tβ4 mit den Lysinresten an den Positionen 16, 18 oder 19 im Tβ4-Molekül. Analog zur Diskussion über die EDC-Vernetzungsstellen konnten auch in diesem Fall neben den Vernetzungsfragmenten parallel die unvernetzten Aktin-Fragmente nachgewiesen werden. Dies deutet daraufhin, dass nicht alle drei Vernetzungsmöglichkeiten zwingend - 89 - Diskussion gleichzeitig genutzt werden. Im Unterschied zur EDC-Vernetzung entstehen bei der enzymatisch katalysierten Reaktion mehrere Vernetzungsprodukte, die aus jeweils einem Aktinmolekül und einer unterschiedlichen Anzahl von Tβ4-Molekülen bestehen. Dabei entsteht am ehesten ein Tβ4-Aktin-Addukt im molaren Verhältnis von 1:1, die Vernetzung weiterer Tβ4-Moleküle erfolgte mit stetig sinkender Intensität. Inwieweit diese zusätzlichen Tβ4-Moleküle an Aktin oder bereits vernetztes Tβ4 gebunden werden, konnte nicht geklärt werden. Die intramolekulare Brückenbindung im Tβ4-Molekül der dritten Vernetzungsmöglichkeit lässt vermuten, dass weitere Tβ4-Moleküle im Addukt jeweils an vernetztes Tβ4 gebunden werden. Safer et al. lokalisierten eine andere Vernetzungsstelle im Tβ4-Aktin-Addukt: Der Glutaminrest an Position 41 des Aktins wurde mit dem Lysinrest an Position 38 des Tβ4 enzymatisch verbunden [38]. Eine Erklärung für diese Abweichung könnte sein, dass nicht wie in dieser Arbeit mTGA, sondern Ca2+-abhängige Lebertransglutaminase aus dem Meerschweinchen verwendet wurde. Huff et al. zeigten in Untersuchungen zur Markierung von Tβ4 mit Dansylcadaverin mittels Lebertransglutaminase, dass vorwiegend die Glutaminreste an Position 23 und 36 von Tβ4 reagierten [48]. Der dritte Glutaminrest an Position 39 von Tβ4 reagierte nur mit einer sehr geringen Effizienz. Auch diese Ergebnisse mit gpTGA konnten bei Verwendung der mTGA nicht bestätigt werden. In den eigenen Untersuchungen reagierte ausschließlich der Glutaminrest an Position 39 als Glutaminylsubstrat (Acyl-Donor). Gleichzeitig reagierte Tβ4 auch über den Lysylrest an Position 19 als Acyl-Akzeptor. Die Vernetzungsstelle zwischen Q41 von Aktin und K19 von Tβ4 wird durch Arbeiten von Eligula et al. gestützt [84]. Diese untersuchten die Vernetzung zwischen Aktin und Myosin unter Verwendung einer mTGA. Analog zu den eigenen Ergebnissen und denen von Safer et al. war der Glutaminrest an Position 41 im Aktinmolekül in die Vernetzungsreaktion involviert. Myosin besitzt eine Lysin-reiche Region am S1-Teil der schweren Kette zwischen den Aminosäuren 636 und 642, die durch mTGA mit Q41 des Aktins enzymatisch vernetzt werden konnte [84]. Diese Lysin-reiche Region findet sich analog im Bereich der Vernetzungsstelle von Tβ4: Der zentrale Abschnitt zwischen den Aminosäuren 14 und 19 enthält vier Lysinreste. In einer weiteren Arbeit wurde die Interaktion zwischen Aktin und Cofilin mittels mTGA untersucht. Auch in diesem Fall konnte Q41 in der Subdomäne 2 als Vernetzungsstelle im Aktinmolekül identifiziert werden [85]. Cofilin gehört wie Tβ4 zur Familie der Aktin-bindenden Proteine und führt durch seine Bindung zur Depolymerisation von F-Aktin. Die Bindung von - 90 - Diskussion Cofilin an Subdomäne 2 konnte durch massenspektrometrische Analysen von Kamal et al. bestätigt werden, deren Daten zeigen, dass Cofilin an die Subdomänen 1 und 2 des Aktins bindet [86]. Dies unterstützt außerdem die Aussage, dass Vernetzungsreaktionen mit mTGA zur Identifizierung von Protein-Protein-Interaktionen geeignet sind. Abb. 5-5. Lokalisation der an der enzymatischen Vernetzung beteiligten Aminosäurereste von Aktin und Tβ4. Die mTGA führt zur Vernetzung von Aktin K61 mit Tβ4 Q39, Aktin Q41 mit Tβ4 K19, sowie einer Doppelvernetzung zwischen Tβ4 Q39 und Aktin Q41 mit den zentralen Lysinen 16, 18, oder 19 von Tβ4. Aktin: grau, Tβ4: blau, wichtige Aminosäurereste: rot und beschriftet. (1-4) Einteilung der Subdomänen des G-Aktins In Abb. 5-5 sind die Aminosäuren hervorgehoben, die an der mTGA-Vernetzung zwischen Aktin und Tβ4 beteiligt sind. Auffällig ist, dass Aktin nur innerhalb der Subdomäne 2 durch mTGA vernetzt wird. Dabei handelt es sich um die Region der höchsten Mobilität [87], sowie die Region verschiedener Bindestellen, z. B. für Myosin, DNase I und Cofilin [65, 84-86]. Sowohl Aktin als auch Tβ4 agieren gleichzeitig als Lysyl- und Glutaminylsubstrate. Ein Vergleich der Vernetzungsstellen zwischen Aktin und Tβ4 nach chemischer und enzymatischer Vernetzung (vergl. Abb. 5-3 und Abb. 5-5) zeigt übereinstimmend die Bindung des C-Terminus von Tβ4 an die Subdomäne 2 des Aktins. Jedoch ist nach EDC-Vernetzung der zentrale Lysin-reiche Abschnitt von Tβ4 an den N-Terminus in Subdomäne 1 des Aktins gebunden, während dieser nach Vernetzung mit mTGA an Subdomäne 2 gebunden wird. Auch konnte keine Bindestelle des N-terminalen Abschnittes von Tβ4 nach mTGAVernetzung nachgewiesen werden, wohingegen die Behandlung mit EDC zur Vernetzung an Subdomäne 3 des Aktins führte. Die zum Teil abweichenden Ergebnisse lassen sich durch eine hohe Flexibilität von Tβ4 erklären. In wässriger Lösung liegt Tβ4 unstrukturiert vor, erst - 91 - Diskussion bei der Bindung an Aktin werden nachweislich in den N- und C-terminalen Regionen zwei Helices ausgebildet [14]. 5.4.3 Einfluss der enzymatischen Vernetzung von Thymosin β4 auf seine antifibrotische Wirkung Die nachgewiesene enzymatische Vernetzung von Tβ4 an verschiedene Proteine der extrazellulären Matrix ermöglicht die Untersuchung der Wirkung von vernetztem Tβ4 in Zellexperimenten. Die Beschichtung der Zellkulturtestplatten mit Proteinen, wie Fibronektin, Kollagen und Gelatine wirkt sich positiv auf die Adhäsion und Migration von verschiedenen Zellen aus. Aus Kostengründen wurde die Vernetzung für die Zellexperimente mit Gelatine durchgeführt. Tβ4 inhibiert die PDGF-induzierte Migration von humanen HSC [34]. Diese Wirkung von PDGF auf HSC ist ein Kennzeichen der Transdifferenzierung, die eine Schlüsselrolle in der fibrogenen Kaskade spielt. Diese Hypothese war der Ausgangspunkt zur Untersuchung des Einflusses der enzymatischen Vernetzung von Tβ4 auf seine antifibrotische Wirkung. Die eigenen Messungen bestätigen die Arbeiten von Reyes-Gordillo et al. bezüglich der inhibitorischen Wirkung von Tβ4 auf die Induktion der Zellmigration durch PDGF [34]. Darüber hinaus wurden in dieser Arbeit die Wirkung von scrambled Tβ4 sowie der Einfluss von enzymatisch vernetztem Tβ4 untersucht. Scrambled Tβ4 besitzt die gleiche Aminosäurezusammensetzung wie Tβ4, jedoch in einer randomisierten Abfolge. Dies ermöglicht die Unterscheidung zwischen unspezifischen Effekten, die nur auf Größe und Ladung des Peptids zurückzuführen sind, und spezifischen Effekten des Tβ4. Es konnte kein Einfluss von scrambled Tβ4 auf die Migration von PDGF induzierten HSC festgestellt werden. Daraus lässt sich ableiten, dass der Effekt spezifisch für Tβ4 und seine bestimmte Aminosäureabfolge ist. Zur Untersuchung des Einflusses der enzymatischen Vernetzung von Tβ4 auf diesen spezifischen Effekt wurden die Zellkulturtestplatten speziell behandelt. Dabei gelang die Vernetzung nachweislich durch Inkubation der Gelatine-vorbeschichteten Platten mit Tβ4 und mTGA. Die eigenen Messungen zeigen, dass die Vernetzungsreaktion zum Verlust der inhibitorische Wirkung von Tβ4 auf die PDGF-induzierte Migration der HSC führt. Die Hypothese von Huff et al., dass die enzymatische Vernetzung von Tβ4 eine Möglichkeit zur - 92 - Diskussion lokalen Anreicherung und Wirkungsverstärkung darstellt, wurde in diesem System nicht bestätigt. Es wäre interessant festzustellen, ob die Vernetzung von Tβ4 auch in anderen Systemen dessen Wirkung reduziert. So haben extrazelluläre Gaben von Tβ4 eine induzierende Wirkung auf die Migration von Endothelzellen [22]. Da die Wirkung von Tβ4 auf die Migration von HSC und Endothelzellen gegensätzlich verläuft, scheint diese auf verschiedenen Wirkmechanismen zu beruhen. Es wäre möglich den Effekt von Tβ4 auf die Migration von Endothelzellen auf eine vergleichbare Weise in einem Wundheilungs-Assay mit vernetztem Tβ4 zu vergleichen. Reyes-Gordillo et al. konnten nachweisen, dass Tβ4 die PDGF-induzierte Phosphorylierung von Akt inhibiert, was auch die Migration beeinflusst. Jedoch konnte kein inhibitorischer Effekt auf Kinasen beobachtet werden, die der Akt vorgeschaltet sind, beispielsweise PI3K [34]. Sie postulieren daraus eine Aufnahme von Tβ4 in die Zellen und eine mögliche Kompetition zwischen Tβ4 und Akt um die Aktin-Bindung. Durch die enzymatische Vernetzung von Tβ4 in dieser Arbeit war eine Aufnahme in die Zelle nicht möglich. Die fehlende inhibitorische Wirkung von vernetztem Tβ4 ist damit mit dieser These konform. Neuste Untersuchungen von Selmi et al. unterstützen diese These zusätzlich, indem sie zeigen konnten, dass extrazelluläres biotinyliertes-Tβ4 in verschiedene Zelllinien aufgenommen werden konnte [88]. Eine weitere Alternative Hypothese, welche die von Reyes-Gordillo et al. nachgewiesenen Effekte von Tβ4 erklärt, ist eine mögliche direkte Interaktion von Tβ4 mit PDGF. Diese Interaktion würde die Bindung von PDGF an den PDGF-β-Rezeptor verhindern oder dessen Reaktion verändern. Auch diese Hypothese erklärt die Verhinderung der PDGF-induzierten Phosphorylierung der Akt durch Tβ4 und damit auch die Verhinderung der PDGF-induzierten Migration der HSC, sowie den Verlust dieser Wirkungen durch Vernetzung. 5.4.4 Identifizierung von PDGF als neuen Interaktionspartner für Thymosin β4 In der vorangegangenen Diskussion wurde die Hypothese aufgestellt, dass Tβ4 eine Interaktion mit PDGF eingehen, die Rezeptorbindung von PDGF inhibieren oder zumindest verändern und somit die PDGF-induzierte Migration von HSC verhindern könnte. Der Nachweis dieser Interaktion zwischen Tβ4 und PDGF erfolgte durch chemische Vernetzung. Dies ist eine übliche Methode zur Identifizierung von Protein-Protein-Interaktionen durch intermolekulare oder Proteinstrukturen durch intramolekulare Vernetzungen [89-90]. - 93 - Diskussion Die chemische Vernetzung zwischen Tβ4 und PDGF gelang durch den Null-LängenCrosslinker EDC. SDS-PAGE-Experimente bestätigen die Bildung eines 1:1- Vernetzungsproduktes zwischen Tβ4 und PDGF. Unter den gleichen Bedingungen konnte keine Vernetzung zwischen Tβ4 und Lactalbumin als Negativkontrolle nachgewiesen werden, wodurch die Spezifität der Interaktion zwischen Tβ4 und PDGF bestätigt wird. Aus der Vernetzung von Tβ4 mit PDGF durch EDC lassen sich Parallelen zur Komplexbildung zwischen Tβ4 und Aktin ziehen. Tβ4 bildet mit G-Aktin einen 1:1 Komplex und verhindert dadurch die Polymerisation zu F-Aktin [21]. Diese Interaktion konnte ebenfalls durch Vernetzung mit EDC nachgewiesen werden [38, 91]. Neben Tβ4 sind auch alle weiteren untersuchten β-Thymosine in der Lage Aktin zu sequestrieren [35, 92]. Für die Interaktion mit PDGF konnte dieser analoge Effekt innerhalb der β-Thymosine bestätigt werden. In Anwesenheit eines 10fach molaren Überschusses an Tβ10 wurde Tβ4 aus seinem Komplex mit PDGF verdrängt. Nach wie vor konnte für Tβ4 kein Wirkmechanismus identifiziert werden, der seine vielfältigen extrazellulären und intrazellulären Effekte erklärt. Es sind wenige intrazelluläre Interaktionspartner wie Aktin, PINCH, ILK und ATPase beschrieben wurden, von denen Aktin der meistuntersuchte Interaktionspartner ist [39, 91, 93]. Durch die Bestätigung der Interaktion zwischen Tβ4 und PDGF mittels chemischer Vernetzung im Rahmen dieser Arbeit wurde ein extrazellulärer Interaktionspartner identifiziert. Eine Interaktion zwischen Tβ4 und PDGF würde außerdem die inhibitorische Wirkung von extrazellulärem Tβ4 auf die PDGFinduzierte Migration von HSC erklären, sowie den Verlust der inhibitorischen Wirkung nach enzymatischer Vernetzung des Tβ4. Die Interaktion zwischen PDGF und Tβ4 wurde durch chemische Vernetzung mit EDC nachgewiesen. Dies ist ein physikalischer Beweis für eine Protein-Protein-Interaktion, da sich beide Proteine in unmittelbarer Nähe zueinander befanden. Die Bestätigung einer physiologischen Interaktion könnte z. B. durch Immunpräzipitation erfolgen. Auch der Einfluss der Anwesenheit von Tβ4 auf die Rezeptorbindung von PDGF könnte mittels Rezeptor-Ligand-Bindungsstudien untersucht werden. Die Lokalisation der Interaktion ist durch EDC-Vernetzung und HPLC-ESI-MS-Analyse möglich, analog zur Identifizierung des Aktin-Tβ4-Komplexes. - 94 - Literaturverzeichnis Literaturverzeichnis 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Goldstein, A.L., History of the discovery of the thymosins. Ann N Y Acad Sci, 2007. 1112: p. 1-13. Hannappel, E., S. Davoust, and B.L. Horecker, Thymosins beta 8 and beta 9: two new peptides isolated from calf thymus homologous to thymosin beta 4. Proc Natl Acad Sci U S A, 1982. 79(6): p. 1708-11. Hannappel, E., F. Wartenberg, and X.R. Bustelo, Isolation and characterization of thymosin beta 9 Met from pork spleen. Arch Biochem Biophys, 1989. 273(2): p. 396402. Hannappel, E., H. Kalbacher, and W. Voelter, Thymosin beta 4Xen: a new thymosin beta 4-like peptide in oocytes of Xenopus laevis. Arch Biochem Biophys, 1988. 260(2): p. 546-51. Erickson-Viitanen, S. and B.L. Horecker, Thymosin beta 11: a peptide from trout liver homologous to thymosin beta 4. Arch Biochem Biophys, 1984. 233(2): p. 815-20. Low, T.L., D.T. Liu, and J.H. Jou, Primary structure of thymosin beta 12, a new member of the beta-thymosin family isolated from perch liver. Arch Biochem Biophys, 1992. 293(1): p. 32-9. Stoeva, S., S. Horger, and W. Voelter, A novel beta-thymosin from the sea urchin: extending the phylogenetic distribution of beta-thymosins from mammals to echinoderms. J Pept Sci, 1997. 3(4): p. 282-90. Huff, T., et al., beta-Thymosins, small acidic peptides with multiple functions. Int J Biochem Cell Biol, 2001. 33(3): p. 205-20. Edwards, J., Single-domain beta-thymosins: the family history. Ann N Y Acad Sci, 2012. 1269: p. 7-15. Low, T.L., S.K. Hu, and A.L. Goldstein, Complete amino acid sequence of bovine thymosin beta 4: a thymic hormone that induces terminal deoxynucleotidyl transferase activity in thymocyte populations. Proc Natl Acad Sci U S A, 1981. 78(2): p. 1162-6. Hannappel, E., Thymosin beta4 and its posttranslational modifications. Ann N Y Acad Sci, 2010. 1194: p. 27-35. Czisch, M., et al., Conformation of thymosin beta 4 in water determined by NMR spectroscopy. Eur J Biochem, 1993. 218(2): p. 335-44. Simenel, C., et al., Structural requirements for thymosin beta4 in its contact with actin. An NMR-analysis of thymosin beta4 mutants in solution and correlation with their biological activity. Eur J Biochem, 2000. 267(12): p. 3530-8. Domanski, M., et al., Coupling of folding and binding of thymosin beta4 upon interaction with monomeric actin monitored by nuclear magnetic resonance. J Biol Chem, 2004. 279(22): p. 23637-45. Hannappel, E. and M. van Kampen, Determination of thymosin β4 in human blood cells and serum. J Chromatogr, 1987. 397: p. 279-85. Hannappel, E. and W. Leibold, Biosynthesis rates and content of thymosin beta 4 in cell lines. Arch Biochem Biophys, 1985. 240(1): p. 236-41. Bodendorf, S., G. Born, and E. Hannappel, Determination of thymosin β4 and protein in human wound fluid after abdominal surgery. Ann N Y Acad Sci, 2007. 1112: p. 418-24. - 95 - Literaturverzeichnis 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. Badamchian, M., et al., Identification and Quantification of Thymosin β4 in Human Saliva and Tears. Ann N Y Acad Sci, 2007. Inzitari, R., et al., HPLC-ESI-MS analysis of oral human fluids reveals that gingival crevicular fluid is the main source of oral thymosins beta(4) and beta(10). J Sep Sci, 2009. 32(1): p. 57-63. Kannan, L., et al., Effect of toll-like receptor activation on thymosin beta-4 production by chicken macrophages. Mol Cell Biochem, 2010. 344(1-2): p. 55-63. Safer, D., M. Elzinga, and V.T. Nachmias, Thymosin beta 4 and Fx, an actinsequestering peptide, are indistinguishable. J Biol Chem, 1991. 266(7): p. 4029-32. Malinda, K.M., A.L. Goldstein, and H.K. Kleinman, Thymosin beta 4 stimulates directional migration of human umbilical vein endothelial cells. FASEB J, 1997. 11(6): p. 474-81. Bock-Marquette, I., et al., Thymosin β4 activates integrin-linked kinase and promotes cardiac cell migration, survival and cardiac repair. Nature, 2004. 432: p. 466-72. Philp, D., et al., Thymosin beta4 increases hair growth by activation of hair follicle stem cells. FASEB J, 2004. 18(2): p. 385-7. Ho, J.H., et al., Internalization is essential for the antiapoptotic effects of exogenous thymosin beta-4 on human corneal epithelial cells. Invest Ophthalmol Vis Sci, 2007. 48(1): p. 27-33. Smart, N., et al., Thymosin beta4 induces adult epicardial progenitor mobilization and neovascularization. Nature, 2007. 445(7124): p. 177-82. Morris, D.C., et al., Thymosin beta4 improves functional neurological outcome in a rat model of embolic stroke. Neuroscience, 2010. 169(2): p. 674-82. Sosne, G., et al., Thymosin beta 4 suppression of corneal NFkappaB: a potential antiinflammatory pathway. Exp Eye Res, 2007. 84(4): p. 663-9. Sosne, G., et al., Thymosin-beta4 modulates corneal matrix metalloproteinase levels and polymorphonuclear cell infiltration after alkali injury. Invest Ophthalmol Vis Sci, 2005. 46(7): p. 2388-95. Huang, L.C., et al., Ocular surface expression and in vitro activity of antimicrobial peptides. Curr Eye Res, 2007. 32(7-8): p. 595-609. Malinda, K.M., et al., Thymosin β4 accelerates wound healing. J Invest Dermatol, 1999. 113(3): p. 364-8. Sosne, G., et al., Thymosin beta 4 promotes corneal wound healing and decreases inflammation in vivo following alkali injury. Exp Eye Res, 2002. 74(2): p. 293-9. Goldstein, A.L., et al., Thymosin beta4: a multi-functional regenerative peptide. Basic properties and clinical applications. Expert Opin Biol Ther, 2012. 12(1): p. 37-51. Reyes-Gordillo, K., et al., Thymosin-beta4 (Tbeta4) Blunts PDGF-Dependent Phosphorylation and Binding of AKT to Actin in Hepatic Stellate Cells. Am J Pathol, 2011. 178(5): p. 2100-8. Jean, C., et al., Interaction of G-actin with thymosin beta 4 and its variants thymosin beta 9 and thymosin beta met9. J Muscle Res Cell Motil, 1994. 15(3): p. 278-86. Carlier, M.F., et al., Modulation of the interaction between G-actin and thymosin beta 4 by the ATP/ADP ratio: possible implication in the regulation of actin dynamics. Proc Natl Acad Sci U S A, 1993. 90(11): p. 5034-8. Hannappel, E. and F. Wartenberg, Actin-sequestering ability of thymosin β4, thymosin β4 fragments, and thymosin β4-like peptides as assessed by the DNase I inhibition assay. Biol Chem Hoppe Seyler, 1993. 374(2): p. 117-22. - 96 - Literaturverzeichnis 38. 39. 40. 41. 42. 43. 44. 45. Safer, D., T.R. Sosnick, and M. Elzinga, Thymosin beta 4 binds actin in an extended conformation and contacts both the barbed and pointed ends. Biochemistry, 1997. 36(19): p. 5806-16. Freeman, K.W., B.R. Bowman, and B.R. Zetter, Regenerative protein thymosin beta4 is a novel regulator of purinergic signaling. FASEB J, 2011. 25(3): p. 907-15. Bednarek, R., et al., Ku80 as a novel receptor for thymosin beta4 that mediates its intracellular activity different from G-actin sequestering. J Biol Chem, 2008. 283(3): p. 1534-44. Brieger, A., et al., Thymosin beta 4 expression and nuclear transport are regulated by hMLH1. Biochem Biophys Res Commun, 2007. 364(4): p. 731-6. Lee, S.J., et al., Thymosin beta4 is involved in stabilin-2-mediated apoptotic cell engulfment. FEBS Lett, 2008. 582(15): p. 2161-6. Fan, Y., et al., Spatial coordination of actin polymerization and ILK-Akt2 activity during endothelial cell migration. Dev Cell, 2009. 16(5): p. 661-74. Greenberg, C.S., P.J. Birckbichler, and R.H. Rice, Transglutaminases: multifunctional cross-linking enzymes that stabilize tissues. FASEB J, 1991. 5(15): p. 3071-7. Makogonenko, E., et al., Factor XIIIa incorporates thymosin beta4 preferentially into the fibrin(ogen) alphaC-domains. Biochemistry, 2004. 43(33): p. 10748-56. 46. Huff, T., et al., Thymosin β4 is released from human blood platelets and attached by factor XIIIa (transglutaminase) to fibrin and collagen. Faseb J, 2002. 16(7): p. 691-6. 47. Goldstein, A.L., E. Hannappel, and H.K. Kleinman, Thymosin β4: actin sequestering protein moonlights to repair injured tissues. Trends Mol Med, 2005. 11(9): p. 421-9. Huff, T., et al., Thymosin beta(4) serves as a glutaminyl substrate of transglutaminase. Labeling with fluorescent dansylcadaverine does not abolish interaction with G-actin. FEBS Lett, 1999. 464(1-2): p. 14-20. ClinicalTrials.gov. http://www.clinicaltrials.gov/ct2/results?term=thymosin&Search=Search U.S. National Institutes of Health. Stand: Januar 2013: p. abgerufen am 22.01.2013. Laemmli, U.K., Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970. 227(5259): p. 680-5. Swain, M. and N.W. Ross, A silver stain protocol for proteins yielding high resolution and transparent background in sodium dodecyl sulfate-polyacrylamide gels. Electrophoresis, 1995. 16(6): p. 948-51. Bittner, M., P. Kupferer, and C.F. Morris, Electrophoretic transfer of proteins and nucleic acids from slab gels to diazobenzyloxymethyl cellulose or nitrocellulose sheets. Anal Biochem, 1980. 102(2): p. 459-71. Lorand, L., et al., Transamidating enzymes. II. A continuous fluorescent method suited for automating measurements of factor XIII in plasma. Anal Biochem, 1971. 44(1): p. 221-31. Schneider, U., H.U. Schwenk, and G. Bornkamm, Characterization of EBV-genome negative "null" and "T" cell lines derived from children with acute lymphoblastic leukemia and leukemic transformed non-Hodgkin lymphoma. Int J Cancer, 1977. 19(5): p. 621-6. Nakamura, A., et al., Human primary cultured hepatic stellate cells can be cryopreserved. Med Mol Morphol, 2010. 43(2): p. 107-15. Pardee, J.D. and J.A. Spudich, Purification of muscle actin. Methods Enzymol, 1982. 85 Pt B: p. 164-81. 48. 49. 50. 51. 52. 53. 54. 55. 56. - 97 - Literaturverzeichnis 57. 58. 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. 72. 73. 74. 75. MacLean-Fletcher, S.D. and T.D. Pollard, Viscometric analysis of the gelation of Acanthamoeba extracts and purification of two gelation factors. J Cell Biol, 1980. 85(2): p. 414-28. Ballweber, E., et al., Polymerisation of chemically cross-linked actin:thymosin beta(4) complex to filamentous actin: alteration in helical parameters and visualisation of thymosin beta(4) binding on F-actin. J Mol Biol, 2002. 315(4): p. 613-25. Vila, J.A., et al., Assessing the fractions of tautomeric forms of the imidazole ring of histidine in proteins as a function of pH. Proc Natl Acad Sci U S A, 2011. 108(14): p. 5602-7. Tanokura, M., 1H-NMR study on the tautomerism of the imidazole ring of histidine residues. II. Microenvironments of histidine-12 and histidine-119 of bovine pancreatic ribonuclease A. Biochim Biophys Acta, 1983. 742(3): p. 586-96. Reichert, A., et al., Identification of contact sites in the actin-thymosin beta 4 complex by distance-dependent thiol cross-linking. J Biol Chem, 1996. 271(3): p. 1301-8. Holmes, K.C., et al., Atomic model of the actin filament. Nature, 1990. 347(6288): p. 44-9. Oda, T., et al., The nature of the globular- to fibrous-actin transition. Nature, 2009. 457(7228): p. 441-5. Kabsch, W., H.G. Mannherz, and D. Suck, Three-dimensional structure of the complex of actin and DNase I at 4.5 A resolution. EMBO J, 1985. 4(8): p. 2113-8. Kabsch, W., et al., Atomic structure of the actin:DNase I complex. Nature, 1990. 347(6288): p. 37-44. Lazarides, E. and U. Lindberg, Actin is the naturally occurring inhibitor of deoxyribonuclease I. Proc Natl Acad Sci U S A, 1974. 71(12): p. 4742-6. Rubin, B.K., A.P. Kater, and A.L. Goldstein, Thymosin beta4 sequesters actin in cystic fibrosis sputum and decreases sputum cohesivity in vitro. Chest, 2006. 130(5): p. 1433-40. Ballweber, E., et al., Plant profilin induces actin polymerization from actin : betathymosin complexes and competes directly with beta-thymosins and with negative cooperativity with DNase I for binding to actin. FEBS Lett, 1998. 425(2): p. 251-5. Schutt, C.E., et al., The structure of crystalline profilin-beta-actin. Nature, 1993. 365(6449): p. 810-6. Grant, D.S., et al., Thymosin β4 enhances endothelial cell differentiation and angiogenesis. Angiogenesis, 1999. 3(2): p. 125-35. Badamchian, M., et al., Thymosin beta(4) reduces lethality and down-regulates inflammatory mediators in endotoxin-induced septic shock. Int Immunopharmacol, 2003. 3(8): p. 1225-33. Mannherz, H.G. and E. Hannappel, The beta-thymosins: Intracellular and extracellular activities of a versatile actin binding protein family. Cell Motil Cytoskeleton, 2009. Gondo, H., et al., Differential expression of the human thymosin-beta 4 gene in lymphocytes, macrophages, and granulocytes. J Immunol, 1987. 139(11): p. 3840-8. Wodnar-Filipowicz, A., et al., Cloning and sequence analysis of cDNA for rat spleen thymosin beta 4. Proc Natl Acad Sci U S A, 1984. 81(8): p. 2295-7. Gomez-Marquez, J., et al., Thymosin-beta 4 gene. Preliminary characterization and expression in tissues, thymic cells, and lymphocytes. J Immunol, 1989. 143(8): p. 2740-4. - 98 - Literaturverzeichnis 76. 77. 78. 79. 80. 81. 82. 83. 84. 85. 86. 87. 88. 89. 90. 91. 92. 93. 94. 95. 96. 97. 98. Elias, P.M., et al., Freeze-fracture identification of sterol-digitonin complexes in cell and liposome membranes. J Cell Biol, 1978. 78(2): p. 577-96. Naylor, P.H., et al., Immunochemical studies on thymosin: radioimmunoassay of thymosin β 4. Immunopharmacology, 1984. 7(1): p. 9-16. Pelka, M., M. Zimmermann, and E. Hannappel, Thymosin β4 in the oral cavity and its possible role in periodontal disease. Ann N Y Acad Sci, 2009: p. submitted. Yokoyama, K., N. Nio, and Y. Kikuchi, Properties and applications of microbial transglutaminase. Appl Microbiol Biotechnol, 2004. 64(4): p. 447-54. Pankov, R. and K.M. Yamada, Fibronectin at a glance. J Cell Sci, 2002. 115(Pt 20): p. 3861-3. Reyes-Gordillo, K., et al., Protective effects of thymosin beta4 on carbon tetrachloride-induced acute hepatotoxicity in rats. Ann N Y Acad Sci, 2012. 1269(1): p. 61-8. Lee, W.M. and R.M. Galbraith, The extracellular actin-scavenger system and actin toxicity. N Engl J Med, 1992. 326(20): p. 1335-41. Talens, S., et al., Identification of fibrin clot-bound plasma proteins. PLoS One, 2012. 7(8): p. e41966. Eligula, L., et al., Transglutaminase-induced cross-linking between subdomain 2 of Gactin and the 636-642 lysine-rich loop of myosin subfragment 1. Biophys J, 1998. 74(2 Pt 1): p. 953-63. Benchaar, S.A., et al., Mapping the interaction of cofilin with subdomain 2 on actin. Biochemistry, 2007. 46(1): p. 225-33. Kamal, J.K., et al., Three-dimensional structure of cofilin bound to monomeric actin derived by structural mass spectrometry data. Proc Natl Acad Sci U S A, 2007. 104(19): p. 7910-5. Muhlrad, A., et al., Dynamic properties of actin. Structural changes induced by beryllium fluoride. J Biol Chem, 1994. 269(16): p. 11852-8. Selmi, A., et al., Thymosin beta4 promotes the migration of endothelial cells without intracellular Ca2+ elevation. Exp Cell Res, 2012. 318(14): p. 1659-66. Sinz, A., Chemical cross-linking and mass spectrometry for mapping threedimensional structures of proteins and protein complexes. J Mass Spectrom, 2003. 38(12): p. 1225-37. Back, J.W., et al., Chemical cross-linking and mass spectrometry for protein structural modeling. J Mol Biol, 2003. 331(2): p. 303-13. Safer, D. and V.T. Nachmias, Beta thymosins as actin binding peptides. Bioessays, 1994. 16(8): p. 590. Yu, F.X., et al., Thymosin beta 10 and thymosin beta 4 are both actin monomer sequestering proteins. J Biol Chem, 1993. 268(1): p. 502-9. Bock-Marquette, I., et al., Thymosin beta4 activates integrin-linked kinase and promotes cardiac cell migration, survival and cardiac repair. Nature, 2004. 432(7016): p. 466-72. Horn, A., persönliche Mittteilung. 2012. Berman, H.M., et al., The Protein Data Bank. Nucleic Acids Research, 2000. 28(1): p. 235-242. Paavilainen, V.O., et al., Structure of the actin-depolymerizing factor homology domain in complex with actin. Journal of Cell Biology, 2008. 182(1): p. 51-59. Sybyl7.3. 1991–2008, Tripos: St. Louis, USA. Case, D.A., et al., AMBER11. 2010, University of California: San Francisco, USA. - 99 - Literaturverzeichnis 99. 100. 101. 102. 103. 104. 105. Hornak, V., et al., Comparison of multiple amber force fields and development of improved protein backbone parameters. Proteins-Structure Function and Bioinformatics, 2006. 65(3): p. 712-725. Cornell, W.D., et al., A 2nd Generation Force-Field for the Simulation of Proteins, Nucleic-Acids, and Organic-Molecules. Journal of the American Chemical Society, 1995. 117(19): p. 5179-5197. Cheatham, T.E., P. Cieplak, and P.A. Kollman, A modified version of the Cornell et al. force field with improved sugar pucker phases and helical repeat. Journal of Biomolecular Structure & Dynamics, 1999. 16(4): p. 845-862. Wang, J.M., P. Cieplak, and P.A. Kollman, How well does a restrained electrostatic potential (RESP) model perform in calculating conformational energies of organic and biological molecules? Journal of Computational Chemistry, 2000. 21(12): p. 10491074. Lindorff-Larsen, K., et al., Improved side-chain torsion potentials for the Amber ff99SB protein force field. Proteins-Structure Function and Bioinformatics, 2010. 78(8): p. 1950-1958. Onufriev, A., D. Bashford, and D.A. Case, Exploring protein native states and largescale conformational changes with a modified generalized born model. ProteinsStructure Function and Bioinformatics, 2004. 55(2): p. 383-394. Ryckaert, J.P., G. Ciccotti, and H.J.C. Berendsen, Numerical-Integration of Cartesian Equations of Motion of a System with Constraints - Molecular-Dynamics of NAlkanes. Journal of Computational Physics, 1977. 23(3): p. 327-341. - 100 - Anhang Molekulare Modellierung des Aktin-Thymosin β4-Komplexes [94] Die Kristallstruktur von Aktin aus der Proteindatenbank [95] mit dem PDB-Code 3DAW [96] diente als Vorlage für die Modellierung. Zunächst wurden die drei fehlenden N-terminalen Reste (Asp, Asp, Glu) mit Sybyl 7.3 [97] (SDKPDMAEIEKFDKDKLKKTETQEKNPLPSKETIEQEKQAGES) wurde ergänzt. mit Tβ4 Sybyl in gestreckter Konformation modelliert und in räumliche Nähe der Wechselwirkungsstellen von Aktin platziert. Eine Verfeinerung des Modells wurde mithilfe von Moleküldynamiksimulationen des Programmpakets Amber11 [98] mit dem Parametersatz ff99SB-ILDN [99-103] erreicht. Alle Simulationen verwendeten den Generalized-Born-Ansatz für implizites Lösungsmittel mit den empfohlenen Atomradien [104]. Zunächst wurde das Gesamtsystem energetisch minimiert (500 Schritte), um eventuell vorhandene Bereiche starker Spannung zu beseitigen. Daraufhin wurde das System innerhalb von 10 ps auf 300 K erwärmt, wobei der Tβ4-Ligand an das Aktin mit einem harmonischen Potential (Kraftkonstante: 1 kcal mol-1 Å-1) gekoppelt wurde; als Referenzabstand wurde für die Distanz zwischen Asp1(CG) und Lys393(NZ) sowie zwischen Glu167(CD) und Lys378(NZ) 5.0 Å, und zwischen His40(NE2) und SER418(C) 4.5 Å gewählt. Um eine Verzerrung des Aktins zu vermeiden, wurden seine Schweratome mit einer Kraftkonstante von 50 kcal mol-1 Å-1 auf ihren Ausgangskoordinaten festgehalten. Während der ersten 2 ps wurden alle Bindungslängen mit SHAKE [105] eingefroren, um zu große Sprünge in der Energie zu verhindern. In den folgenden 8 ps des Aufheizens und in der dann folgenden 200 ps-langen Produktionsphase wurden nur die Bindungen mit Wasserstoffatomen festgehalten und gleichzeitig die Positionspotentiale der ersten drei modellierten Aktin-Reste aufgehoben. Der Zeitschritt betrug durchgehend 2 fs, alle 1000 Zeitschritte wurden die aktuellen Koordinaten gespeichert. Es wurden alle paarweisen van-der-Waals- und CoulombWechselwirkungen ohne Abstandsgrenzwert berücksichtigt. Die Rechnungen wurden auf dem tinyblue-Cluster des Regionalen Rechenzentrums Erlangen parallel auf 16 Prozessoren durchgeführt. - 101 -