1.1 - Biochemie Trainingscamp
Werbung

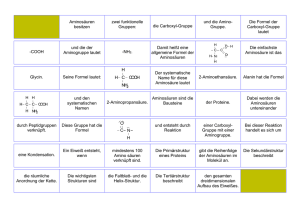
Aminosäuren und Proteine Von Mohammed Jaber Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht nicht--proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Aminosäuren und Proteine Kleinigkeit: 23 proteinogene AS 250 nicht nicht--proteinogene AS (Anzahl synthetisch erzeugten erheblich größer) Was ist ein AMIN???? Abkö Abkömmling li d des AMMONIAKS!! NH3 + NH3 + NH4 + NH2 Chemisch sind AS primäre Amine der Carbonsäuren …aber, aber was ist ein AMIN???? Abkömmlinge des AMMONIAKS!! NH3 + NH3 + NH4 + NH2 Ein Amin hast du, wenn eine NH2NH2-Gruppe an einer Kohlenstoffkette hängt CH3--CH2CH3 CH2-CH2 CH2--CH2 CH2--NH2 oder CH3 CH3--CH2 CH2--CH CH--(NH2)(NH2)-CH2 CH2--CH3. (Ein Amid erkennst du daran daran, dass eine NH2 NH2--Gruppe mit einer Säuregruppe verknüpft ist CH3--CH2CH3 CH2-CH2 CH2--COO COO--NH2.) NH2.) + Ammonium--Ion = NH4 = Kation Ammonium Aminosäuren und Proteine Chemisch sind AS primäre Amine der Carbonsäuren …aber, was ist ein AMIN???? Abkömmlinge des AMMONIAKS!! NH3 + NH3 + NH4 + NH2 Ei Amin Ein A i hast h d du, wenn eine i NH2 NH2--Gruppe G an einer i Kohlenstoffkette hängt CH3--CH2CH3 CH2-CH2 CH2--CH2 CH2--NH2 oder CH3 CH3--CH2 CH2--CH CH--((NH2) (NH2))-CH2 CH2--CH3. (Ein Amid erkennst du daran, dass eine NH2NH2-Gruppe mit einer Säuregruppe verknüpft ist CH3--CH2CH3 CH2-CH2 CH2--COO COO--NH2.) NH2.) Und wo geht der Ammoniak dann hin?! Aminosäuren & Ketosäuren Der Harnstoffcyclus kann nur in der Leber betrieben werden. Aspartat CO2 u. NH4 Carbamoyl Phosphat synthetase 1 Kostet 2 ATP Citrullin Ornithin Carbomayl Transferase Carbamoylphosphat Argininosuccinat synthetase Kostet ein ATP Hier geht das P ab! Argininosuccinat Ornithin Citrullin Austauscher ARGININO SUCCINASE Ornithin Mitochondrium Arginase ARGININ Isoharnstoff FUMARAT HARNSTOFF Von Mohammed Jaber W ist Was i t falsch?! f l h?! W W.R. R 2.17 2 17 D iisoelektrische Der l kt i h P Punkt kt einer i AS liliegtt b beii pH H=6 6,2. 2 Diese AS a) Wandert bei pH = 5 im elektrischen Feld zur Kathode b) Kann eine Monoaminocarbonsäure sein c) Weist die maximale Pufferkapazität bei pH = 6,2 d) Besitzt bei 6,2 6 2 ein starkes Dipolmoment e) Ist bei 8,2 überwiegend negativ geladen Aminosäuren und Proteine Im wesentlichen besitzt jede AS, AS 2 Gruppen die sie erst zu einer AS machen: Aminosäuren und Proteine Im wesentlichen besitzt jede AS, AS 2 Gruppen die sie erst zu einer AS machen: - eine Aminogruppe ( -NH2) – basisch (nicht sauer!) - eine Carboxylgruppe ((-COOH+ ) – sauer (nicht basisch!) Aminosäuren und Proteine Im wesentlichen besitzt jede AS, AS 2 Gruppen die sie erst zu einer AS machen: - eine Aminogruppe ( -NH2 NH2) – basisch (nicht sauer!) + - eine Carboxylgruppe ((-COOH ) – sauer (nicht basisch!) Diese werden auch als funktionelle Gruppen pp bezeichnet. Sie ändern, in Abhängigkeit des pHpH-Wertes, ihre Ladung. NH2 ist basisch, basisch weil es noch ein H+ aufnehmen kann und somit den Gesamt Gesamt--pH nach oben verschiebt (Protonenakzeptor). Aminosäuren und Proteine Im wesentlichen besitzt jede AS, AS 2 Gruppen die sie erst zu einer AS machen: - eine Aminogruppe ( -NH2 NH2) – basisch (nicht sauer!) + - eine Carboxylgruppe ((-COOH ) – sauer (nicht basisch!) Diese werden auch als funktionelle Gruppen pp bezeichnet. Sie ändern, in Abhängigkeit des pHpH-Wertes, ihre Ladung. NH2 ist basisch, basisch weil es noch ein H+ aufnehmen kann und somit den Gesamt Gesamt--pH nach oben verschiebt (Protonenakzeptor). + COOH ist sauer, weil es sein H+ abgeben kann und somit den Gesamt Gesamt--pH nach unten verschiebt (Protonendonator). Außerdem kann die AS auch neutral geladen sein, wenn… Aminosäuren und Proteine Im wesentlichen besitzt jede AS, AS 2 Gruppen die sie erst zu einer AS machen: - eine Aminogruppe ( -NH2 NH2) – basisch (nicht sauer!) + - eine Carboxylgruppe ((-COOH ) – sauer (nicht basisch!) Diese werden auch als funktionelle Gruppen pp bezeichnet. Sie ändern, in Abhängigkeit des pHpH-Wertes, ihre Ladung. NH2 ist basisch, basisch weil es noch ein H+ aufnehmen kann und somit den Gesamt Gesamt--pH nach oben verschiebt (Protonenakzeptor). + COOH ist sauer, weil es sein H+ abgeben kann und somit den Gesamt Gesamt--pH nach unten verschiebt (Protonendonator). Außerdem kann die AS auch neutral geladen sein, wenn sie in ihrem jeweils charakteristischen isoelektrischer Punkt ist. W ist Was i t falsch?! f l h?! W W.R. R 2.17 2 17 D iisoelektrische Der l kt i h P Punkt kt einer i AS liliegtt b beii pH H=6 6,2. 2 Diese AS a) Wandert bei pH = 5 im elektrischen Feld zur Kathode b) Kann eine Monoaminocarbonsäure sein c) Weist die maximale Pufferkapazität bei pH = 6,2 d) Besitzt bei 6,2 6 2 ein starkes Dipolmoment e) Ist bei 8,2 überwiegend negativ geladen Aminosäuren und Proteine Was ist falsch?! Der isoelektrische Punkt einer AS liegt g bei p pH = 6,2. Diese AS… a) Wandert bei pH = 5 im elektrischen Feld zur Kathode. b) Kann eine Monoaminocarbonsäure sein. c) Weist die maximale Pufferkapazität bei pH = 6,2. d) Besitzt bei 6,2 ein starkes Dipolmoment. Die Zahl der (+) ( ) Ladung ist gleich die der ((– –) Ladungen! e)) Ist I t bei b i 8,2 8 2 überwiegend üb i d negativ ti geladen. l d Antwort: c) Aminosäuren und Proteine Im wesentlichen besitzt jede AS, AS 2 Gruppen die sie erst zu einer AS machen: - eine Aminogruppe ( -NH2) - basisch y g pp ((--COOH+ ) – sauer - eine Carboxylgruppe Ausgehend vom I.P. bzw. abhängig vom pHpH-Wert, kann eine AS ein Kation (+) oder ein Anion ((-) sein. Abhängig vom pH pH--Wert kann man folgendes sagen… ( ) d.h., die Carboxylgruppe (+): C ist im Besitz seines Protons, u. kann somit den pH pH--Wert durch die Abgabe dieses H+ sauer machen. (Sie wandert zur Kathode ((--).) die Aminogruppe trägt ein H+ zu wenig und kann durch die Aufnahme eines Protons, den pHpH-Wert basisch machen. (Sie ( wandert zur Anode ((+).) )) Merke: Eine AS ist niemals nicht geladen!! Sie ist entweder ein Kation, ein Anion oder sie ist neutral geladen. Wo ist die AS ein Kation und wo ein Anion?! Das Zwitterion und der Isoelektrische Punkt! Ein Zwitterion ist hier eine AS mit den beiden funktionellen Gruppen: Gruppen: die Carboxylgruppe die ein H+ abgeben kann [Säureeigenschaft] und die Aminogruppe die ein H+ aufnehmen kann [BASENEIGENSCHAFT] Wann liegt g denn nun die AS als Z.I. vor?! Das Zwitterion und der Isoelektrische Punkt! Ein Zwitterion ist hier eine AS mit den beiden funktionellen Gruppen: Gruppen: die Carboxylgruppe die ein H+ abgeben kann [Säureeigenschaft] und die Aminogruppe die ein H+ aufnehmen kann [BASENEIGENSCHAFT] Wann liegt denn nun die AS als Z.I. vor?! W Wenn die di A Aminogruppe i 3H H+ tträgt ä t und die Carboxylgruppe gar keins!! Das Zwitterion und der Isoelektrische Punkt! Wann liegt denn nun die AS als Z.I. vor?! W Wenn die di A Aminogruppe i 3H H+ tträgt ä t und die Carboxylgruppe gar keins!! Bsp: Glycin - Purinbiosynthese GLYCIN Das Zwitterion und der Isoelektrische Punkt! Wann liegt denn nun die AS als Z.I. vor?! W Wenn die di A Aminogruppe i 3H H+ tträgt ä t und die Carboxylgruppe gar keins!! Bsp: Glycin - neutral - Purinbiosyntehse - glucoplastisch (wird zu Pyruvat Ausgangssubstanz d Gl der Gluconeogenese!) !) COOH + I H3N-C-H I H pKs1 + H COO + I H3N-C-H I H I.P. + H COO I H2N-C-H I H pKs2 Das Zwitterion und der Isoelektrische Punkt! Ein Zwitterion ist hier eine AS mit zwei (oder mehreren) funktionellen Gruppen, Gruppen, bei dem die eine Gruppe eine positive und die andere eine negative Ladung trägt (oft ist das Molekül dann insgesamt neutral). Aminosäuren liegen sowohl in wässriger Lösung als auch in der festen Phase als Zwitterionen vor. Ausgehend vom jeweiligen pKs (bzw. pHpH-Wert): + COOH + I H3N-C-H I H pKs1 + H COO + I H3N-C-H I H I.P. + H COO I H2N-C-H I H pKs2 p Wo ist die AS ein Kation und wo ein Anion?! W.R. 2.14 Lysin hat folgende pKpK-Werte: pK--alpha pK alpha--Carboxyl = 2,2 pK--alpha pK alpha--Amino = 8,9 89 pK--epsilonpK epsilon-Amino = 10,5 - W.R. 2.14 Lysin (essentiell) hat folgende pKpK-Werte: pK--alpha pK alpha--Carboxyl = 2,2 pK--alpha pK alpha--Amino = 8,9 89 pK--epsilonpK epsilon-Amino = 10,5 Bei welchen der angegebenen pHpH-Werte hat Lysin Geringste Pufferwirkung?! a) b) c) d) e) 2,2 45 4,5 8,9 97 9,7 10,5 COO +I 3HN-C 3HN C–H I CH2 I CH2 I die CH2 I CH2 I + NH3 - W.R. 2.14 Lysin (essentiell) hat folgende pKpK-Werte: pK--alpha pK alpha--Carboxyl = 2,2 pK--alpha pK alpha--Amino = 8,9 89 pK--epsilonpK epsilon-Amino = 10,5 Bei welchen der angegebenen pHpH-Werte hat Lysin geringste Pufferwirkung?! a) 2,2 b) 4,5 45 c) 8,9 d) 9,7 97 e) 10,5 Lösung: Lö b) COO +I 3HN-C 3HN C–H I CH2 I CH2 I die CH2 I CH2 I + NH3 W.R. 2.14 Lysin (essentiell) hat folgende pKpK-Werte: pK--alpha pK alpha--Carboxyl = 2,2 pK--alpha pK alpha--Amino = 8,9 pK--epsilon pK epsilon--Amino = 10 10,5 5 Bei welchen der angegebenen pHpH-Werte hat Lysin die geringste Pufferwirkung? Lösung: b) 4,5 Bei p pH = p pK ist die g größte Pufferwirkung g einer AS g gegeben. g Und je weiter der pH vom pK desto niedriger ist sie! Der pK pK--Wert zeigt ab wann die Amino Amino--/ Carboxylgruppe in einer wässrigen Lösung als H H--Akzeptor/Akzeptor/-Donator aktiv wird. Ist denn Lysin eine Neutrale, Saure, Basische,… - COO + I 3HN-C – H I CH2 I CH2 I CH2 I CH2 I NH3+ Wo ist die AS ein Kation und wo ein Anion?! Eine wichtige Bedeutung der AS kommt also der Pufferwirkung zu. Hier sei die AS Histidin erwähnt, die sich v.a. in den Seitenketten von vielen Plasmaproteinen befindet,… COO +I NH3-C-H I CH2 NH N Eine wichtige Bedeutung der AS kommt also der Pufferwirkung zu zu. Hier sei die AS Histidin erwähnt die sich vv.a. erwähnt, a in den Seitenketten von vielen Plasmaproteinen befindet, um somit eine entscheidende Rolle bei der pH pH--Konstanthaltung im Körper zu tragn tragn. COO +I NH3-C-H I CH2 NH HISTIDIN! N pH--Zelle: 6,8 - 7,8 pH pHpH-Serum: 7,35 Funktion: Blutpuffer p im Hämoglobin g Hormon (Histamin(Histamin- Synthese ist PALP PALP--Abhängig) Chemotaxis Glucoplastische AS!!! (alpha(alpha-Ketoglutarat) (glucopl. AS die bei Ihrem Abbau entweder Pyruvat o. Zwischenprodukte COO des Citratcyklus liefern) I + NH3-C-H I CH2 NH N HISTIDIN!