Versuch 5 - Isocitrat
Werbung

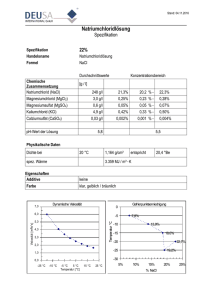
Versuch 5 „Isocitrat-Dehydrogenase“ Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann [email protected] X X X PD Dr. Gimpl Einleitung Ziel des Versuches ist es, die Abhängigkeit der Reaktionsgeschwindigkeit einer enzymatischen Reaktion von der zugegebenen Enzymmenge zu beschreiben. Es soll auch die Spezifität des Enzyms Isocitrat-Dehydrogenase (ICD) für die an ihrer Reaktion beteiligten Cofaktoren gezeigt werden. Weiterhin wird das Reaktionsverhalten des Enzyms bei Aktivierung durch bestimmte Metallionen untersucht. Der Fortschritt der Reaktionen wird mit einem Photometer verfolgt. Als Chromophor dient NADPH, reduziertes NADP+, welches bei der Reaktion entsteht. Die Konzentration von NADPH, und somit auch die Extinktion, ist direkt proportional zum Isocitrat-Umsatz. Theorie Isocitrat-Dehydrogenase Die Isocitrat-Dehydrogenase ist aus zwei identischen α- und β-Untereinheiten zusammengesetzt. Jedes der beiden aktiven Zentren des Enzyms besteht aus den Aminosäuren Asp311, Asp283 und Asp307. Jeweils zwei Aminosäuren (Asp311, Asp307) stammen aus der einen Kette, die dritte (Asp283) aus der jeweils anderen. In eukaryotischen Zellen gibt es zwei Isoenzyme der Isocitrat-Dehydrogenase, wobei beide dieselbe Reaktion katalysieren, nämlich die Decarboxylierung von Isocitrat zu α-Ketoglutarat. Das eine Isoenzym benötigt NAD+ als Cofaktor und katalysiert im Citratzyklus (in den Mitochondrien) einen geschwindigkeitsbestimmenden Schritt, der unter anderem durch Feedback-Hemmung vom Produkt, durch einen hohen NADH/NAD+ Spiegel und durch ADP gehemmt wird. Teilsequenzen des Citratzyklus sind auch extramitochondrial gelegen, so dass sie an anabolen Vorgängen teilhaben können. z.B. Citrat α-Ketoglutarat Fumarat Oxalacetat Die zweite Isoform der Isocitrat-Dehydrogenase hat als Cofaktor NADP+. Sie kommt sowohl im Mitochondrienplasma wie auch im Cytosol vor. Sie katalysiert die α-Ketoglutarat Bildung im Cytosol. Diese ist wichtig für den Aminosäurestoffwechsel. Ein weiteres Produkt der Reaktion ist NADPH2 welches als Reduktionsäquivalent für anabole Stoffwechselwege im Cytosol wie zB. die Fettsäurebiosynthese dient. Reaktionsfolge (NAD+ spezifische Isoform) Im ersten Schritt wird am C(2)-Atom des Isocitrats oxidiert, wobei NAD+ reduziert wird. Als Zwischenprodukt entsteht Oxalosuccinat. Isocitrat Oxalosuccinat Im weiteren Verlauf ist ein Manganion beteiligt. Das Ion polarisiert die Carbonylgruppe und erleichtert dadurch die Abspaltung des Kohlendioxids. Schließlich wird das C(3)-Atom protoniert, was einer Keto-Enol-Tautomerie ähnelt. α-Ketoglutarat OPTISCHER TEST FEEEHHHLLTTT Material und Methode Der Versuch wurde exakt nach Versuchsanleitung durchgeführt. Die Anleitung und die verwendeten Reagenzien sind im Skript auf den Seiten 20 und 21 zu finden. Ergebnisse a) und b): Zeit-Umsatz-Kurve bei Zugabe von verschiedenen Enzymmengen Extinktion Zeit (s) a) (0,05mL b) (0,1mL Enzymlsg.) Enzymlsg.) 0 0,045 0,050 30 0,135 0,230 60 0,220 0,400 80 / 0,490 90 0,310 / 100 / 0,550 120 0,390 0,580 140 / 0,585 150 0,455 / 160 / 0,588 180 0,515 0,588 210 0,555 / 240 0,575 / 270 0,580 / 300 0,585 / Farbig unterlegte Werte sind direkt vergleichbar da sie nach der gleichen Zeit aufgenommen wurden. Zeit-Umsatz-Kurven zu Versuchen a) und b) 0,7 0,6 Extinktion 0,5 0,4 Versuch a): 0,05ml Enzymlsg Versuch b): 0,1ml Enzymlsg 0,3 0,2 0,1 0 0 50 100 150 200 Zeit (s) 250 300 350 c) Nachweis der Coenzymspezifität des Enzyms Zeit (min) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 6 6,5 7 7,5 8 8,5 9 9,5 10 Extinktion 0,005 0,005 0,005 0,005 0,005 0,005 0,005 0,005 0,005 + Zugabe von NADP bei t = 4,5min 0,045 0,140 0,250 0,355 0,450 0,540 0,620 0,680 0,725 0,745 0,750 0,750 Zeit-Umsatz-Kurve zu Versuch c) 0,8 0,7 0,6 Extinktion 0,5 0,4 0,3 0,2 0,1 0 0 2 4 6 Zeit (min) 8 10 12 d) Aktivierung des Enzyms durch Metall-Ionen a) mit Magnesium-Ionen Zeit (min) Extinktion 0 0,025 0,5 0,075 1 0,130 1,5 0,185 2 0,235 2,5 0,275 3 0,333 3,5 0,370 4 0,415 4,5 0,450 5 0,480 5,5 0,510 6 0,530 6,5 0,540 b) mit Calcium-Ionen Zeit (min) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 6 6,5 Extinktion 0,010 0,015 0,020 0,030 0,045 0,060 0,077 0,095 0,115 0,135 0,160 0,185 0,205 0,230 Zeit-Umsatz-Kurve zu Versuch d): Aktivierung des Enzyms mit Metall-Ionen 0,7 Extinktion 0,6 0,5 0,4 0,3 0,2 0,1 0 0 1 2 3 4 5 6 Zeit (min) Aktivierung mit Magnesium-Ionen Aktivierung mit Calcium-Ionen (Aktivierung mit Mangan-Ionen) 7 e) Alternierende Aktivierung und Hemmung des Enzyms Zugabe von.. t E EDTA MnSO4 EDTA 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 6 0,043 0,146 0,183 0,183 0,183 0,183 0,248 0,3 0,31 0,31 0,31 0,31 0,31 Zugabe von.. t E MnSO4 6,5 7 7,5 8 8,5 9 9,5 10 10,5 0,361 0,441 0,486 0,529 0,546 0,552 0,558 0,558 0,558 Zeit-Umsatz-Kurve bei alternierender Aktivierung und Hemmung des Enzyms 0,6 0,5 Extinktion 0,4 0,3 0,2 0,1 0 0 2 4 6 Zeit (min) 8 10 12 Auswertung Zu a) und b) In den Ergebnissen von Versuch a) sieht man deutlich, dass bei einer größeren Enzymmenge das chemische Gleichgewicht der Reaktion schneller erreicht wird. Die Zeit bis zum erreichen des Eqilibriums ist sogar umgekehrt proportional zur zugegebenen Enzymmenge. Somit ist die Reaktionsgeschwindigkeit direkt proportional zur zugegebenen Enzymmenge und es gilt: Doppelte Enzymenge doppelte Reaktionsgeschwindigkeit. In der Tabelle zu Versuch a) sieht man das. Bei doppelter Enzymmenge (0,1mL), ist das chemische Gleichgewicht nach der Hälfte der Zeit, die man bei einfacher (0,05mL) Enzymenge benötigt, erreicht. Das ist logisch, denn bei Zugabe einer größeren Menge Enzym zur einer konstanten Menge an Substrat, können in der gleichen Zeit mehr Enzym-Substrat-Komplexe gebildet werden als bei einer kleineren Menge Enzym, und somit auch mehr Substrat zu Produkt umgesetzt werden, denn die einzelnen Enzyme arbeiten bei gleichen Bedingungen auch alle gleich schnell. Die „Regel“, die besagt, dass die Reaktionsgeschwindigkeit direkt proportional mit steigender Enzymkonzentration steigt, gilt allerdings nur für Reaktionen bei denen Substrat im Überschuss, zumindest jedoch in einer um einiges größeren Menge als das Enzym, vorliegt. Befindet sich in der Lösung weniger Substrat als Enzym, wird das chemische Gleichgewicht nicht schneller erreicht, wenn man mehr Enzym hinzugibt. Zu c) Der Reaktionsansatz unterscheidet sich von dem in den Versuchen a) und b) nur durch das unterschiedliche Coenzym welches sich im Ansatz befindet. In den Versuchen a) und b) wurde beides mal NADP+ in den Ansatz gegeben, in den Ansatz von Versuch c) dagegen NAD+. Nach der Zugabe von Enzym zum Ansatz c) kommt es zu keiner Änderung der Extinktion. Das heißt es wurde kein NADH gebildet (NADH und NADPH haben ihr gemeinsames Absorptionsmaximum bei etwa 350nm). Nach einer Zugabe von NADP+ allerdings kommt es zu einer Änderung der Extinktion, was man auf eine Bildung von NADPH zurückführen kann. Die ICD katalysiert also ihre Reaktion, wobei sie den Elektronentransporter NADP+ reduziert. Die IDC kann also mit NAD+ als Elektronenakzeptor die Reaktion nicht katalysieren. Dies ist der Nachweis für die Coenzymspezifität von ICD. Das Vorhandensein einer Coenzymspezifität ist nicht verwunderlich denn eine Substrat (-stereo) Spezifität ist sehr typisch für Enzyme. Coenzyme sind ja auch eine Art Substrat für Enzyme (deswegen auch manchmal Cosubstrat genannt) und müssen auch an einer bestimmten Stelle mit dem Enzym in Wechselwirkung treten. Passen sie sterisch nicht an diese Stelle des Enzyms so kommt es nicht zu den gewünschten WW und somit auch nicht zur Reaktion. Zu d) Die Zeit-Umsatz-Kurven von Versuch d)a) und d)b) können direkt mit der von Versuch a) verglichen werden, da bei allen drei Versuchen die Ansätze die gleiche Zusammensetzung, abgesehen von den aktivierenden Metallionen, hatten und auch in allen drei Fällen die gleiche Enzymmenge eingesetzt wurde. Bei Aktivierung durch Mangan-Ionen läuft die Reaktion von Isocitrat zu α-Ketoglutarat im Vergleich zu den Reaktionsanssätzen mit anderen Metall-Ionen am schnellsten ab. An zweiter Stelle im Vergleich der drei, kommt das Mg2+-Ion. Bei einer Aktivierung mit diesem Ion wird das Eqilibrium zwar erst nach der doppelten Zeit erreicht, die die ICD mit Mn2+-Ionen braucht, jedoch immer noch viel schneller als bei Substitution der Magnesium-Ionen durch Ca2+-Ionen. In diesem Fall ist das chemische Gleichgewicht nach Ende der Messzeit immer noch lange nicht erreicht. Die Reaktion läuft in diesem Fall am langsamsten ab bzw. die ICD hat bei alleinigem Vorhandensein von Ca2+-Ionen als aktivierendes Ion eine geringere Umsatzzahl. Die ICD ist somit ein Beispiel für Enzyme die mehr als einen Cofaktor benötigen (nämlich NAD+ oder NADP+ und ein zweiwertiges Metallkation) um eine Reaktion zu katalysieren. In der Eukaryotenzelle wird wahrscheinlich, aufgrund der hohen Reaktionsgeschwindigkeit, Mn2+ als aktivierendes Ion gewählt. Zu e) In Versuch e) wurde abwechselnd Mn2+ und EDTA zugegeben. Man kann an der Kurve sehen, dass nach Zugabe von EDTA die Reaktion stagnierte. Erst nach erneuter Zugabe von Mn2+ startete die Reaktion wieder und lief solange bis wir erneut EDTA zugaben. Die Erklärung hierfür liegt auf der Hand: EDTA ist ein Chelator zweiwertiger MetallIonen. Er komplexiert diese im Verhältnis eins zu eins. Somit können die Ionen nicht mehr an der Reaktion teilhaben, und diese stagniert. Gibt man wieder Mn2+-Ionen hinzu übersteigt die Anzahl der Mn2+-Ionen die der EDTA-Moleküle. Da EDTA Mn2+ im Verhältnis 1:1 koordinativ bindet liegen wieder freie Ionen in der Lösung vor, die sich nun wieder an der Reaktion beteiligen können. In diesem Versuch wurde gezeigt, dass Mn2+-Ionen (oder zB. Mg2+ oder Ca2+) essentiell sind für den Katalysemechanismus der ICD. Sie fungieren hier auch als Katalysator, da sie unverändert aus der Reaktion hervorgehen. Literatur -Skript zum Biochemischen Grundpraktikum, Institut für Biochemie, J.-G.-Universität-Mainz -Biochemisches Praktikum, Kleber, Schlee, Schöpp, Verlag: Gustav Fischer, 1997 -Biochemie, Stryer, Verlag: Spektrum, 1994 (2. durchgesehene Auflage) Zusätzliche Rechenaufgabe fürs Protokoll: Alltagsrechnungen aus dem Labor Molekulargewicht von NaCl: 58.4 g/ mol 1. Herstellung von 50 ml einer 3 M NaCl- Lösung (Stammlösung) aus dem Salz. Wieviel wird eingewogen? 2. Herstellung von 5 ml einer 150 mM NaCl Lösung aus a.) dem Salz b.) der 3 M NaCl Stammlösung ___________________________________________________________________ Lösung: 1. -In 1L 3M NaCl-Lsg sind 3mol NaCl. -Also sind in 50mL (= 0,05l) NaCl-Lsg 0,05 x 3mol = 0,15mol NaCl. -0,15mol NaCl wiegen 0,15mol x 58,4g/mol = 8,76g Um 50mL 3M NaCl-Stammlsg. aus reinem NaCl herzustellen muss man 8,76g NaCl einwiegen. 2. a) -In 1L 150mM NaCl-Lsg sind 150mmol NaCl -Dann sind in 5mL (=0,005L) 150mM NaCl-Lsg 0,005 x 0,15mol = 0,00075mol NaCl. -0,00075mol NaCl wiegen 0,00075mol x 58,4g/mol = 0,0438g Um 5mL 150mM NaCl-Lsg aus reinem NaCl herzustellen muss man 0,0438g NaCl einwiegen b) -In 5mL 150mM NaCl-Lsg sind 0,00075mol NaCl. - 1000mL 3M NaCl-Lsg entsprechen 3mol NaCl XXXmL entsprechen 0,00075mol NaCl -In 0,25mL 3M NaCl-Lsg sind 0,00075mol NaCl Um 5mL 150mM NaCl-Lsg aus der 3M NaCl-Stammlsg. herzustellen muss man 0,25mL der Stammlsg. mit 4,75mL H2O auffüllen.