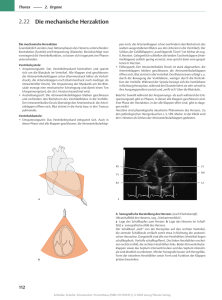
Herz C-6 A - e-Shop
Werbung

C-6 Herz H. M. Piper EINLEITUNG Ein 50-jähriger Mann unternimmt mit seinem Sohn eine Fahrradtour. Beim Erklimmen einer Steigung stöhnt er plötzlich auf, steigt vom Rad und fällt ins Gras. Er ist bleich, und sein Gesicht ist schmerzverzerrt. Er fasst sich an die Brust und klagt über beklemmende Schmerzen. Der Sohn fühlt den Puls. Dieser ist nur schwach zu tasten und hat eine hohe Frequenz. Mit seinem Handy ruft der Sohn einen Notarzt, der dem Vater ein Beruhigungsmittel spritzt und ihn mit der Verdachtsdiagnose ¹akuter Myokardinfarktª ins nächste Krankenhaus bringt. In der dortigen kardiologischen Abteilung wird diese Diagnose mittels EKG und einer Blutanalyse bestätigt. Eine röntgenologische Darstellung (Koronarangiographie) der Herzkranzgefäûe zeigt einen Verschluss im Ramus interventricularis anterior. Dieser Verschluss wird mit einer in die Herzkranzgefäûe vorgeschobenen Sonde mechanisch wiedereröffnet (perkutane transluminale Koronarangioplastie). Vom Auftreten der Schmerzsymptome bis zu diesem Eingriff sind drei Stunden vergangen. Eine eingehende funktionelle Nachuntersuchung des Herzens zeigt nach einer Woche, dass der zeitweilige Gefäûverschluss keine bleibenden Schäden am Herzen hinterlassen hat. p A 6.1 Entwicklung des Herzens l l l Das Herz entwickelt sich aus einem S-förmigen Gefäûschlauch. Zuerst werden ein Ventrikel und ein Vorhof angelegt Die Morphogenese des Herzens beginnt in der 3. Embryonalwoche mit einer schlauchartigen Herzanlage innerhalb der schon gebildeten Perikardhöhle (Abb. 6-1 a, b). Das kraniale Ende des Herzschlauchs (Truncus arteriosus) entspricht den späteren arteriellen Ausflussbahnen, der kaudale Teil (Sinus venosus) den Körpervenen. Der Herzschlauch wächst viel schneller als die umgebende Perikardhöhle, dadurch nimmt die Herzanlage eine S-Form an. Der Durchmesser einzelner Anteile dieser Form weitet sich durch Wachstum aus. Dadurch deutet sich bereits ein mehrkammeriges System an (Ende 3. Embryonalwoche). Am kranialen Gefäûpol liegt der Bulbus cordis, auf den die Anlage einer einzelnen Herzkammer (Ventrikel) folgt. Daran schlieût sich ein einzelner Vorhof Perikard Bulbus cordis Perikardhöhle Ventrikel Sinus venosus Atrium a linkes Atrium Sulcus bulboventricularis Ventrikel b Aortenbogen linkes Atrium Perikardhöhle Truncus arteriosus rechtes Atrium linkes Atrium Conus cordis Bulbus cordis linker Ventrikel trabekulärer Anteil des rechten Ventrikels c d aortale Ausflussbahn c Abb. 6-1. Entwicklung des Herzens. (a) Herzschleife zu Beginn der 4. Embryonalwoche (Ansicht von links). (b) Differenzierung der Herzschleife in Ventrikel, Atrien und Ausflusstrakt in der Mitte der 4. Embryonalwoche (von links). (c, d) Herz zu Beginn der 5. Embryonalwoche mit den Anlagen der beiden Atrien und Ventrikel (c von links, d von vorn). Nach Langmann J. Medizinische Embryologie. 2. Aufl. Thieme Verlag, Stuttgart (1972). (e) Schematische Darstellung der Teilung der Ausflussbahn durch ein spiralig eingewachsenes Septum zu Beginn der 6. Embryonalwoche. Nach Goerttler K. In Bargmann W, Doerr W (Hrsg) Das Herz des Menschen. Band 1. Thieme Verlag, Stuttgart (1963) Truncus arteriosus Bulbus cordis rechtes Atrium Truncus arteriosus Conus cordis rechter Ventrikel Sulcus interventricularis pulmonale Ausflussbahn linkes Atrium Atrioventrikularkanal linker Ventrikel e 6.1 Entwicklung des Herzens Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 139 (Atrium) an, der aus einem Teil der Anlage des Sinus venosus entsteht. Der Herzschlauch macht bei dieser Schleifen- und Segmententwicklung eine Linksdrehung, so dass der Bulbus cordis nahe der Mittellinie, der embryonale Ventrikel linksseitig im Thorax liegt. Aus dem Truncus arteriosus und dem oberen Anteil des Bulbus cordis (Conus cordis) differenzieren sich später die Ausflussbahnen von rechtem und linkem Ventrikel. Der untere Anteil des Bulbus cordis stellt die Anlage für den rechten Ventrikel dar, eine äuûere Einkerbung (Sulcus interventricularis) und eine korrespondierende innenseitige Wandvorwölbung am Übergang zum embryonalen Ventrikel präformieren die spätere Grenze zwischen linkem und rechtem Ventrikel (Abb. 6-1 c, d). Eine Engstelle zwischen embryonalem Ventrikel und Vorhof bildet den Atrioventrikularkanal (5. Embryonalwoche; Abb. 6-1 e). Die weitere Herzdifferenzierung führt zur Entwicklung von Septen im Bereich der Ventrikel- und Vorhofanlagen sowie zur Aufteilung der arteriellen Ausflussbahn in einen pulmonalen und aortalen Anteil (Abb. 6-1 e). Man kennt heute bereits einige Gene, die für Transkriptionsfaktoren codieren, deren zeitlich abgestufte Aktivierung essentiell für eine geordnete und damit normale Herzentwicklung ist. Dazu zählt z. B. GATA4, der für die Mittellinienverschmelzung des S-förmigen Herzschlauchs erforderlich ist und an die DNA-Sequenz GATA bindet (Abschn. A-14.4). Für die Entwicklung der Ventrikel wird z. B. der Faktor Nkx2.5 benötigt. l l l Ventrikel und Ausflussbahn sowie die Atrien der Herzanlage teilen sich durch das Einwachsen von Trennwänden in rechten und linken Ventrikel, die pulmonale und die aortale Ausflussbahn sowie rechtes und linkes Atrium Trennung der Ventrikel und der Ausflussbahn. Die Anlagen des linken und rechten Ventrikels erweitern sich durch Wachstum nach auûen. Am Sulcus interventricularis stoûen diese Wachstumskräfte aufeinander, und zwischen ihnen bildet sich ein muskuläres interventrikuläres Septum, das aber eine offene Verbindung übrig lässt (Foramen interventriculare; 6. Embryonalwoche). In der gemeinsamen Ausflussbahn des rechten und linken Ventrikels, die vom Truncus arteriosus und Conus cordis gebildet wird, entsteht durch das Vorwachsen längs verlaufender Gewebeleisten eine zusammenhängende Trennwand, deren zwei Anteile als Truncus- und Conusseptum bezeichnet werden (Abb. 6-1 e). Diese Trennwand hat einen spiralförmigen Verlauf, wodurch die Ausflussbahn für den rechten Ventrikel (Truncus pulmonalis) frontal und die Ausflussbahn für den linken Ventrikel (Aorta) dorsal zu liegen kommt (7. Embryonalwoche). Der untere Abschnitt des Conusseptums wächst in Richtung der Ventrikel vor und verschlieût allmählich das Foramen interventriculare des Septum interventriculare. Später wird ein Teil dieses interventrikulären Septums bindegewebig ersetzt und bildet dann die fibröse Pars membranacea des Septum interventriculare. In den frühen Embryonalstadien teilt sich die Ausflussbahn kranial von der Herzanlage in sechs Arterienpaare auf (Aortenbö140 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Septum secundum Foramen ovale V. cava superior Vv. pulmonales Septum primum Atrium dextrum Atrium sinistrum Ventriculus sinister V. cava inferior Sinus coronarius Ventriculus dexter Mm. papillares Septum interventriculare Abb. 6-2. Querschnitt durch das Herz eines Neugeborenen. Das Septum interventriculare ist geschlossen. Im Septum primum der Vorhöfe befindet sich eine sekundär entstandene Öffnung, die durch das später entstandene Septum secundum bereits teilweise überdeckt wird. Der verbleibende Durchtrittsspalt heiût wegen seiner Sichelform in seitlicher Ansicht Foramen ovale. Im pränatalen Kreislauf flieût das Blut aus dem rechten Vorhof (Pfeil) über diesen Weg in den linken Vorhof. Nach Ferner H. Eingeweide und Kreislauf. In Ferner H, Staubesand J (Hrsg.) Benninghoff/Goerttler. Lehrbuch der Anatomie des Menschen. Band 2. 10. Aufl. Urban & Schwarzenberg, München (1975) gen). Diese obliterieren teils schnell wieder (1., 2., 5.). Aus den herznächsten 6. Aortenbögen entsteht die Anlage der Pulmonalstrombahn; nach Teilung der Ausflussbahn entspringen sie aus dem Truncus pulmonalis. Aus den 4. Aortenbögen entwickeln sich Teile des Arcus aortae und der rechten A. subclavia. Aus den 3. Aortenbögen entstehen Teile der Karotiden. Trennung der Atrien. Die zunächst einkammerige Anlage des embryonalen Atriums dehnt sich hinter den Truncus arteriosus aus (4. Embryonalwoche). Aus einer mittelständigen Faltung in der Wand dieses Hohlraums entsteht eine zunächst unvollständige Scheidewand, das Septum primum. Die verbleibende Öffnung zwischen den beiden Atrien, das Ostium primum (Abb. 6-2), wird langsam verschlossen. Im embryonalen Kreislauf ist zu diesem Zeitpunkt die Lunge noch nicht entwickelt. Das Blut muss vom rechten in den linken Vorhof flieûen. Dies wird dadurch ermöglicht, dass während des Zuwachsens des Ostium primum ein Durchbruch des interatrialen Septums an anderer Stelle entsteht, das so genannte Ostium secundum (5. Embryonalwoche; Abb. 6-2). Am Ostium secundum wächst in der Folge eine Gewebefalte (Septum secundum) vor, die es zunehmend wieder abdeckt. Zum Zeitpunkt der Geburt ist vom Ostium secundum noch ein sichelförmiger ovaler Spalt vorhanden, der als Foramen ovale (Abb. 6-2) bezeichnet wird. Meistens schlieût sich dieses Foramen ovale durch die veränderten Druckverhältnisse nach Einsetzen des Lungenkreislaufs nachgeburtlich recht schnell, da die genannte Gewebefalte auf den Rand des Ostium secundum gedrückt wird. In 20 % der Fälle bleibt dieser Verschluss aber aus. Ein persistierendes offenes Foramen ovale ist hämodynamisch fast immer bedeutungslos, da der Blutfluss durch diese kleine Öffnung nur sehr gering ist. Bildung der Herzklappen. Mit der Ausbildung des interatrialen Septums geht auch eine Trennung des zunächst einheitlichen Atrioventrikularkanals in eine Doppelöffnung einher. Die Atrioventrikularklappen entstehen in diesen Öffnungen durch ein wulstartiges Vorwachsen des Mesenchyms an den Öffnungsrändern (ab 6. Embryonalwoche). Diese Vorwölbungen werden dann teilweise unterhöhlt und ausgedünnt, so dass am Schluss die brückenartigen Strukturen der Segelklappen mit ihren Verankerungen in den Papillarmuskeln stehen bleiben (Abb. 6-2). Wenn die Mitteltrennung der zunächst gemeinsamen arteriellen Ausflussbahn weitgehend abgeschlossen ist, bilden sich an ihrem oberen Ende höckerige Vorwölbungen der Gefäûwand, aus denen sich halbmondförmige Scheiben entwickeln. Diese wachsen aufeinander zu und bilden in der aortalen und pulmonalen Ausflussbahn je ein Klappensystem (6.±7. Embryonalwoche). Wegen ihrer zum Ventrikel hin vorgewölbten Form werden diese Klappen Taschenklappen oder Semilunarklappen genannt. Verbindung im nachgeburtlichen Kreislauf führt einen Teil des venösen Blutes an den Lungen vorbei und verhindert damit eine ausreichende Sauerstoffaufnahme. Als Folge haben Kinder mit einem solchen Defekt wegen des hohen Anteils von desoxygeniertem Hämoglobin im arteriellen System eine bläuliche Hautfarbe (Cyanose, ¹Blue Babiesª). Eine häufige Fehlbildung im Bereich der Ausflussbahn des Herzens ist die so genannte Fallot-Tetralogie. Sie beruht auf einer ungleichen Teilung des Conus cordis durch eine zu weit nach vorne gelagerte Bildung des Septums zwischen der Aorten- und Pulmonalarterienanlage. Als Folge entstehen (1) eine Pulmonalarterienstenose; (2) ein Defekt des Ventrikelseptums, dessen obere Anteile einen Anteil des Conusseptums mit einschlieûen müssten; (3) eine ¹reitende Aortaª, deren Einflussbahn zu weit nach rechts, über den Ventrikelseptumdefekt, ausgedehnt ist; und (4) eine Hypertrophie des rechten Ventrikels als Folge seiner Druckbelastung. Bei dieser Konfiguration flieût Blut aus dem rechten Ventrikel an der Lungenstrombahn vorbei direkt in die Aorta. Es kommt deshalb auch hier zur Cyanose. Box 6-1. Helen Taussig und die Blue Babies l l l Herzfehler bei Neugeborenen lassen sich auf typische Störungen der Herzentwicklung zurückführen Störungen in der Herzentwicklung führen zu typischen ¹Herzfehlernª bei Neugeborenen (Tab. 6-1). Hier seien nur einige genannt. Wie oben bereits erläutert, ist ein Offenbleiben des Foramen ovale zwischen den Vorhöfen eine meist harmlose Anomalie. Entwicklungsstörungen bei der Verkleinerung des Ostium secundum hinterlassen hingegen groûe, hämodynamisch wirksame Defekte. Die verbleibende Rechts-Links- Tabelle 6-1. Häufige angeborene Herzmissbildungen Bezeichnung Entstehung Korrektur Vorhofseptumdefekt (ASD) Entwicklungsstörung des Septum primum oder des Septum secundum Entwicklungsstörung des Septum interventriculare Entwicklungsstörung des Conusseptums Verschluss Ausbleiben der Spiraldrehung des Conusseptums Gefäûverlagerung (Switch-Operation) Verwachsungen der Klappenanlagen Klappensprengung, Klappenersatz Ventrikelseptumdefekt (VSD) Fallot-Tetralogie (Pulmonalarterienstenose, VSD, reitende Aorta) Transposition der groûen Arterien (Aorta aus rechtem, A. pulmonalis aus linkem Ventrikel) Stenosen der Semilunarklappen Die Amerikanerin Helen Taussig (1898±1986) gilt als Begründerin der Kinderkardiologie. Ihren Wunsch, an der Harvard Medical School Medizin zu studieren, konnte sie sich nur mit Verzögerung erfüllen, da ihr als Frau zunächst der Zugang verwehrt blieb. So studierte sie zuerst nur Anatomie, wobei sie sich besonders mit Herz und Lunge befasste. Diese besonderen Kenntnisse halfen ihr später, als sie sich als ¾rztin mit herzkranken Kindern beschäftigte. Es gelang ihr, als erste die pathophysiologischen Zusammenhänge bei Kindern mit einer Fallot-Tetralogie (Blue Babies) zu verstehen. Sie erkannte, dass für das Überleben dieser Kinder das Ausmaû der pulmonalen Durchblutung von entscheidender Bedeutung ist und entwickelte das Konzept für eine bahnbrechende Operation, die eine künstliche Kurzschlussverbindung zwischen rechter A. subclavia und A. pulmonalis herstellt und so der Lunge vermehrt Blut für den Gasaustausch zuführt. Diese Operation wurde 1944 erstmals von dem Chirurgen Alfred Blalock durchgeführt. Von Taussig und Blalock wurde immer wieder beschrieben, wie bewegend der Moment war, als nach der Operation bei diesem ersten Kind die bläuliche Hautfarbe einer rosigen Erscheinung wich. Die BlalockTaussig-Shunt-Operation hat Tausenden von Kindern ein längeres Leben ermöglicht und wird auch heute noch in modifizierter Form durchgeführt. Verschluss VSD-Verschluss, Erweiterung der Pulmonalarterie 6.1 Entwicklung des Herzens Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 141 é p A 6.2 Aus dem kranialen Teil des primitiven Herzschlauchs entstehen die Ausflussbahnen von rechtem und linkem Ventrikel, aus dem mittleren Teil der rechte Ventrikel, aus dem kaudalen Teil der linke Ventrikel, und aus der Anlage des Sinus venosus entstehen die Vorhöfe. Während der Herzentwicklung vollzieht der Herzschlauch im Thorax eine Drehung nach links. Daher liegt die Anlage des rechten Ventrikels nach vorn, die des linken Ventrikels etwas nach hinten versetzt. Die Septen zwischen den Herzkammern und Vorhöfen werden aus mehreren Entwicklungselementen gebildet. Wird deren Differenzierung gestört, kommt es zu Septumdefekten. Die ursprünglich gemeinsame Ausflussbahn des Herzens wird durch Einwachsen eines spiraligen Septums in einen vorderen pulmonalen und hinteren aortalen Teil aufgeteilt. Anatomie des Herzens l l l Das Herz liegt, nach links ausladend, mittig im Thorax. Über den Herzbeutel ist es kaudal am Diaphragma fixiert. Kranial liegt der Gefäûpol des Herzens mit seinen Ausflussbahnen Einbettung des Herzens. Das Herz ist ein intrathorakales Organ, das zwischen linker und rechter Lunge ins Mediastinum eingebettet ist (Abschn. C-5.4). Etwa zwei Drittel des Herzens liegen links von der Mittellinie. Von frontal betrachtet hat das Herz in seiner Lage im Thorax die Form einer dreiseitigen Pyramide, deren Spitze nach vorn unten links zeigt und deren Basis nach hinten oben rechts gerichtet ist (Abb. 6-3 a, b). Man bezeichnet deshalb den unteren, konisch zulaufenden Anteil auch als den Apex des Herzens, den stumpfen oberen Gefäûpol als seine Basis. Beim Erwachsenen ist das Herz etwa faustgroû und 300 g schwer. Es stellt eine doppelte Pumpe mit jeweils zwei muskulären Hohlkammern dar. Dabei gibt es auf der rechten und der linken Seite jeweils einen Vorhof (Atrium) und eine Herzkammer (Ventrikel). Das Muskelgewebe des Herzens wird als Myokard bezeichnet. Das Herz ist verschieblich in einen serösen Sack, den Herzbeutel, eingebettet. Dieser ist mit ca. 20 mL einer serösen Flüssigkeit gefüllt. Die Herzbeutelhöhle (Cavitas pericardialis) ist herzseitig durch das viszerale Serosablatt, das Epikard, begrenzt. Das parietale Serosablatt bildet zusammen mit der darauf aufliegenden Bindegewebsschicht, dem Pericardium fibrosum, die äuûere Wand der Herzbeutelhöhle, das Perikard. Das Perikard ist am vorderen unteren Rand mit dem Centrum tendineum des Zwerchfells fest verwachsen. Die Umschlaglinien zwischen dem viszeralen und dem parietalen Blatt des Herzbeutels liegen den Gefäûen an, die in das Herz hineinund aus dem Herzen herausführen (Abb. 6-3 c). Sie liegen deshalb an der hinteren und oberen Seite des Herzsitus. Kol142 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* lagenfaserbündel des perikardialen Bindegewebes bilden Faserringe um die groûen Gefäûe und fixieren so den Herzbeutel an diesen Stellen. Da das Herz kaudal über das Perikard am Diaphragma verankert ist, während es mit den anderen Anteilen des Perikards und den zuführenden Gefäûen im Thorax elastisch aufgehängt ist, bewegt sich der Schwerpunkt des Herzens bei der Entleerung der Ventrikel auf das Diaphragma zu (Ventilebenenmechanismus; s. u.). Die Festigkeit des Pericardium fibrosum begrenzt die Dehnung der Ventrikel. Es enthält zwei bis drei sich überkreuzende Kollagenfaserschichten, die sich bei zunehmender Dehnung wie ein Scherengitter gegeneinander verstellen. Durch dieses Bauprinzip ist der Herzbeutel gut verformbar, solange er nicht überdehnt wird. Überdehnungen treten z. B. auf, wenn ein Ventrikel an Gröûe zunimmt oder wenn sich Flüssigkeit in der Herzbeutelhöhle ansammelt. Letzteres kann bei Perikardentzündungen oder Blutungen auftreten. Groûe Volumenansammlungen komprimieren die Ventrikel und behindern damit ihre Pumpfunktion (Herzbeuteltamponade). Einstrom- und Ausflussbahnen. Der kranial liegende Gefäûpol des Herzens enthält zu- und abführende Gefäûe. Der Rücklauf des Blutes aus dem groûen Kreislauf erfolgt über die Vv. cavae inferior und superior, die gemeinsam in den rechten Vorhof münden. Von dort flieût das Blut in den rechten Ventrikel und wird von diesem über seine Ausflussbahn, den Truncus pulmonalis, in den kleinen Kreislauf (Lungenkreislauf) ausgeworfen. Der Rückfluss des Blutes aus dem kleinen Kreislauf erfolgt über vier Pulmonalvenen, die oxygeniertes Blut führen und paarig aus linker und rechter Lunge entspringen, in den linken Vorhof. Aus dem linken Vorhof gelangt das Blut in den linken Ventrikel, um von hier über die Aorta in den groûen Kreislauf ausgeworfen zu werden. l l l In der Ventilebene besitzt das Herz eine feste bindegewebige Stützstruktur, die als Herzskelett bezeichnet wird. Die Arbeitsmuskulatur ist aus zirkulär und spiralig verlaufenden Muskelzügen aufgebaut Herzskelett. Neben den muskulären Anteilen enthält das Herz auch Bindegewebe, das fein verteilt die Kammermuskulatur durchzieht und zwischen Vorhöfen und Ventrikeln eine überwiegend bindegewebige Stützstruktur für das Gesamtorgan bildet, das so genannte Herzskelett. Das Herzskelett liegt in der Ventilebene des Herzens (Abb. 6-3 e). Es umspinnt die beiden Atrioventrikularklappen und die Wurzeln von Aorta und Truncus pulmonalis. In die Tiefe setzt sich das Herzskelett noch ein Stück weit in die Pars membranacea des Kammerseptums fort, die am Faserring um die Aorta ansetzt. Die Arbeitsmuskulatur von Vorhöfen und Kammern wird durch Bindegewebszüge des Herzskeletts funktionell vollständig voneinander getrennt, ist aber dennoch mechanisch fest miteinander verknüpft. Nur die speziellen Muskelfasern des Erregungsleitungssystems durchtunneln das Herzskelett. Wandaufbau. Funktionell kann man bei rechter und linker Herzhälfte einen Niederdruck- und einen Hochdruckanteil Aorta V. cava superior Aorta Truncus pulmonalis V. cava superior Aa. pulmonales dextrae Vv. pulmonales sinistrae Vv. pulmonales dextrae Aa. pulmonales sinistrae Atrium sinistrum A. coronaria sinistra Atrium dextrum Ramus circumflexus A. coronaria dextra Ramus interventricularis anterior V. cava inferior Ventriculus sinister Ventriculus dexter Aa. pulmonales dextrae Vv. pulmonales sinistrae Vv. pulmonales dextrae Atrium sinistrum V. posterior Atrium dextrum Sinus coronarius V. cava inferior Ventriculus sinister a Ventriculus dexter V. cardiaca media b Aorta Truncus pulmonalis V. cava superior Umschlagfalte Perikard und Plexus cardiacus N. phrenicus: A. V. pericardiacophrenica Aorta V. cava superior A. pulmonalis Vv. pulmonales dextrae Sinus transversus pericardii Sinus obliquus pericardii Pleura parietalis V. cava inferior Vv. pulmonales sinistrae Vorwölbung durch Ösophagus Pars diaphragmatica pericardii A. pulmonalis sinistra Vv. pulmonales sinistrae Vv. pulmonales dextrae Atrium sinistrum Valva aortae Valva trunci pulmonalis Valva atrioventricularis sinistra Atrium dextrum Mm. papillares Valva atrioventricularis dextra Septum interventriculare V. cava inferior Ventriculus dexter c Valvula semilunaris dextra Cuspis anterior Cuspis posterior Valvula semilunaris anterior Cuspis septalis Valvula semilunaris sinistra ventral dorsal A. coronaria sinistra Valva aortae Valva atrioventricularis dextra Valvula semilunaris posterior A. coronaria dextra Conus arteriosus Valva trunci pulmonalis d Valvula semilunaris dextra Valvula semilunaris sinistra Ventriculus sinister Mündung der V. cardiaca media Cuspis anterior Cuspis posterior Sinus coronarius Valva atrioventricularis dextra e Abb. 6-3. Anatomie des Herzens. (a) Ansicht von vorne, (b) Ansicht von hinten. (c) Umschlagfalten des Perikards bei herausgenommenem Herzen. (d) Querschnitt durch das Herz. Blick auf die hintere Hälfte, (e) Ansicht der Ventilebene des Herzens von oben 6.2 Anatomie des Herzens Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 143 unterscheiden. Dem Niederdrucksystem gehören die jeweils zuführenden Gefäûe und die Vorhöfe an, den Hochdruckanteil bildet der jeweilige Ventrikel. Entsprechend der Druckverteilung ist die Muskulatur in den Vorhöfen nur gering ausgeprägt, viel stärker ist sie in den Ventrikeln. Der rechte Ventrikel muss geringere Drücke aufbauen, da er das Blut nur durch die Lungenstrombahn befördern muss, die einen geringen Gesamtwiderstand hat. Die Muskulatur des linken Ventrikels ist am stärksten ausgebildet (durchschnittlich ca. fünfmal dicker als beim rechten Ventrikel). Dieser Ventrikel muss die treibende Kraft für den Bluttransport durch den ganzen Rest des Körpers aufbringen. Die Ventrikel erfüllen ihre Pumpfunktion durch Kontraktion ringförmig verlaufender Muskulatur. Bei einem Schnitt durch die Ventrikelwand kann man grob drei Verlaufsrichtungen der Muskelzüge unterscheiden. Unter dem Epikard liegen spiralig verlaufende Muskelzüge, die von der Herzbasis zum Apex absteigen. Am Apex ziehen sie nach innen in die Tiefe und bilden eine an der Innenwand der Ventrikel spiralig aufwärts strebende Formation. Diese innerste und äuûerste Muskelschicht wird von einer in etwa zirkulären Mittelschicht der Muskulatur getrennt, die aus Abzweigungen der beiden angrenzenden Muskelschichten hervorgeht. Aufgrund dieser speziellen Anordnung der Muskulatur ergibt sich bei der Kontraktion der Ventrikel nicht einfach eine pulsierende Einwärts-AuswärtsBewegung, sondern eine um die Herzachse leicht rotierende, ¹spiraligeª Bewegung der Ventrikelmuskulatur. Deformationen der Ventrikel, z. B. als pathologisches ¹Remodelingª (Abschn. C-6.11), stören diesen Bewegungsablauf und damit auch die Pumpfunktion. Auûen liegt der Muskelschicht des Myokards das seröse Epithel des Epikards auf. Innen wird es vom Endokard abgeschlossen, einem Plattenepithel mit einer dünnen Unterschicht von Bindegewebe mit vereinzelten glatten Muskelzellen. Das Endokard ist strukturell und biochemisch dem Gefäûendothel sehr ähnlich (z. B. hemmt es die Blutgerinnung). Es überzieht auch die freien Flächen der Herzklappen. Im rechten und linken Ventrikel springen einzelne endokardüberzogene Muskelstränge ins Lumen vor. In den Einflussbahnen bilden diese ein balkenartiges Netzwerk (Trabeculae carneae). Trotz der grundsätzlichen ¾hnlichkeiten im Wandaufbau ist die makroskopische Geometrie von linkem und rechtem Ventrikel sehr verschieden. Die linke Kammer hat in der Diastole eine länglich-konische Form. Im Längsschnitt bilden äuûere Kammerwand und das Septum etwa eine U-Form. Die rechte Kammer liegt diesem U als eine halbmondförmige flache Tasche an. Die beiden Atrien sind durch das interatriale Septum, die Ventrikel durch das interventrikuläre Septum getrennt. Die Septen werden vom Myokard gebildet. Die Trennung zwischen Atrien und Ventrikeln liegt in der bindegewebsreichen Ventilebene. Sie wird hier durch ringförmige Klappenstrukturen gebildet, die einen gerichteten Blutstrom erlauben (Abb. 6-3 d, e). 144 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* l l l In der Ventilebene befinden sich zwei Arten von Klappen: Segelklappen für die Trennung von Vorhöfen und Ventrikeln und Taschenklappen in den Ausflussbahnen der Ventrikel Atrioventrikularklappen (Abb. 6-3 d, e). Auf der rechten Seite befindet sich zwischen Atrium und Ventrikel eine Klappe mit drei segelartigen Strukturen (Cuspes), die Trikuspidalklappe. Auf der linken Seite gibt es eine Atrioventrikularklappe mit zwei Segeln, die Bikuspidalklappe (Mitralklappe). In der Erschlaffungsphase der Ventrikel, d. h. bei entspannter Arbeitsmuskulatur, geben die Atrioventrikularklappen der Druckdifferenz zwischen Vorhof und Ventrikel nach und öffnen sich mit dem einströmenden Blut ins Cavum des jeweiligen Ventrikels (s. u.). Zu Beginn der Kontraktionsphase der Ventrikel wird es wichtig, dass jedes der Klappensegel durch Sehnenausläufer (Chordae tendineae) vorgespannt werden kann. Die Chordae haften an konischen Ausläufern der Ventrikelmuskulatur, den so genannten Papillarmuskeln, an. Die Anspannung der Papillarmuskeln erfolgt zu Beginn der Ventrikelkontraktion und verhindert, dass die Klappen durch den Aufbau des intraventrikulären Drucks nach atrial durchschlagen, was zu einem Reflux von Blut aus dem Ventrikel in den Vorhof führen würde (zur Klappenfunktion s. Abschn. C-6.6). Semilunarklappen (Abb. 6-3 d, e). An der Basis der groûen aus dem Herzen entspringenden Gefäûe, der Pulmonalarterie (Truncus pulmonalis) und der Aorta, liegen Klappen anderer Bauart, nämlich so genannte Taschenklappen (Semilunarklappen), die Pulmonalklappe und die Aortenklappe (Abschn. C-6.6). Sie haben ihre Namen von der taschenartigen, halbmondförmigen Gestalt ihrer jeweils drei Klappenblätter. Diese sind gegen das Ventrikelinnere kuppelförmig vorgewölbt. Während der Diastole der Ventrikel drückt der höhere Druck in der Ausflussbahn die drei Blätter zum Klappenschluss zusammen. Segel- und Taschenklappen bestehen im Kern aus bindegewebigen Faserplatten, die an allen freien Flächen vom Epithel des Endokards überzogen sind. l l l Das Herz hat eine eigene nutritive Gefäûversorgung, das Koronarsystem. Es entspringt aus der Aorta und mündet in den rechten Vorhof Koronarsystem. Das Herz wird durch ein eigenes Gefäûsystem nutritiv versorgt (Abb. 6-4, Tab. 6-2). Unmittelbar oberhalb der Aortenklappe entspringen aus dem Stamm der Aorta die rechte und linke Koronararterie. Diese verlaufen zunächst (von oben betrachtet) in der Einkerbung zwischen Atrien und Ventrikeln, dem Sulcus atrioventricularis. Von der linken Koronararterie zweigt der Ramus anterior interventricularis ab, der an der Vorderseite des Herzens an der Grenzlinie zwischen rechtem und linkem Ventrikel absteigt, sowie der Ramus circumflexus, der im Sulcus atrioventricularis am äuûeren Rand der Ventilebene nach dorsal verläuft, um an hintere Abschnitte des Ventrikels und das linke Atrium zu gelangen. Die Koronararterien liegen an der Auûenseite des Valva aortae Tabelle 6-2. Die Koronargefäûe des Menschen A. coronaria sinistra Arterien V. cardiaca magna A. coronaria dextra Ramus circumflexus Sinus coronarius V. posterior ventriculi sinistri Ramus interventricularis anterior V. cardiaca parva Ramus interventricularis posterior V. cardiaca media a RV LV Normaltyp RV LV Linkstyp RV LV Rechtstyp b Abb. 6-4. Herzkranzgefäûe. (a) Schema der Anatomie (Arterien rot, Venen blau). (b) Variabilität der arteriellen Gefäûversorgung. Querschnitt durch die Ventrikel (RV rechter Ventrikel; LV linker Ventrikel). Versorgungsgebiet der rechten Koronararterie: schwarz; Versorgungsgebiet der linken Koronararterie: weiû. Nach Leonhardt H. Innere Organe. In Kahle W, Leonhardt H, Platzer W. Taschenatlas der Anatomie. Band 2. Thieme Verlag, Stuttgart (1973) Herzmuskels im epikardialen Fett- und Bindegewebe. Von hier treten kleine Versorgungsarterien senkrecht in die Wand ein und verästeln sich dort bis in Kapillaren. Der Rückstrom des Blutes erfolgt über Koronarvenen, die dem Verlauf der oberflächlichen Koronararterien folgen, sich aber an der Rückseite des Herzens zu einem gemeinsamen Gefäû zusammenschlieûen, dem Koronarsinus (Sinus coronarius). Der Koronarsinus öffnet sich in den rechten Vorhof. Ein kleiner Anteil des venösen Blutes des Herzens (< 10 %) wird auch über die Thebesi-Venen (Vv. cardiacae minimae) direkt in das Cavum der Ventrikel entlassen. Variabilität des Koronarsystems. Die arterielle Versorgung des Herzmuskels durch die zuführenden Koronargefäûe ist sehr variabel. Beim so genannten Normaltyp der Koronarversorgung versorgt die rechte Koronararterie den überwiegenden Teil des rechten Vorhofs, den dorsalen und lateralen Teil der rechten Kammer und die dorsale Hälfte des Ventrikelseptums (Abb. 6-4 b). Der Rest wird über die linke Koronararterie versorgt, wobei der Ramus circumflexus den linken Vorhof und die Hinterwand des linken Ventrikels durchblutet. Beim Rechtstyp ist die Versorgung durch die rechte Koronararterie stärker ausgeprägt. Hier übernimmt die linke Koronararterie nur die Vorderwand des linken Ventrikels und kleine vordere Anteile von Septum und rechtem Ventrikel. Beim Linkstyp der Koronarversorgung ist die Verteilung ge- A. coronaria sinistra (entspringt aus Sinus aortae) gibt ab: Ramus interventricularis anterior Ramus coni arteriosi Ramus lateralis Rami interventriculares septales Ramus circumflexus Ramus atrialis anastomoticus Rami atrioventriculares Ramus marginalis sinister Ramus atrialis intermedius Ramus posterior ventriculi sinistri Ramus nodi sinuatrialis Ramus nodi atrioventricularis Rami atriales A. coronaria dextra (entspringt aus Sinus aortae) gibt ab: Ramus coni arteriosi Ramus nodi sinuatrialis Rami atriales Ramus marginalis dexter Ramus atrialis intermedius Ramus interventricularis posterior Rami interventriculares septales Ramus nodi atrioventricularis Ramus posterolateralis dexter Venen Sinus coronarius (mündet in Atrium dexter) nimmt auf: V. cardiaca magna V. posterior ventriculi sinistri V. cardiaca media V. cardiaca parva V. obliqua atrii sinistri Direkt im Atrium dexter münden: Vv. cardiacae anteriores Vv. cordis minimae rade umgekehrt. Hier ist die Versorgung der rechten Koronararterie im Wesentlichen auf kleinere Teile des rechten Vorhofs und laterale und dorsale Anteile des rechten Ventrikels beschränkt. Die Versorgungsgebiete von linker und rechter Koronararterie überlappen sich immer ein wenig. Für die Pathophysiologie ist wichtig, dass Sinusknoten, AV-Knoten und das Erregungsleitungssystem (Abschn. C-6.4) in der Regel nur durch die rechte Koronararterie versorgt werden. Deshalb haben Gefäûveränderungen in der rechten Koronararterie auch häufig Erregungsleitungs- und Rhythmusstörungen (Abschn. C-6.4) zur Folge. 6.2 Anatomie des Herzens Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 145 é Das Herz besteht funktionell aus zwei doppelkammerigen Pumpen, die jeweils aus einem Atrium und einem Ventrikel bestehen. Zwischen Atrium und Ventrikel liegt die Ventilebene, die zwei Segelklappen für die Trennung von Atrien und Ventrikeln und zwei Taschenklappen für die Trennung der Ventrikel von ihren Ausflussbahnen enthält. Das Herz wird von einem eigenen Gefäûsystem versorgt, das rechts mit der rechten Koronararterie und links mit der linken Koronararterie und deren Verzweigung in den Ramus anterior interventricularis und den Ramus circumflexus beginnt. Der Rückstrom des Blutes aus dem Koronarsystem erfolgt durch ein gemeinsames venöses Endgefäû, den Koronarsinus, in den rechten Vorhof. 6.3 Bindegewebe Kapillarendothel Glanzstreifen Zellkerne (Herzmuskelzellen) PH Arbeitsmyokardzellen weisen eine groûe ultrastrukturelle ¾hnlichkeit zu Skelettmuskelfasern auf, auch wenn Letztere als zelluläre Fusionsprodukte eine viel gröûere Längenausdehnung haben. Insbesondere ist der sarkomerische Myofibrillenapparat grundsätzlich so aufgebaut, wie in Abschn. B-19.1 beschrieben. Die Muskulatur des Arbeitsmyokards besteht aus sehr groûen Einzelzellen (Abb. 6-5 a, b). Zellen des ventrikulären und atrialen Arbeitsmyokards sind grundsätzlich sehr ähnlich aufgebaut, wobei die Muskelzellen der Vorhöfe allerdings schlanker und länger als die der Ventrikel sind. Das Zellinnere (Abb. 6-5 c) ist zu 85 % mit Myofibrillen Kapillarlumen Erythrocyten in Kapillaren A l l l Das Arbeitsmyokard besteht aus quergestreiften Muskelzellen, die Organellen der Energieproduktion (Mitochondrien), der Calciumregulation (sarkoplasmatisches Reticulum) und einen sarkomerischen Kontraktionsapparat enthalten Erythrocyt Zellkern (Fibrocyt) pp p Elektrische Eigenschaften und zelluläre Funktionen des Arbeitsmyokards Nexus Sarkolemm sarkoplasmatisches Reticulum Glanzstreifen Glanzstreifen a Sarkomer A-Bande I-Bande T-Tubulus Kern 146 M-Linie Z-Linie Mitochondrien Glanzstreifen b c Abb. 6-5. (a) Lichtmikroskopische Darstellung der zellulären Struktur des Herzmuskels. Die Einzelzellen bilden untereinander ein enges Netzwerk, die strukturelle Basis des funktionellen Syncytiums. Bild von Prof. Minuth, Regensburg. (b) Schematische Darstellung der Vernetzung von Herzmuskelzellen. (c) Schematische Darstellung der Ultrastruktur des Myokards (nach elektronenmikroskopischen Aufnahmen). Nach Berne RM, Levy MN. Physiology. 2. Aufl. Mosby, St. Louis (1988) Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* BC und Mitochondrien ausgefüllt. Letztere stellen unter Sauerstoffverbrauch das ATP für die Kontraktion der Myofibrillen bereit (Abschn. B-19.3). Die Zellmembran der Herzmuskelzelle, das Sarkolemm, umhüllt die Zelle nicht nur, sondern verästelt sich auch in Form kleiner Kanälchen (T-Tubuli) in den Zellkörper. Die Oberfläche der T-Tubuli steht in engem räumlichen Kontakt mit den Endstücken eines intrazellulären tubulären Kanälchensystems, dem sarkoplasmatischen Reticulum (Abschn. B-19.3). Das sarkoplasmatische Reticulum stellt einen groûen intrazellulären Speicher für Ca2+-Ionen dar. Der enge räumliche Kontakt mit den T-Tubuli ist mit einer funktionellen Kopplung verbunden, da Erregung der Zellmembran im Bereich der T-Tubuli zu einer Freisetzung von Ca2+ aus dem sarkoplasmatischen Reticulum führt (s. u.). Das so freigesetzte Ca2+ trägt wesentlich zur Kontraktion der Myofibrillen bei. Die Myofibrillen der Herzmuskelzelle haben eine Sarkomerenstruktur. Wie beim Skelettmuskel (Abschn. B-19.3) ist ein Sarkomer in Herzmuskelzellen aus parallel angeordneten dicken und dünnen Filamenten aufgebaut. Das häufigste Protein in den dicken Filamenten ist Myosin, das häufigste der dünnen Filamente Actin. Nach der Gleitfilamenttheorie von H. E. und A. F. Huxley findet die Kontraktion in Form einer gleitenden Parallelbewegung von Actin und Myosin statt. Man stellt sich diese Translationsbewegung modellhaft wie eine Ruderbewegung der Myosinköpfe entlang der Actinfilamente vor. Der Querbrückenzyklus, der aus dem Andocken des Myosins am Actin, der Translationsbewegung und dem Loslösen des Myosins vom Actin besteht, stellt den molekularen Antrieb mit Myosin als Motor und ATP als Energiequelle dar (Abschn. B-19.4). l l l Herzmuskelzellen sind über Zell-Zell-Verbindungen mechanisch und funktionell eng gekoppelt. Sie bilden daher ein funktionelles Syncytium Zell-Zell-Verbindungen. Herzmuskelzellen sind an ihren Enden durch die so genannten Glanzstreifen (Disci intercalares) verbunden. Diese Zell-Zell-Verbindungen verdanken ihren Namen ihrer im polarisierten Licht doppelbrechenden Membranstruktur. Hier stoûen die Zellenden aufeinander (Abb. 6-5 a±c). Die Zellenden benachbarter Zellen sind dabei stufenartig untereinander verzahnt. Besondere Kontaktstrukturen innerhalb der Glanzstreifen sorgen für mechanischen Zusammenhalt und chemische und elektrische Kommunikation (Abschn. A-18.2). An den Strukturen vom Typ der Fascia adhaerens sind die dünnen Filamente der Myofibrillen über verschiedene Zwischenproteine am Zellende verankert. Die Macula adhaerens (Desmosom) stellt eine Verbindung dar, die durch interzelluläre Kontaktproteine dem mechanischen Zusammenhalt benachbarter Zellen dient. Der funktionellen Kommunikation zwischen benachbarten Zellen dienen die Gap Junctions (Nexus). Die darin enthaltenen zellverbindenden Connexone (Abschn. A-18.2) zeichnen sich nicht nur durch hohe elektrische Leitfähigkeit aus, sondern sind auch für niedermolekulare cytoplasmatische Substanzen durchlässig, z. B. Elektrolyte, Glucose, Lactat etc. Sie ermöglichen damit auch eine metabolische Kopplung von Nachbarzellen. Durch diese Form von Kopplung bilden über Glanzstreifen verbundene Herzmuskelzellen ein funktionelles Syncytium. l l l Die Arbeitsmyokardzellen weisen unerregt ein stabiles Ruhemembranpotential auf. Das Aktionspotential der Arbeitsmyokardzellen ist ± verglichen mit dem anderer erregbarer Zellen ± ungewöhnlich lang (200±400 ms) Ruhepotential. Die Muskelzellen des Arbeitsmyokards sind elektrisch erregbare Zellen, die aber ohne äuûere Erregung in einem stabilen Ruhezustand bleiben. Unter diesen Ruhebedingungen ist das Zellinnere gegenüber dem Auûenraum negativ polarisiert, über dem Sarkolemm liegt ein Membranpotential, d. h. eine transmembranäre Spannung, von ca. 90 mV. Diese Spannung kann man messen, indem man eine Mikroelektrode in das Zellinnere einsticht und eine Differenzmessung gegenüber einer extrazellulären Elektrode durchführt. Dieses Ruhemembranpotential der Herzmuskelzelle entspricht etwa dem Nernst-Gleichgewichtspotential für K+. Tatsächlich besitzt das Sarkolemm im Ruhezustand eine groûe Leitfähigkeit für K+ und nur sehr geringe Leitfähigkeit für andere Ionen. Im ruhenden Herzmuskel sind die Ionenaktivitäten für das intrazelluläre K+ ca. 140 mmol L±1, für das extrazelluläre K+ ca. 4 mmol L±1. Beim Einsetzen dieser Werte in die Nernst-Gleichung (Abschn. A-9.2) ergibt sich für das Kaliumgleichgewichtspotential: EK 61 mV 4 94 mV 140 Im Ruhezustand wird die Kaliumleitfähigkeit der Arbeitsmyokardzelle durch den so genannten Einwärtsgleichrichter (iK1) bestimmt, einen Kaliumkanal, der bei Depolarisation auf Werte positiver als 70 mV schnell inaktiviert wird. Einwärtsgleichrichter nennt man Kaliumkanäle, die um und unterhalb von EK die gröûte Leitfähigkeit aufweisen. l l l Das Aktionspotential beginnt mit Aktivierung eines Natriumeinstroms (schnelle Depolarisation). Daran schlieûen sich Aktivierungen eines Calciumeinstroms (Plateauphase) und von Kaliumausströmen (Repolarisationen) an Aktionspotential. Wird die Nachbarzelle einer noch ruhenden Zelle elektrisch erregt, führt dies zu kleinen Ladungsverschiebungen zwischen den Oberflächen der beiden Zellen und, über die Gap Junctions, auch zwischen den Zellinnenräumen, weil sich durch das Aktionspotential an der erregten Zelle Ladungsveränderungen eingestellt haben. Die kleinen Ströme zwischen den Nachbarzellen depolarisieren auch die nicht-erregte Zelle ein wenig. Erreicht die Depolarisation einen Schwellenwert von ca. 70 mV, werden sehr schnell spannungsabhängige Natriumkanäle geöffnet. Die K+-Einwärtsgleichrichter werden bei diesem Potential bereits inaktiviert. Durch Aktivierung des Natriumeinstroms kommt es zu einer schnell zunehmenden weiteren Depolarisation (Abb. 6- 6.3 Elektrische Eigenschaften und zelluläre Funktionen des Arbeitsmyokards Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 147 +50 Membranpotential (mV) initiale Spitze (1) Overshoot Plateau (2) 0 Aufstrich (0) Repolarisation (3) – 50 Ruhepotential – 100 – 100 0 100 a 200 Zeit [ms] (4) 300 400 0 i Na i Ca L 0 i to 0 i Cl 0 iK 0 i K1 0 – 100 0 b 100 200 Zeit [ms] 300 400 Abb. 6-6. Das Aktionspotential der Arbeitsmyokardzelle. (a) Das Aktionspotential hat 4 Phasen. Phase 0 ist eine schnelle Depolarisation (Aufstrich). Eine teilweise Repolarisation nach dem Aufstrich bestimmt die folgende Phase 1 (initiale Spitze), die in Phase 2 (Plateau) übergeht. Die endgültige Repolarisation (Phase 3) führt zurück zum Ruhemembranpotential (Phase 4). (b) Relative Stromstärken der beteiligten Ionenkanäle: iNa Natriumstrom; iCa L Calciumstrom (L-Typ); ito transienter Kaliumauswärtsstrom; iCl Chloridstrom; ik verzögerter Gleichrichter; iK1 Einwärtsgleichrichter. Die Pfeile geben die technische Stromrichtung an: ¯ Einwärtsstrom; ­ Auswärtsstrom 6). Diese bildet den Aufstrich des Aktionspotentials (Phase 0 des Aktionspotentials). Der Natriumeinstrom heiût wegen seiner raschen Kinetik auch ¹schneller Natriumeinstromª (iNa). Da während dieser Phase das Plasmalemm fast nur von dieser groûen Natriumleitfähigkeit bestimmt wird, strebt das Membranpotential in Richtung des Natriumgleichgewichtspotentials. Die intrazelluläre Na+-Aktivität liegt bei etwa 10 mmol L±1, die extrazelluläre bei 140 mmol L±1. Daraus errechnet sich nach der Nernst-Gleichung für das Natriumgleichgewichtspotential ein Wert von 60 mV. Dieser Wert wird aber beim Aufstrich des Aktionspotentials nicht er148 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* reicht, da die Natriumkanäle spannungsabhängig geschlossen und inaktiviert werden (Abschn. B-1.4, B-1.5). Dieser Prozess beginnt bei einem Wert von etwa 40 mV und ist innerhalb von ca. 1 Millisekunde beendet. Das Membranpotential erreicht noch einen leicht positiven Wert von 20 mV (Overshoot), dann schlieût sich eine frühe partielle Repolarisation an (Phase 1). Für die partielle Repolarisation während dieser initialen Spitze des Aktionspotentials sind ein weiterer Kaliumausstrom (transienter Auswärtsstrom, ito) sowie ein Cl±-getragener Auswärtsstrom (iCl) verantwortlich. (Cl±-Ionen flieûen in die Zelle hinein, wegen ihrer negativen Ladung stellt dies aber elektrisch einen Auswärtsstrom dar!) Plateauphase und Repolarisation. An die initiale, kurze Repolarisation schlieût sich eine lange Plateauphase (Phase 2) an, während der das Membranpotential etwa bei 0 mV liegt. Diese Phase ist durch ein Gleichgewicht zwischen den zuvor genannten repolarisierenden Strömen und einem Einwärtsstrom bestimmt, dem langsamen Calciumeinstrom (iCa), der auf der spannungsabhängigen Aktivierung von so genannten L-Typ-Calciumkanälen beruht. Diese Kanäle werden bei einer Membranspannung oberhalb von ca. 40 mV aktiviert und haben eine sehr lange Öffnungszeit. Sie bestimmen die Plateauphase des Membranpotentials für etwa 300 Millisekunden (200±400 ms je nach Herzfrequenz und Lokalisation der Zellen). Wenn die Calciumkanäle inaktivieren und die Wirkung repolarisierender Ströme überhand nimmt, beginnt die letzte Phase des Aktionspotentials (Phase 3), die endgültige Repolarisation. An der Repolarisation sind eine Reihe unterschiedlicher Ströme, vor allen Dingen Kaliumströme beteiligt. Besonders wichtig ist ein so genannter K+-Auswärtsgleichrichter (verzögerter Gleichrichter, iK), der im Gegensatz zu dem Einwärtsgleichrichter (iK1) erst in der depolarisierten Zelle und mit zeitlicher Verzögerung aktiviert wird. (Auswärtsgleichrichter nennt man Kaliumströme, die in Auswärtsrichtung, d. h. oberhalb von EK, gröûer sind als in Einwärtsrichtung, d. h. unterhalb von EK). Während der Repolarisationsphase überwiegt damit wiederum die Leitfähigkeit der Zellmembran für K+. Folglich strebt das Membranpotential wieder dem K+-Gleichgewichtspotential von ca. 90 mV entgegen. Dabei übernimmt zunehmend wieder der Einwärtsgleichrichter (iK1) die Führung. Dieser bestimmt das Membranpotential auch nach Ablauf des Aktionspotentials, d. h. unter elektrischen Ruhebedingungen (Phase 4). Ionenverschiebungen. Im Verlauf eines Aktionspotentials kommt es zu Verschiebungen von Na+-, K+-, Cl±- und Ca2+Ionen zwischen Intra- und Extrazellulärraum. Die Mengen sind aber so klein, dass die transsarkolemmalen Konzentrationsdifferenzen von Na+, K+, Cl± und Ca2+ während eines einzelnen Erregungszyklus kaum verändert werden. Für eine langfristige Aufrechterhaltung der Ionenhomöostase müssen dennoch Na+, Cl± und Ca2+ aus dem Zellinneren wieder heraustransportiert und K+ dem Zellinneren wieder zugeführt werden. Für Na+ und K+ wird diese Aufgabe durch die Na+K+-ATPase (Natriumpumpe) des Sarkolemms übernommen, die die beiden Ionen entgegen ihren jeweiligen Konzentrationsgradienten unter Energieaufwand über die Zellmembran austauscht. Für Cl± ist der Weg des Auswärtstransports nicht klar. Der durch die Natriumpumpe aufgebaute Na+-Gradient stellt auch die treibende Kraft für den Na+-Ca2+-Austauscher (Abschn. A-9.6) dar, der Ca2+ entgegen seinem Konzentrationsgradienten im Austausch gegen Na+ über die Zellmembran aus der Zelle heraustransportiert (s. u.). l l l Während des Plateaus des Aktionspotentials ist die Arbeitsmyokardzelle nicht erneut erregbar (Refraktärität). Die Länge der Refraktärität bedingt, dass der Herzmuskel nur Einzelkontraktionen durchführt Refraktärperiode. Während der Plateauphase des Aktionspotentials ist die Herzmuskelzelle elektrisch absolut refraktär (Abb. 6-7 a). Dies bedeutet, dass während dieser Zeit kein weiteres Aktionspotential ausgelöst werden kann. Die Länge der Plateauphase ist im Allgemeinen gröûer als die einer Einzelzuckung. Im Herzmuskel kann es deshalb nicht zur Superposition von Einzelzuckungen oder sogar zur Tetanisierung kommen, was funktionell auch nicht sinnvoll wäre, da die Ventrikel des Herzens ihre Pumpfunktion nur bei zeitlich abgesetzten Einzelkontraktionen erfüllen können (Abb. 6-7 b). Die absolute Refraktärphase endet während der Repolarisationsphase bei einem Membranpotential von etwa 40 mV, weil oberhalb dieses Werts die schnellen Natriumkanäle durch ihre Spannungsabhängigkeit vollständig inaktiviert +50 Membranpotential [mV] Aktionspotential 0 – 50 – 100 0 100 200 300 Zeit [ms] 400 500 a Aktionspotential Kontraktion 0 200 Zeit [ms] b Abb. 6-7. (a) Refraktärperiode der Arbeitsmyokardzelle. Während der absoluten Refraktärperiode ist auch bei sehr hohen Reizstärken kein weiteres Aktionspotential auslösbar. Während der relativen Refraktärperiode sind verkleinerte Aktionspotentiale mit erhöhter Reizstärke auslösbar. (b) Schematischer Vergleich von Aktionspotentialdauer und Kontraktionsdauer im Herzmuskel bleiben (Abschn. B-1.5). Repolarisiert die Zelle über diesen Wert hinaus zu negativeren Potentialen, werden die Natriumkanäle wieder teilweise aktivierbar. Aktionspotentiale werden dann auch wieder auslösbar; diese haben aber zunächst eine geringere Anstiegssteilheit, sind von kürzerer Dauer und werden auch zwischen Nachbarzellen nur langsam fortgeleitet (relative Refraktärphase). Während der relativen Refraktärphase ist die Erregbarkeit im Arbeitsmyokard für kurze Zeit ziemlich inhomogen ausgeprägt. Dieser Umstand begünstigt zusammen mit der reduzierten Erregungsfortleitung die Entstehung von Arrhythmien vom Typ einer kreisenden Erregung (Abschn. C-6.4). l l l Das wesentliche Element der elektromechanischen Kopplung in den Zellen des Arbeitsmyokards ist die Calciumfreisetzung aus dem sarkoplasmatischen Reticulum Calciummobilisierung. Als elektromechanische Kopplung bezeichnet man den Signalmechanismus, der in einer Muskelzelle das Aktionspotential mit der Kontraktion verbindet (Abschn. B-19.5). Wichtigster Signalstoff sind dabei Ca2+-Ionen, die in der ruhenden Zelle nur mit einem Zehntausendstel der extrazellulären Konzentration vorliegen (10±7 mol L±1 im Vergleich zu 10±3 mol L±1). Während der Plateauphase des Aktionspotentials strömt Ca2+ in das Zellinnere ein (Abb. 68 a). Die eingeströmte Calciummenge ist relativ klein, sie stellt aber einen Trigger für das nachfolgende Geschehen dar. Innerhalb der Zelle gibt es einen an den T-Tubuli lokalisierten Verstärkermechanismus für das Calciumsignal. Die TTubuli haben engen Kontakt mit den terminalen Zisternen des sarkoplasmatischen Reticulums. Zwischen beiden Membranen liegt nur ein enger Spalt. Werden die L-Kanäle in der Membran der T-Tubuli geöffnet, strömt Ca2+ in diesen Spalt und erhöht so lokal die Calciumkonzentration. Die angrenzende Membran des sarkoplasmatischen Reticulums enthält Kanalmoleküle, die sich bei Anstieg der Calciumkonzentration öffnen. Die Kanäle werden Ryanodinrezeptoren genannt, da sie den Hemmstoff Ryanodin spezifisch binden. Über diese Kanäle wird dann das im sarkoplasmatischen Reticulum in starker Anreicherung gespeicherte Ca2+ freigesetzt (sog. calciuminduzierte Calciumfreisetzung). Das so freigesetzte Ca2+ trägt 75 % oder mehr zum Anstieg der cytosolischen Calciumkonzentration in der erregten Myokardzelle bei. Adrenerge Modulation der Calciumfreisetzung. Überträgerstoffe des Sympathikus (Noradrenalin aus den sympathischen Nervenendigungen im Herzen, Adrenalin aus dem sympathisch stimulierten Nebennierenmark) stimulieren b1Adrenorezeptoren im Sarkolemm der Herzmuskelzellen (Abb. 6-8 b). Dies führt ± vermittelt durch stimulatorische G-Proteine ± zu einer Aktivierung der membranständigen Adenylatcyclase. Es wird vermehrt zyklisches AMP (cAMP) gebildet, das die Protein-Kinase A (PKA) aktiviert. PKA phosphoryliert verschiedene funktionell wichtige Proteine der Herzmuskelzelle. Phosphorylierung des L-Kanals erhöht dessen Offenwahrscheinlichkeit und damit den Calciumstrom wäh- 6.3 Elektrische Eigenschaften und zelluläre Funktionen des Arbeitsmyokards Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 149 Myofibrillen SR SR bR ATP G Sarkolemm cAMP Calciumpumpe Troponin I 2+ 2+ Ca Ca2+ Calciumkanal Troponin C Na - Ca Austauscher Kontraktion Adrenalin Noradrenalin PKA SR 2+ Ca - Freisetzungskanal Troponin C + cAMP PKA P Na+ AC Sarkolemm Calciumkanal 2+ Ca P T-Tubulus Ca2+ cAMP Ca 2+ Ca2+- Aktionspotential PKA Freisetzungskanal P Ca2+ PL SR-Terminalzisterne Calciumpumpe a Abb. 6-8. (a) Schema der elektromechanischen Kopplung. (b) ¾nderung in der elektromechanischen Kopplung bei Stimulation myokardialer b-Adrenorezeptoren (bR) durch Adrenalin oder Noradrenalin. Rezeptorstimulation aktiviert über stimulatorische G-Proteine (G) die Adenylatcyclase (AC). An der AC wird zyklisches AMP (cAMP) gebildet, das die Protein-Kinase A (PKA) ak- tiviert. Die PKA phosphoryliert den L-Typ-Calciumkanal und aktiviert ihn damit. Die PKA phosphoryliert auch Troponin I, was die Affinität von Troponin C für Ca2+ herabsetzt. Als weiteres Zielprotein phosphoryliert die PKA Phospholamban (PL). Dadurch wird die Calciumpumpe des SR aktiviert, denn PL hemmt im unphosphorylierten Zustand deren Aktivität rend der Plateauphase des Aktionspotentials. Erhöhter Calciumeinstrom bewirkt sekundär auch eine erhöhte Calciumfreisetzung aus dem sarkoplasmatischen Reticulum. Die Ansprechbarkeit der Ryanodinrezeptoren durch cytoplasmatisches Ca2+ wird ebenfalls durch eine PKA-vermittelte Proteinphosphorylierung erhöht (Effekte der PKA auf die sarkoplasmatische Calciumrückspeicherung s. u.). Affinität von Troponin C für Ca2+ und reduziert somit die Calciumsensitivität der Myofibrillen. Deshalb ist bei Stimulation des Sympathikus die Calciumsensitivität des kardialen kontraktilen Apparats reduziert. Dass dennoch unter Sympathikusstimulation eine gröûere Kraftentwicklung auftritt, liegt an dem deutlich vergröûerten Calciumeinstrom (s. o.). Elektromechanische Kopplung. Durch Freisetzung von Ca2+ aus dem sarkoplasmatischen Reticulum steigt die cytosolische freie Calciumkonzentration von einem Ruhewert von 10±7 mol L±1 in der erregten Myokardzelle auf maximal etwa 10±5 mol L±1 an. Dieser Anstieg erfolgt relativ gleichmäûig im Cytosol und aktiviert den kontraktilen Apparat. Ca2+ bindet dort an das Regulatorprotein Troponin C, das mit Actin assoziiert in den dünnen Filamenten vorliegt. Troponin C bildet zusammen mit Troponin I, Troponin T und Tropomyosin einen kooperativen Komplex. Solange Troponin C kein Ca2+ gebunden hat, verhindert die Lage des Tropomyosins die Ausbildung einer Querbrücke zwischen Myosin und Actin. Es wirkt also gewissermaûen als Bremsklotz. In Gegenwart von Ca2+ kommt es zu Konformationsänderungen in diesem Molekülkomplex, wodurch Tropomyosin so verlagert wird, dass Myosin an Actin binden kann. Dadurch werden Querbrückenzyklen ermöglicht, die den molekularen Motormechanismus der Muskelkontraktion darstellen (Abschn. B-19.6). Phosphorylierung von Troponin I durch PKA vermindert die 150 b Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Box 6-2. Künstlicher Herzstillstand Bei chirurgischen Eingriffen am Herzen ist es häufig notwendig, das Herz mechanisch still zu stellen, um dann störungsfrei operieren zu können. Die Funktion von Herz und Lunge muss dann von einer Herz-Lungen-Maschine übernommen werden, die das zentralvenöse Blut ansaugt, mit Sauerstoff anreichert und in den groûen Kreislauf pumpt. Neben der Stillstellung des Herzens ist es bei Herzoperationen häufig auch unvermeidlich, dass die Koronardurchblutung unterbrochen und so das Myokard ischämisch wird. Für die Stillstellung des Herzens (Kardioplegie) und als Ischämieschutz werden nach Anschluss der Herz-Lungen-Maschine so genannte kardioplegische (myokardprotektive) Lösungen ins Herz perfundiert, die die elektromechanische Kopplung unterbrechen und den Energiebedarf des Herzens senken. Zu den Wirkprinzipien dieser Lösungen gehört es, die Kardiomyocyten durch Erhöhung der extrazellulären Kaliumkonzentration zu depolarisieren, um eine elektrische Refraktärität zu erreichen, und das konktraktionsauslösende Ca2+ aus dem Extrazellulärraum auszuwaschen. Diese Kraftsteigerung, die von der Vordehnung des Herzmuskels unabhängig ist, nennt man positive Inotropie. rung des schnellen Natriumeinstroms initiiert. Es enthält eine Plateauphase, getragen vom langsamen Calciumeinstrom und eine abschlieûende Repolarisationsphase, bestimmt durch Kaliumausströme. Während des Aktionspotentials ist die Zelle ca. 300 ms lang elektrisch refraktär. Die lange Refraktärzeit bedingt, dass der Herzmuskel nur Einzelzuckungen ausführt. Der Calciumeinstrom ins Zellinnere während der Plateauphase des Aktionspotentials triggert die Freisetzung einer groûen Calciummenge aus dem sarkoplasmatischen Reticulum ins Cytosol. Wenn Ca2+ an das Troponin C der dünnen Kontraktionsfilamente bindet, wird der Kontakt zwischen Myosin und Actin ermöglicht und damit der Kontraktionsvorgang initiiert. Aktive Rückspeicherung von Ca2+ in das sarkoplasmatische Reticulum beendet die kontraktile Aktivierung. Stimulation der myokardialen b-Rezeptoren (Sympathikuseffekt) erhöht den Calciumeinstrom und dadurch die Calciumfreisetzung aus dem sarkoplasmatischen Reticulum. Dies führt zu einer Kontraktionskraftsteigerung. Die resultierende Kontraktion ist aber wegen der beschleunigten Calciumrückspeicherung auch verkürzt. l l l Die Geschwindigkeit der Calciumrückspeicherung in das sarkoplasmatische Reticulum bestimmt vor allem die Geschwindigkeit der Relaxation des Herzmuskels Der Aufbau einer hohen cytosolischen Calciumkonzentration am Anfang eines Kontraktionszyklus erfolgt sehr schnell, da es sich hier im Wesentlichen um Diffusionsprozesse entlang von groûen Konzentrationsgradienten handelt. In der nachfolgenden Entspannungsphase der Herzmuskelzelle muss das Ca2+ wieder aktiv entgegen einem Konzentrationsgradienten in den Extrazellulärraum und zum gröûten Teil wieder in seinen zentralen Speicher, das sarkoplasmatische Reticulum, zurückgepumpt werden. Das von extrazellulär eingeströmte Ca2+ wird hauptsächlich über den Na+-Ca2+-Austauscher, in geringerem Maûe auch über die Ca2+-ATPase (Calciumpumpe) des Sarkolemms hinaustransportiert. Die Rückführung in das sarkoplasmatische Reticulum erfolgt über Calciumpumpen (Ca2+-ATPase des sarkoplasmatischen Reticulums, sog. SERCA), die in hoher Dichte in der Membran des sarkoplasmatischen Reticulums vorliegen. Dieser energieaufwendige Vorgang ist vergleichsweise langsam. Die Pumpen werden durch das Ansteigen des cytosolischen Ca2+ aktiviert. Sie bestimmen die Nettorichtung der cytosolischen Calciumbewegung allerdings erst dann, wenn die schnelle Entspeicherung des sarkoplasmatischen Reticulums beendet ist. Durch Absenken der cytosolischen Calciumkonzentration auf 10±7 mol L±1 löst sich Ca2+ aus seiner Bindung an Troponin C. Als Folge tritt Tropomyosin wieder in seine blockierende Position zwischen Actin und Myosin, und der Myofibrillenapparat relaxiert. Die Aktivität der SERCA wird durch das Regulatorprotein Phospholamban reguliert. Dieses stellt einen natürlichen Inhibitor der Pumpe dar, der durch Phosphorylierung inaktiviert wird. Eine solche Phosphorylierung tritt z. B. auf, wenn unter b-Adrenorezeptorstimulation (Sympathikus) die Protein-Kinase A der Herzmuskelzelle aktiviert wird. Deshalb ist bei Stimulation des Sympathikus die Relaxation des Herzmuskels beschleunigt. Diesen Effekt nennt man auch positive Lusitropie. é Herzmuskelzellen enthalten den kontraktilen Apparat der quergestreiften Muskulatur, d. h. Actin und Myosin in Sarkomerenstruktur. T-Tubuli des Sarkolemms und das eng assoziierte intrazelluläre sarkoplasmatische Reticulum bilden einen Membranapparat, der die cytosolische Calciumkonzentration reguliert. Gap Junctions zwischen Nachbarzellen koppeln diese elektrisch und metabolisch. Dadurch wird das Arbeitsmyokard ein funktionelles Syncytium. In Ruhe haben die Arbeitsmyokardzellen ein Membranpotential von ca. 90 mV, nahe dem Gleichgewichtspotential für K+. Ein Aktionspotential wird durch spannungsabhängige Aktivie- 6.4 Struktur und Funktion des Erregungsbildungs- und Erregungsleitungssystems A PH l l l Gruppen von speziellen Muskelzellen bilden im rechten Vorhof und den Ventrikeln die Strukturen für Erregungsbildung und Erregungsleitung Strukturen. Die Muskulatur von Vorhöfen und Ventrikeln des Herzens kontrahiert sich rhythmisch. Diese Kontraktionen sind auch dann zu beobachten, wenn das Herz, z. B. bei einer Herztransplantation nach Entnahme aus dem Spender, völlig denerviert ist. Die rhythmischen Kontraktionen beruhen darauf, dass spontane Schrittmacher das Herz in einen geordneten Kontraktionsablauf versetzen. Neuronale und humorale Einflüsse können die autonome Grundaktivität dieses Schrittmachersystems modulieren. Die an diesem Erregungsbildungs- und Erregungsleitungssystem beteiligten Zellen sind spezielle Muskelzellen, die sich von den Arbeitsmuskelzellen des Kraft entwickelnden Myokards (s. u.) abgrenzen lassen. Die Herzmuskelzellen des ventrikulären Erregungsleitungssystems besitzen deutlich weniger T-Tubuli, kontraktile Elemente und Mitochondrien als die Zellen des Arbeitsmyokards (Abschn. C-6.3). Sie enthalten dafür viel Glycogen und Enzyme des anaeroben Energiestoffwechsels. Die Zellen des ventrikulären Erregungsleitungssystems sind breiter und voluminöser als die Zellen der Arbeitsmuskula- 6.4 Struktur und Funktion des Erregungsbildungs- und Erregungsleitungssystems Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* p p 151 Sinusknoten Bündel (Truncus fasciculi atrioventricularis), das diese Bindegewebsbarriere durchdringt und die Erregung vom AVKnoten in die Herzkammern weiterleitet. Es verläuft im Ventrikelseptum zunächst auf der rechten Seite herzspitzenwärts und verzweigt sich bald in einen rechten und einen linken Schenkel (Kammerschenkel, Tawara-Schenkel, Crus dextrum, Crus sinistrum). Der linke Schenkel teilt sich in ein vorderes und ein hinteres Hauptbündel. Die Enden dieser Verzweigungen des His-Bündels gehen in netzartige Ausläufer über, die so genannten Purkinje-Fasern. Über diese Ausläufer wird die Erregung fein verteilt auf die Innenschicht der Ventrikelmuskulatur übertragen. Im Ventrikel wird die Erregung dann durch die Arbeitsmuskelzellen selbst fortgeleitet. Die Papillarmuskeln werden über Ausläufer der Kammerschenkel als erste erreicht und kontrahieren deshalb auch vor der übrigen Kammermuskulatur. Dadurch werden die Segelklappen zu Beginn der Systole fest verschlossen (s. u.). AV-Knoten His-Bündel linker Kammerschenkel rechter Vorhof hinterer Ast rechter Kammerschenkel vorderer Ast Purkinje-Fasern a 60 Vorhöfe 60 AV-Knoten His-Bündel 20 Ausbreitungszeit [ms] Sinusknoten Kammer-Schenkel Purkinje-Fasern 60 Ventrikel 0 200 400 600 Zeit [ms] b Abb. 6-9. (a) Schematische Darstellung des Erregungsbildungs- und Erregungsleitungssystems. Die Pfeile zeigen die bevorzugten Verlaufsrichtungen der Erregung über das Vorhofmyokard an. Nach Antoni H. Electrophysiology of the heart at a single cell level and cardiac rhythmogenesis. In Greger R, Windhorst U (Hrsg.) Comprehensive Human Physiology. Band 2. Springer Verlag, Berlin (1996). (b) Fortleitung von Aktionspotentialen im Erregungsbildungs- und Erregungsleitungssystem. Bitte beachten Sie, dass das Aktionspotential des AV-Knotens dem des Sinusknotens ähnelt tur, was zur schnellen Erregungsleitung dieser Strukturen beiträgt. Noch geringer ist die Ausstattung mit kontraktilen Elementen in den Schrittmacherzellen von Sinusknoten und Atrioventrikularknoten. Der Sinusknoten (Nodus sinuatrialis) besteht aus einigen Hundert Zellen und ist an der Innenseite der hinteren Wand des rechten Vorhofs lokalisiert (Abb. 69 a). Die von ihm ausgehende Erregung (Aktionspotential) wird über die Vorhofmuskulatur weitergeleitet, von wo sie den Atrioventrikularknoten (AV-Knoten, Nodus atrioventricularis, Aschoff-Tawara-Knoten) erreicht, der auf der rechten Seite des Septum interatriale an der Grenze von Vorhof und Kammer lokalisiert ist. Die bindegewebigen Strukturen der Ventilebene leiten die Erregung aus den Vorhöfen nicht weiter, da das Bindegewebe Aktionspotentiale nicht bilden und weiterleiten kann. Am AV-Knoten entspringt ein dünner Strang spezialisierter Muskelzellen, das so genannte His152 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Rolle der Gap Junctions. Die Zahl und Funktion von Gap Junctions (Abschn. A-18.2) zwischen den Zellen des Erregungsleitungssystems und zwischen diesen und Zellen des Arbeitsmyokards bestimmen ganz wesentlich die Ausbreitung der elektrischen Erregung. Die wichtigsten Strukturelemente einer Gap Junction sind Connexone genannte, die Zellen verbindende Kanälchen, die aus transmembranären Proteinkomplexen (Connexine) zweier Nachbarzellen gemeinsam aufgebaut werden (Abschn. A-18.2). Die Connexone haben eine hohe elektrische Leitfähigkeit und dienen damit der elektrischen Kopplung benachbarter Zellen. Im Erregungsleitungssystem des menschlichen Herzens sind vor allem die Connexin-Gene Cx40 und Cx43 exprimiert, im ventrikulären Arbeitsmyokard sind es vorwiegend Cx43 und Cx45, im Vorhof finden sich alle drei Connexine. Die Zellen des Erregungsleitungssystems sind untereinander mit einer gröûeren Zahl von Gap Junctions verbunden als mit dem umliegenden Arbeitsmyokard. Eine Ausnahme bilden die Zellen der Purkinje-Fasern, die direkt der Erregungsübertragung auf die Arbeitsmyokardzellen dienen. Die Geschwindigkeit der Erregungsausbreitung wird durch die Dichte der Gap Junctions innerhalb dieser Strukturen mitbestimmt. Kammerschenkel und Purkinje-Fasern sind bezüglich der Erregungsausbreitung ¹Rennstreckenª. Zwischen den Zellen sind hier besonders viele Gap Junctions ausgebildet. l l l Schrittmacherzellen bilden selbstständig Aktionspotentiale. Autonome Innervation moduliert diese elektrische Spontanaktivität Elektrische Automatizität. Die Schrittmacherzellen des Sinusknotens unterscheiden sich von Arbeitsmyokardzellen dadurch, dass sie kein stabiles Ruhemembranpotential aufweisen, spontan depolarisieren und selbstständig Aktionspotentiale bilden (Abb. 6-10 a). Das maximale negative Potential von Schrittmacherzellen liegt bei etwa 60 mV, d. h. bei deutlich geringerer Negativität als es dem Ruhemembranpotential in Arbeitsmuskelzellen ( 90 mV) entspricht. Der bestimmende Kaliumstrom des Ruhemembranpotentials der Arbeitsmuskelzellen, der Einwärtsgleichrichterstrom Membranpotential [ mV ] 0 – 60 relative Stromstärke 0 i Ca L 0 i Ca T if 0 iK 0 0 100 200 300 400 500 600 700 800 Zeit [ ms] Membranpotential [ mV ] a Sympathikus 0 N. vagus – 20 Schwelle – 40 – 60 – 80 0 200 400 600 800 1000 Zeit [ ms] b Abb. 6-10. (a) Das Aktionspotential der Schrittmacherzellen des Sinusknotens. Oberste Kurve: Das Aktionspotential weist anfangs einen langsamen Anstieg auf. Es gibt keine Plateauphase. Nach Repolarisation auf einen tiefsten Wert von 60 mV depolarisiert die Zelle wieder spontan. Die anderen Kurven zeigen die relativen Stromstärken der beteiligten Ionenkanäle: iCa L LTyp-Calciumstrom; iCa T T-Typ-Calciumstrom; if Schrittmacherstrom; iK verzögerter Gleichrichter. Die Pfeile geben die technische Stromrichtung an: ¯ Einwärtsstrom ­ Auswärtsstrom. (b) Veränderung der Spontandepolarisation der Schrittmacherzellen des Sinusknotens unter Stimulation durch den Sympathikus oder den N. vagus. Überträgerstoffe des Sympathikus (Noradrenalin, Adrenalin) beschleunigen die Spontandepolarisation. Dadurch wird die Schwelle für die Auslösung eines Aktionspotentials früher als normal erreicht. Der Überträgerstoff des N. vagus (Acetylcholin) hat eine entgegengesetzte Wirkung. Als Folge ist die Schrittmacherfrequenz unter Sympathikusstimulation erhöht und unter Vagusstimulation vermindert (iK1), und der schnelle Natriumstrom (iNa), der in Arbeitsmuskelzellen die schnelle Anfangsphase des Aktionspotentials trägt, sind funktionell in Schrittmacherzellen unbedeutend. Ohne den stabilisierenden IK1-Strom depolarisieren die Zellen nach Erreichen von ca. 60 mV langsam spontan. Hier- an sind mehrere Einwärtsströme beteiligt. Am Anfang der Depolarisationsphase wird ein unselektiver, hauptsächlich von Na+ getragener Einwärtsstrom (if, ¹Schrittmacherstromª) aktiviert, der in ventrikulären Arbeitsmuskelzellen gar nicht vorhanden ist. Auûerdem wird ein besonderer Calciumkanal (T-Kanal) aktiviert, der bereits bei negativeren Spannungen als der L-Typ geöffnet wird. In Schrittmacherzellen trägt dieser Strom wesentlich zur Spontandepolarisation bei. Erreicht die Spontandepolarisation einen Schwellenwert von etwa 40 mV, wird der langsame Calciumstrom (L-Typ) aktiviert. Dadurch depolarisiert die Zelle rasch weiter. Der langsame Calciumstrom ist somit Träger der ersten Phase des Aktionspotentials der Schrittmacherzelle, das einen Spitzenwert von 20 mV erreichen kann. Die Aktivierung des verzögerten Gleichrichters (iK) in der depolarisierten Zelle leitet dann eine langsame Repolarisation ein, die mit einer Inaktivierung des L-Typ-Calciumstroms verbunden ist. Eine Plateauphase wie in der Arbeitsmuskelzelle fehlt, da es hier nicht zu einem Gleichgewicht zwischen depolarisierenden und repolarisierenden Strömen kommt. Der iK deaktiviert bei zunehmend negativen Potentialen. Damit fällt am Ende eines Aktionspotentials die Kaliumleitfähigkeit der Schrittmacherzelle deutlich ab, und die langsame Spontandepolarisation beginnt erneut. Nervale Modulation der Schrittmacheraktivität. Die Frequenz der spontan entstehenden Aktionspotentiale in den Schrittmacherzellen des Sinusknotens ist im Wesentlichen von der Geschwindigkeit der Spontandepolarisation abhängig. Der Sinusknoten wird sowohl von Fasern des Sympathikus als auch des N. vagus innerviert (Abschn. C-6.10). Bei Stimulation des N. vagus wird die Depolarisationsgeschwindigkeit deutlich vermindert, bei Stimulation des Sympathikus deutlich erhöht (Abb. 6-10 b). Dies wird durch antagonistische Wirkungen der Überträgerstoffe des N. vagus (Acetylcholin) und des Sympathikus (Noradrenalin, Adrenalin) auf die Sinusknotenzellen bewirkt. Noradrenalin und Adrenalin stimulieren b-Adrenorezeptoren an den Sinusknotenzellen. Vermittelt über stimulatorische G-Proteine führt dies zu einer Aktivierung der Adenylatcyclase und dadurch zur Bildung von cAMP. Acetylcholin stimuliert muscarinische Rezeptoren in den Sinusknotenzellen. Dies bewirkt eine durch inhibitorische G-Proteine vermittelte Hemmung der Adenylatcyclase. Der Schrittmacherstrom if wird bei Erhöhung der zellulären cAMP-Konzentration aktiviert, was die Depolarisation der Zellen beschleunigt. Acetylcholin hat noch einen weiteren Effekt an Schrittmacherzellen. Es aktiviert einen rezeptorgesteuerten Kaliumkanal (Strom iKach; Abschn. A-9.5, B-1.5), was ebenfalls über ein G-Protein vermittelt wird. Vergröûerung der Kaliumleitfähigkeit verschiebt das Membranpotential der Schrittmacherzellen zu stärker negativen Werten. Dadurch wird das Erreichen der Schwelle für das Aktionspotential verzögert. Die frequenzsteigernde bzw. -senkende Wirkung von Sympathikus und N. vagus nennt man positive bzw. negative Chronotropie. Nervale Modulation der Erregungsleitung. Die Schrittmacherzellen des AV-Knotens haben sehr ähnliche elektrische Eigenschaften wie die Zellen des Sinusknotens. Insbesondere weisen sie auch ein vom L-Typ-Calciumstrom getragenes 6.4 Struktur und Funktion des Erregungsbildungs- und Erregungsleitungssystems Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 153 Aktionspotential auf. Stimulation der AV-Knotenzellen über den Sympathikus vergröûert den Calciumstrom und damit die initiale Steilheit des Aktionspotentials. Dieses bedingt eine schnellere Fortleitung der Erregung, eine so genannte positive Dromotropie. Stimulation der AV-Knotenzellen über den N. vagus hat einen gegenteiligen Effekt (negative Dromotropie). Die AV-Knotenzellen besitzen auch den iKachStrom, dessen Aktivierung bei starker Vagusstimulation die Auslösung eines Aktionspotentials in den AV-Knotenzellen verhindern und damit eine vollständige Unterbrechung der Erregungsüberleitung durch den AV-Knoten (AV-Block) auslösen kann. Die Aktionspotentiale des ventrikulären Erregungsleitungssystems ähneln denen der Arbeitsmyokardzellen. Insbesondere bestimmt der schnelle Natriumkanal die Auslösung auch dieser Aktionspotentiale. Die Zellen des ventrikulären Erregungsleitungssystems weisen aber auch einen diastolischen Schrittmacherstrom (if) auf, der langsame Spontandepolarisationen hervorruft. Daher stellen sie potentielle Schrittmacher dar. Formvariationen kardialer Aktionspotentiale. In einer systematischen Übersicht über die charakteristischen Formen von Aktionspotentialen in verschiedenen Teilen des Herzens (Abb. 6-9 b) lassen sich folgende Unterschiede festhalten: · Zellen des Erregungsbildungs- und Erregungsleitungssystems weisen diastolische Spontandepolarisationen und eine geringe initiale Anstiegssteilheit des Aktionspotentials auf. · Arbeitsmyokardzellen der Vorhöfe und der Ventrikel haben ein stabiles diastolisches Ruhemembranpotential, und das Aktionspotential steigt anfangs sehr steil an; die Aktionspotentiale im Vorhof sind allerdings deutlich kürzer als im Ventrikel. · Die Aktionspotentiale in den terminalen Purkinje-Fasern haben eine besonders lange Plateauphase und damit auch Refraktärität, so dass sie als ¹Frequenzfilterª für die Erregungsübertragung auf die Ventrikel wirken. · Im ventrikulären Myokard gibt es ebenfalls groûe Unterschiede in der Dauer von Aktionspotentialen. Die Aktionspotentiale im subendokardialen Myokard sind manchmal zweimal so lang wie die im subepikardialen Myokard. l l l Eine Hierarchie in der spontanen Erregungsbildung bestimmt die Erregungsleitung Erregungsbildung. Unter Normalbedingungen ist der Sinusknoten der bestimmende Taktgeber für die elektrische Automatizität im Herzen: In ihm erfolgt die Spontandepolarisation am schnellsten, und die von ihm ausgehende Erregung kommt in den tiefer gelegenen Anteilen des Erregungsleitungssystems an, bevor diese die eigene Schwelle für die spontane Bildung eines Aktionspotentials erreichen. Auf diese Weise entsteht eine Hierarchie der Schrittmacher (Abb. 6-9 b). Ist die Überleitung zwischen den verschiedenen Anteilen des Erregungsleitungssystems unter pathophysiologischen Bedingungen unterbrochen, lässt sich die Eigenfre154 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* quenz dieser Schrittmacher beobachten. Die Eigenfrequenz des nicht innervierten Sinusknotens liegt bei 60±80 min±1, die des AV-Knotens bei 40±50 min±1 und die von His-Bündel und Kammerschenkeln bei 30±40 min±1. Den Sinusknoten nennt man den primären Schrittmacher, den AV-Knoten den sekundären Schrittmacher, und eine spontane Erregungsbildung unterhalb des AV-Knotens wird als tertiärer Schrittmacher bezeichnet. Erregungsleitung. Bei einer normalen Erregung des Herzens durch den Sinusknoten dauert es etwa 60 ms, bis die Erregung das Vorhofmyokard durchlaufen hat und den AV-Knoten erreicht (Leitungsgeschwindigkeit ca. 0,5 m s±1). Der AVKnoten stellt ein Verzögerungsglied in der Erregungsleitung dar (ca. 0,1 m s±1), die Überleitung durch den AV-Knoten beträgt wiederum etwa 60 ms. Wegen dieser Verzögerung kann die Kontraktion des Vorhofs zum Abschluss kommen, bevor die Erregungswelle das ventrikuläre Myokard zur Kontraktion bringt. Die Strecke vom His-Bündel bis zu den PurkinjeFasern wird sehr schnell durchlaufen, in ca. 20 ms (ca. 1±3 m s±1). Die Ausbreitung der Erregung über die ventrikuläre Arbeitsmuskulatur braucht wieder ca. 60 ms (ca. 0,5 m s±1). Dadurch, dass die Erregungsausbreitungszeit im Arbeitsmyokard deutlich kürzer als die Refraktärzeit der Arbeitsmuskelzelle ist, führt die über das Leitungssystem übergeleitete Erregung nur zur einmaligen Aktivierung des Arbeitsmyokards. Die Refraktärzeit der atrialen Herzmuskelzellen beträgt ca. 200 ms, die der ventrikulären Muskelzellen ca. 300 ms. Diesen Zeiten stehen jeweils ca. 60 ms für die Zeit der Erregungsausbreitung in Atrien und Ventrikeln gegenüber. l l l Störungen des normalen Herzrhythmus nennt man Arrhythmien. Sie können in Form von Extrasystolen, bradykarden oder tachykarden Rhythmusstörungen vorkommen Störungen des Herzrhythmus. Zellen des Erregungsbildungs- und Erregungsleitungssystems bilden auch beim Gesunden gelegentlich atypische Einzelerregungen, die man Extrasystolen nennt, wenn sie eine Ventrikelkontraktion auslösen. Vorübergehende oder anhaltende Störungen des Herzrhythmus unterteilt man in bradykarde (Herzschlag zu langsam) und tachykarde Rhythmusstörungen (Herzschlag zu schnell). Bradykarde Störungen haben ihre Ursache entweder in den Schrittmachern oder in der Erregungsausbreitung. Bei einem starken Vagotonus kommen sogar beide Arten von Ursachen einer Bradykardie zusammen. Störungen der Erregungsausbreitung im Erregungsleitungssystem nennt man ¹Blockª (z. B. AV-Block, Kammerschenkelblock). Tachykarde Störungen unterteilt man nach der Herzfrequenz in (Kammer- oder Vorhof-) Flattern (200±350 min±1) und Flimmern (> 350 min±1). Ventrikuläre Tachykardien sind mit einer normalen Pumpfunktion des Herzens nicht vereinbar, da die Zeiten zur Kammerfüllung und -entleerung zu kurz werden. Ein flimmernder Ventrikel steht hämodynamisch still. Folgende Ursachen von Tachyarrhythmien lassen sich unterscheiden: · Tachyarrhythmien, die durch erhöhte Automatizität ausgelöst werden. Ursache ist in der Regel eine zu hohe automatische Spontanaktivität von Schrittmacherzellen des Erregungsbildungs- und Erregungsleitungssystems. Therapeutisch kommen deshalb Substanzen zum Einsatz, die die Spontandepolarisation von Schrittmacherzellen verlangsamen und ihr Schwellenpotential für das Entstehen eines Aktionspotentials erhöhen. Dies sind beides antagonistische Wirkungen zum Sympathikus. Deshalb stellen b-Blocker, Antagonisten an den myokardialen b-Adrenorezeptoren, wirksame Antiarrhythmika dar. · Tachyarrhythmien, die durch kreisende Erregung ausgelöst werden. Kreisende Erregung in der Ventrikelmuskulatur kann entstehen, wenn die Ausbreitung der elektrischen Erregung in Teilen der Ventrikelmuskulatur verzögert ist, so dass sie nach Durchlaufen dieses Myokardareals auf bereits wieder erregbares, d. h. nicht-refraktäres Myokard trifft. Eine Strategie, solche Arrhythmien zu verhindern, besteht darin, die Refraktärzeit des normalen Myokards zu verlängern. Dies lässt sich z. B. durch Substanzen erreichen, die den repolarisierenden Kaliumstrom des Aktionspotentials hemmen. · Tachyarrhythmien, die durch getriggerte Aktivität ausgelöst werden. Wenn die normale Repolarisation am Ende eines Aktionspotentials in Arbeitsmuskelzellen verzögert ist, kann es zu spontanen Schwankungen des Membranpotentials am Ende oder im Nachlauf des Aktionspotentials kommen, die in der betroffenen Zelle oder in Nachbarzellen ein erneutes Aktionspotential auslösen. Auf diese Weise können einzelne oder auch ganze Serien irregulärer Erregungen ausgelöst werden. Damit wird die gestörte Arbeitsmuskelzelle zu einem irregulären Schrittmacher. Eine pharmakologische Therapie dieser Tachyarrhythmien ist schwierig. Das therapeutische Vorgehen wird sich zunächst darauf konzentrieren, mögliche Ursachen der Zellstörung (z. B. Elektrolytstörungen, Medikamententoxizität) zu beseitigen. é Box 6-3. Elektrotherapie von Herzrhythmusstörungen Elektrische Schrittmacher nennt man Geräte, die das Herz durch abgegebene Stromstöûe erregen, um einen gestörten Herzrhythmus zu normalisieren. Bei dauerhaft getragenen Schrittmachern wird normalerweise die kleine elektronische Steuereinheit subkutan implantiert und der Reiz über eine transvenöse Elektrode auf das Myokard des rechten Ventrikels übertragen. Bei bradykarden Rhythmusstörungen übernimmt der elektrische Schrittmacher die Rolle des herzeigenen Schrittmachers. Eine elektrische Stimulation des Herzens kann auch Tachyarrhythmien unterbrechen. Die Elektrostimulation erzeugt eine homogene Depolarisation des Myokards, nach deren Abklingen häufig wieder ein normaler Erregungsablauf einsetzt. Bei Kammerflattern wird der depolarisierende Strompuls gleichzeitig mit dem EKG-Signal der Kammererregung (Abschn. C 6-5) appliziert (Kardioversion). Bei Kammerflimmern ist keine Triggerung durch das EKG möglich. Dann ist ein gröûerer Stromplus nötig, um eine möglichst homogene Myokarddepolarisation zu erreichen (Defibrillation). Bei Patienten mit pharmakologisch nicht beherrschbaren Tachyarrhythmien wird heute häufig ein schrittmacherartiger Stimulator implantiert, der bei Auftreten von Tachyarrhythmien automatisch einen depolarisierenden Strompuls abgibt (implantierbarer Kardioverterdefibrillator, ICD). In Notfallsituationen kann auch ein ¹Elektroschockª (Defibrillation) über extern angelegte Elektroden transthorakal appliziert werden. 6.5 Sinusknoten und AV-Knoten im rechten Vorhof sowie das ventrikuläre Erregungsleitungssystem steuern die elektrische Herzerregung. Schrittmacherzellen bilden spontan Aktionspotentiale (Automatizität). In Schrittmacherzellen wird das Aktionspotential vom langsamen Calciumstrom getragen, der schnelle Natriumstrom wird nicht aktiviert (Calciumaktionspotential). Es gibt kein stabiles Ruhemembranpotential; nach einem Potentialminimum von 60 mV depolarisieren die Zellen spontan wieder. Die Geschwindigkeit der Spontandepolarisation bestimmt den Eigenrhythmus des Schrittmachers. Sympathikusaktivierung beschleunigt den Eigenrhythmus durch eine Beschleunigung der Spontandepolarisation, Parasympathikusaktivierung bremst den Eigenrhythmus durch eine entgegengesetzte Wirkung. Die Erregung des Herzens entsteht normalerweise im Sinusknoten und erreicht über die Vorhofmuskulatur den Atrioventrikularknoten. Im Ventrikelseptum läuft sie über das His-Bündel in die Kammerschenkel. Über die Purkinje-Fasern greift sie auf das Arbeitsmyokard über. Im Erregungsbildungs- und -leitungssystem gibt es eine durch die Geschwindigkeit der Zellen bestimmte Hierarchie potentieller Schrittmacher. Normalerweise dominiert als schnellster Schrittmacher der Sinusknoten. Die Erregungsausbreitung wird zwischen Vorhöfen und Ventrikeln im AV-Knoten stark verzögert, um deren Kontraktionen zeitlich zu trennen. Die Zeit für die Erregungsausbreitung in der Kammermuskulatur ist deutlich kürzer als deren Refraktärzeit. Dadurch wird jeder Erregungszyklus spontan beendet. Das Elektrokardiogramm PH l l l Die Erregung des Herzmuskels erzeugt ein veränderliches elektrisches Feld im Extrazellulärraum. Dies wird mit dem EKG aufgezeichnet Ursprung des EKGs. Bei der elektrischen Erregung der Herzmuskelzellen verändert sich deren Membranpotential (transmembranäre Spannung), wenn ein Aktionspotential entsteht. Um das Membranpotential einer Zelle zu messen, muss man eine intrazelluläre Ableitung durchführen, bei der eine Ableitungselektrode in das Zellinnere geschoben wird und die Spannung gegenüber einer extrazellulären Referenzelektrode bestimmt wird. Bei elektrokardiographischen Aufzeichnungen wird eine grundsätzlich andere Messgröûe erfasst. Hier werden Veränderungen im Extrazellulärraum oder an der Körperoberfläche aufgezeichnet, d. h. die Elektroden, zwischen denen eine Spannung registriert wird, liegen extrazel6.5 Das Elektrokardiogramm Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* p 155 Spannung Feld- + vektor elektrische Feldlinien + + + + + + + + + Zelle nicht erregt + + + Zelle erregt (depolarisiert) + + + + + Gap Junction + a nicht erregt erregt Teilvektor linker Ventrikel Teilvektor rechter Ventrikel Summationsvektor b Spannung in Ableitelinie 1 Ableitelinie 1 Spannung in Ableitelinie 2 Summationsvektor Ableitelinie 2 c lulär. Zwischen der elektrokardiographischen und der intrazellulären Ableitung von Erregungsvorgängen im Herzen besteht allerdings ein indirekter Zusammenhang. Bei der Erregung einer Herzmuskelzelle flieûen Kationen, d. h. positive Ladungen, von der Zelloberfläche in das Zellinnere ab. Dadurch wird die elektrisch erregte Herzmuskelzelle an ihrer Oberfläche im Vergleich zu einer benachbarten, noch nicht erregten Zelle relativ negativ geladen. Durch diese Ladungsunterschiede entsteht im extrazellulären Raum ein elektrisches Feld. 156 Abb. 6-11. (a) Entstehung eines elektrischen Dipolfelds im Extrazellulärraum an der Grenze zwischen einer erregten und einer nicht-erregten Myokardzelle. Die Auûenseite der erregten Zelle ist im Vergleich zu einer nicht-erregten Nachbarzelle negativ geladen (unten). Dadurch entsteht auf kurzer Distanz ein elektrischer Ladungsunterschied im Extrazellulärraum, der sich vereinfacht als Dipol betrachten lässt (oben). (b) Vektoraddition von Teilvektoren der elektrischen Herzerregung. Bei Ausbreitung der Erregungsfront über das Ventrikelmyokard kann man den elektrischen Vektor, der bei Erregung des linken Ventrikels entsteht, getrennt von dem Vektor für den rechten Ventrikel betrachten. Zusammen ergeben sie nach den Regeln der Vektoraddition von Kräften einen gemeinsamen Summationsvektor beider Ventrikel. (c) Die Spannung zwischen zwei Messpunkten (Ableitungslinie) ist proportional zu der senkrechten Projektion des Summationsfeldstärkevektors auf die jeweilige Ableitungslinie b Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* l l l Eine Erregungsfront im Myokard bildet eine Front elementarer Dipole, deren Feldstärkevektoren sich zu einem Summationsvektor addieren Summationsvektor der elektrischen Feldstärke. Betrachtet man die Oberflächenladung einer erregten Zelle und einer nicht-erregten Nachbarzelle, so handelt es sich um das elektrische Feld eines Dipols (Abb. 6-11 a, Abschn. A-1.5). Auf eine Punktladung, die in das elektrische Feld eines Dipols eingebracht wird, wirkt eine gerichtete Kraft (Kraftvektor), die so genannte elektrische Feldstärke (Feldstärkevektor). Der Feldstärkevektor ist auf der räumlichen Verbindungsgeraden zwischen den beiden Ladungen des Dipols am gröûten. In der Elektrokardiographie wird die Richtung von der negativen zur positiven Ladung positiv gezählt (Pfeilspitze des Vektors). Der elektrische Feldvektor zwischen einer erregten und einer nicht-erregten Zelle zeigt deshalb in Richtung der nicht-erregten Zelle. Die Spannung zwischen zwei Punkten (Elektroden), die sich im Raumfeld eines solchen elektrischen Dipols befinden und damit ein elektrisches Potential besitzen, ist proportional zur senkrechten Projektion des elektrischen Feldvektors auf die Verbindungsgerade der beiden Punkte. Physikalisch synonym zu ¹Spannungª ist der in der Physiologie gebräuchliche Ausdruck ¹Potentialdifferenzª. Steht also der Feldstärkevektor senkrecht zur Verbindungsgeraden der beiden Punkte, so besitzen beide das gleiche elektrische Potential, die Spannung (Potentialdifferenz) ist daher Null. Verläuft der Feldstärkevektor parallel zur Verbindungsgeraden, so ist die Potentialdifferenz zwischen beiden Punkten maximal. Allgemein gilt, dass die Spannung zwischen den beiden Punkten proportional ist zum Produkt aus Feldstärke und dem Cosinus des Winkels, den die Verbindungsgerade zwischen den Punkten und der Feldstärkevektor miteinander einschlieûen. Die Erregung breitet sich über die verschiedenen Strukturen des Herzens in einer geordneten Welle aus. Dadurch werden einander seitlich benachbarte Zellen etwa gleichzeitig erregt und bilden so mit ihren jeweils noch nicht erregten weiteren Nachbarzellen eine Front nebeneinander liegender Dipole. Die elektrischen Feldstärkevektoren dieser einzelnen Dipole addieren sich nach der Vektoraddition von Kräften zu einem elektrischen Summationsvektor. Dieser ist umso gröûer, je mehr Myokardzellen in die Erregungsfront eingeschlossen sind, da dann umso mehr einzelne Dipole in die Summation eingehen. Nach der Vektoraddition ist der Summationseffekt dann besonders groû, wenn die Erregungsfront gerade verläuft und so über die gesamte Erregungsfront die Elementarvektoren der einzelnen Dipole alle in die gleiche Richtung weisen. Deshalb ergibt sich immer dann ein groûer elektrischer Summationsvektor bei der Ausbreitung der elektrischen Erregung, wenn ein groûer Myokardbereich (viele Zellen) mit einer möglichst gradlinig ausgerichteten Erregungsfront erregt wird. Der resultierende Summationsvektor fällt damit für groûe Strukturen wie die Vorhöfe und Ventrikel gröûer aus als für die relativ zellarmen Teile des Erregungsbildungs- und Erregungsleitungssystems. Werden zwei Strukturen gleichzeitig erregt wie der linke und rechte Ventrikel, wird die Erregung des zellreichen linken Ventrikels die Gesamtrichtung des resultierenden gemeinsamen Summationsvektors sehr viel deutlicher bestimmen als die gleichzeitige Erregung des zellarmen rechten Ventrikels (Abb. 6-11 b). Störungen der Erregungsausbreitung, z. B. in Narbenoder Ischämiearealen, verhindern die Erregungsausbreitung in einer gradlinigen Front. Deshalb kommt bei Erregung solcher geschädigten Gewebsanteile meist nur ein kleinerer Summationsvektor als normalerweise zustande. Die zeitliche Koinzidenz von vollständig erregten Vorhöfen und noch unerregten Ventrikeln erzeugt nicht das elektrische Feld eines Dipols, da die Ladungsunterschiede in Vorhöfen und Ventrikeln durch die bindegewebige Ventilebene elektrisch voneinander isoliert sind. l l l In EKG-Ableitungen werden verschiedene Projektionen des elektrischen Summationsvektors des erregten Herzens auf die Körperoberfläche in Form von Spannungsmessungen registriert Projektionen des elektrischen Summationsvektors. Zu jedem Zeitpunkt der Erregungsausbreitung und -rückbildung geht vom Herzen ein elektrischer Summationsvektor aus, dessen Richtung und Gröûe im dreidimensionalen Raum zeitlich variiert. Die für die Routine-Elektrokardiographie gebräuchlichen Konfigurationen von Ableitungselektroden greifen dieses räumlich veränderliche elektrische Feld entweder in der Frontalebene oder in der Horizontalebene ab. Mit den Ableitungselektroden wird die Spannung zwischen den jeweiligen Ableitungspunkten gemessen. Diese Spannung ist proportional zur Projektion des dreidimensionalen elektrischen Summationsvektors auf die Verbindungslinie zwischen den Ableitungspunkten (s. o., Abb. 6-11 c). Planar angeordnete Elektrodenkonfigurationen können nur die Projektionen des dreidimensionalen Vektors in der jeweiligen Ableitungsebene registrieren. Da die verschiedenen EKG-Ableitungen nur verschiedene Projektionen des gleichen veränderlichen dreidimensionalen Summationsvektors darstellen, enthalten sie zeitgleiche Anteile, die der Erregung der Vorhöfe, der Ventrikel und der Repolarisation des Herzens entsprechen. l l l Im EKG-Signal kann man die Erregung von Vorhöfen und Kammern und deren zeitliche Kopplung differenzieren EKG-Signal. Im EKG-Signal (Abb. 6-12 a) eines normalen Erregungsablaufs unterscheidet man rein formal folgende Abschnitte: Ausschläge von der Nulllinie in Form von Wellen oder Zacken und Abschnitte der Nulllinie zwischen benachbarten Wellen oder Zacken, die Strecken genannt werden. Zeitliche Abschnitte, die Wellen oder Zacken und Strecken zusammenfassen, nennt man Intervalle. Die Nulllinie nennt man auch ¹die Isoelektrischeª. Im EKG wird die elektrische Erregung des Herzens als erstes in der P-Welle sichtbar, die durch Erregung der Vorhöfe zustande kommt. Da nur während der Erregungsausbreitung ein signifikanter elektrischer Feldvektor zustande kommt, wird nach vollständiger Erregung des Vorhofs die Nulllinie wieder erreicht und es schlieût sich die PQ-Strecke an. Während der Zeit der PQ-Strecke durchläuft die Erregung den AV-Knoten und das His-Bündel. Ein Übergreifen der Erregung auf Teile des Septums führt zur Q-Zacke. Der normale Erregungsaufbau in der Ventrikelmuskulatur drückt sich in Form von drei aufeinander folgenden Zacken im EKG aus (Q, R und S). Das unterschiedliche Vorzeichen dieser drei Zacken ist darin begründet, dass die Richtung des elektrischen Summationsvektors bei der Ventrikelerregung mehrfach seine räumliche Orientierung wechselt. Die Q-Zacke spiegelt wider, dass zu Beginn der Erregungsausbreitung Teile des Septums in Richtung zur Herzbasis erregt werden. Wird die Masse der Ventrikelmuskulatur erregt, erfolgt dies von den Innenschichten zu den Auûenschichten. Der Summationsvektor weist im Normalfall zunächst in Richtung der Herzspitze (R-Zacke), am Ende kurzzeitig in Richtung der Herzbasis (S-Zacke). Ist der gesamte Ventrikel elektrisch erregt, wird der elektrische Summationsvektor wiederum Null und das EKG-Signal verläuft auf der isoelektrischen Linie. Dieser folgende Abschnitt heiût ST-Strecke. Eine Erregungsfront im Ventrikelmyokard entsteht erst wieder bei der Rückbildung der Erregung, bedingt durch die Repolarisation der Einzelzellen. Diese Rückbildung verläuft ebenfalls in einer recht geordneten Weise. Die Zellen, die als letzte erregt wurden, haben in der Regel die kürzesten Aktionspotentiale, d. h. sie repolarisieren als erste. Das liegt an Unterschieden in der Expression der beteiligten Ionenkanäle. Die Rückbildung der Erregung beginnt in den Auûenschichten des Myokards und läuft auf die Innenschichten zu. Es entsteht die T-Welle. In den meisten Ableitungen hat die TWelle das gleiche Vorzeichen wie die R-Zacke, was darauf zurückzuführen ist, dass der Weg der Repolarisation ungefähr den Weg des Erregungsaufbaus zurückverfolgt. Manchmal wird nach der T-Welle noch eine weitere Auslenkung (U-Welle) registriert, deren Entstehung der Repolarisation in den Purkinje-Fasern zugeschrieben wird. Es ist zu beachten, dass bei Störungen der Erregungsausbreitung in den Ventrikeln die Hauptausbreitungsrichtung der Erregung verändert sein kann, so dass Q- bzw. S- Zacken deutlich gröûer als die zugehörige R-Zacke werden können. 6.5 Das Elektrokardiogramm Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 157 U-Welle inkonstant T-Welle ST-Strecke QRS-Gruppe PQ-Strecke P-Welle Abb. 6-12. (a) Nomenklatur und Zeitdauer der Abschnitte des EKG-Signals. Gezeigt ist eine Registrierung, wie sie typischerweise in Ableitung II nach Einthoven auftritt. (b) Elektrodenschaltung und exemplarische Ableitungen I, II, III nach Einthoven. (c) Elektrodenschaltung und exemplarische Ableitungen aVR, aVL, aVF nach Goldberger. (d) Brustwandableitungen und exemplarische Ableitung V1±V6 nach Wilson b R l l l Die verschiedenen Standard-EKGAbleitungen repräsentieren Teilprojektionen des dreidimensionalen elektrischen Feldvektors in der Frontaloder Horizontalebene des Körpers T (U) P Q S < 0,1 s < 0,1 s QT-Intervall frequenzabhängig bei 70 min–1 0,32–0,39 s PQ-Intervall < 0,2 s a Ableitungen nach Einthoven I I II III II III b Ableitungen nach Goldberger aVR R L aVL aVF F aVR aVL aVF Ableitungen nach Wilson c V1 V2 V3 V4 V1 V2 V5 V3 V4 V5 V6 Medioklavikularlinie V6 d 158 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 100 ms Ableitung nach Einthoven (Abb. 6-12 b). Dabei wird die Spannung zwischen je zwei Elektroden bestimmt, die an drei Extremitäten angelegt werden (Ableitung I: linker gegen rechten Arm; Ableitung II: linkes Bein gegen rechten Arm; Ableitung III: linkes Bein gegen linken Arm). Zum Verständnis dieser Ableitungsformen kann man sich die Extremitäten als elektrolytgefüllte Leiter vorstellen, die die Konfiguration des elektrischen Felds von drei Eckpunkten des Rumpfs (oben rechts, oben links, unten) auf die Ableitungspunkte übertragen, an denen die Elektroden angebracht sind. Noch weiter vereinfacht definieren diese Eckpunkte ein gleichseitiges Dreieck, das so genannte Einthoven-Dreieck (Abb. 6-13 a), in der Frontalebene des Körpers. In den Ableitungen I, II und III werden die jeweiligen linearen Projektionen der Bewegung des elektrischen Summationsvektors in der durch das Dreieck definierten frontalen Ableitungsebene des Körpers bestimmt. Am rechten Bein wird bei dieser Ableitungsform und den im Folgenden genannten Ableitungen eine Erdungselektrode am Körper angelegt, die nicht der Registrierung dient. Ableitung nach Goldberger (Abb. 6-12 c). Bei dieser Ableitungsform wird die Spannung zwischen jeweils einem Eckpunkt des Einthoven-Dreiecks und der Zusammenschaltung der zwei anderen Eckpunkte bestimmt (sog. pseudounipolare Ableitungen). Durch den Zusammenschluss wird ein virtueller zweiter Ableitungspunkt in der Mitte des Dreieckschenkels gebildet, der dem abgeleiteten Eckpunkt gegenüberliegt. Damit ergeben sich wiederum lineare Projektionen für den elektrischen Summationsvektor in der Frontalebene. Die Projektionsrichtungen, die durch die Goldberger-Ableitungen definiert werden, kann man sich als Winkelhalbierende im Einthoven-Dreieck vorstellen, wobei ein elektrischer Summationsvektor, der auf die jeweilige Extremität zuläuft, in der dazugehörigen Ableitung einen positiven Ausschlag gibt (Abb. 6-13 b). Dies hat zur Namensgebung des Ableitungstyps geführt. Sie werden als aVR (Ableitung vom rechten Arm), aVL (Ableitung vom linken Arm) und aVF (Ableitung vom linken Fuû) bezeichnet, wobei ¹aVª für ¹augmented voltageª (verstärkte Spannung) steht. Die Verstärkung besteht dabei in der speziellen Elektrodenverschaltung, durch die die jeweilige Spannung um den Faktor 1,5 gröûer wird als bei einer Messung gegen eine echte Nullelektrode als Bezugselektrode. Einthoven Goldberger aVR aVL I II III a aVF b Cabrera-Kreis –90° –120° –60° aVL aVR –30° –150° +180° 0° +30° +150° Linkstyp I – aVR + 60° +120° III Rechtstyp Horizontaltyp + 90° II aVF Normaltyp Steiltyp c Abb. 6-13. (a) Darstellung der Projektionen der Einthoven-Ableitungen als Einthoven-Dreieck. (b) Darstellung der Projektionen der Goldberger-Ableitungen als Winkelhalbierende im Einthoven-Dreieck. (c) Polarographische Darstellung der Extremitätenableitungen (Cabrera-Kreis). Den Ableitungsrichtungen werden Winkel der Abweichung von der Horizontalen zugeordnet Cabrera-Kreis. In der Frontalebene ergeben die sechs einzelnen Ableitungen nach Einthoven und Goldberger Informationen über sechs Richtungsprojektionen des elektrischen Summationsvektors in dieser Ebene. Man kann die sechs Ableitungsrichtungen parallelverschoben auch in einem gemeinsamen Mittelpunkt zusammenfassen. Dann ergibt sich ein Polarogramm mit einer Unterteilung in Winkel von 30, der so genannte Cabrera-Kreis (Abb. 6-13 c). Viele Sechskanal-EKG-Geräte besitzen eine Funktion, in der die Ableitungen nach Einthoven und Goldberger dem Cabrera-Kreis im Uhrzeigersinn folgend aufgezeichnet werden. Den Ableitungen wird dabei eine Winkelabweichung von der Horizontalen (I) zugeordnet. Diese Zuordnung sieht dann wie folgt aus: 30 aVL; 0 I; 30 aVR; 60 II; 90 aVF; 120 III. Die Richtung des maximalen elektrischen Summationsvektors nennt man elektrische Herzachse. Wenn das Maximum des elektrischen Summationsvektors in einen dieser Winkelbereiche fällt, ist dies dadurch erkennbar, dass auf den jeweils benachbarten Ableitungen die gröûten QRS-Zacken auftreten. Den Winkelbereich, auf dem sich die elektrische Herzachse in der Frontalebene projiziert, charakterisiert man auch durch so genannte Lagetypen (Abb. 6-13 c). Die elektrische Herzachse wird ganz wesentlich von der Masse des zu erregenden Ventrikelmyokards und der relativen Lage des Herzens im Körper bestimmt. Die Bestimmung des Lagetyps ist deshalb ein wichtiger diagnostischer Parameter der EKG-Analyse. Am häufigsten findet man bei jungen Herzgesunden einen so genannten Normal- oder Indifferenztyp (30 bis 60). Eine Linksherzhypertrophie kann z. B. Ursache für einen Horizontaltyp (0 bis 30) bzw. Linkstyp ( 30 bis 0) sein. Ein Linkstyp kann auch physiologischerweise in der Schwangerschaft entstehen, wenn bei hochgestelltem Zwerchfell das Herz angehoben wird. Ein Steiltyp (60 bis 90) oder Rechtstyp (90 bis 120) kann Folge einer Rechtsherzhypertrophie sein. Es gibt auch pathologische Lagetypen (überdrehter Linkstyp, überdrehter Rechtstyp), bei denen die gröûten R-Zacken im Winkelbereichen < 30o oder > 120o auftreten. Ableitung nach Wilson. Da sich der elektrische Summationsvektor im Raum bewegt, werden weitere Ableitungen gebraucht, um seine Projektion in der Horizontalebene zu registrieren. Die hierfür verwendeten Brustwandableitungen nach Wilson (Abb. 6-12 d) sind unipolar. Von einer differenten Elektrode wird gegen die Zusammenschaltung von drei Extremitätenableitungen (Nullelektrode) registriert. Durch die Zusammenschaltung ergibt sich ein virtueller Referenzpunkt in der Mitte des Einthoven-Dreiecks und d. h. auch in der Mitte des Thorax. Diese Ableitungen zeigen daher einen positiven Ausschlag, wenn der Summationsvektor vom Thoraxmittelpunkt auf ihren Ableitungspunkt zuläuft, einen negativen Ausschlag, wenn er davon wegläuft. Es werden sechs Ableitungen (V1±V6) um den vorderen und linkslateralen Thorax in Herzhöhe platziert. Sie liegen damit an der Körperwand vor dem rechten Ventrikel (V1, V2), der Vorderwand des linken Ventrikels (V3, V4, V5) und der Hinterwand des linken Ventrikels (V6). Da der elektrische Summationsvektor seinen gröûten Ausschlag im Raum normalerweise in einer Ausrichtung von hinten oben rechts nach vorne unten links einnimmt, findet man für die horizontale Projektion die gröûte R-Zacke normalerweise in V4. Vektorkardiographie. Fasst man zwei Ableitungen aus der Frontalebene mit einer Ableitung aus der Horizontalebene zusammen, kann man ein dreidimensionales Bild des elektrischen Summationsvektors konstruieren (Vektorkardiographie). Ein rechtwinkliges Koordinatensystem ergibt sich angenähert bei Verwendung der Ableitungen I, aVF und V2. l l l Eine einfache Analyse des EKG-Signals gibt bereits Auskunft über mögliche Störungen des Schrittmachers, der atrioventrikulären Erregungsüberleitung und der Erregungsausbreitung in den Ventrikeln Grundlagen der Interpretation des EKG. Aus der Auswertung einer einzigen EKG-Ableitung (z. B. Einthoven II, wie in Abb. 6-14) lässt sich häufig schon Wichtiges lernen: Aus der zeitlichen Abfolge der QRS-Komplexe lässt sich feststellen, ob diese mit einem regelmäûigen Rhythmus erscheinen oder ob Rhythmusstörungen (Arrhythmien) vorliegen. Wenn regelmäûig jedem QRS-Komplex eine positive P-Welle in konstantem Abstand vorausgeht, handelt es sich um einen Sinusrhythmus. Wenn keine P-Wellen auftreten oder wenn 6.5 Das Elektrokardiogramm Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 159 1 mV –1 Sinusrhythmus (65 min ) a P P 0,2 s P P P P AV-Block 2. Grades b P P P P P P P P AV-Block 3. Grades c Abb. 6-14. EKG-Registrierung (II nach Einthoven). (a) Sinusrhythmus (65 min±1). (b) Atrioventrikularblock 2. Grades, d. h. bei regelmäûigem Sinusrhythmus (P-Wellen in konstantem Abstand) fallen einzelne Kammererregungen aus (QRS-Komplexe fehlen). (c) Atrioventrikularblock 3. Grades, d.h. bei regelmäûigem Sinusrhythmus findet keine Erregungsüberleitung auf die Ventrikel statt. Der Kammerrhythmus (35 min±1) ist unabhängig vom Sinusrhythmus (65 min±1). Die Kammerkomplexe des EKGSignals sind verformt P-Wellen und QRS-Komplexe zeitlich nicht synchronisiert sind, dann folgt der Ventrikel einem anderen Schrittmacher. Ist die P-Welle verformt oder über 0,1 s verlängert, gibt es Überleitungsstörungen im Vorhofmyokard. Das PQ-Intervall ± gerechnet vom Beginn der P-Welle bis zum Beginn des QRS-Komplexes ± sollte nicht länger als 0,2 s sein. Gröûere PQ-Intervalle deuten auf Überleitungsstörungen im Bereich der Vorhöfe oder, sehr viel häufiger, auf Überleitungsstörungen im Bereich des AV-Knotens hin. Die Aufspaltung des QRS-Komplexes in weitere Zacken und Verlängerung über eine Gesamtdauer von 0,1 s weisen auf Störungen der Erregungsausbreitung im ventrikulären Myokard hin, die entweder durch Störungen in den Kammerschenkeln des Erregungsleitungssystems oder durch Leitungsstörungen im Arbeitsmyokard begründet sein können. Die ST-Strecke liegt normalerweise auf der Isoelektrischen. Eine transmurale Myokardischämie führt häufig zu einer Anhebung der ST-Strecke. Dies ist darauf zurückzuführen, dass unter diesen Umständen keine gleichmäûige Depolarisation des Ventrikelmyokards während der Kammererregung erreicht wird, da die Bildung der Aktionspotentiale im ischämischen Gewebe gestört ist. Nach vollständiger Erregung des gesunden Anteils im Kammermyokard bleibt ein Ladungsunterschied und damit ein elektrischer Feldvektor übrig. Daher erreicht das EKG-Signal nicht die Nulllinie. Das QT-Intervall, gerechnet vom Beginn des QRS-Komplexes bis zum Ende der T-Welle, sollte bei einer Herzfrequenz von 60 min±1 nicht mehr als 0,4 s betragen. Das QT-Intervall nimmt mit steigender Frequenz ab. Das liegt daran, dass sowohl die Herzfrequenz als auch die ventrikuläre Erregungs160 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* ausbreitung unter der Kontrolle des Sympathikus stehen. Ein verlängertes QT-Intervall weist auf Erregungsbildungs- oder Erregungsrückbildungsstörungen in den Ventrikeln hin. Arrhythmien. Störungen des normalen Herzrhythmus können ganz unterschiedliche Formen aufweisen, die sich anhand des EKG unterscheiden lassen. Nach Ort der Entstehung der Arrhythmie unterscheidet man supraventrikuläre und ventrikuläre Arrhythmien. Auch ohne besonderen Krankheitswert treten gelegentlich Extrasystolen auf. Hierbei handelt es sich um Extraschläge, deren Erregungsursprung im Vorhof (supraventrikulär) oder im Ventrikel (ventrikulär) liegen kann. Auf ventrikuläre Extrasystolen folgt wegen der Refraktärzeit des Ventrikels häufig eine postextrasystolische Pause, nach der dann ein ganz normaler Rhythmus fortgesetzt wird. Krankheitswert haben atrioventrikuläre Überleitungsstörungen. AV-Block ersten Grades nennt man eine Verlängerung der normalen atrioventrikulären Überleitungszeit, die an einer Verlängerung des PQ-Intervalls zu erkennen ist (> 0,2 s). Beim AV-Block ersten Grades ist der Herzrhythmus normal. Eine Arrhythmie tritt beim AV-Block zweiten Grades (Abb. 6-14 b) auf. Hierbei kommt es zu gelegentlichen Ausfällen der Erregungsüberleitung aus den Vorhöfen mit einer begleitenden Pause der Ventrikelerregung. Beim AVBlock dritten Grades (Abb. 6-14 c) besteht eine völlige elektrische Dissoziation zwischen Vorhöfen und Ventrikeln. Dies kann nur dann überlebt werden, wenn ein tertiärer Schrittmacher die ventrikuläre Erregung übernimmt. Deshalb findet man hierbei P-Wellen und QRS-Komplexe ohne zeitliche Kopplung. é Mit dem EKG werden Veränderungen des extrazellulären elektrischen Felds registriert, die durch Ladungsunterschiede zwischen erregtem und nicht-erregtem Myokard hervorgerufen werden. Die Erregungsausbreitung in den Vorhöfen erzeugt im EKG die PWelle, die in den Ventrikeln den QRS-Komplex. Die Erregungsrückbildung in den Ventrikeln führt zur T-Welle. Extremitätenableitungen nach Einthoven und Goldberger zeigen Projektionen des veränderlichen elektrischen Summationsvektors des Herzens auf Richtungsgeraden in der Frontalebene des Körpers. Diese Richtungsgeraden lassen sich in einem Strahlenkranz mit 30-Winkelteilung zusammenfassen (Cabrera-Kreis). Aus der Lage der gröûten R-Zacken ergibt sich der elektrische Lagetyp des Herzens. Die Wilson-Ableitungen stellen die elektrischen Projektionen in der Horizontalebene dar. Durch zwei Ableitungen aus der Frontalebene und eine Ableitung aus der Horizontalebene kann man den dreidimensionalen elektrischen Summationsvektor rekonstruieren. Eine einfache EKG-Analyse der Standardableitungen ergibt bereits Informationen über: (1) Ursprung der Erregung; (2) Rhythmusstörungen; (3) Leitungsstörungen; und (4) elektrische Herzachse. p PH 6.6 Mechanik der Herzaktion l l l Linkes und rechtes Herz sind jeweils diskontinuierlich arbeitende Pumpen, deren Hauptkammern (Ventrikel) in der Diastole gefüllt und in der Systole entleert werden Phasen des Herzzyklus in den Ventrikeln. Die Ventrikel durchlaufen in jedem Herzzyklus eine Folge verschiedener Funktionsphasen (Abb. 6-15). Hier soll mit dem Ende der Füllung der Ventrikel begonnen werden. Während der Ventrikelfüllung sind die Taschenklappen der Ausflussbahnen (Pulmonalklappe, Aortenklappe) geschlossen, die Atrioventrikularklappen sind geöffnet. Durch die Ausbreitung einer ventrikuläre Systole 120 Aortendruck Druck [mmHg] 100 80 ventrikulärer Druck 60 40 Vorhofdruck 20 0 Ventrikelvolumen [mL] AB C D 120 100 80 60 1 2 3 Herzschall 4 R EKG [mV] 1 T P 0 Q 0 P S 0,1 neuen elektrischen Erregungswelle wird die Arbeitsmuskulatur zur Kontraktion gebracht, und der intraventrikuläre Druck beginnt zu steigen. Mit Beginn des Druckanstiegs und Kontraktion der Papillarmuskeln schlieûen sich die Atrioventrikularklappen. Die Kontraktion der Ventrikelmuskulatur erfolgt dann bei konstantem Füllungsvolumen. Diese Phase wird deshalb als isovolumetrische Anspannungsphase bezeichnet. Überschreitet der Ventrikelinnendruck den Druck in der Ausflussbahn, öffnen sich die Taschenklappen, und der sich kontrahierende Ventrikel wirft einen Teil des enthaltenen Blutvolumens in die Ausflussbahn aus (Schlagvolumen). Beim Erwachsenen beträgt das Schlagvolumen in körperlicher Ruhe ca. 70 mL von 130 mL Füllvolumen. Das Verhältnis von Schlagvolumen zu Füllungsvolumen wird als Ejektionsfraktion bezeichnet (hier: 54 %). Die Austreibung des Schlagvolumens geht mit einer Verkürzung der Muskelzellen einher. Der Druck im Ventrikel steigt noch weiter leicht an. Eine Kontraktion, bei der sich Kraft (Druck) und Länge (Volumen) gleichzeitig ändern, nennt man nach den Begriffen der Muskelphysiologie eine auxotone Kontraktion (Abschn. B-19.4). Deshalb heiût diese Phase die auxotone Austreibungsphase. Noch während der Austreibungsphase wird das Maximum der kontraktilen Aktivierung überschritten und die Relaxation setzt ein. Das führt zu einem Druckabfall im Ventrikel. Wenn der ventrikuläre Druck denjenigen in der Ausflussbahn unterschreitet, entsteht kurzzeitig ein Reflux von Blut in den Ventrikel. Dieser zieht die Taschenklappen zurück in eine geschlossene Position. Danach sind Ventrikel und Ausflussbahn hämodynamisch getrennt. Die Muskulatur der Ventrikel relaxiert weiter, das Ventrikelvolumen bleibt dabei zunächst konstant. Diese Phase nennt man die isovolumetrische Erschlaffungsphase. Unterschreitet der Ventrikeldruck den Druck in dem zugehörigen Vorhof, öffnen sich die Atrioventrikularklappen und die Ventrikel füllen sich erneut. Damit beginnt die nächste Füllungsphase. Anspannungs- und Austreibungsphase bilden zusammen die Systole des Ventrikels, Erschlaffungs- und Füllungsphase die Diastole des Ventrikels. Bei einem ruhigen Herzschlag von 60 min±1 entfallen zwei Drittel der Zyklusdauer auf die Diastole und ein Drittel auf die Systole. 0,2 0,3 0,4 0,5 0,6 0,7 0,8 Zeit [ms] Klappeninsuffizienz. Bei Insuffizienz von Herzklappen wird die Abfolge der Arbeitsphasen der Ventrikel gestört. Bei unvollständigem Klappenschluss einer Atrioventrikularklappe kommt es während der Ventrikelsystole zum Reflux von Blut in das Niederdrucksystem (Abschn. C-7.11) vor dem Ventrikel. Während der folgenden Diastole vergröûert sich dann die Ventrikelfüllung. Bei Insuffizienz der Klappen in den Ausflussbahnen kommt es zum diastolischen Reflux von bereits ausgeworfenem Schlagvolumen in den jeweiligen Ventrikel. In beiden Fällen ist das vorwärts transportierte Blutvolumen effektiv reduziert. Über der insuffizienten Klappe wird ein Blutvolumen pendelnd hinund hergeschoben. Im zeitlichen Mittel bedingt dies eine Volumenbelastung des Ventrikels. Abb. 6-15. Synopse von hämodynamischen Parametern des linken Ventrikels, Herzschall und EKG über einen Herzzyklus. A Beginn der isovolumetrischen Anspannung; B Beginn der auxotonen Austreibung; C Beginn der isovolumetrischen Entspannung; D Beginn der Ventrikelfüllung. Markierungen 1±4 beim Herzschall entsprechen den Herztönen 1±4 6.6 Mechanik der Herzaktion Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 161 Systole Aorta Diastole Lungenvenen linker Vorhof Sog Ventilebene Druck linke Kammer Diaphragma Abb. 6-16. Schematische Darstellung des Ventilebenenmechanismus. Während der Systole entsteht durch Tiefertreten der Ventilebene ein Sog im Vorhof. Während der Diastole schiebt sich der Ventrikel durch Anheben der Ventilebene dem Volumen im Vorhof bei geöffneter Atrioventrikularklappe entgegen l l l Heben und Senken der Ventrikelebene während des Herzzyklus wirkt wie eine Pumpe zur diastolischen Füllung der Ventrikel Die diastolische Ventrikelfüllung ist stark von der vorausgehenden Ventrikelkontraktion und nur wenig von der Vorhofkontraktion abhängig (Abb. 6-16). Während der Systole verkleinern sich die Ventrikel durch den Auswurf des Schlagvolumens. Da sie am Apex des Herzens über das Perikard am Diaphragma fixiert sind, die Herzbasis aber im Thorax beweglich ist, bewegt sich die Ventilebene systolisch auf das Diaphragma zu. Durch die Verschiebung der Vorhöfe entsteht in ihnen ein Unterdruck, und es wird Blut aus den zuführenden Venen in sie hineingesaugt. Bei der diastolischen Erschlaffung nehmen die Ventrikel wieder eine längliche Form an, die Ventilebene rückt vom Diaphragma fort. Bei Öffnung der Atrioventrikularklappen stülpt sich so ein Teil der Ventrikel über das in den vorgeschalteten Vorhöfen bereitliegende Blutvolumen. Ein weiterer Teil des Blutes folgt passiv der atrioventrikulären Druckdifferenz. Erst im letzten Drittel der Diastole kontrahieren sich die Vorhöfe. In Ruhe entfallen ca. zwei Drittel der Ventrikelfüllung auf den Ventilebenenmechanismus und den passiven Volumenfluss, nur ein Drittel auf die Vorhofkontraktion. l l l Die mechanischen Vorgänge am Herzen rufen akustische Signale (Herzschall) hervor, die man mit einem Stethoskop an der Brustwand hören kann Herztöne. Registriert man EKG, Aortenpulskurve (Abschn. C-7.6) und die vom Herzen ausgehenden Schallwellen gleichzeitig, kann man den verschiedenen Phasen der Ventrikelkontraktion charakteristische Abschnitte in diesen Registrierungen zuordnen (Abb. 6-15). Der QRS-Komplex, der im EKG den Ablauf der Ventrikelerregung widerspiegelt, 162 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* überlappt zeitlich den Beginn der Anspannungsphase. Die Anspannung des Ventrikels erzeugt im Herzschall den ersten Herzton. Dieser entsteht während der Frühphase der Kontraktion durch eine Schwingungen auslösende Umformung des Ventrikels: Am Ende der Füllungsphase ist der Ventrikel länglich; kontrahiert er sich, nimmt er eine rundere Form ein. Beginnt die Austreibungsphase, steigt der Aortendruck an, da jetzt Volumen zusätzlich in die Ausflussbahn ausgeworfen wird. Am Ende der Austreibungsphase erscheint die T-Welle im EKG, die die Repolarisation des Kammermyokards reflektiert. Der kleine Reflux am Ende der Austreibungsphase führt zu einem kurzzeitigen Absinken des Aortendrucks, der so genannten Inzisur in der Druckpulskurve. Dem Minimum der Inzisur entspricht der Klappenschluss, dessen Schwingungen den zweiten Herzton hervorrufen. Zu Beginn der Füllungsphase entsteht ein leiser dritter Herzton, der durch das Auftreffen des einströmenden Blutes auf die entspannten Ventrikelwände zustande kommt. Am Ende der P-Welle kann mit Mikrophonverstärkung manchmal noch ein vierter Herzton registriert werden, der durch Schwingungen bei der Vorhofkontraktion zustande kommt. Herzgeräusche. Herztöne entstehen durch zeitlich begrenzte mechanische Schwingungen verschiedener Anteile des Herzens. Den ersten und zweiten Herzton kann man immer leicht mit einem Stethoskop hören, das an die Brustwand angelegt wird. Das Abhören akustischer Phänomene nennt man Auskultation. Es ist klinisch üblich, die Herztöne auch über Mikrophon zu registrieren (Phonokardiographie). Bei Störungen der Blutflüsse in den verschiedenen Phasen der Herzaktion kann es zu turbulenten Strömungsformen kommen, die breitbandige Herzgeräusche hervorrufen. Ursachen für systolische Geräusche sind z. B. Einengungen in den ventrikulären Ausflussbahnen (z. B. Aortenklappenstenose) oder Reflux über insuffiziente Atrioventrikularklappen. Ursachen für diastolische Geräusche sind z. B. Einengungen in den Atrioventrikularklappen oder Reflux über eine insuffiziente Aorten- oder Pulmonalklappe. Für die an den verschiedenen Klappen entstehenden akustischen Ereignisse gibt es Punkte an der Körperoberfläche, an denen sie sich meist besonders gut hören lassen: Für die Aortenklappe liegt ein solcher Auskultationspunkt im 2. Interkostalraum am rechten Sternalrand, für die Pulmonalklappe im 2. Interkostalraum am linken Sternalrand, für die Trikuspidalklappe liegt er im 4. Interkostalraum am linken Sternalrand, für die Mitralklappe in der Herzspitzenregion links medioklavikulär im 5. Interkostalraum. An Engstellen entstehende Strömungsgeräusche werden mit dem Blutstrom fortgeleitet. So ist z. B. das systolische Geräusch einer Aortenklappenstenose auch noch in den Karotiden zu hören. l l l In einem Druck-Volumen-Diagramm umschreibt ein Herzzyklus ein Viereck, das so genannte Arbeitsdiagramm Arbeitsdiagramm des Herzens. Die Hohlkörper des Herzens (Atrien, Ventrikel) werden bei ihrer Füllung durch den Füllungsdruck gedehnt. Die Kurve, die Füllungsdrücke und Füllungsvolumina bei entspannter Wandmuskulatur in Beziehung setzt, nennt man die Ruhedehnungskurve des jeweiligen Hohlkörpers. Die Steigung der Ruhedehnungskurve dP/dV kennzeichnet die Steifheit (engl. stiffness), ihr Kehrwert dV/dP die Dehnbarkeit (engl. compliance) des Hohlkörpers. Die Ruhedehnungskurven von Atrien und Ventrikeln Druck isovolumetrische Maxima U-K urv e Mv isobare Maxima C Pd B Ruhedehnungskurve ÄA IA Mb A E D Volumen Vd SV a 0 120 CD Druck [mmHg] Druck [mmHg] 120 Volumen [mL] AB 80 60 C 120 B 80 60 D 0 0 80 AB 0 A 40 80 120 Volumen [mL] CD 0,5 Zeit [s] 1,0 b Abb. 6-17. (a) Schema eines ventrikulären Druck-VolumenDiagramms mit Darstellung der Ruhedehnungskurve, der Kurve der isovolumetrischen Maxima und der Kurve der isobaren Maxima. Die U-Kurve verbindet das zum enddiastolischen Arbeitspunkt A gehörige isobare Maximum Mb und das isovolumetrische Maximum Mv. Das Viereck ABCD ist das Arbeitsdiagramm des Ventrikels. Vd stellt das enddiastolische ventrikuläre Volumen, Pd den enddiastolischen Aortendruck dar. SV ist das Schlagvolumen. Der Flächeninhalt von ABCD entspricht der äuûeren Arbeit des Ventrikels (¾A), der Flächeninhalt des Dreiecks CDE der inneren Arbeit (IA). (b) Zeitverlauf von Druck und Volumen im linken Ventrikel während eines Herzzyklus (links) und das daraus berechnete Druck-Volumen-Diagramm (rechts) sind nicht linear, sondern werden bei zunehmendem Volumen steiler (Abb. 6-17 a), d. h. dass die Steifheit dieser Hohlkörper bei zunehmender Füllung zunimmt. Trägt man für jeden Zeitpunkt während eines Herzzyklus den intraventrikulären Druck und das intraventrikuläre Volumen des linken Herzens in einem zweidimensionalen Diagramm gegeneinander auf, so entsteht ein Viereck, das Arbeitsdiagramm des linken Herzens (Abb. 6-17 b). Der Kurvenabschnitt der Füllungsphase bildet bei vollständiger Relaxation der Ventrikelmuskulatur einen Teil der Ruhedehnungskurve des Ventrikels. Wie im Skelettmuskel ist auch im Herzmuskel die isometrische Kraftentwicklung von der Vordehnung abhängig (Abschn. B-19.4). Daher gibt es für jeden Punkt auf der Ruhedehnungskurve ein spezifisches isovolumetrisches Maximum des Ventrikeldrucks, das experimentell beobachtet werden kann, wenn durch starke Erhöhung des Drucks in der Ausflussbahn die Öffnung des Ventrikels verhindert wird. Bei rein isovolumetrischer Kontraktion leistet der Ventrikel keine äuûere Arbeit, da er kein Volumen abgibt. Experimentell lässt sich auch das isobare bzw. isotonische Maximum für diesen Punkt der Ruhedehnungskurve bestimmen. Es stellt das Auswurfvolumen dar, das der Ventrikel bei einem vorgegebenen Druck in der Ausflussbahn maximal auswerfen kann. Die systolische Kontraktion der Ventrikel stellt eine Unterstützungszuckung (Abschn. B-19.4) dar, weil zunächst isometrisch Kraft aufgebaut wird (Druckanstieg im Ventrikel) und es dann zu einer Muskelverkürzung bei nur noch wenig veränderlicher Kraft (Volumenverkleinerung während der Austreibungsphase) kommt. Die Endpunkte dieser Unterstützungszuckung liegen im pV-Diagramm auf einer leicht gebogenen Kurve, der Kurve der Unterstützungsmaxima (U-Kurve), die eine Verbindungslinie zwischen dem zugehörigen isotonischen Maximum und dem isovolumetrischen Maximum darstellt (Abb. 6-17 a). Die Lage der U-Kurve ist für die Ventrikelfunktion von entscheidender Bedeutung, da alle von einem gegebenen Punkt A auf der Ruhedehnungskurve (von einer bestimmten diastolischen Füllung) ausgehenden Arbeitszyklen den Endpunkt ihrer Austreibungsphase auf einem Punkt der U-Kurve finden. Die U-Kurve begrenzt somit den möglichen Operationsbereich des Ventrikels für einen gegebenen Punkt der enddiastolischen Füllung auf der Ruhedehnungskurve. ¾uûere Arbeit. Der Durchmesser des Arbeitsdiagramms parallel zur x-Achse entspricht dem Schlagvolumen des abgebildeten Herzzyklus (Abb. 6-17 a). Der Anstieg des Drucks während der Austreibungsphase (B±C) ist ein Maû für die Dehnbarkeit der Ausflussbahn. Steifere Ausflussbahnen erfordern einen gröûeren Druckanstieg, um ein gegebenes Schlagvolumen in die Ausflussbahn hineinzudrücken. Da physikalisch betrachtet das Produkt aus Druck und Volumen Energie (Arbeit) entspricht (Abschn. A-1.2), ist das Integral der vom Arbeitsdiagramm umschriebenen Fläche ein Maû für die äuûere Arbeit, die das Herz beim Fördern eines Schlagvolumens bei gegebenem äuûeren Druck leistet. Da der rechte Ventrikel ein gegebenes Schlagvolumen nur gegen den geringen Druck in der Pulmonalstrombahn auswirft, ist seine Arbeitsleistung gegenüber der des linken Ventrikels deutlich geringer, der gegen den hohen Druck in der Aorta auswirft. Ein Zahlenbeispiel macht dies deutlich: Das Schlagvolumen (SV) der beiden Ventrikel sei 70 mL (70 ´ 10±6 m3), der mittlere Aortendruck 100 mmHg (100 ´ 133 N m±2), der mittlere Pulmonalisdruck 15 mmHg (15 ´ 133 N m±2). Daraus ergibt sich für den linken Ventrikel die Arbeit ALV P ´ SV 0,93 Nm und für den rechten Ventrikel ARV 0,14 Nm. Innere Arbeit. Die Energiebilanz des Ventrikels beschränkt sich aber nicht auf die äuûere Arbeit. Der durch U-Kurve und Ruhedehnungskurve definierte Arbeitsbereich des Ventrikels umschlieût links vom Arbeitsdiagramm (ABCD) noch eine dreieckige Fläche (CDE), die ebenfalls eine Energiegröûe dar6.6 Mechanik der Herzaktion Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 163 stellt. Das Restvolumen unter dieser Fläche könnte vom Ventrikel zusätzlich ausgeworfen werden, wenn man den Druck in der Ausflussbahn am Punkt C des Arbeitsdiagramms schnell reduzierte. Die Fläche CDE stellt also eine potentielle Energie dar, die in der übrigbleibenden Volumenfüllung des Ventrikels auf Höhe der Linie CD gespeichert ist. Im geschlossenen Kreislauf hat der Ventrikel diese Energie zuvor selbst über äuûere Schlagarbeit aufgebracht: Da diese das Blut durch den Kreislauf treibt und damit auch den Rückstrom des Blutes zum Herzen bewirkt, bestimmt sie so letztlich die Volumenfüllung des Herzens. Die in der Restvolumenfüllung des Ventrikels gespeicherte potentielle Energie bezeichnet man als ¹innere Arbeitª. Der Stoffwechsel des Ventrikels muss im zeitlichen Mittel immer die Gesamtbilanz aus äuûerer und innerer Arbeit decken. Volumenbelastung DV Druck [mmHg] 300 U U’ 200 120 80 Pd SV2 SV1 A 0 Frank-Starling-Mechanismus. Es gehört zu den elementaren Eigenschaften der quergestreiften Muskulatur, dass die entwickelte Kraft von der Vordehnung des Muskels abhängig ist (Abschn. B-19.4). Zwei Mechanismen sind wesentlich hierfür verantwortlich: Zum einen gibt es bei einer mittleren Sarkomerenlänge von 2,2 mm eine optimale Überlappung von Actin und Myosin, bei der sich ein Maximum von Querbrücken ausbilden kann. Wird das Sarkomer weiter gedehnt, finden nicht alle Myosinköpfchen an den dünnen Filamenten einen korrespondierenden Angriffspunkt. Ist das Sarkomer kürzer, kommt es zu räumlichen Behinderungen bei der Ausbildung von Querbrücken (Abschn. B-19.6). Zum anderen variiert die Calciumsensitivität der Myofibrillen auch längenabhängig, so dass ein gegebener Anstieg des cytosolischen Ca2+ bei sehr kurzen Sarkomerenlängen eine geringere kontraktile Aktivierung auslöst als in einer Myokardzelle mit vorgedehnten Sarkomeren. Im pV-Diagramm (Abb. 6-17 a, Abb. 6-18 a) erkennt man die längenabhängige Kraftsteigerung des Herzmuskels am Verlauf der Kurve der isovolumetrischen Maxima. Die Differenz zwischen dieser Kurve und der Ruhedehnungskurve stellt den maximal entwickelten Druck (in der Systole) in Abhängigkeit von der Vordehnung dar. Im linken Ventrikel nimmt diese Gröûe bis zu Füllungsvolumina von ca. 180 mL stetig zu, danach fällt sie ab. Die Vordehnung des Herzens, d. h. der Ausgangspunkt des Arbeitsdiagramms auf der Ruhedehnungskurve, ist indirekt abhängig vom enddiastolischen Füllungsdruck des Ventrikels, da durch diesen Druck das entsprechende Volumen in den Ventrikel hineingedrückt wird. Diesen enddiastolischen Füllungsdruck nennt man klinisch auch Vorlast des Herzens. Man kann deshalb sagen, dass der Frank-Starling-Mechanismus die Abhängigkeit der systolischen Druckentwicklung von der Vorlast beschreibt. In der Darstellung im pV-Diagramm (Abb. 6-18 b) wird deutlich, dass der Frank-Starling-Mechanismus auch einer kurzfristigen Anpassung des Schlagvolumens an einen veränderten Druck in der Ausflussbahn, der so genannten Nachlast (aortaler Mitteldruck, pulmonaler Mitteldruck) dient. 164 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 0 60 130 200 Volumen [mL] a Druckbelastung 300 Druck [mmHg] l l l Bei Zunahme der diastolischen Füllung erhöht sich unabhängig von der Innervation das Schlagvolumen des Herzens A’ U U’ 200 Pd’ SV2 120 Dp Pd 80 SV3 SV1 A A’ 0 0 60 130 200 Volumen [mL] b Abb. 6-18. Ventrikelaktion bei gleichbleibender Inotropie. (a) Erhöhung des Schlagvolumens nach Vergröûerung der enddiastolischen Ventrikelfüllung. Durch die Volumenbelastung wird A nach A0 auf der Ruhedehnungskurve verschoben. Zu diesem neuen enddiastolischen Arbeitspunkt A0 gehört die veränderte U0 -Kurve. Das Arbeitsdiagramm, das bei gegebenem enddiastolischen Aortendruck Pd von A0 ausgeht, hat ein gröûeres Schlagvolumen als das vorige Arbeitsdiagramm (SV2 > SV1). (b) Verkleinerung des Schlagvolumens durch Druckbelastung und Kompensation dieser Störung. Steigt der enddiastolische Aortendruck von Pd auf Pd0 , verkleinert sich das Schlagvolumen bei gegebener enddiastolischer Füllung des Ventrikels (Arbeitspunkt A) von SV1 auf SV2 Wird in einem ersten Herzzyklus die Nachlast plötzlich erhöht, wird das nachfolgende Schlagvolumen vermindert (SV2 < SV1) und das im Ventrikel zurückbleibende Volumen erhöht. Wenn für den nächsten Schlag das diastolisch aufgenommene Volumen etwa gleich bleibt, wird nun das enddiastolische Volumen erhöht, d. h. der Ventrikel besitzt eine gröûere Vordehnung. Zu diesem neuen enddiastolischen Ar- beitspunkt A0 gehört eine neue U-Kurve U0 im pV-Diagramm, deren Steilheit sich aber nur wenig von der der ursprünglichen U-Kurve unterscheidet. Das von diesem Punkt A0 ausgehende Arbeitsdiagramm kann deshalb mit einem wieder vergröûerten Schlagvolumen durchgeführt werden (SV3 SV1). Es ergibt sich also eine Kompensation für einen Verlust von Schlagvolumen durch Erhöhung der Vordehnung. Die Anpassung des Schlagvolumens durch Variation der Vordehnung ist von Schlag zu Schlag wirksam. Sie stellt einen sehr schnellen und effizienten autonomen Mechanismus des Herzens zur Stabilisierung der Auswurfleistung dar. Insbesondere dient sie der engeren Kopplung zwischen Auswurfleistung von rechtem und linkem Ventrikel. den Zellen der Arbeitsmuskulatur stimulieren, führen zu einer längenunabhängigen Kraftsteigerung. Im pV-Diagramm kommt dies wesentlich darin zum Ausdruck, dass die Kurven der isovolumetrischen Maxima zu gröûeren Druckwerten hin verschoben sind (Abb. 6-19 a; vgl. Mv und Mv0 ). Bei einer gegebenen Vordehnung kann damit ein gröûerer höheres Schlagvolumen Mv’ Box 6-4. 400 U’ Angeregt durch Untersuchungen von Magnus Blix (1892) über die Kontraktionsmöglichkeiten des Skelettmuskels führte Otto Frank (1895) am isolierten Froschherzen die ersten systematischen Untersuchungen zu den Kontraktionsmöglichkeiten dieses Hohlmuskels durch. Die in Abb. 6-17 dargestellten Gesetzmäûigkeiten entsprechen seinen Erkenntnissen. Ernest Starling und Mitarbeiter (1914) analysierten an einem isolierten Herzlungenpräparat des Hundes, wie sich ein erhöhter venöser Zustrom oder eine Druckerhöhung in der Ausflussbahn auf das geförderte Schlagvolumen auswirkt (ähnlich wie in Abb. 6-18). Die Regulation der Schlagarbeit des Herzens durch das enddiastolische Füllungsvolumen wurde unter dem Eindruck seiner Darstellung häufig auch als ¹Starling-Gesetzª bezeichnet. Starlings Befunde stellen eine Bestätigung der von Frank bereits beschriebenen Prinzipien für das Warmblüterherz dar. Die Vordehnungsabhängigkeit der Herzarbeit wird heute im deutschen Schrifttum überwiegend als Frank-Starling-Mechanismus bezeichnet. Die Erkenntnis, dass dieser Mechanismus ganz wesentlich auf der längenabhängigen Interaktion von Actin und Myosin beruht und insofern auch identisch mit der vordehnungsabhängigen Kraftsteigerung im Skelettmuskel ist, wurde erst Mitte des 20. Jahrhunderts gewonnen. Druck [mmHg] Geschichte des Frank-Starling-Mechanismus U 300 Mv 200 120 Pd 80 A 0 0 60 130 200 Volumen [mL] SV SV’ a höherer Druck Mv’ l l l Als positive Inotropie (erhöhte Kontraktilität) bezeichnet man Kraftsteigerungen des Herzmuskels, die unabhängig von der diastolischen Ventrikelfüllung sind 400 U’ Druck [mmHg] U Positive Inotropie. Der Überträgerstoff des Sympathikus, Noradrenalin, und das unter Sympathikusstimulation adrenal freigesetzte Adrenalin, die die b-Adrenorezeptoren an 300 Mv 200 c Abb. 6-19. Ventrikelaktion bei vergröûerter Inotropie. (a) Erhöhung des Schlagvolumens durch positive Inotropie. Für einen gegebenen Arbeitspunkt A der enddiastolischen Füllung wird die zugehörige U-Kurve steiler (U 0 -Kurve). Dadurch verbreitert sich das Arbeitsdiagramm, d. h. das Schlagvolumen wird gröûer (SV 0 > SV). (b) Beibehaltung des Schlagvolumens bei Erhöhung des Aortendrucks ermöglicht durch eine positive Inotropie. Bei steilerer U0 -Kurve (durch positive Inotropie) kann der Ventrikel sein bisheriges Schlagvolumen auch nach Erhöhung des enddiastolischen Aortendrucks auswerfen (SV0 SV) Pd’ Dp 120 Pd 80 A 0 0 60 130 200 Volumen [mL] b 6.6 Mechanik der Herzaktion Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 165 maximaler Druck erzeugt werden. Damit verläuft auch die U-Kurve im pV-Diagramm (U0 -Kurve) steiler. Dies führt dazu, dass bei einem gegebenen enddiastolischen Arbeitspunkt (A) und gegebener Nachlast (Pd) ein gröûeres Schlagvolumen gefördert wird (SV0 > SV). Die Steilheit der U-Kurve kann man als Maû für die Inotropie (Kontraktilität) ansehen. Der Mechanismus der kontraktilen Aktivierung durch positive Inotropie beruht im Wesentlichen darauf, dass die bei der elektromechanischen Kopplung ins Cytosol freigesetzte Calciummenge erhöht wird. Auslöser hierfür ist eine Vergröûerung des Calciumeinstroms (L-Typ), die sekundär zu einer gröûeren Freisetzung von Ca2+ aus dem sarkoplasmatischen Reticulum führt (Abschn. C-6.3). Gröûere Spitzenkonzentrationen des cytosolischen Ca2+ führen dann zu einer stärkeren Aktivierung der Kontraktion. Noradrenalin und Adrenalin stellen die wichtigsten physiologischen inotropen Stimuli dar, es gibt aber noch eine Vielzahl anderer Faktoren, die die Herzkraft auf ähnliche Weise steigern können. Digitalisglycoside sind die bekanntesten Pharmaka, um eine positiv inotrope Wirkung zu erzielen. Diese Stoffe hemmen die sarkolemmale Na+-K+-ATPase. Das dann im Zellinneren zurückgehaltene Na+ führt über eine Verminderung der treibenden Kraft des Na+-Ca2+-Austauschers zu einem Anstieg der zellulären Calciumkonzentration. Eine erhöhte Füllung des sarkoplasmatischen Reticulums ist Grundlage für den positiv inotropen Effekt (s. o.). Bei einer akuten arteriellen Widerstandserhöhung (Abb. 619 b; vgl. Pd und Pd0 ) wird dem linken Ventrikel eine erhöhte Schlagarbeit abverlangt. Die hierzu notwendige Kraftvermehrung wird zunächst durch den Frank-Starling-Mechanismus, d. h. durch stärkere Vordehnung, gewonnen. Reicht dieser Mechanismus nicht aus und fällt das Herzminutenvolumen daher ab, kommt es zu einer reflektorischen Sympathikusaktivierung (Barosensorenreflex, Abschn. C-7.10), die durch Stimulation kardialer b-Rezeptoren die Herzfrequenz erhöht und die Inotropie steigert. Abb. 6-19 b zeigt, dass eine Erhöhung der Inotropie ausreicht, um ein gegebenes Schlagvolumen gegen einen erhöhten Aortendruck (vgl. Pd mit Pd0 ) zu fördern, auch ohne dass die Vordehnung erhöht ist. é 166 Ein Herzzyklus teilt sich in vier Phasen: (1) die isovolumetrische Anspannungsphase; (2) die auxotone Austreibungsphase; (3) die isovolumetrische Erschlaffungsphase; und (4) die Füllungsphase. Phase 1 und 2 bilden die Systole, 3 und 4 die Diastole der Ventrikel. Im Druck-Volumen-Diagramm umschreibt ein Herzzyklus ein geschlossenes Viereck. Die Lage dieses Arbeitsdiagramms ist durch den Verlauf der Ruhedehnungskurve und das enddiastolische Füllungsvolumen bestimmt. Wichtige Parameter der Ventrikelfunktion sind die isovolumetrischen und die isotonischen Maxima. Die in der Systole entwickelte Kraft des Herzmuskels ist von seiner Vordehnung und damit von der enddiastolischen Ventrikelfüllung abhängig. Dieses Phänomen wird Frank-Starling-Mechanismus genannt. Er stellt einen autonomen Mechanismus des Herzens zur Stabili- Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* sierung der Auswurfleistung dar. Als positive Inotropie bezeichnet man Kraftsteigerungen des Herzmuskels, die unabhängig von der Vordehnung sind. Physiologisch am wichtigsten ist der durch Sympathikusaktivierung ausgelöste positiv inotrope Effekt. 6.7 Herzstoffwechsel und Energetik der Pumpfunktion l l l Der Herzmuskel kann bei ausreichender Sauerstoffzufuhr Glucose, Lactat und Fettsäuren zur Energiegewinnung nutzen Der Herzmuskel gehört zu den stoffwechselaktivsten Geweben des menschlichen Körpers. Der Energiebedarf ist bereits unter Ruhebedingungen so groû, dass er nur durch oxidative Energiegewinnung gedeckt werden kann. Die wichtigsten Energie liefernden Substrate sind Glucose, Fettsäuren und Lactat, die in variablen relativen Anteilen zur oxidativen Energiegewinnung herangezogen werden können (Abb. 6-20, Abschn. A-6.7, A-10.3). Ist die Sauerstoffzufuhr zu gering und sinkt deshalb der pO2 im Gewebe ab, wird die vollständige Oxidation dieser Substrate eingeschränkt. Bei Sauerstoffmangel wird der myokardiale Stoffwechsel auf anaerobe Glycolyse umgestellt, d. h. auf den Abbau von Glucose zu Lactat, wobei pro umgesetztem Glucosemolekül nur etwa 7 % der Energiemenge entstehen wie beim vollständigen oxidativen Abbau. Die Steigerung des anaeroben Glucoseabbaus ist aber für eine energetische Kompensation nicht ausreichend. Daher entsteht im Sauerstoffmangel ein Energiedefizit. Bei der anaeroben Glycolyse entstehen auch Protonen (Lactat; Abschn. A-6.2), so dass das anaerobe Myokard angesäuert wird. l l l Glucose wird aerob vollständig oxidiert. Es ist das einzige Substrat des Herzens, das auch anaerob Energie liefert Die Aufnahme von Glucose in die Herzmuskelzelle erfolgt über spezielle Glucosetransporter (GLUT4, GLUT1; Abschn. A-9.5), deren Anzahl durch Einbau von präformierten Transportermolekülen aus dem Zellinneren in die Zellmembran unter Insulin erhöht wird. Ein groûer transsarkolemmaler Gradient wird dadurch aufrechterhalten, dass die in das Zellinnere gelangte Glucose sofort von der Hexokinase unter ATP-Verbrauch phosphoryliert wird. Das so entstandene Glucose-6-phosphat wird über Glycolyse zu Pyruvat abgebaut. Der geschwindigkeitsbestimmende und damit entscheidende Schritt für den Abbau ist die durch Phosphofructokinase katalysierte Reaktion (Abschn. A-6.2). Diese wird durch hohe cytosolische Citrat- und ATP-Spiegel gehemmt, wie sie bei guter aerober Substratversorgung im Cytosol vorliegen. Bei Sauerstoffmangel wird Pyruvat nicht weiter oxidiert, sondern ± getrieben durch ein hohes NADH/NAD+-Verhältnis p p BC PH Glucose Pyruvat PFK CrP Glycolyse ADP Substratkettenphosphorylierung CK ATP Cr Lactat Pyruvat oxidative Phosphorylierung ADP PDH Fettsäuren Acetyl-CoA Citratzyklus Elektronentransport O2 Mitochondrien CO2 Herzmuskelzelle ± in der durch Lactat-Dehydrogenase katalysierten Gleichgewichtsreaktion zu Lactat reduziert. Lactat wird über ein spezifisches Carriersystem aus der Zelle ausgeschleust. Pyruvat gelangt über einen Carrier in die Mitochondrien, in denen es letztendlich zu CO2 und H2O verstoffwechselt wird (Abschn. A-6.2, A-7.6). l l l Lactat, das nach starker Muskelarbeit im Blut zirkuliert, kann vom Herzen als Energieträger weiter abgebaut werden. Bei hohem Fettsäureangebot nützt das Herz bevorzugt Fettsäuren zur aeroben Energiegewinnung Lactat. Bei hohen Lactatplasmaspiegeln, wie sie im Blut z. B. nach starker körperlicher Leistung vorliegen, wird Lactat in die Herzmuskelzellen aufgenommen. Unter aeroben Verhältnissen, d. h. bei niedrigem NADH/NAD+-Quotienten, entsteht an der Lactat-Dehydrogenase (LDH) Pyruvat, das dann als Substrat auf dem oben beschriebenen Weg weiter abgebaut wird. Es entsteht also auf Ebene des Pyruvats eine Konkurrenz zwischen den Substratquellen Lactat und Glucose, die bei hohen Lactatspiegeln zu einer präferentiellen Nutzung des externen Lactats führt. Die Herz-LDH (LDH-Isoform H4) katalysiert damit die Rückreaktion der Skelettmuskel-LDH (LDH-Isoform M4) (Abschn. A-6.2). Fettsäuren. Im Plasma zirkulieren langkettige Fettsäuren, die als Nahrungsbestandteile in den Kreislauf gelangen, vorwiegend in veresterter Form in Chylomikronen und Lipoproteinkomplexen (Abschn. A-8.5, A-10.5). Lipasen am Gefäûendothel setzen aus diesen Transportkomplexen Fettsäuren frei, die eine hohe Affinität zu Albumin haben und in der Assoziation mit Albumin an der Herzmuskelzelle binden. Aus die- Abb. 6-20. Substratquellen für die Energieproduktion der Herzmuskelzelle. PFK Phosphofructokinase; PDH Pyruvat-Dehydrogenase; CK Creatin-Kinase; CrP Creatinphosphat; Cr Creatin ser Bindung erfolgt die Aufnahme in die Zellen. Freie Fettsäuren werden durch den Prozess der b-Oxidation oxidativ zu Acetyl-CoA abgebaut (Abschn. A-10.3). Bei jedem Verkürzungszyklus entstehen FADH2 und NADH, die dann der oxidativen ATP-Synthese dienen. Unter anaeroben Bedingungen kommt die b-Oxidation zum Stillstand, da freies NAD+ und FAD fehlen. Fettsäuren liefern somit nur unter aeroben Bedingungen Energie. Die genaue Bilanz der oxidativen Energiegewinnung aus Fettsäuren hängt von deren Kettenlänge und Sättigungsgrad ab. In der Bilanz entstehen bei vollständiger Oxidation von Palmitinsäure 106 Moleküle ATP pro Molekül oxidierter Palmitinsäure (Abschn. A-10.3). Bei hohem Plasmaspiegel von Fettsäuren, z. B. nach einer fettreichen Mahlzeit, gewinnt das Herz oxidative Energie bevorzugt aus dem Fettsäureabbau. Der hohe Anfall von NADH durch die b-Oxidation wirkt hemmend auf die Pyruvat-Dehydrogenase und damit auf den Glucosestoffwechsel (s. o.). l l l Circa 90 % des Energiebedarfs des Herzens dient der Kontraktion Für die Kontraktion des Herzmuskels wird Energie in Form von ATP gebraucht. Ungefähr 70 % des umgesetzten ATP werden direkt an den Myofibrillen durch die Myosin-ATPase verbraucht. Circa 20 % des Energiebedarfs entfallen auf die ATPasen der zellulären Ionenpumpen, ohne die das Aktionspotential, die elektromechanische Kopplung und die Aufrechterhaltung der zellulären Ionenhomöostase nicht möglich ist. Damit entfallen insgesamt etwa 90 % des Energiebedarfs ± direkt oder indirekt ± auf die kontraktile Funktion. Nur etwa 10 % des Energiebedarfs des Herzmuskels werden für Vorgänge aufgewendet, die der Aufrechterhaltung der zellulären Integrität dienen (reiner Erhaltungsstoffwechsel). Der Herzmuskel enthält neben ATP als weiteres energierei6.7 Herzstoffwechsel und Energetik der Pumpfunktion Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:37:13 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 167 ches Phosphat auch Creatinphosphat (Abschn. B-19.6). Die energiereiche Phosphatbindung von Creatinphosphat entsteht in einer von Creatin-Kinase katalysierten Gleichgewichtsreaktion durch Übertragung einer Phosphatgruppe von ATP auf Creatin. Creatin-Kinase ist in verschiedenen Isoformen im cytoplasmatischen Raum verteilt und scheint den intrazellulären Transport von Energieäquivalenten zu beschleunigen. Dazu passt, dass Mäuse, in denen die CreatinKinase gentechnisch ausgeschaltet wurde, zwar in Ruhe eine normale Herzfunktion zeigen, nicht aber bei einer Leistungssteigerung. l l l Das Herz hat im Vergleich zu anderen Organen einen hohen Sauerstoffund Energieverbrauch Der Sauerstoffbedarf des Herzens VO2 errechnet sich als VO2 AVDO2 KBF wobei AVDO2 die arteriovenöse Konzentrationsdifferenz von Sauerstoff, KBF den koronaren Blutfluss bezeichnet. Bei einem Erwachsenen misst man in körperlicher Ruhe etwa 25 mL O2 min±1 (ca. 1 mmol O2 min±1) als Sauerstoffverbrauch des Herzens. Bei einer O2-Gesamtaufnahme des Körpers von etwa 300 mL bedeutet dies, dass unter Ruhebedingungen auf das Herz knapp 10 % des gesamten Sauerstoffverbrauchs des Körpers entfallen. Auf die Gewichtseinheit bezogen (Herzgewicht 300 g) verbraucht das Myokard in Ruhe 8 mL min±1 pro 100 g Gewebe. Unterbricht man künstlich die Kontraktionen des Herzmuskels, wie es z. B. in der Herzchirurgie durch so genannte Kardioplegieverfahren üblich ist, reduziert sich der Sauerstoffverbrauch auf etwa ein Zehntel dieses Werts. Dieses Verhältnis entspricht recht gut den oben genannten Abschätzungen über den Energiebedarf des zellulären Erhaltungsstoffwechsels. Bei körperlicher Arbeit steigt der Sauerstoffbedarf des Herzens je nach Intensität der Arbeit auf das 2- bis 5fache des Ruhewerts, bei maximaler Leistung kann kurzfristig fast der 10fache Sauerstoffbedarf auftreten. schen Grundumsatz der Myokardzelle, werden die metabolischen Kosten der Herzarbeit vor allem von der Ventrikelgeometrie bestimmt. Eine vereinfachte Überlegung zeigt bereits, dass die Kraftentwicklung in den myokardialen Muskelfasern nicht nur von der zu überwindenden Nachlast, sondern auch von der Ventrikelgeometrie abhängt: Wenn sich die Muskelfasern in der Ventrikelwand während der isovolumetrischen Anspannungsphase anspannen, um einen Druck (p) zu erzeugen, muss eine bestimmte Kraft pro Muskelquerschnitt (Spannung s) aufgewendet werden. Bei Annahme eines kugelförmigen Ventrikels ergibt sich nach dem Laplace-Gesetz die Beziehung: r sp 2d wobei r den Ventrikelradius und d die Wanddicke des Muskelmantels bezeichnet (Abb. 6-21). Die Kraftentwicklung in den Muskelfasern des Ventrikelmyokards muss demnach ansteigen, wenn der aufzubringende Druck p (Ausflussbahnverengung, Erhöhung des peripheren Widerstands) oder der Ventrikelradius r (Ventrikeldilatation) zunehmen oder wenn das Dickenwachstum hinter der Radiuszunahme zurückbleibt (z. B. bei einer exzentrischen Hypertrophie, s. u.). Ventrikelgeometrie und Energiebedarf. Die äuûere Arbeit (Kraft ´ Weg), die die Muskelfasern leisten müssen, hängt von der Spannung und der Verkürzungsstrecke ab, die sie beim Auswerfen des Schlagvolumens zurücklegen. Um ein gegebenes Schlagvolumen zu fördern, ist bei einem Ventrikel mit groûem enddiastolischen Füllungsvolumen (Ventrikeldilatation) nur eine kleine Verkürzungsstrecke der Muskelfasern notwendig. Dadurch kann in der Bilanz der äuûeren Arbeit die höhere Faserspannung kompensiert werden. Im pV-Diagramm arbeitet ein dilatierter Ventrikel weit rechts auf der Ruhedehnungskurve (Abb. 6-17, Abb. 6-18). Er wird in diesen Arbeitsbereich gezwungen, wenn die myokardiale Inotropie reduziert ist (insuffizientes Myokard), was sich in einer flachen U-Kurve ausdrückt. Fördert der dilatierte VentriRadius r Die Sauerstoffaufnahme von 8 mL min±1 pro 100 g Gewebe in körperlicher Ruhe entspricht bei einem Herzgewicht von 300 g und auf den Tag hochgerechnet einem ATP-Gesamtumsatz von etwa 5 kg, d. h. einer ATP-Masse von etwa 6 % des Körpergewichts eines Erwachsenen. (Diese wird nicht vollständig aufund abgebaut, da beim ATP-Umsatz immer nur eine Phosphatgruppe abgespalten wird.) Bei Verrichtung körperlicher Arbeiten kann der ATP-Umsatz des Herzens auch 20 kg pro Tag betragen. Diese Extrapolation macht deutlich, wie energieintensiv die Herzarbeit im menschlichen Körper ist. l l l Der Energiebedarf des Herzens steigt, wenn das Schlagvolumen bei vergröûerter enddiastolischer Füllung gefördert wird Ventrikelgeometrie und Kraftentwicklung. Die Stoffwechselenergie, die von einem Ventrikel für ein bestimmtes Auswurfvolumen aufgebracht werden muss, ist keine konstante Gröûe. Neben einer Reihe von Faktoren, z. B. dem metaboli168 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Druck p Wandspannung σ Kugelmodell Dicke d LaPlace: σ = p • r 2d Abb. 6-21. Schema der Laplace-Gleichung für ein kugelförmiges Ventrikelmodell kel in diesem Arbeitsbereich ein normales Schlagvolumen, ist die äuûere Arbeit (¾A) hierfür sogar kleiner als normal (Flächeninhalt des Arbeitsdiagramms). Die innere Arbeit (Inhalt der Dreiecksfläche, IA) ist aber stark angestiegen. Da auch hierfür metabolische Energie aufgewendet werden muss, ist der Wirkungsgrad zwischen Stoffwechselleistung und äuûerer Arbeit im Fall eines dilatierten Ventrikels deutlich verschlechtert. Für eine bestimmte Auswurfleistung wird also bei Zuhilfenahme des Frank-Starling-Mechanismus (Ventrikeldilatation) mehr Sauerstoff gebraucht. Dies ist deshalb besonders ungünstig, weil bei erhöhten diastolischen Drücken der Koronarwiderstand vergröûert ist und sich somit eine Schere zwischen Zunahme des Sauerstoffbedarfs und Verminderung des Sauerstoffangebots auftun kann. Das Risiko ischämischer Schädigungen ist daher bei einer deutlichen Rechtsverschiebung des Arbeitsdiagramms erhöht. l l l Myokardischämie führt nur kurzfristig zur Aktivierung anaerober Energieproduktion, da die zunehmende Acidose im Gewebe die Glycolyse hemmt. Zellnekrose ist die Folge Reicht die Koronardurchblutung nicht aus, um den Sauerstoffbedarf des Myokards zu decken, spricht man von einer Myokardischämie. Ursache für einen Durchblutungsmangel ist in der Regel eine Einengung oder ein Verschluss einer Koronararterie. Im ischämischen Myokard fehlt Sauerstoff für den aeroben Stoffwechsel. Zur Energiegewinnung wird die anaerobe Glycolyse aktiviert. Die anaerobe Energieproduktion deckt aber von Anfang an nicht den Energiebedarf des arbeitenden Myokards. Das ischämische Areal stellt deshalb innerhalb kurzer Zeit (bei kompletter Ischämie in weniger als 1 min) seine Kontraktionsfunktion ein und trägt deshalb auch nicht mehr zur Pumpfunktion des Organs bei. Selbst die anaerobe Energieproduktion kommt bald zum Erliegen, da die hierbei entstehenden Protonen nicht aus dem ischämischen Gewebe ausgeschwemmt werden und eine Säurehemmung der Glycolyse bewirken (Abschn. A-6.2). Damit entfällt auch die Energiebereitstellung für den zellulären Erhaltungsstoffwechsel und als Folge sterben die Myokardzellen ab. So entsteht ein Myokardinfarkt. (Im klinischen Sprachgebrauch bezeichnet man häufig auch schon eine Myokardischämie mit noch reversibler Zellschädigung als ¹akuten Myokardinfarktª.) Nekrotische Herzmuskelzellen setzen cytoplasmatische Proteine frei, die sich als Infarktindikatoren verzögert (Beginn nach 3±6 Stunden, unterschiedlich für die verschiedenen Indikatorproteine) im Blutplasma nachweisen lassen (z. B. Lactat-Dehydrogenase, Creatin-Kinase, Troponin T). Bei ausgedehnten Infarkten finden sich meist auch im EKG charakteristische Veränderungen (Abschn. C-6.5). Rhythmusstörungen und Pumpversagen können als akute Folgen einer Myokardischämie zu einem plötzlichen Herztod führen. Wird der Myokardinfarkt überlebt, entsteht im infarzierten Gewebe eine bindegewebige Narbe, die Muskulatur regeneriert sich nicht. Klinisch wird heute immer versucht, einen Koronarverschluss innerhalb der ersten Stunden wiederzueröffnen (s. Einleitung). Solche ¹Revaskularisationenª können sich bis zu 8 h nach Verschluss infarktreduzierend auswirken; bei früher Intervention und guter Versorgung des betroffenen Myokardareals durch schon bestehende Kollateralgefäûe kann sogar oft ein vollständiger Gewebserhalt erzielt werden. Box 6-5. Der Herzkatheter Der Deutsche Werner Forssmann führte 1929 zum ersten Mal in mutigen Selbstversuchen Rechtsherzkatheterisierungen durch. Diese blieben lange unbeachtet. 1956 wurde er allerdings für diese bahnbrechenden Versuche mit dem Nobelpreis ausgezeichnet. Heute gehören Katheterisierungen der Herzhöhlen und der Kranzgefäûe zu den Routinemethoden in der kardiologischen Klinik. Sie dienen entweder der Diagnostik, z. B. wenn über einen Herzkatheter Röntgenkontrastmittel in ein Koronargefäû gespritzt wird, um dies selektiv darzustellen (Koronarangiographie), oder die Katheterisierung wird für einen lokalen Eingriff verwendet, z. B. wenn ein verengtes oder verschlossenes Koronargefäû über einen vorgeschobenen Katheter mechanisch geweitet oder wieder eröffnet wird (PTCA von perkutane transluminale koronare Angioplastie). Der Pioneer der PTCA war ebenfalls ein Deutscher, Andreas Gruentzig, der 1977 erstmals mit einem Katheter, der an der Spitze einen kleinen aufblasbaren Ballon trug, eine PTCA am Menschen durchführte (Ballondilatation). Heute wird das Prinzip des Ballonkatheters auch für den Zweck erprobt, lokale Wandveränderungen in Koronargefäûen durch das örtliche Einbringen von Genmaterial einer lokalen somatischen Gentherapie zu unterziehen. é Das Herz kann je nach Substratangebot Glucose, Fettsäuren oder Lactat zur oxidativen Energiegewinnung verwenden. Bei Sauerstoffmangel ist der Herzmuskel auf anaerobe Glycolyse angewiesen, die pro umgesetztem Glucosemolekül nur ca. 7 % der oxidativ gewonnenen ATP-Menge produziert. In Ruhe beträgt der Sauerstoffbedarf des Herzens ca. 8 mL min±1 pro 100 g Gewebe. Der Sauerstoffbedarf für den Erhaltungsstoffwechsel beträgt etwa ein Zehntel hiervon. Bei starker körperlicher Belastung steigt der Sauerstoffbedarf etwa auf das Fünffache. Der Auswurf eines gegebenen Schlagvolumens ist bei einem dilatierten Ventrikel energetisch ungünstiger als bei einem kleinen Ventrikel, da ein dilatierter Ventrikel mehr innere Arbeit aufbringen muss, die ebenfalls Stoffwechselenergie verbraucht. Bei Ischämie aktiviert der Herzmuskel die anaerobe Energieproduktion. Es entwickelt sich aber trotzdem schnell ein zellulärer Energiemangel, der bei Andauern der Ischämie zum Infarkt führt. 6.7 Herzstoffwechsel und Energetik der Pumpfunktion Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 169 l l l Die Koronardurchblutung variiert in enger Kopplung mit dem Sauerstoffbedarf des Herzens Diastole Aorta 100 50 linker Ventrikel 0 linke Koronararterie 100 0 –1 In Ruhe beträgt die Koronardurchblutung ca. 80 mL min±1 pro 100 g Herzgewebe. Sie kann maximal etwa 5fach gesteigert werden. Die Koronardurchblutung regelt das Sauerstoffangebot für das Herz. Generell gilt, dass das Sauerstoffangebot gleich dem Produkt aus arterieller Sauerstoffkonzentration (caO2) und koronarem Blutfluss (KBF) ist. Der Sauerstoffbedarf des Herzens VO2 spiegelt sich in der tatsächlich extrahierten Sauerstoffmenge pro Zeit wider: Systole Druck [mmHg] Regulation der Koronardurchblutung –1 6.8 Fluss [mL min ] PH Fluss [mL min ] p l l l Der Blutfluss im Koronarsystem ist phasisch: Er ist hoch während der Diastole und sehr niedrig während der Systole der Ventrikel Die Widerstandsregulation im Koronarkreislauf weist gegenüber anderen Stromgebieten eine Besonderheit auf (Abb. 6-22). Diese besteht darin, dass die intramuralen Anteile des koronaren Strombetts mit jeder Systole durch den Anstieg der Spannung in der Muskulatur extern komprimiert werden. 170 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* rechte Koronararterie 100 0 200 –1 wobei E die Extraktionsrate des Herzens für Sauerstoff darstellt, d. h. den Anteil, der von der antransportierten Sauerstoffmenge tatsächlich entnommen wird. Im Koronarkreislauf beträgt die Extraktionsrate bereits unter Ruhebedingungen ca. 70 %. Deutliche Steigerungen der Sauerstoffversorgung zur Deckung eines gewachsenen Sauerstoffbedarfs sind deshalb über eine Erhöhung der Extraktionsrate für Sauerstoff nicht zu erreichen, sie müssen immer durch eine Steigerung des koronaren Blutflusses erbracht werden. Deshalb besteht zwischen Sauerstoffbedarf des Herzens und koronarer Durchblutung eine proportionale Beziehung, d. h. bei Steigerung des Energiebedarfs des Herzens um den Faktor 5 steigt auch die Durchblutung um diesen Faktor. Treibende Kraft für die koronare Durchblutung ist nach dem Ohmschen Gesetz die Druckdifferenz über dem Koronarkreislauf. Da der Druck in den Koronararterien etwa gleich dem Aortendruck und im Koronarsinus angenähert Null ist, entspricht diese Druckdifferenz im zeitlichen Mittel dem aortalen Mitteldruck (pA), d. h. es gilt: KBF 1/R ´ pA, wobei R den Koronarwiderstand bezeichnet. Bleibt der Aortendruck konstant, hängt die Flussregulation im Koronarkreislauf allein vom Koronarwiderstand ab. Wegen der umgekehrten Proportionalität von Fluss und Widerstand gilt dann auch, dass es eine umgekehrte Proportionalität zwischen Koronarwiderstand des Herzens und Sauerstoffbedarf gibt: 1/R VO2 . Diese Proportionalität reflektiert eine kausale Beziehung, denn der Stoffwechsel des Herzmuskels steuert tatsächlich die Widerstandsregulation (s. u.). Fluss [mL min ] VO2 E ´ caO2 ´ KBF 100 Koronarsinus 0 0 0,5 Zeit [s] 1,0 Abb. 6-22. Synopse der Drücke im linken Ventrikel und in der Aortenwurzel sowie der Blutflüsse im Koronarsystem Die Wandspannung des Ventrikels ist zu Beginn der Systole so groû, dass Blut aus den intramuralen Gefäûen sogar in die Koronararterien zurückgedrückt wird. Erst mit Nachlassen der Wandspannung während der Auswurfphase kommt es zu einem geringen Blutfluss in arteriovenöser Richtung. Zu Beginn der Diastole steigt der Koronarfluss sprunghaft an, weil jetzt die Wandspannung gering ist und gleichzeitig die treibende Kraft des arteriellen Mitteldrucks in der Aorta einen hohen Wert aufweist. Im rechten Ventrikel ist die intramurale Spannungsentwicklung in der Systole deutlich geringer, deshalb ist die Behinderung des koronaren Blutflusses hier kleiner. Groûe Anteile des Myokards werden also während eines Herzzyklus nur zeitweilig perfundiert, nämlich nur während der Diastole. Deshalb ist es für die Koronarperfusion von Bedeutung, dass sich der Anteil der Diastolendauer an der Herzperiode mit steigender Herzfrequenz verkürzt. Bei einem ruhigen Herzschlag von 60 min±1 entfallen zwei Drittel der Zyklusdauer auf die Diastole, ein Drittel auf die Systole (Abb. 6-23). Bei einer Herzfrequenz von 100 min±1 verteilt sich die Zyklusdauer bereits 1: 1 auf Diastole und Systole. Bei hohen Herzfrequenzen kann deshalb ein Mangel der Sauerstoffversorgung des Myokards auftreten. Der durch die Kontraktion es weist Vasokonstriktion bei steigendem Druck und Vasodilatation bei fallendem Druck auf. Die Folge ist eine weitgehende Konstanz der Perfusion bei ¾nderungen des Perfusionsdrucks. 1,5 1:1 Zeit [s] 2:1 1,0 Sy Di 0,5 a st sto ol e le n nda d au e r ue r 0 50 75 100 125 150 –1 Herzfrequenz [min ] Abb. 6-23. Systolendauer und Diastolendauer in Abhängigkeit von der Herzfrequenz bestimmte Anteil des Koronarwiderstands wird als extravasale Komponente bezeichnet. Dem steht die vasale Komponente des Koronarwiderstands gegenüber, die durch Regulation der Widerstandsgefäûe während der Diastole bestimmt ist. l l l An der vasalen Regulation der Koronardurchblutung sind in erster Linie lokale ± metabolische, myogene und endothelvermittelte ± Mechanismen beteiligt. Zusätzlich spielt auch die nervale Regulation eine Rolle (Abschn. C-7.10) Metabolische Kontrolle. Die Arbeit der Herzmuskelzelle setzt abhängig von ihrer Aktivität Metaboliten frei, die vasodilatierend wirken können. Eine wichtige Rolle spielt dabei Adenosin, das bei starkem Abbau von ATP entsteht und auch von den Herzmuskelzellen freigesetzt wird. Adenosin stimuliert spezielle Adenosinrezeptoren (A2) an den Gefäûmuskelzellen, die intrazellulär an die Adenylatcyclase koppeln. Der vermehrt gebildete Second Messenger cAMP wirkt in Glattmuskelzellen relaxierend. Auch das bei starker aerober Arbeit entstehende CO2 und die bei anaerober Arbeit freigesetzte Milchsäure wirken durch ihren ansäuernden Effekt vasodilatierend, da die Gefäûmuskelzellen in saurem Milieu erschlaffen. Stark arbeitende Muskulatur setzt auch Kalium und anorganisches Phosphat frei, die beide ebenfalls eine Vasodilatation bewirken (Abschn. C-7.8). Eine mäûige Erhöhung der extrazellulären Kaliumkonzentration führt über einwärts gleichrichtende Kaliumkanäle an den Glattmuskelzellen zu einer Hyperpolarisation der Zellmembran (Abschn. B-1.5) und damit zu einer Relaxation der glatten Muskelzellen. Anorganisches Phosphat hat eine direkt relaxierende Wirkung auf den kontraktilen Apparat der Gefäûmuskelzellen. Myogene Kontrolle. Die myogene Vasoregulation beruht darauf, dass sich arterioläre Glattmuskelzellen bei intraluminalem Druckanstieg kontrahieren und bei Druckabfall relaxieren (Bayliss-Effekt; Abschn. C-7.8). Ein Strombett, dessen Widerstandsverhalten von diesem myogenen Mechanismus bestimmt wird, zeigt Eigenschaften der Autoregulation, d. h. Endotheliale Kontrolle. Der dritte wichtige Mechanismus der lokalen Regulation der Koronardurchblutung ist die Freisetzung vasoaktiver Substanzen aus dem Endothel. Die wichtigsten sind Stickstoffmonoxid (NO) und Prostacyclin (PGI2). Diese endothelialen Mediatoren werden unter einer Reihe von Stimuli freigesetzt. Mit am wichtigsten ist die Freisetzung durch Veränderung der Wandschubspannung, die an der Endotheloberfläche zunimmt, wenn die Flieûgeschwindigkeit des Blutes ansteigt, und abfällt, wenn die Flieûgeschwindigkeit abnimmt. Nervale Einflüsse. Die Koronardurchblutung wird auch durch neuronale Einflüsse gesteuert. Dabei steht die sympathische Innervation ganz im Vordergrund. Es gibt zwar auch einzelne parasympathische Fasern an den Koronararterien, funktionell haben diese aber keine Bedeutung. Bei Sympathikusstimulation wird lokal Noradrenalin freigesetzt. Zusätzlich kann aus dem Nebennierenmark Adrenalin freigesetzt werden und über den Blutweg ins Koronarsystem gelangen. Noradrenalin und Adrenalin stimulieren an Glattmuskelzellen a- und b-Rezeptoren. Die Stimulation von a-Rezeptoren führt zur Vasokonstriktion, die Stimulation von b-Rezeptoren zur Vasodilatation. Die Dichte der a- und b-Rezeptoren ist entlang der Koronarstrombahn heterogen. Groûe Koronargefäûe besitzen meist mehr b-Rezeptoren, die kleinen Arteriolen überwiegend a-Rezeptoren. b-Rezeptoren finden sich zudem auf den Herzmuskelzellen und üben dort einen positiv inotropen Effekt aus. Bei Stimulation des Sympathikus ergibt sich ein Bild, das überwiegend dem einer b-adrenerg vermittelten Vasodilatation entspricht. Dies ist aber nur zu einem geringeren Teil auf eine direkte neuronale Wirkung auf die Arteriolen zurückzuführen, zum gröûeren Teil beruht es auf einer metabolisch bedingten Dilatation als Folge des inotropen Effekts. Anpassung der Koronardurchblutung. In der Koronarstrombahn ist die relative Bedeutung der drei bisher diskutierten Vasoregulationsmechanismen unterschiedlich verteilt. Die endothelabhängige Vasoregulation spielt vor allem im Bereich der Arterien und groûen Arteriolen (> 100 mm) eine Rolle, die myogene Antwort ist besonders ausgeprägt im Bereich mittlerer Arteriolen (50±100 mm) und die metabolische Regulation im Bereich kleiner Arteriolen (< 50 mm). Abb. 6-24 zeigt schematisch die Anpassung der Koronardurchblutung an einen steigenden Bedarf bei inotroper Stimulation. Die erhöhte Stoffwechselaktivität bei steigender Herzarbeit setzt metabolische Faktoren frei, die vorwiegend im Bereich kleiner Arteriolen vasodilatatorisch wirken. Dies wird durch eine b-adrenerge Dilatation unterstützt. Wenn in den kleinen Arteriolen eine Gefäûerweiterung stattfindet, verläuft der Druckabfall in den vorgeschalteten Gefäûabschnitten steiler, d. h. hier sinkt der mittlere Druck. Der Druckabfall führt in den mittleren Arteriolen zu einer myogenen Vasodilatation, was zusammen mit der Dilatation im Endstrombereich eine Steigerung des Blutflusses bewirkt. Im Bereich der vorge6.8 Regulation der Koronardurchblutung Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 171 große Arteriolen > 100 µm mittlere Arteriolen 50–100 µm endothelvermittelte Dilatation myogene Dilatation NO-Freisetzung Druck kleine Arteriolen < 50 µm metabolische Dilatation Schubspannung Stromstärke Adenosin Herzarbeit Abb. 6-24. Zusammenspiel verschiedener vasodilatatorischer Mechanismen in der koronaren Mikrostrombahn schalteten Arterien erzeugt die Zunahme des Volumenstroms eine gröûere Strömungsgeschwindigkeit und zunehmende Wandschubspannung. Diese setzt aus dem Endothel vasodilatierende Substanzen, z. B. NO, frei, die nun auch die Arterien erweitern. Der erhöhte Sauerstoffbedarf in der Mikrostrombahn wirkt deshalb über diese Signalkaskade stromaufwärts auf das gesamte zuführende Gefäûbett. é p PH 6.9 Der Herzmuskel hat nur eine Bedarfsperfusion über die Koronararterien. Bei Erhöhung des Sauerstoffbedarfs steigt auch die Koronarperfusion an. An dieser Perfusionsanpassung sind myogene, metabolische (z. B. Adenosin, Milchsäure), endothelvermittelte (z. B. NO, Prostacyclin) und nervale Mechanismen (Sympathikus) der Vasoregulation beteiligt. Im linken Ventrikel ist die Koronarperfusion diskontinuierlich. Sie sistiert während der Systole. Funktionelle Kopplung von Herz und Kreislauf l l l Herz und Kreislaufsystem sind funktionell eng gekoppelt. Der Blutdruck im arteriellen System ist abhängig von der Pumpleistung; die Pumpleistung hängt wiederum vom venösen Rückstrom ab. Beim aufrechten Stehen (Orthostase) wird das Venensystem in der unteren Körperhälfte gedehnt. Als Folge sinkt der venöse Rückstrom Vorwärts- und Rückwärtskopplung des linken Ventrikels. Kleiner und groûer Kreislauf bilden zusammen ein geschlossenes System mit zwei in Serie geschalteten Pumpen, dem 172 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* rechten und dem linken Herzen. Die Kopplung des linken Ventrikels an das arterielle System erfolgt durch die Abhängigkeit des Schlagvolumens von der Nachlast (aortaler Mitteldruck). Bei sinkender Nachlast steigt das Schlagvolumen, da sich die Aortenklappe früher öffnet und mit geringerem Kraftaufwand Blut ausgeworfen werden kann. Die Erhöhung des Schlagvolumens führt zu einem Anstieg des mittleren Aortendrucks (Abschn. C-7.6), d. h. sie erhöht kompensatorisch wieder die Nachlast. Eine enge funktionelle Kopplung zwischen rechtem und linkem Ventrikel wird durch den Frank-Starling-Mechanismus ermöglicht. Der rechte Ventrikel bestimmt durch seine Förderleistung die diastolische Füllung des linken Ventrikels und damit auch dessen Förderleistung. Die Pumpfunktion des rechten Ventrikels ist wesentlich vom venösen Rückstrom bestimmt. Nach dem Ohmschen Gesetz ist der venöse Rückstrom abhängig vom Widerstand des Venensystems und der Druckdifferenz zwischen Peripherie und den herznahen, zentralen Anteilen des Venensystems. Die Widerstände im venösen Systems sind verglichen mit denen im arteriellen System sehr gering, deshalb gibt es auch zwischen venöser Peripherie und den zentralen Venen nur eine geringe Druckdifferenz. Kopplung von Herz und venösem Rückstrom. Für die Kopplung von venösem Rückstrom und Pumpfunktion des Herzens besteht eine gegensätzliche Abhängigkeit vom zentralen Venendruck (Abschn. C-7.6). Steigt dieser an, vermindert sich der venöse Rückstrom, die Pumpfunktion verbessert sich aber wegen der gröûeren Vordehnung des rechten Ventrikels. Diese Abhängigkeiten lassen sich als zwei unabhängige Kurven darstellen, die aber nur experimentell so zu trennen sind. Im gekoppelten System eines intakten Kreislaufs ist der Schnittpunkt dieser beiden Kurven der einzige mögliche Arbeitspunkt (Abb. 6-25 a). Verschiebungen des Arbeitspunkts sind möglich durch Veränderung der Kurven des venösen Rückstroms, durch Veränderungen des peripheren Venendrucks oder durch Veränderung der Funktionskurve des Herzens, d. h. durch Veränderung des Inotropiezustands. Normalerweise beträgt im Liegen der periphere Venendruck ca. 7 mmHg, der zentrale Venendruck nur 0±1 mmHg. Diese Druckdifferenz stellt die treibende Kraft dar, mit der während der Diastole der rechte Ventrikel gefüllt werden kann. Steigt der zentrale Venendruck (ZVD), vermindert sich die Druckdifferenz und damit auch der Rückstrom von Blut zum Herzen (Abb. 6-25 a). Wird der ZVD im Extremfall gleich dem peripheren Venendruck, kommt der Rückstrom zum Stehen. Auch eine Verminderung des peripheren Venendrucks, z. B. als Folge eines venösen Tonusverlusts oder einer verminderten venösen Füllung (Blutverlust), reduziert den venösen Rückstrom. Als Folge einer Verminderung des Rückstroms nimmt dann das vom rechten und linken Herzen geförderte Herzzeitvolumen ab (Abb. 6-25 a, A ® B). Umgekehrt nimmt das Herzzeitvolumen zu, wenn der periphere Venendruck durch Steigerung des Venentonus oder vergröûerte venöse Füllung ansteigt (Abb. 6-25 a, A ®C). Veränderungen des zentralen Venendrucks werden im Wesentlichen durch ¾nderung des Inotropiezustands des Herzens bestimmt. Vermindert sich die Inotropie, bleibt am Ende der Austreibungsphase ein gröûeres Restvolumen im rechten Herzen liegen. Dies behindert den Einstrom von Blut Herzzeitvolumen oder –1 venöser Rückstrom [L min ] 12 HZV 8 Venenkonstriktion C A Normalsituation B 4 Venendilatation 0 –2 0 2 4 6 8 10 zentraler Venendruck [mmHg] a –1 Herzzeitvolumen oder venöser Rückstrom [L min ] (Abb. 6-25 b, D ® E). Auf diese Weise beeinflusst der Inotropiezustand des Herzens den venösen Rückstrom, d. h. die beiden hämodynamischen Parameter sind miteinander gekoppelt. 24 Sympathikusaktivierung (positive Inotropie) 20 16 Herz-Kreislauf-Kopplung bei Orthostase. Beim Lagewechsel aus dem Liegen in das Stehen addiert sich zu den hämodynamisch erzeugten Drücken noch der Einfluss der Schwerkraft. Dies führt dazu, dass sich die arteriellen und venösen Drücke im Fuûbereich um etwa 130 mmHg erhöhen, während sie im Kopfbereich um etwa 50 mmHg abnehmen (Abschn. C-7.12). Da die Venen sehr dehnbar sind, führt die Druckerhöhung beim Aufstehen zu einer akuten Speicherung von Blut in den Beinvenen (ca. 0,5 L). Als Akutreaktion sinken dadurch der venöse Rückstrom und folglich das Herzzeitvolumen ab (Abschn. C-7.12). l l l Mechanosensoren in den Vorhöfen vermitteln eine reflektorische Kontrolle des venösen Rückstroms 12 Normalsituation E VR 8 D C Herzinsuffizienz (negative Inotropie) A 4 B Sympathikus 0 –2 0 2 4 6 8 10 zentraler Venendruck [mmHg] b Abb. 6-25. (a) Abhängigkeit des venösen Rückstroms zum Herzen vom zentralen Venendruck. Der Rückstrom ist bei Venenkonstriktion oder erhöhter venöser Füllung (Hypervolämie, Transfusion) gesteigert und bei Venendilatation oder Blutverlust vermindert. Die gestrichelten Kurven zeigen die Abhängigkeit des Herzzeitvolumens (HZV) vom zentralen Venendruck. Die schwarzen Kreise zeigen die möglichen Arbeitspunkte eines geschlossenen Kreislaufsystems (venöser Rückfluss Herzzeitvolumen). (b) Abhängigkeit des Herzzeitvolumens (HZV) vom zentralen Venendruck. Unter Sympathikusstimulation ist die HZVKurve steiler (positive Inotropie), unter Herzinsuffizienz abgeflacht (negative Inotropie). Die gestrichelten Kurven zeigen die Abhängigkeit des venösen Rückstroms (VR) vom zentralen Venendruck. Punkt A ist der Arbeitspunkt des Herzens unter Kontrollbedingungen. Unter Sympathikusstimulation zeigt das Herz positive Inotropie und das Venensystem wird tonisiert. Damit wird der Arbeitspunkt von A nach E verlagert. B stellt den Arbeitspunkt des insuffizienten Herzens ohne Venentonisierung durch den Sympathikus dar. C stellt eine hämodynamisch kompensierte Situation bei Herzinsuffizienz dar, die durch sympathische Venentonisierung erreicht wird aus den zentralen Venen während der nachfolgenden Diastole, und der zentrale Venendruck steigt an. Als Folge nimmt der venöse Rückstrom ab (Abb. 6-25 b, A ® B). Tonisierung der Venen durch Sympathikusaktivierung verbessert den venösen Rückstrom wieder (Abb. 6-25 b, B ® C). Umgekehrt kommt es bei positiver Inotropie zu einem Absinken des zentralen Venendrucks und damit zu einer Vergröûerung des venösen Rückstroms (Abb. 6-25 b, A ® D). Tonisierung der Venen durch Sympathikusaktivierung verstärkt diesen Effekt Mit dem N. vagus (Abschn. B-3.7, C-4.2) verlaufen afferente Fasern, die ihren Ursprung in Mechanosensoren in den beiden Vorhöfen haben. Die so genannten A-Sensoren werden durch Zunahme der aktiven Muskelspannung im Vorhof, die so genannten B-Sensoren durch passive Dehnung aktiviert. Die durch stärkere Vordehnung der Vorhöfe erzeugten afferenten Impulse hemmen im ZNS die Kerne des Sympathikus und aktivieren die des Parasympathikus. Daraus resultiert ein Absinken des Herzzeitvolumens, eine periphere arterielle Vasodilatation und eine Verminderung des venösen Tonus (Abschn. C-7.10). Zusätzlich wird auch die Ausschüttung von antidiuretischem Hormon vermindert, was zu einer Volumenausscheidung über die Niere führt (Henry-Gauer-Reflex). Diese reflektorischen Effekte wirken der Volumenfüllung des rechten Vorhofs entgegen. l l l Herzmuskelzellen des rechten Vorhofs bilden Peptidhormone (ANP, BNP), die bei Wanddehnung freigesetzt werden und in der Niere die Wasserund Natriumausscheidung stimulieren Endokrine Funktion von Herzmuskelzellen. Herzmuskelzellen können auch Peptidhormone bilden. Die bekanntesten sind die eng verwandten Peptide ANP (atriales natriuretisches Peptid) und BNP (brain natriuretic peptide). Das im gesunden Herzen mengenmäûig dominierende ANP wird als Vorform (Pro-ANP) in den Kardiomyocyten vor allem der Vorhöfe gebildet und in Vesikeln gespeichert (Abschn. C7.11). Wird der Vorhof gedehnt (z. B. als Folge einer Zunahme des zentralvenösen Volumens), wird ANP ± ein aus 28 Aminosäuren bestehendes Peptid ± abgespalten und gelangt in die Zirkulation. In der Niere bewirken natriuretische Peptide eine Erhöhung der Wasser- und Natriumausscheidung (Abschn. C-7.11, C-14.10). Dieser Effekt reduziert das Blutvolumen. Dadurch nimmt die Dehnung des rechten Vorhofs wieder ab. Dieser endokrin gesteuerte Regelkreis unterstützt 6.9 Funktionelle Kopplung von Herz und Kreislauf Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 173 den Henry-Gauer-Reflex, der die Vorhofdehnung über Nervenendigungen registriert und die renale Wasserausscheidung über das antidiuretische Hormon (ADH) steuert (Abschn. C-3.2, C-14.6). Im fetalen Herzmuskel exprimieren auch ventrikuläre Muskelzellen natriuretische Peptide. N. sympathicus N. vagus Ganglion cervicale superius N. cardiacus superior Dieses fetale Muster der Genexpression findet sich auch im insuffizienten Herzmuskel wieder. Deshalb wird häufig die ventrikuläre Expression von ANP, hauptsächlich aber von BNP als molekularer Marker der Herzinsuffizienz verwendet. Ganglion cervicale medium Ganglion stellatum N. cardiacus medius N. recurrens é Herz und Kreislauf arbeiten in enger hämodynamischer Kopplung. Der venöse Rückstrom bestimmt die Füllung und vermittelt über den Frank-Starling-Mechanismus auch die Auswurfleistung des rechten Herzens. Rechter und linker Ventrikel sind ebenfalls über den Frank-Starling-Mechanismus gekoppelt, so dass der venöse Rückstrom indirekt auch das Schlagvolumen des linken Herzens mitbestimmt. Ein akuter Effekt von Orthostase ist die Reduktion des venösen Rückstroms. N. cardiacus inferior Ganglion cardiacum Plexus cardiacus superficialis Plexus cardiacus profundus Plexus coronarius sinister Plexus coronarius dexter p p A 6.10 Innervation des Herzens a PH Anatomie. Das Herz wird von sympathischen und parasympathischen Anteilen des autonomen Nervensystems innerviert (Abb. 6-26, Kap. C-4). Die Zellkörper der präganglionären sympathischen Fasern liegen im zweiten bis vierten Thorakalsegment (Th2±Th4) des Rückenmarks. Die Zellkörper des zweiten efferenten Neurons liegen zum gröûten Teil in den Ganglien des Grenzstrangs, von denen sie in Form gebündelter Herznerven, Nn. cardiaci, zum Plexus cardiacus ziehen. Diese postganglionären Neuronen erreichen alle Substrukturen des Herzens und seiner Gefäûe. Insbesondere werden Sinus- und AV-Knoten sowie das ventrikuläre Erregungsleitungssystem, das Arbeitsmyokard von Ventrikeln und Vorhöfen und das Koronarsystem sympathisch innerviert. Aus axonalen Verdickungen, den so genannten Varikositäten, setzen die postganglionären Neurone Überträgerstoffe frei. Der wichtigste Überträgerstoff ist das Noradrenalin. Viele setzen auch Neuropeptid Y (NPY) frei. NPY wirkt vasodilatierend und kontraktionskraftsteigernd, da es in Glattmuskelzellen und Herzmuskelzellen rezeptorvermittelt die Adenylatcyclase aktiviert. Das Herz wird auch durch parasympathische Fasern des N. vagus innerviert. Die Vagusfasern des ersten efferenten Neurons der Rami cardiaci des N. vagus entstammen dem Nucleus dorsalis des N. vagus in der Medulla oblongata. Die meisten parasympathischen Fasern verlaufen zum Sinusund AV-Knoten und zur Muskulatur der Vorhöfe. Spärlicher 174 Sympathikus l l l Das Herz wird durch sympathische Herznerven und durch den N. vagus innerviert Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* N. vagus Sinusknoten Vorhofmyokard AV-Knoten Kammerschenkel Kammermyokard Koronarterien b Abb. 6-26. Autonome Innervation des Herzens. (a) Makroskopischer Verlauf der Herznerven. (b) Schema der Innervation einzelner Herzstrukturen durch sympathische Herznerven oder den N. vagus kommen sie auch an ventrikulären Blutgefäûen und sehr selten im ventrikulären Myokard vor. Der wichtigste Überträgerstoff des zweiten Neurons ist Acetylcholin. Es werden aber auch andere Überträgerstoffe (z. B. vasoaktives intestinales Polypeptid (VIP) und Substanz P) in vagalen Nervenendigungen des Herzens gefunden, deren physiologische Funktion in dieser Lokalisation unklar ist. Sympathische und parasympa- thische Nervenfasern bilden auûerhalb des Herzbeutels am oberen Gefäûpol des Herzens ein dichtes Geflecht, den Plexus cardiacus. l l l Die sympathische Innervation steigert die Herzfunktion auf Vorhofund Ventrikelebene (Frequenz-, Kraftsteigerung), Innervation durch den N. vagus antagonisiert die sympathischen Vorhofwirkungen (Frequenzsenkung) Funktionelle Effekte. An den Schrittmachern steigert der Sympathikus die Spontanfrequenz (positiv chronotrope Wirkung). Die Fortleitung der Erregung im Erregungsleitungssystem wird beschleunigt (positiv dromotrope Wirkung), was sich besonders deutlich im AV-Knoten auswirkt. Im Bereich der Vorhof- und Kammermuskulatur steigert der Sympathikus die Kraftentwicklung unabhängig von der Vordehnung (positiv inotrope Wirkung). Die Relaxation des Herzmuskels wird ebenfalls beschleunigt (positiv lusitrope Wirkung). Durch direkte und indirekte Effekte erweitert Sympathikusstimulation auch das Koronarsystem (vasodilatatorische Wirkung). Am Herzen wirkt der Sympathikus vor allem über bAdrenorezeptoren (Abschn. C-4.1). Ein Teil der inotropen Wirkung am Herzen wird auch über a-Adrenorezeptoren (Abschn. C-4.1) vermittelt. Bei einer zentralen Sympathikusaktivierung kommt es nicht nur über die lokale Freisetzung von Noradrenalin zu den genannten Wirkungen auf das Herz. Eine zentrale Aktivierung des Sympathikus stimuliert auch die Freisetzung von Adrenalin aus dem Nebennierenmark. Dieses auf dem Blutweg zum Herzen transportierte Neurohormon unterstützt die lokale Wirkung des Sympathikus. Adrenalin hat bei gleicher Konzentration eine stärkere Wirksamkeit als Noradrenalin auf b-Adrenorezeptoren und eine geringere auf a-Adrenorezeptoren. Die lokale Wirkung von Noradrenalin auf b-adrenerg vermittelte Effekte ist dennoch ausgeprägt, da es im Gewebe in hoher Konzentration freigesetzt wird. Entsprechend seiner begrenzten Verteilung ist die Wirkung des Parasympathikus fast ausschlieûlich auf die Strukturen des Vorhofs begrenzt. Hier wirkt er negativ chronotrop am Sinusknoten, negativ inotrop an der Vorhofmuskulatur und negativ dromotrop am AV-Knoten. Die Wirkung wird über so genannte muscarinische Rezeptoren für Acetylcholin an den Zielzellen vermittelt. l l l Im Herzen befinden sich auch sensorische Nervenendigungen für die Schmerzrezeption Schmerzempfindungen aus dem Herzen. Im Myokard und an den Koronargefäûen finden sich auch sensorische Nervenfasern, die auf unterschiedliche chemische Reize ansprechen. Sie verlaufen afferent mit den sympathischen Herznerven oder mit den Ausläufern des N. vagus. Mit den sympathischen Nerven verlaufen die chemosensitiven Afferenzen zum Rückenmark, die Schmerzempfindungen im Herzen, z. B. bei Myokardischämie oder Myokardinfarkt, vermitteln. Das bei Ischämie freigesetzte Adenosin stellt einen wichtigen chemischen Schmerzauslöser dar. Diese nozizeptiven kardialen Afferenzen konvergieren im Tractus spinothalamicus des Rückenmarks mit somatosensorischen Afferenzen aus der Brustwand, der Schulter und dem Arm der linken Körperseite. Dies erklärt vermutlich, warum vom Herzen ausgelöste Schmerzempfindungen häufig in diesen Körperregionen lokalisiert werden (Head-Zonen; Abschn. B-11.4, C-4.4). é 6.11 Das Herz wird sympathisch und parasympathisch innerviert. Sympathisch innerviert sind das Erregungsbildungs- und Erregungsleitungssystem, das Vorhof- und Ventrikelmyokard sowie das Koronarsystem. Parasympathisch innerviert ist nur der Vorhof mit Sinusknoten und AV-Knoten. Sympathische Innervation wirkt positiv chronotrop, dromotrop, inotrop und lusitrop. Parasympathische Innervation wirkt im Vorhof negativ chronotrop und dromotrop. Im Herzen finden sich auch sensorische, chemosensitive Nervenfasern. Solche Afferenzen aus dem Myokard können bei Myokardischämie Schmerzempfindungen vermitteln. Pathophysiologie des insuffizienten Herzens PH l l l Ein Versagen der physiologischen Pumpfunktion, die so genannte Herzinsuffizienz, geht meist mit einer Ventrikeldilatation einher Ursachen und Progredienz. Herzinsuffizienz ist in den westlichen Industrieländern statistisch betrachtet die häufigste Todesursache. Herzinsuffizienz, d. h. ein Versagen der Pumpfunktion unter physiologischen Belastungsbedingungen, kann eine Vielzahl von Ursachen haben. Funktionell versagen kann sowohl die linke als auch die rechte Herzkammer. Drei wichtige Gruppen von Ursachen sollen hier genannt werden: 1. Myokardiale Zellschädigung durch ischämische oder entzündliche Prozesse. Ursachen, die direkt die myokardiale Zellfunktion stören, reduzieren die Inotropie, häufig wirken sie auch proarrhythmogen. Ein Ventrikel mit reduzierter Inotropie dilatiert. Unter Umständen erlaubt dies eine partielle Kompensation der Pumpfunktion durch den Frank-Starling-Mechanismus, der energetische Wirkungsgrad des Ventrikels wird allerdings ungünstig beeinflusst. 2. Lang anhaltende Druckbelastung. Eine lang anhaltende Druckbelastung der Ventrikel entsteht bei pulmonaler oder systemischer Widerstandserhöhung, meistens aufgrund chronischer Gefäûerkrankungen. Das Myokard antwortet in der Regel mit einer Hypertrophie der Ventrikelmuskulatur. Dies stellt zunächst einen Vorgang der Adaptation dar. Insuffizienz tritt auf, wenn das Ventrikelwachstum mit der Druckbelastung nicht Schritt hält. 6.11 Pathophysiologie des insuffizienten Herzens Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* p 175 3. Chronische Volumenbelastung. Bei Störungen der Schlieûfunktion der Herzklappen kommt es zu pendelnden Blutvolumina und zur Volumenüberlastung der Ventrikel. Durch Erhöhung des diastolischen Volumens wird dem Herzen eine energetisch ungünstige Geometrie aufgezwungen. Funktionell unterscheidet man zwischen systolischem und diastolischem Herzversagen. Als systolisches Herzversagen bezeichnet man eine Einschränkung der systolischen Auswurfleistung des Herzens, d. h. eine Einschränkung des Schlagvolumens. Diastolisches Herzversagen bezeichnet eine Einschränkung der Herzentleerung, was zu einem Anstieg der diastolischen Füllungsdrücke führt. Bei Widerstandserhöhung im Ausflusstrakt, d. h. bei Erhöhung der Nachlast, erhöht sich die systolische Wandspannung im Herzen, da jetzt ein gröûerer mittlerer Druck (p) zur Austreibung des Schlagvolumens aufgebracht werden muss. Nach dem LaplaceGesetz (s p r/2 d; Abschn. C-6.7) kann die Wandspannung (s) normalisiert werden, wenn die Wanddicke (d) ohne Vergröûerung des Ventrikelradius (r) zunimmt. Eine solche konzentrische Hypertrophie wird in der Regel in Frühstadien der Drucküberlastung beobachtet. Für die Herzökonomie bleibt die Wachstumszunahme aber nicht ganz folgenlos, da die erhöhte Steifheit eines hypertrophierten Ventrikels auch schon erhöhte Füllungsdrücke bedingt. Überschreitet das Herz (normal ca. 300 g) ein Gewicht von etwa 500 g (kritisches Herzgewicht), so kommt es in der Regel zu einer zunehmenden Dilatation. Diese ist mit einer Radiusvergröûerung des Ventrikelcavums und mit einer Ausdünnung der Wand durch die Verschiebung von Gewebsschichten (Gefügedilatation) verbunden. Beide Veränderungen erhöhen die Wandspannung. Die erhöhte endsystolische Restfüllung des Herzens bedingt einen Anstieg des diastolischen Füllungsdrucks. Auf diese Weise wird im zeitlichen Mittel die Wandspannung in der Diastole erhöht, was einer normalen Koronarperfusion entgegensteht. Es entwickeln sich daher zunehmend ischämische Gewebsschäden, die den Prozess des Organversagens weiter beschleunigen. Volumenüberlastungen des linken Herzens führen sehr viel früher in eine solche dilatative Phase, sie rufen deshalb auch schneller eine manifeste Insuffizienz hervor. Nach Myokardinfarkt kommt es häufig zu einer völlig ungleichmäûigen Formveränderung des Ventrikels. Die Narbenareale werden durch den intraventrikulären Druck zunehmend gedehnt, während das verbleibende vitale Myokard hypertrophiert. Insgesamt resultiert eine ungünstige Geometrie, die ebenfalls in eine Gesamtdilatation des Ventrikels mündet. Prozesse, die mit einer zunehmend ungünstigen Ventrikelgeometrie verbunden sind, nennt man im klinischen Sprachgebrauch Remodeling. Unabhängig von der konkreten auslösenden Ursache ähneln sich die terminalen Stadien der Herzinsuffizienz häufig sehr. Mechanische oder humorale Faktoren beeinflussen im Laufe des Krankheitsgeschehens die Herzmuskelzellen so, dass sie ihren normalen Phänotyp verändern. Typischerweise treten Veränderungen in der Expression von Genen auf, die die cytosolische Calciumkontrolle beeinflussen. Ein Beispiel ist eine verminderte Expression der Ca2+-ATPase des sarkoplasmatischen Reticulums (SERCA). Andere Veränderungen betreffen die Expression von Genen für Proteine des kontraktilen Apparats. Häufig finden sich Gene und Isoformen von Genen exprimiert, die für die Fetalentwicklung charakteristisch sind (z. B. die Gene von ANP, BNP im ventrikulären Myokard). Zum Teil als Folge einer veränderten Genexpression, aber auch durch direkte Zellschädigung kommt es zu Störungen der elektromechanischen Kopplung, der kontraktilen Aktivierung sowie der Relaxation. Diese zellulären Veränderungen beschleunigen die Entwicklung der Insuffizienz. 176 Kapitel C-6 Herz Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* l l l Die Therapie des insuffizienten Herzens versucht vor allem, die Ventrikeldilatation zu begrenzen Therapeutisches Eingreifen und Kompensationsmechanismen. Die therapeutische Intervention zielt in erster Linie darauf ab, die auslösende Ursache eines Herzversagens zu beseitigen (z. B. Senkung von Bluthochdruck, Korrektur eines Klappenfehlers). Oft ist dies aber nicht möglich. Dann muss therapeutisch versucht werden, die Progredienz der Ventrikeldilatation aufzuhalten. Kurzfristig kann man eine Verkleinerung des Ventrikels durch eine positiv inotrope Stimulation erreichen. Klinische Studien haben aber gezeigt, dass dies in der langfristigen Therapie das Überleben der Patienten nicht verbessert. Für die langfristige Therapie scheint es entscheidend zu sein, die zelluläre Wachstumsstimulation zu begrenzen. Hier greifen z. B. Hemmstoffe des Angiotensin-Converting-Enzyms (ACE) ein, da diese die Bildung des Wachstumsfaktors Angiotensin II hemmen. (Angiotensin ist ein vasokonstriktorisches Peptid, das auch das hypertrophierende Wachstum von Gefäûen und Herz begünstigt; Abschn. C7.11.) é Eine Einschränkung der physiologischen Pumpfunktion des Herzens, d. h. Herzinsuffizienz, ist häufig die Folge von Myokardischämie, Druck- oder Volumenbelastung des Herzens. Der insuffiziente Ventrikel akkumuliert zunehmend diastolisches Volumen, ohne den Frank-Starling-Mechanismus nutzen zu können. Als Folge dilatiert er. Ventrikeldilatation verschlechtert die metabolische Ökonomie und leistet einer Progredienz der Insuffizienz weiter Vorschub. Im insuffizienten Herzen ändert sich die Genexpression. Auch dies trägt zur Progredienz bei. USB dA LIC Kc Das Herz ist eine beeindruckend leistungsfähige und langlebige biologische Pumpe. Im Laufe eines 70-jährigen Lebens kontrahiert es sich 2±3 Milliarden Mal. Dies wird über die Lebensspanne von den immer gleichen Herzmuskelzellen durchgeführt, da diese sich nicht mehr teilen. Veränderung der Zellfunktion durch unphysiologische mechanische Dauerbelastung, etwa bei Druck- oder Volumenbelastung des Herzens, durch Zellverlust, wie beim Myokardinfarkt, oder durch Störungen der elektrischen Herzerregung sind die häufigsten Ursachen für lebensbedrohliche Herzerkrankungen. Erkrankungen des Herzens gehören neben den Krebskrankheiten zu den häufigsten Todesursachen in den Industrieländern. In den meisten Fällen leitet sich ein Verständnis der Pathophysiologie von Herzerkrankungen und der therapeutischen Eingriffsmöglichkeiten unmittelbar aus den physiologischen Grundprinzipien ab. 6.11 Pathophysiologie des insuffizienten Herzens Y:/ftb01/auftrag/proedit/l80168/umbruch/teil-c/kap06.3d***18.3.2003***13:22:33 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 177