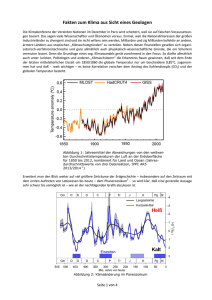
Ermittlung von Störfallbeurteilungswerten für kanzerogene
Werbung

Ermittlung von Störfallbeurteilungswerten für kanzerogene Stoffe – Fortsetzung 3 GESAMTBERICHT Gutachten erstellt im Auftrag des Landesamtes für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen Recklinghausen Forschungs- und Beratungsinstitut Gefahrstoffe GmbH Werthmannstraße 16 • 79098 Freiburg Bearbeitung: Dr. Martin Hassauer, Dr. Ulrike Schuhmacher-Wolz, Dr. Fritz Kalberlah Freiburg, März 2009 2 3 Inhalt Zusammenfassung 1,2-Dibromethan Benzotrichlorid Acrylnitril 4 Zusammenfassung Im vorliegenden Projekt wurden Störfallbeurteilungswerte für nichtkanzerogene Effekte, wie sie z.B. als AEGL-Werte („acute exposure guideline levels“) etabliert sind, bei drei Stoffen einem rechnerischen stoffspezifischen Krebsrisiko von 1:10000 nach Einmalexposition gegenübergestellt. Damit wird es möglich zu entscheiden, ob zur Vermeidung ernster Gesundheitsgefahren möglicherweise bereits unterhalb des AEGL-2- Niveaus (Vermeidung nichtkanzerogener irreversibler Schäden und Vermeidung einer Fluchtbehinderung) wegen einer krebserzeugenden Wirkung Handlungsbedarf im Störfall besteht. Es handelt sich bei diesen drei Substanzen um 1,2-Dibromethan, Benzotrichlorid und Acrylnitril. Die Substanzen wurden in einer vorgeschalteten Machbarkeitsstudie aus einer Liste des Landesamts für Natur, Umwelt und Verbraucherschutz, Nordrhein-Westfalen (LANUV) selektiert. Dabei wurden Prioritäten des LANUV ebenso berücksichtigt wie die Datenlage, die die Quantifizierung des Risikos ermöglichen sollte. Die Methodik wurde unverändert aus Vorgängerprojekten übernommen. Dieses dritte Projekt wurde in der Zeit von September 2008 bis Ende Februar 2009 durch das Forschungs- und Beratungsinstitut Gefahrstoffe GmbH (FoBiG) durchgeführt und mit einer Präsentation der Ergebnisse am 18. März 2009 abgeschlossen. 1,2-Dibromethan Stoffcharakterisierung 1,2-Dibromethan (DBE; CAS: 106-93-4) ist eine leichtflüchtige Flüssigkeit mit einem süßlichen, chloroformähnlichen Geruch. DBE reizt in dampfförmigem oder flüssigem Zustand die Schleimhäute der Augen, oberen Atemwege und gegebenenfalls auch der Haut. Die Substanz wurde von verschiedenen Organisationen als wahrscheinlich für den Menschen krebserregend eingestuft (EU: Kanzerogen Kategorie 2). DBE wurde nicht hinsichtlich Keimzell-Mutagenität und Reproduktionstoxizität eingestuft. Daten zur Kanzerogenität Die Ergebnisse einer Langzeitinhalationsstudie an Fischer 344 Ratten (NTP, 1982) belegen die krebserzeugende Wirkung von DBE. Die Tiere wurden gegen 0, 10 oder 40 ppm DBE (0, 78 oder 313 mg/m3; 6 h/d, 5 d/w, bis zu 106 Wochen) exponiert. Bei den männlichen und weiblichen Tieren der höchsten Dosisgruppe trat eine erhöhte Mortalität auf, so dass die Exposition in diesen Gruppen vorzeitig beendet werden musste. In der Kontroll- und niedrigen Dosisgruppe war die Überlebensdauer vergleichbar. Bei beiden Geschlechtern war die Inzidenz der Karzinome, Adenokarzinome und Adenome der Nasenhöhe und der Haemangiosarkome des Kreislaufsystems zum Teil bereits in der niedrigen Dosisgruppe signifikant erhöht. Bei männlichen Tieren traten weiterhin Mesotheliome der Tunica Vaginalis auf, bei weiblichen Tieren wurden Fibroadenome der Mamma sowie alveoläre und bronchioläre Lungenadenome und –karzinome beobachtet. Vergleichbare Ergebnisse wurden in einer Kanzerogenitätsstudie mit B6C3F1Mäusen, die lebenslang gegen 0, 10 oder 40 ppm DBE exponiert wurden, erzielt. Es traten alveoläre und bronchioläre Adenome und Karzinome (Männchen und 5 Weibchen), sowie bei den Weibchen Haemangiosarkome des Kreislaufsystems, Fibrosarkome im subkutanen Gewebe, Nasenhöhlenkarzinome und Adenokarzinome der Mamma auf. Die krebserzeugende Wirkung des DBE wurde in weiteren Inhalationsstudien und in Untersuchungen mit oraler und dermaler Applikation bestätigt. Vorliegende Humanstudien lassen meist auf Grund von Mängeln bei den Expositionsdaten keine eindeutigen Schlussfolgerungen zu. Daten zur Gentoxizität DBE erwies sich in allen getesteten in vitro Systemen als gentoxisch: DBE ist ein direkt wirksames Mutagen in Bakterien. In Säugerzellen induziert DBE Mutationen, Chromosomenaberrationen, Schwesterchromatidaustausche, DNA-Strangbrüche, Cross-links, außerplanmäßige DNA-Synthese und Zelltransformationen. In vivo traten DNA-Strangbrüche und Cross-links auf, aber keine Induktion von Chromosomenaberrationen und Mikrokernen. DBE bindet in vitro und in vivo an die DNA, RNA und Proteine. Bei vergleichbarer Exposition weisen Ratten 4-5-fach höhere DNA-Adduktlevel auf als Mäuse. Krebserzeugende Potenz bei Einmalexposition Die Berechnungen zur krebserzeugenden Wirkung bei Einmalexposition wurden mit Hilfe der T25 Methode (Berechnung der Dosis, die zu einer Tumorinzidenz von 25% führt) auf Basis der Kanzerogenitätsstudie an Ratten (NTP, 1982) durchgeführt. Bei der Berechnung wurden humanäquivalente Konzentrationen und unter Berücksichtigung der nicht lebenslangen Expositions-/Beobachtungszeit adjustierte Inzidenzen zu Grunde gelegt. Bei der Berechnung der Kanzerogenität nach Kurzzeitexposition auf Basis der chronischen Studie wurde der Standardunsicherheitsfaktor 6 verwendet. Die numerischen Ergebnisse sind in der Tabelle unten dargestellt. Betrachtungen zur krebserzeugenden Wirkung von DBE bei Kurzzeitexposition im Rahmen der AEGL-Wert Ableitung wurden nach der Standardmethode des National Research Councils und unter Berücksichtigung des von der amerikanischen Umweltbehörde EPA auf Basis der Langzeitinhalationsstudie an Ratten (NTP, 1982) abgeleiteten Unit Risks (6 x 10-4 pro µg/m3) durchgeführt. Die sich daraus ergebenden Werte für ein zusätzliches Krebsrisiko von 1:10000 (siehe unten) sind um ca. den Faktor 2 niedriger als die im Rahmen dieser Arbeit abgeleiteten Werte mit Hilfe der T25 Methode. AEGL-Werte Im Rahmen der Aktivitäten des National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL Committee) wurden auf Basis der nicht-kanzerogenen Wirkungen AEGL-Werte für DBE abgeleitet. Die in der nachfolgenden Tabelle berichteten Werte wurden anhand von Inhalationsstudien an der Ratte abgeleitet („proposed“ Status; TECHNICAL SUPPORT DOCUMENT vom 13.07.2007). AEGL-1 Werte wurden auf Basis der Konzentration, die bei bis zu 7stündiger Exposition noch nicht zu adversen Effekten führte, abgeleitet. 6 Lebertoxische Effekte waren ausschlaggebend für die AEGL-2 Werte und die höchste nicht letale Expositionskonzentration für die AEGL-3 Werte. Zeitpunkt 10-min 30-min 1-h 4-h 8-h AEGL-1 (ppm) 52 26 17 7,1 4,6 AEGL-2 (ppm) 73 37 24 10 6,5 AEGL-3 (ppm) 170 76 46 17 10 Vergleich kanzerogene Potenz nach Einmalexposition vs. AEGL-Werte Der Vergleich der AEGL-2 Werte mit den Störfallbeurteilungswerten, die auf Basis der kanzerogenen Wirkung des DBE auf Basis des von der EPA ermittelten Unit Risk oder des T25-Verfahrens abgeleitet wurden, zeigt, dass die AEGL-2 Werte (und auch die AEGL-1 Werte) ca. eine Größenordnung über den kalkulierten Werten für ein Risiko von 1:10000 liegen. Zeitpunkt AEGL-2 Zusätzliches Krebsrisiko 1:10.000 8 Stunden 4 Stunden 1 Stunde (nicht kanzeroKalkuliert nach NTP (1982) gener Endpunkt) unter Verwendung des Unit Risk* 6,5 ppm 0,27 ppm 10 ppm 0,55 ppm 24 ppm 2,2 ppm Kalkuliert nach NTP (1982) unter Verwendung der T25 Methode** 0,53 ppm 1,06 ppm 4,25 ppm * Ableitung im Rahmen der AEGL-Ableitung ** Ableitung im Rahmen dieser Arbeit Schlussfolgerungen Eine Beurteilung der Störfallsituation auf Basis einer chronischen Studie ist mit großen Unsicherheiten behaftet. Der in beiden Fällen verwendete Standardextrapolationsfaktor 6 ist möglicherweise zu hoch, da z.B. Effekte in einer subchronischen Studie, die bei Konzentrationen auftraten, die in der Langzeitstudie kanzerogen waren, bei ausreichender Nachbeobachtungsdauer reversibel waren. Berücksichtigt man weiterhin, • dass der NOAEL in der 13-Wochen-Inhalationsstudie mit Ratten bei 3 ppm lag und somit fast identisch ist mit dem 8-Stunden Störfallwert unter Berücksichtigung kanzerogener Effekte bei einem Risiko von 1:10000, und • dass die Effekte, die nach einwöchiger Exposition gegen 10 ppm DBE aufgetreten sind, vollständig reversibel waren, so kann plausibel angenommen werden, dass die vorliegende Berechnung zu Störfallbeurteilungswerten sehr konservativ ist und vermutlich unter Einhaltung der AEGL-2 Werte auch ein ausreichender Schutz vor kanzerogenen Effekten besteht. 7 Benzotrichlorid Stoffcharakterisierung Benzotrichlorid (CAS: 98-07-7) ist eine farblose bis gelbliche ölige Flüssigkeit mit einem stechenden Geruch. Die Substanz ist für die Haut und Schleimhäute stark reizend. Die Substanz wurde von verschiedenen Organisationen als wahrscheinlich für den Menschen krebserregend eingestuft (EU: Kanzerogen Kategorie 2). Benzotrichlorid wurde nicht hinsichtlich Keimzell-Mutagenität und Reproduktionstoxizität eingestuft. Daten zur Kanzerogenität Es liegen keine aussagekräftigen Studien am Menschen vor, bei denen eine alleinige Exposition gegen Benzotrichlorid bestand. In Tierversuchen mit epikutaner, intragastraler, intraperitonealer und inhalativer Applikation erwies sich Benzotrichlorid als eindeutig krebserzeugend. Neben dem Auftreten lokaler Tumore wurden auch Tumore nach systemischer Verteilung der Substanz beobachtet. In einer chronischen Inhalationsstudie an weiblichen Sprague-Dawley Ratten, die gegen 0, 0,1, 0,4, 1 und 2 ppm Benzotrichlorid (0, 0,8, 3,2, 8,0 und 16,0 mg/m3) exponiert wurden (6 h/d, 5 d/w, 104 Wochen), wurde bei Konzentrationen ≥ 0,4 ppm eine gegenüber der Kontrollgruppe erhöhte Mortalität beobachtet. Todesursachen waren Tumore sowie Begleiterkrankungen, Lungenentzündungen und spontane Erkrankungen. Bei den Tieren der verschiedenen Dosisgruppen traten Atemwegstumore (12-92%) und Nasentumore (28-64%) auf. Neben Tumoren des Atemtrakts wurden vor allem Tumore der Haut und des äußeren Gehörgangs beobachtet (Fukuda und Takemoto, 1980, 1984a, b). Männliche ICR Mäuse wurden über 5 Monate gegen 6,7 ppm (30 Minuten an 2 Tagen pro Woche) exponiert, die Nachbeobachtungszeit betrug 1-5 Monate, in der Kontrollgruppe 12 Monate. Bei den exponierten Tieren wurde eine erhöhte Mortalität und ein insgesamt schlechter Gesundheitszustand beobachtet. Sie wiesen eine gegenüber den Kontrolltieren signifikant erhöhte Tumorinzidenz auf (Lungenadenome und –karzinome, Hautpapillome und –karzinome, maligne Lymphome). Weiterhin wurden bei den Tieren schwere Lungenerkrankungen, Hautund Organschädigungen festgestellt (Yoshimura et al., 1979; 1986). Daten zur Gentoxizität Benzotrichlorid ist nach metabolischer Aktivierung mutagen im Ames Test. Weiterhin traten in vitro DNA-Strangbrüche und die Induktion von Mikrokernen auf. In vivo wurde die Induktion von Chromosomenaberrationen, Mikrokernen und Schwesterchromatidaustauschen beobachtet. 8 Krebserzeugende Potenz bei Einmalexposition Die Berechnungen zur krebserzeugenden Wirkung bei Einmalexposition wurden mit Hilfe der T25 Methode vergleichend auf Basis der Langzeitinhalationsstudie an Ratten (Fukuda und Takemoto, 1980, 1984a, b) und auf Basis der subchronischen Inhalationsstudie an Mäusen (Yoshimura et al., 1979; 1986) durchgeführt. Die Berechnung anhand der Langzeitinhalationsstudie an Ratten erfolgte nach der Standardmethode des NRC (2001). Bei der Benzotrichlorid vermittelten Krebsentstehung kommt der Expositionskonzentration wahrscheinlich eine stärkere Bedeutung als der Expositionsdauer zu. Deshalb wurde bei der Kalkulation des Krebsrisikos bei Kurzzeitexposition auf die Verwendung eines Unsicherheitsfaktors verzichtet. Die sich aus beiden Verfahren ergebenden Werte sind numerisch fast identisch und sind in der unten stehenden Tabelle dargestellt. AEGL-Werte Bislang wurden im Rahmen der Arbeiten des NAC/AEGL Committee keine AEGLWerte auf Basis der nicht-kanzerogenen Wirkungen von Benzotrichlorid abgeleitet, weshalb im Rahmen dieser Arbeit vorläufige AEGL Werte berechnet wurden. Auf Grund des Fehlens geeigneter Daten wurde auf die Ableitung von AEGL-1 Werten verzichtet. Die Ableitung der AEGL-2 Werte erfolgte auf Basis der Daten für den AEGL-3. AEGL-2 Werte wurden als AEGL-3/3 ermittelt. AEGL-3 Werte wurden anhand der Daten einer Inhalationsstudie an Ratten ermittelt. Als Ausgangspunkt für die Berechnungen diente die Expositionskonzentration bei Einmalexposition, die nicht zu Letalität aber der Einschränkung der Fähigkeit zur Flucht führte. Zeitpunkt 10-min 30-min 1-h 4-h 8-h AEGL-1 (ppm) nicht abgeleitet nicht abgeleitet nicht abgeleitet nicht abgeleitet nicht abgeleitet AEGL-2 (ppm) nicht abgeleitet 1,4 ppm 1,1 ppm 0,28 ppm 0,14 ppm AEGL-3 (ppm) nicht abgeleitet 4,25 ppm 3,3 ppm 0,84 ppm 0,43 ppm Vergleich kanzerogene Potenz nach Einmalexposition vs. AEGL-Werte Die abgeleiteten Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung sind numerisch praktisch identisch mit den AEGL-2 Werten. Zeitpunkt AEGL-2 Zusätzliches Krebsrisiko 1:10.000 8 Stunden 4 Stunden 1 Stunde (nicht kanzeroge- T25 Methode, chronische T25 Methode, ner Endpunkt) Studie (Fukuda und subchronische Studie Takemoto, 1980, 1984a, b) (Yoshimura et al., 1979, 1986) 0,14 ppm 0,12 ppm 0,16 0,28 ppm 0,24ppm 0,32 1,1 ppm 0,96 ppm 1,3 9 Schlussfolgerungen Die Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung sind praktisch identisch mit den AEGL-2 Werten. Die ausgewiesenen Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung sind insgesamt als eher konservativ einzustufen: Bei den Berechnungen wurden die tatsächlichen Expositionskonzentrationen auf (niedrigere) kontinuierliche Expositionskonzentrationen umgerechnet. Der Einfluss der Konzentration auf die Tumorentstehung, vermittelt durch eine Reizreaktion, wird dadurch möglicherweise überschätzt. Diese Interpretation wird durch die Beobachtung gestützt, dass eine 1 und 3 monatige Exposition (6 h/d, 5 d/w) von Ratten gegen 1 ppm, also der Konzentration die rechnerisch zu einem zusätzlichen Krebsrisiko von 1:10000 bei einstündiger Exposition führen würde, während der Expositionszeit der Tiere nicht zu neoplastischen Veränderungen oder Tumoren. Es kann deshalb plausibel angenommen werden, dass bei Einhaltung der AEGL-2 Werte auch ein ausreichender Schutz vor der krebserzeugenden Wirkung bei kurzzeitiger Exposition besteht. Acrylnitril Stoffcharakterisierung Acrylnitril (AN) ist eine leichtflüchtige, farblose Flüssigkeit mit einem schwach stechenden Geruch. AN wird hauptsächlich zur Produktion von Acrylfasern, synthetischem Kautschuk und anderen Kunststoffen verwendet. AN reizt Haut und Atemwege, kann ernste Augenschäden verursachen und wirkt sensibilisierend. Daten zur Kanzerogenität In tierexperimentelle Untersuchungen wirkte AN nach inhalativer und oraler Exposition kanzerogen. Die Substanz wurde von verschiedenen Organisationen als wahrscheinlich für den Menschen krebserregend eingestuft. Die zentrale Studie zur Bewertung der Kanzerogenität stellt die Arbeit von Quast et al. (1980) dar, bei der nach inhalativer Exposition über 2 Jahre gegen 0, 20 und 80 ppm (0, 44 und 176 mg/m3) vermehrt Gliazelltumore (Astrozytome) und Zymbaldrüsentumore (beide Geschlechter); Brustdrüsenadenokarzinome (Weibchen) sowie Dünndarmtumore und Plattenepithelzelltumore der Zunge (Männchen) auftraten. Die vorliegenden Humanstudien liefern Verdachtsmomente für einen Zusammenhang zwischen AN-Exposition und dem vermehrten Auftreten von Lungenkrebs, jedoch ist die Evidenz aus epidemiologischen Studien unzureichend. Allerdings stehen die beobachteten Inzidenzen in den Tierstudien quantitativ in Einklang mit den beobachteten Tumorhäufigkeiten beim Menschen. 10 Daten zur Gentoxizität AN wirkte in einer Vielzahl von in vitro-Testsystemen schwach gentoxisch, insbesondere nach metabolischer Aktivierung, während die in vivo-Befunde in Versuchstieren zumeist negativ waren. Humanbefunde ergeben Verdachtsmomente auf gentoxische Wirkung. Krebserzeugende Potenz bei Einmalexposition Mangels geeigneter Kurzzeitdaten wurden auf Basis der Gehirntumore in der chronischen Studie von Quast et al. mittels linearer Verfahren für Kurzzeitexposition folgende Konzentrationen abgeschätzt, welche mit einem Risiko von 1:10000 assoziiert sind. Auf Basis des unit risk (Risiko pro µg/m3) bzw. der T25 (Konzentration, die mit 25% Tumorinzidenz korreliert) resultierten folgende Abschätzungen: 8 h: 72-132 ppm 4 h: 144-264 ppm 1 h: 576-1056 ppm AEGL-Werte Im Rahmen der Aktivitäten des National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL Committee) wurden auf Basis der nicht-kanzerogenen Wirkungen AEGL-Werte für AN abgeleitet („proposed“ Status; TECHNICAL SUPPORT DOCUMENT vom Juli 2007). Zeitpunkt 10 min 30 min 1h 4h 8h AEGL-1 (ppm) 4,6 4,6 4,6 4,6 4,6 AEGL-2 (ppm) 290 110 57 16 8,6 AEGL-3 (ppm) 480 180 100 35 19 Der AEGL-1 Wert stellt eine Konzentration ohne Effekte in einer Freiwilligenstudie dar, gestützt durch Befunde an Berufstätigen. Die AEGL-2-Werte basieren auf Daten zur Reizwirkung in einer Tierstudie unter Berücksichtigung von Sicherheitsfaktoren. Die AEGL-3 Werte wurden anhand von Letalitätsdaten bei Tieren abgeleitet. Alle AEGL-Werte befinden sich im „proposed status“ und sind noch nicht finalisiert. Vergleich kanzerogene Potenz nach Einmalexposition vs. AEGL-Werte Vergleich der Störfallbeurteilungswerte kanzerogener Endpunkte: auf Basis kanzerogener und nicht- 11 Zeitpunkt AEGL-2 Zusätzliches Krebsrisiko 1:10.000 Kalkuliert nach unter Verwendung des unit risk Kalkuliert unter Verwendung der T25 8 Stunden 4 Stunden 1 Stunde (nicht kanzerogener Endpunkt) 8,6 ppm 16 ppm 57 ppm 72 ppm 144 ppm 576 ppm 132 ppm 264 ppm 1056 ppm Schlussfolgerungen Die Gentoxizitätsdaten sprechen für eine schwache gentoxische Aktivität in vitro. In vivo wurden überwiegend negative Befunde erhalten, wenn auch bei beschränkter Datenlage. Für die DNA-schädigende Wirkung wird der oxidativ gebildete Metabolit Cyanoethylenoxid verantwortlich gemacht. Es liegen keine Studien vor, in denen die krebserzeugende Wirkung nach kurzer Expositionszeit untersucht wurde. Gentoxische Effekte wurden bereits nach einmaliger Exposition berichtet. Dies begründet die Ableitung von Störfallbeurteilungswerten auf Basis der kanzerogenen Wirkung. Im Bezug auf die Kanzerogenese im Gehirn von Ratten wird ein indirekter gentoxischer Mechanismus vermutet, welcher auf indirekter DNA-Schädigung infolge von oxidativem Stress der Zellen beruht. Rechnerisch liegen die Störfallbeurteilungswerte auf Basis von Kanzerogenitätsdaten oberhalb der AEGL-2 (und der AEGL-1) Werte für nichtkanzerogene Effekte, was die relativ niedrige kanzerogene Aktivität bei hohen Expositionskonzentrationen widerspiegelt. Je nach verwendeter Methode (ausgehend vom unit risk oder mittels T25) unterscheiden sich die Werte nur um etwa den Faktor 2. Eine Beurteilung der Störfallsituation auf Basis einer chronischen Studie ist mit großen Unsicherheiten behaftet. Es wurde der Standardfaktor 6 zur Berücksichtigung der Unsicherheiten bei der Extrapolation von der chronischen auf die akute Situation angewendet. Dieser Faktor ist möglicherweise zu hoch, wenn man berücksichtigt, dass in Langzeitstudien erste Tumore erst nach 7-12 Monaten beobachtet wurden, die Gentoxizität offensichtlich nur schwach ausgeprägt ist und weitere, indirekt gentoxische Mechanismen der Kanzerogenese relevant sein dürften. Unter diesen Aspekten kann plausibel angenommen werden, dass die vorliegenden Störfallbeurteilungswerte ausreichend Schutz vor kanzerogenen Effekten bieten. Ermittlung von Störfallbeurteilungswerten für kanzerogene Stoffe – Fortsetzung 3 Teilbericht: Stoffbeispiel 1,2-Dibromethan Gutachten erstellt im Auftrag des Landesamtes für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen Recklinghausen Forschungs- und Beratungsinstitut Gefahrstoffe GmbH Werthmannstraße 16 • 79098 Freiburg Bearbeitung: Dr. Fritz Kalberlah Dr. Ulrike Schuhmacher-Wolz Jan Oltmanns, MSc Freiburg, März 2009 1,2-Dibromethan (CAS 106-93-4) 2 1 Stoffbeispiel 1,2-Dibromethan 1.1 Stoffspezifische Daten 1,2-Dibromethan (synonym: Ethylendibromid, Ethylenbromid, DBE) ist eine leichtflüchtige Flüssigkeit mit einem süßlichen, chloroformähnlichen Geruch (BUA, 1991). DBE reizt in dampfförmigem oder flüssigem Zustand die Schleimhäute der Augen, oberen Atemwege und gegebenenfalls auch der Haut (Henschler, 1976/77). Die Substanz wurde von verschiedenen Organisationen als wahrscheinlich für den Menschen krebserregend eingestuft. Organisation Kanzerogenität Kategorie EU 2 DFG (MAK) 2 WHO/IARC 2A EPA „likely to be carcinogenic to humans“ DBE wurde nicht hinsichtlich Keimzell-Mutagenität und Reproduktionstoxizität eingestuft. Für die Umrechnung von mg/m3 in ppm gilt: 1 mg/m3 = 0,128 ppm (BUA, 1991; Henschler, 1976/77). Die humantoxischen Wirkungen der Substanz sind nach Anhang VI der Verordnung 1272/2008/EC mit folgenden R-Sätzen zu kennzeichnen: R45: Kann Krebs erzeugen. R23/24/25: Giftig beim Einatmen, Verschlucken und Berühren der Haut R36/37/38: Reizt die Augen, Atmungsorgane und die Haut 1.1.1 Kanzerogenität Die wenigen vorliegenden Humanstudien lassen auf Grund der fehlenden statistischen Power oder unzureichender Daten zur Exposition keine eindeutige Aussage zu (IARC, 1999: „inadequate evidence in humans“). In Tierversuchen konnte eine krebserzeugende Wirkung eindeutig nachgewiesen werden (IARC, 1999: „sufficient evidence in experimental animals“). Auf Grund der Beobachtungen zur Gentoxizität (vgl. Abschnitt 1.1.2) handelt es sich bei DBE offensichtlich um ein gentoxisches Kanzerogen. 1.1.1.1 Humandaten Untersuchungen an Arbeitern der chemischen Industrie, die gegen verschiedene Chemikalien, unter anderem DBE, exponiert waren, gaben keine Hinweise auf eine signifikant erhöhte Krebsmortalität. Auch Untersuchungen an Arbeitern von Getreidemühlen in den USA, in denen unter anderem DBE als Begasungsmittel eingesetzt 1,2-Dibromethan (CAS 106-93-4) 3 wurde, lassen keine eindeutigen Schlüsse zu: Zwar wurden in einer Studie eine signifikant erhöhte Mortalität durch Non-Hodgkin Lymphome und Bauchspeicheldrüsenkrebs beobachtet, es liegen jedoch keine verlässlichen Expositionsdaten vor (IARC, 1999). 1.1.1.2 Tierdaten Inhalation In einer 2-Jahresinhalationsstudie wurden B6C3F1-Mäuse gegen 0, 10 oder 40 ppm DBE (0, 78 oder 313 mg/m3) für 78-106 Wochen exponiert. Alle männlichen Tiere der behandelten und Kontrollgruppen mussten wegen hoher Mortalität vorzeitig nach 78 Wochen getötet werden (Todesursache meist: aufsteigende eitrige Harnwegsinfekte, nekrotische und ulzerative Läsionen der Harnöffnung, aufsteigende Pyelonephritis). Bei den exponierten Tieren beiderlei Geschlechts war eine dosisabhängig erhöhte Inzidenz alveolärer und bronchiolärer Adenome und Karzinome. Bei den weiblichen Tieren waren weiterhin Haemangiosarkome des Kreislaufsystems, Fibrosarkome im subkutanen Gewebe, Nasenhöhlenkarzinome und Adenokarzinome der Mamma (letztere nicht dosisabhängig) signifikant erhöht (NTP, 1982). DBE induzierte Lungentumore (Adenome) in allen AJ-Mäusen, die gegen 20 oder 50 ppm DBE über 6 Monate (6 h/d, 5 d/w) exponiert wurden (Adkins et al., 1986). Parallel zu der Studie an B6C3F1-Mäusen wurden auch Fischer 344 Ratten untersucht (NTP, 1982). Die Tiere wurden für 6 Stunden/Tag an 5 Tagen/Woche über 88106 Wochen gegen 0, 10 oder 40 ppm (0, 78 oder 313 mg/m3) exponiert (Ganzkörperexposition). Bei den männlichen und weiblichen Tieren der höchsten Dosisgruppe trat eine erhöhte Mortalität auf (ca. 90% bzw. 84%, respektiv), so dass die Exposition in diesen Gruppen vorzeitig beendet werden musste (nach 88 Wochen bei Männchen und nach 91 Wochen bei Weibchen). In der Kontroll- und niedrigen Dosisgruppe war die Überlebensdauer vergleichbar. Bei beiden Geschlechtern war die Inzidenz der Karzinome, Adenokarzinome und Adenome der Nasenhöhe und der Haemangiosarkome des Kreislaufsystems zum Teil bereits in der niedrigen Dosisgruppe signifikant erhöht (siehe Tabelle 1-1). Bei männlichen Tieren der höchsten Dosisgruppe traten Nasentumore bereits nach 43 Wochen (adenomatöse Polypen) auf. Nasenkarzinome waren erstmals nach 56 Wochen sichtbar. Bei männlichen Tieren traten daneben Mesotheliome der Tunica Vaginalis auf. Bei den weiblichen Tieren wurden weiterhin Fibroadenome der Mamma sowie alveoläre und bronchioläre Lungenadenome und –karzinome beobachtet. 1,2-Dibromethan (CAS 106-93-4) Tabelle 1-1 4 Tumorinzidenz bei Ratten, die chronisch inhalativ gegen Dibromethan exponiert wurden (Daten aus NTP, 1982) Tumortyp Männliche Tiere Weibliche Tiere 0 ppm 10 ppm 40 ppm 0 ppm 10 ppm 40 ppm Adenome 0/50 11/50** 0/50 0/50 11/50 3/50 Karzinome 0/50 0/50 21/50** 0/50 0/50 25/50** Adenokarzinome 0/50 20/50** 28/50** 0/50 20/50** 29/50** 0/50 39/50** 41/50** 1/50 34/50** 43/50** 0/50 1/50 15/50** 0/50 0/50 5/50* 0/50 7/50** 25/50** 4/50 29/50** 24/50** 0/50 0/48 5/47* Nasenhöhle Nasentumore insgesamt a Kreislaufsystem Haemangiosarkome Tunica Vaginalis Mesotheliome Brustdrüse Fibroadenome Lunge (Alveolär/bronchioloär) Adenome und Karzinome * p< 0,05; ** p ≤ 0,001 a: Adenome, Adenokarzinome, papilläre Adenome, Plattenepithelzelladenome / -karzinome In einer weiteren Langzeitinhalationsstudie an Sprague-Dawley Ratten, die gegen 0 oder 20 ppm DBE für 18 Monate exponiert wurden (7 h/d, 5 d/w) wurde eine erhöhte Mortalität bei den behandelten Tieren beobachtet. Signifikant erhöht war bei beiden Geschlechtern die Inzidenz der Haemangiosarkome der Milz, der Nebennierentumore, bei den Weibchen die Inzidenz der Mammatumore und bei den Männchen die Inzidenz der subkutanen mesenchymalen Tumore (Wong et al., 1982). Die Nasenhöhle wurde in dieser Studie nicht untersucht. Andere Pfade In einer Untersuchung des NCI (1978) wurde die kanzerogene Wirkung von DBE nach oraler Gabe an B6C3F1-Mäusen getestet. Die Tiere wurden an 5 Tagen die Woche über 53 Wochen exponiert (durchschnittlich 62 und 107 mg/kg · d) und für weitere 24-37 Wochen beobachtet. Bei beiden Geschlechtern traten Vormagentumore (Plattenepithelzellkarzinome) und alveoläre/bronchioläre Adenome auf. Die Inzidenzen waren in den behandelten Tieren jeweils deutlich gegenüber den Kontrolltieren erhöht, jedoch ohne klare Dosis-Wirkungsbeziehung. In einer Trinkwasserstudie an B6C3F1-Mäusen (Männchen: 116 mg/kg · d; Weibchen 103 mg/kg · d über 450 Tage) wurden bei den exponierten Tieren vor allem 1,2-Dibromethan (CAS 106-93-4) 5 Plattenepithelzellkarzinome des Vormagens und vereinzelt papillome der Speiseröhre beobachtet (van Duuren et al., 1985). Plattenepithelzell- Auch in einer Fütterungsstudie an Ratten (Männchen: 38 oder 41 mg/kg · d; Weibchen: 37 oder 39 mg/kg · d; 36 bis 57 Wochen Exposition, 5 Tage/Woche, 2-13 Wochen Nachbeobachtungszeit) war bei den exponierten Tieren eine gegenüber den Kontrollen signifikant erhöhte Inzidenz an Plattenepithelzellkarzinomen des Vormagens zu beobachten. Diese traten bereits nach 12 Wochen auf. Bei den Männchen traten außerdem Hämangiosarkome der Milz auf (statistisch signifikant nur in der niedrigen Dosisgruppe) (NCI, 1978). Swiss-Mäuse, denen dreimal wöchentlich 25 oder 50 mg DBE/Tier auf die rasierte Rückenhaut aufgetragen wurde, entwickelten Hauttumore (Papillome). Diese waren in der höchsten Dosisgruppe statistisch signifikant erhöht (8/30). Weiterhin war bei den exponierten Tieren die Inzidenz an papillären Lungenadenomen statistisch signifikant erhöht (24/30 und 26/30 bei 25 und 50 mg) (Van Duuren et al., 1979). 1.1.2 Gentoxizität Humandaten In zwei unterschiedlichen Studien an Arbeitern, die inhalative gegen DBE-Konzentrationen von durchschnittlich 0,46 mg/m3 oder 0,12-1,35 mg/mg3 (in der zweiten Studie wurden Arbeiter aus sechs verschiedenen Fabriken untersucht) exponiert waren, war gegenüber den Kontrollgruppen kein erhöhtes Auftreten von Schwesterchromatidaustauschen oder Chromosomenaberrationen zu beobachten. Peak-Expositionen erreichten bis zu 17 mg/m3 (IARC, 1999). In humanen lymphoblastoiden Zelllinien wurden ohne exogene metabolisierende Systeme TK-6 und AHH-1 Mutationen induziert (IARC, 1999). Andere Daten DBE erwies sich in allen getesten in vitro Systemen als gentoxisch: DBE ist ein direkt wirksames Mutagen in Bakterien. Die Mutagenität ist in Gegenwart einer hohen Glutathiontransferase-Aktivität besonders ausgeprägt. In Säugerzellen induziert DBE Genmutationen, Chromosomenaberrationen, Schwesterchromatidaustausche, DNAStrangbrüche, Cross-links, außerplanmäßige DNA-Synthese und Zelltransformationen (IARC, 1999). Auch in Drosophila melanogaster erwies sich DBE als mutagen. Geschlechtsgebundene rezessive Letalmutationen wurden in Drosophilamännchen der F2 und F3 beobachtet (IARC, 1999). DBE induziert in vivo bei Ratten und Mäusen DNA-Strangbrüche und Cross-links (in weiblichen Ratten bereits bei 1,8 mg/kg, peroral; üblicherweise wurden sonst einmalige Dosierungen von ≥ 50 mg/kg peroral oder intraperitoneal verabreicht) und außerplanmäßige DNA-Synthese in Hepatozyten männlicher Ratten, aber nicht in Spermatozyten. Negative Ergebnisse wurden weiterhin im Dominant-Letal-Assay in Mäusen und Ratten beobachtet. Weiterhin waren bei CD-1 Mäusen, denen bis zu 168 mg DBE/kg intraperitoneal appliziert wurde, keine Effekte hinsichtlich einer Induktion von Chromosomenaberrationen und Mikrokernen zu erkennen. (Anonymous, 2007; IARC, 1999). Einmalige inhalative Exposition über 2 h gegen 30 ppm DBE führte in der Muta-Maus nicht zu mutagenen Effekten in der Lunge oder Nasenschleimhaut, 1,2-Dibromethan (CAS 106-93-4) 6 während eine über 10 Tage wiederholte Exposition eine erhöhte Mutationsfrequenz in der Nasenschleimhaut bewirkte (Schmezer et al., 1998). In Ratten und Mäusen und in vitro bindet DBE kovalent an DNA, RNA und Proteine. DNA-Bindung in vivo war bereits nach einmaliger intraperitonealer Applikation von 1,2 mg/kg in Ratten und Mäusen nachweisbar (IARC, 1999). Nach einmaliger intraperitonealer Gabe wurden DNA-Addukte (S-[2-(N7-guanyl)ethyl]glutathion) in der Leber verschiedener Ratten- und Mäusestämme nachgewiesen, wobei die Adduktlevel in Ratten 4-5-fach höher als in Mäusen waren (IARC, 1999). 1.1.3 Metabolismus Der Metabolismus von DBE ist gut untersucht. Für eine umfassende Darstellung der komplexen Stoffwechselwege muss an dieser Stelle auf die Literatur verwiesen werden (z.B. EPA, 2004). Nachfolgend wird nur eine vereinfachte Übersicht (siehe Abbildung 1-1) gegeben. In Nagern wird DBE vor allem durch Cytochrom P450 Isoenzyme (insbesondere CYP2E1) oxidiert und durch Glutathion (GSH) konjugiert. Der primäre Metabolit nach CYP2E1-Oxidation ist 2-Bromacetaldehyd. 2-Bromacetaldehyd kann über verschiedene Stoffwechselwege weiter zu S-(2-Hydroxyethyl)glutathion oder S-Carboxymethylglutathion verstoffwechselt werden: durch direkte Wechselwirkung mit Glutathion unter Beteiligung der Glutathiontransferase (GST, insbesondere GST theta), oder durch Oxidation zu 2-Bromethanol und 2-Bromessigsäure und anschließender Glutathionkonjugation. DBE kann auch direkt in einer GST-katalysierten Reaktion mit GSH zu S-(2-Bromethyl)GSH reagieren, das sich spontan zu einem Episulfoniumion umlagert, das an die DNA binden kann (Anonymous, 2007; EPA, 2004; IARC, 1999). Abbildung 1-1 Vereinfachtes Metabolismusschema für Dibromethan (in Anlehnung an Watanabe et al., 2007). DBE-Metabolite werden vor allem (ca. 80%) über den Urin und nur zu geringen Teilen über die Faeces und die Atemluft ausgeschieden (Anonymous, 2007; EPA, 2004; IARC, 1999). 1,2-Dibromethan (CAS 106-93-4) 7 Die durch CYP2E1 gebildeten Metabolite sind überwiegend für die Bindung an Proteine und die daraus resultierende Gewebetoxizität verantwortlich. Während des oxidativen Stoffwechsels kommt es zur Debromierung, einer Erhöhung der internen Bromkonzentration, die zur Lipidperoxidation führen kann (IARC, 1999). Vor allem die durch GSH-Konjugation gebildeten Metabolite sind für die Bildung der DNA-Addukte und folglich für die Gentoxizität und Kanzerogenität verantwortlich. Als Hauptaddukt wurde das S-[2-(N7-guanyl)ethyl]glutathion identifiziert, das mehr als 95% der gebildeten Addukte ausmacht. Daneben wurden drei weitere Guanyl- bzw. Adenyl-Addukte identifiziert. Die DNA-Adduktbildung kann durch eine Induktion des GSH-abhängigen Stoffwechsels oder durch eine Hemmung des oxidativen Stoffwechsels gefördert werden. In der Rattenleber und –niere werden bei gleicher Dosierung höhere Adduktlevel gefunden als in den entsprechenden Organen von Mäusen (IARC, 1999; Watanabe et al., 2007). In vitro Untersuchungen mit humanem und Rattenleberzytosol weisen darauf hin, dass die Metabolismusrate bei der Ratte ca. 2-fach höher als beim Menschen ist. In Nagern dominiert der oxidative Stoffwechsel über den Glutathiontransferase-abhängigen Stoffwechsel (Verhältnis ungefähr 4:1). Im Gegensatz dazu sagen andere Modellberechnungen einen deutlich höheren Anteil der Glutathiontransferase am DBE-Metabolismus gegenüber dem oxidativen Metabolismus bei der Ratte voraus, während beim Menschen beide Stoffwechselwege etwa zu gleichen Teilen beteiligt sind. Nach diesem Modell haben sensitive Menschen ein viel geringeres Risiko als Ratten bezogen auf die durch GST-gebildeten Metabolite (Anonymous, 2007; IARC, 1999). Für den Menschen ist eine polymorphe Ausprägung der Cytochrom P450 Enzyme und der Glutathiontransferasen bekannt (Anonymous, 2007; EPA, 2004). 1.2 Berechnung der krebserzeugenden Potenz von 1,2-Dibromethan nach Einmalexposition 1.2.1 Mechanistische Überlegungen Eine gentoxische Wirkung konnte für DBE in Bakterien und verschiedenen Säugerzellen in vitro nachgewiesen werden. Aus in vivo Untersuchungen liegen Verdachtsmomente (Induktion von DNA-Strangbrüchen, Cross-links , außerplanmäßiger DNASynthese) vor. Weiterhin konnte in vitro und in vivo die Bindung von DBE an die DNA, RNA und Proteine nachgewiesen werden. DBE erwies sich in verschiedenen Langzeituntersuchungen nach oraler, inhalativer und dermaler Applikation als kannzerogen im Tierversuch, so dass plausibel angenommen werden kann, dass es sich bei DBE um ein gentoxisches Kanzerogen handelt. Es liegen keine Studien vor, in denen das Auftreten von Tumoren nach Kurzzeitexposition mit entsprechender Nachbeobachtungszeit untersucht wurde. Nitschke und Mitarbeiter (1981) exponierten männliche und weibliche Ratten bis zu 13 Wochen lang (6 h/d, 5 d/w) gegen 0, 3, 10 oder 40 ppm DBE. Die Nachbeobachtungszeit betrug 88 Tage. Zwischenuntersuchungen wurden nach 1 und 6 Wochen durchgeführt (d.h. 5, 29 bzw. 68 Expositionstage). Neben der Untersuchung klinisch chemischer Parameter, wurden zu den angegebenen Zeitpunkten das Körpergewicht, Organgewichte und histopathologische Untersuchungen des Atemtrakts (Untersuchung der Lunge, Bronchien, Trachea und der Nasenmuschel auf 4 Ebenen) sowie von Leber, Niere, Testes, Ovarien, Uterus und Eileiter durchgeführt. Der Atem- 1,2-Dibromethan (CAS 106-93-4) 8 trakt erwies sich als am empfindlichsten gegenüber einer DBE-Exposition. Bei 10 ppm waren zu allen Untersuchungszeitpunkten eine leichte epitheliale Hyperplasie der Nasenmuschel sichtbar, die am Ende der Nachbeobachtungszeit vollständig reversibel war. In der höchsten Dosisgruppe (40 ppm) war das Körpergewicht vermindert, das Leber- und Nierengewicht erhöht, weiterhin wurden eine Hyperplasie, eine nicht keratinisierende schuppenartige Metaplasie des Respirationsepithels der Nasenmuschel beobachtet, die bei 19/20 Tieren am Ende der Nachbeobachtungszeit reversibel war. Bei einem Tier verblieb ein isolierter hyperplastischer Focus, der nach Meinung der Autoren bei etwas verlängerter Nachbeobachtungszeit reversible gewesen wäre. Der NOAEL lag in dieser Studie bei 3 ppm. Diese Daten werden unterstützt durch die Untersuchungen von Reznik et al. (1980), die Fischer Ratten und B6C3F1 Mäuse über 13 Wochen (6 h/d, 5 d/w, whole body) gegen 0, 3, 15 oder 75 ppm exponierten. Vier männliche Mäuse der niedrigsten Dosisgruppe verstarben vor dem Ende der Expositionszeit (genauer Zeitpunkt und Todesursache nicht angegeben). Histomorphologische Veränderungen waren nur im Atemtrakt (Nasenhöhle, Luftröhre, Lunge) der Tiere zu beobachten, bei Ratten bereits bei 15 ppm und bei 75 ppm sowohl bei Ratten als auch bei Mäusen (Zytomegalie, fokale Hyperplasie, squamöse Metaplasie, Zilienverlust). Diese beiden subchronischen Studien, insbesondere die Zwischenuntersuchung von Nitschke et al. (1981) nach einer Woche, zeigen, dass in dem Konzentrationsbereich, in dem in der chronischen Studie Tumore beobachtet wurden, auch in der Kurzzeitstudie bereits Schädigungen in der Nase, dem Hauptzielorgan bei der Kannzerogenese nach Inhalation, auftreten können. Nitschke et al. (1981) beschreiben zwar, dass diese Veränderungen nach einer ausreichenden Erholungsphase reversibel waren, auf Grund der Beobachtungen zur Gentoxizität und Bindung von DBE an DNA, RNA und Proteine bereits nach einmaliger intraperitonealer oder peroraler Exposition kann aber nicht mit Sicherheit ausgeschlossen werden, dass auch bereits eine Kurzzeitexposition zu bleibenden Schäden führt. Für eine endgültige Bewertung wären Daten zur DNA-Bindung nach inhalativer Exposition notwendig. Auf Grund dieser Beobachtungen wird eine Betrachtung von DBE in Hinblick auf eine Störfallsituation als relevant erachtet. Wegen des Fehlens von Kurzzeitstudien wird die Berechnung von Störfallbeurteilungswerten für DBE auf Basis der NTP-Kanzerogenitätsstudie an Ratten (NTP, 1982) durchgeführt. Diese Studie diente auch als Basis für die Unit Risk Berechnung der EPA und war Grundlage für die Abschätzung des National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL Committee) für die kanzerogene Kurzzeitwirkung von DBE. 1.2.2 Verwendung stoffspezifischer Daten 1.2.2.1 Verwendung von Kanzerogenitätsdaten Unit Risk Ableitung der EPA Die EPA (2004) leitete auf Basis der chronischen Inhalationsstudie an Ratten (NTP, 1982) ein inhalatives Unit Risk in Höhe von 6 x 10-4 pro µg/m3 ab. Das Unit Risk ist nach Angaben der EPA (2004) nicht bei Expositionskonzentrationen > 0,003 ppm (0,023 mg/m3) ppm anzuwenden, da bei höheren Konzentrationen kein linearer 1,2-Dibromethan (CAS 106-93-4) 9 Dosis-Wirkungszusammenhang besteht. Basis für die Kalkulation war die Inzidenz der Nasentumore in männlichen Ratten. Die Expositionskonzentrationen wurden in Werte für kontinuierliche Exposition umgerechnet (x 6/24, x 5/7). Wegen der beobachteten lokalen Effekte wurde unter Berücksichtigung der physikalisch/chemischen Eigenschaften des DBE, des Inhalationsvolumens von Ratte und Mensch und der Oberfläche des Atemtrakts von Ratte und Mensch die Expositionskonzentration in eine humanäquivalente Konzentration umgerechnet (EPA, 2004): RGDR(ET) = (MVa/Sa)/(MVh/Sh) RGDR(ET) : “regional gas dose ratio for the nasal cavity” (Atemtrakt außerhalb des Thorax)” MVa : Atemminutenvolumen Tier (männliche Ratte : 0,21 L/min) MVh : Atemminutenvolumen Mensch (13,8 L/min) Sa : Oberfläche des tierischen Atemtrakts außerhalb des Thorax (Ratte : 15 cm2) Sh : Oberfläche des menschlichen Atemtrakts außerhalb des Thorax (200 cm2) RGDR(ET)Ratte/Mensch = (0,21/15)/(13,8/200) = 0,20 Mit Hilfe des „Poly-3 Verfahren“ wurde berücksichtigt, dass die Tiere nicht alle bis zum Studienende überlebten: Adjustierung der Tierzahlen im Nenner mittels (t/104)3, mit t = Zeitpunkt der Tötung der jeweiligen Dosisgruppe. Somit ergeben sich die in Tabelle 1-2 angegebenen Expositionskonzentrationen und angepassten Inzidenzen. Tabelle 1-2 Nasentumore (Adenome, Adenokarzinome, papilläre Adenome, Plattenepithelzelladenome / -karzinome) bei männlichen Ratten in der Langzeitinhalationstudie von NTP (1982) Expositionkonzentration (ppm) Äquivalente kontinuierliche Konzentration (ppm) a Humanäquivalente kontinuierliche Konzentration (ppm) b Adjustierte Nasentumorinzidenz c 0 0 0 1/46 (2%) 10 1,8 0,36 39/45 (86,7%) 40 7,1 1,42 41/43 (95%) a Expositionskonzentration x 6/24 x 5/7 äquivalente kontinuierliche Konzentration x 0,20 c adjustiert mittels Poyl-3-Verfahren (siehe Text) b Die Dosis-Wirkungsbeziehung wurde mit Hilfe des „multistage models“ oder des „loglogistic models“ modelliert. Für die Extrapolation in den Niedrigdosisbereich wurde als „point of departure“ ein Wert in der Nähe des beobachteten Bereichs gewählt (im 1,2-Dibromethan (CAS 106-93-4) 10 Falle der Nasentumoren: benchmark response 87%) gewählt und der Wert des unteren 95%-Vertrauensinterval bei der Benchmark Response (BMCL87 = 0,18 ppm für die Nasentumore) aus der Dosis-Wirkungsbeziehung ermittelt. Zur Berechnung des Unit Risk wurde dann linear in den Niedrigdosisbereich extrapoliert (0,87 / 0,18 = 4,8 ppm-1). Dies entspricht einem Unit Risk von 0,6 (mg/m3)-1 = 6 x 10-4 pro µg/m3. NAC/AEGL-Kanzerogenitätsbewertung für DBE Auf Basis des von der EPA (2004) berechnete Unit-Risk in Höhe von 6 x 10-4 pro µg/m3 führte das NAC/AEGL seine Kalkulationen zur kanzerogenen Wirkung von DBE bei Kurzzeitexposition durch. Diese wurde nach der Standardmethode des National Research Council (2001) durchgeführt. Ausgehend von dem Unit Risk von 6 x 10-4 pro µg/m3 wurde die „virtually safe dose“ (VSD) bei einem Risiko von 1:10000 berechnet: d = 10-4 / (6 x 10-1 (mg/m3))-1 = 1,67 x 10-4 mg/m3 Diese Berechnungen gehen von einer lebenslangen Exposition (70 Jahre = 25600 Tage) aus. Für eine Kurzzeitexposition von einem Tag ergibt sich somit: Gesamt-d = d x 25600 = 1,67 x 10-4 mg/m3 x 25600 = 4,27 mg/m3 Das NAC/AEGL verwendete einen Standardunsicherheitsfaktor von 6, um die Unsicherheiten bei der Berechnung der Kanzerogenität nach Kurzzeitexposition auf Basis einer chronischen Studie zu berücksichtigen: 4,27 mg/m3 / 6 = 0,71 mg/m3 = 0,091 ppm (Anmerkung: An dieser Stelle liegt im TSD ein Rechenfehler/Schreibfehler vor, statt 0,71 mg/m3 wurde mit 71 mg/m3 weitergerechnet. Die nachfolgend ausgewiesenen Werte unterscheiden sich deshalb von den „falschen“ Werten, wie sie in dem TSDDokument stehen um den Faktor 100.) Eine Konzentration von 0,091 ppm über 24 Stunden würde also einem Risiko von 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Beziehung cn x t = k mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 0,27 ppm 4 h: 0,55 ppm 1 h: 2,2 ppm T25-Konzept Für die Berechnungen nach dem T25-Konzept (zur Methodik vergleiche AGS, 2008) wurden die Daten für Nasentumore bei männlichen Ratten zu Grunde gelegt, da bei diesen Tumoren bereits in der niedrigsten Expositionskonzentration eine hohe Tumorinzidenz beobachtet wurde. Der sich daraus ergebende Wert für T25 ist niedriger als der entsprechende Wert auf Basis der Ergebnisse in weiblichen Tieren. Zur Berechnung wurden wie bei der Unit Risk Ableitung die humanäquivalenten Konzentrationen und die mittels Poly-3-Prozedur adjustierten Inzidenzen zu Grunde gelegt (vgl. 1,2-Dibromethan (CAS 106-93-4) 11 Tabelle 1-2). T25 = 0,36 ppm x (0,25/(0,867 – 0,02) x (1 – 0,02)/1) = 0,104 ppm Linear umgerechnet auf ein 1:10000 Risiko ergibt sich auf Basis der T25: Tumorrisiko 1:10000 bei 0,0000416 ppm Diese Berechnungen gehen von einer lebenslangen Exposition (70 Jahre = 25600 Tage) aus. Für eine Kurzzeitexposition von einem Tag ergibt sich somit: Gesamt-d = 0,0000416 ppm x 25600 = 1,06 ppm Unter Verwendung eines Standardunsicherheitsfaktor von 6, um die Unsicherheiten bei der Berechnung der Kanzerogenität nach Kurzzeitexposition auf Basis einer chronischen Studie zu berücksichtigen, ergibt sich: 1,06 ppm / 6 = 0,177ppm Eine Konzentration von 0,177 ppm über 24 Stunden würde also einem Risiko von 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Beziehung cn x t = k mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 0,53 ppm 4 h: 1,06 ppm 1 h: 4,25 ppm 1.2.2.2 Verwendung von Gentoxizitätsdaten Es liegen, bis auf die Untersuchungen an der Muta-Maus, keine Daten zur Gentoxizität/Bindung an biologische Makromoleküle nach inhalativer Exposition vor. Die Verwendung der Daten nach peroraler oder intraperitonealer Applikation erscheint nicht sinnvoll, da bei DBE auf Grund des schnellen Metabolismus in der Leber von einem effizienten first-pass-Effekt ausgegangen werden kann. Auf eine Kalkulation anhand dieser Gentoxizitätsdaten muss daher verzichtet werden. Wie bereits im Abschnitt 1.1.2 (Gentoxizität) erwähnt, führte einmalige inhalative Exposition über 2 h gegen 30 ppm DBE in der Muta-Maus nicht zu mutagenen Effekten in der Lunge oder Nasenschleimhaut, während eine über 10 Tage wiederholte Exposition eine erhöhte Mutationsfrequenz in der Nasenschleimhaut bewirkte (Schmezer et al., 1998). Diese Daten stützen grundsätzlich die Annahme, dass bereits eine Exposition über kurze Zeiträume zu Schädigungen des Erbmaterials führen kann, die in der Folge möglicherweise zur Tumorentstehung führen können. Eine Quantifizierung auf Basis der Befunde in der Muta-Maus ist jedoch derzeit nicht möglich wegen der zu großen Unterschiede zwischen Mensch und transgenen Tieren. 1.3 AEGL-Werte für 1,2-Dibromethan Im Rahmen der Aktivitäten des National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL Committee) wurden AEGLWerte für DBE abgeleitet. Das „Technical Support Document“ (vom 13.07.2007) ist noch nicht finalisiert und befindet sich im „proposed“ Status. In der Endfassung des 1,2-Dibromethan (CAS 106-93-4) 12 TSD können sich also noch Änderungen gegenüber den hier dargestellten Werten ergeben. AEGL-1 Werte wurden auf Basis der Daten zur akuten Inhalation bei Ratten abgeleitet (Rowe et al., 1952). Eine Exposition der Tiere gegen 50, 100, 200 oder 800 ppm für 420, 150, 42 oder 6 Minuten führte nicht zu adversen Effekten. Ausgangspunkt (point of departure) für die AEGL-1 Ableitung war die Exposition der Tiere über 420 Minuten gegen 50 ppm, der niedrigsten Konzentration und der längsten Expositionsdauer ohne Effekt. Es wurde ein Gesamtunsicherheitsfaktor von 10 gewählt (Faktor 1 für die Interspezies- und Faktor 10 für die Intraspeziesvariabilität). Der Faktor 1 für die Interspeziesvariabilität wurde für ausreichend erachtet, da Ratten ca. 3-fach höhere DBE-Mengen als der Mensch aufnehmen (Kalkulation mittels PBPK-Modell) und deutlich mehr toxische Metabolite als der Mensch bilden. Mögliche geringe pharmakodynamische Unterschiede sind demgegenüber zu vernachlässigen. Auf Grund der beobachteten genetischen Variabilität beim Menschen bezüglich der Cytochrom P450 und Glutathiontransferase-abhängigen Bildung der DBE-Metabolite wurde ein Intraspeziesfaktor 10 gewählt. Für die Zeitextrapolation wurde ein Wert von n = 1,6 ermittelt. AEGL-2 Werte basieren auf akuten Inhalationsdaten bei der Ratte (Rowe et al., 1952). Bei Ratten, die für 9, 60 oder 240 Minuten gegen 800, 200 oder 100 ppm exponiert wurden, wurden erhöhte Lebergewichte und leichte histopathologische Veränderungen (ohne weitere Spezifizierung) der Leber beobachtet. Diese Effekte liegen unterhalb des AEGL-2 Niveaus. Ausgangspunkt (point of departure) für die AEGL-2 Ableitung war die Exposition der Tiere über 240 Minuten gegen 100 ppm. Es wurde ein Gesamtunsicherheitsfaktor von 10 angewendet (Faktor 1 für die Interspezies- und Faktor 10 für die Intraspeziesvariabilität, Begründung siehe oben). Für die Zeitextrapolation wurde ein Wert von n=1,6 ermittelt. AEGL-3 Werte wurden anhand der Daten zur Letalität bei Ratten nach inhalativer Exposition ermittelt (Rowe et al., 1952). Keins der Tiere, die gegen 100 ppm DBE für 8,5 Stunden exponiert wurden, starb während der dreiwöchigen Nachbeobachtungszeit. Von diesem Ausgangspunkt (point of departure) aus und mit einem Gesamtunsicherheitsfaktor von 10 (Faktor 1 für die Interspezies- und Faktor 10 für die Intraspeziesvariabilität, Begründung siehe oben) und einem kalkulierten n von 1,4 wurden die AEGL-3 Werte für die einzelnen Zeitpunkte ermittelt. Die nachfolgende Tabelle bietet eine Übersicht über die einzelnen AEGL-Werte. Es fällt auf, dass die AEGL-1, AEGL-2 und AEGL3 Werte zum Teil sehr dicht beeinander liegen. Insbesondere für die längeren Zeitpunkte liegen AEGL-1 und AEGL-3 nur um ca. Faktor 2 auseinander. Tabelle 1-3 AEGL-1, AEGL-2- und AEGL-3-Werte für DBE (Anonymous, 2007) Zeitpunkt AEGL-1 (ppm) AEGL-2 (ppm) AEGL-3 (ppm) 10-min 52 73 170 30-min 26 37 76 1-h 17 24 46 4-h 7,1 10 17 1,2-Dibromethan (CAS 106-93-4) 8-h 1.4 13 4,6 6,5 10 Vergleich kanzerogene Potenz nach Einmalexposition vs. AEGL-Werte Der Vergleich der AEGL-2 Werte mit den Störfallbeurteilungswerten, die auf Basis der kanzerogenen Wirkung des DBE nach der Methode des NRC (2001) auf Basis des von der EPA (2004) ermittelten Unit Risk oder des T25-Verfahrens abgeleitet wurden, zeigt, das die AEGL-2 Werte (und auch die AEGL-1 Werte) ca. eine Größenordnung über den kalkulierten Werten für ein Risiko von 1:10000 liegen. Tabelle 1-4 Zeitpunkt Vergleich der Störfallbeurteilungswerte, auf Basis kanzerogener und nicht-kanzerogener Endpunkte AEGL-2 Zusätzliches Krebsrisiko 1:10.000 (nicht kanzero- Kalkuliert nach NTP (1982) gener Endpunkt) unter Verwendung des Unit Risk Kalkuliert nach NTP (1982) unter Verwendung der T25 Methode 8 Stunden 6,5 ppm 0,27 ppm 0,53 ppm 4 Stunden 10 ppm 0,55 ppm 1,06 ppm 1 Stunde 24 ppm 2,2 ppm 4,25 ppm 1.5 Diskussion DBE wurde als wahrscheinlich krebserzeugend für den Menschen eingestuft. Auf Grund der Daten zur Gentoxizität kann plausibel angenommen werden, dass es sich um ein gentoxisches Kanzerogen handelt. Es liegen keine Studien vor, in denen die krebserzeugende Wirkung nach kurzer Expositionszeit untersucht wurde. Auf Grund der Beobachtungen, dass bereits nach Einmalexposition Bindung an DNA, RNA und Proteine erfolgt und in vivo DNA-Schädigungen zu beobachten sind, kann jedoch nicht ausgeschlossen werden, dass es bereits nach einer Kurzzeitexposition zu bleibenden Schäden kommt. Dies begründet die Ableitung von Störfallbeurteilungswerten unter Berücksichtigung der kanzerogenen Wirkung. Eine Beurteilung der Störfallsituation auf Basis einer chronischen Studie ist jedoch mit großen Unsicherheiten behaftet. Rechnerisch liegen die Störfallbeurteilungswerte auf Basis der Daten zur Kanzerogenität, unabhängig ob ausgehend vom Unit Risk oder mittels T25 berechnet (die Ergebnisse nach beiden Methoden unterscheiden sich nur um etwa den Faktor 2) unterhalb der AEGL-2 (und der AEGL-1) Werte. In beiden Fällen wurde der Standardfaktor 6 zur Berücksichtigung der Unsicherheiten bei der Extrapolation von der chronischen auf die akute Situation angewendet. Dieser Faktor ist möglicherweise zu hoch, wenn man berücksichtigt, dass • nach subchronischer Exposition und einer fast 90-tägigen Nachbeobachtungszeit keine Tumore aufgetreten sind. 1,2-Dibromethan (CAS 106-93-4) 14 • in der chronischen Studie erst nach 43 Wochen die ersten Tumore aufgetreten sind. • die Effekte in der subchronischen Studie, die bei Konzentrationen auftraten, die in der Langzeitstudie kanzerogen waren, bei ausreichender Nachbeobachtungsdauer reversibel waren. Berücksichtigt man weiterhin, • dass der NOAEL in der 13-Wochen-Inhalationsstudie mit Ratten bei 3 ppm lag und somit fast identisch ist mit dem 8-Stunden Störfallwert unter Berücksichtigung kanzerogener Effekte bei einem Risiko von 1:10000, und • dass die Effekte, die nach einwöchiger Exposition gegen 10 ppm DBE aufgetreten sind, vollständig reversibel waren, so kann plausibel angenommen werden, dass die vorliegende Berechnung zu Störfallbeurteilungswerten sehr konservativ ist und vermutlich unter Einhaltung der AEGL-2 Werte auch ein ausreichender Schutz vor kanzerogenen Effekten besteht. 1.6 Literatur BUA, Beratergremium für umweltrelevante Altstoffe der Gesellschaft Deutscher Chemiker, 1991 1,2-Dibromoethan BUA-Stoffbericht, 66, 1991 Anonymus, 2007 Acute Exposure Guideline Levels (AEGLs) for 1,2-Dibromoethane Proposed Version 1, Juli 2007 Adkins, B., van Stee, E. W., Simmons, J. E., Eustis, S. L., 1986 Oncogenic response of strain A/J mice to inhaled chemicals Journal of Toxicology and Environmental Health, 17, 1986, 311-322 AGS, Ausschuss für Gefahrstoffe, 2008 Leitfaden zur Quantifizierung von Krebsrisikozahlen bei Exposition gegenüber krebserzeugenden Gefahrstoffen für die Grenzwertsetzung am Arbeitsplatz Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Dortmund/Berlin/Dresden, 2008 EPA, Environmental Protection Agency, 2004 Toxicological Review of 1,2-Dibromoethane Online: http://www.epa.gov/iris/, [Druck: September 2008] Henschler, D., 1976/77 1,2-Dibromäthan Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAKWerten, Loseblattsammlung, 5. Lfg. DFG, Deutsche Forschungsgemeinschaft, VCH Verlag Weinheim, 1976/77 NCI, National Cancer Institute, 1978 Bioassay of 1,2-Dibromoethane for Possible Carcinogenicity (CAS No. 106-93-4) Technical Report Series, No. 86; DHEW Publication No. (NIH) 78-1336, United States National Cancer Institute, zitiert nach IAR, 1999 Bethesda, MD, United States Department of Health, Education, and WelfareNitschke, K. D., Kociba, R. J., Keyes, D. G., McKenne, M. J., 1981 A thirteen week repeated inhalation study of ethylene dibromide in rats Fundamental and Applied Toxicology, 1, 1981, 437-442 NTP, National Toxicology Program, 1982 Carcinogenesis Bioassay of 1,2-Dibromoethane in F344 Rats and B6C3F1 Mice (Inhalation Study). TR 210 U.S. Department of Health and Human Services; Public Health Service, 1982 NRC, National Research Council, 2001 1,2-Dibromethan (CAS 106-93-4) 15 Standing Operating Procedures for Developing Acute Exposure Guideline Levels for Hazardous Chemicals National Academy Press, Washington, DC, 2001 Reznik, G., Stinson, S. F., Ward, J. M., 1980 Respiratory pathology in rats and mice after inhalation of 1,2-dibromo-3-chloropropane or 1,2 dibromoethane for 13 weeks Archives of Toxicology, 46, 1980, 233-240 Rowe, V. K., Spencer, M. C., McCollister, D. D., Hollingsworth, R. L., Adams, E. M., 1952 Toxicity of ethylene dibromide determined on experimental animals Industrial Hygiene and Occupational Medicine, 6, 1952, 158-173 Schmezer, P., Eckert, C., Liegibel, U. M., Zelezny, O., Klein, R. G., 1998 Mutagenic activity of carcinogens detected in transgenic rodent mutagenicity assays at dose levels used in chronic rodent cancer bioassays Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis, 405, 1998, 193-198 van Duuren, B. L., Goldschmidt, B. M., Loewengart, G., Smith, A. C., Melchionne, S., Seidman, I., Roth, D., 1979 Carcinogenicity of halogenated olefinic and aliphatic hydrocarbons in mice Journal of the National Cancer Institute, 63, 1979, 1433-1439 van Duuren, B. L., Seidman, I., Melchionne, S., Kline, S. A., 1985 Carcinogenicity bioassay of bromoacetaldehyd and bromoethanol - potential metabolites of dibromoethane Teratogenesis, Carcinogenesis, and Mutagenesis, 5, 1985, 393-403 Watanabe, K., Liberman, R. G., Skipper, P. L., Tannenbaum, S. R., Guengerich, F. P., 2007 Analysis of DNA adducts formed in vivo in rats and mice from 1,2-dibromoethane, 1,2dichloroethane, dibromomethane, and dichloromethane using HPLC/accelerator mass spectrometry and relevance to risk estimates Chemical Research in Toxicology, 20, 2007, 1594-1600 Wong, L. C. K., Winston, J. M., Hong, C. B., Plotnick, H., 1982 Carcinogenicity and toxicity of 1,2-dibromoethane in the rat Toxicology and Applied Pharmacology, 63, 1982, 155-165 Ermittlung von Störfallbeurteilungswerten für kanzerogene Stoffe – Fortsetzung 3 Teilbericht: Benzotrichlorid Gutachten erstellt im Auftrag des Landesamtes für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen Recklinghausen Forschungs- und Beratungsinstitut Gefahrstoffe GmbH Werthmannstraße 16 • 79098 Freiburg Bearbeitung: Dr. Ulrike Schuhmacher-Wolz, Dr. Fritz Kalberlah Freiburg, März 2009 Benzotrichlorid (CAS 98-07-7) 2 1 Benzotrichlorid: Ableitung von Störfallbeurteilungswerten unter Berücksichtigung der krebserzeugenden Wirkung 1.1 Stoffspezifische Daten Benzotrichlorid (synonym: α, α, α-Trichlortoluol, Phenyltrichlormethan, Trichlormethylbenzol) dient vor allem zur Herstellung von Benzoylchlorid, und als Zwischenprodukt für Farbstoffe und Pflanzenschutzmittel (BG-Chemie, 1990). Benzotrichlorid ist eine farblose bis gelbliche ölige Flüssigkeit mit einem stechenden Geruch (IARC, 1999). Die Substanz ist in organischen Lösungsmitteln (Benzol, Diethylether, Ethanol) löslich und hydrolysiert in Wasser (BG-Chemie, 1990). Benzotrichlorid ist für die Haut und Schleimhäute stark reizend (Greim, 1996). Die Substanz wurde von verschiedenen Organisationen als wahrscheinlich für den Menschen krebserregend eingestuft. Organisation Kanzerogenität Kategorie EU 2 DFG (MAK) 2 WHO/IARC 2A* EPA B2 * Gemeinsame Bewertung der α-Chlortoluole (α-chlorierten Toluene und Benzoylchlorid). Die experimentellen Daten zu Benzotrichlorid wurden als ausreichende Hinweise für die kanzerogene Wirkung der Substanz im Tierversuch gewertet („There is sufficient evidence in experimental animals for the carcinogenicity of benzotrichloride.“). Benzotrichlorid wurde nicht hinsichtlich Keimzell-Mutagenität und Reproduktionstoxizität eingestuft. Für die Umrechnung von mg/m3 in ppm gilt (Greim, 1996; BUA, 1992): 8,11 mg/m3 = 1 ppm bzw. 1 mg/m3 = 0,12 ppm Die humantoxischen Wirkungen der Substanz sind nach Anhang VI der Verordnung 1272/2008/EC mit folgenden R-Sätzen zu kennzeichnen: R22: Gesundheitsschädlich beim Verschlucken. R23: Giftig beim Einatmen. R37/38: Reizt die Atmungsorgane und die Haut. R41: Gefahr ernster Augenschäden. R45: Kann Krebs erzeugen. Benzotrichlorid (CAS 98-07-7) 1.1.1 3 Kanzerogenität Für den Menschen liegen keine aussagekräftigen Studien vor. Im Tierversuch führte Benzotrichlorid jedoch nach oraler, dermaler, inhalativer und intraperitonealer Applikation zu einer erhöhten Tumorinzidenz. Die meisten Studien wurden in japanischen Fachzeitschriften publiziert und werden deshalb hier meist nach der sehr ausführlichen Darstellung im SIDS-Dokument (OECD, 2004) beschrieben. 1.1.1.1 Humandaten Es liegen keine aussagekräftigen Studien am Menschen vor, bei denen eine alleinige Exposition gegen Benzotrichlorid bestand. Im Zusammenhang mit der Herstellung und nach dem Umgang mit Benzoylchlorid wurden 6 Fälle von Krebs der Atmungsorgane beobachtet. Es bestand zugleich auch eine Exposition gegen Benzotrichlorid (Sakabe et al., 1976, 1977). Die Lungenkrebsfälle traten in mehreren kleineren Betrieben mit insgesamt < 100 Personen auf. Auffallend war das niedrige Lebensalter (35-44 Jahre, einmal 57 Jahre) und dass zwei der Betroffenen Nichtraucher waren (Greim, 1996). Bei Arbeitern, die in der Produktion von chlorierten Toluolen beschäftigt waren, ergaben sich Hinweise auf eine erhöhte Krebsmortalität, während andere Todesursachen in der Gruppe der Exponierten nicht erhöht waren. Es traten Tumore des Atem- und des Magen-Darm-Trakts auf. Ein ursächlicher Zusammenhang mit einer Benzotrichloridexposition wird diskutiert, auch wenn dieser in der Studie nicht nachgewiesen werden konnte (Sorahan et al., 1983). Eine prospektive Mortalitätsstudie an Arbeitern einer Chlorierungsfirma in den USA weist auf einen Zusammenhang zwischen dem Chlorierungsprozess von Toluol und einem erhöhten Risiko für Krebs der Atmungsorgane hin. Auf Grund geringer Fallzahlen, fehlender Raucheranamnese und der Mischexposition sind jedoch keine endgültigen Aussagen auf Basis dieser Studie möglich (Wong und Morgan, 1988). 1.1.1.2 Tierdaten In Tierversuchen mit epikutaner, intragastraler, intraperitonealer und inhalativer Applikation erwies sich Benzotrichlorid als eindeutig krebserzeugend. Neben dem Auftreten lokaler Tumore wurden auch Tumore nach systemischer Verteilung der Substanz beobachtet. Inhalation In einer chronischen Inhalationsstudie wurden weibliche Sprague-Dawley Ratten über 104 Wochen (6 Stunden/Tag, 5 Tage/Woche) gegen 0; 0,1; 0,4; 1 und 2 ppm Benzotrichlorid (0; 0,8; 3,2; 8,0 und 16,0 mg/m3) exponiert und für 3 weitere Wochen beobachtet. Wegen erhöhter Mortalität musste die Expositionskonzentration in der höchsten Dosisgruppe schrittweise reduziert werden (nach 10 Wochen auf 1,6 ppm, nach 20 Wochen auf 1 ppm) und wurde nach 25 Wochen ganz ausgesetzt. Dennoch verstarben alle verbliebenen Tiere dieser Gruppe bis zur 39ten Woche. Todesursachen waren Tumore sowie Begleiterkrankungen, Lungenentzündungen und spontane Erkrankungen. Außer in der niedrigsten Expositionsgruppe wurden in allen Dosisgruppen erhöhte Mortalitätsraten beobachtet (100% Mortalität bereits nach 40, 80 und 107 Wochen bei 2, 1 und 0,4 ppm; vgl. Tabelle 1-1). Atemwegstumore traten bei Benzotrichlorid (CAS 98-07-7) 4 12-92% und Nasentumore bei 28-64% der Tiere der verschiedenen Dosisgruppen auf (sieheTabelle 1-2). Die meisten Tumore des Kehlkopfs und der Luftröhre waren Plattenepithelzellkarzinome. Neben Tumoren des Atemtrakts wurden vor allem Tumore der Haut und des äußeren Gehörgangs beobachtet (Fukuda und Takemoto, 1980, 1984a, b). Tabelle 1-1: Kumulative Mortalität (%) in der chronischen Inhalationsstudie mit Benzotrichlorid an Sprague-Dawley-Ratten (Fukuda und Takemoto, 1980, 1984a, b) Expositionsdauer (Wochen) Expositionskonzentration (ppm) 0 0,1 0,4 1,0 2,0 20 0 0 0 0 2 40 0 0 2 2 100 60 2 4 16 22 80 4 14 46 100 100 38 46 86 107 54 54 100 Benzotrichlorid (CAS 98-07-7) Tabelle 1-2: 5 Tumorinduktion in Sprague-Dawley-Ratten durch chronische Inhalation von Benzotrichlorid (Fukuda und Takemoto, 1980, 1984a, b) Expositionskonzentration (ppm) 0 0,1 0,4 1 2 Tiere pro Gruppe 50 50 50 50 43 Tiere mit Tumoren 42 41 45 49 28 Tumore des Atemtrakts 0 6 38 46 28 Nasenkarzinome 0 0 17 32 12 Nasenadenome/papillome 0 2 18 12 9 Larynxkarzinome 0 0 9 12 0 Larynxpapillome 0 0 3 4 0 Lungenkarzinome 0 0 5 7 15 Lungenadenome/papillome 0 0 0 5 0 Gehörgangkarzinome 0 Gehörgangpapillome 0 2 12 14 0 0 2 3 0 Hautkarzinome 2 2 17 17 0 Hautpapillome 1 2 3 1 0 In einer chronischen Inhalationsstudie mit weiblichen ICR Mäusen, die über 104 Wochen (6 h/d, 5 d/w) gegen 0; 0,1; 0,4; 1,0 und 2 ppm Benzotrichlorid exponiert und für drei weitere Wochen beobachtet wurden, traten Tumore des Atemtrakts, der Haut und des äußeren Gehörgangs auf. In der höchsten Dosisgruppe, in der sukzessive die Expositionskonzentration bis auf 1 ppm gesenkt wurde, verstarben alle Tiere innerhalb von 45 Wochen an der Folge der aufgetretenen Lungentumore und der Atemtraktsentzündungen (Fukuda und Takemoto, 1980, 1984a, b). Die Studie liegt nur in Form von Kurzveröffentlichungen vor. Männliche Sprague Dawley Ratten (Anzahl nicht angegeben) wurden über 1, 3 oder 6 Monate (6 h/d, 5 d/w) gegen 1 ppm Benzotrichlorid exponiert. Nach 6-monatiger Exposition waren im oberen Respirationstrakt squamöse Metaplasien und Hyperplasien, sowie Papillome der Nasenhöhle zu beobachten. Bei kürzeren Expositionszeiträumen traten keine neoplastischen Veränderungen auf. In der Gruppe mit 6monatiger Exposition und einer 5-monatigen Nachbeobachtungszeit wurden maligne und benigne Tumore im Atemtrakt, in der Haut und im äußeren Gehörgang beobachtet (Koshi und Fukuda, 1986). Neben diesen qualitativen Angaben wurden in der Kurzveröffentlichung keine quantitativen Angaben gemacht. Männliche ICR Mäuse wurden über 5 Monate (je 30 Minuten an 2 Tagen pro Woche) Benzotrichlorid (CAS 98-07-7) 6 gegenüber bei 50°C verdampftem Benzotrichlorid exponiert (6,7 ± 1,66 ppm). In der Expositionsgruppe waren 33 Tiere (32 ausgewertet) und in der Kontrollgruppe 30 Tiere. Die Nachbeobachtungszeit betrug 1-5 Monate, in der Kontrollgruppe 12 Monate. Wegen erhöhter Mortalität und eines insgesamt schlechten Gesundheitszustandes der Tiere in den Expositionsgruppen wurde die Studie nach 10 Monaten beendet. Von den zwölf Tieren, die während der Behandlungszeit verstarben, wiesen 2 Lungenadenome und 6 maligne Lymphome auf. Am Ende der Expositionszeit waren bei 6/11 Tieren Lungenadenome und bei 1/11 maligne Hauttumore zu beobachten. Nach 10 Monaten wurden folgende Tumorinzidenzen beschrieben: Lungenadenome bei 8/9 Tieren, Lungenadenokarzinom bei 1/9 Tieren, Hautkarzinome bei 3/9 Tieren und Hautpapillome bei 4/9 Tieren. Die Gesamttumorinzidenzen waren wie folgt (Tabelle 1-3): Lungenadenome (16 Tiere), Lungenkarzinom (1 Tier), Hautpapillome und –karzinome (jeweils 4 Tiere), maligne Lymphome (8 Tiere). Die Tumorraten waren signifikant gegenüber der Kontrolle erhöht. Fast alle Tiere wiesen eine schwere Bronchitis und eine bronchioläre Pneumonie auf. Ab dem dritten Monat waren Hautläsionen bis hin zu ulzerösen Läsionen sichtbar. Bei vielen Tieren waren entzündliche Läsionen und Organhypertrophien (z.B. Lymphknoten, Thymus, Milz) sichtbar. Es liegen keine Angaben zur Körpergewichtsentwicklung vor (Yoshimura et al., 1979; 1986). In einer weiteren Untersuchung wurden 38 (davon 37 ausgewertet) männliche ICR Mäuse über 10 Monate (je 30 Minuten an 2 Tagen pro Woche) gegen 1,62 ± 0,43 ppm Benzotrichlorid exponiert (erzeugt durch Verdampfung bei Raumtemperatur). Die Kontrollgruppe bestand aus 30 Tieren. Die Nachbeobachtungszeit betrug bei den exponierten Tieren 2-5 Monate und bei den Kontrollen 12 Monate. Die Behandlung führte bei 17 von 37 Mäusen zu Lungenadenomen, bei 13 zu Lungenkarzinomen, bei 6 zu Hautpapillomen, bei 4 zu Hautkarzinomen und bei 4 zu malignen Lymphomen (Tabelle 1-3) (Yoshimura et al., 1979; 1986). Es liegen keine Angaben zum Körpergewicht vor. In anderen Sekundärquellen wird zum Teil eine Expositionszeit von 12 Monaten genannt (IARC, 1999). Tabelle 1-3: Tumorinzidenz bei männlichen Mäusen nach Inhalationsexposition gegen Benzotrichlorid (Yoshimura et al., 1979; 1986) Tumorlokalisation Expositionskonzentration (Expositionsdauer) 0 ppm a 6,7 ppm (5 Monate) 1,6 ppm (10 Monate) Lungentumore 3 b /30 (10%) 17/32 (53%) 30/37 (31%) Hauttumore 0/30(0%) 8/32 (25%) 10/37 (27%) Maligne Lymphome 0/30(0%) 8/32 (25%) 4/37 (11%) a: Ergebnisse für die Kontrollgruppe liegen nur für die Studie mit 5-monatiger Expositionzeit vor. b: Lungenadenome Ein weiterer Inhalationsversuch an Mäusen, die zweimal pro Woche für 30 Minuten gegen 6,8 ppm Benzotrichlorid exponiert wurden ist wegen des Fehlens einer Kontrollgruppen nicht eindeutig interpretierbar. Bei den Tieren wurden Tumore der Haut und des Atemtrakts beobachtet (Takemoto et al., 1978). Benzotrichlorid (CAS 98-07-7) 7 Orale Exposition Weibliche ICR-Mäuse erhielten über 25 Wochen zweimal wöchentlich Benzotrichlorid mittels Schlundsonde (0, 0,043, 0,17, 0,7 und 2,7 mg/Maus; 40 Tiere pro Gruppe). Achtzehn Monate nach Beginn der Behandlung wurden die Tiere getötet und untersucht: Es traten dosisabhängig Plattenepithelzellkarzinome des Vormagens, Lungenadenome und Lundenadenokarzinome sowie gutartige Thymustumore auf. Die Inzidenzen sind in Tabelle 1-4 dargestellt. In den beiden höchsten Dosisgruppen trat erhöhte Mortalität auf. Nach 6,5 und 16,5 Monaten waren bereits die Hälfte der Tiere in der höchsten und zweithöchsten Dosisgruppe gestorben (Fukuda et al., 1978, 1993). Tabelle 1-4: Tumorhäufigkeiten bei ICR-Mäusen nach intragastraler Verabreichung von Benzotrichlorid (zweimal wöchentlich über 25 Wochen) Dosis (mg/Maus) Tumorhäufigkeit Vormagen Lunge Plattenepithelkarzinom Adenokarzinom Thymus Adenom Thymom 0 0/35 0/35 1/35 0/35 0,04 0/37 1/37 0/37 0/37 0,17 2/38 9/38* 6/38 1/38 0,7 22/40* 16/40* 17/40* 2/40 2,7 24/35* 10/35* 10/35* 7/35* * statistisch signifikant erhöht (p < 0,001) Dermale Exposition In drei verschiedenen Versuchen, in denen Mäuse unverdünntes oder mit Benzol verdünntes Benzotrichlorid über ca. 7, 10 oder 13 Monate auf die Haut aufgetragen bekamen, entwickelten die Benzotrichlorid-exponierten Tiere vor allem Haut und Lungentumore. In einem dieser Versuche wird zusätzlich das Auftreten von Tumoren der Lippen, Zunge, Speiseröhre, des Vor- und Drüsenmagens berichtet. In einem anderen Versuch wurden zusätzlich Lymphome beobachtet. In den Kontrollgruppen (Benzol) wurden keine Tumore bzw. in einem Versuch 2 Lungenadenome beobachtet (Fukuda et al., 1981). Andere Pfade Männliche und weibliche A/J-Mäuse erhielten dreimal wöchentlich über 8 Wochen 12, 30 und 60 mg/kg Benzotrichlorid intraperitoneal appliziert (Gesamtdosis: 287, 719 und 1440 mg/kg). Vierundzwanzig Wochen nach Versuchsbeginn wurde die Beobachtung abgebrochen. Die durchschnittliche Anzahl an Lungenadenomen pro Maus lag in der Kontrollgruppe bei 0,46, und bei ca. 18, 43 und 128 in der niedrigsten, mittleren und höchsten Dosisgruppe. In der höchsten Dosisgruppe wurde eine erhöhte Mortalität beobachtet. Andere Tumorarten neben Lungenadenomen wurden Benzotrichlorid (CAS 98-07-7) 8 nur in der höchsten Dosisgruppe beobachtet: 3 Lymphome und 2 Nierensarkome, deren Auftreten von den Autoren ebenfalls als substanzbedingt gewertet wurde (Stoner et al., 1986). 1.1.2 Gentoxizität Humandaten Es liegen keine epidemiologischen Befunde vor. In vitro Untersuchungen Benzotrichlorid ist mutagen in Salmonella typhimurium TA 100, TA 1535, TA 98 und Escherichia coli WP2 nach metabolischer Aktivierung aber nicht ohne metabolische Aktivierung. Positiv wirksam war es auch im rec-Assay in Bacillus subtilis ohne Zugabe eines Aktivierungssystems (IARC, 1999; Greim, 1996). An menschlichen Bronchialepithelzellen, die gegen 0,1 und 1 µg Benzotrichlorid/ml exponiert wurden, wurden mittels alkalischer Elution DNA-Strangbrüche nachgewiesen (BG-Chemie, 1990). Benzotrichlorid induzierte Mikrokerne in kultivierten Knochenmarkszellen von Balb/c-Mäusen (OECD, 2004). In vivo Untersuchungen Männliche Sprague Dawley Ratten (Anzahl nicht angegeben) wurden über 1, 3 oder 6 Monate (6 h/d, 5 d/w) gegen 1 ppm Benzotrichlorid exponiert. In allen Expositionsgruppen war ein leichter, aber signifikanter Anstieg an Chromosomenaberrationen in Knochenmarkszellen erkennbar. In peripheren Lymphozyten trat eine signifikant erhöhte Frequenz an Schwesterchromatidaustauschen auf. In diesen Lymphozyten war die Anzahl der Chromosomenaberrationen nach 6 monatiger Exposition signifikant erhöht, aber nicht bei kürzeren Expositionszeiten (Koshi und Fukuda, 1986). Numerische Angaben wurden in der Kurzveröffentlichung nicht gemacht. Benzotrichlorid induziert in vivo Mikrokerne: Positive Befunde wurden in Balb/cMäusen erhoben, die vor der einmaligen intraperitonealen Behandlung mit 100 oder 200 mg/kg Benzotrichlorid einmal mit polychlorierten Biphenylen (PCB) vorbehandelt wurden. Ohne PCB-Vorbehandlung war die Mikrokernrate nicht erhöht. Ein noch stärkerer Anstieg der Mikrokernrate als durch die PCB-Vorbehandlung der Tiere wurde erreicht, wenn unbehandelte Mäuse Benzotrichlorid verabreicht bekamen, das zuvor mit S9-Mix von PCB-behandelten Mäusen inkubiert wurde (Suzuki, 1985). 1.1.3 Metabolismus Benzotrichlorid wird bei Kontakt mit Wasser rasch unter Abspaltung von Salzsäure zu Benzoesäure hydrolytisch gespalten. Die Halbwertszeit in Wasser (pH 7; 25°C) beträgt 19 Sekunden (Greim, 1996; OECD 2004). Benzotrichlorid wird rasch und umfassend nach oraler Gabe in den Körper aufgenommen und fast vollständig mit dem Urin als Hippursäure ausgeschieden: Untersuchungen mit radioaktiv markiertem Benzotrichlorid an jungen Ratten, denen einmalig 40 mg/kg oral verabreicht wurden, ergaben eine Halbwertszeit von 3 Stunden für die gastrointestinale Absorption. Im Blut wurde eine Eliminationshalbwertszeit von 22 Stunden und im Gewebe von 14 Stunden ermittelt. Die höchsten Konzentrationen wurden im Fett, gefolgt von Leber und Niere nachgewiesen. Nach 48 Stunden war ein geringer Anteil der Radioaktivität in der Faeces und über 90% der Radioaktivität Benzotrichlorid (CAS 98-07-7) 9 im Harn nachweisbar, 91% hiervon als Hippursäure, 5,5% als nicht identifizierte Metabolite. Benzotrichlorid selbst war nicht im Harn nachweisbar (Greim, 1996; OECD, 2004). Untersuchungen zur inhalativen Exposition von Ratten weisen darauf hin, dass Benzotrichlorid auch über die Lungen aufgenommen und als Hippursäure mit dem Harn ausgeschieden wird. Quantitative Aussagen sind auf Basis der vorliegenden Daten nicht möglich (BG-Chemie, 1990). 1.2 Berechnung der krebserzeugenden Potenz von Benzotrichlorid nach Einmalexposition 1.2.1 Mechanistische Überlegungen Die Befunde in den Kanzerogenitätsstudien (eindeutig krebserzeugend im Tierversuch) und den Untersuchungen zur Mutagenität (mutagen in vitro und in vivo) kennzeichnen Benzotrichlorid als ein gentoxisches Kanzerogen. Es liegen keine Untersuchungen zu einer möglichen krebserzeugenden Wirkung nach Einmalexposition vor. In zwei Rattenstudien mit einer Expositionszeit von 5 Monaten (ca. 7 ppm) oder 6 Monaten (1 ppm) und einer mehrmonatigen Nachbeobachtungszeit traten vor allem lokale Tumore im Atemtrakt und auf der Haut auf. In einer Studie mit ein- oder dreimonatiger Exposition von Ratten gegen 1 ppm traten am Ende der Behandlungszeit keine Tumore auf, die Tiere wurden nicht nachbeobachtet. Auf Grund der derzeitigen Datenlage kann eine mögliche krebserzeugende Wirkung auch nach kurzfristiger, einmaliger Exposition nicht ausgeschlossen werden. Deshalb wird eine Betrachtung von Benzotrichlorid im Hinblick auf eine Störfallsituation als relevant erachtet. Die nachfolgenden Berechnungen zu den Störfallbeurteilungswerten basieren auf der chronischen Inhalationsstudie an Ratten (Fukuda und Takemoto, 1980, 1984a, b). Zum Vergleich wurde auch die subchronische Inhalationsstudie an Mäusen von Yoshimura et al. (1979, 1986) herangezogen. 1.2.2 Verwendung stoffspezifischer Daten 1.2.2.1 Verwendung von Kanzerogenitätsdaten 1.2.2.1.1 Unit Risk Ableitung der EPA Die EPA (EPA, 2008) berechnete mit Hilfe des linearisierten Mehrstufenverfahren auf Basis der Studie von Fukuda et al. (1978) unter Berücksichtigung der Inzidenz an Lungenadenokarzinomen einen oralen Slope Faktor von 13 pro mg/kg/Tag. Das Trinkwasser Unit Risk beträgt 3,6 x 10-4 pro µg/L. Slope Faktor, oral: 13 pro mg/kg/Tag; Trinkwasser Unit Risk: 3,6 x 10-4 pro µg/L Eine Berechnung von Störfallbeurteilungswerten auf Basis des Unit Risks bei oraler Exposition halten wir nicht für sinnvoll, da Benzotrichlorid nach inhalativer Exposition vor allem zum Auftreten lokaler Tumore im Atemtrakt führt. Die systemische Verfügbarkeit von Benzotrichloride in der Lunge nach oraler Applikation ist auf Grund der schnellen hydrolytischen Spaltung der Substanz deshalb nicht mit der lokalen Wirkung nach Inhalation zu vergleichen. Benzotrichlorid (CAS 98-07-7) 10 1.2.2.1.2 Ableitung auf Basis des T25-Wertes JRC Von der Europäischen Kommission wurde ein T25-Wert für Benzotrichlorid in Höhe von 0,02 mg/kg · d publiziert mit dem Hinweise, dass dieser Wert sich auf Lungentumore in weiblichen Mäusen nach inhalativer Exposition bezieht (JRC, 2000). Es werden keine weiteren Angaben zur Datengrundlage und Berechnung gemacht. Es ist deshalb unklar, ob sich diese Daten auf die Veröffentlichungen von Fukuda und Takemoto (1980, 1984a, b) oder auf Takemoto et al. (1978) beziehen. Eine diesbezügliche Anfrage beim Herausgeber von JRC (2000) blieb bislang unbeantwortet. Die T25 von 0,02 mg/kg · d ergibt unter den in Dybing et al. (1997) genannten Standardwerten für die weibliche Maus (Gewicht: 25 g; Inhalationsvolumen: 1,8 l/h; Standardlebensspanne: 2 Jahre) eine Konzentration von 0,0014 ppm (0,02 mg/kg · d x 0,025 kg / 0,0432 m3 = 0,012 mg/m3 = 0,0014 ppm). Wegen der mit diesem Wert verbundenen Unsicherheit wird auf eine weitere Verwendung im Rahmen der Ableitung der Störfallbeurteilungswerte verzichtet. 1.2.2.1.3 Ableitung des T25-Wertes auf Basis der subchronischen Inhalationsstudie an Ratten Die Berechnung des T25-Wertes basiert auf den Ergebnissen der subchronischen Inhalationsstudie an Ratten (Yoshimura et al., 1979, 1986). Tumorinzidenz (Lungentumore) in der Kontrollgruppe: 3/30 = 10% 6,7 ppm: 17/32 = 53% Umrechnung auf kontinuierliche Exposition: 6,7 ppm x 0,5/24 x 2/7 = 0,04 ppm kontinuierlich Berechnung T25: T25= 0,04 ppm x (0,25/0,53-0,1) x ((1-0,1)/1) T25= 0,021 ppm Die nachfolgende Abbildung zeigt die Tumorinzidenzen für Lungen- bzw. Atemtrakttumore in der subchronischen (Yoshimura et al., 1979, 1986) und chronischen (Fukuda et al., 1980, 1984a, b) Inhalationsstudie an Ratten in Abhängigkeit von der Expositionsdauer und -konzentration. Für die Darstellung wurden die Expositionskonzentrationen unter Berücksichtigung der täglichen und wöchentlichen Expositionsdauer auf eine kontinuierliche Expositionskonzentration umgerechnet und mit der Expositionsdauer in Monaten multipliziert (ppm Monate, vgl. Abbildung 1-1). Benzotrichlorid (CAS 98-07-7) 11 Subchronische Studie (Yoshimura et al., 1979, 1986): Expositionskonzentration x 0,5/24 x 2/7 x 5 bzw. 10 Monate Chronische Studie (Fukuda et al., 1980, 1984a, b): Expositionskonzentration x 6/24 x 5/7 x 24 Monate In der subchronischen Inhalationsstudie waren bei niedrigeren ppm-Monaten etwas höhere Tumorinzidenzen zu beobachten, als man auf Basis der Langzeitstudie erwarten würde. Dies weist auf einen stärkeren Einfluss der Expositionskonzentration gegenüber der Expositionsdauer bei der Tumorentstehung durch Benzotrichlorid hin. 100 90 80 Tumorinzidenz (%) 70 60 50 40 30 20 10 0 0 1 2 3 4 5 6 7 8 9 10 ppm Monate Fukuda/chronisch Yoshimura/subchronisch Abbildung 1-1: Vergleich der Tumorinzidenz für Atemtrakt- bzw. Lungentumore in der chronischen (Fukuda et al., 1980, 1984a, b) bzw. subchronischen Inhalationsstudie (Yoshimura et al., 1979, 1986) an Ratten in Bezug auf die kumulative Expositionskonzentration. Rechnet man den T25-Wert aus der subchronischen Studie linear um auf ein 1:10000 Risiko, so ergibt sich: Tumorrisiko 1:10000 bei 0,0000084 ppm Diese Berechnungen gehen von einer Exposition während ca. eines Viertels der Lebenszeit aus. Für eine Kurzzeitexposition (70 Jahre/4 = 25600/4 = 6400 Tage) von einem Tag ergibt sich somit: Gesamt-d = 0,0000084 ppm x 6400 = 0,054 ppm Benzotrichlorid (CAS 98-07-7) 12 Da nach den obigen Ausführungen die Expositionskonzentration eine stärkere Bedeutung als die Expositionsdauer hat, wird auf die Verwendung eines Unsicherheitsfaktors zur Kalkulation des Krebsrisikos bei Kurzzeitexposition verzichtet. Eine Konzentration von 0,054 ppm über 24 Stunden würde also einem Risiko von 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Beziehung cn x t = k mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 0,16 ppm 4 h: 0,32 ppm 1 h: 1,3 ppm 1.2.2.1.4 Ableitung des T25-Wertes auf Basis der Langzeitinhalationsstudie an Ratten Die Berechnung des T25-Wertes basiert auf den Ergebnissen der Langzeitinhalationsstudie an Ratten (Fukuda et al., 1980, 1984a, b). Tumorinzidenz (Atemtraktstumore) in der Kontrollgruppe: 0/50 = 0% 0,1 ppm: 6/50 = 12% 0,4 ppm;´: 38/50 = 76% Umrechnung auf kontinuierliche Exposition: 0,4 ppm x 6/24 x 5/7= 0,07 ppm kontinuierlich 0,1 ppm x 6/24 x 5/7= 0,018 ppm kontinuierlich Berechnung T25: Dargestellt ist die Berechnung der T25 mit der 0,4 ppm Gruppe, da diese zu einer niedrigeren T25 führt als bei Verwendung der 0,1 ppm Gruppe. T25= 0,07 ppm x (0,25/0,76) x ((1-0)/1) T25= 0,023 ppm Linear umgerechnet auf ein 1:10000 Risiko ergibt sich auf Basis der T25: Tumorrisiko 1:10000 bei 0,0000092 ppm Diese Berechnungen gehen von einer lebenslangen Exposition (70 Jahre = 25600 Tage) aus. Für eine Kurzzeitexposition von einem Tag ergibt sich somit: Gesamt-d = 0,0000092 ppm x 25600 = 0,24 ppm Benzotrichlorid (CAS 98-07-7) 13 Der Wert für die T25 auf Basis der chronischen Studie ist praktisch identisch mit dem Wert, der auf Basis der subchronischen Studie ermittelt wurde (0,023 ppm vs. 0,021 ppm). Nach der Konzentrations-Zeitbeziehung von ten Berge (Cn x t = k) würde man zunächst erwarten, das bei nur ca. einem Viertel der Expositionszeit eine ca. vierfach höhere Expositionskonzentration notwendig wäre, um den gleichen Effekt zu erzielen. Dies trifft in diesem Fall jedoch nicht zu. Darum wird bei der Berechnung der Kanzerogenität nach Kurzzeitexposition der Standardunsicherheitsfaktor von 6 voll ausgeschöpft. Es ergibt sich somit: 0,24 ppm / 6 = 0,04 ppm Eine Konzentration von 0,04 ppm über 24 Stunden würde nach diesem Rechenansatz also einem Risiko von 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Beziehung cn x t = k mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 0,12 ppm 4 h: 0,24 ppm 1 h: 0,96 ppm Berechnung mit Hilfe der Benchmarkdosis Eine Berechnung der Störfallbeurteilungswerte auf Basis der anhand der Langzeitinhalationsstudie an Ratten kalkulierten BMD10/BMDL10 würde zu vergleichbaren Ergebnissen führen wie die Berechnung mit Hilfe der T25 (Daten nicht gezeigt), weshalb auf eine weitere Darstellung an dieser Stelle verzichtet wurde. 1.2.2.2 Verwendung von Gentoxizitätsdaten Es liegen Untersuchungen zur gentoxischen Wirkung von Benzotrichlorid bei inhalativer Exposition von Ratten vor. In der Kurzveröffentlichung von Koshi und Fukuda (1986) werden jedoch nur qualitative und keine quantitativen Angaben gemacht, so dass eine Berechnung von Störfallbeurteilungswerten auf Basis dieser Daten nicht möglich ist. 1.3 AEGL-Werte für Benzotrichlorid Benzotrichlorid wurde bislang nicht im Rahmen der Aktivitäten des National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL Committee) bearbeitet. Im Rahmen dieses Projekts (siehe Anhang) wurden folgende AEGL-Werte für Benzotrichlorid abgeleitet: Benzotrichlorid (CAS 98-07-7) Tabelle 1-5: 1.4 14 AEGL-1, AEGL-2- und AEGL-3-Werte für Benzotrichlorid (dieses Dokument) Zeitpunkt AEGL-1 (ppm) AEGL-2 (ppm) AEGL-3 (ppm) 10-min nicht abgeleitet nicht abgeleitet nicht abgeleitet 30-min nicht abgeleitet 1,4 ppm 4,25 ppm 1-h nicht abgeleitet 1,1 ppm 3,3 ppm 4-h nicht abgeleitet 0,28 ppm 0,84 ppm 8-h nicht abgeleitet 0,14 ppm 0,43 ppm Vergleich kanzerogene Potenz nach Einmalexposition vs. AEGL-Werte Die abgeleiteten Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung sind numerisch praktisch identisch mit den AEGL-2 Werten. Tabelle 1-6 Zeitpunkt Vergleich der Störfallbeurteilungswerte, auf Basis kanzerogener und nicht-kanzerogener Endpunkte AEGL-2 Zusätzliches Krebsrisiko 1:10.000 (nicht kanzeroge- T25 Methode, chronische ner Endpunkt) Studie (Fukuda und Takemoto, 1980, 1984a, b) T25 Methode, subchronische Studie (Yoshimura et al., 1979, 1986) 8 Stunden 0,14 ppm 0,12 ppm 0,16 4 Stunden 0,28 ppm 0,24ppm 0,32 1 Stunde 1,1 ppm 0,96 ppm 1,3 1.5 Diskussion Die hier abgeleiteten Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung sind mit einer gewissen Unsicherheit behaftet. Die Werte wurden auf Basis einer chronischen bzw. subchronischen Inhalationsstudie abgeleitet. Die resultierenden Werte sind praktisch identisch. In beiden Fällen wurden die experimentell verwendeten Expositionskonzentrationen auf (niedrigere) kontinuierliche Werte umgerechnet. Dies ist mit einer gewissen Unsicherheit behaftet: Benzotrichlorid ist auf Grund der schnellen Freisetzung von Salzsäure in wässriger Umgebung stark schleimhautreizend. Welchen Anteil die Reizwirkung an der Tumorentstehung hat, ist bislang unklar. Es kann jedoch plausibel angenommen werden, dass durch die Reizwirkung ein Proliferationsreiz besteht, der die Tumorentstehung beschleunigt. Bei den niedrigeren kontinuierlichen Expositionskonzentrationen ist möglicherweise auch die Reizwirkung geringer, so dass die hier vorgenommenen Abschätzungen der Benzotrichlorid (CAS 98-07-7) 15 Störfallbeurteilungswerte eher als konservativ bewertet werden können. Dies wird durch die oben ausgeführten Betrachtungen zum Einfluss der Expositionskonzentration gestützt. Die Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung sind praktisch identisch bzw. etwas höher als die AEGL-2 Werte. Wie oben diskutiert, sind die ausgewiesenen Störfallbeurteilungswerte auf Basis der krebserzeugenden Wirkung insgesamt als eher konservativ einzustufen. In der Kurzzeitstudie an Ratten führte eine 1 und 3 monatige Exposition gegen 1 ppm (6 h/d, 5 d/w) während der Expositionszeit nicht zu neoplastischen Veränderungen oder Tumoren. Es kann deshalb plausibel angenommen werden, dass bei Einhaltung der AEGL-2 Werte auch ein ausreichender Schutz vor der krebserzeugenden Wirkung bei kurzzeitiger Exposition besteht. 1.6 Literatur BG-Chemie, Berufsgenossenschaft der chemischen Industrie, 1990 Toxikologische Bewertung Benzotrichlorid (Nr. 5) BG Chemie, Heidelberg, 1990 BUA, Beratergremium für umweltrelevante Altstoffe, 1992 Benzalchlorid, Benzotrichlorid, Benzoylchlorid, BUA-Stoffberichte 71-73 VCH Verlag, Weinheim, 1992 Dybing, E.; Sanner, T.; Roelfzema, H.; Kroese, D.; Tennant, R.W., 1997 T25: a simplified carcinogenic potency index: description of the system and study of correlations between carcinogenic potency and species/site specificity and mutagenicity Pharmacology & Toxicology, 80, 1997, 272-279 EPA, Environmental Protection Agency, 2008 Integrated Risk Information System (IRIS) online: http:/www.epa.gov./iris/; Druckdatum: 08.12.2008 Fukuda, K.; Takemoto, K., 1980 Species difference and concentration-effect relationship in cancers inducet by inhalation of benzotrichloride (BTC) The 44th General Meeting of the Japanese Cancer Association, zitiert nach OECD, 2004 Fukuda, K.; Takemoto, K., 1984a Erzeugung von Tumoren im Respirationssystem von Ratten und Maeusen durch Inhalation von Benzotrichlorid (BTC) Haigan, Chiba-Shi, 24, 1984, 673, zitiert nach OECD, 2004 Fukuda, K.; Takemoto, K., 1984b Inhalations-Karzinogenitaet von Benzotrichlorid (II) Proc 57th Annual Meeting Japan Association of Industrial Health, 380-381, zitiert nach OECD, 2004 Fukuda, K.; Matsushita, H.; Takemoto, K., 1978 Carcinogenicity of benzotrichloride by the oral route of administration (J-4774) In: Proceedings of the 52nd Annual Meeting of the Japanese Industrial Health Association pp. 516517, zitiert nach Greim, 1996 Fukuda, K.; Matsushita, H.; Sakabe, H.; Takemoto, K., 1981 Carcinogenicity of benzyl chloride, benzal chloride, benzotrichloride and benzoyl chloride in mice by skin application Gann, 72, 1981, 655-664, zitiert nach Greim, 1996 Fukuda, K.; Matsushita, H.; Takemoto, K.; Toya, T., 1993 Carcinogenicity of benzotrichloride administered to mice by gastric intubation Industrial Health, 31, 1993, 127-131, zitiert nach OECD, 2004 Greim, H., 1996 Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAKWerten, Loseblattsammlung, 23. Lfg. Benzotrichlorid (CAS 98-07-7) 16 DFG, Deutsche Forschungsgemeinschaft, VCH Verlag Weinheim, 1996 IARC, International Agency for Research on Cancer, 1999 IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol. 71. Re-Evaluation of some Organic Chemicals, Hydrazine and Hydrogen Peroxide (Part 1-3) WHO, World Health Organization, Geneva, 1999 JRC, Joint Research Centre, 2000 Carcinogens in the context of council Directive 96/82/EC. Report by the technical working group 8, edited by Michalis Christou, April 2000. EUR 19650 EN (http://mahbsrv.jrc.it/downloadspdf/wg8FinalReport-1.pdf) Koshi, K.; Fukuda, K., 1986 Cytogenetic and morphological findings in rats exposed to benzotrichloride. Abstr. No. 25 Mutation Research, 164, 1986, 272 OECD, Organisation for Economic Co-Operation and Development, 2004 SIDS Initial Assessment Report for SIAM 18. α,α,α-Trichlorotoluene (Trichloromethylbenzene) UNEP Publications, 2004 Sakabe, H.; Matsushita, H.; Koshi, S., 1976 Cancer among benzoyl chloride manufacturing workers Annals of the New York Academy of Sciences, 271, 1976, 67-70, zitiert nach BG-Chemie, 1990 Sakabe, H.; Fukuda, K., 1977 An updating report on cancer among benzoylchloride manufacturing workers Industrial Health, 15, 1977, 173-174, zitiert nach BG-Chemie, 1990 Sorahan, T.; Waterhouse, J.A.H.; Cooke, M.A.; Smith, E.M.B.; Jackson, J.R.; Temkin, L., 1983 A mortality study of workers in a factory manufacturing chlorinated toluenes Annals of Occupational Hygiene, 27, 1983, 173-182, zitiert nach BG-Chemie, 1990 Stoner, G.D.; You, M.; Morgan, M.A.; Superczynski, M.J., 1986 Lung tumor induction in strain A mice with benzotrichloride Cancer Letters, 33, 1986, 167-173 Suzuki, Y., 1985 Studies on development of the sensitive micronucleus test (Part 1) methods of induction by polychlorinated biphenyl and of metabolic activation Tokyo Jikeikai Med J, 100, 1985, 695-705, zitiert nach OECD, 2004 Takemoto, K.; Yoshimura, H.; Matsushita, S., 1978 Experiment of pulmonary tumorgenicity of benzotrichloride Proceedings of the 51st Annual Meeting of the Japan Assoc Ind Health, 514-515, zitiert nach Greim, 1996 Wong, O.; Morgan, R.W., 1988 A cohort mortality study of employees at the Velsicol Chattanooga Plant 1943-1982 Environmental Health Associates, Inc., Oakland, 31. July 1984 American Journal of Industrial Medicine, 14, 1988, 417-431, zitiert nach BG-Chemie, 1990 Yoshimura, H.; Katayama, H.; Takemoto, K.; Matsushita, S., 1979 Experimental lung tumors induced by exposure to benzotrichloride (2) Proc. Japan Ass. Industr. Health., 332-333, TSCA 8e Submission 8EHQ-0980-0360 Document No. 86-8000116, Washington, DC: Office of Toxic Substances, U.S. Environmental Protection Agency, zitiert nach OECD, 2004 Yoshimura, H.; Takemoto, K.; Fukuda, K.; Matsushita, H., 1986 Carcinogenicity in mice by inhalation of benzotrichloride and benzoyl chloride Japanese Journal of Industrial Health, 28, 1986, 352-259, zitiert nach OECD, 2004 Benzotrichlorid (CAS 98-07-7) 17 Anhang Ableitung der AEGL-Werte für Benzotrichlorid Benzotrichlorid (CAS 98-07-7) 18 2 Anhang: Ableitung der AEGL-Werte für Benzotrichlorid 2.1 Humandaten zur Toxizität Nach zusammenfassenden Darstellungen sollen Benzotrichlorid bzw. seine Dämpfe beim Menschen akut stark reizend wirken an Haut, Augen und den Atemwegsschleimhäuten. Weitere Humandaten zur akuten Toxizität liegen nicht vor (BGChemie, 1990). 2.2 Tierdaten zur Toxizität 2.2.1 Akute Letalität Die akute Letalität von Benzotrichlorid nach Inhalationsexposition wurde in verschiedenen Studien untersucht. Es handelt sich hierbei zumeist um nicht publizierte, firmeninterne Studien oder Publikationen in japanischer Sprache. Diese Studien werden nachfolgend deshalb entsprechend der Angaben im SIDS-Dokument (OECD, 2004) berichtet. 2.2.1.1 Ratte Eine siebenstündige Exposition von Wistar Ratten gegen ca. 1000 mg/m3 Benzotrichlorid führte innerhalb von 24 Stunden zum Tod aller männlichen und weiblichen Tiere. Eine dreistündige Exposition gegen ca. 1000 mg/m3 führte bei 1/6 Männchen und bei 4/6 Weibchen innerhalb 3-13 Tage zum Tode. Eine einstündige Exposition gegen ca. 800 mg/m3 war nicht letal (Bayer AG, 1978). Sowohl die beobachteten Todesfälle als auch die Gewichtszunahme/-verlust während der 14-tägigen Nachbeobachtungszeit (siehe Tabelle 2-1) weisen darauf hin, dass die weiblichen Tiere empfindlicher als die männlichen Tiere reagieren. Eine halbstündige Exposition gegen ca. 750/790 mg/m3 beeinträchtigte die Gesundheit der Tiere nicht. Dagegen waren nach einstündiger und längerer Exposition Irritationen der Augenschleimhaut und des Atemtrakts erkennbar. Weiterhin waren bei den Tieren Atemstörungen (bis zu 13 Tagen lang) und Verhaltensauffälligkeiten (Lethargie, schmutziges Fell) zu beobachten. Angaben zu histopathologischen Untersuchungen liegen nicht vor. Tabelle 2-1: Akute Inhalationstoxizität von Benzotrichlorid in der Ratte (Bayer AG, 1978) Konzentration Expositions(mg/m3) dauer (h) Todesfälle Anzahl Todeszeitpunkt Tiere mit Symptomen** Durchschnittlicher Gewichtsverlust in der Nachbeobachtungszeit * Männchen 1067 7 6 < 24 h 6/6 Nicht bestimmt 1147 3 1 3d 6/6 -21 797 1 0 6/6 +9 Benzotrichlorid (CAS 98-07-7) 790 0,5 19 0 0/6 +55 Weibchen 1193 7 6 < 24 h 6/6 Nicht bestimmt 995 3 4 3-13 d 6/6 -40 795 1 0 6/6 -4 747 0,5 0 0/6 +8 * 14 Tage ** keine detaillierte Angaben Die beschriebenen Geschlechtsunterschiede wurden auch in einer weiteren Untersuchung an Wistar Ratten beobachtet (Bayer AG, 1978): Die Männchen/Weibchen wurden für 4 Stunden gegen 258/300, 550/530 und 600/654 mg/m3 exponiert (Exposistionskonzentration analytisch mittels Gaschromatographie bestimmt) und für 21 Tage beobachtet. Der LC50-Wert für Weibchen lag in dieser Studie bei 530 mg/m3 und bei >600 mg/m3 bei Männchen (vgl. Tabelle 2-2). In der mittleren und hohen Dosisgruppe waren Irritationen der sichtbaren Schleimhäute erkennbar. Bei der pathologischen Untersuchung wurden Lungenemphyseme, Leberatrophien und dunkle Verfärbungen der Milz sichtbar (keine Angaben zur Dosisgruppe). Die weiblichen Tiere und die männlichen Tiere der mittleren und höchsten Dosisgruppe verloren über die gesamte Studiendauer von 21 Tagen an Gewicht. Der Gewichtsverlust bei den Weibchen war deutlicher ausgeprägt als bei den Männchen. Die sechs Männchen der niedrigsten Dosisgruppe zeigten im Mittel einen minimalen Gewichtsanstieg (< 10 g in 3 Wochen), der aber insgesamt viel zu niedrig ausfiel. Tabelle 2-2: Konzentration (mg/m3) Akute Inhalationstoxizität von Benzotrichlorid in der Ratte nach 4stündiger Exposition (Bayer AG, 1978) Todesfälle Anzahl Todeszeitpunkt Tiere mit Symptomen Durchschnittliches Gewicht (g) Vor der Studie Nach 21 Tagen Männchen 600 2 2-21 d 6/6 187 143 550 2 1-2 d 6/6 195 171 258 1 16 d 6/6 188 195 Weibchen 654 4 1-21 d 6/6 175 108 530 3 17-21 d 6/6 169 110 300 2 13-18 d 6/6 167 149 Cavender (1979) berichtet für Charles River CD Ratten eine LC50 von 8390 mg/m3 bei einer Expositionszeit von 1 Stunde. Jeweils 5 männliche und weibliche Ratten wurden für 1 Stunde gegen 2000, 4010, 4820, 6010, 10860, 20300 mg/m3 Benzo- Benzotrichlorid (CAS 98-07-7) 20 trichlorid exponiert, was in 0, 0, 5, 5, 4, 9 Todesfällen in den einzelnen Gruppen resultierte. In allen Gruppen wurde eine dosisabhängige Gewichtsreduktion beobachtet. Während der Exposition wurde bei den Tieren reichlich Nasensekret, Speichelfluss und Augenzwinkern beobachtet. Diese Effekte waren nur transient. Bei den meisten Tieren trat Atemnot auf, die über den gesamten 14-tägigen Beobachtungszeitraum anhielt. Die Tiere der höheren Dosisgruppen (keine weiteren Angaben) zeigten eine verminderte Aktivität, Ataxie und Schnappatmung. Die pathologische Untersuchung der Tiere ergab zum Teil dunkel lila verfärbte Lungen mit roten Flecken oder Foci in allen Expositionsgruppen. In der höchsten Dosisgruppe waren dunkle Foci auf der Magenschleimhaut und schwarz-orange-gestreifte Eingeweide sichtbar. Smyth et al. (1951) berichten, dass 5/6 Ratten starben, die für 4 Stunden gegen 1014 mg/m3 (125 ppm) exponiert waren. Eine halbe Stunde war die maximale Expositionszeit gegen gesättigten Dampf, die keine Todesfälle zur Folge hatte. Mikhailova (1964) berichtet nachfolgende Werte zur Toxizität von Benzotrichlorid in der Ratte (2 Stunden Exposition, 4 Wochen Nachbeobachtung): LC16 = 90 mg/m3; LC50 = 150 mg/m3; LC84 = 240 mg/m3. Wenn die Expositionskonzentrationen über 100 mg/m3 lagen, wurden die Tiere unruhig und zeigten Irritationen an den Schleimhäuten der Augen und des Atemtrakts. Die Atmung war verlangsamt. Während des Versuchs war eine starke Hyperämie der Ohren, der Schwänze und Pfoten sichtbar. Bei Konzentrationen über 1000 mg/m3 waren die Tiere deutlich gehemmt, Zuckungen der peripheren Muskulatur traten auf. Bei der histopathologischen Untersuchung wurden Entzündungen im Atemtrakt, die mit bakteriellen Superinfektionen einhergingen, sowie Effekte auf Leber (z.B. fettige Degenerationen der Hepatozyten), Niere (Tubulieffekte bis hin zu Nekrosen), Herz und Gehirn (z.B. Schwellungen der Zellen im Cortex) sowie Störungen des Blutflusses in allen Organen beobachtet. Es ist unklar, bei welchen Expositionskonzentrationen welche histopathologischen Effekte auftreten. Die Studie wurde von der OECD (2004) als ungenügend dokumentiert bewertet. In einer weiteren Versuchsanordnung wurden 10 männliche Ratten für 2 Stunden gegen 100 mg/m3 Benzotrichlorid exponiert und für weitere 4 Wochen beobachtet (Mikhailova, 1964). Drei der 10 Tiere verstarben (keine weiteren Angaben). Die überlebenden Tiere wiesen Gewichtsverluste auf und erreichten nach 4 Wochen wieder das Ausgangsgewicht (-36; - 39; -18 und -0 g nach 5, 14, 21 und 30 Tagen). Die Tiere wiesen 4 Wochen nach der Exposition eine Leukopenie auf. Weiterhin waren die renale Exkretion und die Proteinausscheidung mit dem Urin vermindert. 2.2.1.2 Maus Für die Maus wurden folgende Werte für die Toxizität von Benzotrichlorid angegeben (2 Stunden Exposition, 2 Wochen Nachbeobachtung; Mikhailova, 1964): LC16 = 30 mg/m3; LC50 = 60 mg/m3; LC84 = 120 mg/m3. Die klinischen und histopathologischen Symptome waren die gleichen wie in der Ratte: Bei Expositionskonzentrationen über 100 mg/m3 wurden die Tiere nervös und zeigten Irritationen an den Schleimhäuten der Augen und des Atemtrakts. Die Atmung war verlangsamt. Während des Versuchs war eine starke Hyperämie der Ohren, der Schwänze und Pfoten sichtbar. Bei Konzentrationen über 1000 mg/m3 waren die Tiere deutlich gehemmt, unkontrollierte Bewegungen traten auf. Entzündungen im Atemtrakt mit bakteriellen Superinfektionen, sowie Effekte auf Leber, Niere, Herz und Gehirn traten auf. Benzotrichlorid (CAS 98-07-7) 2.2.2 21 Toxizität bei wiederholter Applikation Ratten wurden bis zu 8 Wochen lang täglich (2 h/d) gegen 0, 30 und 100 mg/m3 Benzotrichlorid exponiert (Arkhipova et al., 1963). Nach einer Woche traten Gewichtsreduktion, erhöhte Aggressivität der Tiere, Blutdruckabfall und Leukopenie auf. Die weitere Exposition führte zu folgenden histopathologischen Befunden: eitrige Bronchitis, Pneumonie, fettige Degeneration von Leber Zellen, Karyolyse der kortikalen Gehirnzellen, sowie zu Leber-, Nieren- und Nebennierendystrophie. Die OECD (2004) bewertete diese Studie als ungenügend berichtet. Jeweils 10 männliche und weibliche Ratten wurden über 4 Wochen (6 h/d, 5 d/w) gegen 0; 5,1; 48,2 und 460 mg/m3 exponiert. Die Exposition in der höchsten Dosisgruppe wurde nach einer Woche wegen erheblicher Dyspnoe und Mortalität abgebrochen. In der mittleren Dosisgruppe wurde eine verminderte Gewichtszunahme und deutliche Dyspnoe in der 4. Woche beobachtet. Histopathologisch waren entzündliche degenerative und ulzerative Veränderungen der Lungen sichtbar. In der niedrigsten Dosisgruppe traten keine Effekte auf (Levin, 1981). 2.2.3 Geruchs-/Wahrnehmungsschwelle Es liegen keine Angaben zur Geruchs-/Wahrnehmungsschwelle vor. 2.2.4 Reproduktionstoxizität Spezifische Untersuchungen zu Effekten auf die Fertilität wurden nicht durchgeführt. In einer dreiwöchigen Studie mit dermaler Applikation wurde bei Tieren mit Dosierungen ≥ 100 mg/kg bw/d pathologische Veränderungen der Hodenkanälchen (Degenerationen, mehrkernige Riesenzellen) beobachtet. In den Krebsstudien werden keine pathologischen Veränderungen der Reproduktionsorgane beschrieben (OECD, 2004). Auf Grund dieser Daten können Effekte auf die Fertilität nicht ausgeschlossen werden. Bei Ratten, die an den Tagen 6-15 der Trächtigkeit mittels Gavage exponiert wurden, traten in allen Dosisgruppen (12,5, 25 und 50 mg/kg bw/d) entwicklungstoxische Effekte auf (z.B. vermindertes fetales Gewicht, Skelettanomalien; sowie eine erhöhte Anzahl an Resorptionen in der höchsten Dosisgruppe). Maternale Toxizität trat in der mittleren und höchsten Dosisgruppe auf. Die OECD (2004) wertete diese Studie als unzureichend dokumentiert. 2.2.5 Gentoxizität Männliche Sprague Dawley Ratten (Anzahl nicht angegeben) wurden über 1, 3 oder 6 Monate (6 h/d, 5 d/w) gegen 1 ppm (8 mg/m3) Benzotrichlorid exponiert. In allen Expositionsgruppen war ein leichter, aber signifikanter Anstieg an Chromosomenaberrationen in Knochenmarkszellen erkennbar. In peripheren Lymphozyten trat eine signifikant erhöhte Frequenz an Schwesterchromatidaustauschen auf. In diesen Lymphozyten war die Anzahl der Chromosomenaberrationen nach 6 monatiger Exposition signifikant erhöht, aber nicht bei kürzeren Expositionszeiten (Koshi et al., 1986). Numerische Angaben wurden in der Kurzveröffentlichung nicht gemacht. Benzotrichlorid (CAS 98-07-7) 2.2.6 22 Mechanistische Überlegungen Benzotrichlorid wird nach oraler Gabe schnell und umfassend resorbiert und im ganzen Körper verteilt. Die Substanz wird fast vollständig über den Urin in Form von Hippursäure ausgeschieden. Untersuchungen zur inhalativen Exposition von Ratten weisen darauf hin, dass Benzotrichlorid auch über die Lungen aufgenommen und als Hippursäure mit dem Harn ausgeschieden wird (OECD, 2004; BG-Chemie, 1990). Die Daten zur Krebsentstehung und Gentoxizität weisen darauf hin, dass es sich bei Benzotrichlorid um ein gentoxisches Kanzerogen handelt. Der Mechanismus, über den Benzotrichlorid seine nicht-kanzerogenen Effekte ausübt, ist nicht genau geklärt. Die lokalen Reizwirkungen sind vermutlich auf die durch hydrolytische Spaltung entstehende Salzsäure zurückzuführen. Es liegen keine Hinweise auf ausgeprägte Interspeziesunterschiede vor, weshalb ein verminderter Interspeziesextrapolationsfaktor von 3 angewendet werden kann. Die häufig verzögert auftretenden letalen Effekte bei Benzotrichloridexposition weisen darauf hin, dass möglicherweise Metabolite für die letale Wirkung mit verantwortlich sind. Zur Berücksichtigung individueller Unterschiede im Metabolismus und in der Pharmakodynamik wird der Standardfaktor 10 verwendet. 2.3 Ableitung der AEGL-Werte 2.3.1 AEGL-1 Es liegen keine geeigneten Studien vor, in denen AEGL-1 relevante Effekte beobachtet wurden. Quantitative Beschreibungen der Reizwirkungen beim Menschen sind nicht vorhanden. Geeignete Studien beim Tier fehlen. In der Studie von Bayer (Bayer AG, 1978) wird beschrieben, dass bei einer halbstündigen Exposition gegen ca. 750 mg/m3 keine Symptome wie z.B. Irritationen, Beeinträchtigung der Atemfunktion, auftreten. Aber bei dieser Konzentration tritt bereits eine eingeschränkte Körpergewichtszunahme auf, was über dem Effektniveau für AEGL-1 liegt. Deshalb wird an dieser Stelle auf die Ableitung von AEGL-1 Werten wird verzichtet. 2.3.2 AEGL-2 Symptome, wie sie von Mikhailova (1964) bei Expositionskonzentrationen > 100 mg/m3 beschrieben wurden (Irritationen, verlangsamte Atmung, Tiere beginnen unruhig zu werden) wären prinzipiell geeignet als AEGL-2 relevante Endpunkte herangezogen zu werden. Die Konzentrationsangaben sind jedoch zu ungenau. Die nächste Konzentration, die genannt wird liegt, bei über 1000 mg/m3 und führt bereits zu Effekten auf AEGL-3 Niveau (u.a. Tiere gehemmt, Muskelzuckungen). Weiterhin liegen keine Angaben vor, ob die Effekte bei > 100 mg/m3 reversibel sind, so dass eine Ableitung auf Basis dieser Studie nicht möglich erscheint. In der Bayer-Studie sind die Symptome, wenn sie auftreten, bereits so schwerwiegend (bis hin zur Lethargie und Letalität), dass sie über das AEGL-2 Niveau hinausgehen. Die Ableitung des AEGL-2 erfolgt deshalb auf Basis der Daten für den AEGL-3. AEGL-2 Werte werden als AEGL-3/3 ermittelt. Benzotrichlorid (CAS 98-07-7) 23 Basisstudie Bayer AG, 1978 Endpunkt Männliche/weibliche Ratte, ca. 800 mg/m3, 1 h: Atemstörungen, die bis zu 13 Tagen nach der Exposition anhalten; Verhaltensstörungen (u.a. Lethargie) Kalkulation AEGL-2 als AEGL-3/3 30 Min 11,3 mg/m3 (1,4 ppm) 2.3.3 1h 9,0 mg/m3 (1,1 ppm) 4h 2,2 mg/m3 (0,28 ppm) 8h 1,13 mg/m3 (0,14 ppm) AEGL-3 Die nachfolgende Tabelle fasst die Daten zur Letalität nach inhalativer Exposition zusammen: Tabelle 2-3: Expositionskonzentration (mg/m3) Daten zur akuten inhalativen Toxizität von Benzotrichlorid Expositionsdauer (h) Tote Tiere/exponierte Tiere (Geschlecht) Referenz Ratte 100 2 3/10 (m) Mikhailova, 1964 150 2 LC50 Mikhailova, 1964 258 4 2/6 (m) Bayer AG, 1978 300 4 2/6 (w) Bayer AG, 1978 530 4 3/6 (w); LC50 Bayer AG, 1978 550 4 2/6 (m) Bayer AG, 1978 600 4 2/6 (m) Bayer AG, 1978 654 4 4/6 (w) Bayer AG, 1978 747 0,5 0/6 (w) Bayer AG, 1978 790 0,5 0/6 (m) Bayer AG, 1978 795 1 0/6 (w) Bayer AG, 1978 797 1 0/6 (m) Bayer AG, 1978 995 3 4/6 (w) Bayer AG, 1978 1014 4 5/6 Smyth et al., 1951 Benzotrichlorid (CAS 98-07-7) 24 1147 3 1/6 (m) Bayer AG, 1978 1167 7 6/6 (m) Bayer AG, 1978 8390 1 LC50 Cavender (1979) Maus 60 2 LC50 Mikhailova, 1964 Die niedrigsten LC50-Werte für Benzotrichlorid werden von Mikhailova (1964) berichtet: LC50 (2 h) Maus: 60 mg/m3, LC50 (2 h) Ratte: 150 mg/m3. Diese relativ hohe Toxizität steht im Widerspruch zu den von Cavender (1979) erhobenen Daten, die für die Ratte eine LC50 (1 h) von 8390 mg/m3 berichten. Mittlere Werte für die Letalität werden in der Bayer Studie (Bayer AG, 1978) berichtet. Diese Studie wurde von der OECD (2004) als qualitativ hochwertig, fast den Anforderungen der OECD TG 403 entsprechend, bewertet. Dagegen ist nach Meinung der OECD die Dokumentation in der Publikation von Mikailova (1964) ungenügend. Diese Einschätzung wird für die nachfolgende Bewertung übernommen. Eine eigene Bewertung ist nicht möglich, da die Studie von Bayer nicht publiziert und nicht öffentlich zugänglich ist. Neben den Daten zur Letalität wird in der Bayer-Studie beschrieben, dass Tiere, die für 1 Stunde gegen ca. 800 mg/m3 exponiert waren, außer Irritationen Atemstörungen und Verhaltensauffälligkeiten (u.a. Lethargie) zeigten, die auch noch mehrere Tage nach der Exposition anhielten. Diese Effekte sind als derart schwerwiegend einzustufen, dass dadurch die Fähigkeit zur Flucht eingeschränkt ist. Sie werden deshalb als Basis für die Ableitung des AEGL-3 herangezogen. Der Wert in Höhe von 800 mg/m3 stellt zugleich den NOAEL für Letalität dar. Da keine Anhaltspunkte für das Vorliegen relevanter Interspeziesunterschiede vorliegen, wird ein Interspeziesfaktor 3 verwendet. Die Beobachtung, dass Letalität häufig erst mehrere Tage nach der Exposition auftrat, weist darauf hin, dass nicht nur die Muttersubstanz sondern auch die Stoffwechselprodukte für das Auftreten der adversen Wirkung verantwortlich sind. Zur Berücksichtigung möglicher interindividueller Unterschiede im Metabolismus und pharmakodynamischer Unterschiede wird ein Faktor 10 für die Intraspeziesextrapolation verwendet. Die Zeitextrapolation erfolgt nach ten Berge: Cn × t = k. Wegen der großen Unterschiede zwischen den einzelnen Studien bezüglich der Angaben zu LC50-Werten ist eine stoffspezifische Ableitung der n-Werte nicht möglich. Die Daten aus der Bayer-Studie weisen auf einen linearen Zusammenhang, also n=1, bei der Konzentrationszeitextrapolation hin. Zur Verbreiterung der Datenbasis wurden in der nachfolgenden Abbildung auch Werte nahe der LC50 verwendet (vgl. Abbildung 2-1). Benzotrichlorid (CAS 98-07-7) 25 9000 8000 7000 Konzentration (mg/m3) 6000 5000 4000 3000 2000 1000 0 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 Zeit (h) Abbildung 2-1: Konzentrations-Zeitbeziehung der Benzotrichlorid bedingten Letalität unter Berücksichtigung der publizierten LC50-Werte. Im Sinne einer konservativen Vorgehensweise wurden bei der vorliegenden AEGL-3 Ableitung bei der Zeitextrapolation der Standardwert n=3 für die Extrapolation auf kürzere Expositionszeiten und n=1 für die Extrapolation auf längere Expositionszeiten verwendet. Für die AEGL-3 Ableitung ergibt sich somit: Basisstudie Bayer AG, 1978 Endpunkt Männliche/weibliche Ratte, ca. 800 mg/m3, 1 h: Atemstörungen, die bis zu 13 Tagen nach der Exposition anhalten; Verhaltensstörungen (u.a. Lethargie), keine Letalität Zeitextrapolation Nach ten Berge: Cn × t = k mit dem Standardwert n=1 für die Extrapolation auf längere Expositionszeiten und n=3 für die Extrapolation auf kürzere Zeitpunkte Unsicherheitsfaktoren Gesamt 30 Interspeziesvariabilität 3 Intraspeziesvariabilität 10 Modifying factor 1 Kalkulation Benzotrichlorid (CAS 98-07-7) 26 30 Min 34 mg/m3 (4,25 ppm) 1 h 27 mg/m3 (3,4 ppm) 4 h 6,75 mg/m3 (0,85 ppm) 8 h 3,4 mg/m3 (0,43 ppm) 2.4 Plausibilitätsprüfung Die nachfolgende Tabelle fasst die hier abgeleiteten AEGL-Werte zusammen. Tabelle 2-4: Vorläufige AEGL-Werte für Benzotrichlorid (dieses Dokument) 3 3 Zeitpunkt AEGL-1 mg/m 3 AEGL-2 * mg/m 10-min nicht abgeleitet nicht abgeleitet nicht abgeleitet 30-min nicht abgeleitet 11,3 (1,4 ppm) 34 (4,25 ppm) 1-h nicht abgeleitet 9,0 (1,1 ppm) 27 (3,4 ppm) 4-h nicht abgeleitet 2,3 (0,28 ppm) 6,8 (0,84 ppm) 8-h nicht abgeleitet 1,13 (0,14 ppm) 3,4 (0,43 ppm) AEGL-3 mg/m *: als AEGL-3/3 Zum Vergleich mit den hier abgeleiteten AEGL-Werten werden die derzeitigen Protection Action Criteria (PAC, bei denen es sich in diesem speziellen Fall nur um einen anderen Namen für die ursprünglichen TEEL-Werte handelt) sowie der Temporary Emergency Exposure Limit TEEL-0 herangezogen (siehe http://www.atlintl.com/DOE/teels/teel/result.asp, Druckdatum 19. Januar 2009). Weitere Vergleichswerte wie z.B. ERPG liegen für Benzotrichlorid nicht vor. TEEL-0 = 0,35 mg/m3 (0,04 ppm) PAC1 = 1 mg/m3 (0,1 ppm) PAC2 = 7 mg/m3 (0,9 ppm) PAC3 = 25 mg/m3 (3 ppm) TEEL-Werte gelten für eine 15-minütige Spitzenexposition. Eine Begründung für die TEEL bzw. PAC Werte liegt uns nicht vor. AEGL-2 und AEGL-3 Werte für die 30minütige Exposition stimmen gut mit den PAC-Werten überein und werden durch diese gestützt. Von der „American Conference on Governmental Industrial Hygienists” (ACGIH, 1998) wurde eine Arbeitsplatzgrenzwert (TLV) in Höhe von 0,1 ppm (0,8 mg/m3) festgelegt. In der Begründung für diesen Wert heißt es, dass dies unter Berücksichti- Benzotrichlorid (CAS 98-07-7) 27 gung seiner irritierenden Wirkung und in Analogie zu den anderen alphaChlortoluolen erfolgte, ohne Nennung weiterer Details. Es kann also angenommen werden, dass die akute Reizwirkung maßgeblich für die Ableitung des TLV-war. Dieser Wert stützt somit den hier abgeleiteten AEGL-2 für 8 Stunden. Benzotrichlorid (CAS 98-07-7) 2.5 28 Literatur-Anhang ACGIH, American Conference of Governmental Industrial Hygienists, 1998 Documentation of the Threshold Limit Values and Biological Exposure Indices, 1998 Cincinnati, OH, 1998 Arkhipova, O.G.; Kochetova, T.A.; Shinkarenko, B. N., 1963 Toxic properties and biotransformation of benzotrichloride Gigiena i Sanitarija, 28, 1963, 30-34, zitiert nach OECD, 2004 Bayer AG, 1978 Benzotrichlorid akute toxikologische Untersuchungen. Study report No. 7839 dated September 29, 1978, zitiert nach OECD, 2004 BG-Chemie, Berufsgenossenschaft der chemischen Industrie, 1990 Toxikologische Bewertung Benzotrichlorid (Nr. 5) BG Chemie, Heidelberg, 1990 Cavender. F. L., 1979 Acute inhalation toxicity study in rats. Report No 163-662 dated April 27, 1979 with cover letter dated 7/27/82. Velsicol Chem Corp. FYI Submission FYI-OTS-1180-0107, Washington, DC: Office of Toxic Substances, U.S. Environmental Protection Agency, zitiert nach OECD, 2004 Craig, D.K.; Davis, J.S.; DeVore, R.; Hansen, D.J.; Petrocchi, A.J.; Powell, T.J., 1995 Alternative guideline limits for chemicals without environmental response planning guidelines American Industrial Hygiene Association Journal, 56, 1995, 919-925 Koshi, K.; Fukuda, K., 1986 Cytogenetic and morphological findings in rats exposed to benzotrichloride. Abstr. No. 25 Mutation Research, 164, 1986, 272 Levin, A.A., 1981 FYI Submission FYI-OTS-0981-0122, Office of Toxic Substances, U.S. EPA, Washington, D.C.; zitiert nach Greim, 1996 Mikhailova, T.V., 1965 Comparative toxicity of chlorine derivatives of toluene: benzyl chloride, benzal chloride and benzotrichloride Federation Proceedings. Translation Supplement, 24, 1965, T877-T880 OECD, Organisation for Economic Co-Operation and Development, 2004 SIDS Initial Assessment Report for SIAM 18. α,α,α-Trichlorotoluene (Trichloromethylbenzene) UNEP Publications, 2004 Smyth, H.F.; Carpenter, C.P.; Weil, C.S., 1951 Range-finding toxicity data: list IV Archives of Industrial Hygiene and Occupational Medicine, 4, 1951, 119-122 Ermittlung von Störfallbeurteilungswerten für kanzerogene Stoffe – Fortsetzung 3 Teilbericht: Stoffbeispiel Acrylnitril Gutachten erstellt im Auftrag des Landesamtes für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen Recklinghausen Forschungs- und Beratungsinstitut Gefahrstoffe GmbH Werthmannstraße 16 • 79098 Freiburg Bearbeitung: Dr. Martin Hassauer Dr. Fritz Kalberlah Freiburg, Februar 2009 Acrylnitril (CAS 107-13-1) 2 1 Stoffbeispiel Acrylnitril 1.1 Stoffspezifische Daten Acrylnitril (synonym: Acrylsäurenitril, Vinylcyanid, Cyanethylen, 2-Propennitril, AN) ist eine leichtflüchtige, farblose Flüssigkeit mit einem schwach stechenden Geruch. AN wird hauptsächlich zur Produktion von Acrylfasern, synthetischem Kautschuk und anderen Kunststoffen verwendet. AN reizt Haut und Atemwege, kann ernste Augenschäden verursachen und wirkt sensibilisierend (Greim, 1999; UBA, 1997; WHO, 2002). Die Substanz wurde von verschiedenen Organisationen als wahrscheinlich für den Menschen krebserregend eingestuft. Organisation Kanzerogenität Kategorie EU 2 DFG (MAK) 2 WHO/IARC 2B EPA B1 Für die Umrechnung von mg/m3 in ppm gilt: 1 mg/m3 = 0,45 ppm, 1 ppm = 2,2 mg/m3 (WHO, 2002). Die humantoxischen Wirkungen der Substanz sind nach Anhang I der Richtlinie 67/548/EEC mit folgenden R-Sätzen zu kennzeichnen: R45: Kann Krebs erzeugen. R23/24/25: Giftig beim Einatmen, Verschlucken und Berühren der Haut R37/38: Reizt die Atmungsorgane und die Haut R41: Gefahr ernster Augenschäden R43: Sensibilisierung durch Hautkontakt möglich 1.1.1 Kanzerogenität Die vorliegenden Humanstudien liefern Verdachtsmomente für einen Zusammenhang zwischen AN-Exposition und dem vermehrten Auftreten von Lungenkrebs, jedoch ist die Evidenz aus epidemiologischen Studien unzureichend (IARC, 1999: „inadequate evidence in humans“). In Tierversuchen konnte eine krebserzeugende Wirkung eindeutig nachgewiesen werden (IARC, 1999: „sufficient evidence in experimental animals“). Bei dieser Datenlage wird AN als Substanz eingestuft, die für den Menschen als krebserzeugend angesehen werden sollte. Die Untersuchungen zur Gentoxizität (vgl. Abschnitt 1.1.2) ergaben positive Befunde in vitro, in vivo wurden überwiegend negative Ergebnisse erhalten. Acrylnitril (CAS 107-13-1) 3 1.1.1.1 Humandaten Frühe epidemiologischen Daten der 70er und 80er Jahre des letzten Jahrhunderts ergeben Hinweise auf eine lungenkanzerogene Wirkung von AN bei beruflicher Exposition. In den entsprechenden Follow-Up-Studien und auch aktuelleren Studien konnte jedoch kein eindeutiger Zusammenhang zwischen dem Auftreten von Lungen- oder anderen Tumoren und beruflicher AN-Exposition nachgewiesen werden. Zusammenfassende und wertende Darstellungen liefern z.B. Cole et al. (2008), IARC (1999), Sapphire (2004) und WHO (2002). Aktuellere Untersuchungen werden im Folgenden kurz dargestellt (ggf. unter Bezug auf die älteren Arbeiten). O‘Berg (1980) beschrieb das signifikant erhöhte Auftreten von Lungentumoren bei beruflicher inhalativer AN-Exposition in US-amerikanischen Betrieben zur Acrylfaserherstelllung („DuPont-Kohorte“). Es wurden 25 Krebsfälle beobachtet (20,5 erwartet), davon 8 Lungentumore (4,4 erwartet). Weiterhin wurden bei den Exponierten erhöhte Inzidenzen für Prostatatumore beobachtet (3 Fälle vs. 0,9 erwartete). In einer Followup-Studie war das Auftreten von Lungentumoren immer noch leicht, jedoch nicht mehr signifikant erhöht. (O‘Berg et al., 1985). Es liegt eine weitere Follow-up-Studie für diese Kohorte vor, in der weitere Arbeiter (insgesamt 2559) mit in die Auswertung einbezogen wurden (Wood et al., 1998). Die Standardmortalitätsrate für Lungenkrebs betrug 0,8 (bezogen auf die Mortalitätsrate der Allgemeinbevölkerung). Die Gesamtmortalitätsrate der exponierten Arbeiter war niedriger als in der Allgemeinbevölkerung (SMR 0,69, healthy worker effect). In einem aktuellen Follow-up dieses Kollektives mit 2548 Arbeitern zeigte sich keine erhöhte Sterblichkeitsrate oder tumorbedingte Mortalität mehr (Symons et al., 2008). Ein genereller Mangel der Studien ist, dass der Raucherstatus nicht berücksichtigt wurde (Cole et al., 2008). Czeizel et al. (2004) untersuchten die Krebsrisiken von 623 Berufstätigen mit Exposition gegenüber AN in Ungarn, wobei 452 Personen kontinuierlich und 171 Personen nur gelegentlich exponiert waren (Kontrollgruppe n = 160). Die Exposition betrug durchschnittlich 0,784 mg/m3. Die Autoren fanden keine erhöhten Krebsrisiken im Vergleich zur Allgemeinbevölkerung, basierend allerdings auf nur einem aufgetretenen Gehirntumor. Das kleine Kollektiv beschränkt zudem die Sensitivität der Studie. In einer Studie, die 25460 Arbeiter der AN-produzierenden oder verarbeitenden Industrie der USA einschloss („NCI-NIOSH-Studie“), wurde insgesamt kein erhöhtes Risiko für Tumore des Magens, Gehirns, der Brust, der Prostata oder des lymphatischen und hämatopoetischen Systems beobachtet (Blair et al., 1998). Die kumulative Exposition wurde dabei in folgende Kategorien eingeteilt: 0; 0,01 - 0,13; 0,14 - 0,57; 0,58 - 1,5; 1,5 - 8,0 und > 8,0 ppm @ Jahre. In der höchsten Expositionsgruppe (> 8 ppm) wurde eine nicht signifikant erhöhte Mortalität infolge von Lungentumoren beobachtet (1,5; 0,9-2,4), bei den niedrigeren Expositionskategorien war keine klare Dosis-Wirkungsbeziehung ersichtlich. Bei einer Einteilung der Expositionskategorien in Dezile zeigte sich, dass das relative Risiko für Lungentumore mit steigender Exposition nicht weiter anstieg, vielmehr sank das relative Risiko von der zweithöchsten (RR 1,7; neuntes Dezil) zur höchsten (RR 1,3; zehnte Dezil) Expositionskategorie ab, was wiederum auf eine unklare Dosis-Wirkungsbeziehung hinweist. Eine Reanalyse dieses Kollektives durch Marsh et al. (2001) ergab auf Basis von SMR-Daten der Allgemeinbevölkerung der USA bzw. der Regionalbevölkerung Acrylnitril (CAS 107-13-1) 4 geringere Risiken im Vergleich zur relativen Risikobetrachtung auf Basis interner Studiengruppenvergleiche, wie sie von Blair et al. (1998) durchgeführt wurde (SMR 1,13 bzw. 0,9 beim Quintil der höchstexponierten Arbeiter). Sponsiello-Wang et al. (2006) führten eine Metaanalyse von insgesamt 11 der vorliegenden Studien durch. Sie ermittelten eine SMR für Lungentumore von 0,95 (0,86-1,06), unter Berücksichtigung eines healthy-worker Effekts (Basis: Vergleich der beobachteten Tumorraten mit denen der internen Kontrollkollektive) eine SMR von 1,25 (1,1-1,43, signifikant). Die Validität der Aussage wird jedoch dadurch beschränkt, dass anhand der entsprechenden Originaldaten der Raucherstatus meist nicht berücksichtigt werden konnte. Collins und Acquavella (1998) führten eine Metaanalyse von 25 epidemiologischen Studien durch, welche die AN-bedingten Tumorinzidenz bzw. Krebsmortalität untersucht hatten. Diese Meta-Analyse konnte keine signifikant erhöhten Krebsrisiken für AN-exponierte Arbeiter nachweisen. Zwar war das Risiko für Blasenkrebs erhöht, jedoch nicht dosisabhängig und nur in Fabriken, in denen auch gleichzeitig eine Exposition gegenüber aromatischen Aminen bestand (Mortalitätsstudien, Relatives Risiko: Tumore allgemein: RR = 0,8; Lunge: RR = 0,9; Prostata: RR = 1,0; Gehirn: RR = 1,1; Harnblase: RR = 1,4). In 7 der vorliegenden Studien wurde die Inzidenz relativ zur Expositionshöhe betrachtet. Über diese 7 Studien gemittelt errechneten Collins und Acquavella (1998) ein relatives Risiko von 1,2 für Lungenkrebs. In keiner dieser Studien wurde allerdings ein expositionshöhenabhängiger Trend beobachtet. Zu übereinstimmenden Befunden kommen auch Collins und Strother (1999) bei einer ähnlich gelagerten Auswertung im Hinblick auf Gehirntumore im Zusammenhang mit AN-Exposition (Metaanalyse von 12 Studien, RR = 1,1; 0,8-1,5) Eine weitere Metaanalyse von 15 Kohortenstudien mit Exposition gegenüber AN (Bofetta et al., 2008) kommt zu dem Schluss, dass die frühen Befunde zu einem vermehrten Auftreten von Lungentumoren in den später durchgeführten Studien nicht bestätigt werden und in den Follow-up-Studien über die Jahre (bis 1998) eine Abnahme des Lungenkrebsrisikos in den Kollektiven ersichtlich ist. Das zusammengefasste relative Risiko aus diesen Studien war 1,1 (0,9-1,4), wobei allerdings die individuellen Dosis-Wirkungsbeziehungsdaten der einzelnen Studien nicht berücksichtigt werden konnte. In der aggregierten Auswertung der 4 umfangreichsten Kohorten durch Cole et al. (2008) war für keine der ausgewerteten Endpunkte (Lunge, Gehirn, Blase, Prostata) eine erhöhte Sterblichkeit durch Tumore ersichtlich. In Ergänzung zu den o.g. Kohortenstudien wurde von Scelo et al (2004) eine FallKontrollstudie durchgeführt (2861 europäische Patienten mit Lungentumoren, 3118 Kontrollen), welche die Zusammenhänge zwischen einer Exposition gegenüber Vinylchlorid, AN und Styrol untersuchte. Eine mögliche berufliche Exposition wurde mit Hilfe von Experten abgeschätzt. 39 Patienten und 20 Kontrollen wurden als gegenüber AN exponiert kategorisiert, es ergab sich ein signifikantes OR (odds ratio) von 2,2 (1,11-4,36). Zu kritisieren ist diese Studie wegen der kleinen Fallzahlen und der nur geschätzten Exposition. Zudem waren 22% der Exponierten in der Schuhfabrikation beschäftigt. Dies beinhaltet einen Umgang mit Nitrilkautschuk, deshalb vermutliche Mischexposition mit Butadien und eine vermutlich nur geringe Exposition gegenüber AN (Cole et al., 2008). Acrylnitril (CAS 107-13-1) 5 Zusammenfassend scheint also AN-Exposition vor allem in älteren Studien mit einem erhöhten Lungenkrebsrisiko korreliert, wobei nur in den höchsten Expositionsgruppen ein signifikant erhöhtes relatives Risiko zu beobachten war. Bei den neueren Untersuchungen und den aktuellen follow-up-Studien wurde nahezu durchgängig kein dosisabhängig signifikant erhöhtes Risiko beobachtet. Zu einer ähnlich gelagerten Einschätzung kommen Sapphire (2004) und Haber und Patterson (2005), welche die Diskussion des Peer Review Panels zu Sapphire (2004) zusammenfassten. Die Autoren kamen zu dem Schluss, dass trotz einer umfangreichen Datenbasis (> 50000 exponierte Berufstätige), z.T. guter Expositionskategorisierung und langen Follow-up-Zeiträumen die epidemiologischen Daten bei den entsprechenden Expositionskonzentrationen keinen eindeutigen Zusammenhang zwischen AN-Exposition und erhöhtem Krebsrisiko aufzeigen, dass aber eine Assoziation dennoch nicht vollständig ausgeschlossen werden könne. Allerdings könne speziell bei höheren Expositionskonzentrationen eine kanzerogene Wirkung von AN auch beim Menschen relevant werden. 1.1.1.2 Tierdaten In den tierexperimentelle Untersuchungen zur kanzerogenen Wirkung (ältere Studien nur an Ratten, zusammengefasst z.B. in Greim, 1999, IARC, 1999 oder WHO, 2002) wirkte AN nach inhalativer und oraler Exposition kanzerogen. Mittlerweile wurden weitere Studien mit oraler Exposition von Ratten (Johannsen und Levinskas, 2002a, 2002b; Quast, 2002), und eine Langzeituntersuchung an Mäusen (Ghanayem et al., 2002) veröffentlicht, jedoch keine aktuelleren Studien mit inhalativer Exposition (aktuelle Übersicht z.B. Sapphire, 2004). Inhalation Bei Sprague-Dawley-Ratten (30 Tiere je Geschlecht und Dosis), die für ein Jahr gegenüber AN in Konzentrationen von 0, 5, 10, 20 und 40 ppm (0, 11, 22, 43 oder 86 mg/m3, 4 h/d, 5 d/w, 52 Wochen) inhalativ exponiert und über die gesamte Lebensspanne beobachtet wurden, war die Gesamtinzidenz an benignen und malignen Tumoren erhöht, ohne dass Tumoren einer spezifischen Lokalisation signifikant gegenüber der Kontrolle vermehrt waren. Zudem war keine DosisWirkungsbeziehung ersichtlich. Bei 43 und 86 mg/m3 traten bei einzelnen Tieren Gliazelltumore des Gehirns (enzephalische Gliome) auf, die bei Kontrolltieren nicht beobachtet wurden (Maltoni et al., 1977; Maltoni und Mehlman, 1987; Maltoni et al., 1988). Auch in einer weiteren Inhalationsstudie, bei der trächtige Ratten sowie deren Nachkommen (in utero und postnatal) inhalativ exponiert wurden (132 mg/m3, 4 h/d, 5 d/w bis 7 Wochen postnatal, danach 7 h/d, 5 d/w, Nachkommen für 8 oder 97 Wochen, Muttertiere 97 Wochen), wurde eine erhöhte Inzidenz an malignen Tumoren in allen Behandlungsgruppen beobachtet (Maltoni und Mehlman, 1987; Maltoni et al., 1988). U.a. traten Tumore der Brustdrüse, extrahepatische Angiosarkome, Tumore der Zymbaldrüse auf, welche aber für die jeweilige Lokalisation nicht signifikant erhöht waren. Ein ähnliches Tumorspektrum wurde auch in der Langzeitstudie von Quast et al. (1980) beschrieben: Sprague-Dawley-Ratten wurden über 2 Jahre gegen 0, 20 und 80 ppm (0, 44 und 176 mg/m3) AN exponiert (100 Tiere/Gruppe/Geschlecht, 6 Stunden/Tag, 5 Tage/Woche außer an Feiertagen). Folgende Tumore wiesen Acrylnitril (CAS 107-13-1) 6 erhöhte Inzidenzen auf: Gliazelltumore (Astrozytome) und Zymbaldrüsentumore (beide Geschlechter); Brustdrüsenadenokarzinome (Weibchen); bei Männchen: Dünndarmtumore und Plattenepithelzelltumore der Zunge, sowie Vormagentumore (nicht statistisch signifikant). Bei beiden Geschlechtern wurden auch Entzündungen und Hyperplasien in der Nase beobachtet. Bei den Weibchen der höchsten Dosisgruppe traten Nasentumore auf, jedoch nicht statistisch signifikant. Die behandelten Tiere wiesen gegenüber den Kontrollen eine erhöhte Mortalität auf (statistisch signifikant bei 80 ppm bereits im ersten Versuchsjahr), was auf eine Überschreitung der maximal tolerablen Dosis (MTD) hinweist. Das Körpergewicht war bei beiden Geschlechtern in der höchsten Dosisgruppe über die gesamte Versuchsdauer signifikant gegenüber der Kontrolle vermindert (außer bei Weibchen in den letzten Versuchsmonaten). Die Inzidenzen für die genannten Lokalisationen sind in der folgenden Tabelle 1 wiedergegeben. Tabelle 1 Tumorinzidenz bei Sprague-Dawley-Ratten nach inhalativer Exposition gegen Acrylnitril über die gesamte Lebenszeit (Quast et al., 1980). Tumortyp Geschlecht 0 ppm 20 ppm (44 mg/m3) 80 ppm (176 mg/m3) Überlebende Tiere nach 12 Monaten m 96/100 92/100 81/100 w 91/100 97/100 81/100 18/100 14/100 4/100 22/100 9/100 1/100 0/100 0/99 7/99 0/100 4/100 4/100 0/100 4/99 15/99* 0/100 4/100 17/100* 1/96 0/14 7/89* 0/96 0/9 1/91 Überlebende Tiere nach 24 Monaten m w Fokale oder multifokale Gliazellproliferationen m w Astrozytome m w Zunge (Plattenepithelkarzinome) m w Acrylnitril (CAS 107-13-1) Dünndarmkarzinome 7 m w Zymbaldrüsentumore (Adenome und Karzinome) Brustdrüsenadenokarzinome m w m w 2/99 2/20 14/98* 0/100 3/100 4/100 2/100 4/100 11/100* 0/100 2/100 13/100* 0/100 0/100 1/100 9/100 8/100 20/100* * signifikanter Effekt, p < 0,05 (Fisher’s Exact Test) Andere Pfade Quast (2002) exponierten Sprague-Dawley Ratten (je 80 pro Geschlecht und Dosis in der Kontrollgruppe, je 48 in den Dosisgruppen) für 2 Jahre gegenüber AN im Trinkwasser in Konzentrationen von 0, 35, 100 und 350 mg/l (0, 3,4; 8,5 und 21,3 mg/kg • d für Männchen, 0, 4,4; 10,8 und 25,0 mg/kg • d für Weibchen). Zusätzlich wurde eine Gruppe von 10 Tieren pro Geschlecht und Dosis 1 Jahr exponiert. Die Exposition bewirkte in allen Gruppen eine Körpergewichtsreduktion und bei Weibchen erhöhte Mortalität (bei Männchen bei 300 mg/l). Beobachtet wurden dosisabhängige Hyperplasien und Hyperkeratosen des Vormagenepithels bei allen exponierten Weibchen, bei Männchen ab 100 mg/l, und nichtneoplastische Veränderungen in mehreren Organen, u.a. dem Gehirn (fokale Gliosen). Tumore des Gehirns (u.a. Astrozytome) und Vormagenpapillome traten bereits nach 7-12 Monaten auf und waren am Ende der Studie bei Tieren beiderlei Geschlechts in allen Expositionsgruppen signifikant und dosisabhängig vermehrt. Weitere Lokalisation mit signifikanter kanzerogenen Effekten waren Zymbaldrüse, Zunge, Vormagen, Darm und Brustdrüse. Bei Sprague-Dawley Ratten (40 Tiere je Geschlecht und Dosis, Kontrollgruppe je 75 Tiere), die für ein Jahr per Schlundsonde 3-mal pro Woche gegenüber 5 mg/kg AN exponiert und über die gesamte Lebensspanne beobachtet wurden, war keine signifikante kanzerogene Wirkung zu beobachten (Maltoni et al., 1977; Maltoni und Mehlman, 1987; Maltoni et al., 1988). Johannsen und Levinskas (2002a) exponierten Sprague-Dawley Ratten (100 je Gruppe und Geschlecht) für ca. 20 Monate gegenüber 0, 1 und 100 mg/l Trinkwasser (entsprechend 0, 0,09-0,15 und 8,0-10,7 mg/kg • d) oder per Schlundsonde in Dosen von 0, 0,1 und 10 mg/kg • d (vergleichbare Dosen für verschiedene Applikationsart). Bei Männchen der höheren Dosis (beide Studien) war die Körpergewichtsentwicklung verzögert. Verabreichung über Trinkwasser bewirkte bei der höheren Dosis eine vermehrte Bildung von Astrozytomen des Gehirns sowie Karzinomen des Vormagens und der Zymbaldrüse. Bei der Schlundsondenstudie wurde eine erhöhte Acrylnitril (CAS 107-13-1) 8 Inzidenz für Tumore in Gehirn (Astrozytome), Zymbaldrüse (Karzinome) und Vormagen (Papillome/Karzinome) beobachtet. Die Trinkwasserverabreichung war hinsichtlich der Entstehung der Astrozytome effektiver als Schlundsondenapplikation, während die kanzerogene Wirkung im Verdauungstrakt bei Schlundsondengabe stärker war. Johannsen und Levinskas (2002a) untersuchten die kanzerogene Wirkung von AN bei lebenslanger Trinkwasserexposition auch in F344 Ratten in Konzentrationen von 0, 1, 3, 10, 30 und 100 mg/l, entsprechend Körperdosen von 0, 0,1; 0,3-0,4; 0,8-1,3; 2,5-3,7 und 8,4-10,9 mg/kg • d. Bei der höchsten Dosierung war die Körpergewichtentwicklung verzögert und die Mortalität erhöht. Ab 10 mg/l traten signifikant vermehrt Astrozytome des Gehirns und Karzinome der Zymbaldrüse auf. Nichtkanzerogene und kanzerogene Veränderungen waren auch im Vormagen zu beobachten (Hyperplasien und Hyperkeratosen/ Papillome und Karzinome). Zusätzlich zu den beschriebenen Studien an Ratten liegt auch eine NTP-Studie an Mäusen vor (Ghanayem et al., 2002; NTP, 2001). Hierbei wurden B6C3F1 Mäuse per Schlundsonde an 5 d/w für 2 Jahre gegenüber 0, 2,5, 10, und 20 mg/kg • d AN exponiert. Bei der höchsten Dosis war die Mortalität erhöht und die Körpergewichte reduziert. Weiterhin zeigten sich bei weiblichen Tieren vermehrt Atrophien und Zysten der Ovarien. Bei den beiden höheren Dosisgruppen traten signifikant vermehrt nichtkanzerogene und kanzerogene Effekte im Vormagen (Hyperplasien und Hyperkeratosen/ Papillome und Karzinome) auf. Die Inzidenzen für Tumore der Harder’schen Drüse waren bei allen exponierten Männchen und Weibchen ab 10 mg/l erhöht. Die Autoren werten die Befunde als „clear evidence of carcinogenic activity“. Kanzerogene Effekte in Ovarien und Lunge bei weiblichen Mäusen wurden als „may have been related to administration of acrylonitrile” gewertet. In vitro induzierte AN Zelltransformationen in Mäuse- und Hamsterzellkulturen, welche mit der Induktion von 8-Oxodeoxyguanosin korreliert waren (IARC, 1999; Saphhire, 2004). 1.1.2 Gentoxizität Humandaten Zwei in einer Übersichtsarbeit zitierte Untersuchungen an gegenüber AN exponierten Arbeitern sind wegen Mischexposition gegenüber anderen Chemikalien nicht bewertbar (ECB, 2004). Beskid et al. (2006) untersuchten Chromosomenschäden bei 61 AN-exponierten Arbeitern (Kautschukpolymerisation, Exposition bis zu 0,7 mg/m3 AN, keine Angaben, ob Mischexposition vorlag) mittels Fluoreszenz-in situ- Hybridisierung der Chromosomen 1 und 4. Sie fanden signifikante Unterschiede im Vergleich zu 49 nichtexponierten Kontrollen. Die Anzahl der Aberrationen auf Chromosom 1 der Exponierten waren erniedrigt, die auf Chromosom 4 erhöht. Berufliche Exposition gegenüber AN und Dimethylformamid (bis zu 0,3-17,6 mg/m3 bzw. 0,6 bis 23 mg/m3) führte bei 26 exponierten Arbeitern im Vergleich zu Kontrollpersonen zu erhöhten Raten an Chromosomenaberrationen, Schwesterchromatidaustauschen und außerplanmäßiger DNA-Synthese (UDS) in peripheren Lymphozyten (Major et al., 1998). Da Dimethylformamid in entsprechenden Acrylnitril (CAS 107-13-1) 9 Gentoxizitätsstudien überwiegend negativ getestet wurde, könnte diese Wirkung von AN herrühren. Allerdings beschränkt die kleine Fallzahl und die Mischexposition die Aussagekraft dieser Studie. Andere Daten AN wirkte in einer Vielzahl von in vitro Testsystemen gentoxisch, insbesondere nach metabolischer Aktivierung, während die in vivo-Befunde zumeist negativ waren (allerdings bei beschränkter Datenbasis). In der Sekundärliteratur wird AN (nach metabolischer Aktivierung zu Cyanoethylenoxid, vgl. Abschnitt 1.1.3) als nur schwaches Mutagen bewertet (ECB, 2004; Sapphire, 2004; WHO, 2002). Zahlreiche Tests an Bakterien erbrachten (fast ausschließlich bei metabolischer Aktivierung) positive Befunde in Salmonella typhimurium sowie in E.coli. Auch in Hefen wurden durch AN gentoxische Effekte (Genkonversionen, Mutationen, Aneuploidie) induziert. In Untersuchungen an Säugerzellen in vitro erwies sich die Substanz sich als mutagen, so (mit und ohne metabolische Aktivierung) im L5178Y Mauslymphom-Assay und bei metabolischer Aktivierung in humanen Lymphoblasten. Für dieses Testsystem liegen aber auch negative Befunde vor. Bei Untersuchungen auf chromosomenschädigende Wirkungen (Induktion von Mikronuklei, Chromosomenaberrationen oder Schwesterchromatidaustausch) in Zellen des chinesischen Hamsters wurden (mit und ohne metabolische Aktivierung) überwiegend positive Ergebnisse beobachtet, während die Resultate in humanen Zellen (Lymphozyten, Bronchialepithelzellen) uneinheitlich ausfielen. Allerdings waren positive Befunde z.T. mit zytotoxischen Wirkungen assoziiert. AN verursachte DNA-Brüche in Säugerzellen verschiedener Spezies, die Befunde zur Induktion von UDS waren überwiegend negativ. Der Metabolit Cyanoethylenoxid war (ohne metabolische Aktivierung) in menschlichen Lymphoblasten (TK-Locus) mutagen und induzierte UDS in humanen Mammaepithelzellen, aber nicht in primären Rattenhepatozyten. Die Substanz band auch in vitro an Nukleinsäuren und bildet 7(2-oxoethyl)-Guaninaddukte und weitere DNA-Addukte (ECB, 2004; Greim, 1999; IARC, 1999; Sapphire, 2004; WHO, 2002). In Drosophila melanogaster war das Auftreten von somatischen Mutationen und Rekombinationen nach inhalativer und oraler Exposition erhöht. In vivo wurden in Nagern überwiegend negative Befunde zur gentoxischen Wirkung erhoben (Tests auf Induktion von Mikronuklei, Chromosomenaberrationen und Schwesterchromatidaustausch in Knochenmark und Blut von Mäusen sowie von dominanten Letalmutationen bei Mäusen und Ratten). Nach intraperitonealer Applikation von AN wurden in einer Studie geringe DNA-Adduktmengen in der Leber von Ratten nachgewiesen (N7-(2-oxoethyl-)-Guanin-Addukte), nicht aber bei mehreren Studien im Gehirn von Ratten. In weiteren Untersuchungen (subakute orale Exposition von Ratten) war die Menge an 8-Oxodeoxyguanosin im Gehirn erhöht. Dies weist auf eine oxidative Schädigung der DNA im Gehirn hin. Nach subchronischer oraler Exposition von Ratten wurde eine dosisabhängig erhöhte Mutationsrate am HPRTLokus in T-Zellen der Milz berichtet. Studien, bei denen nach oraler Exposition von Ratten Induktion von UDS und DNA-Addukte in Leber, Verdauungstrakt, Gehirn, Lunge und Testes nachgewiesen wurden, werden als nicht verlässlich eingeschätzt, da bei der gewählten Methodik evtl. auch replizierende Zellen erfasst wurden und möglicherweise Kontamination mit Protein (und damit Proteinaddukten) vorlag: AN kann als direktes Alkylans mit den Thiolgruppen von Proteinen reagieren und bildet z.B. effektiv Hämoglobinaddukte (N-Cyanethyl-Valin in Erythrozyten), welche als Acrylnitril (CAS 107-13-1) 10 interner Belastungsparameter verwendet werden (ECB, 2004; Greim, 1999; Greim und Lehnert, 2000; IARC, 1999; Sapphire, 2004; WHO, 2002). In einer in diesen Übersichtsarbeiten nicht berücksichtigten Studie von Wakata et al. (1998) wurde nach i.p. Applikation oder Schlundsondengabe eine Induktion von Schwesterchromatidaustauschen in Maus-Knochenmarkzellen sowie die Induktion von Mikrokernen im Knochenmark von Ratten beobachtet. 1.1.3 Metabolismus AN wird inhalativ, oral und dermal gut resorbiert. Beim Menschen wurde in Freiwilligenstudien bei inhalativer Exposition eine Resorptionsrate von ca. 50% bestimmt, bei Ratten und Affen war die Retention nahezu vollständig. Bei oraler Exposition wird nach Befunden aus Tierstudien von vollständiger Resorption ausgegangen. Die dermale Penetrationsrate bei Freiwilligen war 0,6 mg/cm2 • h, an menschlicher Haut in vitro 3,6 mg/cm2 • h (ECB, 2004; Sapphire, 2004). AN wird über zwei Reaktionspfade verstoffwechselt: - beim reduktiven, entgiftenden Stoffwechsel führt eine nichtenzymatische oder enzymatische Konjugation mit Glutathion (GSH) zur Bildung von N-Acetyl-S(2-cyanoethyl)cystein und S-(2-Cyanoethyl)thioessigsäure, welche im Urin von Nagern nachgewiesen werden konnten (letztere nur bei der Maus). - beim oxidativen Stoffwechsel, welcher bei Glutathionmangel begünstigt wird, wird AN durch Cytochrom P450 (CYP2E1) zu Cyanoethylenoxid metabolisiert, was als aktivierender Schritt interpretiert wird. Dieser Metabolit ist ein stabiles Epoxid mit einer Halbwertszeit von 99 min (37 °C, Phosphatpuffer). Es wurde im Blut und im Gehirn von behandelten Tieren nachgewiesen. Cyanoethylenoxid kann entweder mit Makromolekülen reagieren (vgl. Abschnitt 1.1.2), mit Glutathion konjugiert werden oder hydrolysieren. Im Urin von Nagern gefundene Hauptmetabolite waren N-Acetyl-S-(2hydroxyethyl)cystein und N-Acetyl-S-(1-cyano-2-hydroxyethyl)cystein, weiterhin N-Acetyl-S-(2-carboxymethyl)cystein, Thiodiglykolsäure, Thionyldiessigsäure und Thiocyanat (siehe Abbildung -1). Bei inhalativer und oraler Exposition scheint auch bei niedrigen Dosen neben dem reduktiven Metabolismus ein relevanter oxidativer Stoffwechsel stattzufinden. Die Ausscheidung erfolgt überwiegend über den Urin, in geringerem Umfang auch über Faeces und Abatmung (als CO2). Eine nennenswerte Akkumulation ist nicht zu erwarten (ECB, 2004; Greim, 1999; IARC, 1999; Sapphire, 2004; WHO, 2002). Acrylnitril (CAS 107-13-1) Abbildung -1 1.2 11 Metabolismusschema für Acrylnitril (in Anlehnung an IARC, 1999 bzw. WHO, 2002). Berechnung der krebserzeugenden Potenz von Acrylnitril nach Einmalexposition 1.2.1 Mechanistische Überlegungen Es liegen experimentelle Vergleichsdaten vor, welche das Auftreten von Tumoren nach kürzerer als lebenslanger Exposition berichten: in der Studie von Maltoni (Maltoni et al., 1977; Maltoni und Mehlman, 1987; Maltoni et al., 1988) wurden Ratten nur über 52 Wochen inhalativ exponiert und lebenslang nachbeobachtet (vgl. Abschnitt 1.1.1.2). Es war jedoch in dieser Studie keine klare DosisWirkungsbeziehung der kanzerogenen Effekte ersichtlich. Die bei jeweils wenigen Tieren pro Gruppe (1-2) beobachteten enzephalischen Gliazelltumore des Gehirns unterschieden sich zudem vom Tumortyp von den in der Studie von Quast et al. (1980) nach 2-jähriger Expositionsdauer hauptsächlich aufgetretenen Astrozytomen. Eine nach Expositionsdauer differenzierte Risikoabschätzung auf Basis dieser Daten erscheint deshalb äußerst unsicher. In älteren Studien an Ratten, Mäusen und Hunden (Brewer, 1976) wurden dagegen bei inhalativer Exposition bis zu 243 mg/m3 (6 h/d, 5 d/w 57 Expositionen) Anzeichen von Atemwegsreizungen, jedoch keine hyper- oder neoplastischen Gewebsveränderungen berichtet. Im Hinblick auf den Mechanismus der Kanzerogenese wird das durch CYP2E1 gebildete Cyanoethylenoxid überwiegend für die Bindung an Nukleinsäuren (N7-(2- Acrylnitril (CAS 107-13-1) 12 oxoethyl-)-Guanin-Addukte) sowie die Bindung an Proteine und eine daraus resultierende Gewebetoxizität verantwortlich gemacht, während die Konjugation mit Glutathion einen entgiftenden Schritt darstellt. Die Diskrepanz der gentoxischen Aktivität von Cyanoethylenoxid (in vitro positiv, in vivo überwiegend negativ, siehe Abschnitt 1.1.2) wird mit entgiftenden Mechanismen im lebenden Organismus erklärt, welche in vitro nicht existieren. Es ist vorstellbar, dass es bei sehr hoher Exposition infolge von Sättigung dieser Mechanismen (Glutathiondepletion) zu einer vermehrten Bildung von Cyanoethylenoxid und evtl. gentoxischer Wirkung kommt (Bolt, 2003; ECB, 2004; Sapphire, 2004; WHO, 2002). Als relevanter Mechanismus für die Entstehung der Gehirntumoren bei der Ratte wird in letzter Zeit vor allem (abgesehen von einer evtl. sehr schwachen gentoxischen Wirkung), eine indirekte gentoxische Wirkung in Form oxidativer DNA-Schädigung infolge von oxidativem Stress angesehen. Da das Gehirn selbst eine nur geringe Aktivität für den AN-Metabolismus aufweist, sind vermutlich in anderen Organen (Leber, Lunge) gebildete und über das Blut ins Gehirn transportierte Metabolite für die toxischen Effekte verantwortlich (Bolt, 2003; Sapphire, 2004; WHO, 2002). Diese vermutlich organspezifische Wirkung im Gehirn der Ratte wird u.a. mit einer geringeren Aktivität an antioxidativen Schutzmechanismen im Vergleich zur Maus sowie einer AN-induzierten Inhibition der interzellulären Kommunikation erklärt. (Sapphire, 2004). Zusätzlich zu diesen Faktoren scheiden Ratten AN langsamer aus als Mäuse (nach i.v. Applikation äquivalenter Dosen), so dass die interne Belastung bei Ratten vermutlich höher ist als bei Mäusen (Jacob und Ahmed, 2004). Zwei Studien berichten die vermehrte Bildung von 8-Oxodeguanosin im Gehirn von Sprague-Dawley Ratten, welche 14-90 Tage mit 30-500 mg/l Trinkwasser behandelt worden waren. Bei Exposition gegenüber bis zu 5 mg/l konnten auch nach 90 Tagen keine derartigen Veränderungen beobachtet werden, so dass ein Schwellenwert für oxidativen Stress unterstellt wird. In Mäusehirnen zeigten sich dagegen keine oxidativen DNA-Schäden (Jiang et al., 1998; Sapphire, 2004; Whysner et al., 1998). Die oxidative DNA-Schädigung korrelierte aber nicht notwendigerweise mit anderen zelltypischen Anzeichen von oxidativem Stress: zwar fanden Jiang et al. (1998) reduzierte Glutathionkonzentration, Katalase und Superoxid-Dismutase-Aktivität im Gehirn der behandelten Tiere, Whysner et al. (1998) konnten dagegen keine Veränderung der Konzentration an Glutathion oder Aktivitätsänderungen der Glutathionoxidase oder Katalase und auch keine vermehrte Lipidperoxidation nachweisen. Auch in einem weiteren in vivo-Experiment an Ratten, denen 14 Tage lang 200 mg/l AN im Trinkwasser verabreicht wurde, konnte in den Gehirnen im Vergleich zu Kontrollen keine Anzeichen von oxidativem Stress beobachtet werden (untersuchte Parameter: Lipidperoxidation, verminderte Glutathionkonzentrationen und erniedrigte Katalasewerte; Carrera et al., 2007). Oxidative DNA-Schäden wurden auch bei Studien mit Rattengehirnzellen in vitro beobachtet. In der Studie von Kamendulis et al. (1999) verursachte AN in Gliazellen die Bildung von 8-Hydroxydeguanosin (nicht aber in Parallelstudien mit Hepatozyten), zusammen mit einer Verringerung der Glutathionkonzentration und der Aktivitäten von Katalase und Superoxid-Dismutase. Eine oxidative DNASchädigung, jedoch keine DNA-Strangbrüche, wurden in einer Untersuchung von Pu et al. (2006) an Rattenastrozyten berichtet, welche durch Antioxidanzien vermindert und durch Glutathiondepletion verstärkt wurde. Die Zugabe eines Cytochrom P450- Acrylnitril (CAS 107-13-1) 13 Inhibitors verhinderte die DNA-Schädigung, was mit der Hypothese der oxidativen Aktivierung der Substanz in Einklang steht. Auch die zelltransformierenden Eigenschaften von AN in Hamsterembryozellen in vitro wurden mit einer oxidativen Schädigung erklärt (Zhang et al., 2002). Die oxidative DNA-Schädigung ist deshalb relevant, weil die Anwesenheit von 8Oxodeguanosin bei der Replikation Mutationen (A → T oder C → G Austausche) auslösen und die Genexpression verändern kann (Murata et al., 2001; Sapphire, 2004). Dass speziell die Glutathiondepletion ein relevanter Mechanismus der AN-Toxizität sein könnte zeigen in vitro-Experimente an Rattengehirnzellen bei denen die toxischen Wirkungen von AN in Rattenastrozyten und –gliazellen (Viabilität, Membranschädigung, Lipidperoxidation) durch N-Acetylcystein als Glutathionquelle, nicht aber durch andere Antioxidanzien vermindert wurden (Carrera et al., 2007; Esmat et al., 2007). Als weitere Ursache für toxische Wirkungen wird auch das bei der Hydrolyse des Cyanoethylenoxids entstehende Cyanid vermutet (Chanas et al., 2003; Esmat et al., 2007), welches durch Entkopplung der oxidativen Phosphorylierung reaktive Sauerstoffspezies und somit ebenfalls oxidativen Stress auslösen kann (Murata et al., 2001). Dennoch ist AN ein pluripotentes Kanzerogen in Ratten (Zymbaldrüse; Brustdrüse, Zunge, Vormagen, Dünndarm, Nase) und Mäusen (Harder’sche Drüse, Vormagen). Es kann also vermutet werden, dass mit Ausnahme des Gehirns andere Mechanismen der Kanzerogenese als oxidative DNA-Schädigung relevant sind, so z.B. die in anderen Organen beobachtet DNA-Adduktbildung (Bolt, 2003; ECB, 2004). Das Ausbleiben von Lebertumoren (einem Hauptorgan des Stoffwechsels, mit potenziell hoher Wahrscheinlichkeit der Bildung des gentoxischen Metaboliten Cyanoethylenoxid und dem Nachweis geringer Mengen an N7-(2-oxoethyl-)-GuaninAddukten) zeigt jedoch, dass zusätzlich zu gentoxischen Effekten noch weitere Faktoren relevant sein müssen. 1.2.2 Verwendung stoffspezifischer Daten 1.2.2.1 Verwendung von Kanzerogenitätsdaten NAC/AEGL-Kanzerogenitätsbewertung für Acrylnitril Im „Technical Support Document“ für Acrylnitril (Stand: Juli 2007, Proposed status) wurde ein nennenswertes Krebsrisiko bei Einmalexposition gegenüber AN verneint und keine quantitative Betrachtung im Vergleich zu nichtkanzerogenen Effekten vorgenommen (Anonymus, 2007). Unit Risk Ableitungen Es liegen mehrere unit risk-Abschätzungen für die inhalative Exposition vor, welche entweder auf den Lungentumorraten bei Humanexposition oder auf den Daten der Rattenstudie von Quast et al. (1980) basieren (entweder auf Basis kumulierter Inzidenzen in mehreren Organen oder auf Basis der Gehirntumore). Eine Zusammenfassung dieser Abschätzungen und ihre Qualitätsbewertung finden sich in Acrylnitril (CAS 107-13-1) 14 Schneider et al. (2002). Die Autoren kommen zu dem Schluss, dass Abschätzungen auf Basis von Humandaten generell mit großen Unsicherheiten behaftet sind (Kategorie UR-, u.a. wegen der Verwendung veralteter Daten, Unsicherheiten der Expositionsabschätzung, Nichtberücksichtigung des Raucherstatus, teilweise Mischexposition mit anderen Kanzerogenen). Gleiches trifft auf die mittlerweile vorliegende aktuellere Risikoabschätzung der WHO (2000) zu, bei der gegenüber der Fassung von 1987 keine inhaltliche Aktualisierung erfolgte. Dagegen wurden die Ableitungen auf Basis der Tierstudie mittels linearer Extrapolation in den Niedrigdosisbereich (direkte lineare Extrapolation, MultistageModell, ED10/LED10-Verfahren auf Basis eines Multistage-Modells) durchgängig als verlässlicher, jedoch angesichts der mechanistischen Diskussion (mögliche Beteiligung indirekt gentoxischer und/oder nichtgentoxischer Faktoren) dennoch als mit Unsicherheiten behaftet angesehen. Die Spanne der Abschätzungen ist trotz teilweise etwas unterschiedlicher Methodik sehr gering und umfasst unit riskSchätzer im Bereich von 5,7 • 10-6 bis 2,7 • 10-5 pro µg/m3 (Faktor < 5). Zu Vergleichszwecken wurde auch von Sapphire (2004) eine lineare Extrapolation analog den o.g. Risikoabschätzungen durchgeführt. Die Autoren kamen auf Basis der externen Belastungen und einer LED10 der zusammengefassten Ergebnisse der vorliegenden Inhalationsstudien zu Gehirntumoren (Quast et al.; Maltoni et al.: Daten von Muttertieren und Nachkommen) zu einem unit risk-Schätzer in Höhe von 1,5 • 10-6 pro µg/m3. Für die Daten der Studie von Quast et al. (1980) ergäbe sich entsprechend ein unit risk von 1,7 • 10-6 pro µg/m3 (Faktor <3 niedriger als die untere Grenze der o.g. Spanne). Ausgehend von einer Betrachtung der inneren Belastung gegenüber Cyanoethylenoxid im Gehirn (Methodik siehe im folgenden Abschnitt „Nichtlineare Risikoextrapolation“) wurde eine LED10 von 22,9 mg/m3 abgeleitet, welche in linearer Extrapolation mit einem unit risk von 4,4 • 10-6 pro µg/m3 korrespondiert. Insgesamt kommen die vorliegenden linearen Risikoabschätzungen also zu gut übereinstimmenden Werten (für unterschiedliche Verfahren mit einer Spanne von ca. einer Größenordnung). Allerdings ist davon auszugehen, dass diese unit risk-Werte angesichts des vermuteten Schwellenwert-behafteten Mechanismus einer oxidativen DNA-Schädigung eine Risikoüberschätzung bedingen. Wenn man ein unit risk von 0,8 • 10-5 pro µg/m3 (Mittel der Spanne der Risikoabschätzungen auf Basis der Gehirntumore in männlichen Ratten der Studie von Quast et al., 1980) als Basis für die Extrapolation auf kurzzeitige Exposition zugrunde legt, ergibt sich ein Risiko von 1 • 10-4 (1:10000) bei einer lebenslangen Exposition (70 Jahre = 25600 Tage) gegenüber 12,5 µg/m3. Für eine Kurzzeitexposition von einem Tag ergibt sich somit: 12,5 µg/m3 x 25600 = 320 mg/m3 Das National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL) verwendet üblicherweise einen Standardunsicherheitsfaktor von 6, um die Unsicherheiten bei der Berechnung der Kanzerogenität nach Kurzzeitexposition auf Basis einer chronischen Studie zu berücksichtigen. 320 mg/m3 / 6 = 53 mg/m3 (24 ppm). Eine Konzentration von 24 ppm über 24 Stunden würde also einem Risiko von Acrylnitril (CAS 107-13-1) 15 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Haber’schen Gesetzes Cn x t = constant mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 72 ppm 4 h: 144 ppm 1 h: 576 ppm T25-Ableitung In ECB (2004) wurde für die Berechnung nach dem T25-Konzept (zur Methodik vergleiche AGS, 2008) die Daten für Gehirntumore bei männlichen Ratten aus der Studie von Quast et al. (1980) zu Grunde gelegt. Es ergab sich eine T25 von 16,1 mg/kg • d. Umgerechnet auf die äußere Exposition des Menschen (Annahme 20 m3 Atemvolumen/d, 70 kg Gewicht) entspricht dies einer Luftkonzentration von 56,4 mg/m3 (25,6 ppm). Linear umgerechnet auf ein 1:10000 Risiko ergibt sich auf Basis der T25 ein Tumorrisiko von 1:10000 bei 0,023 mg/m3 Diese Berechnungen gehen von einer lebenslangen Exposition (70 Jahre = 25600 Tage) aus. Für eine Kurzzeitexposition von einem Tag ergibt sich somit: 0,023 mg/m3 x 25600 = 589 mg/m3 Unter Verwendung des bei NAC/AEGL üblichen Standardunsicherheitsfaktors von 6, um die Unsicherheiten bei der Berechnung der Kanzerogenität nach Kurzzeitexposition auf Basis einer chronischen Studie zu berücksichtigen, ergibt sich: 589 mg/m3 / 6 = 98 mg/m3 (44 ppm) Eine Konzentration von 44 ppm über 24 Stunden würde also einem Risiko von 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Beziehung cn x t = k mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 132 ppm 4 h: 264 ppm 1 h: 1056 ppm Angesichts der guten Modellierbarkeit der Daten der Studie von Quast et al. (1980) mit dem Multistage-Modell ist im konkreten Fall der Risikoabschätzung auf Basis der ED10/LED10-Methode der Vorzug zu geben, da hierbei die gesamte DosisWirkungsbeziehung berücksichtigt werden kann. Die Abschätzung auf Basis der T25 kommt allerdings nur zu geringfügig höheren Werten bestätigt i.w. deren Befunde. Nichtlineare Risikoextrapolation Während u.a. ECB (2004) AN als Kanzerogen ohne Schwellenwert betrachten, Acrylnitril (CAS 107-13-1) 16 kommen Sapphire (2004) und Haber und Patterson (2005) zu der Einschätzung, dass sowohl die Verwendung eines unit risk auf Basis von Humandaten zur Risikoabschätzung als auch eine lineare Extrapolation auf Basis von Tierdaten angesichts eines zu vermutenden nicht-gentoxischen Mechanismus nicht angemessen sei. In Sapphire (2004) wurde folgender Ansatz verfolgt: - Kumulative Auswertung der Inzidenzen für Gehirntumore in den vorliegenden Studien mit inhalativer und Trinkwasser-Exposition - Umrechnung der externen Belastung dieser Datensätze auf interne Gehirnbelastung gegenüber Cyanoethylenoxid mittels eines PBPK-Modelles von Kedderis et al. (1996) (hierbei erwiesen sich nach den Betrachtungen von Kirman et al. (2000) die Spitzenkonzentrationen zur Modellierung der Dosis-Wirkungsbeziehung als geeigneter im Vergleich zur AUC). - Modellierung der Dosis-Wirkungsbeziehung (extra risk, gamma-Modell) und Bestimmung eines „Point of Departure“ (POD) für die Risikobewertung (ED05 und LED05 für Cyanoethylenoxid-Konzentration) - Umrechung dieser Werte mittels des PBPK-Modells auf humane äußere Luftbelastungen. Es ergab sich so eine ED05 von 25,9 mg/m3 und eine LED05 von 21,3 mg/m3. Ausgehend von diesen Werten wurde unter Berücksichtigung eines Gesamtunsicherheitsfaktors von 220 eine Konzentration analog einer Referenzdosis von gerundet 0,1 mg/m3 abgeleitet. Bei Einhaltung dieser Konzentration sei nach Ansicht der Autoren kein nennenswertes Krebsrisiko mehr zu unterstellen. Der Faktor von 220 setzt sich zusammen aus Unsicherheitsfaktoren von 3,2 (Interspeziesfaktor für dynamische Unterschiede der Toxizität, toxikokinetische Unterschiede durch das Modell berücksichtigt), 7 für Intraspeziesunterschiede (2,2 für toxikokinetische Unterschiede auf Basis des Vergleichs von mittlerer Cyanoethylenoxid-Belastung und dessen 95. Perzentil, Faktor 3,2 für dynamische Unterschiede der Toxizität) und 10 (zur Abschätzung eines NOAEL ausgehend von einem 5% Effektniveau). Wenn man in Ergänzung zu den Extrapolationsrechnungen auf Basis von unit riskund T25-Werten diese ED05 in Höhe von 25,9 mg/m3 auf einmalige Exposition umrechnet, ergibt sich ein Tumorrisiko von 1:10000 bei 0,052 mg/m3. Damit ist das Krebsrisiko unter Berücksichtigung eines PBPK-Modells zur Konzentration des relevanten Metaboliten Cyanoethylenoxid um ca. den Faktor 2 höher als die Abschätzung unter Verwendung der externen Expositionsdaten. Diese Berechnungen gehen von einer lebenslangen Exposition (70 Jahre = 25600 Tage) aus. Für eine Kurzzeitexposition von einem Tag ergibt sich somit: 0,052 mg/m3 x 25600 = 1331 mg/m3 Unter Verwendung des bei NAC/AEGL üblichen Standardunsicherheitsfaktors von 6, um die Unsicherheiten bei der Berechnung der Kanzerogenität nach Kurzzeitexposition auf Basis einer chronischen Studie zu berücksichtigen, ergibt sich: 1331 mg/m3 / 6 = 222 mg/m3 (101 ppm) Acrylnitril (CAS 107-13-1) 17 Eine Konzentration von 101 ppm über 24 Stunden würde also einem Risiko von 1:10000 entsprechen. Linear umgerechnet auf die kürzeren Zeiträume unter Berücksichtigung der Beziehung cn x t = k mit n = 1 ergibt sich somit unter Berücksichtigung eines Krebsrisikos von 1:10000: 8 h: 303 ppm 4 h: 606 ppm 1 h: 2424 ppm Diese Werte sind das Resultat einer linearen Abschätzung, ausgehend von der ED05 auf Basis pharmakokinetischer Modellierung für den oxidativen Stoffwechsel. Unter der Annahme einer nichtlinearen Dosis-Wirkungsbeziehung wäre bei weiterer Extrapolation in den Niedrigdosisbereich ein Knickpunkt in der DosisWirkungsbeziehung zu erwarten, dessen Abschätzung innerhalb des gegebenen Rahmens aufwandsbedingt nicht möglich war. Eine Extrapolation der von Sapphire (2004) abgeleiteten Referenzdosis auf Kurzzeitexposition würde beträchtliche Unsicherheiten in sich bergen und wurde aus diesem Grund nicht durchgeführt. 1.2.2.2 Verwendung von Gentoxizitätsdaten Geeignete in vivo-Daten zu gentoxischen Wirkungen liegen nicht vor. 1.3 AEGL-Werte für Acrylnitril Im Rahmen der Aktivitäten des National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances (NAC/AEGL Committee) wurden AEGLWerte für AN abgeleitet. Das „Technical Support Document“ (vom 7. Juli 2007) befindet sich im „proposed“ Status. In der Endfassung des TSD können sich also noch Änderungen gegenüber den hier dargestellten Werten ergeben. Der AEGL-1 Wert basiert auf einer Studie von Jakubowski et al. (1987), bei der nach 8-stündiger Exposition von Freiwilligen gegenüber 4,6 ppm keine Effekte beobachtet wurden. Dieser Wert wird gestützt durch Daten an Berufstätigen, wo bis zu 10 ppm keine Effekte beschrieben sind und ab 12-15 ppm erste Reizwirkungen auftraten. Nachdem erste, minimale Effekte in Studien an Berufstätigen unabhängig von der Expositionsdauer auftraten, wurde keine Zeitabstufung des AEGL-1 Wertes vorgenommen. Die AEGL-2 Werte wurden abgeleitet auf Basis einer Studie von Dudley und Neal (1942), bei der Ratten nach einer 2 h Exposition gegenüber 305 ppm leichte Augenund Nasenreizungen aufwiesen, welche innerhalb von 12 h reversibel waren. Die Befunde werden durch Befunde bei Berufstätigen gestützt. Ausgehend von diesem POD wurde ein Gesamtunsicherheitsfaktor von 10 gewählt (Faktor 3 für Interspeziesvarianz auf Basis eines PBPK-Modells für CyanoethylenoxidKonzentrationen in Blut und Gehirn für Ratten und Menschen; Faktor 3 für Intraspeziesvariabilität wegen geringer innerartlicher Unterschiede bei akuten Effekten). Für die Zeitabhängigkeit fand das Haber’sche Gesetz Cn x t = constant mit n = 1,1 Anwendung. Acrylnitril (CAS 107-13-1) 18 Die AEGL-3 Werte wurden anhand von BMCL05-Modellierungen von Letalitätsdaten aus den Studien von Dudley und Neal (1942) sowie Appel et al. (1981) für 30 min, 1 h und 8 h Expositionsdauer abgeleitet. Ausgehend von diesem POD wurde ein Gesamtunsicherheitsfaktor von 10 gewählt (Faktor 3 für Interspeziesvarianz auf Basis eines PBPK-Modells für Cyanoethylenoxid-Konzentrationen in Blut und Gehirn für Ratten und Menschen; Faktor 3 für Intraspeziesvariabilität wegen geringer innerartlicher Unterschiede bei akuten Effekten). Für die Zeitabhängigkeit zur Ableitung der 10 min- und 4 h-Werte fand das Haber’sche Gesetz Cn x t = constant mit n = 1,1 Anwendung. Die AEGL-Werte sind in der folgenden Tabelle 2 zusammengefasst. Tabelle 2 Proposed AEGL-1, AEGL-2- und (Anonymous, 2007; EPA, 2009) AEGL-3-Werte für Acrylnitril Zeitpunkt AEGL-1 (ppm) AEGL-2 (ppm) AEGL-3 (ppm) 10 min 4,6 290 480 30 min 4,6 110 180 1h 4,6 57 100 4h 4,6 16 35 8h 4,6 8,6 19 1.4 Vergleich kanzerogene Potenz nach Einmalexposition vs. AEGLWerte Der Vergleich der AEGL-2 Werte mit den Störfallbeurteilungswerten, die auf Basis der kanzerogenen Wirkung von AN (nach der Methode des NRC (2001) auf Basis des unit risk- oder des T25-Verfahrens) abgeleitet wurden, zeigt, das die AEGL-2 Werte um ca. eine Größenordnung unter den kalkulierten Werten für ein Risiko von 1:10000 liegen. Die auf Basis der ED05 (Sapphire, 2004) abgeleiteten Werte lägen nochmals um den Faktor ca. 2 höher. Nachdem diese Risikoabschätzungen vermutlich alle eine Risikoüberschätzung beinhalten (vgl. Abschnitt 1.2.1), stellt dies eine konservative Betrachtung dar. Die Relevanz kanzerogener Effekte bei Kurzzeitexposition ist demnach vermutlich noch geringer. Die Werte sind in der folgenden Tabelle 3 zusammengefasst. Tabelle 3 Zeitpunkt 8 Stunden Vergleich der Störfallbeurteilungswerte auf Basis kanzerogener und nicht-kanzerogener Endpunkte AEGL-2 Zusätzliches Krebsrisiko 1:10.000 (nicht kanzerogener Endpunkt) Kalkuliert nach unter Verwendung des unit risk Kalkuliert unter Verwendung der T25 8,6 ppm 72 ppm 132 ppm Acrylnitril (CAS 107-13-1) 19 4 Stunden 16 ppm 144 ppm 264 ppm 1 Stunde 57 ppm 576 ppm 1056 ppm 1.5 Diskussion AN ist ein Kanzerogen der Kategorie 2. Die Gentoxizitätsdaten sprechen für eine schwache gentoxische Aktivität in vitro. In vivo wurden überwiegend negative Befunde erhalten, wenn auch bei beschränkter Datenlage. Für die DNA-schädigende Wirkung wird der oxidativ gebildete Metabolit Cyanoethylenoxid verantwortlich gemacht, welcher die DNA und auch Proteine alkylieren kann. Häufig wird diskutiert, dass die Befunde in den Tierstudien nicht in Einklang mit Humanbefunden stehen würden, da beim Menschen keine erhöhten Tumorinzidenzen nach beruflicher Exposition gefunden wurden (z.B. Sapphire, 2004). Wie jedoch in Schneider et al. (2002) gezeigt wurde, steht die Risikoabschätzung auf Basis der Tierdaten zu Gehirntumoren nicht im Widerspruch zu den Humandaten für Lungenkrebs: ausgehend von einem gemittelten unit risk von 1,26 • 10-5 pro µg/m3 lassen sich auf Basis der ppm-Jahre z.B. niedrigere Risiken als die in der Studie von Blair et al. (1998) beobachteten abschätzen, so dass das tatsächliche Humanrisiko auf Basis von Tierdaten tendenziell sogar unterschätzt wird. Die zu erwartenden Risiken wären ebenfalls nicht statistisch signifikant. Zu vergleichbaren Aussagen kommen auch Schulz et al. (2001): sie schätzten anhand der Daten der Studie von Quast et al. (1980), umgerechnet auf ppm-Jahre, eine vergleichbare Zahl an Gehirntoten wie die tatsächlich beobachteten Fälle für die Kohorten aus den Studien Blair et al. (1998) (17,7 vs. 12), Swaen et, al (1998) (3,7 vs. 6) und Wood et al. 1998 (7,6 vs. 6). Sämtliche geschätzten Fallhäufigkeiten lagen innerhalb der beobachteten Konfidenzintervalle der humankanzerogenen Wirkung. Es liegen keine Studien vor, in denen die krebserzeugende Wirkung nach kurzer Expositionszeit untersucht wurde. Auf Grund der Beobachtungen, dass bereits nach Einmalexposition in vitro eine Bindung an DNA erfolgt und weitere gentoxische Effekte beobachtet wurden, kann nicht ausgeschlossen werden, dass es bereits nach einer Kurzzeitexposition zu bleibenden Schäden kommt. Dies begründet die Ableitung von Störfallbeurteilungswerten unter Berücksichtigung der kanzerogenen Wirkung. Im Bezug auf die Kanzerogenese im Gehirn von Ratten wird ein indirekter gentoxischer Mechanismus vermutet, welcher auf indirekter DNA-Schädigung infolge von oxidativem Stress der Zellen beruht. Eine Beurteilung der Störfallsituation auf Basis einer chronischen Studie ist mit großen Unsicherheiten behaftet. Rechnerisch liegen die Störfallbeurteilungswerte auf Basis der Daten zur Kanzerogenität, unabhängig ob ausgehend vom unit risk oder mittels T25 berechnet (die Ergebnisse nach beiden Methoden unterscheiden sich nur um etwa den Faktor 2) oberhalb der AEGL-2 (und der AEGL-1) Werte. Dies spiegelt die relativ niedrige kanzerogene Aktivität bei hohen Konzentrationen wider. In beiden Fällen wurde der Standardfaktor 6 zur Berücksichtigung der Unsicherheiten bei der Extrapolation von der chronischen auf die akute Situation angewendet. Dieser Faktor ist möglicherweise zu hoch, wenn man berücksichtigt, dass in Langzeitstudien erste Tumore erst nach 7-12 Monaten beobachtet wurden, die Gentoxizität offensichtlich nur schwach ausgeprägt ist und weitere, indirekt gentoxische Mechanismen der Kanzerogenese relevant sein dürften. Acrylnitril (CAS 107-13-1) 20 Unter diesen Aspekten kann plausibel angenommen werden, dass die vorliegenden Störfallbeurteilungswerte ausreichend Schutz vor kanzerogenen Effekten bieten. 1.6 Literatur AGS, Ausschuss für Gefahrstoffe, 2008 Leitfaden zur Quantifizierung von Krebsrisikozahlen bei Exposition gegenüber krebserzeugenden Gefahrstoffen für die Grenzwertsetzung am Arbeitsplatz Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Dortmund/Berlin/Dresden, 2008 Anonymus, 2007 Acute exposure guideline levels (AEGLs) for acrylonitrile, proposed status, Stand Juli 2007 Docket ID Number EPA-HQ-OPPT-2008-0026 online: www.regulations.gov, Abfragedatum Januar 2009 Appel, K.E.; Peter, H.; Bolt, H.M. 1981 Effect of potential antidotes on the acute toxicity of acrylonitrile International Archives of Occupational and Environmental Health, 48, 1981, 157-163 Beskid, O.; Dusek, Z.; Solanský, I.; Srám, R.J., 2006 The effects of exposure to different clastogens on the pattern of chromosomal aberrations detected by FISH whole chromosome painting in occupationally exposed individuals Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis, 594, 2006, 20-29 Blair, A.; Stewart, P.A.; Zaebst, D.D.; Pottern, L.; Zey, J.N.; Bloom, T.F.; Miller, B.; Ward, E.; Lubin, J., 1998 Mortality study of industrial workers exposed to acrylonitrile Scandinavian Journal of Work, Environment and Health, 24, Suppl. 2, 1998, 25-41 Boffetta, P.; McLaughlin, J.K.; La Vecchia, C.; Tarone, R.E.; Lipworth, L.; Blot W. J., 2008 False-positive results in cancer epidemiology: a plea for epistemological modesty Journal of the National Cancer Institute, 100, 2008, 988-995 Bolt, H.M., 2003 Genotoxicity - threshold or not? Introduction of cases of industrial chemicals Toxicology Letters, 140-141, 2003, 43-51 Brewer, W.E., 1976 90-Day Subacute Vapour Inhalation Toxicity Study with Acrylonitrile in Beagle Dogs, Albino Rats and Albino Mice (Industrial Biotest Report no. 74-42, prepared for the Monsanto Company), zitiert nach Sapphire, 2004 Carrera, M.P.; Antolín, I.; Martín, V.; Sainz, R.M.; Mayo, J.C.; Herrera, F.; García-Santos, G.; Rodríguez, C., 2007 Antioxidants do not prevent acrylonitrile-induced toxicity Toxicology Letters, 169, 2007, 236-244 Chanas, B.; Wang, H.; Ghanayem, B.I., 2003 Differential metabolism of acrylonitrile to cyanide is responsible for the greater sensitivity of male vs female mice: role of CYP2E1 and epoxide hydrolases Toxicology and Applied Pharmacology, 193, 2003, 293-302 Cole, P.; Mandel, J.S.; Collins, J.J., 2008 Acrylonitrile and cancer: A review of the epidemiology Regulatory Toxicology and Pharmacology, 52, 2008, 342-351 Collins, J.J., Acquavella, J.F., 1998 Review and meta-analysis of studies of acrylonitrile workers Scandinavian Journal of Work, Environment and Health, 24, Suppl. 2, 1998, 71-80 Collins, J.J.; Strother, D.E., 1999 CNS tumors and exposure to acrylonitrile: inconsistency between experimental and epidemiology studies Neuro-Oncology, 1, 1999, 221-230 Czeizel, A.E.; Szilvási, R.; Tímár, L.; Puho, E., 2004 Occupational epidemiological study of workers in an acrylonitrile using factory with particular Acrylnitril (CAS 107-13-1) 21 attention to cancers and birth defects Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis, 547, 2004, 79-89 Dudley, H.C.; Neal, P.A.,1942 Toxicology of acrylonitrile (vinyl cyanide). I. Study of the acute toxicity Journal of Industrial Hygiene and Toxicology, 24, 1942, 27-36 EPA, Environmental Protection Agency, 2009 Acute Exposure Guideline Levels (AEGLs), Acrylonitrile Results (Proposed) online: http://www.epa.gov/oppt/aegl/, Abfragedatum Januar 2009 Esmat, A.; El-Demerdash, E.; El-Mesallamy, H.; Abdel-Naim, A.B., 2007 Toxicity and oxidative stress of acrylonitrile in rat primary glial cells: preventive effects of Nacetylcysteine Toxicology Letters, 171, 2007, 111-118 ECB, European Chemicals Bureau, 2004 European Union Risk Assessment Report: Acrylonitrile. 1st Priority List, Vol. 32 EUR 20857 EN, European Commission, Joint Research Centre, 2004 online: http://ecb.jrc.ec.europa.eu/esis/index.php?PGM=esi&DEPUIS=autre Ghanayem, B.I.; Nyska, A.; Haseman, J.K.; Bucher, J.R., 2002 Acrylonitrile is a multisite carcinogen in male and female B6C3F1 mice Toxicological Sciences, 68, 2002, 59-68 Greim, H., 1999 Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAKWerten, Loseblattsammlung, 28. Lfg. DFG, Deutsche Forschungsgemeinschaft, WILEY-VCH Verlag, Weinheim, 1999 Greim, H.; Lehnert, G., 2000 Biologische Arbeitsstoff-Toleranz-Werte (BAT-Werte) und Expositionsäquivalente für krebserzeugende Arbeitsstoffe (EKA), Arbeitsmedizinisch-toxikologische Begründungen 9. Lfg., DFG, Deutsche Forschungsgemeinschaft, 2000 Haber, L.T.; Patterson, J., 2005 Report of an independent peer review of an acrylonitrile risk assessment Human and Experimental Toxicology, 24, 2005, 487-527 IARC, International Agency for Research on Cancer, 1999 IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol. 71. Re-Evaluation of some Organic Chemicals, Hydrazine and Hydrogen Peroxide (Part 1-3) WHO, World Health Organization, Geneva, 1999 Jacob, S.; Ahmed, A.E., 2004 Species difference in the disposition of acrylonitrile: quantitative whole-body autoradiographic study in rats and mice Toxicology and Industrial Health, 20, 2004, 9-19 Jakubowski, M.; Linhart, I.; Pielas, G.; Kopecky, J., 1987 2-Cyanomethylmercapturic acid in the urine as a possible indicator of exposure to acrylonitrile British Journal of Industrial Medicine, 44, 1987, 834-840 Jiang, J.; Xu, Y.; Klaunig, J.E., 1998 Induction of oxidative stress in rat brain by acrylonitrile (ACN) Toxicological Sciences, 46, 1998, 333-341, zitiert nach Sapphire, 2004 und WHO, 2002 Johannsen, F.R.; Levinskas, G.J., 2002a Comparative chronic toxicity and carcinogenicity of acrylonitrile by drinking water and oral intubation to Spartan Sprague-Dawley rats Toxicology Letters, 132, 2002, 197-219 Johannsen, F.R.; Levinskas, G.J., 2002b Chronic toxicity and oncogenic dose-response effects of lifetime oral acrylonitrile exposure to Fischer 344 rats Toxicology Letters, 132, 2002, 221-247 Kamendulis, L.M.; Jiang, J.; Xu, Y.; Klaunig, J.E., 1999 Induction of Oxidative Stress and Oxidative Damage in Rat Glial Cells by Acrylonitrile Carcinogenesis, 20, 1999, 1555-1560, zitiert nach Sapphire, 2004 Acrylnitril (CAS 107-13-1) 22 Kedderis, G.L.; Teo, S.K.O.; Batra, R.; Held, S.D.; Gargas, M.L., 1996 Refinement and verification of the physiologically based dosimetry description for acrylonitrile in rats Toxicology and Applied Pharmacology, 140, 1996, 422-435 Kirman, C.R.; Hays, S.M.; Kedderis, G.L.; Gargas, M.L.; Strother, D.E., 2000 Improving cancer dose-response characterization by using physiologically based pharmacokinetic modeling: an analysis of pooled data for acrylonitrile-induced brain tumors to assess cancer potency in the rat Risk Analysis, 20, 2000, 135-151 Major, J.; Hudák, A.; Kiss, G.; Jakab, M.G.; Szaniszlo, J.; Naray, M.; Nagy, I.; Tompa, A., 1998 Follow-up biological and genotoxicological monitoring of acrylonitrile- and dimethylformamideexposed viscose rayon plant workers Environmental and Molecular Mutagenesis, 31, 1998, 301-310 Maltoni, C.; Ciliberti, A.; Di Maio, V., 1977 Carcinogenicity bioassays on rats of acrylonitrile administered by inhalation and by ingestion Medicina del Lavoro, 68, 1977, 401-411 Maltoni, C.; Mehlman, M. A., 1987 Archives of Research on Industrial Carcinogenesis. Vol. VI. Experimental Research on Acrylonitrile Carcinogenesis Princeton Scientific Publishers, Inc., Princeton, NJ, 1987 Maltoni, C.; Ciliberti, A.; Cotti, G.; Perino, G., 1988 Long-term carcinogenicity bioassays on acrylonitrile administered by inhalation and by ingestion to Sprague-Dawley rats Annals of the New York Academy of Sciences, 534, 1988, 179-202 Marsh, G.M.; Youk, A.O.; Collins, J.J., 2001 Reevaluation of lung cancer risk in the acrylonitrile cohort study of the National Cancer Institute and the National Institute for Occupational Safety and Health Scandinavian Journal of Work, Environment and Health, 27, 2001, 5-13 Murata, M.; Ohnishi, S.; Kawanishi, S., 2001 Acrylonitrile enhances H2O2-mediated DNA damage via nitrogen-centered radical formation Chemical Research in Toxicology, 14, 2001, 1421-1427 NRC, National Research Council, 2001 Standing Operating Procedures for Developing Acute Exposure Guideline Levels for Hazardous Chemicals National Academy Press, Washington, DC, 2001 NTP, National Toxicology Program, 2001 Toxicology and Carcinogenesis Studies of Acrylonitrile in B6C3F1 Mice (Gavage Studies). TR 506 U.S. Department of Health and Human Services; Public Health Service, 2001 O'Berg, M.T., 1980 Epidemiologic study of workers exposed to acrylonitrile Journal of Occupational Medicine, 22, 1980, 245-252 O‘Berg, M.T.; Chen, J.L.; Burke, C.A.; Walrath, J.; Pell, S., 1985 Epidemiologic study of workers exposed to acrylonitrile: an update Journal of Occupational Medicine, 27, 1985, 835-840 Pu, X.; Kamendulis, L.M.; Klaunig, J.E., 2006 Acrylonitrile-induced oxidative DNA damage in rat astrocytes Environmental and Molecular Mutagenesis, 47, 2006, 631-638 Quast, J.F., 2002 Two-year toxicity and oncogenicity study with acrylonitrile incorporated in the drinking water of rats Toxicology Letters, 132, 2002, 153-196 Quast, J. F.; Schuetz, D. J.; Balmer, M. F.; Gushow, T. S.; Park, N. C.; McKenna, M. J., 1980 A Two-Year Toxicity and Oncogenicity Study with Acrylonitrile Following Inhalation Exposure of Rats Prepared by the Toxicology Research Laboratory, Health and Environmental Science, Dow Chemical USA, Midland, MI, 1980 Sapphire, The Sapphire Group, Inc., 2004 Acrylnitril (CAS 107-13-1) 23 Toxicological review of acrylonitrile (and appendices), Oktober 2004 online: http://www.tera.org/peer/AN/ANWelcome.htm, Abfragedatum Januar 2009 Scélo, G.; Constantinescu, V.; Csiki, I.; Zaridze, D.; Szeszenia-Dabrowska, N.; Rudnai, P.; Lissowska, J.; Fabiánová, E.; Cassidy, A.; Slamova, A.; Foretova, L.; Janout, V.; Fevotte, J.; Fletcher, T.; Mannetje, A.; Brennan, P.; Boffetta, P., 2004 Occupational exposure to vinyl chloride, acrylonitrile and styrene and lung cancer risk (Europe) Cancer Causes and Control, 15, 2004, 445-452 Schneider, K., Schuhmacher-Wolz, U., Oltmanns, J., Hassauer, M., 2002 Klassierung krebserzeugender Stoffe zur Begrenzung der Massenkonzentration im Abgas nach der Nr. 5.2.7.1.1 der TA Luft-Novelle (Entwurf). UBA-Berichte 3/02Umweltbundesamt Berlin, Erich Schmidt Verlag, Berlin, 2002 Schulz, M.R.; Hertz-Picciotto, I.; Todd, L.; Ball, L.M., 2001 Reconciling animal and human data in a cancer risk assessment of acrylonitrile Scandinavian Journal of Work, Environment and Health, 27, 2001, 14-20 Sponsiello-Wang, Z.; Sanders, E.; Weitkunat, R., 2006 Occupational acrylonitrile exposure and lung cancer: a meta-analysis Journal of Environmental Science and Health, Part C, 24, 2006, 257-284 Swaen, G.M.H.; Bloemen, L.J.N.; Twisk, J.; Scheffers, T.; Slangen, J.J.M.; Collins, J.J.; ten Berge, W.J.; Sturmans, F., 1998 Mortality of workers exposed to acrylonitrile in the Netherlands Scandinavian Journal of Work, Environment and Health, 24, Suppl. 2, 1998, 10-16 Symons, J.M.; Kreckmann, K.H.; Sakr, C.J.; Kaplan, A.M.; Leonard, R.C., 2008 Mortality among workers exposed to acrylonitrile in fiber production: an update Journal of Occupational and Environmental Medicine, 50, 2008, 550-560 UBA, Umweltbundesamt, 1997 Aktualisierung des Forschungsberichtes 60: Basisdaten Toxikologie für umweltrelevante Stoffe zur Gefahrenbeurteilung bei Altlasten mit Ableitung von toxikologisch begründeten tolerierbaren resorbierten Körperdosen (TRD-Werten) für Acrylnitril Bericht zum F+E-Vorhaben 103 40 815 Überarbeitung, Aktualisierung und Abstimmung der „Basisdaten Toxikologie“ zum Bundesbodenschutzgesetz, erstellt von FoBiG im Auftrag des Umweltbundesamtes, 1997 Wakata, A., Miyamae, Y., Sato, S., Suzuki, T., Morita, T., Asano, N., Awogi, T., Kondo, K., Hayashi, M., 1998 Evaluation of the rat micronucleus test with bone marrow and peripheral blood: summary of the 9th collaborative study by CSGMT/JEMS. MMS. Environmental and Molecular Mutagenesis, 32, 1998, 84-100 WHO, World Health Organization, 2000 Air Quality Guidelines for Europe WHO Regional Publications, European Series, No. 91, 2nd ed., Copenhagen, 2000 WHO, World Health Organization, 2002 Concise International Chemical Assessment Document No. 39. Acrylonitrile Geneva, 2002 Whysner, J.; Steward, R.E.; Chen, D.; Conaway, C.C.; Verna, L.K.; Richie, J.P.; Ali, N.; Williams, G.M., 1998 Formation of 8-oxodeoxyguanosine in brain DNA of rats exposed to acrylonitrile Archives of Toxicology, 72, 1998, 429-438 Wood, S.M., Buffler, P.A., Burau, K., Krivanek, N., 1998 Mortality and morbidity experience of workers exposed to acrylonitrile in fiber production Scandinavian Jouernal of Work, Environment and Health, 24, Suppl. 2, 1998, 54-62 Zhang, H.; Kamendulis, L.M.; Klaunig, J.E., 2002 Mechanisms for the induction of oxidative stress in Syrian hamster embryo cells by acrylonitrile Toxicological Sciences, 67, 2002, 247-255