Streitpunkte der Schilddrüsentherapie
Werbung

I
Streitpunkte der Schilddrüsentherapie
Liebe Kolleginnen und Kollegen
Zum Jubiläum des 30. Winterthurer Fortbildungskurses ist das Thema wieder einmal
die Schilddrüse. Zum Thema Schilddrüsendiagnostik und Therapie fand auch der
erste Kurs im Jahr 1979 statt. In der Therapie der Schilddrüsenerkrankungen hat
sich zwar in den letzten Jahren nicht wirklich viel Neues getan, aber das heisst nicht,
dass deshalb alles klar ist. Überraschend viele Therapien sind nur auf den ersten
Blick selbstverständlich, und der Blick zum Nachbarn zeigt, dass er manche Dinge
ganz anders macht. Um solche „Streitpunkte“ geht es heute. Es gibt also keinen
geordneten Überblick der gesamten Schilddrüsenerkrankungen und ihrer
Behandlung, sondern nur die Rosinen aus dem Kuchen. Dies verspricht also ein
spannendes und kontroverses Programm zu werden. Auch wenn am Schluss sicher
herauskommen wird, dass man viele Dinge halt doch so oder so machen kann und
mit beidem ans Ziel kommt. Alle Wege führen nach Rom, und viele Wege führen
zum gleichen Ziel. In manchen Fällen mag es also das Ziel sein, einen Konsens und
eine Unité de doctrine zu finden, bei vielen anderen geht es mit der heutigen
Veranstaltung darum, die verschiedenen Varianten mit ihren Vor- und Nachteilen
darzustellen, um im Einzelfall das Passende zu wählen.
Herzlich
Dr. Dirk Kappeler
080564_Inhalt.indd I
23.5.2008 14:52:50 Uhr
II
Inhaltsverzeichnis
Seiten
Frau Dr. med. Maier-Wölfle / PD Dr. med. M. Brändle
Was tun mit den Knoten?
Dr. med. I. Tosoni
Feinnadelpunktion; ist ein Karzinom ein
Karzinom ein Karzinom?
6 - 17
Dr. med. Th. Clerici
Wie viel „Strumektomie“ ist gut genug?
18 - 21
Prof. Dr. med. Christoph A. Meier
Nachsorge von Schilddrüsenkarzinomen
22 - 27
Dr. med. Jörg Furrer
Labor; was braucht es, was kann man sparen?
28 - 32
Dr. med. J. Lareida
Indikationen und Grenzen des Ultraschalls
33 - 36
Dr. med. A. Meili
Die Rolle der Nuklearmedizin
37 - 43
Dr. med. D. Kappeler
Cordarone und Schilddrüse
44 - 47
Dr. med. K. Scheidegger
Selen und die Schilddrüse
48 - 51
Frau PD Dr. med. M. Christ-Crain
Subklinische Dysthyreose; Krankheit oder Laborente?
52 - 55
Dr. med. Christian Meier
Sind Schilddrüsenpatienten wirklich anders?
56 - 60
Dr. med. G. von Arx
Diagnostik und Management der endokrinen Orbitopathie
Das EUGOGO consensus statement
61 - 70
Frau Dr. med. K. Schiessl
Schilddrüse und Fertilität
71 - 75
Dank an die Sponsoren
080564_Inhalt.indd II
1-5
76
23.5.2008 14:52:52 Uhr
1
Was tun mit den Knoten?
Dr. med. Margarete Maier-Wölfle,
Endokrinologie/Diabetologie Kantonsspital St. Gallen
Einleitung
Schilddrüsenknoten sind häufig. In Autopsiestudien und gezielten
grossangelegten sonographischen Untersuchungen weisen bis zu 50%
der Schilddrüsen knotige Veränderungen auf (Struma mit einem oder
mehreren Knoten). Die Inzidenz steigt mit dem Alter an, pro
Lebensdekade um etwa 10%. Interessant ist die Detektionsrate bei der
Schilddrüsenpalpation: nur bei 5-10% der untersuchten Organe lassen
sich eine knotige Veränderung vermuten. Dies hängt einerseits
wesentlich von der Grösse und Lage des Knotens innerhalb der
Schilddrüse, der Schilddrüsengrösse per se und der Anatomie des
Halses ab, andererseits aber auch von der Expertise des Untersuchers.
Müssen nun alle Knoten abgeklärt werden? Warum sollten
Schilddrüsenknoten denn überhaupt abgeklärt werden? Mechanische
Langzeitprobleme (retrosternale Struma mit Kompression der Trachea
und/oder Ösophagus), die potentielle Entwicklung einer Hyperthyreose
und die Möglichkeit der malignen Entartung sind von grosser Bedeutung.
In der Mehrzahl der Fälle handelt es sich um benigne Kolloidknoten,
Adenome, zystische oder gemischt solid/zystische Läsionen. Nur bei 510% der palpierten Knoten wird letztendlich ein Malignom diagnostiziert,
unabhängig davon, ob es sich um einen Solitärknoten oder eine Struma
mit mehreren Knoten handelt. Die Inzidenz von klinisch relevanten
Schilddrüsenkarzinomen liegt bei 0.005% pro Jahr dh 5 Fälle pro 100000
Personen pro Jahr.
Das papilläre Schilddrüsenkarzinom ist dabei mit ca. 80% das häufigste,
gefolgt vom follikulären und medullären (sporadisch oder familiär
auftretenden) sowie dem seltenen anaplastischen Karzinom. Lymphome
kommen etwas häufiger bei einer zu Grunde liegenden HashimotoThyroiditis vor, maligne Knoten finden sich auch etwas häufiger in der
Basedow-Struma verglichen mit einer normalen Schilddrüse.
080564_Inhalt.indd 3
23.5.2008 14:52:54 Uhr
2
Pathogenese und Aetiologie
Zu den wichtigsten auslösenden Faktoren der Knotenbildung gehört
neben dem Jodmangel die Bestrahlung des Halses in der Kindheit. Die
Entwicklung einer Struma wird auch während einer Schwangerschaft
beobachtet: ȕ-HCG wirkt ähnlich wie das TSH als Wachstumsstimulans.
Ebenfalls fördert Rauchen die Knotenbildung, da die steigende
Thiocyanatkonzentration zu einem relativen Jodmangel führt und es
dadurch zur vermehrten TSH-Produktion kommt. Auch Wachstumsfaktoren wie z.B. IGF-1 haben einen strumigenen Einfluss – bei
Patienten mit Akromegalie finden sich gehäuft knotig veränderte
Schilddrüsen. Überdies wird aus Familienstudien, insbesondere mit
eineiigen Zwillingen deutlich, dass molekulargenetische Faktoren eine
wichtige Rolle spielen; ebenso das Alter und das Geschlecht.
Diagnostik
Allem voran steht die Anamneseerhebung mit problem-orientierter
Evaluation der persönlichen Vorgeschichte und der Familienanamnese wichtig ist hierbei insbesondere die Frage nach familiär gehäuft
auftretenden Schilddrüsentumoren. Wie entwickelten sich welche
Symptome in welchem Zeitintervall, was konnte an konsekutiven
klinischen Veränderungen beobachtet werden? Bestehen Kompressionssymptome wie Dyspnoe oder Dysphagie? Ergeben sich klinische
Hinweise auf eine Hyperthyreose?
Als zweiter Schritt folgt dann eine detaillierte klinische Untersuchung
(Schilddrüse, Hals/ Nacken, obere Thoraxapertur).
An Laboruntersuchungen ist primär die Bestimmung des TSHSerumspiegels ausreichend und sinnvoll. Auf die Bestimmung von
Autoantikörpern kann in der Erstuntersuchung verzichtet werden. Die
Bestimmung von Thyreoglobulin und Calcitonin ist bei der
Grundabklärung ebenfalls nicht zu empfehlen - beide Parameter sind
jedoch exzellente Tumorverlaufsmarker beim papillären bzw. medullären
Schilddrüsenkarzinom.
Die bildgebende Untersuchung der 1. Wahl ist die Schilddrüsen-Sonographie. Mit ihr wird die Morphologie des Organs (Lage, Grösse,
Parenchymbeschaffenheit) untersucht. Sie liefert wichtige Informationen
bezüglich Anzahl, Grösse und eine detaillierte Beschreibung von intraund extrathyreoidalen Läsionen. Es handelt sich dabei um eine einfach
durchzuführende, für den Patienten nicht schmerzhafte, kostengünstige
080564_Inhalt.indd 4
23.5.2008 14:52:56 Uhr
3
Untersuchung. Die Resultate sind jedoch eindeutig von der Expertise
des Untersuchers abhängig. Die Untersuchung lässt keine Rückschlüsse
auf die Schilddrüsenfunktion zu. Die Aussagekraft bezüglich Malignität
ist gering.
Im Gegensatz dazu liefert die Schilddrüsen-Szintigraphie eine klare
Information bezüglich der Funktionalität von Schilddrüsenläsionen. Es
kann zwischen destruktiven und hyperaktiven Veränderungen
unterschieden werden. Eine Schilddrüsenszintigraphie sollte nur bei
klinischen und biochemischen Hinweisen auf eine Hyperthyreose,
insbesondere mit der Fragestellung nach uni- oder multifokaler
Autonomie veranlasst werden. Die Sensitivität dieser Untersuchung ist
schlecht dh. kleine Läsionen (<1cm) werden nicht detektiert, eine
Unterscheidung zwischen soliden und zystischen Veränderungen ist
nicht möglich.
Die Indikation zur Durchführung einer Computertomographie oder
Magnetresonanztomographie ist nur gegeben, wenn präoperativ
sonographisch die intrathorakale Ausdehnung der Struma nicht schlüssig
beurteilt werden konnte.
Als weiterer Meilenstein in der Diagnostik von Schilddrüsenknoten gilt
die Feinnadelpunktion, sie wird sonographisch gesteuert durchgeführt.
Die Untersuchung bedarf einfacher Hilfsmittel wie Plastikspritze, Nadel
und Desinfektionsmittel. Sie ist sehr kostengünstig durchführbar.
Komplikationen (Blutungen) sind sehr selten. Die Aspirationszytologie
liefert aussagekräftige Informationen bezüglich der Malignität bzw.
Benignität eines Schilddrüsenbefundes. Durchgeführt von einem
versierten Untersucher liefert sie in mindestens 90% der Punktionen eine
verwertbare Zytologie: insgesamt ergeben über 70% der Zytologien
keinen Hinweis auf Malignität (sog. makrofollikuläre Veränderungen). In
bis zu 10% lassen sich ganz klar maligne Aspekte nachweisen, welche
eine Operation implizieren; in weiteren 10% findet man verdächtige
Zellbilder, sog. follikuläre Neoplasien, die ebenfalls operativ saniert
werden sollten – da in bis zu 10% dieser Neoplasien die letztendliche
Diagnose follikuläres Karzinom lautet.
Diagnostische und therapeutische Empfehlungen
Neu diagnostizierte Schilddrüsenknoten (durch Palpation oder inzidentell
diagnostiziert im Rahmen einer andersartigen radiologischen
Untersuchung) sollen ab einer Grösse von 1,0-1,5cm weiter abgeklärt
werden. Nach einer differenzierten Anamneseerhebung und klinischen
Untersuchung – insbesondere unter dem Aspekt von möglichen Hin-
080564_Inhalt.indd 5
23.5.2008 14:52:59 Uhr
4
weisen auf Malignitiät wie familiäre Häufung von Schilddrüsenkarzinomen, Bestrahlung des Halses in der Kindheit, rasche
Grössenzunahme des Knotens – wird primär der Frage der Schilddrüsenfunktion durch Messung des TSH-Serumpiegels nachgegangen.
A) Liegt eine Euthyreose vor (TSH im Normbereich), erfolgt eine
Schilddrüsensonographie, welche den Solitärknoten bestätigt oder
eine Struma mit mehreren Knoten beschreibt. Mit der anschliessend
durchgeführten Feinnadelpunktion des Solitärknotens oder der
dominanten Knoten in der Struma wird der Frage bezüglich Malignität
bzw. Benignität Rechnung getragen.
- Lautet die zytologische Diagnose makrofollikuläres Zellbild, so
entspricht dies einem benignen Befund. Es wird eine klinische und
allenfalls sonographische Verlaufskontrolle nach 6 Monaten bei dem
gleichen Spezialarzt empfohlen, bei stabilen Befunden dann weitere
Kontrollen beim Hausarzt in einem Zeitintervall von z.B. 2 Jahren bzw.
engmaschiger entsprechend der Klinik. Treten neu Kompressionssymptome auf (u.a. Dysphonie, Dysphagie und Dyspnoe), ist die
chirurgische Intervention die Therapie der Wahl. Die Behandlung
eines benignen Solitärknoten oder einer benignen Knotenstruma mit
Schilddrüsenhormonen ist in Anbetracht der erhöhten kardiovaskulären Morbidität (Myokarddysfunktion, Tachyarrhythmien) und den
ungünstigen Einflüssen auf den Knochenmetabolismus (Osteoporose)
nicht zu empfehlen. Der volumenvermindernde Effekt ist inkonsistent
(20-50%, je nach Studie) und wird nur erreicht bei TSH-Werten <
0.1mU/l, was meist mit einer floriden Hyperthyreose einhergeht. Nach
Absetzen der Hormone wird eine erneute Grössenprogredienz
beobachtet.
- Lautet die Diagnose Schilddrüsenkarzinom, so ist die Operation
indiziert; liegt eine follikuläre Neoplasie vor, wird eine Operation
empfohlen, da diese in bis zu 10% maligne sein können.
- Ist das durch die Feinnadelpunktion gewonnene Material nicht
repräsentativ bzw nicht konklusiv zu beurteilen, muss die Feinnadelpunktion wiederholt werden, bis dass schlüssige Resultate vorliegen.
Bei zystischen Läsionen bzw. gemischt solid/zystischen Formationen
ist darauf zu achten, dass nicht nur die Zystenflüssigkeit sondern
auch die soliden Strukturen innerhalb der Zyste bzw. an der
Zystenwand gezielt punktiert und zytologisch aussagekräftig beurteilt
werden. Bei suspekter Zytologie ist die Operation die Therapie der
Wahl.
B) Finden wir laborchemisch ein TSH < 0.6 mU/l vor, erfolgt eine
Schilddrüsenszintigraphie mit der Frage nach autonomen bzw.
dekompensierten Knoten, die dann – je nach Beschwerdebild und
080564_Inhalt.indd 6
23.5.2008 14:53:02 Uhr
5
Grössenausdehnung - mittels Radiojodtherapie (Grössenreduktion um
40-60 %) oder operativ therapiert werden. Eine Feinnadelpunktion
szintigraphisch speichernder Areale im Sinne einer Hyperthyreose
sollte aufgrund der meist nur schwer interpretierbaren Zytologie
(follikuläre Neoplasie) vermieden werden. Im Übrigen ist die
Prävalenz eine Karzinoms in diesen autonomen Arealen vernachlässigbar gering. Liegt ein sogenannter „kalter Knoten“ vor, so sollte
eine schlüssige Zytologie gewonnen werden.
C) Ist das TSH > 4.0 mU/l ergibt sich der Verdacht auf eine
autoimmune Schilddrüsenerkrankung; ergänzend können die AutoAntikörper Anti-TPO und Anti-TG durchgeführt werden. Die
Grunderkrankung sollte hier primär therapiert werden. Sind
palpatorisch und dann sonographisch bestätigt Knoten darstellbar, ist
die Feinnadelpunktion zu empfehlen.
Prinzipiell wird empfohlen: Schilddrüsenknoten <1cm sollen bei nicht
suspekter Anamnese weder sonographisch verlaufskontrolliert noch
punktiert werden. Schilddrüsenknoten >4cm werden meistens direkt dem
Chirurgen zur Operation zugewiesen werden. Eine Feinnadelpunktion
mit der Frage nach Malignität gleicht hier „der Suche nach der Nadel im
Heuhaufen“. Die Gefahr des „sampling errors“ dh des falsch negativen
zytologischen Befundes ist bei diesem Knotenvolumen zu gross.
Literaturempfehlung
1. Meier CA: Thyroid nodules: pathogenesis, diagnosis and treatment. Baillieres
Clin Endocrinol Metab 2000; 14: 411 – 426
2. Burger G.A.: Schilddrüsenknoten und Knotenstruma. Schweiz Med Forum
2002; 44: 1039 - 1043
3. Hegedüs L., Bonnema S.J. et al.: Management of simple nodular goiter:
current status and future perspectives. Endocrine Reviews 2004; 24 (1) : 102
– 132
4. AACE/AME Guidelines : Medical guidelines for clinical practise for the
diagnosis and management of thyroid nodules. Endocrine Practice 2006; 12
(1): 64 - 102
080564_Inhalt.indd 7
23.5.2008 14:53:04 Uhr
6
Interpretation der Feinnadelpunktion in der Schilddrüsendiagnostik:
ist ein Karzinom ein Karzinom ein Karzinom ?
1. Einführung
Die Feinnadelpunktion der Schilddrüse ist im Rahmen der Bausteindiagnostik (Anamnese,
Klinik, Laborparameter, Bildgebung, Szintigraphie und Morphologie) eine effiziente Methode
zur Abklärung diffuser oder fokaler pathologischer Veränderungen mit besonderer
Berücksichtigung entzündlicher und tumoraler Entitäten.
2. Feinnadelpunktionstechnik
Mit der Feinnadelpunktion kann rasch und einfach Zellmaterial gewonnen werden, am besten
unterstützt durch die Ultraschall-gezielte Punktion. Es handelt sich in der Regel um eine
risikoarme und wenig belastende, kostengünstige Untersuchung.
Die zytologische Diagnosestellung kann bei Bedarf mittels Schnelluntersuchung sofort oder
innert Stunden gleichentags mitgeteilt werden.
Als sehr seltene mögliche Komplikationen gilt es lokale Blutergüsse, Infektionen und
vagovasale Reaktion zu erwähnen.
Wie bei allen angewandten Techniken gilt auch hier, dass die/der Erfahrene eindeutig bessere
Punktionsresultate erzielt als die/der Unerfahrene, welcher die Feinnadelpunktion nur
gelegentlich durchführt.
Die adäquate Anwendung der Feinnadelpunktionstechnik ist die unerlässliche Basis für eine
aussagekräftige Zytodiagnostik.
2.1. Qualitative Anforderungen an das Punktat
zellreich
– mindestens 6 Verbände von Schilddrüsenzellen mit 15-20 Zellen pro Verband
– Ausnahmen vorbehalten wie z.B. Kolloid- und Blutungszysten
dünn ausgestrichen (leicht hämorrhagischer Hintergrund unproblematisch)
gut fixiert
080564_Inhalt.indd 8
23.5.2008 14:53:06 Uhr
7
2.2. Feinnadelpunktionstechnik
Punktionsmaterial
10 ml Einwegspritze mit Spritzenhalter und Nadeln
Objektträger
080564_Inhalt.indd 9
23.5.2008 14:53:11 Uhr
8
Punktionstechnik
Ultraschall-gezielte, fächerförmige Punktion des Befundes (Sog dosieren)
Spritzeninhalt mit aufgesetzter Nadel in Form von 3-5 mm messenden Tropfen auf die
Objektträger geben (Ausnahme: Flüssigkeiten nicht ausstreichen, sondern nativ einsenden)
080564_Inhalt.indd 10
23.5.2008 14:53:14 Uhr
9
Ausstrichtechnik (quer oder längs)
Variante 1: Aspirat mit zweitem Objektträger quer dünn ausstreichen
Variante 2: Aspirat mit zweitem Objektträger längs dünn ausstreichen
080564_Inhalt.indd 11
23.5.2008 14:53:20 Uhr
10
Fixation und Trocknung
Objektträger innert 3 Sekunden mittels 96% Alkohol oder Spray fixieren
Objektträger gut trocknen lassen und bruchsicher versenden
080564_Inhalt.indd 12
23.5.2008 14:53:24 Uhr
11
2.3. Fehlerquellen der Feinnadelpunktionstechnik
2.3.1. Fehlerquelle 1: zu dicke Nadel
ergibt oft nur Blut mit wenig Zellmaterial oder dann grosse, schlecht fokussierbare
Mikrohistofragmente !
2.3.2. Fehlerquelle 2: zu wenig ausgedehnte FNP
wenig oder kaum Zellmaterial nachzuweisen !
2.3.3. Fehlerquelle 3: Herausziehen der Spritze mit Nadel unter Sog
das Material wird in den Spritzenkolben aspiriert (dann Material mit Cytobrush-Bürse
aus dem Kolben „abholen“!)
2.3.4. Fehlerquelle 4: zu viele Ausstriche
Ausstriche zu dünn mit meist degeneriertem und zerstrichenem Material (nicht
verlässlich beurteilbar) !
2.3.5. Fehlerquelle 5: zu späte Fixation
vollständig degenerierte Zellen (nicht verlässlich beurteilbar) !
3. Diagnostische Zytopathologie der Schilddrüse
3.1. Struma nodosa colloides
hohe diagnostische Treffsicherheit
Amerkung:
- Spreu vom Weizen trennen
- Ausschluss der Malignität
- (inzidentelles Mikrokarzinom schwierig oder kaum erfassbar)
3.2. hyperplastisch-adenomatoider Schilddrüsenknoten
relativ hohe diagnostische Treffsicherheit
Anmerkung:
–
bei mikrofollikulären und kolloidarmen Läsionen mit Kernunruhe ist die
Abgrenzung gegenüber einer Neoplasie der Schilddrüse schwierig
080564_Inhalt.indd 13
23.5.2008 14:53:28 Uhr
12
3.3. Thyreoiditis
3.3.1. eitrige Thyreoiditis
hohe diagnostische Treffsicherheit:
– Primärdiagnose
– Mikrobiologie
Anmerkung:
– Rarität
– Immunsuppression
– postinterventionell
– septikopyämisch
– posttraumatisch
3.3.2. granulomatöse Thyreoiditis de Quervain
hohe diagnostische Treffsicherheit im floriden Stadium
Anmerkung:
– wenig Material bei regressiv-fibrosierenden Formen
– manchmal nur fokal (Detektion: Ultraschall)
– Rarität: spezifischer Infekt (Tbc/Pilze) und Sarkoidose
3.3.3. Palpationsthyreoiditis
Diagnose praktisch nur zusammen mit der Anamnese möglich („übermässige
Palpation“ DD: posttraumatisch)
Anmerkung:
–
Abgrenzung gegenüber granulomatöser Thyreoiditis de Quervain, spezifischen
Infekten und Sarkoidose
3.3.4. Autoimmunthyreoiditis (Hashimoto)
hohe diagnostische Treffsicherheit im floriden Stadium
Anmerkung:
– Abgrenzung gegenüber unspezifischer Entzündung bei Knotenbildung
– falsch-positive Diagnose einer Schilddrüsenneoplasie: Option Zytometrie
– in umschriebenen proliferativen nodalen Läsionen manchmal keine Entzündung
nachweisbar
– Abgrenzung gegenüber MALT-Lymphom (Rarität) schwierig
3.3.5. postpartale Thyreoiditis
diagnostische Treffsicherheit im floriden Stadium nur zusammen mit der Klinik
(SS/post partum) gegeben
Anmerkung:
– Abgrenzung gegenüber klassischer Immunthyreoiditis allein morphologisch
unmöglich
080564_Inhalt.indd 14
23.5.2008 14:53:32 Uhr
13
3.3.6. Struma Riedel
Diagnose meist nur zusammen mit der Klinik und konsekutiv erzwungener Histologie
möglich
Anmerkung:
– Rarität
– FNP vielfach zellarm oder zellfrei bei Fibrose
– cave: falsch-positiver Befund eines anaplastisches Karzinoms (wegen schwer
atypischer reaktiver Spindelzellen)
3.4. Morbus Basedow
diagnostisch schwierig
Anmerkung:
– falsch-positive Diagnosen (Atypie/Malignität)
– Option: Zytometrie
3.5. Neoplasien
3.5.1 papilläres Karzinom
hohe diagnostische Treffsicherheit
seltene Fallgruben:
– DD: benigne Makropapillen
– DD: Morbus Basedow
– DD: follikuläre Varianten
3.5.2. medulläres Karzinom
hohe diagnostische Treffsicherheit bei klassischem Bild
Anmerkung:
– Entität wird nicht zwingend erkannt bei z.B. follikulären oder papillären
Varianten
3.5.3. anaplastisches Karzinom
hohe diagnostische Treffsicherheit
Anmerkung:
– DD: anaplastische Metastase
– Fehlinterpretation bei sarkomatöser Differenzierung (z.B. MFH-like)
– DD: Immunthyreoiditis mit reaktiven „anaplastischen“ Atypien
080564_Inhalt.indd 15
23.5.2008 14:53:34 Uhr
14
3.5.4. follikuläre Proliferation mit Atypien („follikuläre Neoplasie“)
„Spreu vom Weizen“ trennen (Screening Tool)
Anmerkung:
– hyperplastisch-adenomatoider Knoten versus Adenom versus follikuläres
Karzinom zytologisch bei atypischem Zellbild nicht auseinanderzuhalten
– Auflösung der Differentialdiagnose praktisch nur durch operatives Vorgehen
mit histologischer Untersuchung möglich: Ausschluss oder Nachweis von
Kapseldurchbrüchen oder Gefässeinbrüchen
– Option: Zytometrie und/oder Immunzytochemie zur optimierten
Dignitätseinschätzung (Fall-abhängige Indikation)
Karzinom ja/nein ?
Molekulare Pathologie zur Dignitätseinschätzung:
– P53
– RET Onkogen
– Telomerase
– Galectin-3
– Matrix Metal Protease (MM23)
Problem: bisher nur ansatzweise befriedigende Umsetzung für die Routinediagnostik
3.5.5. Malignes Lymphom
hohe diagnostische Treffsicherheit bei grosszelligen Lymphomen:
– auf dem Boden einer Immunthyreoiditis
– bei thyreoidaler Beteiligung eines generalisierten Lymphoms
Anmerkung:
– Rarität MALT-Lymphom schwierig gegen floride Immunthyreoiditis abzugrenzen
080564_Inhalt.indd 16
23.5.2008 14:53:37 Uhr
15
3.5.6. Metastasen
hohe diagnostische Treffsicherheit (in Kombination mit Immunzytochemie)
Anmerkung:
–
DD: papilläre Adenokarzinome anderen Ursprungs (Immunzytochemie)
–
DD: anaplastische Metastasen
3.6. Therapie-induzierte Veränderungen
diagnostisch sehr schwierig:
– Radiojod-Therapie
– Thyreostatika-Therapie
– Strahlentherapie
Anmerkung:
–
cave: falsch-positive Diagnose (Atypie/Malignität)
3.7. zytologische Spezialuntersuchungen
3.7.1. Zytometrie (DNS-Analyse)
Die Zytometrie ist eine hilfreiche Zusatzuntersuchung zur Identifikation potentiell
maligner Neoplasien bei unklarem, respektive atypischem Zellbild
unterstützt die therapeutische bzw. operative Entscheidungsfindung bei
morphologisch unklarem, respektive atypischem Zellbild
DNS-Analyse mit Bestimmung des Ploidie-Status:
– Diploidie
– Polyploidie
– Triploidie/Tetraploidie / Aneuploidie
tetraploide und aneuploide Zellpopulationen repräsentieren in 50 - 70% histologisch
maligne Neoplasien unter Einschluss sogenannter atypischer Adenome
rein polyploide Zellpopulationen repräsentieren meist reaktive Veränderungen (z.B.
Immunthyreoiditis)
Prognoseeinschätzung bei Malignomen:
–
Diploidie: prognostisch günstig
–
Aneuploidie: prognostisch ungünstig
3.7.2. Immunzytochemie
Zusatzuntersuchung bei Läsionen mit Atypien zur Dignitätseinschätzung:
080564_Inhalt.indd 17
–
HBME-1 (Human Bone Marrow Endothelial Cell-1)
–
Galectin-3 (endogenes Lektin)
23.5.2008 14:53:39 Uhr
16
HBME-1:
– wird in follikulären und papillären Karzinomen exprimiert
Problem: falsch-positive Ergebnisse in 30% der Fälle
Galectin-3:
– hohe Expression bei papillären Karzinomen
– heterogene Expression in follikulären Karzinomen
Problem: falsch-negative Ergebnisse für follikuläre Karzinome (15-40%)
4. Stärken der Feinnadelpunktionsdiagnostik
Entzündungen
–
–
Thyreoiditis de Quervain
Autoimmunthyreoditis (Hashimoto)
Neoplasien
–
Ausschluss der Malignität in > 90% der zytologisch nicht atypischen Knoten
Tumortypisierung:
–
papilläres Karzinom
–
(medulläres Karzinom)
–
anaplastisches Karzinom
–
Metastasenabklärung
5. Grenzen der Feinnadelpunktionsdiagnostik
funktionelle Veränderungen (Ueber- oder Unterfunktion; M.Basedow)
(hochdifferenzierte papilläre Karzinome)
follikulär oder papillär gewachsene medulläre Karzinome
follikulärer hyperplastisch-adenomatoider Strumaknoten/follikuläres Adenom mit
reaktiven Zellatypien versus Karzinom (zytologisch follikuläre Proliferation mit Atypien,
sive “follikuläre Neoplasie”): Auflösung der Differentialdiagnose praktisch nur durch
operatives Vorgehen mit histologischer Untersuchung möglich
Zytometrie (und Immunzytochemie) als Option zur verbesserten Dignitätseinschätzung
080564_Inhalt.indd 18
23.5.2008 14:53:42 Uhr
17
6. Literatur/Quellenangabe
American Association of Clinical Endocrinologists and Associazione Endocrinologici Medici:
Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules,
Endocrine Practice 2006, Vol. 12 January/February (pdf Internet)
Saskia Albrecht und Alfred Böcking: Treffsicherheit der Feinnadelaspirationsbiopsie der
Schilddrüse für die Diagnose von Schilddrüsentumoren, Dissertation, Heinrich-HeineUniversität Düsseldorf, 2004 (pdf Internet)
Mary C. Frates et al.: Management of thyroid nodules detected US: Society of radiologists in
Ultrasound Consensus Cenference Statement, Radiology 2005; 237: 794-800
Claude Gerber: Zytologie: Zytodiagnostik der Schilddrüse – neue Erkenntnisse aus alten
Nadeln, Schweiz Med Forum 2004;4:1313-1314
Heitham Gheriani: Update on epidemiology classification, and management of thyroid cancer,
Lybian J Med 2006: AOP:060514 (pdf Internet)
Svante R. Orell et al.: Punktionszytologie, Handbuch und Atlas, Georg Thieme Verlag, 1999
Jean-Claude Pache et Massimo Bongiovanni: Cytologie Thyroidienne, Kongress der
Schweizerischen Gesellschaft für Zytologie, Kongressbeitrag, 2006
Quiwei Ren et al.: Review on thyroid carcinoma of molecular pathology, Life Science Journal
2007, Vol. 4, No.2: 33-36
Peter Spieler: Klinische Zytologie: eine universelle Diagnosemethode von der Morphologie bis
zur Genanalyse, Schweiz Med For 2002, 51/52: 1242
Peter Spieler: Die Feinnadelpunktion – ein Ueberblick, Schweiz Med Forum 2005; 5: 1171-1181
Lester D.R. Thompson, Endocrine Pathology, A Volume in the Series Foundations in
Diagnostic Pathology, Churchill Livingstone, 2006: 1-144
Ivo Tosoni und Peter Spieler: Ultraschall und Zytologie: Ultraschall-gezielte Feinnadelpunktion,
Praxis 2001, 90: 678-680
Michael Wannenmacher et. al.: Das Schilddrüsenkarzinom: Empfehlungen für eine
standardisierte Diagnostik, Therapie und Nachsorge, Schriftenreihe des Tumorzentrums
Heidelberg/Mannheim, 2003 (pdf Internet)
080564_Inhalt.indd 19
23.5.2008 14:53:44 Uhr
18
Schilddrüsenoperationen – welche wann ?
Resektionsausmass bei gutartiger Struma
Th. Clerici, Chirurgische Endokrinologie, Klinik für Chirurgie, Kantonsspital St. Gallen
1. Einleitung
Nachdem über Jahrzehnte die subtotale Thyreoidektomie „unter Belassung eines dattelgrossen
Lappenrest“ beidseits bei gutartigen Strumaformen als der Operationsstandard galt, ist nun
unter angelsächsischem Einfluss auch in unsren
Breitengraden die Qualität dieser Operation zunehmend in Frage gestellt. Der Ruf nach radikaleren Resektionsformen fordert von Chirurgen
weiter reichende Kenntnisse und Erfahrung als
die bislang üblichen subtotalen Resektionsformen. Diese Tatsache wiederum führt zu standespolitischen Diskussionen darüber, wer diese
bisher als allgemeinchirurgische Standardoperation geltende Intervention durchführen soll bzw.
durchführen darf.
Operationstaktisch gilt es grundlegend zwischen
nodösen (ungeachtet einer vorliegenden funktionalen Autonomie) und diffusen Strumen zu
unterscheiden.
2. Resektionsausmass bei nodösen
Strumen
In der zweiten Hälfte des 19. Jahrhunderts hatte
die Schilddrüsenresektionen bei gutartigen Affektionen eine Letalität von nahezu 40%. Durch
Theodor Kocher (1841 – 1917) wurde diese
massiv gesenkt. Nachdem er im Jahre 1882 rund
60% aller Patienten mittels einer totalen (radikalen) Thyreoidektomie erfolgreich therapiert hatte, propagierte er dieses Resektionsausmass als
Standard, „da diese weniger blutig verlaufe und
zudem sicher vor dem Rezidiv schütze, was insbesondere in manch schwerem Fall vorzuziehen
sei“1.
Wenig später musste Kocher erkennen, dass die
radikale Thyreoidektomie insbesondre bei Jugendlichen zu einem Defizitsyndrom mit geistiger
Retardierung und Minderwuchs führte, welches
er ‚Cachexia strumipriva‘ nannte. In der Folge
verurteilte er die von ihm empfohlene radikale
Thyreoidektomie als „leichtsinnig“ sowie eine
„Versündigung gegen die Interessen des Patienten“. Kocher hatte hinsichtlich der zu operierenden Pathologie sowie der Rezidivproblematik
visionär das richtige Resektionsausmass ange-
080564_Inhalt.indd 20
strebt - er war aber an der Tatsache gescheitert, dass zu jenem Zeitpunkt die Funktion der
Schilddrüse und damit auch Thyroxin, welches
zur Substitution gebraucht worden wäre, nicht
bekannt war.
In der Folge wurde weitläufig die von Mikulicz
(1850 – 1905) beschriebene Resektion unter
Belassung von dorsalen Resten beidseits zur
Verhinderung der ‚Cachexia strumipriva‘ durchgeführt, wobei Mikulicz bereits selber auf die
Problematik der dadurch verursachten StrumaRezidive hinwies.
Beobachtungsstudien zeigen, dass in der Tat
nach subtotalen Resektionen in 10-40% aller
operierten Patienten reoperationspflichtige Rezidive entstehen2-4. Die Ursache dafür liegt in der
zu Grunde liegenden „Panthyreopathie“5-7 und
der Tatsache, dass im belassenen Restgewebe
praktisch immer pathologische Knoten belassen
werden. Rezidiveingriffe haben wiederum im
Vergleich zur Erstintervention erwartungsgemäss
eine deutlich höhere Morbidität. Aus deutschen
Multizenterstudien wissen wir, dass sich die Rate
an Rekurrensparesen um einen Faktor 6 (0.6%
auf 3.6%) und die Rate an Patienten mit definitivem Hypoparathyreoidismus um einen Faktor 3
erhöht (1.1% auf 3.4%)8,9.
Im Jahre 1987 schlug T. Reeve, nachdem er
ebenfalls wie fast 100 Jahre zuvor Kocher 60%
aller Patienten mit einer radikalen Thyreoidektomie behandelt hatte, die totale Thyreoidektomie als Standardoperation für die gutartige
Struma vor10. In seiner Hand hatte die totale
Thyreoidektomie im Vergleich zu den subtotalen
Resektionsformen keine höhere Morbidität hinsichtlich Rekurrensparese und Hypoparathyreoidismus. Natürlich hatte Reeve im Gegensatz zu
Kocher den Vorteil, dass die Schilddrüsensubstitution mittels Thyroxin kein Problem mehr darstellte.
Nachdem auch andere Autoren (spezialisierte
endokrine Chirurgen) bestätigten, dass in geübter Hand radikale Resektionen morbiditätsarm
durchgeführt werden können, fand diese Resektionsformen vor allem in angelsächsischen Ländern zunehmend Verbreitung. Die Argumente
der Protagonisten sind folgende:
23.5.2008 14:53:46 Uhr
19
30. Winterthurer Fortbildungskurs
x Berücksichtigung der Pathogenese im Resektionsausmass (autonome „Panthyreopathie“)
x im Vergleich zu subtotalen Resektionen
nicht erhöhte Morbidität
x sichere Verhinderung von Rezidiveingriffen
Zweifelsohne scheint die radikale Thyreoidektomie für die zugrundliegende Pathologie als therapeutisches Konzept kohärent und richtig zu
sein. Es stellt sich nun die Frage, ob dieses therapeutische Konzept auch in der Breite als Therapieoption der Wahl Gültigkeit haben soll.
Entscheidend dazu ist die Frage, ob NichtSpezialisten ebenfalls in der Lage sind, die radikalere Form der Resektion morbiditätsarm
durchzuführen. Falls dies nicht der Fall wäre,
würde man den Vorteil der Rezidivfreiheit mit
dem Nachteil einer erhöhten Morbidität der Erstintervention erkaufen, was nicht statthaft wäre.
Ob dem so ist, lässt sich auf Grund von deutschen Multizenterstudien unter Berücksichtigung
von peripheren ‚Versorgungskrankenhäusern‘
ergründen5,11,12.
Auf Grund dieser Daten kann man den Schluss
ziehen, dass beim Postulat ‘Struma = totale Thyreoidektomie‘ bei funktional autonomer oder
euthyreoter Knotenstruma voraussichtlich die
Rate von Patienten, welche eine Rekurrensparese erleiden würden von 0.8% auf 2.3% steigen
würde. Eindrücklicher ist die Situation hinsichtlich des Hypoparathyreoidismus: hier würde das
erwähnte Postulat eine Erhöhung der Komplikationsrate von 0.9% auf 10.5% bedeuten. Gerade
diese Komplikation wird m.E. hinsichtlich Bedeutung für die Lebensqualität des Betroffenen sowie den Folgekosten für das Gesundheitswesen
stets massiv unterschätzt.
Die Datenlage zeigt also, dass die radikale Thyreoidektomie für die Behandlung der Knotenstruma das wohl richtige Therapiekonzept
darstellt; dieses Konzept lässt sich jedoch beim
gegenwärtigen Ausbildungstand der die Schilddrüsenchirurgie praktizierenden Chirurgen nicht
als Therapie der Wahl propagieren. Dieses Dilemma zwischen Rezidivträchtigkeit und Komplikationsrisiko liesse sich nur durch eine Verbesserung der chirurgischen Leistungsfähigkeit lösen.
Pragmatisch gesehen hiesse dies eine verbesserte Ausbildung der Allgemein- und Viszeralchirurgen in endokriner Chirurgie oder eine Subspezialisierung eines Teils der Chirurgen in endokriner
Chirurgie. Diese Diskussion ist Gegen-stand
standespolitischer Auseinandersetzungen in chi-
080564_Inhalt.indd 21
Resektionsausmass benigne Struma
rurgischen Gesellschaften auf nationaler wie
auch internationaler Ebene13.
3. Resektionsausmass bei diffusen
Strumen
Etwas anders gelagert ist die Situation bei diffusen Strumen, welcher einer chirurgischen Behandlung bedürfen. Hier liegt die Rezidivproblematik weniger in Form des morphologischen
Strumarezidivs sondern viel mehr in der Möglichkeit funktionaler Persistenzen oder Rezidive.
Denn der Mehrheit dieser Strumen liegen Erkrankungen zu Grunde, welche zu einer funktionalen Autonomie führen:
x Autoimmunhyperthyreose (M. Basedow)
x Amiodaroninduzierte Hyperthyreose
x Diffuse Schilddrüsenautonomie
Diese Indikationen machen in einem chirurgischen Krankengut approximativ 65% aller Operationen bei funktional autonomer Struma aus.
Primär werden selbstverständlich die Erkrankungen konservativ symptomatisch mittels thyreostatischer Pharmaka angegangen. Vor der Indikationsstellung zu einer chirurgischen Form der
Ablation erfolgt der grundsätzliche Entscheid, ob
chirurgisch vorgegangen werden soll oder ob
alternativ einer Radiojodablation der Vorzug
gegeben werden soll. Dieser Entscheid ist unter
anderem auch abhängig davon, wie die nationalen Traditionen diesbezüglich liegen und wie
streng die Strahlenschutzauflagen zur Anwendung von Radiojod sind.
Grundsätzlich lassen sich beide Methoden für die
Behandlung autonomer diffuser Strumen einsetzen. Der chirurgischen Option ist immer dann
den Vorzug zu geben, wenn
x ein schneller definitiver Wirkungseintritt erwünscht ist
x eine relevante Volumenreduktion der
Schilddrüse notwendig ist
x begleitende Schilddrüsenpathologie histologisch geklärt oder behandelt sein muss14.
Folgende Indikationen stellen eine primäre Indikation zur chirurgischen Form der Ablation dar:
x Schwierig einzustellende Hyperthyreose
x Grosse Struma
x Malignitätsverdacht
x Schwangerschaft
x Stillzeit
x Zustand noch Jodexposition (Kontrastmittel, Cordarone®)
x Endokrine Orbitopathie.
23.5.2008 14:53:50 Uhr
20
30. Winterthurer Fortbildungskurs
Sowohl bei der nuklearmedizinischen wie auch
chirurgischen Form der Ablation wird prätherapeutisch mittels Thyreostatika eine Euthyreose
angestrebt. Im Falle des M. Basedow erfolgt
üblicherweise während einem Jahr ein konservativer Therapieversuch mit konsekutivem Absetzten der thyreostatischen Medikation. Die Indikation zu einer definitiven ablativen Behandlung
erfolgt meistens erst nach Eintreten des ersten
Hyperthyreoserezdivs.
Bei der Festlegung des chirurgischen Resektionsausmasses ist die Verhinderung einer funktionalen Persistenz oder eines funktionalen Rezidivs das prioritäre Ziel. Auf Grund von in den 80er Jahren durchgeführten Studien weiss man,
dass zur Erreichung einer Rezidivfreiheit maximal
4-5g Gewebe belassen werden sollten (1g ~
1ml)15,16. Zur Vermeidung von bilateralen Rezidiveingriffen mit entsprechend erhöhter Morbidität
soll das verbleibende Gewebe ausschliesslich auf
einer Seite belassen werden. Als Konzession für
die erreichte Rezidivfreiheit nimmt man in Kauf,
dass
der
Patient
Schilddrüsenhormonersatzpflichtig wird. Auch bei der nuklearmedizinischen Ablationsform stellt die substitutionspflichtige Hypothyreose das Behandlungsziel dar.
In der chirurgischen Terminologie wird die beschriebene Operation mit vollständiger unilateraler Resektion mit Belassen von ~4g Gewebe auf
der kontralateralen Seite eine ‚HartleyDunhill’sche Resektion‘ genannt.
Bei Vorliegen einer endokrinen Orbitopathie besteht Konsens darin, dass eine chirurgische Resektion erfolgen soll, da die Verlaufsresultate
hinsichtlich der Orbitopathie besser sind als bei
der Verwendung von Radiojod.
Resektionsausmass benigne Struma
Chirurgenseite würde lediglich die Verbesserung
der Ausbildung in endokriner Chirurgie oder die
Subspezialisierung in endokriner Chirurgie dazu
die Voraussetzungen schaffen.
4. Zusammenfassung:
Moderne Tendenzen in der Chirurgie der Schilddrüse zeigen auch bei der Behandlung gutartiger
Affektionen eine Zunahme von vollständigen
(oder fast-vollständigen) Resektionen. Diese
vollständigen Resektionen werden der zugrunde
liegenden Pathologie, welche bei belassenem
Schilddrüsengewebe zur Entwicklung von Strumarezidiven führt, gerecht.
Auf Grund der Tatsache, dass eine generelle
Empfehlung zur totalen Thyreoidektomie landläufig zu einer relevanten Erhöhung der operativen Morbidität (insbesondere des Hypoparathyreoidismus) führen würde, ist die Forderung,
dass die totale Thyreoidektomie zur Behandlung
gutartiger Schilddrüsenaffektionen die Therapie
der Wahl darstelle, (noch) nicht statthaft. Von
080564_Inhalt.indd 22
23.5.2008 14:53:53 Uhr
21
30. Winterthurer Fortbildungskurs
Resektionsausmass benigne Struma
5. Literatur
1. Kocher,Th. Ueber die Kropfexstirpation und ihre Folgen. Archiv für Klinische Chirurgie 29, (1883).
2. Pappalardo,G., Guadalaxara,A., Frattaroli,F.M., Illomei,G. & Falaschi,P. Total compared with subtotal thyroidectomy in benign nodular disease: personal series and review of published reports. Eur. J Surg 164, 501506 (1998).
3. Rojdmark,J. & Jarhult,J. High long term recurrence rate after subtotal thyroidectomy for nodular goitre. Eur. J
Surg 161, 725-727 (1995).
4. Seiler,C.A., Vorburger,S.A., Burgi,U., Candinas,D. & Schmid,S.W. Extended Resection for Thyroid Disease has
Less Operative Morbidity than Limited Resection. World J Surg 31, 1005-1013 (2007).
5. Ramelli,F., Studer,H. & Bruggisser,D. Pathogenesis of thyroid nodules in multinodular goiter. Am. J. Pathol.
109, 215-223 (1982).
6. Studer,H., Gerber,H., Zbaeren,J. & Peter,H.J. Histomorphological and immunohistochemical evidence that human nodular goiters grow by episodic replication of multiple clusters of thyroid follicular cells. J. Clin. Endocrinol. Metab. 75, 1151-1158 (1992).
7. Teuscher,J., Peter,H.J., Gerber,H., Berchtold,R. & Studer,H. Pathogenesis of nodular goiter and its implications
for surgical management. Surgery 103, 87-93 (1988).
8. Dralle,H. et al. Risk factors of paralysis and functional outcome after recurrent laryngeal nerve monitoring in
thyroid surgery. Surgery 136, 1310-1322 (2004).
9. Thomusch,O. et al. The impact of surgical technique on postoperative hypoparathyroidism in bilateral thyroid
surgery: a multivariate analysis of 5846 consecutive patients. Surgery 133, 180-185 (2003).
10. Reeve,T.S., Delbridge,L., Cohen,A. & Crummer,P. Total thyroidectomy. The preferred option for multinodular
goiter. Ann. Surg 206, 782-786 (1987).
11. Thomusch,O., Sekulla,C. & Dralle,H. [Is primary total thyroidectomy justified in benign multinodular goiter?
Results of a prospective quality assurance study of 45 hospitals offering different levels of care]. Chirurg
74, 437-443 (2003).
12. Thomusch,O. et al. Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in germany. World J Surg 24, 1335-1341 (2000).
13. Sosa,J.A. et al. The importance of surgeon experience for clinical and economic outcomes from thyroidectomy. Ann. Surg 228, 320-330 (1998).
14. Clerici,T., Oettli,R. & Lange,J. (Surgical and nuclear medicine treatment of hyperthyroidism). Schweiz. Med.
Wochenschr. 125, 1546-1551 (1995).
15. Dralle,H., Schober,O. & Hesch,R.D. Operatives Therapiekonzept der Immunthyreopathie. Langenbecks Arch.
Chir. 371, 217-232 (1987).
16. Roher,H.D., Horster,F.A., Frilling,A., Goretzki,P.E. & Witte,J. Surgery for Immunogenic Hyperthyroidism. Exp.
Clin. Endocrinol. 97, 292-296 (1991).
080564_Inhalt.indd 23
23.5.2008 14:53:55 Uhr
22
Nachsorge des Schilddrüsenkarzinoms
Katharina Binz*, Andreas Haldemann°, Christoph A. Meier°°°
* Stockerstrasse 42, 8002 Zürich, ° Nuklearmedizin, Stadtspital Triemli, Zürich,
°°° Departement Innere Medizin, Stadtspital Triemli, Zürich
Einleitung
In der Schweiz werden pro Jahr ca. 350 neue differenzierte Schilddrüsenkarzinome
diagnostiziert [1]. Weltweit wurde über eine Zunahme der Inzidenz des papillären
Schilddrüsenkarzinoms berichtet, wobei insbesondere die Änderungen der
histologischen
Kriterien,
sowie
die
häufigere
Verwendung
von
Ultraschalluntersuchungen der Schilddrüse und des Halses tragen wesentlich zum
Anstieg der Inzidenz bei [2].
Die
Prognose
nach
totaler
Thyroidektomie
ist
beim
differenzierten
Schilddrüsenkarzinom nach adäquater Primärtherapie ausgezeichnet [3]; so liegt
beim papillären Schilddrüsenkarzinom die 10-Jahresüberlebensrate bei 97%
(allerdings mit bis zu 20% Lokal- und Lymphknotenrezidiven) und beim follikulären
bei 75% [4].
Die Aggressivität des chirurgischen Vorgehens sowie die Nachbehandlung müssen
demzufolge dem Risiko angepasst werden.
Patienten mit sehr niedrigem Risiko:
Unifokale differenzierte Karzinome 1cm
N0 M0
Patienten mit niedrigem Risiko:
T 1-2 cm N0 M0
T2 N0 M0
Patienten mit hohem Risiko:
Alle T3 und T4
Alle T N1 M1
Untersuchungen bei Verdacht auf Schilddrüsenkarzinom
Als erste Untersuchung beim Befund eines Schilddrüsenknotens wird ein TSH
Spiegel bestimmt. Falls dieser erhöht oder erniedrigt ist, sollte ein FT4 Wert bestimmt
werden.
Die Sonographie der Schilddrüse ist die Methode der Wahl für die Diagnose von
Schilddrüsenknoten, deren genaue Lokalisation, die Messung der Knotengrösse und
die sonographisch gesteuerte Feinnadelpunktion (FNP). Obwohl sonographischen
Zeichen, die für eine Malignität des Knotens sprechen, beschrieben wurden
(Mikrokalzifikationen, Hypoechogenizität und/oder unregelmässige Begrenzungen
oder ein solider Knoten ohne hypoechogenen Randsaum (sogenanntes „Halo“),
Blutflussmuster im Farbdoppler), sind diese unzuverlässig und erlauben keine
sichere Diagnose der Dignität [8], [9].
Feinnadelpunktiert werden alle Knoten über 1-1.5 cm Durchmesser (oder unter 1 cm
bei Risikokonstellation). Bei der Struma multinodosa werden die grössten 2-3
Knoten, oder diejenigen, deren sonographische Erscheinung verdächtig erscheint,
feinnadelpunktiert. Die FNP ist die beste diagnostische Untersuchung der
080564_Inhalt.indd 24
23.5.2008 14:53:58 Uhr
23
Schilddrüsenknoten. Sie ist sowohl bei solitären Knoten, wie auch bei der Struma
multidonodosa die Untersuchung der Wahl. Die zytologische Untersuchung ergibt die
wichtige Unterscheidung einer makrofollikulären (gutartigen) oder einer
mikrofollikulären (unsichere Dignität) Läsion und sie erlaubt die Diagnose eines
papillären Schilddrüsenkarzinoms. In 10% der Fälle ist sie allerdings nicht
diagnostisch, weil zu wenig Material punktiert wurde. Über die Schilddrüsenknoten
und deren Abklärung berichtet ausführlich ein früherer Uebersichtsartikel [10,11].
Mit Hilfe der Ultraschalluntersuchung werden etwa so viele Schilddrüsenknoten
diagnostiziert, wie bei der Autopsie, d.h. bei >50% der Bevölkerung. Nur ein Zehntel
davon wird klinisch je manifest. Die Prävalenz eines Karzinomes in einem
Schilddrüsenknoten wird auf etwa 10 – 15% geschätzt, wobei die grosse Mehrzahl
papilläre Mikrokarzinome ohne klinische Bedeutung sind. Mit anderen Worten
bedeutet dies, dass mittels der sonographischen Untersuchung Karzinome
diagnostiziert werden können, die klinisch nie manifest werden und somit keiner
Behandlung bedürften.
Therapie des Schilddrüsenkarzinoms
Chirurgie
Bei der Diagnose eines differenzierten Schilddrüsenkarzinoms sind neben der FNP
und einer Halssonographie keine weiteren Untersuchungen indiziert. Nur in
Ausnahmesituationen (grosse retrosternale Struma, Verdacht auf Infiltration der
Trachea oder des Oesophagus) kann gelegentlich eine zusätzliche MRIUntersuchung zur Operationsplanung sinnvoll sein.
Mit Ausnahme des solitären gut differenzierten Mikrokarzinoms (Durchmesser bis 1
cm), bei dem kein Hinweis für Lymphknotenmetastasen besteht und keine frühere
Bestrahlung des Halses vorausgegangen ist, ist die totale Thyroidektomie die
Therapie der Wahl, wobei diese beim papillären Karzinom risikoabhängig mit einer
Lymphknotenresektion im zentralen Kompartiment kombiniert wird. Im Falle von
präoperativ nachgewiesenen Lymphknotenmetastasen oder eines intraoperativ
verdächtigen Befundes muss eine Lymphadenektomie der befallenen Kompartimente
erfolgen [7].
Diese Operation sollte in erfahrenen Zentren durchgeführt werden, um Morbidität und
Rezidivrate gering zu halten. Erfahrene Chirurgen operieren mit einem Risiko von
1,6% für persistierende unilaterale Rekurrensparesen und 2-3% für einen
persistierenden Hypoparathyreoidismus [6]. Eine Heiserkeit infolge einer passageren
Rekurrensschädigung kommt häufiger vor, ist aber meistens innerhalb von 1-6
Monaten regredient. Vorübergehende Hypokalzämien treten in bis zu 1/3 der
operierten Patienten auf, die Parathyreoideae erholen sich aber häufig innerhalb von
3 Monaten.
Postoperative Radiotherapie (Radiojodablation)
Die Radiojodablation wird in speziell ausgerüsteten Zentren durchgeführt mit dem
Ziel das verbleibende normale Schilddrüsengewebe, sowie eventuelle
mikroskopische Tumorreste mittels 131-Iod zu zerstören. 2-5 Tage nach der Ablation
wird eine Ganzkörperszintigraphie (TBS, total body scan) durchgeführt, um mögliche,
bisher unerkannte, Tumormetastasen zu erkennen. Ausserdem werden die
080564_Inhalt.indd 25
23.5.2008 14:54:01 Uhr
24
Thyreoglobulinspiegel als wichtiger Verlaufsparameter gemessen. Die Patienten
dürfen dazu während mehrere Wochen kein Schilddrüsenhormon eingenommen
haben (Ziel: TSH Spiegel > 30 mU/l), dürfen kein Jod erhalten haben (cave:
Röntgenkontrastmittel bedingt mindestens 1-2 Monate Wartezeit) und müssen aus
rechtlichen Gründen (Strahlenschutz) in speziellen Strahlenschutzzimmern
hospitalisiert werden (3-5 Tage). Die Dosis wird je nach Risiko vom Nuklearmediziner
festgelegt (i.A. 3700 MBq). Welche Patienten eine Radiojodablation erhalten sollen
ist in Tabelle 1 zusammengefasst [13].
Schwangerschaft und Stillzeit sind absolute Kontraindikationen für eine
Radiojodbehandlung. Während 12 Monaten nach der Radiojodbehandlung dürfen
Frauen zudem nicht schwanger werden.
Neuerdings ist es auch möglich die Radiojodablation nach Injektion von
rekombinantem TSH durchzuführen, womit ein Absetzen der Schilddrüsenhormone
und die z.T. invalidisierenden Symptome der Hypothyreose vermieden werden
können.
TSH Suppressionstherapie
Eine TSH Suppressionstherapie hat folgende Ziele: die Substitution der athyreoten
Patienten mit Thyroxin und die Unterdrückung des TSH-abhängigen Wachstums
möglicher noch vorhandener Tumorzellen. Bei Patienten, die definitiv geheilt sind
(z.B. Mikrokarzinom oder Stadium I), macht die suppressive Therapie keinen Sinn
und muss durch eine Schilddrüsenersatztherapie (TSH-Zielwert 0.5-1 mU/L) abgelöst
werden.
Eine suppressive Therapie wird mit Levothyroxin durchgeführt und hat das Ziel einen
TSH Spiegel von 0.1 mU/l (oder gar <0.01 mU/L bei Hochrisikopatienten) mit im
hoch-normalen Bereich liegenden FT4 Spiegeln zu erreichen. Nach 3 Monaten sollte
eine erste TSH Messung erfolgen. Später werden die TSH Spiegel alle 6-12 Monate
kontrolliert.
Die Suppressionstherapie ist sicher indiziert bei Patienten mit persistierender
Tumoraktivät (radiologisch sichtbar oder bei Thyreoglobulin-positiven Patienten). Bei
Patienten mit hohem Risiko, welche eine Remission nach initialer Therapie erreicht
haben, wird die Suppressionstherapie für 3-5 Jahre fortgeführt. Bei Patienten mit
niedrigem Risiko, bei denen eine Heilung erzielt wurde, ist das Rezidivrisiko gering (<
1%) und die Levothyroxindosis kann angepasst werden, so dass ein TSH Spiegel im
unteren Normbereich erzielt wird (0.5 – 1.0 mU/l) [14].
Die wichtigsten Nebenwirkungen einer induzierten subklinischen Hyperthyreose sind
kardiale
Komplikationen
(Vorhofflimmern,
Herzinsuffizienz
und
erhöhte
kardiovaskuläre Mortalität), sowie eine Verminderung der Knochendichte. Deshalb
sollte bei älteren Patienten und bei Patienten mit Herzerkrankungen von einer zu
aggressiven suppressiven Therapie abgesehen werden. Auch hier gilt es, den
Patienten risikogerecht zu behandeln.
Andere Therapieformen wie z.B. die externe Radiotherapie oder die Chemotherapie
haben keinen Platz in der Therapie des differenzierten Schilddrüsenkarzinoms, mit
Ausnahme von inoperablen und Radiojod-refraktären Tumoren.
080564_Inhalt.indd 26
23.5.2008 14:54:05 Uhr
25
Nachfolgeuntersuchungen
Ein europäischer Konsensus für die Therapie und die Nachsorge des differenzierten
Schilddrüsenkarzinoms wurde 2004 erarbeitet und publiziert (Figur, [12]) und beruht
im Wesentlichen auf der Messung der Serum Thyreoglobulinspiegel (basal und
stimuliert durch TSH), Ultraschall und Radiojodszintigraphie.
Neu ist die Verwendung von rhTSH, welches die Stimulation durch endogenes TSH
nach 6 wöchigem Entzug von Levothyroxin ersetzt. Diese rhTSH Stimulation erlaubt
sowohl eine Messung des Thyreoglobulins (Tg) als auch eine diagnostische
Ganzkörperszintigraphie und in Spezialfällen sogar eine Radiojodtherapie [15,16].
Für die betroffenen Patienten ist die Stimulation mit rhTSH deutlich weniger
belastend und es entstehen keine Arbeitsausfälle. rhTSH ist allerdings teuer
(Thyrogen®, Genzyme, kostet 1680.55 CHF, Stand September 07) und wird in der
Schweiz als Pflichtleistung der Krankenkassen für 2 Anwendungen übernommen.
Eine Bedingung für die Anwendung von rhTSH ist ein sensitiver Thyreoglobulin Test
mit Messung der Wiederfindung (Problem der Testinterferenz mit anti-Thyreoglobulin
Antikörpern), damit eine ausreichende Sensibilität und Spezifizität erreicht werden
kann. Dieser Test wird nicht in allen Labors standardmässig durchgeführt.
Die Sonographie des Halses spielt in der Nachsorge ebenfalls eine wichtige Rolle, da
sie in geübten Händen eine hohe Sensibilität für Rezidive, die meist lokal sind
(Schilddrüsenloge oder Halslymphknoten), aufweist. Eine FNP muss bei jedem
verdächtigen Befund durchführt werden und sollte unter Ultraschallkontrolle erfolgen.
Theoretisch sollten die meisten Patienten jährlich bis zweijährlich über lange Zeit
(>10 Jahre) nachuntersucht werden. Bei Patienten in hohem Alter oder bei Patienten
mit sehr geringem Rezidivrisiko macht dies jedoch keinen Sinn und die
Ultraschalluntersuchung kann auch durch eine Palpation abgelöst werden.
Therapie und Nachsorge des differenzierten Schilddrüsenkarzinoms, leicht
modifiziert nach dem europäischen Konsensus [9]
Legende:
Tg: Thyreoglobulin; interner Grenzwert: der Thyreoglobulin Grenzwert sollte
institutsintern für jede einzelne Messmethode bestimmt warden.
FT3: freies Trijodothyronin, LT4: Levothyroxin
rhTSH; rekombinantes humanes TSH
Sonographie Hals: jeder auffällige Befund muss mittels einer FNP oder
anderer Tests abgeklärt werden.
TBS ('total body scan'): Ganzkörperszintigraphie
*dieses Intervall hängt vom Tg-Spiegel und klinischen Kontext ab
** gewisse Experten schlagen eine zweite rhTSH-stimulierte Tg-Bestimmung
nach spätestens 2 – 5 Jahren vor
080564_Inhalt.indd 27
23.5.2008 14:54:08 Uhr
26
Totale Thyroidektomie und 131-Iod Ablation
Evalutation zum Zeitpunkt der Ablation:
Posttherapeutische Ganzkörperszintigraphie – Status – Tg:
Kein Nachweis der Erkrankung
Nachsorge nach 3 Monaten:
TSH, Tg, fT3 unter Levothyroxin, Sonographie Hals, Status:
Kein Nachweis der Erkrankung
Nachsorge nach 6 - 12 Monaten:
rhTSH-stimuliertes Tg, Sonographie Hals, Status
TBS bei positivem posttherapeutischen Scan
Nicht nachweisbares Tg
Keine anderen
Auffälligkeiten
Tg nicht nachweisbar,
Nachweisbares Tg und
aber < internem Grenzwert
andere Auffälligkeiten
keine anderen Auffälligkeiten oder Tg > interner
Grenzwert
LT4 Dosis verringern
Wiederholung des rhTSH
jährliche Evaluation
stimulierten Tg in jährTg unter LT4 ± Sonographie** lichen Intervallen*
Tg abnehmend
LT4 absetzen; Therapie
mit hochdosiertem Radio
jod und/oder Chirurgie
Post-Therapie TBS
Tg stabil oder zunehmend
Schlussfolgerungen
Das differenzierte Schilddrüsenkarzinom ist ein seltener Tumor mit guter Prognose.
Die Palpation und Sonographie mit gesteuerter Feinnadelpunktion stellt meist
frühzeitig die Diagnose. Therapie der Wahl beim Karzinom über 1.5 - 2 cm
Durchmesser ist die totale Thyroidektomie meist (risikoabhängig) mit
anschliessender
ablativer
Radiojodbehandlung.
Die
suppressive
Levothyroxintherapie spielt insbesondere bei hohen Risiken eine wichtige Rolle,
muss aber patientengerecht differenziert angewendet werden. In der Folge kann der
Patient meist mittels klinischer Untersuchung, Sonographie des Halses und Messung
der Thyreoglobulinspiegel nachkontrolliert werden. In Fällen mit höherem Risiko
kommt
eine
rhTSH
stimulierte
Thyreoglobulin
Messung
ggf.
mit
Ganzkörperszintigraphie in Frage. Allenfalls wird bei sehr hohem Risiko oder bei
Metastasen eine weitere Radiojodbehandlung angeschlossen. Die Betreuung und
Nachsorge dieser Patienten erfolgt am besten interdiszipliär in spezialisiert
organisierten Zentren unter Einbezug von Chirurgen, Nuklearmedizinern, Pathologen
und Endokrinologen.
080564_Inhalt.indd 28
23.5.2008 14:54:12 Uhr
27
Referenzen
1.
Schweizerisches Krebsregister, Globocan 2002, www.vskr.ch
2.
Verkooijen HM, Fioretta G, Pache JC, Francesci S, Raymond L, Schubert H,
Bouchardy C. Diagnostic changes as a reason for the increase in papillary thyroid cancer
incidence in Geneva, Switzerland. Cancer Causes Control, 2003 Feb;14(1):13-7.
3.
Schlumberger MJ. Papillary an follicular thyroid carcinoma. N Engl J Med.
1998;338(5):297-306.
4.
Triponez F, Simon S, Robert J, Andereggen E, Ussel M, Bouchardy C et al. Thyroid
Cancer: the Geneva experience. Ann Chir. 2001 Dec;126(10):969-76
5.
Boice JD, Thyroid disease 60 years after Hiroshima and 20 years after Chernobyl.
Jama 2006;295:1011-12.
6.
Gemsenjäger E, Heitz PU, Seifert B, Benedict M, Schweizer I. Differentiated thyroid
carcinoma. Swiss medical weekly 2001;131:157-163.
7.
Gemsenjäger E, Perren A, Seifert B, Schüler G, Schweizer I, Heitz PU. Lymph node
surgery in papilary thyroid carcinoma. American College of Surgeons 2003;197:182-190
8.
Rago T, Vitti P, Chiovato L, Mazzeo S, De Liperi A, Miccoli P et al. Role of
conventional ultrasonography and color flow-doppler sonography in predicting malignancy in
‘cold’ Thyroid nodules. Eur J Endocrinol 1998;138(1):41-6.
9.
Papini E, Giuglielmi R, Bianchini A, Crescenzi A, Taccogna S, Nardi F, Panunzi C,
Rinaldi R, Toscano V. Pacella CM. Risk of malignancy in nonpalpable thyroid nodules:
predictive value of ultrasound and colour doppler. Clin Endocrinol Metab. 2002
May;87(5):1941-6.
10.
Petite Ch, Meier CA. Nodules thyroïdiens et goitres: le traitement chirurgical. Schweiz
Med Forum 2004;4:1090-6
11.
Meier CA. Thyroid nodules: pathogenesis, diagnosis and treatment. Baillière’s Clinical
Endocrinology and Metabolism 2000; Vol14, No4, pp 559-575
12.
Pacini F, Schlumberger M, Dralle H, Elisei R, Smit J, Wiersinga W et al.. European
consensus for the management of patients with differentiated thyroid carcinoma of the
follicular epithelium. European J Endocrinol 2006;154:787-803.
13.
Pacini F, Schlumberger M, Harmer C, Berg GG, Cohen O, Duntas L et al. Postsurgical use of radioiodine in patients with papillary and follicular thyroid cancer and the issue
of remnant ablation: a consensus report. Eur J endocrinol 2005;153(5):651-9.
14.
Cooper DS, Specker B, Ho M, Sperling M, Ladenson PW, Ross DS et al. Thyrotropin
suppression and disease progression in patients with differentiated thyroid cancer: results
from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid 1998;8(9):737-44
15.
Haugen B, Pacini F, Reiners C, Schlumberger M, Ladenson P, Sherman SI. A
comparison of recombinant human thyrotropin an thyroid hormone withdrawal for the
detection of thyroid remnant or cancer. J Clin Endocrinol Metab 1999;84:3877-85
16.
Kloos R, Mazzaferri EL. A single recombinant human thyrotropin-stimulated serum
thyroglobin measurement predicts differentiated thyroid carcinoma metastases three to five
years later. 2005;J Clin Endocrinol Metabol 90:5047-57.
080564_Inhalt.indd 29
23.5.2008 14:54:16 Uhr
28
Labor: Was braucht es – was kann man sparen
Jörg Furrer, Zürich
Idealerweise verordnen wir die Bestimmung von Laborwerten aufgrund von Symptomen,
anamnestischen Angaben und körperlichen Untersuchungsbefunden, was die Differentialdiagnosen
einengt und die angeforderten Laborwerte vermindert.
Das Screening bezüglich Schilddrüsenerkrankungen asymptomatischer Erwachsenen wird
– da zu teuer - nicht empfohlen, da die Inzidenz trotz relativ hoher Prävalenz (für manifeste Hypound Hyperthyreosen meist unter 1% angegeben) zu niedrig ist. Dagegen ist das Screening mittels
TSH-Bestimmung zur frühzeitigen Erfassung von Hypothyreosen bei Neugeborenen etabliert und
kosteneffizient.
Wenn wir sparen wollen, müssen wir überlegen, auf welche Parameter weitgehend verzichtet
werden kann. So hat etwa die Bestimmung des fT3 (neben dem fT4) bei der Frage nach
Hypothyreose keinen zusätzlichen diagnostischen Stellenwert. Gesamt-T4 und T3, sowie das
Thyroxinbindende Globulin (TGB) müssen heute in der Routine nicht mehr bestimmt werden. Das
gleiche gilt weitgehend auch für die Anti-Thyreoglobulin-Antikörper, da die Anti-TPO-Antikörper
sensitiver und bei Autoimmunerkrankungen der Schilddrüse nur selten negativ sind.
Auch Thyreoglobulin wird zu häufig bestimmt, da es bei zu vielen verschiedensten
Schiddrüsenerkrankungen erhöht und deshalb sehr unspezifisch ist. Thyreoglobulin ist eigentlich nur
für die Nachkontrolle behandelter Schilddrüsencarcinome relevant um Rezidive zu erfassen.
Allenfalls noch – wegen der meist tiefen Thyreoglobulin-Werte - zur Stützung eines Verdachtes
auf eine Hyperthyreose factitia.
Eine Schilddrüsenszintigraphie (mit 99m Pertechnat) sollte nur erfolgen, wenn dadurch
diagnostische oder therapeutische Konsequenzen zu erwarten sind. Gute Indikationen sind
Hyperthyreosen, bei denen weder klinisch noch labormässig ein M. Basedow vorliegt und die
Diagnose ohne Szintigramm nicht genügend sicher gestellt werden kann, während etwa die Frage ob
ein Schilddrüsenknoten maligne oder benigne ist mittels Szintigraphie nicht beantwortet werden
kann, dazu braucht es die Zytolgie des (oft mittels Ultraschall) durch eine Punktion gewonnenen
Materials aus dem Knoten. Auch bei Hypothyreosen bringt eine Szintigraphie nichts, es sei denn für
die Suche einer (extrem seltenen) ektopen Schildrüse oder von
Schilddrüsenhormonsynthesestörungen im (Klein-) Kindesalter. Zytologische Untersuchungen sind
bei der Frage nach Malignität unerlässlich und müssen manchmal wiederholt veranlasst werden, bei
Thyreoitiden sind sie nur ausnahmsweise nötig.
Die Evaluation bezüglich Iodmangel braucht es dank der Iodierung des Kochsalzes bei der in der
Schweiz lebenden Bevölkerung selten, sie sollte wegen des Aufwandes und der delikaten
Interpretation nur unter (vorherigem) Beizug eines Spezialisten erfolgen.
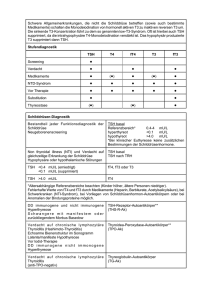
Indikationen zur TSH-Bestimmung
Da Symptome, die durch eine hypo- oder hyperthyreote Stoffwechsellage verursacht sein könnten
so häufig sind, wird - um Kosten zu sparen – zur Bestätigung der Euthyreose häufig primär nur
das TSH bestimmt. Doch welche Diagnosen verbergen sich hinter den bei diesem Vorgehen
isoliert erhaltenen normalen, erhöhten oder erniedrigten TSH-Werten? Nicht immer, was man
primär denken würde, so ist der Reflex normales TSH = Euthyreose fast immer richtig, es sei denn
es verberge sich dahinter eine zentrale schwere Hypothyreose .........! Dies verdeutlicht: Bei der
Interpretation der zum sparen isoliert angefordeten TSH-Werte ist Aufmerksamkeit gefordert. Die
unten zusammengestellten Tabellen zur
„ Differentialdiagnose von TSH-Werten“ sollten dabei hilfreich sein. Auf die Angabe von
Normalbereichen wird bewusst verzichtet, da diese von Labor zu Labor verschieden sein können. Ist
der klinische Verdacht auf eine hypo- oder hyperthyreote Stoffwechsellage stark, können TSH und
fT4 schon von Anfang an zusammen bestimmt werden, um diagnostische Irrtümer zu vermeiden. Im
folgenden ist mit „unbehandelt“ gemeint, dass die (erwachsenen) Probanden nicht wegen einer
Schilddrüsenerkrankung behandelt sind.
080564_Inhalt.indd 30
23.5.2008 14:54:19 Uhr
29
Differentialdiagnosen eines normalen TSH bei unbehandelten Probanden
TSH normal: keine weiteren Funktions-Tests, wenn kein Verdacht auf zentrale
Hypothyreose besteht
- Euthyreose (TSH und fT4 normal)
- euthyreote Schilddrüsenknoten (Malignität ausschliessen), euthyreote Strumen
- hypophysäre Insuffizienz mit sekundärer Hypothyreose (fT4 erniedrigt). Selten, aber
es gibt sie, auf weitere Symptome einer Hypophyseninsuffizienz achten, z.B.
Amenorrhoe, Potenz-, Libidoprobleme etc)
Merke: bei hypophysärer Hypothyreose liegt das TSH oft im Normbereich,
manchmal sogar leicht darüber, oder es ist erniedrigt. Dieser diagnostische Fallstrick muss
beherzigt werden, da sonst die Diagnose einer (allerdings seltenen)
zentralen Hypothyreose verpasst wird. Für die Diagnose einer zentralen
Hypothyreose braucht es deshalb die Bestimmung von fT4.
- hypothalamische Störungen mit tertiärer Hypothyreose ( fT4 erniedrigt, sehr selten)
- Schilddrüsenhormonresistenz (sehr selten, fT4 und fT3 erhöht)
Differentialdiagnosen eines erhöhten TSH bei unbehandelten Patienten
TSH erhöht: fT4 für das Ausmass der Hypothyreose bestimmen
- Hypothyreosen verschiedenster Aetiologie ( autoimmun, atroph, nach Thyreoidektomie,
Radiodbehandlung, schwerer Iodmangel in Gebieten ohne Iodprophylaxe; fT4 erniedrigt, fT3 für
Diagnose nicht nötig oder gar irreführend, da fT3 trotz manifester Hypothyreose oft im unteren
Normbereich liegt).
- subklinische Hypothyreose (fT4 normal). Ev. nur transient!
- passagere hypothyreote Stoffwechsellagen im Ablauf von Thyreoiditiden
(postpartum, silent, de Quervain)
Merke: die erwähnten Thyreoiditiden beginnen (nicht immer) mit einer
hyperthyreoten Phase und heilen über eine transiente hypothyreote Phase meist mit einer
Euthyreose aus. Es ist wichtig dies zu kennen, da sonst möglicherweise eine
lebenslängliche Substitutionstherapie mit T4 erfolgt, die gar nicht nötig wäre!
- diskret knapp über der oberen Normgrenze selten auch bei zentraler Hypothyreose möglich
- Durch Medikamente induzierte Hypothyreosen (Lithium, Amiodaron u.a.)
- Medikamentös induzierte leichte Erhöhung der TSH-Sekretion ohne Hypothyreose
- Ausheilung eines euthyroid sick syndroms, Morbus Addison
- Schilddrüsenhormonresistenz (sehr selten)
- TSH-produzierende Hypophysentumoren mit konsekutiver Hyperthyreose (extrem selten)
- Analytische Artefakte
Differentialdiagnosen eines erniedrigten TSH bei unbehandelten Patienten
TSH erniedrigt: fT4 und fT3 für das Ausmass der Hyperthyreose, aber auch zum Ausschluss einer
zentralen Hypothyreose, bezw. zur Bestätigung einer Euthyreose mit tiefem TSH
- Hyperthyreosen (Basedow, tox. Adenom, multinoduläre tox. Struma)
- passagere hyperthyreote Stoffwechsellage bei Thyreoiditiden (postpartum,
silent, de Quervain)
Merke: bei diesen Thyreoiditiden ist die Biosynthese der Schilddrüsenhormone nicht
erhöht. Thyreostatische Therapien sind deshalb nutzlos. Die Diagnose erfolgt klinisch,
anamnestisch, bei postpartum und silent Thyroiditiden passen dazu die meist positiven
Anti-TPO-Antikörper oder die stark erhöhte Senkung bei der de Quervain Thyreoiditis,
Ultraschall und (nur) wenn nötig szintigraphisch, da die Radionukleotidaufnahme trotz
peripherer Hyperthyreose erniedrigt ist. Die TRAK sind negativ.
- subklinische Hyperthyreose (fT3 und fT4 im Normbereich). Ev. nur transient!
- sehr selten bei „Hashitoxikose“, Schilddrüsencarcinomen und eitriger Thyreoiditis
- Hyperthyreose factitia, iatrogen (tiefer oder fehlender uptake in der Szintigraphie!)
- Schwangerschaftshyperthyreosen (durch hCG bedingt)
- Medikamente, die eine Hyperthyreose induzieren können (Amiodaron,
080564_Inhalt.indd 31
23.5.2008 14:54:23 Uhr
30
Interferone und Interleukine, Iod, iodhaltige Medikamente u.a.)
- ohne Hyperthyreose (d.h. Euthyreose) bei älteren Patienten, in der Frühschwangerschaft, bei
schweren allg. Erkrankungen, Akromegalie und bei Medikamenten, welche die TSHSekretion inhibieren (Dopamin-Agonisten, Glucocorticoide, u.a.)
- hypophysäre oder hypothalamische Hypothyreosen (nur mit fT4 fassbar!!)
Merke: Ein tiefes TSH ist nicht pathognomonisch für eine Hyperthyreose und kann selten
auch bei gesunden, vor allem älteren Leuten gefunden werden.
fT4, fT3 und TSH zur Evaluation bei Verdacht auf Hyperthyreose
Ein nicht supprimiertes TSH (Voraussetzung hochsensitive Assay der 3.
Generation, wie sie in der Schweiz verwendet werden sollten) schliesst eine Hyperthyrose
weitgehend aus, denn die Ausnahmen (TSH normal oder erhöht bei erhöhtem fT4): TSH
sezernierendes Hypophysenadenom, Schilddrüsenhormonresistenz, paraneoplastische TRHSekretion sind extrem selten. In diesem Sinne kann mit einer alleinigen TSH-Bestimmung eine
hyperthyreote Stoffwechsellage weitgehend ausgeschlossen werden. Häufiger ist ein
supprimiertes TSH bei normalem fT4. Hier liegt dann meist eine subklinische Hyperthyreose (TSH
suprimiert, sowohl fT4 als auch fT3 im Normbereich) oder eine T3-Toxikose (gemäss Literatur
einige bis 10% aller Hyperthyreosen) vor. Hat man also klinisch Verdacht auf eine Hyperthyreose
und liegt das fT4 im Normbereich , so muss fT3 nachbestimmt werden, wenn TSH supprimiert ist. Ist
das TSH grenzwertig tief und besteht klinisch Verdacht auf eine hyperthyreote Stoffwechsellage
sollen fT3 und fT4 sicherheitshalber bestimmt werden.
Szintigramm und Radionukleotidaufnahme zur Differentialdiagnose von
Hyperthyreosen
Eine wertvolle Untersuchung, ausser beim sicheren M. Basedow, wo die Szintigraphie für die
Diagnose nicht notwendig ist (Sparpotential).
Der Uptake ist erhöht, wenn die Hyperthyreose Folge einer gesteigerten Hormonsynthese ist: wie
beim M. Basedow, Toxischen Knoten (uni- oder multinodulär), oder
TSH induziert (extrem selten).
Der Uptake ist erniedrigt, wenn die Hormonsynthese vermindert ist: de Quervain, silent und
postpartum Thyreoiditis (CAVE keine Szinigraphie wenn gestillt wird), factitia oder iatrogen.
Bei der sehr seltenen Struma ovarii findet sich die Aktivität im Ovar. Bei der iod-induzierten
Hyperthyreose ist der uptake erniedrigt, aber auch erhöht, die Distribution des Nucleotids in der
Schilddrüse kann fehlen oder ist heterogen.
Sparpotential: Auch für die Differentialdiagnose der Nicht-Basedow-Hyperthreosen braucht es
nicht immer eine Szinigraphie, so zum Beispiel, wenn klinisch eine De Quervain-Thyreoiditis
vermutet, die Schilddrüse stark schmerzhaft, die Senkung sehr hoch ist und im Ultraschall das
typische Muster gefunden wird. Untersuchungen mit Radioiod werden praktisch nur noch im
Zusammenhang mit Therapien für Schilddrüsenmalignome durchgeführt.
„Indikationen“ zur Bestimmung von Schilddrüsen-Antikörpern
Anti-TPO-Antikörper
Diese sind bezüglich genauerer Diagnostik unspezifisch, kommen sie doch auch bei
gesunden Probanden und im Rahmen irgendwelcher Autoimmunerkrankungen vor. Der
diagnostische Wert ist deshalb beschränkter als die Anzahl der Bestimmungen vermuten lassen
müsste, am ehesten trifft meist noch die Aussage „der Befund passt zu...“ Anti-TPO-Antikörper
finden sich vor allem bei (können aber auch negativ sein!):
- Chronischer Autoimmun Thyreoiditis (sog. Hashimoto) und bei M. Basedow
- Hypothyreose ( bei autoimmuner Pathogenese)
- Thyreoiditiden (postpartum, silent, akute Hashimoto). Nicht bei de Quervain, meist negativ.
- polyglanduläre Autoimmunsyndrome
- Patienten mit anderen Autoimmunerkrankungen
080564_Inhalt.indd 32
23.5.2008 14:54:27 Uhr
31
Anti-Thyreoglobulin-Antikörper
Hohes Sparpotential. Auf deren Bestimmung könnte meist verzichtet werden, da sie noch
unspezifischer als die Anti-TPO und letztere sensitiver bezüglich Autoimmunprozessen der
Schilddrüse sind. Ausnahme bei Verdacht auf Autoimmunthyreoiditis, aber negativen Anti-TPOAntikörper, sowie bei der Nachbetreuung von Patienten mit Schilddrüsencarcinomen, da Anti-TgAK die dort indizierte Thyreoglobinbestimmung stören. Ueberdenken ob die Bestimmung
Konsequenzen hat.
Stimulierende Antikörper gegen den TSH-Rezeptor (TSI,TRAK)
Sie haben einen direkten pathogenetischen Effekt, weil sie den TSH-Rezeptor stimulieren und
werden nur bei Verdacht (oder als Argument für den Ausschluss) auf M.Basedow oder bei der
„euthyreoten“ endokrinen Orbitopathie bestimmt. Sie gelten als sehr spezifisch für den M. Basedow.
Selten liegt klinisch ein M. Basedow vor, die TSH-Rezeptor stimulierenden Antikörper sind jedoch
negativ und werden erst im Verlauf postiv, was u.a. mit den Bestimmungsmethoden
zusammenhängt. Negative TSI oder TRAK schliessen also einen M.Basedow nicht aus. Sind auch
die Anti-TPO-Antikörper negativ liegt einer Hyperthyreose eher eine Autonomie, ev. eine
de Quervain Thyroiditis zugrunde.
Thyreoglobulin
Sehr hohes Sparpotential. Wie in der Einleitung erwähnt sehr selten indiziert, da bei den
verschiedensten euthyreoten und hyperthyreoten Schilddrüsenpathologien erhöht (maligne, aber
auch benigne Knoten, Strumen, unbehandelte Basedow-Hyperthyreose, Thyreoiditiden, Amiodaron
induzierte Hyperthyreosen), das heisst diagnostisch viel zu unspezifisch. Indiziert bei der
Nachkontrolle behandelter Schilddrüsencarcinome.
Indikationen für TRH-Stimulationstest
Hohes Sparpotential, da seit Einführung der ultrasensitiven TSH-Assays nur selten indiziert,
Interpretation meist schwierig mit entsprechend beschränkter Aussagekraft, nur für erfahrene
Schilddrüsenspezialisten und seltene Fragestellungen.
TSH, fT4 und fT3 bei schweren Allgemeinerkrankungen und hospitalisierten
Patienten
Sollten immer mit einem Spezialisten besprochen werden, bevor therapeutische Entscheidungen
getroffen werden, da nur vorübergehend pathologische Veränderungen auftreten können, die sich
nach Abheilung der Grundkrankheit wieder normalisieren und die nicht Ausdruck einer hypo- oder
hyperthyreoten Stoffwechsellage sind. Ein wichtiges Beispiel ist die bei Magersucht oft gefundene
T3- Erniedrigung (ohne dass eine Hypothyreose vorliegt, sog. Low T3-Syndrom), die nicht zu einer
Behandlung mit Schilddrüsenhormonen führen darf.
Medikamentöse Interaktionen mit Schilddrüsenhormonen und mit TSH
Im Titel heisst es: Was braucht es? Immer auch eine sorgfältige Medikamentenanamnese, einige
inhibieren (Glucocorticoide, Dobutamin u.a.) oder erhöhen (Metoclopramid u.a.) die TSH Sekretion
ohne hyper- oder hypothyreote Stoffwechsellage; induzieren Hyper- (siehe oben) und
Hypothyreosen (Lithium u.a.), beeinflussen Bindung (Steroidhormone u.a.), Metabolismus
(Phenytoin u.a.), Konversion von T4 zu T3 (Amiodaron u.a.) und bei Einnahme von Thyroxin
dessen Resorption aus dem Magendarmtrakt (Cholestyramin u.a.). Wenn klinisch relevant braucht
es bei Behandlungen mit solchen Medikamenten bei erhöhten TSH-Werten fT4 oder bei tiefen fT3
und fT4 Bestimmungen zur Bestätigung der Euthyreose.
Thyroxin Substitutionstherapien wegen Hypothyreosen
Bei primären Hypothyreosen ist nach erreichen der zur Normalisierung des TSH benötigten Dosis
die 6-12 monatliche Kontrolle des TSH, welches im mittleren Normbereich liegen soll, meist
genügend. Thyroxin sollte bei Kontrollen von fT4 erst nach der Blutentnahme eingenommen
080564_Inhalt.indd 33
23.5.2008 14:54:32 Uhr
32
werden, da sonst die Werte oft leicht über der Norm liegen und zu ungerechtfertigten
Dosisreduktionen führen. Ebenso wichtig ist die klinische Beurteilung. In der Schwangerschaft muss
bei mit Thyroxin behandelten Frauen häufiger und vor allem im ersten Trimester wegen des
erhöhten Bedarfs auch fT4 bestimmt werden. Bei zentraler Hypothyreose muss neben der Klinik
immer der fT4-Wert - er soll im oberen Normbereich liegen - beigezogen werden, das TSH ist für
die Therapiekontrolle nicht brauchbar und muss nicht zwingend bestimmt werden. Bei
Suppressionstherapien nach Behandlung eines Schilddrüsencarcinoms muss durch Kontrolle der
peripheren Schilddrüsenhormone sichergestellt werden, dass nicht eine dauernd ausgeprägte
iatrogene Hyperthyreose besteht (u.a. zur Vermeidung einer Osteoporose).
TSH bei thyreostatischer Behandlung des M. Basedow
Nach Beginn bleibt das TSH oft über Monate (oder noch länger) trotz Normalisierung von fT4 und
fT3 (welches trotz normalem fT4 hoch sein kann und deshalb speziell zu beachten ist)) supprimiert.
Bei euthyreoter Klinik darf die Thyreostatikadosis nicht ohne Kontrolle von fT4 bis zum Anstieg
des TSH erhöht werden, da diese erzwungene „Normalisierung“ des TSH ev. mit einer schweren
iatrogenen Hypothyreose erkauft wird.
Zusammenfassend zeigt diese (unvollständige) Zusammenstellung, dass bei der
Schilddrüsendiagnostik durch Verzicht auf unnötige Untersuchungen und schrittweise
Laborbestimmungen gespart werden kann, allerdings zum Preis sorgfältiger
differentialdiagnostischer Ueberlegungen. Will man kostensparend Labor verordnen, kommt man
um eine vertiefte Reflexion in jedem Einzelfall nicht herum und muss sich immer die Frage stellen:
Ist die Bestimmung zur Diagnose nötig, hat sie therapeutische Konsequenzen ? Dazu möchte dieses
Manuskript einige Anregungen geben. Bei paradoxen Laborkonstellationen braucht es den Beizug
eines Spezialisten, er sollte dann nicht weggespart werden.
Literatur: U. Kolyvanos, J. Furrer, L. Käser, W. Vetter, Hypothyreose, Praxis 2007;96:14111418. Hyperthyreose, Praxis 2007;96:1505-1512, CME Online-Fortbildung
www.praxis.ch.
C. Moser, J.Furrer, F.Ruggieri, Halsschmerzen und Fieber nach Peginterferon
alpha-2a, Praxis 2007; 96: 205-207
Jörg Furrer
Dr. med, dipl.sc.nat.ETH
Hohenbühlstrasse 3
CH - 8032 Zürich
[email protected], www.desg.ch
Zürich, 5. Juni 2008
080564_Inhalt.indd 34
23.5.2008 14:54:36 Uhr
33
Indikationen und Grenzen des Ultraschalls
1. Allgemeines
Die Schilddrüsendiagnostik wurde in den vergangenen20 Jahren revolutioniert.
Während frührer der Schilddrüsenszintigraphie grosse Bedeutung zukam, ist diese
wegen des Ultraschalls in die zweite Reihe zurückgedrängt worden und muss nur
noch in speziellen Situationen zu Hilfe gezogen werden. Eine Schilddrüsendiagnostik
ohne Ultraschall ist heute kaum mehr denkbar. Sowohl bei nodulären
Veränderungen, wie auch bei entzündlichen Schilddrüsenerkrankungen leistet der
Ultraschall wertvolle Dienste. Der Ultraschall ist nicht invasiv und relativ billig. Er
erkennt Veränderungen, die mittels Szintigraphie oder Palpation nicht erkennbar
sind.
Nebst einem erfahrenen Sonographeur ist jedoch auch die korrekte Sonde eminent
wichtig. So wird am besten eine lineare 7-10MHz Sonde verwendet.
2.Schilddrüsenknoten
Die Sonographie der Schilddrüse soll helfen relevante Schilddrüsenerkrankungen zu
diagnostizieren, insbesondere in der Früherkennung des Schilddrüsenkarzinoms
kann sie wichtig sein(1,2)alpatorisch weisen ca 5% der Bevölkerung einen
Schilddrüsenknoten auf, aber in ca 50% der Bevölkerung sind sonographisch kleine
Schilddrüsenknoten nachweisbar. Asymptomatische Schilddrüsenkarzinome sind in
Autopsieserien sehr häufig (bis zu 25%). Klinisch relevante Schilddrüsen-Karzinome
treten lediglich mit einer Inzidenz von weniger als 0.005% auf (Tab1,2). Die
Sonographie kann die Grösse eines Schilddrüsenknotens mit grosser Präzision
beschreiben, kann Zysten von soliden Knoten unterscheiden und je nach Gerät auch
die Durchblutung der Schilddrüse respektive der Knoten beschreiben und messen.
Sie kann aber nicht eine definitive Diagnose hinsichtlich Dignität geben. Hier sind
weitere Abklärungen wie die ultraschallgesteuerte Feinnadelspirationsbiopsie nötig.
Da mittels Sonographie auch klinisch nicht relevante Veränderungen dokumentiert
werden können, soll er nur in Risikosituationen als Screening Methode eingesetzt
werden (Tab 3). Bei allen Patienten, welche eine Knotenstruma aufweisen, sollte
eine Ultraschalluntersuchung mit Dokumentation der Knoten durchgeführt werden. Im
Bedarfsfall kann gleichzeitig eine ultraschallgesteuerte Feinnadelaspirationsbiopsie
gemacht werden(3).
Knoten können solide, zystisch oder komplex ( zystische und solide Anteile) sein.
Zystische oder komplexe Knoten müssen ebenfalls punktiert werden, da sich
papilläre Schilddrüsenkarzinome zystisch präsentieren können.
3. Dysthyreose
Der Ultraschall kann bei Hyperthyreose hilfreich sein. Die Unterscheidung zwischen
Knotenstruma und entzündlicher Schilddrüsenerkrankung macht der Ultraschall in
der Regel ausgezeichtnet, sodass auch eine Schilddrüsenszintigraphie verzichtete
werden kann. Zusätzlich kann mittels Doppler-Untersuchung die Durchblutung
gemessen werden.
080564_Inhalt.indd 35
23.5.2008 14:54:39 Uhr
34
In der Beurteilung der Autoimmunentzündung der Schilddrüse kann der Ultraschall
ebenfalls gelegentlich hilfreich sein. Er kann Schilddrüsenveränderungen erfassen,
welche nicht palpabel sind.
Da die Thyreoiditis Hashimoto wie auch der M. Basedow mit erhöhter Inzidenz an
Schilddrüsenkarzinomen assoziiert ist, stellt diese Erkrankung ebenfalls eine
Indikation zur Schilddrüsensonographie dar (4-7).
Bei der Amiodaroneinduzierten Thyreotoxikose (AIT) weisen Knoten in die Richtung
Typ 1AIT. Eine vermehrte Durchblutung spricht für Typ 1 AIT, eine verminderte
Durchblutung für Typ2 AIT (destruktive Thyreoiditis).
4. Zusammenfassung
Die Sonographie der Schilddrüse ist eine kostengünstige und effiziente Methode um
strukturelle Veränderungen der Schilddrüse nachzuweisen. Es kommt ihr deshalb in
der Abklärung von Schilddrüsenknoten und etwas weniger bei entzündlichen
Schilddrüsenveränderungen grosse Bedeutung zu.
Benigne
Kolloidknoten
Thyreoiditis Hashimoto
Hämorrhagische oder simple Zyste
Follikuläres Adenom
Subakute Thyreoiditis de Quervain
Maligne
Primär
Follikelzellabkömmlinge
Papilläres Ca
Follikuläres Ca
Anaplastisches Schilddrüsen-Ca
C-Zell-Abkömmlinge
Medulläres Schilddrüsenkarzinom
Lymphom der Schilddrüse
Sekundär
Intrathyreoidale Metastasen
Tab 1: Ursachen von Schilddrüsenknoten:
080564_Inhalt.indd 36
23.5.2008 14:54:42 Uhr
35
St.n. Radiatio des Halses in Kindheit
Positive Familienanamnese für papilläres,
medulläres Schilddrüsenkarzinom oder MEN 2
Alter <20 oder >70
Männer
Grössenwachstum des Knotens
Zervikale Lymphadenopathie
Verminderte Verschieblichkeit
Parese des Nervus Recurrens
Tab 2: Risikofaktoren für Malignität
• Schlechte Indikationen
– Generelles Screening
– Niedriges Risiko für Schilddrüsenkarzinom und
normaler Schilddrüsenpalpation
• Gute Indikationen
– Palpabler Knoten
– St.n.Bestrahlung des Halses
– Positive Familienanamnese für papilläres SD-Ca,
medulläres SD-Ca, MEN2
– Unerklärte zervikale Lymphadenopathie
Tab 3: Indikationen der Schilddrüsensonographie
080564_Inhalt.indd 37
23.5.2008 14:54:45 Uhr
36
Literatur:
1) Baskin HJ: Ultrasound of thyroid nodules. In Baskin HJ, Editior: Thyroid ultrasound
and ultrasound-guided FNA biopsy. Bosaton: Kluwer Academic Publishers; 2000:7186
2) AACE/AME Task Force on Thyroid Nodules. Endocr Pract 2006;12:63-102
3) Hossein Gharib, Enrico Papini: Thyroid nodules: Clinical Importance, Assessment
and Treatment. Endocrinol Meta Clin N Am; 36:707-735
4) Del Rio P et al: The association between papillary carcinoma and chronic
lymphocytic thyroiditis. Minerva Endocrinol. 2008;33:1-5
5) Boi F et al: High prevalence of suspicious cytology in thyroid nodules associated
with positve thyreoid antibodies. Eur J Endocrinol. 2005; 153:637-42
6) Mishira et al: Thyroid nodules in Graves’ disease. J Postgrad Med. 2001;47:244-7
7) Majima et al: Anaplastic Carcinoma associated with Graves’ disease. Endocr.J.
2005; 52:551-7
080564_Inhalt.indd 38
23.5.2008 14:54:48 Uhr
37
Die Rolle der Nuklearmedizin
Einleitung
Die Nuklearmedizin befasst sich mit der medizinischen Anwendung von Radioisotopen am Patienten
aus diagnostischen und therapeutischen Gründen. Die Schilddrüsenstörungen gehören zu den ersten
Anwendungsgebieten der Nuklearmedizin mit Verwendung radioaktiven Jods zu therapeutischen
Zwecken bereits schon seit 1942. 131-Jod ermöglichte damals erstmals das Studium des Jodzyklus im
Körper unter grösster oder millionenfacher molarer Verdünnung ohne Störung der Physiologie durch
stoffwechselanaloges Verhalten wie beim stabilen 127-Jod. Heute ist die Schilddrüsenszintigraphie
zur funktionellen Erfassung der Schilddrüse bei Funktionsstörungen und die Radiojodtherapie der
Hyperthyreose und des differenzierten Schilddrüsencarcinoms zu einem bewährten
Routineverfahren geworden.
Radiophysik und Anwendungseignung verschiedener Isotopen
131-Jod als Reaktorprodukt steht täglich auf Anforderung zur Diagnostik und vor allem zur Therapie
zur Verfügung. Die Gammastrahlung dient zur Funktionsmessung und szintigraphischen Bildgebung,
modern spricht man heute von „molecular or functional imaging.“ Das Radiojod ist sowohl
spezifischer Stoffwechseltracer und Indikator für die Szintigraphie als auch durch die emittierten
Betateilchen therapeutisch wirksam. Die Betaenergie von 0.61 MeV mit einer mittleren Reichweite
von nur 0.5mm führt über den crossfire –Effekt und eine verhältnismässig lange Verweildauer zu
einer hohen Dosisleistung und damit zum Gewebeabbau bei Hyperthyreose und malignen
Schilddrüsentumoren in Verbindung mit grösstmöglicher Umgebungsschonung. Die lange
Halbwertszeit von 8.02 Tagen und die hohe Gammaenergie von 364 keV führten dazu, dass zur
alleinigen Szintigraphie und für das Radiojodstudium radiohygienisch das 123-Jod als reiner
Gammastrahler von 167 keV mit einer kurzen Halbwertszeit von 13 Stunden angewendet wird. Zur
schnellen Routinediagnostik findet allerdings heute das preisgünstige 99m Technetium-Pertechnetat
als Generatorpeluat mit einer idealen Gammaenergie von 140 keV und einer Halbwertszeit von nur 6
Stunden primäre Verwendung. Das Molekül wird in der Schilddrüse über den Na-Jodsymporter (NIS)
analog der Jodisation akkumuliert, aber schnell nach der Aufnahme wieder ausgewaschen, da die
Jodisation oder Verstoffwechselung nicht stattfinden kann, sodass nur eine Szintigraphie und initiale
Aufnahmemessung möglich ist.
Die Szintigraphie der Schilddrüse und des Ganzkörpers
Die funktionelle Abbildung der Schilddrüse ist indiziert bei Funktionsstörungen, vornehmlich bei
erniedrigtem TSH bei Verdacht auf autonome Schilddrüsenfunktion, prätherapeutisch kombinierbar
mit einem Radiojodstudium. Die Untersuchungsdaten dienen dabei gleichzeitig der Dosimetrie zur
Radiojodtherapie. Bei supprimiertem TSH findet sich sporadisch eine Thyreoiditis mit typisch
fehlender Aufnahme bei Ausschüttungshyperthyreose im akuten Stadium. Bei Morbus Basedow mit
entsprechendem klinisch typischem Bild und positivem TRAK-Test genügt der Ultraschall zur initialen
Diagnostik vor Thyreostase oder Operation.
Im Einzelfall eignet sich 123-Jod und va. 131-Jod zur Erfassung extrahyroidalen Schilddrüsengewebes.
080564_Inhalt.indd 39
23.5.2008 14:54:51 Uhr
38
Bei der Struma multinodosa kann die Szintigraphie Informationen liefern in der Suche kalter Knoten
mit Funktionsdefekt in Kombination mit dem Ultraschall mit echoarmen Knoten zur Wahl geeigneter
nodöser Veränderungen für die Feinnadelpunktion.
Beim
differenzierten
Jod
speichernden
Karzinom
wird
posttherapeutisch
die
Ganzkörpersszintigraphie mit 131-Jod in Kombination meist mit der Emissionstomographie
angewendet zur Erfassung der Speicherfähigkeit und Lokalisation des Tumorgewebes. Bei gesicherter
Annahme von Rest- oder Rezidivtumor bei erhöhtem Thyreoglobulin oder positivem
Ultraschallbefund mit FNP der Halslymphknoten kann auf das prätherapeutische Szintigramm
verzichtet werden, da der posttherapeutische Scan mit der hohen Restaktivität bessere Bilder liefert
und in jedem Fall die Therapie vorzusehen ist. Auch das diskutierte Stunning des Tumors durch eine
niedrig dosierte prätherapeutische diagnostische Radiojodabgabe kann so vermieden werden nebst
besserem Patientenkomfort bei direkter Applikation der metabolischen Radiojodtherapie.
Radiodtherapie, Dosisberechnung
Die Therapie mit 131-Jod wird heute einfach peroral in Kapselform durchgeführt, die besondere
Eleganz des Verfahrens liegt im Umstand begründet, dass nur Schilddrüsenzellen Jod oder Radiojodid
aufnehmen können. Bei den benignen Indikationen darf in der Schweiz bis 200 MBq Aktivität
ambulant therapiert werden, oft praktikabel beim Morbus Basedow und sehr kleinvolumigen
Autonomien. Grösservolumige Autonomie oder Morbus Basedow erfordern eine Hospitalisation bei
400 MBq von mindestens 48 Stunden, bei höheren Aktivitäten länger und bis zum Abfall zur
Schwellendosisleistung auf 5uSv/h in 1 m Abstand, eine Fraktionierung in mehrere ambulante
Einzeldosen ist aus Strahlenschutz- und –biologischen Gründen unzulässig. Die Strahlungsintensität
wird täglich im Isotopentherapie-Einzelzimmer anlässlich der Visite gemessen. Während der
Hospitalisation besteht die Anweisung zur Hydrierung, sodass bei erhöhter Trinkmenge das freie
Jodid vorwiegend renal ausgeschieden werden kann. Der Speicheldrüsenschutz erfolgt mit
angesäuerten Getränken oder Zitronensaft. Die pflegerischen Massnahmen reduzieren sich auf das
notwendige Minimum. Schwangerschaft und Stillzeit sind die Kontraindikationen. Für die
Radiojodtherapie gibt es keine Altersgrenzen. Aus dem Grundsatz der Notwendigkeit und
Rechtfertigung und aus Gründen der richtig dosierten rationalen Therapie ist zur Dosisberechnung
ein Szintigramm mit Radiojodstudium erforderlich, abgekürzt möglich auch nur ein quantitatives
Pertechnetatszintigramm aus Kostengründen zur Abschätzung der geeigneten Aktivität aufgrund der
patientenspezifischen Parameter. Dieses Vorgehen ist in Deutschland aus Qualitätsgründen in der
Richtlinie für den „Strahlenschutz in der Medizin“ vorgeschrieben.
Die Therapieaktivität MBq 131-J errechnet sich aus der Marinelli-Formel nach dem Zielvolumen, der
angestrebten Energie-Herddosis, der Aufnahme und der Verweildauer des Isotops und einer
Konstanten:
SD-Volumen (ml) * Herddosis (Gy) * K
Aktivität (MBq) = -----------------------------------------------------max. uptake in % * eff. HWZ (h)
080564_Inhalt.indd 40
23.5.2008 14:54:54 Uhr
39
Der Wirkungseintritt erfolgt nach etwa 6 Wochen, da es nach der absorbierten Strahlenenergie
verzögert zur Apoptose und zum Gewebeabbau kommt mit entsprechendem Abfall der
Hormonspiegel.
Die Radiojodtherapie bei Morbus Basedow
Die Radiojodresektion der Hyperthyreose kann dosissparend mit der Intention Organerhaltung
funktionsoptimiert konservativ schonend erfolgen mit dem Risiko einer Zweittherapie einer
Resthyerthyreose, die Zieldosis beträgt 150 Gy. Dieses Prozedere kann zu prolongierten
Nachkontrollen und fortgesetzter thyreostatischer Therapie führen bis zum Erreichen der Euthyreose
oder Hypothyreose zu 50%, Eignung bei niedrigem Rezidivrisiko. Bei nicht vergrössertem Organ ist
bei diesem Konzept eine ambulante Therapie mit 200 MBq 131-Jod meistens genügend und
unübertroffen kostengünstig. Das ablative Dosiskonzept setzt sich mit der einmaligen Ersttherapie
die kalkulierte substitutionsbedürftige Hypothyreose (>90%) zum Ziel. Dieses Dosiskonzept ist einfach
und erfolgreich, die Dosis liegt volumenadaptiert mit 20 gr. SD-Gewicht bei 200 Gy, mit 25-40 gr. bei
250 Gy, sonst 300 Gy bei grösseren Schilddrüsen, allerdings verlängert sich dabei zusehends die
stationäre Aufenthaltszeit. Bei endokriner Orbitopathie und vor allem bei grösseren Strumen ist mit
dem Risiko einer Ankurbelung des autoimmunen Prozesses durch Abbauprodukte zu rechnen, sodass
nach Ermessen ein kurzdauernder Steroidstoss empfohlen wird im Anschluss an die Radiojodgabe.
Eine Thyreostatikabehandlung kann im Bedarfsfall niedrig dosiert auch über die Therapiephase
belassen werden bis zum Wirkungseintritt.
Die Radiojodtherapie bei der Autonomie
Bei der dekompensierten nodösen Autonomie sowohl in Form der einzelnen Adenome oder
plurifokalen Autonomie erfolgt die Radiojodelimination selektiv unter Schonung des supprimierten
regelbaren Restgewebes. In Abhängigkeit der genügenden Kapazität der Restschilddrüse kommt es
posttherapeutisch bei nicht zu hohem Anteil autonomen Gewebes an der Schilddrüse nicht zu einer
Hypothyreose (10-20%). Dies trotz der hochdosierten Therapie mit 400 Gy auf das autonome
Volumen, da das supprimierte Gewebe praktisch ohne Jodaufnahme nicht nennenswert geschädigt
wird. Beim Eliminationseffekt nach knapp 2 Monaten ist eine laborchemische passagere
Unterfunktion die Regel, da im Rahmen der thyreotropen Stimulation nach Wegfall der Autonomie
die Restschilddrüse erst wieder rekompensieren muss.
Bei der disseminierten Autonomie mit negativem TRAK als Abgrenzung zum Basedow wird das
Volumen aus den Aufnahmewerten abgeschätzt und könnte durch ein Suppressionsszintigramm mit
Schilddrüsenhormon bei Grenzwerthyperthyreosen genauer erfasst werden. Bei der Frage nach
Notwendigkeit der quasi prophylaktischen Therapie eines szintigraphisch kompensierten autonomen
Adenomes oder auch gar einer latenten Hyperthyreose folgt die Indikation der klinischen
Therapieerwartung. Oft handelt es sich dafür sprechend um Altershyperthyreosen mit dem Problem
des Vorhofflimmerns, der Osteoporosegefährdung und dementieller Entwicklung. In jedem Fall muss
bei der kompensierten Autonomie während der Therapiegabe eine Schilddrüsenhomonsuppression
des Restgewebes stattfinden.
In seltenen Fällen tritt posttherapeutisch eine Autoimmunisierung durch die Therapie oder
begleitend eine Autoimmunhyperthyreose auf, das Marine-Lenhart Syndrom, beschrieben 1911. Die
Behandlung erfolgt entsprechend einem Basedow.
080564_Inhalt.indd 41
23.5.2008 14:54:57 Uhr
40
Welche Therapie bei Hyperthyreose ?
Unter Berücksichtigung des Patientenwunsches und der Befürchtungen bezüglich der Strahlung bei
Radiojod, der Risiken von Narkose und Operation und der Agranulozytose bei Thyreostase gibt es
zusätzliche Entscheidungskriterien:
Pro Radiojod
Schilddrüsenvolumen bei Basedow unter 60 ml, Autonomie bei Struma unter 100 ml
Kein Malignomverdacht
Erhöhtes Operationsrisiko, Voroperationen, Recurrensparese bei Rezidiv auf beiden Seiten oder auf
der Gegenseite, transienter Hypoparathyreoidismus nach Erstoperation
Persistenz der Hyperthyreose Basedow über 6-12 Monate unter Thyreostase oder Rezidiv
Selektive Ausschaltung multifokaler Autonomie
Pro Operation
Nicht Zutreffen obiger Kriterien
Kompressionssymptome , Notwendigkeit eines sofortigen Therapieeffektes
Persistenz der Hyperthyreose Basedow über 6-12 Monate unter medikamentöser Therapie oder
Rezidiv.
Prozess zur Histologiegewinnung
Pro Thyreostase
Morbus Basedow vorwiegend mit geringem Rezidivrisiko (weibliches Geschlecht, Alter unter 40
Jahren, Schilddrüsenvolumen unter 40 ml, TRAK unter 10 U/l)
Relevante Begleiterkrankungen oder Umstände, die gegen eine Operation oder Radiojodtherapie
sprechen.
Radiojodresektion der euthyreoten Struma
Alternativ kann bei lokaler oder allgemeiner Inoperabilität erfolgreich die Radiojodresektion mit 150
Gy zur Volumenreduktion in Erwägung gezogen werden. Diese stationäre Therapie erfordert zur
Optimierung der Aufnahme und der Wirkung eine thyreotrope Stimulation mit rekombinantem TSH.
Bei Trachealkompression durch die Struma ist nach Therapie die Gabe von Steroiden bei
Radiothyreoiditis möglich.
Die metabolische Radiojodtherapie beim Schilddrüsencarcinom
Die Radiojodtherapie findet ihre Anwendung beim differenzierten Schilddrüsencarcinom einerseits in
der postoperativen Elimination von Restgewebe zur Erzielung der völligen Athyreose und
080564_Inhalt.indd 42
23.5.2008 14:55:00 Uhr
41
andererseits in der Metastasentherapie. Die Restschilddrüsenablation erfolgt unter prolongierter
Hypothyreose mit endogener TSH-Stimulation oder idealerweise unter Thyroxinsubstitution mit je
zwei Injektionen von 0.9 mg rekombinantem TSH (Thyrogen) am 1. und 2. Tag und der Radiojodgabe
am 3. Tag stationär. Die Thyrogenstimulation ohne Desubstitution ist mit uneingeschränktem
Patientenkomfort verbunden und sichert eine optimale Radiojodaufnahme und auch schnellere
Elimination unter euthyreoten Stoffwechselverhältnissen. Die Therapie kann individuell dosiert in
Abhängigkeit der Ausdehnung des Restgewebes oder mit Standarddosen von 3.7 GBq oder nur 1.1
GBq bei der low risk Gruppe erfolgen.
Die Therapie basiert auf folgenden Annahmen:
1. Elimination von mikroskopischen Tumorfoci im Restgewebe und Senkung der Rezidivrate und
möglicherweise der Mortalitätsrate.
2. Die erzielte völlige Athyreose ermöglicht die frühe Erkennung von Rezidiven, basiert auf den
Thyreoglobulinbestimmungen und ev. 131-Jodscan.
3. Die hohe Aktivität ermöglicht einen sensitiven Scan mit der Therapiedosis zum Ausschluss
unerkannter Tumormanifestationen.
-Sichere Indikation: high risk / Resttumor oder Metastasen, oder Kapselüberschreitung oder
Lymphknotenbefall
-Mögliche Indikation: low risk / ungünstige Histologie, T1 über 1 cm, T1 multifokal, unvollständige
Thyreoidektomie, keine Lymphknotendissektion, Alter unter 18 und über 45 Jahren.
-Keine Indikation: very low risk / unilokulärer Tumor unter 1cm und mit günstiger Histologie.
Die Rezidiv- und Metastasentherapie führt in zwei Drittel zur Remission bei lokoregionärem
Lymphknotenrezidiv und in einem Drittel bei Fernmetastasen. Die Isotopentherapie wird
insbesondere mit dem posttherapeutischen Scan soweit möglich mit der Chirurgie besonders beim
Lymphknoten- und Knochenbefall kombiniert, es lassen sich so die besten Resultate erzielen. Bei
fehlender Metastasenspeicherung oder erhöhtem und ansteigendem Thyreoglobulin und negativem
131-Jod-Scan soll keine weitere therapeutische Jodgabe erfolgen. Die wiederholbaren Einzeldosen
von 7.4-8.0 GBq können kumuliert werden bis 22 GBq, innerhalb dessen die meisten Remissionen mit
negativem Scan und nicht nachweisbarem TG erreicht werden. Bei persistierendem Tumor gibt es für
den Patienten kein maximales Dosislimit, weitere Radiojodtherapien richten sich individuell nach der
Therapieerwartung und insbesondere nach der Knochenmarksreserve unter Berücksichtigung des
erhöhten Risikos für Leukämie und Blasencarcinom ab 22-26 GBq. Die perkutane Radiotherapie
findet Anwendung bei inoperablem persistierendem cervicomediastinalem Tumor, bei Knochen- und
Hirnmetastasen. Die cytotoxische Chemotherapie kommt lediglich zum Einsatz bei unkontrolliert
progressivem Leiden aus palliativen Gründen. Die Therapie mit Doxorubicin-Cisplatin scheint bei
erhöhtem TSH besser zu wirken. Aktuell werden erfolgversprechender Angiogenese-Inhibitoren wie
Thalidomid, Lenalidomid, sowie der VEGF-Rezeptorhemmer Axitinib in Phase 2-Studien untersucht.
Therapiekosten
Bei den benignen Indikationen ist die ambulante Radiojodtherapie beim Morbus Basedow am
effektivsten und billigsten mit 500.- bis 600.- Franken nach TARMED abgerechnet.
080564_Inhalt.indd 43
23.5.2008 14:55:03 Uhr
42
Beim stationären Vorgehen liegen die Kosten für den Versicherer bei 2200.- bis 3400.- Franken in der
Grundversicherung, sich zusammensetzend aus maximal möglicher Aktivität von 7.4 GBq zu Fr.
1144.-, Aufenthaltspauschale 1606.- und Tagespauschale Fr. 636.-, für den Chirurgiepatienten
vergleichbar.
Die engeren Betriebskosten einer Strumaoperation (DRG 290 mit der Hauptdiagnose E04) liegen
schon 2005 über 8000.- Franken unter Berücksichtigung der Inanspruchnahme der
Infrastrukturkosten der Operation, Anästhesie und Pflege.
Bei der Thyreostase müssen die erheblichen Kosten einer prolongierten Behandlung mit
wiederholten Konsultationen und Laborkosten summiert und mit dem ablativen Vorgehen der
Chirurgie oder Nuklearmedizin verglichen werden.
Nebenwirkungen und Risiko
Die Radiojodtherapie bei benignen Erkrankungen führt beim ablativen Dosiskonzept zur
beabsichtigten Hypothyreose, sonst nur sporadisch. Selten ist die Immunthyreopathie nach
Autonomie oder Aggravation einer endokrinen Orbitopathie und einer Sialadenitis oder manifesten
Radiothyreoiditis. Es besteht kein erhöhtes somatisches oder genetisches Risiko, dieses liegt
theoretisch bei 0.01 bis 0.05%.
Bei den radiojodtherapierten malignen Erkrankungen besteht dagegen ein erhöhtes Risiko für
somatische Mutationen mit Leukämie und Zweittumoren ab kumulativen Dosen über 22 GBq.
Bleibende Defekte deterministischer Art mit Schwellendosis nach wiederholten metabolischen
Radiojodgaben können eine Xerostomie sein , verfrühte Menopause, ebenfalls Hypospermie und
Lungenfibrose nach diffuser Lungenmetastasierung, allenfalls Knochenmarksinsuffizienz. Sporadisch
transient möglich Radiothyreoiditis bei grossen Restschilddrüsen und Sialadenitis und
Geschmackstörungen, Nausea bei Gastritis.
Wegen der stochastischen Zufallsrisiken der Mutation ist Spermienbanking empfehlenswert oder
keine Konzeption während mindestens 4 Monate, entsprechend der Spermienlebensdauer. Bei
Frauen Antikonzeption für mindestens 6 Monate, Abortrate innert 6-12 Monaten noch leicht erhöht.
Bei Kinderwunsch muss die Prognose des Leidens mitberücksichtigt werden.
18 F-FDG-Positronenemissionstomographie
Seit August 2006 gibt es eine kassenpflichtige Indikation für PET beim Jod-131-Stoffwechselnegativen Schilddrüsenkarzinom zum Restaging und Rezidivdiagnostik extrapulmonaler Läsionen im
Hinblick auf eine vorwiegend präoperative Abklärung. Die Untersuchung ist sensitiver bei erhöhtem
TSH. Die Prognose der nicht Jod speichernden und FDG-positiven Tumoren ist ungünstiger. Die
Kombination von 131-Jod-Scan und PET ergeben die höchste Sensitivität durch vorwiegend
alternierenden Uptake.
080564_Inhalt.indd 44
23.5.2008 14:55:06 Uhr
43
Literatur
Joseph G. Hamilton and Mayo H. Soley: Studies in iodine metabolism by the use of a new
radioactive isotope of iodine, Am J Physiol Legacy Content, Sept 1939; 127: 557-572
Society of nuclear medicine procedure guidelines for thyroid scintigraphy, February 7,1999
DGN, Dietlein M. et al, Leitlinie zur Schilddrüsendiagnostik
Bell E., Grünwald F., Radiojodtherapie bei benignen und malignen Schilddrüsenerkrankungen.
Springer 1999, Berlin
EANM Procedure guidelines for therapy with iodine-131, 14.2.2002
Marinelli LD, Dosage determination with radioactive isotopes. Am J Röntgenol 1948; 59: 260 - 281
Radiojodtherapie bei benignen Schilddrüsenerkrankungen, Leitlinien Nuklearmedizin AWMF 2004
online,
www. uni-duesseldorf.de
DGN, Dietlein M. et al, Leitlinie zur Radiojodtherapie bei benignen Schilddrüsenerkrankungen 2007
Therapeutische Konzepte der Radiojodtherapie bei der Autoimmunhyperthyreose vom Typ Morbus
Basedow,
2005 online, www.publikationen.ub.uni-frankfurt.de
Nygaard B. e.a., : Radioiodine treatment of multinodular non-toxic goitre, BMJ,1993;307:828-832
European consensus for the management of patients with differentiated thyroid carcinoma of the
follicular epithelium. European Journal of Endocrinology (2006) 154, 787-803, ISSN 0804-4643
Society of Nuclear Medicine Procedure Guideline for Scintigraphy for differentiates Papillary and
Follicular Thyroid Cancer. www:snm
Richtlinie „Strahlenschutz in der Medizin“, zur StrlSchV, www.bmu.de/strahlenschutz
Schweizerische Eidgenossenschaft, Bundesamt für Gesundheit, Weisungen, www.str-rad.ch.
Weisung L-04-01 Therapeutische Applikation von 131-Jod, L-07-03 Abschirmungen für 131-JodTherapie-Patientenzimmer.
F.Pacini et al., Radioiodine Ablation of thyroid remnants after preparation with human thyreotropin
in differentiated thyroid carcinoma: results of an international, randomized, controlled study. The
Journal of Clinical Endocrinology and Metabolism 91: 926-932 ,2006
080564_Inhalt.indd 45
23.5.2008 14:55:09 Uhr
44
Amiodarone und die Schilddrüse:
Amiodarone ist ein in der Kardiologie gern verwendetes Klasse-III-Antiarrhythmikum.
Leider kann es aber neben seinen positiven Wirkungen am Herzen auch diverse
Nebenwirkungen an anderen Organen aufweisen. Von endokrinologischer Seite fallen hier
vor allem die Wirkungen auf die Schilddrüse ins Gewicht.
Eine Störung des Schilddrüsenstoffwechsels durch Amiodarone kommt einerseits durch eine
spezifische Wirkung des Amiodaronemoleküls andererseits einfach durch die grosse
enthaltene Jodmenge zustande. Bei einer Tagesdosis von 600 mg Cordarone beträgt die
aufgenommene Jodmenge etwa 9 mg. Dies entspricht einem mehrfachen der normalen
Tagesmenge. Auf Grund der Lipophilität wird Amiodarone ausserdem im Fett- und
Muskelgewebe eingelagert, was zu einer extrem langen Halbwertszeit von ca. 100 Tagen
führt.
Physiologie der Schilddrüse:
Die Schilddrüse produziert auf Stimulation der Hypophyse mittels TSH hauptsächlich T4
(Thyroxin) und kleine Mengen T3 (Trijodthyronin). Das T4 ist aber nur gering aktiv. Das
eigentlich aktive Schilddrüsenhormon ist T3 welches in den Zielorganen, hauptsächlich der
Leber, in T3 umgewandelt wird. Diese Umwandlung erfolgt durch unterschiedliche
Dejodinasen. Je nach entferntem Jodatom entsteht entweder T3 bei Entfernung eines
Jodatoms am äusseren Phenylring, oder reverses T3 bei Entfernung eines Iodatoms am
inneren Tyrosinring. Zur Bildung des aktiven T3 ist die 5’-Deiodinase nötig.
080564_Inhalt.indd 46
23.5.2008 14:55:12 Uhr
45
Reguläre Wirkungen des Amiodaron auf die Schilddrüse:
Amiodaron hemmt die 5’-Deiodinase und führt damit zu einem Abfall von T3 und einer
Zunahme von reversem T3 und durch Rückstau auch des T4. Daneben wird auch die
Aufnahme von T4 in die Zelle und die Bindung von T3 an den Zellkern gehemmt. In der
Kardiologie wird diese Steigerung des rT3-Spiegels zur Dosiskontrolle verwendet. Bei
korrekter Dosierung steigt rT3 auf das doppelte bis dreifache der Norm an. Werte des fünfbis sechsfachen der Norm liegen im toxischen Bereich und können zu plötzlichem Herztod
und anderen Komplikationen führen.
Zu Beginn der Therapie kann es vorübergehend zu einem TSH-Anstieg kommen, im Verlauf
normalisiert sich das TSH in den meisten Fällen. Sowohl leicht erhöhte wie erniedrigte TSHWerte können aber auch ohne eigentliche Schilddrüsenstörung vorkommen, so dass das
TSH als Beobachtungsparameter relativ ungeeignet ist. Das T4 steigt an und bleibt unter
Therapie im oberen Normbereich oder leicht erhöht. Die Aussagekraft ist damit auf
erniedrigte Werte bei amiodaroeninduzierter Hypothyreose beschränkt. Das T3 sinkt ab
Therapiebeginn in den unteren Normbereich und ist damit bei einem Anstieg der beste
Marker für eine amiodaron-induzierte Hyperthyreose während das rT3 nur zur obgenannten
Dosiskontrolle herangezogen werden kann.
Vor einer Amiodarontherapie sollte ein vorbestehendes Schilddrüsenleiden gesucht werden.
Neben TSH, fT4 und fT3 sollten auch die Anti-TPO- und ev. TRAK bestimmt werden. Bei
positiven TPO-Antikörpern besteht ein erhöhtes Risiko für Hypothyreose, bei positiven TRAK
für einer Typ1-Hyperthyreose. Auch eine Struma sollte mindestens manuell oder mit
Ultraschall gesucht werden. Bei knotiger oder grösserer diffuser Struma ist das Risiko für
eine Typ1-Hyperthreose erhöht.
Unter Therapie empfiehlt es sich, alle 3-6 Monate die Hormonwerte zu wiederholen.
Komplikationen von Amiodaron an der Schilddrüse:
Im Gegensatz zu den Komplikationen an anderen Organen scheinen diese an der
Schilddrüse dosisunabhängig aufzutreten. Es kommen sowohl eine amiodaroneinduzierte
Hypothyreose wie eine Hyperthyreose vor. Die relative und absolute Häufigkeit hängen vor
allem von der Jodversorgung der Region ab. Eine gute Jodversorgung führt zu einer
Abnahme der Hyperthyreosen hingegen zu einer Zunahme der Hypothyreosen durch
Amiodarone. In einer Studie von Martino von 1984 wurde die Inzidenz in Pisa in der
Toskana, einer Region mit Jodmangel, mit der Inzidenz in Worcester, Massachusetts, einer
Region mit guter Jodversorgung, verglichen. Die Häufigkeit der Hypothyreose betrug in Pisa
5%, in Massachusetts hingegen 22%, die Hyperthyreose in Pisa hingegen 10% und in
Massachusetts nur 2%.
Für die Entstehung der Dysfunktion wird eine Störung im Wolff-Chaikoff-Effekt postuliert.
Normalerweise wird bei Aufnahme grosser Jodmengen die Syntheseleistung der Schilddrüse
vorübergehend heruntergefahren. Diesen sogenannten Wolff-Chaikoff-Effekt macht man sich
bei der Plummerung hyperthyreoter Patienten beispielsweise vor chirurgischen Eingriffen zu
Nutze. Nach einigen Tagen erholt sich die Syntheseleistung spontan.
Bei der amiodaron-induzierten Hyperthyreose Typ 1 ist diese Downregulation der Synthese
gestört. Verantwortlich dafür sind vorbestehende Schilddrüsenerkrankungen wie Autonomie,
M. Basedow o.ä.
Bei der amiodaron-induzierten Hypothyreose ist hingegen die Wiederaufnahme der
Syntheseleistung nach der Downregulation gestört. Hier wird eine vorbestehende
Dysthyreose vom Typ Hashimoto vermutet.
Die dritte Form der Schilddrüsenkomplikationen ist die Hyperthyreose Typ 2. Ursächlich ist
hier ein direkter toxischer Effekt mit Zelldestruktion.
080564_Inhalt.indd 47
23.5.2008 14:55:15 Uhr
46
Amiodaron-induzierte Hypothyreose:
In Regionen mit guter Jodversorgung liegt die Häufigkeit bei ca. 20% der mit Amiodaron
behandelten Patienten. Die Hypothyreose zeigt eine Präferenz für ältere Patienten und ist
etwas häufiger bei Frauen als bei Männern. Bei vorbestehend erhöhten Anti-TPOAntikörpern ist das Risiko deutlich erhöht. Die Klinik unterscheidet sich nicht von der
herkömmlichen Hypothyreose ohne Amiodaron. Wichtigster diagnostischer Faktor ist ein
erniedrigtes oder tief normales fT4, da dieses unter Amiodarone normalerweise hoch normal
ist. Das TSH ist nur bei deutlich erhöhten Werten diagnostisch. Die Therapie gestaltet sich
unkompliziert mit T4-Präparaten. Ein Absetzen des Amiodarone ist nicht nötig. In Fällen in
denen Amiodarone abgesetzt wurde erholte sich allerdings die Schilddrüsenfunktion in den
meisten Fällen innert einiger Monate.
Amiodaron-induzierte Hyperthyreose (Amiodaroninduzierte Thyreotoxikose = AIT) :
Die Häufigkeit ist in Regionen guter Jodversorgung recht niedrig und liegt um 1%. Es werden
zwei Formen unterschieden; Typ 1 und Typ 2. Beiden gemeinsam ist ein Auftreten erst im
Verlauf, nach Monaten bis Jahren Therapie, teils sogar nach bereits erfolgtem Absetzen des
Medikaments. Die Klinik ist im Vergleich zur spontanen Hyperthyreose abgeschwächt auf
Grund der kardialen Wirkung des Amiodarone. Leitsymptome sind Gewichtsverlust,
Durchfall, Nervosität und Angstzustände. Zur Diagnostik eignet sich vor allem das T3,
welches normalerweise unter Amiodarone im unteren Normbereich ist. Hoch normale Werte
sind verdächtig, erhöhte Werte beweisend. Das T4 ist hingegen auch normalerweise unter
Amiodarone leicht erhöht. Als pathologisch können hier nur deutlich erhöhte Werte gelten.
Ähnlich verhält es sich auch mit dem TSH. Ein supprimiertes TSH ist nur im Zusammenhang
mit den peripheren Werten aussagekräftig, es kann unter Amiodarone auch ohne
Hyperthyreose bis 0 reduziert sein.
- AIT Typ 1:
Die Amiodaroninduzierten Thyreotoxikose (AIT) Typ 1 tritt nur bei vorgeschädigter
Schilddrüse auf. Diese führt zu einem Versagen des Wolff-Chaikoff-Effekts. Durch die
grossen in Amiodarone enthaltenen Jodmengen kommt es zu einer vermehrten
Syntheseleistung. Teils führt dies dazu, dass trotz der grossen Jodmengen weiterhin eine
normale oder sogar gesteigerte Jodaufnahme in der Szintigraphie nachweisbar ist. In den
meisten Fällen kommt es aber wie generell unter Amiodarone zu einer Übersättigung mit
Erliegen der Jodaufnahme in die Schilddrüse. Sonographisch findet sich im Doppler eine
vermehrte Perfusion als Ausdruck der gesteigerten Syntheseleistung. Zur Unterscheidung
vom Typ 2 kann unter Umständen Interleukin-6 als Marker der Zelldestruktion herangezogen
werden. Auf Grund der Ätiologie ohne Zellzerstörung ist das Il-6 typischerweise normal oder
nur leicht erhöht.
- AIT Typ 2:
Die AIT Typ 2 tritt in gesunden Schilddrüsen ohne prädisponierende Schädigung auf. Sie
entsteht durch eine direkte toxische Wirkung des Amiodarone auf die Schilddrüsenzellen.
Durch Zelldestruktion kommt es zu vermehrter Freisetzung gespeicherter Hormone in die
Zirkulation. Die Jodaufnahme ist dementsprechend reduziert, die Durchblutung nicht
gesteigert. Typisch sind deutlich erhöhte Interleukin-6-Spiegel. Im Verlauf kann es
längerfristig zum Übergang in eine Hypothyreose kommen.
In Regionen mit Jodmangel nimmt die Häufigkeit der AIT Typ 1 zu. Bei guter Jodversorgung
ist der Grossteil der AIT vom Typ 2.
080564_Inhalt.indd 48
23.5.2008 14:55:18 Uhr
47
Die Unterscheidung ist nicht immer möglich. Einerseits auf Grund relativ häufiger
Mischformen, andererseits wegen schwierigen Diagnosekriterien. Eine vorhandene oder
gesteigerte Jodaufnahme beweist praktisch den Typ, ist aber nur selten vorhanden. Eine
fehlende Aufnahme hilft hingegen zur Unterscheidung nicht weiter. Die Perfusion zeigte
prospektiv bei Verlaufsstudien eine gute Differenzierung aber ist stark untersucherabhängig
und in der Momentaufnahme schlechter zu beurteilen. Das Interleukin-6 hilft vor allem bei
stark erhöhten Spiegeln, während leicht erhöhte Werte kaum Aussagekraft haben.
Entsprechend findet sich in der Literatur nur in einem Teil der Studien eine gute
Aussagekraft des Il-6. Zusätzlich in Betracht gezogen werden sollten die für Typ-1 nötigen
prädisponierenden Faktoren. Bei Struma nodosa oder grösserer Struma diffusa ebenso wie
bei positiven TRAK ist von einem Typ 1 auszugehen.
Therapie der Amiodaron-induzierten Hyperthyreose:
Sofern die Unterscheidung von Typ 1 und 2 klar ist, erfolgt die Therapie unterschiedlich.
Beim Typ 1 mit gesteigerter Hormonsynthese kommen Thyreostatika zum Einsatz. Allerdings
ist die Wirksamkeit durch das Amiodarone stark reduziert so dass hoch dosiert werden
muss. Bevorzugt zu verwenden ist Propylthiouracil, da dieses gleichzeitig auch die
Konversion von T4 zu T3 hemmt. Im allgemeinen sind Dosen von 600mg-800mg PTU nötig.
Trotzdem ist eine reine Thyreostatikatherapie oft ungenügend. Zusätzlich kann mit NaPerchlorat (Irenat) die Jodaufnahme in die Schilddrüse gehemmt werden. Unter dieser
Kombination kann meist innert 2-6 Wochen eine Euthyreose erzielt werden. Allerdings hat
Na-Perchlorat vor allem in höherer Dosierung und bei längerer Gabe ein Risiko für
Agranulozytose, aplastische Anämie und nephrotisches Syndrom. Es sollte daher mit
Bedacht eingesetzt und nach spätestens 6 Wochen abgesetzt und die Tagesdosis von 1 g
nicht überschritten werden.
Beim Typ 2 sind Thyreostatika auf Grund der fehlenden Hormonsynthese ineffizient. Hier
erfolgt die Therapie mit Kortikosteroiden. Neben der antiinflammatorischen Wirkung hemmen
diese auch die 5’-Deiodinase und führen damit zu einer Reduktion des T3. Die Dosierung
liegt bei zwischen 15-80mg, initial meist 40-60mg/die.
Bei unklarem Typ oder Mischformen kann kombiniert werden mit beispielsweise 40 mg
Prednison und 400 mg PTU täglich.
Da die Radioiodtherapie auf Grund der gestörten Jodaufnahme in den meisten Fällen
unmöglich ist, ist die Operation bei fehlendem Ansprechen die Ultima ratio Sie stellt
allerdings, vor allem bei weiterhin florider Hyperthyreose und kardial vorbelastetem
Patienten, ein Risikoeingriff dar.
Für ein Ausheilen der AIT ist ein Absetzen des Amiodaron nötig. Die medikamentöse
Kontrolle der Hyperthyreose bei Fortführen der Medikation gelingt nur schwer. Allerdings ist
mit einer Besserung der Ansprechens auf Thyreostatika erst nach einigen Monaten zu
rechnen. Kurzfristig kann es zu einer Verschlechterung der kardialen Situation kommen.
Neben der initial beim Einsetzen gewünschten Wirkung des Amiodarone hat dieses auch
einen paradoxen kardioprotektiven Effekt bezüglich der Hyperthyreose, welcher beim
Absetzen verloren geht.
080564_Inhalt.indd 49
23.5.2008 14:55:21 Uhr
48
Selen und die Schilddrüse
K.Scheidegger, Endokrinologie/Diabetologie FMH, St.Gallen
Einleitung
Selen wurde bereits 1817 vom schwedischen Chemiker Brezelius entdeckt. Wegen
seiner bekannten Toxizität in hohen Dosen war es in der medizinischen Forschung
aber lange Zeit wenig attraktiv. Erst 1957 wurde es als essentielles Spurenelement
anerkannt. In den letzten rund 30 Jahren entwickelte sich ein reges Interesse an
diesem Halbmetall. Am 13.Winterthurer Fortbildungskurs über Spurenelemente
bezeichnete Prof. Truniger Selen als „möglicherweise bedeutsames prophylaktisches
und/oder therapeutisches Prinzip bei verschiedensten Krankheiten und
Schädigungen, vor allem aber in Zusammenhang mit Krebs und Karzinogenese“.
Grundsätzliches zu Selen
Selen kommt in sehr unterschiedlicher Konzentration ubiquitär im Boden vor. In
Nordamerika (USA und Kanada) findet man vielerorts eine hohe Konzentration.
Selenmangel mit seinen entsprechenden Folgen kommt dort kaum vor. Am anderen
Ende des Spektrums liegt China, wo sogar spezifische durch Selenmangel bedingte
Krankheiten auftreten können. Europa liegt – mit grösseren geologischen/
geografischen Unterschieden – zwischen den Extremen. Die Schweiz gehört zwar
nicht zu den eigentlichen Selen-Mangelgebieten. Es stellt sich aber auch in unserem
Land die Frage, ob in gewissen Situationen eine (zusätzliche) Selen-Supplementation sinnvoll sein könnte. Die ausserordentlich stark unterschiedliche Selenversorgung in verschiedenen Ländern erschwert die Interpretation medizinischer
Studien sehr.
Hauptsächliche Selenquellen für den Menschen sind „Meerfrüchte“ (Hummer,
Crevetten, Austern), Lachs und Kabeljau, Innereien bzw. – je nach Tierfütterung –
generell Fleisch. Beim Getreide, insbesondere Weizen, gegessen hauptsächlich als
Brot oder Teigwaren, spielt die Herkunft eine ausgeprägte Rolle. Paranüsse sind
zwar sehr selenreich, ihr Verzehr ist in der Regel aber limitiert. Wichtigste chemische
Form ist das Selenomethionin. Die recommended dietary allowance (RDA) für Selen
wird unterschiedlich angegeben. Sie liegt in etwa bei (knapp) 1 ȝg / kg Körpergewicht / Tag. Der upper recommended level (URL) ist bei etwa 400 ȝg / Tag
festgelegt, der upper tolerable level (UTL) bei etwa 800 ȝg / Tag. Die für eine
optimale Selenversorgung nötige Zufuhr liegt also nur um den Faktor 8 – 10 unter
der Toxizitätsgrenze.
Biologische Bedeutung von Selen
Selen ist essentiell für die Synthese von Selenocystein, dem zentralen Bestandteil
der Selenoproteine, von denen bis heute ca. 35 entdeckt wurden. Wichtigste
Enzymfamilie ist die Glutathion-Peroxidase, von der 4 Formen bekannt sind. Die
Glutathion-Peroxidase ist ein potentes Antioxidans. Es katalysiert die Beseitigung
von Wasserstoffperoxid (und anderen Hydroperoxiden). Selenmangel limitiert die
Aktivität der GSH-Peroxidase und begünstigt damit die Ueberflutung mit Sauerstoff-
080564_Inhalt.indd 50
23.5.2008 14:55:24 Uhr
49
radikalen. Das Wissen um diese Zusammenhänge weckte das Interesse an der
Bedeutung von Selen auf Alterungsvorgänge, Atherosklerose, Karzinogenese und
andere Krankheiten, welche mit erhöhter Produktion von freien Radikalen verbunden
sind. Zahlreiche – hauptsächlich epidemiologische – Beobachtungen, aber auch
gewisse
Interventionsstudien
mit
Selen-Supplementation
bestätigen
die
herausragende Bedeutung von Selen auf die Gesundheit:
-
In Selenmangelgebieten besteht ein erhöhtes Risiko für Bronchus-, Magenund Pankreaskarzinome
Supplementation mit 200 ȝg Selen / Tag reduzierte die Inzidenz für Bronchus-,
Colon- und Prostatakarzinome
Es wird angenommen, dass die Entwicklung neuer Influenzavirus-Subtypen
nicht zufällig in China, der Ausbruch der HIV-Infektion nicht zufällig in Zaire
stattfand. Beide Länder sind ausgesprochene Selenmangel-Gebiete.
Bei der HIV-Infektion korreliert der Plasma-Selenspiegel mit der Zahl der CD4Helfer-T-Zellen, und zwar unabhängig von einer allfälligen Malnutrition. Die
Selenkonzentration ist ein guter Prädiktor für die HIV-Prognose.
Bei genügender Selen-Versorgung wird die Entwicklung der Hepatitis B und C
zu einem hepatozellulären Karzinom gehemmt.
PS: Viren sind fähig, das Selen-Depot des Wirts zu knacken und für den
Aufbau eigener Selenoproteine zu verwenden.
Die Rate von Frühaborten ist erhöht bei Selenmangel
Selenmangel beschleunigt den kognitiven Zerfall im Alter
Patienten mit Alzheimer haben deutlich tiefere Plasma-Selenspiegel als
Gesunde
etc.
Beim Menschen sind mindestens 2 Selenmangel-Krankheiten bekannt. Sie wurden in
China beschrieben: Bei der Keshan-Krankheit handelt es sich um eine entzündliche,
dilatative Kardiomyopathie. Die Kashin-Beck-Krankheit ist eine destruierende
Arthropathie. Co-Faktoren spielen in deren Entstehung wahrscheinlich eine Rolle
(Coxsackie-Virus-Infektion?). Schwere Mangelzustände mit Myopathie und
Kardiomyopathie kommen heute nur noch selten vor, am ehesten im Rahmen einer
langdauernden parenteralen Ernährung, eines schweren Malabsorptionssyndroms
oder bei schwerem chronischem Alkoholabusus.
Das essentielle Spurenelement Selen hat also eine wichtige Bedeutung in der
antioxidativen Abwehr, in der Verminderung der mutagenen Aktivität zahlreicher
karzinogener Substanzen, in der Bekämpfung von Entzündungsreaktionen und in der
Immunmodulation.
Selen und Schilddrüse
Aufgrund dieser Eigenschaften und dem Umstand, dass die JodothyroninDejodinasen, welche für die Produktion und Regulation des aktiven Hormons T3 (aus
T4) verantwortlich sind, ebenfalls zur Familie der Selenoenzyme gehören, kommt
dem Selen neben Jod die wohl bedeutendste Rolle in der (Patho-)Physiologie der
Schilddrüse zu. Es ist unverzichtbar für Synthese und Metabolismus der
Schilddrüsenhormone.
080564_Inhalt.indd 51
23.5.2008 14:55:27 Uhr
50
Selen in der Kontrolle des Metabolismus der Schilddrüsenhormone
Zur Synthese der Schilddrüsenhormone bedarf es einer adäquaten Versorgung mit
Jod, Selen, Eisen und Calzium. Wegen der Wichtigkeit einer sowohl lokal wie
systemisch genügenden Konzentration des aktiven Hormons T3 wird die Funktion
der Jodothyronin-Dejodinasen präferentiell aufrecht erhalten, auch im Zustand
leichten bis mässigen Selenmangels. Sie stehen in der Hierarchie der
Selenverteilung im Organismus (bei ungenügender Reserve für alle selenabhängigen
Funktionen) zuoberst. Allerdings können die Dejodinasen unabhängig von der
Selenversorgung durch Zytokine, Wachstumsfaktoren und Medikamente beeinflusst
werden. Bei gleichzeitigem Jodmangel kann die Dejodinierung mit entsprechendem
Jodverlust im Urin die Jodversorgung noch weiter kompromittieren und das Auftreten
einer Hypothyrose begünstigen, wenn Selen vor dem Jod ersetzt wird.
Die Ueberversorgung mit Selen hat einen negativen Einfluss auf die Aktivität der
Dejodinasen und führt dadurch zu einem Abfall von T3 und einem Anstieg von T4
und rT3, ev. sogar des TSH. Eine unkritische und unkontrollierte SelenSupplementation ist deshalb klar unerwünscht.
Selen und Schilddrüsen-Autoimmunität
Die Bedeutung von Selen bei der Autoimmunthyreoiditis hat wohl viel mit seiner
Eigenschaft als Antioxidans zu tun. Erhöhte TSH-Spiegel bedeuten vermehrten
oxidativen Stress. In mehreren Studien konnte gezeigt werden, dass die tägliche
Gabe von 200 ȝg Selen, welche eine optimale Wirkung der Glutathione-Peroxidase
garantiert, zu einer signifikanten Reduktion bzw. sogar zum Verschwinden der TPOAntikörper führen kann. Dieser Effekt ist unabhängig vom initialen Selenstatus. Der
Antikörper-Titer konnte auch bei selen-suffizienten Patienten gesenkt werden.
Allerdings wurden bis heute nur vereinzelte Fälle publiziert, bei denen die
Behandlung mit Selen auch die Schilddrüsenfunktion (Reduktion von TSH) positiv
beeinflussen konnte. Als Hinweis auf eine verminderte Entzündung/Destruktion nahm
bei zahlreichen Patientinnen die für eine aktive Autoimmunthyreopathie typische
Hypoechogenität in der Ultrasonografie ab.
Bei schwangeren Frauen mit positivem TPO-Antikörper-Titer konnte durch eine
konsequente Supplementation von Selen während der Schwangerschaft und in der
postpartalen Periode das Auftreten einer Hypothyreose signifikant reduziert werden.
Dies könnte ein Hinweis darauf sein, dass die Intervention früh im Verlauf einer
Autoimmunthyreopathie erfolgen sollte.
Ueber die Bedeutung von Selen bei der Autoimmunhyperthyreose vom Typ des
Morbus Basedow ist noch recht wenig bekannt. Die Produktion freier SauerstoffRadikale ist beim Basedow erhöht, die Expression von Entzündungsfaktoren wie
TNF-Į oder Interleukin in Lymphozyten verändert. Es ist deshalb sehr
wahrscheinlich, dass eine adäquate Selenversorgung für Patienten mit Morbus
Basedow wichtig ist. In einer Studie konnte gezeigt werden, dass bei gleichzeitiger
Gabe eines Thyreostatikums und von Selen rascher eine Euthyreose erzielt werden
konnte als mit Methimazol allein. Rezidive nach thyreostatischer Therapie eines
Morbus Basedow traten bei Patienten mit höheren Selenspiegeln seltener auf.
080564_Inhalt.indd 52
23.5.2008 14:55:30 Uhr
51
Selen und Schilddrüsen-Karzinom
Wie für andere Karzinome (siehe oben) konnte auch für differenzierte
Schilddrüsenkarzinome gezeigt werden, dass Selenmangel ein Risikofaktor ist.
Ausblick
Es bestehen heute keine Zweifel mehr, dass dem Selen eine grosse Bedeutung
zukommt in der (Patho-)Physiologie der Schilddrüsenhormone, im Rahmen von
Autoimmunthyreopathien (mit konsekutiver Hypo- und Hyperthyreose) und bei der
Entstehung des Schilddrüsenkarzinoms. Ein faszinierendes neues Forschungsgebiet
hat sich aufgetan. Zum heutigen Zeitpunkt sind allerdings mehr Fragen offen als je
zuvor. Für unsere tägliche Arbeit in der Praxis ist es klar zu früh, Empfehlungen
abgeben zu können. Wir sollten aber ein Basiswissen über Selen und seine mögliche
gesundheitliche Bedeutung – insbesondere auf die Schilddrüse - haben, da uns
immer mehr Patienten darauf ansprechen werden. Nach dem jetzigen Stand des
Wissens dürfen wir denen, welche ihre Krankheit begleitend mit einer SelenSupplementation behandeln möchten guten Gewissens sagen: „Nützt’s nüt, so
schad’s nüt“, sofern sie die tägliche Dosis von 200 ȝg respektieren.
Literatur
Rayman MP et al.; Am J Clin Nutr 2008 Febr; (2) : 370 – 8
Wertenbruch T et al.; Med Chem 2007 May; 3 (3) : 281 – 4
Negro R et al.; J Clin Endocrinol Metab 2007 Apr; 92 (4) : 1263 – 8
Hashemipour M et al.; Exp Clin Endocrinol Diabetes 2008 Febr; 116 (2) 75 – 9
Gärtner R et al. ; J Clin Endocrinol Metab 2002 Apr ; 87 (4) : 1687 – 91
Chanoine JP et al. ; J Clin Endocrinol Metab 2001 Mar ; 86 (3) : 1160 – 3
Riese C et al. ; Endocrinology 2006 Dec ; 147 (12) : 5883 – 92
Schomburg L et al. ; Endocrinology 2006 Mar ; 147 (3) : 1306 – 13
Gärtner R. Et al.; Biofactors 2003; 19 (3-4) : 165 – 70
Köhrle J; Thyroid 2005 Aug; 15 (8) : 841 – 53
Duntas LH Thyroid 2006 May; 16 (5) : 455 – 60
Brown KM et al.; Public Health Nutr 2001 Apr; 4 (2B) : 593 – 9
Truniger B, 13. Winterthurer Fortbildungskurs 1991 : 36 – 9
Scheck R et al.; Ernährung & Medizin 2007 ; 22 : 20 – 5
Duntas LH et al.; Eur J Endocrinol 2003 ; 148 : 389 – 93
Turker O et al. ; J Endocrinol 2006 ; 190 : 151 – 6
Rayman MP, Lancet 2000 ; 356 : 233 – 41
Berger MM, Schweiz Med Forum 2003 ; 31 : 720 – 26
080564_Inhalt.indd 53
23.5.2008 14:55:33 Uhr
52
Subklinische Dysthyreose: Krankheit oder Laborente?
Durch die vermehrte Bestimmung des TSH (Thyroid-stimulating hormone) im Rahmen von
Screeninguntersuchungen und durch die verbesserten Assays zu dessen Bestimmung werden immer
häufiger so genannt subklinische Störungen der Schilddrüsenfunktion diagnostiziert, definiert als
erhöhter resp. erniedrigter TSH-Wert mit noch normalen peripheren Schilddrüsen-Hormonwerten
((f)T3, (f)T4). Dabei stellt sich die Frage, ob eine solche Laborkonstellation klinische Konsequenzen
hat und somit behandlungsbedürftig ist oder nicht.
1)
Subklinische Hypothyreose
Eine subklinische Hypothyreose ist biochemisch charakterisiert als Funktionsstörung mit erhöhtem
Serum-TSH (>4.49 mU/l) und normalen peripheren Schilddrüsenwerten. Die Prävalenz liegt je nach
untersuchtem Kollektiv zwischen 2.5% und 15.4 % und ist in der Gruppe der über 60 jährigen Frauen
am höchsten. Insgesamt sind Frauen etwa 9x häufiger betroffen als Männer. Umgerechnet für die
Schweiz bedeutet dies, das etwa 400'000 Personen betroffen sind.
Die Ursachen der subklinischen Hypothyreose sind die gleichen wie die der manifesten Hypothyreose:
-Autoimmunthyreoiditis (Hashimoto-Thyreoiditis): häufigste Ursache, schmerzlos; charakterisiert durch
die Präsenz von Thyreoperoxidase (TPO)-Antikörpern.
-Frühere Behandlung mittels Radiojod oder chirurgische Intervention aufgrund einer Hyperthyreose,
Struma oder eines Malignoms.
-Direkte medikamentöse Wirkung (Lithium, Sulfonamide, Phenylbutazon), exzessive Jodzufuhr und
dadurch Blockade der Schilddrüse.
-Ungenügende Substitution bei manifester Hypothyreose.
Differentialdiagnostisch muss auch an ein sogenanntes ‚euthyroid sick syndrom’ gedacht werden. Im
Rahmen von schweren Allgemeinerkrankungen wird die Schilddrüsenfunktion reduziert, was sich in
erniedrigten T3-Werten zeigt. Das TSH kann in einer solchen Situation sowohl erniedrigt als auch (vor
allem in der Erholungsphase) erhöht sein (bis maximal 20 mU/l).
Eine subklinische Hypothyreosen kann in eine manifeste Unterfunktion übergehen. Die jährliche Rate
dabei beträgt etwa 4-8 % und ist vor allem abhängig von der Höhe des initialen TSH-Wertes (je höher
desto wahrscheinlicher und früher tritt eine manifeste Hypothyreose auf) und der Präsenz und
Titerhöhe von TPO-Antikörpern (1). Allerdings ist der Prozentsatz der Patienten etwa gleich hoch, die
innerhalb der nächsten 2-4 Jahre wieder eine Normalisierung des TSH-Wertes aufzeigen (2).
Eine subklinische Hypothyreose ist meist asymptomatisch, oft finden sich jedoch oligosymptomatische
Formen. Abhängig von der Höhe des TSH-Wertes sind unspezifische Beschwerden wie u.a.
Müdigkeit, trockene Haut oder Parästhesien bei Patienten mit subklinischer Hypothyreose doppelt so
häufig wie bei Kontrollen. Die Verwendung eines standardisierten klinischen Scores zur Erfassung der
Symptomatik hat sich bewährt.
Eine wesentliche metabolische Veränderung bei subklinischer Hypothyreose ist die Dyslipidämie,
charakterisiert durch erhöhtes totales und LDL-Cholesterin, im Schnitt um etwa 18 % höher als bei
einer gesunden Kontrollgruppe. Bei Patienten mit subklinischer Hypothyreose mit hohem TSH
(>12mU/l) und hohem LDL-Cholesterin kann eine Normalisierung des TSH durch Substitution zu einer
signifikanten Verbesserung der LDL-Konzentrationen führen (3).
Etwas weniger Klarheit besteht bezüglich Zusammenhang mit Blutdruck und kardialer Funktion. So
scheint der diastolische Blutdruck bei subklinischer Hypothyreose erhöht zu sein, ebenfalls die
arterielle Pulswellengeschwindigkeit als Marker der arteriellen Steifigkeit. Ebenfalls findet sich häufiger
echokardiographisch eine diastolische Dysfunktion, die unter Substitution reversibel ist. Diese
Veränderungen scheinen auch Auswirkungen auf die Gesamtmortalität und kardiovaskuläre Morbidität
zu haben: so zeigte unter anderem die Rotterdam-Studie eine Assoziation zwischen subklinischer
Hypothyreose, aortaler Atherosklerose und dem Auftreten einer koronaren Herzkrankheit (4-6). Die
Evidenz, dass eine Behandlung der subklinischen Hypothyreose einen Benefit bringt in Bezug auf
kardiovaskuläre Endpunkte steht aber aus.
Als kardiovaskuläre Risikofaktoren gelten unter anderem auch ein erhöhter Homozystein- und ein
erhöhter C-reaktiver Protein (CRP)-Wert. CRP ist bei Patienten mit subklinischer Hypothyreose höher
als bei einem euthyeoten Kontrollkollektiv. Allerdings führte eine Behandlung mittels T4 Präparat nicht
zu einer signikanten Senkung der Homocystein- oder CRP werte (7).
080564_Inhalt.indd 54
23.5.2008 14:55:35 Uhr
53
Im Jahr 2004 hat ein Expertenkommitee die vorhandene Literatur bezüglich Evidenz einer Behandlung
der subklinischen Hypothyreose gesichtet und folgendermassen zusammengefasst (8):
a) asymptomatische subklinische Hypothyreosen mit einem TSH zwischen 4.5 bis 10 mU/l sollten
nicht behandelt werden, da die Evidenz dazu fehlend ist. Eine regelmässige Verlaufskontrolle ist
jedoch indiziert.
b) Ausnahmen: bereits Substitution bei einem TSH zwischen 4.5 – 10 mU/l bei unerfülltem
Kinderwunsch, Schwangerschaft, Dyslipidämie, Depression, Vorliegen einer Struma
c) bei einem TSH > 10 mU/l wird eine Substitution mit dem Ziel einer TSH-Normalisierung empfohlen
Die Substitution sollte mit einem reinen T4-Präparat durchgeführt werden, das eine lange
Halbwertszeit (180 Stunden) und eine hohe Bioverfügbarkeit aufweist. Die T-4 Dosis sollte individuell
in 25ȝg Schritten alle 4-6 Wochen angepasst werden. Ziel ist das Erreichen eines normalen TSH (=
Verlaufsparameter) und Vermeiden einer TSH-Suppression. Ein Kombinationspräparat mit einem T3Anteil führt gemäss einer Meta-Analyse nicht zu einem besseren Endresultat, sondern kann aufgrund
der rascheren Halbwertszeit (T3: 18 Stunden) und stärkeren Plasmaschwankungen zu
Nebenwirkungen wie Palpitationen führen.
Bei einer Schwangerschaft steigt der Bedarf an Schilddrüsenhormonen normalerweise um etwa 45%
an. Somit sollte bei festgestellter Schwangerschaft die vorbestehende Substitution um etwa 1/3 erhöht
werden mit Laborkontrollen alle 4 Schwangerschaftswochen bis zur 20. Woche, wo sich der Bedarf in
der Regel stabilisiert. Postpartal sollte erneut eine Laborkontrolle wegen wieder sinkendem Bedarf
durchgeführt werden.
2)
Subklinische Hyperthyreose
Als subklinische Hyperthyreose wird die Laborkonstellation eines supprimierten TSH (<0.3 mU/l) und
normalen peripheren Hormonen bezeichnet. Die Prävalenz beträgt etwa 0.3 bis 1%. Auch hier stellt
sich die Frage, ob diese Laborkonstellation klinische Konsequenzen hat und behandlungsbedüftig ist.
Kardial findet sich bei einer subklinischen Hyperthyreose gehäuft Vorhofflimmern: dessen Inzidenz lag
bei 2% in einer euthyreoten Population, bei 14 % bei Vorliegen einer manifesten Hyperthyreose und
bei 13% bei subklinischer Hyperthyreose. Vergleichbar die Resultate einer Untersuchung bei 2000
über 70 jährigen Personen mit einer mehr als verdoppelten Inzidenz von Vorhofflimmern, wenn das
TSH unter 0.1 mU/l supprimiert war. Echokardiographisch fand sich eine vergrösserte Dicke des
Septums und der Hinterwand des linken Ventrikels, verbunden mit einer vermehrten Inzidenz einer
diastolischen Dysfunktion. Eine subklinische Hyperthyreose kann somit vor allem für Patienten mit
vorbestehender Herzerkrankungen von erheblicher Bedeutung sein. Die Auswirkungen auf die
kardiovaskulären Endpunkte und insbesondere die Gesamtmortalität sind aber widersprüchlich: Im
allgemeinen wird in Studien das erhöhte Risiko für Vorhofflimmern bestätigt, es besteht jedoch bei
subklinischer Hyperthyreose kein erhöhtes Risiko für eine erhöhte kardiovaskuläre Gesamtmortalität.
Eine manifeste Hyperthyreose führt zu einer verminderten Knochendichte und zu einer vermehrten
Frakturrate. Unklar bleibt, ob auch eine subklinische Hyperthyreose die Knochendichte vermindert;
Knochenumbaumarker wie das Osteokalzin und das Deoxy-Pyridinolin können erhöht sein.
Konkrete Guidelines zum Management einer subklinischen Hyperthyreose existieren nicht.
Auch hier gab ein Expertenkommitee im Jahr 2004 Empfehlungen zur Therapie heraus (8):
Hohes Risiko für Komplikationen (kardial (insbesondere Vorhofflimmern), Skelett (Osteoporose))
TSH <0.1mU/l
Abklärung und Therapie
TSH >0.1mU/l
im Einzelfall und in Absprache mit Patient
Tiefes Risiko für Komplikationen
TSH <0.1mU/l
im Einzelfall und in Absprache mit Patient
TSH >0.1mU/l
beobachten
080564_Inhalt.indd 55
23.5.2008 14:55:39 Uhr
54
Bei etwa 50% der Patienten kann eine spontane Normalisierung des TSH wertes festgestellt werden.
Deshalb wird in jedem Fall eine Kontrolle des TSH-Wertes nach 4-6 Wochen empfohlen, sowie dann
in regelmässigen Abständen.
Von spezieller Bedeutung bei jeder Form einer subklinischen Hyperthyreose ist die JodExpositionsprophylaxe. Unser täglicher Jodbedarf beträgt etwa 200-300ȝg täglich. Kontrastmittel für
Computertomographien oder Koronar-/Angiographien sind sehr jodhaltig mit 150 bis 300 mg Jod / ml
Kontrastmittel. Eine solche Jodbelastung kann somit ein bisher relativ stabiles Gleichgewicht zur
Entgleisung bringen: eine manifeste Hyperthyreose oder gar eine thyreotoxische Krise, die mit einer
Mortalität von 20-50% assoziiert ist, kann die Folge sein. Aus diesem Grund wird eine JodExpositionsprophylaxe mit Thyreostatika bei Patienten mit subklinischer Hyperthyrose empfohlen: 210 Stunden vor Jodapplikation sollten 20mg Neo-Mercazole verabreicht werden, diese Dosis sollte
während 7 Tagen nach Jodgabe weiter eingenommen werden.
Zusammenfassung
Subklinische Störungen der Schilddrüsenfunktion sind definiert als pathologische TSHKonzentrationen bei noch normalen peripheren Schilddrüsenhormonen. Die Prävalenz der
subklinischen Hypothyreose (erhöhtes TSH) liegt zwischen 2.5 bis 15%, sie kann, insbesondere bei
TSH Werten >10mU/L mit Allgemeinsymptomen und einer Dyslipidämie assoziiert sein. Deshalb wird
eine Substitution in der Regel erst ab einem TSH von > 10ȝU/l empfohlen und sollte mit einem reinen
T4-Präparat durchgeführt werden. Bei tieferen TSH-Werten richtet sich die Indikation nach
zusätzlichen Risikofaktoren und Symptomen, es gibt aber keine Evidenz dass der Patient davon einen
Benefit hat.
Die subklinische Hyperthyreose (supprimiertes TSH) ist mit einem erhöhten Risiko für das Aurtreten
von Vorhofflimmern assoziiert, mit erhöhter kardialer Morbidität wohl eher nicht, obwohl dies
kontrovers diskutiert wird. Die Indikation zur Diagnostik und Therapie richtet sich individuell nach dem
Risiko. Bei hohem Risiko (speziell Vorhofflimmern und Osteoporose) wird eine Therapie ab einem
TSH-Wert <0.1mU/L empfohlen. Eine konsequente Jod-Prophylaxe mit Thyreostatika sollte bei
Exposition mit Röntgenkontrastmitteln durchgeführt werden.
Referenzen
1.
Huber G, Mitrache C, Meier C, Guglielmetti M, Huber P, Staub JJ. [Long-term study
of subclinical hypothyroidism: spontaneous course and predictors of manifest
hypothyroidism]. Schweizerische medizinische Wochenschrift. 1998;128(48):1902-5.
2.
Vanderpump MP, Tunbridge WM, French JM, Appleton D, Bates D, Clark F, Grimley
Evans J, Hasan DM, Rodgers H, Tunbridge F, et al. The incidence of thyroid disorders in the
community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol (Oxf).
1995;43(1):55-68.
3.
Meier C, Staub JJ, Roth CB, Guglielmetti M, Kunz M, Miserez AR, Drewe J, Huber
P, Herzog R, Muller B. TSH-controlled L-thyroxine therapy reduces cholesterol levels and
clinical symptoms in subclinical hypothyroidism: a double blind, placebo-controlled trial
(Basel Thyroid Study). J Clin Endocrinol Metab. 2001;86(10):4860-6.
4.
Imaizumi M, Akahoshi M, Ichimaru S, Nakashima E, Hida A, Soda M, Usa T,
Ashizawa K, Yokoyama N, Maeda R, Nagataki S, Eguchi K. Risk for ischemic heart disease
and all-cause mortality in subclinical hypothyroidism. J Clin Endocrinol Metab.
2004;89(7):3365-70.
5.
Singh S, Duggal J, Molnar J, Maldonado F, Barsano CP, Arora R. Impact of
subclinical thyroid disorders on coronary heart disease, cardiovascular and all-cause
mortality: a meta-analysis. Int J Cardiol. 2008;125(1):41-8.
6.
Hak AE, Pols HA, Visser TJ, Drexhage HA, Hofman A, Witteman JC. Subclinical
hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in
elderly women: the Rotterdam Study. Ann Intern Med. 2000;132(4):270-8.
7.
Christ-Crain M, Meier C, Guglielmetti M, Huber PR, Riesen W, Staub JJ, Muller B.
Elevated C-reactive protein and homocysteine values: cardiovascular risk factors in
080564_Inhalt.indd 56
23.5.2008 14:55:42 Uhr
55
hypothyroidism? A cross-sectional and a double-blind, placebo-controlled trial.
Atherosclerosis. 2003;166(2):379-86.
8.
Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, Franklyn JA,
Hershman JM, Burman KD, Denke MA, Gorman C, Cooper RS, Weissman NJ. Subclinical
thyroid disease: scientific review and guidelines for diagnosis and management. Jama.
2004;291(2):228-38.
080564_Inhalt.indd 57
23.5.2008 14:55:45 Uhr
56
Sind Schilddrüsenpatienten wirklich anders?
Psychische Veränderungen bei Hypo- und Hyperthyreosen
Dr. Christian Meier, Endokrinologische Praxis und Labor, 4055 Basel
Psychiatrische Auffälligkeiten bei Patienten mit Schilddrüsenfunktionsstörungen können sehr
vielgestaltig sein. So werden häufig kognitive Funktionsstörungen und depressive Zustandsbilder, seltener Angststörungen sowie psychotische Zustände mit Wahnvorstellungen und Halluzinationen beschrieben. Wie aus Fallsammlungen bekannt kann sich eine Hypo- bzw. Hyperthyreose alleinig durch diese psychischen Veränderungen manifestieren ohne dass typisch organisch geprägte Symptome bestehen müssen. Um eine zugrundeliegende Schilddrüsenerkrankung frühzeitig erkennen und gezielt behandeln zu können, ist die Kenntnis psychischer Manifestationsformen erforderlich.
1. Psychiatrische Manifestationen bei Hypothyreosen
Schwere psychotische Krankheitsverläufe im Rahmen fortgeschrittener hypothyreoter Stoffwechselentgleisungen treten heute durch eine frühzeitige Diagnostik (TSH-Screening) nur noch
selten auf (Inzidenz <5% der Hypothyreosen). Trotzdem werden bei Patienten mit manifesten
Hypothyreosen häufig leichte, individuell sehr unterschiedliche psychische Alterationen beobachtet. Bei frühzeitiger Diagnose und entsprechender kausaler Behandlung können lange, für
den Patienten oft sehr belastende Krankheitsverläufe verhindert werden.
Neben unspezifischen Allgemeinsymptomen wie Müdigkeit oder Schwäche und typischen somatischen Beschwerden werden bei Patienten mit manifester Hypothyreose schon zu Beginn
der Erkrankung nicht selten kognitive Veränderungen beobachtet. Auf gezieltes Erfragen werden von den Patienten Aufmerksamkeits- und Konzentrationsstörungen, Frühgedächtnisstörungen sowie verlangsamte Gedankengänge beschrieben. Diese meßbar verlängerte Reaktionszeit geht in einen Verlust an Initiative und Interesse über und schließlich tritt eine allgemeine
Stumpfheit und Lethargie mit konsekutiver Persönlichkeitsstörung auf. Bewusstseinsveränderungen mit Somnolenz und Koma (Myxödemkoma) können bei schweren Verläufen beobachtet
werden. Hypothyreose-assoziierte depressive Zustandsbilder wie melancholische Verstimmung,
Antriebshemmung, Interessenverlust und Rückzugsverhalten (bis zur Isolierung) müssen von
affektiven Psychosen abgegrenzt werden. Im Gegensatz zur depressiven Gehemmtheit werden
selten auch agitierte Phasen beobachtet. Dabei können innere Unruhe, Bewegungsdrang,
Schlaflosigkeit und Reizbarkeit bis hin zu psychotischen Entgleisungen mit Angstzuständen
(speziell Agoraphobien) oder Halluzinationen (“myxedema madness”) auftreten. Diese psychotische Manifestationsformen sind heute dank verbesserter Diagnostik und frühzeitiger Behandlung der Hypothyreose nur noch selten (ca. 5%) anzutreffen.
Tab. 1: Psychiatrische Manifestationen und deren Häufigkeit bei Hypothyreose
kognitive Veränderungen (50-90%)
Depressives Zustandsbild (40%)
Agitiertes Zustandsbild (<5%)
Bewusstseinsveränderungen (<5%)
080564_Inhalt.indd 58
x
x
x
x
x
x
x
x
x
x
x
x
x
Aufmerksamkeitsstörungen
Konzentrationsstörungen
Gedächtnisstörungen
Verlangsamte Gedankengänge
Initiativenlosigkeit
Stumpfheit, Lethargie
Melancholische Verstimmung
Antriebshemmung
Interessenverlust
Rückzugverhalten (Isolation)
Innere Unruhe, Bewegungsdrang
Schlaflosigkeit, Reizbarkeit
Psychotische Entgleisung mit Angstzuständen, Halluzinationen (“myxedema madness”)
x Somnolenz und Koma
(Myxödemkoma)
23.5.2008 14:55:48 Uhr
57
Kontrovers bleibt, inwieweit psychische Beschwerden bei Patienten mit subklinischen Hypothyreosen anzutreffen sind. Definitionsgemäss sind Patienten mit dieser frühen Form der Schilddrüsenunterfunktion asymptomatisch. Basierend auf neueren Arbeiten muss jedoch angenommen werden, dass individuell unterschiedlich klinische Veränderungen auftreten können. Gemäß einer Untersuchung von Haggerty und Mitarbeitern ist das Risiko, zu Lebzeiten an einer
Depression zu erkranken, gegenüber euthyreoten Kontrollpersonen signifikant erhöht (56% vs
20%). In Tab. 2 sind kontrollierte, prospektive Studien, welche einen günstigen Effekt einer T4Substitutionsbehandlung bei Patienten mit subklinischer Hypothyreose untersucht haben, zusammengefaßt. In allen Studien wurden die Patienten mit einem T4-Präparat substituiert mit
dem Ziel einer euthyreoten Stoffwechseleinstellung. Bei relativ hoher T4-Substitutionsdosis und
entsprechend tiefnormalen TSH-Werten kann in den Arbeiten von Nyström und Monzani nicht
ausgeschlossen werden, dass bei einzelnen Patienten durch eine passagere Ueberdosierung
im Sinne einer leichten TSH-Suppression der Therapieeffekt überschätzt wird.
Tab. 2: Effekte auf neuropsychologische Parameter bei subklinischer Hypothyreose unter LT4
Therapie
LT4Therapie
Dauer
(Monate)
12
6
6
10
3
12
Patienten
(n)
TSH
vor LT4
TSH
nach LT4
Psychiatrische Parameter
17
17
14
18
19
31
10,8 ± 2,2
7,7 ± 0,9
8,8 ±1,5
12,3
12,0 ± 1,2
12,8 ± 1,4
2,6 ± 0,5
1,9 ± 0,4
1,3 ± 0.2
4,6
2,2 ± 0.3
3,1 ± 0,3
Hypothyreosesymptomatik Ļ
Gedächtnisleistung Ĺ, Reaktionszeit Ļ
Gedächtnisleistung Ĺ, Ängstlichkeit Ļ
Gedächtnisleistung Ĺ
Gedächtnisleistung Ĺ
Hypothyreosesymptomatik Ļ
Referenz
Cooper et al.
Nyström et al.
Monzani et al
Jaeschke et al.
Baldini et al.
Meier et al.
Prävalenz von Hypothyerosen im psychiatrischen Krankengut
Neben den dargestellten psychiatrischen Sympomen von Patienten mit manifester bzw. subklinischer Hypothyreose stellt sich die Frage, wie häufig eine Hypothyreose in einem psychiatrischen Krankengut anzutreffen ist. Aus methodischen Gründen (Labormethodik; Testsensitivität;
ambulantes oder stationäres Krankengut; Untersuchungen in Gegenden unterschiedlichen Jodgehalts) ist die Erfassung der Hypothyreoseprävalenz bei psychiatrischen Patienten erschwert.
So fanden sich bei 27.6% der 880 in eine deutsche psychiatrische Klinik eingewiesenen Patienten Veränderungen der T4- und TSH-Konzentrationen. Bei der Mehrzahl der Patienten waren
die Hormonveränderungen unspezifisch und reversibel, nur bei 9 der aufgenommenen Patienten (0.1%) fand sich eine Hypothyreose (2 manifest, 7 subklinisch; davon 6 bereits bekannte
Hypothyreosen). Aehnliche Prävalenzahlen ergab eine retrospektive kanadische Studie, in der
bei 13.7% der psychiatrische eingewiesenen Patienten pathologische Schilddrüsenwerte gemessen wurden, aber nur bei 0.9% der Patienten eine Schilddrüsendysfunktion neu diagnostiziert werden konnte.
Laborabklärungen
Aufgrund der alters- und geschlechtsabhängig erhöhten Prävalenz von Hypothyreosen bei psychiatrischen Patienten wird insbesondere Frauen über 60 Jahren ein TSH-Screening empfohlen. Weitere Kriterien für eine erhöhte Inzidenz von Hypothyreosen sind “rapid-cycling” bipolare
Störungen, therapierefraktäre Depressionen und Patienten unter einer Lithiumtherapie.
Da psychiatrische Manifestationen bei hypothyreoten Patienten unspezifisch sind und eine
Schizophrenie, eine affektive Psychose oder einen paranoiden Zustand vortäuschen können, ist
eine gezielte Anamnese und körperliche Untersuchung bezüglich somatischer Hypothyreosestigmata wegweisend. Zur Bestätigung bzw. zum Ausschluß einer hypothyreoten Stoffwechsellage ist die Bestimmung der Serumkonzentrationen von TSH und fT4 angezeigt. Dank der
hohen Testsensitivität ist meist eine klare Abgrenzung zu primär psychiatrischen Erkrankungen
möglich.
080564_Inhalt.indd 59
23.5.2008 14:55:52 Uhr
58
Speziell kontrollbedürftig sind Patienten unter einer Lithiumtherapie. Es wird angenommen,
dass Lithium einen direkten antithyroidalen Effekt durch Hemmung der Schilddrüsenhormonsekretion und durch Modulation einer vorbestehenden Autoimmunität ausübt. Neben der strumigenen Wirkung (Strumainzidenz etwa 50%) wird bei 2% bis 10% der Lithium-behandelten
Patienten im Verlauf eine Hypothyreose beobachtet. Die höchste Prävalenz findet sich während
der ersten beiden Behandlungsjahren, insbesondere bei Frauen über 40 Jahren (Prävalenz
>20%). Bei fortgesetzter Lithiumbehandlung ist eine Schilddrüsenhormonsubstitution indiziert.
Insbesondere bei Patienten mit bipolaren Störungen und raschem Phasenwechsel (“rapid cycling”) sollte die Schilddrüsenfunktion regelmässig kontrolliert werden: bei rund 50% dieser Patienten trat im Verlauf unter Lithium eine manifeste Hypothyreose auf, wohingegen bei Patienten
mit “non-rapid cycling” Störungen unter einer Lithiumtherapie viel seltener eine Hypothyreose
festzustellen war.
Therapeutische Maßnahmen bei Hypothyreosen
Psychische Veränderungen bei hypothyreoten Patienten sind meist nach adäquater T4Substitutionsbehandlung reversibel. Erfahrungsgemäss kann man 4 bis 8 Wochen nach Beginn
der Hormontherapie damit rechnen, dass die psychiatrische Symptome abklingen, seltenerweise kann die Dauer bis zur vollständigen klinischen Erholung bis 6 Monaten verlängert sein.
Ausgenommen sind Patienten, bei denen zusätzlich zur Hypothyreose eine endogene affektive
Psychose vorliegt. Allgemein genügt zur Substitutionsbehandlung der Einsatz eines reinen T4Präparates (Thyroxin). Kontrovers wird die zusätzliche Gabe von T3 (Triiodothyronin) diskutiert.
Aufgrund tierexperimenteller Studien, in denen zur Normalisierung der Gewebshypothyreose
(gemessen anhand der gewebespezifischen Deiodinaseaktivität) die zusätzliche Gabe eines
T3-Präparat in physiologischer Dosierung notwendig war, wird ein günstiger Effekt einer T4/T3Kombinationsbehandlung postuliert. Ob diese Daten auf hypothyreote Patienten mit depressiver
Symptomatik übertragen werden können, bleibt unklar. Generell gilt in der Substitutionsbehandlung, dass die T4-Dosis individuell angepasst und die prinzipiell niedrigste Dosierung zum Erreichen einer euthyreoten Stoffwechsellage angestrebt werden sollte.
Als Therapieoption bei euthyreoten Patienten mit therapierefraktärer Depressionen wird nicht
selten der Einsatz von T4- oder T3-Präparaten (Augmentationsbehandlung) erwogen. Bei 50%
bis 60% der Patienten mit schwerer, therapierefraktärer Depression konnte mit supraphysiologischen T4-Dosen (480 ȝg tgl.) zusätzlich zur antidepressiven Therapie innerhalb von 3 Monaten
eine klinische signifikante Besserung erreicht werden konnte. Augrund der Tatsache dass bei
Patienten mit therapierefraktärer Depression eine subklinische Hypothyreose häufiger als in der
Allgemeinbevölkerung ist, kann zumindest bei einigen Patienten ein Schilddrüsenhormonmangel als Kofaktor postuliert werden. In Anbetracht des Nebenwirkungspotentials der supraphysiologischen Schilddrüsenhormondosis sollten diese therapeutischen Optionen für ausgewählte
Fälle reserviert bleiben.
2. Psychiatrische Manifestationen bei Hyperthyreosen
Bei Patienten mit manifesten Hyperthyreosen sind psychische Veränderungen häufig anzutreffen. Neben den typischen somatischen Hyperthyreosezeichen werden oft Stimmungsschwankungen, Reizbarkeit, Ungeduld, emotionale Labilität, Schlafstörungen, Konzentrations- und Gedächtnisstörungen beschrieben. Seltener präsentieren sich Patienten deutlich euphorisch und
hyperaktiv, in extremen Fällen kann ein psychotisches manisches oder deliriöses Zustandsbild
bestehen (Inzidenz etwa 1%). Bei Patienten mit bekannten chronischen Psychosen (Manie,
bipolare Psychose) kann eine neuaufgetretene manifeste Hyperthyreose Auslöser eines neuen
psychotischen Schubes sein. Nächtliche Schlafstörungen bei hyperthyreoten Patienten führen
meist zu einer ausgeprägten Müdigkeit und Schwäche tagsüber, ein wichtiges Merkmal zur Differenzierung zu endogenen manischen Erkrankungen, bei denen die Patienten tagsüber vitalitäts- und antriebsgesteigert sind. Wechselnde manische und depressive Phasen (Zyklothymie)
sind meist Ausdruck einer vorbestehenden bipolaren Depression. Differentialdiagnostisch sind
zudem Angstzustände und Panikattacken von manifesten Hyperthyreosen mit psychiatrischen
Manifestationen abzugrenzen.
080564_Inhalt.indd 60
23.5.2008 14:55:56 Uhr
59
In einer retrospektiven Studie wurden die Daten von 18 innerhalb eines Zeitraumes von 20 Jahren stationär behandelte Patienten zusammengefasst, bei denen sich eine floride Hyperthyreose durch schwere psychotische Veränderungen manifestiert hat. Ein spezifisches klinisches
Bild war bei den hyperthyreoten Patienten nicht feststellbar, es dominierten jedoch die affektiv
ausgestalteten Psychosen. Weniger häufig waren schizophrene Psychosen, in je einem Fall
wurden eine paranoide Psychose und ein Delirium diagnostiziert. Erwartungsgemäß besserte
sich die psychische Symptomatik bei den meisten Patienten nach einer anfänglichen Behandlung rasch und weitere psychiatrische Erkrankungen traten in der Folge nicht mehr auf.
Vor allem bei älteren Patienten kann die Hyperthyreose im Gegensatz zu den erwähnten Manifestationsformen atypisch verlaufen. Bei der sogenannten “apathetic thyrotoxicosis” handelt es
sich um einen meist oligosymptomatischen Hyperthyreoseverlauf mit Überwiegen einer depressiven Symptomatik. Geriatrische Patienten präsentieren sich nicht selten apathisch, geistig verwirrt und dement. Die klinische Diagnose wird erschwert durch das häufige Fehlen klassischer
Hyperthreosesymptome wohingegen meist ein beträchtlicher Gewichtsverlust vorliegen kann.
Tab. 3: Psychiatrische Manifestationen bei Hyperthyreosen
x
x
x
x
x
x
x
Emotionale Labilität, Stimmungsschwankungen (häufig)
Reizbarkeit, Unruhe, Ungeduld
Schlaflosigkeit, Müdigkeit (tagsüber)
Konzentrations- und Gedächtnisstörungen
Euphorie, Hyperaktivität
Aengstlichkeit (etwa 40%)
Manisches oder deliriöses Zustandsbild (<5%)
x Bewusstseinsveränderungen mit Somnolenz oder Koma (Thyreotoxische Krise; < 1%)
Prävalenz von Hyperthyerosen im psychiatrischen Krankengut
Die Prävalenz neuentdeckter Hyperthyreose in psychiatrischen Kliniken ist klein (neu-entdeckte
manifeste Hyperthyreose in <1%, subklinische Hyperthyreosen in 5-6%). Bei Patienten mit
supprimierten TSH-Werten ist eine Abgrenzung zu unspezifischen, nicht-thyroidal bedingten
und im Verlauf reversiblen Schilddrüsenhormonveränderungen erforderlich.
Therapeutische Maßnahmen bei Hyperthyreosen
Die Behandlung hyperthyreoter Patienten mit psychiatrischen Begleitbeschwerden erfolgt unabhängig von der zugrunde liegenden Schilddrüsenpathologie initial durch eine thyreostatische
Behandlung (Carbimazol, Propylthiouracil). Eine Radiojodbehandlung oder ein operatives Vorgehen ist in der akuten Situation meist nicht möglich. Zur symptomatischen Therapie haben
sich der zusätzliche Einsatz von E-Rezeptorenblockern und Neuroleptika (Haloperidol,
Chlorpromazin) bewährt. Trizyklische Antidepressiva sind kontraindiziert, da nicht selten schwer
verlaufende thyreotoxische Entgleisungen induziert werden können.
3. Schilddrüsenhormonveränderungen als Folge von psychiatrischen Erkrankungen
Die Beurteilung der Schilddrüsenfunktion kann bei Patienten mit nicht-thyreoidalen Erkrankungen, einschließlich psychiatrischen Leiden, erschwert sein. Typischerweise können bei akut
erkrankten Patienten erniedrigte T3- und T4-Konzentrationen sowie leicht supprimierte oder
auch erhöhte TSH-Werte nachgewiesen werden (“euthyroid-sick syndrome”). Diese laborchemischen Variationen, welche auf eine verminderte T4/T3-Konversion sowie auf eine veränderte
Proteinbindung der Schilddrüsenhormone zurückgeführt werden können, sind nicht krankheitsspezifisch, im Verlauf reversibel und meist nicht therapiebedürftig. Bei hospitalisierten psychiatrischen Patienten sind primäre Hypo- und Hyperthyreosen selten (Prävalenz ca. 1%).
Bei depressiven Patienten findet man häufig ein partielles TSH-Suppressionssyndrom mit basal
leicht supprimiertem TSH und vermindertem TSH-Anstieg nach TRH-Stimulation. In der Erholungsphase kann das basale TSH auch leicht erhöht sein (bis maximal 20 mU/l). Bei Patienten
mit akuten psychotischen Manifestationen, vor allem Schizophrenien, können passager erhöhte
T4-Konzentrationen mit/ohne TSH-Suppression beobachtet werden.
080564_Inhalt.indd 61
23.5.2008 14:56:00 Uhr
60
Zur Screeninguntersuchung werden heute in der klinischen Routine ultrasensitive TSH-Assays
mit einer funktionellen Sensitivität von 0,01 mU/l (zum Teil bis 0,005) angewendet. Dank dieser
hochsensitiven Assays ist meist eine klare Abgrenzung nicht-thyroidaler Laborveränderungen
von behandlungsbedürftigen hyperthyreoten Stoffwechsellagen möglich. Eine endogene Hyperthyreose ist bei basal nicht meßbarem TSH (<0.005 mU/l) und erhöhtem fT4 (und T3) anzunehmen. Ein basales TSH >20 mU/l spricht für das Vorliegen einer manifeste Hypothyreose; in
beiden Fällen ist eine weitere endokrinologische Abklärung indiziert. Bei hospitalisierten psychiatrischen Patienten empfiehlt sich die gleichzeitige Bestimmung von TSH und fT4 zum gezielten Ausschluß einer Schilddrüsendysfunktion. Da die meisten Schilddrüsenhormonveränderungen bei hospitalisierten Patienten passager sind, ist eine Wiederholung des Schilddrüsenstatus
in unklaren Fällen 2-4 Wochen nach Entlassung angezeigt.
080564_Inhalt.indd 62
23.5.2008 14:56:04 Uhr
61
Consensus Statement of the European Group on Graves' Orbitopathy
(EUGOGO) on Management of Graves' Orbitopathy
“Empfehlungen der European Group on Graves' Orbitopathy (EUGOGO)
zur Abklärung und Behandlung der endokrinen Orbitopathie“
publiziert in
Thyroid. 2008 Mar;18(3):333-46 und Eur J Endocrinol. 2008 Mar;158(3):273-85
Georg von Arx, basedow.ch, 4600 Olten
Die Behandlung von Patienten mit endokriner Orbitopathie (EO) ist eine grosse
klinische und therapeutische Herausforderung. Die EO ist die häufigste extrathyroidale
Manifestation der Autoimmunhyperthyreose vom Typus M.Basedow. Sie kann schon vor
(euthyreote EO), gleichzeitig mit der Manifestation der Hyperthyreose, aber auch erst im
späteren Verlauf auftreten. In einem kleinen Prozentsatz tritt sie jedoch auch bei Patienten
mit Hypothyreose vom Typ Thyroiditis Hashimoto auf (hypothyreote Form). Weil eine
ausführliche Diskussion der Pathogenese der EO den Rahmen dieses Vortrages sprengen
würde,
soll
hier
lediglich
auf
die
Beziehung
dieses
Krankheitsbildes
zwischen
Schilddrüsenerkrankung und orbitaler Manifestation verwiesen werden, was klinische und
therapeutische Bedeutung hat. Die optimale Abklärung und Behandlung der EO erfordert ein
koordiniertes Vorgehen zur Behandlung sowohl der Schilddrüsenfehlfunktion, wie auch der
EO. Die EO ist zwar oft mild und selbstlimitierend, whs. in der Häufigkeit auch eher
abnehmend, aber immer noch mit ca. 3-5% schweren, visusbedrohenden Formen.
Manifestation und Progression der EO werden von verschiedenen Faktoren beeinflusst,
welche teils selbst beeinflusst werden können wie etwa Zigaretten-Rauchen, Dysthyreose
und Wahl der Behandlung der Dysthyreose. Suboptimale Behandlungen von Patienten mit
EO scheinen leider weitverbreitet zu sein. Das Ziel dieses Vortrags soll die praxisbezogene
080564_Inhalt.indd 63
23.5.2008 14:56:07 Uhr
62
Information von Spezialisten und Nicht-Spezialisten zur Verbesserung der Abklärung und
Behandlung von Patienten mit EO sein.
EUGOGO ist ein multidisziplinäres Konsortium von Klinikern aus 12 Europäischen
Universitätszentren, welche sich der Erforschung der EO und der Verbesserung der
Behandlung dieser anspruchsvollen Erkrankung verschrieben haben (www.eugogo.org). Im
November 2006 wurde eine Arbeitsgruppe gebildet mit dem Auftrag ein Arbeitspapier für ein
“Consensus Statement” zu erarbeiten.
Dieses wurde in der Folge an verschiedenen
Arbeitssitzungen und im Plenum diskutiert, revidiert und danach der European Thyroid
Association (ETA), sowie der European Society of Ophthalmic Reconstructive and Plastic
Surgeons (ESORPS) zur kritischen Durchsicht und Begutachtung unterbreitet. Das so
entstandene Dokument wurde dann im September 2007 am ETA Jahreskongress in Leipzig
erstmals der Öffentlichkeit vorgestellt. Relevante Literaturquellen und Referenzen wurden
mittels MEDLINE gesucht (MESH: Graves’ ophthalmopathy oder Orbitopathy, thyroidassociated ophthalmopathy oder Orbitopathy und thyroid-eye disease). Die gebrauchten
Definitionen der “Types of Evidence” und des “Grading of Recommendations” folgt den
Richtlinien und Empfehlungen der “Agency for Health Care Policy and Research” (AHCPR),
neu “Agency for Healthcare Research and Quality” (AHRQ) (www.ahrq.gov). Betreffs
relevanter Literatur und detaillierter Information wird an dieser Stelle auf die o.e. Publikation
in den Fachzeitschriften „Thyroid“ und „European Journal of Endocrinology“ vom März 2008
verwiesen.
080564_Inhalt.indd 64
23.5.2008 14:56:09 Uhr
63
1. Kombinierte Spezialsprechstunden für Patienten mit EO
Grundversorgern, Hausärzten, Internisten und Spezialärzten, ohne spezielle
Erfahrung (no particular expertise) in der Behandlung der EO, wird empfohlen,
Patienten mit EO in spezialisierte Sprechstunden (combined thyroid-eye clinics)
zur weiteren Abklärung und Behandlung zuzuweisen. (IV,C).
Abklärung und Zuweisungskriterien (as recommended by EUGOGO (IV, C).
- Patienten mit Autoimmundysthyreose (Graves’ disease), welche weder Zeichen,
noch
Symptome
einer
EO
aufweisen,
brauchen
weder
weitere
ophthalmologische Abklärungen, noch müssen sie an ein spezialisiertes
Zentrum (combined thyroid-eye clinic) zugewiesen werden.
- Patienten mit ungewöhnlichem Krankheitsbild (asymmetrische u/o unilaterale
EO oder euthyreote EO) sollten hingegen zur Sicherung der Diagnose und
Behandlungseinleitung überwiesen werden, wie mild deren klinische Zeichen
und Symptome auch immer sind.
- Alle anderen Patienten sollten gemäss folgendem Protokoll behandelt werden
(IV, C):
Dringliche Überweisung bei folgenden Symptomen und/oder Befunden:
Symptome
Unerklärte Sehverschlechterung
Störungen des Farbsinns (Rotentsättigung, Farbsinnstörung)
Plötzlicher Exophthalmus und/oder Subluxatio bulbi
Befunde
Hornhauttrübungen
Lidschlussdefizit
Papillenschwellung / Papillenödem
Nicht dringliche Überweisung bei folgenden Symptomen und/oder Befunden:
Symptome
Auffällige Lichtempfindlichkeit mit Zunahme im Verlauf der letzten 1-2 Monate
Extrem kratzende Augen ohne Besserung auf befeuchtende Therapie innert 1 Woche
Schmerzen in oder hinter den Augen mit Zunahme in den letzten 2 Monaten
Progrediente, sichtbare Veränderung der Augen / Augenlider in den letzten 1-2
Monaten
Veränderungen der Augen/Augenlider, welche den Patienten beängstigen
Neuauftreten von Doppelbildern
Befunde
Beschwerden durch Lidretraktion / Lagophthalmus
Ungewöhnliche Schwellung und / oder Rötung der Augen und / oder Augenlider
Auftreten von restriktiven Motilitätsstörungen und / oder manifestem Strabismus
Auftreten einer Kopfzwangshaltung (KZH) zur Vermeidung von Doppelbildern
080564_Inhalt.indd 65
23.5.2008 14:56:13 Uhr
64
2. Rauchen und EO
Alle Patienten mit Autoimmundysthyreose (M.Basedow = Graves’ disease)
müssen über die Risiken des Rauchens bezüglich EO informiert werden (IV, C)
unter besonderem Hinweis auf den schädlichen Effekt hinsichtlich:
-Neuauftreten einer EO (IIb, B)
-Exazerbation einer vorbestehenden EO (IIb, B)
-schlechteres Ansprechen einer manifesten EO auf die Therapie (IIb, B)
-Risiko der Progredienz einer EO nach Radiojodtherapie (Ib, A)
Wenn die Aufklärung alleine die Patienten nicht zum Rauchverzicht bewegen
kann, sollte eine Zuweisung in eine Rauchstop-Sprechstunde (kantonale
Lungenliga), und / oder andere Rauchstop-Strategien erwogen werden. (IV, C)
3. Behandlung der Hyperthyreose und EO
Bei allen Patienten mit EO sollte so rasch und so konsequent wie möglich
Euthyreose wiederhergestellt werden (III, B).
Ein engmaschiges Monitoring (alle 4-6 Wochen) der SD-Werte in der
Initialphase, oder solange noch mit Veränderungen und Schwankungen der
SD-Werte gerechnet werden muss ist dabei zwingend (IV, C).
Patienten mit aktiver EO, welche mit Radiojod behandelt werden, sollten
prophylaktisch mit Steroiden abgeschirmt werden (initial mit 0.3-0.5 mg
Prednison/kg KG pro die p.o 1-3 Tage nach Radiojodapplikation und dann über
3 Monate langsam ausschleichend) (Ib, A). Kürzere Steroidgaben (1-2 Monate)
können u.U. denselben protektiven Effekt haben (IV, C)
Patienten mit inaktiver EO kann problemlos ohne Steroidschutz Radiojod
verabreicht werden, solange eine Hypothyreose konsequent vermieden wird
(IIb, B), und keine weiteren Risikofaktoren für eine Progredienz der EO wie
insbesondere Rauchen vorliegen (IV, C).
080564_Inhalt.indd 66
23.5.2008 14:56:16 Uhr
65
4. Einfache Massnahmen zur Verminderung der lokalen Symptome bei EO
Befeuchtende Augentropfen tags und Gel oder Salben nachts bei allen
Patienten mit EO und Symptomen der Hornhautexposition (III, B).
Prismenfolien bei Patienten mit Doppelbildern sofern möglich. Andernfalls
Okklusivverband/-Folie auf ein Auge (IV, C).
Botox-Injektion in die Oberlidretraktoren zur Verminderung der Lidretraktion
durch einen in dieser Technik erfahrenen Augenarzt (IV, C).
5. Bestimmung von Aktivitäts- und Schweregrad bei EO
EUGOGO empfiehlt die Bestimmung von Aktivitäts- und Schweregrad der EO
in spezialisierten Zentren mit ausreichender Erfahrung durchzuführen (IV, C):
(a) Bestimmung der Aktivität basierend auf den klassischen Entzündungszeichen: Der
Clinical Activity Score (CAS) ist die Summe aller einzelnen Punkte:
1.
2.
3.
4.
5.
6.
7.
Spontane retrobulbäre Schmerzen
Zunahme der Schmerzen bei Blickhebung und/oder Seit-/Abblick
Gerötete Augenlider
Injektion (Rötung) der Konjunktiven
Chemose (Schwellung der Konjunktiva)
Injektion und/oder Schwellung der Plica semilunaris und / oder der Caruncula
Schwellung (Oedeme) der Augenlider
Ein CAS > 3/7 definiert eine aktive EO
(b) Bestimmung des Schweregrades:
1.
Lidspalte (Distanz zwischen den Lidrändern in mm bei Blick geradeaus und
gemessen in der Pupillenachse = Primärposition)
2. Lidödeme (keine/fraglich – mässig - schwer) 1
3. Rötung der Augenlider (nein - ja) 1
4. Rötung (Injektion) der Konjunktiven (nein - ja) 1
5. Chemose (nein - ja) 1
6. Rötung (Injektion) der Caruncula/Plica (nein - ja) 1
7. Exophthalmus (in mm mit immer demselben Hertel Exophthalmometer und immer
derselben Basis in jedem einzelnen Patienten)
8. Subjektiver Diplopie Score (0 = keine DB; 1 = intermittierend, zB. In Primärposition
bei Müdigkeit oder beim Aufwachen; 2 = inkonstant, zB. Bei extremen Blickwendungen; 3 = konstant, also immer und in allen Blickrichtungen DB)
9. Motilitätseinschränkung (Monokulare Duktionen in Grad) 1
10. Hornhautbeteiligung (nein – Stippen – Ulkus)
11. Dysthyreote Opticus Neuropathie = DON (bester korrigierter Visus, Farbsinn, Papille,
RAPD (nein - ja), Gesichtsfeld, VEP)
1
080564_Inhalt.indd 67
www.eugogo.org
23.5.2008 14:56:20 Uhr
66
6. Klassifizierung des Schweregrades der EO
EUGOGO empfiehlt die folgende Klassifizierung (IV, C):
1.
2.
3.
Visusbedrohende EO: Patienten mit Dysthyreoter Opticus Neuropathie (DON)
und/oder Hornhautdekompensation. Diese Patienten gelten als absolute
NOTFÄLLE und ERFORDERN SOFORTIGE BEHANDLUNG
Mittelschwere bis schwere EO: Patienten ohne visusbedrohende EO mit
ausreichender Beeinträchtigung der täglichen Lebensqualität, welche die
Risiken einer immunsuppressiven Therapie (bei aktiver EO) oder einer
chirurgischen Intervention (bei inaktiver EO) rechtfertigt. Patienten mit
mittelschwerer bis schwerer EO weisen üblicherweise einen oder mehrere der
folgenden Befunde auf: Lidretraktion > 2 mm; mittelschwere bis schwere
Beteiligung der Weichteilgewebe; Exophthalmus > 3 mm über der Geschlechtsund Ethnie-korrigierten Norm; inkonstante oder konstante Doppelbilder
Milde EO: Patienten deren Symptome und Zeichen der EO eine zu geringe
Beeinträchtigung der täglichen Lebensqualität verursacht, welche eine
immunosuppressive oder chirurgische Therapie rechtfertigen würde. Diese
Patienten weisen üblicherweise einen oder mehrere der folgenden Befunde auf:
Lidretraktion (<2mm); milde Weichteilbeteiligung; Exophthalmus < 3 mm über
der Geschlechts- und Ethnie-korrigierten Norm; intermittierende oder keine
Doppelbilder; auf eine befeuchtende Therapie gut ansprechende Hornhautbeteiligung
7. Behandlung der DON mit Steroiden oder chirurgischer Orbitadekompression
Die bis heute einzigen erwiesenermassen wirksamen Behandlungen der DON
sind die hochdosierte Gabe von IV-Glucocorticoiden (IVGC) und die
chirurgische Orbitadekompression (III, B)
Die hochdosierte Gabe von IVGC ist die bevorzugte Primär-Behandlung bei der
DON (III, B).
Falls die hochdosierte Gabe von IVGC nach 1-2 Wochen zu keiner
Funktionsverbesserung führt, oder die erforderliche Dosis/Therapiedauer der
IVGC zu signifikanten Nebenwirkungen führt, sollte eine unverzügliche
chirurgische Orbitadekompression zur Entlastung des N.opticus durchgeführt
werden (IV, C).
Eine Orbitadekompression sollte bei Patienten mit DON und / oder Hornhautdekompensation und Steroidunverträglichkeit /-Kontraindikation schon primär
angeboten werden (III, B).
Sowohl die Behandlung mit hochdosierten IVGC, wie auch die chirurgische
Orbitadekompression, sollten ausschliesslich an spezialisierten Zentren mit
ausreichender Erfahrung durchgeführt werden (IV, C).
080564_Inhalt.indd 68
23.5.2008 14:56:24 Uhr
67
8. Visusbedrohende Hornhaut-Dekompensation bei der EO
Die visusbedrohende Hornhautdekompensation muss als Notfall behandelt
werden (IV, C).
Behandlung der visusbedrohenden Hornhautdekompensation:
Häufige befeuchtende Therapie (konservierungsmittelfreie Augentropfen und
Gels), Uhrglasverband, Blepharo-/Tarsorrhaphie, oder andere temporäre
Massnahmen bis zur Abheilung der Hornhaut (IV,C).
Systemische Steroide oder chirurgische Dekompression, falls die o.e.
Massnahmen allein nicht ausreichend sind (IV, C).
Bei Hornhautperforation und/oder schwerem Hornhautulkus, adäquate
Antibiose, sofortige Fibrinklebung, passagere Deckung mit Amnionmembran,
oder Hornhauttransplantation je nach Situation (IV, C).
Ist die Hornhautdekompensation einmal unter Kontrolle, muss zwingend eine
adäquate Verbesserung des Lidschlussdefizits (Lagophthalmus) folgen, damit
eine erneute Dekompensation verhindert werden kann (IV, C).
080564_Inhalt.indd 69
23.5.2008 14:56:28 Uhr
68
9. Behandlung der mittelschweren bis schweren, AKTIVEN EO
Behandlung der Wahl für die mittelschwere bis schwere, aktive EO (CAS > 3/7)
ist die gepulste Immunsuppression mit IVGC (iv Glucocorticoide) (Ib, A). Diese
Behandlung sollte in Zentren mit ausreichender Erfahrung durchgeführt
werden (IV, C).
Die totale kumulative Dosis Methylprednisolon sollte 8 g pro individuellen
Behandlungszyklus nicht übersteigen (III, B).
Bei Patienten, die mit hochdosierten IVGC behandelt werden sollen, müssen
vor Therapiebeginn Kontraindkationen wie etwa Leberfunktionsstörungen,
arterielle Hypertonie, gastrointestinale Ulkusleiden, Diabetes mellitus,
Harnwegsinfekte und Glaukom ausgeschlossen werden. Alle Patienten
müssen, während der gesamten Therapiedauer monitorisiert werden (IV, C).
Bisphosphonate werden bei Langzeitbehandlungen (> 3 Monate) mit oralen
Steroiden (durchschnittliche Tagesdosis > 5 mg Prednisonäquivalent)
empfohlen (Ia, A). Dies ist auch bei IVGC sinnvoll (IV, C).
Eine Orbitabestrahlung sollte bei Patienten mit aktiver EO und restriktiven
Motilitätsstörungen erwogen werden (Ib, A). Orbitabestrahlungen mit niedrigen
kumulativen Dosen (10 Gy) können genauso wirksam und besser verträglich
sein als höhere kumulative Dosen (20 Gy) (Ib, A). Dosen >20 Gy werden nicht
empfohlen (IV, C).
Bei Patienten unter 35 Jahren sollten Orbitabestrahlungen zurückhaltend
verschrieben werden; bei Patienten mit diabetischer und/oder hypertensiver
Retinopathie sind Orbitabestrahlungen kontraindiziert (III, B
Die Kombination von oralen Steroiden mit Orbitabestrahlung ist wirksamer
(more effective) als die Monotherapie mit einer Therpiemodalität alleine (Ib, A),
aber randomisierte klinische Studien, welche dies auch für IVGC zeigen
würden fehlen bis heute (IV, C).
080564_Inhalt.indd 70
23.5.2008 14:56:31 Uhr
69
10. Zeitpunkt und Reihenfolge chirurgischer Eingriffe bei der EO
Zeitpunkt und Reihenfolge chirurgischer Eingriffe sollten sorgfältig geplant
werden (IV, C).
Folgende sequentielle Reihenfolge sollte wenn immer möglich eingehalten
werden: Orbitadekompression – Schieloperation – Lidverlängerungen mit oder
gefolgt von blepharoplastischen Eingriffen, da der Effekt jedes vorangehenden
Eingriffs mit dem folgnden Eingriff interferieren kann (III, B).
Rehabilitative Eingriffe sollten nur in Patienten erfolgen, die eine während
mindestens sechs Monaten inaktive EO ohne jegliche Veränderungen
aufweisen (III, B).
Rehabilitative Eingriffe bei EO sollten nur in Zentren mit ausreichender
Erfahrung durchgeführt werden (IV, C).
11. Behandlung der milden EO
Bei milder EO sind Steroide selten indiziert, da deren mögliche Risiken und zu
erwartenden Nebenwirkungen den potentiellen Nutzen überwiegen (IV, C).
Ein exspektatives Verhalten ist in den meisten Fällen gerechtfertigt (IV, C).
In einer Minderheit der Patienten mit milder EO, kann die Lebensqualität
dermassen eingeschränkt sein, dass eine Behandlung wie bei einer
mittelschweren und schweren EO zu rechtfertigen ist (IV, C).
12. Diabetes und arterielle Hypertension bei EO
Diabetes und/oder arterielle Hypertension sind keine Kontraindikationen gegen
eine Behandlung mit Steroiden oder chirurgische Behandlungen bei EO (IV, C).
Eine diabetische Retinopathie und/oder eine schwere arterielle Hypertension
sind hingegen absolute Kontraindikationen hinsichtlich Orbitabestrahlung (III,
B).
Diabetes ohne Retinopathie ist eine relative Kontraindikation gegen eine
Orbitabestrahlung, jedoch ist die Beweislast (evidence) diesbezüglich weniger
klar (IV, C).
080564_Inhalt.indd 71
23.5.2008 14:56:34 Uhr
70
13. EO bei Kindern und Jugendlichen
Euthyreose so rasch und konsequent wie möglich wiederherstellen (III, B)
Kinder mit EO sollten konservativ behandelt
visusbedrohende Situation vorliegt (IV, C).
werden,
solange
keine
Einfache Massnahmen zur Behandlung spezifischer Symptome wie bei
Erwachsenen wenn immer möglich (sh. unter 4) (IV, C).
Steroide sollten bei Kindern wenn immer möglich vermieden werden (IV, C).
Orbitabestrahlung ist bei Kindern kontraindiziert (IV, C).
Anstreben einer konsequenten
passives Rauchen (IV, C)
080564_Inhalt.indd 72
Expositionsprophylaxe
für
aktives
und
23.5.2008 14:56:37 Uhr
71
Schilddrüse und Fertilität
Dr. Katharina Schiessl
Klinik für Reproduktions-Endokrinologie
UniversitätsSpital Zürich
Die Schilddrüsenfunktion der Frau hat grundlegende Bedeutung für die normale
Zyklusfunktion, Fertilität und Schwangerschaft sowie die fetale Entwicklung. Dies ist umso
bedeutender, da Schilddrüsenerkrankungen deutlich häufiger bei Frauen als bei Männern
vorkommen. Störungen der Schilddrüsenfunktion können ursächlich sein für gynäkologische
Erkrankungen und sollten früh in die Differentialdiagnose mit einbezogen werden. In der
Schwangerschaft ist eine ausreichende fetale Versorgung mit Schilddrüsenhormon essentiell
für die kindliche zerebrale Entwicklung. [1]
Schilddrüse, Zyklus und Fertilität
Notwendig für einen ungestörten ovulatorischen Zyklus ist ein ungestörter und
funktionierender Regelkreis Hypothalamus-Hypophyse-Ovar. Alle Formen einer
Schilddrüsendysfunktion beeinflussen direkt oder indirekt die Funktion der Ovarien und
damit des Reproduktionssystems. Frauen mit Schilddrüsendysfunktion neigen zu
Menstruationsstörungen, Infertilität, Aborten und erhöhter Morbidität in der Schwangerschaft.
Die Abklärung der Schilddrüsenfunktion gehört heute zu den Standards der
Sterilitätsabklärungen und steht am Anfang der Diagnostik. Bei Vorliegen einer Störung wird
zunächst die Schilddrüsenfunktion durch Substitution oder Suppression normalisiert und
damit sowohl die spontane Fertilität als auch die Ausgangslage für eine Sterilitätsbehandlung
verbessert.
Hypothyreose
2-4 % der Frauen im reproduktiven Alter leiden an eine Hypothyreose, die am häufigsten
durch eine Autoimmunerkrankung der Schilddrüse bedingt ist. Bei der Hypothyreose führt der
erhöhte hypotalamische TRH-Stimulus nicht nur zu einer erhöhten TSH-Sekretion, sondern
auch zu einer erhöhten Prolaktinfreisetzung aus der Hypophyse. Zusätzlich kommt es zu einer
Störung des Östrogenmetabolismus, indem vermehrt statt Östradiol das weniger stark
wirksame Östriol gebildet wird. Die so veränderte Rückkopplung der Östrogene stört den
Regelkreis auf hypothalamisch-hypophysärer Ebene und führt zusammen mit der
Hyperprolaktinämie zur Störung des LH-Pulsmusters. Je nach Ausmass führt dies zu
zunehmenden funktionellen Störungen des normalen Zyklus: von einer Störung der
Follikelreifung mit nachfolgender Corpus-Luteum-Insuffizienz über das Entstehen
anovulatorischer Zyklen mit Durchbruchblutungen bis hin zur Amenorrhoe. Während ältere
Arbeiten das Vorkommen von Menstruationsstörungen bei der Hypothyreose mit bis zu 70 %
bezifferten, sprechen neuere Arbeiten von einer Prävalenz von 20-25 %.
Zusätzlich führt die verminderte SHBG-Produktion der Leber bei Hypothyreose zu einem
Anstieg des freien (wirksamen) Testosterons, so dass Androgenisierungserscheinungen wie
Hirsutismus auftreten können.
Unabhängig von diesen hormonellen Effekten kann eine Hypothyreose über eine verminderte
Produktion von Gerinnungsfaktoren zu Menorrhagien führen.
Latente (subklinische) Hypothyreose
Die subklinische Hypothyreose ist ein in der Fertilitätsmedizin seit langem diskutierter
Befund. Sie liegt vor, wenn die Schilddrüsenhormonkonzentration noch im Referenzbereich
080564_Inhalt.indd 73
23.5.2008 14:56:41 Uhr
72
liegt, TSH aber wiederholt oberhalb desselben gemessen wird. Heute nicht mehr allgemein
gebräuchlich ist der TRH-Test, dessen überschiessende Reaktion bei normalen Basalwerten
ebenfalls zu dieser Diagnose führt.
Untersuchungen aus den 80er Jahren brachten diese Konstellation in Zusammenhang mit
Zyklusstörungen im Sinne einer Corpus-Luteum-Insuffizienz und plädierten daher für eine
Substitutionsbehandlung [2]. Nachfolgende Untersuchungen konnten diesen Zusammenhang
nur zum Teil nachvollziehen, wobei die Datenlage insgesamt schwer vergleichbar ist und
Kontrollgruppen zum Teil fehlen. Aktuelle Daten scheinen eine niedrigere
Schwangerschaftsrate und eine höhere Abortrate für Frauen mit latentern Hyopthyreose zu
belegen, unabhängig von dem Vorliegen einer Autoimmunthyreoiditis.
Hyperthyreose
Eine hyperthyreote Stoffwechsellage führt neben den bekannten Symptomen zu einer
vermehrten SHBG-Produktion in der Leber und dadurch zu einer Abnahme des freien
Testosterons sowie zu einer vermehrten Östrogensynthese aus den androgenen Präkursoren.
Der teilweise zu beobachtende LH-Anstieg mit Verlust der Pulsatilität ist bisher
pathophysiologisch noch unvollkommen verstanden. Im Allgemeinen bleibt aber der
ovulatorische Zyklus bei der Hyperthyreose erhalten, während die Aborthäufigkeit erhöht ist.
Latente Hyperthyreose
Die subklinische Hyperthyreose kommt in der Normalbevölkerung mit einer Häufigkeit von
1-5 5 vor. Sie kann Hinweis auf eine noch kompensierte Stoffwechsellage sein, die unter den
Bedingungen einer Schwangerschaft exazerbieren könnte und sollte daher abgeklärt werden.
Immunthyreopathie
5-10 % der Frauen im gebärfähigen Alter sind von einer Immunthyreopathie betroffen,
Männer in 5-10fach geringerem Mass. Sie ist die häufigste Schilddrüsenerkrankung von
Frauen und damit auch die häufigste Ursache einer Schilddrüsendysfunktion, kann aber auch
symptomlos verlaufen. Trotz schwieriger Vergleichbarkeit der vorliegenden Studien scheinen
doppelt soviel Frauen mit Fertilitätsstörungen davon betroffen zu sein. Es besteht ein
Zusammenhang zum Vorkommen der Endometriose und des PCO-Syndroms sowie anderer
Autoimmunerkrankungen. Zum pathogenetischen Zusammenhang der Immunthyreopathie mit
Sterilität liegen weder In-vitro-Studiendaten noch Tiermodelldaten vor, so dass
Erklärungsmodelle augenblicklich spekulativ bleiben [3].
Schilddrüsenstörungen und männliche Fertilität
Auf die männliche Fertilität und Spermienproduktion hat die Schilddrüsenfunktion deutlich
weniger Einfluss als auf die weibliche. Bisherige Untersuchungen können keinen
wesentlichen und konstanten Einfluss auf die Spermienanzahl und Qualität in Bezug auf
Schilddrüsenerkrankungen belegen [4].
Schilddrüsenstörungen in der Reproduktionsmedizin
Neuere Untesuchungen zeigen einen signifikanten Einfluss des TSH-Spiegels auf den Erfolg
einer IVF-Behandlung: Frauen mit hohen Werten hatten häufiger keine Befruchtung der
Eizellen [5].
Die kontrollierte ovarielle Überstimulation im Rahmen einer IVF/ICSI-Behandlung führt zur
gleichzeitigen Reifung mehrerer Eizellen und damit zu einer Erhöhung des Östradiolspiegels
auf Werte, die denen des mittleren Schwangerschaftsdrittels entsprechen [3]. Hohe
Östrogenspiegel führen zu einem Anstieg des Thyroxin-bindenden Globulins TBG, das 75 %
des zirkulierenden T4 bindet und damit zu einem Absinken des freien wirksamen T4 führt.
Dies stellt eine wichtige Ursache für eine TSH-Erhöhung im Rahmen der Behandlung dar.
080564_Inhalt.indd 74
23.5.2008 14:56:44 Uhr
73
Schilddrüsenantikörper
Patientinnen mit TPO-Antikörpern und normaler Schilddrüsenfunktion haben im IVFProgramm eine normale Schwangerschaftsrate, aber signifikant erhöhte Abortraten [6].
Metaanalysen zeigen eine klare Assoziation zwischen der Präsenz von
Schilddrüsenantikörpern und dem Risiko einer Fehlgeburt [7], das auf das 3-5fache steigt.
Schilddrüsenantikörper scheinen per se einen negativen Einfluss auf die Implantation zu
haben und führen zu erhöhten Frühaborten. Augenblicklich existieren drei erklärende
Hypothesen: 1. sie repräsentieren als Marker eine generelle Imbalance des Immunsystems, die
sich auf das fetale Gewebe auswirkt 2. trotz peripherer Euthyreose liegt bei den betroffenen
Frauen eine leichte Unterversorgung oder Fehlanpassung an den durch hohe Östrogenspiegel
oder Schwangerschaft erhöhten Bedarf vor (ausgehend von dem Befund, dass bei Abortus
imminens die Frauen mit niedrigerem Schilddrüsenhormon häufiger abortierten) 3. durch den
(unerklärten) Zusammenhang von Immunthyreopathie und Sterilität werden die betroffenen
Frauen später schwanger – und Alter ist ein starker unabhängiger Faktor für Aborte.
Es gibt inzwischen mehrere Studien, die zeigen, dass durch eine frühzeitige adäquate T4Substitution die Abortrate (und Frühgeburtenrate) gesenkt werden kann [8]. Für eine generelle
Substitutions-Empfehlung fehlen allerdings noch die Daten einer grossen doppelblinden
placebokontrollierten Studie.
Diagnostik
Durch die moderne Labordiagnostik mit hochsensitiven Assays kann eine Euthyreose heute
allein aufgrund des TSH-Wertes sicher nachgewiesen werden. Strittig ist aber immer mehr der
obere Grenzwert, der als normal anzusehen ist. Aufgrund neuerer epidemiologischer
Untersuchungen präferieren mehrere Autoren einen oberen Grenzwert von 2-2,5 mIU/l (z.B.
die National Academy of Clinical Biochemistry) und empfehlen diesen für Frauen, die eine
Schwangerschaft planen. Frauen mit einem TSH-Wert im Bereich von 2,5 – 4 mIU/l sollten
eine zusätzliche Bestimmung von TPO-Antikörpern durchführen, da bei positiven
Antikörpern langfristig die Gefahr einer Hypothyreose bestehen kann [3] .
Schwangerschaft
Während der Schwangerschaft steigen die Bindungsproteine der Schilddrüsenhormone stark
an, während die Konzentration des nicht gebundenen stoffwechselaktiven
Schilddrüsenhormons konstant bleibt. Dieser Effekt erklärt sich unter anderem durch die
TSH-ähnliche Wirkung des Schwangerschaftshormons HCG, die auf der partiellen
Strukturgleichheit beruht und die ausreichende Schilddrüsenhormonversorgung des Feten
sicherstellen soll [9, 10]. Grundsätzlich ist diese für die kindliche zerebrale Entwickung
eminent wichtig, entscheidend für das Vermeiden eines kindlichen Kretinismus ist die
ausreichende Schilddrüsenhormonversorgung im 1. und 2. Schwangerschaftstrimenon [11].
Vorbestehende Schilddrüsenerkrankungen wie Autoimmunthyreoditiden, behandelte
Hypothyreosen oder substituierte Patientinnen nach Schildrüsenresektion können dazu führen,
dass der erhöhte Schilddrüsenhormonbedarf in der Schwangerschaft nicht erfüllt werden kann
und eine hypothyreote Stoffwechsellage resultiert. Bei mit L-Thyroxin behandelten Frauen
sollte der TSH-Zielbereich zwischen 0,5-2 mIU/l liegen.
Hyperemesis
Die Hyperemesis gravidarum ist definiert als persistierendes Erbrechen mit einer Frequenz
von mehr als fünfmal pro Tag, eine Gewichtsabnahme von mehr als 5 % sowie erschwerte
Nahrungs- und Flüssigkeitsaufnahme. Das Krankheitsbild ist teilweise mit einer
hyperthyreoten Stoffwechsellage vergesellschaftet (HCG-assoziierte Hyperthyreose). Speziell
080564_Inhalt.indd 75
23.5.2008 14:56:47 Uhr
74
bei hohen HCG-Werten wie bei dem Vorliegen von Gemini oder einer Blasenmole bindet
HCG am TSH-Rezeptor und kann so zur Überfunktion führen. Ursächlich kommen aber auch
TSH-Rezeptorvarianten in Frage [12]. Es wird angenommen, dass ein selbstlimitierender
transienter Hyperthyreoidismus der Hyperemesis gravidarum (THHG) existiert. Er kann bis
zur 18. SSW bestehen und ist nicht therapiebedürftig. Voraussetzung für die Diagnose eines
THHG sind,
- dass pathologische serologische Befunde während einer Hyperemesis festgestellt werden,
- keine Überfunktion der Schilddrüse vor der Schwangerschaft bestand,
- keine klinischen Zeichen eines Hyperthyreoidismus existieren und
- ein negativer Antikörpertiter vorhanden ist [13].
Hyperthyreose
Eine unbehandelte Hyperthyreose geht einher mit einem erhöhten Risiko für Frühgeburten,
intrauteriner Wachstumsretardierung, fetalen Tachykardien, Präekklampsie, Totgeburten,
einer neonatalen Thyreotoxikose und der Gefahr einer postpartalen Autoimmun-Thyreoiditis
Hypothyreose
Eine unbehandelte Hypothyreose geht einher mit erhöhten Abortraten, Frühgeburten und
Störungen der zerebralen kindlichen Entwicklung (Neuronale Zelldifferenzierung und
Migration, axonales und dentritsches Wachstum, Myelinformation und Synaptogenese) [14].
Hinweise für die Praxis
x
x
x
x
Patientinnen mit Zyklusstörungen, Sterilität oder wiederholten Aborten sollten
bezüglich der Schilddrüsenfunktion abgeklärt werden (basales TSH, bei
pathologischen Werten weitere Abklärung)
vor einer Sterilitätsbehandlung sollten Schilddrüsendysfunktionen behandelt werden
schon präkonzeptionell substituierte Patientinnen haben unter einer IVF/ICSIBehandlung sowie in der Schwangerschaft einen erhöhten Bedarf und sollten
engmaschig kontrolliert und mit der Dosis angepasst werden
Frauen mit subklinischer Hypothyreose sollten bei Zyklusstörungen und
Sterilitätsbehandlungen substituiert werden
Literatur
1.
2.
3.
4.
5.
6.
7.
080564_Inhalt.indd 76
Haddow, J.E., et al., Maternal thyroid deficiency during pregnancy and subsequent
neuropsychological development of the child. N Engl J Med, 1999. 341(8): p. 549-55.
Bohnet, H.G., K. Fiedler, and F.A. Leidenberger, Subclinical hypothyroidism and
infertility. Lancet, 1981. 2(8258): p. 1278.
Poppe, K., B. Velkeniers, and D. Glinoer, Thyroid disease and female reproduction.
Clin Endocrinol (Oxf), 2007. 66(3): p. 309-21.
Poppe, K., et al., Is systematic screening for thyroid disorders indicated in subfertile
men? Eur J Endocrinol, 2006. 154(3): p. 363-6.
Cramer, D.W., et al., Serum prolactin and TSH in an in vitro fertilization population:
is there a link between fertilization and thyroid function? J Assist Reprod Genet, 2003.
20(6): p. 210-5.
Poppe, K., et al., Assisted reproduction and thyroid autoimmunity: an unfortunate
combination? J Clin Endocrinol Metab, 2003. 88(9): p. 4149-52.
Prummel, M.F. and W.M. Wiersinga, Thyroid autoimmunity and miscarriage. Eur J
Endocrinol, 2004. 150(6): p. 751-5.
23.5.2008 14:56:51 Uhr
75
8.
9.
10.
11.
12.
13.
14.
080564_Inhalt.indd 77
Negro, R., et al., Levothyroxine treatment in euthyroid pregnant women with
autoimmune thyroid disease: effects on obstetrical complications. J Clin Endocrinol
Metab, 2006. 91(7): p. 2587-91.
Kennedy, R.L. and J. Darne, The role of hCG in regulation of the thyroid gland in
normal and abnormal pregnancy. Obstet Gynecol, 1991. 78(2): p. 298-307.
Glinoer, D., The regulation of thyroid function in pregnancy: pathways of endocrine
adaptation from physiology to pathology. Endocr Rev, 1997. 18(3): p. 404-33.
Cao, X.Y., et al., Timing of vulnerability of the brain to iodine deficiency in endemic
cretinism. N Engl J Med, 1994. 331(26): p. 1739-44.
Rodien, P., et al., Familial gestational hyperthyroidism caused by a mutant
thyrotropin receptor hypersensitive to human chorionic gonadotropin. N Engl J Med,
1998. 339(25): p. 1823-6.
Chan, N.N., Thyroid function in hyperemesis gravidarum. Lancet, 1999. 353(9171): p.
2243.
Lazarus, J.H., Thyroid dysfunction: reproduction and postpartum thyroiditis. Semin
Reprod Med, 2002. 20(4): p. 381-8.
23.5.2008 14:56:55 Uhr
76
Der 30. Winterthurer Fortbildungskurs wird vollumfänglich durch die folgenden
Firmen finanziert:
ABBOTT AG Primary Care, Baar
ABBOTT Diabetes Care, Baar
ASTRA ZENECA AG, Zug
BAYER (Schweiz) AG, Diabetes Care, Zürich
BIOFORCE AG, Roggwil
ELI LILLY (Suisse) S. A., Vernier
ESSEX Chemie AG, Luzern
FUTURELAB – ILAMED, Frauenfeld
GLAXO SMITH KLINE AG, Münchenbuchsee
IBSA S. A., Lugano
MEPHA Pharma AG, Aesch BL
MERCK Schweiz AG, Dietikon
MERCK SHARP & DOME-CHIBRET AG, (Schw.) Glattbrugg
NOVARTIS Consumer Health (Schweiz) AG, Bern
NOVARTIS Pharma (Schweiz) AG, Bern
NOVO NORDISK Pharma AG, Küsnacht-Zürich
PERMAMED AG, Therwil
PFIZER AG, Zürich
ROCHE Diagnostics (Schweiz) AG, Rotkreuz
ROCHE Pharma (Schweiz) AG, Reinach/BL
SANOFI - AVENTIS Pharma (Suisse) S. A., Meyrin
SERVIER (Suisse) S. A., Meyrin
TAKEDA - PHARMA AG, Lachen
VIOLLIER Winterthur AG, Winterthur
Den oben genannten Firmen möchten wir von Herzen danken, dass Sie immer bereit
sind, die ärztliche Fortbildung zu unterstützen.
Wissenschaftliche Leitung: Dr. med. D. Kappeler
Der nächste 31. Winterthurer Fortbildungskurs findet statt:
Donnerstag, den 04.06.2009
Thema: Nebennieren
080564_Inhalt.indd 78
23.5.2008 14:56:59 Uhr
III
Referentenverzeichnis
Dr. med. Georg von Arx
Facharzt Ophthalmologie FMH
ADMEDICO Augenzentrum
Fährweg 10
4600 Olten
Tel. 062 206 87 37
[email protected]
Prof. Dr. med. Christoph A. Meier
Departementsleiter Innere Medizin
Chefarzt der Klinik für Innere Medizin
Stadtspital Triemli
Dept. für Innere Medizin
Birmensdorferstr. 497
8063 Zürich
Tel. 044 466 21 01
[email protected]
Dr. med. Ivo Tosoni
Leitender Arzt
Facharzt für Pathologie und klinische Zytopathologie FMH
Kantonsspital Winterthur
Brauerstr. 15 / Postfach 834
8401 Winterthur
Tel. 052 266 25 05
[email protected]
PD Dr. med. Mirjam Christ-Crain
Oberärztin Endokrinologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
Tel. 061 265 52 06
[email protected]
Dr. med. Thomas Clerici
Leitender Arzt
FMH Schwerpunkt Viszeralchirurgie
Klinik für Chirurgie
Kantonsspital St. Gallen
9007 St. Gallen
Tel. 071 494 13 35
[email protected]
Dr. med. Katharina Schiessl
Oberärztin
Klinik für Reproduktions-Endokrinologie
Dept. Frauenheilkunde
UniversitätsSpital Zürich
Frauenklinikstr. 10
8091 Zürich
Tel. 044 255 50 09
[email protected]
080564_Inhalt.indd 79
23.5.2008 14:57:01 Uhr
IV
Dr. med. Jürg Lareida
Facharzt Endokrinologie/ Diabetologie FMH
Vordere Vorstadt 16
5000 Aarau
Tel. 062 822 27 66
[email protected]
Dr. med. Christian Meier
Facharzt Endokrinologie/Diabetologie FMH
Missionsstr. 24
4055 Basel
Tel. 061 264 97 97
[email protected]
Dr. med. Karl Scheidegger
Facharzt Endokrinologie/Diabetologie FMH
Vadianstr. 31
9000 St. Gallen
Tel. 071 223 51 52
[email protected]
Dr. med. Dirk Kappeler
Facharzt Endokrinologie/Diabetologie
Untertor 1
8400 Winterthur
Tel. 052 232 08 40
[email protected]
Dr. med. Jörg Furrer
Hohenbühlstr. 3
8032 Zürich
Dr. med. Margarete Maier-Wölfle
Fachärztin Endokrinologie/Diabetologie FMH
Kantonsspital St. Gallen
Rorschacherstrasse
9007 St. Gallen
[email protected]
Dr. med. Andreas Meili
Leitender Arzt Nuklearmedizin
Institut für Radiologie und Nuklearmedizin
Kantonsspital Winterthur
Brauerstr. 15
8400 Winterthur
Tel. 052 266 26 33
[email protected]
080564_Inhalt.indd 80
23.5.2008 14:57:04 Uhr