Foliensammlung
Werbung

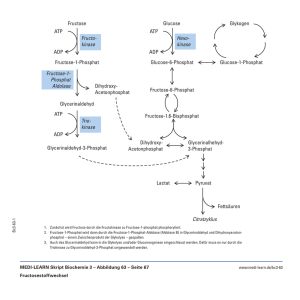
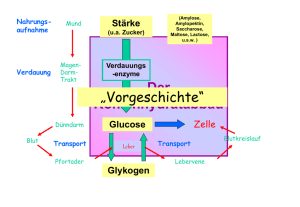
Allgemeine Biologie III: Biochemische Grundlagen WS 2007/2008 Scheer 15.10. - 12.11.07 Einführung Stoffwechsel Bioenergetik Glycolyse Nickelsen 19.11. - 17.12.07 Energiestoffwechsel im Mitochondrium Citratcyclus Atmungskette Fettsäureabbau 17.12.08 1. Klausur: Teile Scheer/Nickelsen Soll 7.1. - Photosynthese Gluconeogenese 4.2.08 4.2.08 2. Klausur: Teil Soll Klausuren – Regelung Die Abschlussklausur umfasst drei Teile zu jeweils ca. 35 Punkten (je 45 Minuten) Zwei davon werden am 17.12.07 geschrieben (Teile Scheer, Nickelsen), der dritte am 4.2.07 (Teil Soll). Eine Teilklausur ist bestanden, wenn mindestens 50% der maximalen Punkte erreicht wurden. Die Gesamtklausur ist bestanden, wenn mindestens 50% der maximalen Punktzahl aller drei Teile erreicht sind. Nicht bestandene Teile können nachgeschrieben werden. Die Nachklausuren für alle drei Teile finden voraussichtlich am 29.2.07 statt (bitte auf Änderungen achten). Eine weitere Nachklausur gibt es bei Bedarf Anfang SS 2008. Literatur Grundlagen Campbell: Biologie Kap. 2,6,8-10 Horton et al.: Principles of Biochemistry Richter: Biochemie der Pflanzen Kap. 1,2,4,9,14 Strasburger: Lehrbuch derBotanik Teil 2.1 Zur Vertiefung Heldt: Pflanzenbiochemie Lehninger: Biochemie Metzler: Biochemie 1 und 2 Stryer: Biochemie Voet/Voet: Lehrbuch der Biochemie Stryer Biochemie Spiel Biochemical Pathways Atmungskette http://www.expasy.ch/cgi-bin/search-biochem-index The Biochemists Songbook Vorlesungsfolien und andere Materialien im Internet .http://www.botanik.biologie.uni-muenchen.de/scheer → Ergänzendes Material → Allgemeine Biologie Begleitblätter im Netz Vorlesungsteil I „Übersicht, Thermodynamik und Glykolyse“ • 29 MB Power-Point Datei (.ppt), mit Animationen Rechtsclick und speichern als .ppt-Datei, • 6 MB Hypertext Datei (.htm), ohne Animationen Anclicken (ohne Animationen) • 4 MB AdobeWriter Datei (.pdf), ohne Animationen Rechtsclick und speichern als .pdf-Datei • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Homöostase Entwicklung Reproduktion Kristalle sind a) beständig, b) wachsen, und c) können aus Bruchstücken neue Kristalle bilden Fließgleichgewicht Fremyella diplosiphon t o R t h lic Gr ün lic ht Adaptationen Evolution Cys-260 Cys-20 Nach Lamparter, 2004 • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Heterotrophie (Cytoplasma) (Mitochondrium-Matrix) (MitochondriumMembran) Energiereiche Verbindungen Fette Fettsäure -Triglyceride (Öle), –Ether (Wachse) Kohlehydrate Zucker, Stärke, Glykogen, Zellulose Proteine Muskelproteine, Speicherproteine ATP NAD(P)H Adenosintriphosphat Nicotinamid-Adenosin-Dinucleotid, reduziert Autotrophie Licht Chemoautotrophe Synthese Beispiel: S0 + Fdox → SO4-- + Fdred Sonnenenergie erhält Biosystem Erde Solarkonstante 1,5 kW/qm Sonnenlyrik Franz von Assisi Ingeborg Bachmann Echnaton Medium für Cyanobakterium (Anabaena PCC 7120) Photoautotrophie Chemoautotrophie Medium für Purpurbakterium (Rhodobacter spheroides) Photoheterotrophie Medium für Desulfobacter sp. Auxotrophie C – Kreislauf (bei Raten alle Werte pro Jahr) Heterotrophie Eintrag: 5 Gt Austrag: 1 Gt Photoautotrophie Atmosphäre: 721 Gt Verbrennung fossiler Res. 5 Gt Dissimilation: 56 Gt Assimilation: 113 Gt (- 210) Pflanzen: 560 Gt Dissimilation: 56 Gt Streu: 56 Gt Boden: 1120 Gt 1 Gt • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele C – Kreislauf: Energiebilanz (alle Werte pro Jahr) Heterotrophie Verluste: >99 % Photoautotrophie Atmosphäre: 721 Gt Verbrennung fossiler Res. 5 Gt 2 • 1017 kJ Dissimilation: 56 Gt 2,23 • 1018 kJ Assimilation: 113 Gt 4,5 • 1020 kJ Pflanzen: 560 Gt Dissimilation: 56 Gt Streu: 56 Gt 2,23 • 1018 kJ 2,23 • 1018 kJ Boden: 1120 Gt 1 Gt 4 • 1016 kJ Energetik des C-Cyclus Heterotrophe Organismen ΔG = ΔH - T ΔS Freie ReaktionsEnthalpie (maximal verfügbare Energie) ReaktionsEnthalpie (Wärmetönung) ReaktionsEntropie (Ordnungsänderung) ΔG°´ Freie Standard-Reaktionsenthalpie ΔG°´ = - RT • ln K Standardbedingungen T = 25°C = 298 K p = 1 atm c = 1 M aber cWasser = 55 M pH = 7 Temperatur in K Gaskonstante 8,31 J • grad -1 • Mol-1 Gleichgewichtskonstante K = Π cend / Π cAusgang im Gleichgewicht Gleichgewichte Statisches Gleichgewicht (Ruhend, im Energieminimum) • • • • • Kugel in ruhender Schale Kristall bei tiefer Temperatur Meeresstille Toter Organismus ΔG = 0 Dynamisches Gleichgewicht (Reversible Auslenkungen um Energieminimum) • • • • Kugel in vibrierender Schale Proteinmolekül Bewegte See ΔG = 0 Fließgleichgewicht (ausgeglichener Zu- und Abfluss von Materie, weit v. statischen /dynamischen Gleichgewicht, ständig Bedarf an freier Energie, Umkehrung erfordert Energie) • • • • Wasserfall Wasserkraftwerk Lebender Organismus ΔG < 0 ΔG Freie Reaktionsenthalpie unter Nicht-Standard Bedingungen ΔG = ΔG°´ + RT • ln (Πcend / ΠcAusgang) Konzentrationsarbeit Energiereiche Verbindungen: Energetik Verbrennung (Redox – Energie) Fette ΔG°´Oxidation = - 39 kJ/g (-11.000 kJ•Mol-1) Palmitat Zucker ΔG°´Oxidation = - 17 kJ/g (- 2.870 kJ•Mol-1) Glucose Proteine ΔG°´Oxidation = - 23 kJ/g (- 2.300 kJ•Mol –1 pro AS) ΔG°´part. Oxid = - 17 kJ/g (- 1.700 kJ•Mol –1 pro AS) NADH + ½ O2 →NAD + H2O ΔG°´ = - 218 kJ•Mol -1 Hydrolyse von Energiereichen Bindungen (Säure – Anhydride, Thioester) ATP Adenosintriphosphat ΔG°´ ≈ -32 kJ•Mol -1 ATP → ADP + Pi ADP → AMP + Pi ΔG°´ ≈ -32 kJ•Mol -1 ATP → AMP + PPi ΔG°´ ≈ -32 kJ•Mol -1 PPi → 2 Pi ΔG°´ ≈ -32 kJ•Mol -1 Acyl-CoA Acetyl-CoA → Acetat + CoA-SH ΔG°´≈ -32 kJ•Mol-1 NH2 ΔG°´Hydrolyse ≈ -32 kJ/Mol ATP O O N N O -O P O P O P O OO O- OH ΔG°´Oxidation m. Sauerstoff ≈ -218 kJ/Mol NADH O H H N N O OH NH2 N N NH2 O N O OH O O P O P O O OOH N N O OH OH -Statisches Gleichgewicht: Kugel am Tiefpunkt in ruhender Schale Wiederholung 1. Tag -Dynamische Gleichgewicht:Kugel nahe Tiefpunkt in vibrierender Schale -Fließgleichgewicht: Stabiler Zustand entfernt vom statischen oder dynamischen Gleichgewicht,stabilisiert durch ständige Zufuhr von freier Energie -Einige Charakteristika des Lebens: Homöostase, Entwicklung, Vermehrung, Anpassungen, Evolution Deckung freier Energie bei: durch: -Heterotrophie: Energiereiche organische Nahrung -Autotrophie: Licht oder anorganische Redoxchemie -Auxotrophie: Bedarf spezifischer organischer Zusatzstoffe Thermodynamik −ΔH Änderung der inneren Energie (Wärmetönung) −ΔS Änderung der Entropie (Ordnungsgrad) −ΔG Änderung der freien (= nutzbaren) Energie ΔG = ΔH - T•ΔS ΔG°´ = -R•T•lnK oder ΔG°´ = -n•F• ΔE°´ ΔG = ΔG°´ + RT • ln (Π cend / Π cAusgang) Energetische Kopplung Glc + ATP → Gcl-6-P + ADP Glc-6-P → Glc + Pi . ATP → ADP + Pi ΔG°´ = -18,4 kJ • Mol-1 ΔG°´ = - 13,6 kJ • Mol-1 ΔG°´ = - 32 kJ • Mol-1 Phosphatgruppen – ΔG°´Übertragung A→B = ΔG°´Hydrolyse A - ΔG°´Hydrolyse B Übertragungspotential ΔG°´Hydrolyse [kJ/Mol] Reaktion ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯ PEP → Pyruvat + Pi - 61 P2GS → 3-PGS + Pi - 54 Kreatin + Pi - 43 Kreatin-P→ ATP → AMP + PPi -33 - 37 ADP → AMP + Pi - 36 ATP → ADP + Pi - 34 PPi → 2 Pi - 33 Glc-1-P → Glc + Pi - 21 Glc-6-P → Glc + Pi - 14 Beispiele: PEP + ATP → Pyruvat + ATP Glc-1-P + ADP → Glc + ATP ΔG°´ = -61 + 34 = -27 kJ/Mol ΔG°´ = -21 + 34 = +13 kJ/Mol Energetische Kopplung: P-Übertragung ΔG°´total = Σ ΔG°´Einzelreaktionen . ΔG°´ = - 32 kJ • Mol-1 ΔG°´ = + 14 kJ • Mol-1 Glc + ATP → Gcl-6-P + ADP ΔG°´ = - 18 kJ • Mol-1 ATP Glc + Pi ATP GDP + Pi → ADP + Pi → Glc-6-P → ADP + Pi → GTP ATP + GDP → ADP + GTP ΔG°´ = - 32 kJ • Mol-1 ΔG°´ = + 32 kJ • Mol-1 ΔG°´ = 0 kJ • Mol-1 Wichtige Redoxreagentien Elektronen – Übertragungspotential (Redoxpotential) ΔG°´ Freie Standard-Reaktionsenthalpie ΔG°´ = - nF ΔEo´ Differenz der Standard-Redoxpotentiale Faraday Konstante F = 9,65 kJ • V-1 • e-1 • Mol-1 Zahl der übertragenen Elektronen Energetische Kopplung: e- - Übertragung ΔG°´total = Σ ΔG°´Einzelreaktionen NADH + ½ O2 Fumarat + H2O → NAD + H2O ΔG°´ = - 218 kJ • Mol-1 → Succinat + ½ O2 ΔG°´ = +152 kJ • Mol-1 NADH + Fumarat → NAD + Succinat ΔG°´ = -66 kJ • Mol-1 • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Übersicht Abbaureaktionen Polysaccharide Hydrolyse Monosaccharide NADH + ATP Glycolyse Fette Polypeptide Hydrolyse Hydrolyse Glycerin + Fettsäuren Aminosäuren NADH + ATP Transaminierung ß-Oxidation NADH + ATP Pyruvat Gärungen (anaerob) - NADH Acetyl-CoA Carbonsäuren Citratcyclus NADH + ATP + CO2 Atmungskette (aerob) Ethanol + CO2 Laktat O2 ATP +H2O + NAD+ Systematik für Stoffwechselreaktionen Glucose-6-phosphat Mg2+ oder Mn2+ Phosphoglucoisomerase Fructose-6-phosphat ATP + Phosphofructokinase ADP Fructose-1,6-bisphosphat ATP ADP, AMP, Fructose-2,6-bisphosphat ATP, Citrat Edukte und Produkte ATP Enzyme Cofaktoren, Cosubstrate Positive + Regulatoren Negative Glucose H-C=O 1 H-C-OH * 2 HO-C-H * 3 H-C-OH * 4 H-C-OH * 5 CH2OH 6 CH2OH 6 H2O *5 4 O * OH HO * 3 1 2 * * OH OH Glucose: Stereochemie HO HO * * HO * O Cellulose: ß-1,4 * OH ß * OH OH α Stärke: α-1,4 (+ α-1,6) Glykogen: α-1,4 Cellulose H H H HOCH2 H H H HOCH2 O HO HO Stärke OH OH O HO HO H H H H OH OH α-1,4 ß-1,4 Monomer Amylose Amylopektin Stärke Pi Amylasen Phosphorylasen Maltose Glc-1-P P-Glucomutase Maltase ATP ADP Glc ATP ADP Glc-6-P Hexokinase Fru-6-P P-Hexose-Isomerase Fru-1,6-P P-Fructokinase Aldolase 2 x 2-PGS 2 x 3-PGS P-Glyceromutase Enolase 2 x P2-GS PGS-Kinase GAP GAP-Dehydrogenase 2 Pi 2 ATP 2 NAD 2 PEP Pyruvat-Kinase 2 NADH 2 ATP 2 Pyruvat Glykolyse DHAP Triose-P-Isomerase IN PRAISE OF E.M.P. (Tune: "The Brifish Grenadiers") Some pathways lead to glory, like Hatch and Slack and Knoop, Utter, Calvin, Cori-a most distinguished group, But of all of nature's pathways, we sing the praise today Of Parnas, Embden, Meyerhof-the glycolytic way. Glucose, by hexokinase is turned to G6P (You might use glucokinase, you must use ATP) And, note, glycogenolysis (when stores are in the cell) Gives GIP which then mutates to G6P as well. The moiety of glucose, in the succeeding phase 1s transferred to a ketose by an isomerase Phosphofructokinase now, acts on that F6P; Fructose 1-6 bisphosphate is the product that's set free. The kinase is effected quite complicatedly And as you'll have suspected it uses ATP; FDP by aldolase is split reversibly To phosphoglyceraldehyde, also DHAP. The former and the latter can each equilibrateIt really doesn't matter for metabolic fateSo follow PG aldehyde and double what you see, You'll get the total balance sheet for a hexose moiety. Wiederholung - Zwei energiereiche Verbindungen: ATP Adenosintriphosphat*** NADH Nicotinamid-Adenin-Dinucleotid 2. Tag Hydrolyse Säureanhydrid Reduktionsenergie - Phosphatgruppen-Übertragungspotential Steigt mit Oxidationsgrad: Anhydrid > Halbacetal > Ester C-P-Anhydrid > P-P-Anhydrid - Elektronenübertragungspotential Wasserstoffelektrode Bezugspunkt (E°´= 0 V) Ferredoxin > NADH > H2 >Fe++ - Abbau schrittweise: 1) Poly- oder Oligomere > Monomere 2) Monomere > Fragmentierung bis hin zu CO2 und H2O - Glykolyse 1) Stereochemie der Verknüpfung 2) Stärke, Glykogen > Glc 2) Aktivierung durch doppelte Phosophorylierung 3) Spaltung in Triosephosphate 4) Oxidation + interne Umlagerungen > 2 ATP und 2 NADH/Glc NH2 ΔG°´Hydrolyse ≈ -32 kJ/Mol ATP O O N N O -O P O P O P O OO O- OH ΔG°´Oxidation m. Sauerstoff ≈ -218 kJ/Mol NADH O H H N N O OH NH2 N N NH2 O N O OH O O P O P O O OOH N N O OH OH Stärke Pi Amylasen Phosphorylasen Maltose Glc-1-P P-Glucomutase Maltase ATP ADP Glc ATP ADP Glc-6-P Hexokinase Fru-6-P P-Hexose-Isomerase Fru-1,6-P P-Fructokinase Aldolase 2 x 2-PGS 2 x 3-PGS P-Glyceromutase Enolase 2 x P2-GS PGS-Kinase GAP GAP-Dehydrogenase 2 Pi 2 ATP 2 NAD 2 PEP Pyruvat-Kinase 2 NADH 2 ATP 2 Pyruvat Glykolyse DHAP Triose-P-Isomerase ΔG°´ [kJ/Mol] Glykolyse: Energetik Standardenergien (aus Moran et al., Biochemistry) ΔG [kJ/Mol] Hexokinase Phosphofructokinase Pyruvatkinase Glykolyse Intermediate Konzentrationen in menschlichen Erythrocyten (aus Lehninger, Biochemistry) ΔG°´ [kJ/Mol] Glykolyse: Energetik Standard- (oben) und ΔG [kJ/Mol] Hexokinase tatsächliche (unten) Phosphofructokinase freie Energien der Pyruvatkinase Glykolyse-Intermediate in menschlichen Erythrocyten (aus Moran et al., Biochemistry) • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Stärke Pi Amylasen Phosphorylasen Maltose Glc-1-P P-Glucomutase Maltase ATP ADP Glc ATP ADP Glc-6-P Hexokinase Fru-6-P P-Hexose-Isomerase Fru-1,6-P P-Fructokinase Aldolase 2 x 2-PGS 2 x 3-PGS P-Glyceromutase Enolase 2 x P2-GS PGS-Kinase GAP GAP-Dehydrogenase 2 Pi 2 ATP 2 NAD 2 PEP Pyruvat-Kinase 2 NADH 2 ATP 2 Pyruvat Glykolyse DHAP Triose-P-Isomerase Enzyme - sind biologische Katalysatoren - sind meist Proteine (Ausnahme: Ribozyme) Aliphatisch: Glycin (Gly, G) Alanin (Ala, A) Valin (Val, V) Leucin (Leu, L) Isoleucin (Ile, I) Prolin (Pro, P) Sauer: Aminosäuren Aromatisch: Phenylalanin (Phe, F)) Tryptophan (Trp, W) Alkohole: Tyrosin (Tyr, Y) Serin (Ser, S) Threonin (Thr, T) Amide: Asparagin (Asn, N) Glutamin (Gln, Q) Prolin (Pro, P) Aspartat (Asp, D) Glutamat (Glu, E) Tyrosin (Tyr, Y) Basisch: Histidin (His, H) Lysin (Lys, K) Schwefel-haltige: Arginin (Arg, R) Cystein/Cystin (Cys, C) Methionin (Met, M) α-Helix Phe (F) Gly (G) Asp (D) Arg (R) Tyr (Y) Val (V) Thr (T) Ile (I) Lys (K) http://www.rcsb.org/pdb/ (1IJD, chain B) Viewer: Rasmol oder SPV Download unter: http://us.expasy.org/spdbv/text/download.htm 2.6 β-Faltblatt (4BCL) Loop Proline (Pro, P) (1IG8) Tertiärstruktur Enzyme - sind biologische Katalysatoren sind meist Proteine (Ausnahme: Ribozyme) sind häufig modifiziert und/oder enthalten Kofaktoren sind spezifisch für das/die Substrate ändern bei Substratbindung ihre Konformation Cys - Thioether Cytochrome c (1C52) Ferredoxin (1A70) Fe Cys Hexokinase ohne Glc (1IG8) mit Glc (1BDG) Loop β-Faltblatt Glc α-Helix Enzyme - sind biologische Katalysatoren sind meist Proteine (Ausnahme: Ribozyme) sind häufig modifiziert und/oder enthalten Kofaktoren sind spezifisch für das/die Substrate ändern bei Substratbindung ihre Konformation können bei Katalyse vorübergehend chemisch reagieren sind spezifisch für die katalysierte Reaktion Enzymtypen Oxidoreduktasen GAP-Dehydrogenase GAP-NADH-Oxidoreduktase Transferasen Hexokinase ATP-Glucose-Phosphotransferase Hydrolasen Amylase Amylose – Hydrolase Lyasen Aldolase Fructosebisphosphat-GAP-Lyase Isomerase Triosephosphat-Isomerase GAP – DHAP – Isomerase Ligase Aminoacyl - tRNA – Ligase Schwierig einzuordnen Chaperone Ionenkanäle Enzyme - sind biologische Katalysatoren sind meist Proteine (Ausnahme: Ribozyme) sind häufig modifiziert und/oder enthalten Kofaktoren sind spezifisch für das/die Substrate ändern bei Substratbindung ihre Konformation können bei Katalyse vorübergehend chemisch reagieren sind spezifisch für die katalysierte Reaktion sind „Antikörper“ gegen den Übergangsgszustand können reguliert werden Phosphofructokinase (1PFK) Allosterisches ADP Fru-1,6-P2 Produkt ADP Wiederholung 3. Tag - DG‘ (reale Bedingungen) kann sehr von DG°‘ abweichen - Für meiste Reaktionen der Glykolyse ist DG‘ ≈ 0, d.h. sie sind reversibel Ausnahmen: Glc + ATP → Glc-6-P + ADP (Hexokinase) (Phosophofructokinase) Fru-6-P + ATP → Fru-1,6-P2 + ADP → Pyruvat + ATP (Pyruvat Kinase) PEP + ADP - Enzyme sind biologische Katalysatoren, d.h sie reduzieren die Aktivierungsenergie, aber verschieben nicht das Gleichgewicht. sind meist Proteine (Ausnahme: Ribozyme) sind häufig modifiziert und/oder enthalten Kofaktoren sind spezifisch für das/die Substrate ändern bei Substratbindung ihre Konformation können bei Katalyse vorübergehend chemisch reagieren sind spezifisch für die katalysierte Reaktion sind „Antikörper“ gegen den Übergangszustand können reguliert werden Songbook: Michaelis Anthem Melodie: O Tannenbaum .... © 1982 Harold Braun, ISBN 0-08-027370-X, Pergamon Press Enzyme - sind biologische Katalysatoren sind meist Proteine (Ausnahme: Ribozyme) sind häufig modifiziert und/oder enthalten Kofaktoren sind spezifisch für das/die Substrate ändern bei Substratbindung ihre Konformation können bei Katalyse vorübergehend chemisch reagieren sind spezifisch für die katalysierte Reaktion sind „Antikörper“ gegen den Übergangsgszustand können reguliert werden lassen sich quantitativ nach Michaelis/Menten beschreiben Affinität KM (Michaelis-Menten-Konstante) Umsatzgeschwindigkeit vmax Auftragung nach Michaelis-Menten Auftragung nach Lineweaver-Burke Hemmtypen Beschleunigung durch Enzyme Enzym Geschwindigkeit ohne Enzym [s-1] Geschwindigkeit mit Enzym [M.1 s-1] Beschleunigung 10-1 7 x 106 Triosephosphat Isomerase 4 x 10-6 4 x 108 1014 ß-Amylase 7 x 10-14 107 1020 Carbonic Anhydrase 7 x 107 Aus: Horton / Moran / Scrimgeour / Perry / Rawn: Principles of Biochemistry • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele ΔG°´ [kJ/Mol] Glykolyse: Energetik Standard- (oben) und ΔG [kJ/Mol] Hexokinase tatsächliche (unten) Phosphofructokinase freie Energie der Pyruvatkinase Glykolyse-Intermediate in menschlichen Erythrocyten (aus Moran et al., Biochemistry) Stärke Pi Amylasen Phosphorylasen Maltose Glc-1-P Maltase P-Glucomutase ATP ADP Glc ATP ADP Glc-6-P Hexokinase Fru-6-P P-Hexose-Isomerase Fru-1,6-P P-Fructokinase Aldolase 2 x 2-PGS 2 x 3-PGS P-Glyceromutase Enolase 2 x P2-GS PGS-Kinase GAP GAP-Dehydrogenase 2 Pi 2 ATP 2 NAD 2 PEP Pyruvat-Kinase 2 NADH 2 ATP 2 Pyruvat Glykolyse DHAP Triose-P-Isomerase Regulation der Glykolyse . Stärke +Amylasen Glucagon, Epinephrin (extracellulär) Phosphorylasen + + ATP GA3 cAMP + Proteinkinase Aa Glc Glc-6-P Hexokinase + Fru-2,6-P2 Citrat Proteinkinase Ai + Fru-6-P P-Phosphorylase-Kinasea Phosphorylase-Kinasei ATP + P-Fructokinase + ADP Fru-1,6-P2 PEP Pyruvat-Kinase 2 ATP Pyruvat . Phosphofructokinase (1PFK) Allosterisches ADP Fru-1,6-P2 Produkt ADP Songbook: Glycolysis © 1982 Harold Braun, ISBN 0-08-027370-X, Pergamon Press Anaerob: Regeneration des NAD NAD NADH CO2 H C COOH C NADH NAD Pyruvat Decarboxylase O CH2OH Acetaldehyd Dehydrogenase CH3 CH3 Alkoholische Gärung O CH3 COOH NADH NAD H NADH NAD Laktat Dehydrogenase C OH CH3 Milchsäure-Gärung • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Aerob: Oxidative Decarboxylierung CO2 COOH O S-CoA O Pyr Acetyl-CoA NAD NADH Pyruvat - Dehydrogenase CoA-SH Kofaktoren - TPP - Liponsäure - FAD - NAD - CoA-SH Inhibitor: ATP (Phosphorylierung der Pyr-Dehydrogenase) O NH2 O P OPO3- O + N N C N S H H+ Thiamin-Pyrophosphat (Vitamin B1) + N C - ....verschiebt C=O – Gruppe um ein C - Atom S R1 O R2 + N R1 HO R2 C S Beispiele: Pyruvat – Decarboxylase (R1 = COOH, R2 = CH3) Transketolase (R1 = CH2OH, R2 = CHOH... α-Ketosäure-Dehydrogenase TPP H+ + N NAD NADH2 FADH2 FAD - C S R O HOOC + N R C S HO - E E OOC CO2 S + HO C - E SH SH N R SH S S TPP S O CoA S C R O R CoA-SH Coenzym A . O HS O N O N OH Ser-36 O P O O NH2 Acyl Carrier Protein (ACP) N N O HS O N O N Panthotensäure (Vit B3) OH O O P O P O O O- Coenzym A (CoASH) N N O O OH PO3-O CoASH + HOOC R CoAS + H2 O R ΔG°' = + 36 kJ/Mol . Pyruvat Dehydrogenase (eukaryotisch) Grün: Liponsäure - Acyltransferase Rot: Liponsäure - Dehydrogenase Gelb: Pyruvat - Dehydrogenase g g Regeneration von NAD unter anaeroben Bedingungen a) Milchsäure-Gärung (Pyruvat → Laktat) b) Alkoholische Gärung (Pyruvat → Ethanol + CO2), Cofaktor Thiamin Oxidative Decarboxylierung von Pyruvat unter aeroben Bedingungen Bildung von Acetyl-CoA, NADH und CO2 Grundlagen der Enzymkinetik: E + S ' ES → EP → E + P (Konzentration von ES ist geschwindigkeitsbestimmend) vmax [S] 1 KM 1 1 v = ———— —— = —— * —— + —— KM + [S] v vmax [S] vmax Michaelis-Menten (hyperbolisch) / Lineweaver-Burke-Auftragung (linear) Hemmungarten - kompetitiv (KM verringert, vmax konstant) - nicht kompetitiv (KM konstant, vmax verringert) - gemischte Formen - kooperativ positiv: KM steigt nach Bindung von 1. Substrat negativ: KM sinkt nach Bindung von 1. Substrat Der Pentosephosphatweg liefert: - NADPH für Synthesen - C5 - Zucker für Nucleotide, Nucleinsäuren, Cofaktoren, etc. - C4 – Zucker für aromatische Aminosäuren, Flavonoide, Lignin, etc • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Pentosephosphatweg (oxidativ) PO PO COOH - O OH HO O OH OH NADP OH O HO-C-H HO NADPH CH2-OH H-C-OH H-C-OH OH O NADP H-C-OH CH2OP Glc-6-P 6-P-Gluconolacton Glc-6-P-Dehydrogenase Netto: C6 + 2 NADP H-C-OH NADPH H-C-OH CH2OP 6-P-Gluconat Lactonase Rub-5-P 6-P-Gluconat-Dehydrogenase C5 + CO2 + 2 NADPH Optional: C5 >> C4 >>> Phe, Tyr, Trp, Flavonoide, Lignin C5 >>> Nucleinsäuren, Nucleotide C5 >>> C6, C3 (Glykolyse) CH2OH CH2OH C=O C=O O H HO-C-H C H H-C-OH H-C-OH O C HO-C-H H-C-OH H-C-OH CH2O-P H-C-OH GAP CH2O-P HO-C-H CH2O-P Ery-4-P Seduheptulose-7-P H-C-OH H-C-OH CH2O-P Transaldolase Fru-6-P CnP+CmP↔Cn-3P+Cm+3P CH2OH C=O O H HO-C-H C H H-C-OH H-C-OH CH2O-P Fru-6-P CH2OH C=O O C HO-C-H CH2O-P GAP HO-C-H H-C-OH CH2O-P Ery-4-P HO-C-H Transketolase H-C-OH CH2O-P Rub-5-P CnP+CmP↔Cn-2P+Cm+2P Songbook: Pentosphosphate © 1982 Harold Braun, ISBN 0-08-027370-X, Pergamon Press • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Polysaccharid-Abbau Übersicht Stärke, Glykogen Glucose NADP alternativ NADPH Pentosephosphatweg ATP ADP Glykolyse Fru-1,6-P2 GAP ADP ATP NADH Acetyl-CoA (aerob) Pyruvat NADH NAD (anaerob) Laktat oder Ethanol + CO2 Fettabbau: Übersicht Triglycerid Oleasom Fettsäuren + Glycerin CoASH Hydrolyse Glykolyse ATP AMP Acyl-CoA Aktivierung Cytoplasma Transport Mitochondrium n/2 Acetyl-CoA+NADH + FADH2 Abbau O OO O 16:0 O 18:0 Triglycerid O 18:1 Lipase Glycerin HOOC R (3 x) ATP 2 Pi PPi O Acyl-CoA-Synthetase AMP R CoASH AMP O CoAS R Aktivierung . O CoAS FAD Acyl-CoA-Dehydrogenase FADH2 O CoAS H 2O Enoyl-CoA-Hydratase Mehrfache Wiederholung bis Acetyl-CoA im letzten Durchlauf O OH CoAS Hydroxyacyl-CoA-Dehydrogenase O NAD NADH O CoAS CoASH Thiolase O CoAS O ß – Oxidation zu Acetyl-CoA CoAS . Rückblick Triglycerid Oleasom Stärke, Glykogen Fettsäuren + Glycerin Glucose CoASH Glykolyse NADP ATP NADPH AMP Pentosephosphatweg Acyl-CoA alternativ Cytoplasma ATP ADP Glykolyse Fru-1,6-P2 GAP ADP Mitochondrium n/2 Acetyl-CoA+NADH + FADH2 ATP NADH (aerob) Pyruvat NADH NAD (anaerob) Laktat oder Ethanol + CO2 • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Stärke Glykolyse: Pi Amylasen Phosphorylasen Reversible Maltose Glc-1-P Maltase Reaktionen P-Glucomutase ATP ADP Glc ATP ADP Glc-6-P Hexokinase Fru-6-P P-Hexose-Isomerase Fru-1,6-P P-Fructokinase Aldolase 2 x 2-PGS 2 x 3-PGS P-Glyceromutase Enolase 2 x P2-GS PGS-Kinase GAP GAP-Dehydrogenase 2 Pi 2 ATP 2 NAD 2 PEP Pyruvat-Kinase 2 ATP 2 Pyruvat 2 NADH DHAP Triose-P-Isomerase Synthese von PEP PEP A/GDP CO2 A/GTP Pyruvat-Dikinase Pyruvat-Kinase 2 ATP -: ATP, Kinase +: Fru-1,6-P2 ATP PEP-Carboxykinase se a l xy o rb a ATP C at v ru y HCO3 P Pyruvat ADP + Pi Oxalacetat Acetyl-CoA Citratcyclus +: Acetyl-CoA Kinase – Phosphorylase - Wechselspiel - : ATP, Citrat +: AMP, Fru-2,6-P2 -: Glc-6-P Hexokinase P-Fructokinase ATP ADP ATP ADP Glc Glc-6-P Fru-6-P Fru-1,6-P P-Hexose-Isomerase Pi Glu-6-P - Phosphatase Pi Fru-1,6-P2 - Phosphatase -: AMP, Fru-2,6-P2 Biosynthese von Speicher-Polysacchariden Stärke / Glykogen Pi Stärke-Synthetase(n) Glykogen-Synthetase(n) Phosphorylasen Amylasen ADP ADP-Glc ATP UDP-Glc UTP UDP Maltose Maltase 2 Pi Hexokinase PPi Pyrophosphatase ATP ADP Glc Glc-1-P PPi 2 Pi Pyrophosphatase P-Glucomutase Glc-6-P Abbau • • • • • • • • • • Eigenschaften lebender Systeme Inhalt Energieversorgung Bioenergetik Glykolyse Enzyme Regulation der Glykolyse Bildung von Acetyl-CoA Oxidativer Pentosephosphat-Weg Abbau von Fetten Glukoneogenese • Klausurfragen: Beispiele Beispielfragen I Beispielfragen II Ende des ersten Teils Demnächst in diesem Theater: Citratcyclus Atmungskette mit Jörg Nickelsen