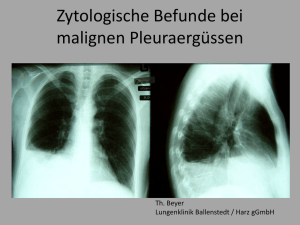
Die prognostische Aussagefähigkeit des 18
Werbung

Aus der Abteilung Nuklearmedizin der Radiologischen Universitätsklinik der Albert- Ludwigs-Universität Freiburg im Breisgau Ärztlicher Direktor: Professor Dr. Dr. Dr. h. c. E. Moser Die prognostische Aussagefähigkeit der 18F-FDG-PET bei Patienten mit kleinzelligem Bronchialkarzinom INAUGURAL- DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert- Ludwigs- Universität Freiburg i. Br. Vorgelegt von Michael Arbogast geboren in Oberkirch Dekan: Prof. Dr. C. Peters 1. Gutachter: Priv.-Doz. Dr. I. Brink 2. Gutachter: Prof. Dr. C. Waller Jahr der Promotion: 2007 für Leo, der es immer geschafft hat mich zu motivieren 1. Inhaltsverzeichnis 1. Inhalt ......................................................................................4 2. Einleitung ..............................................................................6 2.1. Bronchialkarzinome ....................................................................................... 6 2.1.1. Inzidenz ..................................................................................................... 6 2.1.2. Diagnostik .................................................................................................. 7 2.1.3. Therapie und Prognose ........................................................................... 15 2.2. Die Positronen-Emissions-Tomographie.................................................... 18 2.2.1. Technische Grundlagen ........................................................................... 18 2.2.2. PET bei NSCLC....................................................................................... 22 2.2.3. PET beim SCLC ...................................................................................... 23 2.3. Studienziel..................................................................................................... 25 3. Material und Methoden ......................................................26 3.1. Patienten ....................................................................................................... 26 3.2. PET- Protokolle ............................................................................................. 28 3.2.1 Untersuchungsprotokoll / Durchführung ................................................... 29 3.2.2 Rekonstruktion.......................................................................................... 30 3.2.3 Quantifizierung.......................................................................................... 30 3.3. Statistik.......................................................................................................... 32 4. Ergebnisse ..........................................................................33 4.1. Prognose SCLC ............................................................................................ 33 4.1.1. Alters- und Geschlechtsverteilung ........................................................... 33 4.1.2. SUVmax Ergebnisse................................................................................ 33 4.1.3. Stadium des SCLC und Therapie ............................................................ 34 4.1.4 Überlebenszeit.......................................................................................... 35 4.2. Vergleich der Soffwechselaktivität zwischen NSCLC und SCLC ............. 39 4.2.1. Histologie ................................................................................................. 39 4.2.2. SUVmax Werte ........................................................................................ 39 4.2.3. Staging der NSCLC / Fernmetastasen..................................................... 40 4.2.4. SUVmax Werte bei Fernmetastasierung ja/nein ...................................... 41 5. Diskussion ..........................................................................42 6. Zusammenfassung.............................................................51 7. Literatur ...............................................................................52 7.1 Abkürzungsverzeichnis………………………………………………….….…….57 8. Danksagung ........................................................................58 9. Lebenslauf...........................................................................59 6 Einleitung 2. Einleitung 2.1. Bronchialkarzinome 2.1.1. Inzidenz Lungenkrebs ist heute eine der häufigsten Todesursachen in der westlichen Welt. Mehr als 1/6 aller Krebstodesursachen sind verursacht durch Lungenkrebs. In den USA werden 2006 170.000 Neuerkrankungen und 160.000 Todesfälle an Lungenkrebs erwartet, weltweit sind es jährlich über 1 Million Todesfälle [1]. In Deutschland rechnet man mit ca. 37.000 Neuerkrankungen pro Jahr [2]. Die Wahrscheinlichkeit im Laufe des Lebens an einem Bronchialkarzinom zu erkranken liegt bei Männern bei 7,6 %, bei Frauen bei 5,2 % [1]. Die Diagnose Lungenkrebs verkürzt die Lebenszeit der Betroffenen im Schnitt um 12 bis 13 Jahre [2]. Grund hierfür ist die frühe Metastasierung und die hohe Aggressivität des Bronchialkarzinoms. Die meisten Patienten werden im bereits fortgeschrittenen Stadium diagnostiziert und sterben an dem progredienten Tumorgeschehen. 80- 95 % aller Patienten sind oder waren Raucher. Der starke Anstieg der Inzidenz (s. Abb.1) wird mit dem steigenden Tabakkonsum in Verbindung gebracht. Der Zusammenhang ist unbestritten. Außer dem Tabakrauch gibt es noch weitere bekannte Noxen, die die Entstehung der Bronchialkarzinome begünstigen: radioaktive Stäube, Asbest, Arsen, Silikate, Chromdämpfe, Kokereirohgase, Nickeldämpfe und auch verschiedene Retroviren [3]. Primär werden die Bronchialkarzinome histologisch in kleinzellige und nichtkleinzellige Bronchialkarzinome unterteilt. Die größte Gruppe macht mit 80 % die nichtkleinzelligen Bronchialkarzinome (non small cell lung cancer- NSCLC) aus. Je nach Histologie werden diese in 4 Untergruppen unterteilt: dem Plattenepithelkarzinom, großzelligen Karzinom und Adenokarzinom mit der Untergruppe des bronchioloalveolären Karzinoms [4]. Eine dritte Gruppe bilden die Neuroendokrinen Tumore, auch Karzinoide genannt. Das kleinzellige Bronchialkarzinom (small cell lung cancer- SCLC) macht ca. 20 % aller malignen Lungentumoren aus. Patienten mit einem Kleinzeller haben eine deutlich schlechtere Prognose als Patienten mit NSCLC. Die mittlere Überlebenszeit der SCLC wird in der Literatur zwischen 7 und 20 Monaten 7 Einleitung angegeben [4]. Die Überlebenzeiten deuten auf eine aggressivere biologische Aktivität der Tumorzellen hin. Der SCLC ist häufig zentral lokalisiert und im Vergleich zu anderen Bronchialkarzinomen von größerem Volumen, es verdoppelt sich in durchschnittlich 33 Tagen, dreimal schneller als bei anderen Bronchialkarzinomen [5]. Unbehandelt führt das kleinzellige Bronchialkarzinom innerhalb 2- 4 Monaten zum Tod [6]. Inzidenz des Bronchialkarzinoms in den USA 1930-2002 , Jemal et al, Cancer statistics 2006 [1] 2.1.2. Diagnostik Anamnese Wichtige diagnostische Maßnahme bei Verdacht auf ein Bronchialkarzinom ist die körperliche Untersuchung. Erste Symptome können dabei von dem Primärtumor direkt, der mediastinalen Ausbreitung, von Metastasen oder im Rahmen eines paraneoplastischen Syndroms auftreten. Eine ausgesprochene B-Symptomatik mit Gewichtsverlust, Husten, Dyspnoe, Hämoptysen oder eine poststenotische Pneumonie finden sich bei den meisten 8 Einleitung Patienten. Brustschmerzen können auf eine Beteiligung der Pleura parietalis, Schulterschmerzen, Schmerzen im Arm sowie das Horner- Syndrom auf eine Ausbreitung in der oberen Pleurahöhle bzw. Kompression des Plexus brachialis hinweisen. Symptome einer mediastinalen Ausbreitung können bei linksseitigem Tumorgeschehen Heiserkeit aufgrund der Beeinträchtigung des Nervus recurrens sein, bei rechtsseitigem Wachstum kann der Abfluss in der Vena cava behindert sein. Bei einer Paralyse des Nervus phrenicus durch Tumorinfiltration kann es zu einer einseitigen Zwerchfellparese kommen. Selten kommt es aufgrund des Tumorgeschehens zu einer Dysphagie durch Obstruktion des Ösophagus oder zu einer Perikardtemponade. Durch die Beteiligung von Zellen des APUD- Systems finden sich teilweise paraneoplastische Endokrinopathien. In 40 % der Fälle liegt eine ungenügende ADH- Sekretion vor (SIADH). Durch ektope ACTH- Produktion kann sich ein Cushing- Syndrom ausbilden, die ektope Produktion von parathormonverwandten Peptiden kann eine Hyperkalziämie auslösen. Neurologische Auffälligkeiten wie die Enzephalomyelitis, Kleinhirndegeneration und weitere Neuropathien können auftreten. Als paraneoplastische Osteopathie kann die hypertrophe Osteoarthropathie unter anderem zusammen mit Trommelschlegelfinger auftreten (Marie- Bamberger- Syndrom). Bei rund zwei drittel der Patienten mit Lambert- Eaton- Syndrom ist ein kleinzelliges Bronchialkarzinom assoziiert. Hierbei kommt es zur Bildung von Autoantikörpern gegen präsynaptische spannungsabhängige Kalziumkanäle und damit verminderter Acetylcholinfreisetzung bei muskulärer Belastung. Bei den Adenokarzinomen kommt es häufig zu einer paraneoplastischen Thromboseneigung. Außerdem können Bronchialkarzinome mit Dermatomyositis und Glomerulonephritis assoziiert sein [4]. Im Labor ist meist Entzündungsparameter die LDH können erhöht, bei eine Leukozytose postobstruktiven und Pneumonien erhöhte auffallen. Zusätzlich zur Routine- Labordiagnostik werden spezifische Tumormarker bestimmt (z.B. NSE, CYFRA-21), die nicht in der Tumorauffindung, jedoch in der Verlaufsbeobachtung und Rezidivkontrolle eine wichtige Bedeutung besitzen. Metastasen sind bei der Erstdiagnose oft schon vorhanden. Die Art der Metastasierung der Bronchialkarzinome ist sowohl hämatogen als auch lymphogen. An der Metastasierung selbst sind verschiedene Faktoren beteiligt, die 9 Einleitung jeweils von bestimmten Genen kontrolliert werden. So verlieren Gene ihre Funktion, die die Zelladhäsionsmoleküle (Integrine) und deren Rezeptoren kodieren. Durch Motilitätsfaktoren und Chemokine können sie sich aus dem Zellverband des Tumors lösen. Metalloproteinasen und Plasminogenaktivatoren, welche von Wachstumsfaktoren stimuliert werden, werden von der Tumorzelle sezerniert, die hierdurch die Basalmembran und Kollagen abbauen und durchbrechen kann. Die Tumorzelle kann dadurch in Gewebe und Gefäße einbrechen und gelangt in die terminale Strombahn. Hier kann es auf unterschiedlichen Wegen zur Absiedlung kommen. Durch Rezeptoren an der Endotheloberfläche oder Zelloberfläche von ihr selbst kann die Tumorzelle sich anheften. Manche Tumorzellen werden von Proliferationsfaktoren angezogen, die von den verschiedensten Zellen sehr spezifisch sezerniert werden. Die Tumorzelle selbst kann sich auch durch ihre Glykoproteinummantelung an Glukoseketten der Endothelien binden. Die Tumorzelle dringt in der Implantationsphase in das Organgewebe ein und veranlasst durch eigene oder aufgenommene Angiogenesefaktoren die eigene Versorgung und kann nun zu einer Metastase heranwachsen [3]. Die häufigsten Absiedlungen finden sich in je nach Histologie und Studien in der Leber (30- 50 %), Gehirn (20- 40 %), Nebennieren (30- 40 %) und dem Skelett (2535 %), hier bevorzugt in der Wirbelsäule. Abdominelle Lymphknotenmetastasen werden in bis zu 20 % der Patienten gefunden, Knochenmarksmetastasen bis zu 30 % [7]. Viele Patienten, speziell beim Adenokarzinom der Lunge, präsentieren sich wegen Beschwerden, die von Metastasen ausgehen. Diese können je nach Ort die unterschiedlichsten Symptome hervorrufen. Bei Verdacht auf ein Bronchialkarzinom sollte als erstes eine Röntgenthoraxuntersuchung in 2 Ebenen erfolgen. Zeichen der Malignität sind hierbei eine unregelmäßige Randbegrenzung und fehlende Verkalkungen von Raumforderungen. Der zweite Schritt der bildgebenden Diagnostik ist die Computertomographie (CT). Die Aufnahme im Spiral CT mit Kontrastmittel dient der Lokalisation und kann gegebenenfalls anhand der Densitometrie und das Vorhandensein von Verkalkungen Hinweise auf die Morphologie der Raumforderung geben. Auch die Gefäßversorgung des Tumors kann dabei Aufschluss geben [8]. Zur Diagnosesicherung nach einem Verdacht auf ein Bronchialkarzinom im 10 Einleitung Röntgen-Thorax oder CT dient die Bronchoskopie. Hierbei können Tumorzellen mittels einer transbronchialen Biopsie (TBB) oder Bronchoalveolären Lavage (BAL) nachgewiesen werden. Die Treffsicherheit bei bronchoskopisch sichtbaren Tumoren liegt bei über 90 %, bei kleinen nicht- sichtbaren Tumoren bei ca. 30- 55 %, bei Tumoren über 4 cm bei über 80 %. Die zusätzlich durchgeführte Bürstenzytologie und die Bronchiallavage führt in 25- 65 % bzw. 40- 65 % der Fälle zur Diagnose. Bei der Kombination mit bilddiagnostischem Material erhöhen sich diese Prozentzahlen entsprechend [8]. Die sichere Diagnose kann insbesondere beim SCLC häufig durch die Bronchoskopie gestellt werden, da die Tumore durch ihr zentrales, hilusnahes Wachstum oft gut zu erreichen sind. In einigen Fällen ist eine videoassistierte Thorakoskopie (VATS) zur Sicherung der Diagnose notwendig, bei nur wenigen Patienten muss man auch thorakotomieren. In einigen wenigen Fällen gelingt bei bronchusnahen Tumoren (z.B. Plattenepithelkarzinom) auch der Nachweis von malignen Zellen im Sputum. Im Falle der potentiellen Operabilität werden die Patienten einer kardiopulmonalen Funktionsdiagnostik zugeführt, die aus einem EKG, einer arteriellen Blutgasanalyse und der metabolischen Stoffwechsellage und einer Spirometrie besteht. Bei der Spirometrie sind insbesondere die Vitalkapazität sowie die Einsekunden- Kapazität (FEV1) wichtig [9]. Staging- weiterführende Diagnostik Entscheidend für die Einleitung der richtigen Therapie ist das exakte Staging. Staginguntersuchungen dienen zur Feststellung der regionalen Tumorausbreitung und einer Metastasierung. Das Staging wird anhand der TNM- Kriterien standardisiert. T beschreibt die Ausdehnung des Primärtumors, N die Ausbreitung des Tumors in den regionalen Lymphknoten, M steht für Fernmetastasen. Diese werden zusammenfassend in klinische Stadien (I-IV) eingeteilt, nach denen sich dann die Therapie richtet [10,11,12] . Bei den SCLC wird hierfür eine vereinfachte Einteilung nach ´limited/ extensive desease´ (ED/LD) vorgenommen, da die SCLC häufig bei Erstdiagnose bereits metastasiert sind. (s. folg. Abb.) Neben CT von Thorax und Abdomen werden eine Skelettszintigraphie, ein MRT oder CT des Schädels und eine Knochenmarkspunktion durchgeführt [6]. Eine Mediastinoskopie mit Biopsie kann bei vergrößerten Lymphknoten in der CT 11 Einleitung weiteren Aufschluss über einen mediastinalen Befall geben. Bei fraglichem Pleurabefall kann die Videoassistierte Thorakoskopie (VATS) wichtig sein [13]. In mehreren Studien wurde bereits die Bedeutung der PET Untersuchung zur Stagingdiagnostik bei NSCLC und auch bei den SCLC bewiesen [14-23]. Der Vorteil der PET Untersuchung beim NSCLC, bzw. einer kombinierten PET/CT Untersuchung (Fusionsbilder) gegenüber dem CT alleine ist ebenfalls belegt. Erste Studien auch beim SCLC deuten auf eine Verbesserung des Stagings durch die Einführung der PET hin [10,15, 24] . 12 Einleitung TNM- Staging NSCLC TUMORAUSBREITUNG Tx Tumor ist durch maligne Zellen nachgewiesen, jedoch radiologisch und bronchoskopisch nicht sichtbar T0 kein Anhalt für Primärtumor Tis Carcinoma in situ T1 Tumor < 3 cm, von Lunge oder viszeraler Pleura umgeben, ohne Infiltration eines Lobärbronchus T2 Tumor > 3 cm, mindestens 2 cm distal der Carina, Infiltration der viszeralen Pleura oder Lobärbronchus, Atelektasen oder obstruktive Entzündung bis zur Hilusregion ohne Befall der gesamten Lunge T3 Tumor jeder Größe, mit Infiltration der Brustwand (einschließlich Sulcus superior Strukturen), Zwerchfell, mediastinale Pleura, Perikard, Tumor näher als 2 cm an der Carina jedoch ohne Befall Carina T4 Tumor jeder Größe mit Infiltration des Mediatinums, des Herzens, große Gefäße, Trachea, Ösophagus, Wirbelkörper, Carina oder bei malignem Pleuraerguß Regionale Lymphknoten Nx Lymphknoten können nicht beurteilt werden N0 keine Lymphknoten befallen N1 ipsilaterale Lymphknoten peribronchial oder hilär befallen N2 ipsilaterale Lymphknoten mediastinal oder subcarinal befallen N3 kontralaterale Lymphknoten mediastinal, hilär oder supraclaviculär befallen Fernmetastasen Mx Fernmetastasen können nicht beurteilt werden M0 keine Fernmetastasen M1 mindestens eine Fernmetastase ist vorhanden TNM- Klassifikation des Bronchialkarzinoms nach UICC 2002 13 Einleitung Klinische Stadieneinteilung der NSCLC STADIUM: 0 TISN0M0 Ia T1N0M0 Ib T2N0M0 IIa T1N1M0 IIb T2N1M0, T3N0M0 IIIa T3N1M0, T1-3N2M0 IIIb T4N0-3M0,T1-4N3M0 IV T1-4N0-3M1 Stadiengruppierung nach TNM- Klassifikation nach UICC 2002 14 Einleitung Staging SCLC Aufgrund der initial häufigen Fernmetastasierung wird, wie bereits vorher erwähnt, die Einteilung der SCLC vereinfacht. Die Patienten werden in zwei Gruppen eingeteilt, die von der ´Veterans Administration Lung Cancer Study Group´ entwickelt wurden. Differenziert werden limited disease (LD) und extensive disease (ED). Patienten mit limited disease haben ein auf den ipsilateralen Hemithorax, Mediastinum und kontralateral hilär oder supraclaviculär beschränktes Tumorgeschehen. Extensive disease ist definiert als ein über das LD Stadium hinaus metastasierendes Tumorgeschehen. Tumore mit Pleura- oder Perikardbeteiligung sind ebenfalls als extensive disease zu bewerten [11,12,25]. LD limited disease (ca. 30-50 %) ED extensive disease (ca. 50-70 %) Definition der SCLC Stadien beschränkt auf einen Hemithorax mit mediastinalen, supraclaviculären und contralateral hilären Lymphknotenmetastasen alle Stadien die über die LD hinausgehen, mit Perikard oder Pleurabefall, mit Fernmetastasen 15 Einleitung 2.1.3. Therapie und Prognose Therapie NSCLC Die Therapie des NSCLC erfolgt heutzutage stadienabhängig mit multimodalen Methoden. Im Frühstadium ist die chirurgische Resektion mit kurativer Intention möglich. Sie wird kombiniert mit einer Radio- und bzw. oder Chemotherapie. Im späten Stadium wird die Radio- und Chemotherapie zur wichtigsten Therapieoption, eine Operation mit Teil- bzw. Totalresektion wird palliativ angewandt. Die Prognose ist dann wesentlich schlechter [2,4,6]. Bei Patienten mit Fernmetastasen kann durch die Kombination von Zytostatika der neueren Generation eine signifikante Lebenszeitverlängerung erreicht werden [2]. Beim NSCLC wird in den Stadien I und II die vollständige Resektion bevorzugt. Diese reicht von der Keilresektion bzw. Lobektomie bis zur Pneumonektomie. Bei der Infiltration der parietalen Pleura oder der Thoraxwand kann eine en- bloc Resektion der Thoraxwand durchgeführt werden. Je nach Lokalisation und Lungenfunktion kann auch eine Manschettenresektion mit anschließender Anastomosierung der Bronchien und Gefäße erfolgen. Durch eine zusätzliche Chemotherapie kann hierbei eine Mikrometastasierung unterbunden bzw. verhindert werden [2]. Im weiter fortgeschrittenen Stadium IIIa+b erhöht die Kombination von platinhaltiger Chemotherapie und Radiotherapie die Resektionsrate und damit auch das Langzeitüberleben [28]. Im nicht operablen Stadium IIIa+b ist ebenfalls die kombinierte Radiochemotherapie das Mittel der Wahl. Hier ergab sich in Studien ein deutlicher Überlebensvorteil gegenüber einer alleinigen Radiotherapie. Im Stadium IV wird durch die platinhaltigen Chemotherapeutika ein Überlebensgewinn von ca. 2- 4 Monaten mit deutlicher Verbesserung der Lebensqualität im Vergleich zu nicht platinhaltigen Chemotherapeutika erzielt [2]. Zusätzlich bewirkt im fortgeschrittenen Stadium des NSCLC der parallele Einsatz einer Antikörpertherapie gegen Angiogenesefaktoren eine signifikante Lebenszeitverlängerung. Ebenfalls im fortgeschrittenen NSCLC als Kombinationsoder Monotherapeutikum in der second- line Therapie werden inzwischen monoklonale Antikörper zur extrazellulären Blockade von Rezeptoren der HER- 16 Einleitung oder EGFR- Familie eingesetzt. Niedermolekulare Substanzen können in die Zelle eindringen und intrazelluläre Domänen von Wachstumsfaktoren besetzen. Mit diesen Mechanismen werden Wachstumsfaktoren blockiert, was im besten Fall bei bestimmten Tumoren zur Remission führen kann [26,27]. Therapie SCLC Grundsätzlich spricht das kleinzellige Bronchialkarzinom mit einer Sensitivität von 80-100 % im Stadium LD, und 60-80 % bei ED besser auf die Chemotherapie an als andere Bronchialkarzinome. Die Operabilität des SCLC ist umstritten [6,29,30]. Einzelne Zentren operieren im frühen Stadium LD. Einige Studien unterteilen hierzu Patienten mit bzw. ohne regionalen Lymphknotenbefall der Gruppe LD, respektive N0 und N1 Situation. Hierbei wurden sehr gute Ergebnisse für die alleinige Resektion bei Patienten ohne Lymphknotenbefall beschrieben [25,31,32]. In den LD Stadien mit regionalen Lymphknotenbefall wurde in einer Studie die Resektion kombiniert mit Chemotherapie durchgeführt, was ebenfalls gute Ergebnisse gezeigt hat, jedoch bleibt die Diskussion über die Wertigkeit kontrovers. Andere Autoren empfehlen im Falle der möglichen Resektion, dass durch eine Mediastinoskopie die Tumorfreiheit der tracheobronchialen Lymphknoten festgestellt werden muss. Bei gesicherter histologischer Diagnose sollten dann mindestens 2 Zyklen neoadjuvanter Chemotherapie erfolgen. Neben der Chemotherapie wird eine Mediastinal- und eine prophylaktische Hirnradiatio hinterfragt [25]. Im Stadium ED ist die Chemotherapie die wichtigste Therapieoption. Hier werden verschiedene Kombinationen von Chemotherapeutika verwendet. Bei Studien haben sich hierbei Protokolle mit Cisplatin als leicht bevorteilt herausgestellt. Die prophylaktische Hirnradiatio zur Verhinderung des Auftretens von zerebralen Metastasen wird hierbei weiterhin diskutiert und von verschiedenen Zentren unterschiedlich gehandhabt [29,33]. Trotzdem ist die Prognose bei SCLC schlecht, da Rezidive früh und häufig auftreten [4,6]. 17 Einleitung Prognose Die 5 Jahres- Überlebensrate (5- JÜR) aller Patienten mit Bronchialkarzinom liegt bei 14-15 %, bei den SCLC alleine bei unter 5 %. Nach kompletter chirurgischer Tumorresektion beträgt im besten Fall die 5- JÜR bei den NSCLC insgesamt nicht mehr als 40- 67 % [4]. Die Prognose der SCLC unterscheidet sich in den Stadien LD und ED wesentlich. Die mittlere Überlebenszeit bei LD liegt bei 14- 20 Monaten, die bei ED bei 7- 10 Monate [4,16]. Die 2- JÜR bei LD liegt bei 20- 30 % für ED < 5 %. Ein Langzeitüberleben (5- JÜR) kann bei 5- 10 % der Patienten mit LD festgestellt werden, im Stadium ED liegt die Zahl der Langzeitüberlebenden unter 1 % [4,25,34]. Eine frühe Diagnose, ein korrektes Staging mit adäquater Therapie und guter allgemeiner Gesundheitszustand können die Prognose positiv beeinträchtigen [14]. 18 Einleitung 2.2. Die Positronen-Emissions-Tomographie 2.2.1. Technische Grundlagen Allgemeines Die PET ist ein nuklearmedizinisches bildgebendes Verfahren, das auf dem Positronenzerfall (ß+) von Isotopen beruht. Die dabei entstehenden Photonen (511 keV Vernichtungsquanten) können hierbei gemessen werden. Dabei werden physiologische und biochemische Prozesse nicht- invasiv sichtbar gemacht. Je nach Radiopharmazeutikum gewinnt man quantitative Informationen über Blutfluss und die metabolische Vorgänge [35]. Bereits 1952 stellten Gordon L. Brownell und Williams Sweet vom Massachusetts General Hospital mit Hilfe von Positronen einen Gehirntumor dar. Sie konnten eine Aussage über die ungefähre Lokalisation des Tumors treffen, indem sie mit einem einzigen Detektor Aufnahmen von verschiedenen Seiten des Schädels durchführten. Erstmals beschrieben wurde die PET schon 1962 von Rankowitz et al., mit mehreren Detektoren in einer Reihe. 1973 maßen Kuhl et al. Gewebskonzentrationen von Radioisotopen auf Schnittbildern [36]. 1975 wurde dann das erste PET- Gerät von der Industrie vorgestellt. Gemessen wurde 1979 primär der zerebrale Glucosestoffwechsel des Menschen mit der neu synthetisierten 2-(Fluor-18)fluoro-2-desoxy-D-Glucose (FDG). Anfangs 1980 wurde der erste Vollringtomograph eingeführt. Die 18F-FDG-PET wurde zunächst bei kardiologischen und neurologischen Fragestellungen angewandt, ab 1990 dann auch bei onkologischen Fragestellungen. Heute wird die PET, speziell die 18F-FDG-PET, hauptsächlich bei onkologischen Fragestellungen eingesetzt [37,38]. Physikalische Grundlagen Die Positronen- Emissions Tomographie beruht auf dem radioaktiven ß+- Zerfall von Isotopen. Hierbei gelangt ein protonenreicher Atomkern in einen stabileren Energiezustand. Ein Proton wandelt sich in ein Neutron um, ein Positron und ein Neutrino werden emittiert. Die freiwerdende Energie verteilt sich auf das Positron und das Neutrino. 19 Einleitung Das massenlose und elektrisch neutrale Neutrino verschwindet, wohingegen das positiv geladene Positron im umliegenden Gewebe einen Weg von bis zu einem Millimeter zurücklegt. Es vereinigt sich mit einem Elektron und wird zum Positronium. Bei diesem Annihilationsprozeß entstehen zwei Gammaquanten, welche mit einer Energie von jeweils 511 keV in genau entgegengesetzter Richtung emmitiert werden. Restimpulse bewirken eine Winkelunschärfe von ca. 0,5 Grad. Die beiden Quantenimpulse können nun von Detektoren erfasst werden. Der Ort der Annihilation des Positrons kann auf der Koinzidenzlinie (“line of response”, LOR) zwischen den jeweiligen Detektoren bestimmt werden. Hierbei gibt es die echte Koinzidenz, die zufällige und die gestreute, wobei nur die echte eine tatsächliche Aussage über den Bildpunkt liefern können. Die Zeitspanne der Ankunft der beiden Quanten liegt bei ungefähr 12 ns. Neue Scanner haben ein Koinzidenzfenster zwischen 4,5- 8 ns. Ereignisse, die länger auseinander liegen oder singuläre Ereignissse werden nicht aufgezeichnet. Aufbau des Scanners und Messung Der Tomograph besteht aus einem Vollring mit mehreren Blockdetektoren nebeneinander, die in Koinzidenz geschaltet sind. Die jeweils gegenüberliegenden sind ebenfalls miteinander in Koinzidenz geschaltet. Die ringförmige Anordnung der Detektoren erlaubt eine Auswertung anhand mehrerer Ereignisse unter einem unterschiedlichen Winkel. Die Schichten werden nicht nur mit dem Detektor gegenüber verbunden, sondern auch zu dem nebenan. Hierdurch entstehen mehr Schnittebenen, die Dateninformation wird wesentlich genauer, die Aktivitätsverteilung im Querschnitt des zu untersuchenden Objektes kann mit höherer Sensitivität berechnet werden (3D- Messung). Die Kombination von Detektorenringen erlaubt die gleichzeitige Erfassung mehrerer Schnittbilder auf einmal, so dass auch die Aktivitätsverteilung von Organen, die mehrere Schnittbilder beanspruchen, möglich ist. Die Winkelunschärfe von 0,5 Grad sowie die Tatsache, dass das Positron nicht am Ort seiner Entstehung sondern am Ort seiner Vernichtung detektiert wird ergibt eine theoretisch maximale räumliche Auflösung von ca. 1 mm [37,39]. 20 Einleitung Bildrekonstruktion Anhand iterativer Berechnungen und der darauffolgenden Bildrekonstruktion kann nun die Aktivität der 18F-FDG im Körper dargestellt werden. Zuerst werden theoretische Projektionsdaten als ´Gerüst´ berechnet. Diese werden dann immer wieder mit den tatsächlichen gemessenen Werten korrigiert, bis eine definitive Annäherung erreicht ist. Daraus kann nun die endgültige Bildrekonstruktion gewonnen werden. Gestreute oder zufällige Koinzidenzen sowie die Korrektur der Zählereignisse des Scanners werden schon vorab korrigiert. Besonders wichtig für die Bildqualität ist die Korrektur absorbierter Koinzidenzen. Diese Schwächungskorrektur wird durch die PISAC erreicht (post injection method for segmented attenuation correction). Hierbei wird unter anderem die Absorption der Gammastrahlung des Patienten selbst berücksichtigt, die anhand externer Germaniumquellen gemessen wird [37]. 18F-FDG, Pharmakokinetik, Anwendung 18F-FDG besteht aus dem Glucoseanalogon 2-Desoxyglucose und dem 18F als Positronenstrahler. 18F besitzt im Vergleich zu anderen Positronenstrahlern eine relative geringe Energie (max. 635 KeV) und ist aufgrund der leichten Herstellbarkeit und der relativ hohen Stabilität weit verbreitet [39]. Aufgrund der Halbwertszeit von 110 min kann aus einem Produktionssatz das Material für entfernte Zentren ohne eigenes Zyklotron ebenfalls mit verwendet werden. Mit der PET wird die Verteilung des 18F-FDG im Körper dargestellt. Die radioaktiv markierte Deoxyglukose gelangt auf die gleich Art wie auch Glukose in die Zellen und ist ein Äquivalent für den zellulären Glukosemechanismus. Das 18F-FDG wird intravenös infundiert. Im Gewebe wird die 18F-FDG Glucose aktiv über verschiedene Glukosetransporter in die Zelle gebracht. Durch die Hexokinase wird das 18F-FDG in FDG-6-Phosphat umgewandelt und deponiert. Aufgrund der Substitution am C-2 Atom kann sie nun nicht wie normale Glukose weiter metabolisiert werden- sie reichert sich in der Zelle an. Dieses Speicherverhalten wird trapping genannt. 21 Einleitung Nach ca. 1- 2 h erfolgt nun die Aufnahme mit dem PET. Nach dieser Zeit besteht ein ein gutes Verhältnis der Abbildung des Tumors zur Umgebung bei noch akzeptabler Count- Rate. Anhand des Kompartment Modells nach Sokoloff et al 1977 und der metabolischen Ähnlichkeit mit der physiologischen Glukose kann man sehen, dass die 18F-FDG Akkumulation ein direktes Maß für den Glukosestoffwechsel darstellt [37]. Abb.: Kompartment Modell nach Sokoloff Schon 1924 wurde der erhöhte Energiebedarf von Tumorzellen beschrieben [40]. Dies beruht zum einen auf einer Überexpression von Glukosetransportproteinen, sowie zum anderen auf einer erhöhten Enzymaktivität von Isoenzymen der Hexokinase mit einer schlechteren Abbaufähigkeit für Glukose. Bekannt sind heutzutage mehr als 18 Glukosetransporter (GLUT 1-12, SGLT 1-6). In Tumorzellen konnte bis jetzt die Überexpression der Transporter GLUT 1, GLUT 3 und GLUT 12 nachgewiesen werden. 22 Einleitung 2.2.2. PET bei NSCLC Beim Bronchialkarzinom wird die 18F-FDG-PET Untersuchung unter der Fragestellung der Dignitätsbeurteilung, dem N- und M- Staging und der Verlaufsdiagnostik eingesetzt. Insbesondere für die Beurteilung der Dignität des Tumors ist die PET das aussagekräftigste nichtinvasive Verfahren [41- 45]. Eine Metaanalyse ergab eine Sensitivität von 96 %, eine Spezifität von 80 % und eine diagnostische Genauigkeit von 91 % bei der Beurteilung der Dignität der Primärtumore [41]. Das N- Staging mit 18F-FDG-PET ist dem der CT deutlich überlegen. Unerwartete extrathorakale Metastasen wurden in dieser Studie in 12 % der Fälle gefunden. So änderte sich das Therapie Schema bei 18 % der insgesamt 695 Patienten [41] . Die sichtbare metabolische Aktivität der 18F- FDG und der tatsächlichen Aktivität des Tumors korreliert gut. So korreliert auch die Überlebenszeit der NSCLC Patienten mit dem FDG- uptake des Primärtumors [44]. Eine interdisziplinäre Konsensuskonferenz mit Vertretern aus allen an der PET interessierten Fachrichtungen hat die PET- Studien einer Analyse unterzogen, um den klinischen Stellenwert der 18F-FDG-PET zu bewerten. Es wurde ein Schema erstellt, das für spezifische klinischen Fragestellungen wie u.a. Primärstaging, Rezidivkontrolle, Therapiekontrolle für eine Vielzahl von Tumorentitäten bewertete, inwieweit der klinische Nutzen der 18F-FDG-PET gesichert (1a- Indikation), wahrscheinlich (1b- Indikation), im Einzelfall nützlich (Grad 2), aufgrund fehlender Daten noch nicht zu bewerten (Grad 3) oder nicht vorhanden (Grad 4) ist. Das N- und M- Staging beim Bronchialkarzinom sind bei der Konsensuskonferenz als 1a- Indikationen für die 18F-FDG-PET Untersuchung bewertet. Als nicht invasives Verfahren bietet die 18F-FDG-PET die höchste diagnostische Genauigkeit aller bildgebenden Verfahren bei der Beurteilung der Dignität, dem NStaging, bei Abklärung von Metastasen und zur Rezidivdiagnostik. Auch ist es kosteneffektiv bei Nachuntersuchungen und besitzt einen des Gemeinsamen prognostischen Wert [44]. Im Dezember 2005 folgte dann der Beschluss Bundesausschusses über neue Richtlinien zur Positronenemissionstomographie 23 Einleitung bei NSCLC. Diese Richtlinie beinhaltet, dass für PET- Untersuchungen zur Stadienbestimmung und Rezidivdiagnostik bei primären nichtkleinzelligen Lungenkarzinomen ausreichend, zweckmäßig und wirtschaftlich ist, und somit unter die Leistungen im Rahmen der gesetzlichen Krankenversicherungen fällt. Gültig ist diese Richtlinie bis jetzt jedoch nur im stationären Bereich. Abb.: 18F-FDG- PET, SCLC in frontaler (a) und sagittaler Schnittführung (b) im Stadium LD 2.2.3. PET beim SCLC Über die Wertigkeit des PET beim SCLC gibt es wenige aussagekräftige gute Studien. Die Untersuchungen der SCLC mit der PET wurden bereits mit 99mTcTetrofosmin, 201Tl- Chlorid und 111In- Octreotid erprobt. Diese Marker haben sich in der Darstellung der SCLC jedoch nicht bewährt [46,47,48]. Heutzutage ist der Marker der Wahl beim SCLC das 18F-FDG. Einige Arbeiten mit 18F-FDG deuten darauf hin, dass eine PET Diagnostik die Zahl der erforderlichen Staging Untersuchungen für die Patienten reduziert und die Anzahl der invasiven Staging Untersuchungen verringert [10]. Die Sensitivität des Lymphknotenstagings ist in der PET höher als in der CT, insbesondere hiläre und mediastinale Lymphknoten werden durch die PET Untersuchung genauer erkannt [6,16,17]. Dies ist der Vorteil der 18F-FDG-PET Untersuchung. Die wichtige Therapieoption 24 Einleitung der Strahlentherapie kann erst nach einer erfolgten PET Untersuchung präzise genutzt werden. So konnten Brink et al. 2004 eine signifikante Therapieänderung bei 14 von 120 Patienten nach einer 18F-FDG-PET Untersuchung durch die Entdeckung neuer Lymphknoten- und Fernmetastasen sowie die Möglichkeit der Differenzierung zwischen Nebennierenmetastasen und Adenom beschreiben. In einigen Arbeiten wird beschrieben, dass der regionale Lymphknotenbefall erst anhand der 18F-FDG-PET Untersuchung festgestellt werden konnte, so dass der Bestrahlungsplan dementsprechend optimiert werden konnte. Bei Bradley et al. 2004 waren dies 25 % des Patientenkollektivs [49]. 25 Einleitung 2.3. Studienziel Diese Arbeit soll die prognostische Wertigkeit der 18F-FDG-PET beim Staging der SCLC aufzeigen, indem sie eine mögliche Korrelation zwischen 18F-FDG-PET Ergebnissen und klinischem Verlauf bzw. Überleben untersucht. Hierbei wurden von 98 Patienten mit histologisch gesichertem Kleinzelligen Bronchialkarzinom die SUVmax Werte des Tumors bezüglich des Überlebens in Monaten betrachtet. Die Hypothese ist, dass Patienten mit einem hohen SUVmax Wert und damit auch verbundener höherer biologischer Aktivität eine schnellere Tumorprogredienz und damit auch kürzere Überlebenszeiten aufweisen. Des Weiteren wurden die Kleinzelligen Bronchialkarzinome als biologisch aggressiver als die Nicht- Kleinzelligen Bronchialkarzinome beschrieben. Hieraus ergibt sich die Vermutung, dass Kleinzellige Bronchialkarzinome einen höheren Glukosemetabolismus besitzen, und damit einen höheren SUVmax Wert des Primärtumors zeigen. Diese Hypothese wurde in der vorliegenden Studie an insgesamt 227 Patienten mit verschiedenen Bronchialkarzinomen überprüft. Eine weitere Hypothese bestand darin, dass Tumore mit hohem Glukosemetabolismus schneller metastasieren. Anhand des M- Kriteriums wurde diese Fragestellung bei 227 Patienten mit Bronchialkarzinomen überprüft. 26 Danksagung 3. Material und Methoden 3.1. Patienten SCLC Von 1998- 2004 wurden 151 Patienten zur Primärdiagnostik und Verlaufsbeobachtung eines SCLC in der Freiburger Uniklinik einer 18F-FDG-PET Untersuchung unterzogen. In die Studie aufgenommen wurden Patienten, die eine 18F-FDG-PET Untersuchung zur prätherapeutischen Stagingdiagnostik bekommen hatten. Folgende Daten wurden erhoben: Geschlecht, Alter, Zeitpunkt der Erstdiagnose, limited/ extensive disease, bzw. TNM Staging, Karnofsky- Index, Raucherstatus, Art der Therapie, die histologischen Befunde sowie das outcome. Ausgeschlossen wurden Patienten, die vor der Aufnahme bereits einen oder mehrere Zyklen Chemotherapie oder Radiotherapie hinter sich hatten. Die dadurch erreichte Verkleinerung des Tumors hätte die uptake Werte als Maß der Aktivität möglicherweise verringert, und somit die Studie verfälscht. Ebenfalls ausgeschlossen wurden Patienten, die bereits einem thoraxchirurgischen Eingriff an dem Tumor selbst oder auf der ipsilateralen Seite des Tumors unterzogen wurden. Da 18F-FDG auch durch Insulin beeinflusst wird, wurden alle insulinpflichtigen Diabetiker von der Studie ausgeschlossen. Wurde die Diagnose des SCLC nach post- OP Beurteilung des Operationspräparates durch einen Pathologen in Frage gestellt, wurden die betroffenen Patienten aus der Studie ausgeschlossen. Diese Änderung der Diagnose kommt aufgrund der höheren Spezifität der pathologischen Beurteilung des Resektates zustande. Patienten, die ab dem 1.1.2004 diagnostiziert und zum Zeitpunkt des Studienabschlusses noch am Leben waren, fließen zusätzlich in die Auswertung des Tumorverhaltens bezüglich des uptakes, nicht jedoch bei der Betrachtung der Überlebenszeiten ein. Fehlende Informationen bezüglich des Überlebens durch z.B. Umzug oder Wechsel des betreuenden Arztes führten ebenfalls zum Ausschluß von Patienten. So konnten insgesamt 98 Patienten im Alter zwischen 34 und 79 Jahren mit einem SCLC in die Studie aufgenommen werden. 27 Material und Methoden NSCLC Gleiche Ein- und Ausschlusskriterien galten für die Auswertung der NSCLC. Insgesamt konnten 119 Patienten zwischen 24 und 91 Jahren in die Studie aufgenommen werden. Bei diesen Patienten erfolgte das Tumorstaging anhand der TNM – Klassifikation. Die Einteilung in die Subgruppen Adenokarzinome mit der extra Gruppe der Bronchioloalveolären Karzinome, Großzellige- und Plattenepithelkarzinome erfolgte anhand der histologischen Gutachten der Biopsate aus der Pathologie der Universitätsklinik Freiburg. Ausgeschlossen wurden Patienten mit unklaren pathologischen Befunden oder gemischtzelligen Tumoren. Für jeden in die Studie aufgenommenen Patienten konnte der Tumor eindeutig identifiziert werden. Bei unterschiedlichen Gutachten vor und nach Resektion des Tumors wurde das Gutachten nach der Resektion berücksichtigt. Therapie der Patienten mit SCLC In der Betrachtung der Überlebenszeit ist auch die Therapie berücksichtigt. So wurde bei 78 der 98 Patienten mit SCLC das primäre Chemotherapie- Protokoll mit in die statistischen Auswertungen genommen. Insgesamt wurde am häufigsten das EpiCo- Protokoll zur Chemotherapie eingesetzt (n=52). Das EpiCo- Protokoll nach Drings et al beinhaltet eine Verabreichung von 70 mg/m² Epirubicin über 15- 30 min, 1000 mg/m² Cyclophosphamid über 30 min und Vincristin 2 mg als i.v. Bolus am 1. Tag. Unter Berücksichtigung der Herzfunktion (aufgrund der Kardiotoxizität von Anthrazyklin) des Blutbildes, sowie von Elektrolyten, Leberwerten, Diurese und der Retentionsparameter wird dieses Schema am 22. Tag wiederholt. Als Alternative und oder auch Rezidivtherapie nach EpiCo wurden bei insgesamt 29 Patienten auch folgende Chemotherapie Protokolle eingesetzt: Das VIP-E Protokoll besteht aus Epirubicin 50 mg/m², Etoposidphosphat 500 mg/m², Cisplatin 50 mg/m2 und Ifosfamid 4000 mg/m², alles an Tag 1. Unter Kontrolle der üblichen Parameter wird das Protokoll alle 21 Tage wiederholt. TP besteht aus dem Topotecan 1 mg/m² von Tag 1 bis 5, und Cisplatin 75 mg/m² an Tag 1. Hier werden bis zu 6 Zyklen alle 21 Tage durchgeführt. Das PE- Protokoll besteht ebenfalls aus Cisplatin 75 mg/m² am ersten Tag, hier jedoch in Kombination mit Etoposid 100 mg/m² von Tag 1-3. 28 Material und Methoden Bei dem TEC- Protokoll kommen Etoposidphosphat 125 mg/m² von Tag 1 bis 3 zum Einsatz, an Tag 4 zusätzlich Paclitaxel 175 mg/m² und Carboplatin in der Dosierung AUC 5. Im Stadium LD erfolgt zusätzlich eine Radiatio des Mediastinums und des Gehirns. Vier Patienten im Stadium LD wurden in kurativer Intention operiert mit zusätzlicher Chemotherapie, 1 Patient hiervon wurde ausschliesslich operiert. Erhebung der Überlebenszeit Aus den Arztbriefen der Universitätsklinik Freiburg konnten in den meisten Fällen die Überlebenszeiten bzw. der Todeszeitpunkt festgestellt werden. In einigen Fällen mußte der jeweilige Hausarzt telefonisch konsultiert werden. Die Zeit des Überlebens nach der Erstdiagnose bzw. PET Untersuchung wurde dabei, wenn möglich, auf den Tag genau ausgerechnet. In wenigen Fällen konnte der genaue Todestag nur in einem Zeitraum von 2 Wochen angegeben werden, was noch toleriert wurde. Entsprechend der bisherigen Literatur wurden die Überlebensdaten in Monaten angegeben. Hierfür wurden die Tage in Monate umgerechnet. 3.2. PET- Protokolle Für die Untersuchungen der insgesamt 227 Patienten standen zwei verschiedene PET Scanner der Firma CTI/Siemens zur Verfügung. Ein Ecat Exact Scanner 921/31 mit einem Doppelringsystem mit je 48 Detektorblöcken und einem Ecat Exact Scanner 922/47 mit einem Dreiringsystem mit ebenfalls je 48 Detektorblöcken. Die Detektoren bestehen aus Wismutgermanat (BGO). Es können jeweils 31 bzw. 47 Schnittbilder auf einmal erfasst werden. Das axiale Gesichtsfeld beträgt 10,8 und 16,2 cm. Die maximal erreichbare Auflösung beträgt 6- 8 mm, eine halben Detektorbreite [39]. Die Bildauswertung erfolgte am Auswerterechner des Scanners mit der jeweils geräteseitig verfügbaren Standardsoftware (ECAT 6.5b, ECAT 7). 29 Material und Methoden Die Auswertung basiert auf der Berechnung von standard uptake values (SUV). Dieser semiquantitative Parameter beschreibt die in einem Zielgebiet (region of interest= ROI) gemessene Radioaktivität (A ROI) bezogen auf die injizierte Aktivität (A0) und das Gewicht des Patienten. Als dimensionsloser Wert gibt er die Mehr- oder Minderanreicherung des Radiopharmazeutikums im Verhältnis zur Gleichverteilung an, d.h. die Aktivitätskonzentration des Tumors im Verhältnis zu der des übrigen Gewebes. An dem Ecat Exact 922/47 wurde das SUV direkt durch das Computerprogramm angegeben. Bei dem anderen Scanner wurde der SUV anhand folgender Formel berechnet: Gegeben sind: Die Halbwertszeit von 18F-FDG Glukose T1/2 = 110 min; Aktivität in der ROI At = [µCi/ml]; Aktivität der injizierten 18F-FDG Glukose Ao =[MBq]; das Körpergewicht des Patienten = [ kg ] und die Zeitspanne von der Injektion der 18FFDG zur Aufnahme der PET = t [min]. Faktor zur Umrechnung von µCi in MBq = 1:37, 1 ml entsprechen kg x 1000 (Wasserdichte 1g/ml) SUV = 37 000 x A ROI [µCi /ml] x Gewicht [kg] / A0 [MBq] x 1 [g/ml] Tracerspezifische Korrektur der Aktivität: At = Ao x e –t/T1/2 , e –k x t , k = ln 2 / T1/2 => At = Ao x 2 t/T1/2 3.2.1 Untersuchungsprotokoll / Durchführung Die Patienten wurden über den Ablauf und die möglichen Risiken der PET Untersuchung aufgeklärt. So liegt die Strahlenexposition im Bereich von 6- 10 mSV; was vergleichbar mit der eines CT- Thorax ist. Alle Aufnahmen wurden zur Stagingdiagnostik bei unbehandelten SCLC bzw. NSCLC durchgeführt. Dokumentiert wurden im PET Protokoll Alter, Gewicht und 30 Material und Methoden Größe des Patienten, sowie der aktuelle Blutzuckerspiegel und die Menge und Aktivität der verabreichten 18F-FDG. Der Zeitpunkt der Injektion sowie die Dauer der Speicherzeit und die Messzeit des Tomographen wurden ebenfalls protokolliert. Die Patienten wurden nüchtern zum PET bestellt. Zunächst wurde eine Blutzuckermessung durchgeführt. Der Spiegel sollte möglichst unter 110 mg/dl liegen, um eine ausreichende 18F-FDG Aufnahme zu gewährleisten. Bei Patienten mit einem Plasmaglukosewert von über 110 mg/dl wurde der Spiegel durch die i.v. Applikation von schnell wirksamem Humaninsulin normalisiert. Anschließend wurde eine körperliche Ruhezeit von 90 min eingehalten. 3.2.2 Rekonstruktion Bei allen Patienten wurde eine statische PET- Aufnahme des Körperstamms durchgeführt. Für jede Bettposition wurde eine 8-minütige Emissions- und 2minütige heiße Transmissionsaufnahme aufgezeichnet. Die Messung der Transmission erfolgte mit einer extern rotierenden 68 Germanium (68GE) Stabquelle und wurde für die Abschwächungskorrektur benötigt. Die Aufnahme dauerte insgesamt zwischen 70 und 110 min, gescannt wurden pro Patient am Ecat Exact Scanner 921/31 zwischen 8 (bei Männern) und 9 (bei Frauen) Bettpositionen mit jeweils 10,8 cm und am Ecat Exact Scanner 922/47 zwischen 5 und 6 Bettpositionen mit jeweils 16,2 cm. Nach der Korrektur der Daten mit der Totzeit des Scanners, den gestreuten, zufälligen und absorbierten Koinzidenzen wurden mithilfe des iterativen Rekonstruktionsverfahren koronale, sagittale und transversale Schnittbilder angefertigt [37,52]. 3.2.3 Quantifizierung Die Messung des uptakes erfolgte am PC mit der standard SIEMENS Software. Gemessen wurde der maximale uptake (SUVmax) des Primärtumors. Hierbei maßgebend bei der Bestimmung des Primärtumors war der schriftliche Befund durch zwei unabhängige Fachärzte für Nuklearmedizin. Nach Sichtung der axialen und sagittalen Schichten sowie der Ganzkörperprojekton konnte die maximale Ausbreitung des Primärtumors in der Transversalebene festgestellt werden. Nun 31 wurde eine zirkuläre ROI in den Material und Methoden Transversalschnitt um die maximale Tumorausbreitung gelegt. Gemessen wurde der Umfang dieser ROI durch alle Schichten auf denen der Tumor zu sehen war. Aufgelistet wurden die jeweiligen Maximalwerte der einzelnen Schichten bis auf 2 Dezimalstellen nach dem Komma. Ebenfalls wurden bei 88 Patienten alle befundeten Metastasen auf ihren SUVmax hin ausgemessen. Hierbei wurde die gleiche Methode wie bei den Primärtumoren angewandt. Bei mehr als zwei Metastasen in einem Organ wurden die zwei am intensivsten speichernden Metastasen ausgewertet. Nicht gemessen wurden Hirnmetastasen, weshalb die Validität der Metastasenbetrachtungen eingeschränkt ist. Zur eindeutigen Feststellung der Pathologie des Tumors wurde der vom pathologischen Institut der Universitätsklinik in Freiburg erhobenen Befund des Biopsates verwendet. Falls eine Operation bei dem betreffenden Patienten möglich war, wurde der histologische Befund des Resektates bevorzugt. Bei den NSCLC wurde ausschließlich der Primärtumor auf die SUVmax hin untersucht. Hierbei wurde genauso wie bei den SCLC verfahren. Die Lokalisation wurde anhand des entgültigen nuklearmedizinischen Befundes visuell bestimmt. Je nach Tumorausbreitung in den Transversalebenen wurde, wie bei den SCLC, eine zirkuläre oder ellipsoide ROI um den Tumor gelegt und durch die auffälligen Schichten, sichtbar in den Sagittalschnitten, durchgemessen. Das Staging des Primärtumors vor Therapieeinleitung wurde aus den Akten des Patienten entnommen. Bei einigen wenigen Differenzen zwischen klinischem und späterem pathologischen Staging wurde der pathologische Befund dem Klinischen vorgezogen. 32 Danksagung 3.3. Statistik Zur Unterscheidung der Einflüsse von SUVmax, Alter, Geschlecht, pack years, klinischen Stadium und Histologie auf die Überlebenszeit und der Interaktion des SUVmax mit jeweils einer bzw. mehreren Co-Variablen wurde der Wilcoxon Test angewandt. Diese Testreihe wurde mit verschiedenen Cut- off Grenzen des SUVmax durchgerechnet. Der Log-rank Test konnte hier aufgrund der Fehlermöglichkeiten bei kleinen Patientengruppen nicht angewandt werden. Der Bezug zweier Gruppen wurde mit dem t- Test für unabhängige Stichproben ausgewertet, der dann anhand eines p- Wertes angegeben wurde, bei dem ein pWert unter 0,05 mit einem signifikanten Unterschied gleichzusetzen ist. Die graphische Darstellung der Überlebenszeit erfolgte in Form der Kaplan-Meier Kurve. Diese Darstellung entspricht im Wesentlichen der umgekehrten Summenhäufigkeitsfunktion. Es wird zunächst berechnet nach welcher Zeit welcher Anteil der beobachteten Patienten noch am Leben war. Hierbei wird die Patientengesamtzahl als 100 % angegeben (1,0). Für jeden Tag wird errechnet, wie groß die Wahrscheinlichkeit der Patienten ist, diesen zu überleben. Mit jedem Todesfall verringert sich darauf die Wahrscheinlichkeit. Beispiel: angenommen n=10, 5 Todesfälle innerhalb der Beobachtungszeit im Monat 3, 7, 11, 23. Wahrscheinlichkeit den Beginn des Monats zu erleben Wahrscheinlichkeit diesen Monat zu überleben Wahrscheinlichkeit am Ende dieses Monates noch zu leben 3 100 % 9/10 100 % x 9/10= 90 % 7 90 % 8/9 90 % x 8/9= 80 % 11 80 % 7/8 80 % x 7/8= 70 % 23 70 % 6/7 70 % x 6/7= 60 % 346 60 % 5/6 60 % x 5/6= 50 % Monat Bsp.: Kaplan-Meier Methode 33 Ergebnisse 4. Ergebnisse 4.1. Prognose SCLC 4.1.1. Alters- und Geschlechtsverteilung Insgesamt wurde eine Population von 108 Patienten mit histologisch gesichertem kleinzelligen Bronchialkarzinom ausgemessen. 77 Patienten waren Männer (71,3 %), 31 Frauen (28,7 %). Somit betrug das Verhältnis von Frauen zu Männern 1: 2,5. Das Durchschnittsalter betrug 60,6 ± 9,1 Jahre. Der jüngste Patient war 34 Jahre, der älteste 79 Jahre. Das mittlere Alter bei den Frauen betrug 57 (57,1 ± 6,44) Jahre, bei den Männern 62 Jahre (62,16 ± 9,65). 4.1.2. SUVmax Ergebnisse Alle ausgemessenen SCLC Tumore waren größer als 2 cm im kleinsten Durchmesser. Somit kann der Partialvolumeneffekt und sein Einfluß auf den SUV Wert bei Läsionen unter 2 cm, der von Hickeson et al. 2002 und Hallett et al. 2001 beschrieben wurde, vernachlässigt werden [53,54]. Der mittlere SUVmax des Primärtumors betrug 10,3 ± 4,3. Dabei gab es keinen signifikanten Unterschied des Speicherverhaltens zwischen Männern und Frauen (p > 0,91, Frauen: 10,3 ± 3,1; Männer: 10,3 ± 4,8). Abb.: Patient mit kleinzelligem Bronchialkarzinom bei ED mit Pleura- und Lebermetastasierung 34 Ergebnisse Fünfzehn von 88 Patienten mit Metastasen wiesen einen höheren 18F-FDG uptake in regionalenen Lymphknotenmetastasen als in dem Primärtumor selbst auf. Dies entspricht einem Anteil von 17 %. Bei 73 Patienten war der Primärtumor der Ort des höchsten uptakes (83 %). Aufgrund der Fragestellung wird im folgenden Text ausschließlich der SUVmax des Primärtumors als SUVmax bezeichnet. 4.1.3. Stadium des SCLC und Therapie Bei 52 Patienten wurde das EpiCo Chemotherapie-Protokoll eingesetzt, sieben Patienten bekamen das VIP-E, vier Patienten wurden mit Topotecan mono behandelt, drei jeweils mit CE oder TEC, zwei nach dem ABC Protokoll, vier wurden lediglich operiert. Statistisch ergab sich hierbei unter Berücksichtigung von Alter, Geschlecht, Stadium und pack years keine signifikante Lebenszeitverlängerung der Patienten, die mit EpiCo behandelt wurden gegenüber den anderen Protokollen. Somit wurden 20 Patienten, bei denen die Chemotherapie- Protokolle nicht zu erheben waren, in der Betrachtung der Überlebenszeit wieder mit eingefügt. Einzig die vier operierten Patienten überlebten den Studienzeitraum. Abb.: SCLC (a) LD mit regionalen Lymphknotenmetastasen (b) ED mit multipler Metastasierung und zentraler Nekrose des Primärtumors 35 Ergebnisse Bei der Gesamtpopulation von n=108 wurden initial 63 Patienten als extensive disease eingestuft (58,3 %), 45 als limited disease (41,7 %). Das Patientenalter unterschied sich in den beiden Gruppen (ED 61 ± 8,63 Jahre; LD 60 +/- 9,9 Jahre) unwesentlich (p > 0,64). Der mittlere SUVmax der Primärtumoren unterschied sich in beiden Stadien nicht signifikant (p > 0,75). Bei den Patienten im Stadium ED ergab sich ein mittlerer SUVmax Wert von 10,03 ± 4,53, bei den Patienten im Stadium LD ein Wert von 10,6 ± 4,27 (gesamt :10,26 ± 4,41, range: 4,18-26,46). SCLC gesamt n=108 ED 63 58,3 % LD 45 41,7 % SCLC Überlebenszeit n=98 ED 58 59,2 % LD 40 40,8 % Tab.: Verteilung SCLC gesamt und in der Gruppe Überlebenszeit 4.1.4 Überlebenszeit In die Studie der Überlebenszeit mit einer Mindestbeobachtungszeit der Überlebenden von einem Jahr konnten 98 Patienten aufgenommen werden, davon 29 Frauen (29,6 %) und 69 Männer (70,4 %). Das Durchschnittsalter betrug 59,8 +/- 9,7 Jahre. (Frauen: 55,8 ± 6,6 Jahre und 61,5 ± 10,3 bei den Männern). Die Altersverteilung in den Stadien LD und ED war hierbei nicht signifikant unterschiedlich (p > 0,48). Zwischen den Geschlechtern bestand kein signifikanter Unterschied bezüglich der Überlebenszeit (p > 0,6). (Männer: 14,96; 95% KI: 12,37; 17,54; Frauen 12,13; 95% KI: 8,7;15,54). Ebenso war auch die Geschlechterverteilung auf das Stadium ED/ 36 Ergebnisse LD nicht signifikant unterschiedlich (p > 0,48). Die mediane Überlebenszeit betrug 14,15 Monate (95% KI: 12,06; 16,24). Von 98 Patienten wurden 58 als ED eingestuft (59,2 %), 40 als LD (40,8 %). Die mittlere Überlebenszeit (ÜLZ) der Patienten mit ED betrug 13,58 Monate (95% KI: 10,7; 16,44). Für die Patienten im Initialstadium LD ergibt sich eine ÜLZ von 15,4 Monaten ( 95% KI: 12,54; 18,26). Es bestand ein signifikanter Unterschied zwischen den Stadien ED/ LD und der Überlebenszeit (p < 0,0004, Abb.2). SCLCÜberleben LDvs. EDn=98 EDn=58 SCLC 1 1 0,9 0,9 0,8 0,8 0,7 0,7 0,6 0,6 0,5 0,5 0,4 0,4 0,3 0,3 0,2 0,2 0,1 0,1 0 LDn=40 0 0 10 20 30 40 Überleben [ Monate] Abb 1: SCLC Überleben 50 60 70 0 10 20 30 40 50 60 70 Überleben [Monate] Abb 2: SCLC Überleben nach ED/LD Die beste Diskrimination nach dem SUVmax Wert konnte rechnerisch mit Einsatz des Wilcoxon Tests bei einem SUVmax = 7 festgestellt werden. Dies ist als signifikant zu werten (p < 0,0197). Ein SUVmax > 7 korreliert mit einer schlechteren Überlebenszeit. Von den 4 operierten Patienten befinden sich 3 in der Gruppe LD, SUVmax > 7, nur einer in der Gruppe LD, SUVmax < 7. Für Patienten mit LD und einem SUVmax < 7 (n=6) betrug die ÜLZ 17 Monate, LD und SUVmax > 7 (n=34) bedeuteten eine ÜLZ von 15,33 Monaten ( 95% KI: 12,16; 18,5). 37 Ergebnisse Die schlechteste Prognose weisen Patienten mit ED und einem SUVmax > 7 (n=41) mit einer mittleren ÜLZ von 13,03 Monate auf (95% KI: 9,31; 16,75), wohingegen Patienten mit ED und SUVmax < 7 (n=17) im Mittel 15,07 Monate überlebten (95% KI: 11,32; 18,81)(Abb. 3). Eine Korrelation der SUVmax Werte mit dem Alter gab es hierbei nicht (p > 0,61). Die Einteilung der Patienten in die Gruppen ED/ LD und SUVmax </> 7 zeigen einen signifikanten Unterschied in der Überlebenszeit. Patienten im Stadium LD und SUVmax < 7 überleben am längsten (p < 0,0007). SUV <>7 ED vs. LD LD SU V<7 ED SUV<7 LD SUV>7 ED SUV>7 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 0 10 20 30 40 50 60 † berleben [Monate] Abb.: Korrelation zwischen der Stagingdiagnostik nach ED/LD und zusätzliche Trennung nach SUV </ >7 (p < 0,0007). 70 38 Ergebnisse Die berechnete 1- Jahres Überlebensrate bei Patienten mit ED SUVmax > 7 beträgt 46,34 %, bei SUVmax < 7 überleben 52,94 %. Bei den Patienten mit LD bei SUVmax < 7 überleben 100% das erste Jahr, bei SUVmax > 7 sind es 73,53 %. Dies entspricht den Werten aus der gängigen Literatur. 1- JÜR n SUVmax > 7 ED 41 46,34 % SUVmax < 7 ED 17 52,94 % SUVmax > 7 LD 34 73,53 % SUVmax < 7 LD 6 100 % Tab.: 1- Jahres Überlebensrate der Gruppen nach ED/ LD und SUVmax 39 Ergebnisse 4.2. Vergleich der Soffwechselaktivität zwischen NSCLC und SCLC 4.2.1. Histologie Hierbei wurden insgesamt 227 Patienten bewertet. 108 Patienten hatten ein kleinzelliges Bronchialkarzinom (47,6 %), 50 Patienten ein Adenokarzinom (22 %), 11 Patienten ein Bronchioloalveoläres Karzinom (BAC) (4,8 %), 34 Patienten ein Plattenepithelkarzinom (15 %) und 24 ein Großzelliges Karzinom (10,6 %). Die ähnliche Verteilung von SCLC gegenüber NSCLC kommt hierbei aufgrund der Fragestellung der Arbeit zustande, und steht hiermit nicht repräsentativ für die zahlenmäßige Verteilung der Bronchialkarzinome der Uniklinik Freiburg. SCLC Adenokarzinom BAC n=108 n=50 Alter <60 >60 Geschlecht m w T Stadium T1 T2 T3 T4 Tx N Stadium N0 N1 N2 N3 Nx M Stadium M0 M1 n=11 Plattenepithel Ca Großzelliges Ca n=34 n=24 26 93 14 36 3 8 2 32 7 17 86 33 34 16 5 6 28 6 19 5 30 28 10 11 39 9 15 3 3 19 6 3 0 2 0 9 5 4 4 12 6 5 3 2 8 36 12 18 10 43 10 4 9 8 19 5 3 1 1 1 13 3 4 0 14 8 2 4 1 9 65 54 26 24 6 5 22 12 11 13 Tab.: TNM Stadien der Patienten bei unterschiedlichen Bronchialkarzinomen 40 Ergebnisse 4.2.2. SUVmax Werte Die Vermutung daß kleinzellige Bronchialkarzinome einen höheren uptake als andere histologische Typen besitzen konnte sich nicht bestätigen. Den geringsten mittleren SUVmax zeigten die Bronchioloalveolären Karzinome (8,7 ± 6,0), (t-Test, p < 0,05). Einen ebenfalls signifikant geringeren mittleren SUVmax als die SCLC besaßen die Adenokarzinome (8,8 ± 5,0). Mit einem mittleren Uptake der Primärtumore von SUVmax = 10,31 ± 4,34 besaßen die SCLC einen niedrigeren SUVmax Wert als die Plattenepithelkarzinome (11,9 ± 8,3) und die Großzelligen Karzinome (12,4 ± 5,9) . Diese Unterschiede sind jedoch nicht als signifikant zu bewerten. Histologie n SUVmax SUV range Bronchioloalveoläre Karzinome 11 8,7 +/- 6,0 2,3- 19,6 Adenokarzinome 50 8,8 +/- 5,0 1,2- 24,2 SCLC 108 10,3 +/- 4,3 4,2- 26,5 Plattenepithelkarzinome 34 11,9 +/- 8,3 1,6- 35,0 Großzellige Karzinome 24 12,4 +/- 5,9 3,5- 24,8 Tab.: SUVmax der Bronchialkarzinome 4.2.3. Staging der NSCLC / Fernmetastasen In der Gruppe der Adenokarzinome (n=50) wurden 26 Patienten (52 %) als M0 eingestuft. (n=24 im Stadium M1). Frei von Fernmetastasen waren auch 54 % (n=6) der Patienten mit dem Bronchioloalveolären Karzinom. (M1: n=5) Bei den Plattenepithelkarzinomen überwog der Anteil der Patienten ohne Fernmetastasen mit 64,7 % (n=22); 35,3 % (n=12) hatten Fernmetastasen. Bei den Großzelligen Karzinomen waren 54,2 % (n=13) bereits metastasiert, 11 Patienten hatten keine Fernmetastasen. 41 Ergebnisse 4.2.4. SUVmax Werte bei Fernmetastasierung ja/nein Der mittlere SUVmax bei den Bronchioloalveolären Karzinomen betrug 8,7 ± 6,0. Für die Patienten im Stadium M1 ergab sich ein Wert von 8,0 ± 2,9, im Stadium M0: 9,3 ± 8,0. Auch bei den Adenokarzinomen lag der mittlere SUVmax im Stadium M0 überraschend höher als in M1 (M0: 10,0 ± 5,6; M1: 7,7 ± 4,1). Die Patienten mit einem Plattenepithelkarzinom besaßen im Stadium M0 einen niedrigeren Wert mit 10,1 ± 7,9 gegenüber 15,0 ± 8,6 im Stadium M1. Beim Großzelligen Karzinom glichen sich die SUVmax Werte der beiden Gruppen (M0: 11,9 ± 5,7; M1: 12,8 ± 6,2). Die Auswertung der SCLC im Stadium mit Fernmetastasen (M0, M1) entsprach dem Verhältnis ED und LD. Auch hier liegen die SUVmax Werte, wie oben bereits beschrieben, bei den zwei Gruppen eng zusammen (M0: 10,39, M1: 10,26). M0 M0 M1 M1 SUVmax SUVrange SUVmax SUVrange 8,7 2,3- 19,6 8,0 3,9- 11,5 Adenokarzinom 10,0 1,2- 24,2 7,7 2,0- 18,9 Plattenepithelkarzinom 10,1 1,6- 34,7 15,0 5,5- 30,8 SCLC 10,4 4,3- 22,1 10,3 4,2- 26,5 Großzelliges Karzinom 11,9 3,9- 21,7 12,8 3,5- 24,8 BAC Tab.: SUVmax bei Fernmetastasierung der Bronchialkarzinome 42 Diskussion 5. Diskussion Das Bronchialkarzinom stellt ein großes Gesundheitsproblem in der westlichen Welt dar. Die Prognose, insbesondere beim SCLC, ist weiterhin sehr schlecht und hat sich in den letzten 20 Jahren trotz Verbesserungen in Diagnostik und Therapie nur unwesentlich geändert. Ein Patient mit einem Bronchialkarzinom wird einer Vielzahl verschiedener Staging Untersuchungen unterzogen, um sowohl seine Behandlungsmöglichkeiten, als auch seine Prognose einschätzen zu können. Hierzu zählen klinische, radiologische, laborchemische, pathologische, so wie auch molekulargenetische Untersuchungen auf Oberflächenantigene, die inzwischen wichtige Angriffspunkte für die Therapie darstellen können. Studien anhand prätherapeutischer CT- und Röntgenaufnahmen zeigen, dass das Wachstum und die Verdopplungszeit des Tumors als prognostische Parameter angesehen werden können [15,34,43,49]. Ein aktuelles Forschungsthema sind Untersuchungen molekularer Veränderungen und Oberflächenantigenen der Tumorzellen auf ihre prognostische Aussagefähigkeit hin [53]. Eine immunhistochemisch festgestellte Überexpression der Glukosetransporter Glut 1 und 3 konnte bereits mit einer schlechteren Prognose gleichgesetzt werden [16]. Dies legt nahe, dass der Glukosemetabolismus die Aggressivität und somit auch die Prognose der Erkrankung bestimmt. Die prognostische Aussagefähigkeit und auch der sich daraus ableitende Nutzen bezüglich der Therapie soll mit dieser Studie untersucht werden. Umfangreiche Studien belegen den hohen Stellenwert der PET beim NSCLC zur Dignitätsbeurteilung, Primär- und Rezidivdiagnostik [13,15,18-23,41-45,55,61]. Pilotstudien haben gezeigt, dass die PET beim SCLC von großer Wichtigkeit beim Staging ist [10,15-17,24,49,64]. So beschreiben Brink et al. 2004 eine signifikante Änderung der Therapiestrategie in 14 von 120 Fällen durch die prätherapeutische FDG-PET Untersuchung. Bei Bradley et al. 2004 konnten bei 6 von 24 Patienten (25 %) mit SCLC unerwartete regionale Lymphknotenmetastasen durch die PET nachgewiesen werden, woraufhin diese in den Bestrahlungsplan mit eingebunden werden konnten [15,16,49]. 43 Diskussion Die Patientenpopulation in dieser Studie entsprach beim SCLC der üblichen Verteilung: 60 % ED und 40 % LD, sowie ein mittleres Alter von 60 Jahren entsprechen der bisherigen Literatur [4]. Die 2- Jahres Überlebensrate von 47,5 % bei LD und 7,7 % bei ED sind günstiger als einige Autoren beschreiben. Dies ist möglicherweise auf die inzwischen verbesserten Therapieoptionen in verschiedenen Ländern zurückzuführen. Andere Studien zeigen jedoch ähnliche Zahlen (LD: 2- JÜR bis zu 40 %, ED: 2JÜR 5- 10 % [4,16]. Bei den NSCLC bewegt sich die Verteilung der histologischen Subgruppen in ähnlichen Grenzen wie bei anderen Studien, und auch das mittlere Alter von 64 Jahren bei einer Population von 119 Patienten entsprach den üblichen Werten. Nach der Messung des 18F-FDG uptakes der SCLC anhand des SUVmax Wertes und statistischer Auswertung konnten die Patienten am empirisch ermittelten Cutoff Punkt in zwei Gruppen unterteilt werden: Patienten mit einem SUVmax < 7 weisen eine bessere Prognose auf, als Patienten mit einem SUVmax > 7. Die initiale Speicherung von 18F-FDG beim Primärtumor erlaubt eine prognostische Aussage, die unabhängig vom Stadium der Erkrankung ist. Kombiniert man die klinische Einteilung nach LD/ ED mit diesen Gruppen (SUVmax </> 7), so erhält man vier Gruppen, die sich in der Überlebenszeit signifikant unterscheiden. Die beste Prognose haben Patienten im Stadium LD mit einem SUVmax < 7 (logrank: p < 0,0007). Somit kann eine präzisere Aussage über die Prognose der SCLC getroffen werden, als allein nach der klinischen Einteilung. Die höhere Aktivität des Glukosemetabolismus kann damit, wie in der Hypothese vermutet, neben der Metastasierung als weiterer Prognosefaktor angesehen werden. Diese Aussage konnte bereits von Sasaki et al. für die NSCLC untermauert werden. Fu et al. berichteten 2005 über eine bessere Prognose von Frauen mit Bronchialkarzinomen gegenüber Männern [54]. Gemessen wurde auch der Unterschied im Glukosemetabolismus des SCLC bei Mann und Frau. Zwischen den Geschlechtern unterschied sich das uptake Verhalten des Primärtumors nicht (p > 0,62). Bezüglich des Überlebens von Frauen und Männer mit SCLC konnte kein Unterschied festgestellt werden. 44 Diskussion Ebenso konnte keine signifikante Besserung der Prognose der jüngeren Patienten festgestellt werden, genauso wie die Patienten unter 60 Jahren keine niedrigeren SUVmax Werte zeigten als die Patienten über 60 Jahre (p > 0,93). Sasaki et al. 2005 konnten den prognostischen Wert der PET Untersuchung beim NSCLC darstellen. Sowohl prätherapeutisch als auch im klinischen Verlauf konnten anhand des SUVmax Wertes des Primärtumors Aussagen über die Prognose bei insgesamt 162 Patienten gemacht werden [23]. Pandit et al. 2003 konnten bei 63 Patienten mit SCLC eine signifikante Korrelation zwischen SUVmax und Überleben feststellen [16]. In diese Studie wurden sowohl unbehandelte, als auch bereits behandelte Patienten eingeschlossen. Dies führte zu einer gewissen Selektion, da bereits nach dem 1. Chemotherapiezyklus der SUVmax des Tumors drastisch abnehmen kann, was an der hohen Chemosensitivität des SCLC liegt. Auch der FDG- uptake ist post Chemotherapie geringer. Nach einer Bestrahlung kann eine erhöhte Glukoseaufnahme des Lungenparenchyms Ausdruck einer Strahlenpneumonitis sein. Eine unabhängige Aussage über die Korrelation des SUVmax des Primärtumors mit der Prognose kann in diesem Fall nicht mehr gemacht werden. Die Patienten unserer Studie wurden alle prätherapeutisch untersucht. Jede Art von Therapie vor der PET Aufnahme führte zum Ausschluss aus der Studie. Trotzdem bestätigen unsere Ergebnisse Pandits Hypothesen [16]. Bei den NSCLC wurde bereits von Vansteenkiste et al. ein Cut- off bei SUVmax = 7 als bester Prognoseindikator bei 125 Patienten bestimmt [55]. Bei Sasaki und auch Higashi et al. zeigte der Cut- off von SUVmax = 5 den größten Unterschied [23,60]. Aufgrund des unterschiedlichen uptake- Verhaltens der einzelnen histologischen Gruppen muss man davon ausgehen, dass der Cut- off nicht für alle Gruppen gleich ist. So sind auch die mittleren SUVmax der Gruppen in dieser Studie unterschiedlich. Die Glukoseaktivität der SCLC unterscheidet sich nicht wesentlich von der Aktivität der Plattenepithel- (SUVmax = 11,9 ± 8,3) und Großzelligen Bronchialkarzinome (SUVmax = 12,4 ± 5,9). Die Adenokarzinome und die Bronchioloalveolären Karzinome weisen einen geringeren Glukosemetabolismus auf (SUVmax = 8,7 ± 6 und 8,8 ± 5). Nach 45 unseren Ergebnissen zu urteilen, Diskussion sollte die quantitative 18F-FDG PET Untersuchung für die Subgruppen getrennt betrachtet werden. Der Glukosemetabolismus der Patienten mit bereits metastasiertem NSCLC war nicht immer höher, als bei Patienten im Stadium M0. So konnte lediglich beim Plattenepithelkarzinom eine höhere Aktivität des Primärtumors in der Gruppe der Patienten mit Fernmetastasen gefunden werden. Der Glukosemetabolismus alleine ist somit unabhängig von der Metastasierung. Für die Tumorausbreitung sind die anatomische Lage des Tumors bzw. die Invasion in Gefäßstrukturen oder Lymphabflusswege, der Verlust der Gene der Zelladhäsionsmoleküle und die Bildung von Motilitätsfaktoren verantwortlich [3]. Auch die Implantationsphase der Tumorzellen in fremde Gewebe muss von der Tumorzelle vollzogen werden. Die Interaktion dieser Faktoren begünstigt die Metastasierung, ein Faktor alleine reicht wahrscheinlich nicht für eine prognostische Aussage aus. Aufgrund dieser Überlegung wurde der SUV der Metastasen oder deren Anzahl nicht weiter in die Studie mit einberechnet. Möglicherweise kann in Zukunft das 18F-FDG-PET eine zentrale Rolle in der Diagnosestellung und dem Staging des SCLC spielen. So könnte in Zukunft eine Fusion zwischen Thorax- CT und 18F-FDG-PET sowie einem Schädel- MRT eingesetzt werden und auf die bisherige übliche Durchführung von Abdominal- CT, Knochenszintigraphie und sonographischen Untersuchungen verzichtet werden. Dies würde bei besseren Ergebnissen eine Zeitersparnis und eine Entlastung des Patienten bedeuten. Abb.: Wirbelkörpermetastase im PET/CT 46 Diskussion Die vergleichsweise hohen Kosten von ca. 1000 € pro 18F-FDG-PET beeinflussen oft die Indikationsstellung. Bei der Kalkulation der Kosten muss jedoch immer bedacht werden, dass die 18F-FDG-PET Untersuchung das N und M Staging übernehmen kann. Die Kosteneffizienz der Untersuchung bei Lungenrundherden ist international bewiesen (Gambhir et al. für die USA, Kosuda et al. für Japan, Gugiatti et al. für Italien, Alzahouri K et al. für Frankreich [57-60]). Bei einer kombinierten CT-Thorax/ PET Untersuchung mit Schädel- MRT mit daraus resultierendem Wegfall der bisherigen Diagnostik wäre die Kosteneffizienz auch beim SCLC gegeben. Die PET Untersuchung mit 18F-FDG besitzt verschiedene potentielle Fehlermöglichkeiten. Durch die physiologische Anreicherung der markierten Glukose entstehen verschiedene uptake Zeiten bei verschiedenen Patienten. Eine Studie ergab, dass im Schnitt nach einer uptake Zeit von 90 min die Bildqualität der Aufnahmen am Besten ist. Dies wurde im Mittel auch eingehalten (mean: 90,7min). Hierzu kommt dann noch die Aufnahmezeit, also insgesamt 90- 180 min, die Einfluss auf den SUVmax gehabt haben könnten. Hierbei hingen diese Differenzen nicht von der Art des Bronchialkarzinoms ab, sondern von logistischen und auch technischen Gründen, so dass dieser Effekt sich auf alle Gruppen erstreckt haben müsste. Zumal die Differenzen in diesem Zeitrahmen bei der 18F-FDG keine Rolle spielen dürften. Einschränkungen im Glukosestoffwechsel weisen Diabetiker auf. Sowohl bei Diabetes mellitus Typ 1 als auch Typ 2 ist die Glukoseaufnahmefähigkeit aufgrund des zu gering oder gar nicht vorhandenen Insulins, oder der Störung der Insulinsensitivität der Zellen, vermindert. So kann man sich vorstellen, dass schon bei einem nicht manifesten Diabetes der Glukosemetabolismus so gestört ist, dass der resultierende SUVmax Wert verändert wird. Durch Blutzuckermessungen vor der 18F-FDG-PET Aufnahme kann bei diabetischer Stoffwechsellage durch anschließende Korrektur des Blutzuckerspiegels der Verfälschungseffekt aufgehoben werden [52,61]. Die 18F-FDG Glucose Gabe erfolgte gewichtsadaptiert (5 MBq FDG/kg Körpergewicht), um eine vergleichbare Qualität der Bilder zu erreichen. Die Fettgewebsverteilung im Körper wurde in dieser Studie nicht ausgewertet, da 47 Diskussion der Einfluss der Fettverteilung gering und die zur Verfügung stehenden Korrekturmethoden noch nicht ausgereift sind [62]. Das Versterben der Mehrheit der Patienten innerhalb von 2 Jahren zeigt die Schwere der Erkrankung. Woran diese Patienten verstorben sind konnte man bei den meisten Patienten klar nachvollziehen. Die Arztbriefe bzw. auch die behandelnden Hausärzte selber berichten von den Tumorauswirkungen im Endstadium. Unfalltod konnte in jedem Fall ausgeschlossen werden. Apoplex oder Herzinfarkt sind mögliche andere Todesursachen, wobei diese ebenso gut auch durch die erhöhte Thrombogenität durch den Tumor selbst ausgelöst werden können. Bei allen Patienten war das SCLC die Hauptdiagnose, zusätzlich wiesen zahlreiche Patienten Begleiterkrankungen auf. Wegen der sehr schlechten Prognose und dem schnell progredienten Verlauf gehen wir davon aus, dass alle anderen Nebenerkrankungen den Krankheitsverlauf nur minimal beeinflusst haben können, schwerwiegendere Erkrankungen der Patienten führten zum Ausschluss aus der Studie (n=1). Die möglichen Fehler konnten aus unserer Sicht damit weitgehend minimiert werden. Eine potentielle Auswirkung auf das Ergebnis bei dieser Patientenanzahl ist nicht zu erwarten. Bei der Datenerhebung der NSCLC- Patienten bezüglich des Stagings gab es einige Patienten im Stadium Tx. Dies waren Patienten, deren Tumoren sich in der Bildgebung nicht klar abgrenzen ließen. Bei den NSCLC gab es zudem Tumoren, die kleiner als 2 cm im Durchmesser waren. Hier kann der Fehler durch den Partialvolumeneffekt nicht wie bei den SCLC ausgeschlossen werden. Dies muss in die Betrachtung der Ergebnisse der NSCLC mit einbezogen werden. Dadurch entstehen evtl. kleine Toleranzen, die in ihrer Größe die Gesamtaussage bei der Beurteilung der NSCLC nicht beeinflussen werden, da auch unter den NSCLC Gruppen die Verteilung der Größenverhältnisse gleichmäßig verteilt waren. Ein weiterer Fehleraspekt betrifft die Möglichkeit der zentralen Nekrose der Tumoren. Durch das zu schnelle Wachstum sind hier schon Teile des Tumors abgestorben, die möglicherweise sehr viel aktiver waren als der übrige Tumor in dieser Momentaufnahme. Dies ist jetzt allerdings mit dem SUV nicht mehr zu fassen. Aufgrund der Überlegung, dass die Zellen jedoch weiterhin von ein und 48 Diskussion demselben Tumor sind, d.h. die metabolische Aktivität ähnlich bleibt, wurden diese Patienten in der Studie belassen. Ein weiterer Punkt ist die Bestimmung des Cut- off Punktes. Sie erfolgte anhand des Vergleichs der Berechnung jedes einzelnen in Frage kommenden Wertes. Hierbei ergab sich ein signifikanter Cut- off Punkt bei dem Wert SUV </> 7. Der log rank Test wurde hierbei nicht angewendet, weil er sich nicht für die Bestimmung eignet. Durch unterschiedliche Gruppengrößen wären bei dem Einsatz des log-rank Testes statistisch nicht vergleichbare Cut- off Punkte herausgekommen. Je kleiner die Patientenpopulation bei den extremen Cut- off Punkten wird, umso schlechter korrelieren die einzelnen Gruppen, der p- Wert wird automatisch schlechter. Andere Studien, die größtenteils diesen Test zur Cut- off Bestimmung verwendet haben, müssen daher auf Ihre Aussagekräftigkeit überprüft werden. So kommen die unterschiedlichen Autoren auch alle auf verschiedene Cut- off Punkte, ein einheitlicher Cut- off konnte bisher für die gleiche Tumorentität noch nicht gefunden werden. Die unterschiedlichen Chemotherapie Protokolle haben nicht zu einer signifikant unterschiedlichen Überlebenszeitverlängerung geführt. Hauptsächlich waren in dieser Studie die Patienten mit dem EpiCo Protokoll vertreten. Neue Studien haben jedoch gezeigt, dass die Protokolle, welche Cisplatin verwendeten, einen leichten Überlebensvorteil der Patienten gegenüber allen anderen ChemotherapieProtokollen aufweisen [63]. Die Gruppe mit Cisplatin war in dieser Studie noch relativ klein. Möglicherweise hat sich deshalb keine statistische Relevanz herauskristallisiert. Bei der Abklärung der Dignität von NSCLC und SCLC gibt es bereits Daten, die gezeigt haben, dass das kombinierte PET/CT anhand von Fusionsbildern die Therapie maßgeblich beeinflussen kann [64]. Unbestritten kommt der 18F-FDG-PET Untersuchung bei der Therapieplanung des SCLC, vor allem in der Kombination mit dem CT, eine wichtige Bedeutung zu. Nur hier kann in einer Untersuchung das Vorhandensein von Fernmetastasen und die lokale Ausbreitung des Tumors mit Lymphknotenmetastasen festgestellt werden. Dies führt zu einer Entlastung des Patienten durch die Verringerung der Zahl der Staginguntersuchungen. Zusätzlich kann der behandelnde Arzt Informationen über die Prognose mit in die Therapieplanung einbeziehen. 49 Diskussion Abb.: Fusion FDG- PET und CT Eine prognostische Bedeutung der 18F-FDG-PET Untersuchung beim SCLC kann durch diese Studie bestätigt werden. Die Einteilung der SCLC Patienten nach ED und LD erweist sich als günstiger in der Prognosestellung. Angesichts der Überlebenszeiten und auch der möglichen Therapiefolgerungen muss man sich fragen, ob eine weitere Untergliederung der ED/ LD Klassifizierung unter Berücksichtigung des Glukosemetabolismus Sinn macht. Möglicherweise kann bei der Einführung neuer Therapieoptionen die weitere Aufteilung anhand des SUVmax Wertes des Primärtumors einen wichtigen Beitrag leisten. Man könnte sich ganz konkret vorstellen, dass z.B. alle Patienten in dem Stadium LD und SUVmax < 7 operiert werden könnten. 50 Diskussion Gegenwärtig findet auch unabhängig vom Metabolismus die TNM- Klassifikation wieder verstärkte Anwendung für die Therapieentscheidung. Die differenziertere Einteilung führt im Schnitt auch zu einer besser abgestimmten Therapie. Um den einzelnen Patienten individuell behandeln zu können, ist jede Information wichtig. Deshalb wäre eine Analyse des FDG-PET auf TNM- Stadien auch sinnvoll. Dies beeinflusst jedoch diese Studie in ihrer Gültigkeit nicht und wird sicher Gegenstand weiterer Studien sein. 51 Zusammenfassung 6. Zusammenfassung In dieser Studie wurde bei 227 Patienten mit Bronchialkarzinom das uptake Verhalten des Primärtumors im Rahmen einer prätherapeutischen 18F-FDG-PET Untersuchung gemessen. 98 Patienten mit SCLC wurden anhand ihres SUVmax in zwei Gruppen unterteilt und hinsichtlich des outcome betrachtet. Hierbei konnte für Patienten mit niedrigen SUVmax (< 7) eine bessere Prognose abgeleitet werden. Bei der Unterteilung der SCLC nach ED/ LD und SUVmax </> 7 in vier Gruppen konnten signifikante Unterschiede bezüglich des Überlebens festgestellt werden. Patienten mit LD und einem SUVmax < 7 hatten die beste Prognose (p < 0,0007). Die schlechteste Prognose hatten Patienten mit ED und einem SUVmax > 7. Im Vergleich des SUVmax aller Bronchialkarzinome unterschied sich der SUVmax von SCLC, Plattenepithel- und Großzelligen Karzinomen nur unwesentlich. Adenokarzinome und Bronchioloalveoläre Karzinome wiesen im Vergleich einen geringeren SUVmax auf. Der SUVmax wurde auch mit unterschiedlichen M Stadien verglichen. Hier wiesen das Plattenepithelkarzinom und das Großzellige Karzinom einen Adenokarzinomen, erhöhten Stoffwechsel Bronchioloalveolären in Stadium und auch M1 den auf. Bei den kleinzelligen Bronchialkarzinomen hatten die Patienten im Stadium M0 die höchsten SUVmax Werte. Die Unterschiede sind jedoch nicht als signifikant zu bewerten. Die Metastasierung aufgrund von höherer Stoffwechselaktivität kann hier nicht bestätigt werden. Die Studie zeigt, dass der SUVmax Wert des Primärtumors bei der FDG-PET Untersuchung prognostische Informationen besitzt. Dies ist besonders in Kombination mit den Stadien ED und LD aufschlussreich. Wir empfehlen daher diese Information bei der Planung der Therapie und Betreuung des Patienten unbedingt mit einzubeziehen. 52 Literatur 7. Literatur 1. Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, Thun M (2006). Cancer Statistics, CA Cancer Journal for Clinicians; 56: 106-130. 2. Digel W, Henke M, Stoelben E (2001). Therapie des nicht- kleinzelligen Bronchialkarzinoms, Atemwegs- und Lungenkrankheiten, Jahrgang 27, Nr 6, S. 279-284. 3. Riede UN, Schaefer HE (2001). Allgemeine und spezielle Pathologie. Thieme Verlag, 4. Auflage. 4. Hoffman P, Mauer A, Vokes E (2000). Lung cancer, The Lancet; 355: 479-485. 5. Payne D, Naruke T (1999). Lung Cancer. In: Manual of clinical oncology. Ed. Pollock, Rafael, 7th edition, John Wileys& sons’ inc. Publ. New York, pp 385-405. 6. Simon G, Wagner H (2003). Small Cell Lung Cancer, Chest; 123: 259- 271. 7. Berger DP, Engelhard R, Mertelsmann R (2002). Das Rote Buch: Hämatologie und internistische Onkologie. 2. überarbeitete und erweiterte Auflage. Landsberg/Lech, S. 588- 597. 8. Kauczor HU, Heussel CP, Thelen M (2000). Radiodiagnostik der Lunge. Der Radiologe; 40: 870-877. 9. Hoffmann H, Dienemann H (2000). Der pulmonale Rundherd- Prinzipien der Diagnostik. Dt Ärzteblatt; 16, 907-912. 10. Brink I, Schumacher T, Mix M, Ruhland S, Stoelben E, Digel W, Henke M, Ghanem N, Moser E, Nitzsche EU (2004). Impact of 18F-FDG-PET on the primary staging of small-cell lung cancer. Eur J Nucl Med Mol Imaging; 31: 161420. 11. Argiris A, Murren JR (2001). Staging and clinical prognostic factors for small-cell lung cancer. Cancer J; 7(5): 437-447. 12. Sobin LH, Wittekind CH (eds.) International Union Against Cancer (UICC). TNM classification of malignant tumours. 6th edition. New York: Wiley-Liss. 13. Pieterman RM, van Putten JWG, Meuzelaar JJ, Mooyaart EL, Vaalburg W, Koeter GH, Fidler V, Pruim J, Groen HJM (2000). Preoperative staging of nonsmall-cell lung cancer with positron- emission tomography. N Engl J Med; 343: 254-261. 14. Paesemans M, Sculier JP, Lecomte J, Thiriaux J, Libert P, Sergysels R, Bureau G, Dabouis G, Van Cutsem O, Mommen P, Ninane V, Klastersky J (2000). Prognostic factors for patients with small cell lung carcinoma. Cancer; 89: 523533. 53 Literatur 15. Kamel E, Zwahlen D, Wyss M, Stumpe K, Schulthess von G, Steinert H (2003). Whole- Body (18)F-FDG PET improves the management of patients with small cell lung cancer, J Nucl Med; 44: 1911-1917. 16. Pandit N, Gonen M, Krug L, Larson S (2003). Prognostic value of [18F] FDGPET imaging in small cell lung cancer. Eur J Nucl Med Mol Imaging; 30, 78-84. 17. Schumacher T, Brink I, Mix M, Reinhadt M, Herget G, Digel W, Henke M, Moser E, Nitzsche E (2001). FDG -PET imaging for the staging and follow-up of small cell lung cancer, Eur J Nucl Med; 28, 483-488. 18. Weber W, Petersen V, Schmidt B, Tyndale-Hines L, Link T, Peschel C, Schwaiger M (2003). Positron emission tomography in non-small-cell lung cancer: prediction of response to chemotherapy by quantitative assessment of glucose use, J Clin Oncol; 21(14): 2651-2657. 19. Bastarrika G, Garcia-Velloso MJ, Lozano MD, Montes U, Torre W, Spiteri N, Campo A, Seijo L, Alcaide AB, Pueyo J, Cano D, Vivas I, Cosin O, Dominguez P, Serra P, Richter JA, Montuega L, Zulueta JJ (2005). Early lung cancer detection using spiral computed tomography and positron emission tomography. Am J Respir Crit Care Med; 171(12): 1378-83. 20. Eschmann SM, Friedel G, Paulsen F, Reimold M, Hehr T, Scheiderbauer J, Budach W, Kotzerke J, Bares R (2007). Impact of staging with (18)F-FDG-PET on outcome of patients with stage III non-small cell lung cancer: PET identifies potential survivors. Eur J Nucl Med Mol Imaging; 34(1): 54-59. 21. Pepe G, Rossetti C, Sironi S, Landoni C, Gianolli L, Pastorino U, Zannini P, Mezzetti M, Grimaldi A, Galli L, Messa C, Fazio F (2005). Patients with known or suspected lung cancer: evaluation of clinical management changes due to 18Ffluorodeoxyglucose positron emission tomography (18F-FDG PET) study. Nucl Med Commun; 26(9): 831-837. 22. Borst GR, Belderbos JS, Boellaard R, Comans EF, De Jaeger K, Lammertsma AA, Lebesque JV (2005). Standardised FDG uptake: a prognostic factor for inoperable non-small cell lung cancer. Eur J Cancer; 41(11): 1533-1541. 23. Sasaki R, Komaki R, Macapinlac H, Erasmus J, Allen P, Forster K, Putnam JB, Herbst RS, Moran CA, Podoloff DA, Roth JA, Cox JD (2005). [18F]fluorodeoxyglucose uptake by positron emission tomography predicts outcome of non-small cell lung cancer. J Clin Oncol; 23(6):1136-1143. 24. Blum R, MacManus MP, Rischin D, Michael M, Ball D, Hicks RJ (2004). Impact of positron emission tomography on the mangement of patients with small-cell lung cancer: preliminary experience. Am J Clin Oncol; 27:164-171. 25. Herold G. Innere Medizin 2007. 50737 Köln, S. 354- 358. 26. Mendelsohn J, Baselga J (2006). Epidermal growth factor receptor targeting in 54 Literatur cancer. Semin Oncol; 33(4): 369-85. 27. Haber DA, Bell DW, Sordella R, Kwak EL, Godin-Heymann N, Sharma SV, Lynch TJ, Settleman J (2005). Molecular targeted therapy of lung cancer: EGFR mutations and response to EGFR inhibitors. Cold Sprin Harb Symp Quant Biol; 70: 419-26. 28. Stoelben E, Digel W, Henke M, Passlick B. Multimodal treatment of non small cell lung cancer. Zentralbl Chir. 2006 Apr; 131(2):110-114. 29. Elias A (2002), Treatment of small cell carcinoma of the lung, www.uptodate.com 30. Szczesny TJ, Szczena A, Shepherd FA, Ginsberg RJ (2003). Surgical Treatment of Small Cell Lung Cancer. Sem Oncol;30(1): 47-56. 31. Chandra V, Allen MS, Nichols FC 3rd, Deschamps C, Cassivi SD, Pairolero PC (2006). The role of pulmonary resection in small cell lung cancer. Mayo Clin Proc;81(5): 619-624. 32. Inoue M, Miyoshi S, Yasumitsu T, Mori T, Iuchi K, Maeda H, Matsuda H (2000). Surgical results for small cell lung cancer based on the new TNM staging system. Ann Thorac Surg; 70: 1615-9. 33. Pujol JL, Carestia, Daures JP (2000). Is there a case for cisplatin in the treatment of small- cell lung cancer? A meta-analysis of randomized trials of a cisplatin- containing regimen versus a regimen without this alkylating agent. Br J Cancer; 83(1): 8-15. 34. Adjei AA (2000). Management of small cell cancer of the lung. Curr Opin Pulm Med.; 6: 384-390. 35. Weber WA, Avril N, Schwaiger M (1999). Relevance of positron emission tomography (PET) in oncology. Strahlenther Onkol 175: 356-373. 36. Kuhl DE, Edwards RQ, Ricci AR, Reivich M (1973). Quantitative section scanning using orthogonal tangent correction. J Nucl Med; 14(4): 196-200. 37. Wieler HJ (1999). PET in der klinischen Onkologie. Steinkopff Verlag, Darmstadt. 38. Kletter K, Becherer A (1999). FDG-PET in der Onkologie: Methodische Grundlagen und klinische Anwendung. Radiologe; 39: 600-609. 39. Wienhard K, Wagner R, Heiss W-D (1989). PET- Grundlagen und Anwendungen der Positronen- Emissions- Tomographie. Springer Verlag, S. 1-29. 40. Warburg O, Posener K, Negelein E (1924). The metabolism of cancer cells. Biochem Zeitschr; 152:129-169. 41. Hellwig D, Ukena D, Paulsen F, Bamberg M, Kirsch CM (2001). Metaanalyse zum Stellenwert der Positronen- Emissions- Tomographie mit F-18- 55 Literatur Fluordesoxyglukose (FDG-PET) bei Lungentumoren. Pneumologie; 55; 367-377. 42. Farrell MA, McAdams HP, Herndon JE, Patz EF Jr (2000). Non-small cell lung cancer: FDG PET for nodal staging in patients with stage I disease. Radiology; 215(3): 886-890. 43. Patz EF, Connolly J, Herndon J (2000). Prognostic value of thoracic FDG- PET imaging after treatment for non-small cell lung cancer. AJR Am J Roentgenol; 174: 769-774. 44. Ahuja V, Coleman RE, Herndon J, Patz EF Jr. (1998). The prognostic significance of fluorodeoxyglucose positron emission tomography imaging for patients with nonsmall cell lung cancer. Cancer; 83(5): 918-924. 45. Valk PE, Pounds TR, Hopkins DM, Hasemann MK, Hofer GA, Greiss HB, Myers RW, Lutrin CL (1995). Staging non- small cell lung cancer by whole- body positron emission tomographic imaging. Ann Thorac Surg; 60:1573-1582. 46. Takekawa H, Shinano H, Tsukamoto E, Koseki Y, Ikeno T, Miller F, Kawakami Y (1999). Technetium- 99m- tetrofosmin imaging in lung cancer: relationship with histopathology. Ann Nuclear Medicine; 13(2): 71-75. 47. Takekawa H, Takaoka K, Tsukamoto E, Kanegae K, Kozeki Y, Yamaya A, Miller F, Kawakami (1997). Visualization of lung cancer with Tc-99m tetrofosmin imaging: a comparison with 201TI chloride. Nuc Med Commun;18(4): 341-345. 48. Vaccarili M, Lococco A, Fabiani F, Staffilano A (2000). Clinical diagnostic application of 111In- DTPA- ocreotide scintigraphy in small cell lung cancer. Tumori; 86(3): 224-228. 49. Bradley J, Dehdashti F, Mintun M, Govidan R, Trinkhaus K, Siegel BA (2004). Positron emission tomography in limited-stage small-cell lung cancer: A prospective study. J Clin Oncol; 22(16): 3248-3254. 50. Mix M, Nitzsche EU (1999). PISAC: a post- injection method for segmented attenuation correction in whole body PET. J Nucl Med; 40 (suppl.): 297p. 51. Hickeson M, Yun M, Matthies A, Zhuang H, Adam LE, Lacorte L, Alavi A (2002). Use of corrected standardized uptake value based on the lesion size on CT permits accurate characterization of lung nodules on FDG-PET. Eur J Nucl Med Mol Imaging; 29(12): 1639-47. 52. Hallett WA, Marsden PK, Cronin BF, O´Doherty MJ (2001). Effect of corrections for blood glucose and body size on [18F]FDG PET standardised uptake values in lung cancer. Eur J Nucl Med; 28(7): 919- 922. 53. Digel W, Lubbert M (2005). DNA methylation disturbances as novel therapeutic target in lung cancer: preclinical and clinical results. Crit Rev Oncol Hematol; 55(1): 1-11. 56 Literatur 54. Fu J, Kau Y, Severson R, Kalemkerian G (2005). Lung Cancer in Woman. Chest 127; 3: 768-777. 55. Vansteenkiste JF, Stroobants SG, Dupont PJ, De Leyn PR, Verbeken EK, Deneffe GJ, Mortelmans LA, Demedts MG (1999). Prognostic importance of the standardized uptake value on (18)F-fluoro-2-deoxy-glucose-positron emission tomography scan in non- small- cell lung cancer: analysis of 125 cases. J Clin Oncol;17(10): 3201-3206. 56. Higashi K, Ueda Y, Arisaka Y, Sakuma T, Nambu Y, Oguchi M, Seki H, Taki S, Tonami H, Yamamoto I (2002). 18F-FDG uptake as a biologic prognostic factor for recurrence in patients with surgically resected non-small cell lung cancer. J Nucl Med; 43(1): 39-45. 57. Gambhir SS, Hoh CK, Phelps ME, Madar I, Maddahi J (1996). Decision tree sensitivity analysis for cost-effectiveness of FDG-PET in the staging and management of non-small-cell lung carcinoma. J Nucl Med; 37: 1428-1436. 58. Alzahouri K, Lejeune C, Woronoff-Lemsi MC, Arveux P, Guillemin F (2005). Cost-effectiveness analysis of strategies introducing FDG-PET into the mediastinal staging of non-small-cell lung cancer from the French healthcare system perspective. Clin Radiol; 60(4): 479-492. 59. Gugiatti A, Grimaldi A, Rossetti C, Lucignani G, De Marchis D, Borgonovi E, Fazio F (2004). Economic analysis on the use of positron emission tomography fort he work-up of solitary pulmonary nodules and for staging patients with nonsmall-cell-lung cancer in Italy. Q J Nucl Med Mol Imaging; 48(1): 49-61. 60. Kosuda S, Ichihara K, Watanabe M, Kobayashi H, Kusano S (2000). Decisiontree sensivity analysis for cost-effectiveness of chest 2-fluoro-2-D[(18)F]fluorodeoxyglucose positron emission tomography in patients with pulmonary nodules (non-small cell carcinoma) in Japan. Chest; 117(2): 346-353. 61. Lindholm P, Minn H, Leskinen-Kallio S, Bergman J, Ruotsainen U, Joensuu H (1993). Influence of the blood glucose concentration on FDG uptake in cancer- a PET study. J Nucl Med; 34(1): 1-6. 62. Erselcan T, Turgut B, Dogan D, Ozdemir S (2002). Lean body mass-based standardized uptake value, derived from a predictive equation, might be misleading in PET studies. Eur J Nucl Med Mol Imaging; 29(12): 1630-1638. 63. Pujol JL, Carestia, Daures JP (2000). Is there a case for cisplatin in the treatment of small-cell lung cancer? A meta-analysis of randomised trials of a cisplatin-containing regimen versus a regimen without this alkylating agent. British J Cancer; 83(1): 8-15. 64. Fischer BM, Mortensen J, Langer SW, Loft A, Berthelsen AK, Petersen BL, Daugaard G, Lassen U, Hansen HH (2006). A prospective study of PET/CT in initial staging of small-cell lung cancer: comparison with CT, bone scintigraphy and bone marrow analysis. Ann Oncol;18(2):338-345. Literatur 57 7.1. Abkürzungsverzeichnis ACTH Adrenokortikotropes Hormon ADH Antidiuretisches Hormon APUD Amine Precursor Uptake and Decarboxylation AUC Area Under Curve BAC BAL CYFRA – 21 Bronchioloalveoläres Karzinom Bronchoalveoläre Lavage Cytokeratin Fragment 21 ED Extensive Desease (SCLC) EGFR Epidermal- Growth- Factor- Receptor FEV1 Forcierte Expiratorische Vitalkapazität FDG Fluorodeoxyglukose GLUT Glucose Transporter HER Human Epidermal Growth Factor LD Limited Desease (SCLC) LDH Laktatdehydrogenase LOR Line of Response NSCLC Non Small Cell Lung Cancer NSE Neuronenspezifische Enolase PISAC post injection method for segmented attenuation correction ROI Region of Interest SCLC Small Cell Lung Cancer SGLT Sodium dependend Glucose Transporter SIADH Syndrom der insuffizienten ADH Produktion SUV Standard Uptake Value TBB Transbronchiale Biopsie UICC Union Internationale Contre le Cancer VATS Videoassistierte Thorakoskopie 58 Danksagung 8. Danksagung Ganz besonderer Dank gilt meinem Betreuer und Doktorvater Priv.-Doz. Dr. Ingo Brink. Sein Ideenreichtum hat die Arbeit grundlegend mitgestaltet. Ich bedanke mich für die Anleitung zum selbstständigen Arbeiten, sein Vertrauen in meine Fähigkeiten, dass er immer hinter mir stand und stets mein Interesse wecken konnte. Vor allem aber möchte ich mich bei ihm für seine Geduld bedanken, die angenehmen und unterstützenden Treffen, die mir persönlich sehr weitergeholfen haben. Außerdem danke ich Prof. C. Waller, der sich freundlicherweise sehr kurzfristig als Zweitkorrektor zur Verfügung gestellt hat. Herrn Prof. J. Schulte- Mönting danke ich für die statistische Auswertung. Besonderer Dank gilt Claudia Santini- Böttcher die für mich immer ein offenes Ohr hatte und mich in großem Maße unterstützt hat, sowie auch allen Mitarbeitern der Nuklearmedizin, die mich während meiner Arbeit sehr freundlich aufgenommen haben. 59 Lebenslauf 9. Lebenslauf Name Michael Arbogast Geburtstag 5.6.1980 in Oberkirch/ Baden Eltern Mutter: Angelika Arbogast, Kaufmännische Angestellte Vater: Dipl.-Ing. Wolfgang Arbogast, Vermessung Geschwister Schwester: Sylvia Arbogast, Finanzassistentin Schulbildung 1986-1990 Grundschule Kappelrodeck 1991-1999 Gymnasium Achern, Abitur Zivildienst 1999-2000 Pflegeheim Ottenhöfen und Friedrichshafen Studium 2000 -2007 Studium der Humanmedizin Albert-Ludwigs-Universität Freiburg 1. Abschnitt der ärztlichen Prüfung im Frühjahr 2003 Famulaturen März 2004 Universitätsklinikum Freiburg, Anästhesie März 2005 Universitätsklinikum Freiburg, Nuklearmedizin Oktober 2005 Klinikum Offenburg, Kardiologie und Pneumologie September 2005 Praxisgemeinschaft Wiehre, Dr. med. Jörg Schweigler, Allgemeinmedizin/Anästhesie November 2005 Concord Repatriation General Hospital, Sydney, Australien PJ März- Juni 2006 Hôpitaux Universitaires de Genève, HUG, Schweiz Viszeral- und Transplantationschirurgie Juni-Oktober 2006 Universitätsklinikum Freiburg, Anästhesie Oktober- Januar 2007 Universitätsklinikum Freiburg, Innere Medizin