H - Institut für Organische Chemie
Werbung

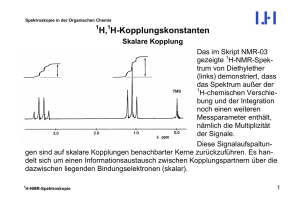
Spektroskopie in der Organischen Chemie 1 H,1H-Kopplungskonstanten Geminale Kopplungen Wenn sich die beiden Kopplungspartner (wie Zwillinge; lat.: gemini) am gleichen Kohlenstoffatom befinden, also nur H zwei Bindungen voneinander entfernt sind, nennt man dies C eine geminale Kopplung, 2J(1H,1H). H In sehr vielen Fällen sind die beiden Kerne chemisch äquivalent oder enantiotop (Æ) und haben deshalb die gleiche chemische Verschiebung; sie sind isochron. Dann ist das Signal – bei Fehlen weiterer Kopplungspartner – ein Singulett, und die natürlich auch in solchen Fällen existierende geminale Kopplung ist aus keiner Signalaufspaltung abzulesen. (Æ Spinsysteme AX/AB Æ A2) Sind die beiden Wasserstoffkerne dagegen diastereotop, sind sie anisochron, bilden ein AX- bzw. AB-Spinsystem bzw. -Teilsystem, und die Kopplung ist ermittelbar. 1 H-NMR-Spektroskopie 1 Spektroskopie in der Organischen Chemie Beispiele für geminale Kopplungskonstanten: Einfluss des s-Charakters: H H H H C H2 C C C H -12.4 Hz H H H +2.5 Hz -4.5 Hz Einfluss der Substitution: H HO H C H -10.8 Hz 1 H-NMR-Spektroskopie H O Cl H C C C H +5.5 Hz H H -1.3 Hz 2 Spektroskopie in der Organischen Chemie Vicinale Kopplungen H C H C 1 C ϕ H H-NMR-Spektroskopie H Wenn sich die beiden Kopplungspartner an benachbarten Kohlenstoffatomen (lat.: vicinus, der Nachbar) befinden, also drei Bindungen voneinander entfernt sind, nennt man dies eine vicinale Kopplung, 3 1 J( H,1H)-Werte sind immer positiv. Die Besonderheit der vicinalen Kopplung ist, dass sie eine starke Abhängigkeit vom Torsionswinkel ϕ zwischen den beiden C-H-Bindungen besitzt. Diese wird durch die sog. KARPLUS-Beziehung beschrieben (nächste Seite). In der Abbildung unten ist der Torsionswinkel ca. 600; die beiden Wasserstoffatome stehen gauche zueinander. 3 Spektroskopie in der Organischen Chemie KARPLUS-Beziehung 3J(1H,1H) in Hz ϕ C H H C ϕ 3 J(1H,1H) = 8.5 cos2 ϕ - 0.28 bei 00 ≤ ϕ ≤ 900 3 bei 900 ≤ ϕ ≤ 1800 J(1H,1H) = 9.5 cos2 ϕ - 0.28 Merke: Die KARPLUS-Beziehung liefert für eine experimentell ermittelte Kopplung keinen exakten Torsionswinkel, sondern immer nur Winkelbereiche! 1 H-NMR-Spektroskopie 4 Spektroskopie in der Organischen Chemie Die Die KARPLUS-Abhängigkeit gilt auch für olefinische Wasserstoffatome: Z H C H C E H C H z.B.: C H 7-12 Hz C Ph 14-19 Hz Ph H C H C COOH H 12.3 Hz C COOH 15.8 Hz Merke: Die 3J(1H,1H)-Kopplungskonstante ist ein hervorragender Parameter zur Unterscheidung cis- bzw. trans-Olefinen (Z bzw. E). Es gibt aber auch hier Abhängigkeiten vom s-Charakter und von Substitution: C C H H 11.6 Hz 1 H-NMR-Spektroskopie H C C C C H 2.8 Hz 5.1 Hz H H C C 8.8 Hz H H H H 7.5 Hz 5 Spektroskopie in der Organischen Chemie C C H H 7-8.5 Hz C O C H H 1-3 Hz O C C H H H H 5-8 Hz H H C 2-5 Hz H H H 2-5 Hz H 9-12 Hz H H H C C C H Bei frei drehbaren Teilstrukturen (Kohlenwasserstoff-Ketten) beobachtet man J(1H,1H) = 7 bis 8 Hz als Durchschnittswert. 3 1 H-NMR-Spektroskopie 6 Spektroskopie in der Organischen Chemie Es gibt aber auch eine Abhängigkeit von benachbarten elektronegativen Substituenten: H H H Bei den Zuckern sind die 3J(1H,1H)Kopplungskonstanten wegen der Existenz der Sauerstoffatome am unteren Ende des Erwartungsbereiches. H 9 - 12 Hz 2 - 5 Hz aber: HOH2C HO HO H HOH2C O H HO HO H O HO OH HO H α: 3.5 Hz β: 7.7 Hz OH D-Glucose 1 H-NMR-Spektroskopie 7 Spektroskopie in der Organischen Chemie Fernkopplungen (Long-Range-Kopplungen) Sind die beiden Kopplungspartner mehr als drei Bindungen voneinander entfernt, spricht man von Fernkopplungen (long-range-Kopplungen). n 1 J( H,1H) mit n > 3 Meist sind diese Kopplungen sehr klein (< 0.5 Hz), unter bestimmten Umständen können sie jedoch Werte annehmen, die im Spektrum erkennbare Signalaufspaltungen verursachen. Unter folgenden strukturellen Voraussetzungen können long-range-Kopplungen beobachtet werden: (a) W-Kopplung (4J): Die Wasserstoff- und die dazwischen liegenden Kohlenstoffatome bilden C H H eine Anordnung wie der Buchstabe W. C C Achtung: Das ganze Strukturelement muss 1-4 Hz weitgehend koplanar sein. Geringe Abweichungen werden aber toleriert. 1 H-NMR-Spektroskopie 8 Spektroskopie in der Organischen Chemie (b) Allyl-Kopplung (4J): (c) Homoallyl-Kopplung (5J): H -3,5 bis +2.5 Hz H -3 bis +2 Hz H C C C H 1 H-NMR-Spektroskopie 0 bis 2.5 Hz H H 1 bis 2 Hz C C C H H C H C C C C 1 bis 3 Hz H H 0 bis 1 Hz 9