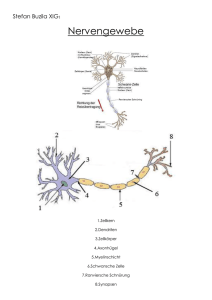
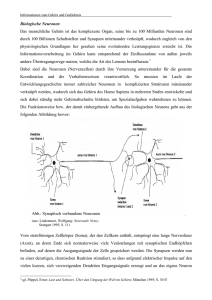
Neurotrophe Mechanismen während der Entwicklung des retino
Werbung

Neurotrophe Mechanismen während der Entwicklung des retino-tectalen Systems der Taube (Columba livia) Inaugural – Dissertation zur Erlangung des Grades eines Doktors der Naturwissenschaften in der Fakultät für Psychologie der RUHR-UNIVERSITÄT BOCHUM vorgelegt von: Carsten Theiß Gedruckt mit Genehmigung der Fakultät für Psychologie der RUHR-UNIVERSITÄT BOCHUM Referent: Prof. Dr. Onur Güntürkün Korreferent: Prof. Dr. Irene Daum Tag der mündlichen Prüfung: 21.02.2000 Danksagung Herrn Prof. Dr. O. Güntürkün möchte ich meinen Dank ausdrücken für die Bereitstellung des Dissertationsthemas sowie für die hervorragende Betreuung und konstruktive Kritik während der gesamten Phase der Anfertigung der vorliegenden Doktorarbeit. Ebenso möchte ich meinen Dank an Frau Prof. Dr. I. Daum aussprechen, die als Korreferentin das Fortkommen dieser Arbeit aufmerksam verfolgt und unterstützt hat. Herrn Prof. Dr. K. Meller gilt mein tiefster Dank für die Bereitstellung eines umfangreichen histologischen Arbeitsplatzes und der intensive Unterweisung in die Elektronenmikroskopie. Die mit Prof. Meller geführten Diskussionen zur Interpretation der Ergebnisse haben in anregender Weise zur Anfertigung dieser Dissertation beigetragen. Prof. Dr. K.P. Hoffmann und PD Dr. C. Distler danke ich für die Einweisung und die Möglichkeit der Nutzung des konfokalen Mikroskops am Lehrstuhl für allgemeine Zoologie und Neurobiologie in Bochum. Ein besonderer Dank gilt der Arbeitsgruppe der Cytologie. Die vielfältigen Unterstützungen von Claudia Grzelak, Anke Lodwig und Medah Özcan im Labor, die Hilfe von Herrn Donberg bei der Fertigstellung der fotografischen Abzüge, und die sekretärische Hilfe von Frau Bloch, haben Probleme in einzelnen Teilabschnitten der Arbeit schnell vergessen lassen. Sehr herzlich Danken möchte ich Frau Dr. Kerstin Krah und Frau Dr. Martina Manns für die vielfältig anregenden Diskussionen und das Korrekturlesen des Manuskripts. Ein besonderer Dank gilt meiner Frau Marion. Inhaltsverzeichnis 1 Einleitung __________________________________________________________ 4 1.1 Fragestellung___________________________________________________________ 10 1.2 Das Modellsystem _______________________________________________________ 12 1.2.1 Das visuelle System der Taube ________________________________________________12 1.2.2 Die Retina ________________________________________________________________14 1.2.2.1 Retinale Verschaltungen___________________________________________________14 1.2.2.2 Morphologische Besonderheiten der Taubenretina ______________________________15 1.2.2.3 Verarbeitung visueller Informationen_________________________________________16 1.2.3 Das Tectum opticum ________________________________________________________16 1.2.3.1 Morphologie des Tectum opticum ___________________________________________17 1.2.3.2 Afferente und efferente Projektionen des Tectum opticum ________________________19 1.2.3.3 Verschaltung retinaler Informationen im Tectum opticum ________________________20 1.2.3.4 Funktionelle Studien zum Tectum opticum ____________________________________20 1.2.4 Entwicklung des visuellen Systems ____________________________________________21 1.3 Die Entwicklung des Nervensystems _______________________________________ 22 1.3.1 Neuronale Migration ________________________________________________________23 1.3.2 Genetische Determination ____________________________________________________24 1.4 Neurotrophine__________________________________________________________ 24 1.4.1 Die Struktur der Neurotrophine________________________________________________26 1.4.2 Die Neurotrophin-Rezeptoren _________________________________________________26 1.4.3 Die Signalkaskade nach Neurotrophin-Bindung ___________________________________28 1.4.4 Retrograde oder anterograde Signalleitung? ______________________________________28 1.4.5 Funktionen der Neurotrophine ________________________________________________29 1.5 Zielsetzung der Arbeit ___________________________________________________ 30 2 Material und Methoden ______________________________________________ 32 2.1 Material _______________________________________________________________ 32 2.2 Die Immunhistochemie __________________________________________________ 32 2.3 Retinale und Tectale Gewebeaufbereitung __________________________________ 32 2.3.1 Perfusion juveniler und adulter Tauben _________________________________________32 2.3.2 Immersionsfixierung juveniler und adulter Tauben ________________________________33 2.3.3 Immersionsfixierung embryonalen Gewebes _____________________________________34 2.4 Schneiden des Gewebes __________________________________________________ 34 2.4.1 Herstellung von Gefrierschnitten ______________________________________________34 2.4.2 Herstellung von Vibratomschnitten_____________________________________________35 1 Inhaltsverzeichnis 2.5 Die Antikörperherstellung________________________________________________ 36 2.5.1 Antikörper gegen BDNF _____________________________________________________36 2.5.2 Antikörper gegen NT-3 ______________________________________________________37 2.5.3 Antikörper gegen trk B ______________________________________________________37 2.5.4 Antikörper gegen trk C ______________________________________________________37 2.5.5 Antikörper gegen Vimentin___________________________________________________38 2.5.6 Sekundäre Antikörper _______________________________________________________38 2.6 Immunhistochemie für die Lichtmikroskopie ________________________________ 39 2.6.1 Avidin-Biotin Reaktion ______________________________________________________41 2.6.2 Diaminobenzidin-Reaktion ___________________________________________________42 2.6.2.1 DAB-Reaktion der Retina _________________________________________________42 2.6.2.2 DAB-Reaktion der Hirnschnitte _____________________________________________42 2.6.3 Fluoreszenz-Immunhistochemie _______________________________________________43 2.7 Prozessierung für die Transmissionselektronenmikroskopie____________________ 44 2.7.1 Immunhistochemie _________________________________________________________44 2.7.2 Einbettung in Epoxidharz ____________________________________________________44 2.7.3 Herstellung von Ultradünnschnitten ____________________________________________45 2.8 Kolokalisationsuntersuchungen im Tectum opticum __________________________ 45 2.9 Kresylviolett-Färbung ___________________________________________________ 45 3 2.10 Eindeckeln der Präparate ______________________________________________ 46 2.11 Lichtmikroskopie _____________________________________________________ 46 2.12 Transmissionselektronenmikroskopie ____________________________________ 46 2.13 Fluoreszenzmikroskopie _______________________________________________ 47 2.14 Konfokale Mikroskopie ________________________________________________ 47 2.15 Spezifitätskontrollen der Antikörper _____________________________________ 48 Ergebnisse_________________________________________________________ 49 3.1 Kontrollexperimente ____________________________________________________ 50 3.2 Retinale Expression von BDNF, NT-3, trk B und trk C ________________________ 50 3.2.1 Retinale BDNF Expression ___________________________________________________51 3.2.2 Retinale NT-3 Expression ____________________________________________________57 3.2.3 Retinale trk B-Expression ____________________________________________________62 3.2.4 Retinale trk C-Expression ____________________________________________________67 2 Inhaltsverzeichnis 3.3 Tectale Expression von BDNF, NT-3, trk B und trk C _________________________ 76 3.3.1 Tectale BDNF Expression____________________________________________________77 3.3.2 Tectale NT-3 Expression_____________________________________________________84 3.3.3 Tectale trk B Expression _____________________________________________________90 3.3.4 Tectale trk C Expression _____________________________________________________97 3.4 Ultrastrukturelle Untersuchungen im Tectum opticum adulter Tauben _________ 106 3.4.1 Rekonstruktion der tectalen Schichtung im Semidünnschnitt ________________________106 3.4.2 Ultrastrukturelle Lokalisation von BDNF _______________________________________110 3.5 Kolokalisationsuntersuchungen im Tectum opticum _________________________ 118 4 3.5.1 BDNF – Vimentin _________________________________________________________119 3.5.2 NT-3 – Vimentin __________________________________________________________121 3.5.3 Trk B – Vimentin _________________________________________________________124 3.5.4 Trk C – Vimentin _________________________________________________________126 Diskussion________________________________________________________ 129 4.1 Trophische Mechanismen in der Retina ___________________________________ 130 4.2 Trophische Mechnismen im Tectum opticum _______________________________ 134 4.3 Neuronale Migration tectaler Neuronen ___________________________________ 137 4.4 BDNF und NT-3 als retrograde Signalstoffe ________________________________ 143 4.5 BDNF und NT-3 als anterograde trophische Signalstoffe _____________________ 146 4.6 Ultrastrukturelle Untersuchungen des Tectum opticum ______________________ 149 4.7 Aktivitätsabhängige Ausschüttung der Neurotrophine _______________________ 151 4.8 Aktivitätsabhängige Expression von BDNF, NT-3, trk B und trk C _____________ 153 4.9 Neurotrophin-induzierte intrazelluläre Signale _____________________________ 155 4.10 Wird visuelle Lateralisation durch Neurotrophine gesteuert? _______________ 156 4.11 Ausblick ___________________________________________________________ 161 4.12 Therapeutische Einsatzmöglichkeiten von Neurotrophinen _________________ 162 5 Zusammenfassung _________________________________________________ 165 6 Literatur _________________________________________________________ 168 3 Einleitung 4 1 Einleitung Für die Entwicklung sich aktiv bewegender komplexer Organismen war die Bildung eines effizienten neuronalen Kontrollsystems wichtig, über welches Informationen aus der Umwelt aufgenommen werden, um in einer für das jeweilige Individuum sinnvollen Weise auf einzelne Reize zu reagieren. Die ersten, einfach organisierten Nervennetze zeigen die Coelenteraten. Im Laufe der Evolution entwickelten sich solche Nervennetze zu Nervensystemen weiter, wobei insbesondere das als übergeordnete Steuereinheit fungierende Gehirn schließlich bei den phylogenetisch jungen Klassen der Vögel und Säuger eine hohe nervale Komplexität erreicht. Grundlage der Komplexität ist die morphologische Vielfalt von Neuronen und Gliazellen, den Bausteinen des Nervensystems, und deren vielfältige Verschaltungen, begründet in den spezifischen Anforderungen der Informationsaufnahme, Informationsverarbeitung und Informationsweiterleitung. Ein Teil dieser neuralen Leistungen sind asymmetrisch organisiert (Broca, 1865). So werden kognitive Teilleistungen bei der Verarbeitung von sensorischen Informationen, Gedächtnis, Emotionen, motorischer Kontrolle, Sprache und vielen anderen Sinnesqualitäten im Gehirn häufig von einer Hemisphäre dominant ausgeführt (Hellige, 1993; Davidson & Hugdahl, 1995). Gleichwohl aber zum Beispiel die linksseitige Dominanz bestimmter Komponenten der Sprache im menschlichen Gehirn seit nunmehr 150 Jahren bekannt ist, so ist die neuronale Basis für die Asymmetrie von Sprachverarbeitung nicht klar verstanden, ebenso wie die Mechanismen, welche zur Ausbildung von Asymmetrien im menschlichen Gehirn führen. Um weitere Informationen über die asymmetrische Organisation des menschlichen Gehirns zu erhalten, muß zunächst die Frage gestellt werden, wodurch Asymmetrien in diesem System ausgezeichnet sind und welche meßbaren Parameter für diese Asymmetrien vorliegen. Ein morphologisches Kriterium für Asymmetrien im Gehirn sind Größenunterschiede bestimmter Areale zwischen linker und rechter Hemisphäre, die Ausdruck unterschiedlicher Neuronengrößen, Dichteunterschiede der Neuronen sowie deren Verschaltungen sein können. Die Schwierigkeiten bei der Beschreibung solcher Asymmetrien liegen darin, daß die Unterschiede zwischen den beiden Hemisphären häufig sehr fein sind. Bei dem menschlichen Gehirn ergibt sich das weitere Problem, daß morphologische Studien nur begrenzt möglich sind, zumeist an postmortalem Gewebe älterer Personen, bei denen häufig zusätzliche Begleiterscheinungen wie altersabhängige Demenzen die Erhebung von gesicherten Daten erschweren. Gänzlich unmöglich sind darüber Einleitung 5 hinaus Studien zur Ontogenese von Hirnasymmetrien, die beim Menschen schon im Embryo etabliert sind, nach der Geburt in einer kritischen Phase aber modifizierbar bleiben. Da das Phänomen von links-rechts Asymmetrien des Gehirns auch im Tierreich weit verbreitet ist, können gerade Untersuchungen an einem einfachen, klar zu beschreibenden Objekt weitere Erkenntnisse über asymmetrische Organisationsprinzipien des Gehirns liefern. Als Untersuchungsobjekt zum Studium von Asymmetrien bietet sich hierbei das visuelle System der Vögel an, bei denen in der linken und rechten Hemisphäre verschiedene Aspekte visueller Informationen verarbeitet werden. Die Daten zur Lateralisation des Gehirns bei verschiedenen Vögeln konnten zumeist in Versuchen mit einseitigen Augenkappen gewonnen werden, die aufgrund der vollständigen Kreuzung des optischen Nervs zur kontralateralen Hirnhälfte (Weidner et al., 1985) das gezielte Studium einer Hirnhälfte ermöglichen. Insbesondere bei der Taube Columba livia wurde die lateralisierte Informationsverarbeitung verschiedener visueller Stimuli demonstriert. Hierbei zeigen Untersuchungen, daß das rechte Auge dominant ist bei der Unterscheidung zwei-dimensionaler unnatürlicher Objekte (Güntürkün, 1985) und dreidimensionaler natürlicher Objekte (Güntürkün & Kesch, 1987), ebenso wie bei dem Erkennen geometrischer optischer Illusionen (Güntürkün, 1997b). Asymmetrien wurden außerdem auch im visuellen Gedächtnis mit deutlicher Dominanz des rechten Auges, beziehungsweise der linken Hemisphäre gezeigt (v. Fersen & Güntürkün, 1990). In einem Freilandversuch zeigten Tauben nach dem Aussetzen an einem entfernten Ort Vorteile bei dem Zurückfinden zu ihrem Heim über ein ihnen bekanntes Gebiet bei der Betrachtung mit dem rechten Auge (Ulrich et al., 1999). Desweiteren entwickeln sich kognitiven Prozesse wie „learning to learn“ Effekte schneller beim Gebrauch des rechten Auges im Vergleich zum Gebrauch des linken Auges (Diekamp et al., 1999). In unilateralen Läsionsstudien in der Taube bestätigte sich die Dominanz der linken Hemisphäre bei der visuellen Informationsverarbeitung durch deutliche Einbußen nach linksseitigen versus rechtsseitigen Läsionen (Güntürkün & Hoferichter, 1985; Güntürkün & Hahmann, 1999). Zusammen zeigen diese Daten eine Dominanz des rechten Auges und der linken Hemisphäre bei der Analyse visueller Objekte. Die Dominanz der linken Hemisphäre bei visuellen Aufgaben wurden auch bei anderen Vögeln wie Hühnchen (Mench & Andrew, 1986; Rogers, 1996; Vallortigera et al., 1996), Zebrafinken (Alonso, 1998), und Meisen (Clayton & Krebs, 1994) bestätigt. Grundlage der beobachteten Lateralisation bei der Verarbeitung visueller Stimuli sind nicht periphere Faktoren, wie zum Beispiel Unterschiede in der Sehschärfe, Detektion bestimmter Einleitung 6 Wellenlängen oder Tiefenauflösungen der beiden Augen (Martinoya et al., 1988; Remy & Emmerton, 1991; Güntürkün & Hahmann, 1994), sondern vermutlich strukturelle Asymmetrien in den beiden großen aufsteigenden visuellen Sehbahnen bei Vögeln, dem thalamofugalen System (Retina >> Nucleus geniculatus lateralis pars dorsalis >> Wulst) und tectofugalen System (Retina >> Tectum opticum >> Nucleus rotundus >> Ectostriatum), die vermutlich mit lateralisiertem Verhalten im Hühnchen (Rogers, 1996) und Tauben korreliert (Skiba et al., im Druck). Während im thalamofugalen System vermutlich visuelle Prozesse der Mustererkennung und dem Erkennen von Bewegungen verarbeitet werden (Hodos, 1976; Wilson, 1980; Macko & Hodos, 1984; Güntürkün et al. 1989), so werden im tectofugalen System visuelle Informationen über Farbe, Muster und Bewegungen von Objekten verarbeitet (Hodos, 1969; Hodos & Karten, 1970; Wang et al., 1993). Anatomisch unterscheiden sich das tectofugale und thalamofugale System voneinander durch die differierende Repräsentation des visuellen Gesichtsfeldes. Im roten Feld der Retina, welches im dorso-temporalen Quadranten der Netzhaut liegt, wird das binokulare frontale Gesichtsfeld abgebildet. Dieser Teil der Retina projiziert nahezu ausschließlich in das tectofugale System, während die Projektionen vom gelben Feld der Retina, welches sich über die gesamte Netzhaut mit Ausnahme des roten Feldes erstreckt, zumeist in das thalamofugale System ziehen (Remy & Güntürkün, 1991). Im thalamofugalen System werden somit Informationen des monokularen lateralen Gesichtsfeldes verarbeitet (Güntürkün & Hahmann, 1999). Die in Verhaltensexperimenten gewonnen Daten über die lateralisierte Verarbeitung visueller Informationen wurden zumeist in Skinner-Boxen erhoben, wobei die visuellen Stimuli im binokularen frontalen Gesichtsfeld lagen. In einer solchen Lernbox ist die Datenaufnahme zur Verarbeitung visueller Informationen im thalamofugalen System sehr schwierig, und wird in der Aussagekraft gegenwärtig diskutiert. Begleitend zu den Ergebnissen aus Verhaltensversuchen und elektrophysiologischen Experimenten wird seit einigen Jahren auch nach morphologischen und biochemischen Asymmetrien im visuellen System von Vögeln gesucht. In Lateralisationsuntersuchungen des thalamofugalen Systems bis zu zwei Wochen alter Hühnchen wurden hierbei morphologische und biochemische Asymmetrien erkannt. So sind die Projektionen vom linken Nucleus geniculatus lateralis pars dorsalis auf den visuellen Wulst der rechten Hemisphäre signifikant größer als von der rechten auf die linke Hemisphäre (Rogers & Sink,1988; Rogers & Bolden, 1991; Rejendra & Rogers, 1993). Für die Basalganglien konnten Stewart und Mitarbeiter (1992b) desweiteren zeigen, daß bei zwei Tage Einleitung 7 alten Hühnchen die synaptische Dichte rechts um 22% größer ist als links. Bei diesen wurden weitere neuroanatomische subzelluläre Asymmetrien darüber hinaus auch in einer rechtshemisphärisch höheren Dichte und Größe dendritischer Spines (Stewart et al., 1984; Stewart, 1991) sowie im Spinekopfdurchmesser in den Basalganglien gefunden (Patel & Stewart, 1988). Auch biochemisch konnten Asymmetrien zwischen den beiden Hemisphären in jungen Hühnchen gezeigt werden, die sich in einer rechtsseitig gesteigerten NMDA-Sensitivität (Stewart et al, 1992a) und [14C]2-desoxyglucose Aufnahme bei visueller neuronaler Aktivität (Rose & Csillag, 1985), und einer einseitig um 50% höheren Anzahl von Vesikeln pro Synapse (Stewart et al., 1984) ausdrückt. Gleichwohl muß an dieser Stelle erwähnt werden, daß in adulten Hühnchen die beschriebenen morphologischen links-rechts Unterschiede nicht mehr nachweisbar sind, und auch adulte Tauben keine morphologischen Asymmetrien im thalamofugalen System zeigen (Burkhard Hellmann, persönliche Korrespondenz). Messungen der Perikariengröße in den superficialen Schichten des Tectum opticum von Tauben ergaben links-hemisphärisch signifikant größere Somata als rechts-hemisphärisch (Güntürkün, 1997a), ebenso wie im Nucleus rotundus (Manns & Güntürkün, 1999b). Die Projektionen von Neuronen des Tectum opticums auf den Nucleus rotundus sind bilateral organisiert (Hellmann & Güntürkün, 1999), wodurch im tectofugalen System jeder Hemisphäre das ipsi- und kontralaterale Auge repräsentiert ist. In Tauben ist der Anteil ipsi- und kontrolateraler tectorotundaler Projektionen asymmetrisch, mit zweimal mehr Neuronen vom rechten Tectum opticum zum linken Nucleus rotundus als umgekehrt (Güntürkün et al. 1999). Daher erhält der Nucleus rotundus der dominanten linken Hemisphäre neben den Efferenzen des ipsilateralen TO auch massiven Eingang von der kontralateralen Seite mit der Konsequenz einer deutlichen anatomischen Asymmetrie des visuellen Eingangs links-hemisphärisch. Die funktionelle Relevanz dieser Asymmetrie liegt vermutlich in der Integration visueller Informationen des binokularen Gesichtsfeldes im linken Nucleus rotundus (Güntürkün & Hahmann, 1999; Skiba et al., im Druck). Die Verarbeitung visueller Informationen in den beiden großen aufsteigenden Systemen korreliert möglicherweise mit einer Aufteilung der Hemisphären bei der Verarbeitung verschiedener visueller Informationsqualitäten (Farbe, Bewegung, Muster, usw.) da zumindest das tectofugale System deutlicher in der linken Hemisphäre repräsentiert ist. Inwieweit bei adulten Vögeln die Verarbeitung visueller Informationen im thalamofugalen System dominant in der rechten Hemisphäre erfolgt, bleibt gegenwärtig noch unbeantwortet. Möglicherweise wird über eine Einleitung 8 Aufteilung der Verarbeitung visueller Stimuli in den beiden großen aufsteigenden Sehbahnen eine Konfliktvermeidung bei der Informationsverarbeitung gewährleistet, gleichwohl visuelle Informationen auch in beiden Systemen parallel verarbeitet werden (Rogers, 1996). Die Ergebnisse verschiedener biochemischer, anatomischer und verhaltensphysiologischer Untersuchungen deuten darauf hin, daß bei der Determination von Körperasymmetrien genetische und epigenetische Faktoren eine Rolle spielen. Hierbei werden die ersten bei Vertebraten zu beobachtenden Körperasymmetrien, wie die Anlage der visceralen Organe Milz, Leber und Herz durch eine Reihe von Signalmolekülen bestimmt, die während bestimmter Entwicklungsvorgänge einseitig exprimiert werden (Levin et al., 1995; Yost, 1995). Im Hühnerembryo konnte gezeigt werden, daß ein Signalmolekül namens Activin während der Gastrulation asymmetrisch exprimiert wird und an entsprechenden symmetrisch exprimierten Rezeptoren (cAct RIIb) bindet. Dies wiederum induziert die Expression eines weiteren Rezeptors (cAct RIIa) auf der rechten Seite, wodurch die Expression eines weiteren Signalmoleküls (Shh) auf die linke Seite begrenzt bleibt. Anschließend wird das Gen „cNR-1“, welches ein sekretorisches Signalmolekül der TGFßFamilie („transforming growth factor-ß“) codiert, asymmetrisch linksseitig exprimiert. Dieses sekretorische Signalmolekül nimmt im folgenden Einfluß auf das Wachstum der umliegenden Zellen (Levin et al., 1995), und bedingt eine Rotation des Embryos im Ei (Robertson, 1997). Die Existenz einer molekularen Signalkaskade von asymmetrisch exprimierten Signalmolekülen während der Gastrulation zeigt, daß im Hühnerembryo links-rechts Asymmetrien determiniert sind, bevor erste morphologische Asymmetrien zu beobachten sind. Neben den genetischen Faktoren konnte in den letzten Jahren auch der Einfluß von epigenetischen Faktoren auf die Ausbildung von Asymmetrien, insbesondere bei der Verarbeitung visueller Informationen, näher beschrieben werden. Als Modellsystem für die Untersuchung solcher Phänomene bietet sich das zunächst einfach aufgebaut erscheinende visuelle System von Vögeln an, bei denen die vollständige Kreuzung des optischen Nervs differenzierte Studien eines Auges / einer Hemisphäre ermöglichen. Nach einer einseitigen oder beidseitigen Manipulation, zum Beispiel durch Augenkappen, können im visuellen System gezielt Effekte in der jeweils kontralateralen Hemisphäre beziehungsweise in beiden Hemisphären gleichermaßen untersucht werden. In ontogenetischen Studien wurde gezeigt, daß eine Dunkelinkubation der Eier die Ausbildung von visuellen Asymmetrien in Hühnchen (Rogers, 1982) und Tauben verhindert (Güntürkün, Einleitung 9 1993). Außerdem führt bei Tauben, nicht aber bei Hühnchen, eine zehntägige monokulare Deprivation des rechten Auges beginnend nach dem Schlupf zu einer Umkehr der links-rechts Asymmetrien, während die monokulare Deprivation des linken Auges eine Verstärkung der normalen Dominanz der linken Hemisphäre im tectofugalen System bewirkt (Manns & Güntürkün, 1999a). Augenkappenversuche zwanzig Tage nach dem Schlupf zeigten hingegen keine Effekte auf Asymmetrien im visuellen System der Taube (Manns, 1998). Aus diesen Experimenten wird ersichtlich, daß Manipulationen der visuellen Erfahrungen funktionelle Asymmetrien in einem kritischen Zeitfenster beeinflussen, bei Hühnchen nur im Embryo, bei Tauben auch während einer gewissen Phase nach dem Schlupf. Darüber hinaus zeigen die Ergebnisse, daß die Asymmetrien im visuellen System bei Hühnchen und Tauben durch den epigenetischen Faktor Licht vor dem Schlupf gesteuert werden (Rogers, 1996). Bis zur Etablierung dieser Hirnasymmetrien im visuellen System der Vögel kommt es vermutlich zu einer Kaskade von Ereignissen, an deren Anfang vermutlich genetisch determinierte Signalkaskaden stehen (siehe oben), die zu einer asymmetrischen Lage des Vogelembryos im Ei führen (Kuo, 1932). Diese Position des Embryos im Ei bedingt eine Abschattung des linken Auges durch den Körper, während das rechte Auge der Eischale zugewandt ist. Durch die Eischale eindringendes Licht, welches vermutlich primär vom rechten Auge perzipiert werden kann, ist bei der Taube der epigenetische Faktor, welcher die Ontogenese der visuellen Lateralisation des Taubengehirns steuert. Einleitung 1.1 10 Fragestellung In der Ontogenese des Nervensystems ist das Grundgerüst, daß heißt seine Kompartimentierung in verschiedene Hirnanteile mit einem jeweils charakteristischen Aufbau, genetisch determiniert. Die hohe, zum Teil asymmetrische Organisation des Gehirns, mit der Fähigkeit zu Lernen, dem Erinnerungsvermögen sowie der überlegten Handlung, erfordert jedoch viele Feinabstimmungen, zum Beispiel bezüglich der Morphologie von Neuronen und deren synaptischer Verbindungen. Hierbei beeinflussen epigenetische Faktoren Musterbildungsprozesse (Purves & Lichtman, 1985), wobei ein Anstieg an Komplexität durch die Interaktion zwischen einem induzierenden und einem antwortenden Gewebe erreicht wird (Nieuwkoop et al., 1985). Im visuellen System von Vögeln ist die linke Hemisphäre dominant bei der detaillierten Analyse von visuellen Merkmalen, während die rechte Hemisphäre dominant räumliche Prozesse und die Erinnerung bekannter Objekte in einem sozialen Kontext verarbeitet (Güntürkün, 1997c). Diese Lateralisation im visuellen System ist vergleichbar mit Hirnasymmetrien beim Menschen, was daraufhin deutet, daß zumindest ein Teil der Lateralisationen im Gehirn einen gemeinsamen Ursprung zwischen Mammaliern und Vögeln hat (Güntürkün, 1997c). Bei den Vögel ist der epigenetische Faktor Licht ein wichtiger Parameter für die Etablierung visueller Lateralisationen. In einer Kaskade von Signalen sind Mechanismen wahrscheinlich, bei denen eine genetisch determinierte Lage des Vogelembryos im Ei eine asymmetrische Lichtstimulation des visuellen Systems bedingt. Die Konsequenzen sind vermutlich unterschiedliche Aktivitätsmuster der beiden Augen zu bestimmten Phasen der embryonalen Entwicklung, die nach einer Umwandlung in entsprechende molekulare Signale die beschriebenen morphologischen Asymmetrien im Vogelhirn bewirken. Solche morphologischen Organisationsprinzipien korrelieren wiederum mit lateralisierter Informationsverarbeitung sowie lateralisiertem Verhalten. Um das Phänomen der Asymmetrie des Gehirns weiter zu verstehen, sind verschiedene experimentelle Ansätze denkbar, die unterschiedliche Teilaspekte in dem Gesamtkomplex Lateralisation behandeln. In Verhaltensversuchen können immer feinere Unterschiede der Informationsverarbeitung im Gehirn erfaßt werden. Verhaltensversuche kombiniert mit gezielten Läsionsstudien lassen zumeist eine genaue Überprüfung der gewonnen Ergebnisse über asymmetrische Informationsverarbeitung zu. Einleitung 11 Neben diesen Ergebnisse zur asymmetrischen Informationsverarbeitung im Gehirn können histologische Untersuchungen weitere grundlegende Daten für morphologische Korrelate von lateralisiertem Verhalten liefern. Insbesondere ein histologisches Studium der Ontogenese des visuellen Systems sollte dazu beitragen, neue Erkenntnisse über die Etablierung von Lateralisation zu gewinnen. Zum Verständnis der Konsequenzen molekularer Signalwege müssen hierbei nicht nur die Mechanismen erforscht werden, welche zu einer asymmetrischen Verteilung der Signalmoleküle führen, sondern auch die Mechanismen, über welche Zellen die asymmetrisch exprimierten Signale interpretieren. Möglicherweise erfüllen trophische Faktoren, zu denen die Gruppe der Neurotrophine zählen, wichtige Funktionen bei der Etablierung von Organisationsstrukturen im Gehirn. Wie in den weiteren Ausführungen eingehend beschrieben wird, sind Neurotrophine endogene, lösliche Proteine, die das Überleben, das Wachstum, die morphologische Plastizität und die Synthese von Proteinen in Neuronen regulieren (Hefti et al., 1993). In der vorliegenden Arbeit wird die Expression der beiden Neurotrophine “brain-derived neurotrophic factor” und “neurotrophin-3” sowie der zugehörigen “high-affinity”-Rezeptoren trk B und trk C während der Entwicklung der retino-tectalen Konnektivitäten in der Taube Columba livia untersucht. In dieser ontogenetischen Expressionsstudie dieser aktivitätsabhängig exprimierten und freigesetzten Neurotrophine soll die Frage untersucht werden, welche Rolle Neurotrophine möglicherweise als Vermittler zwischen dem epigenetischer Faktor Licht und dem Auftreten von morphologischen Asymmetrien in diesem System erfüllen. Die Taube als Tiermodell zur Untersuchung des Einflusses neurotropher Faktoren während der Etablierung und Stabilisierung des visuellen System eignet sich für diese Untersuchungen in vielfältiger Weise. Es handelt sich um eine Tierart, deren Nervensystem eine hohe Komplexität mit deutlichen morphologisch und verhaltensphysiologisch charakterisierten Asymmetrien zeigt. Außerdem ist die morphologische Entwicklung des retino-tectalen Systems dieser beim Schlupf noch unreifen Vögel gut charakterisiert. Die Innervation retinaler Axone in das Tectum opticum beginnt vier Tage vor dem Schlupf und dauert etwa zwanzig Tage an, wobei sich parallel die tectale Schichtung etabliert (Manns & Güntürkün, 1997). In diesem Zeitraum von etwa drei Wochen werden darüber hinaus die morphologischen und funktionellen Asymmetrien des visuellen Systems determiniert (Manns & Güntürkün, 1999a), ein Prozeß, der zum Beispiel bei den nesthockenden Hühnchen bereits beim Schlupf abgeschlossen ist (Rogers, 1996). Einleitung 12 In den folgenden Abschnitten wird das in der vorliegenden Arbeit untersuchte Modellsystem, das retino-tectale System der Taube Columba livia, eingehend beschrieben, bevor einige Grundlagen der Etablierung des Nervensystems bei Vertebraten allgemein dargestellt werden. Anschließend werden die untersuchten Neurotrophine und Neurotrophin-Rezeptoren vorgestellt, und die bekannten Wirkungsmechnismen dieser Signalmoleküle während der Etablierung verschiedener Systeme als auch in Adulten kurz skizziert. 1.2 Das Modellsystem Als Modell für die Untersuchungen neurotropher Mechanismen wurde das retino-tectale Systems der Taube Columba livia, welche zur Klasse der Vögel (Aves) gehört, ausgewählt. Die Entwicklung des bei dieser Spezies gut ausgeprägten und komplexen visuellen Systems ist mit dem Schlupf der Tiere nicht abgeschlossen, sondern dauert bis nach dem Schlupf an (Manns & Güntürkün, 1997). In den folgenden Abschnitten wird die Komplexität der retino-tectalen Informationsfortleitung dargestellt deren Etablierung vermutlich eine Vielzahl an Feinanpassungen erfordert. 1.2.1 Das visuelle System der Taube Die tagaktive Taube Columba livia ist eine visuell hochentwickelte Spezies (Emmerton, 1983). Bereits ihre seitlich am Kopf plazierten Augen deuten durch die Größe im Vergleich zum Kopf auf die Dominanz dieser Sinnesorgane hin. Visuelle Informationen, welche in Form von Lichtreizen die Linse und den Glaskörper passieren, werden am Augenhintergrund auf der Retina abgebildet. Von dieser nehmen die Projektionen des visuellen Systems als Nervus opticus ihren Ursprung. Der Nervus opticus, mit ca. 2.4 Millionen Axonen (Binggelli & Paule, 1969) etwa 2.5mal faserreicher als der Nervus opticus des Menschen (Curcio & Allen, 1990), kreuzt nahezu vollständig im Chiasma opticum (Cowan et al., 1961), um in der kontralateralen Hirnhälfte im Nucleus geniculatus lateralis, pars ventralis (GLv) et pars dorsalis (GLd), Nucleus suprachiasmaticus, Area praetectalis, Nucleus lentiformis mesencephali, Nucleus of the Basal Optic Root (nBor), und im Tectum opticum zu terminieren (Hirschberger, 1967; Karten & Nauta, 1968; Meier & Cuénod, 1973). Einleitung 13 Ein geringer Anteil an ipsilateralen Projektionen zieht zum nBor (Güntürkün & Karten, 1991, Shimizu et al., 1994), zum GLv (Shimizu et al., 1994), zu den Nuclei praetectalis parvocellularis et magnocellularis (Shimizu et al., 1994), und zum Nucleus lateralis anterior (Remy & Güntürkün, 1991; Shimizu et al., 1994). Die beiden großen aufsteigen Sehbahnen bilden das thalamofugale und das tectofugale System. Im thalamofugalen System findet die Informationsfortleitung von der Retina über den GLd zum im Vorderhirn gelegenen visuellen Wulst statt. Im tectofugalen System wird visuelle Information von der Retina zum mesencephalen Tectum opticum, und von dort über den diencephalen Nucleus rotundus zum telencephalen Ectostriatum weitergeleitet. Das thalamofugale System entspricht dem geniculocorticalen System, das tectofugale System dem extrageniculocorticalen System der Säuger (Karten & Shimizu, 1989). Da retinale Axone zu 75-95% im Tectum opticum terminieren (Remy & Güntürkün, 1991), und es sich hierbei um ein durch epigenetische Faktoren beeinflußtes System handelt (Güntürkün, 1997a), waren in der vorliegenden Arbeit neurotrophe Mechanismen in der Retina und dem Tectum opticum sowie bei der Etablierung retino-tectaler Konnektivitäten von besonderem Interesse. 1.2.2 Die Retina Bei der Taube zeigt die Retina den für Vertebraten typischen Aufbau aus zellkörperreichen (nukleären) und zellkörperarmen (plexiformen) Schichten (Abbildung 2). In der adulten Retina finden sich zwei plexiforme Schichten, eine äußere plexiforme Schicht (ÄpS) und eine innere plexiforme Schicht (IpS) sowie drei nukleäre Schichten, eine äußere nukleäre Schicht (Äns), eine innere nukleäre Schicht (InS), und eine Ganglion-Zellschicht (GzS). Den einzelnen nukleären Schichten der Retina läßt sich eine begrenzte Anzahl an Zelltypen zuordnen. In der Abbildung 2: Skizze nach Wässle & Boycott (1991) Licht wird von den Photorezeptoren in elektrische Signale umgewandelt, welche über die Bipolarzellen zu den retinalen Ganglienzellen weitergeleitet werden, deren Axone als einzige die Retina verlassen. Horizontal- und ÄnS sind sogenannte Einleitung 14 Photorezeptoren lokalisiert, in der InS Horizontal-zellen, Amakrinzellen, inter-plexiforme Zellen und Bipolar-zellen; und die Ganglienzellen sind Namensgeber der entsprechenden GzS (Wässle & Boycott, 1991). 1.2.2.1 Retinale Verschaltungen Zwei Typen an Photorezeptoren können unterschieden werden, die äußerst lichtempfindlichen Stäbchen, denen besondere Bedeutung beim Dämmerungssehen zukommen und die für das Farbsehen verantwortlichen Zapfen und Doppelzapfen (Morris, 1970; Mariani & Leure-DuPree, 1978). Grundsätzlich bestehen Photorezeptoren aus einem inneren und einem äußeren Segment, wobei das innere Segment in der ÄnS, das äußere Segment in der ÄpS lokalisiert ist (Nalbach et al., 1993). Das innere Segment dient der Energieversorgung und der Proteinsynthese, wohingegen im äußeren Segment Lichtreize mit Hilfe von Sehfarbstoffen in elektrische Signale umgewandelt werden. Diese elektrischen Signale werden über nachgeschaltete Bipolarzellen zu den retinalen Ganglienzellen weitergeleitet, die auch als zweite und dritte Neuronen der visuellen Projektionsbahn bezeichnet werden. Jede Bipolarzelle erhält ihre Eingänge von Stäbchen oder Zapfen. Zumeist versorgen 15-45 Stäbchen oder alternativ 5-20 Zapfen eine Bipolarzelle. In den Foveae, retinalen Bereichen mit besonders hoher Sehschärfe, ist hingegen eine 1:1 Verschaltung von Zapfen auf Bipolarzellen zu verzeichnen (Sterling et al., 1988). Die Bipolarzellen, welche keine eigenen Impulse erzeugen, sondern auf Lichtaktivierung der Photorezeptoren mit anhaltenden De- oder Hyperpolarisationen reagieren, stehen im synaptischen Kontakt mit den retinalen Ganglienzellen. Deren Axone verlassen als einzige die Retina, um als Nervus opticus den Ursprungsort der retinalen Projektionen zu bilden. Eine Subpopulation an Ganglienzellen ist außerdem in der InS lokalisiert und wird als “displaced ganglion cells” (DGCs) bezeichnet (Brecha & Karten, 1981). Solche mittelgroßen und großen DGCs haben bis in die IpS reichende Dendriten (Britto et al., 1988) und projizieren zum Nucleus accessorius bei Vögeln (Fite et al., 1981). Sie sind vornehmlich in der peripheren Retina lokalisiert (Prada et al., 1989; Prada et al., 1992). Ein geringer Anteil an kleinen DGCs liegt hingegen in der zentralen Retina, wobei die Projektionen dieser Neuronen noch unbekannt sind (Hayes & Holden, 1983). Die in der InS lokalisierten Horizontalzellen und Amakrinzellen fungieren in der Retina als Interneuronen. Horizontalzellen stellen den Kontakt zwischen verschiedenen Photorezeptoren her. Einleitung 15 Sie sind untereinander über elektrische Synapsen, sogenannte Gap-junction Proteine, verbunden. Die Funktion der Horizontalzellen liegt vermutlich in der Integration der Erregung verschiedener Photorezeptoren. Die Amakrinzellen stehen im synaptischen Kontakt sowohl mit Bipolarzellen als auch Ganglienzellen, wodurch eine abgestimmte Erregung retinaler Ganglienzellen möglich wird. 1.2.2.2 Morphologische Besonderheiten der Taubenretina In der Taubenretina lassen sich zwei verschieden gefärbte Bereiche gegeneinander abgrenzen: das “rote Feld” im dorso-temporalen Quadranten von dem sich über die restliche Retina erstreckenden “gelben Feld”. Für das Farberscheinen dieser Felder verantwortlich sind verschiedenfarbige Öltropfen (Galifret, 1968), welche im inneren Segment der Zapfen vorliegen (Bloch & Marturana, 1971; Mariani & Leure-DuPree, 1978). Bestandteile dieser Öltropfen sind gelöste Karotinoide (Varela et al., 1993). Die Funktion der Öltropfen liegt in der Absorption von Licht unterhalb einer spezifischen Wellenlänge, wobei die sogenannten “cut-off” Filter die für einen Photorezeptor sensitivsten Lichtwellenlängen passieren lassen (Bowmaker, 1977; Emmerton, 1983; Young & Martin, 1984; Kawamuro et al., 1997, Hart et al., 1998). Desweiteren sind in der Taubenretina zwei Bereiche erhöhter Ganglienzelldichte abzugrenzen, die “Area dorsalis” im roten Feld und die “Area centralis” im gelben Feld (Binggeli & Paule, 1969; Hayes & Holden, 1983). 1.2.2.3 Verarbeitung visueller Informationen In der Vogelretina werden große, mittelgroße und kleine Ganglienzellen unterschieden, die durch morphologische und elektrophysiologische Kennzeichen, ähnlich denen der Y-, X, und W-Zellen der Katzenretina (Illing & Wässle, 1981), gegeneinander abzugrenzen sind (Hayes & Holden, 1980; Remy & Güntürkün, 1991). Die beschriebene morphologische Unterteilung der Taubenretina in ein rotes und ein gelbes Feld korreliert mit der differenzierten Verarbeitung visueller Information. Im roten Feld, welches das ventro-frontale, binokulare Gesichtfeld der Taube repräsentiert, werden Informationen über nahe, am Boden liegende Objekte, wie zum Beispiel Futter, aufgenommen (Bloch & Martinoya, 1982; Uhlrich et al., 1982). Hingegen werden mit der im gelben Feld gelegenen Area centralis, in der das monokulare, laterale Gesichtsfeld abgebildet wird, weit entfernte Objekte fixiert (Blough, Einleitung 16 1971). Die Area centralis ist die Region der maximalen visuellen Auflösung der Taubenretina (Hahmann & Güntürkün, 1993). Charakteristisch für die Vogelretina ist die Verarbeitung komplexer Reizmuster auf retinaler Ebene. So wurde in den sechziger Jahren in elektrophysiologischen Untersuchungen eine direkte Einzellaktivierung auf individuelle Reizparameter wie Bewegung und Orientierung in der Netzhaut gemessen (Marturana, 1962; Marturana & Fenk, 1963). 1.2.3 Das Tectum opticum Das mesencephale Tectum opticum (TO) ist Bestandteil der tectofugalen Sehbahn. Nach nahezu vollständiger Kreuzung im Chiasma opticum terminieren ca. 75-95% der Axone retinaler Ganglienzellen im kontralateralen TO (Remy & Güntürkün, 1991), um von dort über den thalamischen Nucleus rotundus ipsilateral zum telencephalen Ectostriatum zu projizieren. Diese aufsteigende Sehbahn vergleichen Karten & Shimizu (1989) mit dem extragenikulostriatären System der Säuger, bei welchen die Projektion von der Retina über den mesencephalen Colliculus superior zum thalamischen Pulvinar und anschließend weiter zum extrastriatärem Cortex verläuft. 1.2.3.1 Morphologie des Tectum opticum Mit einer ca. 6mm großen Ausdehnung in der rostro-caudal Achse ist das TO im Vergleich zur Gesamtlänge des Taubengehirns (20mm) proportional gut ausgeprägt. Im Nissl-Präparat zeigt sich eine deutliche laminäre Struktur, wobei nukleäre und plexiforme Schichten unterschieden werden. Nach Ramon y Cajal (1911) werden im TO adulter Tauben von außen nach innen, daß heißt von der Oberfläche zum Seitenventrikel, 15 Schichten unterschieden, die mit den arabischen Nummern 1 bis 15 belegt sind (Abbildung 3). Kennzeichnend für die einzelnen Schichten sind das Vorkommen diverser Zelltypen (Hayes & Webster, 1975), Abbildung 3: Die einzelnen Schichten des TO adulter Tauben, nach Ramon y Cajal (1911) mit den arabischen Nummer 1-15 belegt, sind im Nissl-Präparat gut abgrenzbar. Einleitung 17 dorso-ventrale Unterschiede in der Schichtdicke (Hayes & Webster, 1985) sowie Unterschiede in der Zelldichte (Theiss et al., 1998). Die Schicht 1 des TO ist eine reine Faserschicht, über welche retinale Axone in einer retinotopen Ordnung in das TO einziehen (McGill et al., 1966; Crossland et al., 1974; Clark & Whitteridge, 1976; Remy & Güntürkün, 1991), um dann die superficialen Schichten 2-7, insbesondere die Schichten 3, 5, und 7 zu innervieren (Hayes & Webster, 1975, Angaut & Repérant, 1976; Acheson et al., 1980). Die höchste synaptische Dichte wird in der Schicht 5 im TO erreicht (Hayes & Webster, 1985). In den superficialen Schichten finden sich vornehmlich horizontale Zellen, mit in den Schichten 4 und 5 gelegenen Perikaria und parallel zur tectalen Oberfläche verlaufenden Dendriten. Die Mehrzahl dieser Zellen ist anaxonal, daß heißt sie projizieren nicht aus dem TO heraus (Van Gehuchten, 1892). Vielmehr stehen sie in prä- und postsynaptischen Kontakt mit den Dendriten weiterer Zellen des TO oder erhalten, wie im Falle der horizontalen Zellen der Schicht 5, direkten Input retinaler Axone. Neben den horizontalen Zellen finden sich radiale Zellen in der Schicht 4. Die Schichten 8 bis 12 können im Nissl-Präparat deutlich gegeneinander abgegrenzt werden, wobei das Vorkommen bestimmter Zelltypen für die einzelnen Schichten kennzeichnend ist. In der Schicht 8 wird ein deutliches Band dicht gepackter Radialzellen sichtbar. Weniger dicht liegen Radialzellen in den Schichten 9 bis 12. Neben den Radialzellen sind in den tectalen Schichten 10 und 11 auch sogenannte multipolare Neuronen lokalisiert (Van Gehuchten, 1892), deren Efferenzen vermutlich die praetectalen Kerne erreichen. Die Dendriten der in den mittleren Zellschichten lokalisierten Neuronen steigen bis in die superficialen Schichten auf, um dort synaptische Kontakte mit retinalen Ganglienzell-Axonen oder Horizontalzellen einzugehen. Die Radialzellen projizieren mit ihren Efferenzen zum ventralen Thalamus und zum GLd (Hunt & Künzle, 1976; Wild, 1989). Die größten Zellen des TO sind die multipolaren Neuronen der Schicht 13. Ihre Perikaria erreichen Durchmesser von 30 bis 50µm (Hardy et al., 1985), und ihre massiven und weitreichenden Dendriten ziehen radial in die superficialen Schichten (Van Gehuchten, 1892; Ramon y Cajal, 1911). Diese Neuronen bilden mit ihren zum Nucleus rotundus projizierenden Axonen den Hauptteil des efferenten Ausgangs aus dem TO. Die beiden periventrikulären Schichten 14 und 15 liegen zwischen dem Ependym des tectalen Ventrikels und der Schicht 13. Es handelt sich um Faserschichten mit nur sehr wenigen Neuronen. Einleitung 18 In der vorliegenden Untersuchung wurden die tectalen Laminae 1 bis 7 als superficiale Schichten, die Laminae 8 bis 12 als mittlere Schichten, und die Laminae 13 bis 15 als tiefe tectale Schichten zusammengefaßt. Dieser Zusammenschluß diverser Zellschichten reflektiert morphologische und funktionelle Aspekte der Informationsfortleitung im TO, da insbesondere die superficialen Schichten retino-rezipient sind, Neuronen der mittleren Schichten zumeist als Interneuronen fungieren, während die tiefen tectalen Schichten den Hauptteil der tectalen Efferenzen ausmachen. 1.2.3.2 Afferente und efferente Projektionen des Tectum opticum Die Afferenzen des TO der Taube sind in visuelle und nicht-visuelle Projektionen einzuteilen (Brecha, 1978). Der Großteil der visuellen Projektionen stammt von der Retina, und zu geringeren Anteilen von weiteren zum Sehsystem gehörenden Strukturen, wie dem visuellen Wulst und dem multimodal arrangiertem Archistriatum. Die Projektionen der Retina sind im TO topographisch organisiert, wobei die superio-temporale Retina (beinhaltet das rote Feld) mit Efferenzen auf das rostro-ventrale TO, die inferio-temporale Retina mit Efferenzen auf das rostrodorsale TO, die superio-nasale Retina mit Efferenzen auf das caudo-ventrale TO, und schließlich die inferio-nasale Retina mit Efferenzen auf das caudo-dorsale TO projiziert (Remy & Güntürkün, 1991). Sowohl die Area dorsalis im roten Feld als auch die Area centralis im gelben Feld der Retina werden disproportional vergrößert im TO abgebildet (Clarke & Whitteridge, 1976). Die Efferenzen des TO gelangen zu verschiedenen visuellen, motorischen und multimodal arrangierten Strukturen des Gehirns, wie zum Beispiel dem Thalamus, dem Praetectum, den pontinen Kernen, der Formatio reticularis, und den isthmischen Kernen (Hunt & Künzle, 1976). 1.2.3.3 Verschaltung retinaler Informationen im Tectum opticum Die Axone retinaler Ganglienzellen terminieren vornehmlich auf radial orientierten Dendriten in den superficialen Schichten sowie zu geringen Anteilen auf tief in der Schicht 4 gelegenen Horizontalzellen (Hayes & Webster, 1975; Angaut & Repérant, 1976; Repérant & Angaut, 1977; Hardy et al., 1985). In elektrophysiologischen Experimenten untersuchten Hardy und Mitarbeiter (1985) die intratectale Verarbeitung visueller Informationen im tectofugalen System. Demnach erhalten multipolare Neuronen der Schicht 13 über ihre Dendriten Informationen aus direkt innervierenden retinalen Zellen und leiten diese ohne weitere synaptische Verschaltungen Einleitung 19 weiter. Daneben haben aber auch Radialzellen der Schichten 10 und 11 direkte Verschaltungen mit retinalen Zellen, um als Interneuronen die elektrische Erregung zu den Neuronen der Schicht 13 weiterzuleiten, wo sie axo-somatische Synapsen bilden. Auf Grund autoradiographischer Untersuchungen wird Glutamat als exzitatorischer Neurotransmitter für diese Signalleitung vermutet (Beart, 1976; Henke et al., 1976a/b). In einer immunhistochemischen Arbeit konnte gezeigt werden, daß verschiedene Glutamatrezeptoren vom AMPA-Typ im TO der Taube exprimiert werden (Theiss et al., 1998). Insbesondere die superficialen Schichten als auch die Schichten 9, 10 und sehr stark 13 des TO zeigten deutliche Immunreaktivität gegen diese Rezeptoren. Die in den superficialen Schichten gelegenen Horizontalzellen bilden trisynaptische Schaltkreise mit postsynaptischem retinalen Input und präsynaptischen Kontakten auf radial orientierten Dendriten. Sie fungieren als Interneuronen und modulieren vermutlich retinale Informationen. Als inhibitorischen Neurotransmitter exprimieren diese Neuronen GABA (Hunt & Künzle, 1976a, Streit et al., 1978) und Glycin (Hunt et al., 1977). 1.2.3.4 Funktionelle Studien zum Tectum opticum In TO der Taube dominieren die visuellen Afferenzen, mit dem Hauptteil der Axone von retinalen Ganglienzellen (Remy & Güntürkün, 1991). Elektrophysiologische Untersuchungen zeigten, daß 70% der tectalen Neuronen auf bewegte Reize, davon 30% mit einer bestimmten Vorzugsrichtung dieser Bewegung, reagieren (Jassik-Gerschenfeld & Guichard, 1972). Die Größe der rezeptiven Felder ist in den superficialen Schichten mit 0.5° bis 4.0° sehr gering, nimmt in den tiefen tectalen Schichten 12 bis 14 aber auf bis zu 180° zu (Jassik-Gerschenfeld et al., 1975; Frost et al., 1981). Die Verarbeitung von Informationen über die Bewegung von Objekten wurde in weiteren elektrophysiologischen Untersuchungen näher charakterisiert, wobei eine Bewegung eines Objektes vor einem ruhigen Hintergrund zu einer gesteigerten Antwort von Neuronen im TO führte, während die gleichgerichtete Bewegung von Objekt und Hintergrund eine Inhibition der Neuronenantwort im TO bewirkte (Frost & Nakayama, 1983). Es ist wahrscheinlich, daß Neuronen des TO die Diskrimination von Objekten und Hintergrund durch die Analyse von Bewegungsdifferenzen der Beiden leisten (Frost et al., 1990). Neben dieser Bewegungsanalyse antworten etwa 30% der tectalen Neuronen auf farbige Stimuli (Letelier, 1983). Auf Grund der anatomischen Organisation der retino-tectalen Projektionen, mit der exklusiven Projektion des roten Feldes der Retina auf das tectofugale System, werden hier Einleitung 20 visuelle Informationen des frontalen, binokularen Gesichtsfeldes verarbeitet (Remy & Güntürkün, 1991). Einleitung 21 1.2.4 Entwicklung des visuellen Systems Die Taube gehört zu den nesthockenden Vögeln. Jungtiere lösen sich erst nach der dritten bis vierten Lebenswoche von den Elterntieren. Beim Schlupf haben sie noch geschlossene Augen. Kennzeichnend für das visuelle System zu diesem Stadium sind die erst unvollständig entwickelten Projektionen (Bagnoli et al., 1985, 1987). Die von nun an ablaufende Entwicklung des visuellen Systems ist grundsätzlich vergleichbar zu der in Hühnerembryonen (Hamburger & Hamilton, 1951), jedoch ist die Ausreifung der Projektionen sowie der entsprechenden Zielgebiete gegenüber den nestflüchtenden Hühnchen deutlich verzögert (Manns & Güntürkün, 1997). Die Entwicklung der embryonalen beziehungsweise juvenilen Taube wurden von Manns & Güntürkün (1997) klassifiziert. Da Tauben zwei Eier innerhalb von drei Tagen legen, mit dem Brüten aber erst nach Ablage des zweiten Ei beginnen, wurde der Tag der zweiten Eiablage als E 0 (Embryonal-Tag 0) definiert. Es folgen 17 Bruttage (E 1-E 17). Der Schlupftag der Tiere wurde als „Posthatching-Tag 0“ (PH 0) eingeordnet. Die Ergebnisse der Entwicklung der laminären Struktur des TO sowie der retino-tectalen Projektion stützen sich auf die Untersuchungen von Manns und Güntürkün (1997). Demnach erfolgt die Entwicklung der tectalen Schichten sowie die retinale Innervation entlang eines rostrocaudalen und latero-medialen Gradienten. Die Laminierung des TO hat ab E 8 im gesamten TO begonnen und endet um PH 14 im caudo-ventralen Bereich des TO. Während dieser Zeit entstehen die Neuronen in der Ventrikularschicht, der Schicht 0, um anschließend zur tectalen Oberfläche zu migrieren, wobei ein “inside-outside layering” (siehe Punkt 1.3.1) zu beobachten ist. In der vorliegenden Arbeit werden Schichten des TO aufgrund ihrer Morphologie und Funktion zusammengefaßt und als tiefe, mittlere und superficiale Schichten bezeichnet, deren Entstehung skizziert wird. Die als tiefe Schichten bezeichneten Laminae 13, 14 und 15, werden im embryonalen TO in einer alphabetischen Nomenklatur als Schichten A, B und C bezeichnet. Bis ca. E 9 sind sie angelegt und gegeneinander abzugrenzen. Die mittleren Zellschichten des TO, die Laminae 8 bis 12, während der Embryonalstadien als Schichten D, E, F, G und H klassifiziert, entstehen bis E 13. In den verbleibenden 18 Tagen, bis PH 14 wird die Entwicklung des TO mit der Reifung der superficialen Schichten 1-7 abgeschlossen. Die Reifung der Schichten ist hierbei zuerst im Einleitung 22 lateralen Bereich abgeschlossen, mit einer zeitlichen Verzögerung von 1-2 Tagen folgt das dorsale, und wiederum 1-2 Tage später das ventrale TO. Die Entwicklung der retino-tectalen Projektion zeigt eine Innervation des TO bereits zum Zeitpunkt E 14, wobei ab E 15-E 16 einziehende Fasern die retino-rezipienten Schichten erreichen, ein Prozeß, der bis PH 3-PH 4 anhält. Insgesamt ist eine deutliche Verzögerung der Entwicklung des retino-tectalen Systems gegenüber dem Hühnchen, welches bereits vor dem Schlupf ausgereift und innerviert ist (LaVail & Cowan, 1971a, McLoon, 1985; Thanos & Bonhoeffer, 1983, 1987), wie auch der Wachtel (Senut & Alvarado-Mallar, 1986) festzuhalten. In den nächsten Abschnitten werden verschiedene Mechanismen der Entwicklung des Nervensystems bei Vertebraten beschrieben, bevor mögliche Funktionen von trophischen Signalen bei diesen Entwicklungsprozessen dargestellt sind. 1.3 Die Entwicklung des Nervensystems Die hier beschriebenen grundlegenden Prozesse der Entwicklung des Nervensystems werden ausführlich von M. Jacobson in „Developmental Neurobiology“ (2rd, Plenum Press, New York, London, 1978), und von W.A. Himwich (Editor) in „Developmental Neurobiology“ (C.C. Thomas, Springfield, Illinois, USA, 1970) beschrieben. Bei Vertebraten wird im Verlauf der Embryogenese die Bildung des Nervensystems aus dem Ektoderm vom darunterliegenden Mesoderm der Gastrula induziert. Es entsteht zunächst die einschichtige Neuralplatte, aus welcher das gesamte Zentralnervensystem (ZNS) hervorgeht. Die Ränder dieser Neuralplatte proliferieren, es bilden sich Neuralwülste, die schließlich in der Mitte verschmelzen, um das Neuralrohr zu entwickeln. Der Neuralrohrschluß, welcher im anterioren Bereich des Embryos beginnt, wird als Neurulation bezeichnet. In der weiteren Entwicklung nimmt der anteriore Teil des Neuralrohres an Dicke zu und bildet die Hirnanlage, wohingegen der übrige Teil zum Rückenmark ausdifferenziert. In der Hirnanlage kommt es zu vielfältigen morphogenetischen Entwicklungsprozessen, welche Zellvermehrungen, Einschnürungen und Krümmungen beinhalten und deren Resultat die Entstehung der verschiedenen Hirnanteile wie Prosencephalon, Mesencephalon und Rhombencephalon ist. Zu Beginn der Histogenese finden sich im Neuralrohr nur eine Schicht sich schnell teilender Neuroepithelzellen. Ihre Ausläufer reichen von der inneren ventrikulären Seite, bis zur äußeren, Einleitung 23 der Pia mater anliegenden Seite. Nach der Zellteilung dieser Neuroepithelzellen verliert zumeist eine der beiden Tochterzellen den Kontakt zur Ventrikeloberfläche und wandert aus. Sie migrieren nach außen, zur pialen Oberfläche, wodurch eine dreischichtige Struktur aus einer Ventrikelzone (Proliferationszone), einer mittleren Intermediärzone, und einer äußeren Marginalzone entsteht. In der Intermediärzone finden sich auswandernde Neuronen, die mit ihren Axonen die äußere Marginalzone bilden. Die Entstehung der typischen Schichtungen, wie zum Beispiel im Cortex, beginnt mit dem Auswandern von Neuroblasten in die Marginalzone. Es entstehen die sogenannten kortikalen Platten, die zur Vielschichtigkeit heranreifen. Ist diese Entwicklung abgeschlossen, verschwindet die Ventrikelzone, übrig bleibt ein einschichtiges Ependym der Ventrikelwand. Nach Beendigung der Zellmigration finden sich in der Intermediärzone keine Neuronen mehr, wohl aber zahlreiche eingewachsene Nervenfasern, welche bei Adulten die weiße Substanz bilden. Grundsätzlich lassen sich zwei Typen an Neuroepithelzellen unterscheiden, die Neuroblasten und die Glioblasten. Die Neuroblasten sind die teilungsfähigen Vorläufer der Nervenzellen, die Glioblasten hingegen die der Gliazellen. Nach ihrer Auswanderung aus der Ventrikelzone sind die Nervenzellen postmitotisch, sie können sich nicht mehr teilen, wogegen die Gliazellen auch nach Erreichen ihrer Endposition noch teilungsfähig sind. 1.3.1 Neuronale Migration Leitstrukturen für migrierende Neuronen sind in vielen Bereichen des ZNS Radialgliazellen. Dies sind Gliazellen, welche mit ihren langen Ausläufern sowohl Kontakt zur Ventrikeloberfläche, als auch zur pialen Oberfläche während der Entwicklung halten. Migrierende Neuronen im Cortex nutzen dieses Gerüst aus radialen Gliazellen, um in Bewegungen entlang dieser glialen Fortsätze ihre endgültige Position zu erreichen (Rakic et al., 1971, 1972; Goldowitz & Mullen, 1982). Kennzeichnend für die Entstehung des vielschichtigen Cortex ist das sogenannte “inside-outside layering”. Zunächst wird die innerste, kortikale Schicht gebildet, welche dann die sich später entwickelnden Neuronen durchwandern müssen, um die folgende Schicht zu bilden. Im adulten Tier, nach Abschluß der Zellmigration, erfahren Radialgliazellen eine Umwandlung in Astrocyten (Schmelchel & Rakic, 1979). Histologisch unterscheidbar sind die beiden Zelltypen anhand ihrer Morphologie sowie ihres cytoskelettalen Aufbaus. Während die Radialzellen das Intermediärfilament Vimentin exprimieren (Dahl et al., 1981), synthetisieren die reifen Astrocyten Einleitung 24 im adulten Tier das für sie spezifische „glial fibrillary acidic protein“ (GFAP), ein Intermediärfilament Protein (Bignami et al., 1980). 1.3.2 Genetische Determination Das präzise Auswandern der Neuronen sowie das Etablieren von Zellkontakten mit entsprechenden Zielorganen und anderen Nervenzellen ist die Grundlage für den Aufbau eines funktionsfähigen Nervensystems. Dieses System, mit etwa 1010 bis 1012 Nervenzellen, wird bei Vertebraten durch eine Anzahl von etwa 106 Genen bestimmt. Die genetische Information reicht nicht allein zur Schaffung eines solch komplexen Systems aus, sondern sie steht vielmehr mit epigenetische Faktoren in einer Interaktion. Zum Beispiel ist das Wachstum der Dendriten genetisch determiniert (Privat & Drian, 1976), die Geometrie der dendritischen Verzweigung hingegen wird durch das Zusammenspiel verschiedener epigenetischer endogener Faktoren wie das afferente System (Calvet et al., 1983; Mason et al., 1990; Cohen-Cory et al., 1991; Lindholm et al., 1993) sowie mechanische Einflüsse der Migration bestimmt (Jäger et al., 1988). Neben den endogenen nehmen auch exogene epigenetische Faktoren, zum Beispiel der Umweltfaktor Licht, Einfluß auf die Ausbildung morphologischer Charakteristika von Nervengeweben (Güntürkün, 1997a). Auf molekularer Ebene werden insbesondere endogenen trophischen Substanzen, von denen die Familie der Neurotrophine im folgenden näher beschrieben wird, bedeutende Funktionen für die Ontogenese des Nervensystems zugeschrieben (Levi-Montalcini, 1987). 1.4 Neurotrophine Ein “ernährender” nervaler Einfluß auf Gewebe wurde bereits im Jahr 1824 von Magendie untersucht. Zu einem Zeitpunkt als Anästhetika noch nicht bekannt waren, durchtrennte Magendie einseitig den fünften Hirnnerv, den Nervus trigeminus, bei Kaninchen und beobachtete bei diesen Tieren bereits wenige Tage später die Trübung der Cornea, diverse Eiterherde sowie deutliche Veränderungen der Zunge auf der lädierten Seite. Er führte seine Beobachtungen auf veränderte ernährende, neurale Einflüsse zurück. Aus heutiger Sicht ist diese Beobachtung jedoch nur bedingt richtig, da ein steriles Arbeiten zur Vermeidung von Infektionsgefahren nicht üblich war. Einige Jahre danach wurden die Ergebnisse von Samuel (1860) aufgegriffen, der den Begriff der Einleitung 25 “trophischen Nerven” postulierte, Nerven, deren Funktion in der Bereitstellung ernährender Stoffe für die Gewebe läge. Heidenhain (1878) dachte diese Funktion den sympathischen Nerven zu. Sherington korrigierte diese Auffassung in Schäfers “Text book of physiology” (1900) insoweit, als daß alle Nerven einen trophischen Einfluß auf das Gewebe ausüben könnten. Die Richtung trophischer Einflüsse folge dabei der Signalleitung innerhalb des Nerven, bei motorischen Nerven zum Beispiel hin zum Muskel. Der von der Richtung der Sinnesfortleitung unabhängige Weg tropischen Signalflusses wurde 1934 durch Torrey postuliert. In seinen Experimenten fand er die Degeneration von Geschmacksknospen nach Durchtrennen der entsprechenden Geschmacksnerven. Ein Ausbleiben des trophischen Signals, einer sogenannten “Neurosubstanz”, die von den im Hirnstamm gelegenen Somata produziert und bis in die Zunge transportiert würde, sei die Ursache des Absterbens der Geschmacksknopsen. Diese Arbeit bot die Grundlage zweier Erkenntnisse, dem Konzept der neurotrophen Faktoren und dem des axonalen Transports. In den folgenden Jahren zeigte die experimentelle Entfernung nervalen Zielgewebes in Hühnerembryonen, zum Beispiel der Extremitätenknospe, daß sowohl die spinalen Motoneuronen als auch die sensorischen Neuronen in den Spinalganglien zugrunde gingen (Hamburger, 1934; Hamburger & Levi-Montalcini, 1949). Nun begann die Suche nach den peripher vorhandenen neurotrophen Faktoren, die ein Überleben der Neuronen gewährleisteten. Anstelle der entfernten Gewebe (z.B. einer Extremitätenknospe) wurden von Levi-Montalcini & Hamburger (1951) verschiedene Gewebe wie Muskel, Hirngewebe, Leber oder auch Haut implantiert, ohne jedoch direkte Hinweise auf die gesuchten Substanzen zu finden. Erst drei Jahre später, 1954, gelangen es Levi-Montalcini und Mitarbeiter erstmals, einen neurotrophen Faktor, den sogenannten “nerve growth-promoting factor”, zu isolieren. Später wurde diese Substanz in “nerve growth factor” (NGF) umbenannt (Cohen et al., 1954). Bis in die achtziger Jahre war NGF der einzige bekannte neurotrophe Faktor. Erst 1982 wurde aus dem Schweinegehirn der “brain-derived neurotrophic factor” (BDNF) isoliert (Barde et al., 1982). Acht Jahre später fand man schließlich einen weiteren Vertreter dieser neurotrophen Faktoren, das sogenannte “Neurotrophin-3” (NT-3) (Hohn et al., 1990; Maisonpierre et al., 1990; Rosenthal et al., 1990). In den letzten Jahren konnten weitere neurotrophe Faktoren identifiziert werden (NT-4/5: Berkmeier et al., 1991; Hallböök et al., 1991; NT-6: Götz et al., 1994; NT-7: Lai et al., 1998), welche alle zur selben Genfamilie gehören und gemeinschaftlich als Neurotrophine bezeichnet werden. Einleitung 26 Im folgenden werden die in Vögeln und Mammaliern exprimierten Neutrophine NGF, BDNF, NT-3 und NT-5 sowie ihre zugehörigen Rezeptoren mit den bekannten Eigenschaften und Funktionen beschrieben. 1.4.1 Die Struktur der Neurotrophine Das Protein NGF ist ein 26-kDa Homodimer zweier 13-kDa Polypeptide, mit jeweils 118 Aminosäuren (Scott et al., 1983; Ullrich et al., 1983). Sechs Cystein-Reste innerhalb dieser Sequenz bilden untereinander Disulfidbrücken, wodurch die dreidimensionale Struktur des Moleküls entsteht. Das Motiv der sechs Cystein-Reste innerhalb eines Monomers findet sich bei BDNF, NT-3 und NT-5 wieder, wobei die Monomere bei letzteren aus 120 Aminosäuren bestehen. Die Sequenzhomologie der Aminosäuren zwischen den Neutorophinen beträgt zwischen 50-60% (Zhou & Rush, 1996a,b). 1.4.2 Die Neurotrophin-Rezeptoren Grundsätzlich werden zwei Typen an Neurotrophin-Rezeptoren unterschieden: der “low-affinity Rezeptor” und die “high-affinity Rezeptoren” (Sutter et al., 1979). Die etwa 400 Aminosäuren des low-affinity Rezeptors bilden eine Transmembrandomäne sowie vier sich wiederholende Cystein-reiche Domänen am extrazellulär gelegenen N-terminalen Ende. Die Cystein-Domänen dienen der Bindung der Neurotrophine (Welcher et al., 1991). Die Molekularmasse des low-affinity Rezeptors beträgt 75kDa, woraus sich der Name “p75Rezeptor” (p75) ableitet. Kennzeichnender Weise bindet p75 sowohl NGF (Sutter et al., 1979), als auch BDNF (Rodriguez-Tebar et al., 1990) und NT-3 (Squinto, 1991) mit gleicher Affinität. Die spezifische Wirkung der einzelnen Neurotrophine wird über entsprechende high-affinity Rezeptoren vermittelt. Erstmals isoliert wurde ein solches 140-kDa großes Glykoprotein als Produkt des “trk proto-Oncogens” aus dem menschlichen Darm (Martin-Zanca et al., 1986, 1989). Der Terminus “trk” steht hierbei für “Tropomyosin-Rezeptor-Kinase”, dem als protoOncogen umarrangierten Gen (Martin-Zanca et al., 1986). Man nutzte im folgenden die bekannte Gensequenz, um weitere verwandte trk-Gene, “trk B” (Klein et al., 1989) und “trk C” (Lamballe et al., 1991) zu identifizieren. Die physiologische Wirkung der exprimierten Proteine als Rezeptoren für Neurotrophine wurde jedoch erst fünf Jahre später entdeckt. So erkannte man Einleitung 27 den als trk A bezeichneten Rezeptor als spezifischen high-affinity Rezeptor für NGF (Kaplan et al., 1991; Klein et al., 1991a), wohingegen der trk B Rezeptor mit hoher Affinität BDNF (Klein et al., 1991; Soppet et al., 1991; Squinto et al., 1991) und NT-4/5 (Berkemeier et al., 1991, Klein et al., 1992; Ip et al., 1992), und der trk C Rezeptor NT-3 bindet (Lamballe et al., 1991). Kennzeichen dieser Rezeptoren ist der Aufbau aus einem extrazellulären Signalpeptid (1), gefolgt von einer Anbindungs-region Abbildung 1 (modifiziert nach Barbacid, 1994): Skizze der Neurotrophin/Rezeptor-Wechsel-wirkungen von NGF, BDNF, NT-3 und NT-5 bei Vögeln und Säugern. Die Pfeile zeigen die primären NeurotrophinBindungen an. NT-3 kann mit geringer Affinität auch an den trk A und trk B Rezeptoren binden (gestrichelte Linien). (2) für Neurotrophine, die einem Transmembransegment (3), sowie einer katalytisch aktiven TyrosinKinase Domäne (4) auf cytoplasmatischen Seite (Barbacid, 1994; Abbildung 1). Zwischen trk A, trk B und trk C Rezeptoren besteht eine AminosäureSequenzhomologie von 66-68% (Lamballe et al., 1991). Desweiteren werden durch alternatives Splicing trk BTK- und trk CTK- Rezeptoren exprimiert, die als “truncated”, das heißt verkürzte Rezeptoren, bezeichnet werden. Ihnen fehlt die cytoplasmatische Tyrosin-Kinase Domäne, welche durch eine 21 oder auch 23 Aminosäuren lange, vermutlich katalytisch inaktive, Sequenz ersetzt wird (Klein et al., 1990; Middlemas et al., 1991). Die Funktion der trkTK- Rezeptoren liegt möglicherweise in einer negativen Regulation des trophischen Signals, zum Beispiel durch Bindung von Neurotrophinen, ohne daß eine cytoplasmatische Reaktion ausgelöst wird oder auch durch die Bildung eines trk/trkTK- Heterodimers, welches katalytisch inaktiv ist (Bothwell, 1995). 1.4.3 Die Signalkaskade nach Neurotrophin-Bindung Die Aktivierung der trk-Rezeptoren nach Anbindung der entsprechenden Neurotrophine initiiert eine Signalkaskade, die bei allen Tyrosin-Kinase Rezeptoren gleichermaßen abläuft (Schlessinger & Ullrich, 1992). Zunächst kommt es nach Neurotrophin-Bindung zu einer Homodimerisation des Rezeptor-Moleküls auf der Zelloberfläche, gefolgt von einer Autophosphorylierung der TyrosinReste (Jing et al., 1992). Inwieweit auch der p75-Rezeptor in die Aktivierung der trk-Rezeptoren Einleitung 28 einbezogen ist, wird gegenwärtig noch diskutiert. Die phosphorylierten Tyrosin-Reste bilden Ankerstellen für “downstream-Signalelemente”, zum Beispiel die Phospholipase C (PLC) (Ohmichi et al., 1991; Vetter et al., 1991; Widmer et al., 1993), die Steuereinheit p85 der Phosphatidyl-Inositol-3´Kinase (PI-3K) (Soltoff et al., 1992; Ohmichi et al., 1992; Obermeier et al., 1993) sowie MAP-Kinasen (Schanen-King et al., 1991; Loeb et al., 1992), welche über SH2 Domänen vermittelt werden (Schlessinger & Ullrich, 1992). Diese Signalelemente sind Bestandteil verschiedenen Proliferationsabläufe. 1.4.4 Retrograde oder anterograde Signalleitung? Gemäß der klassische Interpretation des Einflusses neurotropher Signale wird ein Neurotrophin von einem innervierten Neuron, der sogenannten Zielzelle, an einer Synapse ausgeschüttet und diffundiert über den synaptischen Spalt zur präsynaptischen Membran des Axonterminus, um dort an entsprechenden trk-Rezeptoren zu binden. Anschließend wird das trophische Signal retrograd, zum Soma des innervierenden Neurons weitergeleitet oder transportiert. DiStefano und Mitarbeiter (1992) demonstrierten, daß nach Bindung an den Rezeptor das Neurotrophin selbst zum Soma der Zelle retrograd transportiert wird. Ebenfalls retrograd transportiert wird der phosphorylierte, also aktivierte, trk-Rezeptor (Ehlers et al., 1993). Beide Untersuchungen gemeinsam lassen den Schluß zu, daß es nach Anbindung des Neurotrophins an den trk-Rezeptor zu einer endocytotischen Internalisierung dieses Neurotrophin-Rezeptor Komplexes kommt, welcher anschließend retrograd zum Soma der Zelle transportiert wird. Während des Transportes bleibt der Rezeptor aktiviert und kann die unter Punkt 1.4.3 beschriebenen Kaskaden auslösen (Bhattacharyya et al., 1997). Lange Zeit war dieser Wirkungsmechanismus der einzige bekannte Weg trophischen Signalflusses. In jüngerer Zeit wurde aber auch der anterograde trophische Signalfluß entdeckt. Im visuellen System bei Hühnchen konnten von Bartheld und Mitarbeiter (1996) zeigen, daß Neurotrophine vom Zellkörper entlang des Axons hin zum Axonterminus transportiert werden. Präsynaptisch werden sie in intakter Form ausgeschüttet, diffundieren über den synaptischen Spalt und binden postsynaptisch an den entsprechenden trk-Rezeptoren. Zhou und Rush (1996a,b) bestätigten den anterograden Transport von BDNF in Spinalganglien. Einleitung 29 1.4.5 Funktionen der Neurotrophine Die beiden Wege der trophischen Signalleitung, der retrograde und der anterograde Signalfluß sowie das Vorkommen verschiedener Neurotrophine ermöglicht eine Vielzahl von Wirkungen an den entsprechenden Zielzellen, mit dem Ergebnis einer ständigen Anpassung an die jeweiligen Bedürfnisse, im juvenilen wie auch im adulten Nervensystem. In den letzten Jahren wurden zahlreiche Wirkungen der Neurotrophine NGF, BDNF und NT-3 beschrieben (reviewed durch Ebadi et al., 1997). Mögliche Wirkungen von NGF in Nervenzellen sind demnach die positive Beeinflussung des axonalen Wachstums, der synaptischen Umorganisation, der dendritischen Verzweigung sowie der Peptid-Synthese. Außerdem stimuliert NGF Transmitter-synthetisierende Enzyme wie zum Beispiel die Acetylcholinesterase. Ebenso vielfältig sind die Wirkungen von BDNF, welches fördernd auf die Zelldifferenzierung, auf Transmitter-synthetisierende Enzyme sowie auf die Peptidsynthese und die Expression Calciumbindender Proteine wirkt. Desweiteren erhöht BDNF die synaptische Effizienz zwischen verschiedenen Nervenzellen. NT-3 hingegen fördert das Überleben und die Proliferation von Precursor-Zellen sowie die axonale Verzweigung im Zielgebiet sich entwickelnder neuronaler Systeme. Ähnlich dem BDNF wirkt NT-3 auch stimulierend auf die Expression Calciumbindender Proteine sowie steigernd auf die synaptische Effizienz. Den Neurotrophinen gemeinsam ist eine über elektrische und synaptische Aktivität gesteuerte Synthese und Freisetzung (Castren et al., 1992; Lindholm et al., 1994; Schoups et al., 1995; Blochl & Thoenen, 1995). Hierbei beeinflußt der epigenetische Faktor Licht die Expression von Neurotrophinen und der entsprechenden Rezeptoren (Castren et al., 1992; Okazawa et al., 1994). Einleitung 1.5 30 Zielsetzung der Arbeit Das Gehirn der Vertebraten wird in seiner Komplexität von keinem anderen Organ übertroffen. Als höchstes Koordinationszentrum kennzeichnet es eine hohe Vielschichtigkeit bei der Verarbeitung von Informationen der Umwelt. Die Grundlage einer differenzierten Informationsverarbeitung liegt in der ungeheuer großen Vielfalt der Morphologie und Verschaltungen der Bausteine dieses Organs, den Nervenzellen und Gliazellen. Wenngleich das Wissen über einzelne Bauelemente des Gehirns recht gut ist, so sind komplexe Prozesse, wie zum Beispiel die lateralisierte Verarbeitung von Informationen aus der Umwelt in der linken oder rechten Hemisphäre, bislang nicht umfassend verstanden. Insbesondere die Wirkungsketten, welche zur Ausbildung solcher Hirnasymmetrien führen, sind unbekannt. In der vorliegenden Arbeit wird ein möglicher Teilaspekt bei der Etablierung von Hirnasymmetrien an Hand der Entwicklung des retino-tectalen Systems der Taube untersucht. Grundsätzlich sind alle nervalen Systeme, einschließlich ihrer Musterbildung während der ontogenetischen Entwicklung genetisch determiniert. Die genetische Information allein reicht aber nicht aus, um sinnvolle Zellkontakte zwischen einzelnen Neuronen zu etablieren, unsinnige hingegen wieder zu verwerfen. Vielmehr sind weitere Faktoren für das Überleben einzelner Nervenzellen, die korrekte Verschaltung zwischen den Neuronen sowie der Etablierung von Asymmetrien im Gehirn erforderlich. Insbesondere den Neurotrophinen kommen zahlreiche Funktionen zu, welche sich zum einen auf die Etablierung nervaler Systeme, zum anderen aber auch auf die ständigen Feinanpassungen des Systems im adulten Tier beziehen. In der vorliegenden Arbeit wurden mögliche Funktionen der beiden Neurotrophine BDNF und NT-3 während der Entwicklung der Retina, des Tectum opticums sowie der Bildung des retinotectalen Systems in der Taube Columba livia untersucht: Einleitung 31 1. In immunhistochemischen Untersuchungen wurde die Expression der beiden Neurotrophine BDNF und NT-3 sowie der zugehörigen high-affinity Rezeptoren trk B und trk C in der Retina und im Tectum opticum in den Altersstadien E 14 bis zum adulten Tier kartiert. Mit Hilfe dieser Expressionsdaten werden intrinsische neurotrophe Mechnismen in der Retina und im Tectum opticum diskutiert. Außerdem erlaubt die genaue zeitliche Rasterung der Neurotrophin-Expression eine Interpretation neurotropher Mechanismen während der Etablierung des retino-tectalen System unter Berücksichtigung des epigenetischen Faktors Licht vor und nach dem Schlupf. 2. Basierend auf den Ergebnissen einer differentiellen Expression der Neurotrophine, sollten mit Hilfe ultrastruktureller Untersuchungen zur Lokalisation von BDNF im adulten Tectum opticum mögliche trophische Signalwege erfaßt werden, die Hinweise auf die Wirkungen von BDNF in der adulten Taube liefern könnten. 3. Im Verlaufe der Untersuchungen ergaben sich Fragen, bezüglich eines Zusammenhangs von Zellmigration und neurotrophen Mechanismen während der Etablierung der Zellschichten im Tectum opticum. In weiteren Untersuchungen wurden Fluoreszenz-Doppelmarkierungen von Neurotrophinen und Neurotrophin-Rezeptoren mit Vimentin, einem in Radialglia vorkommenden Intermediärfilament, durchgeführt, die mit Hilfe eines Fluoreszenzmikroskops und eines konfokalen Lasermikroskops ausgewertet wurden. Material und Methoden 32 2 Material und Methoden 2.1 Material Für die Untersuchung neurotropher Mechanismen während der Entwicklung des retino-tectalen Systems standen 73 Tauben beiden Geschlechts der Spezies Columba livia zur Verfügung, die aus eigener Zucht sowie von einem lokalen Züchter bezogen wurden. Untersucht wurden die „embryonalen Altersstadien“ E 14 und E 16, daß heißt Eier nach vierzehn beziehungsweise sechzehn Tagen Inkubationszeit durch die Elterntiere, wobei der Tag E 1 mit der Ablage des zweiten Ei im Nest definiert ist. Der Schlupftag der Jungtiere nach 18-tägiger Inkubationszeit wird als „Posthatching Tag“ 0 (PH 0) definiert. Die sich anschließenden Altersstadien der gegenwärtigen Untersuchungen waren PH 1, PH 2, PH 4, PH 7, PH 14 sowie adulte Tiere. Die Entnahme der Retinae und Gehirne erfolgte stets vormittags zwischen 9.00-10.00 Uhr. 2.2 Die Immunhistochemie Die Immunhistochemie ist eine Methode der Detektion biologischer Stoffe und zellulärer Strukturen, wie zum Beispiel Transmitter, Rezeptoren oder Enzyme im Gewebe mit Hilfe speziell gegen diese gerichteten Antikörpern. Die immunologische Detektion beinhaltet zunächst das Herstellen mikroskopischer Schnittpräparate sowie an diesen Präparaten ablaufende biochemische Reaktionen, welche in den nachfolgenden Gliederungspunkten erläutert werden. In allen Fällen muß die Vorbehandlung des Gewebes möglich schonend sein, um eine Denaturierung, Maskierung oder Verlagerung der nachzuweisenden Substanz zu vermeiden. 2.3 Retinale und Tectale Gewebeaufbereitung 2.3.1 Perfusion juveniler und adulter Tauben Bei den Tieren ab PH 0 war der erste Schritt der Gewebeaufbereitung die Perfusion, bei welcher das Kreislaufsystem der Tiere zum Durchspülen mit einer Kochsalzlösung (NaCl) und anschließend mit einem Fixativ genutzt wurde. Im einzelnen wurde eine halbe Stunde vor Beginn der Perfusion eine Dosis von 0,1-0,2ml Heparin (1000 Units) intramuskulär in den Musculus pectoralis major gespritzt, um die Blutgerinnung während der Perfusion zu minimieren. Fünfzehn Material und Methoden 33 bis dreißig Minuten später wurde den Tauben eine Überdosis Equithesin (0,40ml/100g Körpergewicht) ebenfalls in den Musculus pectoralis major injiziert. Die Tiere fielen nach 15 bis 20 Minuten in eine tiefe Anästhesie. Anschließend wurden die Federn ventral am Thorax gerupft, und der Brustkorb der Tiere eröffnet. Das Perikard wurde gespalten und eröffnet, um einen Katheder in den linken Herzventrikel einzuführen. Durch einen Schnitt über dem Fettring des rechten Atriums wurde eine Austrittspforte für das venöse Blut, ebenso wie die Perfusionslösungen nach Durchlaufen des Kreislaufsystems geschaffen. Über den angelegten Katheder wurde zunächst für zwei Minuten mit einer 40°C warmen 0,9% NaCl-Lösung perfundiert, um das Blut aus dem Kreislaufsystem zu treiben. Der Perfusionsdruck wurde in Abhängigkeit zum Alter der Tiere variabel eingestellt, um ein Platzen der Gefäße zu vermeiden. Anschließend wurde mit der 37°C warmen Fixierlösung perfundiert, in der Dauer und Menge jeweils abhängig von der Größe der Tiere. Bei den bis zu vier Tage alten Tieren reichten 150ml Fixativ, in den Altersstadien PH 7 und PH 14 wurde 250ml Fixativ benötigt, und bei Adulten wurde mit 500ml Fixativ perfundiert. Eine gelungene Perfusion wurde zumeist schon während der Prozedur durch ein Versteifen des Körpers, insbesondere durch ein Überstrecken des Kopfes nach hinten, deutlich. Das Fixativ für die lichtmikroskopischen Untersuchungen bestand aus 4% Paraformaldehyd (PFA) und 0.2% Glutaraldehyd (GA) in PBS (Phosphat-Buffered Saline). Für die ultrastrukturellen Untersuchungen mittels der Transmissionselektronenmikroskopie wurde ein Fixativ bestehend aus 2.5% GA und 1.5% PFA in PBS benutzt. 2.3.2 Immersionsfixierung juveniler und adulter Tauben Eine deutlich verbesserte Gewebekonservierung erreichte man über eine der Perfusion anschließende 1.5-2 -stündige Immersionsfixierung. Hierzu wurden die Tiere direkt nach der Perfusion dekapitiert und die Augen und das Gehirn präpariert. Zum besseren Eindringen des Fixativs in die Retinae wurde von anterior ein etwa 6mm großes Loch in die Augen geschnitten, um Cornea, Linse, und Glaskörper zu entfernen. Zur Immersionsfixierung der Gehirne wurden die Hirnhäute weitestgehend entfernt. Nach dem Postfixierung wurden Retinae und Gehirne in einer 30%-igen Succrose (w/v) in PBS bei 4°C über Nacht aufbewahrt. In dieser Lösung wurde dem Gewebe osmotisch Wasser entzogen, wodurch die Bildung von Gefrierartefakten in Form einer Kristallbildung im Gewebe beim Auffrieren auf dem Kryostaten verringert wurde. Material und Methoden 34 2.3.3 Immersionsfixierung embryonalen Gewebes Die Tiere der Altersstadien E 14 und E 16 wurden nicht perfundiert sondern ausschließlich immersionsfixiert. Hierzu wurden die Embryonen aus dem Ei herausgelöst und dekapitiert. Anschließend wurde der Schädel sagittal eröffnet und unter einem Binokular die Augen und das Gehirn vorsichtig entnommen. Die weitere Präparation der Augen und Gehirne ist mit der oben beschriebenen Vorgehensweise identisch. Anschließend wurde das Material für 24 Stunden in 4% PFA und 0.2% GA in PBS immersionsfixiert, bevor es in eine 30% Succrose (w/v) und 0.3% Natriumazid (w/v) in PBSLösung bei 4°C für einen weiteren Tag überführt wurde. Tabelle 1: Fixative der lichtmikroskopischen Untersuchungen Juvenil – Adult Perfusion Immersionsfixierung 4% PFA + 0.2% GA 4% PFA + 0.2% GA Menge: 150-500ml Dauer: 1.5 – 2 Stunden --- 4% PFA + 0.2% GA Embryonen Dauer: 24 Stunden 2.4 Schneiden des Gewebes Für die immunhistochemischen Darstellungen der Expression von BDNF, NT-3, trk B und trk C auf retinaler und tectaler Ebene wurden Gefrierschnitte angefertigt. Hingegen wurde das Tectum opticum für die ultrastrukturellen Untersuchungen, ebenso wie für die immunhistochemischen Kolokalisationsuntersuchungen oben genannter Proteine mit Vimentin auf einem Vibratom geschnitten. 2.4.1 Herstellung von Gefrierschnitten Für die immunhistochemischen Untersuchungen der Expression der Neurotrophine und Neurotrophin-Rezeptoren in der Taubenretina wurden 15µm Sagittalschnitte auf dem Kryostaten angefertigt. Hierzu wurde beidseitig des Pecten des Taubenauges ein Schnitt gesetzt, bevor die Retina vorsichtig stumpf von der Sclera abgesetzt werden konnte. Die entnommene Retina wurde in einer Petrischale ausgebreitet, zentral wurde ein Tropfen Gefriermedium (Tissue Embedding Material und Methoden 35 Medium, Slee Technik, Mainz, Deutschland) aufgetragen, bevor die Retina eng eingerollt wurde. Diese Rolle wurde anschließend mit einem Ende im Winkel von 90° auf den Kryostaten aufgesetzt und bei zirka –20°C unter ständiger Zugabe weiteren Gefriermediums aufgefroren. Nach einer viertel Stunde war das Gewebe komplett durchgefroren, und die ersten sagittalen Retinaeschnitte wurden direkt auf gelatinisierte Objektträger aufgenommen. Die für die Expressionsuntersuchungen der Neurotrophine und Neurotrophin-Rezeptoren verwendeten Gehirne wurden zunächst schnell auf –40°C gekühlt. Hierzu wurde eine Menge von zirka 50ml iso-Pentan in flüssigem Stickstoff auf die gewünschte Temperatur abgekühlt, bevor die Gehirne für etwa 30 Sekunden in die Lösung gegeben wurden. Durch das rapide Einfrieren wurde die Kristallbildung im Gewebe reduziert. Anschließend wurden die Gehirne rostral auf den Gewebehalter des Kryostaten mit Gefriermedium (s.o.) bei zirka -30°C aufgefroren. Etwa fünfzehn Minuten später wurden von caudal beginnend 25µm starke Frontalschnitte angefertigt, die zum einen in PBS mit 0.3% Natriumazid gesammelt, zum anderen direkt auf gelatinisierte Objektträger aufgezogen wurden. Natriumazid empfiehlt sich als Zusatz zur PBS-Lösung bei einem längeren Aufbewahren der Schnitte, weil es die Pilz- und Bakterienbildung unterdrückt, in dieser Konzentration aber keinen schädigenden Einfluß auf das Gewebe hat. Das genutzte Gefriermikrotom war ein „Leitz 1720 digital Kryostat“, Ernst Leitz Wetzlar GmBH, Deutschland. 2.4.2 Herstellung von Vibratomschnitten Für die elektronenmikroskopischen Untersuchungen und die Kolokalisations-untersuchungen wurden Vibratomschnitte angefertigt. Hierzu wurde der zu schneidende Bereich weitestgehend auf das Tectum opticum getrimmt, daß heißt die Gehirne wurden entlang der Sutura sagittalis in zwei Hälften gespalten, und anschließend das gesamte Vorderhirn und Kleinhirn entfernt. Der verbleibende Quader wurde in einer 4%-igen Agar-Agar Lösung (w/v) eingebettet. Insbesondere für das embryonale und juvenile Gewebe, welches trotz Fixierung sehr fragil war, diente der Agar-Mantel zur Stabilisierung beim Schneiden. Mit Hilfe eines Gewebeklebers wurde das Material auf Halteblöcke fixiert, und 100µm Sagittalschnitte angefertigt, die bis zur histochemischen Behandlung in PBS-Natriumazid Lösung verblieben. Das genutzte Gerät war ein „Vibratome 1000“ der Firma „tpi“, St. Lois, Amerika. Material und Methoden 2.5 36 Die Antikörperherstellung Antikörper sind Glykoproteine, die als Antwort auf den Kontakt mit einer Fremdsubstanz, einem sogenannten Antigen im Organismus, produziert werden. Sie gehen mit dem Antigen einen spezifischen Komplex mit hoher Bindungsaffinität (Ka = 107 bis 1010 M-1) ein, der anschließend aus dem Körper entfernt wird. Antikörper bilden die Grundlage der humoralen Antwort des Immunsystems; sie gehören zu den Immunglobulinen (Ig), zumeist zur Klasse der IgG. Die Antikörperherstellung erfolgt durch eine Immunisierung von Tieren wie Maus, Kaninchen oder Ziege, wobei dem Tier die im folgenden nachzuweisende Substanz subcutan injiziert wird. Für das immunisierte Tier stellt dieses Protein eine Fremdsubstanz, ein sogenanntes Antigen, dar. Es reagiert gegen dieses Antigen mit einer spezifischen Antikörperreaktion. Zum Zeitpunkt der maximalen Immunantwort, daß heißt, der maximalen Antikörperproduktion, wird dem Tier Blut entnommen. Durch Zentrifugation entfernt man die roten Blutkörperchen, wonach ein antikörperhaltiges Serum übrig bleibt (Antiserum). Da ein Antigen zumeist mehrere Epitope aufweist, an welche wiederum verschiedene Antikörper binden können, werden in der Regel Antikörper unterschiedlicher Spezifität gegen das Antigen produziert, sogenannte polyklonale Antikörper. Sehr spezifisch gegen nur ein Epitop gerichtet sind sogenannte monoklonale Antikörper. Bei der Herstellung monoklonaler Antikörper werden B-Lymphocyten, aus der Milz immunisierter Tiere, zum Beispiel der Maus, mit Myelomzellen hybridisiert, und anschließend nahezu unbegrenzt kultiviert. Kennzeichen dieser Hybridome ist die Produktion nur eines, für die B-Zelle typischen Antikörpers, welches in der Folgezeit entsprechend abgeschöpft und genutzt werden kann. Die in dieser Arbeit verwendeten primären Antikörper detektieren spezifisch die Neutrophine BDNF und NT-3, die Neurotrophin-Rezeptoren trk B und trk C sowie das cytoskelettale Intermediärfilament Vimentin. Die eingesetzten sekundären Antikörper gehen spezifische Bindungen mit den entsprechenden primären Antikörpern ein. 2.5.1 Antikörper gegen BDNF Der BDNF-Antikörper (N-20) von Santa Cruz Biotechnology, Inc. USA, ist ein affinitätsgereinigter polyklonaler Antikörper aus Kaninchen gegen menschliches BDNF-Antigen. Der Antikörper ist gegen die Aminosäure 128-147 des carboxyterminalen Endes des BDNF Material und Methoden 37 gerichtet, welche identisch zwischen Mensch und Maus ist. Gemäß den Herstellerangaben zeigt der Antikörper keine Kreuzreaktivität gegen NGF, NT-3 und NT-4. Bezogen wurde das Produkt über IC Chemikalien, Deutschland. 2.5.2 Antikörper gegen NT-3 Der Antikörper gegen NT-3 (N 20) von Santa Cruz Biotechnology, Inc. USA, ist ein affinitätsgereinigter polyklonaler Antikörper aus Kaninchen gegen die Aminosäuren 139-158 des carboxy-terminalen Endes menschlichen NT-3. Diese Sequenz verhält sich konservativ zwischen Mensch und Maus. Der Antikörper zeigt keinerlei Kreuzreaktivität zwischen NGF, BDNF und NT-4. Das Produkt wird von IC Chemikalien, Deutschland, vertrieben. 2.5.3 Antikörper gegen trk B Der von Santa Cruz Biotechnology, Inc. USA, hergestellte polyklonale, affinitätsgereinigte Antikörper gegen trk B (794) aus Kaninchen ist gegen die carboxy-terminalen Aminosäuren des Maus trk B Proteins gerichtet. Der Antikörper erkennt das trk B Protein in Maus und Mensch, ist aber nicht kreuzreaktiv mit trk A und trk C. Zu beziehen ist das Produkt über IC Chemikalien, Deutschland. 2.5.4 Antikörper gegen trk C Der trk C (C-14) Antikörper aus Kaninchen von Santa Cruz Biotechnology, Inc. USA, ist gegen die carboxy-terminale Aminosäuresequenz des Schweine trk C Proteins gerichtet. Es handelt sich um einen polyklonalen, affinitätsgereinigten primären Antikörper, der zum Teil Kreuzreaktivität gegen trk A und trk B Proteine zeigt. Der Antikörper wird von IC Chemikalien, Deutschland, vertrieben. Ein ebenfalls getesteter trk C (798) Antikörper aus Kaninchen von Santa Cruz Biotechnology, Inc. USA, der gegen eine Aminosäuresequenz der Precursor Form des Schweine trk C Peptids gerichtet ist, ohne dabei Kreuzreaktivitäten gegen trk A und trk B zu zeigen, war bei der Taube stets negativ. Material und Methoden 38 2.5.5 Antikörper gegen Vimentin In der kommerziellen Herstellung des monoklonalen Antikörpers anti-Vimentin (Klon Vim 3B4) wurden Mäuse mit gereinigtem Vimentin aus Rinder Augenlinsen immunisiert. Die Milzzellen des Tiere wurden anschließend mit Myelomzellen fusioniert, und die gewonnenen Antikörper affinitätsgereinigt. Der Antikörper reagiert mit dem Intermediärfilament Vimentin aus einer Vielzahl von Spezies, darunter auch dem aus Vögeln. Vertrieben wird anti-Vimentin (Klon Vim 3B4) von Boehringer Mannheim, Deutschland. 2.5.6 Sekundäre Antikörper Zur Visualisierung der immunologischen Detektion und zur dauerhaften Färbung mittels der Diaminobenzidin-Reaktion (DAB-Reaktion) wurden ein affinitätsgereinigter, polyklonale sekundärer Antikörper eingesetzt. Die Spezifität dieses Antikörpers, an welchen das Vitamin Biotin gekoppelt wurde, ist Ziege gegen Immunglobuline des Kaninchens. Der Antikörper ist Bestandteil des „ABC-Elite Kit“ der Firma „Vector Laboratories“, und kann über „Camon“ in Wiesbaden bezogen werden. Für die ultrastrukturellen Untersuchungen zur Lokalisation von BDNF wurde ein Gold-markierter sekundärer Antikörper eingesetzt (Ziege anti-Kaninchen, 10nm Gold, Sigma, Produktnummer G 7402, Deutschland). In der Fluoreszenz-Immunhistochemie wurden FITC oder TRITC gekoppelt sekundäre Antikörper verwendet: 1. Zur Darstellung der Neutrophine, beziehungsweise der Neurotrophin-Rezeptoren wurden FITC-gekoppelte und affinitätsgereinigte anti-Kaninchen Antikörper aus der Ziege eingesetzt. Der Antikörper mit der Produktnummer F-6005 wird von Sigma, Deutschland vertrieben. 2. Die Detektion des Maus Antikörpers gegen Vimentin erfolgte mittels eines TRITCgekoppelten, affinitätsgereinigten anti-Maus Antikörpers aus Schaf, welche unter der Produktnummer T-5268 bei Sigma, Deutschland zu beziehen ist. Material und Methoden 39 Tabelle 2: Antikörper für DAB-Präparate Primärer Antikörper BDNF NT-3 Trk B Trk C Wirt Kaninchen Konzentration sekundärer Antikörper Konzentration Ziege gegen Kaninchen 1/100 1 / 100 Tabelle 3: Antikörper für die Elektronenmikrsokopie Primärer Antikörper Wirt BDNF Kaninchen Konzentration sekundärer Konzentration Antikörper 1/100 Ziege gegen 1/100 Markierung 10nm Gold Kaninchen Tabelle 4: Antikörper für Fluoreszenz-Präparate Primärer Antikörper BDNF NT-3 Trk B Trk C Vimentin 2.6 Wirt Konzentration sekundärer Konzentration Antikörper FluoreszenzFarbstoff Ziege gegen Kaninchen 1/100 FITC 1/100 TRITC Kaninchen 1/100 Maus 1/100 Ziege gegen Maus Immunhistochemie für die Lichtmikroskopie Die gesamte Immunhistochemie der auf Objektträger aufgezogenen Retinae wurde in einer feuchten Kammer bei 4°C durchgeführt, die der Hirnschnitte hingegen frei flotierend bei Raumtemperatur. Im ersten Schritt wurden die Retinae und Hirnschnitte für dreißig Minuten in Wasserstoffperoxid inkubiert. Dies diente der Inaktivierung endogener Peroxidasen im Gewebe, welche den unspezifischen Hintergrund einer DAB-Reaktion (Punkt 2.6.2) erhöhen. Drei Waschgänge zu je 2 Minuten und zwei Waschgänge zu 10 Minuten in PBS schlossen sich an. Material und Methoden 40 Eine anschließende Inkubation für dreißig Minuten in 10%-igem Normalserum vom Spender des zweiten Antikörpers (Schaf) in einer Standardlösung, bestehend aus 0.3%-igen Triton X-100 Lösung in PBS, diente dazu, unspezifische Anbindungsstellen für die Antikörper, zum Beispiel zellständige Fc-Fragmente oder sehr saure oder basische Komponenten zu blocken. Das Detergenz Triton X-100 diente der Permeabilisierung des Gewebes für die Antikörper durch Herauslösen von Lipiden aus der Zellmembran. Nach dem Blockierungsschritt wurde kurz in PBS gewaschen, bevor das Material mit dem primären Antikörper für zwölf Stunden (zumeist über Nacht) bei 4°C auf einem Schüttler inkubierte. Die primären Antikörper wurden in der Standardlösung verdünnt. Die Konzentrationen sind den Tabellen 2 und 4 zu entnehmen. Anschließend wurde wiederum dreimal 2 Minuten und zweimal 10 Minuten mit PBS gewaschen, um nicht gebundene primäre Antikörper zu entfernen. Die Immunhistochmie wurde mit dem sekundären Antikörper für zirka eine Stunde auf dem Schüttler bei Raumtemperatur fortgesetzt (Konzentrationen siehe Tabellen 2 und 4). Die Visualisierung dieser Antikörperkaskade erfolgte entweder über die ABC-DAB Methode für die Dauerpräparate, oder direkt mittels eines Fluoreszenzmikroskops für die Immunfluoreszenzpräparate: 1. ABC-Reaktion: die verwendeten sekundären Antikörper sind am C-terminalen Ende mit dem Vitamin Biotin konjugiert, welches als Anbindungsstelle für weitere Reaktionskomponenten dient. Mittels der anschließenden DAB-Reaktion (siehe Punkt 2.6.2) wird die Kaskade sichtbar gemacht. 2. Fluoreszenz-Immunhistochemie: die sekundären Antikörper sind direkt mit einem Fluoreszenz-Farbstoff, FITC oder TRITC, konjugiert und Auflichtfluoreszenzmikroskop nachgewiesen werden (Gliederungspunkt 2.6.3). können im Material und Methoden 41 2.6.1 Avidin-Biotin Reaktion Die Avidin-Biotin Reaktion, allgemein als ABC-Methode beschrieben, dient der Färbung der Antikörperkaskade, mit dem Vorteil einer hohen Sensitivität durch eine weitere Signalverstärkung. Die Abkürzung ABC beschreibt den Meerettichperoxidase konjugierten Avidin-Biotin-Komplex. Im Versuchsprotokoll schlossen sich nach der Inkubation im sekundären Antikörper drei Waschgänge zu 2 Minuten und zwei Waschgänge zu 10 Minuten in PBS an, um nicht gebundene sekundäre Antikörper aus dem Gewebe zu entfernen. Die einzelnen Reaktionskomponenten des ABC-Kit sind das Eiweißglykoprotein Avidin (A) und das mit dem Vitamin Biotin (B) konjugierte Enzym Meerettichperoxidase (P). Dreißig Minuten vor Beginn der ABC-Reaktion wurden die bei 4°C aufbewahrten Stammlösungen der Komponenten A und B des „ABC-Elite-Kit“ (Vector Laboratories) laut Herstellerangaben zusammengefügt, wobei sich drei Moleküle des Meeretichperoxidase konjugierten Biotins mit einem Avidin verbanden. Das Verhältnis der Komponenten war so bestimmt, daß nicht alle Bindungsstellen am Avidin durch Biotin besetzt sind. Während der an-schließenden Inkubation der Hirnschnitte in der ABC-Lösung, für eine Stunde bei Raum- temperatur auf dem Schüttler, wurden freie Anbindungsstellen des Avidins durch die am sekundären Antikörper Biotinmoleküle gebundenen besetzt (siehe Abbildung 4). Drei Spülgänge in PBS dienten dem Entfernen nicht gebundener Abbildung 4: Die Antikörper-ABC-Bindungskaskade Der primäre Antikörper (pAK) bindet spezifisch am Antigen, der biotinylierte sekundäre Antikörper (sAK) erkennt wiederum spezifisch das Fc-Fragment des pAK. Der Meerettichperoxidase konjugierte AvidinBiotin-Komplex bindet im letzten Schritt über das Biotin am sekundären Antikörper. ABC-Komponenten aus dem Gewebe, bevor mit der Diaminobenzidin-Reaktion (DABReaktion) fortgefahren wurde. Material und Methoden 42 2.6.2 Diaminobenzidin-Reaktion Zur Lokalisation des Antigens im Gewebe wurde eine DAB-Reaktionen durchgeführt. Grundsätzlich wird bei der DAB-Reaktion durch eine Peroxidase das zunächst farblose Chromogen 3,3´-Diaminobenzidin durch einen Oxidationsprozess in ein bräunliches Produkt umgewandelt (Abbildung 5). Die Reaktionen an den immunologisch präparierten Retinae beziehungsweise Hirnschnitten wurden methodisch unterschiedlich angegangen. Abbildung 5: Die DAB-Reaktion Freigesetzte Sauerstoff-Radikale sind die Starter der Reaktion, bei der mittels der Peroxidase das farblose Chromogen 3,3´DAB durch eine Oxidation in einen bräunlichen Farbstoff umgewandelt wird. 2.6.2.1 DAB-Reaktion der Retina Die DAB-Reaktion der Retinae erfolgte nach dem Protokoll von Graham und Karnovsky (1966), wobei das Gewebe in einer 0.06% 3,3´-DAB-Lösung unter Zugabe von 0.3% Wasserstoffperoxid für zirka 3 Minuten inkubiert wurde. Nachfolgend schlossen sich fünf kurze Spülgänge in PBS zum Stoppen der Reaktion an. 2.6.2.2 DAB-Reaktion der Hirnschnitte Bei der im folgenden beschriebenen DAB-Reaktion handelte es sich um eine Nickel-Kobaltintensivierte 3,3´-Diaminobenzidin-Reaktion (Adams, 1981; Shu et al., 1988). AmmoniumNickelsulfat, Ammonium-Chlorid und Kobalt-Chlorid dienen der Signalverstärkung, die Glucose fungiert als Substrat für die Glucoseoxidase. Zum Protokoll: zur Ansäuerung des Gewebes wurde zweimal für 10 Minuten mit NatriumAcetatpuffer (pH 6.0) gespült. Anschließend wurden die Hirnschnitte für fünfzehn Minuten in Material und Methoden 43 DAB präinkubiert, um eine Sättigung mit DAB zu erreichen. Im zweiten Schritt erfolgte die eigentliche Farbreaktion in einem frischen Gefäß mit neuen Lösungen unter Zusatz von Glucoseoxidase. Das aus dem Schimmelpilz gewonnene Enzym Glucoseoxidase katalysierte die folgende Reaktion, als deren Endprodukt H2O2 entstand: ß-D-Glucose + O2 ⇒ D-Gluconsäure-δ-lacton + H2O2 Der Vorteil der Reaktion ist eine langsame und kontinuierliche Freisetzung des Wasserstoffperoxid, welches mittels der mit dem Biotin konjugierten Peroxidase das Chromogen DAB oxidiert. Das DAB polymerisierte dabei unter Diazotierung, am Ort der Oxidierung ergab sich eine bräunliche Färbung. Gestoppt wurde die Reaktion durch mehrere kurze Spülgänge, zunächst in Natrium-Acetatpuffer, anschließend in PBS. 2.6.3 Fluoreszenz-Immunhistochemie In der Fluoreszenz-Immunhistochemie werden Fluoreszenzfarbstoff gekoppelte sekundären Antikörper eingesetzt, welche durch Licht einer charakteristischen Wellenlänge im Auflichtfluoreszenzmikroskop sichtbar fluoreszierende mit Farbstoffe gemacht werden. Kommerziell erhältlich sind unter- schiedlichen Emissionsspektren. Der an das Antigen bindende primäre Antikörper wurde mit Hilfe eines spezifisch gegen diesen gerichteten sekundären Antikörper nachgewiesen. Der sekundäre Antikörper wiederum war mit den Fluoreszenzfarbstoff FITC oder TRITC konjugiert, welche im AuflichtfluoreszenzMikroskop selektiv angeregt werden können (Abbildung 6). Die für FITC und TRITC charakteristischen Eigenschaften sowie die zur Anregung zugehörigen Filter sind den Tabellen 5 / 6 zu Abbildung 6: Fluoreszenz-Immunhistochemie Der spezifisch gegen ein zu untersuchendes Antigen gerichtet primäre Antikörper (pAK) wird mit Hilfe eines Fluoreszenzfarbstoff gekoppelten (F) sekundären Antikörper (sAK) detektiert. Material und Methoden entnehmen. 44 Material und Methoden 45 Tabelle 5: Anregungs- und Emissionsspektrum der Fluoreszenzfarbstoffe Fluroeszenz-Farbstoff Anregungsspektrum [nm] Emissionsspektrum [nm] FITC 494 518 TRITC 555 580 Tabelle 6: Filter der Fluoreszenz-Imunhistochemie 2.7 2.7.1 Filter Anregungsfilter [nm] Emissionsfilter [nm] Farbteiler [nm] FITC 450-490 520 510 TRITC 546 590 580 Prozessierung für die Transmissionselektronenmikroskopie Immunhistochemie Im ersten Schritt der immunhistochemischen Untersuchungen zur Expression von BDNF im adulten TO wurden die Vibratomschnitte frei flotierend für 2 Stunden in 10%-igem Normalserum aus dem Schaf in einer Standardlösung, bestehend aus 0.03% Triton X-100 in PBS (PBS-T), bei Raumtemperatur inkubiert. Anschließend wurde dreimal 10 Minuten in PBS gespült, bevor das Material im Antikörper gegen BDNF (1/100 in PBS-T) für 36 Stunden bei 4°C inkubiert wurde. Es folgten Spülgänge in PBS, bevor sich die Inkubation in dem mit 10nm Gold-markierten sekundären Antikörper (1/100) gegen BDNF für 12 Stunden bei 4°C anschloß. 2.7.2 Einbettung in Epoxidharz Die immunhistochemisch aufbereiteten Vibratomschnitte des Tectum opticum wurden mittels einer Rasierklinge in etwa 2mm lange, vom Ventrikelpithel bis zur pialen Oberfläche reichende Quadrate zerlegt, welche für 2 Stunden in 1% Osmiumtetroxid (OsO 4) kontrastiert wurden. Anschließend wurde in einer aufsteigenden Ethanolreihe in 30 minütlichen Schritten von 30% EtOH bis schließlich 100% EtOH entwässert, wobei die Gewebestücke im 70% EtOH, dem 1% Uranylacetat und 1% Phosphorwolframsäure zugesetzt war, für 16 Stunden verblieben. Nach vollständiger Entwässerung wurden die Präparate über das Intermedium Propylenoxid in das Epon (Serva, Deutschland) überführt, wobei das Propylenoxid schrittweise durch Epon ersetzt Material und Methoden 46 wurden. Nach abschließender Durchtränkung der Gewebestücke mit Epon wurden die Kunstharzpräparate unter Zugabe von Härter bei 60°C auspolymerisiert. 2.7.3 Herstellung von Ultradünnschnitten Die auspolymerisierten Gewebestücke wurden mit Hilfe eines Diamantmessers (Leitz, Deutschland) auf einem Ultramikrotom (Ultratome III LKB, Reichert, Deutschland) geschnitten. Es wurden Semidünnschnitte (2µm Dicke) zur lichtmikroskopischen Kontrolle angefertigt. Die Anfärbung erfolgte in einer Lösung bestehend aus je 1% Methylenblau, Azur II und Borsäure in Aqua dest. Ultradünnschnitte (70nm Dicke) der Präparate wurden auf Formvar beschichtete (0.33% Formvar in Chloroform) 75-mesh-Kupfernetze aufgefangen und getrocknet. Eine weitere Kontrastierung erfolge mit Hilfe des Leika EM-Stain über eine Stunde. Die Kontrastierlösungen waren Ultrastain I (Dauer 10 Minuten) und Ultrastain II (Dauer 20 Minuten). 2.8 Kolokalisationsuntersuchungen im Tectum opticum In immunhistochemischen Kolokalisationsuntersuchungen nutzt man die unterschiedlichen Emissionsspektren diverser Fluoreszenzfarbstoffe, um durch gezielten Einsatz verschieden markierter sekundärer Antikörper mehrere Antigene in einem Präparat zu detektieren. Im TO der Taube wurden dazu Doppelmarkierungen in einem Präparat von BDNF, NT-3, trk B und trk C jeweils mit Vimentin in verschiedenen Altersstadien durchgeführt. Im Versuchsablauf wurde zunächst eine Fluoreszenz-Immunhistochmie gegen Vimentin durchgeführt, gefolgt von der Imunhistochemie gegen das entsprechende Neurotrophin beziehungsweise gegen den trk-Rezeptor. Durch die entsprechende Filterwahl am Mikroskop konnten so in einem Präparat jeweils zwei Antigene vergleichend untersucht werden. 2.9 Kresylviolett-Färbung Zur lichtmikroskopischen Darstellung nahezu aller Neuronen in einem jeweiligen Nervengewebe eignete sich die Kresylviolett-Färbung, bei welcher der Farbstoff Kresylviolett charakteristisch das endoplasmatischen Retikulum der Zellen anfärbt. Während der Färbeprozedur wurde das Material zunächst kurz in Aqua dest. und anschließend in 70%-igem Alkohol gespült, bevor es durch eine Inkubation für ein bis zwei Minuten in Aqua dest., versetzt mit 5 Tropfen 99%-igem Material und Methoden 47 Eissessig auf 100ml, leicht angesäuert wurde. Die Färbung erfolgte durch eine Inkubation der Präparate für zehn Minuten in 1%-igem Kresylviolett auf dem Schüttler. Es schlossen sich zwei kurze Spülgänge in Aqua dest. an, bevor unter steter optischer Kontrolle in Spülgängen in Alkohol plus Eisessig (70% und 96% EtOH) differenziert wurde. 2.10 Eindeckeln der Präparate Das Eindeckeln der Retinae erfolgte direkt mittels erwärmter Glycerine-Gelatine. Die auf gelatinisierten Objekträgern aufgezogenen Hirnschnitte wurden hingegen in einer aufsteigenden Alkoholreihe (70%, 96%, und 2 x 100%) entwässert. Nach zweimaligem Klären in dem Lösungsmittel Xylol, welches den Alkohol im Gewebe verdrängt, wurden sie mit DEPEX (Serva, Feinbiochemic GmbH & Co, Deutschland) eingedeckelt. Für die Fluoreszenz-Mikroskopie behandeltes Gewebe wurde ohne Vorbehandlung mit erwärmtem Moviol (Höchst, Deutschland), welches keine Eigenfluoreszenz aufweist, eingedeckelt. 2.11 Lichtmikroskopie Die DAB-Präparate wurde auf einem Zeiss-Durchlichtmikroskop mit integrierter Kamera, ausgewertet. Es standen variable Objektivvergrößerungen (6.3-; 16-: 25-; 40-fach) zur Verfügung. Die Gesamtvergrößerung des Mikroskops errechnet sich aus: Objektiv x Optovar (= 1.2) x 3.2 Die Fotodokumentation erfolgte auf dem Film AGFA APX-25, 25 ASA. 2.12 Transmissionselektronenmikroskopie Die ultrastrukturellen Untersuchungen wurden auf einem Philips 420 Transmissionsektronenmikroskop durchgeführt. Die fotografische Dokumentation erfolgte auf Guilleminot Filmen. Material und Methoden 48 2.13 Fluoreszenzmikroskopie Die Fluoreszensmikroskopie wurde an einem Zeiss Mikroskop mit entsprechenden Filtern und Neofluar-Objektiven (25-; 40-fach) durchgeführt. Die Fotodokumentation erfolgte auf Ilford HP5, 400 ASA, mittels einer angeschlossenen Spiegelreflexkamera. 2.14 Konfokale Mikroskopie Zur Visualisierung der für die Kolokalisationsuntersuchungen einzelner Proteine eingesetzten Fluoreszenz-gekoppelten Antikörper im Tectum opticum der Taube wurde das konfokale Mikroskop „MRC-500“ von Bio-Rad Microscience (England) genutzt. Das konfokale Mikroskop fokussiert den zur Anregung der Fluoreszenzfarbstoffe eingesetzten Argon-IonenLaser auf eine Lochblende, der dann über einen Spiegel in das Mikroskopobjektiv gelenkt wird. Das Objektiv wiederum bündelt das Licht in der gewünschten Tiefe des Präparates. Das von dieser Ebene im Präparat emittierte Licht wird wieder vom Objektiv erfaßt, und auf die Öffnung einer weiteren Lochblende fokussiert, hinter welcher sich ein Detektor befindet. Vom Gewebe außerhalb der Fokusebene emittiertes Licht, welches die Abbildung unscharf erscheinen läßt, wird von dieser Lochblende abgeschirmt. Unter Verwendung einer computergestützten Steuereinheit wird der Laser in der Fokusebene über das Präparat gefahren, und die gewonnenen Daten auf einem Bildschirm visualisiert. Die konfokale Mikroskopie eignet sich insbesondere zur Darstellung von Strukturen, welche eine Tiefenausdehnung im Präparat zeigen. Eine so entstandene scharfe Abbildung der gesamten Ausdehnung wäre im normalen Fluoreszenzmikroskop nicht möglich. Im konfokalen Mikroskop wurden nacheinander verschiedene Fokusebenen im Präparat aufgezeichnet, und die gewonnen Schichtbilder anschließend über die Software MRC-500 zu einem Bild zusammengefügt. Zur detaillierten Darstellung möglicher Kolokalisationen bestimmter Proteine in einer Zelle wurde diese Prozedur zunächst für jeden Fluoreszenzfarbstoff (FITC und TRITC) einzeln durchgeführt, bevor die Rekonstruktionen mit Hilfe der Bio-Rad Softwear farblich abgesetzt übereinander gelegt wurden. So entstand ein exaktes Muster zur Expression der untersuchten Proteine im Tectum opticum in einer Tiefenausdehnung von 50-70µm. Material und Methoden 49 2.15 Spezifitätskontrollen der Antikörper Die Aussagekraft der Ergebnisse einer immunhistochemischen Untersuchung hängt von der Spezifität der eingesetzten Antikörper ab. Vorangegangene Arbeiten zeigten, daß die eingesetzten Antikörper die gleichen Antigene bei Ratten und Tauben erkennen (Vázquez et al., 1994; Hannestad et al., 1998). In der vorliegenden Arbeit wurden außerdem Kontrollen durchgeführt, bei denen der primären Antikörper durch ein affinitätsgereinigten Antiserum (Vector SP 1000) vom Spender der primären Antikörper, jedoch ohne den spezifischen primären Antikörper, ersetzt wurde, ohne die weitere Vorgehensweise der Immunhistochemie zu ändern. Aufschluß über die Spezifität des sekundären Antikörpers konnte durch eine immunhistochemische Reaktion ohne die Inkubation der Präparate mit dem primären Antikörper gewonnen werden. Ergebnisse (Retinale Expression...) 3 49 Ergebnisse Die im folgenden dargestellten Ergebnisse zeigen die Expression der beiden Neurotrophine BDNF und NT-3 sowie der high-affinity Neurotrophin-Rezeptoren trk B und trk C in der Retina und im Tectum opticum der Taube Columba livia während der Entwicklung des retino-tectalen System. Mit Hilfe dieser Untersuchungen werden intra-retinale und intra-tectale trophische Regelkreise erfaßt, ebenso wie mögliche retrograde und anterograde Signalwege im retinotectalen System. Insbesondere mögliche neurotrophe Mechanismen während der Entwicklung einer lateralisierten Informationsverarbeitung in diesem System werden basierend auf diesen Ergebnissen diskutiert. Die Untersuchungen der Expression dieser Proteine wurden im embryonalen Gewebe der Altersstadien E 14 und E 16, als auch in diversen Altersstadien nach dem Schlupf durchgeführt, beginnend mit dem Schlupftag (PH 0) und fortlaufend mit 1 Tag, 2 Tage, 4 Tage, 7 Tage, 14 Tage alten Tieren (PH 1, PH 2, PH 4, PH 7, PH 14) und adulten Tauben. Diese Altersstadien reflektieren den Zeitraum, in welchem retino-tectale Verbindungen und damit einhergehend auch die Lateralisation dieses System entstehen. Die Datenaufnahme in den Untersuchungen bezieht sich auf drei bis acht Tiere pro Altersstadium. Insgesamt wurden mit den eingesetzten Antikörper spezifische Markierungen der Zellsomata und Fortsätze neuronaler Zellen in der Retina und im Tectum opticum gleichermaßen beobachtet. Die ultrastrukturellen Untersuchungen im Tectum opticum adulter Tauben dienten einer morphologischen Charakterisierungen einzelner tectaler Schichten, wobei immunhistochemisch die ultrastrukturelle Lokalisation des Neurotrophins BDNF untersucht wurde. Die gewonnen Ergebnisse lassen detaillierte Schlußfolgerungen über den BDNF vermittelten trophischen Signalfluß im retino-tectalen System adulter Tauben zu. Die Kolokalisationsuntersuchungen von Neurotrophinen und Neurotrophin-Rezeptoren mit dem für Radialglia spezifischen Intermediärfilament Vimentin wurden zur näheren Charakterisierung faserartiger, Neurotrophin / Neurotrophin-Rezeptor positiver Strukturen im Tectum opticum (siehe Punkt 3.3) während einzelner juveniler Altersstadien durchgeführt. Die Ergebnisse zeigen eine deutliche Koexpression dieser Proteine im Tectum opticum, wodurch bislang nicht bekannte neurotrophe Mechnismen bei der Zellmigration erfaßt wurden. Ergebnisse (Retinale Expression...) 3.1 50 Kontrollexperimente In den Untersuchungen zur Spezifität der eingesetzten Neurotrophin- und Neurotrophin-Rezeptor Antikörper wurde ersichtlich, daß die verwendeten Kaninchen gegen Ratte Antikörper auch die entsprechenden Antigene im Taubenhirn erkannten. In immunhistochemischen Kontrollen wurde der primäre Antikörper gegen ein immunologisch nicht reaktives Serum ersetzt. Nach einer ansonsten unveränderten immunhistochemischen Prozedur blieben somatischer Signale oder diffuse Markierungen im Taubenhirn und den Retinae aus. Auch die sekundären Antikörper zeigten keinerlei unspezifische Markierungen in den Präparaten. 3.2 Retinale Expression von BDNF, NT-3, trk B und trk C Zur Charakterisierung des retinalen Expressionsmuster von BDNF, NT-3, trk B und trk C während der Entwicklung des retino-tectalen Systems wurden Netzhäute der Altersstadien E 16, PH 0, PH 1, PH 2, PH 4, PH 7, PH 14 sowie adulter Tauben untersucht. Im ersten untersuchten Altersstadium E 16 waren alle retinalen Schichten etabliert, wenngleich die Neuronen in den einzelnen Schichten vermutlich noch nicht voll differenziert waren. Diese Aussage basiert auf ausschließlich lichtmikroskopischen morphologischen Betrachtungen, wobei die Schichtdicke der inneren plexiformen Schicht im Verlaufe der untersuchten Altersstadien zunahm, während die Schichtdicken der inneren und äußeren nukleären Schichten leicht abnahmen. Vermutlich korrelierte die Straffung der nukleären Schichten mit der etablierten Konfiguration der Neuronen in einzelnen Schichten, während die Ausdehnung der plexiformen Schichten zunehmende synaptische Kontakte der Neuronen wahrscheinlich machte. Insgesamt waren die Perikarien der retinale Ganglienzellen und der Photorezeptorzellen anhand ihrer Lage unterhalb der inneren plexiformen, bzw. oberhalb der äußeren plexiformen Schicht eindeutig zu erkennen, wohingegen die Zuordnung der immunhistochemisch-positiven Neuronen zu einem bestimmten retinalen Zelltyp in der inneren nukleären Schicht basierend auf der Lage der Zellkörper innerhalb dieser Schicht, der Perikariengröße sowie der Art ihrer Fortsätze durchgeführt wurde. Retinale Neuronen zeigten in den durchgeführten Experimenten eine deutliche Immunreaktivität gegen die eingesetzten Antikörper, wobei das Signal von BDNF und trk C zumeist auf das Perikarion der Neuronen begrenzt war, hingegen die Antikörpern gegen NT-3 und trk B sowohl Ergebnisse (Retinale Expression...) 51 die Somata als auch die proximalen Fortsätze einzelner Neuronen markierten. Darüber hinaus zeigten die eingesetzten Antikörper diffuse, aber deutliche Markierungen des Neuropils. 3.2.1 Retinale BDNF Expression In den Untersuchungen zur Expression von BDNF in der Taubenretina wurde das Neurotrophin in diversen Zelltypen nachgewiesen (Abbildungen 7-10). Nach immunhistochemischer Behandlung zeigten sich deutliche Markierungen retinaler Ganglienzellen sowie moderate Signale in der inneren nukleären Schicht. Anhand der Lage der markierten Neuronen direkt oberhalb der inneren plexiformen Schicht ist es wahrscheinlich, daß diese Nervenzellen zu den Amakrinzellen sowie zu den displaced Ganglienzellen der Retina zählen (Abbildung 9). Desweiteren zeigten die Somata der Photorezeptorzellen in der Taubenretina eine BDNF-Immunreaktivität (Abbildung 10). Außer den somatischen Markierungen spezifischer Neuronen war eine Neuropil-Färbung der inneren und äußeren plexiformen Schichten sichtbar (Abbildung 9). Im einzelnen folgten die BDNF-Expressionen in den einzelnen Schichten der Taubenretina vom Embryonalstadium bis zu den adulten Tieren einem zeitlichen Gradienten, wobei die embryonale Retina keinerlei BDNF-Expression, weder somatisch noch des Neuropils zeigte (Abbildung 7). Die BDNF-Synthese begann am Schlupftag (PH 0) mit vereinzelten BDNF-positiven retinalen Ganglienzellen (Abbildung 7). Eine Markierung der inneren plexiformen Schicht war zum Zeitpunkt PH 0 ebenfalls zu erkennen, wenn auch sehr schwach. Ergebnisse (Retinale Expression...) 52 Abbildung 7: E 16 - PH 0 a) In der embryonalen Retina wurden keine BDNF-positiven Neuronen detektiert. b) Ab dem Schlupftag zeigten retinale Ganglienzellen (G) und diffus die innere plexiforme Schicht BDNF Immunreaktivität (Pfeile). Balken = 50µm. Einen Tag nach dem Schlupf (PH 1) war die Expression des Neurotrophins noch immer auf vereinzelte retinale Ganglienzellen begrenzt, wobei die Markierung der inneren plexiformen Schicht an Signalintensität zunahm (Abbildung 8). Ergebnisse (Retinale Expression...) 53 Abbildung 8: PH 1-PH 2 a) Einen Tag nach dem Schlupf waren retinale Ganglienzellen (G) und die innere plexiforme Schicht (Pfeile) BDNF markiert. b) Am zweiten Tag nach dem Schlupf dehnte sich die somatische BDNF Markierung auf Neuronen der inneren nukleären Schicht (weiße Pfeile) und diffus auf die äußere und innere plexiforme Schicht aus (schwarze Pfeile). Balken = 50µm. Zwei Tage nach dem Schlupf (PH 2) wurde BDNF von retinalen Ganglienzellen und erstmals auch von Neuronen der inneren nukleären Schicht exprimiert (Abbildung 8). Das Signal dieser retinalen Zellen war schwach, aber eindeutig. Ob es sich hierbei um Bipolarzellen, Amakrinzellen oder displaced Ganglienzellen handelte, konnte nicht abschließend geklärt werden. Desweiteren war ab PH 2 eine diffuse Markierung der äußeren plexiformen Schicht zu erkennen (Abbildung 8). Vom Tag vier (PH 4) bis hin zum Tag 14 nach dem Schlupf (PH 14) war ein sehr starkes Ergebnisse (Retinale Expression...) 54 BDNF-Signal in retinalen Ganglienzellen als auch in Neuronen der inneren nukleären Schicht zu verzeichnen (Abbildung 9). Abbildung 9: PH 4-PH 7 Eine intensive somatische BDNF Markierung retinaler Ganglienzellen (G) und Neuronen der inneren nukleären Schicht (weiße Pfeile) wurde vier (a) und sieben Tage (b) nach dem Schlupf erkannt, begleitet von einer diffusen Markierung der äußeren und inneren plexiformen Schicht (schwarze Pfeile). Balken = 50µm. Ergebnisse (Retinale Expression...) 55 Die BDNF-positiven Ganglienzellen ergaben das Bild einer perlschnurartigen Aufreihung, wohingegen die markierten Neuronen in der inneren nukleären Schicht in verschiedenen Tiefen, zumeist aber direkt oberhalb der inneren plexiformen Schicht, lagen. Möglicherweise handelte es sich hierbei um BDNF-positive Amakrinzellen oder displaced Ganglienzellen, nicht aber um die zur äußeren plexiformen Schicht orientierten Bipolarzellen. Auch in den juvenilen Altersstadien PH 4 bis PH 14 war eine diffuse Markierung der äußeren plexiformen Schicht zu erkennen (Abbildungen 9-10). In der adulten Taubenretina ähnelte die Expression von BDNF dem Muster im Altersstadium PH 14 (Abbildung 10). Es ergab sich ein sehr klares BDNF-positives Signal retinaler Ganglienzellen, welche dicht gepackt nebeneinander lagen. Die sich anschließende innere plexiforme Schicht zeigte ein moderates BDNF-Signal. In der inneren nukleären Schicht synthetisierten insbesondere die direkt an der inneren plexiformen Schicht gelegenen Neuronen BDNF, wobei es sich vermutlich um Amakrinzellen und/oder displaced Ganglienzellen handelte. Außerdem kennzeichnete die adulte Taubenretina eine deutliche somatische BDNF-Expression der Photorezeptorzellen (Abbildung 10). Ergebnisse (Retinale Expression...) Abbildung 10: PH 14 – Adult In der Retina vierzehn Tage alter (a) und adulter Tauben (b) wurden deutliche somatische BDNF Markierungen in retinalen Ganglienzellen (G) und Amakrinzellen (A), als auch, bei den Adulten (b), in der äußeren nukleären Schicht (weiße Pfeile) erkannt. Desweiteren zeigten sich diffuse Markierungen der inneren plexiformen Zellschicht (schwarze Pfeile). Balken = 50µm. 56 Ergebnisse (Retinale Expression...) 57 3.2.2 Retinale NT-3 Expression Die immunhistochemischen Untersuchungen zur Expression von Neutrotrophin-3 (NT-3) in der Taubenretina zeigten die Synthese des Proteins in verschiedenen Zelltypen (Abbildungen 11-14). NT-3-positiv waren retinale Ganglienzellen, Neuronen der inneren nukleären Schicht, wahrscheinlich Bipolarzellen, Amakrinzellen und displaced Ganglienzellen sowie die Somata von Photorezeptorzellen in der äußeren nukleären Schicht. Neben der somatischen Markierungen waren noch Neuropilmarkierung der inneren plexiformen Schicht mit dem Antikörper gegen NT-3 zu beobachten. Die Expression des Proteins erfolgte in aufeinanderfolgenden Stadien vom Embryonalstadium bis zum adulten Tier, wobei einzelne Neuronentypen unterschiedliche Expressionsmuster während der Entwicklung aufwiesen. In der embryonalen Retina (E16) konnte NT-3 immunhistochemisch nicht nachgewiesen werden (Abbildung 11). Hingegen war bereits am Schlupftag (PH 0), also zwei Tage später, eine massive Expression von NT-3 in einer Vielzahl retinaler Ganglienzellen, aufgereiht wie auf einer Perlenkette, zu beobachten (Abbildung 11). Außerdem war ab PH 0 eine Neuropilfärbung der inneren plexiformen Schicht zu verzeichnen. Einen Tag nach dem Schlupf (PH 1) war das Expressionsmuster mit dem von PH 0 nahezu identisch, wobei zusätzlich erste Neuronen der inneren nukleären Schicht sehr schwach NT-3positiv waren (Abbildung 12). Es handelte sich hierbei um direkt über der inneren plexiformen Schicht gelegene Neuronen, wodurch eine Zuordnung dieser zu den Amakrinzellen und/oder displaced Ganglienzellen wahrscheinlich ist. Wiederum einen Tag später (PH 2) exprimierten retinale Ganglienzellen und vermutlich Bipolarzellen der inneren nukleären Schicht das Neurotrophin NT-3 (Abbildung 12). Die Klassifizierung der NT-3-positiven Zellen als 2. Neuronen der Sehbahn beruhte zum einen auf ihrer Lokalisation im zentralen Bereich der inneren nukleären Schicht sowie zum anderen auf ihren charakteristischen und deutlich markierten distalen Fortsätze, welche zu den Ganglienzellen projizierten. In einer subjektiven Bewertung des immunhistochemischen Signals zeigte sich die höchste Signalintensität am PH 2, wobei neben dem somatischen Signal auch die distalen Fortsätze der retinalen Ganglienzellen und der Bipolarzellen markiert waren (Abbildung 12). Zu beobachten war außerdem eine moderate Markierung der inneren plexiformen Schicht als auch eine schwache und diffuse Markierung der Photorezeptorschicht (Abbildung 12). Ergebnisse (Retinale Expression...) Abbildung 11: E 16 – PH 0 a) In der embryonalen Retina (E 16) wurden keine NT-3 Markierungen beobachtet. b) Zwei Tage später (PH 0) hingegen waren eine Vielzahl retinaler Ganglienzellen (G) NT-3-positiv. Darüber hinaus zeigte sich eine schwache diffuse Markierung der inneren plexiformen Schicht (Pfeil). Balken = 50µm. 58 Ergebnisse (Retinale Expression...) Abbildung 12: PH 1 – PH 2 a) Einen Tag nach dem Schlupf (PH 1) waren retinale Ganglienzellen (G) mit dem Antikörper gegen NT-3 markiert. Erste schwach NT-3-positive Neuronen zeigten sich in der inneren nukleären Schicht (Pfeile). b) Am zweiten Tag nach dem Schlupf (PH 2) waren retinale Ganglienzellen (G) und Bipolarzellen (B) der inneren nukleären Zellschicht NT-3-positiv, wobei die Somata und die proximalen Dendriten deutlich zu erkennen waren. Balken = 50µm. 59 Ergebnisse (Retinale Expression...) 60 Ab dem vierten Tag nach dem Schlupf (PH 4) bis zum letzten untersuchten juvenilen Stadium PH 14 war eine moderate NT-3 Synthese in den retinalen Ganglienzellen erkennbar, wobei die Dichte der NT-3 exprimierenden Ganglienzellen in den älteren Entwicklungsstadien abnahm (Abbildungen 13-14). Ebenso waren Neuronen der inneren nukleären Schicht schwach NT-3positiv, vermutlich Bipolarzellen und Amakrinzellen wie gleichermaßen displaced Ganglienzellen. Diffus markiert waren in den Altersstadien PH 4 bis zu den Adulten die innere plexiforme Schicht (Abbildungen 13-14). Abbildung 13: PH 4 – PH 7 In den Altersstadien PH 4 (a) und PH 7 (b) zeigten retinale Ganglienzellen (G) und Neuronen der inneren nukleären Zellschicht (schwarze Pfeile) NT-3 Immunreaktivität. Diffus markiert mit dem Antikörper gegen NT-3 war die innere plexiforme Schicht (weiße Pfeile). Balken = 50µm. Ergebnisse (Retinale Expression...) 61 Zum Zeitpunkt PH 14 waren zusätzlich vereinzelte Photorezeptorzellen diskret somatisch NT-3positiv (Abbildung 14). In der adulten Retina war das NT-3 Signal schwach (Abbildung 14). Vermutlich synthetisierten in Adulten etwa die Hälfte der retinalen Ganglienzellen das Neurotrophin sowie vereinzelt Neuronen der inneren nukleären Zellschicht (Amakrinzellen und/oder displaced Ganglienzellen). Abbildung 14: PH 14 – Adult Bei vierzehn Tage alten (PH 14) (a) und adulten Tauben (b) waren retinale Ganglienzellen (G) NT-3-positiv. Während im Altersstadium PH 14 Bipolarzellen (B) und die Somata der Photorezeptoren NT-3 markiert waren (schwarze Pfeile), so zeigten bei Adulten insbesondere Amakrinzellen (A) Immunreaktivität gegen NT-3. Außerdem diffus markiert war die innere plexiforme Schicht (weiße Pfeile). Balken = 50µm. Ergebnisse (Retinale Expression...) 62 3.2.3 Retinale trk B-Expression Der high affinity Rezeptor trk B wurde in der Taubenretina von verschiedenen Zelltypen exprimiert. Mit Hilfe immunhistochemischer Methoden wurde das Protein in den Somata retinaler Ganglienzellen, in Neuronen der inneren nukleären Schicht (vermutlich in displaced Ganglienzellen, Amakrinzellen und Bipolarzellen) sowie diffus in der inneren und äußeren plexiformen Schicht nachgewiesen (Abbildung 15–18). Insgesamt war eine deutliche Korrelation zwischen der trk B Expression und einzelnen Altersstadien zu erkennen. Beginnend mit der embryonalen Retina E 16 war keine trk B Immunreaktivität zu verzeichnen (Abbildung 15). Am Schlupftag (PH 0) waren die ersten Ganglienzellen vereinzelt, aber sehr deutlich trk B-positiv (Abbildung 15). Außerdem waren in der inneren nukleären Schicht der Retina vereinzelt Zellen mit dem Antikörper gegen trk B markiert, wobei es sich vermutlich um Amakrinzellen handelte. Moderat und diffus war am PH 0 die innere plexiforme Schicht markiert (Abbildung 15). Einen Tag nach dem Schlupf (PH 1) zeigte die Retina das gleiche Expressionsmuster wie am PH 0; Ganglienzellen synthetisierten den trk B Rezeptor ebenso wie vereinzelte Neuronen in der inneren nukleären Schicht (Abbildung 16). Hinzu kam eine diffuse Markierung der äußeren und inneren plexiformen Schicht. Im Zeitraum von zwei Tagen (PH 2) (Abbildung 16) bis vier Tagen nach dem Schlupf (PH 4) (Abbildung 17) waren es vermutlich Amakrinzellen und auch displaced Ganglienzellen, welche ein deutliches trk B-positives Signal zeigten. Hierbei kennzeichneten sich die displaced Ganglienzellen durch ihre Somagröße aus ebenso wie die trk B-positiven Neuronen in der retinalen Ganglienzellschicht. In der äußeren plexiformen Schicht war weiterhin eine diffuse Markierung zu erkennen (Abbildung 16). Ergebnisse (Retinale Expression...) Abbildung 15: E 16 – PH 0 a) Im Altersstadium E 16 wurde keine trk B Immunreaktivität in der Retina der Taube erkannt. b) Ab dem Schlupftag (PH 0) waren vereinzelt Neuronen der inneren plexiformen Schicht (vermutlich Amakrinzellen: A) und retinale Ganglienzellen (G) trk B-positiv. Mit dem Antikörper gegen trk B diffus markiert war die innere plexiforme Schicht (Pfeile). Balken = 50µm. 63 Ergebnisse (Retinale Expression...) Abbildung 16: PH 1 – PH 2 a) Am Tag eins nach dem Schlupf waren retinale Ganglienzellen somatisch trk B markiert (G) ebenso wie vereinzelte Neuronen der inneren nukleären Schicht (schwarze Pfeile). Diffus trk B-positiv waren die äußere und innere plexiforme Schicht (weiße Pfeile). b) Am zweiten Tag nach dem Schlupf wurden trk B-positive retinale Ganglienzellen (G), Amakrinzellen (A), displaced Ganglienzellen (DG) sowie schwach markierte Bipolarzellen (B) erkannt. Insbesondere die proximalen Fortsätze der Amakrinzellen waren trk B-positiv. Balken = 50µm. 64 Ergebnisse (Retinale Expression...) 65 Abbildung 17: PH 4 – PH 7 a) Im Altersstadium PH 4 waren retinale Ganglienzellen (G) sowie Amakrinzellen (A) somatisch trk B markiert, begleitet von einer diffusen Markierung der inneren plexiformen Schicht (Pfeile). b) Sieben Tage nach dem Schlupf nahm die Immunreaktivität gegen trk B zu. Retinale Ganglienzellen (G) und Amakrinzellen (A) exprimierten den highaffinity Rezeptor, ebenfalls begleitet von einer diffuses Markierungen der inneren plexiformen Schicht (Pfeile). Balken = 50µm. Ab dem siebten Juveniltag (PH 7) bis hin zum Tag 14 nach dem Schlupf (PH 14) wurde das trk B Signal subjektiv stärker (Abbildungen 17-18), wobei retinale Ganglienzellen und Neuronen der inneren nukleären Schicht massiv trk B-positiv waren. Insbesondere am PH 14 zeigten eine Vielzahl von vermutlich Amakrinzellen eine starke Immunreaktivität gegen den trk B Rezeptor Ergebnisse (Retinale Expression...) 66 (Abbildung 18). Außer diesen somatischen Markierungen war eine diffuse Färbung des Neuropils der inneren plexiformen Schicht zu erkennen. In der adulten Taube reduzierte sich das retinale trk B-positive Signal somatisch auf die Ganglienzellen und diffus auf die innere plexiforme Schicht (Abbildung 18). Ergebnisse (Retinale Expression...) Abbildung 18: PH 14 – Adult a) Vierzehn Tage nach dem Schlupf wurden intensive Immunreaktivitäten gegen trk B in retinalen Ganglienzellen (G) und vermutlich Amakrinzellen (A) beobachtet, wobei die proximalen Fortsätze der Amakrinzellen trk B-positiv waren. Begleitet wurde die somatischen Markierungen von diffusen Färbungen der inneren und schwach der äußeren plexiformen Schichten (Pfeile). b) In den adulten Tauben waren somatisch retinale Ganglienzellen (G) und diffus die innere plexiforme Schicht (Pfeile) trk B-positiv. Balken = 50µm. 67 Ergebnisse (Retinale Expression...) 68 3.2.4 Retinale trk C-Expression In den folgenden immunhistochemischen Darstellungen wurde die Expression des high-affinity trk C Rezeptor von diversen Zelltypen der Taubenretina nachgewiesen. Deutlich wurde die Synthese dieses spezifischen Neurotrophin-Rezeptors in retinalen Ganglienzellen und in Neuronen der inneren nukleären Schicht, wobei es sich vermutlich um displaced Ganglienzellen sowie Amakrinzellen handelte (Abbildungen 19–22). Ein schwach somatisches und diffuses trk C Signal war darüber hinaus in der äußeren nukleären und plexiformen Schicht und ausschließlich diffus in der inneren plexiformen Schicht zu erkennen. Auch die Expression des trk C Proteins in der Taubenretina kennzeichnete ein differentielles Muster in den verschiedenen Entwicklungsstadien. In der embryonalen Retina wurde der trk C Rezeptor immunhistochemisch nicht nachgewiesen (Abbildung 19). Erst ab dem Schlupftag (PH 0) wurde ein moderates trk C Signal in vereinzelten Somata retinaler Ganglienzellen sichtbar (Abbildung 19). Sehr vereinzelt zeigte sich ab PH 0 ein schwaches trk C-positives Signal in den Somata von Photorezeptorzellen sowie eine diffuse Markierung der inneren plexiformen Schicht. Ein und zwei Tage nach dem Schlupf (PH 1 / PH 2) exprimierten retinale Ganglienzellen den trk C Rezeptor, wobei erstmals vereinzelte Neuronen der inneren nukleären Schicht ein schwaches trk C-positives Signal zeigten (Abbildung 22). Desweiteren wurde eine Intensitätszunahme der Neuropilfärbung der inneren plexiformen Schicht und eine trk C Markierung der äußeren plexiformen Schicht in diesen Altersstadien beobachtet. Ergebnisse (Retinale Expression...) Abbildung 19: E 16 – PH 0 a) In der embryonalen Retina (E 16) wurde keine trk C Immunreaktivität erkannt. b) Ab dem Schlupftag (PH 0) exprimierten vereinzelte retinale Ganglienzellen (G) und darüber hinaus schwach somatisch einzelne Photorezeptoren (schwarzer Pfeil) den trk C Rezeptor. Diffus markiert war ab PH 0 die innere plexiforme Schicht (weiße Pfeile). Balken = 50µm. 69 Ergebnisse (Retinale Expression...) 70 Abbildung 20: PH 1 – PH 2 a) Einen Tag nach dem Schlupf waren retinale Ganglienzellen (G) trk C-positiv ebenso wie die innere und äußere plexiforme Schicht (Pfeile). b) Zwei Tage nach dem Schlupf zeigten auch Neuronen der inneren nukleären Schicht trk C Immunreaktivität, wobei es sich vermutlich um Amakrinzellen (A) und/oder displaced Ganglienzellen (DG) handelte. Die trk C Expression in den retinalen Ganglienzellen (G) nahm in diesem Altersstadium an Quantität und Signalstärke zu. Diffus markiert waren die innere und äußere plexiforme Schicht. Balken = 50µm. Zwischen dem vierten und siebten Tag nach dem Schlupf (PH 4 / PH 7) zeigte sich eine klare Immunreaktivität in retinalen Ganglienzellen und in Neuronen der inneren nukleären Schicht Ergebnisse (Retinale Expression...) 71 (Abbildung 21). Aufgrund der Lage dieser Neuronen direkt oberhalb der inneren plexiformen Schicht waren es vermutlich Amakrinzellen und/oder displaced Ganglienzellen. In den Altersstadien PH 4 und PH 7 waren intensive diffuse trk C Markierung der inneren und äußeren plexiformen Schicht zu erkennen (Abbildung 21). Abbildung 21:PH 4 – PH 7 Die trk C Expression im Altersstadium PH 4 (a) und PH 7 (b) war deutlich sichtbar in retinalen Ganglienzellen (G) als auch Neuronen der inneren nukleären Schicht (schwarze Pfeile). Vermutlich handelte es sich um Amakrinzellen und/oder displaced Ganglienzellen. Diffus markiert waren die innere und äußere plexiforme Schicht mit dem Antikörper gegen trk C (weiße Pfeile). Balken = 50µm. Ergebnisse (Retinale Expression...) 72 Ergebnisse (Retinale Expression...) 73 Vierzehn Tage nach dem Schlupf (PH 14) nahm das trk C Immunsignal ni den Neuronen der inneren nukleären Schicht an Intensität ab, blieb aber in den retinalen Ganglienzellen hoch. Vermutlich handelte es sich hier bei den Neuronen der inneren nukleären Schicht um Amakrinund/oder displaced Ganglienzellen (Abbildung 22). In den vierzehn Tage alten Tauben waren außerdem die äußere und innere plexiforme Schicht trk C markiert (Abbildung 22). Die adulte Taubenretina zeigte eine deutliche trk C Expression in retinalen Ganglienzellen und eine schwächere Expression des Rezeptors in der inneren plexiformen Schicht. Aufgrund der Lokalisation dieser trk C-positiven Neuronen direkt an der innere plexiformen Schicht handelte es sich wahrscheinlich um Amakrinzellen und displaced Ganglienzellen (Abbildung 22). Zusätzlich trk C-positiv war die innere plexiforme Schicht (Abbildung 22). Die Signalintensität in den retinalen Ganglienzellen schien in einer subjektiven Betrachtung, beginnend mit PH 0 bis zum Adultstadium, kontinuierlich an Intensität zuzunehmen (Abbildungen 19-22). Hingegen schien eine maximale Signalintensität der Neuronen der inneren nukleären Schicht zwischen PH 4 und PH 7 erreicht worden zu sein (Abbildung 21). Ergebnisse (Retinale Expression...) Abbildung 22:PH 14 –Adult In den Retinae vierzehn Tage alter (a) und adulter Tauben (b) waren retinale Ganglienzellen (G) intensiv trk C immunreaktiv. Etwas schwächer waren auch Amakrin und/oder displaced Ganglienzellen (schwarze Pfeile) mit dem Antikörper gegen trk C markiert. Begleitet wurden diese somatischen Markierungen von einer diffusen Färbung der inneren plexiformen Schicht (weiße Pfeile). Balken = 50µm. 74 Ergebnisse (Retinale Expression...) 75 Die Tabelle 7 faßt die Ergebnisse der retinalen Expression der Neurotrophine BDNF und NT-3 sowie der high-affinity Rezeptoren trk B und trk C zusammen. Deutlich wird die mit dem Schlupftag beginnende und in den juvenilen Altersstadien anhaltend intensive Expression von BDNF und NT-3 und ebenso der trk B und trk C Rezeptoren in retinalen Ganglienzellen und Neuronen der inneren nukleären Schicht. Während BDNF in der adulten Taube weiterhin intensiv in Neuronen der inneren nukleären Schicht und den retinalen Ganglienzellen synthetisiert wurde, so war ein Maximum der NT-3 Expression zwischen PH 2 und PH 14 zu erkennen. Die retinale Expression von trk B und trk C hingegen verlief in der Taube relativ gleichförmig. Beginnend mit dem Schlupftag waren vereinzelte retinale Ganglienzellen trk B und trk C positiv, wobei die Signale der beiden high-affinity Rezeptoren in den folgenden Altersstadien an Intensität zunahmen und auch in den adulten Tieren deutlich zu erkennen waren. Außerdem zeigten Neuronen der inneren nukleären Schicht intensive Immunmarkierungen gegen die beiden trk Rezeptoren, insbesondere in den juvenilen Altersstadien. Tabelle7: Zeitlicher Verlauf der retinalen Expression von BDNF, NT-3, trk B und trk C ÄNS = äußere nukleäre Schicht, INS = innere nukleäre Schicht, RGZ = retinale Ganglienzellschicht. Markierungsintensität: + = moderat; ++ = intensiv; +++ = sehr intensiv; - = nicht zu erkennen. BDNF NT-3 Trk B Trk C E 16 PH 0 PH 1 PH 2 PH 4 PH 7 PH 14 Adult ÄNS - - - - - - - + INS - - - + ++ +++ +++ +++ RGZ - + + ++ +++ +++ +++ +++ ÄNS - - - + - - + - INS - - + ++ ++ ++ ++ + RGZ - +++ +++ +++ ++ ++ ++ ++ ÄNS - - - - - - - - INS - + + ++ ++ +++ +++ - RGZ - + + ++ ++ +++ +++ +++ ÄNS - + - - - - - - INS - - - + ++ ++ + + RGZ - + ++ ++ ++ +++ +++ +++ Ergebnisse (Retinale Expression...) 76 Die Expression von BDNF, NT-3, trk B und trk C ist ein Indiz für neurotrophe Signalflüße in der juvenilen und adulten Taubenretina. Hierbei erfolgte die immunhistochemische Detektion der oben genannten Antigene ab dem Schlupftag der Tauben, während in der embryonalen Retina keine immunmarkierten Strukturen erkennbar waren. Obgleich auch die Retinae embryonaler Tauben durch die Eischale dringendes Licht empfangen können, so sind die Tiere einer massiven Lichtstimulation ab dem Schlupftag ausgesetzt. Die ebenfalls ab PH 0 beginnende Expression der Neurotrophine / Neurotrophin-Rezeptoren deutet auf aktivitätsabhängige, über Licht gesteuerte Prozesse bei der Synthese dieser Proteine hin. Möglicherweise fungieren die in der äußeren und inneren nukleären Schicht, und ebenso in der retinalen Ganglienzellschicht exprimierten Neurotrophine als intrinsische Signale während der Etablierung der Retina, zum Beispiel bei der Entwicklung der dendritischen Verzweigung oder der Synapsenbildung der Neuronen. Nach einer von Bovolenta und Mitarbeitern (1996) durchgeführten Neutralisation von NT-3 durch spezifische Antikörper wurden massive Entwicklungsstörungen der Retina beobachtet. Die Ausdehnung der Zellschichten unterblieb, ebenso wie die dendritische Verzweigung der retinalen Ganglienzellen. Auch die Anzahl der Axonen im Nervus opticus wurde durch die Blockierung von NT-3 drastisch reduziert. Neben NT-3 deuten diverse Untersuchungen (siehe Punkt 4.1) auch auf BDNF als wichtigen trophischen Faktor der retinalen Entwicklung (Überblick: v. Bartheld, 1998). Möglicherweise regulieren die beiden trophischen Substanzen im Zusammenspiel die Entwicklung der Retina. Hierbei ist die mit dem Schlupftag beginnende massive Expression von NT-3 ein Hinweis auf eine wichtige Funktion dieses Neurotrophins bei der retinalen Entwicklung direkt nach der massiven Lichtstimulation. Im gleichen Zeitraum wird BDNF im Gegensatz zu NT-3 schwächer exprimiert, mit steigender Tendenz im weiteren Verlauf der retinalen Differenzierung bis zur adulten Taube. Möglicherweise ist BDNF ein wichtiger trophischer Faktor während der späten retinalen Differenzierung. Die beiden Neurotrophine BDNF und NT-3 und der Neurotrophin-Rezeptor trk C werden auch in diversen Schichten der adulten Taubenretina exprimiert, wodurch auch hier trophische intraretinale Signalflüsse denkbar sind. Die funktionellen Relevanzen solcher intraretinalen Neurotrophin-Signalflüsse liegen möglicherweise in einer ständigen Feinanpassung des Systems, zum Beispiel hinsichtlich der Dendritenmorphologie, der Transmittersynthese, und der synaptischen Verschaltungen (Überblick: Ebadi et al., 1997). Die Synthese von BDNF, NT-3, Ergebnisse (Retinale Expression...) 77 trk B und trk C in den retinalen Ganglienzellen juveniler wie auch adulter Tauben kann darüber hinaus Ausdruck anterograder und/oder retrograder Signalflüsse zwischen der Retina und diversen weiteren Hirnstrukturen sein. Die im folgenden beschriebenen Ergebnisse zur Expression dieser Proteine im Tectum opticum lassen eine genauere Analyse retino-tectalen Signalflüsse zu. Ergebnisse (Tectale Expression...) 3.3 76 Tectale Expression von BDNF, NT-3, trk B und trk C Die Charakterisierung des tectalen Expressionsmusters der Neurotrophine BDNF, NT-3 sowie der high-affinity Rezeptoren trk B und trk C wurde in den Altersstadien E 14, E 16, PH 0, PH 1, PH 2, PH 4, PH 7, PH 14 und in der adulten Taube durchgeführt. Viele Neuronen dieser mesencephalen Struktur kennzeichnete eine deutliche somatische Immunreaktivität mit zum Teil proximal gefärbten Fortsätzen. Die Klassifizierung erfolgte zum einen auf Grund der Lage der immunhistochemisch markierten Somata in den zu bestimmenden tectalen Schichten, zum anderen anhand der zum Teil markierten Zellfortsätze. In den retino-rezipienten superficialen Schichten wurde neben den klar abgrenzbaren Radialzellen auch weitere Neuronen erkannt, deren genaue Zuordnung anhand dieser immunhistochemischen Daten nicht erfolgen konnte. Es handelte sich um Nervenzellen, deren mit den Antikörpern markierte Fortsätze horizontal zur tectalen Oberfläche verliefen. Vermutlich waren dies Horizontalzellen der superficialen Schichten, aber insbesondere in den juvenilen Altersstadien auch tangential zur tectalen Oberfläche migrierende Neuronen. In den mittleren Zellschichten waren Radialzellen und multipolare Neuronen, deren Dendriten bis in die superficialen Schichten reichten, immun-positiv gegen die eingesetzten Antikörper. In den immunhistochemischen Untersuchungen waren in den tiefen tectalen Schichten, die mit den Neuronen der Schicht 13 den Hauptanteil der Efferenzen aus dem Tectum opticum bilden, und wo außerdem während der Entwicklung der mesencephalen Struktur Neuronen im Ventrikelepithel generiert werden, mutipolare Neuronen in der Schicht 13 und kleine Neuronen der Schichten 14 und 15 dargestellt. Zusätzlich waren radial verlaufende, mehrere Zellschichten überspannende faserartige Markierungen ohne somatisches Signal zu beobachten. Eine genaue Zuordnung dieser im folgenden als radial orientierte Fasern bezeichneten Strukturen erfolgt im Abschnitt 3.4 “Kolokalisationsuntersuchungen”. Der bei der Beschreibung der Immunmarkierung tectaler Neuronen gebrauchte Begriff der Kolumnen bezieht sich auf die morphologische Betrachtung eines mehrere Zellschichten überspannenden, somatischen und diffusen Signals, mit klarer Abgrenzung zu direkt benachbarten Bereichen. Die Beschriftung der Schichten erfolgt in den Embryonalstadien der in der Einleitung beschrieben alphabetischen Nomenklatur und ab PH 0 der von Ramon y Cajal (1911) eingeführten numerischen Nomenklatur. Ergebnisse (Tectale Expression...) 77 3.3.1 Tectale BDNF Expression In den immunhistochemischen Untersuchungen zur Expression von BDNF wurde das Neurotrophin in diversen Zellen unterschiedlicher tectaler Schichten in einem zeitlich differenten Expressionsmuster nachgewiesen (Abbildungen 23-28). Außerdem waren in diversen Altersstadien radial orientierte Fasern BDNF-positiv, welche zumeist mehrere tectale Schichten überspannten. Im ersten untersuchten Altersstadium (E 14) wurden vereinzelt BDNF-positive Neuronen in der Schicht C (adulte Schicht 13) detektiert (Abbildung 23). Eine moderate auf vereinzelte Neuronen beschränkte BDNF Immunmarkierung war darüber hinaus auch in Neuronen der Schichten A und B (Adult: 15 und 14) sowie im Ventrikelepithel zu beobachten (Abbildung 23). Bei drei Tieren zeigte sich das BDNF Signal im rostro-lateralen TO, bei einem weiteren Tier zum Zeitpunkt E 14 in der gesamten ventro-dorsalen Ausdehnung des rostralen TO, wohingegen im caudalen TO kein positives BDNF Signal beobachtet wurde. Zwei Tage später, zum Zeitpunkt E 16, war eine intensive somatische Schicht C Markierung ventro-rostral sowie caudo-dorsal (Abbildung 23) zu verzeichnen. Außerdem stellten sich in den Experimenten insbesondere im caudalen TO Neuronenmarkierungen in den Schichten A und B dar, begleitet von BDNFpositiven, radial orientierten Fasern. Kennzeichnend für diese Fasern war ein Verlauf durch nahezu alle tectalen Schichten, vom Ventrikelepithel bis zu den oberflächlichen Schichten. Sehr vereinzelt synthetisierten Neuronen der mittleren Zellschichten BDNF (Abbildung 23). Ergebnisse (Tectale Expression...) 78 Abbildung 23: E 14 - E 16 a) Im Altersstadium E 14 zeigten intensiv Schicht C Neuronen (C) sowie schwächer Neuronen in den tiefen tectalen Schichten (Pfeile) BDNF Immunreaktivität. b) Nach 16-tägiger Brutdauer (E 16) waren Neuronen der Schicht C (C) und der tiefen tectalen Schichten (A-B) trk C markiert. Begleitet wurde die somatische Immunreaktivität von einer Fasermarkierung, welche vom Ventrikelepithel bis zu den superficialen Schichten reichte (Pfeile). Balken = 100µm. Ergebnisse (Tectale Expression...) 79 Am Schlupftag (PH 0) dehnte sich die somatische Immunreaktivität gegen BDNF auf alle vorhandenen tectalen Zellschichten aus (Abbildung 24). Dabei waren Neuronen der Schichten 15 bis 13 und der Schicht 10 in der gesamten ventro-dorsalen Ausdehnung BDNF markiert. Die somatischen BDNF Signale der Schichten 9 und 8 waren hingegen nicht uniform in der ventrodorsal Ausdehnung, sondern vielmehr in breiten Kolumnen lokalisierbar. BDNF-positive radial orientierte Fasern ohne zuzuordnendes Perikarion waren unabhängig von den beschriebenen somatischen Markierungen im gesamten TO zu identifizieren (Abbildung 24). Abbildung 24: PH 0 Die Immunreaktivität gegen BDNF war somatisch in nahezu allen tectalen Schichten im Altersstadium PH 0 zu erkennen. Die Neuronen der Schichten 15 bis 10 waren in der gesamten dorso-ventralen Ausdehnung gleichermaßen BDNF-positiv, hingegen zeigten sich in den höheren Schichten kolumnäre Markierungen (Pfeile). Balken = 100µm. In den folgenden Untersuchungsstadien PH 1, PH 2 und PH 4 (Abbildungen 25-26) glichen die somatischen Immunmarkierungen denen von PH 0 (Abbildung 24). Über das gesamte TO zeigten Neuronen aller entwickelten und sich entwickelnden tectalen Schichten somatische Immunreaktivität. Während auch hier Neuronen der Schichten 15 bis 13 nahezu uniform in der ventro-dorsal Ausdehnung BDNF-positiv waren, offenbarten sich in den mittleren und superficialen Schichten breite kolumnenartige Lokalisationen BDNF-synthetisierender Ergebnisse (Tectale Expression...) 80 Nervenzellen. Radial orientierte und mit dem Antikörper markierte Fasern waren bei PH 1 im gesamten TO (Abbildung 25), bei PH 2 und PH 4 hingegen deutlicher im caudo-ventralen TO zu Abbildung 25: PH 1 Einen Tag nach dem Schlupf zeigten Neuronen aller tectalen Schichten BDNF Immunreaktivität. Nervenzellen der Schichten 10-15 waren in der dorso-ventralen Ausdehnung gleichermaßen BNDF positiv waren, während Neuronen in den höheren Zellschichten, in Kolumnen angeordnet, BDNF markiert waren (massive Pfeile). Außerdem mit dem Antikörper gegen BDNF markiert waren radiale Fasern ohne zuzuordnendes somatisches Signal (dünne Pfeile). Balken = 100µm. erkennen (Abbildungen 26). Ergebnisse (Tectale Expression...) 81 Abbildung 26: PH 2 – PH 4 In den Altersstadien PH 2 (a) und PH 4 (b) waren Neuronen in allen etablierten tectalen Schichten BDNF-positiv. Balken = 100µm. Ergebnisse (Tectale Expression...) 82 Sieben und vierzehn Tage nach dem Schlupf waren somatische BDNF Markierungen in den tiefen und mittleren Schichten und verstreut in den superficialen Schichten zu beobachten (Abbildung 27). Radial orientierte, BDNF markierte Fasern waren in diesen Altersstadien nahezu ausschließlich auf das ventrale TO begrenzt (Abbildung 27), wobei von vier PH 14 Tieren eines Abbildung 27: PH 7 – PH 14 In den Altersstadien PH 7 (a) und PH 14 (b) waren Neuronen der Schicht 13 intensiv mit dem Antikörper gegen BDNF markiert. Darüber hinaus zeigten Neuronen der tiefen und der mittleren und höheren tectalen Schichten vereinzelt BDNF Immunreaktivität. Radial orientierte BDNFpositive Fasern wurden im ventralen Tectum opticum erkannt (Pfeile). Balken = 100µm. Ergebnisse (Tectale Expression...) 83 keine Fasermarkierungen zeigte. In der adulten Taube hingegen waren BDNF-positive Neuronen in allen tectalen Schichten zu beobachten (Abbildung 28), wobei weder rostro-caudale noch ventro-dorsale Unterschiede Abbildung 28: Adult Im adulten Tectum opticum exprimierten Neuronen in allen tectalen Schichten das Neurotrophin BDNF. Balken = 100µm. offensichtlich wurden. Ergebnisse (Tectale Expression...) 84 3.3.2 Tectale NT-3 Expression Verschiedene tectale Laminae zeigten in den Untersuchungen eine deutliche NT-3 Immunreaktivität, bei welcher sowohl Neuronen der tiefen als auch der mittleren und superficialen Schichten somatisch markiert waren (Abbildungen 29-31). Außerdem wurden in bestimmten Altersstadien mehrere Schichten überspannende, radial orientierte Fasern dargestellt (Abbildungen 30-34). Kennzeichnend für die Expression von NT-3 war ein differentielles Muster, beginnend mit E14 bis zur adulten Taube, wobei NT-3-positive Neuronen vereinzelt bereits zum Zeitpunkt E 14 in den tiefen und mittleren Schichten des TO zu erkennen waren (Abbildung 29). Abbildung 29: E 14 Im Altersstadium E 14 waren schwach NT-3-positive Neuronen in den tiefen tectalen Schichten (Pfeile) zu erkennen. Balken = 100µm. Die Intensität und Häufigkeit der NT-3 Expression nahm ab E 16 deutlich zu (Abbildung 30). Es waren Neuronen der tiefen Schichten, insbesondere der Schicht C (adulte Schicht 13) sowie vereinzelte Zellen der mittleren Schichten NT-3 markiert, wobei die Neuronen der Schicht C anhand ihrer proximal markierten Fortsätze gut zu erkennen waren (Abbildung 30). Außerdem traten ab E 16 radial orientierte Fasern auf, die vom Ventrikelepithel bis zur tectalen Oberfläche reichten (Abbildung 30). Ergebnisse (Tectale Expression...) 85 Abbildung 30: E 16 Im Altersstadium E 16 waren Neuronen der tiefen tectalen Schichten (kleine Pfeile) und vereinzelt auch in den mittleren Schichten (kleine Pfeile) NT-3 immunreaktiv, wobei die proximalen Dendriten der multipolaren Neuronen der Schicht C markiert waren. Außerdem NT-3-positiv waren radiale Fasern, die alle tectalen Schichten vom Ventrikelepithel bis zur pialen Oberfläche des Tectum opticum überspannten (dünne Pfeile). Balken: 100µm. Ab dem Schlupftag (PH 0) wurden neben der Markierung von Neuronen der tiefen tectalen Schichten auch NT-3-positive Neuronen in den mittleren und superficialen Schichten beobachtet (Abbildung 31). Außer diesen somatischen Markierung waren auch die proximalen Fortsätze der Neuronen immunreaktiv, wodurch insbesondere die multipolaren Neuronen der Schicht 13 identifizierbar waren (Abbildung 31). Ein und zwei Tage nach dem Schlupf (PH 1 und PH 2) war die Immunreaktivität gegen NT-3 auf alle tectalen Schichten ausgedehnt, wobei die Schicht 13 im gesamten ventro-dorsalen Verlauf NT-3-positiv war, das Immunsignal in den mittleren und höheren Zellschichten hingegen auf breite Kolumnen begrenzt wurde (Abbildung31-32). Im Altersstadium PH 2 waren in den superficialen Schichten deutliche NT-3-positive Radialzellen, Horizontalzellen und tangential migrierende Neuronen und Radialzellen der mittleren Zellschichten zu erkennen (Abbildung 32). In einer subjektiven Betrachtung der Signalintensität schien ein Maximum am PH 2 erreicht zu sein. NT-3 Ergebnisse (Tectale Expression...) 86 markierte radiale Fasern ohne zuzuordnendes Perikarion waren im Zeitraum PH 0 bis PH 4 im gesamten TO erkennbar (Abbildungen 31-33). Abbildung 31: PH0 – PH 1 In den Altersstadien PH 0 (a) und PH 1 (b) wurden NT-3-positive Neuronen in den tiefen (T), mittleren (M) und superficialen Schichten (S) des Tectum opticums erkannt. Dabei waren die somatischen Markierungen von Neuronen der mittleren und superficialen Schichten auf breite Kolumnen begrenzt (Pfeile), während die tiefen tectalen Schichten in der dorso-ventralen Ausdehnung keine Markierungsunterschiede aufwiesen. Begleitet war das somatische NT-3 Signal von radial verlaufenden Fasermarkierungen vom Ventrikelepithel bis zur pialen Oberfläche. Balken: 100µm. Ergebnisse (Tectale Expression...) 87 Ergebnisse (Tectale Expression...) 88 Abbildung 32: PH2 a) Zwei Tage nach dem Schlupf (PH 2) waren NT-3-positive Neuronen in den tiefen (T), mittleren (M) und superficialen Schichten (S) des Tectum opticum zu erkennen. Die somatischen Markierungen in den mittleren und superficialen Schichten waren auf Kolumnen begrenzt (Pfeile). Radiale Fasern ohne somatisches Signal waren auch in diesem Altersstadium NT-3-positiv (Pfeile). Balken: 100 µm. b) In einer Ausschnittsvergrößerung der mittleren und superficialen Schichten sind NT-3-positive Radialzellen (R) und Horizontalzellen (H) und/oder tangential migrierende Neuronen zu identifizieren. Balken: 30µm. Ergebnisse (Tectale Expression...) 89 Am vierten Tag nach dem Schlupf (PH 4) waren in der Schicht 13 viele, in den mittleren und superficialen Schichten vereinzelte Neuronen NT-3-positiv, welche in Kolumnen angeordnet Abbildung 33: PH 4 Vier Tage nach dem Schlupf (PH 4) waren Neuronen der tiefen tectalen Schichten in der gesamten dorso-ventralen Ausdehnung NT-3-positiv (T). In den mittleren (M) und superficialen Schichten (S) war das Immunsignal auf breite Kolumnen begrenzt, wobei Radialzellen und Horizontalzellen und/oder tangential migrierende Neuronen deutliche Immunreaktivität zeigten (Pfeile). Radiale NT-3-positive Fasern waren noch schwach zu erkennen. Balken: 100µm. waren (Abbildung 33). In den folgenden Altersstadien nahm die Immunreaktivität gegen das Neurotrophin NT-3 stetig ab. Sieben Tage nach dem Schlupf waren NT-3-positive Neuronen in den tiefen tectalen Schichten lokalisiert, wohingegen keine NT-3 markierten Neuronen in den mittleren und superficialen Schichten detektiert werden konnten (Abbildung 34). Bei vierzehn Tage alten Tieren reduzierte sich das Immunsignal weiter. Es waren nur sehr schwach NT-3 markierte Neuronen in der Schicht 13 zu erkennen (Abbildung 34), bevor schließlich bei Adulten keine NT-3 exprimierenden tectalen Neuronen sichtbar waren (Abbildung 34). Ergebnisse (Tectale Expression...) 90 Abbildung 34: PH 7 / PH 14 / Adult In den Altersstadien PH 7 (a), PH 14 (b) und Adult (c) nahm die Immunreaktivität gegen NT-3 im Tectum opticum stetig ab. Bei sieben Tage alten Tauben (a) waren die multipolaren Neuronen der Schicht 13 und vereinzelt Neuronen der Schichten 14 und 15 NT-3-positiv. Vierzehn Tage alte Tiere (b) zeigten noch eine schwache NT-3 Markierung von Schicht 13 Neuronen, während bei Adulten (c) keine NT-3-positiven Neuronen erkannt werden konnten. Balken: 100µm. Ergebnisse (Tectale Expression...) 91 3.3.3 Tectale trk B Expression Die Expression von trk B wurde in Neuronen unterschiedlicher tectaler Schichten mittels der Immunhistochemie nachgewiesen (Abbildungen 35-39). Hierbei zeigten sich deutliche somatische Markierungen von Neuronen der Schichten 13-15, der mittleren Zellschichten (8-12) und der superficialen Schichten 2-7. Außer dem somatischen trk B Signal kennzeichnete insbesondere Neuronen der superficialen Schichten eine intensive Markierung der proximalen Fortsätze, wobei es sich vermutlich um Horizontalzellen und tangential migrierende Neuronen handelte (Abbildung 36). Ebenfalls trk B-positiv waren die proximalen Fortsätze der multipolaren Neuronen der Schicht 13 und der Radialzellen der mittleren Schichten (Abbildung 37). Neben den eindeutig einem Neuronentypen zuzuordnenden Signalen wurden im TO der Taube trk B-positive und radial orientierte Fasern gefunden (Abbildungen 35-40). Insgesamt war die trk B Synthese auf die Entwicklungsphase des TO begrenzt, wobei sich für die verschiedenen Altersstadien spezifische Expressionsmuster des Rezeptors in den diversen Zellschichten ergaben. Beginnend mit E 14 zeigte sich im rostralen TO eine schwache somatische Immunreaktivität in der Schicht C (adulte Schicht 13), vereinzelt in den tiefen Schichten A und B, und darüber hinaus in den mittleren Schichten D bis H (adulte Schichten 12-8) (Abbildung 35). Im caudalen TO war das somatische Signal sehr schwach, aber grundsätzlich mit dem im rostralen TO identisch. Zwei Tage später im Altersstadium E 16 zeigten sich insbesondere im rostralen TO intensive trk B Immunmarkierungen der multipolaren Schicht C Neuronen und vereinzelt von Neuronen der tiefen und mittleren Zellschichten. Im caudalen TO war das Signal vornehmlich auf die dorsalen Schichten A, B und C begrenzt (Abbildung 35). In diesem Altersstadium wurde außerdem eine intensive Markierung radial orientierter Fasern beobachtet (Abbildung 35). Ergebnisse (Tectale Expression...) 92 Abbildung 35: E 14 – E16 a) Im Altersstadium E 14 wurden erste schwach trk B-positive Neuronen (Pfeile) in den tiefen und mittleren Schichten des rostralen Tectum opticum detektiert. b) Die Immunreaktivität gegen den trk B Rezeptor war im Altersstadium E 16 intensiv in den multipolaren Neuronen der Schicht C (C). Vereinzelt waren auch Neuronen der Schichten A und B und der mittleren Schichten trk B markiert (Pfeile). Außerdem zeigten sich radial orientierte, vom Ventrikelepithel bis zur pialen Oberfläche verlaufende, trk B-positive Fasern (Pfeile). Balken: 100µm. Am Schlupftag (PH 0) war im TO der Taube eine intensive trk B Markierung zu erkennen, welche sich über die tiefen und mittleren bis zu den superficialen Schichten erstreckte (Abbildung Ergebnisse (Tectale Expression...) 93 36). Die Neuronen der Schichten 13, 14 und 15 synthetisierten den trk B Rezeptor nahezu gleichmäßig über den gesamten ventro-dorsalen wie auch rostro-caudalen Bereich der mesencephalen Struktur (Abbildung 36). Hingegen zeigte sich eine intensive auf Kolumnen begrenzte Markierung von Neuronen der mittleren und superficialen Schichten, vornehmlich im ventralen und lateralen TO (Abbildung 36). Zum Teil konnten in diesen Schichten Radialzellen und Horizontalzellen und/oder tangential migrierende Neuronen identifiziert werden (Abbildung 36). Auch am PH 0 zeigten radial orientierte Fasern ohne zuzuordnendes somatisches Signal eine deutliche trk B Immunreaktivität, welche sich zumeist im ventro-lateralen TO in Kolumnen ausdrückte (Abbildung 36). Ergebnisse (Tectale Expression...) 94 Ein bis vier Tage nach dem Schlupf (PH 1, PH 2, und PH 4) (Abbildungen 37-38) glich das Bild der trk B Expression dem von PH 0 (Abbildung 36), wobei die Markierungen der Radialzellen und Horizontalzellen der mittleren und superficialen Zellschichten über die gesamte ventro-dorsale Achse des TO eine kolumnäre Verteilung zeigten. Radial orientierte Fasern wurden in diesem Zeitraum ebenfalls über das gesamte TO mit dem Antikörper gegen trk B dargestellt (Abbildungen 37-38). Abbildung 37: PH 1 Einen Tag nach dem Schlupf wurde eine intensive trk B Immunreaktivität in allen tectalen Schichten nachgewiesen. Die Neuronen der Schicht 13 waren in der dorso-ventralen Ausdehnung uniform markiert, wogegen in den mittleren und superficialen Schichten kolumnäre Markierungen sichtbar wurden (Pfeile). Desweiteren waren radiale Fasern im gesamten TO trk B-positiv. Balken: 100µm. Abbildung 36: PH 0 Am Schlupftag (PH 0) waren Neuronen der tiefen (T), mittleren (M) und superficialen Schichten (S) trk B-positiv (a). Balken: 100µm. Auffallend waren die kolumnären Markierungen von Radialzellen und Horizontalzellen und/oder tangential migrierende Neuronen (Pfeile) der mittleren und superficialen Schichten (b). Radial verlaufende trk B-positive Fasern, welche vom Ventrikelepithel bis zur pialen Oberfläche reichten, waren auch im Altersstadium PH 0 zu erkennen. Balken: 30µm. Ergebnisse (Tectale Expression...) 95 Abbildung 38: PH 2 – PH 4 In den Altersstadien PH 2 (a) und PH 4 (b) waren die Neuronen aller tectalen Schichten trk Bpositiv. Deutlich zu erkennen waren die in Kolumnen trk B markierten Radialzellen und Horizontalzellen und/oder tangential migrierende Neuronen der mittleren und superficialen Schichten. Auch radiale trk B-positive Fasern waren in diesen Altersstadien detektierbar (Pfeile). Balken: 100µm. Ergebnisse (Tectale Expression...) 96 Am Tag sieben nach dem Schlupf (PH 7) reduzierte sich das somatische trk B Signal vornehmlich auf Neuronen der Schicht 13, vereinzelt waren aber auch Neuronen der mittleren und superficialen Schichten trk B-positiv (Abbildung 39). In diesem Altersstadium waren trk B markierte und radial orientierte Fasern nahezu ausschließlich im ventro-caudalen TO zu erkennen Abbildung 39:PH 7 Im Tectum opticum sieben Tage alter Tauben waren Neuronen der Schicht 13 immunreaktiv gegen den trk B Rezeptor. Vereinzelt waren darüber hinaus auch Nervenzellen der mittleren und superficialen Schichten mit dem Antikörper markiert. Im ventro-caudalen Bereich dieser mesencephalen Struktur waren zusätzlich radial orientierte trk B-positive Fasern lokalisierbar (Pfeile). Balken: 100µm. (Abbildung 39). Vierzehn Tage nach dem Schlupf (PH 14) war die trk B Immunreaktivität im TO zumeist auf die caudalen Bereiche dieser mesencephalen Struktur eingrenzbar. Neben tectalen Neuronen der Schicht 13 waren auch vereinzelt Neuronen der mittleren und superficialen Schichten trk Bpositiv, welche als Radialzellen und Horizontalzellen und/oder tangential migrierende Neuronen identifizieren wurden (Abbildung 40). Sehr wenige radial orientierte trk B-positive Fasern waren im ventro-caudalen TO lokalisiert. In der adulten Taube waren keine trk B-positive Neuronen oder Fasern zu beobachten (Abbildung 40). Ergebnisse (Tectale Expression...) 97 Abbildung 40: PH 14 – Adult a) In den immunhistochemischen Untersuchungen zur Expression des trk B Rezeptors wurden im caudalen Tectum opticum somatische Markierungen von Neuronen der Schicht 13 erkannt, zum Teil begleitet von kolumnären Markierungen von Nervenzellen in den mittleren und superficialen Schichten (Pfeile). Sehr schwach trk B-positiv waren auch radial orientiert Fasern im caudalen Tectum opticum. b) In der adulten Taube wurde keine trk B Immunreaktivität im Tectum opticum erkannt. Balken: 100µm. Ergebnisse (Tectale Expression...) 98 3.3.4 Tectale trk C Expression In den tiefen, mittleren und superficialen Schichten des TO der Taube wurden trk C synthetisierende Neuronen beobachtet, wobei das Immunsignal zumeist auf das Perikarion der Neuronen begrenzt war (Abbildungen 41-44). In einem Zeitfenster von E 16 bis PH 4 wurden darüber hinaus radial orientierte Fasern beobachtet, welche zum Teil über mehrere Schichten vom Ventrikelepithel bis zur tectalen Oberfläche verfolgt werden konnten (Abbildungen 41-43). Die Häufigkeit und Intensität dieser Fasern war aber geringer als in den immunhistochemischen Untersuchungen zu BDNF, NT-3 und trk B (Punkt 3.3.1-3.3.3). Während der tectalen Entwicklung zeigten sich Unterschiede im Expressionsmuster von trk C. Im Altersstadium E 14 wurde eine schwache Immunmarkierung der tiefen tectalen Schichten, insbesondere der Schicht C (adulte Schicht 13), erfaßt (Abbildung 41). Sehr vereinzelt waren zu diesem Zeitpunkt auch Neuronen der mittleren Schichten trk C-positiv. Zwei Tage später, im Embryonalstadium E 16, waren deutlich trk C synthetisierende Nervenzellen in der Schicht C auszumachen (Abbildung 41). Auffallend intensiv markiert waren die Somata und proximalen Dendriten von Schicht C Neuronen im dorsalen TO. Zudem waren verstreut einzelne Neuronen der mittleren Zellschichten trk C-positiv. Bezüglich der trk C Expression zwischen E 14 und E 16 war ein subjektiv stärkeres Signal im linken versus dem rechten TO bemerkenswert. Ab dem Schlupftag PH 0 dehnte sich das trk C Immunsignal von den tiefen über die mittleren bis zu den superficialen Schichten aus (Abbildung 42). Während trk C synthetisierende Neuronen der Schicht C über die gesamte ventro-dorsale Ausdehnung gleichermaßen detektierbar waren, zeigten trk C exprimierende Neuronen der mittleren und superficialen Schichten ein kolumnäres Auftreten (Abbildung 42). Einen Tag nach dem Schlupf (PH 1) glich das Expressionsmuster des high-affinity Neurotrophin Rezeptors in der tectalen Expression dem beschriebenen Muster von PH 0 (Abbildung 42). Außer den somatischen Markierungen wurden radial orientierte, zumeist schwach trk C-positive Fasern in den Altersstadien E 16 bis PH 1 in schmalen Kolumnen detektiert (Abbildungen 41-42). Ergebnisse (Tectale Expression...) 99 Abbildung 41: E 14 - E 16 In den embryonalen Untersuchungsstadien E 14 (a) und E 16 (b) wurde eine moderate Immunreaktivität gegen den trk C Rezeptor in der Schicht C (C) und vereinzelt in den mittleren Zellschichten erkannt (kleine Pfeile). Begleitet waren diese somatischen trk C Signale von einer trk C-positiven Markierung radialer Fasern (dünne Pfeile). Balken: 100µm. Ergebnisse (Tectale Expression...) 100 Ergebnisse (Tectale Expression...) 101 Abbildung 42: PH 0 – PH 1 Ab dem Schlupftag PH 0 (a) waren Neuronen in den tiefen (T), mittleren (M) und superficialen Schichten (S) trk C-positiv. Auch einen Tag nach dem Schlupf (b) zeigten die Neuronen dasselbe trk C Expressionsmuster wie am Schlupftag. In beiden Altersstadien waren Neuronen der Schicht 13 in der gesamten dorso-ventralen Ausdehnung uniform, in den mittleren und superficialen Schichten hingegen kolumnär markiert. Schwach trk C-positive radiale Fasern wurden im gesamten Tectum opticum erkannt (Pfeile). Balken: 100µm. Ergebnisse (Tectale Expression...) 102 Zwei und vier Tage nach dem Schlupf (PH 2; PH 4) waren Neuronen der superficialen Schichten noch vereinzelt kolumnär trk C-positiv, während die multipolaren Neuronen der Schicht 13 wie auch Neuronen in den Schichten 14 und 15 deutliche trk C Immunreaktivität zeigten (Abbildung 43). Vereinzelte radiale trk C-positive Fasern waren zumeist im caudalen Tectum opticum zur erkennen (Abbildung 43). Ergebnisse (Tectale Expression...) 103 In den folgenden Altersstadien PH 7 bis PH 14 waren vornehmlich Neuronen der tiefen tectalen Schichten trk C markiert (Abbildungen 44-45). Auffallend waren die intensiv trk C-positiven Neuronen der Schicht 13, begleitet von einer Vielzahl von kleinen Neuronen in den tiefen Schichten 14 bis 15 (Abbildung 44). Vereinzelt waren auch in diesen Altersstadien im caudalen Tectum opticum Neuronen der superficialen und mittleren Zellschichten mit dem Antikörper gegen trk C markiert (Abbildung 45). In den adulten Tauben waren immunhistochemisch keine trk Cpositiven Neuronen im Tectum opticum zu beobachten, mit Ausnahme einer sehr schwachen Hintergrundfärbung (Abbildung 45). Abbildung 44: PH 7 Sieben Tage nach dem Schlupf waren multipolare Neuronen der Schicht 13 (13) und kleine Neuronen in den tiefen Schichten 14 und 15 trk C-positiv. Vereinzelt waren im caudalen Tectum opticum Neuronen der mittleren und superficialen Schichten trk C markiert (Pfeile). Balken: 100µm. Abbildung 43: PH 2 - PH 4 In den Altersstadien PH 2 (a) und PH 4 (b) waren die Neuronen der Schicht 13 intensiv trk Cpositiv (13), während Immunmarkierungen mit dem Antikörper gegen den trk C Rezeptor in den mittleren (M) und superficialen Schichten (S) kolumnär auf distinkte Bereiche begrenzt waren (Pfeile). Im caudalen Tectum opticum wurden vereinzelte trk C-positive Fasern detektiert (Pfeile). Balken: 100µm. Ergebnisse (Tectale Expression...) 104 Ergebnisse (Tectale Expression...) 105 Abbildung 45 PH 14 – Adult a) Im Tectum opticum vierzehn Tage alter Tauben wurden trk C-positive Neuronen in den Schichten 13 bis 15 und caudal vereinzelt in den mittleren (M) und superficialen Schichten (S) erkannt. Auch in diesem Altersstadium waren es in den tiefen tectalen Schichten multipolare Neuronen der Schicht 13 und kleine Neuronen der Schichten 14 bis 15, welche den trk C Rezeptor exprimierten (Pfeile). b) Im adulten Tectum opticum wurde eine sehr schwache trk C Markierung erkannt, die als Hintergrund gewertet wurde. Balken: 100µm. Ergebnisse (Tectale Expression...) 106 In der Tabelle 8 werden die tectalen Expressionsmuster der Neurotrophine BDNF und NT-3 sowie der korrespondierenden high-affinity Rezeptoren trk B und trk C zusammengefaßt. In den vorgestellten Untersuchungen zeigten sich erste immun-positive Signale der Proteine im Altersstadium E 14, woraufhin in den weiteren untersuchten Altersstadien generell ein qualitativer und quantitativer Anstieg der Expression dieser Proteine zu beobachten war. Unterschiedlich zeigte sich aber das Expressionsmuster in adulten Tauben. Während das Neurotrophin BDNF auch in adulten Tieren in allen tectalen Schichten prominent exprimiert wurde, so konnte eine NT-3 Synthese nur bis PH 7, beziehungsweise sehr schwach bis PH 14 in den tiefen tectalen Schichten erkannt werden. Die beiden Neurotrophin-Rezeptoren trk B und trk C wurden in der embryonalen und juvenilen Taube gleichermaßen deutlich exprimiert, im adulten Tier hingegen konnten diese Proteine nicht nachgewiesen werden. Radial zur tectalen Oberfläche orientierte Fasern, welche intensive Immunmarkierungen gegen BDNF, NT-3, trk B und trk C zeigten, wurden insbesondere in den juvenilen Altersstadien prominent dargestellt. Tabelle 8: Zeitlicher Verlauf der tectalen Expression von BDNF, NT-3, trk B und trk C S = superficiale Schichten (2-7), M = mittlere Schichten (8-12), T = tiefe Schichten (13-15) Markierungsintensität: + = moderat; ++ = intensiv; +++ = sehr intensiv; - = nicht zu erkennen. Die grauen Schraffierungen zeigen mehrere Schichten überspannende, immun-positive radiale Fasern in den entsprechenden Altersstadien an. E 14 E 16 S BDNF PH 4 PH 7 PH 14 Adult ++ ++ ++ ++ ++ ++ ++ - +++ +++ +++ +++ +++ +++ ++ T + ++ +++ +++ +++ +++ +++ +++ ++ + ++ ++ + - - - M - + ++ ++ +++ + - - - T (+) ++ +++ +++ +++ ++ + (+) - ++ ++ ++ + (+) (+) - M (+) + ++ ++ ++ ++ (+) (+) - T + ++ +++ +++ +++ ++ ++ + - ++ ++ + + + (+) - ++ ++ ++ + + (+) - S trk C PH 2 - S trk B PH 1 M S NT-3 PH 0 M - + Ergebnisse (Tectale Expression...) T + ++ 107 +++ +++ +++ ++ ++ + - Auch im TO der Taube deuten die Ergebnisse zur Expression von BDNF, NT-3, trk B und trk C auf neurotrophe Mechnismen innerhalb dieser mesencephalen Struktur hin. Gegenüber der Retina waren die Antigene aber bereits im embryonalen TO zu detektieren, daß heißt vor der mit dem Schlupftag einsetzenden massiven Lichtstimulation. Wenngleich auch die embryonale Taube durch die Eischale dringendes Licht perzipieren kann, so deutet das in der vorliegenden Arbeit erkannte Expressionsmuster auf intra-tectale neurotrophe Mechanismen hin, die möglicherweise in der embryonalen Taube nicht mittelbar durch den epigenetischen Faktor Licht gesteuert sind, während in der juvenilen Tauben solche Prozesse denkbar sind. Zwar innervieren erste retinale Fasern ab E 14 das TO der Taube (Manns & Güntürkün, 1997), aber die Expression der Neurotrophine und Neurotrophin-Rezeptoren beginnt zunächst in den nur bedingt retinorezipienten tiefen und mittleren tectalen Schichten während der embryonalen Altersstadien. Erst mit dem Schlupftag, und einer damit einsetzenden massiven Lichtstimulation, dehnt sich die Expression von BDNF, NT-3, trk B und trk C auf die superficialen, retino-rezipienten Schichten aus. Es ist daher wahrscheinlich, daß ab dem Schlupftag der Tiere der epigenetische Faktor Licht über neurotrophe Wechselwirkungen die retino-tectalen Verschaltungen beeinflußt. Wenngleich die Bedeutung retino-tectaler neurotropher Wechselwirkungen mit dem Schlupftag zunimmt, so sind auch in den juvenilen Altersstadien intra-tectale neurotrophe Mechnismen zur Etablierung der tectalen Morphologie anzunehmen. Die Untersuchungen zeigten neben den eindeutig zu charakterisierenden somatischen Markierungen auch Neurotrophin und Neurotrophin-Rezeptor positive Fasern im TO sich entwickelnder Tauben. Eine genaue Charakterisierung dieser radial zu tectalen Oberfläche verlaufenden, mehrere Zellschichten überspannenden Fasern war zunächst nicht möglich. Möglicherweise handelte es sich um immunpositive Dendriten tectaler Neuronen oder in das TO einziehenden retinale Ganglienzellaxone. Die wahrscheinlichste Hypothese war aber, daß es sich bei den dargestellten Fasern, die in allen tectalen Schichten vorkamen, um Radialglia handelte. Radialglia fungieren als Leitstrukturen der Zellmigration im sich entwickelnden Nervengewebe (Rakic, 1971). Bei der Taube dauert die Etablierung der tectalen Schichtung bis nach dem Schlupf an (Manns & Güntürkün, 1997). Möglicherweise deuten die mehrere Zellschichten überspannenden Neurotrophin / Neurotrophin-Rezeptor positiven radialen Fasern auf eine Beteiligung dieser Proteine bei der Zellmigration hin. Ergebnisse (Tectale Expression...) 108 Ausgehend von dieser Arbeitshypothese wurden in Kolokalisationsuntersuchungen von BDNF, NT-3, trk B und trk C mit dem für Radialglia spezifischen Intermediärfilament Vimentin, mögliche neurotrophe Wirkungsketten zwischen Radialglia und migrierenden Neuronen erfaßt (siehe Punkt 3.5), die eine Bedeutung von Neurotrophinen als intra-tectale Signale während der Entwicklung in der juvenilen Taube zeigten. Die fehlende Expression von trk B und trk C Rezeptoren im TO adulter Tauben zeigt darüber hinaus, daß die in der adulten Retina exprimierten Neurotrophine BDNF und NT-3 vermutlich nicht als anterograde Signale im retino-tectalen System eingesetzt werden. Im retino-tectalen System adulter Tauben kann lediglich BDNF als retrograder Signalstoff vom TO ausgeschüttet werden, um über den von retinalen Ganglienzellen exprimierten trk B Rezeptor zu wirken. Eine genauere Identifizierung BDNF-vermittelter trophischer Signalflüsse im retino-tectalen System adulter Tauben gelang durch ultrastrukturellen Untersuchungen (siehe Punkt 3.4). Ergebnisse (Ultrastrukturelle Untersuchungen...) 3.4 106 Ultrastrukturelle Untersuchungen im Tectum opticum adulter Tauben In der adulten Taube scheinen intra-tectale neurotrophe Mechnismen eine untergeordnete Rolle zu spielen, da lediglich BDNF exprimiert wird, nicht aber NT-3 und die korrespondierenden Rezeptoren trk B und trk C. BDNF könnte in der adulten Taube als möglicher retrograder Signalstoff für retinale Ganglienzellen fungieren, welche den trk B Rezeptor massiv synthetisieren. Ebenso denkbar ist der anterograde Signalfluß von BDNF im tectofugalen System zum Nucleus rotundus oder weiteren Zielgebieten tectaler Efferenzen. Um diese möglichen trophischen Signalwege in adulten Tauben genauer zu erfassen, wurde in ultrastrukturellen Untersuchungen die Morphologie dieser mesencephalen Struktur näher charakterisiert und anschließend immunhistochemisch die genaue Lokalisation des Neurotrophins BDNF untersucht. Morphologisch waren die superficialen Schichten 2 bis 7 durch die Somata der Horizontalzellen und Radialzellen sowie parallel und radial zur tectalen Oberfläche verlaufende Dendriten gekennzeichnet. In diesen Schichten waren eine Vielzahl an Synapsen, vermutlich zumeist von einziehenden Axonen retinaler Ganglienzellen, zu erkennen, die auf den Dendriten der superficialen Schichten terminierten. In den mittleren Zellschichten waren zahlreiche radiale Dendriten und Somata identifizierbar, die keine synaptische Verbindungen aufwiesen. In der tiefen tectalen Schicht 13 prominent dargestellt wurden die großen mutlipolaren Neuronen, auf deren Dendriten eine Vielzahl von axo-somatischen Synapsen terminierten. 3.4.1 Rekonstruktion der tectalen Schichtung im Semidünnschnitt In der fotografischen Rekonstruktion eines Semidünnschnittes der tectalen Morphologie waren einzelne Charakteristika der Zellschichtung zu erkennen (Abbildung 46-47). Weiß erscheinende Löcher mit runder, länglicher oder ovaler Form stellten Blutgefäße im TO dar. Neuronale Strukturen in der lichtdichten Schicht 1 waren die myelinisierten Axone retinaler Ganglienzellen, welche in das Tectum opticum einzogen. Die folgenden Schichten 2 bis 7 waren durch zahlreiche Somata sowie dünne parallel und radial zur tectalen Oberfläche verlaufenden Dendriten gekennzeichnet, wobei die Zelldichte in den Schichten 2, 3, 4 und 6 hoch, in den Schichten 5 und 7 gering war. Die mittleren Zellschichten 8-12 zeigten eine höhere Zelldichte als die superficialen Schichten, mit einem Maximum in den Schichten 8 und 10. Neben den Somata der Nervenzellen Ergebnisse (Ultrastrukturelle Untersuchungen...) 107 waren zahlreiche zumeist radial orientierte Dendriten auszumachen. Vereinzelt waren außerdem Axone an der lichtdichten Myelinisierung zu identifizieren. Auf Grund ihrer Größe prominent dargestellt waren die Neuronen der Schicht 13, deren proximale Dendriten ebenfalls im Semidünnschnitt zu erkennen waren. Ihre Somata waren zirka dreimal größer als die der mittleren und superficialen tectalen Schichten. Auch in dieser tiefen tectalen Zellschicht waren zahlreiche Dendriten und myelinisierte Axone zu erkennen. In der folgenden Schicht 14 dominierten myelinisierte Axone das Bild. Ergebnisse (Ultrastrukturelle Untersuchungen...) 108 Abbildung 46: Semidünnschnitt der superficialen und mittleren Zellschichten Im Semidünnschnitt des dorsalen Tectum opticum adulter Tauben waren die einzelnen Zellschichten gegeneinander abgrenzbar (Schichten 1 bis 12). Neben den weiß erscheinenden Anschnitten von Blutgefäßen waren die myelinisierten Axone der Schicht 1 gut zu erkennen. Die Dichte an Nervenzellen war hoch in den superficialen Schichten 2,3,4 und 6 und ebenso in den mittleren Zellschichten 9 bis 11. Zum Teil waren in den superficialen Schichten parallel und radial orientierte Dendriten, in den mittleren Schichten radial orientierte Dendriten zu erkennen (kleine Pfeile). In den mittleren Schichten zeigten sich außerdem vereinzelt myeliniserte Axone (dünne Pfeile). Balken: 100µm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 109 Abbildung 47: Semidünnschnitt der tiefen tectalen Zellschichten In der tiefen tectalen Schicht 13 waren die multipolaren Neuronen anhand ihrer Somagröße und angeschnitten Dendriten (Pfeile) gut zu identifizieren. In dieser tectalen Schicht waren außerdem zahlreiche myelinisierte Axone auszumachen. Die folgende Schicht 14 zeigte vereinzelt Nervenzellen, zum Großteil aber myelinisierte Axone. Balken: 100µm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 110 3.4.2 Ultrastrukturelle Lokalisation von BDNF Im adulten TO der Tauben wurden ultrastrukturelle Untersuchungen zur Lokalisation des Neurotrophins BDNF mit Hilfe eines Gold-markierten sekundären Antikörpers gegen Ratten IgG durchgeführt. Hierbei zeigte sich eine schwächere Immunreaktivität als in den lichtmikroskopischen Untersuchungen, wobei die Goldmarkierungen zumeist auf die äußeren Bereiche der Ultradünnschnitte begrenzt blieben. Dennoch erschien das Immunsignal eindeutig und konsistent in verschiedenen Präparaten. Die ultrastrukturellen Darstellungen der tectalen Morphologie beziehen sich auf Kontrolltiere, die eine wesentlich bessere Morphologieerhaltung zeigten, als die Tauben nach der immunhistochemischen Prozedur, bei welcher die Zellmembran mit Hilfe von Triton X 100 permeabilisiert wurde. Ultrastrukturell waren in der tectalen Schicht 1 zahlreiche myelinisierte Axone zu erkennen (Abbildung 48). Bei hoher elektronenmikroskopischer Auflösung konnten einzelne Myelinlamellen sowie cytoskelettale Mikrotubuli und Neurofilamente identifiziert werden, nicht aber ein BDNFpositives Signal. In den superficialen Schichten 3 bis 5 waren myelinisierte Axone, Neuronen und radial und parallel zur tectalen Oberfläche verlaufende Dendriten zu erkennen, wobei letztere bei hoher elektronenmikroskopischer Vergrößerung zahlreiche Synapsen aufwiesen (Abbildung 49). Immunhistochemisch wurde in diesen tectalen Schichten das Neurotrophin ausschließlich postsynaptisch detektiert (Abbildung 50). Auf der präsynaptischen Seite stellten sich zahlreiche Vesikel ohne zu erkennende BDNF Immunreaktivität dar (Abbildung 50). Die folgende superficiale Schicht 6 war durch parallel nebeneinander angeordnete Somata gekennzeichnet, an denen radial orientierte Dendriten ohne synaptische Kontakte vorbeiliefen (Abbildung 51). Immunhistochemisch wurde in den Dendriten der superficialen und mittleren Zellschichten das Neurotrophin BDNF in enger Lokalisation zu Elementen des Cytoskeletts, vermutlich Mikrotubuli, nachgewiesen (Abbildung 51). Die tectalen Schicht 13 Neuronen zeigten sich elektronenmikroskopisch etwa dreimal größer als die Neuronen der superficialen Schichten (Abbildung 52). Sehr nah am Soma waren myelinisierte Axone sowie prominente Dendriten der Schicht 13 Neuronen mit zahlreiche Synapsen zu erkennen, die deutliche präsynaptische Vesikel erkennen ließen (Abbildung 52). In den für die Elektronenmikroskopie immunhistochemisch aufbereiteten Präparaten konnte das Neurotrophin in dieser Schicht an den gut ausgeprägten Synapsen nicht nachgewiesen werden (Abbildung 53). Ergebnisse (Ultrastrukturelle Untersuchungen...) 111 Abbildung 48: Ultrastruktur der tectalen Schicht 1 Die Abbildung (a) zeigt zahlreiche in der tectalen Schicht 1 einziehende retinale Axone im Querschnitt sowie einen längs geschnitten Dendriten einer tectalen Nervenzelle (Vergrößerung: 7260-fach). Balken: 1000nm. In der Ausschnittsvergrößerung wurden die Myelinlamellen dieser Axone (weiße Pfeile) und das Cytoskelett sichtbar, wobei Mikrotubuli und Neurofilamente dargestellt wurden (dünne Pfeile) (Vergrößerung: 231000-fach). In dieser Schicht konnte ultrastrukturell kein BDNF-positives Signal detektiert werden. Balken: 45nm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 112 Abbildung 49: Ultrastruktur der superficialen tectalen Schichten a) In den superficialen tectalen Schichten 3 bis 5 waren Neuronen (Pfeil) sowie radiale (R) und parallel (P) zur tectalen Oberfläche verlaufende Dendriten zu erkennen, die synaptische Kontakte (Pfeile) zeigten (Vergrößerung: 7269-fach). Balken: 1000nm. b) Ausschnittsvergrößerung eines radialen Dendriten mit synaptischem Kontakt (Vergrößerung: 202500-fach). Balken: 50nm. c) Ausschnittsvergrößerung eines parallelen Dendriten mit synaptischem Kontakt (Vergrößerung: 243000-fach). Balken: 40nm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 113 Abbildung 50: Postsynaptische Lokalisation von BDNF In der Schicht 5 wurde BDNF an axo-dendritischen Kontaktstellen detektiert. Die 10nm großen Goldpartikel (G: Pfeile) zeigten eine postsynaptische ultrastrukturelle Lokalisation des Neurotrophins. Präsynaptisch wurden Vesikel der Synapse erkannt (V: Pfeile), jedoch ohne ein positives BDNF Signal. Elektronendicht stellte sich der synaptische Spalt dar (S) (Vergrößerung: 243000-fach). Balken: 40nm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 114 Abbildung 51: Ultrastruktur der Schicht 6 a) In der tectalen Schicht 6 sind zahlreiche Somata (S) dicht nebeneinander lokalisiert, an denen radial zur tectalen Oberfläche orientierte Dendriten vorbeiziehen (R) (Vergrößerung: 7260fach). Balken: 1000nm. b) In den immunhistochemischen Untersuchungen zeigte sich, daß das Neurotrophin BDNF in den Dendriten der superficialen und mittleren tectalen Schichten lokalisiert war (Peile), und zwar dicht an den cytoskelettalen Mikrotubuli. (Vergrößerung: 164000-fach). Balken: 60nm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 115 Abbildung 52: Ultrastruktur der tectalen Schicht 13 a) In der tectalen Schicht 13 waren große Neuronen (N) lokalisiert, die von vielen Dendriten (D) und Axonen (A) umgeben waren (Vergrößerung: 7260-fach). Balken: 1000nm. b) Auf den Dendriten in der Schicht 13 terminierten zahlreiche Axone mit Synapsen (S: Pfeil), wobei präsynaptisch Vesikel zu erkennen waren (Vergrößerung: 231000-fach). Balken: 40nm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 116 Abbildung 53: Axo-dendritische Synapse in der tectalen Schicht 13 In der Schicht 13 lokalisierte axo-dendritische Syapsen zeigten präsynaptisch Vesikel (V: Pfeil), die vermutlich kein BDNF enthielten. Ebenso wurde auf der postsynaptischen dendritischen Seite (D) kein BDNF-positives Signal detektiert. (Vergrößerung: 172200-fach). Balken: 60nm. Ergebnisse (Ultrastrukturelle Untersuchungen...) 117 Die ultrastrukturellen Untersuchungen deuten auf die komplexe synaptische Organisation des Tectum opticum der Taube hin, mit zahlreichen Synapsen in den retino-rezipienten superficialen Schichten und ebenfalls prominenten axo-somatischen synaptischen Kontakten auf den multipolaren Neuronen der Schicht 13. Mit Hilfe der Immunogold-Methode wurde das Neurotrophin BDNF postsynaptisch in den superficialen tectalen Schichten nachgewiesen ebenso wie in den radial orientierten Dendriten der mittleren tectalen Schichten. Die axo-somatischen Synapsen auf den multipolaren Schicht 13 Neuronen hingegen zeigten keine BDNF Markierungen. Diese Ergebnisse zeigen, daß in adulten Tauben BDNF sehr wahrscheinlich als retrograder Botenstoff des mesencephalen TO für retinale Ganglienzellen fungiert, welche den korrespondierenden trk B Rezeptor exprimieren. Möglicherweise ist BDNF an der ständigen Feinanpassung der retino-tectalen Verknüpfungen beteiligt, wobei zum Beispiel die synaptische Effizienz in den retino-rezipienten Schichten des TO reguliert wird (Ebadi et al., 1997). Eine Feinanpassung der synaptischen Morphologie ist dabei vermutlich nicht auf die in den superficialen Schichten gelegenen Neuronen begrenzt, sondern erfolgt darüber hinaus auch an den synaptischen Verbindungen zu Neuronen der mittleren und tiefen tectalen Schichten. Auch diese erhalten direkten visuellen Eingang über ihre bis in die superficialen Schichten reichenden radialen Dendriten (Hardy et al., 1985). Da auch Neuronen der mittleren und tiefen tectalen Schichten BDNF exprimieren (siehe Punkt 3.2), und das Neurotrophin anhand der hier gewonnen Ergebnisse entlang der Dendriten in die retino-rezipienten Schichten transportiert wird, ist auch für diese Neuronen der retrograde Signalfluß von BDNF zu den retinalen Ganglienzellen anzunehmen. Inwieweit BDNF auch anterograd zu den Zielgebieten tectaler Projektionen transportiert wird, kann basierend auf den gegenwärtigen Daten nicht abschließend geklärt werden, wenngleich auf Grund der fehlenden Lokalisation von BDNF in den Axonen tectaler Neuronen eine anterograde Signalfortleitung nicht wahrscheinlich ist. Insgesamt liefern die ultrastrukturellen Untersuchungen zur Lokalisation von BDNF deutliche Hinweise für den retrograden trophischen Signalfluß vom TO zur Retina, während intratectale BDNF vermittelte Wechselwirkungen in der adulten Taube vermutlich nicht vorliegen. Ergebnisse (Kolokalisationsuntersuchungen...) 118 3.4 Kolokalisationsuntersuchungen im Tectum opticum Die Ergebnisse der immunhistochemischen Untersuchungen zeigten zahlreiche immun-positive, radial orientierten Fasern im TO der juvenilen Taube (siehe Punkt 3.2). Eine genaue Zuordnung dieser Fasern als retinale Ganglienzellaxone, Dendriten tectaler Neuronen oder tectaler Radialglia war zunächst nicht möglich, gleichwohl die Morphologie dieser mehrere Zellschichten überspannenden Fasern eine Beschreibung dieser als Radialglia wahrscheinlich machte. Die Frage nach der Herkunft dieser Fasern war für die Interpretation intra-tectaler trophischer Mechanismen jedoch von zentraler Bedeutung. Würde es sich um Radialglia handeln, so wäre das ein erstmaliger Beweis für neurotrophe Signalwege zwischen migrierenden Neuronen und Radialglia. Damit einhergehend wären weitere wichtige Bausteine der Etablierung der tectalen Morphologie erfaßt, deren morphologische Asymmetrien während der Entwicklungsphase des TO angelegt werden. Zur näheren Charakterisierung der radial orientierten Neurotrophin und trk-Rezeptor positiven Fasern im TO wurden Fluoreszenz-Doppelmarkierungen mit Vimentin in den Altersstadien PH 0, PH 2, PH 4, PH 14 und in adulten Tieren durchgeführt. Die Altersstadien wurden so gewählt, daß eine Aussage über die Identität der beschriebenen immun-positiven radialen Fasern möglich wurde. Vimentin ist ein Intermediärfilament im Cytoskelett von Neuronen, welches spezifisch in Radialglia-Zellen exprimiert wird. In der gegenwärtigen Untersuchung diente der Antikörper gegen Vimentin zur spezifischen Markierung von Radialglia-Zellen im Tectum opticum der Taube während der Entwicklung der tectalen Schichtung. Hierbei war die Vimentin Immunreaktivität deutlich sichtbar in den Altersstadien PH 0 bis PH 14, wobei radial zur tectalen Oberfläche verlaufenden Fasern mit dem Antikörper dargestellt wurden (Abbildung 54-60). Die Immunreaktivitäten gegen die einzelnen Neurotrophine und trk-Rezeptoren waren mit den beschriebenen Ergebnissen unter Punkt 3.2 identisch, in der Intensität der Markierung jedoch etwas schwächer. In den superficialen und mittleren tectalen Schichten waren zumeist Fasern, in den tiefen tectalen Schichtend darüber hinaus auch viele Somata von Nervenzellen immunhistochemisch markiert. Bei den somatischen Signalen handelte sich um große multipolare Neuronen der Schicht 13 und kleinere migrierende Neuronen, welche insbesondere in den Schichten 14 und 15 sichtbar wurden. Bei den radialen Fasern handelte sich um die Fortsätze der Ergebnisse (Kolokalisationsuntersuchungen...) 119 Radialglia Zellen, welche in der adulten Taube nicht vorhanden waren. Die zum Teil tangential verlaufenden Fasern in den superficialen Schichten waren vermutlich Markierungen der Fortsätze von Horizontalzellen oder auch von tangential migrierenden Neuronen. Die Darstellungsweisen der Immunmarkierungen mittels Fluoreszenz-Doppelbelichtungen oder der konfokalen Lasermikroskopie richtete sich zum einen nach der Signalintensität, und zum anderen nach der Deutlichkeit der Darstellung. Grundsätzlich war das Fluoreszenzsignal im Altersstadium PH 14 schwächer, so daß insbesondere mit Hilfe des konfokalen Lasermikroskops ein klares Immunsignal erkannt wurde. In den Altersstadien PH 0 bis PH 4 war hingegen das Fluoreszenzsignal in den Vibratomschnitten so intensiv, daß in den FluoreszenzDoppelbelichtungen zum Teil keine deutlich abgrenzbaren Strukturen zu erkennen waren, mit Hilfe der konfokalen Lasermikroskopie jedoch auch hier scharfe Darstellungen der Immunmarkierungen gelangen. 3.5.1 BDNF – Vimentin In den Kolokalisationsuntersuchungen der beiden Proteine BDNF und Vimentin war das Fluoreszenzsignal eindeutig und zum Teil überlagert. Die BDNF positiven Fasermarkierungen reichten in den untersuchten Altersstadien PH 0 bis PH 14 vom Ventrikelepithel bis zu den superficialen Schichten, wobei in den tiefen tectalen Schichten BDNF markierte Somata von multipolaren Schicht 13 Neuronen und kleinere migrierende Neuronen in den Schichten 14 und 15 sichtbar wurden (Abbildung 54). In den Fluoreszenz-Doppelbelichtungen von BDNF und Vimentin wurde eine Koexpression der beiden Antigene deutlich, bei welcher mit beiden Antikörpern markierte Fasern alle tectalen Zellschichten überspannten (Abbildung 54). Demnach synthetisierten die Vimentin markierten Radialgliazellen auch das Neurotrophin BDNF. Insbesondere mit Hilfe der konfokalen Lasermikroskopie wurde die enge Beziehung der kleinen, migrierenden BDNF positiven Neuronen in den tiefen tectalen Schichten zu den Radialglia-Zellen deutlich (Abbildung 54f), während in den superficialen Schichten in den untersuchten Altersstadien zumeist radiale Fasern markiert waren (Abbildung 54e). Ergebnisse (Kolokalisationsuntersuchungen...) 120 Abbildung 54: Kolokalisation von BDNF und Vimentin Im Altersstadium PH 2 wurde in Fluoreszenz-Doppelbelichtungen eine Koexpression von BDNF und Vimentin in radialen Fasern der superficialen tectalen Schichten erkannt (a=BDNF; b=Vimentin). Ebenso exprimierten radiale Fasern in den tiefen tectalen Schichten BDNF und Vimentin (c=BDNF, d=Vimentin). Außerdem wurden kleine, BDNF-positive Neuronen in den tiefen Schichten erkannt, die in enger räumlicher Beziehung zu den Vimentin und BDNF-positiven radialen Fasern lagen (Pfeile). Im Altersstadium PH 14 wurde mit Hilfe der konfokalen Mikroskopie das Muster einer Koexpression der beiden Proteine in radialen Fasern der superficialen Schichten bestätigt (e), wobei in den tiefen tectalen Schichten kleine BDNF synthetisierende Neuronen in enger Beziehung zu den Vimentin und BDNF-positiven radialen Fasern erkannt wurden (f). Farbkodierung: grün = BDNF; rot = Vimentin; gelb = Koexpression. Ergebnisse (Kolokalisationsuntersuchungen...) 121 3.5.2 NT-3 – Vimentin Die Fluoreszenzsignale von NT-3 und Vimentin waren in den in den Altersstadien PH 0 bis PH 14 zum Teil übereinander gelagert, wodurch eine Koexpression der beiden Antigene dargestellt wurde (Abbildungen 55-56). Das somatische NT-3 Signal entsprach dem unter Punkt 3.2 vorgestellten Muster, wobei auch in den fluoreszenzmikroskopischen Bildern tangential zur tectalen Oberfläche verlaufende Fasern in den superficialen tectalen Schichten detektierbar waren (Abbildung 55). Darüber hinaus waren die großen multipolaren Neuronen der Schicht 13 auf Grund ihrer NT-3 positiven multipolaren Dendritenstruktur zu identifizieren (Abbildung 56). Neben diesen somatischen Markierungen wurden radial orientierte NT-3-positive Fasern offenbar, welche vom Ventrikelepithel bis in die superficialen Schichten reichten (Abbildungen 55-56). In Fluoreszenz-Doppelbelichtungen in den Altersstadien PH 2 und PH 4 zeigte sich, daß diese NT-3 markierten Fasern auch das Intermediärfilament Vimentin exprimierten (Abbildungen 55-56). Besonders im Altersstadium PH 0 wurde in den konfokalen lasermikroskopischen Darstellungen die Dichte der Vimentin und NT-3 synthetisierenden Radialglia in den tiefen tectalen Schichten deutlich (Abbildung 56a,b). Ergebnisse (Kolokalisationsuntersuchungen...) 122 Abbildung 55: Kolokalisation von NT-3 und Vimentin Im Altersstadium PH 2 wurden in den superficialen und mittleren tectalen Schichten Koexpressionen von NT-3 (a) und Vimentin (b) in radialen Fasern erkannt. In den superficialen Schichten waren außerdem vereinzelte parallel zur tectalen Oberfläche verlaufende Fortsätze der Horizontalzellen und / oder tangential migrierender Neuronen NT-3-positiv (Pfeile). Ergebnisse (Kolokalisationsuntersuchungen...) 123 Abbildung 56: Kolokalisation von NT-3 und Vimentin Mit Hilfe der konfokalen Mikroskopie wurde im Altersstadium PH 0 die Koexpression von NT-3 und Vimentin in radialen Fasern der mittleren und superficialen Schichten (a) und ebenso in den tiefen tectalen Schichten (b) bestätigt. Insbesondere in den tiefen Schichten wurde ein dichtes radiales Fasernetz erkannt. Farbkodierung: grün = BDNF; rot = Vimentin; gelb = Koexpression. In den Fluroeszenzdoppelbelichtungen im Altersstadium PH 4 waren in den tiefen tectalen Schichten außer den NT-3 (c) und Vimentin (d) positiven radialen Fasern auch multipolare Schicht 13 Neuronen NT-3 markiert (c: Pfeile). Ergebnisse (Kolokalisationsuntersuchungen...) 124 3.5.3 Trk B – Vimentin Der trk B Rezeptor und das in Radialgliazellen vorkommende Intermediärfilament Vimentin wurden im sich entwickelnden TO in den Altersstadien PH 0 bis PH 14 der Taube zum Teil koexprimiert (Abbildungen 57-58). In den fluoreszenzmikroskopischen Darstellungen wurden Fasermarkierungen mit dem Antikörper gegen trk B erkannt, begleitet von intensiven somatischen trk B Markierungen der multipolaren Neuronen der Schicht 13 (Abbildungen 57-58). Die trk B Fasermarkierungen in den juvenilen Altersstadien reichten vom Ventrikelepithel bis zu den superficialen Schichten des TO, unabhängig von der lichtmikroskopischen Darstellung einer Fluoreszenz-Doppelbelichtung in den Altersstadien PH 0 und PH 2 (Abbildungen 57, 58a,b) oder der Betrachtung mit Hilfe des konfokalen Lasermikroskops im Altersstadium PH 14 (Abbildung 58c). Abbildung 57: Kolokalisation von trk B und Vimentin Im Altersstadium PH 2 wurde in den mittleren und superficialen tectalen Schichten in den Fluoreszenz-Doppelbelichtungen eine Koexpression von trk B (a) und Vimentin (b) in radialen Fasern erkannt. Außerdem trk B-positiv waren die multipolaren Neuronen der Schicht 13 (a: Pfeile). Ergebnisse (Kolokalisationsuntersuchungen...) 125 Abbildung 58: Kolokalisation von trk B und Vimentin In den tiefen tectalen Schichten wurden am Schlupftag (PH 0) Doppelmarkierung von trk B (a) und Vimentin (b) in radialen Fasern erkannt. Somatisch trk B markiert waren in diesem Altersstadium die multipolaren Neuronen der Schicht 13 (Pfeile). (c) Mit Hilfe der konfokalen Mikroskopie wurde das dichte Netz radial orientierten Fasern in den tiefen tectalen Schichten offensichtlich, die sowohl den trk B Rezeptor (grün) als auch das Intermediärfilament Vimentin (rot) exprimierten. Ergebnisse (Kolokalisationsuntersuchungen...) 126 3.5.4 Trk C – Vimentin In den immunhistochemischen Untersuchungen zur Koexpression des trk C Rezeptors mit Vimentin war teilweise eine Überlagerung der Fluoreszenzsignale zu erkennen. Vornehmlich radial orientierte Fasern zeigten eine Kolokalisation des high-affinity Rezeptors mit Vimentin (Abbildungen 59-60). Diese Fasern reichten im Altersstadium PH 2 vom Ventrikelepithel bis zu den superficialen Schichten. Außerdem markierte der Antikörper gegen trk C somatisch Neuronen in verschiedenen tectalen Schichten (Abbildungen 59-60). Zwei Tage nach dem Schlupf waren neben den multipolaren Neuronen der Schicht 13 viele kleine Neuronen in den Schichten 14 und 15 sowie vereinzelte in den mittleren und superficialen Schichten trk C-positiv. Insbesondere die kleinen den trk C Rezeptor exprimierenden Neuronen zeigten eine nahe Lokalisation zu den radialen, trk C und Vimentin markierten Fasern (Abbildung 60). Abbildung 59: Kolokalisation von trk C und Vimentin Zwei Tage nach dem Schlupf waren in den mittleren und superficialen tectalen Schichten in den Fluoreszenz-Doppelbelichtungen Kolokalisationen von trk C (a) mit Vimentin (b) in radialen Fasern sichtbar. Vereinzelt waren außerdem in diesen tectalen Laminae Neuronen somatisch trk C markiert (a: Pfeile). Ergebnisse (Kolokalisationsuntersuchungen...) 127 Abbildung 60: Kolokalisation von trk C und Vimentin Radiale Fasern der tiefen tectalen Schichten zeigten zwei Tage nach dem Schlupftag (PH 2) Doppelmarkierung von trk C (a) und Vimentin (b). In diesem tectalen Bereich somatisch trk C markiert waren außerdem die multipolaren Neuronen der Schicht 13 und eine Vielzahl kleiner Neuronen ebenso wie das Ventrikelepithel (Pfeile). (c,d) Mit Hilfe der konfokalen Mikroskopie wurde die enge räumliche Beziehung zwischen den kleinen trk C-positiven Neuronen (grün) und den Vimentin synthetisierenden radialen Fasern (rot) sichtbar. Ergebnisse (Kolokalisationsuntersuchungen...) 128 Die Ergebnisse der Kolokalisationsuntersuchungen von Vimentin mit den Neurotrophinen BDNF und NT-3 sowie mit den beiden high-affinity Rezeptoren trk B und trk C im Tectum opticum der Taube sind in der Tabelle 9 zusammengefaßt. Demnach exprimierten radiale, Vimentin positive Fasern auch die Proteine BDNF, NT-3, trk B und trk C in den Altersstadien PH 0 bis PH 14. Kennzeichnender Weise zeigten kleine migrierende Neuronen auch BDNF und trk C positive Signale. Tabelle 9: Koexpression von BDNF, NT-3, trk B und trk B mit Vimentin Radiale Vimentin positive Fasern Migrierende Neuronen BDNF NT-3 Trk B Trk C + + + + + - - + Diese Untersuchungen zeigen, daß Radialglia sowohl die Neurotrophine BDNF und NT-3 als auch die Neurotrophin-Rezeptoren trk B und trk C exprimieren, wodurch neurotrophe Mechanismen während der Etablierung der tectalen Morphologie sehr wahrscheinlich sind. Bei Hühnchen wird die Zielfindung tectaler Neuronen durch Radialglia gestützt (Gray & Sanes, 1991). Bislang nicht geklärt sind hierbei die Wechselwirkungen zwischen migrierenden Neuronen und der Radialglia. In einer Arbeit von Yuasa und Mitarbeitern (1996) wurde in diesem Zusammenhang über die Rezeptor vermittelte Aufnahme von Wachstumsfaktoren zur Steuerung der Zellmigration entlang der Radialglia spekuliert. Die in der vorliegenden Arbeit durchgeführten Kolokalisationsstudien sind ein erster Hinweis darauf, daß von Radialgliazellen exprimierte Neurotrophine als Substrat für die migrierenden Neuronen dienen könnten. Zum Beispiel könnte von den Radialglia exprimiertes NT-3 über den trk C Rezeptor von den migrierenden Neuronen aufgenommen werden, die ihrerseits wiederum mit den Radialglia über BDNF wechselwirken. Radialglia exprimieren die korrespondieren Rezeptoren trk B und trk C, wodurch eine Neurotrophin gestützte Festigung und Etablierung der Radialglia erfolgen könnte. Desweiteren sind die Expressionsdaten aber auch ein Hinweis auf mögliche autocrine, BDNF vermittelte Wechselwirkungen der Radialglia selbst, wobei BDNF zum Beispiel die Morphologie der das Neurotrophin synthetisierenden Zelle beeinflußt. Diskussion 129 4 Diskussion In der vorliegenden Arbeit wurde die Expression der beiden Neurotrophine BDNF und NT-3 sowie ihrer korrespondierenden high-affinity Rezeptoren trk B und trk C in der Retina und dem Tectum opticum (TO) während der Entwicklung des retino-tectalen Systems der Taube Columba livia untersucht. Abhängig vom Alter der Tiere zeigt sich eine deutliche Expression dieser Neurotrophine und Neurotrophin Rezeptoren, wobei das Expressionsmuster zum Teil zeitlich mit Entwicklungsvorgängen in diesem Teil des visuellen Systems korrelierte. In der Retina war die Expression beider Neurotrophine und der trk Rezeptoren ab dem Schlupftag zu beobachten, und im TO waren BDNF, NT-3, trk B und trk C in diversen Schichten bereits ab dem Embryonaltag E 14 zu detektieren. Die zeitlichen Korrelationen zwischen der Expression von Neurotrophinen und Neurotrophin Rezeptoren und den in diesen Altersstadien ablaufenden Entwicklungsvorgängen im visuellen System lassen den Schluß zu, daß Neurotrophine an diesen Entwicklungsprozessen direkt beteiligt sind. Hierbei fungieren BDNF und NT-3 vermutlich zum einen als intraretinale und intratectale trophische Signale bei der Entwicklung dieser Strukturen, und zum anderen als retrograde und anterograde trophische Signalstoffe bei der Etablierung der retino-tectalen Konnektivitäten. Für das Neurotrophin BDNF sind darüber hinaus auch trophische Funktionen im retino-tectalen System adulter Tauben wahrscheinlich. In der anschließenden Diskussion werden zunächst intrinsische trophische Mechanismen von BDNF und NT-3 in der Retina und dem TO der Taube diskutiert. Solche lokalen Wirkungen von Neurotrophinen in den jeweiligen Geweben ihrer Synthese wurden bereits in der Retina (de Araujo & Linden, 1993) und im TO gezeigt (Herzog et al., 1994). Insbesondere im TO deuten in der vorliegenden Arbeit durchgeführte Kolokalisationsuntersuchungen der Neurotrophine sowie der entsprechenden Rezeptoren mit dem für Radialglia spezifischen Intermediärfilament Vimentin darauf hin, daß in dieser mesencephalen Struktur Neurotrophine auch die Entstehung der tectalen Laminierung beeinflussen. In den folgenden Diskussionspunkten werden anschließend mögliche neurotrophe Signalflüsse im retino-tectalen System juveniler und adulter Tauben diskutiert. In adulten Tauben durchgeführte Diskussion 130 elektronenmikroskopische Untersuchungen konnten dabei weitere Erkenntnisse über mögliche BDNF vermittelte Signalwege in diesem System geben. Basierend auf den Expressionsdaten der hier untersuchten Neurotrophine und Neurotrophin Rezeptoren werden im Anschluß aktivitätsabhängige Prozesse der Neurotrophin Ausschüttung und Expression erörtert, bevor intrazelluläre Signalkaskaden nach Neurotrophin-Bindung an den trk Rezeptoren vorgestellt werden. Wie in dem sich anschließenden Abschnitt dargelegt wird, werden möglicherweise über solche Neurotrophin induzierten Signalkaskaden morphologische Asymmetrien im visuellen System der Taube etabliert. Die in diesem Abschnitt aufgestellten Hypothesen zur Wirkung von Neurotrophinen bei der Entstehung der Lateralisation im visuellen System der Taube könnten in weiterführenden Experimenten, wie sie im Punkt „Ausblick“ vorgeschlagen werden, experimentell überprüft werden. Im abschließenden Diskussionspunkt werden diverse Einsatzmöglichkeiten von Neurotrophinen bei der Therapie humaner neurodegenerativer Erkrankungen des Nervensystems darzulegen, deren Erforschung gegenwärtig intensiv bearbeitet wird. 4.1 Trophische Mechanismen in der Retina In der Taubenretina wurde eine zunächst schwache BDNF Expression vom Schlupftag an in den retinalen Ganglienzellen, ab dem Tag zwei nach dem Schlupf zusätzlich in der inneren nukleären Schicht, und in adulten Tauben auch in den Somata der Photorezeptoren erkannt. NT-3 wurde hingegen bereits ab dem Schlupftag massiv in retinalen Ganglienzellen und einen Tag später auch von Neuronen der inneren nukleären Schicht snythetisiert. Zwei Tage nach dem Schlupf schien ein Maximum der NT-3 Expression erreicht zu sein, deutlich sichtbar an der massiven NT-3 Immunreaktivität in der retinalen Ganglienzellschicht und der inneren nukleären Schicht, in welcher insbesondere die Bipolarzellen NT-3-positiv waren. In den folgenden Untersuchungsstadien nahm die Expression des Neurotrophins ab, bis schließlich in Adulten nur noch ein schwaches NT-3 Signal in den retinalen Ganglienzellen und Amakrinzellen der inneren nukleären Schicht detektiert wurde. Die vorgestellten Daten zeigen Übereinstimmungen mit den Expressionsmustern dieser Neurotrophine in Ratten und Hühnchen. In der embryonalen Retina des Hühnchens wurde BDNF mRNA in geringen Mengen in Photorezeptoren (Hallböök et al., 1996), in nicht eindeutig identifizierten Neuronen der inneren nukleären Schicht (Pérez & Caminos, 1995; Hallböök et al., Diskussion 131 1996), und in retinalen Ganglienzellen beobachtet (Herzog et al., 1998). Auch in embryonalen und adulten Rattenretinae wird BDNF in nicht eindeutig zu bestimmenden Neuronen der inneren nukleären Schicht (Pérez & Caminos, 1995) und retinalen Ganglienzellen exprimiert (von Bartheld, 1998). Die Expression der entsprechenden high-affinity Rezeptoren trk B und trk C in der Taubenretina konnte ab dem Schlupftag verfolgt werden. Dabei wurde der trk B Rezeptor in vereinzelten retinalen Ganglienzellen und sehr schwach in der inneren nukleären Schicht ab dem Schlupftag detektiert. In den folgenden Untersuchungsstadien bis vierzehn Tage nach dem Schlupf wurde ein Expressionsanstieg von trk B deutlich, bei dem retinale Ganglienzellen und vermutlich Amakrinzellen der inneren nukleären Schicht trk B-positiv waren, bevor sich in den Adulten die Synthese von trk B auf die retinalen Ganglienzellen reduzierte. Der trk C Rezeptor zeigte ein ähnliches Expressionsmuster, beginnend mit vereinzelt trk C markierten retinalen Ganglienzellen und einzelnen Photorezeptorzellen am Schlupftag und einer darauf folgenden Steigerung der Expression bis zur adulten Taube, mit deutlich trk C-positiven retinalen Ganglienzellen und Neuronen der inneren nukleären Schicht. Bei den Letzteren handelte es sich wahrscheinlich um Amakrinzellen und/oder displaced Ganglienzellen. Ein Vergleich mit den Expressionsdaten anderer Studien zeigt auch hier Übereinstimmungen zwischen Säugern und Vögeln. Photorezeptoren der Mäuse- und Hühnchenretina zeigten trk B und trk C Immunreaktivität (Llamosas et al., 1997; Garner et al., 1996; von Bartheld, 1998). In der inneren nukleären Schicht waren Bipolarzellen des Hühnchens trk C-positiv (Hallböök et al., 1996) sowie Amakrinzellen trk B und trk C markiert (Garner et al., 1996; Hallböök et al., 1996). In Ratten und Hühnchen exprimierten retinale Ganglienzellen sowohl trk B als auch trk C Rezeptoren (Jelsma et al., 1993, Hallböök et a., 1996; von Bartheld et al., 1996). Die Ergebnisse der vorliegenden Arbeit als auch die Daten der Literatur zeigen, daß neben den Projektionsneuronen der Retina, den retinalen Ganglienzellen, auch weitere retinale Zellen Neurotrophine und Neurotrophin-Rezeptoren exprimieren. Eine mögliche Funktion der Neurotrophine in diesen Neuronen sind intrinsische trophische Signalflüsse innerhalb der Retina selbst. Bovolenta und Mitarbeiter (1996) demonstrierten, daß die Neutralisation von NT-3 durch entsprechende Antikörper die Entwicklung der Retina massiv störte. Hierdurch wurde die Anzahl retinaler Axone im optischen Trakt reduziert, ebenso wie die Ausdehnung der Zellschichten und Diskussion 132 die dendritische Verzweigung retinaler Ganglienzellen in der inneren plexiformen Zellschicht. Desweiteren wurde gezeigt, daß bereits ab dem fünften Embryonaltag NT-3 mRNA im Pigmentepithel und Neuronen der Hühnchenretina exprimiert wird, um vermutlich als intrinsisches Signal die Entwicklung und Differenzierung retinaler Zellen zu regulieren (Bovolenta et al., 1996). Der korrespondierende trk C Rezeptor wurde im selben Altersstadium von retinalen Zellen synthetisiert, und war ab dem Embryonaltag zwölf in allen retinalen Schichten detektierbar (Hallböök et al., 1996). Außerdem verhindert NT-3 zwischen den Embryonaltagen E 9 und E 11 den Zelltod von Amakrinzellen und retinalen Ganglienzellen bei Hühnchen (de la Rosa et al., 1994). Ebenfalls positive Effekte auf die Überlebensrate retinaler Zellen wurde durch in vitro-Experimente für das Neurotrophin BDNF dokumentiert (Johnson et al., 1986; Rodríguez-Tébar et al., 1989; Thanos et al., 1989), während in BDNF knock-out Mäusen in vivo kein signifikantes Zellsterben retinaler Zellen beobachtet wurde (Jones et al., 1994). Vermutlich ist ein Zusammenspiel beider Neurotrophine, BDNF und NT-3, für die retinale Entwicklung entscheidend, bei welchem NT-3 verschiedene Schritte der frühen retinalen Entwicklung steuert, und BDNF das Zellüberleben und das Neuritenwachstums in späteren Entwicklungsstadien beeinflußt (von Bartheld, 1998). Für das retinale Pigmentepithel in Xenopus laevis wurde aber auch eine sehr frühe kritische Funktion von BDNF als autocriner trophischer Faktor erkannt, der möglicherweise die Differenzierung der Neuroblasten reguliert (Liu et al., 1997). Weitere Aufgaben des Pigmentepithels sind die Phagocytose verbrauchter äußerer Photorezeptorsegmente (Young & Bok, 1969) und die Regeneration der Photopigmente (Bridges, 1976), Prozesse, bei denen die Neurotrophine BDNF und NT-3 möglicherweise regulierend unterstützen (Bovolenta et al., 1996; Hackett et al., 1998). In der Taube spricht die Expression von trk C in retinalen Photorezeptorzellen für eine mögliche neurotrophe Wechselwirkung mit dem Pigmentepithel, aber auch mit den NT-3 exprimierenden Bipolarzellen der inneren nukleären Schicht. Eine positive Stimulation durch Neurotrophine, speziell durch BDNF, wurde für das dendritische Wachstum der dopaminergen Amakrinzellen der inneren nukleären Schicht bei Ratten drei Wochen nach der Geburt gezeigt (Cellerino et al., 1998). Zumindest ein Teil der Amakrinzellen der Taubenretina synthetisieren BDNF und steht in synaptischem Kontakt mit Bipolarzellen und retinalen Ganglienzellen in der inneren plexiformen Schicht. Die diffusen BDNF und trk B Markierungen der inneren plexiformen Schicht und die Diskussion 133 somatischen trk B Expressionen von vermutlich Amakrinzellen und retinalen Ganglienzellen deuten auf BDNF vermittelte, wechselseitige trophische Signalflüsse zwischen diesen Neuronen hin. Ebenso wahrscheinlich sind auch NT-3 vermittelte intrinsische, wechselseitige trophische Signalwege zwischen Bipolarzellen, Amakrinzellen und retinalen Ganglienzellen in der juvenilen Taubenretina. Da die NT-3-positiven Signale vornehmlich in der juvenilen Retina erkannt wurden, unterstützt NT-3 vermutlich die Etablierung der Dendritenmorphologie sowie synaptische Kontakte zwischen den Neuronen, während BDNF wahrscheinlich auch in adulten Tauben retinale Feinanpassungen regulierend beeinflußt. Die in der gegenwärtigen Arbeit dargestellten Ergebnisse zur immunhistochemischen Detektion der Neurotrophine BDNF und NT-3 sowie der korrespondierenden trk B und trk C Rezeptoren in der Taubenretina zeigen generell Übereinstimmungen mit dem Daten aus anderen Spezies. Auffällig ist jedoch die zeitlich abweichende Expression dieser Antigene im Vergleich mit Hühnchen, in welchen bereits in der embryonalen Retina diese Neurotrophine und Neurotrophin Rezeptoren detektiert wurden. An dieser Stelle kann die Möglichkeit eines methodischen Fehlers zur immunhistochemischen Darstellung der Neurotrophine im embryonalen retinalen Gewebe der Taube nicht ausgeschlossen werden. Möglicherweise exprimieren auch Tauben diese Proteine in retinalen Nervenzellen, wobei die Konzentration an BDNF, NT-3, trk B und trk C in der embryonalen Taubenretina aber zu gering war, als das sie mit den hier angewendeten Darstellungsverfahren detektiert werden konnte. Hierbei ist zu erwähnen, daß die Techniken der Immunhistochemie ebenso wie der nicht eingesetzten in-situ Hybridisierung relativ wenig sensitiv bezüglich der Detektion nur sehr schwach vorkommender trophischer Moleküle sind (Anderson et al., 1995; Ibánez, 1996). Ebenso denkbar ist, daß BDNF und NT-3 vermittelte neurotrophe Mechanismen in der Taubenretina im Vergleich zum Hühnchen erst zu späteren Entwicklungszeitpunkten notwendig werden, und somit erst zu diesem Zeitpunkt detektierbar sind, da die gesamte retino-tectale Entwicklung der nesthockenden Taube gegenüber dem nestflüchtenden Hühnchen deutlich verzögert ist. Aufgrund der im folgenden Abschnitt diskutierten immunhistochemischen Detektion von BDNF und NT-3 sowie der entsprechenden high-affinity Rezeptoren im embryonalen TO derselben Tauben, von denen die Retinae stammen, und die somit gleiche Vorbedingungen bezüglich der Präparation und Fixierung erfahren haben, erscheint die Möglichkeit eines methodischen Fehlers gering. Diskussion 134 Wie im folgenden Abschnitt diskutiert wird, sind die zeitlich mit Entwicklungsvorgängen assoziierten Expressionsmuster der beiden Neurotrophine BDNF und NT-3 sowie der trk B und trk C Rezeptoren ein Hinweis auf trophische Mechanismen innerhalb dieser mesencephalen Struktur in embryonalen, juvenilen und adulten Tauben. 4.2 Trophische Mechnismen im Tectum opticum Die immunhistochemischen Untersuchungen der Expression von BDNF im TO der Taube zeigten zunächst eine schwache neuronale Immunreaktivität am Embryonaltag vierzehn (E 14) in den tiefen und mittleren tectalen Schichten, die sich in den folgenden Altersstadien bis zu den adulten Tieren prominent auf Neuronen der superficialen, mittleren und tiefen tectalen Schichten ausdehnte. Die immunhistochemisch sichtbare Expression von NT-3 war hingegen auf die Entwicklung des TO beziehungsweise des retino-tectalen Systems begrenzt. Ab E 14 waren Neuronen in den tiefen tectalen Schichten NT-3-positiv. In den folgenden Altersstadien dehnte sich die Immunreaktivität auf die mittleren und superficialen tectalen Schichten aus und erreichte zwei bis vier Tage nach dem Schlupf eine maximale Intensität. In sieben und vierzehn Tage alten Tieren hingegen reduzierte sich das NT-3 Signal auf die tiefen tectalen Schichten und verschwand in adulten Tauben ganz. Das Expressionsmuster von BDNF zeigte Übereinstimmungen mit dem anderer Spezies. In der adulten Maus wurde BDNF mRNA in superioren Colliculus detektiert (Leibrock et al., 1989; Hofer et al., 1990), wobei vor allem die superficialen Schichten dieser Struktur durch das massive Vorkommen von BDNF mRNA gekennzeichnet waren (Weltmore et al., 1990; Gall et al., 1992), übereinstimmend mit Hühnchen (Herzog & von Bartheld, 1998). In Ratten stieg die BDNF mRNA Transkription im superioren Colliculus von der Geburt zum adulten Tier stetig an (Friedman et al., 1991). Auch im Hühnchen wurde BDNF im sich entwickelnden TO nachgewiesen (Herzog et al., 1994; Hallböök et al., 1996), mit einem Maximum um den Embryonaltag vier (E 4) und E 11, um anschließend in adulten Hühnchen in der Konzentration wieder abzusinken (Herzog et al., 1994). Ein ähnliches zeitliches BDNFExpressionsmuster wurde auch im TO von Fröschen erkannt (Cohen-Cory & Fraser, 1994). Diskussion 135 Die gegenwärtigen Daten der NT-3 Expression im TO der Taube zeigen Übereinstimmungen mit dem Vorkommen von NT-3 mRNA im superioren Colliculus von Ratten, mit abnehmender Konzentration von der Geburt zum adulten Tier, während NT-3 mRNA im TO von Hühnchen nicht detektiert wurde (von Bartheld et al., 1996). Die Expression der high-affinity Rezeptoren trk B und trk C in der Taube erfolgte ab E 14 schwach in den tiefen tectalen Schichten, dehnte sich in den folgenden Altersstadien bis vier Tage nach dem Schlupf auf die superficialen und mittleren tectalen Zellschichten aus und reduzierte sich anschließend wieder auf die tiefen tectalen Schichten, bevor in den adulten Tieren keinerlei Immunreaktivität gegen trk B und trk C nachgewiesen werden konnte. Im Vergleich mit anderen Spezies wurde der trk B Rezeptor im superioren Colliculus von Ratten nachgewiesen (Cabelli et al., 1996; Furukawa et al., 1998) und trk B mRNA im TO von Hühnchen (Escandón et al., 1994; Garner et al., 1996). Ebenso wurde die mRNA sowie der trk C Rezeptor im superioren Colliculus von Säugern (Merlio et al., 1992; Allendoerfer et al., 1994) und im TO von Hühnchen detektiert (Escandón et al., 1994; von Bartheld et al., 1996). Eine fehlende Detektion von trk B und trk C Rezeptoren in den adulten Tauben ist möglicherweise durch eine Verschiebung des Verhältnisses der katalytisch aktiven trk Rezeptoren zu den katalytisch inaktiven truncated-trk Rezeptoren während der tectalen Entwicklung erklärbar - die mit dem eingesetzten Antikörper nicht detektiert werden können - wie dies für die Reifung des superioren Colliculus der Säuger gezeigt wurde (Allendoerfer et al., 1994). Bei der Betrachtung des zeitlichen Expressionsmuster von BDNF und NT-3 im TO der Taube, beginnend mit E 14 bis zu den Adulten wird deutlich, daß beide Neurotrophine in den frühen Phasen der tectalen Entwicklung exprimiert werden. Die Annahme, daß in diesen frühen Altersstadien intrinsische tectale trophische Mechanismen vorkommen, bevor retinale Neuronen das mesencephale Gebiet innervieren, wird durch die zeitgleiche trk B und trk C Rezeptor Expression in dem Kerngebiet unterstützt. Für Hühnchen wurde die BDNF Expression im Altersstadium E 4 gezeigt (Herzog et al., 1994), zwei Tage bevor die ersten retinalen Axone das TO innervieren (Crossland et al., 1975). Da die Differenzierung der tectalen Neuronen des Hühnchens zwischen E 3 und E 4 beginnt (Goldberg, 1974; Puelles & Bendala, 1978), könnte BDNF die phänotypische Differenzierung sowie das Neuritenwachstum beeinflussen (Herzog et al., 1994). Die Annahme intrinsischer Wirkungsmechanismen im TO wird durch die Expression Diskussion 136 des trk B Rezeptors in tectalen Neuronen in diesen Altersstadien unterstützt (Biffo et al., 1994). Intrinsische Wirkungen von BDNF bezüglich des Neuritenwachstums und der Differenzierung sind für Spinalganglien gezeigt (Wright et al., 1992), ebenso wie für die phänotypische Differenzierung von Neuralleistenzellen (Sieber-Blum, 1991). Möglicherweise sind die ab E 14 im TO der Taube exprimierten Neurotrophine BDNF und NT-3 intrinsische Signale zur Etablierung der tectalen Morphologie, wie zum Beispiel der Dendritenreifung und der neuronalen Migration (Vergleich: 4.3 „Neuronale Migration tectaler Neuronen“). Vermutlich bleiben intrinsische trophische Wechselwirkungen aber nicht auf die embryonalen Altersstadien begrenzt sondern regulieren auch in den juvenilen und adulten Tieren die tectale Morphologie. Da aber in der juvenilen und adulten Taube zusätzlich retino-tectale Wechselwirkungen anzunehmen sind (siehe Punkt 4.4 und 4.5), können intrinsische trophische Signalwege in der Retina und dem TO in diesen Altersstadien in der vorliegenden Arbeit nicht eindeutig charakterisiert werden. Während der Entwicklung der tectalen Morphologie wurden radiale, Neurotrophin- und Neurotrophin Rezeptor-positive Fasern detektiert, deren Zuordnung zu einem speziellen Zelltyp basierend auf diesen Daten nicht möglich war. Da radiale Fasern in Adulten nicht detektiert wurden, lag die Vermutung nahe, daß es sich um speziell für die Reifung des TO wichtige Strukturen handelte. Die Morphologie dieser radialen Fasern, die mehrere Zellschichten überspannten, führte zu der Hypothese, daß es sich um Radialglia handelte. Mit Hilfe von Kolokalisationsuntersuchungen zwischen dem Radialglia-spezifischen Intermediärfilament Vimentin und den Neurotrophinen und Neurotrophin-Rezeptoren wurden neurotrophe Mechanismen während der embryonalen und juvenilen Etablierung der tectalen Zellschichtung näher untersucht. Diskussion 4.3 137 Neuronale Migration tectaler Neuronen Die neuronale Migration postmitotischer Neuronen aus der Ventrikularzone zur letztendlichen Position im entsprechenden Zielgebiet ist entscheidend für die Etablierung der neuronalen Morphologie, der sinnvollen Bildung von Synapsen und der Funktionsaufnahme der einzelnen Neuronentypen (Rakic, 1990). Ein nicht korrektes Auswandern der Nervenzellen bedingt zahlreiche Defekte, mit der Konsequenz einer nicht oder nur teilweise erfüllbaren Funktion des neuronalen Gewebes (Rakic, 1990; Reiner et al., 1995). Die neuronale Migration bildet somit die Basis für das Entstehen neuronaler Systeme, deren zumeist komplexe Vernetzung morphogenetische Mechanismen während der Wanderung von Neuronen in die entsprechenden Zielgebiete erfordert. Als Führungsleitern und Substrat für die neuronale Migration fungieren gemäß der von Rakic (1971) postulierten „Radialglia-Hypothese“ spezifische Radialgliazellen. Neue postmitotische Neuronen zeigen demnach eine bipolare Morphologie und kontaktieren die Fortsätze der Radialglia, um entlang dieser aus der Ventrikularzone in ihr Zielgebiet auszuwandern (Meller & Tetzlaff, 1975; Meller, 1979; Rakic, 1990). Die Perikarien der Radialglia liegen in der Ventrikularzone und ihre Fortsätze reichen von der Ventrikeloberfläche bis zur pialen Oberfläche (Rakic, 1971), wobei eine kolumnäre Anordnung der Radialglia zu erkennen ist (Meller & Tetzlaff, 1975, 1976; Meller, 1979). Bestätigungen dieser Hypothese kommen durch verschiedene in vivo-Untersuchungen im Cortex und Cerebellum und in vitro-Experimenten, in denen dissoziierte Neuronen entlang von Radialglia-Fortsätzen wanderten (Hatten et al., 1986; Hatten et al., 1990). Zur Etablierung der neuronalen Morphologie wird neben der Radialglia-Hypothese auch die von Morest entworfene Hypothese der „Perikaryon-Translokation“ von Neuronen im sich entwickelnden Gewebe diskutiert (Morest, 1970a,b). Gemäß dieser Hypothese bilden neue postmitotische Neuronen Fortsätze zur pialen und zur ventrikulären Oberfläche, und das Soma dieser Zellen „wandert“ entlang dieser Fortsätze zur Endposition im Gewebe. Während der Perikaryon-Translokation bleibt dabei ein Fortsatz der Nervenzelle mit der ventrikulären Oberfläche des Neuroepithels in Verbindung. Nach Abschluß der Wanderung werden beide Fortsätze wieder zurückgebildet. Retrograde Markierungen in sich entwickelnden neuronalen Geweben bei Säugern (Dunlop, 1990) und Vögeln (Snow & Robson, 1994) sprechen für die Perikaryon-Translokations-Hypothese, wenngleich in ultrastrukturellen Untersuchungen vom Diskussion 138 inneren bis zum äußeren Neuroepithel reichende Fortsätze während der Entwicklung nicht gezeigt werden konnten (Snow & Robson, 1995). In der vorliegenden Arbeit wurden im TO der Taube Radialglia durch die immunhistochemische Darstellung von Vimentin, einem spezifisch in Radialglia von Säugern und Vögeln vorkommenden Intermediärfilament (Lemmon, 1985, Alvarez-Buylla et al., 1987), markiert. In den untersuchten Altersstadien PH 0 bis PH 14 zeigten sich dabei deutliche Vimentin-positive radiale Fasern, die vom Ventrikelepithel bis zu den superficialen Schichten verfolgt werden konnten, während in den adulten Tauben Vimentin nicht detektiert wurde. Bei Säugern werden Radialglia im Verlaufe der Entwicklung in Vimentin-negative Astrocyten umgewandelt, die spezifisch das „glial fibrillary acidic protein“ (GFAP) synthetisieren (Bignami et al., 1980). Bei Vögeln werden neben den reifen Astrocyten auch Vimentin-positive radiale Fasern in Adulten, zum Beispiel im Hippocampus, detektiert (Alvarez-Buylla et al., 1987). Im TO von Hühnchen wiederum findet ein bis drei Tage nach dem Schlupf die auch die für Säuger charakteristische Transformation sämtlicher Vimentin-positiver Radialglia in GFAP-markierte Astrocyten statt (Gray & Sanes, 1992; Kálmán et al., 1998). Das unterschiedliche Zeitmuster der tectalen Vimentin Synthese zwischen Hühnchen und Taube erklärt sich durch die bei den nestflüchtenden Hühnchen beim Schlupf abgeschlossene Entwicklung der Zellschichtung im TO (LaVail & Cowan, 1971, McLoon, 1985), ein Prozeß, der bei den nesthockenden Tauben noch für zwei bis drei Wochen nach dem Schlupf andauert (Manns & Güntürkün, 1997). Gemeinsam für Hühnchen und Tauben ist aber, daß die Expression von Radialglia im TO auf die Entwicklungsphasen der tectalen Schichtendifferenzierung begrenzt bleibt, und dieses zeitliche Expressionsmuster eine Beteiligung von Radialglia an tectalen Entwicklungsprozessen in diesen beiden Spezies sehr wahrscheinlich werden läßt. In einem Überblick über Mechanismen der neuronalen Migration diskutieren Snow und Robson (1995), daß möglicherweise sowohl die Perikaryon-Translokation als auch die Radialgliagestützte Zellmigration koexistente Formen des zielgerichteten Auswandern von Nervenzellen darstellen. In der Hühnchen Retina wurde zum Beispiel die Translokation des Perikaryons zur inneren Retina entlang der zwischen beiden retinalen Oberflächen aufgespannten Fortsätze gezeigt (Snow & Robson, 1995). Auch im TO von Hühnchen treten erste postmitotische Neuronen ab E 4 auf (LaVail & Cowan, 1971), deren Fortsätze sowohl die piale als auch die ventrikuläre Oberfläche berühren. In den Altersstadien E 4 bis E 6, während des Entstehens der tiefen tectalen Diskussion 139 Schichten, zeigen diese Nervenzellen eine Perikaryon-Translokation (Domesick & Morest, 1977a,b). Bei der weiteren tectalen Schichtendifferenzierung wurde hingegen die Radialgliagestützte Zellmigration beobachtet (Domesick & Morest, 1977a,b). In einer weiteren Arbeit wurde im Hühnchen vereinzelt auch die Perikaryon-Translokation im TO in Altersstadien nach E 6 beobachtet (Puelles & Bendale, 1978), während aber die Zielfindung tectaler Neuronen in dieser Spezies überwiegend durch Radialglia gestützt ist (Puelles & Bendale, 1978). Wird die enge Bindung zwischen migrierenden Neuronen und Radialglia im TO von Hühnchen verhindert, zum Beispiel durch die Unterdrückung des an diesen Prozessen beteiligten Bindungsproteins Integrin, so wird die Zellmigration verhindert (Galileo et al., 1992). Zusammen bestätigen diese Daten und die in der gegenwärtigen Arbeit vorgestellten Expressionsmuster von Radialglia während des Entstehens der tectalen Morphologie, mit an diesen Radialglia eng assoziierten wandernden Neuronen, die Radialglia-Hypothese als einen bedeutenden Mechanismus der Etablierung der tectalen Morphologie bei Tauben, wie es von weiteren Arbeitsgruppen im Hühnchen demonstriert wurde (Galileo et al., 1992). Untersuchungen zur Expression von Radialglia im Cortex bei Säugern (Levitt & Rakic, 1980) mit enger Assoziation zu migrierenden Neuronen (Gadisseux et al., 1990) ebenso wie Untersuchungen zu den im Kleinhirn auftretenden Bergmann-Glia (Rakic, 1971), deuten auch in diesen Geweben auf Funktionen der Radialglia während der neuronalen Migration hin. Wenngleich Radialglia die Etablierung der tectalen Morphologie in der Phase der tectalen Entwicklung zu unterstützen scheinen, so bleiben Fragen bezüglich der Wechselwirkungen zwischen Radialglia und migrierenden Neuronen weitgehend ungeklärt. Bislang wurde gezeigt, daß die neuronale Migration entlang der Radialglia über verschiedene Faktoren gefördert wird. Zu erwähnen sind Astrotactin, ein möglicher Ligand während der Migration (Zheng et al., 1996), ß1-Integrin, das mit dem von Radialglia exprimierten extrazellulären Matrixmolekül Laminin interagiert (Galileo et al., 1992) und das von Radialglia synthetisierte Neuron-Glia-AdhäsionsMolekül Tenascin (Husmann et al., 1992). Im sich entwickelnden Gehirn dienen Radialglia aber vermutlich nicht nur als Leitstrukturen für auswandernde Neuronen sondern haben wahrscheinlich darüber hinaus trophischen Einfluß auf die unreifen postmitotischen Nervenzellen (Yuasa et al., 1996). In der hier vorgestellten Arbeit wurden im TO der Taube die Expression von Neurotrophinen und Neurotrophin Rezeptoren in Radialglia mittels Doppelmarkierungen von Vimentin mit BDNF, Diskussion 140 NT-3 und trk B und trk C in diversen juvenilen Altersstadien untersucht. Die Ergebnisse zeigten, daß im sich entwickelnden TO Radialglia sowohl die Neurotrophine BDNF und NT-3 als auch die Rezeptoren trk B und trk C exprimieren. In enger räumlicher Lage zu den Radialglia waren insbesondere in den tiefen tectalen Schichten kleine, vermutlich migrierende Neuronen lokalisiert, welche die Neurotrophine BDNF und NT-3 sowie den trk C Rezeptor exprimierten. Trk BMarkierungen wurden in diesen kleinen Neuronen nicht erkannt. Es ist denkbar, daß die von den Radialglia exprimierten Neurotrophine trophische Signale für migrierende Neuronen darstellen, ebenso wie auch der BDNF und NT-3 vermittelte trophische Signalfluß von den migrierenden Neuronen auf die Radialglia wahrscheinlich erscheint. In reifen Astrocyten, also bereits transformierten Radialglia, wurde die Expression und Freisetzung des Neurotrophins NGF („nerve growth factor“), vermittelt über die Aktivierung von NMDA-Rezeptoren und einem Anstieg der intrazellulären Calzium-Konzentration, aufgedeckt (Abiru et al., 1998). Im Hühnchen ist möglicherweise die Ausschüttung von Neurotrophinen nach glutamaterger exzitatorischer Erregung auch in den Bergmann-Glia des Kleinhirns und MüllerZellen der Retina denkbar (siehe Punkt 4.7), da beide Zelltypen NMDA-Rezeptoren exprimieren (Lopez et al., 1997). Ähnliche Prozesse der Neurotrophin Expression und Freisetzung sind auch für die Radialglia im Tectum opticum der Taube denkbar, wenngleich Radialglia im zentralen Nervensystem in den verschiedenen Anteilen Unterschiede aufweisen und für Cortex, Kleinhirn und Mesencephalon spezifisch sind (Götz et al., 1998). Trophische Einflüsse von migrierenden Neuronen auf Radialglia über den „glial growth factor“ (GGF), die lösliche Form von Neuregulin, wurden im Cortex von Ratten demonstriert (Anton et al., 1997). Die Ausschüttung von GGF aus den migrierenden Neuronen fördert hierbei die Richtungsfindung und das Längenwachstum der Radialglia-Fortsätze. Bei Neuregulin handelt es sich um einen Membran-gebundenen, sekretorisch-peptidergen Wachstumsfaktor, der an Rezeptoren der „epidermal growth factor Rezeptor-Familie“ bindet (Carrway & Burden, 1995), wobei die Wirkung über ein sogenanntes „Brain-Lipid-Binding Protein“ vermittelt wird (Anton et al., 1997). Möglicherweise reguliert GGF die Expression von Neurotrophinen, Zelladhäsionsmolekülen, Neurotransmitter Rezeptoren und Ionen-Kanälen (Corfas & Fischbach, 1993; Falls et al., 1993; Mahanthappa et al., 1996). Auf Grund der gegenwärtigen Arbeit sind Neurotrophin regulierte Mechanismen der Etablierung tectaler Morphologie in der Taube sehr wahrscheinlich, wobei basierend auf den Daten der Diskussion 141 Expression von Neurotrophinen und Neurotrophin Rezeptoren gegenwärtig vier vermutlich koexistente Mechanismen der trophischen Wirkung während der Zellmigration denkbar sind: 1. Von Radialgliazellen exprimiertes NT-3 übt direkten trophischen Einfluß auf die kleinen, migrierenden und trk C synthetisierenden Neuronen aus. Möglicherweise dient NT-3 als Substrat für die Wanderung. Ein nach der Sekretion des Neurotrophins aus den Radialglia einhergehender Konzentrationsgradient könnte hierbei die Auswanderungsdistanz in der radialen Achse des TO regulieren. 2. Das von migrierenden Neuronen ausgeschüttete NT-3 bindet an den von Radialglia exprimierten trk C Rezeptoren, wobei als mögliche Konsequenzen die Radialglia in Position und Ausdehnung gefestigt werden. Zusammen mit dem unter Punkt eins erläuterten Weg ergeben sich NT-3 vermittelte trophische Wechselwirkungen zwischen Radialglia und migrierenden Neuronen. 3. Migrierende Neuronen üben möglicherweise über das Neurotrophin BDNF paracrine trophische Wirkungen auf diejenigen Radialglia aus, die den entsprechenden high-affinity Rezeptor trk B exprimieren. Mögliche Wirkungen sind auch hier die unter 2. beschriebenen Etablierungen von Radialglia. 4. Für die Radialglia sind auch autocrine Wirkungen von BDNF denkbar, da sie sowohl das Neurotrophin BDNF als auch den korrespondierenden trk B Rezeptor exprimieren. Durch verschiedene Arbeiten werden diese vier hypothetischen Wege der trophischen Wirkung von BDNF und NT-3 bei der Radialglia-gestützten Etablierung der tectalen Morphologie untermauert. In ultrastrukturellen Untersuchungen migrierender Neuronen wurden dünne Fortsätze erkannt, die in ihrer Morphologie den Filopodien von Wachstumskegeln gleichen (Meller, 1979; Yuasa et al., 1996). In diesen Fortsätzen, die sich entlang der Radialglia erstreckten, wurden endocytotische Vesikel detektiert, wie sie auch in axonalen Wachstumskegeln (Grainger et al., 1968; Grainger & James, 1970; Cheng & Reese, 1987) und bei der Glia-geleiteten Migration von Kleinhirn-Zellen in vitro zu beobachten sind (Gregory et al., 1988). Yuasa und Mitarbeiter (1996) spekulierten daher, daß unter anderem die Rezeptor-gesteuerte Endocytose von Wachstumsfaktoren die Zellmigration entlang der Radialglia fördert. Die in der vorliegenden Arbeit gezeigten Daten zur BDNF und NT-3 Synthese in Radialglia sowie zur trk C Expression in Diskussion 142 migrierenden Neuronen sind eine erste Bestätigung für ein Zusammenwirken von Neurotrophinen und Zellmigration entlang von Radialglia. Als Stop-Signale der neuronalen Migration werden afferente Fasern im Zielgebiet oder dort bereits existente Neuronen diskutiert (Sidman & Rakic, 1973; Hatten, 1990). Möglicherweise sind es aber auch Zelloberflächenmoleküle der Radialglia, die ein Stop-Signal erkennen lassen (Gregory et al., 1988). In diversen Studien wurde neben der radialen auch die tangentiale Migration von Neuronen demonstriert (Walsh & Cepko, 1988, Gray & Sanes, 1991). Denkbar ist, daß zunächst über die Radialglia-gestützte Migration von Neuronen das vorläufige Muster der nervalen Struktur angelegt wird, um im fortgeschrittenen Stadium der Entwicklung die Feinabstimmung der Morphologie zu erreichen (Walsh & Cepko, 1992). Die in der vorgestellten Arbeit gezeigten NT-3 und trk B positiven tangentialen Fasern in den superficialen Schichten sind möglicherweise die Zellfortsätze von tangential migrierenden Neuronen, die in den retino-rezipienten Schichten unabhängig von den Radialglia zu ihrer Zielposition migrieren. Inwieweit die Expression von NT-3 und trkB eine möglicherweise stattfindende tangentiale Zellmigration trophisch reguliert, bleibt spekulativ. Denkbar ist, daß in diesem Zielgebiet Wechselwirkungen mit afferenten Fasern oder bereits etablierten Zellpopulationen eine Rolle spielen. Wie in den vorangegangen Abschnitten dargestellt wurde, regulieren trophische Signale als intrinsische Faktoren eine Vielzahl von Prozessen im Nervengewebe. Darüber hinaus stehen nervale Strukturen aber auch im ständigen Austausch mit den innervierten Gebieten. Hierbei werden nicht nur elektrische Signale gegenseitig integriert, sondern auch trophische Signale ausgetauscht. Zum Beispiel benötigen retinale Ganglienzellen trophische Signale vom innervierten TO (Hughes & McLoon, 1979) und tectale Neuronen wiederum anterograde trophische Signale von der innervierenden Retina (Catsicas et al., 1992; Garner et al., 1996; von Bartheld, 1996). Im folgenden werden basierend auf den Ergebnissen der Expression von BDNF, NT-3, trk B und trk C im retino-tectalen System der Taube die beiden Richtungen trophischer Signalflüsse, der retrograde und der anterograde Signalfluß diskutiert. Diskussion 4.4 143 BDNF und NT-3 als retrograde Signalstoffe In diversen Studien wurde gezeigt, daß ein Überleben retinaler Zellen entscheidend durch das innervierte Gewebe reguliert wird. Zum Beispiel wurde im visuellen System nach Entfernung des TO oder Durchtrennung des Tractus opticus ein signifikantes Absterben retinaler Zellen beobachtet (Vanselow et al., 1990). Vermutlich sind hierbei im Zielgebiet ausgeschüttete Neurotrophine regulative Elemente innerhalb einer Signalkaskade vom innervierten zum innervierenden Gewebe. Im folgenden Abschnitt werden in einem Überblick Erkenntnisse über retrograde neurotrophe Signalwege skizziert, die anschließend mit den in der vorliegenden Arbeit gewonnenen Daten verglichen und diskutiert werden. Fournier und Mitarbeiter (1997) demonstrierten den retrograden Transport von mikroinjiziertem BDNF vom TO zu den retinalen Ganglienzellen in der Ratte, und im Hamster reduzierte in den superioren Colliculus injiziertes BDNF den retinalen Ganglienzelltod während der retinalen Entwicklung (Ma et al., 1998). Hierbei fungiert BDNF als trophischer Überlebensfaktor für retinale Ganglienzellen und reguliert darüber hinaus auch die axonalen Verzweigungen retinaler Ganglienzellen im TO von Xenopus (Cohen-Cory & Fraser, 1995), wie auch im Rattencortex (Cabelli et al., 1995). Jüngste Untersuchungen deuten darauf hin, daß BDNF und NT-3 auch als morphogenetische und chemotopische Agenzien auf das neuronale Wachstum Einfluß ausüben (Ming et al., 1997). Axone retinaler Ganglienzellen wachsen zunächst entlang des unreifen optischen Traktes ins Zielgebiet, wobei unter anderem neuroepitheliale Gliazellen (McLoon & Lund, 1980), Proteoglycane (McAdams & McLoon, 1995) und Tenascin (Perez & Halfter, 1993) axonales Wachstum während der Entwicklung regulieren (Tan & Harvey, 1997). Im TO angekommen beeinflussen trophische Signale der superficialen Schichten das Einwachsen retinaler Axone (Hanklin & Lund, 1987), indem hier die Substanzen Ephrin-A2 und Ephrin-A5 Leitmoleküle in rostro-caudalen Achse darstellen (Cheng et al., 1995; Drescher et al., 1995), hingegen Zelloberflächenmoleküle wie N-Cadherin die tectale Terminierung in einzelnen retinorezipienten Schichten regulieren (Inoue & Sane, 1997). In der Feinabstimmung dieser retinalen Terminationen steigern Neurotrophine die Komplexität retinaler Verzweigungen (Gallo & Letourneau, 1998), beeinflussen aber nicht die laminäre Verteilung (Inoue & Sane, 1997). Auf Grund der vorliegenden Resultate zur Expression der Neurotrophine und der korrespondierenden Rezeptoren in der Taube, ist auch hier eine BDNF vermittelte Zielsteuerung Diskussion 144 retinaler Axone im TO denkbar. Erste BDNF-positive Neuronen wurden im TO der Tauben ab E 14, dem ersten untersuchten embryonalen Stadium, in den tiefen Schichten A-C (adulte Schichten 15 bis 13) des rostralen TO detektiert. Zwei Tage später dehnte sich das BDNF Signal über die gesamte rostro-caudale Achse des TO aus. Vom Schlupftag an bis PH 4 zeigten alle zu diesem Zeitpunkt angelegten tectalen Schichten (5-15) ein deutliches BDNF-positives Signal, wobei insbesondere die superficialen und mittleren Schichten kolumnenartige Markierungen aufwiesen. In sieben und vierzehn Tage alten Tauben waren vornehmlich Neuronen der tiefen und mittleren Zellschichten BDNF markiert, wohingegen im adulten Tier Nervenzellen der tectalen Schichten 2-14 BDNF synthetisierten. Diese differentielle Expression des Neurotrophins im TO zeigt auffällige Gemeinsamkeiten mit dem Innervationsmuster retinaler Axone. In umfassenden morphologischen Untersuchungen zeigten Manns und Güntürkün (1997), daß die tectale Innervation retinaler Fasern ab E 14 im rostralen TO beginnt, um sich in den folgenden Tagen über das gesamte TO auszudehnen. Die Innervation retinaler Fasern dauert etwa bis PH 20 an. Die zeitliche Übereinstimmung zwischen dem Expressionsmuster von BDNF und dem Einwachsen retinaler Fasern ist ein Hinweis darauf, daß im Zielgebiet exprimiertes und vermutlich auch freigesetztes BNDF das korrekte Einwachsen retinaler Fasern sowie das Etablieren entsprechender Zellkontakte reguliert. Insbesondere Horizontalzellen der superficialen Schichten und Radialzellen der superficialen und mittleren Zellschichten, welche direkten retinalen Input erhalten, zeigten eine deutliche BDNF Expression ab PH 0. Obgleich BNDF ab E 14 im TO der Taube exprimiert wird, so scheint der entsprechende trk B Rezeptor nicht vor dem Schlupftag in der Retina synthetisiert zu werden. Vielleicht ist die Expression des Rezeptors in retinalen Zellen in den embryonalen Entwicklungsstadien noch zu gering, als daß der trk B Rezeptor immunhistochemisch detektiert werden könnte. Auch denkbar ist, daß BDNF nicht der einzige, retrograd zur Retina transportierte trophische Faktor ist, welcher retino-tectale Konnektivitäten stabilisieren hilft. So wurde zum Beispiel gezeigt, daß in sich entwickelnden retinalen Ganglienzellen des Hamsters die exogene Applikation von BDNF die Apoptose reduziert (Ma et al., 1998), nicht aber bei Hühnchen (Drum et al., 1996). Es ist daher denkbar, daß andere Neurotrophine die Wirkungen von BDNF auf retinale Zellen kompensieren können, beziehungsweise in anderen Spezies generell erfüllen (Herzog & von Bartheld, 1998). Die in dieser Arbeit erzielten Ergebnisse der Expression von NT-3 im retino-tectalen System der Taube unterstützen diese Hypothese. Diskussion 145 In der Taube waren die ersten NT-3-positiven Neuronen in den tiefen und mittleren tectalen Schichten ab E 14 zu beobachten. In den folgenden Untersuchungsstadien (E 16 bis PH 4) wurden NT-3 Antigen tragende Neuronen in allen, zum jeweiligen Zeitpunkt existierenden Zellschichten detektiert, wobei insbesondere Horizontalzellen der superficialen Schichten Immunreaktivität gegen NT-3 zeigten. Wie bei den BDNF-positiven Markierungen wurden auch für NT-3 breite kolumnenartige Markierungen der mittleren und superficialen Schichten beobachtet. In den sich anschließenden Untersuchungsstadien PH 7 bis PH 14 war die neuronale NT-3 Expression tectaler Zellen auf die Schicht 13 begrenzt, bevor im adulten Tier keine NT-3positiven tectalen Neuronen erfaßt werden konnten. Auffällig ist der zeitliche Gradient in der Expression des Neurotrophins NT-3, welcher sehr genau mit der Etablierung retino-tectaler Konnektivitäten im Zeitraum E 14 bis PH 20 korreliert. Im adulten Tier wird NT-3 vermutlich gar nicht oder in immunhistochemisch nicht zu detektierenden Mengen exprimiert. Die retinale Expression des korrespondierenden trk C Rezeptors wurde immunhistochemisch ab PH 0 in retinalen Ganglienzellen registriert. Für die Etablierung retinotectaler Konnektivitäten mittels NT-3 wäre aber eine Expression von trk C in retinalen Ganglienzellen bereits zu einem früheren Zeitpunkt nötig. Gegenwärtig kann nur spekuliert werden, ob der trk C Rezeptor bereits in embryonalen Stadien in der Retina exprimiert wird, die Menge aber unter der immunhistochemisch detektierbaren Grenze liegt oder andere Faktoren, wie zum Beispiel weitere neurotrophe Faktoren, die frühe Etablierung des retino-tectalen Systems steuern, wobei dann NT-3 und BDNF erst nach dem Schlupf regulierend auf das System einwirken. Insbesondere die BDNF und NT-3 Expression in den superficialen, retino-rezipienten tectalen Schichten, mit deutlichen Markierungen von Radialzellen und zumindest zum Teil von Horizontalzellen, während der Etablierung retino-tectaler Kontakte läßt diese Steuerungsprozesse für die beiden Neurotrophine sehr wahrscheinlich werden. Gleichwohl zeigen die Ergebnisse, daß zumindest ab dem Schlupftag die Entwicklung der retinotectalen Konnektivitäten der Taube vermutlich synergistisch durch BDNF und NT-3 unterstützt werden. Das folgende Modell erläutert den möglichen Wirkungsmechanismus: an einer Synapse vom innervierten Neuron postsynaptisch freigesetzte Neurotrophine diffundieren über den synaptischen Spalt zur präsynaptischen Membran, um dort an den entsprechenden Rezeptoren zu binden. Anschließend kommt es zu einer Initialisierung des Rezeptor-Neurotrophin-Komplex, Diskussion 146 welcher zum Soma des innervierenden Neurons retrograd transportiert wird (Bhattacharyya et al., 1997). 4.5 BDNF und NT-3 als anterograde trophische Signalstoffe Neben dem seit einigen Jahren bekannten retrograden Weg der trophischen Signalfortleitung wurde erst in jüngerer Zeit der vorwärts gerichtete, anterograde Signalfluß trophischer Moleküle nachgewiesen (von Bartheld, 1996; Zhou & Rush, 1996). Wie im folgenden Abschnitt diskutiert wird, sind, basierend auf den Ergebnissen im visuellen System verschiedener Spezies wie Ratten und Hühnchen sowie den Expressionsdaten der vorliegenden Arbeit, anterograde neurotrophe Wirkungsmechnismen auch im retino-tectalen System der Taube denkbar. Während der Entwicklung des retino-tectalen Systems wird ein Überschuß von Nervenzellen im TO angelegt, deren Überleben unter anderem von der Innervation afferenter Fasern abhängt. Gezeigt wurde dies in Untersuchungen, bei denen eine operative Entfernung des Auges ein dramatisches Zellsterben im TO (Kelly & Cowan, 1972) sowie in anderen Zielgebieten des visuellen Systems bewirkte (Cowan, 1973). Auch die Unterbindung des anterograden axonalen Transports wie auch der elektrischen Aktivität in afferenten Fasern führte zu einem signifikanten Absterben neuronaler Zielzellen (Catsicas et al., 1992). Demzufolge benötigen die tectalen Zellen trophische Signale, möglicherweise Neurotrophine, aus der Retina (Catsicas et al., 1992). Jüngere Studien in verschiedenen nervalen Geweben demonstrierten einen anterograden Transport von Neurotrophinen, wobei das Neurotrophin vom Perikarion des innervierenden Neurons entlang des Axons zur Nervenendigung im Zielgebiet transportiert wurde (von Bartheld, 1996; Zhou & Rush, 1996; Conner et al., 1997). Basierend auf den Daten über einen anterograden Neurotrophin-Transport wird gegenwärtig der anterograde trophische Signalfluß seitens des innervierenden Neurons diskutiert (Fawcett et al., 1998; Herzog & von Bartheld, 1998). Im sich entwickelnden retino-tectalen System des Hühnchens wurde exogenes, radioaktiv markiertes BNDF und NT-3 von der Retina zum TO transportiert, präsynaptisch freigesetzt und schließlich in den superficialen tectalen Schichten akkumuliert (von Bartheld, 1996). Da in diesen tectalen Schichten des Hühnchens die high-affinity trk B und trk C Rezeptoren exprimiert werden (Bothwell, 1995), ist ein anterograder trophischer Signalfluß von der Retina zum TO zu vermuten. Diskussion 147 Da in der Taubenretina vom Schlupftag bis zum adulten Tier die Neurotrophine BDNF und NT-3 exprimiert werden, sind auch hier anterograde Wirkungsmechanismen auf Neuronen in Zielgebieten außerhalb der Retina, wie zum Beispiel dem TO, denkbar. In der gegenwärtigen Untersuchung zeigte sich eine deutliche tectale Expression der high-affinity Rezeptoren trk B und trk C vom Embryonalstadium E 14 bis PH 14. Zum Zeitpunkt E 14 waren zunächst Neuronen der tiefen und mittleren Schichten des rostralen TO trk B- und trk C-positiv. In den folgenden Untersuchungsstadien (E 16 bis PH 4) dehnte sich die Markierung über die gesamte rostro-caudale Achse aus, wobei ab PH 0 auch die vorhandenen superficialen tectalen Schichten trk B und trk C-positive Neuronen aufwiesen. Insbesondere in den mittleren und superficialen Schichten waren trk B-, als auch trk C-positive Neuronen in breiten Kolumnen angeordnet. Anhand ihrer Morphologie wurden sie als Radialzellen und zum Teil als Horizontalzellen identifiziert. Zwischen PH 7 und PH 14 waren trk B und trk C markierte Nervenzellen vornehmlich in der Schicht 13 lokalisiert, in der adulten Taube hingegen konnten beide high-affinity Rezeptoren nicht mehr detektiert werden. In den Tauben zeigte sich ein zeitlicher Gradient der Expression der beiden high-affinity Rezeptoren trk B und trk C im TO, welcher mit dem Entstehungsmuster retino-tectaler Konnektivitäten im Zeitraum (E 14 bis PH 20) korreliert. Einwachsende retinale Axone bilden direkte Kontakte mit den Dendriten tectalen Neuronen in den retino-rezipienten Schichten 2-7 des TO, wobei die Somata der Neuronen über die Schichten 2-13 verteilt liegen. Es sind vornehmlich Radialzellen der superficialen und mittleren Schichten sowie Horizontalzellen der superficialen Schichten, welche direkte retinale Efferenzen erhalten, aber auch die multipolaren Neuronen der Schicht 13 (Hayes & Webster, 1975; Hardy et al., 1985), deren Dendriten bis in die Schichten 4 und 5 reichen (Hellmann & Güntürkün, 1999). Da Neuronen dieser Schichten die entsprechenden Neurotrophin-Rezeptoren exprimieren und retinale Ganglienzellen BDNF und NT-3 produzieren, ist eine anterograde Neurotrophinfreisetzung in den retino-rezipienten tectalen Schichten seitens dieser retinalen Zellen wahrscheinlich. Möglicherweise regulieren anterograd freigesetzte Neurotrophine das Überleben tectaler Nervenzellen oder / und beeinflussen während der Entwicklung des Systems auch die tectale Zellmorphologie, wie im Cortex oder Cerebellum für das Dendritenwachstum gezeigt (McAllister, 1995; Velier et al., 1997). Diskussion 148 In den vorangegangenen Abschnitten wurden die beiden möglichen Wege der trophischen Signalleitung im retino-tectalen System der Taube beschrieben und diskutiert. Zusammengefaßt wurde dargestellt, daß in der juvenilen und adulten Retina die beiden Neurotrophine BDNF und NT-3 exprimiert werden, die entsprechenden Rezeptoren trk B und trk C aber nur im juvenilen und nicht im adulten TO zu erkennen sind. Daher ist eine anterograde Signalleitung mit gleichzeitiger Neurotrophin-Freisetzung im juvenilen TO denkbar, während ein solcher Signalfluß im adulten TO mutmaßlich wirkungslos bleiben würde. Dagegen sind die biochemischen Voraussetzungen für eine exzitatorische Signalleitung von der Retina zum TO sowie die postsynaptischen Neurotrophin-ausschüttung im juvenilen wie auch adulten TO gegeben: retinale Ganglienzellen exprimieren vom Schlupftag an trk B und trk C Rezeptoren, und eine tectale BDNF Expression ist ebenfalls in den Entwicklungsstadien bis zum adulten Tier zu erkennen. Lediglich das Neurotrophin NT-3 wird nur im sich entwickelnden TO der Taube synthetisiert. Altersabhängige Neurotrophin-Expressionen wurden bereits im Säugerhirn beobachtet, wobei NT-3 insbesondere in den Entwicklungsstadien und BDNF auch in Adulten nachgewiesen werden konnte (Katoh-Semba et al., 1998). In der gegenwärtigen Arbeit wurde die genaue Lokalisation von BDNF im TO adulter Tauben in elektronenmikroskopischen Untersuchungen nachgewiesen. In diesen ultrastrukturellen Untersuchungen der Morphologie des TO sowie der Lokalisation von BDNF wurde zum einen die Hypothese über retrograde Signalflüsse im retino-tectalen System adulter Tauben bestärkt, und zum anderen gezeigt, daß BDNF vermutlich ausschließlich in den retino-rezipienten tectalen Schichten freigesetzt wird, gleichwohl es auch in den Neuronen der mittleren und tiefen tectalen Schichten synthetisiert wird. 4.6 Ultrastrukturelle Untersuchungen des Tectum opticum Das adulte fünfzehn-schichtige TO der Taube kennzeichnet eine hohe Komplexität in der Verarbeitung visueller und nicht-visueller Eingänge (Brecha, 1978). Die visuellen Projektionen kommen zum Großteil von der Retina, und zu geringeren Anteilen vom visuellen Wulst und dem multimodal assoziativen Archistriatum. Etwa 90% der retinalen Axone ziehen durch die Schicht eins nach vollständiger Kreuzung im Chiasma opticum in das TO der Taube ein (Remy & Güntürkün, 1991). Sie terminieren in den superficialen Schichten 2 bis 7 auf den Dendriten der Diskussion 149 Radialzellen und Horizontalzellen sowie auf den bis in die superficialen Schichten reichenden großen multipolaren Dendriten der Schicht 13 Neuronen (Hayes & Webster, 1975; Angaut & Reperant, 1976; Reperant & Angaut, 1977; Hardy et al., 1985, Hellmann & Güntürkün, 1999). Eingänge vom visuellen Wulst und dem Archistriatum terminieren in den mittleren und tiefen tectalen Schichten 11 bis 13 (Zeier & Karten, 1971; Hunt & Webster, 1972; Karten et al., 1973; Brecha, 1978). Die Verarbeitung visuelle Eingänge im TO der Tauben erfolgt in den Schichten 1-13, während vornehmlich Neuronen der tiefen Schichten bi- oder multimodal visuelle, akustische und somatosensorische Afferenzen integrieren (Cotter, 1976; Knudsen & Knudsen, 1983; Hunt & Brecha, 1984). In den hier durchgeführten elektronenmikroskopischen Untersuchungen wurde deutlich, daß in den superficialen tectalen Schichten eine Vielzahl an Synapsen auf horizontalen und radialen Dendriten die Informationsfortleitung gewährleisten, wobei nach Hayes und Webster (1985) die höchste synaptische Dichte in der tectalen Schicht 5 erreicht wird. In verschiedenen Untersuchungen wurde gezeigt, daß insbesondere die Horizontalzellen der Schicht 5 retinale Efferenzen erhalten und präsynaptische Kontakte mit radialen Dendriten in den superficialen Schichten bilden (Hayes & Webster, 1975; Angaut & Reperant, 1976; Reperant & Angaut, 1977). Die strukturelle Organisation von retinalen Terminalien auf Horizontalzellen und radialen Dendriten tiefer gelegener Neuronen ist auch vom Colliculus superior der Säuger bekannt (Lund, 1969; Sterling, 1971; Liebermann & Webster, 1974). Nach exzitatorischer Erregung der Horizontalzellen über glutamaterge Rezeptoren (Theiss et al., 1998) üben retinale Axone an den synaptischen Verbindungen mit den radialen Dendriten vermutlich inhibierende Wirkungen über den Neurotransmitter GABA aus (Henke et al., 1976a, b). Diese komplexen synaptischen Verbindungen bilden die Basis für die beiden, in elektrophysiologischen Untersuchungen entschlüsselten, Wege der Signalfortleitung visueller Information im TO (Hardy et al., 1985). Zum einen erhalten die multipolaren Neuronen der Schicht 13 über ihre bis in die superficialen Schichten reichenden Dendriten direkten axodendritischen retinalen Eingang, und zum anderen wird das Signal zunächst axo-dendritisch auf Radialzellen der mittleren Zellschichten übertragen, bevor diese über axo-dendritische und axosomatische Kontakte die Signalfortleitung zu den multipolaren Neuronen der Schicht 13 gewährleisten. Die elektronenmikroskopischen Bilder zeigten in der Schicht 13 eine sehr hohe Dichte an Synapsen auf den proximalen Dendriten der multipolaren Neuronen. Vermutlich handelte es sich um synaptische Kontakte der als Interneuronen fungierenden Radialzellen der Diskussion 150 mittleren Zellschichten. Den Hauptteil der Efferenzen aus dem TO bildeten die Neuronen der Schicht 13 mit ihren in der Schicht 13 und 14 deutlich sichtbaren myelinisierten Axonen zu visuellen, motorischen und multimodal arrangierten Kerngebieten (Hunt & Künzle, 1976). In den hier aufgeführten immunhistochemischen elektronenmikroskopischen Untersuchungen wurde das Neurotrophin BDNF postsynaptisch in den superficialen Schichten sowie in radialen Dendriten der superficialen und mittleren tectalen Zellschichten in direkter Nähe zu den cytoskelettalen Elementen lokalisiert. An den Synapsen der tiefen tectalen Schicht 13 Neuronen fehlte hingegen jegliche ultrastrukturelle BDNF Immunreaktivität. Diese Ergebnisse machen zwei Schlußfolgerungen wahrscheinlich. Erstens liegt das Neurotrophin BDNF im TO adulter Tauben hauptsächlich in den superficialen Schichten vor, gleichwohl es in den mittleren und tiefen tectalen Schichten exprimiert wird. Durch in-vitro Experimente wurde gezeigt, daß die mRNA von BDNF und trk B im somato-dendritischen Kompartiment kultivierter Hippocampus Neuronen lokalisiert ist, wobei synaptische Aktivität den dendritischen Transport dieser in die distalen Bereiche fördert (Tongiorgi et al., 1997). Vermutlich wird ebenso in der Taube in tectalen Neuronen der tiefen und mittleren Zellschichten exprimiertes BDNF entlang von Mikrotubuli, welche als cytoskelettale Basis für den schnellen anterograden vesikulären Transport fungieren (Schmitt 1968; Paulson & McClure 1975; Theiss & Meller, 1999), in die retino-rezipienten Schichten transportiert. Der vesikuläre Transport von BDNF und die synaptische Lokalisation wurde auf Grund lichtmikroskopischer in vitro-Untersuchungen vermutet (Haubensak et al., 1998). Zweitens macht die anscheinend ausschließlich postsynaptische Lokalisation von BDNF den retrograden trophischen Signalfluß vom TO zur Retina nach visueller Erregung in adulten Tauben wahrscheinlich. Wie in vitro gezeigt reguliert BDNF an den Synapsen sekretorische Mechanismen über eine gesteigerte Expression verschiedener Vesikelproteine (Takei et al., 1997), mit der Folge einer schnellen Freisetzung des exzitatorischen Neurotransmitters Glutamat (Takei et al., 1998). BDNF fungiert darüber hinaus auch als spezifischer trophischer Faktor für GABAerge Interneuronen (Marty et al., 1997), und fördert die spezifische Ausschüttung von GABA im Rattencortex (Sala et al., 1998). Da tectale Horizontalzellen der Taube als GABAerge Interneuronen wirken (Henke et al., 1976a,b), welche synaptische Verbindungen mit postsynaptischer BDNF Lokalisation zeigten, sind die beschriebenen BDNF vermittelten Mechanismen auch für Horizontalzellen im TO der Taube sehr wahrscheinlich. Diese Daten deuten auf direkte Zusammenhänge zwischen nervaler Aktivität und der Freisetzung und Wirkung von Neurotrophinen hin, die im nächsten Abschnitt näher dargestellt werden. Diskussion 4.7 151 Aktivitätsabhängige Ausschüttung der Neurotrophine Die Phänomene einer aktivitätsabhängigen Freisetzung von Neurotrophinen wurden bereits im Säugercortex, einer ebenfalls funktionell und morphologisch in mehrere Schichten unterteilbaren Hirnstruktur, beschrieben, wo über diese Mechanismen die Entstehung und Etablierung okulärer Dominanzsäulen reguliert werden (Elliot & Shadbolt, 1998). In einer jüngsten Studie wird außerdem die „Neurotrophin induzierte Neurotrophin-Freisetzung“ postuliert (Krüttgen et al., 1998). Nach exzitatorischer Erregung und ihrer damit einhergehenden Freisetzung könnten Neurotrophine demnach ihre eigene Sekretion induzieren, um gezielte positive Signale auf subzellulärer Ebene zu bewirken. Ob die Freisetzung eine generelle neuronale Aktivität im Sinne eines exzitatorischen oder inhibitorischen Signalflusses erfordert oder nicht, ist gegenwärtig nicht zu beantworten. Gleichwohl werden unter anderem Glutamatrezeptoren für eine exzitatorische Signalleitung mit anschließender Neurotrophinfreisetzung diskutiert (Lindholm et al., 1994). Gemäß einem Modell von James E. Johnson von der „Wake Forest University“ in Amerika (persönliche Korrespondenz) kommt es hierbei zu einer präsynaptischen Ausschüttung des Neurotransmitters Glutamat, welcher postsynaptisch an den entsprechenden Glutamatrezeptoren bindet. Die anschließende, durch einen Natrium-Ionen Einstrom vermittelte, postsynaptische Depolarisation bewirkt eine durch zyklisches Adenosin-Mono-Phosphat (cAMP) regulierte Aktivierung des sekundären Botenstoffes Inositol-1,4,5-trisphosphat (IP 3), welches wiederum Calcium-Ionen aus intrazellulären Speichern wie dem endoplasmatischen Retikulum freisetzt. Diese Calcium-Ionen regulieren möglicherweise die postsynaptische BDNF-Sekretion, mit der Folge des unter Punkt 4.4 beschriebenen retrograden neurotrophen Signalflusses. Ebenfalls denkbar ist auch eine synergistische präsynaptische Ausschüttung eines Neurotransmitters und entsprechender Neurotrophine, mit der Konsequenz des unter Punkt 4.5 erläuterten anterograden neurotrophen Signalfluß. Entsprechend dem vorgestellten Modell sind Glutamat vermittelte, aktivitätsabhängige Prozesse der Neurotrophin-Freisetzung im retino-tectalen System der Taube denkbar. Im adulten TO der Taube wurden diverse AMPA-Rezeptor Untereinheiten (α-Amino-3-hydroxy-5-methyl-4isoxazolpropionsäure), welche zur Gruppe der ionotrophen non-NMDA Glutamatrezeptoren Diskussion 152 zählen, detektiert (Theiss et al., 1998). Immunhistochemisch wurde die Untereinheit Glu R1 in den tectalen Schichten 2 bis 5, 9, 10 und 13, die Untereinheiten Glu R2/3 in den Schichten 9, 10 und 13 dargestellt. In einer aktuellen Kooperation mit dem Institut für Hirnforschung (Prof. Zilles) von der Universität Düsseldorf wurden in autoradiographischen Untersuchungen außerdem glutamaterge Kainat-Rezeptoren und NMDA-Rezeptoren insbesondere in den superficialen Schichten des adulten TO der Taube gezeigt. Für das Neurotrophin BDNF wurde eine gesteigerte glutamaterge synaptische Übertragung durch vermehrte präsynaptische Transmitterausschüttung gezeigt (Leßmann & Heumann, 1998), die vermutlich durch eine BDNF induzierte Phosphorylierung von NMDA Rezeptoren induziert wird (Leßmann, 1998). Bislang fehlen Daten zur Expression von Glutamatrezeptoren in der embryonalen und juvenilen Taube. Dennoch konnten erste elektrophysiologische Ableitungen infolge visueller Reize der Retina in der ersten Woche nach dem Schlupf im TO der Taube erfolgen (Bagnoli et al., 1985, 1987), was auf eine funktionsfähige exzitatorische Signalleitung in diesem Entwicklungsstadium schließen läßt. Die elektrophysiologischen Daten und die Ergebnisse zur Expression der Neurotrophine und Neurotrophin Rezeptoren lassen den Schluß zu, daß eine aktivitätsabhängige BDNF-Freisetzung tectaler Neuronen nach erregender Signalleitung im retino-tectalen System der adulten Taube sehr wahrscheinlich ist, dieser Weg für NT-3 aber auf die juvenilen Stadien der Entwicklung begrenzt bleibt. Neben der hier dargestellten vermutlich aktivitätsabhängigen Ausschüttung der Neurotrophine weist das zeitlich graduierte Signal dieser Proteine auch auf eine aktivitätsabhängige Expression hin, die im nächsten Abschnitt diskutiert wird. 4.8 Aktivitätsabhängige Expression von BDNF, NT-3, trk B und trk C Die Annahme einer aktivitätsabhängigen Expression von Neurotrophinen und NeurotrophinRezeptoren leitet sich in der gegenwärtigen Arbeit aus den Daten zur BDNF, NT-3, trk B und trk C Synthese im retino-tectalen System der Taube ab. Retinale BDNF und NT-3 Expression, ebenso wie eine trk B und trk C Synthese wurde in der Taube ab dem Schlupftag beobachtet, dem Zeitpunkt einer gesteigerten retinalen Lichtstimulation. Bei Ratten wurden im Cortex eine Licht regulierte BDNF Expression nachgewiesen (Castren et al., 1992), und auch in der Diskussion 153 Hühnchen-Retina steigerte Licht die trk B und trk C Rezeptor-Expression, während diese bei Dunkelheit reduziert wurde (Okazawa et al., 1994). Im TO der Taube deutet die Expression von BDNF und NT-3 im Altersstadium E 14, dem Zeitpunkt des Einwachsens erster retinaler Axone in die mesencephale Struktur (Manns & Güntürkün, 1997), auf trophische Wechselwirkungen im retino-tectalen System hin. Gleichwohl sind es vornehmlich Neuronen der tiefen tectalen Schichten, die bedingt retino-rezipient sind (Hayes & Webster 1975; Hellmann & Güntürkün, 1999), und in den frühen Embryonalstadien BDNF und NT-3 synthetisieren. Als Voraussetzung für eine durch Licht gesteuerte Expression von Proteinen in den vom Auge entfernten Strukturen des visuellen Systems sind einwachsende axonale Projektionen retinaler Fasern in die betreffenden Hirnregionen anzunehmen. Die Reifung des TO der Taube vom 3-schichtigen Stadium zum Zeitpunkt E 11 bis zur 15-schichtigen und komplex verschalteten Struktur im juvenilen Altersstadium PH 15 dauert insgesamt etwa drei Wochen (Manns & Güntürkün, 1997). Erste retinale Axone erreichen das mesencephale TO im Altersstadium E14, in welchem die tectalen Laminae 7-15 angelegt sind. Als funktionell im Sinne einer exzitatorischen Signalleitung im retino-tectalen System wird das System in der ersten Woche nach dem Schlupf betrachtet, dem frühsten Zeitpunkt, zu welchem visuell erzeugte intratectale Antworten abgeleitet werden konnten (Bagnoli et al., 1985, 1987). Da sich allerdings Bagnoli und Mitarbeiter vornehmlich auf die foveale Region der Retina konzentrierte, ist es denkbar, daß Photorezeptoren der peripheren Retina in der Reifung der zentralen Retina voraus sind, und von diesen elektrische Impulse zum TO geleitet werden können. Für diese Hypothese spricht, daß bereits im Altersstadium E 15 der Pupillen Licht-Reflex ausgelöst werden kann (Heaton & Harth, 1974), gesteuert über eine kleine Anzahl an Ganglienzellen der peripheren Retina (Gamlin et al., 1984). Ein solcher räumlicher und zeitlicher Gradient wurde in der Hühnchen-Retina sowohl für die Expression verschiedener Photopigmentmoleküle wie Opsin und Rhodopsin (Bruhn & Cepko, 1996), als auch in der Entwicklung der retinalen Ganglienzellen von der Peripherie zu den zentralen Bereichen gezeigt (Rager et al., 1993). Ebenfalls denkbar sind aber auch spontan aktive retinale Ganglienzellen mit funktionellen Synapsen im retino-tectalen System bereits vor Beendigung der ersten Lebenswoche, über welche trk B und trk C vermittelte trophische Signalkaskaden (siehe Punkt 4.9) induzieren werden könnten. Über solche Wirkungsketten ist eine durch den epigenetischen Faktor Licht regulierte Expression der Neurotrophine und Neurotrophin-Rezeptoren im TO vor dem Schlupf der Taube denkbar, Diskussion 154 wobei funktionsfähige Photorezeptoren das durch die Eischale dringende Licht verarbeiten, die Erregung anschließend über die Bipolarzellen zu den retinalen Ganglienzellen gelangt, woraufhin deren Efferenzen den Impuls zum sich entwickelnden TO leiten. In der gegenwärtigen Arbeit wurde eine Neurotrophin Expression in der Taubenretina jedoch erst ab dem Schlupftag detektiert. Neben der Möglichkeit eines methodischen Fehlers bei der Darstellung dieser Antigene in den embryonalen Altersstadien, sind an der frühen Entwicklung der Retina und des retino-tectalen System möglicherweise andere Faktoren, zum Beispiel weitere Neurotrophine, beteiligt. Die Neurotrophine BNDF und NT-3 würden den Ergebnissen zur Folge erst ab dem Schlupf intrinsische trophische Funktionen in der Retina sowie anterograde trophische Signale im retino-tectalen System darstellen, erkennbar an der einsetzenden massiven Expression dieser Proteine und der entsprechenden trk Rezeptoren auf retinaler Ebene. Im juvenilen TO deuten die kolumnenartigen Expressionen der Neurotrophine und NeurotrophinRezeptoren in den superficialen und mittleren Zellschichten des juvenilen TO vermutlich auf Bereiche hin, in denen zum gegebenen Zeitpunkt retinale Fasern einwachsen, und dort möglicherweise die Expression von Neurotrophinen und Neurotrophin Rezeptoren über Aktivität fördern. Im anschließenden Kapitel werden bislang aufgeklärte intrazelluläre Signalkaskaden nach Bindung von Neurotrophinen an den korrespondierenden Rezeptoren dargestellt, um die steuernde Wirkung dieser trophischen Substanzen auf die Expression von Proteinen darzulegen. 4.9 Neurotrophin-induzierte intrazelluläre Signale Nach der Bindung der Neurotrophine an die entsprechenden trk Rezeptoren wird eine hoch komplexe intrazelluläre Signalkaskade aktiviert, über welche Neurotrophin-induzierte Wirkungen reguliert werden (Überblick: Heumann, 1994). Die Neurotrophin-Bindung am trk Rezeptor bewirkt die Phosphorylierung verschiedener Bereiche der Kinase-Region des Rezeptors (Jing et al., 1992). Hierdurch werden Bindungsstellen für Proteine mit src-Homologen Motiven (SH2) frei (Schlessinger, 1994). Bei den SH2 handelt es sich um Domänen mit mehr als hundert Aminosäuren, die eine hohe Affinität zu Protein-phosphorylierten Tyrosinresten zeigen (Schlessinger, 1994). Die SH2 Domänen werden wiederum durch die Rezeptor-Kinase der Diskussion 155 trk Rezeptoren phosphoryliert, mit der Folge einer aktivierten Signalkaskade. Phosphotyrosin Bindungsstellen für intrazelluläre SH2 Proteine auf trk Rezeptoren sind das Adapterprotein shc und die Phospholipase C (PLC). In einem möglichen Wirkungskreis assoziiert das Rezeptorgebundene shc-Protein mit dem Adapterprotein Grb, um anschließend einen Komplex mit dem cytoplasmatischen Protein SOS (son of sevenless) zu bilden (Suen et al., 1993; Hashimoto et al., 1994; Ohmichi et al., 1994). SOS aktiviert daraufhin das kleine G-Protein p21 Ras unter Umwandlung von Guanosindiphosphat zu Guanosintriphosphat (Burgering et al., 1993). Das aktivierte p21 Ras Signal führt wiederum zur Phosphorylierung des Serin/Threonin Kinase protoOncogens Raf, mit der Folge einer Raf vermittelten Phosphorylierung der Mitogen-aktivierten Protein Kinase Kinase (MAPKK), welche wiederum die Mitogen-aktivierte Protein Kinase (MAPK) durch Phosphorylierung anregt. In PC 12 Zellen besitzt die MAPK zwei extrazelluläre Signal-regulierte Kinasen: ERK 1 und ERK 2. Die ERKs haben verschiedene Ziele, wie die Zellzyklus steuernde S6-Kinase p90rsk (Blenis, 1993) oder auch Transkriptionsfaktoren (Janknecht et al., 1993). In diversen Untersuchungen konnte gezeigt werden, daß die beiden Neurotrophine BDNF und NT-3 vermutlich über die dargestellten Signalkaskaden die Hydrolyse der Phospholipase und die gesteigerte Transkription von c-fos bewirken (Widmer et al., 1993; Ohsawa et al., 1993), mit der letztendlichen Konsequenz eines Faserwachstums der aktivierten Zellen. Vermutlich sind die intrazellulären Wege für das Faserwachstum aber nicht identisch mit den bislang geklärten Signalwegen für die Steuerung der Zellmotilität (Heumann, 1994). Auf Grund der Komplexität dieser Signalwege ist es wahrscheinlich, daß weitere, spezifische Signalkaskaden an der Vermittlung trophischer Wirkungen hinsichtlich der Transmittersynthese, der Modulation synaptischer Effizienz, der zellulären Morphologie, oder auch der Neurotrophin induzierten Neurotrophinsynthese beteiligt sind (Cellerino & Maffei, 1996). Im folgenden Abschnitt wird diskutiert, welche Funktion Neurotrophine bei der Entstehung von Lateralisation ausüben könnten. Hierbei werden diverse morphologische Diskussionspunkte der vorangegangenen Abschnitte bezüglich des anterograden und retrograden trophischen Signalflusses, der aktivitätsabhängigen Expression und Freisetzung von Neurotrophinen und der intrazellulären Signalkaskade nach Neurotrophin-Bindung aufgegriffen und mit den Daten verschiedener Lateralisationsexperimente konferiert. Das abschließend dargelegte Modell zur Wirkung von Neurotrophinen ist gegenwärtig als rein hypothetisch zu bewerten. Diskussion 156 4.10 Wird visuelle Lateralisation durch Neurotrophine gesteuert? Seit Broca (1865) die asymmetrische Verarbeitung von Sprache der linken Hemisphäre zuordnete, hat das Wissen über die Lateralisation des Gehirns stetig zugenommen. Dennoch sind bis heute zahlreiche Fragen zu den Mechanismen von Lateralisation und deren Funktionen sowie der Entstehung der Hirnasymmetrien nicht beantwortet. Wenngleich mit Hilfe von Verhaltensexperimenten verschiedene Fragen zur lateralisierten Informationsverarbeitung des menschlichen Gehirns untersucht werden können, so sind insbesondere morphologische Untersuchungen dieses Gewebes meist nur sehr eingeschränkt möglich. Da aber auch im Tierreich lateralisierte Gehirne weit verbreitet sind, können gerade hier grundlegende morphologische Charakterisierungen von Hirnasymmetrien, die zumeist ein Indiz für funktionelle Asymmetrien sind, durchgeführt werden. Ein verbreitetes Modell zur Erforschung von Asymmetrien des Vertebratengehirns sind die Vögel. Untersuchungen zur asymmetrischen Informationsverarbeitung in verschiedenen Vogelspezies zeigen, daß Höhrempfindungen bei diesen primär in der linken Hemisphäre lokalisiert sind (Rogers & Anson, 1979), während Geruchsempfindungen dominant in der rechten Hemisphäre verarbeitet werden (Vallortigera & Andrew, 1994). Visuelle Eindrücke werden je nach Information unterschiedlich verarbeitet, bei Tauben im tectofugalen System primär linkshemisphärisch (Güntürkün, 1997c), und zumindest bei jungen Hühnchen im thalamofugalen System primär rechts-hemisphärisch (Rogers, 1996). Die bei der Taube in visuellen Diskriminationsversuchen gezeigte funktionelle Lateralisation des tectofugalen Systems mit einer Dominanz des rechten Auges sowie der linken Hirnhemisphäre spiegelt sich auch in morphologischen Asymmetrien des tectofugalen Systems wieder (Güntürkün, 1997a). Die Somata tectaler Neuronen der Schichten 2 bis 12 sind links-hemisphärisch größer, wohingegen die Neuronen der Schicht 13 in der rechten tectalen Hemisphäre größere Soma zeigen (Güntürkün, 1997a). Ebenfalls links-hemisphärisch größere Somata liegen im Nucleus rotundus der Taube vor (Manns & Güntürkün, 1999b). Neben den Unterschieden in den Somagrößen zwischen linker und rechter Hemisphäre wurde auch die asymmetrische Projektion des Tectum opticum auf den Nucleus rotundus gezeigt, wobei etwa zweimal mehr Fasern vom rechten TO zum linken Nucleus rotundus ziehen als umgekehrt (Güntürkün et al., 1999). Diskussion 157 Für die Etablierung dieser links-rechts Asymmetrien im visuellen System der Tauben ist ein Zusammenspiel von genetischen Faktoren und dem epigenetischen Faktor Licht während der Embryonalentwicklung maßgeblich verantwortlich (Güntürkün, 1993). In einer komplexen Signalkaskade bewirkt eine genetisch determinierte, asymmetrische Expression verschiedener Gene (siehe Einleitung) während der Gastrulationsphase die Rotation des Embryos im Ei. Hieraus resultiert bei Hühnchen und Tauben eine Drehung des Kopfes, in deren Folge das rechte Auge zur lichtdurchlässigen Eischale zeigt, das linke Auge hingegen durch den Körper des Tieres abgeschattet wird (Kuo, 1932). Diese Lage des Kopfes führt bereits vor dem Schlupf zu einer asymmetrischen Lichtstimulation des rechten Auges, während das linke Auge einer natürlichen monokularen Deprivation unterliegt. Wie Untersuchungen an hell-dunkel inkubierten Eiern oder monokular deprivierten Jungtieren zeigten, wird die Somagröße im Tectum opticum (Güntürkün, 1993; Manns & Güntürkün, 1999a), im Nucleus rotundus (Hermann & Bischof, 1986a), und im Ectostriatum (Hermann & Bischof, 1986b) entscheidend beeinflußt durch diese asymmetrische Lichtstimulation. Während in der embryonalen Entwicklungsphase des Tieres eine natürliche monokulare Deprivation des linken Auges vorliegt, so konnte bei Tauben auch direkt nach dem Schlupf eine Plastizität des visuellen Systems durch gezielte Manipulation mit Hilfe von Augenklappen demonstriert werden (Manns & Güntürkün, 1999a). Wenngleich das Zusammenspiel genetischer und epigenetischer Faktoren zur Etablierung von Hirnasymmetrien im visuellen System der Vertebraten bekannt ist, so bleibt die Frage, wie epigenetische Faktoren eine Asymmetrie des Gehirns induzieren, bislang unbeantwortet. Möglicherweise sind aktivitätsabhängige freigesetzte trophische Faktoren an der Etablierung visueller Asymmetrien beteiligt. Da die Projektionen der Retina im tectofugalen System komplett zur kontralateralen Hemisphäre ziehen, ist mit Ausnahme des Nucleus rotundus, welcher Efferenzen vom Tectum opticum beider Hemisphären erhält, keine synaptische Kompetition der Projektionen beider Augen in diesem System vorhanden. Im Tectum opticum ist es daher nicht die Konkurrenz zwischen innervierenden Axone an den Synapsen nach dem „Hebbschen Prinzips“ (Hebb, 1949), welche eine asymmetrische Morphologie dieser mesencephalen Struktur bewirkt, sondern es sind vermutlich aktivitätsabhängige, durch den epigenetischen Faktor Licht gesteuerte Prozesse. Im tectofugalen System der Taube könnten sich zum Beispiel morphologische Unterschiede durch Diskussion 158 aktivitätsabhängige Einflüsse retinaler Zellen auf tectale Neuronen manifestieren, bei welchen Neurotrophine entsprechend der Stärke retinaler Aktivität im TO der Taube ausgeschüttet werden (Güntürkün, 1997 a,b). Gemäß dieser Hypothese sind Neurotrophine als Teil einer „biochemischen Brücke“ zwischen dem epigenetischen Faktor Licht und dem Auftreten morphologischer Asymmetrien denkbar, um unter anderem vielfältige morphologische Effekte über eine gesteigerte Transkription verschiedener Gene zu induzieren. Evidenzen für ein solches Modell bilden einige Arbeiten, die unter anderem im TO von Hühnchen positive neurotrophe Effekte auf die Bildung retinaler Verzweigungen (Inoue & Sanes, 1997) sowie die Größe neuronaler Zellsoma aufzeigen (Ventimiglia et al., 1995). In kombinierten elektrophysiologischen und morphologischen Arbeiten wurde darüber hinaus gezeigt, daß aktivitätsabhängig freigesetzte Neurotrophine auch das axonale und dendritische Wachstum von Neuronen regulieren (McAllister, 1995, 1996). Bei Säugern wurde im Cortex in in vivo- und in vitro-Experimenten eine Signalkaskade mit der aktivitätsabhängigen Expression und Ausschüttung von Neurotrophinen demonstriert (Thoenen, 1995; Bonhoeffer, 1996; McAllister, 1996). Im visuellen System der Taube ist eine ähnliche Wirkungskette denkbar, bei welcher die asymmetrische Lichtstimulation des rechten Auges zu einer erhöhten Aktivität retinaler Ganglienzellen führt, mit der Folge einer aktivitätsabhängigen Sekretion von Neurotrophinen retinaler Efferenzen im linken Tectum opticum, in dem Zeitraum, in welchem funktionelle und morphologische Lateralisationen determiniert werden. Basierend auf den Ergebnissen der vorliegenden Untersuchungen werden vom Schlupftag an bis zum adulten Tier die Neurotrophine BDNF und NT-3 in der Retina und vom embryonalen Tag E 14 bis PH 14 die korrespondierenden Rezeptoren trk B und trk C im Tectum opticum exprimiert. Dadurch sind die Voraussetzungen für einen anterograden trophischen Signalfluß von der Retina zum Tectum opticum in diesem Zeitraum gegeben. Da die beiden Neurotrophine BDNF und NT-3 ab E 14 auch im Tectum opticum exprimiert werden, und retinale Ganglienzellen die entsprechenden Rezeptoren trk B und trk C ab PH 0 synthetisieren, ist desweiteren der retrograde trophische Signalfluß von BDNF und NT-3 vom Tectum opticum zur Retina ab dem Schlupftag der Tauben denkbar. Die Funktion eines solchen retrograden Signalweges liegt möglicherweise in einer verstärkten Transmitterausschüttung retinaler Axone auf tectalen Neuronen und der Stabilisierung der Synapsen. Diskussion 159 In der Retina setzt die Expression der untersuchten Proteine mit dem Schlupftag ein, daß heißt dem Zeitpunkt einer massiven Lichtstimulation. Möglicherweise werden die untersuchten Neurotrophine bereits vor dem Schlupftag exprimiert, wobei die Konzentration aber unter einer hier zu detektierenden Schwelle liegt. Die entsprechenden Rezeptoren für BDNF und NT-3 vermittelte Signale sind im Tectum opticum bereits in der embryonalen Taube vorhanden, beginnend mit dem Entwicklungszeitpunkt, an welchem retinale Fasern diese mesencephale Struktur erreichen. Eventuell sind aber an der embryonalen Anlage der Asymmetrien des retinotectalen System weitere Neurotrophine oder andere Faktoren beteiligt, während BDNF und NT-3 erst ab dem Schlupftag die primären Asymmetrien stabilisieren und etablieren. In einer aktuellen Arbeit wurde gezeigt, daß morphologische Asymmetrien im retino-tectalen System durch experimentelle monokulare Deprivation während einer kurzen Phase nach dem Schlupf beeinflußbar bleiben (Manns & Güntürkün, 1999a). Diese Phase der Plastizität des Systems stimmt überein mit den Entwicklungsprozesse des retino-tectalen Systems sowie dem Zeitraum der Expression der Neurotrophin Rezeptoren trk B und trk C im Tectum opticum. Zusammengenommen ist auf Grund der bisher gewonnen Daten eine Signalkaskade wahrscheinlich, bei welcher in der juvenilen Taube anterograde trophische BDNF und NT-3 Signale der Retina morphologische Charakteristika tectaler Neuronen, wie zum Beispiel die Größe des Somata, stabilisieren. Inwieweit BDNF und NT-3 auch als trophischen Faktoren an der primären Entwicklung der Asymmetrien des retino-tectalen System fungieren, müssen zukünftige Experimente zeigen. Ein solches Modell zu den möglichen Wirkungen von Neurotrophinen bei der Entstehung von Lateralisationen des Gehirns ist als Arbeitshypothese für weiterführende Experimente zu bewerten. In dem sich anschließenden Kapitel „4.11 Ausblick“ werden daher weitere Untersuchungen vorgeschlagen, die zusätzliche Erkenntnisse zur Wirkung von Neurotrophinen im retino-tectalen System der Taube erwarten lassen. Darüber hinaus wird im Kapitel „4.12 Therapeutische Einsatzmöglichkeiten von Neurotrophinen“ versucht, eine kurze Zusammenfassung der verschiedenen Einsatzmöglichkeiten von Neurotrophinen bei der Therapie neurodegenerativer Erkrankungen beim Menschen zu geben. Diskussion 160 4.11 Ausblick Die Ergebnisse zur Expression der Neurotrophine BDNF und NT-3 sowie der Neurotrophin Rezeptoren trk B und trk C zeigen eine Vielzahl von trophischen Mechanismen im untersuchten Tiermodell auf. Die in der Taube Columba livia auch nach dem Schlupf anhaltende Entwicklung des retino-tectalen Systems ebenso wie die in diesen Strukturen charakterisierten funktionellen und morphologischen Asymmetrien bieten eine gute Möglichkeit, in zukünftigen Arbeiten die Wirkungsmechanismen von Neurotrophinen bei der Etablierung von Hirnasymmetrien, als auch bei Entwicklungsprozessen von Neuronen zu untersuchen. • Durch Störungen der Neurotrophin Expression oder Blockierung der Substanzen zu entsprechenden Zeitpunkten sollten weitere Aufschlüsse über trophische Signalflüsse und deren Wirkungen erzielt werden. In weiterführenden Versuchen könnten dabei mittels eingesetzter Antikörper oder anti-sense Proben gegen BDNF, NT-3, trk B und trk C intraretinale, intratectale und ebenso retino-tectale trophische Wechselwirkungen studiert werden. Eine weitere Möglichkeit der Blockade trophischer Signalwege wäre die Applikation von Colchicin. Das Gift der Herbstzeitlosen depolymerisiert Mikrotubuli, die als Basis für den schnellen und langsamen anterograden Transport fungieren (McClure 1972, Krah & Meller, 1999). • Insbesondere die tectale Entwicklung bietet die Möglichkeit neuronale Migrationsprozesse und insbesondere die Zielfindung der Neuronen zu studieren. Hierbei könnten ultrastrukturelle Untersuchungen, speziell die Immunogold-Methode dazu dienen, eine genaue Lokalisation von Neurotrophinen und Neurotrophin Rezeptoren in Radialgliazellen zu ermitteln, um somit Wechselwirkungen von migrierenden Neuronen und Radialglia weitergehend zu erklären. Diskussion • 161 Die Ergebnisse zur Expression von BDNF und NT-3 im retino-tectalen System der Taube legen den Schluß nahe, daß die visuelle Lateralisation in diesen Tieren möglicherweise durch Neurotrophine beeinflußt wird. Da für die visuelle Lateralisation asymmetrische Lichteinflüsse verantwortlich sind, könnten Experimente mit dunkel-inkubierten Tieren und anschließenden quantifizierbaren biochemischen Verfahren möglicherweise Hinweise auf unterschiedlich stark exprimierte Neurotrophine in der linken versus der rechten Hemisphäre zu gewinnen. Alternativ bieten sich auch Versuche mit einseitigen Augenklappen oder Tetrodotoxin zur Verringerung der retinalen Aktivität an. 4.12 Therapeutische Einsatzmöglichkeiten von Neurotrophinen In der gegenwärtige Arbeit wurden neurotrophe Mechnismen während der Entwicklung und Etablierung in einem Teilbereich des visuellen Systems anhand der Taube Columba livia untersucht. Solche, im Tierexperiment gewonnenen Daten bilden zumeist die Basis für das Verständnis der Wirkungsweise von trophischen Substanzen im Nervengewebe allgemein. Im folgenden sollen in einem kurzen Überblick therapeutische Ansätze und Erfolge durch den Einsatz von Neurotrophinen bei verschiedenen neurodegenerativen Erkrankungen des Menschen diskutiert werden, wobei tierexperimentelle und humane Arbeiten, welche mögliche Wirkungsmechanismen erklären helfen, skizziert werden. Bei einer neurodegenerativen Erkrankung von Motoneuronen im Rückenmark, Hirnstamm und Cortex, die als amyotrophe laterale Sklerose bezeichnet wird (Rowland, 1987), wurde die abnorme Expression von Neurofilamenten beobachtet (Cöté et al., 1993). Verschiedene Experimente konzentrieren sich auf den therapeutischen Einsatz von Neurotrophinen bei dieser Erkrankung, da insbesondere die im Vorderhorn des Rückenmarks gelegenen MotoNeuronen einen guten experimentellen Zugang über ihre Axone gewährleisten. Wie in Tierexperimenten gezeigt wurde exprimieren Motoneuronen den trk B Rezeptor (Koliatsos et al., 1993). Eine Verletzung der Axone resultiert in einer gesteigerten Expression der trk B und BDNF Gene in diesen Nervenzellen (Kobayashi et al., 1996). Darüber hinaus in Zellkulturen gewonnene Daten zeigen, daß BDNF und NT-4 das Überleben der Motoneuronen fördert (Henderson et al., 1993), ebenso wie in verschiedenen in Hühnchen und Ratte Diskussion 162 durchgeführten in vivo-Untersuchungen. Die Ergebnisse klinischer Tests zur Wirkung von Neurotrophinen bei der amyotrophen lateralen Sklerose stehen jedoch noch aus (Hefti, 1997). Die Degeneration peripherer sensorischer Neuronen wird als sensorische Neuropathie bezeichnet, und tritt gehäuft bei Diabetes, nach einer Chemotherapie, Alkoholismus, AIDS, oder durch genetische Defekte bedingt auf (Watkins, 1992). Da Neurotrophine das Überleben sensorischer Neuronen im Tierexperiment zeigen (Hohn et al., 1990), sind klinische Anwendungen bei der Therapie dieser Erkrankungen denkbar. Die meisten sensorischen Neuronen exprimieren Neurotrophin Rezeptoren der trk Familie (Henderson et al., 1993). So wurde in Nagern durch NGF die sensorische Neuropathie eingeschränkt (Apfel et al., 1991, 1992). Außerdem zeigte NGF auch Effekte auf das Immunsystem (Torcia et al., 1996), wie zum Beispiel die stimulierte Histamin Freisetzung aus Mastzellen (Mazurek, 1986). Aber auch das Neurotrophin NT-3 ist vermutlich für das Überleben propriozeptiver sensorischer Neuronen verantwortlich (Snider, 1994). In klinischen Tests wird zur Zeit die Wirkung von Kombinationen aus verschiedenen Neurotrophinen, zum Beispiel durch synthetisch hergestellte NGF und NT-3 Heterodimere (Treanor et al., 1995), untersucht. Da bei der Parkinsonschen Krankheit dopaminerge Neuronen in der mesencephalen Substantia nigra sterben und der Ersatz des von diesen Nervenzellen produzierten Neurotransmitters L-Dopa bei ständiger Applikation an Wirkung verliert, bieten Neurotrophine neue therapeutische Ansätze zur Bekämpfung der Krankheit. In Tierexperimenten konnte gezeigt werden, daß unter anderem BDNF das Überleben von dopaminergen Neuronen fördert (Knusel et al., 1991; Hyman et al., 1991), wenngleich in adulten Ratten eine neuroprotektive Rolle für BDNF nach nigrostriataler Transsektion nicht bestätigt werden konnte (Knusel et al., 1992). Die bislang durchgeführten Experimente sind daher nicht ausreichend, um einen therapeutischen Einsatz von BDNF zur Abwehr der Degeneration dopaminerger Neuronen bei Parkinson Patienten sinnvoll erscheinen zu lassen. Charakteristische Kennzeichen der Alzheimer Krankheit sind Demenzen und der Verlust an Nervenzellen mit dem Entstehen von Plaques. Vor allem Bereiche im Gehirn, die mit dem Hippocampus verknüpft sind, werden von der Krankheit betroffen. Im Krankheitsbild besteht eine direkte Korrelation zwischen dem Verlust an Nervenzellen und Demenzen. Cholinerge Diskussion 163 Afferenzen bilden den Großteil der Eingangssignale zum Hippocampus, und eine Beeinflussung dieses Systems resultiert in einer beeinträchtigten Gedächtnisleistung (DeKosky et al., 1992; Lehericy et al., 1993). In Tierversuchen konnte gezeigt werden, daß durch das Neurotrophin NGF die Atrophie cholinerger Neuronen vermindert und Gedächtnisleistungen gesteigert wurden (Hefti et al., 1984, Hefti, 1986). Klinische Daten zur Wirkung von NGF bei Alzheimer Patienten liegen gegenwärtig nur eingeschränkt vor. Neben diesen kurz skizzierten, in der Zukunft möglicherweise in der Klinik nutzbaren Ergebnisse, sind zum Beispiel weitere Einsatzfelder bei Schlaganfall Patienten denkbar. Da nach einem Schlaganfall häufig Hirngewebe abstirbt, könnte die neuroprotektive Wirkung der Neurotrophine, die in Tierexperimenten dargestellt wurden (Buttini et al., 1996), neue Ansätze in der Akuttherapie darstellen. Allgemeine Zusammenfassung Das Gehirn der Vertebraten wird in seiner Komplexität von keinem anderen Organ übertroffen. Als höchstes Koordinationszentrum kennzeichnet es eine hohe Vielschichtigkeit bei der Verarbeitung von Informationen der Umwelt. Wenngleich das Wissen über einzelne Bauelemente des Gehirns, den Nervenzellen und Gliazellen, recht gut ist, so sind komplexe Prozesse, wie zum Beispiel die lateralisierte Verarbeitung von Informationen aus der Umwelt in der linken oder rechten Hemisphäre, bislang nicht umfassend verstanden. Insbesondere die Wirkungsketten, welche zur Ausbildung solcher Hirnasymmetrien führen, sind unbekannt. Grundsätzlich sind alle nervalen Systeme, einschließlich ihrer Musterbildung während der ontogenetischen Entwicklung determiniert. Die genetische Information allein reicht aber nicht aus, um sinnvolle Zellkontakte zwischen einzelnen Neuronen zu etablieren, unsinnige hingegen wieder zu verwerfen. Vielmehr sind weitere Faktoren für das Überleben einzelner Nervenzellen, die korrekte Verschaltung zwischen den Neuronen sowie der Etablierung von Asymmetrien im Gehirn erforderlich. Insbesondere den Neurotrophinen, es handelt sich hierbei um endogene, lösliche Proteine, die das Überleben, das Wachstum, die morphologische Plastizität und die Synthese von Proteinen in Neuronen regulieren, kommen zahlreiche Funktionen zu, welche sich zum einen auf die Etablierung nervaler Systeme, zum anderen aber auch auf die ständigen Feinanpassungen des Systems im adulten Tier beziehen. In der vorliegenden Arbeit wurden mögliche Funktionen der beiden Neurotrophine BDNF (brainderived neurotrophic factor) und NT-3 (neurotrophin-3) während der Entwicklung des Sehsystems der Taube Columba livia untersucht. Es handelt sich hierbei um ein System mit deutlichen morphologisch und funktionell charakterisierten Asymmetrien, die sich in einem Zeitraum von zirka zwanzig Tagen, beginnend vier Tage vor dem Schlupf, unter dem Einfluß einer asymmetrischen Lichtstimulation im Taubenei etablieren. Funktionell zeigen die Tiere eine Dominanz des rechten Auges, und aufgrund der exklusiven Verschaltung mit der linken Hirnhälfte auch eine Dominanz dieser bei der Erkennung und Verarbeitung von Objektinformationen und geometrischen Illusionen, im visuellen Gedächtnis, und beim Zurückfinden zu ihrem Heim über ein bekanntes Gebiet, sofern die Tiere mit dem rechten Auge sehen können. Auf mikroskopischer Ebene lassen sich in histologischen Untersuchungen strukturelle Korrelate dieser funktionellen Lateralisation erkennen, die sich in signifikant stärkeren Projektionen der rechten auf die linken Hemisphäre als umgekehrt sowie links-hemisphärisch größeren Nervenzellen ausdrücken. Für die Etablierung dieser Asymmetrien verantwortlich ist ein exaktes Zusammenspiel genetischer Faktoren und von Umwelteinflüssen während einer kritischen Phase der Entwicklung des visuellen Systems. Eine genetisch determinierte einseitige Expression bestimmter Signalmoleküle steuert zunächst eine Rotation des Taubenembryos im Ei, und diese Position des Embryos im Ei wiederum bedingt eine Abschattung des linken Auges durch den Körper, während das rechte Auge der Eischale zugewandt ist. Durch die Eischale eindringendes Licht, welches primär vom rechten Auge empfangen werden kann, ist bei der Taube der Umweltfaktor, welche die Ontogenese der visuellen Lateralisation des Taubengehirns in einem Zeitraum von zwei bis drei Wochen nach dem Schlupf steuert. In der von mir angefertigten Dissertation stellte sich nun die Frage, über welche Mechanismen diese asymmetrische Lichtstimulation in ein für Nervenzellen erkennbares Signal transferiert wird. Mit Hilfe verschiedener histologischer Untersuchungen, die am Lichtmikroskop, Fluoreszenzmikroskop und ultrastrukturell am Elektronenmikroskop ausgewertet wurden, konnte gezeigt werden, daß Neurotrophine eine entscheidende Rolle bei der Entwicklung nervaler Strukturen der Taube spielen. Sowohl in der Netzhaut der Tiere, als auch in den nachfolgenden Gebieten der visuellen Verarbeitung werden diese Proteine produziert. Ein sehr interessanter Befund der Arbeit war hierbei, daß Neurotrophine vermutlich auch an der Zellmigration, daß heißt dem Auswandern von Nervenzellen von ihrem Entstehungsort zu ihrem Zielgebiet im Hirngewebe eine entscheidende Rolle spielen. Mit Hilfe der elektronenmikroskopischen Untersuchungen gelang es, die genauen Signalwege zwischen der Netzhaut und den nachfolgenden Hirnstrukturen zu erfassen, wobei das Neurotrophin NT-3 vornehmlich Entwicklungsprozesse der Verbindungen zwischen dem Auge und dem Gehirn reguliert, während BDNF darüber hinaus auch in den erwachsenen Tieren eine ständige Feinanpassung des Systems ermöglicht. Auf Grund der in der vorliegenden Arbeit gewonnen Daten ist eine Beteiligung von BDNF und NT-3 an der Etablierung von Hirnasymmetrien in der Taube sehr wahrscheinlich. In der jungen Taube stabilisieren BDNF und NT-3 vermutlich morphologische Charakteristika von Nervenzellen, wie zum Beispiel die Größe der Nervenzellen oder deren Verzweigungen, und regulieren somit morpholgische Asymmetrien, die wiederum die Grundlage der funktionellen Lateralisation sind. Ob Neurotrophine auch primär das Umweltsignal Licht in eine für Nervenzellen verständliche Form übersetzen, oder Ihrerseits wiederum Teil einer größeren Signalkaskade sind, bleibt bislang noch unbeantwortet. Literatur 6 168 Literatur Abiru, Y., Katoh-Semba, R., Nishio, C. & Hatanaka, H. (1998). High potassium enhances secretion of neurotrophic factors from cultured astrocytes. Brain Research, 809, 115-126. Acheson, D.W.K., Kemplay, S.K., Webster, K.E. (1980). Quantitative analysis of optic terminal profile distribution within the pigeon optic tectum. Neuroscience, 5, 1067-1084. Adams, J.C. (1981). Heavy metal intenisification of DAB-based HRP reaction product. The Journal of Histochemistry and Cytochemistry, 29, 775. Allendoerfer, K.L., Cabelli, R.J., Escandón, E., Kaplan, D.R., Nikolics, K., & Shatz, C.J. (1994). Regulation of neurotrophin receptors during the maturation of the mammalian visual system. Journal of Neuroscience, 14, 1795-1811. Alonso, Y. (1998). Lateralization of visual guided behaviour during feeding in zebra finches (Taeniopygia guttata). Behavioural Processes, 43, 257-263. Alvarez-Buylla, A., Buskirk, D.R. & Nottebohm, F. (1987). Monoclonal antibody reveals radial glia in adult avian brain. Journal of Comparative Neurology, 264, 159-170. Alvarez-Buylla, A. & Nottebohm, F. (1988). Migration of young neurons in adult avian brain. Nature, 335, 353-354. Alvarez-Buylla, A., Theelen, M. & Nottebohm, F. (1988). Mapping of radial glia and of a new cell type in adult canary brain. Journal of Neuroscience, 8, 2707-2712. Anderson, K.D., Alderson, R.F., Altar, C.A., DiStefano, P.S., Corcoran, T.L., Lindsay, R.M. & Wiegand, S.J. (1995). Differential distribution of exogenous BDNF, NGF, and NT-3 in the brain corresponds to the relative abundance and distribution of high-affinity and low-affinity neurotrophin receptors. Journal of Comparative Neurolology, 357, 296-317. Angaut, P. & Repérant, J. (1976). Fine structure of the optic fibre termination layers in the pigeon optic tectum: a Golgi and electron microscope study. Neuroscience, 1, 93-105. Anton, E.S., Cameron, R.S., & Rakic, P. (1996). Role of neuron-glial junctional domain proteins in the maintenance and termination of neuronal migration across the embryonic cerebral wall. Journal of Neuroscience, 16, 2283-2293. Anton, E.S., Marchionni, M.A., Lee, K.-F. & Rakic, P. (1997). Role of GGF/neurgulin signaling in interactions between migrating neurons and radial glia in the developing cerebral cortex. Development, 124, 3501-3510. Apfel, S.C., Lipton, R.B., Arezzo, J.C. & Kessler, J.A. (1991). Nerve growth factor prevents toxic neuropathy in mice. Annals of Neurology, 29, 87-90. Literatur 169 Apfel, S.C., Arezzo, J.C., Lipson, L.A. & Kessler, J.A. (1992). Nerve growth factor prevents experimental cisplatin neuropathy. Annals of Neurology, 31, 76-80. Bagnoli, P., Porciatti, V., Lanfranchi, A. & Bedini, C. (1985). Developing pigeon retina: lightevoked responses and ultrastructure of outer segments and synapses. Journal of Comparative Neurology, 235, 384-394. Bagnoli, P., Porciatti, V., Fontanesi, G. & Sebastiani, L. (1987). Morphological and functional changes in the retinotectal system of the pigeon during the early posthatching period. Journal of Comparative Neurology, 256, 400-411. Barbacid, M. (1994). The trk family of neurotrophin receptors. Journal of Neurobiology, 25, 1386-1403. Barde, Y.A., Edgar, D. & Thoenen, H. (1982). Purification of a new neurotrophic factor from mammalian brain. EMBO Journal, 1, 549-553. Beart, P.M. (1976). An evaculation of L-Glutamate as the transmitter released from optic neve terminals of the pigeon. Brain Research, 110, 99-104. Berkemeier, L.R., Winslow, J.W., Kaplan, D.R., Nikolics, K., Goeddel, D.V. & Rosenthal, A. (1991). Neurotrophin-5: a novel neurotrophic factor that activates trk and trkB. Neuron, 7, 857-866. Bhattacharyya, A., Watson, F.L., Bradlee, T.A., Pomeroy, S.L., Stiles, C.D., & Segal, R.A. (1997). TrK receptors function as rapid retrograde signal carriers in the adult nervous system. Journal of Neuroscience, 5, 7007-7016. Biffo, S., Dechant, G., Okazawa, H. & Barde, Y.A. (1994). Molecular control of neuronal survival in the chick embryo. EXS, 71, 39-48. Bignami, A., Dahl, D. & Seiler, M.W. (1980). Neurofilaments in the chick embryo during early development. I. Immunofluorescent study with antisera to neurofilament protein. Developmental Neuroscience, 3, 151-161. Binggeli, R.L. & Paule, W. J. (1969). The pigeon retina: Quantitative aspects of the optic nerve and ganglion cell layer. Journal of Comparative Neurology, 137, 1-18. Blenis J. (1993). Signal transduction via the MAP kinases: proceed at your own RSK. Proceedings of the National Academy of Sciences of the USA, 90, 5889-5892. Review. Bloch, S. & Maturana, H.R. (1971). Oil droplet distribution and colour dirscrimination in the pigeon. Nature of New Biology, 234, 284-285. Bloch, S. & Martinoya, C. (1982). Comparing frontal and lateral viewing in the pigeon. I. Tachistoscopic visual acuity as a function of distance. Behavioural Brain Research, 5, 231244. Literatur 170 Blough, P.M. (1971). The visual acuity of the pigeon for distant targets. Journal of the Experimental Analysis of Behavior, 15, 57-67. Bonhoeffer, T. (1996). Neurotropins and activity-dependent development of the neocortex. Current Opinion in Neurobiology, 6, 119-126. Bothwell, M. (1995). Functional interactions of neurotrophins and neurotrophin receptors. Annual Review of Neuroscience, 18, 223-253. Bovolenta, P., Frade, J.-M., Martí, E., Rodríguez-Peña, M.-A., Barde, Y.-A., & RodríguezTébar, A. (1996). Neurotropin-3 antibodies disrupt the normal development of the chick retina. Journal of Neuroscience, 16, 4402-4410. Bowmaker, J.K. (1977). The visual pigments, oil droplets and spectral sensitivity of the pigeon. Vision Research, 17, 1129-1138. Brecha, N. (1978). Some observations on the organization of the avian optic tectum: afferent nuclei and their tectal projections. Thesis, State University of New York, Stony Brook. Brecha, N.C. & Karten, H.J. (1981). Organization of avian accessory optic system. Annals of the New York Academy of Sciences, 374, 215-229. Bridges, C.D. (1976). Vitamin A and the role of the pigment epithelium during bleaching and regeneration of rhodopsin in the frog eye. Experimental Eye Research, 22, 435-455. Britto, L.R., Keyser, K.T., Hamassaki, D.E. & Karten, H.J. (1988). Catecholaminergic subpopulation of retinal displaced ganglion cells projects to the accessory optic nucleus in the pigeon (Columba livia). Journal of Comparative Neurology, 269, 109-117. Broca, P. (1865). Sur le siège de la Faculté du langage articulé. Bulltein de la Societe de Antrhopologie (Paris), 6, 377-393. Bruhn, S., Cepko, C.L. (1996). Development of the pattern of photoreceptors in the chick retina. Journal of Neuroscience, 16, 1430-1439. Burgering, B.M., Pronk, G.J., van Weeren, P.C., Chardin, P. & Bos, J.L. (1993). cAMP antagonizes p21ras-directed activation of extracellular signal-regulated kinase 2 and phosphorylation of mSos nucleotide exchange factor. EMBO Journal, 12, 4211-4220. Buttini M, (1996). Expression of tumor necrosis factor alpha after focal cerebral ischaemia in the rat. Neuroscience, 71, 1-16. Cabelli, R.J., Shelton, D.L., Segal, R.A. & Shatz, C.J. (1995). Blockade of endogenous ligands of trkB inhibits formation of ocular dominance columns. Neuron, 19, 63-76. Literatur 171 Cabelli, R.J., Allendoerfer, K.L., Radeke, M.J., Welcher, A.A., Feinstein, S.C. & Shatz, C.J. (1996). Changing patterns of expression and subcellular localization of TrkB in the developing visual system. Journal of Neuroscience, 16, 7965-7980. Calvet, M.C., Calvet, J., Camacho, R. & Eude, D. (1983). The dendritic trees of Purkinje cells: a computer assisted analysis of HRP labeled neurons in organotypic cultures of kitten cerebellum. Brain Research, 280, 199-215. Carmignoto, G., Pizzorusso, T., Tia, S. & Vicini, S. (1997). Brain-derived neurotrophic factor and nerve growth factor potentiate excitatory synaptic transmission in the rat visual cortex. Journal of Physiology, 498, 153-164. Carraway, K.L. 3rd & Burden, S.J. (1995). Neuregulins and their receptors. Current Opinion in Neurobiology, 5, 606-612. Castren, E., Zafra, F., Thoenen, H. & Lindholm, D. (1992). Light regulates expression of brainderived neurotrophic factor mRNA in rat visual cortex. Proceedings of the National Academy of Sciences of the USA, 89, 9444-9448. Catsicas. M., P´equignot, Y. & Clarke, P.G. (1992): Rapid onset of neuronal death induced by blockade of either axoplasmic transport or action potentials in afferent fibers during brain development. Journal of Neuroscience, 12, 4642-4650. Cellerino, A. & Maffei, L. (1996). The action of neurotrophins in the development and plasticity of the visual cortex. Progress in Neurobiology, 49, 53-71. Cellerino, A., Pinzón-Duarte, G., Caroll, P. & Kohler, K. (1998). Brain-derived neurotrophic factor modulates the development of the dopaminergic network in the rodent retina. Journal of Neuroscience, 18, 3351-3362. Cheng, H.J., Nakamoto, M., Bergemann, A.D. & Flanagan, J.G. (1995). Complementary gradients in expression and binding of ELF-1 and Mek4 in development of the topographic retinotectal projection map. Cell, 82, 371-381. Cheng, T.P. & Reese, T.S. (1987). Recycling of plasmalemma in chick tectal growth cones. Journal of Neuroscience, 7, 1752-1759. Ciriaco, E., García-Suárez, O., Ricci, A., Abbate, F., Piedimonte, G. & Vega, J.A. (1997). Trklike proteins during the post-hatching growth of the avian bursa of Fabricius. Veterinary Immunology and Immunopathology,55, 313-320. Clarke, P.G.H. & Whitteridge, D. (1976). The Projection of the retina, including the “red area“ on to the optic tectum of the pigeon. Quarterly Journal of Experimental Physiologie, 61, 351-358. Clayton, N.S. & Krebs, J.R. (1994). Memory for spatial and object-specific cues in food-storing and non-storing birds. Journal of Comparative Physiology A, 174, 371-379. Literatur 172 Cohen, S., Levi-Montalcini, R. & Hamburger, V. (1954). A nerve growth-stimulating factor isolated from sarcomas 37 and 180. Proceedings of the National Academy of Sciences of the USA, 40, 1014-1018. Cohen-Cory, S., Dreyfus, C.F., Black, I.B. (1991). NGF and excitatory neurotransmitters regulate survival and morphogenesis of cultured cerebellar Purkinje cells. Journal of Neuroscience, 11, 462-471. Cohen-Cory, S. & Fraser, S.E. (1994). BDNF in the development of the visual system of Xenopus. Neuron, 12, 747-761. Cohen-Cory, S. & Fraser, S.E. (1995). Effects of brain-derived neurotrophic factor on optic axon branching and remodelling in vivo. Nature, 378, 192-196. Colucci,-Guyon, E., Giménez y Ribotta, M., Maurice, T., Babinet, C., & Privat, A. (1999). Cerebellar defect and impaired motor coordination in mice lacking vimentin. Glia, 25, 33-42. Conner, J.M., Lauterborn, J.C., Yan, Q., Gall, C.M., & Varon, S. (1997). Distribution of brainderived neurotrophic factor (BDNF) protein and mRNA in the normal adult rat CNS: Evidence for anterograde axonal transport. Journal of Neuroscience, 17, 2295-2313. Corfas, G. & Fischbach, G.D. (1993). The number of Na+ channels in cultured chick muscle is increased by ARIA, an acetylcholine receptor-inducing activity. Journal of Neuroscience, 13, 2118-2125. Cöté, F., Colland, J.F. & Julien, J.P. (1993). Progressive neuronopathy in transgenic mice expressing the human neurofilament heavy gene: a mouse model of amyotrophic lateral sclerosis. Cell, 73, 35-46. Cowan, W.M. Neuronal death as a regulative mechanism in the control of cell number in the nervous system. In: Reockstein, M. (Hrsg.), Development and aging in the nervous system, Academic Press, New York, 1973, 19-41. Cowan, W.M., Adamson, L. & Powell, T. P. S. (1961). An experimental study of the avian visual system. Journal of Anatomy, 95, 545-563. Crossland, W.J., Cowan, W.M., Rogers, L.A. & Kelly, J.P. (1974). The specification of the retino-tectal projection in the chick. Journal of Comparative Neurology,155, 127-164. Cotter, J.R. (1976). Visual and nonvisual units recorded from optic tectum of Gallus Domesticus. Brain Behavior and Evolution, 13, 1-21. Curcio, C.A. & Allen, K.A. (1990). Topography of ganglion cells in human retina. Journal of Comparative Neurology, 300, 5-25. Dahl, D., Rueger, D.C., Bignami, A., Weber, K. & Osborn, M. (1981). Vimentin, the 57 000 molecular weight protein of fibroblast filaments, is the major cytoskeletal component in immature glia. European Journal of Cell Biology, 24, 191-196. Literatur 173 Dantzker, J.L. & Callaway, E.M. (1998). The development of local, layer-specific visual cortical axons in the absence of extrinsic influences and intrinsic activity. Journal of Neuroscience, 18, 4145-4154. Davenport, R.W., Thies, E., Zhou, R. & Nelson, P.G. (1998). Cellular localization of ephrin-A2, ephrin-A5, and other functional guidance cues underlies retinotopic development across species. Journal of Neuroscience, 18, 975-986. Davidson, R.J. & Hugdahl, K. (Eds.), (1995). Brain Asymmetry. Cambridge, MIT Press. Davies, A.M. (1998). Neuronal survival: Earöly dependence on Schwann cells. Current Biology, 8, R15-R18. de Araujo, E.G & Linden, R (1993). Trophic factors produced by retinal cells increase the survival of retinal ganglion cells in vitro. European Journal of Neuroscience , 5, 1181-1188. Dechant, G., Biffo, S., Okazawa, H., Kolbeck, R., Pottgiesser, J. & Barde, Y.-A. (1993).Expression and binding characteristics of the BDNF receptor chick trkB. Development, 119, 545-558. DeKosky, S.T., Harbaugh, R.E., Schmitt, F.A., Bakay, R.A., Chui, H.C., Knopman, D.S., Reeder, T.M., Shetter, A.G. & Senter, H.J., Markesbery WR (1992). Cortical biopsy in Alzheimer's disease: diagnostic accuracy and neurochemical, neuropathological, and cognitive correlations. Intraventricular Bethanecol Study Group. Annals of Neurology, 32, 625-632 de la Rosa, E.J., Arribas, A., Frade, J.M. & Rodriguez-Tebar, A. (1994). Role of neurotrophins in the control of neural development: neurotrophin-3 promotes both neuron differentiation and survival of cultured chick retinal cells. Neuroscience, 58, 347-352. Diekamp, B., Prior, H. & Güntürkün, O. (in press). Lateralisation of serial color reversal learning in pigeons (Columba livia). Animal Cognition. Di Stefano, P.S., Friedman, B., Radziejewski, C., Alexander, C., Boland, P., Schick, C.M., Lindsay, R.M. & Wiegand, S.J. (1992). The neurotrophins BDNF, NT-3 and NGF display distinct patterns of retrograde transport in peripheral and central neurones. Neuron, 8, 983993. Domesick, V.B. & Morest, D.K. (1977b). Migration and differentiation of ganglion cells in the optic tectum of the chick embryo. Neuroscience, 2, 459-475. Domesick, V.B. & Morest, D.K. (1977a). Migration and differentiation of shepherd's crook cells in the optic tectum of the chick embryo. Neuroscience, 2, 477-491. Drescher, U., (1995). In vitro guidance of retinal ganglion cell axons by RAGS, a 25 kDa tectal protein related to ligands for Eph receptor tyrosine kinases. Cell, 82, 359-370. Literatur 174 Drum, K., Forbes, M.E., Wang, S.W. & Johnson, J.E. (1996). Treatment with BDNF does not prevent normal chicken retinal ganglion cell death in ovo. Society of Neuroscience, Abstract 22, 998. Dunlop, S.A. (1990). Early development of retinal ganglion cell dendrites in the marsupial Setonix brachyurus, quokka. Journal of Comparative Neurology, 293, 425-447. Ebadi, M., Bashir, R.M., Heidrick, M.L., Hamada, F.M., Refaey, H.E., Hamed, A., Helal, G., Baxi, M.D., Cerutis, D.R. & Lassi, N.K. (1997). Neurotrophins and their receptors in nerve injury and repair. Neurochemistry International, 30, 347-374. Ehlers, M.D., Kaplan, D.R. & Koliatsos, V.E. (1993). Retrograde transport of neurotrophin receptors. Society for Neuroscience Abstracts, 19, 538.24. Elliott, T. & Shadbolt, N.R. (1998). Competition for neurotrophic factors: Ocular dominance columns. Journal of Neuroscience, 18, 5850-5858. Escandon, E., Soppet, D., Rosenthal, A., Mendoza-Ramirez, J.L., Szonyi, E., Burton, L.E., Henderson, C.E., Parada, L.F. & Nikolics, K. (1994). Regulation of neurotrophin receptor expression during embryonic and postnatal development. Journal of Neuroscience, 14, 2054-2068. Falls, D.L., Rosen, K.M., Corfas, G., Lane, W.S. & Fischbach G.D. (1993). ARIA, a protein that stimulates acetylcholine receptor synthesis, is a member of the neu ligand family. Cell, 72, 801-815. Fawcett, J.P., Bamji, S.X., Causing, C.G., Aloyz, R., Ase, A.R., Reader, T.A., McLean, J.H., & Miller, F.D. (1998). Fuctional evidence that BDNF is an anterograde neuronal trophic factor in the CNS. Journal of Neuroscience, 18, 2808-2821. Fite, K.V., Brecha, N., Karten, H.J. & Hunt, S.P. (1981). Displaced ganglion cells and the accessory optic system of pigeon. Journal of Comparative Neurology, 195, 279288. Fournier, A.E., Beer, J., Arregui, C.O., Essagian, C., Aguayo, A.J. & McKerracher, L. (1997). Brain-derived neurotrophic factor modulates GAP-43 but not T alpha1 expression in injured retinal ganglion cells of adult rats. Journal of Neuroscience Research, 47, 561-572. Friedman, W.J., Olson, L. & Persson, H. (1991). Cells that express brain-derived neurotrophic factor mRNA in the developing postnatal rat brain. European Journal of Neuroscience, 3, 688-697. Frost, B.J. & Nakayama, K. (1983). Single visual neurons code opposing motion independent of direction. Science, 220, 744-745. Literatur 175 Frost, B.J., Scilley, P.L. & Wong, S.C.P. (1981). Moving backround patterns reveal doubleopponency of directionally specific pigeon tectal neurons. Experimental Brain Research, 43, 173-185. Frost, B.J., Wylie, D.R. & Wang, Y.-C. (1990). The processing of object and self-motion in the tectofugal and accessory optic pathways of birds. Vision Research, 30, 1677-1688. Furukawa, S., Sugihara, Y., Iwasaka, F., Fukumitsu, H., Nitta, A., Nomoto, H. & Furukawa, Y. (1998). Brain-derived neurotrophic factor-like immunoreactivity in the adult rat central nervous system predominantly distributed in neurons with substantial amounts of brain-derived neurotrophic factor messenger RNA or responsiveness to brain-derived neurotrophic factor. Neuroscience, 82, 653-670. Literatur 176 Gadisseux, J.F., Kadhim, H.J., van den Bosch de Aguilar, P., Caviness, V.S., Evrard, P. (1990). Neuron migration within the radial glial fiber system of the developing murine cerebrum: an electron microscopic autoradiographic analysis. Brain Research. Developmental Brain Research, 52, 39-56. Galifret, Y. (1968). Les diverses aires fonctionelles de la retine di pigeon. Zeitschrift für Zellforschung und Mikroskopische Anatomie, 86, 535-545. Galileo, D.S., Majors, J., Horwitz, A.F. & Sanes, J.R. (1992). Retrovirally introduced antisense integrin RNA inhibits neuroblast migration in vivo. Neuron, 9, 1117-1131. Gall, C.M., Gold, S.J., Isackson, P.J. & Seroogy, K.B. (1992). Brain-derived neurotrophic factor and neurotrophin-3 mRNAs are expressed in ventral midbrain regions containing dopaminergic neurons. Molecular and Cellular Neurosciences, 3, 56-63. Gallo, G. & Letourneau, P.C. (1998). Localized sources of neurotrophins initiate axon collateral sprouting. Journal of Neuroscience, 18, 5403-5414. Gamlin, P.D.R., Reiner, A., Erichsen, J.T., Karten, H.J., Cohen, D.H. (1984). The neural substrate for the pupillary light reflex in the pigeon (Columba livia). Journal of Comparative Neurology, 226, 523-543. Garner, A.S., Menegay, H.J., Boeshore, K.L., Xie, X.Y., Voci, J.M., Johnson, J.E. & Large, T.H. (1996). Expression of TrkB receptor isoforms in the developing avian visual system. Journal of Neuroscience, 16, 1740-1752. Götz, M., Stoykova, A. & Gruss, P. (1998). Pax6 controls radial glia differentiation in the cerebral cortex. Neuron, 21, 1031-1044. Götz, R., Koster, R., Winkler, C., Raulf, F., Lottspeich, F., Schartl, M. & Thoenen, H. (1994). Neurotrophin-6 is a new member of the nerve growth factor family. Nature, 372, 266-269. Goldberg S. (1974). Studies on the mechanics of development of the visual pathways in the chick embryo. Developmental Biology, 36, 24-43. Golden, J.A. & Cepko, C.L. (1996). Clones in the chick diencephalon contain multiple cell types and siblings are widely dispersed. Development, 122, 65-78. Golden, J.A., Zitz, J.C., McFadden, K. & Cepko, C.L. (1997). Cell migration in the developing chick diencephalon. Development, 124, 3525-3533. Goldowitz, D. & Mullen, R.J. (1982). Granule cell as a site of gene action in the weaver mouse cerebellum: evidence from heterozygous mutant chimeras. Journal of Neuroscience, 2, 14741485. Literatur 177 Graham, R.C. & Karnovsky, M.J. (1966). The early stages of absorption of injected horseradish peroxidase in the proximal tubules of mouse kidney: Ultrastructural cytochemistry by a new technique. The Journal of Histochemistry and Cytochemistry, 14, 291-302. Grainger, F., James, D.W. & Tresman, R.L. (1968). An electron-microscopic study of the early outgrowth from chick spinal cord in vitro. Zeitschrift für Zellforschung und Mikroskopische Anatomie, 90, 53-67. Grainger, F. & James, D.W. (1970). Association of glial cells with the terminal parts of neurite bundles extending from chick spinal cord in vitro. Zeitschrift für Zellforschung und Mikroskopische Anatomie, 108, 93-104. Gray, G.E. & Sanes, J.R. (1991). Migratory paths and phenotypic choices of clonally related cells in the avian optic tectum. Neuron, 6, 211-225. Gray, G.E. & Sanes, J.R. (1992). Lineage of radial glia in the chicken optic tectum. Development, 114, 271-283. Gregory, W.A., Edmondson, J.C., Hatten, M.E. & Mason, C.A. (1988). Cytology and neuronglial apposition of migrating cerebellar granule cells in vitro. Journal of Neuroscience, 8, 17281738. Güntürkün, O. (1985). Lateralization of visually controlled behavior in pigeons. Physiology and Behavior, 34, 575-577. Güntürkün, O. (1993). The ontogeny of visual lateralization in pigeons. German Journal of Psychology, 17, 276-287. Güntürkün, O. (1997a). Morphological asymmetries of the tectum opticum in the pigeon. Experimental Brain Research 116, 561-566. Academic Press, New York, Kap. 13: 245266. Güntürkün, O. (1997b). Visual lateralization in birds: from neurotrophins to cognition? European Journal of Morphology, 35, 290-302. Güntürkün, O. (1997c). Avian visual lateralization: a review. Neuroreport, 8, iii-xi. Güntürkün, O., Emmerton, J. & Delius, J.D. (1989). Neural asymmetries and viual behavior in birds. In: Lüttgau, H.C., Necker, R. (eds). Biological signal processing. Weinheim: Deutsche Forschungsgemeinschaft. VCH Verlagsgesellschaft. Güntürkün, O. & Hahmann, U. (1994). Visual acuity and hemispheric asymmetries in pigeons. Behavioural Brain Research, 60, 171-175. Güntürkün, O. & Hahmann, U. (1999). Functional subdivisions of the ascending visual pathway in the pigeon. Behavioural Brain Research, 98, 193-201. Literatur 178 Güntürkün, O., Hellmann, B., Melsbach, G. & Prior, H. (1998). Asymmetries of representation in the visual system of pigeons. Neuroreport, 9, 4127-4130. Güntürkün, O. & Hoferichter, H.H. (1985). Neglect after section of a left telencephalotectal tract in the pigeon. Behavioural Brain Research, 18, 1-9. Güntürkün, O. & Kesch, S. (1987). Visual lateralization during feeding in pigeons. Behavioral Neuroscience, 101, 433-435. Hackett, S.F., Friedman, Z., Freund, J., Schoenfeld, C., Curtis, R., DiStefano, P.S. & Campochiaro, P.A. (1998). A splice variant of trkB and brain-derived neurotrophic factor are co-expressed in retinal pigmented epithelial cells and promote differentiated characteristics. Brain Research, 789, 201-212. Hahmann, U. & Güntürkün, O. (1993). The visual acuity for the lateral visual field in the pigeon (Columba livia). Vision Research, 33, 1659-1664. Hallböök, F., Ibanez, C.F. & Persson, H. (1991). Evolutionary studies of the nerve growth factor family reveal a novel member abundantly expressed in Xenopus ovary. Neuron, 6, 845-858. Hallböök, F., Bäckström, A., Kullander, K., Kylberg, A., Williams, R. & Ebendal, T. (1995) Neurotrophins and their receptors in chicken neuronal development. International Journal of Developmental Biology, 39, 855-868. Hallböök, F., Bäckstrom, A., Kullander, K., Ebendal, T., Carri, N.G. (1996). Expression of neurotrophins and trk receptors in the avian retina. Journal of Comparative Neurology, 364, 664-676. Hamburger, V. (1934). The effects of wing bud extirpation on the development of the central nervous system. Journal of Experimental Zoology, 68, 449-494. Hamburger, V. & Levi-Montalcini, R. (1949). Proliferation, differentiation and degeneration in the spinal ganglia of the chick embryo under normal and experimental conditions. Journal of Experimental Zoology, 111, 457-502. Hankin, M.H. & Lund, R.D. (1987). Role of the target in directing the outgrowth of retinal axons: transplants reveal surface-related and surface-independent cues. Journal of Comparative Neurology, 263, 455-466. Hannestad, J., Germaná, A., Catania, S., Laurá, R., Ciriaco, E. & Vega, J.A. (1998). Neurotrophins and their receptors in the pigeon caecal tonsil. An immunohistochemical study. Veterinary Immunology and Immunopathology, 61, 359-367. Hardy, O., Leresche, N. & Jassik-Gerschenfeld, D. (1985). Morphology and laminar dirstribution of electrophysiologically identified cells in the pigeon´s optic tectum: an intracellular study. Journal of Comparative Neurology, 233, 390-404. Literatur 179 Hart, N.S., Partridge, J.C., Cuthill, I.C. (1998). Visual pigments, oil droplets and cone photoreceptor distribution in the european starling (Sturnus vulgaris). The Journal of Experimental Biology, 201, 1433-1446. Hashimoto Y, Matuoka, K., Takenawa, T., Muroya, K., Hattori, S. & Nakamura, S. (1994). Different interactions of Grb2/Ash molecule with the NGF and EGF receptors in rat pheochromocytoma PC12 cells. Oncogene, 9, 869-875. Hatten, M.E., Liem, R.K., Mason, C.A. (1986). Weaver mouse cerebellar granule neurons fail to migrate on wild-type astroglial processes in vitro. Journal of Neuroscience, 6, 2676-2683. Hatten, M.E. & Mason, C.A. (1990). Mechanisms of glial-guided neuronal migration in vitro and in vivo. Experimentia, 46, 907-916. Review. Haubensack, W., Narz, F., Heumann, R. & Leßmann, V. (1998). BDNF-GFP containing secretory granules are localized in the vicinity of synaptic junctions of cultured cortical neurons. Journal of Cell Science, 111, 1483-1493. Hayes, B.P. & Webster, K.E. (1975). An electrone microscope study of the retino-receptive layers of the pigeon optic tectum. Journal of Comparative Neurology, 162, 447-466. Hayes, B.P. & Holden, A.L. (1980). Size classes of ganglion cells in the central yellow field of the pigeon retina. Experimental Brain Research, 39, 269-275. Hayes, B.P. & Holden, A.L. (1983). The distribution of displaced ganglion cells in the retina of the pigeon. Experimental Brain Research, 49, 181-188. Hayes, B.P. & Webster, K.E. (1975). An electrone microscope study of the retino-receptive layers of the pigeon optic tectum. Journal of Comparative Neurology, 162, 447-466. Hayes, B.P. & Webster, K.E. (1985). Cytoarchitectural fields and retinal termination: an axonal transport study of laminar organization in the avian optic tectum. Neuroscience, 16, 641-657. Heaton, M.B. & Harth, M. (1974). Developing visual function in the pigeon embryo with comparative reference to other avian species. Journal of Comparative and Physiological Psychology, 86, 151-156. Hebb, D.O. (1949). The organization of behaviour. A neuropsychological theroy. John Wiley and Sons, London. Hefti, F. (1986). Nerve growth factor promotes survival of septal cholinergic neurons after fimbrial transections. Journal of Neuroscience, 6, 2155-2162. Hefti, F. (1997). Pharmacology of neurotrophic factors. Annual Review of Pharmacology and Toxicology 37, 239-267. Literatur 180 Hefti, F., Dravid, A. & Hartikka, J. (1984). Chronic intraventricular injections of nerve growth factor elevate hippocampal choline acetyltransferase activity in adult rats with partial septohippocampal lesions. Brain Research, 293, 305-311. Hefti, F., Dento, T.L., Knusel B., & Lapechak, P.A. (1993). Neurotrophic factors: what are they and what are they doing? In Neurotrophic factors (ed. S.E. Loughlin & J.H., Fallon), 25-49, Academic Press, San Diego. Heidenhain, R.P.H. (1878). Über sekretorische und trophische Drüsen-nerven. Pflügers Archiv, 17, 1-67. Hellige, J.B. (1993). Hemispheric Asymmetry: What´s right and what´s left. Cambridge, MA, Harvard University Press. Hellmann, B. & Güntürkün, O. (1999). Visual field heterogeneity within the tectorotundal projection of the pigeon. European Journal of Neuroscience, in press. Henderson, C.E., Camu, W., Mettling, C., Gouin, A., Poulsen, K., Karihaloo, M., Rullamas, J., Evans, T., McMahon, S.B. & Armanini, M.P. (1993). Neurotrophins promote motor neuron survival and are present in embryonic limb bud. Nature, 363, 266-270. Henke, H., Schenker, T. M. & Cuénod, M. (1976a). Uptake of neurotransmitter candidates by pigeon optic tectum. Journal of Neurochemistry, 26, 125-130. Henke, H., Schenker, T. M. & Cuénod, M. (1976b). Effects of retinal ablation on uptake of glutamate, glycine, GABA, proline and choline in pigeon tectum. Journal of Neurochemistry, 26, 131-142. Herzog, K.-H. & von Bartheld, C.S. (1998). Contributions of the optic tectum and the retina as sources of brain-derived neurotrophic factor for retinal ganglion cells in the chick embryo. Journal of Neuroscience, 18, 2891-2906. Herzog, K.-H., Bailey, K. & Barde, Y.-A. (1994). Expression of the BDNF gene in the developing visual system of the chick. Development, 120, 1643-1649. Heumann, R. (1994). Neurotrophin signalling. Current Opinion in Neurobiology, 4, 668-679. Heymach, J.V. Jr. & Barres, B.A. (1997). Neurotrophins moving forward. Nature, 389, 789791. Himwich, W. A. (1970). Developmental Neurobiology, C.C. Thomas, Springfield Illionois, USA. Hirschberger, W. (1967). Histologische Untersuchungen an den primären visuellen Zentren des Eulengehirns und der retinalen Repräsentation in ihnen. Journal für Ornithologie, 108, 187202. Hodos, W. (1969). Color discrimination deficits after lesions of nucleus rotundus in pigeons. Brain Behavior Evolution, 2, 185-200. Literatur 181 Hodos, W. (1976). Vision and the visual system. In: Progress in psychobiology and physiological psychology. (Sprague, J.M. & Epstein, A.N. eds.), New York, Academic Press, 29-62. Hodos, W. & Karten, H.J. (1970). Visual intensity and pattern discrimination deficits after lesions of ectostriatum in pigeons. Journal of Comparative Neurology, 140, 53-68. Hofer, M., Pagliusi, S.R., Hohn, A., Leibrock, J. & Barde, Y.A. (1990). Regional distribution of brain-derived neurotrophic factor mRNA in the adult mouse brain. EMBO Journal, 9, 24592464. Hohn, A., Leibrock, J., Bailey, K. & Barde Y.A. (1990). Identification and characterization of a novel member of the nerve growth factor/brain-derived neurotrophic factor family. Nature, 344, 339-341. Hughes. W.F. & McLoon, S.C. (1979). Ganglion cell death during normal retinal development in the chick: comparisons with cell death induced by early target field destruction. Experimental Neurology, 66, 587-601. Hunt, S.P. & Brecha, N. The avian optic tectum: A synthesis of morphology and biochemistry. In: H. Vanegas (Hrsg.), Comparative neurology of the optic tectum, Plenum Press, New York, London, 1984, 619-648. Hunt, S. P. & Künzle, H. (1976). Observations on the projections and intrinsic organization of the pigeon optic tectum: an autoradiographic study based on anterograde and retrograde, axonal and dendritic flow. Journal of Comparative Neurology, 170, 153-172. Hunt, S.P., Streit, P., Künzle, H. & Cuénod, M. (1977). Characterization of the pigeon isthmotectal pathway by selective uptake and retrograde movement of radioactive compounds and by golgi-like horseradish peroxidase labeling. Brain Research, 129, 197-212. Hunt, S. P. & Webster, K. E. (1972). Thalamo-hyperstriate interrelations in the pigeon. Brain Research, 44, 647-651. Husmann, K., Faissner, A. & Schachner, M. (1992). Tenascin promotes cerebellar granule cell migration and neurite outgrowth by different domains in the fibronectin type III repeats. Journal of Cell Biology, 116, 1475-1486. Hyman, C., Hofer, M., Barde, Y.A., Juhasz, M., Yancopoulos, G.D., Squinto, S.P. & Lindsay, R.M. (1991). BDNF is a neurotrophic factor for dopaminergic neurons of the substantia nigra. Nature, 350, 230-232. Ibanez, C.F. (1996). Neurotrophin-4: the odd one out in the neurotrophin family. Neurochemical Research, 21, 787-793. Literatur 182 Illing, R. B. & Wässle, H. (1981). The retinal projection to the thalamus in the cat: a quantitative investigation and a comparison with the retinotectal pathway. Journal of Comparative Neurology, 202, 265-285. Inoue, A. & Sanes, J.R. (1997). Lamina-specific connectivity in the brain: Regulation by Ncadherin, neurotrophins, and glycoconjugates. Science, 276, 1428-1431. Literatur 183 Ip, N.Y., Ibanez, C.F., Nye, S.H., McClain, J., Jones, P.F., Gies, D.R., Belluscio, L., Le Beau, M.M., Espinosa, R. 3d, Squinto, S.P. et al (1992). Mammalian neurotrophin-4: structure, chromosomal localization, tissue distribution, and receptor specificity. Proceedings of the National Academy of Science of the U.S.A., 89, 3060-3064. Jacobsen, M. (1978). Developmental Neurobiology (2ed.), Plenum Press, New York, London, 1978. Jäger, C.B., Kapoor, R., & Llinas, R. (1988). Cytology and organization of rat cerebellar organ cultures. Neuroscience, 26, 509-538. Janknecht, R., Ernst, W.H., Pingoud, V. & Nordheim, A. (1993). Activation of ternary complex factor Elk-1 by MAP kinases. EMBO Journal, 12, 5097-5104. Jassik-Gerschenfeld, D. & Guichard, J (1972). Visual receptive fields of single cells in the pigeon´s optic tectum. Brain Research, 40, 303-317. Jassik-Gerschenfeld, D., Guichard, J. & Tessier, Y. (1975). Localization of directionally selective and movement sensitive cells in the optic tectum of the pigeon. Vision Research, 15, 10371038. Jelsma, T.N., Friedman, H.H., Berkelaar, M., Bray, G.M. & Aguayo, A.J. (1993). Different forms of the neurotrophin receptor trkB mRNA predominate in rat retina and optic nerve. Journal of Neurobiology, 24, 1207-1214. Jing, S., Tapley, P. & Barbacid, M. (1992). Nerve growth factor mediates signal transduction through trk homodimer receptors. Neuron, 9, 1067-1079. Johnson, J.E., Barde, Y.A., Schwab, M. & Thoenen, H. (1986). Brain-derived neurotrophic factor supports the survival of cultured rat retinal ganglion cells. Journal of Neuroscience, 6, 3031-3038. Jones, K.R., Farinas, I., Backus, C. & Reichardt, L.F. (1994). Targeted disruption of the BDNF gene perturbs brain and sensory neuron development but not motor neuron development. Cell, 76, 989-999. Kálmán, M., Székely, A.D. & Csillag, A. (1998). Distribution of glial fibrillary acidic protein and vimentin-immunopositive elements in the developing chicken brain from hatch to adulthood. Anatomy and Embryology, 198, 213-235. Kamel, Y., Inagaki, N., Nishizawa, M., Tsutsumi, O., Taketani, Y., & Inagaki, M. (1998). Visualization of mitotic radial glial lineage cells in the developing rat brain by Cdc2 kinasephosphorylated vimentin. Glia, 23, 191-199. Kang, H.J. & Schuman, E.M. (1995). Neurotrophin-induced modulation of synaptic transmission in the adult hippocampus. Journal of Physiology, 89, 11.23. Literatur 184 Kaplan, D.R., Hempstead, B.L., Martin-Zanca, D., Chao, M.V. & Parada, L.F. (1991) The trk proto-oncogene product: a signal transducing receptor for nerve growth factor. Science, 252, 554-558. Karten, H. J. & Nauta, W. J. H. (1968). Organization of retino-thalamic projections in the pigeon and owl. The Anatomical Record, 160, 373. Karten, J.H., Hodos, W., Nauta, W.J.H. & Revzin, A.L. (1973). Neural connections of the ‘visual wulst’ of the avian telencephalon. Experimental studies in the pigeon (Columba livia) and owl (Speotyto cunicularia). Journal of Comparative Neurology, 150, 253-277. Karten, H. J. & Shimizu, T. (1989). The origins of neocortex: Connections and laminations as distinct events in evolution. Journal of Cognitive Neuroscience, 1, 291-301. Katoh-Semba, R., Semba, R., Takeuchi, I.K. & Kato, K. (1998). Age-related changes in levels of brain-derived neurtrophic factor in selected brain regions of rats, normal mice and senescence-accelerated mice: a comparison to those of nerve growth factor and neurotrophin-3. Neuroscience Research, 31, 227-234. Kawamuro, K., Irie, T. & Nakamura T. (1997). Filtering effect of cone oil droplets detected in the P-III response spectra of Japanese quail. Vision Research, 37, 2829-2834. Kelly, J.P. & Cowan, M.W. (1972). Studies on the development of the chick optic tectum. 3. Effects of early eye removal. Brain Research, 42, 263-288. Klein, R., Jing, S.Q., Nanduri, V., O'Rourke, E. & Barbacid, M. (1991). The trk protooncogene encodes a receptor for nerve growth factor. Cell, 65, 189-197. Klein, R., Parada, L.F., Coulier, F. & Barbacid, M. (1989). TrkB, a novel tyrosine protein kinase receptor expressed during mouse neural development. EMBO Journal, 8, 3701-3709. Klein, R., Conway, D., Parada, L.F. & Barbacid, M. (1990). The trkB tyrosine protein kinase gene codes for a second neurogenic receptor that lacks the catalytic kinase domain. Cell, 61, 647-656. Klein, R., Lamballe, F., Bryant, S. & Barbacid, M. (1992). The trkB tyrosine protein kinase is a receptor for neurotrophin-4. Neuron, 8, 947-956. Knudsen, E.I. & Knudsen, P.E. (1983). Space-mapped auditory projections from the inferior colliculus to the optic tectum in the barn owl (Tyto alba). Journal of Comparative Neurology, 218, 187-196. Knusel, B., Winslow, J.W., Rosenthal, A., Burton, L.E., Seid, D.P., Nikolics, K. & Hefti, F. (1991). Promotion of central cholinergic and dopaminergic neuron differentiation by brainderived neurotrophic factor but not neurotrophin 3. Proceedings of the National Academy of Sciences of the USA, 88, 961-965. Literatur 185 Knusel, B., Beck, K.D., Winslow, J.W., Rosenthal, A., Burton, L.E., Widmer, H.R., Nikolics, K. & Hefti, F. (1992). Brain-derived neurotrophic factor administration protects basal forebrain cholinergic but not nigral dopaminergic neurons from degenerative changes after axotomy in the adult rat brain. Journal of Neuroscience, 12, 4391-4402. Kobayashi, N.R., Bedard, A.M., Hincke, M.T. & Tetzlaff, W. (1996). Increased expression of BDNF and trkB mRNA in rat facial motoneurons after axotomy. European Journal of Neuroscience, 8, 1018-1029. Koliatsos, V.E., Clatterbuck, R.E., Winslow, J.W., Cayouette, M.H. & Price, D.L. (1993). Evidence that brain-derived neurotrophic factor is a trophic factor for motor neurons in vivo. v, 10, 359-367. Krah, K. & Meller, K. (1999). Axonal and dendritic transport in Purkinje cells of cerebellar slice cultures studied by microinjection of HRP. Cell Tissue Research, 295,55-64. Krüttgen, A., Möller, J.C., Heymach, J.V.Jr., & Shooter, E.M. (1998). Neurotrophins induce release of neurotrophins by the regulated secretory pathway. Proceedings of the National Academy of Sciences USA, 95, 9614-9619. Kumar, S., Pena, L.A. & de Vellis, J. (1993). CNS glial cells express neurotrophin receptors whose levels are regulated by NGF. Brain Research Molelular Brain Research, 17, 163168. Kuo, Z.Y. (1932). Ontogeny of embryonic behavior in aves. III. The structural and environmental factors in embryonic bahavior. Journal of Comparative Psychology, 13, 245-271. Lai, K.-O., Fu, W.-Y., Ip, F.C. & Ip, N.Y. (1998). Cloning and Expression of a Novel Neurotrophin, NT-7, from Carp. Molecular and Cellular Neuroscience, 11, 64-76. Lai, K.-O., Fu, W.-Y., Ip, F.C.F., & Ip, N.Y. (1998). Cloning and expression of a novel neurotrophin, NT-7, from carp. Molecular and Cellular Neuroscience, 11, 64-76. Lamballe, F., Klein, R. & Barbacid, M. (1991). Trk C, a new member of the trk family of tyrosine protein kinases, is a receptor for neurotrophin-3. Cell, 66, 967-979. LaVail, J.H. & Cowan, W.M. (1971). The development of the chick optic tectum. II. Autoradiographic studies. Brain Research, 28, 421-441. Lehericy S, (1993). Heterogeneity and selectivity of the degeneration of cholinergic neurons in the basal forebrain of patients with Alzheimer's disease. Journal of Comparative Neurology, 330, 15-31. Leibrock, J., Lottspeich, F., Hohn, A., Hofer, M., Hengerer, B., Masiakowski, P., Thoenen, H. & Barde, Y.A. (1989). Molecular cloning and expression of brain-derived neurotrophic factor. Nature, 341, 149-152. Literatur 186 Lemmon, V. (1985). Monoclonal antibodies specific for glia in the chick nervous system. Brain Research, 355, 111-120. Leßmann, V.. (1998). Neurotrophin-dependent modulation of glutamaterigc synaptic transmission in the mammalian CNS. General Pharmacology, 31, 667-674. Leßmann, V. & Heumann, R. (1998). Modulation of unitary glutamatergic synapses by neurotrophin-4/5 or brain-derived neurotrophic factor in hippocampal microcultures: Presynaptic enhancement depends on pre-e stablished paired-pulse facilitation. Neuroscience, 86, 399-413. Letelier, J. (1983). Respuestas cromáticas en el tectum óptico de la paloma. Tesis de Licenciatura, Fakultad de Ciencias, Universitad de Chile, Santiago, Chile Levi-Montalcini, R. & Hamburger, V. (1951). Selective growth stimulating effects of mouse sarcoma on the sensory and sympathetic nervous system of the chick embryo. Journal of Experimental Zoology, 116, 321-361. Levi-Montalcini, R., Meyer, H. & Hamburger, V. (1954). In vitro experiments on the effects of mouse sarcomas 180 and 37 on the spinal and sympathetic ganglia of the chick embryo. Cancer Research, 14, 49-57. Levi-Montalcini, R. (1987). The nerve growth factor 35 years later. Science, 237, 1154-1162. Levin, M., Johnson, R.L., Stern, C.D., Kuehn, M. & Tabin, C. (1995). A molecular pathway determining left-right asymmetry in chick embryogenesis. Cell, 82, 803-814. Levitt, P. & Rakic, P. (1980). Immunoperoxidase localization of glial fibrillary acidic protein in radial glial cells and astrocytes of the developing rhesus monkey brain. Journal of Comparative Neurology, 193, 815-840. Lieberman, A.R. & Webster, K.E. (1974). Ultrastructural aspects of the synaptic organization of intrinsic neurons in the dorsal geniculate nucleus of the rat. Journal of Neuroscience, 3, 677. Lindholm, D., Dechant, G., Heisenberg, C.P. & Thoenen, H. (1993). Brain-derived neurotrophic factor is a survival factor for cultured rat cerebellar granule neurons and protects them against glutamate-induced neurotoxicity. European Journal of Neuroscience, 5, 1455-1464. Lindholm, D., Castrén, E., Berzaghi, M., Blöchl, A., & Thoenen, H. (1994). Activity –dependent and hormonal regulation of neurotrophin mRNA levels in the brain – Implications for neuronal plasticity. Journal of Neurobiology, 25, 1362-1372. Liu, Z.Z., Zhu, L.Q., & Eide, F.F. (1997). Critical role of TrkB and brain-derived neurotrophic factor in the differentiation and survival of retinal pigment epithelium. Journal of Neuroscience, 17, 8749-8755. Literatur 187 Llamosas, M.M., Cernuda-Cernuda, R., Huerta, J.J., Vega, J.A. & García-Fernández, J.M. (1997). Neurotrophin receptors expression in the developing mouse retina: an immunohistochemical study. Anatomy and Embryology, 195, 337-344. Loeb, D.M., Tsao, H., Cobb, M.H. & Greene, L.A. (1992). NGF and other growth factors induce an association between ERK1 and the NGF receptor gp140prototrk. Neuron, 9, 10531065. López, T., López-Colome, A.M., & Ortega, A. (1997). NMDA receptors in cultured radial glia. FEBS Letters, 405, 245-248. Lowenstein, E.J., Daly, R.J., Batzer, A.G., Li, W., Margolis, B., Lammers, R., Ullrich, A., Skolnik, E.Y., Bar-Sagi, D. & Schlessinger, J. (1992). The SH2 and SH3 domain-containing protein GRB2 links receptor tyrosine kinases to ras signaling. Cell, 70, 431-442. Lund, R.D. (1969). Synaptic patterns of the superficial layers of the superior colliculus of the rat. Journal of Comparative Neurology, 135, 179. Ma, Y.-T., Hsieh, T., Forbes, M.E., Johnson, J.E., & Frost, D.O. (1998). BDNF injected into the superior colliculus reduces developmental retinal ganglion cell death. Journal of Neuroscience, 18, 2097-2107. Macko, K. & Hodos, W. (1984). Near-field acuity after visual system lesions in pigeons: I. Thalamus. Behavioral Brain Research, 13, 1-14. Magendie, M. (1824). De l`influence de la cinquième paire de nerfs sur la nurtrition et les fonctions de l`oeil. Journal de Physiologie Experimentale et Pathologique, 4, 176-182. Mahanthappa, N.K., Anton, E.S. & Matthew, W.D. (1996). Glial growth factor 2, a soluble neuregulin, directly increases Schwann cell motility and indirectly promotes neurite outgrowth. Journal of Neuroscience, 16, 4673-4683. Maisonpierre, P.C., Belluscio, L., Squinto, S., Ip, N.Y., Furth, M.E., Lindsay, R.M. & Yancopoulos, G.D. (1990). Neurotrophin-3: a neurotrophic factor related to NGF and BDNF. Science, 247, 1446-1451. Manns, M. & Güntürkün, O. (1997). Development of the retinotectal system in the pigeon: a cytoarchitectonic and tracing study with cholera toxin. Anatomy and Embryology, 195, 539555. Manns, M. (1998). Die Ontogenese visueller Lateralisation bei der Taube (Columba livia): Entwicklung und Plastizität des Systems. PhD thesis, Fakultät für Psychologie, RuhrUniversität Bochum. Manns, M. & Güntürkün, O. Monocular deprivation alters the direction of functional and morphological asymmetries in the pigeon's visual system. Behavioral Neurscience, (im Druck). Literatur 188 Manns, M. & Güntürkün, O. `Natural´and artificial monocular deprivation effects on thalamic soma sizes in pigeons. Neuroreport, (im Druck). Mariani, A. P. & Leure-du Pree, A. E. (1978). Photoreceptors and oildroplet colors in the red area of the pigeon retina. Journal of Comparative Neurology, 182, 821-838. Martinoya, C., LeHouezec, J. & Bloch, S. (1988). Depth resolution in the pigeon. Journal of Comparative Physiology, 163, 33-42. Martin-Zanca, D., Hughes, S.H., Barbacid M. (1986). A human oncogene formed by the fusion of truncated tropomyosin and protein tyrosine kinase sequences. Nature, 319, 743-748. Martin-Zanca, D., Oskam, R., Mitra, G., Copeland, T., Barbacid, M. (1989). Molecular and biochemical characterization of the human trk proto-oncogene. Molecular and Cellular Biology, 9, 24-33. Marturana, H. R. (1962). Functional organization of the pigeon retina. In: 22nd Congreß of Physiology Science, Leyden, 170-178. International Marturana, H. R. & Frenk, S. (1963). Directional movement and horizontal edge detectors in the pigeon retina. Science, 142, 977. Marty, S., de Penha Berzaghi, M. & Berninger, B. (1997). Neurotrophins and activity-dependent plasticity of cortical interneurons. Trends in Neurosciences, 20, 198-202. Mason, C.A., Christakos, S. & Catalano, S.M. (1990). Early climbing fiber interactions with Purkinje cells in the postnatal mouse cerebellum. Journal of Comparative Neurology, 297, 77-90. Mazurek, N., Weskamp, G., Erne, P. & Otten, U. (1986). Nerve growth factor induces mast cell degranulation without changing intracellular calcium levels. FEBS Letters, 198, 315-320. McAdams, B.D. & McLoon, S.C. (1995). Expression of chondroitin sulfate and keratan sulfate proteoglycans in the path of growing retinal axons in the developing chick. Journal of Comparative Neurology, 352, 594-606. McAllister, A.K., Lo, D.C. & Katz, L.C. (1995). Neurotrophins regulate dendritic growth in developing visual cortex. Neuron, 15, 791-803. McAllister, A.K., Katz, L.C. & Lo, D.C. (1996). Neurotrophin regulation of cortical dendritic growth requires actvity. Neuron, 17, 1057-1064. McClure, W. (1972). Effects of drugs upon axoplasmic transport. Advancces in Pharmacology and Chemotherapy, 10, 185-220. McGill, J.I., Powell, T.P.S. & Cowan, W.M. (1966). The retinal representation upon the optic tectum and isthmo-optic nucleus in the pigeon. Journal of Anatomy, 100, 5-34. Literatur 189 McLoon, S.C. (1985). Evidence for shifting connections during development of the chick retinotectal projection. Journal of Neuroscience, 5, 2570-2580. McLoon, S.C. & Lund, R.D. (1980). Identification of cells in retinal transplants which project to host visual centers: a horseradish peroxidase study in rats. Brain Research, 197, 491-495. Meier, R.E. & Cuénod, M. (1973). Autoradiographic demonstration of retinal projections in the pigeon (Columba livia). Acta Anatomy, 301. Meller, K. (1979). Scanning electron microscope studies on the development of the nervous system in vivo and in vitro. International Review of Cytology, 56, 23-56. Meller, K. & Tetzlaff, W. (1975). Neuronal migration during the early development of the cerebral cortex. A scanning electron microscopy study.Cell and Tissue Research, 163, 313325. Meller, K. & Tetzlaff, W. (1976). Scanning electron microscopic studies on the development of the chick retina.Cell and Tissue Research, 170, 145-159. Mench, J.A., Andrew, R.J. (1986). Lateralisation of a food search task in the domestik chick. Behavioral and Neural Biology, 46, 107-114. Merlio, J.P., Ernfors, P., Jaber, M. & Persson, H. (1992). Molecular cloning of rat trkC and distribution of cells expressing messenger RNAs for members of the trk family in the rat central nervous system. Neuroscience, 51, 513-532. Meyer, S.A., Ingraham, C.A. & McCarthy, K.D. (1989). Expression of vimentin by cultured astroglia and oligodendroglia. Journal of NeuroscienceResearch, 24, 251-259. Middlemas, D.S., Lindberg, R.A. & Hunter, T. (1991). TrkB, a neural receptor protein-tyrosine kinase: evidence for a full-length and two truncated receptors. Molecular and Cellular Biology, 11, 143-153. Ming, G.-l., Lohof, A.M., & Zheng, J.Q. (1997). Acute morphogenic and chemotropic effects of neurotrophins on cultured embryonic Xenopus spinal neurons. Journal of Neuroscience, 17, 7860-7871. Morest, D.K. (1970a). The pattern of neurogenesis in the retina of the rat. Zeitschrift für Anatomie und Entwicklungsgeschichte, 131, 45-67 Morest, D.K. (1970a). A study of neurogenesis in the forebrain of opossum pouch young. Zeitschrift für Anatomie und Entwicklungsgeschichte , 130, 265-305. Morris, V. B. (1970). Symmetry in a receptor mosaic demonstrated in the chick from the frequency, spacing and arrangement of the types of retinal receptors. Journal of Comparative Neurology, 140, 359-398. Literatur 190 Nalbach, H.-O., Wolf Oberhollenzer, F. & Remy, M. Exploring the Image. In: H. P. Zeigler & H.-J. Bischof (Hrsg.), Vision, Brain, and Behavior in Birds, MIT Press, Cambridge, 1993, 25-46. Nieuwkoop, P.D. (1985). Inductive interactions in early amphibian development and their general nature. Journal of Embryology and Experimental Morphology, 89, 333-347. Obermeier, A., Lammers, R., Wiesmuller, K.H., Jung, G., Schlessinger, J. & Ullrich, A. (1993). Identification of Trk binding sites for SHC and phosphatidylinositol 3'-kinase and formation of a multimeric signaling complex. Journal of Biological Chemistry, 268, 22963-22966. Obermeier, A, Bradshaw, R.A., Seedorf, K., Choidas, A., Schlessinger, J. & Ullrich, A. (1995). Definition of signals for neuronal differentiation. Annual New York Academy of Sciences, 766, 1-17. Ohmichi, M., Decker, S.J. & Saltiel, A.R. (1991). Nerve growth factor binds to the 140 kd trk proto-oncogene product and stimulates its association with the src homology domain of phospholipase C gamma 1. Biochemical and Biophysical Research Commmunications, 179, 217-223. Ohmichi, M., Decker, S.J. & Saltiel, A.R. (1992). Activation of phosphatidylinositol-3 kinase by nerve growth factor involves indirect coupling of the trk proto-oncogene with src homology 2 domains. Neuron, 9, 769-777. Ohmichi, M., Matuoka, K., Takenawa, T. & Saltiel, A.R. (1994). Growth factors differentially stimulate the phosphorylation of Shc proteins and their association with Grb2 in PC-12 pheochromocytoma cells. Journal of Biological Chemistry, 269, 1143-1148. Ohsawa, F., Widmer, H.R., Knusel, B., Denton, T.L. & Hefti, F. (1993). Response of embryonic rat hippocampal neurons in culture to neurotrophin-3, brain-derived neurotrophic factor and basic fibroblast growth factor. Neuroscience, 57, 67-77. Okazawa, H., Kamei, M., Imafuku, I. & Kanazawa, I. (1994). Gene regulation of trkB and trkC in the chick retina by light/darkness exposure. Oncogene, 9, 1813-1818. Patel, S.N. & Stewart, M.G. (1988). Changes in the number and structure of dendritic spines 25h after passive avoidance training in the domestic chick, Gallus domesticus. Brain Research, 449, 34-46. Paulson, J.C., McClure, W.O. (1975). Microtubules and axoplasmic transport. Inhibition of transport by podophyllotoxin: an interaction with microtubule protein. Journal of Cell Biology, 67, 461-467. Perez, R.G. & Halfter, W. (1993). Tenascin in the developing chick visual system: distribution and potential role as a modulator of retinal axon growth. Developmental Biology, 156, 278292. Literatur 191 Perez, M.T. & Caminos, E. (1995). Expression of brain-derived neurotrophic factor and of its functional receptor in neonatal and adult rat retina. Neuroscience Letters, 183, 96-99. Prada, F.A., Chmielewski, C.E., Dorado, M.E., Prada, C. & Genis-Galvez, J.M. (1989). Displaced ganglion cells in the chick retina. Neuroscience Research, 6, 329-339. Prada, C., Medina, J.I., Lopez, R., Genis-Galvez, J.M. & Prada, F.A. (1992). Development of retinal displaced ganglion cells in the chick: neurogenesis and morphogenesis. Journal of Neuroscience, 12, 3781-3788. Privat, A. & Drian, M.J. (1976). Postnatal maturation of rat Purkinje cells cultivated in the absence of two afferent systems: an ultrastructural study. Journal of Comparative Neurology, 166, 201-243 . Puelles, L. & Bendala, M.C. (1978). Differentiation of neuroblasts in the chick optic tectum up to eight days of incubation: a Golgi study. Neuroscience, 3, 307-325. Purves, D. & Lichtman, J.W. (1985). Geometrical differences among homologous neurons in mammals. Science, 228, 298-302. Rager, U., Rager, G. & Frei, B. (1993). Central retinal area is not the site where ganglion cells are generated first. Journal of Comparative Neurology, 334, 529-544. Rajendra, S. & Rogers, L.J. (1993). Asymmetry is present in the thalamofugal visual projections of female chicks. Experimantal Brain Research, 92, 542-544. Rakic, P. (1971). Neuron-glia relationship during granule cell migration in developing cerebellar cortex. A Golgi and electronmicroscopic study in Macacus Rhesus. Journal of Comparative Neurololgy, 141, 283-312. Rakic, P. (1972). Mode of cell migration to the superficial layers of fetal monkey neocortex. Journal of Comparative Neurology, 145, 61-83. Rakic P. (1990). Principles of neural cell migration. Experientia, 46, 882-891. Ramón y Cajal, 1911. Histologie du Système Neveux de l`Homme et des Vertébrés, Vol. 2, Maloine, Paris. Reiner, O., Albrecht, U., Gordon, M., Chianese, K.A., Wong, C., Gal-Gerber, O., Sapir, T., Siracusa, L.D., Buchberg, A.M., Caskey, C.T. & Eichele, G. (1995). Lissencephaly gene (LIS1) expression in the CNS suggests a role in neuronal migration. Journal of Neuroscience, 15, 3730-3738 . Remy, M. & Güntürkün, O. (1991). Retinal afferents to the tectum opticum and the n.opticus principalis thalami in the pigeon. Journal of Comparative Neurology, 305, 57-70. Remy, M. & Emmerton, J. 81991). Directional dependence of intraocular transfer of stimulus detection in pigeons (Columba livia). Behavioral Neuroscience, 105, 647-652. Literatur 192 Repérant, J. & Angaut, P. (1977). The retinotectal projections in the pigeon. An experimental optical and electron microscope study. Neuroscience, 2 (1), 119-140. Robertson, E.J. (1997). Left-right asymmetry. Science, 275, 1280. Rodríguez-Tébar, A., Jeffrey, P.L., Thoenen, H. & Barde, Y.A. (1989). The survival of chick retinal ganglion cells in response to brain-derived neurotrophic factor depends on their embryonic age. Developmental Biology , 136, 296-303. Rodriguez-Tebar, A., Dechant, G. & Barde, Y.A., (1990). Binding of brain-derived neurotrophic factor to the nerve growth factor receptor. Neuron, 4, 487-492. Rogers, L.J. (1982). Light experience and asymmetry of brain function in chicken. Nature, 297, 223-225. Rogers, L.J. (1996). Behavioral, structural and neurochemical asymmetries in the avian brain: A model system for studying visual development and processing: Neuroscience and biobehavioral reviews, 20, 487-503. Rogers, L.J. & Anson, J.M. (1979). Lateralization of function in the chicken forebrain. Pharmacological and Biochemical Behavior, 10, 679-686. Rogers, L.J. & Bolden, S.W. (1991). Light-dependent development and asymmetry of visual projections. Neuroscience Letters, 121, 63-67. Rogers, L.J. & Sink, H.S. (1988). Transient asymmetry in the projections of the rostral thalamus to the visual hyperstriatum of the chicken, and reversal of its direction by light exposure. Experimental Brain Research, 70, 378-384. Rose, S.P.R. & Csillag, A. (1985). Passive avoidance training results in lasting changes in deoxyglucose metabolism in left hemisphere regions of chick brain. Behavioral Neural Biology, 44, 315-324. Rosenthal, A., Goeddel, D.V., Nguyen, T., Lewis, M., Shih, A., Laramee, G.R., Nikolics, K. & Winslow, J.W. (1990). Primary structure and biological activity of a novel human neurotrophic factor. Neuron, 4, 767-773. Rowland, L.P. (1987). Motor neuron diseases and amyotrophic lateral sclerosis: research progress. Trends in Neurosciences, 10, 393-397. Sala, R., Viegi, A., Rossi, F.M., Pizzorusso, T., Bonanno, G., Raiteri, M. & Maffei, L. (1998). Nerve growth factor and brain-derived neurotrophic factor increase neurotransmitter release in the rat visual cortex. European Journal of Neuroscience, 10, 2185-2191. Samuel, S. (1860). Die trophischen Nerven. Ein Beitrag zur Physiologie und Pathologie. Leipzig. Schäfer, E.A. (1900). Text-book of physiology. Young J. Pentland, London. Literatur 193 Schanen-King, C., Nel, A., Williams, L.K. & Landreth, G. (1991). Nerve growth factor stimulates the tyrosine phosphorylation of MAP kinase in PC 12 cells. Neuron, 6, 915-922. Schlessinger, J. (1994). SH2/SH3 signaling proteins. Current Opinion in Genetics and Development, 4, 25-30. Review. Schlessinger, J. & Ullrich, A. (1992). Growth factor signaling by receptor tyrosine kinases. Neuron, 9, 383-391. Schmechel, D.E. & Rakic, P.A. (1979). Golgi study of radial glial cells in developing monkey telencephalon: morphogenesis and transformation into astrocytes. Anatomy and Embryology, 156, 115-152. Schmitt, F.O. (1968). Fibrous proteins – neuronal organelles. Proceedings of the National Academy of Sciences of the USA, 60, 1092-1101. Scott, J., Selby, M., Urdea, M., Quiroga, M., Bell, G.I. & Rutter, W.J. (1983). Isolation and nucleotide sequence of a cDNA encoding the precursor of mouse nerve growth factor. Nature, 302, 538-540. Shimizu, T., Cox, K., Karten, H. J. & Britto, L. R. G. (1994). Cholera toxin mapping of retinal projections in pigeons (Columba livia), with emphasis on retinohypothalamic connections. Visual Neuroscience, 11, 441-446. Shu, S., Ju, G. & Lingzhi, F. (1988). The glucose oxidase-DAB-nickel method in peroxidase histochemistry of the nervous system. Neuroscience Letters, 85, 169-171. Sidman, R.L. & Rakic, P. (1973). Neuronal migration, with special reference to developing human brain: a review. Brain Research, 62, 1-35. Review. Sieber-Blum, M. (1991). Role of the neurotrophic factors BDNF and NGF in the commitment of pluripotent neural crest cells. Neuron, 6, 949-955. Skiba, M., Diekamp, B., Prior, H. & Güntürkün, O. Leteralized interhemispheric transfer of color cues: Evidence for dynamic coding principles of visual lateralization in pigeon. (im Druck). Snider, W.D. (1994). Functions of the neurotrophins during nervous system development: what the knockouts are teaching us. Cell, 77, 627-38. Review. Snow, R.L. & Robson, J.A. (1995). Migration and differentiation of neurons in the retina and optic tectum of the chick. Experimental Neurology, 134, 13-24. Soltoff, S.P., Rabin, S.L., Cantley, L.C. & Kaplan, D.R. (1992). Nerve growth factor promotes the activation of phosphatidylinositol 3-kinase and its association with the trk tyrosine kinase. Journal of Biological Chemistry, 267, 17472-17477. Literatur 194 Soppet, D., Escandon, E., Maragos, J., Middlemas, D.S., Reid, S.W., Blair, J., Burton, L.E., Stanton, B.R., Kaplan, D.R., Hunter, T., Nikolics, K., Parada, L.F. (1991). The neurotrophic factors brain-derived neurotrophic factor and neurotrophin-3 are ligands for the trkB tyrosine kinase receptor. Cell, 65, 895-903. Soriano, E., Alvarado-Mallart, R.M., Dumesnil, N., Del Río, J.A., & Sotelo, C. (1997). CajalRetzius cells regulate the radial glia phenotype in the adult and developing cerebellum and alter granule cell migration. Neuron, 18, 563-577. Squinto, S.P., Stitt, T.N., Aldrich, T.H., Davis, S., Bianco, S.M., Radziejewski, C., Glass, D.J., Masiakowski, P., Furth, M.E., Valenzuela, D.M., DiStefano, P.S. & Yancopoulos, G.D. (1991). TrkB encodes a functional receptor for brain-derived neurotrophic factor and neurotrophin-3 but not nerve growth factor. Cell, 65, 885-893. Sterling, P. (1971). Receptive fields and synaptic organization of the superficial gray layer of the cat superior colliculus. Vision Research, 3, 309. Sterling, P., Freed, M.A., Smith, R.G. (1988). Architecture of rod and cone circuits to the onbeta ganglion cell. Journal of Neuroscience, 8, 623-642. Stewart, M.G. (1991). Changes in dendritic and synaptic structure in chick forebrain consequent on passive avoidance learning. In Andrew, R.J. (ed), Neural and behavioral plasticity: The use of the domestic chick as a model. Oxford, Oxford University Press, 305-328. Stewart, M.G., Bourne, R.C., Steele, R.J. (1992a). Quantitative autoradiographic demonstration of changes in binding to NMDA sensitive 3H-glutamate and 3H-MK801, but not 3H-AMPA receptors in chick forebrain 30 minutes after passive avoidance training. European Journal of Neuroscience, 4, 936-943. Stewart, M.G., Rogers, L.J., Davies, H.A. & Bolden, S.W. (1992b). Structural asymmetry in the thalamofugal visual projections in 2-day-old chick is correlated with a hemisphere difference in synaptic density in the hyperstriatum accessorium. Brain Research, 585, 381-385. Stewart, M.G., Rose, S.P.R., King, T.S., Gabbot, P.L.A., Bourne, R. (1984). Hemispheric asymmetry of synapses in the chick medial hyperstriatum ventrale following passive avoidance training: a stereological investigation. Developmental Brain Research, 12, 261-269. Streit, P., Knecht, E., Reubi, J.C., Hunt, S.P. & Cuénod, M. (1978). GABA-specific presynaptic dendrites in pigeon optic tectum: a high resolution autoradiographic study. Brain Research, 149, 204-212. Striedter, G.F. & Beydler, S. (1997). Distribution of radial glia in the developing telencephalon of chicks. Journal of Comparative Neurology, 387, 399-420 (1997). Suen, K.L., Bustelo, X.R., Pawson, T. & Barbacid, M. (1993). Molecular cloning of the mouse grb2 gene: differential interaction of the Grb2 adaptor protein with epidermal growth factor and nerve growth factor receptors. Molecular Cell Biology, 13, 5500-5512. Literatur 195 Sutter, A., Riopelle, R.J., Harris-Warrick, R.M. & Shooter, E.M. (1979). Nerve growth factor receptors. Characterization of two distinct classes of binding sites on chick embryo sensory ganglia cells. Journal of Biological Chemistry, 254, 5972-5982. Takei, N., Sasaoka, K., Inoue, K., Takahashi, M., Endo, Y., & Hatanaka, H. (1997). Brainderived neurotrophic factor increases the stimulation-evoked release of glutamate and the levels of exocytosis-associated proteins in cultured cortical neurons from embryonic rats. Journal of Neurochemistry, 68, 370-375. Takei, N., Numakawa, T., Kozaki, S., Sakai, N., Endo, Y., Takahasi, M., & Hatanaka, H. (1998). Brain-derived neurotrophic factor induces rapid and transient release of glutamate through the non-exocytotic pathway from cortical neurons. Journal of Biological Chemistry, 273, 27620-27624. Tan, M.M.L. & Harvey, A.R. (1997). A comparison of postlesion growth of retinotectal and corticotectal axons after superior colliculus transections in neonatal rats. Journal of Comparative Neurology, 386, 681-699. Thanos, S., Bähr, M., Barde, Y.A. & Vanselow, J. (1989). Survival and axonal elongation of adult rat retinal ganglion cells: in vitro effects of lesioned sciativ nerve and brain-derived neurotrophic factor (BDNF). European Journal of Neuroscience, 1, 19-26. Theiss, C., Helmann, B. & Güntürkün, O. (1998). The differential distribution of AMPA-receptor subunits in the tectofugal system of the pigeon. Brain Research. 785, 114-128. Theiss, C. & Meller, K. (1999). Taxol impairs anterograde axonal transport of microinjected horseradish peroxidase in dorsal root ganglia neurons in vitro. Cell & Tissue Research (im Druck). Thoenen, H. (1995). Neurotrophins and neuronal plasticity. Science, 270, 593-598. Tongiorgi, E., Righi, M., & Cattaneo, A. (1997). Activity-dependent dendritic targeting of BDNF and TrkB mRNAs in hippocampal neurons. Journal of Neuroscience, 17, 9492-9505. Torcia, M., Bracci-Laudiero, L., Lucibello, M., Nencioni, L., Labardi, D., Rubartelli, A., Cozzolino, F., Aloe, L. & Garaci, E. (1996). Nerve growth factor is an autocrine survival factor for memory B lymphocytes. Cell, 85, 345-356. Torrey, T.W. (1934). The relation of taste buds to their nerve fibres. Journal of Comparative Neurology, 59, 203-220. Treanor, J.J., Schmelzer, C., Knusel, B., Winslow, J.W., Shelton, D.L., Hefti, F., Nikolics, K. & Burton, L.E. (1995). Heterodimeric neurotrophins induce phosphorylation of Trk receptors and promote neuronal differentiation in PC12 cells. Journal of Biological Chemistry, 270, 23104-23110. Literatur 196 Uhlrich, D. J., Blough, P. M. & Blough, D. S. (1982). The pigeon´s distant visual acuity as a function of viewing angle. Vision Research, 22, 429-431. Ullrich A, Gray, A., Berman, C. & Dull, T.J. (1983). Human beta-nerve growth factor gene sequence highly homologous to that of mouse. Nature, 303, 821-825. Ulrich, C., Prior, H., Duka, T., Leshchins´ka, I., Valenti, P., Güntürkün, O. & Lipp, H.-P. (1999). Left-hemispheric superiority for visuospatial orientation in homing pigeons. Behavioural Brain Research, 104, 169-178. Vallortigera, G. & Andrew, R.J. (1994). Olfactory lateralization in the chick. Neuropsychologia, 32, 417-423. Vallortigera, G., Regolin, L., Bortolomiol, G. & Tommasi, L. (1996). Lateral asymmetries due to preferences in eye use during visual discrimination learning in chicks. Behavioral Brain Research, 74, 135-143. Van Gehuchten, A. (1892). La structure des lobes optiques chez l´embryon de poulet. La Cellule, 8, 1. Vanselow. J., Dütting, D. & Thanos, S. (1990). Target dependence of chick retinal ganglion cells during embryogenesis: cell survival and dendritic development. Journal of Comparative Neurology, 295, 235-247. Vázquez, E., van de Water, T.R., del Valle, M., Vega, J.A., Staecker, H., Giraldez, F. & Represa, J. (1994). Pattern of trkB protein-like immunoreactivity in vivo and the in vitro effects of brain-derived neurotrophic factor (BDNF) on developing cochlear and vestibular neurons. Anatomy and Embryology, 189, 157-167. Velier, J.J., Ellison, J.A., Fisher, R.S., & Vinters, H.V. (1997). The TrkC receptor is transiently localized to Purkinje cell dendrites during outgrowth and maturation in the rat. Journal of Neuroscience Research, 50, 649-656. Ventimiglia, R., Mather, P.E., Jones, B.E. & Lindsay, R.M. (1995).The neurotrophins BDNF, NT-3 and NT-4/5 promote survival and morphological and biochemical differentiation of striatal neurons in vitro. European Journal of Neuroscience, 7, 213-222. Vetter, M.L., Martin-Zanca, D., Parada, L.F., Bishop, J.M. & Kaplan, D.R. (1991). Nerve growth factor rapidly stimulates tyrosine phosphorylation of phospholipase C-gamma 1 by a kinase activity associated with the product of the trk protooncogene. Proceedings of the National Academy of Sciences of the USA, 88, 5650-5654. von Bartheld, C.S. (1998). Neurotropins in the developing and regenrating visual system. Histology and Histopathology, 13, 437-459. Literatur 197 von Bartheld, C.S., Byers, M.R., Williams, R., Bothwell, M. (1996). Anterograde transport of neurotrophins and axodendritic transfer in the developing visual system. Nature, 379, 830833. Von Fersen, L. & Güntürkün, O. (1990). Visual memory lateralization in pigeons. Neuropsychologia, 28, 1-7. Walsh, C. & Cepko, C.L. (1988). Clonally related cortical cells show several migration patterns. Science, 241, 1342-1345. Walsh, C. & Cepko, C.L. (1992). Widespread dispersion of neuronal clones across functional regions of the cerebral cortex. Science, 255, 434-440. Wang, Y., Jiang, S. & Frost, B. J. (1993). Visual processing in pigeon nucleus rotundus: luminance, color, motion, and looming subdivisions. Visual Neuroscience, 10, 21-30. Watkins, P.J. (1992). Clinical observations and experiments in diabetic neuropathy. Diabetologia, 35, 2-11. Wässle, H. & Boycott, B.B. (1991). Functional architecture of the mammalian retina. Physiological Review, 71, 447-480. Weidner, C., Reperant, J., Miceli, D., Haby, M. & Rio, J.P. (1985). An anatomical study of ipsilateral retinal projections in the qail using radioautographic, horseradish peroxidase, fluorescence and degeneration techniques. Brain Research, 340, 99-108. Welcher, A.A., Bitler, C.M., Radeke, M.J. & Shooter, E.M. (1991). Nerve growth factor binding domain of the nerve growth factor receptor. Proceedings of the National Academy of Sciences of the USA, 88, 159-163. Wetmore, C., Ernfors, P., Persson, H. & Olson, L. (1990). Localization of brain-derived neurotrophic factor mRNA to neurons in the brain by in situ hybridization. Experimental Neurology, 109, 141-152. Widmer, H.R., Kaplan, D.R., Rabin, S.J., Beck, K.D., Hefti, F. & Knusel, B. (1993). Rapid phosphorylation of phospholipase C gamma 1 by brain-derived neurotrophic factor and neurotrophin-3 in cultures of embryonic rat cortical neurons. Journal of Neurochemistry, 60, 2111-2123. Wild, J.M. (1989). Pretectal and tectal projections to the homologue of the dorsal lateral geniculate n. in the pigeon: an antero-retrograde tracing study with cholera. Brain Research, 479, 130-137. Wilson, P. (1980). The organisation of the visual hyperstriatum in the domestic chick. II. Receptive field properties of single units. Brain Research, 188, 333-345. Literatur 198 Wright, E.M., Vogel, K.S. & Davies, A.M. (1992). Neurotrophic factors promote the maturation of developing sensory neurons before they become dependent on these factors for survival. Neuron, 9, 139-150. Yost, H.J. (1995). Vertebrate left-right development. Cell, 82, 689-692. Young, R.W. & Bok, D. (1969). Participation of the retinal pigment epithelium in the rod outer segment renewal process. Journal of Cell Biology, 42, 392-403. Young, S.R. & Martin, G.R. (1984). Optics of retinal oil droplets: a model of light collection and polarization detection in the avian retina. Vision Research, 24, 129-137. Yuasa, S., Kawamura, K., Kuwano, R., & Ono, K. (1996). Neuron-glia interrelations during migration of Purkinje cells in the mouse embryonic cerebellum. International Journal of Developmental Neuroscience, 14, 429-438. Zeier, H. & Karten, H.J. (1971). The archistriatum of the pigeons organization of afferent and efferent connections. Brain Research, 31, 313-326. Zheng, C., Heintz, N. & Hatten, M.E. (1996). CNS gene encoding astrotactin, which supports neuronal migration along glial fibers. Science, 272, 417-419. Zhou, X.F. & Rush, R.A. (1996a). Endogenous brain-derived neurotrophic factor is anterogradely transported in primary sensory neurons. Neuroscience, 74, 945-953. Zhou, X.F. & Rush, R.A. (1996b). Functional roles of neurotrophin 3 in the developing and mature sympathtic nervous system. Molecular Neurobiology, 96, 185-197. Erklärung: Ich versichere, daß ich die von mir vorgelegte Dissertation selbständig und ohne unzulässige Hilfe angefertigt und die benutzten Quellen und Hilfsmittel vollständig angegeben habe, daß diese Dissertation noch keiner anderen Fakultät zur Prüfung vorgelegen hat, daß sie abgesehen von der unten angegebenen Teilpublikation noch nicht veröffentlicht worden ist sowie, daß ich eine solche Veröffentlichung vor Abschluß des Promotionsverfahrens nicht vornehmen werde. Die Bestimmungen der geltenden Promotionsordnung sind mir bekannt. Ein Teil der Ergebnisse wurde an folgender Stelle veröffentlicht: Theiss, C, Güntürkün, O (1998) „NT-3 and trk C expression in the developing retinotectal system in pigeons.“ In: Göttingen Neurobiology Report 1998, Proceedings of the 26th Göttingen Neurobiologen Conference, Vol. II (Elsner, N. and Wehner, R., eds), G. Thieme Verlag Stuttgart, New York, S. 489 (Abstract).