Atomphysik 1 - Universität Potsdam
Werbung

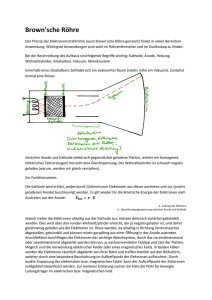
Hildebrandt, Dominik Höhne, Christian Lutzky, Christian Pasemann, Diana Sander, Andreas Thomas, Carola 20.02.2006 - 24.02.2006 Projekt-Praktikum Atomphysik Universität Potsdam, Institut für Physik, Grundpraktikum Betreuer: Dr. H. Weigt, Physik weicher Materie Thema: Experimentelle Bestimmung der atomphysikalischen Fundamentalkonstanten: Plancksches Wirkungsquantum h und Elementarladung e - Präsentationsausgabe - Inhaltsverzeichnis 1. Bedeutung der Konstanten ..................................................................................................... 3 a) Plancksches Wirkungsquantum h ...................................................................................... 3 b) Elementarladung e ............................................................................................................. 4 2. Die Versuche zur Ermittlung der Konstanten im Detail ........................................................ 5 a) e/m-Bestimmung nach Schuster und Busch....................................................................... 5 I. Die Schuster-Methode – Bewegung im magnetischen Querfeld ................................ 5 II. Die Busch-Methode – Bewegung im magnetischen Längsfeld .................................. 8 b) Der lichtelektrische Effekt – Bestimmung von h/e.......................................................... 11 I. Grundlagen ................................................................................................................ 11 II. Versuchsidee ............................................................................................................. 13 III. Versuchsdurchführung .............................................................................................. 14 c) Kurzwellige Grenze der Röntgenbremsstrahlung ............................................................ 15 I. Grundlagen ................................................................................................................ 15 II. Versuchsaufbau ......................................................................................................... 17 d) Franck-Hertz-Versuch...................................................................................................... 18 I. Historisch: ................................................................................................................. 18 II. Versuchsidee: ............................................................................................................ 18 III. Deutung: .................................................................................................................... 18 IV. Bestimmung von h: ................................................................................................... 18 e) Wasserstoff-Spektrum...................................................................................................... 19 I. Grundlagen ................................................................................................................ 19 II. Versuchsaufbau: ........................................................................................................ 21 III. Versuchsdurchführung: ............................................................................................. 22 3. Auswertung .......................................................................................................................... 23 a) Akzeptierte Werte ............................................................................................................ 23 b) Bestimmung der Elementarladung e ................................................................................ 23 I. Ergebnisse und Meßunsicherheiten der Methoden ................................................... 24 1. Methode nach Schuster ...................................................................................... 24 Ergebnisse ....................................................................................................... 24 2. Methode nach Busch .......................................................................................... 26 Ergebnisse ....................................................................................................... 26 3. Bestimmung aus h/e-Quotienten ........................................................................ 28 II. Überblick und Vergleich der Ergebnisse .................................................................. 29 c) Bestimmung des Planckschen Wirkungsquantums h....................................................... 30 I. Ergebnisse und Meßunsicherheiten der Methoden ................................................... 30 1. Lichtelektrischer Effekt...................................................................................... 30 2. Kurzwellige Grenze der Röntgenstrahlung ........................................................ 32 3. Franck-Hertz-Versuch ........................................................................................ 34 4. Wasserstoffspektrum .......................................................................................... 34 II. Überblick und Vergleich der Ergebnisse .................................................................. 35 Anhang ........................................................................................................................ab Seite 37 Quellen- und Literaturverzeichnis 2 1. Bedeutung der Konstanten Fundamentalkonstanten, die in physikalischen Gesetzen enthalten sind, können nur durch Experimente ermittelt werden. Ihre jeweiligen Werte sind von der Natur gegeben, sie ändern sich demnach nicht. Zu ihnen gehören das Plancksche Wirkungsquantum h und die Elementarladung e. a) Plancksches Wirkungsquantum h Im Jahr 1900 führte Max Planck eine Proportionalitätskonstante zwischen der Energie und der Frequenz des Lichts ein, um das Problem der Beschreibung des Strahlungsverhaltens schwarzer Körper zu lösen. Die Proportionalitätskonstante bezeichnete er mit h (von Hilfsgröße). Planck setzte in seiner Rechnung nämlich voraus, dass Strahlung der Frequenz ν nur in Energiepaketen der Größe E = h ⋅ν (1a-1) emittiert und absorbiert werden kann. Die Größe der Konstanten ergab sich aus der Anpassung an die experimentell ermittelten Werten der Schwarzkörperstrahlung. Planck bezeichnete die Konstante als „Wirkungsquantum“, da sie die Dimension einer Wirkung ( Energie ⋅ Zeit ) hat und ihre Einführung erforderte, die Energie des Lichts als nichtkontinuierlich bzw. gequantelt anzusehen. Bei der Aufstellung eines Atommodells für das Wasserstoffatom (1913) machte Niels Bohr die Annahme, dass das Elektron nicht auf beliebigen Bahnen um den Kern kreist, sondern vielmehr auf solchen, bei denen der Bahndrehimpuls des Elektrons mvr ein ganzzahliges Vielfaches der Grundeinheit h = h / 2π des Drehimpulses ist ( Impuls ⋅ Abstand = Wirkung ). In den 1920ern entwickelte sich die Quantenmechanik, in der das ursprünglich zur Lösung eines thermodynamischen Problems eingeführte Wirkungsquantum eine allgemeine Bedeutung erhielt. Es tritt z.B. im Impuls- und Energieoperator in der Schrödingergleichung, der fundamentalen Gleichung dieser Theorie, auf. Später wurde erkannt, dass das Plancksche Wirkungsquantum auch in der Heisenbergschen Unschärferelation auftritt. 1924 gelang de Broglie eine weitere, für das Verständnis des Atombaus grundlegende, Entdeckung. Sein Postulat beinhaltete, dass jedes bewegte Teilchen (z.B. Elektronen) Welleneigenschaften besitzt. Es besteht zwischen der Wellenlänge λ und dem Impuls p des Teilchens die Beziehung h p= λ bzw. λ= h m⋅v (1a-2) Das Plancksche Wirkungsquantum ist also der universelle Umrechnungsfaktor in der Quantenphysik zwischen Energien und (Kreis-)Frequenzen, nicht nur für Photonen, sondern auch zwischen Impulsen und Wellenzahlen. Eine Welle wird durch ihre Frequenz ν und ihre 3 Wellenlänge λ beschrieben, ein Teilchen durch seine Energie E und seinen Impuls p. Die Brechung des Lichts, die hier nur erwähnt werden soll, kann sowohl vom Wellen- als auch vom Teilchenstandpunkt erklärt werden. Im ersten Fall benutzt man ν und λ, im zweiten E und p. Die Plancksche Konstante schafft die Verknüpfung zwischen beiden Vorstellungen, in ihr liegt sozusagen der Schlüssel für den Übergang von der Wellen- zur Teilchendarstellung und umgekehrt. b) Elementarladung e Schon Thales wusste, dass Bernstein (griech. elektron) leichte kleine Körper anzuziehen vermag, nachdem es z.B. an einem Tuch gerieben wurde. Zwischen den Körpern baut sich ein Kraftfeld auf. Die Identität dieser auch bei vielen anderen Stoffen gemachten Beobachtung erkannte der englische Arzt William Gilbert (1600). Physikalische Erscheinungen, die mit diesen Kraftfeldern verbunden sind, bezeichnet man nach ihm als elektrische Erscheinungen. Gleichermaßen gelten sie als Kraftwirkung zwischen der auf den sich anziehenden Körpern vorhandenen Elektrizität. Die Erscheinungen der Elektrizität lassen sich auf Grund der experimentellen Erfahrung mittels einer als Ladung q bezeichneten Größe beschreiben. Sie kann ein positives bzw. negatives Vorzeichen tragen (Georg Christoph Lichtenberg, 1777). Heute weiß man, dass elektrische Ladungen nicht beliebig teilbar sind. Sie treten als ganzzahlige Vielfache einer Elementarladung auf. 1909 entwickelte Millikan eine der genauesten Methoden zur Bestimmung der elektrischen Elementarladung. In seinem Experiment nutzte er die Eigenschaft von Flüssigkeiten wie z.B. Öl, beim Zerstäuben die Tröpfchen elektrisch aufzuladen („Reibungselektrizität“). In einem Plattenkondensator, dessen Platten parallel zur Erdoberfläche ausgerichtet waren, kann man ein ausgewähltes Öltröpfchen verfolgen. Durch Beleuchtung der Milikankammer können die Öltröpfchen aufgrund der Lichtstreuung durch ein Meßmikroskop sichtbar gemacht werden. Je nach Polung sind die Vektoren von Schwerkraft und elektrischem Feld nun parallel bzw. antiparallel. In der Rechnung von Millikan tauchen diesbezüglich nur bekannte und messbare Größen auf, so dass die Ladung des Öltröpfchens bestimmt werden kann. Die kleinste ermittelte Größe entspricht der Elementarladung e. In der Quantenphysik werden auch Drittelladungen von e benutzt. Die sogenannten Quarks besitzen Ladungen von e/3 oder 2e/3. Obgleich diese Drittelladungen durch Versuche nachgewiesen wurden, findet man unter normalen Bedingungen nur ganzzahlige Vielfache von e, da Quarks nur in Zweier- oder Dreierkombination auftreten. In der Superstringtheorie gibt es weitere Unterteilungen der Elementarladung.(Q2) 4 2. Die Versuche zur Ermittlung der Konstanten im Detail a) e/m-Bestimmung nach Schuster und Busch Neben dem Planckschen Wirkungsquantum h und der Elementarladung e ist eine weitere wichtige Konstante der Atomphysik der Quotient e/m, die sogenannte spezifische Ladung des Elektrons. Dabei ist e die Elementarladung des Elektrons und m seine Masse. Diese spezifische Ladung läßt sich experimentell mit relativ geringen Aufwand bestimmen. In den Abschnitten 2a-I. und 2a-II. stellen wir zwei verschiedene Methoden vor. Hat man die spezifische Ladung e/m bestimmt und kennt man die Elektronenmasse m, so lässt sich daraus der Wert für die Elementarladung e berechnen. Historisch war die Vorgehensweise eine andere. Damals hat man aus der spezifischen Ladung des Elektrons, die experimentell deutlich leichter zu bestimmen ist, als die Elektronenmasse m, letztere unter Verwendung der aus dem Milikan-Versuch gewonnenen Elementarladung e berechnet. In unserem Praktikum war es allerdings nicht möglich den Milikan-Versuch durchzuführen, so daß wir aus den folgenden Methoden die Elementarladung e mit gegebenem m bestimmt haben. I. Die Schuster-Methode – Bewegung im magnetischen Querfeld 1. Grundlegende Ideen: Um die spezifische Ladung des Elektrons zu bestimmen, nutzt man die Tatsache, die schon in vielen Versuchen vorher festgestellt wurde, dass auf bewegte geladene Teilchen nicht nur im elektrischen Feld eine Kraft wirkt, sondern auch im magnetischen Feld. Das beispielsweise Elektronen im elektrischen Feld abgelenkt werden, ist nicht weiter erstaunlich und beruht auf der Tatsache, dass sich ungleichnamige Ladungen anziehen und Ladungen mit gleichem Vorzeichen abstoßen. Im magnetischen Feld wirkt zusätzlich auf einen bewegten Ladungsträger eine magnetische Kraft, die so genannte Lorentzkraft. Diese wirkt senkrecht zur Ausbreitungsrichtung der bewegten Ladungsträger und steht senkrecht auf den Feldvektoren der magnetischen Induktion B: r r r FL = q ⋅ v × B (2a-1) Der Proportionalitätsfaktor zwischen den drei genannten Größen ist dabei die Ladung q des bewegten Teilchens. r Betrachtet man nun ein Elektron mit einer Geschwindigkeit v , das in das magnetische Feld, r welches durch seine magnetische Induktion B gekennzeichnet ist, eintritt, so wirkt auf dieses Elektron mit seiner Ladung -e die Lorentzkraft r r r FL = −e ⋅ v × B . 5 Setzt man voraus, dass der Geschwindigkeitsvektor des Elektrons genau senkrecht auf den magnetischen Feldlinien steht, ergibt dich der Betrag der wirkenden Lorentzkraft als FL = e ⋅ v ⋅ B ⋅ sin ϕ = v ⋅ e ⋅ B , (2a-2) r r wobei φ der von v und B eingeschlossene Winkel ist mit φ = 90°. r r r Da nun aber v ⊥ B ⊥ FL ein Rechtssystem bilden, wird das Elektron durch das Wirken der Lorentzkraft auf eine Kreisbahn abgelenkt. Aus dem Ruhesystem gesehen gilt r r FL = FRad , (2a-3) r wobei die Lorentzkraft als Radialkraft FRad wirkt. Aus Gleichung (2a-3) folgt m ⋅ v2 = v⋅e⋅ B. r Dabei ist B die angelegte Magnetflussdichte und r der Radius der Kreisbahn, die das Elektron beschreibt. Während sich B mit einem Meßgerät bestimmen lässt, kann man die dazugehörigen Radien nur experimentell bestimmen, wenn man die Bahn des Elektrons sichtbar macht. Die Geschwindigkeit v der Elektronen lässt sich allerdings nicht so ohne weiteres experimentell bestimmen. Sie lässt sich aber berechnen, wenn man „ruhende“ Elektronen, bevor sie ins Magnetfeld eindringen, in einem elektrischen Feld beschleunigt. Durch Glühemission werden Elektronen aus einer Kathode abgelöst und anschließend im elektrischen Feld zwischen der Glühkatode und einer Anode beschleunigt. Die Energie des elektrischen Feldes ist E = e ⋅U B , (2a-4) wobei U B die angelegte Spannung zwischen Anode und Kathode ist, die sogenannte Beschleunigungsspannung. Nach dem Energieerhaltungssatz ist die Energie der Elektronen, die sie im elektrischen Feld aufgenommen haben gleich ihrer Bewegungsenergie. e ⋅U B = 1 m ⋅ v2 . 2 (2a-5) Aus dieser Energiebilanz lässt sich durch Umstellen nach v die Geschwindigkeit der Elektronen berechnen: e ⋅U B v= 2 m Ersetzt man nun die Geschwindigkeit v in der Kräftebilanz (2a-3) entsprechend der Gleichung (2a-5), erhält man die Gleichung 6 e ⋅U B m 2 = eB . r m (2a-6) Stellt man diese Gleichung nach der gesuchten spezifischen Ladung des Elektrons um, ergibt sich für diese die Formel 2 ⋅U e = 2 B2 . m r ⋅B (2a-7) Damit läßt sich die spezifische Ladung des Elektrons in Abhängigkeit der Meßwerte für die Beschleunigungsspannung UB, dem Kreisbahnradius r und der Magnetflußdichte B berechnen. Alle diese Werte lassen sich gut experimentell bestimmen. 2. Versuchsaufbau: Der Versuch wird in einem sogenannten Fadenstrahlrohr durchgeführt, das ist eine Glaskugel, die geringfügig mit einem Gas, zum Beispiel Wasserstoff, gefüllt ist. Im Fadenstrahlrohr werden die Elektronen wie oben beschrieben durch Glühemission freigesetzt und im elektrischen Feld beschleunigt. Zudem befindet sich meist zwischen der schematische Versuchtsdarstellung: das Magnetfeld zeigt in die Zeichenebene hinein (Abb. aus „Geschke: Physikalisches Praktikum“, S.257, leicht angepaßt) Kathode und der Anode ein Wehneltzylinder, dessen Oberfläche leicht negativ geladen wird. Durch diesen Zylinder werden die Elektronen stärker in der Mitte gebündelt. Er dient also zur Fokussierung des Elektronenstrahls. Durch Zusammenstöße der Elektronen mit den im Fadenstrahlrohr befindlichen Wasserstoffmolekülen wird der Elektronenstrahl für das menschliche Auge sichtbar. Schaltet man nur die Heizung und die Beschleunigungsspannung ein, so bewegen sich die Elektronen geradlinig gleichförmig, ohne daß eine weitere Kraft auf sie wirkt. Im Fadenstrahlrohr erscheint ein gerader Elektronenstrahl. Erst durch das Einschalten des homogenen magnetischen Feldes, das durch ein Helmholtz-Spulenpaar erzeugt wird, wirkt auf die Elektronen die Lorentzkraft und sie werden entsprechend Gleichung (2a-1) auf eine Kreisbahn abgelenkt, welche dann beobachtet werden kann. Zur Bestimmung des Kreisbahnradius sind innerhalb des Fadenstrahlrohres 4 Markierungen angebracht, die durch den Elektronenstrahl zum Leuchten angeregt werden können. Aufgrund der unterschiedlichen Geschwindigkeiten, die die Elektronen beim Verlassen der Beschleunigungstrecke besitzen, haben einzelne Elektronen geringfügig verschiedene Radien und der gesamte Elektronenstrahl streut. Dies wirkt sich auf die Berechnung der spezifischen Masse aus, worauf später noch eingegangen wird. Bei konstanter Beschleunigungsspannung konnte dann, mittels dieser Markierungen, der Radius und das magnetische Feld bestimmt werden. 7 Das magnetische Feld wurde einerseits direkt mit einer Hall-Sonde, ein Meßgerät zur Messung von Magnetfeldern, gemessen. Andererseits ist das durch die Helmholtz-Spulen erzeugte Magnetfeld aber nur in einem begrenzten Bereich annähernd konstant. In diesem Bereich befindet sich allerdings das abgeschlossene Fadenstrahlrohr und so weichen die Werte der Hall-Sonde, die außerhalb von diesem postiert werden mußte, relativ stark von den theoretisch ermittelten Werten ab, wie sich auch in der rechnerischen Auswertung zeigt. Es bietet sich daher an das magnetische Feld aus besser zu messenden Werten zu berechnen. Das Magnetfeld eines Helmholtz- Spulenpaares berechnet sich – entsprechend Gerthsen S.452 – nach der Gleichung B = µ0 N ⋅ I R2 (R 2 +a ) 3 2 2 . Dabei ist R der Radius der Spulen, a der Abstand der beiden Spulen zueinander, N die Windungszahl der Spule, I der angelegte Spulenstrom und µ 0 die magnetische Permeabilitätskonstante. Aus den Unterlagen zu dem Spulenpaar sind die Werte von Radius und Spulenabstand, sowie der Windungszahl bekannt. Das benutzte Spulenpaar hat einen Radius von R = 0,1475m und einen Spulenabstand a = 0,075m. Da in den Unterlagen dazu keine Meßunsicherheiten angegeben waren, wurden diese für die Bestimmung der Meßunsicherheit der spezifischen Masse des Elektrons vernachlässigt. Es läßt sich somit das magnetische Feld auch aus dem angelegten Spulenstrom bestimmen, was genauere Werte liefert als die Hall-Sonde. Die Messungen von r und B wurden im Verlauf des Experimentes für verschiedene Beschleunigungsspannungen aufgenommen. II. Die Busch-Methode – Bewegung im magnetischen Längsfeld 1. Grundlegende Ideen Eine weitere, ähnliche Methode zur Bestimmung der spezifischen Ladung des Elektrons ist die Methode nach Busch. Diese nutzt eine Brownsche Röhre, wie sie in vielen Oszillographen oder alten Fernsehgeräten eingebaut ist. In dieser Röhre werden analog zum Fadenstrahlrohr Elektronen durch Schematische Skizze des Versuchsprinzips (selbsterstelltes Bild) Glühemission freigesetzt und im elektrischen Feld zwischen Glühkatode und Anode beschleunigt. Auch hier dient ein Wehneltzylinder zwischen Katode und Anode zur Fokussierung des Elektronenstrahls. Haben die Elektronen ihre maximale Geschwindigkeit erreicht, d.h. nach Durchqueren der 8 ringförmigen Anode, bewegen sie sich geradlinig gleichförmig weiter durch die Röhre und treffen an ihrem Ende auf einen Schirm, der so beschichtet ist, daß er dort leuchtet, wo Elektronen auftreffen. Auf der Zwischenstrecke, zwischen der Anode und dem Schirm sind in der Brownschen Röhre Ablenkplatten angebracht, durch welche bei Anlegen eine Spannung an die (Kondensator-)Platten die Elektronen sowohl in horizontale, als auch in vertikale Richtung abgelenkt werden können. Nun legt man zusätzlich ein homogenes Magnetfeld an, dessen Feldlinien parallel zur Bewegungsrichtung der Elektronen während der Beschleunigung verlaufen. Im Fall, daß an den Ablenkplatten keine Spannung anliegt, sind der Geschwindigkeitsvektor der Elektronen und der magnetische Feldvektor parallel. Die Lorentzkraft ist in diesem Fall nach (2a-1) r r r r FL = q ⋅ v × B = 0 . Die Elektronen erfahren also keine Ablenkung durch die Lorentzkraft. Legt man nun aber auch an eines Ablenkplattenpaare eine konstante Spannung an, ist der Geschwindigkeitsvektor der Elektronen nach Durchlaufen der Ablenkplatten nicht mehr parallel zu dem Feldlinien. Zur weiteren Berechnung ist es sinnvoll den Geschwindigkeitsvektor in seine Komponenten aufzuteilen entsprechend der hier abgebildeten Skizze. Nun ist aber r r v⊥ ⊥ B und damit ist der Betrag der Lorentzkraft entsprechend (2a-2) FL = v ⊥ ⋅ e ⋅ B . r r Da nun aber überall v ⊥ ⊥ FL gilt, ist die Bahn eines sich senkrecht zum Magnetfeld bewegenden Elektrons ein Kreis, dessen Radius sich aus Gleichung (2a-3) ergibt: r r FL = FRad ⇒ m ⋅ v ⊥2 = v 2⊥ ⋅ e ⋅ B r ⇔r= m ⋅ v⊥ e⋅B Die Zeit T für einen Kreisumlauf des Elektrons ist dann T= 2π ⋅ r , v⊥ bzw. mit der Ersetzung des Radius durch oben ermittelten Term: 9 (2a-8) T= 2 ⋅π ⋅ m e⋅B (2a-9) Nach Gleichung (2a-9) hängt die Umlaufzeit der Elektronen weder vom Kreisradius r, noch von der Elektronengeschwindigkeitskomponente v ⊥ ab. Das bedeutet, Elektronen, die gleichzeitig mit verschiedenen Geschwindigkeitskomponenten v ⊥ vom gleichen Punkt aus starten, kehren gleichzeitig zum Ausgangspunkt zurück nach durchlaufen von Kreisen mit unterschiedlichen Radien. r r Für den Fall, daß v || || B bewegen sich die Elektronen unbeeinflußt weiter, da die wirkende Lorentzkraft 0 ist. Die Elektronen bewegen sich in diesem Fall geradlinig gleichförmig weiter und legen die Strecke s = v ⋅t (2a-10) zurück. In der Zeit, in der Elektronen, die sich senkrecht zur Bewegungsrichtung bewegen, einen Kreisumlauf durchlaufen, legen die Elektronen mit paralleler Geschwindigkeitskomponente die Strecke 2π ⋅ m ⋅ v || s = v || ⋅ T = e⋅B zurück. Mit der Gleichung v || = v ⋅ cos β , die aus obiger Skizze folgt, ergibt sich für die Strecke s die Gleichung: s= 2π ⋅ m ⋅ v ⋅ cos β . e⋅B Legt man eine relativ geringe Ablenkspannung an, so ist β klein genug und es ist cosβ ~ 1. Dann folgt für den zurückgelegten Weg s: s= 2π ⋅ m ⋅ v e⋅B (2a-11) Die Strecke s ist dabei der zurückgelegte Weg der Elektronen von den Ablenkplatten zum Schirm. Die Geschwindigkeit v ergibt sich wie bei obiger Methode aus der Energiebilanz nach (2a-5): e ⋅U B = e ⋅U B 1 . m ⋅ v2 ⇔ v = 2 2 m Führt man nun wieder alle Ergebnisse zusammen, lässt sich die spezifische Ladung des Elektrons aus (2a-11) ermitteln: s= 2π ⋅ m 2e ⋅ U B 2π ⋅ m ⋅ v ⇒s= e⋅B e⋅B m 10 ⇒ e 8π 2 ⋅ U B = 2 2 m s ⋅B (2a-12) 2. Versuchsaufbau In einer Brownschen Röhre werden Elektronen durch Glühemission freigesetzt und im elektrischen Feld zwischen Glühkathode und Anode beschleunigt. Dabei sorgt wieder ein Wehnelt-Zylinder für die Bündelung der Elektronen zu einem gleichmäßigen Elektronenstrahl, analog zum Fadenstrahlrohr. Die Brownsche Röhre befindet sich selbst in einer zylinderförmigen langen Spule, deren Magnetfeldlinien parallel zur Bewegungsrichtung der Elektronen durch die Röhre ausgerichtet sind. Nach Anlegen der Heizspannung und der Beschleunigungsspannung, sowie einem Spulenstrom bewegen sich die Elektronen wie oben beschrieben geradlinig gleichförmig durch die Röhre und treffen an deren Ende auf den Fluoreszenzschirm auf, wo sie als leuchtender Punkt mit dem Auge indirekt beobachtet werden können. Nach Anlegen einer Spannung an die Ablenkplatten bewegen sich die Elektronen von der Anode bis zur Ablenkplatte weiterhin geradlinig gleichförmig und treten dann in eine Schraubenbahn ein, unter der sie dann auf dem Schirm auftreffen. Durch Variation der Spulenstromstärke ändert sich die Schraubenbahn des Elektrons und bei geeignetem Spulenstrom kann das Elektronenbündel auf dem Schirm wieder fokussiert werden. In Abhängigkeit der Anzahl der Knotenpunkte n des Elektronenstrahls, die er vor Auftreffen auf den Schirm durchläuft lässt sich die spezifische Ladung des Elektrons in Erweiterung der Gleichung (2a-12) berechnen zu e n 2 ⋅ 8π 2 ⋅ U B = . m s2 ⋅ B2 (2a-13) Dieses Experiment wurde zuerst in einem Testlauf durchgeführt mit relativ ungenauen Werten, bei dem unabhängig von der Beschleunigungsspannung und dem Magnetfeld die Fokussierpunkte gesucht wurden, in denen der Elektronenstrahl als scharfer Punkt auf dem Bildschirm zu sehen war. Die Beschleunigungsspannung wurde an einem Voltmeter abgelesen und die magnetische Induktion B gemessen mit einer Hall- Sonde. b) Der lichtelektrische Effekt – Bestimmung von h/e I. Grundlagen Eine Messmethode für das Plancksche Wirkungsquantum h ist der lichtelektrische Effekt oder auch Photoeffekt. Historisch hat sich der Physiker Wilhelm Hallwachs als erster mit diesem Effekt beschäftigt, weshalb der Photoeffekt auch des Öfteren als Hallwachs-Effekt bezeichnet 11 wird. Hallwachs beobachtete, dass eine negativ geladene Metallplatte bei einfallendem Licht entladen und eine neutrale Metallplatte positiv aufgeladen wurde. Erhöht man die Intensität des Lichts, so wurden diese Vorgänge beschleunigt. Stellt man eine Glasplatte zwischen Metallplatte und Lichtquelle, so wird der Hallwachs-Effekt so gut wie nicht beobachtet. Eine Erklärung für diese Erscheinung wird mit dem UV-Licht-Anteil des ausgesendeten Lichts geliefert. UV-Licht wird durch die Glasplatte abgeschirmt. Der russische Physiker A.G. Stoletow untersuchte sehr ausführlich die Erscheinung, dass unter Einwirkung von UV-Licht negative elektrische Ladungen von der Metalloberfläche abgelöst werden. Weitere Untersuchungen ergaben, dass es sich bei den negativen Ladungen um Elektronen handelt. Anwendung findet die Photoemission unter anderem in der Photozelle. Eine isoliert befestigte Metallplatte wird mit Licht genügend hoher Frequenz bestrahlt, woraufhin die Elektronen durch die Metalloberfläche hindurch in die Umgebung austreten. Diese Photoelektronen werden dann durch ein elektrisches Feld abgesaugt; es fließt dann ein Photostrom. Mit der Photozelle lassen sich also Lichtsignale in Spannungssignale umwandeln. Die Photozelle besteht aus einem Vakuumgefäß mit Photokathode und Anode. (Abb. Hänsel/Neumann 94) ringförmige Anode Licht Kathode + UA Der lichtelektrische Effekt ist zudem eine Bestätigung der Teilcheneigenschaften des Lichts. Zunächst wurde versucht, den Photoeffekt allein mit Hilfe der Wellennatur des Lichts qualitativ wie folgt zu deuten: Trifft die einfallende elektromagnetische Welle die Resonanzfrequenz der Elektronenschwingungen, so kann die Amplitude der Elektronenschwingungen so groß werden, dass das Elektron aus der Metalloberfläche austritt. Dem entsprechend müsste die Energie, mit der das Elektron austritt, in direktem Zusammenhang zur Intensität der eingestrahlten Welle stehen. Es ergab sich jedoch, dass mit Erhöhung der Intensität nur die Anzahl der austretenden Elektronen streng proportional erhöht wird. Die Geschwindigkeit der Photoelektronen ist aber nur von der Frequenz des einfallenden Lichts abhängig und nimmt mit wachsender Frequenz linear zu. Mit der Welleneigenschaft des Lichts konnte unter Auftreten von Widersprüchen hierzu keine zufriedenstellende Erklärung gefunden werden. Albert Einstein verwies als erster auf die Annahme, dass das Licht als reine Teilchenerscheinung, als Photonenstrom, aufgefasst werden müsse. Die qualitative Deutung des Photoeffekts entwickelt sich dann wie folgt: Das absorbierte Photon überträgt dem Elektron seine Energie. Ist diese so groß, dass das Elektron aus seiner Bindung befreit wird, so kann es aus der Metalloberfläche austreten. Hierbei ist es wahrscheinlich, dass ein 12 ausgelöstes Elektron seine Energie nur von einem Photon übertragen bekommt. Jedoch löst nicht jedes absorbierte Photon ein Elektron aus. Die Energie h·ν der verwendeten Photonen des auftreffenden Lichts muss mindestens der nötigen Austrittsarbeit WA des betreffenden Metalls entsprechen. Ist die Energie der Photonen größer als die aufzubringende Austrittsarbeit, wird die überschüssige Energie in kinetische Energie der ausgelösten Elektronen umgewandelt. Es gilt dabei die photoelektrische Gleichung, auch Lenard-Einstein-Gleichung genannt: m 2 ⋅ v = h ⋅ν − W A 2 (2b-1) wobei v hier als die Geschwindigkeit der schnellsten ausgelösten Elektronen zu verstehen ist. Ekin νGrenz ν Zusammenhang zwischen der kinetischen Energie der Photoelektronen und der Frequenz des Lichtes. (Skizze Schülerduden Physik, S. 322) -WA Ist die Energie eines Photons gerade so groß wie die Austrittsarbeit, kann immer noch ein Photoelektron ausgelöst werden, es besitzt jedoch keine kinetische Energie. Die zugehörige Frequenz des einfallendes Lichts heißt Grenzfrequenz νGrenz., da bei kleinerer Frequenz keine photoelektrische Elektronenemission möglich ist. Die zugehörige Wellenlänge, die Grenzwellenlänge, ergibt sich aus λGrenz ⋅ν Grenz = c mit Lichtgeschwindigkeit c. Oberhalb dieser Grenzwellenlänge können keine Photoelektronen ausgelöst werden. Wird die Photokathode mit Licht geeigneter Wellenlänge bestrahlt, so kann am Arbeitswiderstand eine der Lichtintensität proportionale Spannung abgegriffen werden. (Durch spezielle Gasfüllungen der Photozelle kann eine zusätzliche Verstärkerwirkung erreicht werden.) II. Versuchsidee Nach Gleichung (2b-1) ist die kinetische Energie der in einer Photozelle ausgelösten Elektronen höchsten gleich der Energie der auf die Photokathode treffenden Photonen verringert um die zur Auslösung der Elektronen notwendige Arbeit WA. Gelingt es also die maximale kinetische Energie der, durch Bestrahlung mit Licht einer bekannten Wellenlänge (und damit bekannter Frequenz), aus einer Photokathode ausgelösten Elektronen zu bestimmen und diese Messung für verschiedene Wellenlängen bzw. Frequenzen zu wiederholen so erhält man durch Darstellung von Ekin in Abhängigkeit von ν eine Gerade deren Anstieg dem Planckschen Wirkungsquantum h und deren additive Konstante vom Betrag her der Auslösearbeit WA entspricht. 13 Da eine direkte Bestimmung der Geschwindigkeit und damit der kinetischen Energie die im Rahmen dieses Praktikums zur Verfügung stehenden technischen Möglichkeiten übersteigt, muss die maximale kinetische Energie der Elektronen indirekt ermittelt werden. Hierfür wird die sogenannte Gegenfeldmethode zur Anwendung kommen. Dabei wird zwischen Anode und Kathode der Photozelle eine variable Spannung angelegt gegen die die ausgelösten Elektronen anlaufen müssen, wobei ihre kinetische Energie in potentielle Energie umgewandelt wird. Wird diese Gegenspannung so eingestellt, dass auch die schnellsten Elektronen die Anode der Photozelle gerade nicht mehr erreichen so entspricht die maximale kinetische Energie der ausgelösten Elektronen der potentiellen Energie der Elektronen im angelegten elektrischen Gegenfeld. Es gilt: E kin = e ⋅ U (2b-2) e ⋅ U = h ⋅ν − W A (2b-3) Eingesetzt in Gleichung (2b-1) folgt: Da die Frequenz der eingestrahlten Photonen bekannt ist und die Gegenspannung im Versuch gemessen werden kann, ist es zweckmäßig eine Messkurve für die Gegenspannung U in Abhängigkeit von der Frequenz der Photonen aufzunehmen. Aus Gleichung (2b-3) ergibt sich dabei der Zusammenhang: h WA U = ⋅ν − (2b-4) e e Das heißt, dass sich im Grunde nur der Quotient aus h und e mit diesem Versuch als Anstieg der sich aus der Messreihe ergebenden Geraden bestimmt werden kann. Ohne Kenntnis der Elementarladung e lässt sich also das Plancksche Wirkungsquantum h nicht ohne weiteres aus dem äußeren Lichtelektrischen Effekt bestimmen. III. Versuchsdurchführung Innerer Aufbau der Meßapparatur für den Photoeffekt (Größere Version im Anhang P) 14 Mit Hilfe eines Prismas wird das Licht einer QuecksilberDampflampe in seine Spektralfarben, deren Wellenlängen und Frequenzen bekannt sind, zerlegt. Die einzelnen Spektrallinien können über einen drehbaren Spiegel auf die Photozelle gelenkt werden. Durch eine Spaltblende zwischen Spiegel und Photozelle wird dabei sichergestellt, dass tatsächlich nur das Licht einer Spektrallinie und damit einer Wellenlänge auf die Photokathode fällt. Solange Elektronen von der Kathode zur Anode gelangen, fließt innerhalb der Photozelle ein elektrischer Strom IPh, der ein Maß für die pro Zeiteinheit an der Anode ankommenden Elektronen ist. Dieser Photostrom ist in der Regel sehr klein, so dass ein Messverstärker notwendig ist um ihn während des Versuchs zu messen. Das Ziel einer Messung ist es die Gegenspannung so einzustellen, dass der Photostrom gerade verschwindet, also auch die schnellsten an der Kathode ausgelösten Elektronen die Anode nicht mehr erreichen. Da sich dieser Punkt jedoch nicht sehr exakt ermitteln lässt, wird für jede verwendete Wellenlänge eine Messreihe aufgenommen, indem die Gegenspannung U in festen Schritten erhöht und der jeweilige Photostrom IPh im Messprotokoll festgehalten wird. Durch Auswertung der erhaltenen Kurve wird der jeweilige Nullpunkt bestimmt. Dieser liefert die gesuchte Gegenspannung. c) Kurzwellige Grenze der Röntgenbremsstrahlung I. Grundlagen Eine weitere Möglichkeit zur Bestimmung der Fundamentalkonstanten h und e ergibt sich aus der kurzwelligen Grenze der Röntgenstrahlung bei der Drehkristallmethode. Bevor auf diesen Versuch näher eingegangen wird, folgt zunächst ein Abschnitt zu Röntgenstrahlen an sich. Treffen Elektronen mit geeignet hoher Geschwindigkeit auf eine Anode, so entsteht Röntgenstrahlung. Dabei handelt es sich um eine elektromagnetische Strahlung außerhalb des sichtbaren Bereichs im Picometer-Bereich, die 1985 von Wilhelm Conrad Röntgen entdeckt und später nach ihm benannt wurde. (Er selbst nannte sie X-Strahlen, so werden sie im englischen auch noch heute als X-Rays bezeichnet.) Erzeugen lassen sich diese Strahlen in einer sogenannten Röntgenröhre. Dabei handelt es sich um eine evakuierte Glasröhre mit einer Glühkathode und einer abgeschrägten Anode, üblicherweise aus Kupfer. Zwischen Kathode und Anode wird eine Spannung im zweistelligen kV-Bereich angelegt, um die aus der Glühkathode emittierten Elektronen zu beschleunigen. Aufbau einer Röntgenröhre Beim Aufprall auf die Anode Schematischer (Quelle: gesundheit.de, urspr.: A. Scharmann: Arbeitsbuch Physik; München 1981) geben die Elektronen einen Teil ihrer Energie in Form von Röntgenstrahlung ab, der größere Teil allerdings geht in Wärme über, so daß die Anode zusätzlich gekühlt werden muß. (Dieser Kühlkopf befindet sich üblicherweise direkt an der Anode, im nebenstehenden Schema ist er allerdings nicht eingezeichnet.) 15 Treffen Röntgenstrahlen auf einen Einkristall, d.h. einen Kristall mit durchgehend einheitlicher Gitterstruktur, so fungiert dieser wie ein Gitter und zerlegt die Strahlung in ein Spektrum. Die Intensität der einzelnen „Spektralfarben“ läßt sich mit einem Geiger-MüllerZählrohr messen. Dabei erhält man eine Kurve der folgenden Struktur: Je nach Spannung können noch weitere Peaks vorkommen, die der sogenannten charakteristischen Strahlung entstammen, welche vom Anodenmaterial abhängig ist. Die hier ausschließlich eingezeichnete und bedeutsame Bremsstrahlung dagegen entsteht durch das plötzliche Abbremsen der Elektronen an der Anode, welches ohne direkte Stöße mit den Atomen geschieht. Die kinetische Energie der schnellen Elektronen wird dabei in elektromagnetische Strahlung umgewandelt. Da die Elektronen keinesfalls alle die gleiche Geschwindigkeit haben und auch nicht alle gleichstark gebremst werden, entsteht ein kontinuierliches Spektrum für die Bremsstrahlung. Im Diagramm fällt auf, daß das Spektrum an einem bestimmten Punkt zu den niedrigen Wellenlängen hin abbricht. Erhöht man die Anodenspannung, so wandert diese Grenze weiter nach links, senkt man sie, ist sie noch weiter rechts zu finden. Der Hintergrund dieser kurzwellige Grenze wird klar, wenn man die Entstehung der Röntgenstrahlung betrachtet. Die beschleunigten Elektronen haben durch die Anodenspannung maximal eine kinetische Energie von E kin, max = e ⋅ U A . (2c-1) Wenn nun beim Abbremsen an der Anode die Röntgenstrahlung entsteht, kann ein Photon maximal die gesamte kinetische Energie des Elektrons erhalten, für die maximal mögliche Energie eines Photons gilt also E ph ,max = h ⋅ν max = e ⋅ U A (2c-2) Es ergibt sich also eine maximale Frequenz und damit eine minimale Wellenlänge. Mit bekannter Anodenspannung und Messung der Grenzwellenlänge läßt sich damit das Plancksche Wirkungsquantum h bestimmen. 16 h= e ⋅U A ν max = e ⋅U A ⋅ λ min c (2c-3) Allerdings müssen wir hier zur h-Bestimmung die andere Fundamentalgröße e hineinstecken. Es ist daher durchaus sinnvoll zunächst nicht h selbst, sondern den Quotient aus Wirkungsquantum und Elementarladung zu ermitteln. Mit dem Literaturwert des einen läßt sich nun jeweils der andere Wert bestimmen. h UA = ⋅ λ min e c II. (2c-4) Versuchsaufbau Mit einer Röntgenröhre erzeugte Röntgenstrahlen werden auf einen Einkristall geworfen, der unter dem Winkel ϑ zum einfallenden Strahl geneigt ist. Bei einem Einkristall mit dem Netzebenenabstand d gilt für konstruktive Interferenz die Bragg-Bedingung n ⋅ λ = 2 ⋅ d ⋅ sin(ϑ ) , (2c-5) wobei n die Ordnung des Maximums ist. Der Einkristall ist drehbar gelagert, so daß der Winkel ϑ zwischen 0° und ca. 45° variiert werden kann. Da bei Reflexion der Einfallswinkel gleich dem Ausfallswinkel ist, kann man unter dem Winkel 2ϑ, bezogen auf den einfallenden Strahl, das Interferenzmaximum finden. Die Bragg-Bedingung (2c-5) erlaubt uns den Einkristall in dieser Anordnung wie ein Gitter zur Spektralzerlegung zu nutzen. Die unter dem Winkel ϑ erhaltene Intensität läßt sich mit (2c-5) nun direkt in eine Wellenlänge umrechnen. Die hier und im Anhang R dargestellte Apparatur ermöglicht es uns die Anodenspannung fest einzustellen und dann eine Meßkurve für die Intensität der Strahlung unter dem Winkel ϑ aufzuzeichnen. Rechnet man die Winkel in die entsprechende Wellenlänge um, soerhält man ein Diagramme in der in I. dargestellten Form. Versuchsaufbau für die Messung der kurzwelligen Grenze der Röntgenstrahlung. (Große, beschriftete Version im Anhang R) 17 Wir haben den Versuch für verschiedene Anodenspannungen zwischen 13kV und 25kV für verschiedene Kristalle durchgeführt. In beiden Fällen läßt sich sehr schön die Verringerung der kurzwelligen Grenze bei Erhöhung der Anodenspannung beobachten. d) Franck-Hertz-Versuch I. Historisch: Das Bohrsche Atommodell war bekannt und man wusste, dass Atome nur bestimmte Anregungsenergien aufnehmen können. Man hatte verschiedene Experimente schon durchgeführt, jedoch nur mit optischen Anregungsenergien (Lichtelektrischer Effekt). Die Physiker James Franck (1882-1964) und Gustav Hertz (1887-1975) überlegten, ob dieses auch für beliebige mechanische Anregungsenergien gilt. II. Versuchsidee: Mit nebenstehendem Versuchsaufbau (Abb. 2d.1) wurde das Experiment durchgeführt. Man hatte eine Glasröhre (Gl), in der sich Quecksilberdampf (Hg) befindet. Eine beheizbare Kathode K emittierte Elektronen und diese wurden mit der Spannung UGK beschleunigt. Dabei führten die Elektronen elastische und unelastische Stöße mit den Hg-Atomen aus. Man legte auch noch ein Gegenfeld mit der Spannung UAG an. Wenn die Elektronen genügend Energie haben um das Gegenfeld zu überwinden, konnte man am Ende einen Strom messen. III. Abb. 2d.1 Deutung: Wenn die Elektronen bei der Anode ankommen, dann haben sie keine Energie an die HgAtome abgegeben, das heißt die Stöße zwischen den Elektronen und den Hg-Atomen erfolgte elastisch. Der Strom wächst in diesem Fall monoton mit UGK. Bei 4,9 V folgt ein erster Abfall des Stroms, daraus folgt die Elektronen haben nicht genügend Energie das Gegenfeld zu überwinden. In diesem Fall müssen die Elektronen ihre Energie abgegeben haben, d.h. die Stöße erfolgten unelastisch. Das angeregte Hg-Atom fällt unter Abgabe der aufgenommenen Energie, in Form von Licht, in den Grundzustand zurück. Steigert man die Spannung weiter, so steigt der Strom zunächst wieder an und bei 2 · 4,9V fällt der Strom erneut ab. Die Energie reicht dann aus, um 2 Hg-Atome anzuregen. Damit haben Franck und Hertz gezeigt, dass die Atome auch mechanische Energie nur gequantelt aufnehmen können, hier jeweils in Beträgen von ∆W = 4,9 eV. IV. Bestimmung von h: Ist nun die Wellenlänge λ bekannt, so läßt sich dieser Versuch nutzen, um das Plancksche Wirkungsquantum h zu bestimmen. Wir haben dazu diesen Versuch mit Quecksilber (Hg) durchgeführt. Die Hg-Röhre musste erst geheizt werden, da Quecksilber bei Raumtemperatur nicht gasförmig vorliegt. Nachdem wir die Hg-Röhre auf 150°C geheizt hatten, haben wir in der Röhre Elektronen beschleunigt. Dabei haben wir die Beschleunigungsspannung schrittweise erhöht und die Spannung am Ende gemessen. Diese Messung gab uns Aufschluß darüber, 18 wann wir einen Spannungsabfall hatten und wir konnten so die Maxima und Minima im folgenden Diagramm darstellen. Meßkurve beim Franck-Hertz-Versuch (Hg-Röhre) 0,41 0,39 UAnode in V 0,37 0,35 0,33 0,31 0,29 0,27 0,25 10 15 20 25 30 UBeschl. in V 35 40 45 50 55 Diagramm 2d.1 Beim Vermessen der Abstände zwischen den Maxima bzw. Minima erhielten wir die oben genannte Differenz ∆W. In diesen Abständen gibt es somit jeweils einen Spannungsabfall, d.h. die Elektronen haben ihre Energie abgegeben und kamen nicht mehr durch das Gegenfeld. Die bekannte Wellenlänge, die das Hg-Atom abstrahlt um wieder in den Grundzustand zu kommen ist uns mit 253,7 nm bekannt. Mit c ν= (2d-1) λ und h= ∆W ν = ∆W ⋅ λ c (2d-2) ist es nun möglich h zu bestimmen. Die für h ermittelten Werte sind in Abschnitt 3c zu finden, wo sie mit den Werten aus den anderen Versuchen verglichen werden. Dort wird auch auf Meßunsicherheiten eingegangen. e) Wasserstoff-Spektrum I. Grundlagen Die Idee des Versuchs besteht darin, aus den Strahlungsübergängen im Wasserstoff das Plancksche Wirkungsquantum h zu bestimmen. Diese, dem Versucht zugrunde liegende, Idee basiert auf dem Bohrschen Atommodell, welches annimmt, dass sich die negativ geladenen Elektronen auf diskreten Kreisbahnen um den positiv geladenen Kern bewegen, analog wie unsere Planeten um die Sonne kreisen. Damit wirkt die Coulombkraft als Radialkraft: 19 1 4πε 0 ⋅ Z ⋅ e 2 me ⋅ v 2 = r r2 (2e-1) Die Gleichung (2e-1) gilt bereits für den allgemeinen Fall eines Atoms mit der Kernladungszahl Z. Die Annahme des Bohrschen Atommodells beinhaltet zwei Postulate: 1. Postulat: Der Bahndrehimpuls ist immer ein ganzzahliges Vielfaches von ħ = h/2π. Damit sind nur diskrete Elektronenbahnen zugelassen. L = p⋅r = n⋅ h 2π 2. Postulat: Strahlungsübergänge finden nur zwischen diesen diskreten Elektronenbahnen statt. Springt ein Elektron von einer höheren Bahn in eine niedrigere zurück, gibt es Energie in Form eines Photons ab. Die Energie des ausgesandten Photons ist gleich der Differenz der beiden Energieniveaus für die Bahnen. h ⋅ν = E m − E n Mithilfe dieser beiden Postulate und des Kräfteansatzes kann man nun die Gesamtenergie des Elektrons auf der n-ten Kreisbahn um den Kern berechnen. Diese setzt sich aus der kinetischen und der potenziellen Energie des Elektrons zusammen. Zusammen ergibt das: En = − me ⋅ Z 2 ⋅ e 4 1 ⋅ 8 ⋅ ε 02 ⋅ h 2 n 2 (2e-2) Daraus folgt für Strahlungsübergänge, d. h. ein Elektron „springt“ von der m-ten Kreisbahn auf die n-te Kreisbahn und emittiert dabei ein Photon mit der Frequenz ν: h ⋅ν = E m − E n = me ⋅ Z 2 ⋅ e 4 1 1 ⋅ 2 − 2 2 2 8⋅ε0 ⋅ h n m (2e-3) Diese Gleichung entspricht der Serienformel, für z.B. n = 2 ergibt sich die Balmer-Serie, die von Bedeutung für unser Experiment ist. Mit der Beziehung für die Lichtgeschwindigkeit c = λ ⋅ν , eingesetzt in die obere Formel, erhält man die Gleichung zur Bestimmung von h, da alle Konstanten bekannt sind und λ gemessen wird. 1 1 1 = R∞ ⋅ 2 − 2 λ n m mit R∞ = me ⋅ Z 2 ⋅ e 4 , 8 ⋅ ε 02 ⋅ h 3 ⋅ c wobei R∞ die Rydbergkonstante ist. 20 Das einfachste Atom, das wir kennen, ist das Wasserstoffatom. Es besteht aus einem Proton und einem Elektron. Daher liegt es nahe dieses Element zu verwenden, um mit Hilfe der Idee des Bohrschen Atommodells und der Spektralanalyse das Plancksche Wirkungsquantum h zu bestimmen. Die Formel zur Berechnung von h reduziert sich nämlich wegen der Kernladungszahl Z = 1 auf: 1 1 1 (2e-4) = R∞ ⋅ 2 − 2 λ n m me ⋅ e 4 R∞ = 8 ⋅ ε 02 ⋅ h 3 ⋅ c h=3 me ⋅ e 4 ⋅ λ 1 1 ⋅ 2 − 2 2 8⋅ε0 ⋅c m n Als Zwischenschritt war es für die Auswertung zweckmäßig Gleichung (2e-4) nach R∞ umzustellen, so daß sich die Gleichung zur h-Bestimmung wie folgt darstellt: me ⋅ e 4 h= 8 ⋅ ε 02 ⋅ c ⋅ R∞ 3 (2e-5) Ebenso läßt sich mit der Formel auch die Elementarladung e berechnen, wenn man die Gleichung (2e-5) entsprechend umstellt: e=4 8 ⋅ ε 02 ⋅ c ⋅ R∞ ⋅ h 3 me (2e-6) Formel (2e-4) läßt sich für unseren Fall noch vereinfachen, da nur die Übergänge von den Energieniveaus m > 2 auf das Energieniveau n = 2 im sichtbaren Bereich des Lichts liegen und wir nur diese mit unserem Versuchsaufbau messen können. Es gilt also für (2e-4) hier der Spezialfall 1 1 1 (2e-7) = R∞ ⋅ 2 − mit m > 2. λ 4 m II. Versuchsaufbau: Der Versuchsaufbau besteht aus einem Prismenspektrometer, in dem das Licht in seine Spektrallinien zerlegt wird. Dieses sogenannte Spektrum kann dann auf einem Schirm sichtbar gemacht werden, um eine erste farbliche Erkennung und die Reihenfolge der Spektrallinien festzuhalten. Danach wird mit Hilfe eines Photomultipliers, der an Stelle des Schirms an das Prismenspektrometer angebracht wird, das Spektrum vermessen. An dem Photomultiplier ist ein hochsensibles Messgerät angeschlossen, welches auch Ströme im Nanoampère-Bereich messen kann. Diese Messungen müssen bei größtmöglicher Dunkelheit durchgeführt werden, damit kein Fremdlicht in das Prismenspektrometer gelangt und die Messdaten verfälscht. 21 III. Versuchsdurchführung: Als erstes muss der Prismen-Spektralapparat mittels eines Photomultipliers und einer Spektrallampe mit bekanntem Spektrum kalibriert werden, damit man die Wellenlänge des emittierten Lichts bestimmen kann. Dazu benutzten wir eine Quecksilber-Cadmium-Lampe. Nachdem wir nun das Spektrum erst optisch auf dem Schirm beobachtet und notiert hatten, haben wir mit Hilfe des Photomultipliers die Spektrallinien vermessen. Danach haben wir dann eine sogenannte Balmer-Spektral-Lampe verwendet um das Wasserstoffspektrum aufzunehmen. Wieder haben wir zunächst, das Spektrum auf dem Schirm beobachtet und notiert, danach mit dem Photomultiplier vermessen. Auf dem Schirm waren drei Spektrallinien gut zu erkennen, die rote, die blaugrüne und die erste violette Spektrallinie. Mit dem Photomultiplier konnten wir allerdings auch die zweite violette Spektrallinie detektieren. 22 3. Auswertung a) Akzeptierte Werte Wenn man einen Versuch durchführt, bei dem man eine Fundamentalkonstante bestimmt, liegt es naher, daß man den selber bestimmten Wert auch mit Literaturwerten vergleicht. Doch schon der naheliegende Griff zum nächsten Physikbuch könnte eine kleine Überraschung produzieren, wenn man seinen Literaturwert mit dem eines Kommilitonen vergleicht. So gibt beispielsweise der „Metzler Physik“ in seiner Ausgabe von 2002 das Wirkungsquantum h mit h = (6,6260755 ± 0,0000040) ⋅ 10 −34 Js an. Der „Gerthsen“ von 2004 hingegen gibt einen Wert von h = (6,6260688 ± 0,0000005) ⋅ 10 −34 Js an und die Formelsammlung „Physikalische Formeln und Daten“ aus dem Hause Klett von 2000 listet h schlicht mit h = 6,626176 ⋅ 10 −34 Js. Auch wenn diese Werte sich frühestens ab der vierten Nachkommastelle unterscheiden, tut etwas Orientierung im Wertedschungel not. Naturkonstanten wie auch e und h sind nur durch Experimente bestimmbar. Ihre Existenz folgt zwar aus einer oder mehrere Theorien, nicht jedoch ihr Wert. Immer wieder versucht man mit genaueren Messungen daher die Konstanten auf möglichst viele Stellen exakt zu bestimmen. Entsprechend ändern sich die Werte, wenn auch zumeist nur leicht von Zeit zu Zeit. Zur Orientierung gibt daher das „National Institute of Standards and Technology“ (NIST) – gewissermaßen die us-amerikanische Entsprechung des Deutschen Instituts für Normen (DIN) – eine Liste vom sogenannten „Committee on Data for Science and Technology“ (CODATA) vom „International Council for Science” (ICSU) mit empfohlenen Werten für Naturkonstanten heraus. In Deutschland findet man diese Liste auch in einer Broschüre der Physikalisch Technischen Bundesanstalt (PTB) zu den gesetzlichen Einheiten in Deutschland. Während jedoch die SI-Einheiten selbst im „Gesetz über Einheiten im Meßwesen“ – zuletzt am 25.11.2003 geändert – festgelegt sind, ist dies bei den Werten für die Konstanten nicht der Fall. Die vom CODATA erstellte Liste mit empfohlenen Werten listet für h und e folgende Werte: e = (1,60217653 ± 0,00000014) ⋅ 10 −19 C h = (6,6260693 ± 0,0000011) ⋅ 10 −34 Js Die aktuelle Liste wurde im Jahr 2002 erstellt, die davor stammen aus dem Jahre 1998 und 1986. Beide sind neben der aktuellen noch auf den Internetseiten des NIST einsehbar. Die Internetadressen dazu sind neben den Verweisen zu den Einrichtungen auch im QuellenAnhang Q2 zu finden. b) Bestimmung der Elementarladung e In diesem und auch in dem folgenden Abschnitt c) zur Bestimmung des Wirkungsquantums werden nur Ergebnisse und teilweise Zwischenergebnisse der Berechnungen dargestellt. Die den Rechnungen zugrunde liegenden Formeln sind in den Abschnitten 2a bis 2e bereits hergeleitet worden. 23 I. Ergebnisse und Meßunsicherheiten der Methoden 1. Methode nach Schuster Ergebnisse Mit der Methode nach Schuster (s. Abschnitt 2a-I), unter Nutzung der Hallsonde, ergeben sich bei zwei unabhängigen Messungen Mittelwerte von: e As = (2,355 ± 0,561) ⋅ 1011 m kg in der ersten Messung und e As = (1,495 ± 0,371) ⋅ 1011 m kg in der zweiten Messung. (Die Messunsicherheiten sind nach dem Fehlerfortpflanzungsgesetz berechnet worden.) Der von der CODATA für die Elektronenmasse m empfohlene Wert lautet m = (9,1093826 ± 0,0000016 ) ⋅ 10 -31 kg. Die spezifische Ladung des Elektrons berechnet sich damit zu e As = (1,758820109 ± 0,000000463) ⋅ 1011 . m kg Ein Vergleich mit diesem Wert ergibt für beide experimentell gewonnenen Werte prozentuale Abweichungen von 34,6% im ersten Versuch und 14,6% im zweiten Versuch. Somit weichen beide Messwerte stark vom Literaturwert ab, wobei der zweite Wert dem Literaturwert wesentlich näher kommt. Beide Versuche wurden mit verschiedenen Apparaturen gemacht, unter anderem auch mit zwei verschiedenen Hall- Sonden. Verlässt man sich nun aus bereits in Abschnitt 2a-I dargestellten Gründen nicht auf die Hallsonde, sondern berechnet das magnetische Feld der Helmholtz- Spulen aus dem angelegten Strom, liefert das Werte für die spezifische Ladung von e As = (1,569 ± 0,561) ⋅ 1011 m kg in der ersten Messung und e As = (1,437 ± 0,371) ⋅ 1011 m kg in der zweiten Messung, was auf prozentuale Abweichungen führt von 10,3% im ersten Versuch und 17,9% im zweiten. 24 Bis auf den ersten Wert schließen alle Vertrauensintervalle den Literaturwert ein. Aus den so gewonnenen spezifischen Ladungen des Elektrons lässt sich nun, unter Kenntnis seiner Masse m, seine Ladung berechnen. Dabei ergeben sich folgende Werte: 1. Meßreihe mit Hall-Sonde ohne Hall-Sonde 2. Meßreihe mit Hall-Sonde ohne Hall-Sonde e = (2,150 ± 0,511) ⋅ 10 −19 As e = (1,429 ± 0,511) ⋅ 10 −19 (33,9% Abweichung) As (10,8% Abweichung) e = (1,361 ± 0,338) ⋅ 10 −19 As (15,0% Abweichung) e = (1,309 ± 0,338) ⋅ 10 −19 As (18,3% Abweichung) Die Abweichungen beziehen sich natürlich auf den CODATA-Wert von 2002 aus Abschnitt 3a. Es zeigt sich, dass alle gewonnenen Messwerte in der Größenordnung stimmen und – bis auf den ersten Wert – liegt der oben angegebene Literaturwert im Bereich der Messunsicherheit, die bei diesem Experiment relativ hoch ausfällt. Mit den verwendeten Geräten liefert dieses Experiment keine allzu guten Messwerte. Bildet man aber den Mittelwert der obigen Messwerte als Gesamtergebnis, ergibt sich ein relativ guter Wert bei e = 1,561 ⋅ 10 −19 As. Dieser hat auch nur noch eine prozentuale Abweichung von 2,5% gegenüber dem Literaturwert. Meßunsicherheiten Nach Gleichung (2a-7) berechnet sich die spezifische Ladung des Elektrons allein aus der Kenntnis des angelegten Magnetfeldes, der Beschleunigungsspannung und dem Kreisbahnradius. Unsicherheiten auf Grund der Beschleunigungsspannung sind relativ gering und nur zurückzuführen auf die zur Messung verwendeten Geräte und ihre systematischen Fehler. Anders ist das beim Magnetfeld. Dieses wurde mit einer Hall-Sonde gemessen, die weit außerhalb dem Zentrum der Helmholtz- Spulen angebracht war. Zu dem systematischen Fehler des Messgerätes kommt, wie bereits angedeutet, ein zusätzlicher Fehler aufgrund der Position der Sonde hinzu. Im Zentrum der Spulen, wo sich der Elektronenstrahl befunden hat, ist das Magnetfeld annähernd konstant und ändert sich weiter außen stärker. Dies zeigen auch die Berechnungen, die auf dem Spulenstrom basieren. Das berechnete magnetische Feld weicht teilweise relativ stark von dem mit der Hall-Sonde gemessenen ab und ist die doch sehr große Abweichung bei der ersten Meßreihe von über 30% nicht allzu verwunderlich. Die dritte Größe in der Gleichung ist der Kreisbahnradius. Innerhalb der Kugeln waren fluoreszierende Markierungen angebracht mit bekanntem Radius, deren Unsicherheit zu vernachlässigen war. Die Unsicherheit lag vielmehr an der starken Streuung des Elektronenstrahls, der auf diese Markierungen gefallen ist. Es wurde versucht das Maximum an Leuchtkraft zu finden und dieses der Messung zu Grunde zu legen, was aber per Augenmaß auch schwer einzustellen ist. 25 2. Methode nach Busch Ergebnisse Auch bei der Methode nach Busch führten wir mehrere Meßreihen durch. Bei der ersten Reihe ergibt sich eine mittlere spezifische Elektronenladung von e As = (2,169 ± 0,351) ⋅ 1011 m kg mit einer Abweichung von 24% vom obigen CODATA-Wert. Für dieses Experiment wurde noch eine zweite und dritte, ausführlichere Messung durchgeführt, welche auch geringfügig bessere Werte liefern. Während dieser Messreihen wurde das magnetische Feld gemessen in Abhängigkeit der Knotenpunkte bei konstanter Beschleunigungsspannung. Für das zweite Experiment ergab sich damit im Mittelwert ein Ergebnis von As e = (2,014 ± 0,281) ⋅ 1011 m kg mit 15,1% Abweichung gegenüber dem Literaturwert und im dritten Experiment e As = (2,077 ± 0,312 ) ⋅ 1011 m kg mit 18,7% Abweichung. Lässt man zusätzlich die Messwerte für den dritten Knotenpunkt weg, ergeben sich abermals bessere Werte für die spezifische Ladung des Elektrons, da der dritte Knotenpunkt nicht mehr scharf einzustellen war, sondern über ein kleines Intervall als annähernd scharf betrachtet werden konnte. Es ergäben sich Werte von und e As = (1,928 ± 0,281) ⋅ 1011 m kg e As = (2,000 ± 0,312 ) ⋅ 1011 m kg mit 10,2% Abweichung im ersten Fall mit 14,3% Abweichung im zweiten Fall. Betrachtet man nur den Messwert, bei dem der erste Fokussierpunkt auf dem Leuchtschirm gelandet ist, der von allen drei Punkten am deutlichsten scharf einzustellen war, bessern sich die Werte für die spezifische Ladung auf und e = (1,869 ± 0,281) ⋅ 1011 m e = (1,990 ± 0,312 ) ⋅ 1011 m 26 As kg As . kg Diese Werte weichen nur noch um 6,8% bzw. um 13,7% vom Literaturwert ab. Berechnet man nun wie bereits beim Schuster-Versuch die Elektronenladung e aus der spezifischen Masse des Elektrons ergeben sich unter Betrachtung aller Messwerte als Ergebnis e = (1,834 ± 0,256 ) ⋅ 10 −19 As für das erste Experiment und e = (1,892 ± 0,283) ⋅ 10 −19 As für das zweite Experiment. Das entspricht prozentualen Abweichungen von 14,5% und 18,1% vom CODATA-Wert. Legt man nun die Werte zu Grunde, die nur auf dem ersten Knotenpunkt basieren, ergeben sich Werte von e = (1,702 ± 0,256 ) ⋅ 10 −19 As mit 6,3% Abweichung und e = (1,813 ± 0,283) ⋅ 10 −19 As mit 13,1% Abweichung. Zusammenfassend liefert auch dieses Experiment mit den verwendeten Geräten keine zufriedenstellenden Ergebnisse. Es ist noch versucht worden, das Experiment unabhängig von der Hall-Sonde durchzuführen und das magnetische Feld im Inneren der Spule aus dem angelegten Spulenstrom zu berechnen. Dies scheiterte jedoch an der nicht bekannten Windungszahl der Spule. Dennoch dürften die Messunsicherheiten, die auf der Hall-Sonde basieren, nicht annähernd so groß sein, wie beim ersten Experiment zum Schuster-Versuch, da die Sonde besser innerhalb der Spule positioniert war. Meßunsicherheiten Auffällig bei diesem Experiment ist, dass alle gewonnenen Messwerte größer sind als der Literaturwert. Auch in den Einzelmessungen zur spezifischen Elektronenmasse gibt es nur einen Wert, der kleiner ist als der Literaturwert. Dies weist darauf hin, dass dem ganzen Experiment ein systematischer Fehler zu Grunde liegen könnte. Sehr wahrscheinlich liegt dieser systematische Fehler am Magnetfeld, da außer der Beschleunigungsspannung, die mit dem Voltmeter abgelesen werden konnte, nur Konstanten in der Gleichung (2a-13) enthalten sind. Das Magnetfeld im Inneren einer langen Spule ist auch nur annähernd konstant und in der Mitte, wo sich der Elektronenstrahl in der Röhre befindet am größten. Die Hall- Sonde aber war neben der Brownschen Röhre innerhalb der Spule plaziert und hat somit ein geringfügig kleineres Magnetfeld gemessen. Da das Magnetfeld aber quadratisch in die spezifische Ladung eingeht, ist es durchaus denkbar, dass diese kleine Differenz dafür sorgt, dass alle Messwerte zu hoch sind. Die größte Unsicherheit bei diesem Experiment bleibt dennoch die Schärfeeinstellung des Elektronenstrahls. Bei einer einzelnen Schraubenwindung war dies noch deutlich, aber je mehr Windungen die Elektronenbahn hat, desto unschärfer wurde sie auf dem Leuchtschirm. Die genaue Position einzustellen, wo der Punkt nun letztendlich am schärfsten zu sehen ist, wird mit zunehmender Windungszahl immer schwieriger. 27 3. Bestimmung aus h/e-Quotienten In den Abschnitten 2b bis 2e werden Versuche vorgestellt, die primär der Ermittlung des Planckschen Wirkungsquantums h dienen. Bei jedem dieser Versuche jedoch, kann man h nicht berechnen, ohne e zu kennen. Entsprechend läßt sich auch e berechnen, wenn man für h einen bekannten Wert, in diesem Fall den von den CODATA empfohlenen, in die Gleichung „hineinsteckt“. Wir verwenden daher für die Berechnung von e in diesem Abschnitt den Wert h = (6,6260693 ± 0,0000011) ⋅ 10 −34 Js. Auf die genauen Auswertungsschritte und die Meßunsicherheiten wird im Abschnitt zur Bestimmung des Wirkungsquantums eingegangen. Für den Photoeffekt ergeben sich unter Verwendung des obigen h für e die Werte: emin = 1,552 . 10-19 As emittel = 1,659 . 10-19 As emax = 1,718. 10-19 As Aus diesen drei Werten ergibt sich ein Mittelwert (inkl. Vertrauensintervall) von e = (1,643 ± 0,361) . 10-19 As. Bei dem Versuch zur kurzwelligen Grenze der Röntgenstrahlung, erhält man Werte von und h = (4,094 ± 0,061) ⋅ 10 −15 e h = (4,054 ± 0,071) ⋅ 10 −15 e h = (4,032 ± 0,096 ) ⋅ 10 −15 e J A J A J A für die Messung mit LiF-Kristall, für die erste Messung mit KBr-Kistall für die zweite Messung mit KBr-Kristall. Daraus läßt sich mit obigem h die Elementarladung e berechnen zu e = 1,619 ⋅ 10 −19 As e = 1,634 ⋅ 10 −19 e = 1,644 ⋅ 10 −19 Messung mit LiF-Kristall, As 1. Messung mit KBr-Kristall As 2. Messung mit KBr-Kristall. Mittelt man diese und berechnet als Unsicherheitsintervall die Standardabweichung ergibt sich: e = (1,632 ± 0,013) ⋅ 10 −19 As Vom CODATA-Wert weicht dieser Wert um ca. 1,87% nach oben ab. 28 Beim Franck-Hertz-Versuch haben wir zunächst für die Hg-Röhre bei nur einer Wellenlänge die Formel h⋅c λ= e ⋅U benutzt. Diese läßt sich direkt nach e umformen: e= h⋅c λ ⋅U Dabei ergibt sich (inklusive Unsicherheit) der Wert e = (1,598 ± 0,163) ⋅ 10 −19 As für die Hg-Röhre Dieser Werte liegt 0,25% unter dem CODATA-Wert und liefern dabei ein sehr gutes Ergebnis. Der CODATA-Wert liegt beide Male auch im Unsicherheitsintervall. Beim Wasserstoffatom berechnen wir entsprechend der in Abschnitt 2e hergeleiteten Gleichung (2e-6) die Elementarladung und erhalten einen Wert von: e = (1,605 ± 0,016) · 10-19 As Mit nur 0,14% Abweichung vom CODATA-Wert ist dieser Wert nicht nur besonders gut, sondern auch noch genauer als mit dem Franck_Hertz-Versuch. Der CODATA-Wert liegt auch in seinem Unsicherheitsintervall, welches selbst auch recht klein im Vergleich ist. II. Überblick und Vergleich der Ergebnisse Betrachten wir die Ergebnisse für die Elementarladung e im Überblick: Methode nach Schuster Methode nach Busch Lichtelektrischer Effekt Kurzwellige Grenze Franck-Hertz-Versuch Wasserstoffspektrum zum Vergleich: CODATA-Wert: e = 1,561 ⋅ 10 −19 C e = (1,702 ± 0,256 ) ⋅ 10 −19 C e = (1,642 ± 0,361) ⋅ 10 −19 e = (1,632 ± 0,013) ⋅ 10 −19 e = (1,598 ± 0,163) ⋅ 10 −19 e = (1,604 ± 0,016) ⋅ 10 −19 (mit 1. Knotenpkt.) C C C (Hg-Röhre) C e = (1,60217653 ± 0,00000014) ⋅ 10 −19 C Die Methoden von Schuster und Busch liefern die deutlichsten Abweichungen. Sie sind beide alles in allem schön anzuschauende Experimente, aber mit erheblichen Messunsicherheiten behaftet. Zur Bestimmung der Größenordnung der Elementarladung oder auch der spezifischen Ladung des Elektrons und insbesondere zu Demonstrationszwecken sind sie damit durchaus geeignet, aber bei Unsicherheiten von über 10% gehören sie eher zu den weniger geeigneten Experimenten zur Bestimmung von Naturkonstanten, jedenfalls im Rahmen der zur Verfügung stehenden Instrumente. 29 Die aus den Quotienten errechneten Werte liefern allesamt bessere Ergebnisse, benötigen allerdings für die Bestimmung der einen Naturkonstante jeweils die andere. Dadurch reduziert sich in den Rechnungen natürlich auch die Unsicherheit ein wenig. Der Franck-Hertz-Versuch liefert dabei das zweitbeste Ergebnis, auch hier liegt der Wert weniger als 1% daneben. Die Quecksilber-Röhre liefert allerdings keine direkt sichtbaren Resultate und ist somit für Demonstrationszwecken nur bedingt geeignet, da man allenfalls die Kurve auf dem Oszillographen präsentieren kann. Die Bestimmung über das Wasserstoffspektrum liefert den besten Wert, ist allerdings zu Demonstrationszwecken nicht besonders gut verwendbar. c) Bestimmung des Planckschen Wirkungsquantums h I. Ergebnisse und Meßunsicherheiten der Methoden Analog zu Abschnitt b) werden hier die bereits besprochenen Experimente ausgewertet, die die Bestimmung von h ermöglichen. Die einzelnen Meßwertreihen sind in den Anhängen zu den Versuchen zu finden, Verweise darauf finden sch in den jeweiligen Passagen zu den Auswertungen. 1. Lichtelektrischer Effekt Im Versuch wurden für vier Spektrallinien und damit vier verschiedene Frequenzen (gelb: 5,19.1014 Hz, grün: 5,49.1014 Hz, türkis: 6,08.1014 Hz und blau: 6,88.1014 Hz) Messreihen aufgenommen, wobei die Gegenspannung immer in 0,1V Schritten erhöht wurde. Dabei wurde aufgrund starker Schwankungen am Amperemeter für den Photostrom IPh bei jeder Messung ein Intervall anstelle eines einzelnen Wertes aufgenommen. Da die Geschwindigkeiten der aus der Kathode ausgelösten Elektronen keiner linearen Verteilung folgen, existiert auch kein linearer Zusammenhang zwischen der Gegenspannung und dem Photostrom. Als Linearisierung eignet sich die Darstellung von U in Abhängigkeit von IPh (empirische Erkenntnis). Diese Linearisierung wurde für die Minimalwerte, die Maximalwerte und die aus Minimum und Maximum gebildeten Mittelwerte des Photostroms vorgenommen. Aus den für die einzelnen Linearisierungen erstellten RGP-Tabellen können die jeweiligen Anstiege und Konstanten entnommen werden, mit deren Hilfe die Nullpunkte, also die gesuchten Gegenspannungen bei denen der Photostrom jeweils gerade den Wert Null annimmt, berechnet werden können. Damit ergeben sich für jede Frequenz eine minimale Spannung Umin, eine mittlere Spannung Umittel und eine maximale Spannung Umax. Die entsprechenden Werte, RGP-Tabellen und Ergebnisse für die Gegenspannungen sind in den Anlagen P2 und P3 zusammengefasst. Die maximalen, minimalen und mittleren Gegenspannungen wurden mit den zugehörigen Frequenzen in einer weiteren Tabelle zusammengefasst. Da nach der Gleichung (2b-4) ein linearer Zusammenhang zwischen U und ν besteht, konnten für Umin, Umittel und Umax in Abhängigkeit von ν weitere RGP-Tabellen erstellt werden, aus denen drei Werte für den h entnommen werden können. Quotienten e 30 U(ν ν) 1,3 1,2 1,1 U in V 1 Umin Umittel Umax 0,9 0,8 0,7 0,6 0,5 5,00 5,50 6,00 ν in 10 14 6,50 7,00 Hz Mit dem CODATA-Wert für die Elementarladung: e = (1,60217653 ± 0,00000014) ⋅ 10 −19 C ergeben sich für h die Werte: hmin = 6,181 . 10-34 Js hmittel = 6,401 . 10-34 Js hmax = 6,839 . 10-34 Js Aus diesen drei Werten ergibt sich ein Mittelwert von h = 6,473 . 10-34 Js. Er weicht um etwa 2,4% vom CODATA-Wert h = (6,6260693 ± 0,0000011) ⋅ 10 −34 Js ab. Außerdem ergibt sich eine Standardabweichung von: ∆h = 3,35 . 10-35 Js Aus dieser Standardabweichung ergibt sich für die Anzahl von drei Werten und dem zugehörigen Studentfaktor von 4,3 eine Vertrauensabweichung von: ∆h = 8,32 . 10-35 Js 31 Mit Hilfe des äußeren Lichtelektrischen Effektes konnte h also im Bereich: 5,641 . 10-34 Js < h < 7,305 . 10-34 Js lokalisiert werden. Da bei der Versuchsauswertung die Schwankungen der Anzeige des Amperemeters berücksichtigt wurden und diese alle weiteren zufälligen oder systematischen Fehler überwiegen, ist eine weitere Fehlerrechnung hier nicht mehr erforderlich. 2. Kurzwellige Grenze der Röntgenstrahlung Für die Messungen standen 2 verschiedene Kristalle, einmal aus Lithiumfluorid (LiF) und einmal aus Kaliumbromid (KBr), zur Verfügung. Wir haben mir ersterem eine und mit letzterem zwei Meßreihen aufgenommen. Die kurzwellige Grenze λmin sollte allerdings in jedem Fall die gleiche sein, da der Kristall nur als Gitter fungiert. Aus der in Abschnitt 2c hergeleiteten Gleichung (2c-4) folgt damit, daß nur die unterschiedliche Anodenspannung UA die Grenze verschiebt. Da also λmin bei gleicher Spannung UA sich nicht ändern darf, wird entsprechend der Bragg-Bedingung (2c-5) bei unterschiedlichen Kristallen die gleiche Intensität unter einem anderen Winkel auftreten, da die Netzebenenabstände d selbstverständlich Kristallabhängig sind. Beim LiF-Kristall ist d = 2,01·10-10 m, beim KBrKristall ist der Abstand mit d = 3,295·10-10 m etwas größer. Die Messung der Intensität unter einem bestimmten Winkel wurde vom Computer aufgezeichnet. Stellt man die bereinigten Ergebnisse der Messungen des LiF-Kristall mit den verschiedenen Anodenspannungen in einem Diagramm dar, ergibt sich folgendes Bild: kurzwellige Grenze der Röntgenstrahlung 30 25 rel. Intensität 20 13 kV 16 kV 15 19 kV 22 kV 25 kV 10 5 0 40 50 60 70 80 90 100 λ in pm Zur besseren Unterscheidung sind die zu den verschiedenen Spannungen gehörenden Kurven jeweils farblich gekennzeichnet. Entsprechend Gleichung (2c-3) bzw. (2c-4) muß mit größerer Anodenspannung UA die Grenzwellenlänge λmin kleiner werden und umgekehrt. Dies 32 ist deutlich im Diagramm zu erkennen, die 25kV-Kurve beginnt zuerst, die anderen folgen mit fallender Spannung bis hin zur 13kV-Kurve. Nur dieser Anfangswert ist für die Bestimmung des Wirkungsquantums h bzw. des Quotienten h/e – und damit auch der möglichen Bestimmung der Elementarladung e – nötig. Die kurzwelligen Grenzen sollten dabei die gleichen sein. Die jeweiligen, graphisch ermittelten, Werte für die Messungen lauten: UA λmin (LiF) λmin (KBr) 13 kV 16 kV 19 kV 22 kV 25 kV 91,8 pm 76,0 pm 65,7 pm 59,4 pm 49,7 pm 91,7 pm 74,6 pm 65,5 pm 59,7 pm 47,1 pm λmin (KBr) 2. Messung 89,4 pm 79,2 pm 60,9 pm 55,1 pm 52,9 pm Die zweite Messung beim KBr-Kristall weicht etwas von den anderen Ergebnissen ab, ihre Werte werden im folgenden auch am stärksten von den CODATA-Werten bei der Berechnung der Konstanten abweichen. Um einen möglichst geringen Fehler zu haben, bietet es sich an, den Quotienten h/e aus einer Linearen Regression zu berechnen. Dafür stellen wir Gleichung (2c-4) so um, daß wir eine Geradengleichung mit dem Quotienten als Anstieg erhalten: 1 h λ = ⋅ min UA e c Mit dem reziproken Wert der Spannung in Abhängigkeit vom Quotienten aus λmin und der Vakuumlichtgeschwindigkeit c ergibt sich also nun ein linearer Zusammenhang mit h/e als konstantem Anstieg. Um einen Vergleichswert zu haben, ermitteln wir den Quotienten der CODATA-Werte und erhalten h J = (4,13566744 ± 0,00000105) ⋅ 10 −15 . e A Die in der Gleichung benötigte Vakuumlichtgeschwidigkeit c ist auf den Wert c = 299792458 m . s festgesetzt. Aus unseren Messungen ergeben sich Werte von und h = (4,094 ± 0,061) ⋅ 10 −15 e h = (4,054 ± 0,071) ⋅ 10 −15 e h = (4,032 ± 0,096 ) ⋅ 10 −15 e J A J A J A für die Messung mit LiF-Kristall, für die erste Messung mit KBr-Kistall für die zweite Messung mit KBr-Kristall. Die recht schönen Werte mit Abweichungen nach unten von 1,01%, 1,97% und 2,52% erhält man allerdings nur, wenn man in die Regression den Punkt (0,0) einbezieht, da die obige Formel ja keine additive Konstante hat. Mit dem CODATA-Wert für die Elementarladung 33 e = (1,60217653 ± 0,00000014) ⋅ 10 −19 C ergeben sich für das Plancksche Wirkungsquantum h folgende Werte: h = 6,559 ⋅ 10 −34 Js h = 6,495 ⋅ 10 −34 h = 6,459 ⋅ 10 −34 Messung mit LiF-Kristall, Js 1. Messung mit KBr-Kristall Js 2. Messung mit KBr-Kristall. Mittelt man diese und berechnet als Unsicherheitsintervall die Standardabweichung ergibt sich: h = (6,507 ± 0,051) ⋅ 10 −34 Js Vom CODATA-Wert weicht dieser Wert um ca. 1,83% nach unten ab. Das Ergebnis aus dem LiF-Kristall ist etwas besser mit 1,01%, das der zweiten Messung mit dem KBr-Kristall mit 2,52% wie angekündigt am weitesten daneben. Da der Geigerzähler, der für die Intensitätsmessung verwendet wird, einzelne Photonen zählt und die Anodenspannung nur am Gerät direkt eingestellt werden kann, ist eine weitere Fehlerrechnung nicht erforderlich. 3. Franck-Hertz-Versuch Die für die Auswertung zugrunde liegenden Gleichungen und Betrachtungen wurden bereits in Abschnitt 2d beschrieben. Für die Quecksilber-Röhre beträgt die abgegebene Energiedifferenz beträgt 5 eV, d.h. diesen Betrag an Energie haben also die Elektronen an ein Hg-Atom abgegeben. Um die in 2d hergeleitete Formel (2d-2) zu nutzen, brauchen wir noch die Wellenlänge, die uns mit λ = 253,7 nm bekannt ist, und die ebenfalls bekannte Vakuumlichtgeschwindigkeit c. Damit ergibt sich h zu h = 6,779 ⋅ 10 −34 Js. Der prozentuale Fehler gegenüber dem heute akzeptierten Wert von 6,62607693·10-34 Js – s.a. Abschnitt 3a – liegt bei rund 2,3%. Betrachtet man die Unsicherheit, so muß man leider erwähnen, daß wir die Beschleunigungsspannung nur auf ±0,5V genau bestimmen konnten. Für die Wellenlänge und die Lichtgeschwindigkeit kennen wir keine Fehler. Danach ergibt sich für h bei der Hg-Röhre: h = (6,779 ± 0,192) ⋅ 10 −34 Js 4. Wasserstoffspektrum Zum Kalibrieren nutzten wir eine Quecksilber-Cadmiumlampe mit einem Spektrum, welches die unten angegebenen Wellenlängen enthält. 34 Mit der Kalibrierfunktion des Spektographen kann man nun die Wellenlängen der Wasserstoffspektrallinien und dann das Wirkungsquantum h bestimmen. x λ in nm 700 rot (Cd) 894 643,85 650 gelb (Hg) 851 578,02 grün (Hg) 824 546,07 grün (Cd) 783 512,03 blaugrün (Cd) 743 479,99 blau (Cd) 724 467,03 blau (Hg) 658 435,83 violett (Hg) 571 404,66 Wellenlänge in nm Spektrallinie 600 550 500 450 400 550 650 Spektrallinien der Kalibrierungslampe 750 850 950 relative Position x Die Kalibrierfunktion lautet: λ ( x ) = 5,2505 ⋅ 10 −6 ⋅ x 3 − 0,0097 ⋅ x 2 + 6,3159 ⋅ x − 1014,1 Für die Wellenlängen der Wasserstoffspektrallinien ergeben sich dann: m=3 m=4 m=5 Spektrallinie rot (H) blaugrün (H) 1.violett (H) 2.violett (H) x 901 752 654 589 λ in nm 642,44 ± 6,43 482,89 ± 4,83 436,36 ± 4,37 413,70 ± 4,14 λ bekannt in nm Abweichung 656,28 2,11% 486,13 0,67% 434,05 0,53% 410,17 0,86% m=6 Die bekannten Wellenlängen wurden aus der im Anhang Q1 erwähnten Formelsammlung entnommen. Mit den berechneten Werten für die Wellenlängen kann nun die Rydbergkonstante bestimmt werden. Dafür wird lediglich Gleichung (2e-7) passend umgestellt: R∞ = 1 1 1 λ ⋅ 2 − 4 m R∞ in m-1 rot (1,121 ± 0,011)·107 blaugrün (1,106 ± 0,011)·107 1.violett (1,092 ± 0,011)·107 2.violett (1,088 ± 0,011)·107 Mittelwert (1,102 ± 0,011)·107 m>2 Und aus dem gemittelten Wert für die Rydbergkonstante kann nun h entsprechend der bereits hergeleiteten Gleichung (2e-5) errechnet werden. Es ergibt sich ein Wert von h = (6,617 ± 0,066) · 10-34 Js Dieser Wert weicht vom CODATA-Wert um nur 0,14% ab. II. Überblick und Vergleich der Ergebnisse Für das Wirkungsquantum h betrachten wir ebenfalls die Ergebnisse im Überblick: 35 Lichtelektrischer Effekt h = (6,473 ± 0,832) ⋅ 10 −34 Js Kurzwellige Grenze h = (6,507 ± 0,051) ⋅ 10 −34 Js Franck-Hertz-Versuch h = (6,779 ± 0,192) ⋅ 10 −34 Js Wasserstoffspektrum h = (6,617 ± 0,066) ⋅ 10 −34 Js (Hg-Röhre) zum Vergleich: CODATA-Wert: h = (6,6260693 ± 0,0000011) ⋅ 10 −34 Js Beim ersten Anblick fällt auf, daß die Werte für h im Gegensatz zu den Werten für e deutlich „unschöner“ wirken. Guckt man sich jedoch die prozentuale Abweichung in den vorherigen Einzelbesprechungen an, so klärt sich dies schnell auf. Bei einer Zehnerpotenz von -34 ist einfach der gesuchte Wert so klein, daß bei unseren Möglichkeiten sich nicht mehr machen läßt. Der Franck-Hertz-Versuch sticht mit einer Aberweichung von 2,3% nicht besonders heraus, hat aber auch keine zu große Abweichung. Der historisch bedeutsamere Photoeffekt liefert wie auch die kurzwellige Grenze ein ähnliches Ergebnis, obgleich auch diese Abweichungen alle noch ziemlich gut sind. Das einzige Problem ist, daß die Elementarladung e als bekannt vorausgesetzt werden muß und somit die eine Naturkonstante durch die andere bestimmt wird. Die Methode mit der Spektralanalyse des Wasserstoffatoms ist die genaueste, um das Plancksche Wirkungsquantum h zu bestimmen. Mit einer 0,14%-igen Abweichung liefert dieses Experiment den Wert für h, der am nähsten am CODATA-Wert liegt. Dies mag nicht nur mit den aus der Literatur bekannten Wellenlängen zu tun haben, die man in die Formel steckt, sondern auch damit, daß zur Bestimmung von h und e jeweils die dritte bzw. vierte Wurzel auftaucht, die Abweichungen in den Ausgangswerten schnell klein werden lassen. Alle vier Versuche zur h-Bestimmung verdeutlichen sehr schön die Quantisierung der Energie und damit eine fundamentale Erkenntnis der moderneren Physik. Zu Demonstrationszwecken eignet sich natürlich der Photoeffekt besonders gut, wenn allerdings genügend Zeit vorhanden und eine gute Darstellung der Oszillographenkurve möglich ist, bietet sich auch der FranckHertz-Versuch an. Der Versuch zur kurzwelligen Grenze der Röntgenstrahlung eignet sich gut, um die Verbindung von klassischer mit moderner Physik zu zeigen: In einem vielleicht zunächst gar nicht weiter auffallendem Detail des Graphen bei einer Kristalluntersuchung wird die Quantisierung der Energie deutlich und ihre Auswirkung durch den ziemlich abrupten Abbruch des Spektrums ähnlich „sichtbar“, wie beim Photoeffekt, der durch eine Glasplatte gestoppt wird. Das Wasserstoffspektrum selbst ist auch beobachtbar, jedoch ist der Versuch zu Demonstrationszwecken kaum geeignet, da es einiges an Erklärungen und Herleitungen erfordert, bis man bei der h-Bestimmung angelangt ist. Anders als bei der Röntgenstrahlung oder dem Photoeffekt wird hier die Quantisierung der Energie zwar in den diskreten Linien sichtbar, ist aber nicht so „punktuell“ zu veranschaulichen, wie das bei den anderen Versuchen der Fall ist. 36 Anhang Q – Quellen Q1 Literatur Q2 Internet Ergänzendes Material (Bilder) E – e/m-Bestimmung P – Lichtelektrischer Effekt (Photoeffekt) R – Kurzwellige Grenze der Röntgenstrahlung F – Franck-Hertz-Versuch W – Wasserstoffspektrum Anmerkung zur Präsentationsausgabe: Die Präsentationsversion enthält nicht die Rohdaten und Auswertungstabellen der einzelnen Versuche. Das Ziel der Präsentation ist die Vorstellung des Projektes, d.h. ihres Ansatzes, ihrer Durchführung und ihres Ergebnisses. Ziel ist es nicht, eine fertige Vorlage für eine vollständige Projektauswertung (inkl. aller Daten) zu liefern. Aus diesem Grund sind die oben kursiv dargestellten Menüpunkte nicht im Präsentationsanhang enthalten, da sie keinerlei Diagramme oder Bilder enthalten. Q1: Literaturquellen Wilhelm Walcher: Praktikum der Physik B.G. Teubner Stuttgart 1994 D. Geschke: Physikalisches Praktikum B.G. Teubner, Stuttgart Leipzig 1998 H.Hänsel/W.Neumann: Physik III VEB Deutscher Verlag der Wissenschaften Berlin 1973 Schülerduden Physik Dudenverlag 1995 E.W. Schpolski Atomphysik I & II VEB Deutscher Verlag der Wissenschaften Berlin 1972 Mayer – Kuckuk: Atomphysik Stuttgart 1994 J.Grehn/J.Krause (Hrsg.): Metzler Physik Schroedel Verlag GmbH, Hannover 2002 D.Meschede: Gerthsen Physik Springer-Verlag Berlin Heidelberg New York, 2004 Fischer/Dorn: Physikalische Formeln und Daten Ernst Klett Verlag GmbH, Stuttgart 1982 A. Scharmann: Arbeitsbuch Physik München 1981 Q2: Internetquellen http://plancksches_wirkungsquantum.lexikona.de/art/plancksches_wirkungsquantum.html http://de.wikipedia.org/wiki/Hauptseite In Abschnitt 1 wird Bezug genommen auf http://de.wikipedia.org/widi/Elementarladung: „Die Quantenchromodynamik bedingt, dass die in ihr vorkommenden Quarks Ladungen von e/3 oder 2e/3 besitzen. Diese gedrittelten Elementarladungen wurden durch Streuversuche an Protonen und Neutronen, die aus Quarks aufgebaut sind, bestätigt. Da Quarks nur in bestimmten Zweier- oder Dreierkombinationen auftreten, ist unter normalen Bedingungen nach außen immer nur eine ganzzahlige Elementarladung sichtbar. In der Superstsringtheorie treten weitere Unterteilungen der Elementarladung auf.“ http://www.gesundheit.de/ Verwendung des Bildes http://www.gesundheit.de/roche/pics/a33570.000-1_big.gif http://www.codata.org/ Committee on Data for Science and Technology http://www.nist.gov/ National Institute of Standards and Technology Nutzung der Liste der Konstanten von http://physics.nist.gov/cuu/Constants/ http://www.ptb.de Physikalisch Technische Bundesanstalt Broschüre über die gesetzlichen Einheiten in Deutschland: http://www.ptb.de/de/publikationen/download/einheiten.pdf http://www.ludwigsgymnasium.de/unterr/physik/einstein05/einst05photo.htm Stand vom 23.2.2006 P – Anhang zum Photoeffekt P1 – Versuchsanordnung R – Anhang zum Röntgenstrahlungsversuch R1 – Meßanordnung