Reportergen-Assays zur Untersuchung der
Werbung
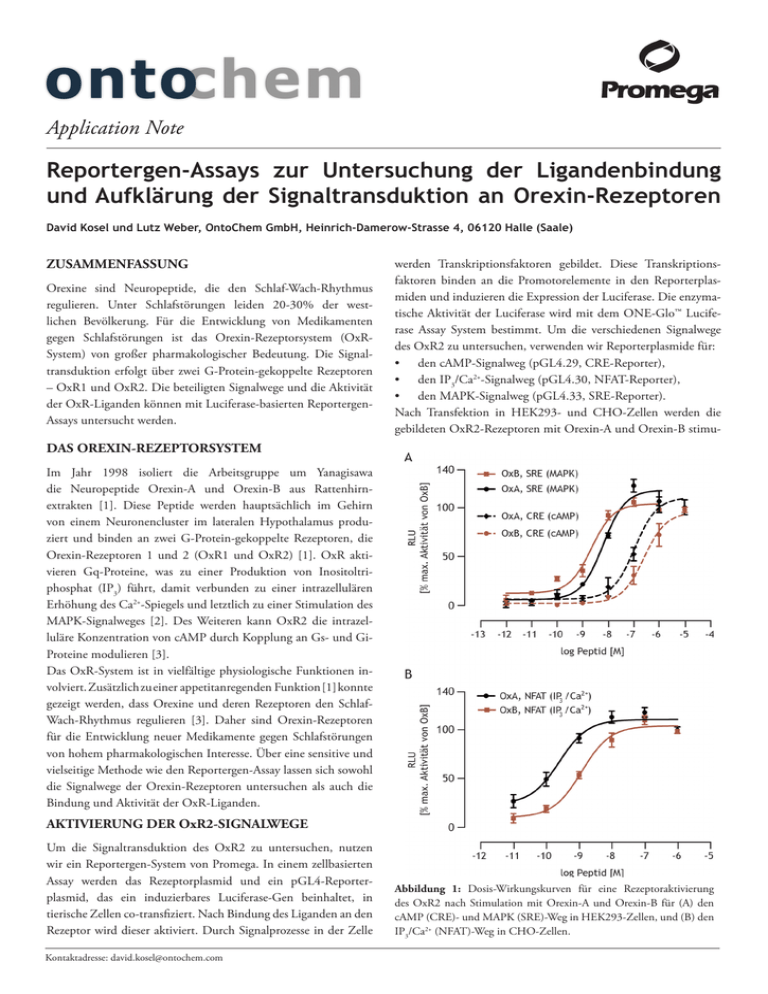
Application Note Reportergen-Assays zur Untersuchung der Ligandenbindung und Aufklärung der Signaltransduktion an Orexin-Rezeptoren David Kosel und Lutz Weber, OntoChem GmbH, Heinrich-Damerow-Strasse 4, 06120 Halle (Saale) ZUSAMMENFASSUNG Orexine sind Neuropeptide, die den Schlaf-Wach-Rhythmus regulieren. Unter Schlafstörungen leiden 20-30% der westlichen Bevölkerung. Für die Entwicklung von Medikamenten gegen Schlafstörungen ist das Orexin-Rezeptorsystem (OxRSystem) von großer pharmakologischer Bedeutung. Die Signaltransduktion erfolgt über zwei G-Protein-gekoppelte Rezeptoren – OxR1 und OxR2. Die beteiligten Signalwege und die Aktivität der OxR-Liganden können mit Luciferase-basierten ReportergenAssays untersucht werden. werden Transkriptionsfaktoren gebildet. Diese Transkriptionsfaktoren binden an die Promotorelemente in den Reporterplasmiden und induzieren die Expression der Luciferase. Die enzymatische Aktivität der Luciferase wird mit dem ONE-Glo™ Luciferase Assay System bestimmt. Um die verschiedenen Signalwege des OxR2 zu untersuchen, verwenden wir Reporterplasmide für: • den cAMP-Signalweg (pGL4.29, CRE-Reporter), • den IP3/Ca2+-Signalweg (pGL4.30, NFAT-Reporter), • den MAPK-Signalweg (pGL4.33, SRE-Reporter). Nach Transfektion in HEK293- und CHO-Zellen werden die gebildeten OxR2-Rezeptoren mit Orexin-A und Orexin-B stimu- DAS OREXIN-REZEPTORSYSTEM Im Jahr 1998 isoliert die Arbeitsgruppe um Yanagisawa die Neuropeptide Orexin-A und Orexin-B aus Rattenhirnextrakten [1]. Diese Peptide werden hauptsächlich im Gehirn von einem Neuronencluster im lateralen Hypothalamus produziert und binden an zwei G-Protein-gekoppelte Rezeptoren, die Orexin-Rezeptoren 1 und 2 (OxR1 und OxR2) [1]. OxR aktivieren Gq-Proteine, was zu einer Produktion von Inositoltriphosphat (IP3) führt, damit verbunden zu einer intrazellulären Erhöhung des Ca2+-Spiegels und letztlich zu einer Stimulation des MAPK-Signalweges [2]. Des Weiteren kann OxR2 die intrazelluläre Konzentration von cAMP durch Kopplung an Gs- und GiProteine modulieren [3]. Das OxR-System ist in vielfältige physiologische Funktionen involviert. Zusätzlich zu einer appetitanregenden Funktion [1] konnte gezeigt werden, dass Orexine und deren Rezeptoren den SchlafWach-Rhythmus regulieren [3]. Daher sind Orexin-Rezeptoren für die Entwicklung neuer Medikamente gegen Schlafstörungen von hohem pharmakologischen Interesse. Über eine sensitive und vielseitige Methode wie den Reportergen-Assay lassen sich sowohl die Signalwege der Orexin-Rezeptoren untersuchen als auch die Bindung und Aktivität der OxR-Liganden. AKTIVIERUNG DER OxR2-SIGNALWEGE Um die Signaltransduktion des OxR2 zu untersuchen, nutzen wir ein Reportergen-System von Promega. In einem zellbasierten Assay werden das Rezeptorplasmid und ein pGL4-Reporterplasmid, das ein induzierbares Luciferase-Gen beinhaltet, in tierische Zellen co-transfiziert. Nach Bindung des Liganden an den Rezeptor wird dieser aktiviert. Durch Signalprozesse in der Zelle Kontaktadresse: [email protected] Abbildung 1: Dosis-Wirkungskurven für eine Rezeptoraktivierung des OxR2 nach Stimulation mit Orexin-A und Orexin-B für (A) den cAMP (CRE)- und MAPK (SRE)-Weg in HEK293-Zellen, und (B) den IP3/Ca2+ (NFAT)-Weg in CHO-Zellen. Reportergen-Assays zur Untersuchung der Ligandenbindung und Signaltransduktion an Orexin-Rezeptoren liert und Dosis-Wirkungskurven mithilfe der Luciferase-Aktivität aufgezeichnet (Abb. 1A und B). Als charakteristische Kenngröße für solche Dosis-Wirkungsbeziehungen dient der sogenannte EC50-Wert. Dieser gibt die Konzentration des Liganden an, bei dem 50% der maximal möglichen Rezeptoraktivierung erreicht sind. Der EC50-Wert wird aus den Dosis-Wirkungskurven mittels der Software GraphPad Prism 5.03 berechnet. Zur Stimulation des cAMP-Signalwegs müssen deutlich höhere Konzentrationen an Orexin-Peptiden eingesetzt werden als zur Stimulation der IP3/Ca2+- und MAPK-Signalwege (EC50Werte cAMP: 110–255 nM; EC50-Werte IP3/Ca2+- und MAPK: 0,2–6,3 nM). Dies zeigt, dass die verschiedenen G-Proteine einer Zelle mit unterschiedlicher Effizienz an die aktive Konformation des OxR2 binden. Der Reportergen-Assay ist dabei so sensitiv, dass sich auch schwächere Signalwege, wie der cAMP-Weg am OxR2, gut detektieren lassen. IDENTIFIZIERUNG VON REZEPTOR-LIGANDBINDEPOSITIONEN IM OxR2 Für die Wirkstoffentwicklung ist die Kenntnis der an der Ligandenbindung beteiligten Aminosäuren im Orexin-Rezeptor von entscheidender Bedeutung. Die Identifizierung der Aminosäuren erfolgt experimentell, indem einzelne Aminosäuren im OrexinRezeptor molekularbiologisch durch die „neutrale“ Aminosäure Alanin ausgetauscht werden. Der Effekt der ausgetauschten Aminosäure auf die Rezeptor-LigandenBindung kann vergleichend zum Wildtyp-Rezeptor untersucht werden. Um zu zeigen, dass Orexin-Rezeptormutanten auch mit dem Reportergen-Assay charakterisiert werden können, werden im OxR2 die Aminosäuren Isoleucin320 (I320) und Asparagin324 (N324) gegen Alanin ausgetauscht. Diese beiden Aminosäuren sind in den für die Rezeptoraktivierung wichtigen Proteinbereichen im OxR2 lokalisiert. Die mutierten Rezeptoren werden in CHO-Zellen transfiziert und mittels Reportergen-Assay auf ihre Aktivierbarkeit mit Orexin-B untersucht (Abb. 2). Der Austausch von I320A zeigt kaum Einfluss auf die Signaltransduktion des OxR2. Die aus Dosis-Wirkungskurven ermittelten EC50-Werte von Wildtyp- 2 OxR2 und OxR2-I320A sind gleich (1,2 nM für wt-OxR2 und 1,9 nM für OxR2-I320A). I320 scheint keine Wechselwirkung mit Orexin-B einzugehen und keinen Einfluss auf die Aktivierung des Rezeptors zu haben. Ein ganz anderes Bild zeigt die Mutation N324A. Hier verschlechtert sich der EC50-Wert von wt-OxR2 zu OxR2-N324A um das 40-fache (1,2 nM für wt-OxR2; 40,9 nM für OxR2-N324A). Eine solche Verschiebung des EC50-Wertes deutet auf eine Beteiligung der Aminosäure N324 an der Bindung des Liganden Orexin-B im OxR2 hin. Diese Daten stimmen mit Resultaten aus einer Studie überein, bei der ein Ca2+/FLIPR-Assay zur Untersuchung dieser OxR2-Mutanten genutzt wurde [4]. SCHLUSSFOLGERUNG Für die Untersuchung und Charakterisierung der Signaltransduktion von Orexin-Rezeptoren kann der sensitive ReportergenAssay vielseitig eingesetzt werden: Die verschiedenen Signalwege der Orexin-Rezeptoren können mit dem Reportergen-Assay in einem einzigen Testsystem erfasst werden. Zudem lässt sich mit dem Reportergen-Assay der Einfluss unterschiedlicher Aminosäuren auf der Aktivierung der Orexin-Rezeptoren studieren. Die Kenntnis der für die Liganden-Rezeptor-Interaktion wichtigen Aminosäuren ist eine grundlegende Voraussetzung für die Entwicklung niedermolekularer Wirkstoffe an Orexin-Rezeptoren. LITERATUR [1] Sakurai, T, Amemiya, A, Ishii, M et al. (1998) Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell 92: 573-585 [2] Ramanjaneya, M, Conner, AC, Chen JC et al. (2009) Orexin-stimulated MAP kinase cascades are activated through multiple G-protein signalling pathways in human H295R adrenocortical cells: divers roles for orexins A and B. J. Endocrinol. 202: 249-261 [3] Scammell, TE, Winrow, CJ (2011) Orexin receptors: pharmacology and therapeutic opportunities. Annu. Rev. Pharmacol. Toxicol. 51: 243-266 [4] Tran, DT, Bonaventure, P, Hack, M et al. (2011) Chimeric, mutant orexin receptors show key interactions between orexin receptors, peptides and antagonists. Eur. J. Pharmacol. 667: 120-128 Abbildung 2: Dosis-Wirkungskurven für Orexin-Rezeptormutanten nach Stimulation mit Orexin-B in CHO-Zellen. Kontaktadresse: [email protected]