Inner-sphere oder outer
Werbung
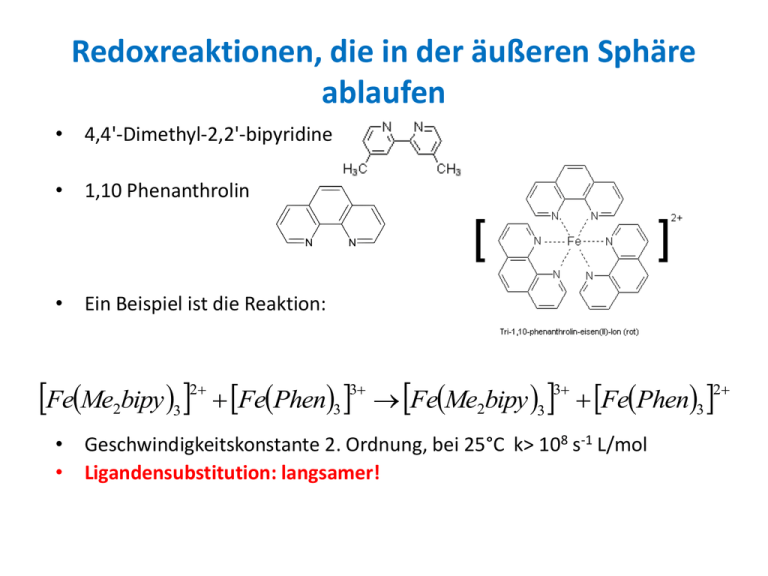
Redoxreaktionen, die in der äußeren Sphäre ablaufen • 4,4'-Dimethyl-2,2'-bipyridine • 1,10 Phenanthrolin • Ein Beispiel ist die Reaktion: FeMe bipy 2 2 3 FePhen3 FeMe2bipy 3 FePhen3 3 3 • Geschwindigkeitskonstante 2. Ordnung, bei 25°C k> 108 s-1 L/mol • Ligandensubstitution: langsamer! 2 • Der eindeutige Beweis, dass eine Redoxreaktion unter Erhalt der Koordinationsschalen verläuft, ist schwierig d.h. • macht eine Kombination von Reaktanden notwendig, bei denen die Redoxreaktion wesentlich rascher verläuft als irgend ein Substitutionsprozess am Oxidations- oder Reduktionsmittel. • Am einfachsten zu behandeln ist der Fall, in dem keine chemische Veränderung erfolgt, • z.B. Reaktion zwischen zwei Komplexen mit gleichem Zentralatom und gleicher Koordinationshülle aber verschiedener Oxidationsstufe (=Austauschreaktion) 54 25 Mn O4 VII 55 25 VI Mn O4 2 54 25 VI Mn O4 2 55 25 Mn O4 Natürliches Mangan besteht zu 100% aus dem Isotop Mn-55. Markiert werden kann mit dem radioaktiven Isotop Mn-54 (Elektroneneinfang, t1/2 = 303 d) Bei solchen Reaktionen hat die e- Übertragung keine Konzentrationsänderung irgendeines der Reaktanden zur Folge! Daher gilt VII G 0 0 Methode zur Bestimmung der Reaktionsgeschwindigkeitskonstante: Mischung von Kaliumpermanganat (violett, diamagnetisch) mit Kaliummanganat (grün, paramagnetisch) in wässr. Lsg. mit radioaktiv markiertem KMnO4 versetzt, in regelm. Zeitabständen Proben entnommen, Manganat als BaMnO4 gefällt, Verteilung der Radioaktivität als Funktion der Reaktionszeit gemessen. Auswertung nach der McKay Gleichung. • McKay Gleichung: ln( 1 F ) k ( A B ) t AX AX F AX AX 0 e 0 • Falls sich optisch stabile Enantiomere eines Komplexes herstellen lassen, kann man die optische Drehung messen: Os bipy 3 Os bipy 3 Os bipy 3 Os bipy 3 2 • 3 3 Die Elektronenübertragung hat eine Änderung der resultierenden optischen Drehung zur Folge 0 G 0 • Falls gleiche Konzentrationen an Reaktanden eingesetzt werden, ist die Geschwindigkeit der Racemisierung ein Maß für die Geschwindigkeit der Elektronenübertragung. • Bipy= 2,2‘ Bipyridin 2 Franck-Condon-Prinzip • Der Elektronenübergang erfolgt innerhalb einer Zeitspanne (10-15 s) • die wesentlich kürzer ist als die Zeit, die ein Kern benötigt, um seine Stellung zu ändern (>10-13 s) • Der elektronische Übergang ist sehr schnell im Verhältnis zur Schwingungsbewegung der Kerne. Dies bedeutet, dass die Atome während des e- Überganges an ihren Plätzen verharren. • Da das Elektron eine statische Situation vorfindet, kann während des Elektronenüberganges keine Zufuhr oder Abfuhr von Rotations- oder Schwingungsenergie erfolgen, auch keine Änderung der räumlichen Anordnung der Atome. • Ein Elektronenübergang ist nur dann erlaubt, wenn er keinen Energieeffekt und keine Änderung der Geometrie des Übergangszustandes erfordert! FeH O 2 2 6 FeH 2O6 FeH 2O6 FeH 2O6 3 3 2 3 2 • FeH 2O6 und FeH 2O6 haben verschiedene Geometrie d.h. die Gleichgewichts-Bindungslänge zw. Zentralatom und Liganden ist verschieden. • Im Grundzustand ist daher kein e- Übergang möglich. Beide Reaktionspartner, Fe(II) und Fe(III) müssen in angeregten Schwingungszuständen vorliegen. 1 Å= 0.1 nm Outer-sphere Redoxreaktionen, Zusammenfassung • Es gilt das Franck-Condon Prinzip: Nur wenn die MetallLigand Bindungen vor der Reaktion zusammengepresst bzw. gedehnt werden, sodass die Geometrie des ÜZ sich während des Elektronenüberganges nicht ändert, kann der e- Übergang auch wirklich stattfinden. • Diese Anregungsenergien sind Beiträge zur Aktivierungsenthalpie H der Reaktion. • Ein zweiter Faktor, der zur Aktivierungsenthalpie beiträgt, ist die Neuanordnung von äußeren LMMolekülen. • Elektrostatische Wechselwirkungen zwischen den Reaktanden spielen dagegen bei outer-sphere Redoxreaktionen keine besondere Rolle! Viele Reaktionen zwischen hochgeladenen Ionen gleichen Ladungsvorzeichens sind sehr rasch. RuCl63- Aktivierungsentropien bei outer-sphere Redoxreaktionen • Vor allem durch Solvatationseffekte bestimmt • Negative Aktivierungsentropien sind für Reaktionen zwischen Ionen desselben Ladungsvorzeichens zu erwarten (ÜZ stärker solvatisiert). • Mit steigender Gesamtladung des ÜZ wird S immer negativer. • Elektronentransferreaktionen, bei denen eine chemische Änderung erfolgt, sind gewöhnlich viel schneller als die entsprechenden Austauschreaktionen. • z.B. ist die Cr2+ - Fe3+ Reaktion viel schneller als die Cr2+ - Cr3+ und die Fe2+ - Fe3+ Reaktion. • Es besteht ein Zusammenhang zwischen dem ΔG0 der Redoxreaktion und der Reaktionsgeschwindigkeit! • Für eine Reihe verwandter Reaktionen gilt: je negativer das ΔG0 desto niedriger das G , desto größer die Reaktionsgeschwindigkeitskonstante. (Eine thermodynamisch begünstigte Reaktion ist also auch kinetisch begünstigt!) • Die Geschwindigkeitskonstanten von outer-sphere Redoxreaktionen lassen sich nach der Marcus-Theorie theoretisch berechnen. Rudolph Arthur Marcus • Rudolph A. Marcus wurde für seine wichtigen Beiträge zur Theorie des outer-sphere Elektronentransfers in chemischen Systemen 1992 mit dem Nobelpreis geehrt. • In biologischen Stoffwechselprozessen wie zum Beispiel der Primärreaktion der Photosynthese spielt der outer-sphere Elektronentransfer die zentrale Rolle. Nobelpreis für Chemie 1992 Rudolph A. Marcus (USA, *1923) Theorien zur Elektronenübertragung http://www.cce.caltech.edu/faculty/marcus/ • Die Marcus-Gleichung ist fast immer sehr gut erfüllt. • Ein großer Unterschied zwischen den berechneten und den experimentell bestimmten Geschwindigkeitskonstanten weist darauf hin, dass ein anderer Mechanismus (inner-sphere) vorliegt. • Die Marcus-Gleichung lässt sich gut verstehen, wenn man näherungsweise annimmt, dass die Reaktionspartner im Fall der outer-sphere Redoxreaktion keinen gemeinsamen aktivierten Komplex bilden, sondern getrennt voneinander aktiviert werden. Gl.5 & Gl.2: G AB G A G B G A GB Gl.6 & Gl.1: 0 GAB G A G B GAB G A G B Gl.6 Gl.7 Gl.7&Gl.3&Gl.4: 0 GAB GAB GAA G A G A GBB G B G B Gl.8&Gl.2: 0 2 GAB GAB GAA GBB G AB 1 0 GAB GAA GBB 2 Gl.8 G kij zij exp RT ij Im Parameter zij steckt zusätzlich, dass der ÜZ aufgeteilt ist, also noch eine Zusammenstoßhäufigkeit der Teil-ÜZ zu berücksichtigen ist. k AA G AA ln z AA RT k BB GBB ln z BB RT k AB G AB ln z AB RT ln K AB 0 G AB RT G AB 1 0 G AB G AA GBB 2 k AB 1 k AA k BB ln K AB ln ln ln z AB 2 z AA z BB k AB k AA k BB K AB z AB z AA z BB k AB K AB k AA k BB F 2 F z AB 1 z AA z BB Zusammenhang zwischen G 0 und G für eine Serie verwandter Reaktionen: Die Marcus-Theorie führt auf eine quadratische Gleichung: G G 1 4 0 2 Der Parameter λ beschreibt die Umordnungsenergie (reorganisation energy), die auf der Änderung von Bindungsabständen und der Solvatation beruht. λ ist für all diese verwandten Reaktionen gleich. G G 1 4 0 2 G nimmt zunächst ab, wenn G 0 von Null zu einem negativen Wert abnimmt (wie erwartet), die Reaktionsgeschwindigkeit steigt (normale Region) G 0 Bei G wird Reaktionsgeschwindigkeit! 0 d.h. Wird G noch negativer, so steigt G die Reaktionsgeschwindigkeit sinkt wieder. 0 Maximum der Marcus entwickelte seine Theorie 1956-1965. wieder (inverser Marcus-Bereich), • Ab 1970 Durchbruch der Marcus-Theorie, experimentelle Bestätigungen • Wird heute vielfach angewendet z.B. auf elektrolytische Reaktionen, elektrisch leitfähige Polymere, photochemische Prozesse, Photosynthese, Chemilumineszenz, Korrosionsvorgänge u.a. Redoxreaktionen, die in der inneren Sphäre ablaufen • ÜZ durch einen gemeinsamen Brückenliganden zwischen den beiden Reaktionspartnern charakterisiert • tritt in biologischen Systemen eher selten auf • Wichtig beim Elektronentransfer von Übergangsmetallen in Lösung 1983 wurde der Nobelpreis an Henry Taube (19152005) verliehen - für die Beschreibung des Elektronentransfers bei inner-sphere Redoxreaktionen (Elektronentransfer von Übergangsmetallen in Lösungen.) Seine theoretischen Modelle waren von großer Bedeutung für die spätere Forschung. Foto: http://news.stanford.edu/news/2005/november30/taube-113005.html CrH O 2 2 6 CoNH3 5 Cl 5 H3O CrClH 2O5 CoH 2O6 5 NH4 2 Diese Reaktion ist rasch, k=6x105 s-1mol-1L Inner-sphere oder outer-sphere Mechanismus? 2 2 Verhalten gegenüber Liganden-Substitution: Co(III) inert, Co(II) labil, Cr(III) inert, Cr(II) labil 1. Annahme: outer-sphere (?) CrH O 2 2 6 CoNH3 5 Cl direct e transfer CrH 2O 6 CoNH3 5 Cl 2 CoNH Cl 3 5 3 5 H3O H 2O schnell CoH 2O6 5 NH4 Cl 2 CrH O 3 2 6 Cl langsam CrClH 2O5 H 2O 2 2. Annahme: inner-sphere CrH O 2 2 6 CoNH3 5 Cl Brückenmechanismus CrClH 2O5 CoNH3 5 ( H 2O) 2 CoNH H O 2 3 5 2 2 5 H3O schnell CoH 2O6 5 NH4 2 Die Schlüsselfrage ist, ob die CrCl2+ Spezies rasch (inner-sphere durch den Redoxmechanismus) oder langsam (outer sphere durch den Liganden-Substitutionsschritt) gebildet wird. 2 Beweis für inner-sphere Mechanismus: Wird die CrCl2+ Spezies durch Ionenaustausch aus dem Reaktionsgemisch abgetrennt und mit einer UV-Methode bestimmt, so erkennt man, dass sie wesentlich rascher entsteht als durch einfache Liganden-Substitution. Brücken Zwischenverbindung H O Cr Cl CoNH 4 2 5 3 5 Bedingung für einen inner-sphere Mechanismus: Der Brückenligand muss imstande sein, als Lewis-Base (Elektronenpaardonator) für zwei Metallatome gleichzeitig zu dienen. Wenn z.B. alle Liganden am inerten Reaktanden NH3 sind, dann muss die Reaktion nach einem outer-sphere Mechanismus vor sich gehen, denn N hat nur ein Paar nichtbindender Elektronen keine Brückenstruktur möglich Der outer-sphere Mechanismus ist ungünstiger, denn zwischen dem Oxidations- und Reduktionsmittel besteht keine Wechselwirkung, die diesen helfen könnte, ihre Energien aneinander anzugleichen, wie dies von der Franck-Condon Bedingung gefordert wird! Oxidation von Cr 2 mit CoNH 3 5 Cl 2 um 10 Größenordnungen rascher als mit Co NH 3 6 3 Wo erfolgt der Angriff wenn der Brückenligand mehrere Atome hat? Cr H O CrH O X 2 * 2 6 2 2 5 Cr * H 2O 5 X CrH O 2 2 2 6 für X=NCS- ist k=1,4x10-4 s-1mol-1L für X=SCN- ist k=4x101 s-1mol-1L (25°C) Cr(H2O)52+ ist eine recht harte Lewis-Säure: stabilere Bindung mit N (harte Lewis-Base) als mit S (weiche Lewis Base) höhere Konzentration an ÜZ im QuasiGleichgewicht wenn X=SCN- CoNH NCS 2 3 5 CrH 2O6 2 ergibt ausschließlich das Cr-SCN2+ Produkt d.h. der Angriff erfolgt am weiter entfernten Atom remote attack CoNH SCN 2 3 5 CrH 2O6 2 ergibt 30% Cr-SCN2+ d.h. Angriff am unmittelbar benachbarten Atom adjacent attack und 70% Cr-NCS2+ remote attack Das angreifende Cr2+ hat eine „Vorliebe“ für das S-Atom, obwohl das Cr-SCN2+ thermodynamisch weniger stabil ist als das Cr-NCS2+ WARUM? Der Mechanismus des Elektronentransfers zerfällt in zwei Teilschritte 1.) Brücke wird reduziert 2.) Weiterleitung des e- auf das Oxidationsmittel S lässt sich durch ein benachbartes Cr2+ leichter reduzieren als N.











