Triphenylphosphin-imin, -oxid und
Werbung

METALL [O]-VERBINDUNGEN M IT NICH TA RO M A TISCH EN STICKSTOFF-jr-SYSTEM EN V
739
Metall [ 0 ] -V erbindungen m it nichtarom atischen S tickstoffs-S ystem en V 1
Triphenylphosphin-imin, -oxid und -äthylen als Liganden in MolybdänfO]und W olfram[0]-Carbonyl-Komplexen
H a n s B o c k u n d H e i n d i r k t o m D ie c k 2
Institut für Anorganische Chemie der Universität München
(Z. Naturforschg. 21 b, 739—746 [1966]; eingegangen am 7. April 1966)
Die Komplexbildungsfähigkeit von Triphenylphosphin-imin (C6H5) 3P = NH, -oxid (C6H5) 3P = 0
und -äthylen (C6H5) 3P = CHCH3 wird verglichen: Die verschiedenen Ph3P = X-Systeme setzen
sich mit Molybdän- und Wolfram-hexacarbonyl, Cycloheptatrien-Molybdäntricarbonyl oder Bis(dialkylcyanamid)-Molybdäntetracarbonyl je nach Reaktionsbedingungen zu den Komplexen
[ (Ph3P = X ) 2Me(CO)4] (Me = Mo, W und X = NH, O), [(P h 3P = X ) 3Mo(CO)3] (X = O,
CHCH3) sowie dem ungewöhnlich stabilen, zweikernigen [(P h 3P = N H )2Mo(CO)3] 2 um. Die Struk­
turen und der P = X/Metall-Bindungstyp werden an Hand der Schwingungsspektren diskutiert.
D ie durch K om plex-Liganden an nullw ertigen
Zentralm etallen induzierte negative Ü berschußladung
sollte nicht n u r durch R ückbindung an den L iganden
selbst (a) oder tran s-stän dige A kzeptorgruppen (b ),
so n d ern auch durch D elokalisierung der positiven
P artia llad u n g im Liganden-System (c) stabilisiert
w erden:
j«
^
s ''
(a)
te
[L —~M e] ----------------\
Je
CL^Me ]
]
[ L— ~Me —-A
N
Je
[
—
- i—
(1)
(b)
<te
-Me
J
(c)
\
M o/W (C 0 ) 6+
A . Darstellung und Eigenschaften der Molybän-
und W olfram carbonyl-K om plexe m it Triphenylphosphin-imin, -oxid und -äthylen
E rh itzt m an T riphenylphosphin-im in 1 oder Triphenylphosphin-oxid 2 m it M olybdän- oder Wolfram carb o n y l u n ter Luftabschluß in inerten L ösungs­
m itteln au f 8 5 ° , so scheiden sich b ald gelbe bis rote
K ristalle der entsprechenden D isubstitutionsprodukte
3 - 6 ab:
[ ( ( C 6H 5) 3P = N H ) 2M o ( C O ) 4] 3
* [ ( (C6H 5) 3P = N H ) 2W (CO) 4] 4
2 (C6H5) 3P = N H /
1
Aus diesem G runde erw arten w ir, daß bei D o n ato r­
liganden P h 3P = X die a-B indung zum M etall in der
R eihenfolge P = 0 < P = N < P = C verstärkt w ird.
- 2 CO
2 (C6H 3) 3P = 0
2
\
(2 )
* [ ( (C6H 3) 3P = 0 ) 2Mo (CO) 4]
, [ ( ( C 6H 5) 3P = 0 ) 2W ( C 0 ) 4]
H eiß filtriert lassen sich die reinen V erbindungen
3 — 6 von den Ausgangsstoffen trennen. Aus dem
o rangefarbenen einkernigen K om plex 3 entsteht in
höhersiedenden Lösungsm itteln bei T em peraturen
5
6
o berhalb 110 °C u n ter A bgabe von 1 Mol K ohlen­
oxid der gelbe zw eikernige K om plex 7, d er unter
diesen B edingungen auch direkt aus den K om ponen­
ten zugänglich ist:
a ta C A h P -N H h M o fC O ),]
3
2 Mo (CO) 6+ 4 (C6H5) 3P = NH
T^ o
1 4. Mitt.: H. B o c k u . H. t o m D i e c k , Angew. Chem. 78,
54 [1966], internal. Edit. 5, 520 [1966].
[ ( (C6H 5) 3P = NH) 2Mo (CO) 3] 2
7
2 H. t o m
1966.
D ie c k ,
(3)
Teil der Dissertation, Universität München
Unauthenticated
Download Date | 2/17/17 10:54 AM
740
H. BOCK UND H. TOM DIECK
E ine entsprechende R eaktion w ird bei den V er­
bindungen 4 — 6 nicht beobachtet: T rip h en y lp h o s­
phinoxid liefert bei E rhöhung der R eaktionstem pe­
ra tu r auf 120 °C nach dem IR -Spektrum z .T . ein
trisubstituiertes P ro d u k t; T riphenylphosphinäthylen
8 schließlich ist therm isch zu em pfindlich; auch p h o ­
tolytisch w erden hier n u r Z ersetzungsprodukte er­
halten. Um zu trisu b stitu ierten M etallcarbonyl-D erivaten zu gelangen, brachten wir CycloheptatrienM olybdän-tricarbonyl 9 3, m it den P = X-Systemen
1, 2 und 8 im inerten Lösungsm ittel bei N orm al­
tem p eratu r zur R e ak tio n :
+ (C6H5) 3P = 0 —*■^ (CßHö) 3P —0 ) 3Mo (CO) 3]
2
1 0
C7H8Mo (CO) 3 + (C6H5) 3P = CHCH3 -> [ ( (C«H5) 3p 7 CHCH3) 3M0 (CO) 3] + c 7h 8
8
11
+ (C6H-) 3P = NH —> 1- ( (C6H5) 3P = NH) 2Mo (CO) 3] 2
e
o 3
7
D er olefinische L igand w ird dabei in der R eihen­
folge P = 0 < P = N < P = C m it zunehm ender Ge­
schw indigkeit verdrängt. W ährend m an m it Phosphin-oxid 4 und -äthylen die erw arteten trisu b stitu ­
ierten V erbindungen erhält — wobei die AlkylenV erbindung 11 wegen ih rer U nlöslichkeit nicht ge­
reinigt w erden kann — ergibt T riphen y lp h o sp h in ­
2 Mo (CO) 6+ 4 (C6H 5) 3P = NH
1
im in w iederum ausschließlich 7. Dieser zw eikernige
K om plex entsteht auch bei der V erdrängung von Dialkylcyanam id aus cis-M olybdän(O ) -bis (dialkylcy an am id )-tetracarb o n y l 72 5 bei 5 0 c in Benzol. Im
Reaktionsschem a (5) sind die Umsetzungen zusam ­
m engefaßt, bei denen 7 als einziges P ro d u k t auftritt:
2(C 6H5) 3P = NH)oMo(CO) 4
T<80°
—4 CÖ
3
r> n o °
-
6 CO
20 °
(4)
r> n o °
[ ( (CgH 5) 3P = NH) 2Mo (CO) 3] 2
-2C,H8
2 C7H8Mo (CO) 3 + 4 (C6H5) 3P = NH
9
1
Das dim ere B is(triphenylphosphinim in)-M o ly b dän-tricarbonyl 7 übertrifft in der therm ischen S ta­
b ilität alle anderen K om plexe (vgl. T ab. 1 ), ist lu ft­
beständig und — auch nach Zusatz von N etzm it­
teln — unem pfindlich gegen Basen und verdünnte
S äuren. Um sicherzustellen, daß in 7 nicht eine
/rons-disubstituierte V e rb in d u n g 6’ 7 m it um gelager­
ten Liganden gem äß 1. c. 6 vorliegt,
3 M. A . B e n n e t , L. P r a t t u . G. W i l k i n s o n , J. ehem. Soc.
[London] 1961, 2037; E. W . A b e l , M. A . B e n n e t u . G.
W i l k i n s o n , 1959, 2323,
4 Die Triphenylphosphinoxid-Molybdän-carbonyle 5 und 10
haben gleichzeitig und unabhängig von uns L. C h a n d r a s e g a r a n u. R . A. R o d l e y , Inorgan. Chem. 4, 1360 [1965]
dargestellt.
-
2 co
50°
-4 r 2n c x
- 2 co
(5)
2 (R2NCN) 2Mo (CO) 4 + 4 (C6H5) 3P = NH
12
1
(C«H5) 3P = NH
— *(C6H5) 2P —NHC6H5
(6)
w urde 7 in ko n zen trierter w äßrig/m ethanolischer
Salzsäure zersetzt und 6 8% durch H ydrolyse des
L iganden
isoliert.
entstandenes
T riphenylphosphinoxid
2
T ab. 1 gibt einen Ü berblick über die Eigenschaf­
ten der neuen 4 V erbindungen.
5 H. B o c k u . H. t o m D i e c k , Z. anorg. allg. Chem. 345. 9
[1966].
6 F. A. C o t t o n , Inorgan. Chem. 3, 702 [1964] ; L. E. O r g e l ,
1,25 [1962],
7 7rans-disubstituierte Komplexe sind nur mit relativ gut
rückbindenden Liganden bekannt, wobei die CO-Frequenzen im Bereich von 1970 —1940/cm (Big) und 1920 bis
1890/cm (E„) liegen. Vgl. 1. c . 8.
Unauthenticated
Download Date | 2/17/17 10:54 AM
METALL [0]-VERBINDUNGEN MIT NICHTAROMATISCHEN STICKSTOFF-jr-SYSTEMEN V
Nr.
Verbindung
3
((C6H 5)3 P = N H )2Mo(CO)4
4
((C6H5)3P = N H )2W(CO)4
5
((C6Hs )3P = 0)2M o(C0)4
6
((C6H 5) 3 P = 0 ) 2W(CO)4
7
[((C6H 5 )3 P = N H )2Mo(CO)3]2
10
((C6H 5)3 P = 0 )3 M o(CO)3
11
((C6H5)3P=CHCH3)3Mo(CO)3
741
F arbe und
Form
Ausbeute
[% ]
Zers.-Temp.
orangefarbene
K ristalle
karm inrote
K ristalle
hellgelbe
K ristalle
hellgelbe
Kristalle
goldgelbe N adeln
oder K örner
goldgelbe
Kristalle
hellgelbes
Pulver
70
1 2 7 -1 4 0
92
1 7 0 -1 7 4
82
ab 145
88
ab 138
86
2 3 5 -2 4 5
78
2 0 0 -2 2 0
[°C]
1 2 6 -1 4 0 *
100*
Tab. 1. Eigenschaften von Molybdän- und Wolframcarbonyl-Koraplexen mit Triphenylphosphin-imin, -oxid und -äthylen als
Liganden. * Rohprodukt.
B. Zur Struktur der (C6H 3)3P = X-Molybdänund W olfram -carbonyle
W ie schon bei den C r [ 0 ] - und Mo [ 0 ] -Dialkylcyanam id-carbonylen 5 näher beschrieben, ist beson­
ders der A bsorptionsbereich der M etallcarbonylgru p p en 6 für die jew eilige G eom etrie des G esam t­
kom plexes und fü r die elektronischen Eigenschaften
d er neuen L iganden aufschlußreich. Die A usw ahl­
den L iganden eine lokale Cav-Symmetrie nicht m ehr
voraussetzen kann, u n d die in C3V entartete Schwin­
g ungsrasse E d ah e r deutlich aufgespalten sein
sollte. T ran ssu b stitu ierte K om plexe sind m it den
vorliegenden stark en D o n ato r-L ig an d en 7 nicht zu
erw arten.
regeln erfo rd ern hier für czs-disubstituierte K om ­
plexe cw-L2M o (C O ) 4 (Cgv) vier IR -aktive Carbonylschw ingungen; fü r cis-trisubstituierte K om plexe
ci.s-L3M o (C O ) 3 sind im vorliegenden Fall drei B an ­
den zu erw arten, da m an bei so raum beanspruchen­
Nr.
Verbindung
Punkt­
gruppe
3
((C6H5)3P = N H )2Mo(CO)4
C2v
4
((C6H5)3P = N H )2W(CO)4
c 2v
5
((C6H5)3P = 0 ) 2Mo(CO)4
c 2v
6
((C6H5)3 P = 0 )2W(CO)4
c 2v
7
[((C6H5)3P =N H )2Mo(CO)3]2
10
11
((C6H 5)3 P = 0 )3Mo(CO)3
((C6H5)3P=CHCH3)3Mo(CO)3
Lage und Z u o rd n u n g der M etallcarbonyl-V alenzfrequenzen in den dargestellten (C 6H 5) 3P = X-substitu ierten M olybdän- und W olfram -carbonylen fin­
den sich in T ab. 2 zusam m engefaßt.
D iese D aten bestätigen fü r die V erbindungen
3 — 6 cw -D isubstitution, fü r 1 0 und 11 cz's-Trisubstitution. E in Vergleich m it den entsprechend substi­
tuierten D ialkylcyanam id-, Chrom- und M olybdän-
d
2
„C3v“
„C3v“
CO-Frequenzen
(Rasse )
2000
(Ai)
1976
(Ai)
2000
(Ai)
2000
(Ai)
1894
(Bi)
1894
(Ai)
1898
(Ai)
1863
(Bi)
1845
(Bi)
1876
(Bi)
1855
(Bi)
1770
(B3)
1757
1840
(Ai)
1828
(Ai)
1840
(Ai)
1835
(Ai)
1787
(Bo)
1779
(B2)
1795
(B2)
1792
(B2)
1733
(„E“)
1799
1767
(„E“ )
Tab. 2. Metallcarbonyl-Valenzfrequenzen (cm *) der (C6H5) 3P = X-Molybdän- und Wolframcarbonyle (in Nujol/HostaflonSuspension).
Unauthenticated
Download Date | 2/17/17 10:54 AM
742
H. BOCK UND H. TOM DIECK
carbonylen 5 zeigt, daß die C arbonylfrequenzen h ier
noch langw elliger liegen; die (C6H 5) 3P = X -Systeme
folglich noch stärkere D onatoren als die D ialkylcyanam ide sind. Trotzdem ist eine wesentlich ge­
ringere Em pfindlichkeit der festen V erbindungen
gegenüber L uft und T em peratureinw irkung als bei
D ialkylcyanam id-V erbindungen festzustellen, ein Be­
fund, der in Ü bereinstim m ung m it dem A usgangsP ostulat zur Stabilität der (C6H 5) 3P = X -D onatorK om plexe steht.
D er außerordentlich beständige dim ere P hosphinim in-M olybdän-carbonyl-K om plex 7 stellt auch h in ­
sichtlich seiner S tru k tu r eine A usnahm e dar. Aus
S tabilitätsgründen ist — trotz fast gleicher an a ly ti­
scher W erte von 3 und 7 — eine Irans -A nordnung
der L iganden in 7 au szuschließen'. E in stärkeres
A rgum ent h ie rfü r liefert die langw ellige V erschie­
bung der C arbonylabsorption, die eindeutig im Be­
reich czs-substituierter C arbonyl-K om plexe liegt. Das
H ydrolyseprodukt T riphenylphosphinoxid belegt des
w eiteren einen im K om plex 7 chemisch u n v erä n d er­
i
ten L iganden. F ü r 7 w ird d aher eine zw eikernige,
carbonylverbrückte S tru k tu r vorgeschlagen:
Nach den A usw ahlregeln (lokale Sym m etrie Do)
sind von den sechs möglichen Carbonylschw ingungen (A, B l , B2 , B3 der vier endständigen CO-Gruppen sowie A, B 3 der B rückencarbonyle) n u r zwei
( B l und 5 3) infrarot-aktiv. Die B 1-Schwingungsrasse der S ym m etriegruppe D 2 sollte in g rober
N äh eru n g der B ^R asse cw -disubstituierter K om ­
plexe {3 — 6: 1860 — 1880/cm ) entsprechen und
w ird d ah er der Bande bei 1894/cm zugeordnet. Die
F requenz von B rückencarbonylen liegt nach der E r ­
fah ru n g im Bereich kurzw ellig absorbierender K etone,
w eshalb die A b sorptionsbande bei 1770/cm als B3-
i
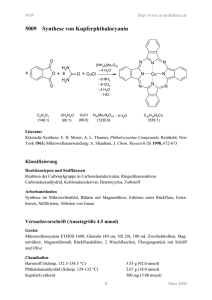
l((CeH5)3 P=NH)2 Mo(CO)J
Abb. 1. IR-Spektren von Triphenylphosphinimin 1, Bis (triphenylphosphinimin)-Molybdän-tetracarbonyl 3 und dime­
rem Bis(triphenylphosphinimin)-Molybdän-tricarbonyl 7 (in Nujol/Hostaflon-Suspensionen).
Unauthenticated
Download Date | 2/17/17 10:54 AM
METALL [ 0 ] -VERBINDUNGEN MIT NICHTAROMATISCHEN STICKSTOFFS-SYSTEMEN V
Nr.
Verbindung
J 'p - X
vp=x
(Komplex)
(Ligand)
1193 m
1193 m
1192 s
1186 s
1192 s
1186 s
1193 m
1192 s
1186 s
824 m
3
4
5
((C6H5)3P =N H )2Mo(CO)4
((C6H 5)3P = N H )2W(CO)4
((C6H 5)2P = 0 ) 2Mo(CO)4
1153 w
1158 w
1149 s
6
((C6H5)3 P = 0 )2W(C0)4
1143 s
7
10
[((C6H5)3P = N H )2Mo(CO)3]2
((C6H5)3 P = 0 )3Mo(CO)35
930 s
1188 s *
11
((C6H5)3P=CHCH3)3M o(CO)3
(784)
743
v®
VP —X
8 7 0 - 750
8 7 0 - 750
9 5 0 -1 0 0 0
9 6 0 -1 0 0 0
8 7 0 - 750
9 5 0 -1 0 0 0
7 9 0 - 775
Tab. 3. Vergleich der P = X-Valenzfrequenzen komplexgebundener und freier Liganden mit denen entsprechender P ® —XEinfachbindungen 9 (in cm- J ). s = stark, m = mittel, w = schwach. * Mittelwert aus vier Banden (1205, 1163, 1183 und
1171/cm).
Rasse dieser G ruppen gedeutet w ird. Bem erkensw ert
ist d arü b erh in au s die langwellige V erschiebung der
N —H -V alenzfrequenz im dim eren K om plex 7
(3 2 2 5 /cm ) gegenüber dem einkernigen 3 (3 3 3 5 /
cm) und dem freien P hosphinim in 1 (3 3 8 0 /c m ),
w odurch sich — wie bei den noch zu besprechenden
P = N -Schw ingungen — eine verschieden starke K o­
o rd in ation in beiden K om plexen verrät. Die charak­
teristischen IR-spektroskopischen B efunde soll Abb. 1
nochm als deutlich machen.
A bschließend w erden in Tab. 3 die P = X-Valenzfrequenzen kom plexgebundener und freier Ligan©
den den P —X -V alenzfrequenzen in Phosphonium -
Aus den schw ingungsspektroskopischen D aten e r­
g ib t sich som it fü r die L iganden m it P = N-, P = 0 und P = C-Bindungen ein stark er D onatorcharakter.
D abei stehen im Falle des T rip h enylphosphinim ins 1
fü r die D o n ato rb in d u n g zum M etall form al zwei v er­
schiedene M öglichkeiten offen: ö-K oordination an
das M etall ü b er das freie E lek tro n en p aar des IminStickstoffs (a)-<— ^ (b ) oder rr-K oordination ü ber
das eigentliche D oppelbindungs-E lektronenpaar (c) :
\
Se H
— P = f / —-
\ Se
Me
/
\ie
^ se
/
8 übereinstimmend werden in den zahlreichen bekannten
Kationenkomplexen mit Phosphinoxiden (I. L i n d q v i s t , In­
organic Adduct Molecules of Oxo-Compounds, SpringerVerlag 1963, S . 35 ff.) und Phosphinsulfiden (H. T e i c h ­
m a n n , Angew. Chem. 77, 809 [1965]) langwellige Ver­
schiebungen von etwa 50/cm gefunden. In den einzigen
bisher bekannten Phosphin-imin-Kationenkomplexen (W.
S e i d e l , Angew. Chem. 77, 809 [1965]) werden hierzu
(a)
\
<>®_y H
7
—P = N
(3)
L ie
©
salzen [ (C6H 5) 3P —X] Y 0 gegenübergestellt.
T ab. 3 ist zu entnehm en, daß in allen di- und trisubstituierten (C6H 5) 3P = X-M olybdän- und -Wolfram -carbonylen die P = X -V alenzfrequenzen der
kom plexgebundenen
Liganden
gegenüber
den
freien n u r geringfügig erniedrigt sind 8. D abei w ird
in P hosphinalkylenen die B indung bereits im freien
Z ustand am besten durch eine D ipolstru k tu r
© ©
^ P —C
beschrieben 9. E ine deutliche A usnahm e
bildet auch hier das stabile dim ere Bis (triphenylph o sp hinim in)-m olybdän-tricarbonyl 7, dessen ein ­
zige neue, intensive A bsorption bei 9 3 0 /cm p ra k ­
tisch schon in das Gebiet der P —N -Einfachbindungen fällt 9, ein weiteres Indiz fü r eine stärkere oder
an d ersartig e K oordination des P hosphinim ins in 7.
H
— p— N
(b) }
(c)
F ü r eine ^ -K o o rd in atio n (c) finden sich im Ge­
gensatz zu den Nickel ( 0 ) -dialkylcyanam id-carbonyl e n 10 keine A n h altsp u n k te; das P h o sp h in im in ist
eindeutig ü b er das freie E lek tro n en p aar an das M e­
tall gebunden. E in Gleiches gilt fü r die P h o sp h in ­
oxide und -alkylene, w obei erstere u n ter w eitgehen­
dem E rh a lt der D oppelbindung nach ( a ), letztere
n atu rg em äß nach (b) o-koordiniert sind. W ährend
in den ein k ern ig en P hosphinim in-K om plexen 3 und
4 der L ig an d offensichtlich ebenfalls gem äß (a)
fixiert ist, lassen sich die abw eichenden chemischen
und physikalischen E igenschaften des dim eren K om ­
plexes 7 u n ter der A nnahm e verstehen, daß die
keine Angaben gemacht. Auch vom Triphenylphosphin­
methylen ist ein Kationen-Komplex bekannt ( D . S e y f e r t h
u. S. 0 . G r i m , J. Amer. chem. Soc. 83, 1610 [1961]).
9 W . L ü t t k e u . K. W i l h e l m , Angew. Chem. 77, 867 [1965].
10 H. B o c k u . H. t o m D i e c k , Chem. Ber. 99, 213 [1966] sowie
H. B o c k , Angew. Chem. 74, 695 [1962], internat. Edit. 1,
550 [1962].
Unauthenticated
Download Date | 2/17/17 10:54 AM
744
H. BOCK UND H. TOM DIECK
P = N-Doppelbindung zugunsten einer verstärkten
Metall-Stickstoff-Bindung nach (b) aufgerichtet ist.
Eine rr-Rückbindung ist bei der PhosphoniumStruktur (b) energetisch zwar denkbar, aber räum­
lich unwahrscheinlich, da sie sich nur über den posi­
tiv geladenen Phosphor als Zentrum formulieren
ließe. Die Beständigkeit der P = X-Molybdän- und
Wolfram-carbonyle läßt daher das Ausgangspostu­
lat einer zusätzlichen Stabilisierung bei Delokalisation der positiven Ladung im Liganden als sinnvoll
erscheinen.
Beschreibung der Versuche
T r i p h e n y l p h o s p h i n - i m i n 1 gewinnt man
nach B i r k h o f e r 11 durch Alkoholyse des aus Triphenyl­
phosphin und Trimethylsilylazid erhältlichen P-Triphephyl-A-trimethylsilyl-phosphinimins; Schmp. 128°. Das
IR-Spektrum ist in Abb. 1 angegeben.
T r i p h e n y l p h o s p h i n o x i d 2 läßt sich durch
Hydrolyse des Bromaddukts an Triphenylphosphin in
über 90% Ausbeute darstellen. Nach U m kristallisieren
aus Petroläther schmilzt das reine Produkt bei 156° 12.
T r i p h e n y l p h o s p h i n ä t h y l e n 8 wird durch
Deprotonierung von Triphenyläthylphosphoniumbromid mit einer ätherischen Lithiumbutyl-Lösung erhal­
ten 13. Nach Abziehen aller Lösungsmittel, Aufnehmen
in Petroläther, Filtration und Einengen der P etroläther­
lösung im Vakuum kristallisiert 8 in roten, schuppigen
Kristallen, die sich oberhalb 75° langsam zersetzen.
C20H 19P (290,3)
Ber. C 82,72
Gef. C 81,17
IR : *;p = c = 824/cm.
H 6,60,
H 6,78.
N M R : (in Benzol, TMS als externer Standard)
Methylprotonen (a) 7,78 (Quadruplett)
Methylprotonen (b) 8,92 (kompl. M ultiplett)
Kopplungskonstanten / (in Hz) : / ab = 7,
/aP = 19, /b P = 18.
C y c 1o h e p t a t r i e n - M o l y b d ä n - t r i c a r b o n y 1 14 9 kristallisiert in Form roter Nadeln beim
Abkühlen der 7 Stdn. in Methylcyclohexan erhitzten
I : 1-Mischung von Molybdänhexacarbonyl und Cycloheptatrien. Das Rohprodukt wird zweckmäßig nochmals
ohne Erwärmen in Petroläther aufgelöst und die Lö­
sung nach Filtration unter Stickstoff auf —78° gekühlt;
Schmp. 94° (Lit. 14 99").
C10H8MoO3 (272,1)
Ber.
Gef.
C 44,13
C 44,51
H 2,96,
H 3,04.
B i s ( c y a n p y r r o l i d i n ) - M o l y b d ä n ( 0) - t e t r a c a r b o n y l 12 synthetisierten wir nach den in
II L.
B irk h o fe r,
A.
R itte r u .
S. M.
K im ,
Chem. Ber. 96, 3099
[1963],
12 A. M i c h a e l i s
[1885],
u.
H. v.
Soden,
Liebigs Ann. Chem. 229, 295
1. c. 5 ausführlich beschriebenen Verfahren aus Molybdän-hexacarbonyl und A^-Cyanpyrrolidin in 92% Aus­
beute mit Zersetzungspunkt 113 —120°.
C14H 8MoN40 4 (400,3)
Ber.
Gef.
C 42,01
C 42,83
H 4,03
H 4,14
N 14,00,
N 14,21.
Für die meisten Reaktionen ist es nicht erforderlich,
die absoluten Lösungsmittel unter Stickstoff zu destil­
lieren; in Einzelfällen wird darauf hingewiesen.
Darstellung der (C6H3)3P = X-Molybdän- und
W olfram-carbonyle
Bis(triphenylphosphinimin)-Molybdäntetracarbonyl 3
5,50 mMol (1,76 g) Triphenylphosphinimin 1 koch­
ten 6 Stdn. mit der gleichen Molmenge M olybdänhexa­
carbonyl (molarer Überschuß) in 30 ml absol. Cyclo­
hexan ( I ) . Nach Heißfiltration über eine G3-Schlenkfritte verbleiben 1,14 g (47% bez. auf 1 ) orangefar­
bene K ristalle, die sich bei 127 —140° unter Schwarz­
färbung zersetzen. Eine auf 24 Stdn. verlängerte Reak­
tionszeit (II) steigert die Ausbeute auf 70 Prozent.
C40H3oMoN2O4P 2 (762,6)
Ber.
Gef.
C 63,00
C 62,38
C 62,80
H 4,22
H 4,36
H 4,28
N 3,67,
N 3,54. (I)
N 3,49. (II)
Bis(triphenylphosphinimin)-Wolframtetracarbonyl 4
640,4 mg 1 (2,25 mMol) und 390 mg (1,13 mMol)
W olframhexacarbonyl werden unter Stickstoff in absol.
Toluol bei leicht vermindertem Druck (Siedetemperatur
90°) umgesetzt. Nach 7 Stdn. filtriert man heiß die
Hauptm enge Produkt (720 mg = 73%) unter Stick­
stoff ab; aus dem F iltrat lassen sich weitere 180m g =
19% als weniger reine zweite Fraktion erhalten. Die
karm inroten Kristalle verfärben sich im geschlossenen
Röhrchen unter Stickstoff ab 130°, bei 170 —174° tritt
Schwarzfärbung ein.
C49H32N20 4P 2W (850,5)
Ber.
Gef.
C 56,52
C 56,92
H 3,79
H 3,85
N 3,29,
N 3,08.
B is ( t r i p h e n y l p h o s p h i n o x i d ) - M o l y b d ä n tetracarbonyl 5
U nter Stickstoff kochen 260mg (0,95 mMol) 2 mit
174 mg (0,66 mMol) Molybdänhexacarbonyl bei einer
Badtem peratur von 95° 8 Stdn. in Stickstoff-gesättigtem Cyclohexan. Das Heißfiltrat wird nochmals 1 Stde.
erhitzt. Insgesamt isoliert man 296 mg = 82% feine,
13 U. S c h ö l l k o p f , in: Neuere Methoden der präparativen or­
ganischen Chemie, Verlag Chemie 1961, III. Bd., S . 93.
14 E. W . A b e l , M. A . B e n n e t , R. B u r t o n u . G. W i l k i n s o n , J.
chem. Soc. [London] 1958, 4559.
Unauthenticated
Download Date | 2/17/17 10:54 AM
METALL [O]-VERBINDUNGEN M IT N ICH TA RO M A TISCH EN ST IC K STO FFS-SY ST EM EN V
gelbe Kristalle mit einer Zersetzungstemperatur von
145 —150 im geschlossenen Rohr unter Stickstoff.
C40H30MoO0P 2 (764,5)
Ber. C 62,84 H 3,96,
Gef. C 62,88 H 4,12.
Bis(triphenylphosphinoxid)-Wolframtetracarbonyl 6
Unter Stickstoff reagieren 566 mg 2 (2,02 mMol)
mit 358 mg Wolframhexacarbonyl (1,02 mMol) 24
Stdn. in siedendem Cyclohexan. In der Hitze saugt man
mit Hilfe einer G3 - S c h 1 e n k - Fritte 748 mg = 88%
feine, gelbe Kristalle ab, die sich im geschlossenen
Rohr ab 138° zersetzen.
C40H30O6P 2W (852,5)
Ber.
Gef.
C 56,36
C 55,98
H 3,55,
H 3,65.
S u b s t i t u t i o n s r e a k t i o n e n mi t Cycl oheptatrien-Molybdän-tricarbonyl 9
a) Triphenylphosphinoxid 2 : 220 mg (0,8 mMol) 2
und 110 mg (0,4 mMol) 9 werden unter Stickstoff 15
Stdn. bei Raumtemperatur in 20 ml Benzol belassen.
Dabei verschwindet die rote Lösungsfarbe und aus der
schwachgelben Lösung scheiden sich 225 mg = 78%
(bez. auf 2) goldgelbe, luftbeständige Kristalle von
T ris(triphenylphosphinoxid)- M olybdän - tricarbonyl 10
ab, die im geschlossenen Rohr unter Stickstoff oberhalb
150° sintern und bei 220° schwarz werden.
C57H45M o06P 3 (1014,8)
Ber.
Gef.
C 67,46
C 67,62
H 4,47,
H 4,55.
b) Triphenylphosphinimin 1: 1,70 m (6,1 mMol) 1
werden mit 0,54 g (2,0 mMol) 9 in 50 ml absol. Benzol
unter Stickstoff bei Raumtemperatur hin und wieder
geschüttelt, wobei schon nach 40 Min. die Hauptmenge
7 in goldgelben Würfelchen kristallisiert. Nach W a­
schen der abgefritteten Kristalle mit wenig absol.
Äthanol verbleiben 1,34 g = 92% (bezogen auf 9) di­
meres Bis (triphenylphosphinimin) -Molybdän-tricarbonyl 7, das im geschlossenen Rohr nach leichter V erfär­
bung bei 160° bei 238 —240° schwarz wird.
C78H64Mo2N40 6P 4 (1469,2)
Ber.
Gef.
C 63,77
C 62,88
H 4,39
H 4,25
N 3,81,
N 3,31.
Das Produkt ist nach den IR-Spektren mit den auf
anderen Wegen erhaltenen Proben von 7 identisch.
c) Triphenylphosphinäthylen 8 : Beim Eintropfen
einer Petrolätherlösung von 1 g (3,5 mMol) 8 in eine
Lösung von 1,0 g (3,7 mMol) 9 in Petroläther fällt
sofort ein dicker gelber Niederschlag aus. Nach Zugabe
des gleichen Volumens Benzol (50 ml) wird zur besse­
ren Filtrierbarkeit 12 Stdn. bei Raum tem peratur be­
lassen. Das hinterbleibende hellgelbe, pulvrige und in
praktisch quantitativer Rohausbeute erhaltene Tris(triphenylphosphinäthylen)-M olybdän-tricarbonyl 11 kann
wegen seiner Unlöslichkeit nicht weiter gereinigt wer­
den und schmilzt unscharf bei 126 —140°.
Cß3H5:M oP30 3 (1050,9)
Ber.
Gef.
C 72,01
C (67,77)
745
H 5,47,
H 5,43.
T h e r m i s c h e U m w a n d l u n g von Bi s ( t r i ­
phenylphosphinimin)-Molybdäntetracarbonyl 3
868
mg (1,15 mMol) orangefarbenes 3 werden in
absol. Xylol unter Stickstoff erhitzt, wobei sich bereits
nadi 10 Min. die Farbe aufhellt. Nach 60 Min. läßt
man erkalten und isoliert unter Stickstoff 789 mg =
94,5% goldgelbes 7 mit einer Zersetzungstemperatur
von 2 2 5 - 2 3 5 ° .
C O - B e s t i m m u n g bei der t h e r m i s c h e n
U m w a n d l u n g 3 —>7
In einem zweiten Ansatz entwickelten 534,4 mg
(0,71 mMol) 3 in siedendem Toluol 16,0 ml Kohlen­
oxid (T = 13°, p = 720 T orr), das sind 0,92 mMol
Kohlenoxid je mMol 3. Die isolierte gelbe Substanz ist
mit den auf anderen Wegen erhaltenen Proben von 7
identisch.
C78H64Mo.,N40 6P 4 (1469,2)
Ber. C 63,77 H 4,39
Gef. C 63,01 H 4,50
N 3,81,
N 3,46.
D i r e k t e D a r s t e l l u n g des d i m e r e n
Bi s ( t r i p h e n y l p h o s p h i n i m i n ) - M o l y b ­
d ä n - 1r i c a r b o n y 1s 7
Molybdänhexacarbonyl wurde mit 1 unter verschie­
denen Reaktionsbedingungen umgesetzt. In Toluol muß
man etwa 2 —3 Stdn. kochen, bis die Hauptmenge an
gelbem 7 auskristallisiert; in Xylol ist nach Erreichen
der Siedetem peratur die Reaktion nach etwa 15 Min.
vollendet. Die Produkte sind in allen Fällen identisch.
a) Aus 2,62 g (9,5 mMol) 1 entstehen mit einem
Molybdäncarbonyl-Überschuß bei 3-stdg. Kochen in
absol. Toluol unter Sticktoff 4,7 g = 68% nadelige
K ristalle 7 .
b) Bei der Reaktion von 970 mg (3,5 mMol) 1 mit
einem geringen Molybdäncarbonyl-Überschuß in sie­
dendem Xylol kommt die Kohlenoxid-Entwicklung
schon nach 15 —20 Min. zum Erliegen. Von der unter
Luftausschluß
heiß
filtrierten
Reaktionsmischung
trennt man 1,10 g = 86% gelbe K ristalle ab.
C78H64Mo2N40 6P 4 (1469,2)
Ber.
Gef.
C 63,77
C 62,59
C 62,49
H 4,39
H 4,45
H 4,62
N 3,81,
N 3,32. (a)
N 3,43. (b)
In (a) und (b) wurden außerdem Molybdän und
Phosphor nach Naßveraschung photometrisch bestimmt.
In einer Reihe von Analysen lag der P-Wert dabei
konstant um 1,3% zu niedrig, ein Fehler, der bei Blind­
proben von Gemischen organischer Phosphorverbindun­
gen mit Molybdat nicht auftrat:
Ber.
Gef.
P 8,43
P 7,12
P 7,11
Mo 13,04,
Mo 12,46. (a)
Mo 12,47. (b)
Unauthenticated
Download Date | 2/17/17 10:54 AM
J. F. CORDES
746
Die Bestimmung des Mol.-Gew. von 7 nach B e c k ­
m a n n in Benzol scheitert an der geringen Löslichkeit
der Verbindung. Die osmometrische Bestimmung in
Aceton ergibt stark schwankende W erte von etwa 1000,
da sich die Substanz in diesem Lösungsmittel insbeson­
dere beim schwadien Erwärmen offenbar verändert
(eine Spaltung des Komplexes durch den Donator Ace­
ton ist denkbar).
Hydrolytische
Zersetzung
von 7
154 mg (0,105 mMol) 7 werden mit 10 ml konz.
Salzsäure und 10 ml Methanol zur besseren Benetzung
20 Min. gekocht. Die klare Lösung wird mit 50 ml
Wasser verdünnt und zweimal mit je 15 ml Benzol ex­
trahiert. Nach Trocknung wird die Benzolphase mit
30 ml hochsiedendem Petroläther versetzt und auf
6 —7 ml eingeengt. Beim Erkalten kristallisieren 56 mg
= 48% IR-spektroskopisch charakterisiertes Triphenyl­
phosphinoxid in langen, farblosen Nadeln. Aus der
M utterlauge werden weitere 23 mg erhalten; die Ge­
samtausbeute beträgt 68 Prozent.
Dem Direktor des Instituts für Anorganisdie Che­
mie, H errn Prof. Dr. Dr. h.c. mult. E. W i b e r g und der
B a d i s c h e n A n i l i n - & S o d a - F a b r i k Lud­
wigshafen/Rhein danken wir für die wohlwollende Un­
terstützung unserer Arbeiten.
Untersuchungen zur Ferrocenbildung
J. F. Cordes
Hauptlaboratorium der Badischen Anilin- und Soda-Fabrik AG, Ludwigshafen am Rhein
(Z. Naturforsdig. 21 b, 746—-751 [1966]; eingegangen am 14. April 1966)
Herrn Prof. Dr. A.
S c h n e id e r
zu seinem 60. Geburtstag in D ankbarkeit und Verehrung gewidmet
Die vier Vorgänge bei der Bildung von Dicyclopentadienyleisen oder Ferrocen aus Eisen (II)chlorid und Cyclopentadien in Gegenwart von Alkalialkoholat, die Herstellung des FeCl2 , die
Umsetzung mit Alkoholat, die Reaktion mit monomerem Cyclopentadien und die Isolierung des
Ferrocens, wurden untersucht. Die Verwendung von organischen Lösungsmitteln, in denen sowohl
FeCL als auch FeCL löslich sind, ermöglicht kurze Reaktionszeiten und praktisch quantitative Aus­
beuten.
Für die Herstellung des Dicyclopentadienyleisens
oder Ferrocens, einer erst seit 1951 bekannten eisen­
organischen V erbindung 1, die Verbrennungsvor­
gänge der verschiedensten A r t2 beeinflussen kann,
finden sich in der Literatur zwar zahlreiche V or­
schriften 3, doch war eine Übertragung in den grö­
ßeren Maßstab bei all diesen Verfahren unbefriedi­
gend.
Von den in der Zeitschriften- und Patentliteratur be­
schriebenen Herstellungsmethoden sind die Umsetzun­
gen von Cyclopentadien mit Eisen, Eisenoxyden 4 und
Eisencarbonyl sowie die doppelten Umsetzungen von
Cyclopentadienylsalzen, insbesondere der Alkalimetalle,
1 T . J.
K e a l y u. P . L. P a u s o n , Nature [London] 168, 1039
[1951] ; S. A. M i l l e r , J. A. T e b b o t h u . J. F. T r e m a i n , J.
chem. Soc. [London] 1952, 632.
2 J. H . H a r w o o d , The Industrial Chemist 1960. 176; E. G.
N o t t e s u . J. F. C o r d e s , Erdöl Kohle-Erdgas-Petrodiem.
18. 885 [1965],
3 Siehe z.B. P . L. P a u s o n , in: H . Z e i s s , Organometallic
Chemistry, New York 1960, S. 305.
4 Eine eingehende Untersuchung stammt von R. R i e m s c h n e i ­
d e r u. D. H e l m , Z. Naturforschg. 14 b. 811 [1959] : 16 b,
234 [1961].
und der G r i g n a r d - Verbindungen (z. B. Cyclopentadienylmagnesiumbromid) mit Verbindungen, bevorzugt
den Halogeniden, des Eisens, besonders bekannt ge­
worden.
Möglichkeiten für einen einfachen Herstellungs­
prozeß boten sich unter verschiedensten Gesichts­
punkten vor allem bei der Umsetzung von Eisen(II)chlorid mit Cyclopentadien in Gegenwart von Al­
kalialkoholat 5~7. Wir haben daher vor einiger Zeit
die vier Verfahrensschritte, Herstellung des FeCL,
Umsetzung mit Alkoholat, Reaktion mit monomerem
Cyclopentadien und Isolierung des Ferrocens8-9 ge­
trennt und in Kombinationen untersucht.
5 J. M.
6
7
8
9
B i r m i n g h a m , D. S e y f e r t h u . G. W i l k i n s o n , J. Amer.
chem. Soc. 76, 4179 [1954].
G. W i l k i n s o n , in: Organic Syntheses, Vol. 36, New York
1956. S. 31.
W. F. L i t t l e , R. C. K o e s t l e r u . R. E i s e n t h a l , J. org.
Chemistry 25. 1435 [1960].
Badische Anilin- u. Soda-Fabrik AG (Erf. J. F. C o r d e s ) ,
Dtsch. Bundes-Pat. 1 194 855 und 1 203 265.
J. F. C o r d e s , Angew. Chem. 77, 1017 [1965].
Unauthenticated
Download Date | 2/17/17 10:54 AM