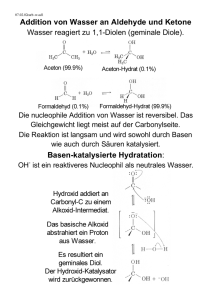
Alkanole
Werbung

Alkanole 1. Schreiben Sie einen kurzen Fachtext zu folgender Abbildung: (siehe Kopie) Sowohl bei der homologen Reihe der Alkane als auch der homologen Reihe der Alkanole steigen die Siedetemperaturen der Verbindungen mit zunehmender Molekülmasse an. Da es sich hier um Verbindungen handelt, deren Moleküle unverzweigt sind, kann man auch sagen, dass die Siedepunkte jeweils erwartungsgemäß mit zunehmender Kettenlänge und damit größer werdender Moleküloberfläche steigen. Vergleicht man ein Alkan mit einem Alkanol ähnlicher Molekülmasse (und damit ähnlicher Moleküloberfläche und auch ähnlicher Elektronenanzahl im Gesamtmolekül), so stellt man fest, dass durchgängig das jeweilige Alkanol einen höheren Siedepunkt besitzt. Allerdings nimmt der Abstand zwischen den Siedetemperaturen des Alkanols und des vergleichbaren Alkans mit steigender Kettenlänge ab. Ursache für die beschriebenen Phänomene sind Unterschiede in der Stärke der zwischenmolekularen Kräfte. Zwischen unpolaren Alkanmolekülen wirken nur van-derWaals-Kräfte. Wegen der Polarität der OH-Gruppe treten zwischen den Alkanolmolekülen zusätzlich zu van-der-Waals-Kräften Wasserstoffbrücken auf. Bei ähnlicher Molekülmasse und damit vergleichbarer Elektronenanzahl sind damit die zwischenmolekularen Kräfte zwischen den Alkanolmolekülen jeweils stärker als zwischen den Alkanmolekülen. In der Abbildung ist dies am Beispiel von Ethanol und Propan dargestellt. Zusätzlich zu den van-der-Waals-Kräften bilden sich zwischen Ethanolmolekülen Wasserstoffbrücken zwischen den Hydroxylgruppen aus, während zwischen den Propanmolekülen nur van-der-WaalsKräfte wirken. Mit zunehmender Kettenlänge wird innerhalb der homologen Reihe der Alkanole jeodch der Effekt der Hydroxylgruppe immer geringer, da der hydrophobe Alkylrest immer stärker die physikalischen Eigenschaften des Alkanols bestimmt. ___________________________________________________________________________ 2. Ethanol reagiert wie Wasser mit Natrium unter Wasserstoffentwicklung. a) Geben Sie für beide Reaktionen die Reaktionsgleichung an. b) Auch andere Alkohole zeigen eine entsprechende Reaktion mit Natrium. Geben Sie die Reaktionsgleichung für die Reaktion von 1-Propanol mit Natrium an. a) 2H 2 O 2Na 2Na 2OH H 2 2C 2 H 5 OH 2 Na 2C 2 H 5 O 2 Na H 2 2C 3 H 7 OH 2 Na 2C 3 H 7 O 2 Na H 2 b) Schreiben Sie die Alkanolmoleküle und die Alkoholatanionen auch einmal Strukturformeln. Beim Sauerstoffatom auch die freien Elektronenpaare angeben! in 3. Geben Sie die Strukturformeln aller isomeren Pentanole an und teilen Sie diese in primäre, sekundäre und tertiäre Alkohole ein. Schreiben Sie selbst die Strukturformeln zu: 1-Pentanol (primär) 2-Methyl-1-butanol (primär) 3-Methyl-1-butanol (primär) 2-Methyl-2-butanol (tertiär) 2,2-Dimethyl-1-propanol (primär) 3-Methyl-2-butanol (sekundär) 2-Pentanol (sekundär) 3-Pentanol (sekundär) ___________________________________________________________________________ 4. Formulieren Sie die Reaktionsgleichung und den Reaktionsmechanismus für die Herstellung von Methanol aus Monoiodmethan. Reaktionsgleichung: CH 3 I K OH CH 3 OH K I Reaktionsmechanismus: Es handelt sich um eine nucleophile Substitution. Da das C-Atom an, dem die Reaktion eintritt, primär ist, läuft die Reaktion nach dem S 2 -Typ (bimolekulare N nucleophile Substitution )ab. Die SN2-Reaktion, Reaktionsmechanismus In der SN2 Reaktion findet ein konzertierter Rückseitenangriff statt, bei dem das Nucleophil und die Abgangsgruppe sich auf entgegen gesetzten Seiten befinden : Dies habe ich aus dem Internet kopiert. Ersetzen Sie Nu durch OH und X durch I (Iodatom). Das OH -Ion greift über das Sauerstoffatom an. In Ihrem Heft finden Sie den entsprechenden Mechanismus für ein anderes Beispiel: „Bromethan reagiert mit Kalilauge zu Ethanol“. Achten Sie darauf, am Sauerstoffatom des Hydroxidions und am Iodatom auch die freien Elektronenpaare anzugeben. Bei dieser Reaktion entsteht aus einem hydrophoben Halogenalkan ein wasserlöslicher Alkohol. ___________________________________________________________________________ 5. Gibt man zu 2-Methyl-2-propanol konzentrierte Salzsäure, so bildet sich nach kurzer Zeit eine organische Schicht aus. Geben Sie die Reaktionsgleichung und den Reaktionsmechanismus an. Reaktionsgleichung: (CH 3 ) 3 C OH HCl (CH 3 ) 3 C Cl H 2 O Auch hier handelt es sich um eine nucleophile Substitution. Dabei ist zu beachten, dass die Substitution der Hydroxylgruppe in Alkoholmolekülen immer über eine anfängliche Protonierung erfolgt. Da bei diesem Beispiel das Nucleophil (Cl -Ion) an einem tertiären CAtom angreift läuft die Reaktion nach dem S 1 -Typ ab. N Reaktionsmechanismus: s. im Unterricht erhaltene Kopie a) Protonierung Schreiben Sie für alle drei organischen Reste ( R , R , R ) jeweils CH 3 (Methylgruppe), schreiben Sie bei HX anstelle des X ein Cl. b) S 1 -Reaktion N Schreiben Sie wieder für alle drei organischen Reste jeweils CH 3 . Typisch für diesen Mechanismus ist, dass die Bindungsneubildung erst nach vorheriger Bindungstrennung (hier Abspaltung von Wasser) erfolgt. Als Zwischenprodukt entsteht ein Carbokation. Dieses bildet im zweiten Schritt eine Bindung zum Nucleophil aus. An der Bildung des Carbokations ist nur ein Teilchen beteiligt, daher spricht man von einer monomolekularen Substitution. Bei dieser Reaktion entsteht aus dem wasserlöslichen Alkohol ein hydophobes Halogenalkan. (Es bildet sich über der wässrigen Phase eine organische Schicht aus.)