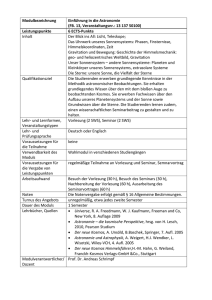
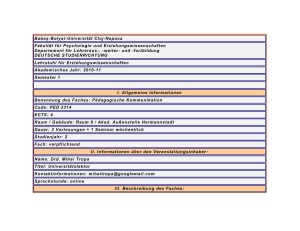
Thermodynamik von inhomogenen Fluiden (WS 2002/03)
Werbung

Thermodynamik von inhomogenen Fluiden (WS 2004/05) 1.Vorlesung (15.10.2004) Bisherige Vorlesung zur Thermodynamik: Beschränkung auf Gleichgewicht und auf homogene Phasen Ziel: Behandlung von inhomogenen Systemen (im Gleichgewicht die Grenzflächen/Nichtgleichgewichtssysteme) Zustandsgleichung als experimentelle Größe. Konstruktion einer Zustandsgleichung aus experimentellen Daten am Beispiel von Wasser: van der Waals Gleichung unzureichend für Beschreibung von kritischem Punkt, bzw. Gleichgewicht von realem System. Einführung einer modifizierten van der Waals Gleichung P=TR/(Vm-b)-a/Vmr mit drei Parametern. Fit der 3 Parameter an Daten von Wasser. Für gegebene Funktion Am(Vm) graphische Bestimmung der Phasen. 2.Vorlesung (18.10.2004) Anhand von van der Waals Gleichung Gewöhnung an Stoffmengendichte =1/Vm. System mit 1 Komponente im 2-Phasengebiet. Für gegebene Funktion Am() Bestimmung der Phasen durch Minimieren der Helmholtzenergie. Ergebnis P1=P2 und 1=2 . Hinweis: Prinzip dA=0 als Kriterium für Gleichgewicht ist in homogenen Systemen äquivalent zu P 1=P2 und 1=2, in inhomogenen Systemen gilt auch im Gleichgewicht nicht generell P 1=P2 , während dA=0 als Kriterium für Gleichgewicht gültig bleibt 3.Vorlesung (22.10.2004) System mit 2 Komponenten A,B im 2-Phasengebiet. Für gegebene Funktion Am(A,B) Bestimmung der Gleichgewichtsphasen durch Minimieren der Helmholtzenergie. Ergebnis A1=A2, B1=B2 und P1=P2 . 4.Vorlesung (14.11.2003) Wiederholung: System mit 1 Komponente (s. Tab). Phasendiagramm für vdW-System: und P als Fkt. von T Wiederholung: System mit 2 Komponenten A,B (s. Tab). Für gegebene Funktion A m(A,B) Bestimmung der Gleichgewichtsphasen durch Minimieren der Helmholtzenergie. Zusammensetzung der Funktion Am(A,B), wenn Am(A), Am(B) der Einzelkomponenten bekannt sind. Wechselwirkungsterm als Maß für die Abweichung vom Fall der idealen Mischung. Mischung zweier van der Waals Komponenten. 5.Vorlesung (21.11.2003) Phasendiagramme für die Mischung von zwei van der Waals Komponenten 6.Vorlesung (28.11.2003) Tabelle für Bestimmung von Phasengleichgewicht für Systeme mit 1,2,3 Komponenten aus Helmholtzenergie Beschreibung von Phasen anstatt durch Dichten durch Molenbrüche (bei Annahme konstanter Dichte) Tabelle für Bestimmung von Phasengleichgewicht für Systeme mit 2,3 Komponenten aus Gibbs Energie bei konstantem Molvolumen (Druck nicht definiert) Helmholtzenergie für reguläres, ternäres System. Die drei Parameter AB, BC, AC . Diskussion von Phasendiagrammen ternärer Systeme. Anwendung für Theorie ternärer Systeme: flüss.-flüss. Extraktion 7.Vorlesung (05.11.2003) Diskussion von Diffusion bei Extraktion. Notwendigkeit, die Fick'sche Gleichung durch Ansatz von Onsager zu ersetzen. Behandlung inhomogener Systeme im Nichtgleichgewicht und im Gleichgewicht, Definition thermodynamischer Größen in inhomogenen Systemen. Unterschiedliche Behandlung von Energie und Entropie Als Beispiel System mit 1 Komponente (Oberfläche). Profil von Dichte, Chem. Potential, Druck. Zusammenhang zwischen Profil des Drucks und der Oberflächenspannung. 8.Vorlesung (12.12.2003) Profile von Dichten, Chemischen Potentialen und Druck für binäre Gemische von vdW Komponenten. Für Flüssig-Dampf Gleichgewicht und für Flüssig-flüssig Gleichgewicht. Standard Behandlung der Oberfläche mit der Gibbs'schen Gleichung 9.Vorlesung (19.12.2003) Binäres System Excelfile OF_bin_2.xls, OF_ten10(t=0..1833) Ward und Tordaj, Diffusion zur Oberfläche Beispiele für ternäres System: Extraktion (Excelfile ter_mix.xls, tab3 und tab3a als Fortsetzung, coll mit OFSpg) Spinodale Entmischung (Film ta_r__14.avi) Ternäres System mit Wandeinfluß: Waschvorgang (Film Tensid_Wasch.avi) 10.Vorlesung (9.1.2004) Phasendiagramme für verschiedene ternäre Systeme: Ohne Wandeinfluß: Flüssig-flüssig Extraktion, Entmischung Mit Wandeinfluß: Chromatographie, Waschvorgang Einführung Chromatographie 11.Vorlesung (16.1.2004) Filme chromat_3.avi, chromat_1.avi, chromat_5.avi, chromat10.avi, chromat11.avi, chromat21.avi Bilder chromt2.doc, chromat1.doc Ankunftzeitverteilungen Berücksichtigung der Schwerkraft bei der Helmholtz Energie für ein einkomponentiges van der Waals Fluid Aufstellung der Gleichgewichtsbedingung durch Forderung grad(chem.Potential)=0. Ergebnis besteht in der expliziten Berechnung des hydrostatischen Drucks. Verallgemeinerung von Schwerkraft auf beliebige äußere Kraft. Betrachtung von Nichtgleichgewicht, d.h. J0 inbezug auf die Wirkung der äußeren Kraft. Vergleich mit phänomenologischer Behandlung der Drift in einem viskosen Medium. Stokes-Einstein-Gleichung 12.Vorlesung (23.1.2004) Potentielle Energie von Ladungsträgern im elektrischen Feld. Definition des elektrochemischen Potentials. Nernst’sche Gleichung. Spezifische Adsorption an Elektrode. Halbzelle. Batterie. Potentialverlauf in einer Batterie. Elektrisches Feld an der Grenzfläche einer Lösung von ionischen Tensiden. Hinweis auf Manipulation von Mikrotropfen mit elektrischen Feldern. 13.Vorlesung (30.1.2004) Dielektrika im elektrischen Feld. Potentielle Energie eines Dielektrikums in Abhängigkeit von der Permitivität r des Stoffes und der äußeren Feldstärke. Manipulation von Tropfen (-Liter) mit inhomogenen elektrischen Feldern. Filme movie1.avi, movie2.avi, movie3.avi, movie4.avi, movie5.avi aus O.D.Velev, B.G.Prevo, K.H.Bhatt, Nature 426, 2003, 515-6 Übersicht über Gesamtvorlesung. Fragen zur Vorlesung und zur Klausur. Klausur (6.2.2004)