STARK: Über 1 Jahr PFS für Ihre PatientInnen 1
Werbung

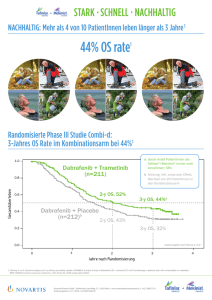
STARK • SCHNELL • NACHHALTIG STARK: Über 1 Jahr PFS für Ihre PatientInnen 1 … wandern, wieder gemeinsam … … und jetzt wieder Schnee und Sonne … 12,6 Monate mPFS 1 … jetzt gehe ich schwimmen … … bei der Gartenarbeit geht es mir gut … 1 Robert C et al., Oral presentation ECC 2015; Abstract 3301 Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 1 20.01.16 14:32 COMBI-v: Investigator-Assessed Progression-Free Survival 12,6 Monate unter Mekinist + Tafinlar 1 Über ein Jahr PFS für Ihre PatientInnen1 Proportion Alive and Progression Free 1.0 0.9 0.8 Dabrafenib + Trametinib 0.7 Median PFS, 12.6 mo (95% CI, 10.7-15.5 mo) 0.6 0.5 0.4 0.3 0.2 Vemurafenib Median PFS, 7.3 mo (95% CI, 5.8-7.8 mo) HR, 0.61 (95% CI, 0.51-0.73); P < 0.001 0.1 0.0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 30 8 26 4 4 0 0 0 0 0 Time From Randomization, months Patients at riska 1 Robert C et al., Oral presentation ECC 2015; Abstract 3301 Trametinib 352 Vemurafenib 352 310 281 270 216 229 162 202 127 175 100 158 81 140 69 125 61 115 59 98 49 56 23 Fachinformation Tafinlar®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Fachinformation Abschnitt 4.8. BEZEICHNUNG DES ARZNEIMITTELS Tafinlar 50 mg Hartkapseln; Tafinlar 75 mg Hartkapseln; QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Tafinlar 50 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 50 mg Dabrafenib. Tafinlar 75 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 75 mg Dabrafenib. Tafinlar 50 mg und 75 mg: Sonstige Bestandteile: Kapselinhalt: Mikrokristalline Cellulose, Magnesiumstearat, Hochdisperses Siliciumdioxid, Kapselhülle: Eisen(III)-oxid (E172), Titandioxid (E171), Hypromellose (E464), Drucktinte: Eisen(II,III)-oxid (E172), Schellack, Propylenglycol; Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE23. Anwendungsgebiete:. Dabrafenib ist angezeigt als Monotherapie oder in Kombination mit Trametinib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in der Fachinformation Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich; Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Zulassungsnummer: Tafinlar 50 mg: EU/1/13/865/001, EU/1/13/865/002; Tafinlar 75 mg: EU/1/13/865/003, EU/1/13/865/004; Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 08/2015. Fachinformation Mekinist®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. BEZEICHNUNG DES ARZNEIMITTELS Mekinist 0,5 mg Filmtabletten, Mekinist 2,0 mg Filmtabletten QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält Trametinib-Dimethylsulfoxid (1:1), entsprechend 0,5 mg Trametinib oder 2,0 mg Trametinib Sonstige Bestandteile: Tablettenkern: Mannitol (E421), Mikrokristalline Cellulose (E460), Hypromellose (E464), Croscarmellose-Natrium (E468), Magnesiumstearat (E470b), Natriumdodecylsulfat, Hochdisperses Siliciumdioxid (E551), Tabletten-Filmüberzug: Hypromellose (E464), Titandioxid (E171), Macrogol, Mekinist 0,5 mg Filmtabletten, Eisen(III)-hydroxid-oxid x H2O (E172), Mekinist 2,0 mg Filmtabletten, Polysorbat 80 (E433), Eisen(III)-oxid (E172). KLINISCHE ANGABEN Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE25. Anwendungsgebiete: Trametinib ist angezeigt als Monotherapie oder in Kombination mit Dabrafenib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Eine Trametinib-Monotherapie hat keine klinische Aktivität bei Patienten gezeigt, deren Erkrankung auf eine vorhergehende Therapie mit einem BRAF-Inhibitor fortschritt (siehe Abschnitt 5.1.) Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich. ZULASSUNGSNUMMERN: Mekinist 0,5 mg Filmtabletten: EU/1/14/931/01-02, Mekinist 2,0 mg Filmtabletten: EU/1/14/931/05-06. Abgabe: NR, rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 12/2015. Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 2 20.01.16 14:32 STARK • SCHNELL • NACHHALTIG SCHNELL: komplette & partielle Remission bei fast 7 von 10 PatientInnen 1 Komplette Remision: 16% Partielle Remision: 53% Stabile Erkrankung: 24% Progressive Erkrankung: 6% 1 Long GV et al., Lancet 2015; 386:444-51 | Nicht auswertbar: 1% Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 3 20.01.16 14:32 Progressionsfreies Überleben und Ansprechen unter Mekinist + Tafinlar 1 Gesamtüberleben und Ansprechen unter Mekinist + Tafinlar 1 Overall Survival 0.4 0.6 0.8 response progressive partialdisease response not evaluated stable disease 55% progressive disease not evaluated 55% 12 24 36 Months 0.0 0.0 0.2 complete stable disease 88% 83% 0 0.2 29% 83% 0.2 51% 95% partial response 2- yr88% 0.0 0.6 not evaluated 0.6 progressive disease 68% 0.4 0.8 stable disease OS Probability partial response 90% PFS Probability 0.8 1.0 complete response 1- yr complete response 0.4 2- yr OS Probability 1.0 1- yr 1- yr 2- yr Overall Survival 95% 1.0 Progression-Free Survival 0 12 24 36 0 Months 12 24 36 Months 1 Long GV et al.; Society of Melanoma Research 2015; 793. Abstract. Baseline and Postbaseline Characteristics Associated With Treatment Benefit Across Dabrafenib and Trametinib Registration Pooled Data. Fachinformation Tafinlar®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Fachinformation Abschnitt 4.8. BEZEICHNUNG DES ARZNEIMITTELS Tafinlar 50 mg Hartkapseln; Tafinlar 75 mg Hartkapseln; QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Tafinlar 50 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 50 mg Dabrafenib. Tafinlar 75 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 75 mg Dabrafenib. Tafinlar 50 mg und 75 mg: Sonstige Bestandteile: Kapselinhalt: Mikrokristalline Cellulose, Magnesiumstearat, Hochdisperses Siliciumdioxid, Kapselhülle: Eisen(III)-oxid (E172), Titandioxid (E171), Hypromellose (E464), Drucktinte: Eisen(II,III)-oxid (E172), Schellack, Propylenglycol; Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE23. Anwendungsgebiete:. Dabrafenib ist angezeigt als Monotherapie oder in Kombination mit Trametinib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in der Fachinformation Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich; Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Zulassungsnummer: Tafinlar 50 mg: EU/1/13/865/001, EU/1/13/865/002; Tafinlar 75 mg: EU/1/13/865/003, EU/1/13/865/004; Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 08/2015. Fachinformation Mekinist®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. BEZEICHNUNG DES ARZNEIMITTELS Mekinist 0,5 mg Filmtabletten, Mekinist 2,0 mg Filmtabletten QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält Trametinib-Dimethylsulfoxid (1:1), entsprechend 0,5 mg Trametinib oder 2,0 mg Trametinib Sonstige Bestandteile: Tablettenkern: Mannitol (E421), Mikrokristalline Cellulose (E460), Hypromellose (E464), Croscarmellose-Natrium (E468), Magnesiumstearat (E470b), Natriumdodecylsulfat, Hochdisperses Siliciumdioxid (E551), Tabletten-Filmüberzug: Hypromellose (E464), Titandioxid (E171), Macrogol, Mekinist 0,5 mg Filmtabletten, Eisen(III)-hydroxid-oxid x H2O (E172), Mekinist 2,0 mg Filmtabletten, Polysorbat 80 (E433), Eisen(III)-oxid (E172). KLINISCHE ANGABEN Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE25. Anwendungsgebiete: Trametinib ist angezeigt als Monotherapie oder in Kombination mit Dabrafenib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Eine Trametinib-Monotherapie hat keine klinische Aktivität bei Patienten gezeigt, deren Erkrankung auf eine vorhergehende Therapie mit einem BRAF-Inhibitor fortschritt (siehe Abschnitt 5.1.) Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich. ZULASSUNGSNUMMERN: Mekinist 0,5 mg Filmtabletten: EU/1/14/931/01-02, Mekinist 2,0 mg Filmtabletten: EU/1/14/931/05-06. Abgabe: NR, rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 12/2015. Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 4 20.01.16 14:32 STARK • SCHNELL • NACHHALTIG NACHHALTIG: Deutlich über 2 Jahre OS für Ihre PatientInnen 1 25,6 Monate mOS1 25,6 Monate mOS1 1 Robert C et al., Oral presentation ECC 2015; Abstract 3301 Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 5 20.01.16 14:33 Combi-v: Overall Survival 25,6 Monate unter Mekinist + Tafinlar 1 Dabrafenib + Trametinib 1.0 Median OS, 25.6 mo (95% CI, 22.6 mo-NR) 0.9 Proportion Alive 0.8 1-yr OS, 73% 0.7 1.5-yr OS, 60% 1-y OS, 64% 0.6 2-yr OS, 51% 0.5 0.4 1.5-yr OS, 50% 0.3 Vemurafenib 2-yr OS, 38% Median OS, 18.0 mo (95% CI, 15.6-20.7 mo) 0.2 HR, 0.66 (95% CI, 0.53-0.81) P < 0.001 0.1 0.0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 Time From Randomization, months Patients at risk a ECC 2015; Abstract 3301 NR, not reached. | 1 Robert C et al., Oral presentation Fachinformation Tafinlar®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Fachinformation Abschnitt 4.8. BEZEICHNUNG DES ARZNEIMITTELS Tafinlar 50 mg Hartkapseln; Tafinlar 75 mg Hartkapseln; QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Tafinlar 50 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 50 mg Dabrafenib. Tafinlar 75 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 75 mg Dabrafenib. Tafinlar 50 mg und 75 mg: Sonstige Bestandteile: Kapselinhalt: Mikrokristalline Cellulose, Magnesiumstearat, Hochdisperses Siliciumdioxid, Kapselhülle: Eisen(III)-oxid (E172), Titandioxid (E171), Hypromellose (E464), Drucktinte: Eisen(II,III)-oxid (E172), Schellack, Propylenglycol; Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE23. Anwendungsgebiete:. Dabrafenib ist angezeigt als Monotherapie oder in Kombination mit Trametinib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in der Fachinformation Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich; Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Zulassungsnummer: Tafinlar 50 mg: EU/1/13/865/001, EU/1/13/865/002; Tafinlar 75 mg: EU/1/13/865/003, EU/1/13/865/004; Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 08/2015. Dabrafenib + trametinib 352 342 336 311 286 260 245 230 217 198 173 128 68 38 16 5 0 Vemurafenib 352 341 315 286 252 231 201 187 166 152 129 88 46 28 7 0 0 Fachinformation Mekinist®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. BEZEICHNUNG DES ARZNEIMITTELS Mekinist 0,5 mg Filmtabletten, Mekinist 2,0 mg Filmtabletten QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält Trametinib-Dimethylsulfoxid (1:1), entsprechend 0,5 mg Trametinib oder 2,0 mg Trametinib Sonstige Bestandteile: Tablettenkern: Mannitol (E421), Mikrokristalline Cellulose (E460), Hypromellose (E464), Croscarmellose-Natrium (E468), Magnesiumstearat (E470b), Natriumdodecylsulfat, Hochdisperses Siliciumdioxid (E551), Tabletten-Filmüberzug: Hypromellose (E464), Titandioxid (E171), Macrogol, Mekinist 0,5 mg Filmtabletten, Eisen(III)-hydroxid-oxid x H2O (E172), Mekinist 2,0 mg Filmtabletten, Polysorbat 80 (E433), Eisen(III)-oxid (E172). KLINISCHE ANGABEN Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE25. Anwendungsgebiete: Trametinib ist angezeigt als Monotherapie oder in Kombination mit Dabrafenib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Eine Trametinib-Monotherapie hat keine klinische Aktivität bei Patienten gezeigt, deren Erkrankung auf eine vorhergehende Therapie mit einem BRAF-Inhibitor fortschritt (siehe Abschnitt 5.1.) Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich. ZULASSUNGSNUMMERN: Mekinist 0,5 mg Filmtabletten: EU/1/14/931/01-02, Mekinist 2,0 mg Filmtabletten: EU/1/14/931/05-06. Abgabe: NR, rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 12/2015. Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 6 20.01.16 14:33 STARK • SCHNELL • NACHHALTIG NACHHALTIG: Fast 4 von 10 PatientInnen leben länger als 3 Jahre 1 38% OS rate 1 1 Daud A et al., ASCO Annual Meeting Proceedings 2015; J Clin Oncol 33 (suppl): Abstract 9036 Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 7 20.01.16 14:33 BRF113220 ASCO 2015: 3 Jahres OS rate bei 38% 1 Estimated Survival Function 1.0 12 mo OS rate: 80% 24 mo OS rate: 51% 36 mo OS rate: 38% 0.8 0.6 0.4 0.2 0.0 Dabrafenib 150mg BID/trametinib 2 mg QD 0 6 12 18 24 Graphik adaptiert nach Daud A et al1 30 36 42 48 Time since Randomization (Months) 1 Daud A et al., ASCO Annual Meeting Proceedings 2015; J Clin Oncol 33 (suppl): Abstract 9036 Fachinformation Tafinlar®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Fachinformation Abschnitt 4.8. BEZEICHNUNG DES ARZNEIMITTELS Tafinlar 50 mg Hartkapseln; Tafinlar 75 mg Hartkapseln; QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Tafinlar 50 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 50 mg Dabrafenib. Tafinlar 75 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 75 mg Dabrafenib. Tafinlar 50 mg und 75 mg: Sonstige Bestandteile: Kapselinhalt: Mikrokristalline Cellulose, Magnesiumstearat, Hochdisperses Siliciumdioxid, Kapselhülle: Eisen(III)-oxid (E172), Titandioxid (E171), Hypromellose (E464), Drucktinte: Eisen(II,III)-oxid (E172), Schellack, Propylenglycol; Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE23. Anwendungsgebiete:. Dabrafenib ist angezeigt als Monotherapie oder in Kombination mit Trametinib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in der Fachinformation Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich; Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Zulassungsnummer: Tafinlar 50 mg: EU/1/13/865/001, EU/1/13/865/002; Tafinlar 75 mg: EU/1/13/865/003, EU/1/13/865/004; Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 08/2015. Fachinformation Mekinist®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. BEZEICHNUNG DES ARZNEIMITTELS Mekinist 0,5 mg Filmtabletten, Mekinist 2,0 mg Filmtabletten QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält Trametinib-Dimethylsulfoxid (1:1), entsprechend 0,5 mg Trametinib oder 2,0 mg Trametinib Sonstige Bestandteile: Tablettenkern: Mannitol (E421), Mikrokristalline Cellulose (E460), Hypromellose (E464), Croscarmellose-Natrium (E468), Magnesiumstearat (E470b), Natriumdodecylsulfat, Hochdisperses Siliciumdioxid (E551), Tabletten-Filmüberzug: Hypromellose (E464), Titandioxid (E171), Macrogol, Mekinist 0,5 mg Filmtabletten, Eisen(III)-hydroxid-oxid x H2O (E172), Mekinist 2,0 mg Filmtabletten, Polysorbat 80 (E433), Eisen(III)-oxid (E172). KLINISCHE ANGABEN Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE25. Anwendungsgebiete: Trametinib ist angezeigt als Monotherapie oder in Kombination mit Dabrafenib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Eine Trametinib-Monotherapie hat keine klinische Aktivität bei Patienten gezeigt, deren Erkrankung auf eine vorhergehende Therapie mit einem BRAF-Inhibitor fortschritt (siehe Abschnitt 5.1.) Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich. ZULASSUNGSNUMMERN: Mekinist 0,5 mg Filmtabletten: EU/1/14/931/01-02, Mekinist 2,0 mg Filmtabletten: EU/1/14/931/05-06. Abgabe: NR, rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 12/2015. Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharma.at | +43 1 866 57-0 | Erstellungsdatum: 01 / 2016 | AT1601424473 NOV_Tafinlar_Mekinist_Onepager_A4_160120.indd 8 20.01.16 14:33