44% OS rate1
Werbung
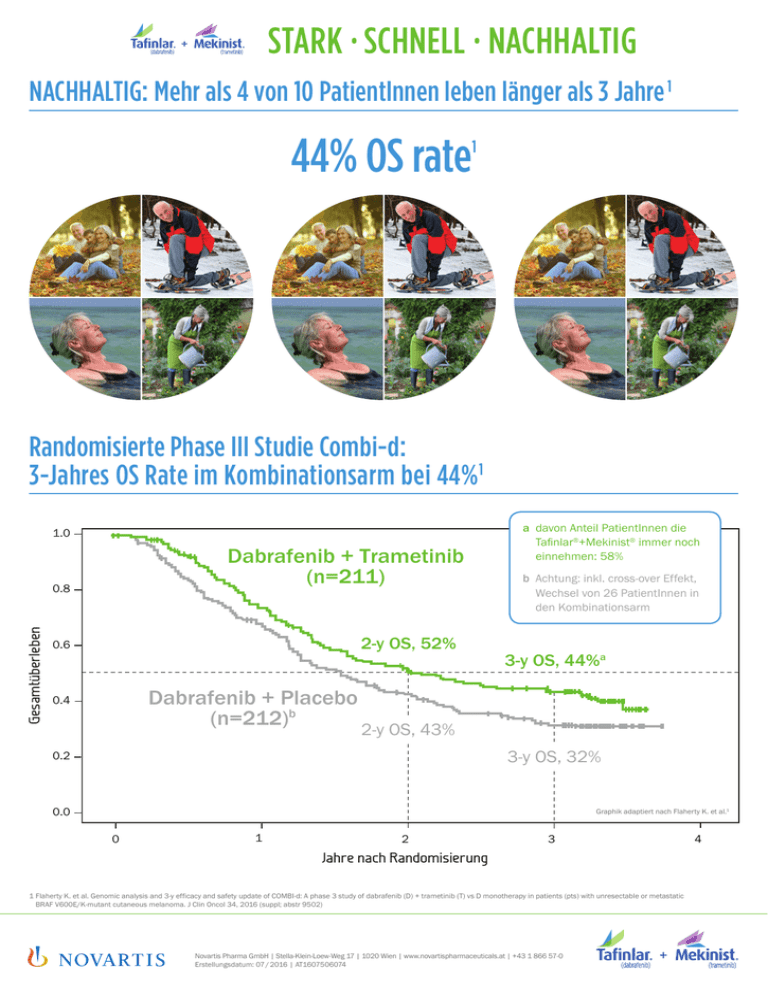
STARK • SCHNELL • NACHHALTIG NACHHALTIG: Mehr als 4 von 10 PatientInnen leben länger als 3 Jahre 1 44% OS rate 1 Randomisierte Phase III Studie Combi-d: 3-Jahres OS Rate im Kombinationsarm bei 44%1 1.0 Dabrafenib + Trametinib (n=211) Gesamtüberleben 0.8 2-y OS, 52% 0.6 Dabrafenib + Placebo (n=212)b 0.4 a d avon Anteil PatientInnen die Tafinlar®+Mekinist® immer noch einnehmen: 58% b A chtung: inkl. cross-over Effekt, Wechsel von 26 PatientInnen in den Kombinationsarm 3-y OS, 44%a 2-y OS, 43% 3-y OS, 32% 0.2 0.0 Graphik adaptiert nach Flaherty K. et al.1 0 1 2 3 Jahre nach Randomisierung 1 Flaherty K. et al. Genomic analysis and 3-y efficacy and safety update of COMBI-d: A phase 3 study of dabrafenib (D) + trametinib (T) vs D monotherapy in patients (pts) with unresectable or metastatic BRAF V600E/K-mutant cutaneous melanoma. J Clin Oncol 34, 2016 (suppl; abstr 9502) Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharmaceuticals.at | +43 1 866 57-0 Erstellungsdatum: 07 / 2016 | AT1607506074 4 STARK • SCHNELL • NACHHALTIG COMBI-d: 3-Jahres Follow-up Subgruppenanalyse Nach drei Jahren leben noch 6 von 10 Patienten mit normaler LDH und weniger als 3 betroffenen Organen, die Tafinlar® + Mekinist® als Erstlinientherapie erhalten haben 100 Tafinlar® + Mekinist® (n=76) 90 3-Jahres-Überleben 62% Patienten (%) 80 70 Tafinlar® + Plazebo (n=96) 60 50 40 30 3-Jahres-Überleben 20 45% 10 0 0 1 2 3 4 Zeit nach Randomisierung (Jahre) Modifiziert nach Flaherty KT et al.; ASCO 2016, Abstract #9502. Fachinformation Tafinlar®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Fachinformation Abschnitt 4.8. BEZEICHNUNG DES ARZNEIMITTELS Tafinlar 50 mg Hartkapseln; Tafinlar 75 mg Hartkapseln; QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Tafinlar 50 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 50 mg Dabrafenib. Tafinlar 75 mg: Jede Hartkapsel enthält Dabrafenibmesilat, entsprechend 75 mg Dabrafenib. Tafinlar 50 mg und 75 mg: Sonstige Bestandteile: Kapselinhalt: Mikrokristalline Cellulose, Magnesiumstearat, Hochdisperses Siliciumdioxid, Kapselhülle: Eisen(III)-oxid (E172), Titandioxid (E171), Hypromellose (E464), Drucktinte: Eisen(II,III)-oxid (E172), Schellack, Propylenglycol; Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE23. Anwendungsgebiete:. Dabrafenib ist angezeigt als Monotherapie oder in Kombination mit Trametinib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in der Fachinformation Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich; Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Zulassungsnummer: Tafinlar 50 mg: EU/1/13/865/001, EU/1/13/865/002; Tafinlar 75 mg: EU/1/13/865/003, EU/1/13/865/004; Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 08/2015. Fachinformation Mekinist®: ▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. BEZEICHNUNG DES ARZNEIMITTELS Mekinist 0,5 mg Filmtabletten, Mekinist 2,0 mg Filmtabletten QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält Trametinib-Dimethylsulfoxid (1:1), entsprechend 0,5 mg Trametinib oder 2,0 mg Trametinib Sonstige Bestandteile: Tablettenkern: Mannitol (E421), Mikrokristalline Cellulose (E460), Hypromellose (E464), Croscarmellose-Natrium (E468), Magnesiumstearat (E470b), Natriumdodecylsulfat, Hochdisperses Siliciumdioxid (E551), Tabletten-Filmüberzug: Hypromellose (E464), Titandioxid (E171), Macrogol, Mekinist 0,5 mg Filmtabletten, Eisen(III)-hydroxid-oxid x H2O (E172), Mekinist 2,0 mg Filmtabletten, Polysorbat 80 (E433), Eisen(III)-oxid (E172). KLINISCHE ANGABEN Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC-Code: L01XE25. Anwendungsgebiete: Trametinib ist angezeigt als Monotherapie oder in Kombination mit Dabrafenib zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation (siehe Abschnitte 4.4 und 5.1). Eine Trametinib-Monotherapie hat keine klinische Aktivität bei Patienten gezeigt, deren Erkrankung auf eine vorhergehende Therapie mit einem BRAF-Inhibitor fortschritt (siehe Abschnitt 5.1.) Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. INHABER DER ZULASSUNG: Novartis Europharm Limited, Frimley Business Park, Camberley GU16 7SR, Vereinigtes Königreich. ZULASSUNGSNUMMERN: Mekinist 0,5 mg Filmtabletten: EU/1/14/931/01-02, Mekinist 2,0 mg Filmtabletten: EU/1/14/931/05-06. Abgabe: NR, rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Stand der Information: 12/2015. Novartis Pharma GmbH | Stella-Klein-Loew-Weg 17 | 1020 Wien | www.novartispharmaceuticals.at | +43 1 866 57-0 Erstellungsdatum: 07 / 2016 | AT1607506074











