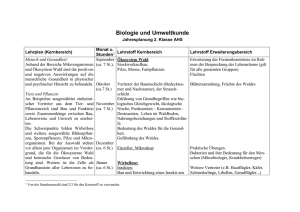
Friedrich-Schiller-Universität Jena Populationsstruktur
Werbung

Friedrich-Schiller-Universität Jena Biologisch-Pharmazeutische Fakultät Institut für Ökologie Populationsstruktur, Wanderverhalten und Habitatnutzung der Gelbbauchunke (Bombina variegata) im Nationalpark Hainich / Thüringen Masterarbeit zur Erlangung des Grades eines Master of Science vorgelegt von Madlen Schellenberg aus Gotha Jena, März 2016 Gutachter Prof. Dr. habil. Günter Köhler Dr. Dierk Conrady Inhalt Abkürzungen..............................................................................................................................I Zusammenfassung ................................................................................................................... II Abstract ...................................................................................................................................IV 1 Einleitung ........................................................................................................................... 1 2 Untersuchungsgebiet ......................................................................................................... 4 3 2.1 Gebietscharakteristik ................................................................................................... 4 2.2 Historische Aspekte der Landnutzung ......................................................................... 7 2.3 Auswahl der Probeflächen und Untersuchungsgewässer ............................................ 9 Material und Methoden .................................................................................................. 12 3.1 Untersuchungszeitraum ............................................................................................. 12 3.2 Erfassung der Gelbbauchunken ................................................................................. 12 3.2.1 Fangmethoden .................................................................................................... 13 3.2.2 Individualerkennung ........................................................................................... 13 3.2.3 Schätzung der Populationsgröße ........................................................................ 15 3.2.4 Altersbestimmung............................................................................................... 18 3.2.5 Geschlechterbestimmung.................................................................................... 18 3.2.6 Vermessung und Wägung................................................................................... 19 3.2.7 Dispersion, Wanderverhalten und Ortstreue ...................................................... 19 3.2.8 Erfassung der Reproduktion ............................................................................... 20 3.3 4 Habitatanalyse ............................................................................................................ 21 3.3.1 Charakterisierung des Landlebensraumes .......................................................... 21 3.3.2 Bestimmung von Gewässerfunktionstypen ........................................................ 22 3.3.3 Ermittelte Parameter an den Gewässern ............................................................. 22 3.3.4 Ermittlung der Gewässerpräferenz bei der Laichablage..................................... 24 3.4 Wetterdaten ................................................................................................................ 25 3.5 Statistische Auswertung ............................................................................................. 25 Ergebnisse ........................................................................................................................ 27 4.1 Gewässerkartierung ................................................................................................... 27 4.2 Populationsstruktur .................................................................................................... 30 4.2.1 Fang-und Individuenzahlen ................................................................................ 30 4.2.2 Populationsgröße und Überlebensraten .............................................................. 32 4.2.3 Altersstruktur ...................................................................................................... 34 4.2.4 Geschlechterverhältnis........................................................................................ 35 4.2.5 Körpergrößen und Körpergewichte .................................................................... 36 4.3 5 6 Ortsbeziehungen ........................................................................................................ 46 4.3.1 Dispersion ........................................................................................................... 46 4.3.2 Ortstreue ............................................................................................................. 47 4.3.3 Aktionsdistanzen und Wanderstrecken .............................................................. 48 4.4 Phänologie und Reproduktion ................................................................................... 51 4.5 Habitatanalyse ............................................................................................................ 57 4.5.1 Landlebensraum.................................................................................................. 57 4.5.2 Gewässer............................................................................................................. 58 4.5.2.1 Gewässer-Funktionstypen ............................................................................. 58 4.5.2.2 Ermittelte Parameter ...................................................................................... 59 4.5.2.3 Laichgewässerpräferenz ................................................................................ 72 Diskussion ........................................................................................................................ 74 5.1 Populationsstruktur .................................................................................................... 74 5.2 Ortsbeziehungen ........................................................................................................ 84 5.3 Phänologie und Reproduktion ................................................................................... 89 5.4 Habitatanalyse ............................................................................................................ 91 Naturschutzfachliche Empfehlung .............................................................................. 105 Literatur ................................................................................................................................ 108 Abbildungen .......................................................................................................................... 119 Tabellen ................................................................................................................................. 121 Abkürzungen AG ANOVA ca CI cm df FFH FH FIS g GIS GLM GPS h ha HB ID juv KG km KRL m m² Max Min Mitt. mündl. MW n N NLP NN NRW NVA p P Range RG rho SchL sd SEM SS sub t TLUG Aufenthaltsgewässer Analysis of variance circa Konfidenzintervall Zentimeter Freiheitsgrade Fauna-Flora-Habitat Fanghäufigkeit Fachinformationssystem Gramm Geografisches Informationssystem Generalized Linear Model Global Positioning System Stunde Hektar Untersuchungsfläche „Hinterberg“ Identifikationsnummer juvenile Gelbbauchunke(n) Körpergewicht Kilometer Kopf-Rumpf-Länge Meter Quadratmeter Maximum Minimum Mitteilung mündlich Mittelwert Stichprobenzahl geschätzte Populationsgröße Nationalpark Nullniveau (mittlerer Meeresspiegel) Nordrhein-Westfalen Nationale Volksarmee Irrtumswahrscheinlichkeit Fangwahrscheinlichkeit Spanne (Min - Max) Reproduktionsgewässer Korrelationskoeffizient Schieblehre Standardabweichung Standardfehler Untersuchungsfläche „Silbersee“ subadulte Gelbbauchunke(n) Prüfgröße des t-Testes Thüringer Landesanstalt für Umwelt und Geologie TÜP u.a. UAV UG V Veg vgl. W X² ZI φ ° °C % ♂♂ ♀♀ Truppenübungsplatz unter anderem Unmanned Aerial Vehicle (Drohne) unbesiedeltes Gewässer Prüfgröße des gepaarten Mann-Whitney-U Testes Vegetation Vergleich Prüfgröße des einfachen Mann-Whitney-U Testes Prüfgröße des Chi²-Testes Untersuchungsfläche „Zirkel“ Überlebensrate Grad Grad Celsius Prozent Männchen Weibchen I Zusammenfassung Die Gelbbauchunke (Bombina variegata) gehört dem Anhang II der Fauna-Flora-HabitatRichtlinie an und zählt damit zu den Tierarten von gemeinschaftlichem Interesse für Europa. Die Bestände der Art gehen deutschlandweit zurück, weshalb bundesweite Naturschutzmaßnahmen vonnöten sind. Um die Effektivität solcher Maßnahmen zu gewährleisten, müssen Untersuchungen an Populationen der Art und deren Lebensräumen durchgeführt werden. In der vorliegenden Arbeit untersuchte ich die Struktur, das Wanderverhalten und die Habitatnutzung einer Gelbbauchunken-Population im Nationalpark Hainich in Thüringen. Die betreffende Population wurde bereits in den 1990er Jahren untersucht, weshalb eine Bewertung der Bestandsentwicklung möglich war. Für die individuelle Wiedererkennung wurde das Bauchmuster der Tiere fotografisch erfasst und am Computer ausgewertet (Programm AmphIdent). Mithilfe einer Fang-Wiederfang-Methodik und der Anwendung eines geschlossenen Populationsmodelles wurde für das Jahr 2014 eine Populationsgröße von 262 Gelbbauchunken geschätzt. 156 dieser Tiere konnten individuell erfasst werden. Der Bestand hat sich folglich seit 1998 und 1999 etwa halbiert. Die adulten Unken zeigten eine Überlebensrate von durchschnittlich 77 % innerhalb eines Sommers. Das Geschlechterverhältnis war zu Gunsten der Männchen verschoben und zeigte keine zeitlichen Schwankungen. Weibliche Unken waren größer und signifikant schwerer als Männchen. Die Messung der Körpergröße mittels einer Schieblehre erbrachte hierbei signifikant kleinere Werte als die Messung am Computer, wobei die Tiere in einer Petrischale fixiert wurden. Die Alterszusammensetzung der Population bestand zur Hälfte aus adulten Unken und zur Hälfte aus frisch metamorphosierten Jungtieren. Subadulte Tiere wurden kaum registriert, was auf eine geringe Reproduktion der Vorjahre schließen lässt. Die Reproduktion des Jahres 2014 brachte knapp 350 Jungtiere hervor und fand lediglich in den beweideten Flächen des Untersuchungsgebietes statt. Die räumliche Verteilung der Gelbbauchunken war stark auf die südlichen Flächen des Gebietes beschränkt, welche unter extensiver Beweidung standen. Innerhalb der Kernzone des Nationalparkes konnten keine Unken nachgewiesen werden, obwohl hier im Jahr 1998 die meisten Tiere erfasst wurden. Die Einstellung der extensiven Beweidung und die vorangeschrittene natürliche Sukzession werden als Grund hierfür verstanden. Von den wiedergefangen Individuen zeigten 95 % eine Ortsbindung an ein spezielles Gewässer oder II Zusammenfassung einen Gewässerkomplex. Maximale Wanderstrecken beliefen sich auf 600 m, wobei weibliche Tiere signifikant weiter wanderten als männliche. Gelbbauchunken bevorzugten temporäre Laichgewässer, welche 1- bis 2-mal während der Sommermonate austrockneten. Laichgewässer waren im Vergleich zu Aufenthaltsgewässern signifikant kleiner, flacher, stärker besonnt und schwächer bewachsen. Zusätzlich wurden in den Laichgewässern signifikant höhere Wassertemperaturen sowie bessere Wasserqualitäten (pH-Wert, Leitfähigkeit, Sauerstoffgehalt) ermittelt. Die Parameter Vegetation, Besonnung, Konkurrenz und Leitfähigkeit wirkten sich signifikant auf die Anzahl abgelegter Eier in den Laichgewässern aus und erscheinen somit als besonders ausschlaggebend für die Laichgewässerwahl durch Bombina variegata. Hinsichtlich der Stärkung der Population sollten zukünftig geeignete Schutzmaßnahmen durchgeführt werden, welche in den natürlichen Sukzessionsverlauf der aquatischen und terrestrischen Habitate der Gelbbauchunke eingreifen. Eine besondere Beachtung sollte hierbei der Erhaltung vorhandener Laichgewässer zukommen. Nur auf diese Weise kann die Reproduktion der Population gefördert und der Bestand mittelfristig erhalten werden. Langfristig sollte das Vorkommen der Gelbbauchunke mit den Beständen an der Werra und Nesse vernetzt werden. Hierdurch wird eine Abwanderung der Tiere aus dem Nationalpark begünstigt und ein aufkommender Interessenkonflikt abgeschwächt. III Abstract The yellow-bellied toad (Bombina variegata) belongs to the appendix II of the Habitats Directive and is thus one of the animal species of community interest for Europe. The species faces a rapid decline throughout Germany, which is why nationwide conservation measures are needed. To ensure the effectiveness of such measures studies must be conducted on populations and their habitats. Therefore, in the present study I examined the structure, migratory behavior and habitat use of a yellow-bellied toad population in the National Park Hainich in Thuringia. The population has already been studied in the 1990s. Thus, an assessment of population trend was possible. For individual identification of the toads I recorded their belly patterns photographically and analyzed them on the computer (software AmphIdent). Using a capturerecapture method a population size of 262 toads was estimated for 2014. 156 of these animals could be registered individually. Hence, the population approximately has halved since 1998 and 1999. The adult toads showed a survival rate of 77 % over the summer month. The sex ratio of the population was shifted in favor of males and showed no seasonal fluctuations. Female toads were larger and significantly heavier than males. The measurement of body size by use of a caliper rule yielded significantly lower values than the measurement on the computer, where the animals where fixed in a Petri dish. The age-composition of the population was half adult toads and half newly metamorphosed juveniles. Subadult animals were hardly registered, suggesting a low reproduction in previous years. The reproduction of 2014 generated nearly 350 juveniles and only took place in the grazed plots of the study area. The spatial distribution of the yellow-bellied toads was heavily restricted to the southern areas of the region, where extensive grazing was conducted. Within the core zone of the National Park no toads could be detected, although this area showed most toads in 1998. The termination of the extensive grazing and the ongoing natural succession seem to be the reason for that. 95 % of the recaptured individuals showed a site fidelity to particular ponds or pond complexes. Maximum walking distances added up to 600 m, with females walking significantly longer distances than males. Yellow-bellied toads preferred temporary spawning ponds which dried up once or twice during the summer months. Compared to residency ponds those for spawning were significantly smaller, shallower, more exposed to the sun and showed less vegetation. In IV Abstract addition, I determined significantly higher water temperatures and better water quality (pH, conductivity, oxygen content) in the spawning ponds. The parameters vegetation, sun exposure, competition and conductivity had a significant effect on the number of laid eggs in the ponds and thus appear to be most decisive for the choice of spawning ponds by Bombina variegata. Regarding the preservation of the population appropriate conservation measures should be carried out, which intervene in the natural succession of the aquatic and terrestrial habitat of the yellow-bellied toad. Special attention should be paid on the preservation of existing spawning ponds. Only in this way the reproduction of the population can be enhanced and thus, the stock preserved in the midterm. In the long term the yellow-bellied toad population should be connected to populations along the rivers Werra and Nesse. This would result in a dispersal of animals out of the National Park and would weaken an emerging conflict of interest. V 1 Einleitung Amphibien reagieren äußerst sensibel auf sich ändernde Umweltbedingungen (CORN, 2005). Ihre semipermeable Haut und ihre ektotherme Lebensweise machen sie extrem abhängig von den Bedingungen ihrer Umwelt (WELLS, 2007). Werden Lebensräume zerstört, verändert oder verschmutzt, kann man die Folgen dieser Handlungen an Bestandsrückgängen von Amphibienpopulationen erkennen. Amphibien gelten daher als Indikatoren für die Intaktheit und „Gesundheit“ eines Ökosystems (WAKE, 1991). Der seit den 1980er Jahren verzeichnete weltweite Rückgang der Amphibien (STUART, 2004; MCCALLUM, 2007) ist somit wie der sprichwörtliche “Kanarienvogel in der Kohlenmine”, der in seinem Käfig von der Stange fällt, sollte der Sauerstoff knapp werden. Ein Hinweis, schnellstmöglich etwas gegen die drohende Gefahr zu unternehmen. Die Gelbbauchunke, Bombina v. variegata (LINNAEUS, 1758) (Amphibia, Bombinatoridae) (Abbildung 1) ist eine der europäischen Arten, deren Bestände im letzten Jahrhundert stark zurückgegangen sind (NÖLLERT, 1996). Ihr Verbreitungsraum erstreckt sich von Frankreich im Westen, über die ukrainischen Karpaten im Osten, bis nach Italien im Süden (GOLLMANN & GOLLMANN, 2002; NÖLLERT & GÜNTHER, 1996). Die nördliche Verbreitungsgrenze ist nach SCHLEGEL (2000) das Weserbergland in Niedersachsen. Abbildung 1.1 Adulte Gelbbauchunke (Bombina variegata). Charakteristisch für die Art sind die gelbschwarz gefleckte Bauchunterseite und die herzförmigen Pupillen. Vor allem in Deutschland ist die Art vom Rückgang bedroht. In der Roten Liste Deutschland wird sie als „stark gefährdet“ eingestuft (KÜHNEL et al., 2009). Im Freistaat Thüringen erlitt Bombina variegata in den letzten 30 Jahren besonders starke Bestandseinbußen, weshalb sie in der Roten Liste Thüringen als „vom Aussterben bedroht“ 1 Einleitung geführt wird (NÖLLERT et al., 2011). Aktuell sind nur noch 15 Vorkommen bekannt, wovon die meisten nur wenige Einzeltiere aufweisen (SERFLING et al., 2014). Da sich Thüringen an der nordwestlichen Verbreitungsgrenze der Art befindet, sind die hiesigen Bestände von besonderem naturschutzfachlichem Wert. Die wichtigste Ursache für die Gefährdung der Art ist, wie bei den meisten Amphibienarten, die Zerstörung ihrer Lebensräume, vor allem die Vernichtung von Gewässern (GOLLMANN & GOLLMANN, 2002). Viele Stillgewässer werden im Rahmen der landwirtschaftlichen Nutzung, durch Flächentrockenlegung sowie durch die Absenkung des Grundwasserspiegels zerstört. Dies trifft besonders auf Klein- und Kleinstgewässer zu, in welchen sich Gelbbauchunken bevorzugt ansiedeln. Ursprüngliche Lebensräume der Art, wie überschwemmte Bach- und Flussauen, Wildsuhlen und Windwürfe in Quellbereichen, sind in unserer mitteleuropäischen Kulturlandschaft kaum noch zu finden. Diese Biotope bieten der Art neben hohem Strukturreichtum auch ein geeignetes Maß an Dynamik. Als Pionierart bevorzugen Gelbbauchunken Lebensräume die durch regelmäßige Störungen in ihr Initialstadium (Pionierstadium) zurückversetzt werden. Da diese jedoch auf natürliche Weise kaum noch entstehen, ist die Art auf Sekundärlebensräume anthropogenen Ursprungs angewiesen. Heute findet man Gelbbauchunken daher vorwiegend in Kies- und Tongruben, Wagenspuren und auf Truppenübungsplätzen (GOLLMANN & GOLLMANN, 2002). Ein solcher Sekundärlebensraum war Untersuchungsgegenstand der vorliegenden Arbeit. Der ehemalige Truppenübungsplatz „Kindel“, im westlichen Thüringen, beherbergt eine Gelbbauchunken-Population, welche in den 1990er Jahren erstmals untersucht wurde. Nach dem Abzug der sowjetischen Truppen wurde die Fläche für Naturschützer zugänglich und von BELLSTEDT et al. (1994) hinsichtlich der vorherrschenden Fauna untersucht. Laut den Ergebnissen dieser Bestandsschätzung siedelte im Gebiet die zu dieser Zeit individuenstärkste Gelbbauchunken-Population Deutschlands (BELLSTEDT et al., 1994). Das Befahren mit schweren Kettenfahrzeugen schuf auf dem Gelände ein reich strukturiertes Mosaik aus Kleingewässern und Landlebensräumen verschiedener früher Sukzessionsstadien. Die Gelbbauchunken, ihrer natürlichen Lebensräume weitgehend beraubt, fanden hier optimale Lebensbedingungen. Durch die Stilllegung des militärischen Übungsbetriebes im Jahr 1990 und die einsetzende natürliche Sukzession im Gebiet, ging der Bestand der Art jedoch in den darauffolgenden Jahren stark zurück. SERFLING (1998) konnte einen Bestandsrückgang von 25 % innerhalb von fünf Jahren nach Aufgabe der militärischen Nutzung nachweisen. Seither wurde die betreffende Gelbbauchunken-Population nicht detailliert untersucht. Dennoch wächst das Interesse an Bombina variegata stetig. Neben der Listung als bedrohte Tierart in Deutschland steht die Gelbbauchunke in der gesamten Europäischen 2 Einleitung Union unter besonderem Rechtsschutz. Sie gehört zu den Tierarten von gemeinschaftlichem Interesse, für deren Erhaltung besondere Schutzgebiete im NATURA-2000-Netz eingerichtet werden müssen (NATURA 2000, 2009). Die Art ist damit im Anhang II der „Richtlinie zur Erhaltung der natürlichen Lebensräume sowie der wildlebenden Tiere und Pflanzen“ (FFHRichtlinie) aufgeführt (BMU, 1992). Neben dem Schutz der natürlichen Lebensräume der Art werden auch der Verbund einzelner Vorkommen sowie das Anlegen neuer Lebensräume angestrebt. Um die Effektivität solcher Naturschutzmaßnahmen gewährleisten zu können und die Bestände langfristig zu sichern, sind Langzeitstudien an Populationen der betreffenden Art unerlässlich. Ziel meiner Studie war es daher die Gelbbauchunken-Population auf dem „Kindel“ populationsökologisch zu untersuchen und deren Status nach 25 Jahren ohne militärische Nutzung zu bewerten. Durch den Vergleich mit den Ergebnissen der beiden vorangegangenen Studien in den 1990er Jahren konnte ein Trend der Bestandsentwicklung dieser Gelbbauchunken-Population aufgezeigt werden. Neben der Schätzung der aktuellen Populationsgröße, wurde auch der strukturelle Aufbau der Population untersucht. Anzeichen struktureller Veränderungen können Hinweise auf die Reaktionsnorm der Population hinsichtlich Habitatveränderungen geben (SY, 1998). Eine entscheidende Rolle spielt außerdem die Reproduktion einer Population. Sie hilft das langfristige Überleben abschätzen zu können. Untersuchungen zu Dispersion und Wanderverhalten helfen die Raumansprüche und das Ausbreitungspotential einer Art zu bestimmen. Für den Verbund vorhandener Vorkommen und die Neuschaffung geeigneter Lebensräume für die Gelbbauchunke, sind solche Informationen zwingend erforderlich. Ein weiterer Schwerpunkt meiner Untersuchung lag auf der genauen Charakterisierung des Lebensraumes und der von den Gelbbauchunken besiedelten Gewässer im Gebiet. Ich bestimmte, welche Bedingungen ein Gewässer vorweisen muss, um von der Art besiedelt zu werden. Unterschiede zwischen Reproduktionsgewässern und Aufenthaltsgewässern wurden analysiert. Der Erfolg der Reproduktion in den untersuchten Gewässern erlaubte es Aussagen über die Bedingungen eines geeigneten Reproduktionsgewässers für die Art zu treffen. Da sich die im Zuge der FFH-Richtlinie geforderten Maßnahmen für den Erhalt der Gelbbauchunke auf die Anlage neuer Gewässerkomplexe konzentrieren, können die durch die Arbeit gewonnen Erkenntnisse enormen Wert für den angewandten Naturschutz der Art haben. Die Informationen über die Gelbbauchunken-Population auf dem „Kindel“ helfen zukünftige Naturschutzmaßnahmen in diesem Bereich zu planen und können so entscheidend zum Schutz der Art in Thüringen beitragen. 3 2 Untersuchungsgebiet 2.1 Gebietscharakteristik Das Untersuchungsgebiet befand sich auf dem ehemaligen Truppenübungsplatz (TÜP) „Kindel“ im Westen des Freistaates Thüringen (51° 1' 0.01", 10° 26' 9.92"). Es war Bestandteil des 7513 ha großen Nationalparkes Hainich und Teil des Naturparkes EichsfeldHainich-Werratal. Der ehemalige TÜP „Kindel“ befindet sich im südlichen Teil des Nationalparkes. Im Norden grenzt er an den von Nordwest nach Südost verlaufenden Höhenzug Hainich, welcher von den Städten Mühlhausen, Bad Langensalza und Eisenach eingegrenzt wird. Der Hainich wird dem Naturraum Hainich-Dün-Hainleite zugeordnet (HIEKEL et al., 2004). Das Untersuchungsgebiet umfasste mit 619 ha nur rund ein Viertel des gesamten ehemaligen TÜP (Abbildung 2.1). Die nächstgelegene Stadt Eisenach befand sich etwa 8 km in südwestlicher Richtung. Abbildung 2.1 Lage des Untersuchungsgebietes im Wartburgkreis. Karte erstellt im FIS der TLUG. Kartengrundlage: Geobasisdaten des Thür. Landesamtes für Vermessung und Geoinformation. 4 Untersuchungsgebiet Das untersuchte Gebiet lag im Einzugsgebiet der Nesse, welche mit den Flusssystemen der Hörsel und der Werra großflächige Vernetzungsmöglichkeiten für Amphibienpopulationen darstellen. Die heute nur noch in wenigen Bereichen vorkommenden Auen dieser Flüsse boten der Gelbbauchunke einst wichtige Primärhabitate (MEY, 1988; MEY & SCHMIDT, 2002). Geologisch war das Untersuchungsgebiet durch Oberen Muschelkalk geprägt. Der ehemalige TÜP bildet einen Teil der Südwestflanke des Hainich-Massives und ist durch eine zum Teil flachwellige, mit Kuppen und Flachrücken ausgestattete Geländeausformung charakterisiert. Die Oberfläche des Untersuchungsgebietes zeigte einen solchen Flachrücken, welcher von Süden von etwa 269 m über NN in Richtung Norden bis etwa 399 m über NN anstieg. Der Großteil des Untersuchungsgebietes (82 %) zeigte Böden vom Typ einer flach bis mittelgründigen Kalkton-Rendzina (FIS TLUG, 2014). Diese Böden zeichnen sich durch hohe Anteile an lehmig, kalkhaltigem Ton und einen unausgeglichenen Wasserhaushalt aus. Neben einem Wechsel aus Vernässung und Austrocknung zeigen sie eine geringe Wasserhaltekraft. Das Niederschlagswasser versickert in Karstspalten im Muschelkalk und tritt nur an wenigen Stellen, in Form von Quellen, wieder zu Tage. Weitere Teile des Untersuchungsgebietes besaßen grundwasserbeeinflusste Böden (Anmoorgley, 8 % der Fläche) und Staunässeboden (Pseudogley, 8 % der Fläche). Brauner Auenboden aus lehmig-sandigen Talsedimenten (Vega) fanden sich auf knapp 2 % der Fläche. Die Böden des Gebietes wurden durch das Befahren der Fläche mit tonnenschweren Kettenfahrzeugen während der militärischen Nutzung stellenweise stark verdichtet. Eine daraus resultierende Besonderheit des Gebietes war die Vielzahl an Klein- und Kleinstgewässern, welche sich nach starken Regenfällen bildeten (Abbildung 2.2 d, e). Diese führten je nach Größe nur periodisch Wasser und waren stark niederschlagsabhängig. Im Südwesten des Untersuchungsgebietes lag der Silbersee, das größte Standgewässer des Nationalparkes. Neben diesen anthropogen geschaffenen Gewässern fanden sich vereinzelt Quellen, Quellbäche und Schichtwasseraustritte, welche auch bei Trockenheit Wasser führten. Die Vegetation des Gebietes wurde durch jahrelange extensive militärische und landwirtschaftliche Nutzung geprägt. Es handelte sich bei dem Untersuchungsgebiet um eine Grünland-Offenfläche mit eingestreuten Gehölz- und Gebüschflächen unterschiedlichen Verbuschungsgrades (Abbildung 2.2 a, b). 5 Untersuchungsgebiet a b c d e Abbildung 2.2 Gebietscharakteristische Habitatstrukturen im Untersuchungsgebiet. Offenfläche mit unterschiedlichem Verbuschungsgrad (a, b); beweidete Offenfläche (c); Kleingewässer (d, e) 6 Untersuchungsgebiet Besonders im Norden setzten sich vermehrt strukturreiche Waldränder und Gebüschkomplexe mit Arten wie Schlehe (Prunus spinosa), Weißdorn (Crataegus spec.) und Hartriegel (Cornus spec.) durch. Im Süden hingegen dominierten Grünlandbereiche, welche durch extensive Schaf- und Ziegenbeweidung offen gehalten werden (Abbildung 2.2 c). Auf dem Großteil der Fläche fand sich ein Mosaik aus mesophilem Grünland frisch bis mäßig feuchter Ausprägung (FIS TLUG, 2014). Die stark vom Relief bewegten, südexponierten Flächen wiesen vermehrt Trocken- und Halbtrockenrasenflächen auf. Dominante Arten waren hier Gewöhnliche Fieder-Zwenke (Brachypodium pinnatum), Echter Schafschwingel (Festuca ovina), Wiesen-Flockenblume (Centaurea jacea) und Gemeine Schafgarbe (Achillea millefolium). In Bereichen, die stark durch den militärischen Übungsbetrieb beansprucht wurden, fanden sich Offenböden. Klimatisch unterlag der untersuchte Raum einem subatlantischen Einfluss mit durchschnittlich 680 mm Jahresniederschlag und einer Jahresmitteltemperatur von 9°C (EXPLORATORIEN ZUR FUNKTIONELLEN BIODIVERSITÄTSFORSCHUNG (2014), STATION HEG03 (2008 - 2014), PHILIPPS UNIVERSITÄT MARBURG). Innerhalb der Untersuchungsfläche kann es jedoch durch den Südabfall zu erheblichen Differenzierungen im Mikroklima kommen. Die Standorttrockenheit wird an den südexponierten Hängen wesentlich verstärkt (KLAUS & REISINGER, 1995). 2.2 Historische Aspekte der Landnutzung Im Untersuchungsgebiet erfolgten bereits 1871, während der Kaiserzeit, erste militärische Übungen (KÖBIS, 2000). Der Truppenübungsplatz „Kindel“ wurde in den 1930er Jahren von der deutschen Wehrmacht eingerichtet. Hierfür wurden Flächen aufgekauft und Wälder gerodet. Der Name „Kindel“ geht auf die Kleinsiedlung „Künkelhof“ im Süden des Gebietes zurück, deren landwirtschaftliche Flächen in den Übungsplatz einbezogen wurden (KLAUS & REISINGER, 1995; Abbildung 2.2). Das Militärgelände diente zunächst als Erprobungs- und Schießplatz für in Eisenach gefertigte Artilleriegeschütze und zum Erproben von Panzern. Nach Ende des Zweiten Weltkrieges wurde der Platz von der Sowjetarmee übernommen und mehrfach erweitert. Insgesamt erreichte der TÜP eine Fläche von 2230 ha (NATIONALPARKVERWALTUNG HAINICH, 2014). Die Sowjetarmee nutzte die Fläche als Panzerschieß- und Militärflugplatz. Es wurden großflächig Schießbahnen mit befestigten Trassen und flankierenden Gräben angelegt und Stellungslöcher per Hand ausgehoben (BELLSTEDT, 1994; KÖBIS, 2000). Diese prägen noch heute das Bild der Landschaft. Durch die politischen Veränderungen in der DDR wurde der Übungsbetrieb auf dem „Kindel“ zum 7 Untersuchungsgebiet Jahresende 1989 eingestellt und im Jahre 1991 zogen die sowjetischen Truppen ab. Das Gebiet ging 1993 im Zuge der Konversion alter militärischer Liegenschaften in den Besitz des Freistaates Thüringen über und wurde 1995 erstmalig unter Schutz gestellt (NATIONALPARKVERWALTUNG HAINICH, 2014). Die Flächen nördlich der Bundesstraße 84 wurden mit der Gründung des Nationalparkes Hainich 1997 in diesen einbezogen. Abbildung 2.3 Truppenübungsplatz „Kindel“ im Jahr 1945. Rot markiert: Kleinsiedlung „Künkelhof“ (Pfeil) und ungefähre Lage des Untersuchungsgebietes (Linie). Luftbild: 1:25000, Thüringer Landesvermessungsamt. Über die Landnutzung des Gebietes vor 1900 liegen kaum Informationen vor. Der südliche Teil der Fläche, nahe der B84, stand vermutlich schon früher unter landwirtschaftlicher Nutzung (KLAUS & REISINGER, 1995). Während der militärischen Nutzung wurde das Gebiet großflächig mit Schafen beweidet. Besonders in den südlichen Bereichen, in denen die Schießbahnen errichtet wurden, wurde Wanderschäferei betrieben (mdl. Mitt. der Schäfer). Im nördlichen Teil der Fläche befanden sich zu Zeiten der Wehrmacht noch vereinzelt Waldflächen, welche durch den Übungsbetrieb jedoch stark geschädigt waren (KÖBIS, 2000). Diese letzten Baumbestände entfernte die Sowjetarmee durch Einschläge im Jahr 1968 (KÖBIS, 2000). Anschließend ließen sie auch diese Flächen beweiden. Durch die Beweidung und den militärischen Übungsbetrieb selbst (Befahrung, Entbuschungsaktionen) wurde die Fläche offen gehalten. Nach der Gründung des Nationalparkes im Jahr 1997 wurde die landwirtschaftlich genutzte Fläche gemäß den 8 Untersuchungsgebiet Vorgaben des Nationalparkgesetzes sukzessiv reduziert. Ab 2003 stellte der Nationalpark die Beweidung auf den nördlichen Flächen komplett ein (NATIONALPARKVERWALTUNG HAINICH, 2010). Diese Flächen werden seither der natürlichen Sukzession überlassen. In den südlichen Bereichen werden aktuell noch 146 ha extensiv mit Schafen und Ziegen beweidet. 2.3 Auswahl der Probeflächen und Untersuchungsgewässer Nach der ersten Begehung des Untersuchungsgebietes wurde dieses in ein weiteres und ein engeres Untersuchungsgebiet eingeteilt. Diese Einteilung erfolgte anhand der Eignung des Lebensraumes für die Gelbbauchunke. Das weitere Untersuchungsgebiet hatte eine Fläche von 619 ha und schloss alle Flächen des engeren Untersuchungsgebietes ein (Abbildung 2.3). Im Norden und Osten grenzte das Gebiet an Waldflächen, im Süden und Westen an die Nationalparkgrenze. Es wurde so gewählt, dass möglichst die gesamte für Gelbbauchunken geeignete Offenfläche des „Kindels“ einbezogen wurde. Abbildung 2.4 Das weitere Untersuchungsgebiet (grün) und das engere Untersuchungsgebiet (blau) mit den drei Teilflächen. Äußere rote Linie (fett) - Nationalparkgrenze, innere rote Linie (dünn) Grenze der Kernzone. Karte erstellt im FIS der TLUG. Kartengrundlage: Geobasisdaten des Thür. Landesamtes für Vermessung und Geoinformation. 9 Untersuchungsgebiet Das engere Untersuchungsgebiet stellte das Gebiet dar, welches im Laufe dieser Untersuchung intensiver betrachtet wurde. Es wurde vor der ersten Begehung in die drei Teilgebiete „Zirkel“ (ZI), „Hinterberg“ (HB) und „Silbersee“ (SS) gegliedert (Abbildung 2.3). Mithilfe von Orthofotos aus dem Jahr 2012 (Maßstab 1:2500, FIS TLUG, 2014) wurden naturräumliche und anthropogene Gegebenheiten bestimmt, welche sich zur Eingrenzung der Gebiete eigneten. Das Teilgebiet SS umfasste eine Fläche von 136 ha. Die Teilgebiete HB und ZI besaßen Flächengrößen von 204 ha und 83 ha. Vom 08. bis 20. Mai 2014 fand eine Kartierung aller Gewässer im weiteren Untersuchungsgebiet statt. Hierfür lief ich die Flächen systematisch ab und erfasste alle vorhandenen Wasserkörper mithilfe eines GPS-Gerätes (Trimble® TNJ31, Genauigkeit 10 m). Jedes Gewässer erhielt eine Identifikationsnummer (ID), bestehend aus der Abkürzung des Gebietsnamens (ZI, HB, SS) und einer fortlaufenden vierstelligen Nummer. So erhielt das erste kartierte Gewässer im Teilgebiet Zirkel beispielsweise die ID ZI0001. Ausgedruckte Orthofotos des Untersuchungsgebietes (Maßstab 1:2500) wurden hierbei als Orientierungshilfe genutzt. Zusätzlich wurde das gesamte Untersuchungsgebiet vom 24. April bis 06. Mai 2014 mittels eines UMV (Unmanned Aerial Vehicle) Oktokopters (HiSystems©) in einer Höhe von 50 m beflogen. Mithilfe einer Kompaktkamera als optischer Sensor im visuellen Bereich konnten Orthofotos mit einer Auflösung von 4000 x 3000 Pixeln aufgenommen werden (MUSTAFA et al., 2014). Durch diese Art der Kartierung konnten Gewässer in einem relativ großen Gebiet mit vergleichsweise geringem Zeitaufwand ermittelt werden. Gewässer, welche ich während der Begehung im Feld übersehen habe, flossen auf diese Weise trotzdem in die Untersuchung ein. Die Kartierung wurde durch das Thüringer Institut für Nachhaltigkeit und Klimaschutz (ThINK) im Auftrag der Thüringer Landesanstalt für Umwelt und Geologie (TLUG) durchgeführt. Die entstandenen Orthofotos wurden anschließend von Martin Weißenborn im Auftrag der Nationalparkverwaltung Hainich interpretiert. Alle kartierten Gewässer wurden nochmals im Feld verifiziert und genau abgegrenzt. Auf diese Weise entstand ein genauer Überblick der vorhandenen Klein- und Kleinstgewässer im Lebensraum der Gelbbauchunke auf dem „Kindel“. Während der Kartierung im Feld wurden erste Charakteristika der Gewässer notiert. Diese beinhalteten den Gewässertyp (Graben, Pfütze, Fahrspur, Tümpel), die Vegetationsbedeckung (stark bewachsen, schwach bewachsen, vegetationslos) und die geschätzte Größe der Gewässer. Anhand dieser Informationen wurde die Eignung der Gewässer für die Gelbbauchunke eingeschätzt. Diese Einschätzung basierte auf meinen eigenen Erfahrungen, die ich während vorheriger Arbeiten mit der Art gesammelt habe, sowie 10 Untersuchungsgebiet auf Literaturangaben (BARANDUN & REYER, 1997; GOLLMANN & GOLLMANN, 2002 u.a.). Für die detaillierte Gewässeranalyse (Abschnitt 3.3.3) wurde anschließend eine realisierbare Anzahl an geeigneten Gewässern ausgewählt. In diese Auswahl wurden alle Gewässer eingeschlossen, in denen im Zuge des jährlichen Amphibien-Monitorings des Nationalparkes in diesem Gebiet bis 2013 Gelbbauchunken nachgewiesen werden konnten. Des Weiteren habe ich alle Gewässer einbezogen, welche laut SERFLING (1998) im Jahr 1998 von Unken besiedelt wurden. Die Methode der gezielten Auswahl von Untersuchungsgewässern anhand von arttypischen Charakteristika („purposive sampling“ nach KREBS, 1999) wurde gewählt, da der Fokus der Arbeit auf einer aussagekräftigen Bestandsschätzung der Gelbbauchunke lag und somit möglichst viele der besiedelten Gewässer im Gebiet einbezogen werden sollten. Während der fortlaufenden Untersuchung wurden in regelmäßigen Abständen weitere Gewässer im näheren Umkreis der Untersuchungsgewässer auf die Besiedlung durch Unken untersucht. 11 3 Material und Methoden 3.1 Untersuchungszeitraum Die Freilanduntersuchungen an der Gelbbauchunken-Population fanden zwischen Mai und Oktober 2014 statt. Zwischen dem 08. Mai und dem 06. September wurde die Fläche mit wenigen Ausnahmen täglich begangen. Der letzte Beobachtungstag war der 02. Oktober 2014. Insgesamt stand die Untersuchungsfläche an 119 Tagen unter Beobachtung. Der Zeitraum der Untersuchung wurde so gewählt, dass die Hauptaktivitätsperiode der Unken abgedeckt wurde. Diese beginnt nach SY & GROSSE (1998) in Thüringen etwa Anfang Mai. Da sich das Erscheinen der Unken nach der Überwinterung jedoch witterungsabhängig um einige Wochen verschieben kann (GOLLMANN & GOLLMANN, 2002), wurde die Fläche bereits in den Monaten März und April stichprobenartig abgesucht. 3.2 Erfassung der Gelbbauchunken Ein Ziel der Studie war die Schätzung der absoluten Populationsgröße der Gelbbauchunke im Untersuchungsgebiet. Sie ist Voraussetzung um Populationsschwankungen zu bewerten und den Status der Art im Gebiet beurteilen zu können. Ich wandte eine Fang-WiederfangMethode an, welche sich vielfach zur Schätzung von Populationsgrößen bewährt hat (KREBS, 1999; SEBER, 1982). Fang-Wiederfang-Methoden liefern allein durch die Menge ihrer Daten weitaus präzisere und weniger verzerrte Ergebnisse als einfache Zählmethoden (SOUTHWOOD, 1978). Neben der Populationsgröße können Aussagen zu Überlebensraten, Dispersion und Wanderverhalten der Tiere getroffen werden. Die Aufnahme von Individualdaten (Größe, Gewicht, Geschlecht, Alter) ermöglichte es zusätzlich, den Zustand der Population zu beurteilen. An jedem der Untersuchungsgewässer wurde in einem 14-tägigen Rhythmus ein Fangtermin durchgeführt. Obwohl angestrebt wurde die Abstände zwischen wiederholten Fängen an einem Gewässer konstant zu halten, konnte dies durch wechselnde Witterungsverhältnisse und die Wasserführung der Gewässer nicht immer eingehalten werden. Die kürzeste Dauer zwischen zwei Fangterminen betrug fünf Tage, die längste 21 Tage. Die Fänge fanden ganztägig statt (ca. 09.00 Uhr - 20.00 Uhr). An Tagen mit witterungsbedingt hoher Aktivität der Tiere (nach starken Regenfällen) wurde das Gebiet zusätzlich nachts begangen. 12 Material und Methoden 3.2.1 Fangmethoden Die Gelbbauchunken wurden je nach Größe des Gewässers mit Keschern oder mit der Hand abgefangen. Für große Gewässer und Gräben nutzte ich einem Teichkescher (rund, Durchmesser 40 cm) mit einer Länge von 1.5 m. Für kleinere Gewässer erwies sich ein Aquarienkescher (viereckig, 20 x 15 cm) als praktisch. Bei flachen, vegetationslosen Gewässern fing ich die Tiere per Hand. In solch kleinen Gewässern konnten Unken zusätzlich „blind“ gefangen werden, indem der Gewässerboden und der Gewässerrand abgetastet wurden. Dies erwies sich als sehr effektiv, da sich die Tiere häufig in Lücken oder im Sediment versteckten. Alle Untersuchungsgewässer wurden stets mit gleicher Intensität abgesucht, weshalb die Suche in großen Gewässern wesentlich mehr Zeit in Anspruch nahm als in kleinen. Wie von MÖLLER (1992) empfohlen, suchte ich jedes Gewässer mehrfach hintereinander ab. Nach dem erstmaligen Abfangen aller Tiere und einer Pause wurde das Gewässer ein zweites oder drittes Mal komplett abgesucht. Hierbei konnten in den meisten Fällen noch zuvor entwischte oder übersehene Tiere gefangen werden. Neben den Gewässern wurde auch das Landhabitat in unmittelbarer Nähe zum Untersuchungsgewässer (< 5 m) nach Gelbbauchunken abgesucht. Die gefangenen Unken bewahrte ich in einem Plastikeimer mit 10 Liter Fassungsvermögen und einem Wasserstand von wenigen Zentimetern auf. Während der Untersuchung wurden die Tiere feucht gehalten, um eine Überhitzung zu vermeiden. Keines der Tiere wurde länger als zwei Stunden aufbewahrt. Nach abgeschlossener Untersuchung entließ ich die Unken in ihr Ursprungsgewässer. 3.2.2 Individualerkennung Die individuelle Unterscheidung gefangener Tiere ist für Fang-Wiederfang-Methoden unverzichtbar. Die Verwendung äußerer Merkmale der Tiere, welche eine eindeutige Identifizierung zulassen, sollte der Anbringung künstlicher Marken stets vorgezogen werden. Äußere Merkmale haben den Vorteil, dass das Verhalten und das weitere Schicksal eines Individuums nicht beeinflusst werden und ethische Bedenken in jedem Fall ausgeschlossen werden können (HENLE, 2000). Bei der Gelbbauchunke hat sich die fotografische Erfassung des Bauchmusters durchgesetzt (vgl. GOLLMANN & GOLLMANN, 2002; KAISER & MÖLLER, 2000; MARCHAND, 1993; MÖLLER, 1992; SEIDEL, 1988; SY, 1998). Dieses ist spätestens nach der ersten Überwinterung der Tiere vollständig ausgeprägt und bleibt ein Leben lang unverändert (BARANDUN, 1995; HABBEL, 1995). Es ist daher möglich Unken über Jahre 13 Material und Methoden hinweg zu identifizieren. Das Verfahren ist zudem im Gelände praktikabel und für die Tiere schmerzfrei und relativ stressarm. Für die fotografische Erfassung im Feld nutzte ich eine digitale Kompaktkamera (Panasonic© Lumix DMC - TZ10) mit einem Normalobjektiv (DC Vario-Elmar 1:3.3 - 6.4, 24 mm). Damit sich die Tiere während der Aufnahmen nicht bewegen konnten und um ein komplettes Abbild des Bauchmusters zu erhalten, fixierte ich die Tiere in einer Petrischale aus Glas (Höhe 2 cm, Durchmesser 10 cm) (Abbildung 3.1). In dem Deckel der Petrischale befestigte ich einen 1 cm dicken Schwamm, welcher vor jeder Aufnahme angefeuchtet wurde. Diese Methode hat sich im Feld als sehr praktikabel und schnell erwiesen. Während des gesamten Handlings der Tiere trug ich Gummihandschuhe. Dies diente dem Schutz der empfindlichen Haut der Unken. Nach HACHTEL et al. (2009) trägt es zusätzlich dazu bei, dass die potentielle Ausbreitung des Amphibien-bedrohenden Chytrid-Pilzes (Batrachochytrium dendrobatidis) vermindert wird. Abbildung 3.1 Adulte Gelbbauchunke in einer Petrischale während der Bauchmusterfotografie. ID des Tieres und Messskala für spätere Bestimmung der Kopf-Rumpf-Länge (KRL) auf Petrischale angebracht. Jeder registrierten Gelbbauchunke wurde eine fortlaufende ID, bestehend aus Buchstaben und Nummern, zugeordnet. Diese wurde mit einem wasserlöslichen Stift auf die Petrischale geschrieben und mitfotografiert. Zusätzlich wurden Fundort (Gewässernummer), Bildnummer, Datum, Uhrzeit, Lufttemperatur und Luftfeuchtigkeit aufgenommen und in einem Feldprotokoll notiert. Die Lufttemperatur und die relative Luftfeuchtigkeit bestimmte ich mit einem Sekunden-Hygrometer (Testoterm© Testo 601, -200 - +800°C, 2.0 - 29 % rF Genauigkeit 0.1°C und ± 2 % rF). 14 Material und Methoden Die Auswertung der individuenspezifischen Bauchmuster erfolgte am PC mit der Wiedererkennungssoftware AmphIdent (MATTHE, 2008). Hierfür wurden alle Bauchmusterfotos nacheinander eingelesen, abgespeichert und mit einer internen Datenbank abgeglichen. Ähnelte ein eingelesen Foto einem bereits vorhandenen Bauchmuster aus der Datenbank, handelte es sich um einen Wiederfang. Diese Information wurde in einer externen Datenbank abgespeichert. Gemeinsam mit einer verknüpften MS Office Excel Datei, welche Aussagen über den Fundort, das Fangdatum und die Individualdaten eines Tieres enthielt, entstand so ein genauer Überblick aller registrierten Unken im Untersuchungsgebiet. Diese Form der Auswertung hatte den Vorteil, dass keine Identifizierung im Feld, beispielsweise über einen Fotokatalog, erfolgen musste. Die genutzte Software hat sich zudem bei FangWiederfang-Daten von Amphibien als verlässlich herausgestellt (vgl. HÖPFER, 2014; NEUBECK & BRAUKMANN, 2014). DRECHSLER et al. (2015) konnten bei einer Studie am Kammmolch (Triturus cristatus) eine Fehlerquote unter 1 % nachweisen. Nach der Auswertung der Fangdaten wurde für jedes Tier eine individuelle Fanghistorie erstellt, welche als Grundlage für die computergestützte Auswertung der Populationsschätzung diente (Abschnitt 3.2.3). Die hierfür notwendige Dateneingabe erfolgte im Windows-Editor im Format nach OTIS et al. (1978). Im Folgenden bezeichnete ich die Anzahl registrierter Individuen stets als „ x Unken oder Tiere“. Beide Begriffe wurden synonym verwendet. Als „x Fänge“ bezeichnete ich eine unbestimmte Anzahl an Unken, welche insgesamt x-mal gefangen wurden. 3.2.3 Schätzung der Populationsgröße Populationsschätzungen mittels Fang-Widerfang-Methoden basieren auf dem Prinzip, dass sich in der untersuchten Population eine bekannte Zahl markierter Individuen befindet. An den darauffolgenden Fangtagen lässt sich die Populationsgröße aus dem Verhältnis von markierten zu unmarkierten Tieren schätzen (HENLE, 2000). Überlebensraten werden aus dem „Verlust“ markierter Tiere geschätzt (SEBER, 1982). Die Schätzung der Populationsgröße errechnet sich wie folgt (SOUTHWOOD, 1978): 15 Material und Methoden Ni = Mi . n i mi Ni: Gesamtzahl der Individuen in der Population zum Zeitpunkt des i-ten Fangtages Mi: Anzahl markierter Individuen in der Population am (i-1)-ten Fangtag ni: Gesamtzahl gefangener Individuen am i-ten Fangtag mi: Anzahl bereits markierter Individuen am i-ten Fangtag Die Hauptschwierigkeit bei Fang-Wiederfang-Studien liegt in der Auswahl der passenden, auf theoretischen Modellen basierenden, Datenanalyse. Das Fangdesign und die Datenanalyse sollten aufeinander abgestimmt sein und bereits bei der Planung der Untersuchung festgelegt werden (SOUTHWOOD, 1978). Da der Fangerfolg in meiner Studie jedoch nicht vorhersehbar war, versuchte ich nach der Datenerhebung eine passende Schätzmethode auf die erhobenen Daten anzuwenden. Besonders berücksichtigt habe ich dabei, dass die vom Modell gestellten Grundannahmen nicht verletzt werden, da dies den Hauptgrund von über- oder unterschätzten Populationsgrößen darstellt (HENLE, 2000). Ich berechnete die Populationsgröße nach drei verschiedenen Methoden: 1) kumulative Methode 2) Programm „Jolly“ 3) Programm „Capture“ Bei der kumulativen Methode ergab sich die Populationsgröße aus der Anzahl der fotografisch erfassten und damit individuell markierten Tiere. Hierbei handelte es sich um die Mindestpopulationsgröße. Die angewandte Jolly-Seber Schätzmethode (JOLLY, 1965; SEBER, 1965) wurde mithilfe des Programmes „Jolly“ (POLLOCK et al., 1990) durchgeführt. Hierbei wurden Populationsgrößen für jeden Fangtermin separat geschätzt. Diese Methode hat den Vorteil, dass von einer offenen Population ausgegangen wird, in der Immigration, Emigration, Natalität und Mortalität angenommen werden (JOLLY, 1965). Die wichtigsten Grundannahmen sind nach POLLOCK et al. (1990): 16 Material und Methoden 1) Alle Individuen haben zum Fangzeitpunkt i die gleiche Fangwahrscheinlichkeit. 2) Alle markierten Individuen überleben mit gleicher Wahrscheinlichkeit bis zum nächsten Fangtermin i + 1. 3) Markierungen können nicht verloren gehen oder übersehen werden. 4) Eine homogene Durchmischung der Population nach dem Fangereignis ist gegeben. 5) Emigration ist permanent. Die wichtigsten Modelle im Programm „Jolly“ sind Modell A mit zeitspezifischen Überlebensraten und Fangwahrscheinlichkeiten, Modell B mit konstanten Überlebensraten und zeitspezifischen Fangwahrscheinlichkeiten sowie Modell D mit konstanten Parametern (POLLOCK et al., 1990). Das passende Modell wurde mithilfe von „Goodness-of-fit“-Tests (Chi² nach PEARSON, 1900) und „Likelihood-ratio-type“-Tests ausgewählt. Ein Problem dieser Methode ist, dass die Schätzung der Populationsgröße empfindlich auf Verletzungen der Grundannahmen reagiert und eine hohe Fangwahrscheinlichkeit der Tiere vorausgesetzt wird (HENLE, 2000). CAROTHERS (1973) weist darauf hin, dass besonders die gleiche Fangwahrscheinlichkeit aller Individuen ein unerreichbares Ideal in natürlichen Populationen darstellt. Aus diesem Grund habe ich eine weitere, robustere Methode für geschlossene Populationen angewandt. Diese wurde mithilfe des Programmes „Capture“ (WHITE et al. 1978) berechnet. Da bei dieser Methode davon ausgegangen wird, dass sich die Populationsgröße nicht ändert (OTIS et al., 1978), wurde eine Größenschätzung für die gesamte Fangperiode durchgeführt. Der Vorteil dieser Methode liegt darin, dass Schätzungen unter der Annahme ungleicher Fangwahrscheinlichkeit durchführbar sind (OTIS et al., 1978). Die Grundannahmen der Modelle sind im Vergleich zur Jolly-Seber-Methode folglich weniger restriktiv. Die verbleibenden Grundannahmen der Modelle lauten nach OTIS et al. (1978): 1) Die Population ist geschlossen. 2) Markierungen können nicht verloren gehen oder übersehen werden. 3) Eine homogene Durchmischung der Population nach dem Fangereignis ist gegeben. OTIS et al. (1978) betrachten drei Gründe von ungleicher Fangwahrscheinlichkeit in natürlichen Populationen und beschreiben diese durch die folgenden Modelle: 17 Material und Methoden 1) zeitliche Variation und Unterschiede zwischen den Fangtagen - Modell Mt (time) 2) Verhaltensänderungen der Tiere nach dem Erstfang - Modell Mb (behavior) 3) Heterogenität aufgrund von individuellen Unterschieden zwischen den Tieren Modell Mh (heterogenity) Diese drei Modelle und deren Kombinationen (Mth, Mtb, Mbh etc.) standen im Programm „Capture“ zur Verfügung. Die Auswahl des passenden Modelles erfolgte über „Goodness-offit“-Tests und „Likelihood-ratio-type“-Tests. Da es nicht möglich war die Teilflächen des Untersuchungsgebietes an einem Tag zu beproben, wurden mehrere aufeinanderfolgende Fangtage zu einem Fangereignis zusammengefügt. Dies hilft die zeitliche Variation so gering wie möglich zu halten (WHITE, 1982). Die Teilfläche „Hinterberg“ (HB) wurde für die Berechnung der Populationsgröße in „Capture“ und „Jolly“ aufgrund der Größe und der Anzahl der Gewässer nochmals unterteilt. Es ergaben sich 12 Fangereignisse für den Bereich HB_1, acht für den Bereich HB_2 und neun für den Bereich SS. Die Populationsgrößen wurden für alle drei Bereiche separat ausgewertet und später addiert. In die Berechnungen wurden nur adulte und subadulte Gelbbauchunken einbezogen. 3.2.4 Altersbestimmung Hinsichtlich des Alters der Tiere unterschied ich zwischen adulten, subadulten und juvenilen Tieren. Das Alter wurde hierbei anhand der Größe (Kopf-Rumpf-Länge) der Tiere abgeschätzt. Nach KAPFBERGER (1984) und SY & GROSSE (1998) bezeichnete ich Tiere mit einer Kopf-Rumpf-Länge von mindestens 30 mm als adult. Tiere in dieser Größenklasse mit Brunftschwielen wurden als Männchen, alle anderen als Weibchen, gewertet. Unken, welche kleiner als 30 mm waren, die aufgrund ihres Fangzeitpunktes und ihrer Größe jedoch mindestens einmal überwintert haben mussten, wurden als subadult bezeichnet. Metamorphosierte Jungtiere vor ihrer ersten Überwinterung bezeichnete ich als juvenil. 3.2.5 Geschlechterbestimmung Die Bestimmung der Geschlechter der Tiere erfolgte, angelehnt an GOLLMANN & GOLLMANN (2002), KAPFBERGER (1982) und SY & GROSSE (1998), anhand der nur bei männlichen Tieren auftretenden Brunftschwielen. Diese sind über die gesamte Saison sichtbar, auch wenn der Pigmentierungsgrad zum Ende der Aktivitätsperiode leicht abnimmt (SY, 1998). Bei 18 Material und Methoden Wiederfängen wurde die Geschlechtszuordnung durch Abgleichen der fotografisch erfassten Bauchmuster nochmals überprüft. Die beiden Geschlechter wurden hinsichtlich ihrer Körpergrößen und –gewichte statistisch verglichen. Des Weiteren wurde das Geschlechterverhältnis der Population berechnet. Juvenile und subadulte Tiere fanden für die Geschlechterbestimmung keine Berücksichtigung. 3.2.6 Vermessung und Wägung Die registrierten Gelbbauchunken wurden gewogen und vermessen. Adulte Tiere wog ich mit einer digitalen Taschenwaage (Kern© CM 320-1, max. 320 g) auf 0.1 g genau. Für Subadulte und Juvenile nutzte ich eine digitale Taschenwaage (Kern© CM 60 - 2N, max. 60 g) mit einer Genauigkeit von ± 0.01 g. Um die Tiere am Wegspringen zu hindern, platzierte ich sie in einem Plastikgefäß mit Deckel, welches mit der Waage tariert wurde. Da die Waagen erst ab Juni zur Verfügung standen, konnten 15 Gelbbauchunken nicht gewogen werden. Es handelte sich um Tiere der ersten beiden Fangtage, welche später nicht wiedergefangen wurden. Die Bestimmung der Kopf-Rumpf-Länge (KRL) erfolgte durch zwei verschiedene Methoden. Ich maß die Tiere mithilfe einer Schieblehre (Kinzo©, 0 - 150 mm, Genauigkeit ± 0.05 mm) von der Schnauzenspitze bis zum Kloakenrand. Hierbei achtete ich darauf, dass die Tiere locker in der Hand lagen. Mit dem Mittelfinger übte ich einem sanften Druck auf den Rücken der Tiere aus, sodass diese ihre Wirbelsäule nicht krümmen konnten. Diese Methode birgt jedoch auch bei geübten Bearbeitern das Risiko, dass die Messwerte um einige Millimeter streuen (Messfehler bis 15 % nach SEIDEL, 1988). Verlässlichere Ergebnisse erhält man, wenn man die Tiere während der Messung an eine Unterlage drückt (KUHN, 1997; SEIDEL, 1988). Aus diesem Grund vermaß ich die Tiere zusätzlich in der Petrischale. Hierzu wurde auf der Schale eine Messskala von 4 cm angebracht, welche bei der Identifizierung der Tiere mitfotografiert wurde (Abbildung 3.1). Anhand der Fotos wurden die Unken später am PC im Programm AmphIdent vermessen. Die Messskala diente hierbei als Referenz. Die Ergebnisse beider Methoden wurden statistisch verglichen. Juvenile Tiere maß ich lediglich mit der Schieblehre, da ich diese nicht individuell erfasste. 3.2.7 Dispersion, Wanderverhalten und Ortstreue Aussagen zu Wanderdistanzen und Raumnutzungen von Arten spielen eine entscheidende Rolle in der Populationsökologie (BEGON et al., 1997). Besonders für den angewandten 19 Material und Methoden Arten- und Naturschutz ist es wichtig, die Raum- und Habitatansprüche einer Art genau zu kennen, bevor man Naturschutzmaßnahmen plant (JACOB et al., 2009). Da ich den Fundpunkt jedes gefangenen Tieres protokollierte, konnte ich die räumliche Verteilung der Individuen im Untersuchungsgebiet (Dispersion) und die Nutzungsintensität der drei Teilbereiche genauer untersuchen. Für jede wiedergefangene Unke konnten außerdem Aktionsdistanz und Wanderstrecke ermittelt werden. Die Aktionsdistanz bezeichnete hierbei nach SCHWERDTFEGER (1979) die maximale Distanz zwischen zwei Fundpunkten eines Tieres (Luftlinie). Für die Wanderstrecke addierte ich die Distanzen zwischen den einzelnen Fundpunkten. Der Schwerpunkt dieser Betrachtungsweise lag hierbei nicht auf der physischen Leistung der Unken, sondern auf deren Ortsbeziehungen. Alle Distanzen wurden im Programm GISterm (Disy Informationssysteme) vermessen. Das Relief fand dabei keine Berücksichtigung, was zu einer Unterschätzung der tatsächlichen Entfernungen führt. Für die Betrachtung der Ortstreue wurden alle mindestens 1-mal wiedergefangenen Gelbbauchunken in drei Kategorien eingeteilt: Kategorie a: Das Tier wurde stets in demselben Gewässer gefangen. Kategorie b: Das Tier wurde an mindestens zwei verschiedenen Gewässern, aber stets in demselben Gewässerkomplex, gefangen. Kategorie c: Das Tier wurde in mindestens zwei Gewässerkomplexen gefangen. Als ortstreu wurden Tiere der Kategorien „a“ und „b“ angesehen (MÖLLER, 1992; SY, 1998). 3.2.8 Erfassung der Reproduktion Die Untersuchungsgewässer wurden 1-mal wöchentlich auf Laich, Larven und metamorphosierte Jungtiere kontrolliert. An Tagen nach starken Regenfällen kontrollierte ich die Gewässer täglich. Die abgelegten Eier wurden mittels eines Handzählgerätes gezählt. Da die Weibchen der Gelbbauchunke Laichklumpen mit nur etwa 10 - 40 Eiern ablegen (HABBEL, 1995) und diese bevorzugt in flachen Bereichen der Gewässer positionieren (GOLLMANN & GOLLMANN, 2002), ist ein vollständiges Zählen des Laiches meist problemlos möglich. Waren Gewässer nach Regenfällen zu stark getrübt und der Laich dadurch nicht sichtbar, wurde an den darauffolgenden Tagen gezählt. Um eine doppelte Zählung zu vermeiden wurden stets neu abgelegte Eier erfasst. 20 Material und Methoden Larven und metamorphosierte Jungtiere zählte ich ebenfalls mit dem Handzählgerät. Die Larven wurden in drei Kategorien eingeteilt: klein (1 - 2 Wochen alt), mittel (2 - 4 Wochen alt) und groß (< 4 Wochen alt, mit sichtbar ausgeprägten Hintergliedmaßen). Metamorphosierte Jungtiere wurden als solche bezeichnet, wenn die Vordergliedmaßen durchgebrochen waren. Als „erfolgreiche Reproduktion“ wertete ich, wenn metamorphosierte Jungtiere am Gewässer nachweisbar waren. Wurden große Larven nachgewiesen, bei denen davon auszugehen war, dass sie vor der nächsten Untersuchung die Metamorphose abschließen würden, wurde dies ebenfalls als „erfolgreiche Reproduktion“ gewertet. Ein frühzeitiges Beenden der Entwicklung der Larven, etwa durch Fressfeinde oder das Austrocknen des Gewässers, wurde als „kein Reproduktionserfolg“ gewertet. Als Laichereignis bezeichnete ich einen Zeitraum von wenigen Tagen intensiver Laichaktivität, dem ein längerer Zeitraum ohne Laichaktivität folgte. 3.3 Habitatanalyse Der zweite Schwerpunkt der Arbeit lag auf dem Lebensraum der Gelbbauchunke im Untersuchungsgebiet. Neben einer Charakterisierung des Landlebensraumes betrachtete ich alle Untersuchungsgewässer hinsichtlich ihrer physischen, chemischen und biologischen Parameter. Es wurde untersucht, ob das jeweilige Gewässer von Gelbbauchunken besiedelt und ob es zur Reproduktion genutzt wurde. Dadurch konnten Aussagen zur Gewässerpräferenz der Art getroffen und die hierfür verantwortlichen Parameter bestimmt werden. 3.3.1 Charakterisierung des Landlebensraumes Der Landlebensraum der Gelbbauchunke wurde durch Informationen aus dem Fachinformationssystem (FIS) Naturschutz der Thüringer Landesanstalt für Umwelt und Geologie (TLUG) bewertet. Vorhandene Biotoptypen und deren Anteile an der Gesamtfläche wurden für die drei Teilflächen berechnet. Im Freiland notierte ich Versteck- und Überwinterungsmöglichkeiten im Umkreis der Untersuchungsgewässer. Hierbei orientierte ich mich an dem ABC-Bewertungsbogen zur Beurteilung der Habitatqualität für die Gelbbauchunken der Thüringer Landesanstalt für Umwelt und Geologie. 21 Material und Methoden 3.3.2 Bestimmung von Gewässerfunktionstypen Anhand der Nutzung der Gewässer durch die Gelbbauchunke teilte ich die Gewässer in Funktionstypen ein. Nach WAGNER (1996) wurden drei Gewässer-Funktionstypen unterschieden: „Aufenthaltsgewässer“ (AG) Gewässer, in denen adulte und subadulte Gelbbauchunken, jedoch keine Entwicklungsstadien der Art, festgestellt wurden. „Reproduktionsgewässer“ (RG) Gewässer, in denen Entwicklungsstadien der Art festgestellt wurden. RG ohne Reproduktionserfolg wurden als „nicht reproduktiv“, solche mit mehr als 100 Larven als „sehr reproduktiv“ und alle weiteren als „mäßig reproduktiv“ eingestuft. „Unbesiedelte Gewässer“ (UG) Gewässer die keinerlei Funde der Art zeigten. Die Bezeichnungen Reproduktionsgewässer und Laichgewässer wurden synonym verwendet. 3.3.3 Ermittelte Parameter an den Gewässern Es ist bekannt, dass die Gelbbauchunke spezifische Anforderungen an ihre Laichgewässer stellt und sich diese von den Aufenthaltsgewässern der Art unterscheiden (vgl. BARANDUN & REYER, 1998; GOLLMANN & GOLLMANN, 2002; KAPFBERGER, 1982). Um herauszufinden, welche Bedingungen ein Laichgewässer bieten sollte, verglich ich die von der Art genutzten Aufenthalts- und Reproduktionsgewässer im Untersuchungsgebiet hinsichtlich verschiedener Parameter. Für die Charakterisierung der Gewässer habe ich folgende Parameter an jedem Gewässer aufgenommen: - Gewässergröße (m²) - Gewässertiefe (m) - Vegetationsbedeckung (%) - Besonnungsgrad (%) - Wassertemperatur (°C) - pH-Wert - elektrische Leitfähigkeit (µS cm-1) - Sauerstoffsättigung (mg/L) - Begleitfauna (Amphibien, Prädatoren) 22 Material und Methoden Die Größe der Untersuchungsgewässer bestimmte ich einmalig anhand von Orthofotos (20 x 20 cm, 2012), welche etwa zum Gewässerhöchststand im Frühjahr (März - April) aufgenommen wurden. Die Vermessung wurde am PC durchgeführt (GISterm, Disy Infomationssysteme). Kleine ephemere Gewässer wurden im Feld mithilfe eines Zollstockes vermessen. Die Wassertiefe von Klein- und Kleinstgewässern kann innerhalb einer Saison stark schwanken, weshalb ich diese 1-mal wöchentlich aufnahm. Da ich eine verlässliche Messung über einen langen Zeitraum garantieren wollte, brachte ich zu Beginn der Untersuchung in jedem der Gewässer eine Holzlatte mit einer Messskala an (Abbildung 3.2). Auf diese Weise konnte der Wasserstand immer an derselben Stelle im Gewässer bestimmt werden. Da ich diesen außerdem von dem Gewässerrand abgelesen konnte, wurde eine Störung des sensiblen Habitats verhindert. Die Vegetationsbedeckung der Gewässer wurde nach MÜHLENBERG (1993) 14-tägig geschätzt. Als Vegetationsbedeckung wurde hierbei der flächenmäßige Anteil des Gewässers (in %) bestimmt, welcher mit Vegetation bewachsen war. Für submerse und emerse Vegetation wurde eine separate Schätzung durchgeführt. In die Auswertung flossen nur Vegetationsbedeckungen aus den Aufnahmen im Juli ein, da die Bedeckung in diesem Monat am höchsten war und somit den maximalen Bewuchs darstellte. Um Aussagen zum Besonnungsgrad der Gewässer treffen zu können, schätzte ich den Anteil der Gewässeroberfläche (in %), welcher nicht durch Gehölze oder Vegetation beschattet wurde. Die Wassertemperatur (°C) ermittelte ich bei jeder Begehung mit einem Combo Tester (HANNA® Instruments HI 98129/130, Genauigkeit ± 0.05°C) wenige Zentimeter unterhalb der Wasseroberfläche. Da sich die Wassertemperatur jedoch mit dem Tagesverlauf stark ändert, sind diese Werte von der Zeit der Begehung abhängig und für einen statistischen Vergleich unbrauchbar. Aus diesem Grund zeichnete ich die Wassertemperatur in 11 Gewässern zusätzlich durch Data Logger (HOBO Pendant® UA-002-08, Genauigkeit ± 0.53°C) auf. Diese Temperatursensoren wurden an der tiefsten Stelle der Gewässer befestigt (Abbildung 3.2). Die Aufzeichnungen fanden vom 25. Juni 2014 bis 30. September 2014, alle 10 Minuten, synchron in den 11 Gewässern statt. Ausgewertet wurde der Zeitraum vom 08. Juli bis 30. September 2014, da die meisten Gewässer zuvor trocken lagen. Die Logger wurden mithilfe der Software HOBOware (Version 3.3.1, Onset Computer Corporation) programmiert und ausgelesen. Für die Datenverarbeitung bestimmte ich Tages- und Nachtmittelwerte, Minima und Maxima sowie die Temperaturspanne (Range) eines jeden Gewässers. 23 Material und Methoden a b Abbildung 3.2 Aufnahme der Wassertiefe und Wassertemperatur in den Gewässern. Holzlatte mit Messskala zur Bestimmung der Wassertiefe (a), Data Logger zur Aufzeichnung der Wassertemperatur (b) Für die Charakterisierung des chemischen Milieus in den Untersuchungsgewässern bestimmte ich 14-tägig den pH-Wert, die elektrische Leitfähigkeit (µS cm-1) und den Sauerstoffgehalt (mg/L) des Wassers. Der pH-Wert und die elektrische Leitfähigkeit wurden mit dem Combo Tester (HANNA® Instruments HI 98129/130, Genauigkeit 0.01 pH) gemessen. Die Menge an gelöstem Sauerstoff bestimmte ich mit einem MultiparameterMessgerät (WTW OxiCal® SL 315i, Genauigkeit ± 0.5 %). Neben den chemischen und physischen Parametern untersuchte ich die Gewässer außerdem auf das Vorhandensein von Konkurrenten und Prädatoren der Gelbbauchunke, beziehungsweise ihrer Entwicklungsstadien. Das Vorhandensein konkurrierender AnurenArten, beispielsweise des Europäischen Laubfrosches (Hyla aborea), wurde notiert. Potentielle Prädatoren wurden in die Gruppen Insektenlarven (Ordnungen: Odonata, Coleoptera) und Molche (Gattungen: Triturus, Lissotriton, Ichthyosaura) eingeteilt. 3.3.4 Ermittlung der Gewässerpräferenz bei der Laichablage Aus der Gesamtheit der ermittelten Parameter sollten diese herausgefiltert werden, welche für die Intensität des Laichens an den Gewässern verantwortlich waren. Hierfür wandte ich eine nicht-lineare Regressionsanalyse an. Die Anzahl abgelegter Eier in den Gewässern stellte die abhängige Variable dar, während die diversen Parameter die erklärenden Variablen darstellten. Da es sich bei der Anzahl abgelegter Eier um Zähldaten handelte, nutzte ich ein log-lineares Regressionsmodell. Bei dem genutzten GLM („Generalized Linear Model“) wurde die Überdispersion berücksichtigt und eine Korrektur der Fehlerverteilung vorgenommen. Das GLM basierte auf dem Prinzip der „Maximum-Likelihood“, das heißt es wurde nach der Parameterkombination gesucht, welche die Varianz innerhalb der Daten am 24 Material und Methoden besten erklärt. Als optimale Parameter galten diejenigen Werte, mit denen die Regressionsgleichung zu konstruieren war, die für bestimmte x-Werte die tatsächlich beobachteten y-Werte der Stichprobe mit höchstmöglicher Wahrscheinlichkeit ermitteln konnte. Hierfür wurde das Grundmodell, welches alle Parameter enthielt, nach dem Prinzip der „Sparsamkeit“ („Principle of parsimony“) schrittweise vereinfacht. Erst wenn sich im Laufe der Vereinfachung die Wahrscheinlichkeit für eine möglichst exakte Regressionsschätzung der Stichprobe nicht mehr steigern ließ, wurde die Vereinfachung abgebrochen und diejenigen Parameter-Schätzwerte, als optimale Schätzwerte akzeptiert (= finales Modell). Die Parameter des finalen Modelles galten als entscheidende Kriterien für die Wahl eines Laichgewässers durch die Gelbbauchunke. In die Analyse flossen alle untersuchten Gewässer der Teilflächen HB und SS (n = 82) ein. Hinsichtlich der Gewässerparameter bezog ich alle neun untersuchten Gewässerparameter ein (Abschnitt 3.3.3). Zusätzlich flossen die Informationen zu der Austrocknungshäufigkeit der Gewässer ein. Die Parameter Vegetationsbedeckung (emers und submers) und Besonnung wurden für die Analyse in Proportionaldaten umgewandelt (÷ 100), da sie in Prozent aufgenommen wurden. 3.4 Wetterdaten Für den gesamten Untersuchungszeitraum standen Wetterdaten der Station HEG03 (HainichDün Grünland, 50° 59' 53.13", 10° 25' 58.62") der Biodiversitäts-Exploratorien (EXPLORATORIEN ZUR FUNKTIONELLEN BIODIVERSITÄTSFORSCHUNG, 2014) zur Verfügung. Die Messstation befand sich etwa 1.4 km südwestlich des Untersuchungsgebietes. Es wurden Tagesdaten für Lufttemperatur (°C, Messung 2 m über dem Boden), Niederschlag (mm) und relative Luftfeuchtigkeit (%, Messung 2 m über dem Boden) ausgewertet. Anhand der Wetterdaten untersuchte ich, ob die Laichereignisse der Gelbbauchunke mit den Niederschlagsmengen korrelierten und ob sich Niederschlag und Tagesmitteltemperatur auf die Anzahl registrierter Unken auswirkten. 3.5 Statistische Auswertung Die Untersuchung auf signifikante Unterschiede zwischen Gruppen erfolgte bei einer Normalverteilung der Daten (Shapiro-Wilk Test: p > 0.05) und einer Varianzhomogenität (FTest: p > 0.05) mittels eines klassischen t-Testes. Dieser prüft, ob die Mittelwerte zweier unabhängiger Stichproben aus der gleichen Grundgesamtheit stammen. Waren die beiden 25 Material und Methoden Datenmengen nicht normalverteilt und/oder varianzhomogen, griff ich auf den MannWhitney-U Test zurück. Hierbei werden die Mediane zweier Stichproben verglichen. Die im Untersuchungszeitraum erfassten Daten wurden in MS Office Excel 2010 verwaltet und ausgewertet. Die Populationsschätzungen wurden mit den in Abschnitt 3.2.3 genannten Programmen durchgeführt. Alle statistischen Berechnungen führte ich im Programm R (Version i386 3.1.2) durch. 26 4 Ergebnisse 4.1 Gewässerkartierung Durch die im Abschnitt 2.3 erklärten Methoden konnten im weiteren Untersuchungsgebiet insgesamt 1972 Gewässer identifiziert werden (Abbildung 4.1). Während der Begehung der Untersuchungsfläche gelang es mir 1131 dieser Gewässer zu kartieren. Weitere 841 Gewässer wurden durch die Drohnen-basierte Befliegung identifiziert. Abbildung 4.1 Kartierte Gewässer im Untersuchungsgebiet (n = 1972). Karte erstellt im FIS der TLUG. Kartengrundlage: Geobasisdaten des Thür. Landesamtes für Vermessung und Geoinformation. 27 Ergebnisse Betrachtet man die Verteilung der kartierten Gewässer im Untersuchungsgebiet so wird deutlich, dass die Teilfläche ZI die meisten Gewässer aufwies. Auf dieser Fläche befanden sich viele große Gewässer, welche stark bewachsen und teilweise versumpft waren. In der Teilfläche SS existierten nur wenige Gewässer, welche stark verstreut lagen. Die Auswirkungen der starken Hangneigung des Untersuchungsgebietes, welche von Norden nach Süden hin abfiel, wurden in der Teilfläche HB sichtbar. Auf dieser Fläche kartierte ich vornehmlich Gräben, welche durch das ablaufende Niederschlagswasser gefüllt wurden. Insgesamt wählte ich 118 Gewässer zur näheren Untersuchung aus. Diese wurden in 19 Gewässerkomplexe eingeteilt, welche jeweils gemeinsam untersucht wurden (Abbildung 4.2) (Anhang A). Hierdurch ergab sich folgendes Bild: „Zirkel“ (ZI): 6 Gewässerkomplexe, 36 Gewässer „Silbersee“ (SS): 5 Gewässerkomplexe, 17 Gewässer „Hinterberg“ (HB): 8 Gewässerkomplexe, 65 Gewässer Abbildung 4.2 Untersuchungsgewässer (n = 118) und Gewässerkomplexe (n = 19) in den drei Teilgebieten. Karte erstellt im FIS der TLUG. Kartengrundlage: Geobasisdaten des Thür. Landesamtes für Vermessung und Geoinformation. 28 Ergebnisse Die meisten der Untersuchungsgewässer waren Tümpel (Abbildung 4.3). In der Fläche HB befanden sich, im Vergleich zu den anderen Teilflächen, anteilsmäßig die meisten Gräben (34 %). Die Fläche ZI wies mit 33 % vergleichsmäßig viele Fahrspuren auf. Auf der Fläche SS befand sich ein Gewässer im Quellgebiet. Zirkel (ZI) Hinterberg (HB) 3% n=1 34% n = 22 Tümpel Fahrspur Graben 42% n = 27 33% n = 12 Tümpel 64% n = 23 Pfütze 17% n = 11 Fahrspur 8% n=5 Graben Silbersee (SS) 6% n=1 6% n=1 Tümpel Pfütze Fahrspur Graben 18% n=3 6% n=1 Quellgebiet 65% n = 11 Abbildung 4.3 Übersicht der Gewässertypen und deren Anteile an der Gesamtzahl der Untersuchungsgewässer der drei Teilflächen (HB: n = 65, ZI: n = 36, SS: n = 17). 29 Ergebnisse 4.2 Populationsstruktur 4.2.1 Fang-und Individuenzahlen Innerhalb des Untersuchungszeitraumes konnten 517 Gelbbauchunken gefangen werden (Tabelle 4.1). Durch die Auswertung der Bauchmuster wurden 334 GelbbauchunkenIndividuen identifiziert. Davon waren 152 Tiere adult (108 ♂♂, 44 ♀♀) und vier subadult. Zusätzlich wurden 178 juvenile Tiere kurz nach der Metamorphose aufgenommen. Diese wurden im Folgenden jedoch nur dann berücksichtigt, wenn die erhobenen Daten von Interesse waren (Abschnitt 4.2.3, 4.4). Tabelle 4.1 Anzahl der Fänge und Individuenzahlen für weibliche, männliche, subadulte und juvenile Gelbbauchunken in den drei Untersuchungsflächen. Gesamt HB SS ZI Individuen 334 296 38 0 (Fänge) 517 460 57 0 Adulte 152 128 24 0 (Fänge) 333 291 42 0 ♂♂ 108 93 15 0 (Fänge) 244 221 23 0 ♀♀ 44 35 9 0 (Fänge) 89 70 19 0 Subadulte 4 3 1 0 (Fänge) 6 4 2 0 Juvenile 178 165 13 0 (Fänge) 178 165 13 0 Betrachtet man nur die adulten Gelbbauchunken, war die Präsenz der Tiere im Juli am höchsten (161 Fänge) (Abbildung 4.4). In den Monaten Juni und Juli wurden in der Summe 61 % aller Fänge durchgeführt. Im Mai und im August wurden mit jeweils 43 Fängen wesentlich weniger Gelbbauchunken gefangen. Im September konnte nur noch 7-mal ein Tier gefangen werden. 30 Anzahl Fänge Ergebnisse 140 130 120 110 100 90 80 70 60 50 40 30 20 10 0 Männchen ♂♂ 124 Weibchen ♀♀ 58 37 31 29 23 14 12 5 Mai Juni Juli August 2 September Abbildung 4.4 Anzahl der Fänge weiblicher und männlicher Tiere verteilt auf die Monate Mai bis September (n = 335). Wiederfänge Von den 156 adulten und subadulten Individuen wurden 49 % (n = 76) wiedergefangen. Etwa die Hälfte der Tiere (51%, n = 80) wurde lediglich 1-mal im Untersuchungszeitraum gefangen. Von den weiblichen Tieren konnten 45 % wiedergefangen werden (n = 20 von 44), von den männlichen Tieren 52 % (n = 56 von 108). Die vier subadulten Tiere wurden alle nur 1-mal gefangen. Die Fanghäufigkeiten der beiden Geschlechter reichten von einem Fang bis zu 10 Fängen innerhalb des Untersuchungszeitraumes (Tabelle 4.2, Abbildung 4.5). Das am häufigsten gefangene Tier war ein Weibchen. Im Schnitt wurden männliche Tiere 2.3-mal gefangen und weibliche Tiere 2.0-mal. Die Fanghäufigkeiten beider Geschlechter unterschieden sich nicht signifikant voneinander (Test of equal proportions: X² = 0.511, df = 1, p > 0.05). Die detaillierten Fanghistorien der 156 adulten und subadulten Individuen können dem Anhang B entnommen werden. Tabelle 4.2 Fanghäufigkeiten (FH) der männlichen, weiblichen und subadulten Gelbbauchunken (n = 156) FH 1x 2x 3x 4x 5x 6x 7x 8x 9x 10x ♂♂ ♀♀ 52 23 11 8 9 3 3 1 0 0 24 9 5 3 2 0 0 0 0 1 Subadulte 4 0 0 0 0 0 0 0 0 0 31 Ergebnisse 90 80 80 70 Individuenzahl 60 50 40 32 30 20 15 11 11 10 2 3 6 7 1 0 1 8 9 10 0 1 2 3 4 5 Zahl der Fänge pro Individuum Abbildung 4.5 Fanghäufigkeiten der adulten und subadulten Individuen (n = 156, Zahl der Fänge = 339) 4.2.2 Populationsgröße und Überlebensraten Auf Grundlage der kumulativen Berechnungsmethode lag die Mindestgröße der betrachteten Gelbbauchunkenpopulation bei 156 Tieren, was der Anzahl der Erstfänge im gesamten Untersuchungsgebiet entsprach (Tabelle 4.3). Tabelle 4.3 Erst- und Wiederfangzahlen der adulten und subadulten Gelbbauchunken in den Teilflächen HB_1, HB_2 und SS. Fangtage Erstfänge Wiederfänge Gesamtfänge (FT) (EF) (WF) (GF) EF/FT WF/FT GF/FT HB_1 12 116 161 277 9.7 13.42 14.75 HB_2 8 15 3 18 1.88 0.38 2.25 SS 9 25 19 44 2.78 2.11 4.89 156 183 339 Gesamt Mithilfe der Schätzmethode aus dem Programm „Capture“ konnte eine aktuelle Populationsgröße von 262 ± 24 Tieren berechnet werden. Hierfür wurden die geschätzten Populationsgrößen der drei Teilbereiche HB_1, HB_2 und SS addiert (Tabelle 4.4). Der Gesamtstandardfehler wurde nach dem Gauß‘schen Fehlerfortpflanzungsgesetz aus den Standardfehlern der Schätzwerte der einzelnen Bereiche berechnet. Für den Teilbereich ZI konnte keine Populationsgröße geschätzt werden, da keine Gelbbauchunken registriert wurden. Die durchschnittlich geschätzte Fangwahrscheinlichkeit betrug 0.11, also 11 %. Eine 32 Ergebnisse relativ hohe Präzision der Schätzwerte in Tabelle 4.4 lässt sich an den vergleichsweise geringen Standardfehlern und den engen Vertrauensbereichen erkennen. Tabelle 4.4 Schätzwerte nach „Capture“ für die Populationsgröße (N) und die Fangwahrscheinlichkeit (P), inklusive Standardfehler (SEM) und 95 % Konfidenzintervall (CI). bestes Modell N SEM 95% CI P SEM 95% CI HB_1 M(th) 179 19 152 - 228 0.13 0.02 0.08 - 0.18 HB_2 M(h) 52 13 34 - 89 0.04 - - SS M(t) 31 3 27 - 41 0.16 0.03 0.09 - 0.22 262 24 0.11 0.04 Gesamt Die passenden Modelle waren die Modelle M(t) für Zeit, M(h) für Heterogenität und deren Kombinationsmodell M(th). Die Wahl des Modelles M(t) deutete darauf hin, dass sich die Fangwahrscheinlichkeit der Tiere mit der Zeit änderte, beziehungsweise zwischen den einzelnen Fangtagen unterschied. Das Modell M(h) zeigte, dass sich die einzelnen Individuen in ihrer Wahrscheinlichkeit gefangen zu werden unterschieden. Die Ergebnisse der „Goodness-of-fit“-Tests, auf denen die Auswahl der drei Modelle beruhte, können dem Anhang C entnommen werden. Die Populationsgröße, welche nach der Jolly-Seber-Methode geschätzt wurde, lag mit insgesamt 91 ± 29 Tieren unterhalb der Mindestpopulationsgröße für das Untersuchungsgebiet (Tabelle 4.5). Für den Teilbereich HB_2 konnte im Programm „Jolly“ keine Schätzung durchgeführt werden. Es ergaben sich im Programm lediglich zwei gültige Werte. Die detaillierten Schätzwerte sowie die Ergebnisse der „Goodness-of-Fit“-Tests sind in dem Anhang C zu finden. Tabelle 4.5 Schätzwerte nach „Jolly“ für die Populationsgröße (N) und die Fangwahrscheinlichkeit (P), inklusive Standardfehler (SEM) und 95 % Konfidenzintervall (CI) HB_1 bestes Modell N SEM 95% CI P SEM 95% CI B 70 23 24 - 116 0.35 0.08 0.19 - 0.51 HB_2 - - - - - - - SS D 21 17 13 - 55 0.23 0.07 0.09 - 0.37 91 29 0.24 0.11 Gesamt Ausgehend von der Populationsgrößenschätzung des Programmes „Capture“ (n = 262 Unken) konnte ich durch meine Fangmethode, bezogen auf die Adulti, 58 % der vorhandenen Gelbbauchunken im Untersuchungsgebiet fangen (n = 152). Die Anzahl registrierter Individuen pro Monat ergab folgende Anteile an der Gesamtpopulation: 33 Anteil von berechneter Gesamtpopulation N [%] Ergebnisse 45 38,9 40 35 30 26,0 25 20 15 14,1 13,4 10 5 2,7 0 Mai Juni Juli August September n = 37 n = 68 n = 102 n = 35 n=7 Abbildung 4.6 Anzahl gefangener adulter Individuen pro Monat (n) und jeweiliger Anteil an der geschätzten Gesamtpopulation von 262 Tieren. Datenbeschriftungen der Anteile in %. Wiederfänge desselben Individuums innerhalb eines Monates wurden nicht einbezogen. Überlebensraten Mithilfe des Programmes „Jolly“ konnten Überlebensraten berechnet werden. Die durchschnittliche Überlebensrate (φ) der Adulten lag bei 0.768 (SEM 0.452). Mit einer Wahrscheinlichkeit von 76.8 % überlebte ein Tier demnach durchschnittlich von einem Fangtermin bis zum nächsten. Im Vergleich zur Populationsgröße sind Schätzwerte für Überlebensraten aus „Jolly“ robust gegenüber verletzten Grundannahmen und können auch dann genutzt werden (CAROTHERS, 1973; CORMACK, 1972). 4.2.3 Altersstruktur Die registrierten juvenilen Tiere machten mit 53 % den größten Anteil an der GesamtIndividuenzahl der Population aus. Der Anteil adulter Tiere lag bei 46 %. Da insgesamt nur vier subadulte Tiere registriert wurden, lag ihr Anteil bei lediglich 1 %. Die Alterszusammensetzung der Population änderte sich über die fünf Untersuchungsmonate (Abbildung 4.7). Der Anteil adulter Individuen fiel im Laufe der Untersuchungsmonate ab. Während im Monat Mai ausschließlich adulte Tiere registriert wurden, lag der Anteil adulter Tiere im September nur noch bei 4 % aller Individuen. Der Anteil juveniler Tiere stieg von 3 % im Juli auf 95 % im September an. Unter Einbeziehung der Juvenilen, welche gezählt, aber nicht individuell registriert wurden (Abschnitt 4.4), läge 34 Ergebnisse der Anteil dieser Altersgruppe noch deutlich höher. Außer im Monat Mai konnte in jedem Monat ein subadultes Tier registriert werden. Die Anteile beliefen sich auf unter 2 % der Gesamt-Individuenzahl. Anteil der Altersklassen an der GesamtIndividuenzahl adult subadult juvenil 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Mai Juni Juli August n = 37 n = 69 n = 106 n = 41 September n = 165 Abbildung 4.7 Verteilung der drei Altersklassen auf die Gesamt-Individuenzahl in den Monaten Mai bis September (n = 418). Wiederfänge desselben Individuums innerhalb eines Monates wurden nicht einbezogen. 4.2.4 Geschlechterverhältnis Mit 108 gefangenen Männchen und 44 Weibchen ergab sich ein Geschlechterverhältnis (♂♂/♀♀) von 2.45 zu Gunsten der Männchen. Der Männchenanteil lag bei 71 %, der der Weibchen bei 29 %. In allen fünf Untersuchungsmonaten wurden mehr männliche als weibliche Individuen gefangen (Abbildung 4.8). Es gab nur eine geringfügige Schwankung. Der höchste Männchenanteil wurde im Juni festgestellt (74 %), der geringste im Mai (70 %). 35 Ergebnisse Männchen ♂♂ Weibchen ♀♀ September 5 2 August 25 10 Juli 73 Juni 29 50 Mai 18 26 0% 10% 20% 30% 40% 50% 60% 70% 11 80% 90% 100% Relative Häufigkeit der Geschlechter Abbildung 4.8 Geschlechterverteilung der adulten Individuen in den Monaten Mai bis September (n = 249). 4.2.5 Körpergrößen und Körpergewichte Methodenvergleich Die Kopf-Rumpf-Längen (KRL) der Gelbbauchunken wurden, wie in Abschnitt 3.2.5 beschrieben, durch zwei Methoden bestimmt. Die Ergebnisse der einzelnen Messungen eines Individuums wurden gemittelt, sodass pro Individuum nur ein Wert in die Auswertung einfloss. Die gemessenen Kopf-Rumpf-Längen unterschieden sich signifikant zwischen den beiden Methoden PC und Schieblehre (SchL) (gepaarter Mann-Whitney-U Test: V = 10420, p < 0.001, n = 304). Der Mittelwert der KRL der PC-Messung war mit 41.7 ± 4.5 mm (33.6 51.5 mm, n = 152) größer, als der Mittelwert der KRL der Schieblehren-Messung mit 38.9 ± 4.1 mm (30.0 - 48.0, n = 152). Ein separater Vergleich männlicher und weiblicher Gelbbauchunken ergab dasselbe Bild. Die ermittelten KRL beider Methoden unterschieden sich für beide Geschlechter signifikant (gepaarter Mann-Whitney-U Test: ♂♂ V = 5383, p < 0.001, n = 216; ♀♀ V = 836, p < 0.001, n = 88) (Abbildung 4.9). Die ermittelten Mediane und Mittelwerte beider Geschlechter waren bei der PC-Messung größer als bei der Schieblehren-Messung (Tabelle 4.6). 36 Ergebnisse Tabelle 4.6 Ermittelte Kopf-Rumpf-Längen (KRL) der adulten Gelbbauchunken mit den beiden Methoden PC und Schieblehre (SchL). Aufgeführt sind die Mittelwerte (MW), Standardabweichungen (sd), Mediane, Minima (Min) und Maxima (Max) sowie die Stichprobengrößen (n). KRL [mm] ♂♂ ♀♀ Methode MW SD Median Min - Max n PC 41.34 4.19 40.24 33.66 - 51.49 108 SchL 38.24 3.54 38.25 30.10 - 46.20 108 PC 42.62 5.00 42.32 33.97 - 51.52 44 SchL 40.63 4.94 41.23 30.00 - 48.00 44 Männchen Weibchen Abbildung 4.9 Vergleich der ermittelten Kopf-Rumpf-Längen für Männchen und Weibchen zwischen den beiden Messverfahren PC und Schieblehre (SchL). Abgebildet sind die Mediane (♂♂: PC = 40.2 mm, n = 108; SchL = 38.3 mm, n = 108; ♀♀: PC = 42.3 mm, n = 44; SchL = 41.2 mm, n = 44) und Quartile der KRL. Gepaarter Mann-Whitney-U-Test: *** = p < 0.001. Für die folgenden Auswertungen nutzte ich die Kopf-Rumpf-Längen, welche mittels der PC-Auswertung bestimmt wurden. Die Gründe hierfür werden in der Diskussion (Abschnitt 5.1) näher erläutert. Größen und Gewichte Die weiblichen Gelbbauchunken waren signifikant schwerer als die männlichen (MannWhitney-U Test: W = 0.960, p < 0.001, n = 137). Hinsichtlich der Kopf-Rumpf-Länge unterschieden sich die Geschlechter nicht signifikant (Mann-Whitney-U Test: W = 2744, p > 0.05, n = 152) (Abbildung 4.10). Die 108 männlichen Gelbbauchunken hatten eine durchschnittliche Kopf-RumpfLänge von 41.34 ± 4.19 mm (33.66 - 51.49 mm, n = 108) und ein Körpergewicht von durchschnittlich 5.8 ± 1.4 g (3.3 - 8.6 g, n = 98) (Tabellen 4.6, 4.8). Weibliche Tiere waren durchschnittlich 42.62 ± 5.00 mm groß (33.97 - 51.52 mm, n = 44) und wogen im Schnitt 6.7 37 Ergebnisse ± 1.9 g (3.0 - 9.6 g, n = 39) (Tabellen 4.6, 4.8). Weibchen waren somit durchschnittlich 1.28 mm größer und 0.9 g schwerer als Männchen. Die Spannweite der Messwerte für die KopfRumpf-Länge betrug bei den Weibchen 17.55 mm und bei den Männchen 17.83 mm. Die Spannweite des Körpergewichtes war bei den Weibchen mit 6.6 g größer, als bei den Männchen mit 5.3 g. Obwohl insgesamt weitaus weniger weibliche Tiere gefangen wurden, war die Streuung der Gewichtsdaten bei den Weibchen höher. Die vier subadulten Individuen hatten eine durchschnittliche Größe von 26.54 ± 6.38 mm (19.80 - 35.17 mm, n = 4) und wogen im Mittel 1.9 ± 0.8 g (1.0 - 3.0 g, n = 4) (Tabellen 4.7, 4.8). Die frisch metamorphosierten Jungtiere besaßen Größen zwischen 13.30 mm und 24.50 mm mit einem Mittelwert von 15.9 ± 1.68 mm (13.30 - 24.50 mm, n = 178). Das durchschnittliche Gewicht dieser Tiere lag bei 0.4 ± 0.15 g (0.2 - 1.6 g, n = 178). Tabelle 4.7 Mittlere Kopf-Rumpf-Längen (KRL) der subadulten und juvenilen Individuen (n = 182). Abgebildet sind die Mittelwerte (MW), Standardabweichungen (sd), Mediane, Minima (Min) und Maxima (Max) sowie die Stichprobengrößen (n). KRL wurden in AmphIdent bestimmt. KRL der Adulten in Tabelle 4.6 (PC) KRL [mm] MW sd Median Min - Max n Subadulte 26.54 6.38 25.6 19.80 - 35.17 4 Juvenile 15.90 1.68 15.6 13.30 - 24.50 178 Tabelle 4.8 Mittlere Körpergewichte (KG) aller gewogenen Individuen (n = 319). Abgebildet sind die Mittelwerte (MW), Standardabweichungen (sd), Mediane, Minima (Min) und Maxima (Max) sowie die Stichprobengrößen (n). KG [g] MW sd Median Min - Max n ♂♂ 5.8 1.4 5.7 3.3 - 8.6 98 ♀♀ 6.7 1.9 6.5 3.0 - 9.6 39 Subadulte 1.9 0.8 1.9 1.0 - 3.0 4 Juvenile 0.4 0.2 0.4 0.2 - 1.6 178 38 Ergebnisse Abbildung 4.10 Mittlere Kopf-Rumpf-Längen (links) und Körpergewichte (rechts) der juvenilen, subadulten und adulten (♂♂,♀♀) Gelbbauchunken. Abgebildet sind die Mediane (KRL: juvenil = 15.6 mm, n = 178; subadult = 25.6 mm, n = 4; ♂♂ = 40.2 mm, n = 108; ♀♀ = 42.3 mm, n= 44; KG: juvenil = 0.4 g, n = 178; subadult = 1.9 g, n = 4; ♂♂ = 5.7 g, n = 98; ♀♀ = 6.5 g, n = 39) und Quartile der beiden Parameter. Die Breite der Boxplots spiegelt die Stichprobengröße der Gruppe wieder. Mann-Whitney-U Test: *** = p < 0.001. 39 Ergebnisse Unterscheiden sich die Körpergrößen und Körpergewichte der Gelbbauchunken zwischen den Teilflächen? Es ist bekannt, dass sich die Körpergrößen und –gewichte von Amphibien zwischen Populationen je nach geografischer Lage, sowie Habitattyp- und qualität unterscheiden können (WELLS, 2007). Lokale Unterschiede innerhalb einer (Meta-)Population wurden hingegen selten gefunden. Daher habe ich die Parameter Kopf-Rumpf-Länge und Körpergewicht für die beiden Teilflächen HB und SS zusätzlich separat untersucht. Adulte Gelbbauchunken waren im Teilgebiet SS größer und schwerer, als im Teilgebiet HB (Tabelle 4.9 und 4.10). Dies galt für beide Geschlechter. Weibliche Gelbbauchunken waren im Teilgebiet SS im Schnitt 2.8 mm größer und 1.08 g schwerer, als im Teilgebiet HB. Männliche Gelbbauchunken im Teilgebiet SS waren durchschnittlich 0.4 mm größer und 0.85 g schwerer, als männliche Tiere im Gebiet HB. Ein statistischer Vergleich der beiden Gebiete ergab einen signifikanten Unterschied für die Körpergewichte der Männchen (Mann-Whitney-U Test: W = 330, p < 0.05, n = 98), jedoch keinen für die Weibchen (Abbildung 4.11). Die Kopf-Rumpf-Längen unterschieden sich nicht signifikant zwischen den Gebieten. Tabelle 4.9 Mittlere Kopf-Rumpf-Längen (KRL) beider Geschlechter in den beiden Gebieten HB und SS. Abgebildet sind die Mittelwerte (MW), Standardabweichungen (sd), Mediane, Minima (Min) und Maxima (Max) sowie die Stichprobengrößen (n). KRL wurden in AmphIdent bestimmt. KRL [mm] Fläche MW sd Median Min - Max n ♂♂ HB 40.4 4.0 39.8 31.5 - 50.0 93 SS 40.8 5.6 41.4 32.0 - 56.0 15 ♀♀ HB 41.6 4.6 41.1 33.8 - 52.4 35 SS 44.4 5.8 42.5 34.0 - 53.9 9 Tabelle 4.10 Mittlere Körpergewichte (KRL) beider Geschlechter in den beiden Gebieten HB und SS. Abgebildet sind die Mittelwerte (MW), Standardabweichungen (sd), Mediane, Minima (Min) und Maxima (Max) sowie die Stichprobengrößen (n). KG [g] Fläche MW sd Median Min - Max n ♂♂ HB 5.45 1.4 5.6 3.0 - 9.2 85 SS 6.30 1.6 6.8 3.2 - 8.9 13 ♀♀ HB 6.42 1.6 6.4 3.0 - 9.3 30 SS 7.50 1.7 7.8 3.7 - 9.7 9 40 Ergebnisse Männchen Weibchen Abbildung 4.11 Vergleich der mittleren Körpergewichte zwischen den Teilflächen HB und SS für männliche und weibliche Gelbbauchunken. Abgebildet sind die Mediane (♂♂: HB = 5.6 g, n = 85; SS = 6.8 g, n = 13; ♀♀: HB = 6.4 g, n = 30; SS = 7.8 g, n = 9) und Quartile der Körpergewichte. MannWhitney-U-Test: * = p < 0.05. Betrachtet man die Verteilung der Kopf-Rumpf-Längen der adulten Tiere auf 10 Größenklassen in einem Diagramm (Abbildung 4.12), so erkennt man jeweils zwei Gipfel für beide Geschlechter. Als Gipfel wird hierbei ein Bereich der Größenklassen bezeichnet, in dem die Individuenzahlen besonders hoch sind. Für Männchen lagen die Gipfel zwischen 36 mm und 40 mm und zwischen 42 mm und 46 mm. Bei den Weibchen waren die Gipfel weniger deutlich, was bedeutet, dass sich die Größen der Weibchen homogener auf die 10 Größenklassen verteilten. Der erste Gipfel der Weibchen lag zwischen 36 mm und 40 mm, der zweite zwischen 46 mm und 48 mm. Für die Verteilung der Körpergewichte war ein ähnliches Bild erkennbar (Abbildung 4.13). Auch hier zeigten die Männchen zwei deutliche Gipfel. Der erste befand sich zwischen den Gewichten 4 g und 5 g und der zweite zwischen den Gewichten 5.5 g und 7.5 g. Die Gewichte der Weibchen waren auch in diesem Fall homogener verteilt. Die Gewichtsklassen 5.5 g bis 6 g und die Gewichtsklassen zwischen 8 g und 9.5 g wiesen besonders hohe Individuenzahlen auf. 41 Ergebnisse Männchen Weibchen Individuenzahl 25 20 15 10 5 0 -34 -36 -38 -40 -42 -44 KRL [mm] -46 -48 -50 -52 Abbildung 4.12 Verteilung der Kopf-Rumpf-Längen (KRL) der vermessenen adulten Gelbbauchunken (n = 152) auf Größenklassen. Beschriftungen der X-Achse geben die Obergrenzen der Klassen an. Männchen 18 Weibchen 16 Individuenzahl 14 12 10 8 6 4 2 0 -3,5 -4 -4,5 -5 -5,5 -6 -6,5 -7 -7,5 Körpergewicht [g] -8 -8,5 -9 -9,5 -10 Abbildung 4.13 Verteilung der Körpergewichte (KG) der gewogenen adulten Gelbbauchunken (n = 137) auf Gewichtsklassen. Beschriftungen der X-Achse geben die Obergrenzen der Klasse an. Die aufgenommenen Parameter Kopf-Rumpf-Länge und Körpergewicht wurden innerhalb der beiden Geschlechter auf eine Korrelation hin untersucht (Spearman Rangkorrelationstest). Für beide Geschlechter konnte eine stark positive Korrelation nachgewiesen werden (Abbildung 4.14). Der Zusammenhang der Korrelation war bei den Weibchen (rho = 0.83, n = 39), wie auch bei den Männchen (rho = 0.70, n = 98), mit einer Irrtumswahrscheinlichkeit von p < 0.001 hoch signifikant. 42 Ergebnisse Abbildung 4.14 Korrelation der Kopf-Rumpf-Längen mit den Körpergewichten bei Weibchen und Männchen. Spearman-Rangkorrelation: Weibchen: rho = 0.83, p < 0.001, n = 39; Männchen: rho = 0.70, p < 0.001, n = 98 Wachstum Die Kopf-Rumpf-Längen und Körpergewichte der adulten Unken waren zu Beginn der Saison, im Mai und Juni, am geringsten und stiegen ab Juli stetig an (Abbildung 4.15, 4.16). Männchen wuchsen innerhalb der Saison durchschnittlich 1.9 mm, von im Mittel 37.2 mm im Mai auf 39.1 mm im September. Sie nahmen in diesem Zeitraum um rund 0.7 g an Gewicht zu. Weibliche Tiere wuchsen im Schnitt um 1.2 mm, von durchschnittlich 40.1 mm im Mai auf 41.3 mm im September und nahmen um 1.5 g an Gewicht zu. 43 Ergebnisse Männchen ♂♂ Weibchen ♀♀ Kopf-Rumpf-Länge [mm] 44 42 40 38 36 34 32 Mai Juni Juli August September Abbildung 4.15 Monatlich gemittelte Kopf-Rumpf-Längen der adulten Gelbbauchunken über die Saison. Stichprobengröße: Mai: ♂♂ = 30, ♀♀ = 12; Juni: ♂♂ = 56, ♀♀ = 24; Juli: ♂♂ = 124, ♀♀ = 38; August: ♂♂ = 30, ♀♀ = 14, September: ♂♂ = 5, ♀♀ = 2 Männchen ♂♂ Weibchen ♀♀ Körpergewicht [g] 8 7 6 5 4 3 Juni Juli August September Abbildung 4.16 Monatlich gemittelte Körpergewichte der adulten Gelbbauchunken über die Saison. Stichprobengröße: Mai: ♂♂ = 30, ♀♀ = 12; Juni: ♂♂ = 56, ♀♀ = 24; Juli: ♂♂ = 124, ♀♀ = 38; August: ♂♂ = 30, ♀♀ = 14, September: ♂♂ = 5, ♀♀ = 2 Lässt der Gewichtsverlauf einzelner Individuen Rückschlüsse auf die Laichaktivität zu? Exemplarisch wurde der Gewichtsverlauf von vier männlichen und drei weiblichen Individuen untersucht (Abbildung 4.17, 4.18). Auch hier wurde ein genereller Trend der Gewichtszunahme über die Saison deutlich. Die ermittelten Gewichte bei dem ersten Fang waren bei allen sieben Individuen niedriger als bei dem letzten Fang. Männliche Gelbbauchunken zeigten keine starken Gewichtsschwankungen über die Zeit (Abbildung 4.17). Alle vier Tiere nahmen stetig leicht an Gewicht zu. Eine durch vermehrte Rufaktivität bedingte Gewichtsabnahme während der Laichperioden konnte nicht nachgewiesen werden. Lediglich die Unke RU00009 nahm während der letzten beiden Laichperioden leicht ab. 44 Ergebnisse 8 Körpergewicht [g] 7 6 5 RU00008 4 RU00009 3 RU00010 2 RU00039 1 0 15.05.14 15.06.14 16.07.14 16.08.14 Abbildung 4.17 Körpergewichte von vier männlichen Gelbbauchunken (RU00008, RU00009, RU00010, RU00039) zum Zeitpunkt der jeweiligen Fänge im Zeitraum vom 15. Mai - 11. September. Fangzahlen: RU00039 = 5-mal; RU00008, RU00009, RU00010 = 6-mal. Orange Balken stellen Laichund Rufperioden dar. Bei den Weibchen waren stärkere Gewichtsschwankungen zu erkennen. Alle drei Individuen zeigten eine Gewichtszunahme zwischen der vierten und fünften Laichperiode (Abbildung 4.18). Die Unke RU00007 zeigte einen Gewichtsverlust zwischen dem ersten Fangereignis (07. Juni, zweite Laichperiode) und dem zweiten (12. Juni, dritte Laichperiode). Innerhalb von fünf Tagen verlor dieses Tier um 0.8 g an Gewicht. Eine zweite Gewichtsabnahme zeigte dieses Tier vor und nach der fünften Laichperiode. Nach der Laichperiode wog das Tier 0.5 g weniger als zuvor. Die Unke RU00034 zeigte eine solche Gewichtsabnahme in der vierten Laichperiode. Kurz vor der Laichperiode (08. Juli) wog das Tier 0.3 g mehr als drei Tage später innerhalb der Laichperiode. Körpergewicht [g] 9 8 7 RU00007 RU00032 RU00034 6 5 4 15.05.14 15.06.14 16.07.14 16.08.14 Abbildung 4.18 Körpergewichte von drei weiblichen Gelbbauchunken (RU00007, RU00032, RU00034) zum Zeitpunkt der jeweiligen Fänge im Zeitraum vom 15. Mai - 11. September. Fangzahlen: RU00007 = 8-mal; RU00032, RU00034 = 5-mal. Orange Balken stellen Laich- und Rufperioden dar. 45 Ergebnisse 4.3 Ortsbeziehungen 4.3.1 Dispersion Die räumliche Verteilung der Gelbbauchunken-Individuen im Untersuchungsgebiet war stark „geklumpt“ (Abbildung 4.19). Die meisten Gelbbauchunken hielten sich im Teilgebiet HB auf. Mit insgesamt 296 Individuen konnten hier 86 % aller Unken registriert werden (128 Adulte, drei Subadulte, 165 Juvenile). Auf der Fläche SS wurden 24 Adulte und ein subadultes Tier, sowie 13 juvenile Tiere gefangen. Im Teilgebiet ZI konnten trotz intensiver Suche und wöchentlicher Begehungen keine Gelbbauchunken nachgewiesen werden. Die Anzahl und Funktion der besiedelten Gewässer in den Teilflächen werden in Abschnitt 4.5.2 näher erläutert. Abbildung 4.19 Dispersion der Gelbbauchunken im Untersuchungsgebiet. Gelbbauchunken-Nachweis (gelb, n = 58), Gewässer ohne Nachweis (rot, n = 60) Gewässer mit 46 Ergebnisse 4.3.2 Ortstreue Für die Betrachtung der Ortstreue wurden die mehrfach gefangenen Individuen (n = 77), wie in Abschnitt 3.2.7 erklärt, in die drei Kategorien „a“, „b“ und „c“ eingeteilt. Von den wiedergefangenen Individuen wurden 33 % (n = 25) stets in demselben Gewässer gefangen (Kategorie „a“) (Abbildung 4.20). Der Anteil der weiblichen Tiere in dieser Kategorie war mit 52 % (n = 11) doppelt so hoch wie der der Männchen (25 %, n = 14) (Abbildung 4.20). Acht der 11 weiblichen Tiere aus dieser Kategorie (73 %) wurden in Reproduktionsgewässern gefangen. Der überwiegende Teil wiedergefangener Tiere gehörte der Kategorie „b“ an (n = 48, 62 %). Diese Tiere wechselten zwischen den Gewässern, verließen den Gewässerkomplex jedoch nicht. Sie bewegten sich demnach in der näheren Umgebung fort. Die nähere Umgebung hing hierbei von den Größen der Gewässerkomplexe ab, welche zwischen 26 ha und maximal 31 ha lagen. Dieser Kategorie gehörten 70 % (n = 39) der Männchen und 43 % (n = 9) der Weibchen an. Bei der Hälfte dieser Tiere (n = 25, 52 %) wurde ein Pendeln zwischen Aufenthaltsgewässern und Reproduktionsgewässern nachgewiesen. Die andere Hälfte wechselte ausschließlich zwischen verschiedenen Reproduktionsgewässern. Von den Männchen dieser Kategorie wurden 72 % in mindestens zwei verschiedenen Reproduktionsgewässern gefangen. Lediglich vier Individuen wurden in zwei verschiedenen Gewässerkomplexen registriert (5 %) und gehörten insofern Kategorie „c“ an. Drei dieser Tiere waren Männchen, eines ein Weibchen. Das Weibchen (RU00040) und eines der Männchen (RU00039) wechselten vom Gewässerkomplex 5 in die 6 und legten Strecken von 225 m (♀♀) und 281 m (♂♂) zurück. Ein anderes Männchen (RU00018) wechselte vom Gewässerkomplex 1 in die 2 und wanderte 381 m. Das dritte Männchen (RU00076) wechselte vom Komplex 19 in die 1 (303 m). Bis auf ein Individuum verblieben alle Tiere in ihren neu gewählten Gewässerkomplexen und wurden dort mehrfach wiedergefangen. Das Männchen RU00076 kehrte nach einmaligem Fang in dem neu gewählten Gewässerkomplex in seinen Ursprungskomplex zurück. Angelehnt an MÖLLER (1992) galten die Kategorien „a“ und „b“ als ortstreu. 95 % der wiedergefangen Tiere (n = 73) im Untersuchungsgebiet waren folglich ortstreu. Da alle subadulten Gelbbauchunken lediglich 1-mal gefangen wurden, kann zu der Ortstreue dieser Altersklasse keine Aussage getroffen werden. 47 Ergebnisse 5% n=4 33% n = 25 Kategorie a Kategorie b 62% Kategorie c n = 48 Weibchen ♀♀ Männchen ♂♂ 5% n=3 5% n=1 25% n = 14 70% n = 39 52% n = 11 43% n=9 Abbildung 4.20 Individuenzahlen der Kategorien „a“, „b“ und „c“ (n) und deren prozentuale Anteile an der Gesamtzahl wiedergefangener Gelbbauchunken (n = 77). 4.3.3 Aktionsdistanzen und Wanderstrecken Für die Individuen der Kategorien „b“ und „c“ (n = 52) konnten Aktionsdistanzen und Wanderstrecken berechnet werden (Tabelle 4.11). Wurde ein Tier nur 1-mal wiedergefangen, entsprach die Wanderstrecke der Aktionsdistanz. Die mittlere Aktionsdistanz der Weibchen war mit 75 m (18 - 225 m, n = 10) um 8 % (6 m) größer, als die der Männchen mit 69 m (11 - 381 m, n = 42). Die Weibchen zeigten außerdem mit durchschnittlich 114 m (18 - 275 m, n = 10) eine größere Wanderstrecke, als die Männchen mit 101 m (14 - 606 m, n = 42). Die Unterschiede zwischen den Geschlechtern waren statistisch jedoch nicht signifikant (Mann-Whitney-U Test, Aktionsdistanz: W = 237, p > 0.05, n = 52, Wanderstrecke: W = 238, p > 0.05, n = 52) (Abbildung 4.21). Die minimalen und maximalen Aktionsdistanzen und Wanderstrecken wurden von männlichen Tieren zurückgelegt. Die bereits genannte Gelbbauchunke RU00018 hatte mit 381 m die größte Aktionsdistanz. Die Gelbbauchunke RU00076, welche nach ihrem 48 Ergebnisse Komplexwechsel in ihren Ursprungsgewässerkomplex zurückkehrte, legte mit insgesamt 606 m die längste Wanderstrecke zurück. Tabelle 4.11 Mittlere Aktionsdistanzen und Wanderstrecken für wiedergefangene männliche und weibliche Gelbbauchunken (n = 52). Abgebildet sind die Mittelwerte (MW), Standardabweichungen (sd), Mediane, Standardfehler (SEM), Minima (Min) und Maxima (Max) sowie die Stichprobengrößen (n). Hohe sd erklären sich durch starke Unterschiede zwischen den Individuen. Aktionsdistanz [m] ♂♂ ♀♀ MW 69 sd 76 Median 46 SEM 12 Min - Max 11 - 381 n 42 75 63 54 20 18 - 225 10 101 118 65 18 14 - 606 42 114 91 97 29 18 - 275 10 Wanderstrecke [m] ♂♂ ♀♀ Abbildung 4.21 Vergleich der Aktionsdistanzen (links) und Wanderstrecken (rechts) der wiedergefangenen Männchen (n = 42) und Weibchen (n = 10). Abgebildet sind die Mediane (Aktionsdistanzen: ♀♀ 54 m, n = 10; ♂♂ 46 m, n = 42; Wanderstrecken: ♀♀ 97 m, n = 10; ♂♂ 65 m, n = 42) und Quartile der beiden Parameter. Die überwiegende Zahl der Männchen legte Aktionsdistanzen zwischen 1 m und 50 m (Abbildung 4.22) und Wanderstrecken zwischen 1 m und 100 m zurück (Abbildung 4.23). Ein geringer Teil der männlichen Individuen zeigte Aktionsdistanzen über 150 m oder wanderte Strecken über 200 m. Die Hälfte der weiblichen Tiere zeigte ebenfalls Aktionsdistanzen zwischen 1 m und 50 m. Die andere Hälfte legte Distanzen zwischen 51 m und 250 m zurück. Ein ähnliches Bild zeigt sich auch bei den Wanderstrecken der Weibchen. Rund die Hälfte der Weibchen wanderte insgesamt weiter als 50 m. 49 Ergebnisse Weibchen Männchen 25 Individuenzahl 20 15 10 5 0 0 -50 -100 -150 -200 -250 -300 -350 -400 Aktionsdistanz [m] Abbildung 4.22 Aktionsdistanzen der wiedergefangenen adulten Gelbbauchunken (n = 52). Beschriftungen der X-Achse geben die Obergrenzen der Klassen an. Weibchen Männchen 18 16 Individuenzahl 14 12 10 8 6 4 2 0 0 -50 -100 -150 -200 -250 -300 -350 -400 -450 -500 -550 -600 -650 Wanderstrecken [m] Abbildung 4.23 Wanderstrecken der wiedergefangenen adulten Gelbbauchunken (n = 52). Beschriftungen der X-Achse geben die Obergrenzen der Klassen an. Korrelierte die Länge der Wanderstrecke mit der Anzahl der Wiederfänge eines Individuums? Es war davon auszugehen, dass die Wanderstrecke eines Tieres mit der Anzahl seiner Fänge korrelierte. Ob es einen Zusammenhang beider Parameter gab, wurde durch einen Korrelationstest (Spearman-Rangkorrelationstest) untersucht. Hierbei stellte ich einen hoch signifikanten Zusammenhang zwischen beiden Parametern fest (rho = 0.57, p < 0.001, n = 52) (Anhang D). Diese positive Korrelation wurde auch bei einer separaten Untersuchung beider Geschlechter nachgewiesen. 50 Ergebnisse 4.4 Phänologie und Reproduktion Phänologie und witterungsbedingte Aktivität Die ersten adulten und subadulten Gelbbauchunken wurden am 21. Mai registriert. Mit einer mittleren Tagestemperatur von 20.4°C war dies der erste sehr warme Tag der Saison. Die Temperaturen in der Nacht blieben erstmals im Mai über 15°C (Abbildung 4.24). Sehr hohe Niederschlagsmengen von bis zu 25 mm (28. Mai) und bleibend warme Temperaturen führten ab Ende Mai zu vermehrten Fängen (Abbildung 4.24). In den folgenden Monaten wurden besonders an Tagen mit hohen Lufttemperaturen und einer hohen Luftfeuchtigkeit viele Individuen gefangen. Für beide Parameter konnte eine positive Korrelation mit der Anzahl gefangener Gelbbauchunken an den Begehungstagen festgestellt werden (SpearmanRangkorrelationstest: Lufttemperatur: rho = 0.25, p > 0.05, n = 34; Luftfeuchte: rho = 0.28, p > 0.05, n = 34). Diese waren allerdings nicht signifikant. Vom 01. bis 30. Juni fielen täglich durchschnittlich 1.3 mm Niederschlag, womit der Juni zu dem trockensten Monat der Saison wurde (Tabelle 4.12). Während dieser Trockenheit war die Aktivität der Unken minimal, weshalb wenige Individuen registriert wurden. Außerdem fanden in dieser Zeit kaum Laichablagen statt (Abbildung 4.25). Im Juli wurden, witterungsbedingt, die meisten Gelbbauchunken registriert. Die letzten Tiere konnte ich am 02. September fangen. Tabelle 4.12 Monatlich gemittelte Tages-Klimadaten für das Untersuchungsgebiet. Zeitraum der Messung: 01. Mai - 30. September. Monate Mai Juni Juli August September Niederschlagsmenge [mm] 4.5 1.3 4.8 4.3 2.0 Lufttemperatur [°C] 12.4 15.7 19.2 15.7 14.6 rel. Luftfeuchte [%] 80.7 77.1 78.3 81.8 91.3 51 Ergebnisse Unkenzahl Laichablage Maximaltemperatur Minimaltemperatur 35 35 30 30 25 20 20 15 10 15 Lufttemperatur [°C] Anzahl Unkenfänge 25 5 10 0 5 -5 0 01.05.14 -10 21.05.14 10.06.14 30.06.14 20.07.14 09.08.14 29.08.14 Abbildung 4.24 Gefangene adulte und subadulte Gelbbauchunken (n = 339), Laichperioden (= Rufperioden) sowie tägliche Minimal- und Maximaltemperaturen für den Zeitraum vom 01. Mai bis 15. September 2014. 52 Ergebnisse Unkenzahl Laichablage Niederschlag 35 50 45 30 Anzahl Unkenfänge 25 35 30 20 25 15 Niederschlag [mm] 40 20 15 10 10 5 5 0 01.05.14 0 21.05.14 10.06.14 30.06.14 20.07.14 09.08.14 29.08.14 Abbildung 4.25 Gefangene adulte und subadulte Gelbbauchunken (n = 339), Laichperioden (= Rufperioden) sowie tägliche Niederschlagsmengen für den Zeitraum vom 01. Mai bis 15. September 2014. 53 Ergebnisse Reproduktion Im Jahr 2014 konnten im Untersuchungsgebiet zwei Hauptlaichphasen mit fünf einzelnen Laichperioden abgegrenzt werden (Tabelle 4.13). Innerhalb dieser Zeit wurden insgesamt mindestens 4536 Eier abgelegt. Tabelle 4.13 Übersicht der Laichperioden im Untersuchungsgebiet im Jahr 2014. Datum Dauer [d] Anzahl abgelegter Eier 1 21.05. - 26.05 6 1188 2 04.06. - 07.06 4 444 3 12.06. - 13.06. 2 801 4 09.07. - 15.07. 7 1882 5 30.07. - 07.08 8 221 27 4536 Hauptlaichphase Laichperiode 1 2 Kräftige Niederschläge in der Woche vom 21. bis 26. Mai führten zu den ersten Laichablagen der Gelbbauchunken (Abbildung 4.26). In dieser ersten Laichperiode wurden mindestens 1188 Eier abgelegt. Die darauffolgenden 12 Tage waren niederschlagsarm, weshalb einige der genutzten Laichgewässer bereits am 10. Juni trocken fielen und deren Larven starben. Erneuter Niederschlag am Folgetag (11. Juni) löste die letzte JuniLaichperiode aus. Vom 12. Juni bis 07. Juli herrschte Trockenheit im Untersuchungsgebiet. Mit Ausnahme der Gewässer HB0271 und HB0039 und dem Gewässer im Quellgebiet (SS0061) trockneten alle Reproduktionsgewässer für mindestens 10 Tage aus. Dies hatte den Verlust der Reproduktion der ersten Hauptlaichphase (2433 Eier) zur Folge. Bis zu diesem Zeitpunkt waren nur an den Gewässern HB0079, HB0289 und HB0202 vereinzelt metamorphosierte Tiere registriert worden. Die nächsten ergiebigen Niederschläge fielen am 08. und 09. Juli (> 82 mm). Die Unken legten an den nachfolgenden sieben Tagen 1882 Eier (4. Laichperiode). Die letzte Laichperiode endete am 07. August. Im Juli, August und September fiel ausreichend Niederschlag, sodass die Laichgewässer nicht erneut austrockneten. 54 Ergebnisse Anzahl abgelegter Eier Niederschlag 1400 50 45 1200 1000 35 30 800 25 600 20 15 400 Niederschlag [mm] Anzahl abgelegter Eier 40 10 200 5 0 01.05.14 01.06.14 01.07.14 01.08.14 0 01.09.14 Abbildung 4.26 Anzahl abgelegter Eier (n = 4536) und tägliche Niederschlagsmengen im Zeitraum vom 01. Mai bis 01. September. Die meisten Eier wurden in den Gewässern der benachbarten Gewässerkomplexe 1 und 19 abgelegt (siehe Abbildung 4.2, 24 % in 1, 28 % in 19). Weitere 21 % aller Eier deponierten die Unken in den Gewässern des Komplexes 6. In dem Komplex 19 wurden fünf Gewässer zur Reproduktion genutzt, in den Komplexen 1 und 6 jeweils sechs Gewässer. Alle diese Komplexe befanden sich in der Teilfläche HB. Hier konnten 96 % der Eier gefunden werden. Von den 152 adulten Individuen wies ich 133 (88 %) mindestens 1-mal während der Laichperioden in einem Reproduktionsgewässer nach. Geht man davon aus, dass es sich hierbei um den Teil der Population handelte, welcher an der Reproduktion teilnahm, reproduzierten 92 % der Männchen (n = 99) und 77 % der Weibchen (n = 34). Der Anteil der Weibchen, welcher ausschließlich in Aufenthaltsgewässern gefangen wurde, lag mit 23 % über dem der Männchen (8 %). Dabei muss berücksichtigt werden, dass Individuen, welche nicht an der Reproduktion teilnahmen und sich daher eventuell an Land aufhielten, eine geringere Wahrscheinlichkeit hatten gefangen zu werden. Der reproduzierende Teil der Population kann daher geringer sein. Bei den weiblichen Tieren die wahrscheinlich reproduzierten (n = 34) wurden 20 wiedergefangen. 13 dieser Tiere traf ich in mindestens zwei verschiedenen Laichperioden innerhalb eines Reproduktionsgewässers an. Dies ließ vermuten, dass Weibchen mehrfach 55 Ergebnisse während einer Saison laichten. Verpaarungen wurden 5-mal beobachtet. Dabei handelte es sich 2-mal um dasselbe Männchen (RU0005), jedoch nie um dasselbe Weibchen. Reproduktionserfolg Von den insgesamt über 4500 abgelegten Eiern und über 2800 Larven fiel rund die Hälfte der Trockenheit zum Opfer. Einige der Laichgewässer trockneten bereits 20 Tage nach der ersten Laichperiode aus (10. Juni). Die restlichen Gewässer führten maximal 40 Tage Wasser, was für die Entwicklung der meisten Gelbbauchunken-Larven nicht ausreichte. Diese brauchen, je nach Bedingungen, für die Entwicklung vom Ablaichen bis zur Metamorphose durchschnittlich ein bis drei Monate (GOLLMANN & GOLLMANN, 2002). Dennoch konnten im Untersuchungsgebiet bereits nach 34 Tagen (24. Juni) vereinzelt metamorphosierte Jungtiere gefunden werden. Der überwiegende Teil der Larven der ersten Hauptlaichphase vertrocknete jedoch (Abbildung 4.27). Die in der zweiten Hauptlaichphase abgelegten Eier (> 2000) hatten gute Überlebenschancen, da die Gewässer im Juli, August und September durchweg Wasser führten. Die ersten Jungtiere dieser Hauptlaichphase wurden am 14. August registriert. Sie durchlebten ihre Entwicklung in 35 Tagen. Die Jungtiere der ersten Generation hatten bis dato schon gut ausgeprägte Bauchmuster entwickelt, was als sicheres Unterscheidungsmerkmal zu den frisch metamorphosierten Tieren diente. Die meisten Jungtiere wurden Anfang September registriert (> 200). Insgesamt konnten bis zum 01. Oktober 350 Jungtiere gezählt werden, von denen wie in Abschnitt 4.2.1 gezeigt 178 individuell registriert wurden. Die Larven der letzten Laichperiode im August wurden bis Mitte November in den Gewässern angetroffen (MEY, mdl. Mitt.). Diese hatten ihre Entwicklung nach über 100 Tagen noch nicht beendet. Ob diese Larven vor dem Winter metamorphosierten, ist ungewiss. Der größte Mortalitätsfaktor der Entwicklungsstadien der Gelbbauchunke im Untersuchungsgebiet war das Austrocknen der Gewässer. Eine Prädation der Larven und Eier konnte nur selten direkt beobachtet werden. Im Gewässer HB0201 wurden am 27. Juli drei adulte Kammmolche beim Fressen von Unkenlaich beobachtet. In den Gewässern HB0202 und HB0075 wurden gelegentlich große Gelbbauchunken-Larven beim Fressen von frischem Unkenlaich gesichtet. Außerdem konnten in dem weichen Boden um die Gewässer Spuren von Vögeln und räuberischen Säugetieren (Marder, Waschbär) entdeckt werden. Dies lässt auf eine Prädation der Larven durch diese Tiergruppen schließen. 56 Ergebnisse a b Abbildung 4.27 Trockenes Reproduktionsgewässer HB0079 am 24. Juni (a) und vertrocknete Amphibienlarven (u.a. Gelbbauchunke) im Gewässer HB0102, die durch erneuten Regen sichtbar wurden (b). 4.5 Habitatanalyse 4.5.1 Landlebensraum Der Landlebensraum der Gelbbauchunken im Untersuchungsgebiet umfasste eine Offenfläche mit eingestreuten Gebüsch- und Waldflächen. Auf allen drei Teilflächen befanden sich in dem direkten Umfeld der Gewässer zahlreiche Versteckmöglichkeiten, wie beispielsweise Steinhaufen, Totholz und Erdspalten. Diese dienten den Tieren als Versteckmöglichkeit und boten Schutz bei Trockenheit und starker Sonneneinstrahlung. Keines der untersuchten Gewässer lag weiter als 100 m von Gebüschflächen und/oder Waldflächen entfernt. Neben geeigneten Überwinterungsquartieren stellten diese Unterschlupfmöglichkeiten dar, welche wahrscheinlich auch während der Sommermonate von den Gelbbauchunken genutzt wurden. Die Biotoptypen unterschieden sich in ihren Anteilen an der Gesamtfläche auf den drei Teilflächen (Tabelle 4.14). Während fast 9 % der Teilfläche ZI mit Standgewässern bedeckt war, wiesen HB und SS unter 2 % Gewässer auf. Auch die Vegetation unterschied sich. Die Fläche SS wies einen hohen Anteil von Trocken- und Halbtrockenrasen auf und nur kleine Flächen mit frisch bis mäßig feuchtem mesophilem Grünland. Dieser Biotoptyp machte auf den Flächen ZI und HB hingegen den größten Anteil aus. 57 Ergebnisse Tabelle 4.14 Prozentuale Anteile der Biotoptypen an den Gesamtflächen der Teilflächen ZI, HB und SS. Teilflächen Biotoptyp ZI [%] HB [%] SS [%] 8.3 <2 <2 5 <2 <2 <2 12 38 mesophiles Grünland, frisch bis mäßig trocken 0 4 22 mesophiles Grünland, frisch bis mäßig feucht 65 74 16 kleine Standgewässer (< 1 ha) Waldflächen > 1 ha Trocken - / Halbtrockenrasen, basiphil 4.5.2 Gewässer 4.5.2.1 Gewässer-Funktionstypen In 58 der insgesamt 118 untersuchten Gewässer konnte die Gelbbauchunke nachgewiesen werden (Tabelle 4.15). Der Nachweis der Art erfolgte durch gefangene Tiere oder den Fund von Entwicklungsstadien (Eier, Larven). 60 der 118 Gewässer (51 %) waren unbesiedelt. 32 Gewässer (37 %) dienten der Art zum Laichen. Von diesen konnte in 24 Gewässern eine erfolgreiche Reproduktion nachgewiesen werden und in acht Gewässern blieb sie aus. Diese acht Gewässer nutzen die Gelbbauchunken nur während der ersten Hauptlaichphase. Nach der Austrocknung der Gewässer wurden sie nicht erneut zum Laichen genutzt, weshalb die Reproduktion dort insgesamt fehlschlug. 26 Gewässer dienten der Art als Aufenthaltsgewässer. In diesen konnten zwar vereinzelt rufende Männchen vernommen werden, es wurden jedoch nie Entwicklungsstadien gefunden. Tabelle 4.15 Untersuchungsgewässer (n = 118) eingeteilt in Gewässer-Funktionstypen. unbesiedelte Gewässer Aufenthaltsgewässer (AG) Definitionskriterium ohne Unken Gewässerzahl 60 Funktionstyp Reproduktionsgewässer (RG) nicht reproduktiv mäßig reproduktiv sehr reproduktiv ohne Entwicklungsstadien ohne Reproduktionserfolg > 100 Larven < 100 Larven 26 8 6 18 58 Ergebnisse Die meisten besiedelten Gewässer befanden sich im Teilgebiet HB. In 50 der 65 Untersuchungsgewässer (77 %) konnten in diesem Gebiet Unken nachgewiesen werden. Außerdem befanden sich 29 der 32 Reproduktionsgewässer in diesem Gebiet. Im Teilgebiet SS wurden acht von 17 untersuchten Gewässern (47 %) durch die Unken besiedelt. In vier Gewässern wurde gelaicht. Drei dieser Gewässer zeigten eine erfolgreiche Reproduktion. Hierzu zählte auch das Gewässer im Quellgebiet (SS0061), welches, aufgrund des gleich bleibenden Wasserstandes, annähernd konstante Bedingungen bot. Hinsichtlich der Gewässertypen spielten Gräben, Tümpel und Fahrspuren eine entscheidende Rolle für die Gelbbauchunken im Untersuchungsgebiet (Tabelle 4.16). Gräben stellten den Gewässertyp dar, welcher prozentual am häufigsten von Unken besiedelt wurde (54 %). Bei Tümpeln, Fahrspuren und Pfützen waren je knapp ein Drittel der untersuchten Gewässer besiedelt. Für die Reproduktion der Unken spielten Fahrspuren die wichtigste Rolle (41 % der Eier). Tabelle 4.16 Anzahl der Untersuchungsgewässer (n = 118) aufgeteilt auf die Gewässertypen sowie deren Anteile an der Zahl gefangener Individuen (n = 156) und der Zahl abgelegter Eier (n = 4536). Fahrspur Tümpel Graben Pfütze Quellbereich Anzahl 26 61 24 6 1 von Gesamt (n = 118) 22% 52% 20% 5% 1% mit Unken 7 27% 18 30% 13 54% 2 33% 1 100% Unken-Individuen 40 63 43 6 4 von Gesamt (n = 156) 26% 40% 27% 4% 3% Anzahl Eier 1855 1655 496 491 66 von Gesamt (n = 4536) 41% 36% 11% 11% 1% 4.5.2.2 Ermittelte Parameter Die Gewässerparameter wurden aufgenommen, um die Untersuchungsgewässer genau zu charakterisieren und eventuelle Unterschiede zwischen den Gewässer-Funktionstypen zu finden. Die Mittelwerte aller Messungen sind in Tabelle 4.17 für die Reproduktionsgewässer (RG) und die Aufenthaltsgewässer (AG) zusammengefasst. Die ermittelten Werte aller Gewässer der beiden Funktionstypen AG und RG wurden statistisch verglichen. 59 Ergebnisse Alle neun ermittelten Parameter unterschieden sich signifikant zwischen den untersuchten Gewässern des Funktionstypes RG (n = 32) und denen des Funktionstypes AG (n = 24) (Tabelle 4.17, Abbildung 4.28). Die Ergebnisse werden im Folgenden für alle Parameter separat erläutert. Die ermittelten Parameter der 118 Untersuchungsgewässer sind im Anhang E zu finden. Eine exemplarische Auswahl von Gewässern beider Funktionstypen finden sich im Anhang F. Tabelle 4.17 Mittlere Parameter aller besiedelten Untersuchungsgewässer zusammengefasst für die Funktionstypen (F-typ) RG (n = 32) und AG (n = 24). Aufgeführt sind die Mittelwerte (MW), Mediane, Minima (Min), Maxima (Max) sowie die Anzahl der Messungen und die Ergebnisse der Statistik (p < 0.05 = *, p < 0.01 = **, p < 0.001 = ***). Parameter F- typ MW Median Min - Max Messungen Größe [m³] RG 38.1 ± 55.8 13.1 3.2 - 223.2 32 AG 103.7 ± 142.3 65.1 5.8 - 671.3 24 Tiefe [cm] RG 19.0 ± 17.3 14 3 - 108 491 AG 40.1 ± 16.9 40 7 - 89 347 Besonnung [%] RG 96 ± 10 100 60 - 100 32 AG 87 ± 14 90 50 - 100 24 Veg_emers [%] RG 24 ± 20 20 0 - 60 32 AG 46 ± 21 50 10 - 90 24 Veg_submers [%] RG 18 ± 20 10 0 - 80 32 AG 53 ± 25 50 10 - 90 24 RG 8.66 ± 0.37 8.62 7.90 - 9.89 257 AG 8.42 ± 0.27 8.44 7.81 - 9.54 193 Leitfähigkeit [µs] RG 342 ± 146.6 311 71 - 940 257 AG 437 ± 126.9 427 161 - 764 193 O2 [mg/L] RG 8.0 ± 3.0 7.9 0.7 - 14.7 153 AG 7.2 ± 2.7 7.4 1.6 - 12.9 118 Temperatur [°C] RG 18.2 ± 4.0 17.6 8.5 - 35.0 97920 AG 16.9 ± 2.6 16.5 10.7 - 24.0 36720 pH t-Test (p) MannWhitney-U Test (p) - ** - *** - ** - *** - *** - *** - *** * - - *** 60 Ergebnisse Abbildung 4.28 Vergleich der ermittelten Parameter zwischen Aufenthaltsgewässern (AG, n = 24) und Reproduktionsgewässern (RG, n = 32). Dargestellt sind die Mediane (können Tabelle 4.17 entnommen werden) und Quartile der einzelnen Parameter. Ausreißer wurden in den Diagrammen Größe, Tiefe und pH entfernt. Mann-Whitney-U Test/ t-Test: *** = p < 0.001, ** = p < 0.01,* = p < 0.05. 61 Ergebnisse Zwei Gewässer des Funktionstypes AG wurden in der statistischen Auswertung ausgeschlossen. Hierbei handelte es sich um zwei sehr flache Pfützen, in welchen einmalig je ein Tier gefunden wurde. Die Anzahl der Messungen (Stichprobenzahl) unterschieden sich zwischen den Funktionstypen, da die Anzahl der Gewässer unterschiedlich war. Gewässergröße Die Aufenthaltsgewässer (AG) waren mit durchschnittlich 103.7 ± 142.3 m² (5.8 - 671.3 m², n = 24) signifikant größer als die Reproduktionsgewässer (RG) mit einer Größe von im Mittel 38.1 ± 55.8 m² (3.2 - 223.2 m², n = 32) (Mann-Whitney-U Test: W = 578, p < 0.01, n = 56). Die sehr reproduktiven Gewässer (Abschnitt 4.5.2.1) zeigten Größen von 5 m² bis 35 m² (Abbildung 4.29). In kleinere und größere Gewässer laichten die Gelbbauchunken ebenfalls ab, jedoch war die Reproduktion dort nicht so erfolgreich (mäßig reproduktive Gewässer). Die meisten der sehr reproduktiven Gewässer (63 %) gehörten den Größenklassen von 5 m² bis 15 m² an und waren somit Klein- bis Kleinstgewässer. nicht reproduktiv (n = 8) mäßig reproduktiv (n = 16) sehr reproduktiv (n = 8) 6 5 Anzahl 4 3 2 1 0 -5 -10 -15 -20 -25 Größe [m²] -30 -35 > 35 Abbildung 4.29 Verteilung der Reproduktionsgewässer (n = 32) auf acht Größenklassen. Beschriftungen der X-Achse geben die Obergrenzen der Klassen an. Gewässertiefe und Permanenz Mit einer mittleren Wassertiefe von 40 ± 16.9 cm (7 - 89 cm, n = 24, 347 Messungen) waren die Aufenthaltsgewässer (AG) signifikant tiefer als die Reproduktionsgewässer (RG) mit durchschnittlich 19 ± 17.3 cm Wassertiefe (3 - 108 cm, n = 32, 491 Messungen) (MannWhitney-U Test: W = 144418, p < 0.001, n = 838). 62 Ergebnisse Die Aufenthaltsgewässer trockneten zwischen kein (58 %) und 1-mal (42 %) während der Saison (01. Mai - 01. Oktober) aus. Die meisten Reproduktionsgewässer (75 %) hatten Wassertiefen unter 24 cm (Abbildung 4.30). Sehr reproduktive Gewässer besaßen Tiefen zwischen 7 cm und 31 cm, mit einem Mittelwert von 15 cm. Sie trockneten 1- bis 2-mal während der Saison aus. Einige der mäßig reproduktiven Gewässer waren über 48 cm tief und führten auch dann Wasser, wenn die flacheren Gewässer bereits trocken lagen. Die meisten nicht reproduktiven Gewässer (62 %) hatten Wassertiefen unter 7 cm, weshalb sie im Schnitt 3-mal austrockneten. Sie wurden von den Gelbbauchunken nach der Trockenheit im Juni gemieden. nicht reproduktiv (n = 8) mäßig reproduktiv (n = 16) sehr reproduktiv (n = 8) 7 6 Anzahl 5 4 3 2 1 0 -12 - 24 -36 Tiefe [cm] -48 > 48 Abbildung 4.30 Verteilung der Reproduktionsgewässer (n = 32) auf acht Klassen anhand der mittleren Wassertiefen. Beschriftungen der X-Achse geben die Obergrenzen der Klassen an. Die größte Menge an Eiern wurde in Gewässer abgelegt, welche 1-mal während der Saison austrockneten (Abbildung 4.31). Insgesamt konnte ich in Gewässern die 1- oder 2-mal austrockneten 71 % aller Eier finden. In den Gewässern die häufiger als 2-mal austrockneten, wurden 24 % der Eier gefunden. Permanente Gewässer, welche dauerhaft Wasser führten, enthielten die geringste Menge an Eiern (5 %). 63 Ergebnisse 40 Anzahl abgelegter Eier [%] 35 30 25 20 15 10 5 0 0 1 2 3 n=3 n = 16 n=6 n=2 4 n=2 5 n=3 Austrocknungen Abbildung 4.31 Prozentualer Anteil der insgesamt abgelegten Eier (n = 4536) in den Reproduktionsgewässern (n = 32) in Abhängigkeit von der Austrocknungshäufigkeit. Besonnung Der Grad der Besonnung eines Gewässers entscheidet mit darüber wie stark und wie schnell sich der Wasserkörper aufwärmt. Ich nahm den Besonnungsgrad der Gewässer auf, um zu untersuchten, ob die Gelbbauchunke zum Laichen stark besonnte Gewässer bevorzugt. Die Reproduktionsgewässer (RG) waren im Schnitt zu 96 ± 10 % (60 - 100 %, n = 32) besonnt. Die Aufenthaltsgewässer (AG) zeigten Besonnungsgrade von durchschnittlich 87 ± 14 % (50 - 100 %, n = 24) und waren signifikant schwächer besonnt als die RG (MannWhitney-U Test: W = 218, p < 0.01, n = 56) (Abbildung 4.28). Die Mehrzahl der RG (78 %) war maximal, also zu 100 %, besonnt. Sieben der 32 Gewässer waren zum Teil von Gehölzen beschattet. 29 % der AG waren maximal besonnt. 40 % zeigten Besonnungsgrade von 90 %. Sehr stark oder komplett beschattete Gewässer wurden von den Gelbbauchunken sowohl als RG, als auch als AG gemieden. Vegetation Hinsichtlich der Vegetationsbedeckung zeigten sich Unterschiede zwischen den GewässerFunktionstypen (Abbildung 4.32). Aufenthaltsgewässer (AG) zeigten Vegetationsbedeckungen von durchschnittlich 46 ± 21 % (10 - 90 %, n = 24) emers und 64 Ergebnisse 53 ± 25 % (10 - 90 %, n = 24) submers und waren signifikant stärker bewachsen als Reproduktionsgewässer (RG) (Mann-Whitney-U Test: emers: W = 584, p < 0.001, n = 56; submers: W = 661.5, p < 0.001, n = 56) (Abbildung 4.28). Die Reproduktionsgewässer waren emers im Schnitt zu 24 ± 20 % (0 - 60 %, n = 32) bewachsen und submers zu 18 ± 20 % (0 80 %, n = 32). Vier der 24 AG hatten submerse und emerse Vegetationsbedeckungen unter 30 %. Der Großteil der AG war submers zu mehr als 60 % und emers zu 30 - 60 % bewachsen. Keines der RG besaß eine emerse Vegetationsbedeckung über 60 %. Die meisten RG (44 %) zeigten emerse und submerse Bedeckungen unter 30 %. Sehr reproduktive Gewässer waren weniger stark bewachsen als die mäßig reproduktiven Gewässer (Abbildung 4.32). Dies wurde besonders bei der submersen Vegetationsbedeckung deutlich. Diese lag bei den sehr reproduktiven Gewässern im Schnitt bei nur 2.5 %, da zwei Drittel der Gewässer komplett vegetationslos waren. 65 HB0079 HB0201 HB0136 HB0202 HB0289 HB0097 HB0021 HB0039 HB0061 HB0075 SS0003 HB0101 HB0102 HB0107 HB0108 HB0140 HB0200 HB0099 HB0271 HB0278 HB0282 HB0290 SS0061 SS0084 HB0081 HB0135 HB0139 HB0204 HB0206 HB0275 HB0285 HB0286 HB0020 HB0080 HB0083 HB0095 HB0096 HB0109 HB0138 HB0203 HB0279 HB0283 HB0284 HB0052 HB0059 HB0060 HB0063 HB0082 HB0240 HB0241 HB0110 HB0291 SS0081 SS0009 SS0082 SS0085 HB0079 HB0201 HB0136 HB0202 HB0289 HB0097 HB0021 HB0039 HB0061 HB0075 SS0003 HB0101 HB0102 HB0107 HB0108 HB0140 HB0200 HB0099 HB0271 HB0278 HB0282 HB0290 SS0061 SS0084 HB0081 HB0135 HB0139 HB0204 HB0206 HB0275 HB0285 HB0286 HB0020 HB0080 HB0083 HB0095 HB0096 HB0109 HB0138 HB0203 HB0279 HB0283 HB0284 HB0052 HB0059 HB0060 HB0063 HB0082 HB0240 HB0241 HB0110 HB0291 SS0081 SS0009 SS0082 SS0085 Ergebnisse 100% sehr reproduktiv mäßig reproduktiv nicht reproduktiv bewachsener Bereich Aufenthaltsgewässer 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% vegetationsloser Bereich Abbildung 4.32 Emerse (oben) und submerse (unten) Vegetationsbedeckung der besiedelten Gewässer (n = 56). Legende und Beschriftungen gelten für beide Diagramme. 66 Ergebnisse Chemische Parameter Die chemischen Parameter pH-Wert, Leitfähigkeit und Sauerstoffgehalt wurden aufgenommen, um die Wasserqualität der besiedelten Gewässer zu bestimmen. Die ermittelten pH-Werte aller untersuchten Gewässer waren leicht basisch. Der mittlere pH-Wert der Aufenthaltsgewässer (AG) von 8.42 ± 0.27 (7.90 - 9.89, n = 24, 257 Messungen) war signifikant niedriger als der mittlere pH-Wert der Reproduktionsgewässer (RG) von 8.66 ± 0.37 (7.81 - 9.54, n = 32, 193 Messungen) (Mann-Whitney-U Test: W = 15358, p < 0.001, n = 450) (Abbildung 4.28). Die Leitfähigkeit in den AG war mit durchschnittlich 437 ± 126.9 µs (161 - 764 µs, n = 24, 193 Messungen) signifikant höher als in den RG mit durchschnittlich 342 ± 146.6 µs (71 - 940 µs, n = 32, 257 Messungen) (Mann-Whitney-U Test: W = 34776, p < 0.001, n = 450) (Abbildung 4.28). In den RG befanden sich 75 % der Werte im Bereich zwischen 281 µs und 430 µs. Bei den AG wurden die meisten Werte im Bereich zwischen 360 µs und 524 µs aufgenommen. Der mittlere Sauerstoffgehalt war in den RG mit 8.0 ± 3.0 mg/L (0.7- 14.7 mg/L, n = 32, 153 Messungen) signifikant höher als in den AG mit 7.2 ± 2.7 mg/L (1.6 - 12.9 mg/L, n = 24, 118 Messungen) (Students t-Test: t = -2.29, df = 269, p < 0.05, n = 271) (Abbildung 4.28). Hinsichtlich der chemischen Parameter Leitfähigkeit und Sauerstoffgehalt konnten in den RG, im Vergleich zu den Werten der AG, somit günstigere Bedingungen ermittelt werden. Wassertemperatur Mithilfe der Data Logger fand eine kontinuierliche Aufnahme der Wassertemperatur in 11 Untersuchungsgewässern statt. Hierdurch konnte ich für jedes Gewässer Tagesdurchschnittstemperaturen berechnen. Diese wurden für die Gewässer der beiden Funktionstypen AG und RG zusammengefasst und wie in Abbildung 4.33 gezeigt, verglichen. Die mittlere Tagesdurchschnittstemperatur lag in den RG mit 18.2 ± 4.0°C (8.5 35.0°C, n = 8, 97920 Messungen) signifikant über der der AG mit 16.9 ± 2.6°C (10.7 24.0°C, n = 3, 36720 Messungen) (Mann-Whitney-U-Test: W = 1493207689, p < 0.001, n = 11 Gewässer, 134640 Messungen) (Tabelle 4.18). Die Temperaturwerte der Gewässer sind im Anhang G aufgeführt. 67 Ergebnisse Abbildung 4.33 Tagesdurchschnittstemperaturen für 11 Gewässer der beiden Funktionstypen RG (n = 8) und AG (n = 3). Mediane (RG = 17.6°C, n = 97920; AG = 16.5°C, n = 36720) und Quartile der Wassertemperaturen über den Zeitraum vom 08. Juli bis 30. September. Mann-Whitney-U Test: *** = p < 0.001. Neben Temperaturmittelwerten des ganzen Tages berechnete ich die Temperaturmittelwerte bezogen auf eine Einteilung des Tages in AM (von 24.00 - 12.00 Uhr) und PM (von 12.00 - 24.00 Uhr). Hierbei stellte ich fest, dass sich die AM-Werte der Gewässer der beiden Funktionstypen RG und AG nicht signifikant voneinander unterschieden (Mann-Whitney-U Test: W = 18885591, p > 0.05, n = 11 Gewässer, 67320 Messungen) (Abbildung 4.34). Die mittlere Temperatur der AM-Werte der RG lag mit 17.6 ± 3.2°C nur minimal über der der AG mit 17.4 ± 2.7°C. Die mittleren PM-Werte hingegen waren in den RG (20.6 ± 4.2°C) signifikant höher als in den AG (18.0 ± 2.8°C) (Mann-Whitney-U Test: W = 25479335, p < 0.001, n = 11 Gewässer, 67320 Messungen). Die Temperaturdifferenz der AM-Werte lag mit durchschnittlich 0.1°C Unterschied zwischen den RG und den AG deutlich unter derer der PM-Werte mit einer Differenz von 2.4°C. Die AM-Werte können als Nachttemperaturen gesehen werden, weshalb sie wesentlich geringer sind als die PM-Werte. Da die Reproduktionsgewässer signifikant kleiner, flacher und besonnter waren als die Aufenthaltsgewässer, konnten diese höhere PM-Werte erreichen. In der Nacht glichen sich die Temperaturen der Gewässer beider Funktionstypen weitestgehend an. Die starke Besonnung der RG äußerte sich zudem in einer hohen Temperaturspanne (Range). Diese lag bei den RG im Mittel bei 26.5°C (8.5 - 35.0°C, n = 8, 97920 Messungen) und bei den AG bei 13.3°C (10.7 - 24.0°C, n = 3, 36720 Messungen) (Tabelle 4.17). Sowohl die höchste Maximaltemperatur (35.0°C, HB0097), als auch die niedrigste Minimaltemperatur (8.5°C, SS0061) wurde in Reproduktionsgewässern gemessen (Anhang G). 68 Ergebnisse Abbildung 4.34 Vergleich der AM (24.00 - 12.00 Uhr) und PM (12.00 - 24.00 Uhr) Temperaturen für 11 Gewässer der beiden Funktionstypen RG (n = 8) und AG (n = 3). AM-Werte mit einer Differenz von 0.1°C zwischen den Funktionstypen (RG: n = 48960, AG: n = 18360), PM-Werte mit 2.4°C Differenz (RG: n = 48960, AG: n = 18360). Mann-Whitney-U Test: ***= p < 0.001. Tabelle 4.18 Mittlere Temperaturen in den 11 Gewässern der Funktionstypen (F-typ) RG (n = 8) und AG (n = 3). Aufgeführt sind die Minima (Min), Maxima (Max), Temperaturspanne (Range) und Mittelwerte (MW) sowie die Anzahl der Messungen (n) und der Zeitraum der Messung in Tagen [d]. F-typ Min [°C] Max [°C] Range [°C] MW AM [°C] ± sd MW PM [°C] MW Tag [°C] ± sd ± sd RG 8.5 35.0 26.5 17.6 ± 3.2 20.6 ± 4.2 AG 10.7 24.0 13.3 17.4 ± 2.7 18.0 ± 2.8 n Dauer [d] 18.2 ± 4.0 79920 83 16.9 ± 2.6 36720 83 In Abbildung 4.35 ist der Verlauf der Temperatur über den gesamten Zeitraum der Messung exemplarisch für ein Reproduktionsgewässer (HB0079, Fahrspur) und ein Aufenthaltsgewässer (HB0095, Graben) verdeutlicht. Zu sehen sind die stets höheren Maximaltemperaturen und die stärkeren Temperaturschwankungen des RG (grau), im Vergleich zu dem AG (schwarz). 69 Ergebnisse 35 RG AG Temperatur [°C] 30 25 20 15 10 5 05.07.14 25.07.14 14.08.14 03.09.14 23.09.14 Abbildung 4.35 Temperaturverlauf eines RG (HB0079) und eines AG (HB0095) über den Zeitraum der Messung (08. Juli - 30. September) aufgezeichnet mit Data Loggern. Anzahl der Messungen: n = 12240 für beide Gewässer. Konkurrenz und Prädation Von den 32 Gewässern in denen Bombina variegata laichte, fanden sich in acht (25 %) konkurrierende Anuren-Arten. In vier Gewässern wies ich Rana temporaria-Larven nach. Vier weitere Gewässer zeigten Larven von Hyla aborea. Die sehr reproduktiven Gewässer waren frei von Konkurrenten. Bei den Aufenthaltsgewässern fanden sich in 18 der 24 Gewässer (75 %) konkurrierende Anuren-Arten. Neben den oben genannten Arten wurden Wasserfrösche nachgewiesen, die jedoch nicht genau bestimmt wurden. Auch hinsichtlich der Prädation unterschieden sich die Gewässer-Funktionstypen voneinander. Während sich in allen Aufenthaltsgewässern Prädatoren fanden, waren 34 % der Laich- und Reproduktionsgewässer prädatorenfrei. Bei den sehr reproduktiven Gewässern waren 38 % frei von Prädatoren, bei den mäßig reproduktiven hingegen keines. Der Großteil der mäßig reproduktiven RG wies Molche auf (63 %). Bei den sehr reproduktiven RG wurden nur in zwei Gewässern (25 %) Molche gesichtet. Nachgewiesene Prädatoren-Arten waren Teichmolch (Lissotriton vulgaris), Bergmolch (Ichthyosaura alpestris), Kammmolch (Triturus cristatus) sowie Larven Wirbelloser (Coleoptera, Odonata). 70 Ergebnisse Unterschieden sich die aufgenommenen Parameter zwischen den besiedelten und unbesiedelten Gewässern? Um herauszufinden, ob bestimmte Eigenschaften der Gewässer dazu führten, dass die Gelbbauchunken diese Gewässer besiedelten oder mieden, verglich ich die aufgenommenen Parameter zwischen allen besiedelten und unbesiedelten Gewässern der beiden bewohnten Teilflächen SS und HB (n = 80). Ich konnte feststellen, dass die besiedelten Gewässer durchschnittlich größer, flacher, stärker besonnt und an der Gewässeroberfläche weniger bewachsen waren als die unbesiedelten (Anhang H). Besiedelte Gewässer zeigten außerdem bessere Wasserqualitäten, das heißt durchschnittlich geringere elektrische Leitfähigkeiten und höhere Saustoffgehalte. Die genannten Parameter unterschieden sich allerdings statistisch nicht signifikant zwischen den Gewässern. Signifikante Unterschiede konnten nur für den pH-Wert und die submerse Vegetationsbedeckung ermittelt werden. Besiedelte Gewässer waren mit durchschnittlich 33 ± 28 % (0 - 90 %, n = 56) submerser Vegetationsbedeckung signifikant schwächer bewachsen als unbesiedelte Gewässer mit einer Vegetationsbedeckung von im Mittel 50 ± 32 % (0 - 90 %, n = 24) (Mann-Whitney-U Test: W = 482.5, p < 0.05, n = 80). Der pH-Wert der besiedelten Gewässer lag mit durchschnittlich 8.56 ± 0.24 (8.15 - 9.13, n = 56) signifikant über dem der unbesiedelten mit rund 8.44 ± 0.18 (8.12 - 8.85, n = 24) (Mann-Whitney-U Test: W = 875.5, p < 0.05, n = 80). Unterschieden sich die Gewässer auf der Teilfläche ZI von den Gewässern der anderen Teilflächen? Ich verglich die Parameter aller Untersuchungsgewässer (n = 118) zwischen den drei Teilflächen, um zu untersuchen, weshalb auf der Teilfläche ZI keine Unken siedelten. Hierbei konnte ich nur geringfügige Unterschiede zwischen den Gewässern der Teilflächen feststellen. Die Gewässer der Teilflächen SS und ZI unterschieden sich in keinem der neun Parameter signifikant. Unterschiede wurden lediglich zwischen den Gewässern der Teilfläche HB und den beiden anderen Gebieten gefunden. Die Gewässer des Gebietes HB zeigten mit durchschnittlich 8.56 ± 0.23 (8.21 - 9.13, n = 65) signifikant höhere pH-Werte als die Gewässer in dem Gebiet SS mit 8.38 ± 0.20 (8.12 - 8.72, n = 17) (Mann-Whitney-U Test: W= 1765.5, p < 0.001, n = 101) und in dem Gebiet ZI mit 8.35 ± 0.13 (8.09 - 8.61, n = 36) (Mann-Whitney-U Test: W= 756, p < 0.001, n = 82). Die Menge an gelösten Sauerstoff war in 71 Ergebnisse den Gewässern des Gebietes HB mit durchschnittlich 7.81 ± 2.23 mg/L (2.99 - 13.25 mg/L, n = 65) höher als im Teilgebiet SS mit 6.37 ± 2.23 (4.31 - 8.90 mg/L, n = 17) (Mann-Whitney-U Test: W = 737, p < 0.001, n = 82) und in dem Gebiet ZI mit 7.00 ± 1.69 mg/L (4.18 - 11.24 mg/ L, n = 36) (Mann-Whitney-U Test: W = 1439, p < 0.05, n = 101). 4.5.2.3 Laichgewässerpräferenz Die Gelbbauchunken legten unterschiedlich viele Eier in die Reproduktionsgewässer. Einige der untersuchten Gewässer wurden gar nicht zum Laichen genutzt. Um herauszufinden, welche der untersuchten Gewässerparameter die Anzahl der abgelegten Eier in den Gewässern am stärksten beeinflussten, wandte ich ein nicht-lineares Regressionsmodell an. Die Anzahl der abgelegten Eier in einem Gewässer wurden von den Parametern Vegetationsbedeckung (emers, submers), Besonnungsgrad, Konkurrenz und Leitfähigkeit signifikant beeinflusst (Tabelle 4.19). Die Koeffizienten der Regression (Tabelle 4.19) geben die Veränderung in der Anzahl abgelegter Eier eines Gewässers an, wenn die jeweilige erklärende Variable (Parameter) um eine Einheit erhöht wird. Diese Veränderung kann positiv oder negativ sein. Die Parameter submerse und emerse Vegetationsbedeckung, Konkurrenz und Leitfähigkeit zeigten negative Effekte auf die Anzahl der Eier eines Gewässers (Abbildung 4.36). Eine Erhöhung dieser Parameter würde, laut des Modells, eine Erniedrigung der Anzahl abgelegter Eier in einem Gewässer zur Folge haben. Der Besonnungsgrad zeigte hingegen einen positiven Effekt auf die Eizahl (Abbildung 4.36). Tabelle 4.19 Koeffizienten des finalen Modelles (GLM) für die Anzahl abgelegter Eier. Aufgeführt sind die Schätzwerte (log-transformiert), Standardfehler (SEM), t-Werte, p-Werte und das Signifikanzniveau (p < 0.05 = *, p < 0.01 = **, p < 0.001 = ***). Parameter Schätzwert SEM (Intercept) 10.49432 Veg_emers -2.87991 Veg_submers Besonnung Konkurrenz Leitfähigkeit t p Signifikanz 2.390708 4.39 3.62E-05 *** 1.3138 2.192 0.03144 * -5.34108 1.572447 -3.397 0.00109 ** 4.49652 2.227831 2.018 0.04709 * -1.72800 0.691097 -2.5 0.01456 * -0.00461 0.001862 -2.476 0.01553 * Die „Residual deviance“ des Modells war mit 6419.5 bei 76 df kleiner als die „Null deviance“ mit 13052.2 bei 81 df. Da die „Null deviance“ die Gesamtabweichung der Daten des Modells, ohne Einbeziehung der erklärenden Variablen (Parameter), darstellte, sprach 72 Ergebnisse dies für die Güte des Modells. Die Daten wurden durch das finale Modell, welches die oben genannten fünf Parameter einbezieht, somit besser erklärt als ohne diese Parameter. Abbildung 4.36 Korrelation der Eizahl der Gewässer mit den Parametern Vegetationsbedeckung (emers, submers), Besonnung und Leitfähigkeit. Berechnete Ausgleichsgeraden in Rot. 73 5 Diskussion 5.1 Populationsstruktur Fangzahlen und Wiederfänge Die Zahl erfasster Gelbbauchunken hängt von der Aktivität der Tiere ab. Sind aufgrund saisonaler oder klimatischer Bedingungen wenige Unken aktiv, wird man nur einen Teil der Population in den Gewässern antreffen. Die Tiere halten sich in Ruhephasen überwiegend in Verstecken im Landhabitat auf (GOLLMANN & GOLLMANN, 2002). Während der Fortpflanzungsperiode von Mai bis August finden sich die meisten adulten Gelbbauchunken an den Gewässern (GOLLMANN & GOLLMANN, 2002). Entsprechend registrierte ich in den Monaten Juni und Juli die meisten Tiere. Unabhängig von saisonalen oder klimatischen Bedingungen kann es zwischen verschiedenen Jahren zu unterschiedlichen Fangerfolgen kommen. So konnte SY (1998) auf einem ehemaligen Militärgelände in Nordthüringen 1997 trotz gleicher Fangintensität weniger Gelbbauchunken fangen als im Vorjahr. Er schloss die Niederschlagsmenge als Ursache hierfür aus und schlussfolgerte, dass sich die Tiere in manchen Jahren gar nicht, oder nur kurzzeitig, in den Gewässern aufhalten. Eine einjährige Studie ist daher nur bedingt geeignet Aussagen über die Struktur einer Population zu treffen. Durch die angewandte Fangmethodik konnten in einem Monat maximal 38.9 % der berechneten Gesamtpopulation erfasst werden. SY (1998) fing durch eine gekoppelte Fangmethode aus Zaun- und Kescherfängen maximal 45.4 % der von ihm untersuchten Population. MÖLLER (1992, 1996) ermittelte in derselben Population durch die gleiche Methodik maximale Anteile bis 49 % und zeigte zudem, dass mittels Kescherfängen allein maximal 28 % der Population erfasst werden konnten. Bei einer wiederholten Studie im Untersuchungsgebiet sollten daher neben Kescherfängen auch Zaunfänge durchgeführt werden. Ein Wiederfang der Gelbbauchunken gelang bei 49 % der Tiere. Im Vergleich zu anderen Untersuchungen an Bombina variegata ist dies gering. HÖPFER (2014) konnte in einer kleinen Population von etwa 30 Unken 72 % der Tiere wiederfangen. KRÜGER (2006) fing 75 % der von ihm registrierten Gelbbauchunken mehrfach. In einer Waldpopulation in Österreich wurden 79.3 % der Männchen und 78.5 % der Weibchen wiedergefangen 74 Diskussion (SEIDEL, 1988). Auch SY (1998) erreichte in einer Gelbbauchunken-Population von knapp 700 Tieren Wiederfangraten über 70 %. Geringe Wiederfangraten deuten darauf hin, dass ein großer Teil der Population nicht sichtbar gemacht wurde. Wird ein Tier nur 1-mal gefangen, ist es entweder nach dem ersten Fang verstorben, abgewandert oder hält sich dort auf, wo man es nicht fangen kann. Letzteres scheint bei Bombina variegata am wahrscheinlichsten. Adulte Gelbbauchunken haben eine hohe Lebenserwartung (PLYTYCZ et al., 1996) und kaum natürliche Feinde (GOLLMANN & GOLLMANN, 2002), weshalb ich ein Sterben der Tiere größtenteils ausschließe. Hierfür sprechen auch die hohen Überlebensraten der Population (Abschnitt 4.2.2). KAPFBERGER (1982) und BARANDUN (1986) deuten geringe Wiederfangzahlen als eine hohe Wanderaktivität der Gelbbauchunken. Diese Annahme korreliert allerdings nicht mit der hohen Ortstreue, welche für die Population ermittelt wurde (Abschnitt 4.3.2). Ein Dispersal der Tiere kann nicht ausgeschlossen werden, wäre bei Gelbbauchunken in der Fortpflanzungszeit jedoch ungewöhnlich (HEUSSER, 1958; MÖLLER, 1992; SEIDEL, 1988) und scheint für 49 % der Population unwahrscheinlich. Übereinstimmend mit BARANDUN & REYER (1998) und HARTEL (2008) gehe ich davon aus, dass sich die übrigen Tiere im terrestrischen Habitat aufhielten. Darauf deuten ebenfalls die geringen Fangzahlen während der Trockenperiode im Juni. Die Fanghäufigkeiten der Individuen unterschieden sich in meiner Untersuchung zwischen den Geschlechtern (Männchen 2.3-mal, Weibchen 2.0-mal). Auch BARANDUN (1997) konnte auf einem Militärgelände bei Zürich Männchen häufiger wiederfangen als Weibchen (Männchen 4.2-mal, Weibchen 2.8-mal). Einige Jahre zuvor fing derselbe Autor in der Kiesgrube Kirchberg (Schweiz) Männchen im Mittel 3.6-mal und Weibchen 3.0-mal (BARANDUN, 1986). SY (1998) registrierte männliche Gelbbauchunken in Thüringen bei Mühlhausen im Mittel 3.5-mal und Weibchen 2.8-mal. Andere Autoren wie ABBÜHL (1997) und JACOB et al. (2009) schildern ebenfalls einen häufigeren Fang männlicher Tiere. KAPFBERGER (1984) begründet dieses Phänomen darin, dass sich Weibchen vermehrt an Land aufhalten und nur während der Reproduktion für wenige Tage die Laichgewässer aufsuchen. Männchen hingegen bleiben aufgrund ihrer Territorialität im Wasser oder halten sich in der engeren Umgebung der Gewässer auf. Dies zeigte sich auch bei meinen Untersuchungen. Während ich Männchen teilweise über Wochen im selben Gewässer antraf, fing ich Weibchen oft wochenlang nicht. Die Suche nach Unken sollte daher auf den gesamten Landlebensraum ausgedehnt werden und sich nicht nur auf die nähere Umgebung der Gewässer beschränken. Alternativ kann auch die Nutzung eines Fangzaunes hilfreich sein. 75 Diskussion Populationsgröße Im Rahmen der Untersuchung wurden aktuelle Populationsgrößen von 156 Tieren (kumulative Methode) und 262 Tieren (Populationsschätzung) ermittelt. Bei der kumulativen Populationsgröße handelt es sich um eine sichere Zahl der mindestens im Untersuchungsgebiet vorhandenen Individuen. Es ist zu beachten, dass die absolute Anzahl der Individuen in der Gesamtpopulation höher liegt (!). Tiere, die an den Untersuchungstagen nicht erfasst werden konnten, weil sie beispielsweise in ihren Landverstecken waren, sind bei der Schätzung der Populationsgröße nach der kumulativen Methode einzukalkulieren. Mit der angewandten Fang-Wiederfang-Methodik und der statistischen Schätzung der Populationsgröße sollte dieser Fehler minimiert werden. Durch das Verhältnis von markierten zu unmarkierten Tieren wird der Teil der Population geschätzt, welcher vom Erfasser nicht registriert wurde. Ähnlich zu der Untersuchung von SENDOR & SIMON (2000) erhielt ich durch die Jolly-Seber-Methode für offene Populationen keine sinnvolle Schätzung (Abschnitt 4.2.2). Ich gehe davon aus, dass die Grundannahmen des Modells verletzt wurden und die Datengrundlage für eine Auswertung im Programm „Jolly“ zu schwach war. Die Modelle setzen einen großen Stichprobenumfang, hohe Wiederfangzahlen und hohe Fangwahrscheinlichkeiten voraus (CAROTHERS, 1973). Diese Bedingungen konnten mit meinen Daten nicht erfüllt werden. Wie für die Bestandsschätzung von Gelbbauchunken-Populationen üblich, nutzte ich daher ein geschlossenes Populationsmodell (vgl. HÖPFER, 2012; MÖLLER 1992; SY 1998). Die Geschlossenheit einer natürlichen Population wird durch die dynamischen Prozesse Mortalität, Natalität, Emigration und Immigration verhindert. Es gibt jedoch Fälle, bei denen eine annähernd geschlossene Population während des Erfassungszeitraumes angenommen werden kann (SENDOR & SIMON, 2000). Die Mortalität habe ich vernachlässigt, da bei einer Lebenserwartung von über 15 Jahren (GOLLMANN & GOLLMANN, 2002) nur ein geringer Einfluss auf die Gesamtpopulation zu erwarten ist. Der Prozess der Natalität konnte ebenfalls ausgeschlossen werden, da nur adulte Tiere in die Berechnung einflossen. Emigration und Immigration können demgegenüber nicht vollkommen ausgeschlossen werden. Gelbbauchunken zeigen in den Sommermonaten jedoch eine starke Bindung an vorhandene Reproduktionsgewässer (BARANDUN, 1995; HEUSSER, 1958; SEIDEL, 1988), was auch für die betreffende Population ermittelt wurde (Abschnitt 4.3.2). Trotz aller Sorgfalt hinsichtlich der Erfüllung der Grundannahmen der Modelle, liefert eine Fang-Wiederfang-Studie nur dann verlässliche Schätzungen, wenn die zeitliche und die räumliche Skala der Stichprobe beachtet werden (ROYLE et al., 2014). Ein 76 Diskussion Untersuchungszeitraum von wenigen Tagen beziehungsweise Wochen führt zur Unterschätzung des Bestandes, da sich nur ein Teil der Gelbbauchunken gleichzeitig im Wasser aufhält (SCHMIDT, 1990; WOLF, 1988). Die von mir durchgeführten 12 Fangereignisse über 24 Wochen gelten nach MÖLLER (1992) für eine Gelbbauchunken-Population als ausreichend. Eine räumlich beschränkte Stichprobe kann den Gesamtbestand einer Population ebenfalls unterschätzen (ROYLE et al., 2014). MÖLLER (1992) konnte zeigen, dass mit abnehmender Größe des betrachteten Ausschnittes die ermittelte Bestandsgröße kleiner wird. Dies versuchte ich durch ein großes Untersuchungsgebiet (423 ha) und eine hohe Zahl an beprobten Gewässern (118) abzuschwächen. Es bleibt das Problem, dass sich die meisten Tiere im Sommer im Landlebensraum aufhalten, wo sie nicht auffindbar sind (BARANDUN, 1986; SEIDEL, 1988). MÖLLER (1992, 1996) geht davon aus, dass sich der Anteil der Population auf bis zu 75 % beläuft (!). Dies führt ebenfalls zu einer Unterschätzung des Gesamtbestandes. BAILEY et al. (2004) konkludieren, dass bei Schätzungen der Populationsgröße lediglich die Größe der „Oberflächenpopulation“ bestimmt wird. Als „Oberflächenpopulation“ bezeichnen sie den Teil der Population, welcher vom Bearbeiter durch die angewandte Methodik erfasst werden kann („apparente Abundanz“). Die „Superpopulation“ schließt die nicht erfassbaren Individuen ein und ist wesentlich größer (BAILEY et al., 2004). Die geschätzte Populationsgröße von 262 Gelbbauchunken stellt somit nur einen Anhaltspunkt dar und kann in der Realität höher sein. Außerdem unterliegt die Größe der „Oberflächenpopulation“ einer jährlich schwankenden Dynamik und ist neben klimatischen Faktoren auch von der Altersstruktur und dem Geschlechterverhältnis der Population abhängig (KAPFBERGER, 1984; MÖLLER, 1992; NIKEISCH, 1995). Um das Extinktionsrisiko der betreffenden Population korrekt abschätzen zu können, wäre eine mehrjährige Untersuchung des Bestandes vonnöten. Nur so können natürliche Fluktuationen in der Populationsgröße von anthropogenen Einflüssen getrennt werden. Für die folgenden Jahre sollten daher regelmäßige Bestandsschätzungen angestrebt werden, welche Vergleichswerte liefern. Bestandsentwicklung Fang-Wiederfang-Untersuchungen wurden an der betrachteten Gelbbauchunken-Population in der Vergangenheit nicht durchgeführt. Die Bestandsentwicklung der Population kann daher nur bedingt interpretiert werden. Populationsgrößenschätzungen liegen nur für die Jahre 1993 (BELLSTEDT et al., 1994), 1998 (SERFLING, 1998) und 1999 (MEY, 1999) vor. BELLSTEDT et 77 Diskussion al. (1994) ermittelten für 1993 einen Mindestbestand von 3.300 Gelbbauchunken auf der Fläche des Untersuchungsgebietes. Sie schätzten die Gelbbauchunken-Population, einschließlich der Bereiche südlich des Nationalparkes und der angrenzenden Waldstücke, auf mehr als 10.000 adulte Exemplare. Laut ihren Aussagen handelte es sich zu dieser Zeit um den individuenstärksten Bestand der Art in Deutschland (BELLSTEDT et al., 1994). Da zu dieser Schätzung weder eine Datengrundlage noch eine Methodik vorliegen, muss dies jedoch kritisch betrachtet werden. Dass es sich bei der untersuchten Population während der militärischen Nutzung um einen Massenbestand gehandelt haben muss, bringt indessen auch MEY (1988) zum Ausdruck. Er konnte in einem milden Sommer zwischen 1978 und 1987 über 1000 adulte Unken auf einer Fläche von circa 3 ha zählen. Nach der Aufgabe der militärischen Nutzung schätzte SERFLING (1998) den Bestand im Untersuchungsgebiet auf etwa 750 Tiere (Sichtung von 145 Tieren an zwei Begehungen). Sie ging, wie von MÖLLER (1992) vorgeschlagen, von einer ermittelten apparenten Abundanz von 20 % aus. MEY (1999) schätzte den Bestand im Folgejahr auf 600 Tiere, ohne eine Methodik anzugeben. Vergleicht man die Schätzungen, dann zeigt sich ein Bestandsrückgang der Population um etwa 77 % in fünf Jahren (3.300 in 1993, 750 in 1998) beziehungsweise um 82 % in sechs Jahren (600 in 1999). MÖLLER (1992) gibt für sein Untersuchungsgebiet, ebenfalls ein militärisch genutztes Gelände, einen jährlichen Bestandsrückgang von 23 % in den ersten drei Jahren nach Aufgabe der Nutzung an. SY (1998) ermittelte nach den folgenden sechs Jahren in derselben Population einen Rückgang um nochmals 50 %. Laut meiner Schätzung hat sich die Population des Nationalparkes seit der letzten Untersuchung halbiert (600 in 1999, 300 in 2014). Die angewandte Methodik beinhaltete jedoch eine weitaus intensivere Erfassung der Unken als dies bei den zuvor durchgeführten Studien der Fall war. Es muss daher von einem noch stärkeren und insgesamt erheblichen Rückgang der Population ausgegangen werden. Die inzwischen kritische Bestandssituation der Gelbbauchunken auf dem „Kindel“ ist somit, trotz der erwähnten methodischen Kritikpunkte, offensichtlich. Als Hauptgrund für den Rückgang der Population gilt die Aufgabe der militärischen Nutzung (MEY & SERFLING, 2011; SERFLING, 1998). Durch den Wegfall der künstlichen Dynamik verschlechterten sich die Lebensbedingungen der Gelbbauchunken auf dem „Kindel“. Der Landlebensraum der Art hat sich durch die natürliche Sukzession von einer Offenfläche im Initialstadium in ein teils bewaldetes und verbuschtes Biotop verwandelt. Auch die Anzahl geeigneter Laichgewässer ist durch die voranschreitende Sukzession stark zurückgegangen (MEY & SCHMIDT, 2002). Einen Hinweis darauf gibt die Tatsache, dass viele der von SERFLING (1998) untersuchten Gewässerkomplexe im Jahr 2014 verlandet oder durch zu starken Bewuchs nicht mehr für die Gelbbauchunken attraktiv waren. Ich konnte im Jahr 78 Diskussion 2014 nur noch in sechs der 26 besiedelten Gewässerkomplexe Unken nachgewiesen. Besonders auf den nördlichen Flächen, in der Teilfläche „Zirkel“, entwickelt sich die Landschaft entgegen den Bedürfnissen der Gelbbauchunke. Viele der ehemaligen Laichgewässer in diesem Gebiet waren im Jahr 2014 stark von Vegetation bewachsen und teils verlandet (Anhang J). Seit 2009 gehört dieser Bereich der Kernzone des Nationalparkes an und steht unter Prozessschutz. Da die extensive Beweidung hier bereits im Jahr 2003 eingestellte wurde (NATIONALPARKVERWALTUNG, 2010), konnte die Sukzession seit 11 Jahren ungehindert voranschreiten. Überlebensraten Die im Zuge der Untersuchung berechnete Überlebensrate von durchschnittlich 78 % bezieht sich auf die Fortpflanzungszeit, beziehungsweise auf die Zeiträume zwischen den einzelnen Fangtagen. Die jährliche Überlebensrate sollte etwas niedriger sein, da besonders die Überwinterung ein Mortalitätsrisiko für Amphibien darstellt (WELLS, 2007). GOLLMANN & GOLLMANN (2002) berechneten Mindestüberlebensraten zwischen zwei Jahren von 78 % für Männchen und 81 % für Weibchen. SY & GROSSE (1998) geben als Überlebensrate für adulte Gelbbauchunken auf einem ehemaligen Truppenübungsplatz in Thüringen 80 % an. Auch (DINO et al., 2010) ermittelten Überlebensraten über 80 %. Für eine hohe Überlebensrate adulter Gelbbauchunken spricht auch die hohe Lebenserwartung der Tiere. Nicht selten wurden in Langzeitstudien Tiere mit einem Alter von über 10 Jahren ermittelt (vgl. GOLLMANN, 1996; PLYTYCZ & BIGAJ, 1993; SEIDEL, 1996b; SY, 1998). Der Rekord einer im Terrarium gehaltenen Gelbbauchunke liegt bei 29 Jahren (ABBÜHL & DURRER, 1998). Es gibt jedoch auch Untersuchungen, in denen weitaus geringere Überlebensraten ermittelt wurden. BARANDUN et al. (1997) geben in einer Kiesgrube bei Zürich eine jährliche Überlebensrate von 62 % an. Im südlichen Weserbergland konnten Werte von 23 - 45 % berechnet werden (MARCHAND, 1993). Einen Hinweis darauf, dass diese gegensätzlichen Aussagen methodisch bedingt sein könnten, gibt SY (1988). Er konnte in einem Untersuchungsjahr nur etwa 43 % der im Vorjahr registrierten Tiere wiederfangen, während er in anderen Jahren bis zu 80 % wiederfing. Unken die nach der Überwinterung nicht wiedergefangen wurden, könnten abgewandert sein oder sich in anderen Bereichen des Habitats aufhalten. Der „Verlust“ eines markierten Tieres darf nicht automatisch als dessen Tod gewertet werden. Auch in meinem Fall könnte die Überlebensrate der Population daher höher sein. 79 Diskussion Altersstruktur Der übliche Altersaufbau einer Gelbbauchunken-Population besteht aus frisch metamorphosierten, juvenilen Tieren, den im Vorjahr metamorphosierten, subadulten Tieren und den Adulten (KAPFBERGER, 1984). Die letztgenannte Gruppe besteht aus Tieren sehr verschiedenen Alters. Der Anteil der einzelnen Altersklassen an der Gesamtpopulation hängt von dem Reproduktionserfolg der vorangegangen Jahre, von Zu- und Abwanderung und von der Überlebensrate der Unken verschiedenen Alters ab (GOLLMANN & GOLLMANN, 2002). In vielen untersuchten Gelbbauchunken-Populationen machen die Altersklassen der juvenilen und subadulten Tiere den zahlenmäßig größten Anteil aus (GOLLMANN & GOLLMANN, 2002). NIEKISCH (1995) fand 77 % juvenile, 20 % subadulte und 3 % adulte Tiere. Auch HOSS (1994) fand mit einem Anteil von 80 % vorwiegend Jungtiere. Eine Gelbbauchunken-Population in den Niederlanden zeigte 86 % Jungtiere und eine Population der Schwesterart Bombina bombina sogar 96 % Jungtiere (BANNIKOV, 1950; NIEUWENHOVEN-SUNIER et al., 1965). Auch KAPFBERGER (1982) fand überwiegend juvenile und subadulte Unken in einer Tongrube bei Nürnberg. Übereinstimmend mit diesen Autoren, bildeten Juvenile in meiner Population die größte Altersklasse. Subadulte Tiere stellten allerdings unter 1 % der Population dar. JAHN et al. (1996), SEIDEL (1988) und SY (1998) ermittelten Anteile subadulter Tiere unter 5 % und schlossen auf einen geringen Reproduktionserfolg des Vorjahres. HÖPFER (2014) konnte in einer GelbbauchunkenPopulation im Ennert bei Bonn gar keine subadulten Tiere nachweisen. Alle Autoren führen suboptimale Fortpflanzungsbedingungen, wie fehlende Laichgewässer oder Trockenheit im Sommer, als mögliche Gründe an. Ein geringer Reproduktionserfolg im Vorjahr wird auch für die untersuchte Population angenommen und im Absatz „Reproduktion“ begründet. Für Bombina variegata wurde eine verstärkte Wanderbereitschaft in den ersten zwei bis drei Jahren nach der Metamorphose nachgewiesen (BESHKOV & JAMESON, 1980; GOLLMANN & GOLLMANN, 2002). Es ist insofern möglich, dass sich die Subadulten vermehrt außerhalb der Gewässerkomplexe aufhielten und daher nicht registriert wurden. Ähnliches schildert HARTEL (2008). Ein geringer Anteil dieser Altersgruppe sollte daher nicht a priori als erfolglose Reproduktion der Vorjahre interpretiert werden. 80 Diskussion Geschlechterverhältnis Das Verhältnis zwischen Männchen und Weibchen sollte in den meisten GelbbauchunkenPopulationen annähernd ausgewogen sein (BEGON et al., 1996; GOLLMANN & GOLLMANN, 2002; KAPFBERGER, 1984; SEIDEL, 1988). Gleichwohl ermittelte ich für die GelbbauchunkenPopulation des „Kindels“ ein unausgewogenes Geschlechterverhältnis zu Gunsten der männlichen Tiere (71%). In den Studien einiger anderer Autoren zeigte sich ein ähnliches Bild. OBERT (1976) ermittelte in einer Population bei Bonn in drei Jahren einen Männchenanteil von 75 - 80 %. In einer Population entlang eines Flusslaufes im Balkangebirge wurden dreimal so viele Männchen wie Weibchen nachgewiesen (76 %) (BESHKOV & JAMESON, 1980). Auch DINO et al. (2010) fanden in seiner über 20 Jahre andauernden Studie stets mehr männliche als weibliche Tiere. Derartige Ergebnisse spiegeln jedoch nicht das tatsächliche Geschlechterverhältnis der Populationen wider (GOLLMANN & GOLLMANN, 2002). Bei allen Untersuchungen, inklusive der vorliegenden Arbeit, wurde sich bei der Unkensuche größtenteils auf die Gewässerkomplexe konzentriert. Da sich männliche Gelbbauchunken über eine längere Zeit an den Reproduktionsgewässer aufhalten und dort auch weitaus präsenter sind als Weibchen, wird man bei einer solchen Methodik vermehrt Männchen fangen (KAPFBERGER, 1984; SEIDEL, 1988; NIEKISCH, 1995; SY & GROSSE, 1998). Weibchen wandern nach der Fortpflanzung oft ab und halten sich dann im Landlebensraum auf. Einen Hinweis hierauf gibt BARANDUN (1995), der im Verlauf der Fortpflanzungszeit an den Laichgewässern mehr Männchen als Weibchen vorfand, während sich im Waldgebiet mehr weibliche Unken aufhielten. Untersuchungen die größere Landlebensräume einbezogen, zeigen in der Regel ein ausgeglichenes Geschlechterverhältnis (HERMANN, 1994; KRÜGER, 2006; MÖLLER, 1992; NIEKISCH, 1995; SEIDEL, 1988). Besonders erwähnt seien in diesem Zusammenhang die langjährigen Untersuchungen von GOLLMANN & GOLLMANN (2002) an einer Gelbbauchunken-Population im Wienerwald in Österreich. Bei der seit 1996 zeitweise wöchentlich untersuchten Population konnten sie ein nahezu ausgeglichenes Geschlechterverhältnis feststellen. Auf ein saisonal unterschiedliches Geschlechterverhältnis weist KAPFBERGER (1984) hin. Während sie im Mai und August mehr Weibchen fing, registrierte sie im Juni und Juli, während der Hauptreproduktionszeit der Unken, mehr männliche Tiere. In meiner Studie konnte allerdings ein nahezu konstantes Verhältnis der Geschlechter über alle fünf Untersuchungsmonate feststellt werden (Abschnitt 4.2.4). Auch in den Studien von SY (1998) und HÖPFER (2014) fehlt eine saisonalen Schwankungen im Geschlechterverhältnis. Eine mögliche Erklärung liefert die unterschiedliche Methodik. Untersucht man lediglich die 81 Diskussion Reproduktionsgewässer, wie KAPFBERGER (1984) es tat, wird man wenig Weibchen antreffen, da sich diese vermehrt in den Aufenthaltsgewässern aufhalten (vgl. BARANDUN, 1986; SEIDEL, 1988; NIEKISCH, 1995). MÖLLER (1992, 1996) konnte mithilfe eines Fangzauns zeigen, dass Weibchen die Reproduktionsgewässer nur kurzzeitig zum Laichen aufsuchen, während sich Männchen über die gesamte Laichperiode in ihnen aufhalten. Er ermittelte daher ein saisonal schwankendes Geschlechterverhältnis in den Reproduktionsgewässern, nicht jedoch in den Aufenthaltsgewässern. Größen und Gewichte Die ermittelten Kopf-Rumpf-Längen und Körpergewichte der Gelbbauchunken auf dem „Kindel“ bewegten sich in dem für mitteleuropäische Gelbbauchunken typischen Rahmen (Tabelle 5.1). Die Unterschiede zwischen den Geschlechtern spiegeln den generellen Trend bei Bombina variegata wider, der zeigt, dass weibliche Unken im Durchschnitt größer und schwerer sind als männliche (ABBÜHL & DURRER, 1993; NÖLLERT & GÜNTHER, 1996). Das größte und schwerste Tier, ein Weibchen, war 51.5 mm groß und wog 9.6 g. Das größte von MEY (1989) in der Region Eisenach vermessene Tier war 55 mm groß. SY (1998) konnte im Norden von Thüringen eine maximale Körperlänge von 45 mm und ein maximales Gewicht von 9.5 g feststellen. Die subadulten und juvenilen Tiere zeigen annähernd dieselben Größenund Gewichtsmaße wie sie SY (1998) für diese Altersklasse bestimmte (Tabelle 5.1). Da sich die Ergebnisse der beiden Messmethoden (Schieblehre und PC) signifikant voneinander unterschieden, sollten Vergleiche mit Literaturwerten nur bei gleicher Methodik durchgeführt werden. Die größeren Kopf-Rumpf-Längen bei der PC Messung erklären sich durch die gestreckte Haltung der Tiere in der Petrischale. Auch SEIDEL (1993) stellte fest, dass Tiere, welche er beim Messen zwischen zwei Platten fixierte bis zu 8 % größer waren, als bei der Messung mittels Schieblehre. GOLLMANN & GOLLMANN (2002) schlussfolgern, dass man genauere Messergebnisse erhält, wenn man die Tiere an eine feste Unterlage drückt. Die Bestimmung der Kopf-Rumpf-Länge mittels passender Software am PC wurde in vergangenen Studien an Bombina variegata selten durchgeführt, weshalb ausreichend Vergleichswerte fehlen. Ich sehe darin eine praktische und zudem exakte Methode mit hohem Potential für zukünftige Untersuchungen. Da die meisten Bearbeiter bereits mit digitaler Bauchseitenfotografie und anschließender Auswertung am PC arbeiten, ergäbe sich kein zusätzlicher Arbeitsaufwand. Die Vermessung der Tiere im Gelände würde entfallen, was den Bearbeitern Zeit und den Tieren Stress erspart. 82 Diskussion Tabelle 5.1 Vergleichswerte für Kopf-Rumpf-Längen (KRL) und Körpergewichte von Gelbbauchunken in verschiedenen Populationen. Untersuchungsgebiet (Quelle) Eigene Untersuchung Thüringen (SY, 1998) Österreich (SEIDEL, 1988) Bayern (KAPFBERGER, 1984) KRL [mm] Körpergewicht [g] n MW ± sd n MW ± sd ♂♂ 108 41.3 ± 4.2 108 5.8 ± 1.4 ♀♀ 44 42.6 ± 5.0 44 6.7 ± 1.9 sub 4 26.5 ± 6.4 4 1.9 ± 0.8 juv 178 15.9 ± 1.7 178 0.4 ± 0.2 ♂♂ 108 38.2 ± 3.5 ♀♀ 44 40.6 ± 4.9 sub 4 27 ± 1.7 ♂♂ 807 38.9 ± 2.1 807 6.0 ± 1.0 ♀♀ 797 39.8 ± 2.3 797 6.1 ± 1.2 sub 85 27.4 ± 2.8 85 2.2 ± 0.6 juv 125 15.9 ± 2.4 125 0.4 ± 0.2 ♂♂ 1910 45.0 ± 2.2 1910 5.7 ± 0.9 ♀♀ 2081 45.9 ± 2.6 2085 6.0 ± 1.1 Geschlecht ♂♂ 38.7 ♀♀ 38.5 sub 21 - 29 juv 10 - 18 PC Schieblehre Schieblehre Schieblehre Schieblehre ♂♂ 13 43.4 ± 0.3 13 6.0 ± 0.1 ♀♀ 17 46.2 ± 0.2 17 7.3 ± 0.1 juv 56 19.7 ± 0.2 Österreich (MIESLER & GOLLMANN, 2000) ♂♂ 50 45.1 ♀♀ 38 48.1 Rumänien (BĂNCILĂ et al., 2010) ♂♂ 440 41.4 ± 0.2 440 5.6 ± 1.3 ♀♀ 599 40.8 ± 0.2 599 5.5 ± 1.9 juv 427 17.6 ± 0.2 427 0.5 ± 0.5 NRW (HÖPFER, 2014) Bestimmung der KRL PC Schieblehre Die Größen- und Gewichtsunterschiede der adulten Unken zwischen den beiden Teilgebieten SS und HB können verschiedene Gründe haben. Neben möglichen Unterschieden in der Qualität der Habitate, welche sich in den Ernährungszuständen der Tiere ausdrücken, könnten die Dichten der beiden Teilpopulationen eine Rolle spielen. Im Vergleich zur Gesamtfläche fanden sich im Gebiet HB weitaus mehr von Gelbbauchunken besiedelte Gewässer, als im Gebiet SS (80% der Unken). Hohe Populationsdichten führen zu einer gesteigerten intraspezifischen Konkurrenz und äußern sich unter anderem in einem geringeren Wachstum der Tiere der Population (BEGON et al,. 1996). Ein weiterer Grund kann eine unterschiedliche Altersstruktur in den beiden Teilpopulationen sein. Durch die geringe Zahl an verfügbaren Laichgewässern und den geringen Reproduktionserfolg im Gebiet SS, besteht diese Teilpopulation vermutlich aus einem höheren Anteil älterer Gelbbauchunken. 83 Diskussion Diese sind meist größer und schwerer als jüngere Unken (vgl. KAPFBERGER 1982, 1984). Eine genetisch unterschiedliche Abstammung der Tiere der beiden Teilpopulationen, welche die unterschiedlichen Größen erklären könnte, ist nach PFEIFFER (2014) eher unwahrscheinlich. Die Autorin fand zwar genetisch unterschiedliche Abstammungslinien innerhalb der „Kindel“-Population. Diese betrafen jedoch lediglich das Gebiet HB. Bei der Verteilung der adulten Unken auf Größenklassen ergaben sich verschiedene Gipfel, das heißt Größenklassen mit besonders vielen Tieren. Diese lagen bei 36 - 40 mm und bei 42 - 48 mm. KRÜGER (2006) ermittelte in einer Gelbbauchunken-Population in Bayern ein ähnliches Muster. Tiere des ersten Gipfels waren bei ihm 30 - 34 mm groß, solche des zweiten 40 - 44 mm. Eine solche Verteilung lässt sich wahrscheinlich auf die Altersstruktur der Population zurückführen. Die Gruppe der kleineren Individuen des ersten Gipfels sollten jünger sein, als Tiere des zweiten Gipfels. Da das Wachstum bei Unken mit zunehmender Größe und nach der Geschlechtsreife abnimmt, ist die Größe jedoch kein sicherer Indikator für das Alter der Tiere (PLYTYCZ & BIGAJ, 1993; DI CERBO, 2001). Adulte Unken verbleiben teils über Jahre hinweg in derselben Größenklasse (PLYTYCZ & BIGAJ, 1993). Es lässt sich somit nicht sagen, um wie viele Jahre sich die Tiere der beiden Gipfel unterscheiden. 5.2 Ortsbeziehungen Dispersion Während die Art das Untersuchungsgebiet zur Zeit der militärischen Nutzung flächendeckend besiedelte (BELLSTEDT et al., 1994), findet sich heute ein insulares Verteilungsbild (Abbildung 4.19). Die starke Konzentration von Individuen im Gebiet HB ist in erster Linie auf den hohen Gewässerreichtum zurückzuführen. Die untersuchten Gewässerkomplexe bestanden aus jeweils 4 - 10 Einzelgewässern und deckten das von Gelbbauchunken benötigte Spektrum an Aufenthalts- und Laichgewässern ab. Im Teilgebiet SS fehlte dieser Gewässerreichtum, was wiederum die geringe Reproduktion und Populationsgröße in diesem Gebiet erklären kann. Drei der fünf untersuchten Gewässerkomplexe bestanden aus nur einem Einzelgewässer. Eine große Anzahl von Gewässern mit unterschiedlichen Eigenschaften, wie sie sich im Teilgebiet HB findet, ermöglicht es den Gelbbauchunken ihren Laich auf verschiedene Gewässer aufzuteilen (räumliche Risikostreuung). Auf diese Weise kann einem Totalausfall der Reproduktion entgegen gewirkt werden, was das langfristige Überleben der Population sichert (ABBÜHL & DURRER, 2000; HEUSSER, 1961). 84 Diskussion Wie durch die heutige Dispersion ersichtlich wird, wirkt sich die extensive Beweidung auf den südlichen Flächen (HB, SS) förderlich auf die Gelbbauchunken-Population aus. Während SERFLING (1998) rund 36 % des damaligen Gelbbauchunken-Bestandes im Teilgebiet HB feststellte, waren es 2014 fast 89 %. Die Mehrzahl der Tiere (63 %) wies sie im Jahr 1998 im Teilgebiet ZI nach, welches zu dieser Zeit noch beweidet wurde (NATIONALPARKVERWALTUNG, 2010). Für das Fehlen der Tiere im Jahr 2014 wird daher das vorangeschrittene Sukzessionsstadium als Grund verstanden. Eine schlechtere Qualität oder Eignung der Gewässer des Gebietes ZI konnte im Zuge der Untersuchung ausgeschlossen werden (Abschnitt 4.5.2.2). Im Jahr 2007 fand die letzte Reproduktion der Gelbbauchunken auf der Fläche ZI statt (MEY, mdl. Mitt.; MEY & SERFLING, 2011). Durch die hohe Lebenserwartung der Art muss davon ausgegangen werden, dass ein Teil dieser Unken noch lebt. Folglich stellt sich die Frage, ob diese Tiere in die südlichen Bereiche abwanderten oder im Gebiet ZI verblieben sind und auf günstige Laichbedingungen warten. Ein solches Abwarten wird bei Gelbbauchunken angenommen, da sie sich über Jahre hinweg reproduzieren können und die Reproduktion in Jahren ungünstiger Bedingungen aussetzen (BARANDUN & REYER, 1997). Eine Abwanderung der Tiere ist jedoch gleichermaßen denkbar. Die Distanz zwischen den Gewässern der drei Teilflächen beläuft sich auf 500 - 3500 m. Solche Entfernungen können von Gelbbauchunken zurückgelegt werden (GOLLMANN et al., 2000; JACOB et al., 2009). MEY (1999) konnte nachweisen, dass die Gelbbauchunken auf dem „Kindel“ auch zwischen den Nationalparkflächen und den südlicheren Bereichen des Industriegebietes pendeln. Er nimmt daher an, dass alle Subpopulationen im Untersuchungsgebiet miteinander vernetzt sind und ein Individuenaustausch auf der gesamten Fläche des ehemaligen Truppenübungsplatzes stattfindet (MEY, mdl. Mitt.). Die räumliche Nähe fördert den genetischen Austausch zwischen den Subpopulationen und senkt das Risiko eines Aussterbens der Gesamtpopulation. Angesichts der geringen Populationsgröße auf dem „Kindel“, ist der Bestand jedoch auch bei einer hinreichenden Vernetzung von einem erhöhten Extinktionsrisiko durch stochastische Zufallsprozesse betroffen. Ortstreue Die ermittelten Daten zur Wanderaktivität der Gelbbauchunken im Untersuchungsgebiet geben größtenteils die Wanderbewegungen zwischen den Laichgewässern in den Sommermonaten wieder. Binnen dieser Zeit zeigen Gelbbauchunken eine besonders starke 85 Diskussion Ortsbindung an ihre Laichgewässer, was durch verschiedene Freilandstudien und durch Verfrachtungsversuche belegt wurde (KAPFBERGER, 1984; MÖLLER, 1992; MÖLLER, 1996; BARANDUN & REYER, 1997; HARTEL, 2008; JACOB et al., 2009). KAPFBERGER (1984) und NIEKISCH (1990) beobachteten, dass die Mehrheit der adulten Tiere nach einer Verfrachtung an ihr Ursprungsgewässer zurückkehrte, selbst wenn sie dazu Distanzen über 400 m zurücklegen mussten. Auch in meiner Untersuchung war ein großer Teil der untersuchten Gelbbauchunken ortstreu (95 %). In einer von MÖLLER (1992) untersuchten Population in Nordthüringen zeigten im Jahr 1990 83 % der Tiere eine Standorttreue und im Jahr 1991 86 %. Unter 10 % der Tiere wechselten in seiner Studie den Gewässerkomplex. In meinem Fall wechselten lediglich 5 % den Komplex (Abschnitt 4.3.2). Der Anteil ortstreuer Unken nimmt mit dem Betrachtungszeitraum jedoch ab. Über einen Zeitraum von drei Jahren waren in der Untersuchung von MÖLLER (1992) nur noch knapp 50 % der Tiere standorttreu. In einem Steinbruch in Österreich zeigten 61 % der untersuchten Tiere eine Ortstreue über drei Jahre hinweg (SEIDEL, 1988). Die Ortsbindung wird unter anderem von der Art und Lage der vorhandenen Gewässer beeinflusst und hängt stark vom jeweiligen Habitat ab (GOLLMANN & GOLLMANN, 2002). SY (1998) konnte beispielsweise auch nach über sieben Jahren noch 91 % der Unken innerhalb einer Entfernung von 100 m vom Erstfundort fangen. In einer Population in Niedersachsen wurden nach zwei Jahren noch zwei Drittel der wiedergefangenen Tiere weniger als 20 m von ihrem alten Fundort entfernt angetroffen (HERRMANN, 1994). Für eine zeitlich unterschiedliche Ortsbindung spricht eine Studie von HARTEL (2008). Über drei Jahre hinweg schwankten die Anteile der ortsreuen Tiere in der Population zwischen 31 % und 51 % bei den Männchen und zwischen 27 % und 42 % bei den Weibchen. Eine hohe Standorttreue bei einer Art wie Bombina variegata stellt zunächst einen Widerspruch dar. Eine Pionierart, die darauf angewiesen ist neu entstehende Habitate rasch zu besiedeln, sollte eher sehr mobil sein. Eine mögliche Erklärung liegt in der beschränkten Betrachtung der aquatischen Lebensräume, in denen sich die Tiere nicht dauerhaft aufhalten. In die Auswertung flossen außerdem nur mehrfach gefangene Individuen ein, welche insgesamt nur einen sehr geringen Teil der geschätzten Gesamtpopulation ausmachten (77 Tiere von circa 300). Ob sich die an Land befindlichen Unken ebenso ortstreu verhalten, kann auf diese Weise nicht untersucht werden. Einen Hinweis darauf, dass dem nicht so ist, gibt HARTEL (2008). Für Tiere die sich im Reproduktionshabitat aufhielten, ermittelte er durchschnittliche Aktionsdistanzen unter 200 m. Tiere, die er im Landhabitat fing, hatten sich hingegen bis zu 1300 m von ihrem Ursprungsgewässer entfernt. Eine starke Ortsbindung an ein spezielles Gewässer, zumindest während der Reproduktionszeit, konnte besonders bei den Weibchen nachgewiesen werden. Von einem 86 Diskussion stationären Verhalten weiblicher Unken sprechen auch BARANDUN (1995), GOLLMANN et al. (2000), JACOB et al. (2009) und MARCHAND (1993). Sie fanden Weibchen während der Laichperioden überwiegend in denselben Laichgewässern. GOLLMANN et al. (2000) führen zusätzlich an, dass männliche Gelbbauchunken häufige, kleinräumige Wechsel durchführen. Dies wurde zudem von BESHKOV & JAMESON (1980) in einem Primärhabitat der Gelbbauchunke in Bulgarien beobachtet. HERRMANN (1994) und NIEKISCH (1995) erklären das stationäre Verhalten eines Teiles der Männchen mit der Besetzung von Territorien in den Laichgewässern. Die dominanten Tiere könnten weitere Männchen, besonders jüngere und revierlose, durch intraspezifische Konkurrenz zu häufigen Wechseln zwischen den Laichgewässern bewegen. Dies würde erklären, weshalb ein sehr hoher Anteil der Männchen in meiner Studie (70 %) in verschiedenen Laichgewässern angetroffen wurde. Aktionsdistanzen und Wanderstrecken Einen weiteren geschlechtsspezifischen Unterschied ermittelte ich hinsichtlich der mittleren Aktionsdistanzen und Wanderstrecken der Unken. Weibchen legten im Durchschnitt größere Distanzen zwischen ihren Fundorten zurück und wanderten im Mittel längere Strecken als Männchen (Abschnitt 4.3.3). Die Tatsache, dass insgesamt weniger Weibchen in die Berechnung einflossen (n = 10, Vergleich Männchen: n = 42), bestärkt dieses Verhältnis zusätzlich. Die höhere maximale Aktionsdistanz und Wanderstrecke der männlichen Individuen bedingt sich vermutlich durch die höhere Stichprobengröße dieses Geschlechts. Auch in Untersuchungen von MARCHAND (1993) zeichneten sich besonders die weiblichen Unken durch häufige, weiträumige Wanderungen aus. JACOB et al. (2009) untersuchten den Raumanspruch der Art durch eine mehrjährige Studie an vier Subpopulationen in Niedersachsen. Sie konnten beobachten, dass Weibchen zwischen den Laichperioden weite Strecken im Landhabitat zurücklegten. Als möglichen Grund hierfür nannten sie die Suche nach geeigneten Nahrungshabitaten zwischen den Laichperioden. Weibchen legten dabei innerhalb eines Jahres maximale Strecken von über 2000 m zurück. Eine Rekordstrecke von über 5000 m wurde von einer weiblichen Unke in drei aufeinander folgenden Jahren zurückgelegt. Die längste von einem Männchen zurückgelegte Entfernung über sieben Jahre belief sich auf 1138 m. In gleicher Weise ermittelten MÖLLER (1992) und HARTEL (2008) für Weibchen höhere mittlere Aktionsdistanzen sowie höhere mittlere Wanderstrecken als für Männchen. HARTEL (2008) geht davon aus, dass weibliche Tiere besonders in regenreichen Perioden andere Gewässerkomplexe erkunden, um deren Qualität für die Reproduktion zu 87 Diskussion bewerten. Da die Kosten der Reproduktion für Weibchen höher sind als für Männchen (Produktion von Eiern im Vergleich zu Spermien (HALLIDAY, 1994)), sollte ein reproduktiver Fehlschlag für Weibchen ebenfalls kostspieliger sein. Sie sollten daher bemüht sein, neu entstandene Gewässerkomplexe rasch aufzufinden und für die Reproduktion zu nutzen. Ist ein Gewässer bereits durch Amphibienlarven anderer Arten besetzt, verliert es an Qualität für die Gelbbauchunken (HEUSSER et al., 2002). Das effiziente Auffinden neuer Gewässer, was oft nur durch lange Wanderungen möglich ist, bietet den Tieren daher Vorteile gegenüber Konkurrenten (BARANDUN & REYER, 1998; HARTEL, 2008). Abgesehen von einzelnen Rekordstrecken, finden sich in der Literatur Aktionsdistanzen ≤ 200 m für die Gelbbauchunke. GOLLMANN et al. (2000) berechneten im Wienerwald durchschnittliche Aktionsdistanzen von 200 m für Weibchen und 130 m für Männchen. BESHKOV & JAMESON (1980) ermittelten entlang eines Flusslaufes im Balkangebirge mit 64 m für Männchen und 20 m für Weibchen geringere Aktionsdistanzen. In der bereits erwähnten Population in Niedersachsen zeigten männliche Tiere mittlere Aktionsdistanzen von 79 m und Weibchen von 86 m (JACOB et al., 2009). Die von mir berechneten Aktionsdistanzen fielen ähnlich aus (♂♂ 69 m, ♀♀ 75 m). Auch die ermittelten durchschnittlichen Wanderstrecken der Gelbbauchunken des Untersuchungsgebietes decken sich mit den Literaturwerten (vgl. GOLLMANN et al., 2000; GOLLMANN & GOLLMANN, 2002; SY, 1998). Übereinstimmend mit HARTEL (2008) gehe ich davon aus, dass die Aktionsdistanzen und Wanderstrecken der Gelbbauchunken stark unterschätzt werden, wenn nur die Wanderungen zwischen den Gewässern Beachtung finden. Mithilfe von Fang-WiederfangMethoden können weiträumig wandernde Individuen nur unzureichend festgestellt werden. Ferner wurde darauf hingewiesen, dass die Wahrscheinlichkeit Individuen zu fangen sinkt, je weiter sich diese von der Ausgangspopulation entfernen (GOLLMANN et al., 2000; SMITH & GREEN, 2005). Darüber hinaus konnte in der Untersuchung gezeigt werden, dass die Wanderstrecken der Tiere positiv mit ihren Fanghäufigkeiten korrelierten (Abschnitt 4.3.3). Bei sehr geringen Fangwahrscheinlichkeiten, oder sehr kleinen Populationen, kann es daher zu einer starken Unterschätzung der tatsächlichen Wanderstrecken der Tiere kommen. Die in der vorliegenden und in anderen Untersuchungen ermittelten Aktionsdistanzen und Wanderstrecken können somit nur als Minimalwerte betrachtet werden. Es muss ergänzend dazu davon ausgegangen werden, dass sich das Migrationsverhalten und die genutzten Aktionsräume der Unken stark in Abhängigkeit von den jährlich schwankenden Witterungsverhältnissen und dem Sukzessionsstadium des Lebensraumes verändern (JACOB et al., 2009). Gewässergruppen die in trockenen Jahren nicht für die Reproduktion geeignet sind, 88 Diskussion können in regenreichen Jahren gute Reproduktionshabitate für die Art darstellen. Nur eine langjährige Studie vermag es daher den Raumanspruch der Art korrekt abzuschätzen. 5.3 Phänologie und Reproduktion Phänologie In Abhängigkeit von der geografischen Lage erscheinen die ersten Gelbbauchunken nach der Überwinterung zwischen März und Mai an den Laichgewässern (GOLLMANN & GOLLMANN, 2002). An der nördlichen Arealgrenze in Thüringen beginnt die Aktivitätsphase der Art zwischen Ende April und Anfang Mai (MÖLLER, 1992; SY 1998). Diesen Zeitraum bestätigt MEY (mdl. Mitt.) auch für die Gelbbauchunken des Untersuchungsgebietes. Das verhältnismäßig späte Erscheinen der Tiere im Jahr 2014 (21. Mai) dürfte an den Witterungsverhältnissen gelegen haben. Für die Zuwanderung zu den Laichgewässern benötigen Gelbbauchunken frostfreie, nicht zu trockene Nächte (MÖLLER, 1996). Die mittleren Tagestemperaturen sollten 14 - 18 °C nicht unterschreiten (NIEKISCH, 1990). Mit regelmäßigen Nachtfrösten (bis 04. Mai) und Nachttemperaturen von häufig unter 5 °C (bis 17. Mai) war die erste Hälfte des Monates Mai im Untersuchungsjahr sehr kühl. Des Weiteren war das Frühjahr 2014 mit durchschnittlichen Niederschlägen von nur rund 0.7 mm in den Monaten März und April und 3.2 mm in der ersten Maihälfte, im Vergleich zu den Vorjahren, ungewöhnlich trocken (EXPLORATORIEN ZUR FUNKTIONELLEN BIODIVERSITÄTSFORSCHUNG, 2014). Reproduktion Die Ruf- und Laichperioden der Gelbbauchunken verliefen im Untersuchungsjahr synchron und setzten stets in leichter Verzögerung zu starken Niederschlägen ein (Abschnitt 4.4). Diese erhöhten den Wasserstand der Gewässer oder füllten zuvor vertrocknete Gewässer auf. Ein rasches Ablaichen bei maximalem Wasserstand erhöht die Chance, dass die Larven bis zur Metamorphose heranwachsen. Besonders in Gebieten, in denen der Wasserstand der Laichgewässer in Abhängigkeit zu den Niederschlägen steht, gelten ergiebige Regenfälle als Auslöser für Ruf- und Laichaktivitäten der Gelbbauchunke (OBERT, 1976; SEIDEL, 1988; BARANDUN, 1995). Dies konnte ich besonders nach Ende der starken Trockenheit im Juli beobachten. Am 08. und 09. Juli fielen mit insgesamt 80 mm Niederschlag die stärksten 89 Diskussion Regenfälle der Saison. In den darauffolgenden sechs Tagen legten die Tiere fast die Hälfte aller Eier der Saison ab. Ähnliches beobachteten GOLLMANN et al. (1999) und MIESLER & GOLLMANN (2000) in einer Population im Wienerwald in Österreich. Neben den Niederschlägen spielen steigende Wassertemperaturen und die hormonelle Bereitschaft der Unken eine Rolle für die Induktion der Laichablage (OBERT, 1973; HOSS, 1994). Mehrere Laichperioden, wie ich sie nachweisen konnte, gelten bei Amphibien als evolutive Anpassung an eine Reproduktion in temporären und ephemeren Kleingewässern (HEUSSER, 1961; KAPFBERGER, 1982; SCHMIDT et al., 2015). Das opportunistische Laichen während günstiger Witterungsbedingungen erhöht die Aussicht, dass zumindest ein Teil der Reproduktion erfolgreich ist (zeitliche Risikostreuung). Die Anzahl und Dauer der einzelnen Laichperioden werden dabei von den Umweltbedingungen im jeweiligen Habitat bestimmt (SY, 1998). In ephemeren Gewässern mit stark schwankenden Wasserständen werden meist häufige, über wenige Tage andauernde, Laichphasen ermittelt (SEIDEL, 1988). Dies beobachtete ich in den meisten der Reproduktionsgewässer im Untersuchungsgebiet. Hier konnten fünf, über zwei bis acht Tage andauernde, Laichperioden abgegrenzt werden. BARANDUN (1992) schließt aus einem solchen zeitlichen Laichmuster ein hohes Mortalitätsrisiko für Eier und Larven im Lebensraum. In permanenten oder temporären Gewässern mit stabilem Wasserstand lassen sich hingegen wenige, lang andauernde oder gar keine getrennten Laichperioden feststellen (BARANDUN, 1990). In meinem Untersuchungsgebiet traf dies lediglich auf das Reproduktionsgewässer im Quellgebiet (SS0061) zu. An dieser Stelle laichten die Unken während der gesamten Saison unabhängig von äußeren Faktoren ab. Der Grund hierfür war der gleichbleibende Wasserstand des Gewässers. Den höchsten Mortalitätsfaktor für die Entwicklungsstadien der Gelbbauchunke stellte die frühzeitige Austrocknung ihrer Laichgewässer dar. Knapp die Hälfte der Gelege aus dem Jahr 2014 vertrocknete. Solche Verluste sind bei Gelbbauchunken keine Seltenheit und eingeplant. Auf einem ehemaligen Truppenübungsplatz bei Zürich entwickelten sich in zwei Untersuchungsjahren nur 7 % beziehungsweise 13 % des Laiches bis zur Metamorphose, 79 % beziehungsweise 37 % der Mortalität war dem Trockenfallen von Tümpeln geschuldet (BARANDUN, 1996). Im Wienerwald in Österreich konnten sich, bedingt durch Trockenheit, in manchen Jahren lediglich 2 % der Larven vollständig entwickeln (MIESLER & GOLLMANN, 2000). In einer Gelbbauchunken-Population im Ennert bei Bonn blieben im Jahr 2013 75 % aller Laichereignisse erfolglos. SEIDEL (1988) beobachtete in einigen Jahren sogar das Vertrocknen des gesamten Laiches einer Gelbbauchunken-Population. Eine erfolglose Reproduktion gefährdet jedoch nicht unmittelbar das Überleben der Population, da sich 90 Diskussion Unken über Jahre hinweg reproduzieren und Verluste in humiden Perioden ausgleichen können (SEIDEL, 1988). Auch im Untersuchungsgebiet kann witterungsbedingt von einem Wechsel aus reproduktiv erfolgreichen und erfolglosen Jahren ausgegangen werden. MEY (mdl. Mitt.), welcher die Gelbbauchunken-Population auf dem „Kindel“ seit über 20 Jahren beobachtet, berichtete, dass einem erfolgreichen Jahr mitunter mehrere erfolglose Jahre folgen können. Im Vergleich zu den Vorjahren deutete er den Reproduktionserfolg im Jahr 2014 als außergewöhnlich gut. Einen Hinweis auf eine sehr geringe oder fehlende Reproduktion in den Jahren von 2008 - 2013 geben die Ergebnisse des jährlichen Amphibien-Monitorings des Nationalparkes. In diesem Zeitraum konnte nur in drei der 27 besiedelten MonitoringGewässern eine Reproduktion der Art nachgewiesen werden. Diese brachte in keinem der Jahre mehr als 10 Jungtiere pro Gewässer hervor. Hierfür spricht auch die sehr geringe Anzahl subadulter Tiere in dieser Untersuchung. Abgesehen von einzelnen erfolgreichen Jahren nahm der Reproduktionserfolg der Gelbbauchunken im Untersuchungsgebiet mit der Einstellung der militärischen Nutzung fortwährend ab (MEY, mdl. Mitt.). Als Grund wird auch hier die sukzessionsbedingte Verschlechterung der Gewässer genannt. Zu diesen Erkenntnissen kam ebenso SY (1998), welcher in einer Gelbbauchunken-Population auf einem ehemaligen NVA Militärgelände im Norden Thüringens nach der Aufgabe der Nutzung kaum noch Reproduktion verzeichnete. Darüber hinaus kann der Klimawandel zum Verlust der Fortpflanzungshabitate von Bombina variegata beitragen. Steigende Temperaturen verbunden mit sinkenden Niederschlägen, wie sie auch in Deutschland verzeichnet werden (DILLER & HEBECKER, 2008), können zu erhöhter Evaporation in den Habitaten der Tiere führen. Ephemere und temporäre Gewässer, die bevorzugten Laichgewässer der Art, sind damit zunehmender Austrocknungsgefahr ausgesetzt (WALTHER et al., 2002; BROOKS, 2009). 5.4 Habitatanalyse Landlebensraum Der Landlebensraum in einem Habitat der Gelbbauchunke dient den Tieren als Aufenthaltsort im Sommer und als Überwinterungsquartier im Winter (GOLLMANN & GOLLMANN, 2002). Da Gelbbauchunken die meiste Zeit ihres Lebens an Land verbringen, ist die Qualität des Landlebensraumes mindestens genauso entscheidend, wie die Qualität der Laichgewässer 91 Diskussion (MÖLLER 1992, 1996). Schon geringe ökologische Störungen des Landlebensraumes können zu wesentlichen Bestandseinbußen führen (SEIDEL, 1996). Als geeigneter Landlebensraum für die Art gelten sonnenexponierte Freiflächen mit unebenem Relief und einem reich strukturierten Mosaik aus Rohbodenstellen, lückiger Ruderal- und Gebüschvegetation und sonnenexponierten Tümpeln (FELDMANN & SELL, 1981; BLAB, 1986; MÖLLER, 1993; NIEKISCH, 1995; GENTHNER & HÖLZINGER, 2007). Auf den Untersuchungsflächen besteht ein solcher terrestrischer Lebensraum, der bedingt durch die historische Nutzung sehr vielfältig ist. Neben offenen Grünlandflächen und Ruderalflächen finden sich auch kleine Waldstücke, welche den Tieren sowohl im Sommer, als auch im Winter, geeignete Versteckmöglichkeiten bieten. Bei hoher Lufttemperatur und niedriger Luftfeuchtigkeit dienen nach GOLLMANN & GOLLMANN (2002) besonders Waldflächen als schutzbietendes Habitat. Entscheidend für die offenen Flächen ist eine gewisse Mindestfeuchte. SY (1998) konnte die meisten Gelbbauchunken außerhalb von Gewässern an ganzjährig feuchten bis nassen Hangbereichen finden. In meiner Untersuchung wurden Unken während Hitze- und Trockenperioden an Land gleichermaßen an feuchten, schattigen Stellen unter Steinen oder im Gebüsch vorgefunden. Von ähnlichen Überdauerungsstrategien berichten NIEKISCH (1995), BARANDUN (1996) und GOLLMANN & GOLLMANN (2002). Als Überwinterungsquartier für Gelbbauchunken hat der Wald eine große Bedeutung. Meist verbringt Bombina variegata den Winter im Landlebensraum. Dort suchen sie im Umfeld des Reproduktionshabitats geschützte, bodennahe Winterquartiere auf (GOLLMANN & GOLLMANN, 2002). Infolge höherer Minimaltemperaturen, ausgeglichener Bodenfeuchte und einem größerem Angebot an Hohlraumsystemen im Boden, sind bewaldete Landschaften günstiger für die Überwinterung (NIEKISCH, 1995). Die angrenzenden Laubwälder im Untersuchungsgebiet mit Fagus sylvatica als dominante Baumart bieten der Art daher gute Überwinterungsquartiere. Dementgegen können auch Felsspalten, Bodenrisse oder Gesteinsschutthaufen als Winterquartier dienen. Besonders Letzteres findet sich im Untersuchungsgebiet recht häufig. MÖLLER (1992) fand in einem Kalkschotterhang in unmittelbarer Nähe zum Laichgewässer versteckte Tiere und nahm diesen als Winterquartier an. HERRMANN (1994) wies einen mit Gesteinsschutt abgedeckten Hang als Überwinterungsquartier der Art nach. Ferner finden sich im Untersuchungsgebiet viele eingelassene Betonteile, Bunker und Panzerstellungen mit Versteckmöglichkeiten, welche als Winterquartier in Betracht kommen. 92 Diskussion Gewässer Das Vorkommen von Organismen mit komplexen Lebenszyklen, wie Amphibien, wird oft durch die Verteilung und Qualität ihrer Reproduktionshabitate eingeschränkt (WILBUR, 1980). Ein Überlebensschlüssel von Amphibien ist daher die Fähigkeit der adulten Tiere Reproduktionshabitate aufzufinden und deren Qualität dauerhaft einschätzen zu können (SINSCH, 1991; LAURILA & AHO, 1997). Da typische Gelbbauchunken-Habitate einer ständigen Dynamik unterliegen und daher unvorhersehbare Bedingungen bieten, ist diese Fähigkeit bei Bombina variegata besonders wichtig. Gewässertypen Die häufige Besiedlung der Entwässerungsgräben durch die Gelbbauchunke kann wie folgt erklärt werden. Gräben dienten der Art aufgrund ihrer Größe, Tiefe und Permanenz als Aufenthaltsgewässer während der Sommermonate. Da die Gräben entlang der befestigten Trassen verliefen und sich somit in unmittelbarere Nähe zu den bevorzugten Laichgewässern befanden (Fahrspuren, Pfützen), konnten die Unken die Laichgewässer bei geeigneten Bedingungen schnell aufsuchen. Darüber hinaus dienten die Gräben vermutlich als Vernetzungs- und Ausbreitungsmöglichkeit. Besonders die Teilfläche HB wurde fast vollständig von Gräben durchzogen, die sowohl von Ost nach West, als auch von Nord nach Süd verliefen. Die Hangneigung des Gebietes führte des Weiteren dazu, dass die Gräben im Süden durch ablaufendes Niederschlagswasser aus den nördlichen Bereichen gefüllt wurden. Dadurch fanden die Unken im Süden fast durchgängig wasserführende Teilbereiche innerhalb der Gräben. Die große Bedeutung der Fahrspuren für die Reproduktion von Bombina variegata wurde bereits durch KRACH (1996) diskutiert. Fahrspuren stellten in seiner Untersuchung 13 % aller untersuchten Laichgewässer, in Bezug auf Lurchvorkommen, dar. In meinem Untersuchungsgebiet legten die Gelbbauchunken 41 % aller Eier in Fahrspuren ab. Fahrspuren sind für die Art jedoch nur dann attraktiv, wenn sie regelmäßig befahren werden. Die Fahrzeuge werfen den Detritus aus, verdichten den Boden und verhindern so eine Sukzession des Gewässers (KRACH, 1996). Im Untersuchungsgebiet wird dies durch die Fahrzeuge der Schäfer bewirkt. Die Aufgabe der Beweidung und der dadurch verursachte Verlust der genutzten Fahrspuren im Gebiet würde das Risiko einer verminderten Reproduktion mit sich bringen. 93 Diskussion Ermittelte Parameter Die Hauptgründe einer erfolglosen Reproduktion bei Bombina variegata sind Austrocknung, Prädation und Konkurrenz (BARANDUN & REYER, 1997). Um eine erfolgreiche Reproduktion zu gewährleisten, sollten adulte Tiere daher Laichgewässer wählen, in denen diese drei Faktoren minimal sind. Permanente Gewässer haben aufgrund ihrer Größe und Tiefe ein sehr geringes Austrocknungsrisiko, zeigen jedoch eine hohe Anzahl und Diversität an Prädatoren und Konkurrenten für die Larven (LICHT, 1974; WOODWARD, 1983; BARANDUN, 1992; BARANDUN & REYER, 1997). Temporäre Gewässer weisen hingegen kaum Prädatoren oder Konkurrenten auf, bergen jedoch oft ein hohes Austrocknungsrisiko (BARANDUN & REYER, 1997). Gelbbauchunken stehen daher hinsichtlich der Wahl eines geeigneten Laichgewässers vor einem Dilemma. Für das Anlegen neuer Gewässerkomplexe im Zuge laufender Naturschutzmaßnahmen muss jedoch bekannt sein, welche Faktoren bei der Wahl der Reproduktionsgewässer die größte Rolle spielen und welche Gewässer unter den gegebenen Bedingungen für die Art geeignet sind. Die vorhandenen Gewässer im Untersuchungsgebiet wurden deshalb hinsichtlich verschiedener physikalischer und chemischer Parameter untersucht. Die ermittelten Werte können allerding lediglich als Ist-Werte gesehen werden, welche sich sowohl im Laufe einer Saison, als auch zwischen verschiedenen Jahren stark unterscheiden können. Durch die witterungsbedingt unvorhersehbaren Bedingungen in Habitaten der Gelbbauchunke, liefert eine einjährige Studie lediglich einen Ausschnitt des Gesamtbildes. Gewässergröße Hinsichtlich der Größe der von Gelbbauchunken besiedelten Gewässer zeigte sich, dass Reproduktionsgewässer signifikant kleiner waren als Aufenthaltsgewässer. Bei der Wahl ihrer Reproduktionsgewässer zeigten Gelbbauchunken eine klare Präferenz für kleine Gewässer (< 40 m²), nutzten jedoch vereinzelt auch große Gewässer (> 100 m²). Der Erfolg der Reproduktion war in Gewässern von 5 - 15 m² am größten. Zu ähnlichen Ergebnissen kommt auch WAGNER (1996). Von 89 untersuchten Laichgewässern zeigten 50 % Größen von 5 - 12 m². Den größten Reproduktionserfolg wies er in dieser Größenklasse nach. SY (1998) ermittelte die höchste Anzahl abgelegter Eier in zwei aufeinander folgenden Jahren in Tümpeln zwischen 0.1 und 15 m². Die Gelbbauchunken einer von HÖPFER (2014) untersuchten Population im Ennert bei Bonn bevorzugten sehr kleine Laichgewässer von 2 - 5 94 Diskussion m². Auch Untersuchungen von NIEKISCH (1995) ergaben, dass Gelbbauchunken in kleinen und kleinsten Wasserstellen laichen und großflächige Gewässer als Laichplätze die Ausnahme sind. Als Gründe für die Meidung großflächiger Gewässer nennt er die verstärkte Wellenbildung und den größeren interspezifischen Konkurrenzdruck durch andere im Wasser lebende Arten. Mit der Größe eines Gewässers nimmt meist auch dessen Tiefe zu, weshalb die negativen Effekte tiefer Gewässer, welche im Folgenden diskutiert werden, auch für großflächige Gewässer gelten. JAHN et al., (1996) gehen davon aus, dass die Gewässergröße allein eine eher untergeordnete Bedeutung für die Laichablage von Bombina variegata darstellt. Wichtig ist nach ihnen die Kombination aus Gewässergröße und –tiefe. In meinem Untersuchungsgebiet war das größte Laichgewässer über 220 m² groß, jedoch nur knapp 30 cm tief, was diese Annahme unterstützt. Gewässertiefe und Austrocknungshäufigkeit Die Reproduktionsgewässer waren signifikant flacher als die Aufenthaltsgewässer. Die erfolgreichsten Reproduktionsgewässer zeigten eine Tiefe von durchschnittlich 15 cm. Auch MEY (1988) gibt als bevorzugte Laichplätze von Bombina variegata im Raum Eisenach Gewässer mit Tiefen bis 20 cm an. Zu gleichen Ergebnissen kommen auch HÖPFER (2014) und SY (1998). Die meisten Eier legten Gelbbauchunken in ihren Untersuchungen in Gewässer mit Tiefen von 10 - 30 cm. Gewässer, welche tiefer als 80 cm waren, nutzten Gelbbauchunken in ihren Studien nicht zum Laichen. In meinem Gebiet wurden Gewässer mit einer Tiefe über 50 cm bereits nicht mehr für die Reproduktion, sondern lediglich als Aufenthaltsgewässer, genutzt. KAPFBERGER (1982) konnte die Gelbbauchunke in Gewässern mit Wassertiefen von 15 - 50 cm nachweisen. In tieferen Gewässern fehlte die Art vollständig. Auch WAGNER (1996) und NIEKISCH (1995) beschreiben als bevorzugte Laichhabitate Flachgewässer, deren Tiefe zwischen wenigen Zentimetern und maximal 40 cm liegen. Tiefere Gewässer werden laut NIEKISCH (1995) von den Unken eher selten und dann auch nur in entsprechend flachen Bereichen zum Laichen aufgesucht. Als minimale Wassertiefe während der Laichzeit gibt er 6 cm an. Das flachste Reproduktionsgewässer in meiner Untersuchung hatte eine durchschnittliche Tiefe von 3 cm. Der Vorteil flacher Reproduktionsgewässer liegt in der schnellen Erwärmung des Wassers. Die Wassertemperatur hat einen erheblichen Einfluss auf den Reproduktionserfolg von Bombina variegata und wird daher unter dem Punkt „Besonnung und Wassertemperatur“ näher betrachtet. 95 Diskussion Neben einer hohen Wassertemperatur zeigen flache Gewässer eine geringe Permanenz (Dauer der Wasserführung). Trocknet ein Gewässer regelmäßig aus, können Prädatoren wie Fische, Molche oder Wirbellose keine großen Populationen aufbauen. Tiefe, permanente Gewässer hingegen zeigen meist hohe Prädatorendichten, was die Mortalität der AnurenLarven stark erhöht (BARANDUN, 1992; ABBÜHL & DURRER, 1993; NIEKISCH, 1995; BARANDUN & REYER, 1997; SCHMIDT et al., 2015). SCHEEL (2015) weist darauf hin, dass das Austrocknen eines Gewässers und die damit verbundene Reduzierung der Prädatorendichte das wichtigste Kriterium für eine erfolgreiche Reproduktion von Bombina variegata darstellt. Dies bestätigen auch meine Ergebnisse. Rund drei Viertel aller Eier legten die Gelbbauchunken in Gewässer ab, die 1- bis 2-mal während der Saison (Mai - Oktober) trocken fielen. SY (1998) konnte ebenfalls den überwiegenden Teil abgelegter Eier (> 40 %) in Gewässern finden, die 2-mal trocken fielen. Neben der Reduzierung der Prädation verändert sich mit dem Austrocknen des Gewässers auch die Nahrungsverfügbarkeit für Amphibienlarven. FEIL (2000) konnte in einem experimentellen Versuch nachweisen, dass sich die Qualität und Quantität der Algen zwischen permanenten und temporären Gewässern unterscheidet. Temporäre Gewässer zeigen nach der Neufüllung überwiegend einzellige Algen (WILBUR & ALFORD, 1985), welche von Amphibienlarven besser verdaut werden können als mehrzellige (PETERSON & BOULTON, 1999). Da Algen die primäre Nahrungsquelle für Gelbbauchunken-Larven bilden (GOLLMANN & GOLLMANN, 2002), kann dies einen entscheidenden Einfluss auf deren Wachstum und Entwicklung haben. Regelmäßig austrocknende Gewässer bergen jedoch die Gefahr, dass Larven vertrocknen, bevor sie die Metamorphose erreichen (BARANDUN & REYER, 1997). Amphibien haben im Laufe ihrer Evolution Strategien entwickelt, um dieses Risiko zu minimieren. Eine Zusammenstellung dieser kann SCHMIDT et al., (2015) entnommen werden. Trotz der Vielzahl an Strategien, kann ein zu häufiges Austrocknen der Gewässer nicht unbegrenzt toleriert werden. Die Wasserführung sollte mindestens so lange gewährleistet sein, bis die Larven die Metamorphose erreichen. In meinem Fall erforderte es circa 35 Tage, bis geschlüpfte Larven B. variegatas metamorphosierten und die Gewässer verließen. Nach GOLLMANN & GOLLMANN (2002) benötigen Gelbbauchunkenlarven für ihr Entwicklung je nach Temperatur, Dichte und Nahrungsverfügbarkeit zwischen ein und über drei Monaten. KAPFBERGER (1984) wies eine mittlere Larvaldauer von 50 Tagen in Gefangenschaft nach. Unter einer Wassertemperatur von 27 °C aufgezogene Laven brauchten nach MORAND et al. (1997) durchschnittlich 65 Tage bis zur Metamorphose. In einem Experiment mit Aufzuchtwannen im Freiland metamorphosierten die ersten Larven nach 43 Tagen (SCHELLENBERG, 2012). 96 Diskussion Mögliche Ursachen für die vergleichsweise schnelle Entwicklung der Larven im Untersuchungsgebiet könnten die hohen Wassertemperaturen und die drohende Austrocknung gewesen sein. Es wurde mehrfach gezeigt, dass Larven B. variegatas in der Lage sind ihre Entwicklung zu beschleunigen und so ihre Larvaldauer zu verkürzen, wenn ihr Reproduktionsgewässer auszutrocknen droht (BÖLL, 2002; BUCHHOLZ & LINSENMAIR 1991, SCHELLENBERG, 2012). Während eines Laborversuches metamorphosierten Larven, welche unter Austrocknungsbedingungen gehalten wurden (sinkender Wasserstand, erhöhte Temperatur), bereits nach 25 - 27 Tagen (BÖLL, 2002). Dieses Phänomen wird als adaptive Reaktion auf die unvorhersehbaren Bedingungen und hohen Austrocknungsrisiken in den Laichgewässern B. variegatas verstanden. In meiner Untersuchung konnten auf diese Weise einige Larven der ersten Hauptlaichphase die Gewässer verlassen, bevor diese Ende Juni trocken fielen. Die Reproduktionsgewässer im Untersuchungsgebiet, in denen Laich und Larven bereits zu Beginn der Fortpflanzungssaison vertrocknet waren, nutzten die Unken nicht erneut zum Laichen. Stattdessen wurde in der zweiten Hauptlaichphase vermehrt in tiefere Gewässer gelaicht, welche Charaktereigenschaften von Aufenthaltsgewässern aufwiesen. Dies spricht für einen gewissen Lerneffekt der Tiere. Nach BARANDUN & REYER (1997) sind Gelbbauchunken nicht in der Lage das Austrocknungsrisiko eines Laichgewässers abzuschätzen, da dieses stark von den jeweiligen Witterungsbedingungen abhängt. Es hat jedoch den Anschein, dass die Tiere im Laufe der Saison solche Gewässer meiden, in denen die Reproduktion zuvor austrocknungsbedingt erfolglos verlief. Die Adulten scheinen sich dann im trade-off zwischen einem hohen Austrocknungsrisiko in prädatorenfreien Gewässern und einem geringen Austrocknungsrisiko in prädatorenreichen Gewässern für Letzteres zu entscheiden. Ein Totalausfall der gesamten Reproduktion eines Jahres durch das Trockenfallen der Gewässer wurde bei B. variegata bisher nur in Habitaten nachgewiesen, in denen nicht genügend Gewässer zur Verfügung standen (NIEKISCH, 1995). Sind die Tiere auf wenige Gewässer angewiesen, steigt das Risiko eines Totalausfalles. Wenn jedoch ein reiches Angebot an kürzer- und längerfristig wasserführenden Gewässern vorhanden ist, ist ein Totalausfall durch Austrocknung unwahrscheinlich. Die Austrocknung hat in diesem Fall nur einen geringen Einfluss auf die Bestandsgröße einer Population (FELLENBERG, 1974). Neben regenwassergespeisten Gewässern sollten in Gelbbauchunken-Habitaten folglich auch grundwassergespeiste Gewässer zur Verfügung stehen, welche den Mortalitätsfaktor Austrocknung abschwächen. 97 Diskussion Vegetation In der Literatur werden Reproduktionsgewässer der Gelbbauchunke häufig als vegetationsarm oder vegetationslos beschrieben, während Aufenthaltsgewässer stark von höheren Pflanzen bewachsen sein können (BARANDUN & REYER, 1997; GOLLMANN & GOLLMANN, 2002; NIEKISCH, 1995). Einige Autoren berichten jedoch, dass sich Bombina variegata auch in Gewässern mit üppiger Vegetation fortpflanzt (WAGNER, 1996; ZAHN und NIEDERMEIER, 2004). Meine Ergebnisse spiegeln ein ähnliches Bild wider. Während die Oberfläche und der Gewässerboden der Aufenthaltsgewässer im Schnitt zur Hälfte durch Vegetation bewachsen waren, zeigten Reproduktionsgewässer im Mittel geringere Vegetationsbedeckungen (Abschnitt 4.5.2.2). Nach der Trockenheit im Juni nutzten die Unken hingegen auch stark bewachsene Gräben zum Laichen. Die erfolgreichste Reproduktion wurde allerdings in komplett vegetationsfreien Gewässer nachgewiesen. Ähnliche Ergebnisse erhielten auch SAMIETZ (1989) und WAGNER (1996). Den größten Reproduktionserfolg verzeichneten sie in Gewässern die wenigstens teilweise vegetationslose Bereiche aufwiesen. Anhand des Regressionsmodells konnte ich außerdem einen negativen Zusammenhang zwischen der Vegetationsbedeckung eines Gewässers und der darin enthaltenen Eizahl ermitteln. SY (1998) fand die meisten von Gelbbauchunken abgelegten Eier in Gewässern mit einer Vegetationsbedeckung unter 20 %, was gut mit meinen Ergebnissen übereinstimmt. Ein starker emerser Bewuchs der Gewässer führt unweigerlich zu einer Beschattung der Gewässeroberfläche und somit zu einer geringeren Wassertemperatur, als in vergleichsweise besonnten Gewässern. Die Gelbbauchunken sollten folglich gegenüber submerser Vegetation toleranter sein als gegenüber emerser (NIEKISCH, 1995). Die Vorteile besonnter Gewässer für die Reproduktion von Amphibien werden unter dem Punkt „Besonnung und Wassertemperatur“ detailliert aufgeführt. Die Vegetationsbedeckung eines Gewässers hängt häufig mit dessen Alter zusammen. Mit steigendem Alter und voranschreitender Sukzession finden sich zunehmend höhere Pflanzen wie Röhricht und Schwimmblattpflanzen in Gewässern (GOLLMANN & GOLLMANN, 2002). Neu entstandene Gewässer, wie frische Fahrspuren und Wildsuhlen, zeigen meist kaum bis keine Vegetation und werden von Gelbbauchunken bevorzugt als Laichgewässer genutzt (BÖHLER et al., 2015; WAGNER, 1996). Die von mir gefundenen Unterschiede in der Vegetation der Gewässer-Funktionstypen können demnach durch das Alter der Gewässer bedingt sein. Sind die Gewässer zu alt und wachsen langsam zu, suchen Gelbbauchunken gezielt neue Komplexe auf (GROSSENBACHER et al., 1988; MEY, 1988). NIEKISCH (1995) beobachtete, dass die Zahl der Unken eines vegetationsfreien Absatzteiches mit 98 Diskussion zunehmendem Bewuchs rapide abnahm. Eine Hilfsaktion bei der vegetationslose Gruben von 25 cm Tiefe im Uferbereich des Gewässers geschaffen wurden, führte dazu, dass Unken diese neuen Stellen innerhalb von zwei Tagen besiedelten und sich in derselben Saison in ihnen reproduzierten. Chemische Parameter Die chemischen Parameter in einem Gewässer haben wichtige ökologische Effekte auf Amphibiengesellschaften (FREDA, 1986) und wirken sich speziell auf das Überleben der Larven aus (BEEBEE, 1986; GOSNER & BLACK, 1957). Diese Parameter können insofern entscheidend darüber sein, ob ein Gewässer für Gelbbauchunken geeignet ist. pH-Wert Die Gelbbauchunke gilt, im Vergleich zu anderen Amphibienarten wie Hyla aborea, Rana temporaria oder Bufo bufo, als säureempfindlicher (NIEKISCH, 1995). Negative Effekte durch Übersäuerung sind in der Literatur nur bei vergleichsweise niedrigeren pH-Werten dokumentiert worden. HAIDACHER & FACHBACH (1991) beschrieben Schlupfraten von 0 % bei einem pH-Wert von 4.4. Bei pH-Werten von 4.6 - 4.8 schlüpften 60 - 90 % der Larven. Eine negative Auswirkung zu hoher pH-Werte ist aus der Literatur nicht bekannt. Das regelmäßige Vorkommen von Bombina variegata in Kalksteinbrüchen lässt vermuten, dass die Art in sehr basischen Gewässern vorkommen und sich in diesen reproduzieren kann. In den von mir untersuchten Gewässern ermittelte ich, bedingt durch die Muschelkalkböden, leicht basische pH-Werte zwischen 7.8 und 9.9. NIEKISCH (1995) gibt eine Spanne von 5.3 - 9.5 für Aufenthaltsgewässer an. WAGNER (1996) ermittelte innerhalb der Gewässer einer Niedersächsischen Population pH-Werte zwischen 5.5 und 8.5. BÖHLER et al. (2015) konnten nachweisen, dass Gewässer mit einem pH-Wert < 5 von der Gelbbauchunke nur in Ausnahmefällen besiedelt wurden. Solche mit pH-Werten von 6.4 - 8.0 wiesen hingegen eine stabile Besiedlungswahrscheinlichkeit auf. Die untersuchten Gewässer im Gebiet erscheinen daher hinsichtlich ihres pH-Wertes für die Gelbbauchunke geeignet. Liegen die pH-Werte außerhalb des sauren Bereiches, schließt WAGNER (1996) einen messbaren Einfluss auf die Funktion einzelner Gewässer für die Gelbbauchunken aus. Meine Ergebnisse zeigten jedoch, dass die Gelbbauchunken innerhalb der für sie geeigneten pHSpanne höhere pH-Werte selektierten. Dementsprechend zeigten besiedelte Gewässer 99 Diskussion signifikant höhere Werte als unbesiedelte und Reproduktionsgewässer signifikant höhere Werte als Aufenthaltsgewässer. Auch die Gewässer im Teilgebiet HB, in welchem sich mit Abstand die meisten Unken ansiedelten, zeigten durchschnittlich höhere pH-Werte als Gewässer in den Gebieten SS und ZI. BÖHLER et al. (2015) konnten zeigen, dass die Besiedlungswahrscheinlichkeit sowie die Wahrscheinlichkeit einer erfolgreichen Reproduktion mit steigendem pH-Wert ansteigt. Sie definierten den pH-Wert daher als einen der einflussreichsten Gewässerfaktoren für diese Art. Leitfähigkeit Hohe Leitfähigkeiten wirken sich negativ auf das Wachstum und die Entwicklung von Bombina variegata-Larven aus (BÖLL, 2002). Larven, welche unter hohen Ionenkonzentrationen (650 µs/L) aufwuchsen, metamorphosierten signifikant kleiner und leichter als Larven unter günstigen Bedingungen (150 µs/L) (BÖLL, 2002). Die von mir untersuchten Gewässer zeigten durchschnittliche Leitfähigkeiten von 437 µs/L für Aufenthaltsgewässer und 342 µs/L für Reproduktionsgewässer und lagen somit im unbedenklichen Bereich. Da Reproduktionsgewässer im Schnitt kleiner und flacher waren als Aufenthaltsgewässer und somit höhere Austrocknungsrisiken aufwiesen, erwartete ich in diesen Gewässern höhere Leitfähigkeiten. Die ermittelten niedrigeren Leitfähigkeiten sind vermutlich durch den regelmäßigen Niederschlag bedingt, welcher in kleinen Gewässern dazu führt, dass ein Großteil des Wassers ausgetauscht wird. Die Leitfähigkeit gehörte zu den Parametern mit einem signifikant negativen Einfluss auf die Anzahl abgelegter Eier in einem Gewässer. Gelbbauchunken bevorzugen folglich Gewässer mit niedrigen Leitfähigkeiten für die Reproduktion. In der Literatur wird B. variegata als sehr tolerant gegenüber schlechter Wasserqualität bezeichnet. Einige Autoren erwähnen ihr Vorhandensein in organisch verschmutztem Wasser und sogar in Jauchepfützen (FELDMANN & SELL, 1981; HEUSSER, 1961; MERTENS, 1928). In diesem Zusammenhang wird allerdings von adulten Individuen gesprochen. Eine erfolgreiche Reproduktion ist in diesen Gewässern schwer vorstellbar und anhand der nachgewiesenen Präferenz für geringe Leitfähigkeiten wohl eher ungewöhnlich. 100 Diskussion Sauerstoffgehalt Die Konzentration an gelöstem Sauerstoff im Wasser unterschied sich zwischen den Reproduktionsgewässern und den Aufenthaltsgewässern um durchschnittlich 0.8 mg/L. Die höhere Konzentration in den Reproduktionsgewässern begründet sich vermutlich in der Sauerstoffproduktion durch Algen. Die Reproduktionsgewässer waren im Schnitt kleiner und stärker besonnt und zeigten höhere Wassertemperaturen, was das Algenwachstum und die damit verbundene Photosynthese förderten. Die Unterschiede sind allerdings unwesentlich für die Gelbbauchunken, da sowohl die adulten Tiere, als auch die Larven in der Lage sind aufzutauchen und atmosphärischen Sauerstoff zu atmen (CROWDER et al., 1998; FEDER, 1983; NOLAND & ULTSCH, 1981). Niedrige Sauerstoffgehalte im Wasser können auf diese Weise auszugleichen werden. WASSERSUG & SEIBERT (1975) fanden zudem, durch Studien an Larven von Rana pipiens, Pseudacris triseriata und Bufo woodhousii, heraus, dass es keine Korrelation zwischen der Auftauchrate und dem gelösten Sauerstoff im Wasser gibt, solange ein kritisches Level von 2.5 mg/L nicht unterschritten wird. Da die von mir ermittelten Werte durchschnittlich zwischen 7.2 mg/L und 8.0 mg/L lagen, schließe ich den Sauerstoffgehalt als bedeutenden Gewässerparameter für die Gelbbauchunke in meiner Studie aus. Besonnung und Wassertemperatur Die Besonnung und die Wassertemperatur der Gewässer stellten die wichtigsten Faktoren für die Wahl eines Laichgewässers durch Bombina variegata dar. Es wurden signifikant höhere Besonnungsgrade und Wassertemperaturen in den Reproduktionsgewässern nachgewiesen. Auch die Anzahl der abgelegten Eier im Gewässer stieg mit zunehmender Besonnung an (Abschnitt 4.5.2.3). Einen solchen Zusammenhang ermittelten BARANDUN & REYER (1997) auch für die Wassertemperatur. Ihrer Ansicht nach sind Gelbbauchunken in der Lage ungünstige Wassertemperaturen zum Laichen aktiv zu meiden. Auch andere Anuren-Arten zeigen eine Präferenz für warme Laichgewässer, zum Beispiel Bufo bufo (KUHN, 1993) oder diverse Rana-Arten (SINSCH, 1984; WOLLMUTH et al., 1987). Da die Umgebungstemperatur bei ektothermen Lebewesen, wie Amphibien, in direktem Zusammenhang mit ihrer Körpertemperatur steht, geht eine Erhöhung der Temperatur mit einer Erhöhung ihrer Stoffwechselrate und somit einer Beschleunigung der meisten biochemischen Prozesse im Körper der Tiere einher (HUEY & STEVENSON, 1979; GILLOOLY, 2001). GelbbauchunkenLarven zeigen mit dem Anstieg der Wassertemperatur erhöhte Wachstums- und 101 Diskussion Entwicklungsraten (BÖLL, 2002; SCHELLENBERG, 2012). Dies ermöglicht ihnen schneller zu metamorphosieren und die Bindung an den aquatischen Lebensraum mit seiner relativ hohen Prädations- und Austrocknungsgefahr zu verkürzen (BARANDUN & REYER, 1997). Die Besonnung eines Gewässers, welche zu einer Erhöhung der Wassertemperatur führt, ist daher für eine Art wie Bombina variegata von besonderem Interesse. Dies konnten auch JAHN et al. (1996) in einer der wenigen Studien in einem natürlichen Habitat der Art zeigen. Entlang eines Flusslaufes im französischen Zentralmassiv nutzten Gelbbauchunken lediglich voll besonnte Gewässer als Laich- und Aufenthaltsgewässer. Auf eine hohe Bedeutung einer sonnenexponierten Lage der Gelbbauchunken-Gewässer wird auch von anderen Autoren hingewiesen (vgl. BLAB, 1986; GOLLMANN & GOLLMANN, 2002; HARTEL et al., 2007; MÖLLER, 1993; NIEKISCH, 1995; SEIDEL, 1993). BÖHLER et al. (2015) konnten einen linearen Anstieg der Besiedlungswahrscheinlichkeit eines Gewässer mit der Besonnungsdauer feststellen. Ab fünf bis sechs Stunden direkter Besonnung zeigte B. variegata eine Besiedlungswahrscheinlichkeit von 50%. An hohe Wassertemperaturen über 30 °C scheinen Gelbbauchunken-Larven evolutiv angepasst zu sein (GOLLMANN & GOLLMANN, 2002; NIEKISCH, 1995). Ich konnte in den Reproduktionsgewässern Wassertemperaturen bis 35 °C ermitteln. Auch SCHELLENBERG (2012) konnte zeigen, dass Wassertemperaturen über 34 °C Gelbbauchunken-Larven keine letalen Schäden zufügen. TIBOR (2007) ermittelte für adulte Gelbbauchunken eine kritische maximale Wassertemperatur von 40.3 ± 0.2 °C, womit die Temperaturtoleranz dieser Art über der einiger tropischer Arten liegt (vgl. HUTCHISON, 1982; MAHONEY & HUTCHINSON, 1969). Diese hohen Temperaturen sind für die Tiere langfristig jedoch nicht optimal (HUEY & STEVENSON, 1979). Die bevorzugten Wassertemperaturen unter Laborbedingungen liegen für adulte Gelbbauchunken bei 20.5 - 23.3 °C (TIBOR, 2007) und für Larven bei 24.6 - 29.7 °C (RÜHMEKORF, 1958). Dies hebt die Vielfältigkeit eines geeigneten Habitats für Bombina variegata hervor. Neben stark besonnten, warmen Reproduktionsgewässern, sollten auch teils beschattete Aufenthaltsgewässer mit Mikrohabitaten vorhanden sein, in die sich die adulten Tiere an heißen Tagen zurückziehen können. Konkurrenz und Prädation Das Vorhandensein von Konkurrenten für B. variegata-Larven scheint ein weiteres wichtiges Kriterium für die Wahl eines Laichgewässers zu sein. Im Untersuchungsgebiet wurden nur in einem Viertel der Gewässer, in denen die Art laichte, andere Anuren-Arten oder deren Entwicklungsstadien nachgewiesen. Der Reproduktionserfolg und die Anzahl abgelegter 102 Diskussion Gelbbauchunken-Eier nahmen mit steigender Konkurrenz in den Gewässern ab (Abschnitt 4.5.2.3). Gelbbauchunken-Larven gelten im Vergleich zu anderen heimischen Anuren-Larven als konkurrenzschwacher (NIEKISCH, 1995). Da Arten wie Rana temporaria und Bufo bufo bereits im März laichen, haben deren Larven zur Laichzeit der Gelbbauchunken bereits ein Alter, indem sie Unken-Larven fressen können (HEUSSER, 1970). Neben Konkurrenten gelten sie damit auch als Prädatoren für Gelbbachunken-Larven. NIEKISCH (1995) beobachtete, dass Unkenlaich durch Grasfroschlarven vollständig vernichtet werden kann. Kannibalismus findet jedoch auch intraspezifisch statt. Ich beobachtete mehrfach, wie ältere GelbbauchunkenLarven frischen Laich fraßen. Auch BUSCHMANN (2003) schilderte ein solches Verhalten. GOLLMANN & GOLLMANN (2002) weisen jedoch darauf hin, dass Laichfraß nur unter speziellen Bedingungen vorkommt und Gelbbauchunken-Larven auch in Vergesellschaftung mit anderen Anuren-Arten zur Metamorphose gelangen können. Neben Anuren-Larven stellen Molche, Coleoptera-Larven, Odonata-Larven, Vögel und vereinzelt auch Säugetiere Prädatoren für Laich und Larven der Gelbbauchunke dar (BARANDUN, 1995; GOLLMANN & GOLLMANN, 2002). Diese Arten können in einem kleinen Gewässer den kompletten Fortpflanzungserfolg verhindern (NIEKISCH, 1990). Neben direktem Fraß wird das Mortalitätsrisiko der Larven durch die reine Anwesenheit von Fressfeinden erhöht (BÖLL, 2002). Waren Larven gekäfigten Fressfeinden ausgesetzt, reduzierten diese ihre Aktivität und folglich ihre Nahrungsaufnahme. Die Mortalität dieser Versuchsgruppe erhöhte sich unter Laborbedingungen um 17 % (BÖLL, 2002). In meinen Untersuchungen stellten Prädatoren jedoch ein vergleichsweise geringes Mortalitätsrisiko für die Larven dar. Prädatoren wurden stets in geringer Zahl und nie permanent in Gewässern festgestellt. Bombina variegata reproduzierte sich im Untersuchungsgebiet ebenso erfolgreich in Gewässern, in denen Prädatoren vorhanden waren. Ähnliche Beobachtungen machten auch (BARANDUN & REYER, 1997; HARTEL et al., 2007; KRACH, 1996; MÖLLER, 1992; SY, 1998). 103 Diskussion Zusammenfassend sollte ein geeignetes Reproduktionsgewässer für Gelbbauchunken folgende Parameter aufweisen: 5 - 35 m² Oberflächengröße 7 - 30 cm Wassertiefe 1 - 2 Austrocknungsvorgänge innerhalb der Sommermonate volle Besonnung (100 % der Gewässeroberfläche) < 30 % emerse und submerse Vegetationsbedeckung oder vegetationslos basische pH-Werte (optimal > 8) Leifähigkeit < 400 µs/L Sauerstoffgehalt > 8 mg/L mittlere Wassertemperaturen ≥ 18 °C (max. 30 °C) frei von Konkurrenten und Prädatoren Es ist zu beachten, dass die angegebenen Gewässerparameter je nach Witterungsbedingungen schwanken und es sich dabei um durchschnittliche Werte aus dem Untersuchungsjahr handelt. Für eine Neuanlage von Gewässern für Bombina variegata ist es zwingend erforderlich, Gewässer mit verschiedenen Eigenschaften (Größe, Tiefe etc.) anzulegen. Dies ermöglicht es den Tieren flexibel auf die gegebenen Witterungsverhältnisse zu reagieren und entsprechend geeignete Gewässer auszuwählen. Die Anlage von Gewässerkomplexen mit mindestens 10 Reproduktionsgewässern und zusätzlichen Aufenthaltsgewässern sollte angestrebt werden. Nur so kann eine räumliche Risikostreuung gewährleistet und die intraspezifische Konkurrenz gemindert werden. 104 6 Naturschutzfachliche Empfehlung Die Gelbbauchunken-Population des ehemaligen Truppenübungsplatzes „Kindel“ stellt auch heute noch den individuenstärksten Bestand der Art in Thüringen dar (MEY, mdl. Mitt.). Ein Aussterben dieser Population würde den Erhaltungszustand der Art im Freistaat maßgeblich verschlechtern. Die Sicherung des aktuellen Bestandes und die Vernetzung des Vorkommens mit anderen Populationen sollten daher zukünftig im Vordergrund stehen. Individuenzahlen wie sie noch zu Beginn der 1990er Jahre in der Population nachgewiesen wurden (BELLSTEDT et al., 1994), wird man zukünftig nicht mehr erreichen. Ein solches Massenvorkommen von Bombina variegata konnte nur durch den militärischen Übungsbetrieb entstehen und lässt sich durch keine andere Nutzungsform erreichen (vgl. (NÖLLERT, 1996; SY, 1998). Dessen ungeachtet sollte der stetige, sukzessionsbedingte Schwund der Laichgewässer im Untersuchungsgebiet mittels geeigneter Maßnahmen reduziert werden. Da Biotoppflegemaßnahmen im Nationalpark durch den angestrebten Prozessschutz nur bedingt möglich sind, sollte zumindest die extensive Beweidung auf den südlichen Flächen langfristig erhalten bleiben. Durch Fraß und Tritt der Weidetiere werden die Gewässer offen gehalten und verdichtet. Auf eine Ausgrenzung der Gewässer sollte deshalb unbedingt verzichtet werden (!) (vgl. MÖLLER, 1992; SY, 1998). Werden beweidungsbedingte Verluste bei der Reproduktion der Unken verzeichnet, könnte eine saisonale Beschränkung der Beweidung Abhilfe schaffen. Die Schäfer sollten darüber hinaus animiert werden mehr Ziegen in ihre Herden einzugliedern, da diese im Vergleich zu Schafen Gebüscharten verbeißen (mdl. Mitt. der Schäfer) und die Sukzession somit effektiver zurückdrängen. Das Befahren des Geländes sollte außerhalb der Fortpflanzungsmonate der Unken kontrolliert stattfinden. Auf diese Weise können neue Fahrspuren geschaffen werden und bestehende Laichgewässer erhalten bleiben. Eine Neuschaffung temporärer Kleingewässer könnte im Zuge eines eventuellen Rückbaus der noch vorhandenen Plattenwege realisiert werden. Die hierfür nötigen schweren Fahrzeuge hinterlassen Fahrspuren und Pfützen, welche als Laichgewässer für die Gelbbauchunke dienen können. Die Munitionsbergungsmaßnahme im Jahr 2007 zeigte, dass die betreffende Population sehr positiv auf solche „Maßnahmen“ reagiert. Die während dieser Aktion entstandenen Fahrspuren wurden noch im selben Jahr intensiv als Laichgewässer genutzt (MEY & SERFLING, 2011). Ziel solcher Bemühungen sollte ein verbesserter Reproduktionserfolg der Gelbbauchunken im Gebiet sein. Dies optimiert die 105 Naturschutzfachliche Empfehlung Altersdurchmischung der Population, stärkt den Bestand und fördert die Ausbreitung. Auf lange Sicht wird es nicht möglich sein die Population ohne regelmäßige Pflegemaßnahmen zu erhalten. Daher muss eine Vernetzung zwischen der GelbbauchunkenPopulation des Nationalparkes und den noch vorhandenen Vorkommen im Umkreis geschaffen werden. An erster Stelle sollten hierbei die Vorkommen im Bereich des südlichen „Kindels“ (Industriegebiet), des „Hinteren Hainaer Holzes“ und entlang der Nesse genannt werden. Diese Vorkommen sind durch die geringe Entfernung (2 - 5 km) und die vorhandenen Tunnelanlagen an der B84 gut durch Individuen der Nationalpark-Population zu erreichen. Während der militärischen Nutzung befand sich im südlichen „Kindel“ der Verbreitungsschwerpunkt der Population des Truppenübungsplatzes. Durch die Bebauung und die inzwischen stark vorangeschrittene Sukzession sind jedoch geeignete Laichgewässer für die Art verschwunden. Die noch vorhandenen Gewässer sind im Verlandungsprozess und für die Gelbbauchunken unattraktiv (Anhang K). Im Jahr 2014 konnte D. Mey (mdl. Mitt.) erstmals wieder (seit 5 - 6 Jahren) eine Reproduktion im Gebiet nachweisen. Als Laichgewässer nutzen die Gelbbauchunken Pfützen, welche bei der Verlegung eines Kabelschachtes entstanden sind. Dies zeigt sehr deutlich, dass die noch vorhandenen Restbestände der Art mit vergleichsweise geringem Aufwand gestärkt werden könnten. Eine Neuanlage von Kleingewässern sollte daher in diesem Gebiet dringend erfolgen. Des Weiteren erscheint eine Vernetzung mit den Vorkommen an der Werra bei Mihla und Ebenshausen, etwa 10 km nordwestlich des Untersuchungsgebietes, effektiv. Das Lauterbachtal zwischen den genannten Vorkommen bietet den Tieren eine gute Wanderroute. Durch eine geringe Bebauung in der Landschaft und wenig frequentierte Fahrwege wird eine Abwanderung der Tiere aus dem Nationalpark begünstigt. In den Gemeinden Berka v. d. Hainich, Bischofroda und Lauterbach befinden sich zudem noch Reliktvorkommen der Gelbbauchunke (MEY, mdl. Mitt.). Durch geeignete Pflegemaßnahmen, wie die Neuanlage von Kleingewässerkomplexen, könnten diese Bestände gestärkt werden und als Trittsteinbiotope dienen. Generell ist eine Rück- und Neubesiedlung von GelbbauchunkenHabitaten für den Erhalt der Art unerlässlich (GLANDT, 2008). Nur so kann ein genetischer Austausch zwischen räumlich getrennten Populationen gefördert werden. Ausgehend von den Auen der Werra und der Nesse, welche den Gelbbauchunken als Primärlebensräume dienten, wurden alle weiteren Gebiete in Westthüringen besiedelt (MEY, 1988; MEY & SCHMIDT, 2002). Die letzten nennenswerten Vorkommen der Art in Thüringen, ungeachtet derer auf den ehemaligen Standortübungsplätzen, befinden sich auch heute noch entlang dieser Flusssysteme (MEY, mdl. Mitt.). Durch eine stellenweise Renaturierung der Flüsse könnten zukünftig Lebensräume geschaffen werden, welche den Primärlebensräumen 106 Naturschutzfachliche Empfehlung der Gelbbauchunke nahe kommen. Geeignete Folgemaßnahmen, wie beispielsweise eine extensive Ganzjahresbeweidung durch Großvieh, könnten in den Auen eine semi-natürliche Dynamik erzielen. Ein ähnliches Projekt wurde bereits erfolgreich an der Fulda in Hessen durchgeführt (NEUBECK & BRAUKMANN, 2014). Diese Form des Artenschutzes, bei dem es langfristig nur minimaler menschlicher Eingriffe bedarf, sollte zukünftig angestrebt werden. 107 Literatur ABBÜHL, R. (1997) Zur Ökologie der Gelbbauchunke (Bombina variegata variegata L.): Populationsdynamik, Habitats-und Verhaltensstudien als Grundlage zum Schutz. Dissertation. Universität Basel. ABBÜHL, R. & DURRER, H. (1993) Zum Bestand der Gelbbauchunke Bombina variegata variegata (L.) in der Region Basel. Verh. Naturforsch. Ges., Basel 103, 73–80. ABBÜHL, R. & DURRER, H. (1998) Modell zur Überlebensstrategie der Gelbbauchunke (Bombina variegata). Salamandra-Bonn 34, 273–278. ABBÜHL, R. & DURRER, H. (2000) Beobachtungen zum Paarungsverhalten der Gelbbauchunke (Bombina variegata variegata). Zeitschrift für Feldherpetologie 7, 1727. BAILEY, L.L., SIMONS, T.R. & POLLOCK, K.H. (2004) Spatial and temporal variation in detection probability of Plethodon Salamanders using the robust capture-recapture design. Journal of Wildlife Management 68, 14–24. BĂNCILĂ, R.I., HARTEL, T., PLĂIAŞU, R., SMETS, J. & COGĂLNICEANU, D. (2010) Comparing three body condition indices in amphibians: a case study of yellow-bellied toad Bombina variegata. Amphibia-Reptilia 31, 558–562. BANNIKOV, A.G. (1950) Age distribution of a population and ist dynamics in Bombina bombina. Doklady Akademii Nauk SSSR 70, 101-103. BARANDUN, J. (1986) Untersuchungen zum Raum-Zeit-System von Gelbbauchunken (Bombina variegata variegata L.). Diplomarbeit. Universität Zürich. BARANDUN, J. (1990) Reproduction of yellow-bellied toads Bombina variegata in a manmade habitat. Amphibia-Reptilia 11, 277–284. BARANDUN, J. (1992) Reproductive flexibility in Bombina variegata (Anura: Discoglossidae). In Proceedings of the Sixth Ordinary General Meeting of European Society of Herpetology pp. 65–68. BARANDUN, J. (1995) Reproductive ecology of Bombina variegata (Amphibia). Dissertation. Universität Zürich. BARANDUN, J. (1996) Vermehrung von Gelbbauchunken: Erkenntnisse und ihre Anwendung im Artenschutz. Naturschutzreport 11, 56–60. BARANDUN, J. & REYER, H.-U. (1997) Reproductive ecology of Bombina variegata: characterisation of spawning ponds. Amphibia-Reptilia 18, 143–154. BARANDUN, J. & REYER, H.-U. (1998) Reproductive ecology of Bombina variegata: habitat use. Copeia, 497–500. 108 Literatur BEEBEE, T.J. (1986) Acid tolerance of natterjack development.Herpetological journal 1, 78–81. toad (Bufo calamita) BEGON, M., HARPER, J.L., TOWNSEND, C.R. (1996) Ecology: individuals, populations and communities. Blackwell Scientific Publications, Oxford. BELLSTEDT, R.,FALSTICH-WARNEYER, T., FRIEDRICH, E., SAMIETZ, J., WAGNER, L., WINTER, R. (1994) LBP Industriegebiet Kindel bei Eisenach: Fauna. unveröff. Mskr. im Auftrag der UTECON GmbH Berlin. BESHKOV, V.A. & JAMESON, D.L. (1980) Movement and abundance of the yellow-bellied toad Bombina variegata. Herpetologica 36, 365–370. BLAB, J. (1986) Biologie, Ökologie und Schutz von Amphibien. Schriftenreihe für Landschaftspflegen und Naturschutz. Blackwell Scientific Publications, Oxford. BMU BUNDESMINISTERIUM FÜR UMWELT, NATURSCHUTZ, BAU UND REAKTORSICHERHEIT. RICHTLINIE 92/43/EWG des Rates vom 21. Mai 1992 zur Erhaltung der natürlichen Lebensräume sowie wildlebenden Tieren und Pflanze. Online im Internet: URL: http://www.bmu.de/fileadmin/bmuimport/files/gesetze_verordnungen/egvo_egrichtlinien/application/pdf/ffh_richtlinie_9243ewg_.pdf [Stand 07.07.2014]. BÖHLER, E., SEIDT, M., ANTHES, N., STRAUB, F., HERMANN, G. (2015) Habitatpräferenzen der Gelbbauchunke (Bombina variegata) im Waldgebiet Rammert (Baden-Württemberg) und Konsequenzen für den Schutz der Art. Zeitschrift für Feldherpetologie 22, 171190. BÖLL, S. (2002) Ephemere Laichgewässer: Anpassungsstrategien und physiologische Zwänge der Gelbbauchunke (Bombina variegata) in einem Lebensraum mit unvorhersehbarem Austrocknungsrisiko. Dissertation. Julius-Maximilians-Universität Würzburg. BROOKS, R.T. (2009) Potential impacts of global climate change on the hydrology and ecology of ephemeral freshwater systems of the forests of the northeastern United States. Climatic Change 95, 469–483. BUCHHOLZ, S. & LINSENMAIR, K. E. (1991) Passen in Pfützen lebende Kaulquappen (Bsp. Bombina variegata) ihre Entwicklungsstrategie an sich verändernde Umweltbedingungen an. Verhandlungen der Deutschen Zoologischen Gesellschaft (84. Jahresversammlung). H.-D. Pfannenstiel (e.d). Gustav Fischer Verlag, Tübingen. BUSCHMANN, H. (2003) Hinweis auf eine räumliche Verteilung von Gelegen bei der Gelbbauchunke (Bombina variegata). Zeitschrift für Feldherpetologie 10, 175-183. CAROTHERS, A.D. (1973) The effects of unequal catchability on Jolly-Seber estimates. Biometrics, 79–100. CORMACK, R.M. (1972) The Logic of Capture-Recapture Estimates. Biometrics 28, 337. CORN, P.S. (2005) Climate change and amphibians. Animal Biodiversity and Conservation 28, 59-67 CROWDER, W.C., NIE, M. & ULTSCH, G.R. (1998) Oxygen uptake in bullfrog tadpoles (Rana catesbeiana). Journal of Experimental Zoology 280, 121–134. 109 Literatur D’ANGELO, S.A., GORDON, A.S. & CHARIPPER, H.A. (1941) The role of the thyroid and pituitary glands in the anomalous effect of inanition on amphibian metamorphosis. Journal of Experimental Zoology 87, 259–277. DI CERBO, A.R. (2001) Ecological studies on Yellow-bellied Toad Bombina v. variegata in Alpine habitats. Biota 2, 17–28. DILLER, C. & HEBECKER, J. (2008) Klimawandel in Deutschland:: Handlungsmöglichkeiten der Regionalplanung. Standort 32, 62–70. DINO, M., MILESI, S. & DI CERBO, A.R. (2010) A long term study on Bombina variegata (Anura: Bombinatoridae) in the ‘Parco dei Colli di Bergamo’(North-western Lombardy). In Atti VIII Congresso Nazionale SHI (Chieti, 22-26 settembre 2010) pp. 225–231. DRECHSLER, A., HELLING, T. & STEINFARTZ, S. (2015) Genetic fingerprinting proves crosscorrelated automatic photo-identification of individuals as highly efficient in large capture–mark–recapture studies. Ecology and evolution 5, 141–151. EXPLORATORIEN ZUR FUNKTIONELLEN BIODIVERSITÄTSFORSCHUNG (2014) Instrumentierung und Fernerkundung (Kernprojekt 3). FB 19 Umweltinformatik. Phillips-Universität Marburg. FEDER, M.E. (1983) The relation of air breathing and locomotion to predation on tadpoles, Rana berlandieri, by turtles. Physiological Zoology, 522–531. FEIL, D. (2000) Experimentelle Untersuchung zur Larvalentwicklung der Gelbbauchunke (Bombina variegata variegata) in Gewässern unterschiedlicher Persistenz, unter besonderer Berücksichtigung der Sukzession von Phyto- und Zooplankton. Praktikumsbericht. Julius-Maximilian-Universität Würzburg. FELDMANN, R. & SELL, M. (1981) Gelbbauchunke–Bombina variegata (LINNAEUS, 1758). Die Amphibien und Reptilien Westfalens.–Abhandlungen des Landesmuseums für Naturkunde Münster 43, 71–74. FELLENBERG, W.O. (1974) Zwei grosse Vorkommen der Gelbbauchunke, Bombina v. variegata (L., 1758), im Kreis Altenkirchen. Dortm. Beitr. Landeskde (Naturw. Mitt.) 7, 37–46. FIS TLUG (2014) Fachinformationssystem der Thüringer Landesanstalt für Umwelt und Geologie. FREDA, J. (1986) The influence of acidic pond water on amphibians: a review. Water, Air, and Soil Pollution 30, 439–450. GENTHNER, H. & HÖLZINGER, J. (2007) Gelbbauchunke Bombina variegata LINNAEUS, 1758. LAUFER, H., FRITZ, K. & P. SOWIG (Hrsg., 2007): Die Amphibien und Reptilien Baden-Württembergs. Ulmer, Stuttgart-Hohenheim, 271–292. GILLOOLY, J.F. (2001) Effects of Size and Temperature on Metabolic Rate. Science 293, 2248–2251. 110 Literatur GLANDT, D. (2008) Heimische Amphibien: Paarungsrufen auf CD-ROM]. Aula-Verlag. bestimmen-beobachten-schützen;[mit GOLLMANN, G. (1996) Zur Populationsbiologie der Gelbbauchunke (Bombina variegata) im Wienerwald. Naturschutzreport 11, 60-63 GOLLMANN, B. & GOLLMANN, G. (2002) Die Gelbbauchunke: von der Suhle zur Radspur. Larenti-Verlag. GOLLMANN, B., GOLLMANN, G. & BAUMGARTNER, C. (1999) Oviposition of yellow-belliedtoads, Bombina variegata, in contrasting water bodies. MIAUD, C & GUYETANT, R. (Hrsg., 1999) Current studies in Herpetology. Le Bourget du Lac (SEH), 139-145. GOLLMANN, B., GOLLMANN, G. & MIESLER, M. (2000) Habitatnutzung und Wanderungen in einer Gelbbauchunken-Population (Bombina v. variegata). Zeitschrift für Feldherpetologie 7, 1–16. GOSNER, K.L. & BLACK, I.H. (1957) The effects of acidity on the development and hatching of New Jersey frogs. Ecology, 256–262. GROSSENBACHER, K., DALANG, T., WILDI, O. & FÜR NATURSCHUTZ, S.B. (1988) Verbreitungsatlas der Amphibien der Schweiz. Centre suisse de cartographie de la faune. HABBEL, A. (1995) Ökologische Untersuchungen an Gelbbauchunke-Populationen im Bergischen Land nach Biotop-Pflegenmaßnahmen. Diplomarbeit. Rheinische Friedrich-Wilhelms-Universität Bonn. HACHTEL, M., SCHLÜPMANN, M., THIESMEIER, B. & WEDDELING, K. (2009) Methoden der Amphibienerfassung–eine Übersicht. Zeitschrift für Feldherpetologie 15, 7–84. HAIDACHER, S. & FACHBACH, G. (1991) Experimentelle Säuretoleranzanalysen von Laich und Larven heimischer Amphibien. Salamandra 27, 108–118. HALLIDAY, T.R. (1994) Sex and evolution. Behaviour and evolution, 150–192. HANSSON, L. (1991) Dispersal and connectivity in metapopulations. Biological journal of the Linnean Society 42, 89–103. HARTEL, T. (2008) Movement activity in a Bombina variegata population from a deciduous forested landscape. North-Western Journal of Zoology 4. HARTEL, T., NEMES, S. & MARA, G. (2007) Breeding phenology and spatio-temporal dynamics of pond use by the yellow-bellied toad (Bombina variegata) population: the importance of pond availability and duration. Acta Zoologica Lituanica 17, 56–63. HENLE, K. (2000) Fang-Wiederfang-Methoden: Generelle Grundlagen, historische Entwicklung und aktueller Entwicklungsstand. Beiträge zur Ökologie 4, 1–14. HERRMANN, D. (1994) Untersuchungen zum Landhabitat und Aktionsraum der Gelbbauchunke (Bombina v. variegata(LINNAEUS, 1758)) im südniedersächsischen Weser- und Leine-Bergland. Diplomarbeit. Universität Hannover. 111 Literatur HEUSSER, H. (1961) Die Bedeutung der äußeren Situation im Verhalten einiger Amphibienarten. Rev. suisse Zool 68, 1–39. HEUSSER, H. (1958) Markierungen an Amphibien. Vierteljahresschrift der naturforschenden Gesellschaft Zürich 101, 189-210. HEUSSER, H. (1970) Laich-Fressen durch Kaulquappen als mögliche Ursache spezifischer Biotoppräferenzen und kurzer Laichzeiten bei europäischen Froschlurchen (Amphibia, Anura). Oecologia 4, 83–88. HEUSSER, H., LIPPUNER, M. & SCHMIDT, B.R. (2002) Laichfressen durch Kaulquappen des Springfrosches (R ana dalmatina) und syntopes Vorkommen mit anderen AnurenArten. Zeitschrift für Feldherpetologie 9, 75–87. HIEKEL, W., FRITZLAR, F., NÖLLERT, A. & WESTHUS, W. (2004) Die Naturräume Thüringens. Thüringer Ministerium für Landwirtschaft, Naturschutz und Umwelt, Jena, Germany. HOSS, U. (1994) Dynamik und Raum-Zeit-System einer Gelbbauchunken-Population. Elaphe, Rheinbach 2, 11–12. HÖPFER, P.E.J. (2014) Reproduktionsbiologische und naturschutzgenetische Untersuchungen an Gelbbauchunken (Bombina variegata L. 1758) im Ennert bei Bonn. Diplomarbeit. Rheinische Friedrich-Wilhelms-Universität Bonn. HUEY, R.B. & STEVENSON, R.D. (1979) Integrating thermal physiology and ecology of ectotherms: a discussion of approaches. American Zoologist 19, 357–366. HUTCHINSON, V.H. (1982) Physiological ecology of the telmatobiid frogs of lake Titiaca. Nat. Geog. Soc. Res. Reports 14, 357-361. JACOB, A., SCHEEL, B. & BUSCHMANN, H. (2009) Raumnutzung in einer Metapopulation der Gelbbauchunke (Bombina variegata) an ihrer nördlichen Verbreitungsgrenze. Zeitschrift für Feldherpetologie 16, 85–102. JAHN, K., KNITTER, H. & RAHMEL, U. (1996) Erste Ergebnisse einer Studie an der Gelbbauchunke (Bombina variegata) in einem natürlichen Habitat im französischen Zentralmassiv. Naturschutzreport 11, 32–46. JOLLY, G.M. (1965) Explicit estimates from capture-recapture data with both death and immigration-stochastic model. Biometrika, 225–247. KAISER, A., MÖLLER, S. (2000) Monitoring an Gelbbauchunken Bombina variegata - ein Schülerprojekt. Beiträge zur Ökologie 4, 83–89. KAPFBERGER, D. (1982) Untersuchungen zur Ökologie der Gelbbauchunke, Bombina variegata variegata L. 1758 (Amphibia, Anura). Diplomarbeit. Universität NürnbergErlangen. KAPFBERGER, D. (1984) Untersuchungen zu Populationsaufbau, Wachstum und Ortsbeziehungen der Gelbbauchunke, Bombina variegata variegata (Linnaeus, 1758). Zoologischer Anzeiger 212, 105–116. 112 Literatur KLAUS, S., REISINGER, E., BIEL, R., FRITZLAR, F., HAUPT, R., HIEKEL, W., NÖLLERT, A., WENZEL, H., WESTHUS, W. (1995) Der Hainich - ein Weltnaturerbe. Landschaftspflege und Naturschutz in Thüringen 32 (Sonderheft), 1-32. KÖBIS, U. (2000) Untersuchungen zur Wald- und Forstgeschichte des ehemaligen Truppenübungsplatzes Kindel. Diplomarbeit. Fachhochschule für Forstwirtschaft Schwarzburg. KRACH, E. (1996) Die Bedeutung von Wagenspuren für das Überdauern von AmphibienPopulationen unter besonderer Berücksichtigung der Ansprüche der Gelbbauchunke. Beiträge zur Naturkunde in Osthessen 32, 115-139. KREBS, C.J. (1999) Ecological methodology. Benjamin/Cummings Menlo Park, California. KRÜG, A. (2006) Analyse und Bewertung von Laich- und Aufenthaltsgewässern, Populationsparametern und Wanderbewegungen einer Gelbbauchunken Population im Lebensraumkomplex Wald um das Naturschutzgebiet Muggenbacher Tongruben. Diplomarbeit. Fachhochschule Weihenstephan Freising. KÜHNEL, K.-D., GEIGER, A., LAUFER, H., PODLOUCKY, R. & SCHLÜPMANN, M. (2009) Rote Liste und Gesamtartenliste der Kriechtiere (Reptilia) Deutschlands. Naturschutz und Biologische Vielfalt 70, 231–256. KUHN, J. (1993) Fortpflanzungsbiologie der Erdkröte Bufo b. bufo (L.) in einer Wildflu\s saue. Zeitschrift für Ökologie und Naturschutz 2, 10. KUHN, J. (1997) Standardisierte Messung von Kopf-Rumpf-Länge von Anuren. Mertensiella 7, 307–314. KUPFERBERG, S.J., MARKS, J.C. & POWER, M.E. (1994) Effects of variation in natural algal and detrital diets on larval anuran (Hyla regilla) life-history traits. Copeia, 446–457. LAURILA, A. & AHO, T. (1997) Do female common frogs choose their breeding habitat to avoid predation on tadpoles? Oikos, 585–591. LICHT, L.E. (1974) Survival of embryos, tadpoles, and adults of the frogs Rana aurora aurora and Rana pretiosa pretiosa sympatric in southwestern British Columbia. Canadian Journal of Zoology 52, 613–627. LINNAEUS, C. (1758) Systema naturae, vol. 1. Systema naturae, Vol. 1. MAHONEY, J.J., HUTCHINSON, V.H. (1969) Photoperiodal acclimation and 24-hour variations on the chritical thermal maxima of a tropical and a temperate frog. Oecologica 2, 143161. MARCHAND, M. (1993) Untersuchungen zur Pionierbesiedlung terrestrischer und limnischer Habitate eines Bodenabbaugebietes im südlichen Wesertal mit besonderer Berücksichtigung der Biologie und Ökologie der Gelbbauchunke, Bombina v. variegata, Linnaeus 1758. Cuvillier. MATTHE, M. (2008) AMPHIDENT Software to analyze digital photographs of amphibians and compare ventral patterns. http://www.amphident.de/eng/index.php. 113 Literatur MCCALLUM, M.L. (2007) Amphibian decline or extinction? Current declines dwarf background extinction rate. Journal of Herpetology 41, 483–491. MERTENS, R. (1928) Zur Naturgeschichte der Europäischen Unken (Bombina). Zeitschrift für Morphologie und Ökologie der Tiere 11, 613–623. MEY, D. (1988) Zum Vorkommen der Gelbbauchunke (Bombina variegata) bei Eisenach (Westthüringen). Veröff. Naturkundemuseum Erfurt 7, 3-11. MEY, D. (1999) Amphibienschutz an Straßen. unveröff. Mskr. MEY, D. & SCHMIDT, K. (2002) Die Amphibien und Reptilien des Wartburgkreises und der Stadt Eisenach (Thüringen). Naturschutz im Wartburgkreis 10, 46-52. MIESLER, M. & GOLLMANN, B. (2000) Populationsstruktur, Wachstum und Fortpflanzung der Gelbbauchunke, Bombina variegata (LINNAEUS, 1758): Ergebnisse aus einer Ein-Jahres-Studie im Lainzer Tiergarten (Wien, Österreich). Herpetozoa, Wien 12, 45–54. MORAND, A., JOLY, P., GROLET, O. (1997) Phenotypic variation in metamorphosis in five anuran species along a gradient of stream influence. Comptes Rendus de l'Academie des Sciences 320, 645-652. MÖLLER, S. (1992) Untersuchungen zur Dispersions-und Abundanzdynamik einer Gelbbauchunkenpopulation (Bombina v. variegata.(L.)) im Landkreis Mühlhausen/Thür. Staatsexamensarbeit, Univ. Jena. MÖLLER, S. (1993) Zur Lebensraumwahl und Fortpflanzungsstrategie der Gelbbauchunke (Bombina variegata) auf einem ehemaligen Truppenübungsplatz im Landkreis Mühlhausen. Landschaftspflege und Naturschutz Thür 30, 30–34. MÖLLER, S. (1996) Dispersions-und Abundanzdynamik einer Population der Gelbbauchunke (Bombina v. variegata) im nordwestlichen Thüringen. Naturschutzreport 11, 46–56. MUSTAFA, O., MAERCKER, J., PFEIFER, C. (2014) Kartierung von Klein- und Kleinstgewässern für die FFH-Art Gelbbauchunke im FFH-Gebiet "Hainich" mittels Drohnenbefliegung. unveröff. Mskr. im Auftrag der Thüringer Landesanstalt für Umwelt und Geologie. MÜHLENBERG, M. (1993) Freilandökologie, vol. 3. Auflage. Quelle and Mayer UTB fur Wissenschaft. NATIONALPARKVERWALTUNG HAINICH (2014) Persönliche Gespräche mit A. Henkel. Bad Langensalza. NATIONALPARKVERWALTUNG HAINICH (Hrsg., 2010) Pflege- und Entwicklungsplan für den Nationalpark Hainich. unveröff. Mskr., Bad Langensalza. NATURA 2000 (2009) Fauna-Flora-Habitatrichtlinie und Vogelschutzrichtlinie – Gebiete und Arten in Deutschland. Online im Internet: URL : http://www.ffh-gebiete.de/ [Stand: 07.07.2014]. NEUBECK, C. & BRAUKMANN, U. (2014) Gelbbauchunke Nordhessen. Deutsche Bundesstiftung Umwelt. 114 Literatur NEWMAN, R.A. (1994) Effects of changing density and food level on metamorphosis of a desert amphibian, Scaphiopus couchii. Ecology, 1085–1096. NIEUWENHOVEN-SUNIER, L. VAN, BREE, P.J.H. VAN, DAAN, S. (1965) Notities over de Geelbuikvuurpad Bombina variegata (linnaeus, 1758) in Nederland. Naturhistorisch Maandblad 54, 7-14. NIEKISCH, M. (1990) Untersuchungen zur Besiedlungsstrategie der Gelbbauchunke Bombina v. variegata Linnaeus, 1758 (Anura, Amphibia). NIEKISCH, M. (1995) Die Gelbbauchunke (Bombina v. variegata): Biologie, Gefährdung, Schutz. Margraf Verlag. NOLAND, R. & ULTSCH, G.R. (1981) The roles of temperature and dissolved oxygen in microhabitat selection by the tadpoles of a frog (Rana pipiens) and a toad (Bufo terrestris). Copeia, 645–652. NÖLLERT, A. (1996) Verbreitung, Lebensraum und Bestandessituation der Gelbbauchunke (Bombina v. variegata) in Thüringen. Naturschutzreport 11, 137–160. NÖLLERT, A. & GÜNTHER, R. (1996) Gelbbauchunke, Bombina variegata (Linnaeus, 1758). Die Amphibien und Reptilien Deutschlands. Gustav Fischer Verlag, Jena, Germany, 232–252. NÖLLERT, A.,SERFLING, C., SCHEIDT, U., UTHLEB, H. (2011) Rote Liste der Lurche (Amphibia) Thüringens. FRITZLAR, F., NÖLLERT, A., WESTHUS, W. (Hrsg., 2011) rRote Listen der gefährdeten Tier- und Pflanzenarten, Pflanzengesellschaften und Biotope Thüringens. Naturschutzreport 26, 61-68. OBERT, H.-J. (1973) Untersuchungen zur hormonalen Steuerung der Ruf-und Paarungsaktivität bei der Rot-und Gelbbauchunke Bombina bombina (L.) und Bombina v. variegata (L.). Zoologische Jahrbücher, Abteilung für Physiologie der Tiere 77, 166-198. OBERT, H.J. (1976) Die Spermatogenese bei der Gelbbauchunke (Bombina variegata variegata L.) im Verlauf der järhlichen Aktivitatsperiode und die Korrelation zur Paarungsfufaktivität (Discoglossidae, Anura). Z Mikrosk Anat Frosch 90, 908–924. OTIS, D.L., BURNHAM, K.P., WHITE, G.C. & ANDERSON, D.R. (1978) Statistical inference from capture data on closed animal populations. Wildlife monographs, 3–135. PEARSON, K. (1900) X. on the criterion that a given system of deviations from the probable in the case of a correlated system of variables is such that it can be reasonably supposed to have arisen from random sampling. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science 50, 157–175. PETERSON, C.G. & BOULTON, A.J. (1999) Stream permanence influences microalgal food availability to grazing tadpoles in arid-zone springs. Oecologia 118, 340–352. PFEIFFER, I. (2014) Genetische Analyse von Abstrichproben der Gelbbauchunke (Bombina v. variegata) im Nationalpark Hainich / Thüringen. unveröff. Mskr. im Auftrag der Thüringer Landesanstalt für Umwelt und Geologie. 115 Literatur PLYTYCZ, B. & BIGAJ, J. (1993) Studies on the growth and longevity of the yellow-bellied toad, Bombina variegata, in natural environments. Amphibia-Reptilia 14, 35–44. PLYTYCZ, B., JOZKOWICZ, A., CHADZINSKA, M. & BIGAJ, J. (1996) Longevity of yellowbellied toads (Bombina variegata) and the efficiency of their immune system. Naturschutzreport 11, 77–84. POLLOCK, K.H., NICHOLS, J.D., BROWNIE, C. & HINES, J.E. (1990) Statistical inference for capture-recapture experiments. Wildlife monographs, 3–97. ROYLE, J.A., CHANDLER, R.B., SOLLMANN, R. & GARDNER, B. (2014) Introduction. In Spatial Capture-recapture pp. 3–19. Elsevier. RÜHMEKORF, E. (1958) Beiträge zur Ökologie mitteleuropäischer Salientia. Zoomorphology 47, 37–53. SAMIETZ, R. (1989) Vorschlag für ein ökologisch begründetes Artenschutzprogramm für die Gelbbauchunke Bombina variegata L. Abh. Ber. Mus. Nat. Gotha 15, 68-75. SCHEEL, B. (2015) Erhaltung von Rohbodengewässern für Gelbbauchunken. Vortrag zur LIFE-AMPHIKULT Fachtagung, 05.-06.09.2014. Hannover. SCHELLENBERG, M. (2012) Anpassungskapazität der Gelbbauchunke (Bombina variegata) an Änderungen durch den Klimawandel im Steigerwald. Bachelorarbeit. FriedrichSchiller-Universität Jena. SCHLEGEL, D. (2000) Nördlichste Vorkommen der Gelbbauchunke (Bombina v. variegata) festgestellt? Beitr. Naturk. Niedersachsen 53, 191 – 194. SCHMIDT, H. (1990) Registrierung der Gelbbauchunke (Bombina variegata L.) und Untersuchung zur Populationsstärke im Kreisgebiet von Mühlhausen. Diplomarbeit Pädagogische Hochschule Erfurt/ Mühlhausen. SCHMIDT, B.R., ZUMBACH, S., TOBLER, U. & LIPPUNER, M. (2015) Amphibien brauchen temporäre Gewässer. Zeitschrift für Feldherpetologie 22, 137–150. SCHWERDTFEGER, F. (1979) Animal ecology. A text-and handbook in three parts. Volume II: demecology. Structure and dynamics of animal populations. Verlag Paul Parey. SEBER, G.A.F. (1965) A note on the multiple-recapture census. Biometrika 52, 249–259. SEBER, G.A.F. (1982) The estimation of animal abundance and related parameters. Griffin London. SEIDEL, B. (1988) Struktur, Dynamik und Fortpflanzungsbiologie einer Gelbbauchunkenpopulation (Bombina variegata variegata L.) in einem Habitat mit temporären Kleingewässern im Waldviertel (NÖ). Dissertation. Universität Wien. SEIDEL, B. (1993) Bericht aus einer seit 1984 laufenden Studie über eine Gelbbauchunkenpopulation Bombina variegata: Ein Diskussionsansatz für feldherpetologische Studien. Salamandra 29, 6–15. 116 Literatur SEIDEL, B. (1996) Populationsuntersuchungen an Gelbbauchunken Bombina variegata (Bombinatoridae, Amphibia) als Beitrag zur Biodeskription. Zeitschrift für Ökologie und Naturschutz 5, 29-36. SENDOR, T. & SIMON, M. (2000) Schätzung der Populationsgrö \s se am Winterquartier schwärmender Zwergfledermäuse (Pipistrellus pipistrellus): Ein Methodenvergleich. Beiträge zur Ökologie 4, 43–52. SERFLING, C. (1998) Erfassung und Bewertung der Vorkommen der Gelbbauchunke im südlichen Hainich. unveröff. Mskr. im Auftrag der Thüringer Landesanstalt für Umwelt Jena. SERFLING, C., BRAUN-LÜLLEMANN, J., UTHLEB, H. (2014) Die Situation der Gelbbauchunke in Thüringen. Ergebnisse aus dem FFH-Monitoring. Deutsche Gesellschaft für Herpetologie und Terrarienkunde e.V., Vortrag zur Jahrestagung zum Lurch des Jahres 2014, 22.-23.11.2014. Hagen. SINSCH, U. (1984) Thermal influences on the habitat preference and the diurnal activity in three European Rana species. Oecologia 64, 125–131. SINSCH, U. (1991) Mini-review: the orientation behaviour of amphibians. Herpetological Journal 1, 1–544. SINSCH, U. & SEIDEL, D. (1995) Dynamics of local and temporal breeding assemlages in a Bufo calamita metapopulation. Australian Journal of Ecology 20, 351–361. SMITH, M. & GREEN, D. (2005) Dispersal and the metapopulation paradigm in amphibian ecology and conservation: are all amphibian populations metapopulations? Ecography 28, 110–128. SMITH-GILL, S.J. & BERVEN, K.A. (1979) Predicting amphibian metamorphosis. American Naturalist, 563–585. SOUTHWOOD, T.R.E. (1978) Ecological Methods: With Particular Reference to the Study of Insect Populations. Chapman and Hall. STUART, S.N. (2004) Status and Trends of Amphibian Declines and Extinctions Worldwide. Science 306, 1783–1786. SY, T. (1998) Untersuchungen zur Struktur, Dynamik und Dispersion einer GelbbauchunkenPopulation (Bombina v. variegata LINNAEUS, 1758) im nordwestlichen Thüringen (Unstrut-Hainich-Kreis). Diplomarbeit. Martin-Luther-Universität Halle-Wittenberg. SY, T. & GROSSE, W.R. (1998) Populationsökologische Langzeitstudien an Gelbbauchunken (Bombina v. variegata) im nordwestlichen Thüringen. Zeitschrift für Feldherpetologie 5, 81–113. TIBOR, S.O.S. (2007) Thermoconformity even in hot small temporary water bodies: a case study in yellow-bellied toad (Bombina v. variegata). Herpetologica 1, 1–11. VEITH, M., KLEIN, M. (1996) Zur Anwendung des Metapopulationskonzeptes auf Amphibienpopulationen. Zeitschrift für Ökologie und Naturschutz Jena 5, 217-228. 117 Literatur WAGNER, T. (1996) Untersuchungen zum aquatischen Lebensraum der Gelbbauchunke Bombina v. variegata (Linnaeus, 1758), als Grundlage für Pflege-und Entwicklungskonzepte. Naturschutzreport 11, 69–76. WAKE, D.B. (1991) Declining amphibian populations. Science 253, 860. WALTHER, G.-R., POST, E., CONVEY, P., MENZEL, A., PARMESAN, C., BEEBEE, T.J., FROMENTIN, J.-M., HOEGH-GULDBERG, O. & BAIRLEIN, F. (2002) Ecological responses to recent climate change. Nature 416, 389–395. WASSERSUG, R.J. & SEIBERT, E.A. (1975) Behavioral responses of amphibian larvae to variation in dissolved oxygen. Copeia, 86–103. WELLS, K.D. (2007) The Ecology and Behavior of Amphibians. The University of Chicago Press Ltd. London. WHITE, G.C. (1982) Capture-recapture and removal methods for sampling closed populations. Los Alamos National Laboratory. WHITE, G.C., BURNHAM, K.P., OTIS, D.L., ANDERSON., D.R. (1978) CAPTURE software to compute estimates of capture probability and population size for closed population capture-recapture data. USGS-PWRC. http://www.mbrpwrc.usgs.gov/software/capture.shtml. [Stand 01.10.2014]. WILBUR, H.M. (1980) Complex life cycles. Annual review of Ecology and Systematics, 67– 93. WILBUR, H.M. & ALFORD, R.A. (1985) Priority effects in experimental pond communities: responses of Hyla to Bufo and Rana. Ecology, 1106–1114. WOLF, T. (1988) Untersuchungen zur Autökologie und Populationsökologie der Gelbbauchunke (Bombina variegata L.) im Kreisgebiet von Mühlhausen. Diplomarbeit. Pädagogische Hochschule Erfurt/ Mühlhausen. WOLLMUTH, L.P., CRAWSHAW, L.I., FORBES, R.B. & GRAHN, D.A. (1987) Temperature selection during development in a montane anuran species, Rana cascadae. Physiological Zoology, 472–480. WOODWARD, B.D. (1983) Predator-prey interactions and breeding-pond use of temporarypond species in a desert anuran community. Ecology, 1549–1555. ZAHN, A., & NIEDERMEIER, U. (2004) Zur Reproduktionsbiologie von Wechselkräte (Bufo viridis), Gelbbauchunke (Bombina variegate) und Laubfrosch (hyla aborea) im Hinblick auf unterschiedliche Methoden des Habitatmanagements. Zeitschrift für Feldherpetologie 11, 41-64. 118 Abbildungen Abbildung 1.1 Adulte Gelbbauchunke (Bombina variegata).. ............................................................... 2 Abbildung 2.1 Lage des Untersuchungsgebietes im Wartburgkreis.. .................................................... 4 Abbildung 2.2 Gebietscharakteristische Habitatstrukturen im Untersuchungsgebiet. ........................... 6 Abbildung 2.3 Truppenübungsplatz „Kindel“ im Jahre 1945. ............................................................... 8 Abbildung 2.4 Das weitere Untersuchungsgebiet und das engere Untersuchungsgebiet mit den drei Teilflächen. .................................................................................................................... 9 Abbildung 3.1 Adulte Gelbbauchunke in einer Petrischale während der Bauchmusterfotografie. ...... 14 Abbildung 3.2 Aufnahme der Wassertiefe und Wassertemperatur in den Gewässern......................... 24 Abbildung 4.1 Kartierte Gewässer im Untersuchungsgebiet. .............................................................. 27 Abbildung 4.2 Untersuchungsgewässer und Gewässerkomplexe in den drei Teilgebieten.. .............. 28 Abbildung 4.3 Übersicht der Gewässertypen und deren Anteile an der Gesamtzahl der Untersuchungsgewässer der drei Teilflächen. ............................................................. 29 Abbildung 4.4 Anzahl der Fänge weiblicher und männlicher Tiere verteilt auf die Monate Mai bis September .................................................................................................................... 31 Abbildung 4.5 Fanghäufigkeiten der adulten und subadulten Individuen ........................................... 32 Abbildung 4.6 Anzahl gefangener adulter und subadulter Individuen pro Monat und jeweiliger Anteil an der geschätzten Gesamtpopulation von 262 Tieren. ............................................... 34 Abbildung 4.7 Verteilung der drei Altersklassen auf die Gesamt-Individuenzahl in den Monaten Mai bis September. ............................................................................................................. 35 Abbildung 4.8 Geschlechterverteilung der adulten Individuen in den Monaten Mai bis September .. 36 Abbildung 4.9 Vergleich der ermittelten Kopf-Rumpf-Längen für Männchen und Weibchen zwischen den beiden Messverfahren PC und Schieblehre (SchL). ............................. 37 Abbildung 4.10 Mittlere Kopf-Rumpf-Längen und Körpergewichte der juvenilen, subadulten und adulten Gelbbauchunken. ............................................................................................ 39 Abbildung 4.11 Vergleich der mittleren Körpergewichte zwischen den Teilflächen HB und SS für männliche und weibliche Gelbbauchunken.. ............................................................... 41 Abbildung 4.12 Verteilung der Kopf-Rumpf-Längen der vermessenen adulten Gelbbauchunken auf Größenklassen. ............................................................................................................ 42 Abbildung 4.13 Verteilung der Körpergewichte der gewogenen adulten Gelbbauchunken auf Gewichtsklassen. ......................................................................................................... 42 Abbildung 4.14 Korrelation der Kopf-Rumpf-Längen mit den Körpergewichten bei Weibchen und Männchen ................................................................................................................... 43 Abbildung 4.15 Monatlich gemittelte Kopf-Rumpf-Längen der adulten Gelbbauchunken über die Saison. ......................................................................................................................... 44 119 Abbildungen Abbildung 4.16 Monatlich gemittelte Körpergewichte der adulten Gelbbauchunken über die Saison. ................................................................................................................................ 44 Abbildung 4.17 Körpergewichte von vier männlichen Gelbbauchunken zum Zeitpunkt der jeweiligen Fänge ......................................................................................................................... 45 Abbildung 4.18 Körpergewichte von drei weiblichen Gelbbauchunken zum Zeitpunkt der jeweiligen Fänge ......................................................................................................................... 45 Abbildung 4.19 Dispersion der Gelbbauchunken im Untersuchungsgebiet. ....................................... 46 Abbildung 4.20 Individuenzahlen der Kategorien „a“, „b“ und „c“ und deren prozentuale Anteile an der Gesamtzahl wiedergefangener Gelbbauchunken ................................................ 48 Abbildung 4.21 Vergleich der Aktionsdistanzen und Wanderstrecken der wiedergefangenen Männchen und Weibchen ......................................................................................... 49 Abbildung 4.22 Aktionsdistanzen der wiedergefangenen adulten Gelbbauchunken . ......................... 50 Abbildung 4.23 Wanderstrecken der wiedergefangenen adulten Gelbbauchunken............................. 50 Abbildung 4.24 Gefangene adulte und subadulte Gelbbauchunken, Laichperioden (= Rufperioden) sowie tägliche Minimal- und Maximaltemperaturen ................................................ 52 Abbildung 4.25 Gefangene adulte und subadulte Gelbbauchunken, Laichperioden (= Rufperioden) sowie tägliche Niederschlagsmengen ....................................................................... 53 Abbildung 4.26 Anzahl abgelegter Eier und tägliche Niederschlagsmengen ...................................... 55 Abbildung 4.27 Trockenes Reproduktionsgewässer HB0079 am 24. Juni und vertrocknete Amphibienlarven im Gewässer HB0102 .................................................................. 57 Abbildung 4.28 Vergleich der ermittelten Parameter zwischen Aufenthaltsgewässern und Reproduktionsgewässern .......................................................................................... 61 Abbildung 4.29 Verteilung der Reproduktionsgewässer auf acht Größenklassen. .............................. 62 Abbildung 4.30 Verteilung der Reproduktionsgewässer auf acht Klassen anhand der mittleren Wassertiefen.............................................................................................................. 63 Abbildung 4.31 Prozentualer Anteil der insgesamt abgelegten Eier in den Reproduktionsgewässern in Abhängigkeit von der Austrocknungshäufigkeit. ..................................................... 64 Abbildung 4.32 Emerse und submerse Vegetationsbedeckung der besiedelten Gewässer. ................. 66 Abbildung 4.33 Tagesdurchschnittstemperaturen für 11 Gewässer der beiden Funktionstypen RG und AG ............................................................................................................................. 68 Abbildung 4.34 Vergleich der AM und PM Temperaturen für 11 Gewässer der beiden Funktionstypen RG und AG .............................................................................................................. 69 Abbildung 4.35 Temperaturverlauf eines RG und eines AG .............................................................. 70 Abbildung 4.36 Korrelation der Eizahl der Gewässer mit den Parametern Vegetationsbedeckung, Besonnung und Leitfähigkeit. ................................................................................... 73 120 Tabellen Tabelle 4.1 Anzahl der Fänge und Individuenzahlen für weibliche, männliche, subadulte und juvenile Gelbbauchunken in den drei Untersuchungsflächen. ....................................................... 30 Tabelle 4.2 Fanghäufigkeiten der männlichen, weiblichen und subadulten Gelbbauchunken ............. 31 Tabelle 4.3 Erst- und Wiederfangzahlen der adulten und subadulten Gelbbauchunken in den Teilflächen ........................................................................................................................ 32 Tabelle 4.4 Schätzwerte nach „Capture“ für die Populationsgröße und die Fangwahrscheinlichkeit .. 33 Tabelle 4.5 Schätzwerte nach „Jolly“ für die Populationsgröße und die Fangwahrscheinlichkeit....... 33 Tabelle 4.6 Ermittelte Kopf-Rumpf-Längen der adulten Gelbbauchunken mit den beiden Methoden PC und Schieblehre........................................................................................................... 37 Tabelle 4.7 Mittlere Kopf-Rumpf-Längen aller gemessenen Individuen. ............................................ 38 Tabelle 4.8 Mittlere Körpergewichte aller gewogenen Individuen . .................................................... 38 Tabelle 4.9 Mittlere Kopf-Rumpf-Längen beider Geschlechter in den Gebieten. ............................... 40 Tabelle 4.10 Mittlere Körpergewichte beider Geschlechter in den Gebieten....................................... 40 Tabelle 4.11 Mittlere Aktionsdistanzen und Wanderstrecken für wiedergefangene männliche und weibliche Gelbbauchunken .............................................................................................. 49 Tabelle 4.12 Monatlich gemittelte Tages-Klimadaten für das Untersuchungsgebiet. .......................... 51 Tabelle 4.13 Übersicht der Laichperioden im Untersuchungsgebiet im Jahr 2014. ............................. 54 Tabelle 4.14 Prozentuale Anteile der Biotoptypen an den Gesamtflächen der Teilflächen ................. 58 Tabelle 4.15 Untersuchungsgewässer eingeteilt in Gewässer-Funktionstypen. ................................... 58 Tabelle 4.16 Anzahl der Untersuchungsgewässer aufgeteilt auf die Gewässertypen sowie deren Anteile an der Zahl gefangener Individuen und der Zahl abgelegter Eier. ....................... 59 Tabelle 4.17 Mittlere Parameter aller besiedelten Untersuchungsgewässer......................................... 60 Tabelle 4.18 Mittlere Temperaturen in 11 Gewässern der Funktionstypen RG und AG. ................... 69 Tabelle 4.19 Koeffizienten des finalen Modelles für die Anzahl abgelegter Eier. ............................... 72 Tabelle 5.1 Vergleichswerte für Kopf-Rumpf-Längen und Körpergewichte von Gelbbauchunken in verschiedenen Populationen. ............................................................................................ 83 121 122