Hellmann - VDFF Fischerei
Werbung

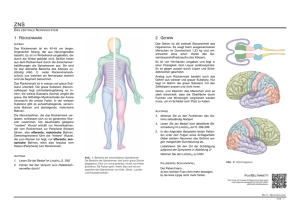
Verband Deutscher Fischereiverwaltungsbeamter und Fischereiwissenschaftler e.V. „Forschung zur Unterstützung der deutschen Binnenfischerei und Aquakultur“ Betäubungs- und Schlachtverfahren für Afrikanische Welse (Clarias gariepinus) John Hellmann1, Wanda Hörnig 2, Matthias Lübke 2, Dieter Steinhagen1 1 Institut für Parasitologie, Abteilung Fischkrankheiten und Fischhaltung der Tierärztlichen Hochschule Hannover, Bünteweg 17, 30559 Hannover 2 Fachgebiet Allgemeine Radiologie und medizinische Physik der Tierärztlichen Hochschule Hannover, Bischofsholer Damm 15, 30173 Hannover Einleitung: Der Afrikanische Wels (Clarias gariepinus) ist eine wärmeliebende, in der deutschen Aquakultur verhältnismäßig neue Spezies, die in intensiven Kreislaufanlagen gehalten wird. Durch das Einführen solcher neuen Spezies müssen nicht nur neue Haltungsformen entwickelt, sondern auch die für die Schlachtung notwendigen Betäubungsmethoden auf eine Tauglichkeit geprüft werden. Nach der Tierschutzschlachtverordnung (TierSchlV) sind für Fische zur Betäubung folgende Methoden erlaubt: Die Elektrobetäubung, der stumpfe Schlag auf den Kopf, die Kohlendioxidexposition bei Salmoniden und die Verabreichung eines Stoffes mit Betäubungseffekt, ausgenommen Stoffe wie Ammoniak, die gleichzeitig dem Entschleimen dienen. Diese herkömmlichen Betäubungsverfahren erweisen sich bei dieser Fischart aufgrund ihrer Anatomie und Physiologie als schwierig bzw. schließen sich aus, da die Erlaubnis auf Salmoniden eingeschränkt ist oder keine Stoffe mit Betäubungseffekt zugelassen sind. In diesem Projekt wurden die Elektrobetäubung simuliert und die Eiswasserbetäubung, als ein neues Verfahren, das in der Tischschutzschlachtverordnung nicht aufgeführt ist, untersucht. Unter Laborbedingungen wurde dokumentiert wie bei Afrikanischen Welsen eine Bolzenschussbetäubung möglich ist. Simulierung der Elektrobetäubung: Material und Methoden • Erstellen eines 3-D Computermodelles aus CT- und MRT-Daten des Fisches (Software AMIRA 5.5.0,Visualization Science Group) • Übertragen der Netze des Modells in das Programm COMSOL Multiphysics (version 4.3b) für die Simulierung einer elektrischen Durchströmung mit Hilfe der Finite Elemente Analyse • Zuweisen der Leitfähigkeiten der einzelnen Gewebe, Festlegen der Randbedingungen und Simulationen mit unterschiedlichen Frequenzen, Spannungen Ergebnisse • Anatomisch korrektes 3-D Modell des Kopfes des Afrikanischen Welses (Abb. 1) • Stromdichten im Gehirn sehr gering im Vergleich zu anderen Geweben (Abb. 2) • Nur mit hohen Frequenzen und Spannungen konnte eine Erhöhung der mittleren Stromdichte im Gehirn erreicht werden (Abb. 3) • Fett und Knochen umgeben das Gehirn und schirmen es weitestgehend vom elektrischen Feld ab • Strom fließt hauptsächlich um das Gehirn herum bzw. durch Gewebe mit einer höheren elektrischen Leitfähigkeit als die von Knochen und Fett (Abb. 4) Abb. 1: 3-D Modell des Kopfes des Afrikanischen Welses Abb. 2: Mittlere Stromdichten ausgesuchter Gewebe Abb. 3: Abhängigkeit der Stromdichte von Frequenz und Spannung bei Verwendung von Plattenelektroden rechts / links Abb. 4: Stromdichteverteilung in einem Transversalschnitt des 3-D Modells. Die Pfeile kennzeichnen die Richtung des Stromflusses und die Schattierung die unterschiedlichen Stromdichten. Ist eine Eiswasserbetäubung möglich? Material und Methoden • Durch starke Lichtreize wurden visuell erzeugte Potentiale (VER) im Elektroenzephalogramm (EEG) ausgelöst • Das Verhalten der VER im EEG wurde unter dem Einfluss der Eiswasserbetäubung untersucht Ergebnisse • Eine Eiswasserbetäubung ist möglich • Nach 5 bis 15 min im Eiswasser (0,1 C) sind im EEG keine Reaktionen durch einen Lichtreiz (VER) mehr nachvollziehbar B Stroboskop Für den Lichtreiz Eiswasserzugabe Afrikanische Wels im EEG/VER Versuch im Eiswasser Abb. 5: Unter Laborbedingungen wurden den Versuchstieren während der Eiswasserbeteubung kontinuierlich VER im EEG abgeleitet Betäubungseintritt Zeit (min) Lichtreiz EEG (mV) A Spannung (mV) Computer zur Datenauswertung Zeit (s) Abb. 6: Auf einen Lichtreiz folgt im EEG ein VER (Pfeil A), wird der Lichtreiz nicht verarbeitet folgt kein VER (Pfeil B) 0,1 C Abb. 7: Über den Betäubungszeitraum ist zu sehen, wie die Potentiale (mV) im EEG abnehmen Ist die Eiswasserbetäubung belastend? Material und Methoden • Während des Haltungs- und Verarbeitungsprozesses wurden Blutproben entnommen • Die Blutproben wurden, unter anderem, auf das „Stresshormon“ Cortisol untersucht Ergebnisse • Vergleiche der normalen Haltung mit der Eiswasserbetäubung ergaben eine signifikant erhöhte Cortisolausschüttung • Vergleiche zwischen der Eiswasserbetäubung und dem Abfischen ergaben keine signifikanten Unterschiede 3-5 C Abb. 8: Nach 5 bis 15 min in 0,1 C kaltem Wasser zeigt das EEG eine Betäubung, bei höheren Temperaturen des Eiswassers ist der Betäubungseintritt verzögert Abb. 9: zwischen A und B sind signifikante Unterschiede in den Cortisol- Werten zu sehen. Innerhalb der Gruppen sind keine signifikanten Unterschiede zu sehen B A Gibt es alternative Methoden? Material und Methoden • Für die Betäubung wurde ein Bolzenschussapparat (z.B. PTB 3-69, Blitz-Kerner Kaliber 9/17) verwendet • Anhand von Knochenpunkten wurde von außen die Lage des Gehirns und somit der Ansatzpunkt der Betäubung abgeschätzt Ergebnisse • Mittels des Bolzenschussapparates konnte eine unmittelbare Betäubung erreicht werden Abb. 10: Die Lage des Gehirns (grüner Kreis) kann von außen aufgesucht werden Zusammenfassung Die Simulation der elektrischen Durchströmung zeigte, dass das Gehirn perfekt durch Fett und Knochen, die es umgeben, gegenüber dem elektrischen Feld abgeschirmt wird. Die elektrischen Leitfähigkeiten dieser Gewebe sind gering. Hierin scheint der Grund für die geringen Stromdichten im Gehirn zu liegen und die Schwierigkeit, den Afrikanischen Wels mittels elektrischem Strom zu betäuben. Anhand der Auswertung spezifischer Reaktionen des Gehirns kann dargestellt werden, dass Afrikanische Welse sich mittels Eiswasser (0;1 C) nach 5 bis 15 min betäuben lassen. Dies führt bei den Tieren zu einer Cortisolausschüttung, wobei zwischen dem Abfischvorgang und Eiswasserbetäubung selbst keine signifikanten Unterschiede zu sehen sind. Durch die Verwendung eines Bolzenschussaparates kann eine unmittelbare Betäubung erreicht werden. Vielen Dank an alle Projektpartner Das Projekt wurde durch den Europäischer Fischereifond (EFF) und das Ministerium für Landwirtschaft, Umwelt und Verbraucherschutz Mecklenburg-Vorpommern gefördert und durch die Fischgut Nord eG und Pal Anlagenbau GmbH unterstützt