Glossar zur Elemente – Werkstatt
Werbung

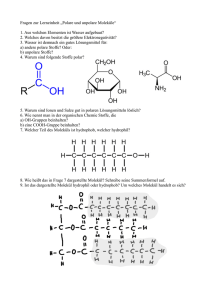
Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 1 Elemente-Werkstatt Die vorliegende Elemente-Werkstatt ist von Dr. Hannes Bösch, Chemielehrer an der Kantonsschule Alpenquai, Luzern für den LWB-Kurs „Oxidation - Reduktion - Analyse Synthese“ im Herbst 1999 erarbeitet worden. Die Kursteilnehmenden hatten Gelegenheit, an einigen Posten dieser Werkstatt zu arbeiten und den Aufbau der Werkstatt kennen zu lernen. Der Autor hat diese Werkstatt anschliessend an der 3. Gymnasialklasse im Chemieunterricht eingesetzt und getestet. Da der Hauptteil dieses Chemiethemas im Naturlehre-Lehrplan der Orientierungsstufe bereits für das 7. Schuljahr vorgesehen ist, haben wir (die Projektleitung Naturlehre) mit dem Einverständnis und der Unterstützung des Autors die Werkstatt vereinfacht und die Posten in kleinere Aufträge unterteilt. Die Vereinfachung ist nicht nur für die Lernenden wichtig, sondern auch für die Lehrperson. Sie verfügt nicht über die gleiche Übersicht und Erfahrung wie ein ausgebildeter Chemiker, der viel eher spürt, welchem Posten er im richtigen Zeitpunkt seine besondere Aufmerksamkeit schenken muss. Damit die Schülerinnen die Lösungen eher finden und der Lehrperson dadurch mehr Zeit für die Überwachung der Versuche bleibt, haben wir die Werkstatt ergänzt mit einer Übersicht der Stoffklassen Metalle / Nichtmetalle (Seite 5), mit Steckbriefen zu den vorkommenden Elementen (Seite 29ff) und mit einem Glossar (Seite 28). Die Werkstatt setzt gewisse Kenntnisse voraus zu: - Benennung und korrekte Handhabung der vorkommenden Laborgeräte - Umgang mit Chemikalien - Schutzmassnahmen bei Versuchen - Begriffe wie: Chemische Reaktionen, Oxidation und Reduktion, Analyse und Synthese Die Werkstattvorlage bietet die verschiedensten Einsatzmöglichkeiten. Es ist klar, dass je nach Zeitvorgaben, Klassengrösse, vorhandenes Versuchsmaterial nur einzelne Posten aus der Werkstatt angeboten werden. Es ist von Vorteil, Versuche, die einen komplizierteren Aufbau verlangen, vorgängig einzuführen und auf mögliche Gefahren aufmerksam zu machen oder als Demonstrationsversuche einzusetzen. Wichtig ist, dass die Schüler eigenständig und sorgfältig nach den Vorgaben an den Posten arbeiten lernen. Die Werkstatt bietet auch später in einem Chemieblock im 9. Schuljahr wieder verschiedene Einsatzmöglichkeiten. An dieser Stelle danken wir Dr. Hannes Bösch herzlich für seine kompetente Kursleitung und für die fachliche Unterstützung der Projektleitung Naturlehre. Literaturangaben: Natur und Technik, Chemie Gesamtband, Cornelsen-Verlag, ISBN 3-464-04242-1, Best. Nr. 42448 Blickpunkt Chemie, Schroedel-Verlag, ISBN 3-507-86-028-7 Umwelt: Chemie, Gesamtband, Klett-Verlag, ISBN 3-12-0796oo-X Projektleitung Naturlehre Lisbeth Kurmann, Werner Cattin, Toni Graf Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 2 Elemente-Werkstatt 1. Um was geht es? Neben den Elementen Wasserstoff und Sauerstoff haben wir die Namen neuer Elemente kennen gelernt. Wir möchten nun herausfinden, welche typischen Eigenschaften sie haben und mit welchen Elementen sie sich gerne verbinden. 2. Wie ist diese Werkstatt aufgebaut? Im Unterrichtszimmer sind die Posten aufgestellt. An jedem Posten findest du ein Arbeitsblatt mit allen notwendigen Angaben zur Durchführung der Versuche. Selbstverständlich sind auch alle Geräte und Chemikalien vorhanden. Du arbeitest in Zweier- oder Dreiergruppen. Die Reihenfolge der Versuche ist frei. Gruppenauftrag: Die Gruppe wählt einen Posten. Jedes Gruppenmitglied nimmt sein persönliches Arbeitsblatt. Ihr führt die Versuche gemeinsam durch und stellt die Ergebnisse übersichtlich auf dem Postenblatt dar. Kreuze den besuchten Posten an Postenübersicht: Nummer Inhalt Posten 1 Aluminium Posten 2 Magnesium Posten 3 Kupfer Posten 4 Silber Posten 5 Blei Posten 6 Eisen Posten 7 Zink Posten 8 Schwefel Posten 9 Chlor Posten 10 Kohlenstoff Posten 11 Kohlendioxid A B C Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 3 3. Was wird von dir erwartet? Als Lehrperson erwarte ich von dir - dass du während der Arbeit die gestellten Fragen überlegst und nach Lösungen suchst, den jeweiligen Posten aufgeräumt verlässt, konzentriert arbeitest, deine Gruppenkameraden angemessen unterstützest, die Arbeitsblätter sauber ausfüllst nichtverstandene Begriffe notierst - dass du nach der Arbeit in der Lage bist die wichtigsten Eigenschaften der von dir untersuchten Elemente anzugeben, eine wichtige Verwendung im Alltag zu beschreiben, ein Protokoll eines Versuches zu erstellen chemische Reaktionen in Worten aufzuschreiben, die Begriffe „Synthese“ und „Analyse“ zu erklären und sie mit Beispielen zu ergänzen, zu erkennen, wann eine Oxidation oder eine Reduktion vorliegt. 4. Bewertung a) Beobachtungsbogen während der Arbeit: 50% gut : 2 Punkte i.O. : 1 Punkt mangelhaft : 0 Punkte b) Prüfung: 50% Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 4 Beobachtungskarte für die ganze Klasse - ungenügend o in Ordnung + gut Schülergruppe Posten Selbstständigkeit Sauberkeit, konzentriertes ZusammenExaktheit Arbeiten arbeit Bemerkungen Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 5 Metalle - Übersicht Es gibt mehr als 80 verschiedene Metalle. Sie bilden eine Stoffklasse mit gemeinsamen Eigenschaften und Merkmalen, die einerseits auf die Anordnung der Atome zurückzuführen sind und andererseits auf die Art und Weise wie diese Atome miteinander „verknüpft“ sind. Die Atomverbände bilden regelmässige Gitter. Gemeinsame Eigenschaften und Merkmale: Typisch metallischer Glanz Undurchlässig für Licht Fest bei Raumtemperatur, Ausnahme Quecksilber (Hg) Leiten die Wärme gut Leiten den elektrischen Strom gut Gut verformbar Grosse Festigkeit Trotz der gemeinsamen Eigenschaften und Merkmale unterscheiden sich die verschiedenen Metalle voneinander. Jedes Metall hat seine typische Dichte. Deshalb teilt man die Metalle in Leichtmetalle (< 5 g/cm3) und Schwermetalle (> 5 g/cm3)ein. Beispiele für Leichtmetalle: Magnesium (Mg), Aluminium (Al) Beispiele für Schwermetalle: Platin (Pt), Gold (Au), Blei (Pb), Silber (Ag) Gewisse Metalle laufen nicht so leicht an. Sie oxidieren weniger als andere. Sie rosten auch nicht. Deshalb werden Metalle unterteilt in: Edelmetalle: Je edler ein Metall ist, desto geringer ist sein Bestreben, sich mit Sauerstoff zu verbinden. Edelmetalle sind die einzigen Metalle, die in der Natur rein (gediegen, elementar) vorkommen. Beispiele: Gold, Silber, Platin. Halbedelmetalle: Sie bilden eine schützende Oxidschicht, Beispiel: Kupfer (Cu). Unedle Metalle: Je unedler ein Metall ist, desto intensiver verbindet es sich mit Sauerstoff. Beispiele: Aluminium, Magnesium, Zink (Zn), Eisen (Fe). AluminiumMagnesiumZinkEisenKupferSilberGoldPlatin (unedle Metalle) (Edelmetalle) Silber und Kupfer leiten den Strom besonders gut. Viele Werkstoffe aus Metall sind nicht rein, sondern Legierungen. Legierungen sind Metallmischungen aus zwei oder mehreren verschiedenen Metallen. Legierungen weisen meistens bessere Eigenschaften auf als die reinen Metalle. Häufige Legierungen: Bronze: Kupfer und Zinn Rotgold: Gold und Kupfer Stahl: Eisen und Kohlenstoff < 1,7% Konstantan: Kupfer und Nickel Messing: Kupfer und Zink Weissgold: Gold, Silber und Nickel Edelstahl: Eisen, Chrom, Nickel und andere Lötzinn: zum Beispiel Zinn und Blei Nichtmetalle – Übersicht Stoffe wie Kohlenstoff (C), Schwefel (S) oder Phosphor (P) zeigen zwar einige, aber nicht alle Eigenschaften der Metalle. Deshalb werden sie nicht der Stoffklasse der Metalle zugeordnet. Sie bilden eine eigene Stoffklasse, die Nichtmetalle. Sie umfasst viel weniger Elemente als die Stoffklasse der Metalle. Nichtmetalle haben im Gegensatz zu den Metallen kaum gemeinsame Eigenschaften. Die meisten leiten den elektrischen Strom nicht. Einige sind bei Raumtemperatur fest, andere gasförmig, Brom (Br) ist flüssig. Die Elemente Fluor (F), Chlor (Cl), Brom und Jod(J) reagieren mit Metallen zu Salzen. Sie heissen deshalb „Salzbildner“ (Halogene). Kohlenstoff, Schwefel und Phosphor sind feste Nichtmetalle. Jedes von ihnen tritt in verschiedenen Erscheinungsformen auf. Die verschiedenen Erscheinungsformen unterscheiden sich nicht in der Art ihrer kleinsten Teilchen, sondern nur wie diese zueinander angeordnet sind. Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 1A 6 Aluminium Al Aluminium kommt in der Natur nur in Verbindungen vor. Bauxit ist der wichtigste Ausgangsstoff für die Herstellung von Aluminium. Aus Bauxit wird zuerst Aluminiumoxid Al 2O3 gewonnen. Durch Elektrolyse von geschmolzenem Aluminiumoxid erhält man das gesuchte Metall. Aluminium ist ein Leichtmetall und wird verwendet für _________________________________________________________________________________________ _________________________________________________________________________________________ Demonstrationsmaterial: Bauxit Versuch: Dichtebestimmung von Aluminium Material: Kunststoff-Messzylinder 100 ml, Waage, Aluminiumprofile Durchführung: a. Wiege ein Stück Aluminium b. Bestimme das Volumen durch Eintauchen in einen mit Wasser auf eine bestimmte Höhe gefüllten Messzylinder. c. Berechne die Dichte in g/cm3 Masse: ____________ Gramm Volumen: ____________ cm3 oder ml Dichte: ____________ g/cm3 Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 1B 7 Aluminium Al Versuch: Aluminium brennt Material: Sehr feines Aluminiumpulver, Spatel, Aluminiumblech, Zange, Stricknadel, Brenner, Schutzbrille Ausführung: Falte ein Blatt Papier in der Mitte und gib mit dem Spatel ganz wenig Aluminiumpulver in den Falt. Blase vorsichtig das Aluminiumpulver in die Flamme des Brenners. Schutzbrille nicht vergessen! Beobachtung: ___________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Halte mit der Zange einen Streifen Aluminiumblech in die heisse Flamme. Das Aluminium schmilzt, aber es tropft nicht ab. Eine zähe Oxidschicht hält die Flüssigkeit wie in einem Säckchen fest. Beim Anstechen mit einer Nadel tropft das Metall ab. Anwendung: Die Oxidschicht schützt das Aluminium vor dem Sauerstoff und vor dem Wasser. Darum kann es für Folien oder für Fassadenverkleidungen eingesetzt werden. Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 1C 8 Aluminium Al Versuch: Aluminium im Haushalt Material: Alufolie, Salzsäure verdünnt (10%), Pinzette, 1 Becherglas 100 ml Durchführung: Fülle das Becherglas ungefähr 2 cm hoch mit Salzsäure. Lege mit der Pinzette ein Stück dünne Alu-Folie hinein. - Vergleiche mit den Alu-Folien, die schon seit einem Tag in Waschmittel-Lauge, beziehungsweise in Essig eingelegt sind. Beobachtung: ____________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 2A 9 Magnesium Mg Magnesium ist ein sehr unedles Leichtmetall. Es kommt in der Natur nicht elementar vor. Es wird durch Elektrolyse eines geschmolzenen Magnesiumsalzes gewonnen. Eigentlich ist Magnesium ein silberglänzendes Metall. Es reagiert aber langsam mit dem Luftsauerstoff und wird unansehnlich grau. Magnesium wird verwendet für _________________________________________________________________________________________ _________________________________________________________________________________________ Versuch: Magnesium brennt! Material: Magnesiumband, Tiegelzange, feuerfeste Unterlage, Brenner, Schutzbrille Durchführung: Nimm ein ca. 5 cm langes Magnesiumband und halte es mit der Tiegelzange kurz in die Brennerflamme. Nimm nach der Entzündung das Magnesium aus der Flamme. Beobachtung: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Reaktionsgleichung: Magnesium + _____________ _________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 10 Posten 2B Magnesium Mg Versuch: Wasser wird von Magnesium gespalten (Aus Rentzsch: Anorg. Chemie) (Eventuell Demonstrationsversuch) Material: Stativ mit Klemme, Brenner, feuerfeste Unterlage, grosses Reagenzglas, Gummistopfen mit 1 Loch und eingeführter Glasdüse, Spritzflasche, Kerze, Holzklotz, Sand, Glaswolle, Schmirgelpapier, Magnesiumband, Schutzbrille, Glasstab Durchführung: 3 2 1 a. In das Reagenzglas füllt man ca. 3 cm hoch Sand (1) und befeuchtet ihn mit dem Wasser aus der Spritzflasche. An den Sand schiebt man mit einem Glasstab einen kleinen Bausch Glaswolle (2). b. Ein ca. 10 cm langes Magnesiumband wird blank geschmirgelt und doppelt gefaltet. Das Band (3) schiebt man so in das Reagenzglas, dass es knapp vor der Glaswolle flach am Glas aufliegt. c. Man verschliesst das Reagenzglas mit dem Stopfen samt der Glasdüse und fixiert es waagrecht am Stativ. Ca. 2 cm vor der Glasdüse steht eine brennende Kerze. d. Der feuchte Sand wird mit grosser Brennerflamme solange erhitzt bis aus der Glasdüse Wasserdampf austritt. Nun erhitzt man das Magnesiumband bis es aufglüht. Man geht mit der Brennerflamme zurück zum Sand und sorgt für Nachschub von Wasserdampf Reaktionsgleichung: Magnesium Mg + Wasser ________________ + ________________ + ______ + ________________ MgO Es handelt sich bei der obigen Reaktion um eine Redoxreaktion; Magnesium wird dabei ___________________________ Wasser wird dabei ____________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 11 Posten 3 Kupfer Cu Kupfer kann elementar vorkommen. Meistens findet man Kupfer in der Natur aber als Verbindung mit dem Schwefel (Kupfersulfid). Kupfer besitzt nach Silber die beste Leitfähigkeit für Wärme und elektrischen Strom. Es wird hauptsächlich mit Zink, Zinn oder Aluminium zusammengeschmolzen, d.h. legiert. Heute bezeichnet man alle Kupferlegierungen mit mehr als 60% Kupfer als Bronzen. Eine Ausnahme bilden die Kupfer/Zink-Legierungen, die als Messing bezeichnet werden. Dichte von Kupfer: _______________ Schmelztemperatur: _______________ Kupfer wird verwendet für: ________________________________________________________________ _________________________________________________________________________________________ Demonstrationsmaterial: Kupferblech, Messing, Bronze Versuch: Kupferoxid wird reduziert (Rentzsch) Material: Stativ mit Klemme, feuerfeste Unterlage, Reagenzgläser, Spatel, Kupfer-II-oxid CuO, Eisenpulver, weisses Papier, Zeitungspapier, Hammer Durchführung: In ein Reagenzglas füllt man 2 Spatel schwarzes Kupferoxid und 1 Spatel Eisenpulver und vermischt das Ganze durch Schütteln. (Ca. 1 cm Gemisch) Das Reagenzglas wird schräg im Stativ fixiert und mit der heissen Brennerflamme einige Minuten erhitzt. Wenn die Reaktion einsetzt, kann man den Brenner abstellen. Nach dem Erkalten des Reagenzglases wird der Inhalt auf das weisse Papier geschüttet. Löst sich der Inhalt nicht vom Glas wird das Ganze in Zeitungspapier eingeschlagen und mit dem Hammer zerschlagen. Reaktionsgleichung: Kupferoxid Überlege: + Eisen ______________ + ____________ Gibt es einen Unterschied im Ablauf der Reaktion, wenn man anstelle von Eisen Zink verwendet? ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 4A 12 Silber Ag Silber ist ein weissglänzendes Metall. Silber findet man in der Natur elementar (gediegen) oder in Verbindungen. Silber wird verwendet für: _________________________________________________________________________________________ _________________________________________________________________________________________ Silber zählt zu den Edelmetallen. Was heisst das? _________________________________________________________________________________________ _________________________________________________________________________________________ Silber ist teuer. Suche in der Tageszeitung den aktuellen Silberpreis pro Kilogramm. _________________________________________________________________________________________ Versuch: Silberoxid wird in die Elemente zerlegt Material: Reagenzglas mit Halter, Brenner, Doppelspatel, Silberoxid Durchführung : Gib eine Spatelspitze schwarzes Silberoxid in das Reagenzglas und erhitze es vorsichtig. Es entsteht weisses Silbermetall und Sauerstoff. Fragen: Wie kann man den Sauerstoff nachweisen? __________________________________________________________________________ __________________________________________________________________________ Die Aufspaltung von Silberoxid heisst _______________________________________ Braucht es für die Aufspaltung Wärme oder gibt sie Wärme ab? __________________________________________________________________________ Die Aufspaltung ist eine exotherme/endotherme chemische Reaktion. __________________________________________________________________________ Die Aufspaltung des Silberoxids ist einfach, weil _____________________________ __________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 4B Versuch: 13 Silber Ag Der Silberspiegel im Reagenzglas Der nachstehende Versuch soll zeigen, dass der sauerstoffhungrige Traubenzucker ein Metall auch vollständig aus seiner chemischen Verbindung zu befreien vermag. Material: 2 saubere Reagenzgläser (eines davon neu), Halter, Silbernitrat (5 g in 100 ml destilliertem Wasser gelöst), Brenner Traubenzucker, Salmiakgeist, Natronlauge, Salpetersäure (konzentriert) Durchführung: Wir verwenden hierzu eine Silberverbindung, nämlich Silbernitrat. Ein noch nicht benütztes, sauberes Reagenzglas wird 2 cm hoch mit der Silbernitratlösung gefüllt und ein paar Tropfen Natronlauge zugegeben, bis ein Niederschlag entsteht. Fügen wir nun ein paar Tropfen Salmiakgeist hinzu, so löst sich dieser Niederschlag wieder auf. In ein anderes Reagenzglas geben wir eine kleine Messerspitze Traubenzucker, giessen etwas destilliertes Wasser nach und mischen 2 cm hoch davon zur Silberlösung. Erwärmen wir nun diese langsam und vorsichtig über der Flamme, so bildet sich an der Wandung des reinen Reagenzglases, soweit sie von der Flüssigkeit bedeckt ist ein prächtiger Silberspiegel. Das metallische Silber wird durch den Traubenzucker aus seiner Verbindung befreit. Auf ähnliche Weise wird das Glas unserer Spiegel versilbert. Zeig dein Resultat der Lehrperson! Der Silberbelag lässt sich mit ein paar Tropfen Salpetersäure, die wir der Wandung des Reagenzglases entlang fliessen lassen, entfernen. Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 14 Posten 5 Blei Pb Blei kommt in der Natur nur in Form von Verbindungen vor, vorwiegend als Oxid oder Sulfid. Blei ist ein bläulich-graues , weiches Schwermetall. Es reagiert an der Luft mit Sauerstoff. Die entstehende Oxidschicht schützt das Metall vor weiteren Reaktionen. Blei und Bleiverbindungen sind ziemlich giftig und führen zu Blutarmut, Gelenkerkrankungen, etc. Schmelztemperatur: _______________ Blei wird verwendet für: _________________________________________________________________________________________ _________________________________________________________________________________________ Versuch: Blei als Bleistift Im 14. Jahrhundert wurden mit Bleistiften Zeichnungen angefertigt. Heute sind die Bleistifte aus Kohlenstoff, d.h. aus Graphit. Material: Bleistück Durchführung: Ritze Blei mit dem Fingernagel. Nimm das Stück Blei und schreibe damit auf die nächste Zeile deinen Namen! Beobachtung: ____________________________________________________________________________ _________________________________________________________________________________________ Versuch 2: Material: Durchführung: Versuch 3: Material: Dichtebestimmung von Blei Bleiwürfel, Masstab, Waage Volumen: _______________cm3 oder ml Masse: _______________ g Dichte: _______________ g/cm3 Bleigiessen Blei, Porzellantiegel, Tondreieck, Brenner, Becherglas 400 ml, Tiegelzange Durchführung: Erhitze eine kleine Menge Blei und giesse das flüssige Metall in das mit Wasser gefüllte Becherglas. Deute die entstehenden Figuren. Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 6A 15 Eisen Fe Eisen ist das wichtigste Schwermetall. Es kommt fast ausschliesslich in Form von Oxiden und Sulfiden vor. Im Hochofen werden die Eisenoxide mit Kohlenstoff reduziert. Gusseisen ist spröd und sehr hart. Es enthält noch sehr viel Kohlenstoff. Stahl ist hart, aber verformbar. Er enthält weniger als 1,7% Kohlenstoff. Eisen wird verwendet für _________________________________________________________________________________________ _________________________________________________________________________________________ Versuch 1: Material: Eisen ist magnetisch Flasche mit Eisenpulver, Stabmagnet, verschiedene Metalle Durchführung: Sortiere die vorliegenden Metallstücke ohne Magnet in eisenhaltige und in nichteisenhaltige Metalle. Überprüfe deine Einteilung mit Hilfe des Magneten. Beobachtung: ___________________________________________________________________________ ___________________________________________________________________________ Halte den Magneten an die Glaswand der Flasche mit dem Eisenpulver. Das Eisenpulver ordnet sich längst der magnetischen Kraftlinien an. Versuch 2: Material: Verbrennt Eisen? Eisenpulver, Blatt Papier, Spatel, Brenner Durchführung: Falte ein Blatt Papier in der Mitte und gib mit dem Spatel ganz wenig Eisenpulver in den Falt. Blase vorsichtig das Eisenpulver in die Flamme des Brenners. Beobachtung: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Anwendung: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 6B Versuch 3: 16 Eisen Fe Beeinflusst das Verbrennen von Eisen das Gewicht? (Streiff) Material: Waage mit Gewichtssatz, frische Taschenlampenbatterie, Drahtstück, Eisenwolle (ohne Seifenzusatz!). Durchführung: Befestige die Eisenwolle, die ganz locker sein muss, mit dem Drahtstück an der Waage. Lege Gewichte auf, damit der Zeiger Null anzeigt. Entzünde die Eisenwatte mit der Batterie. Beobachtung: ____________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Frage: Ändert sich das Gewicht? Formuliere eine Hypothese. _________________________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 17 Posten 7A Zink Zn Zink kommt in der Natur als Sulfid vor. Durch Erhitzen an der Luft entsteht aus dem Sulfid ein Oxid, welches durch Reduktion zum bläulichweissen Metall umgeformt wird. Schmelzpunkt: _______________ Zink wird verwendet für __________________________________________________________________ _________________________________________________________________________________________ Reaktionsgleichung: Zinkoxid + Magnesium Versuch: Material: _______________ + _______________ Zinkoxid wird durch Magnesium reduziert. (Rentzsch) Stativ mit Klemme, feuerfeste Unterlage, Brenner, Reagenzgläser, Spatel, Magnesiumpulver, Zinkoxid. Durchführung: Eine Spatelspitze Magnesiumpulver und 2 Spatelspitzen Zinkoxid werden in ein schwer schmelzbares Reagenzglas gegeben und durch Schütteln gut vermischt. Das Reagenzglas wird leicht geneigt im Stativ fixiert. Man hält den Brenner in der Hand und erhitzt das Gemenge mit der Flamme. Dazu bewegt man den Flammenkegel hin und her. Beobachtung: Beim Erhitzen färbt sich das Gemenge gelb. Gegen Ende des Erhitzens erfolgt eine heftige Reaktion. Frage: Könnte man ausser Magnesium noch andere Metalle einsetzen? Begründe! ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 18 Posten 7B Versuch: Material: Zink Zn Zink reagiert gern mit Säuren Reagenzgläser mit Stopfen und ausgezogenem Glasrohr, Spatel, Zinkgranulat, Essig, Salzsäure (10%), Zündhölzer Durchführung: Gib mit dem Spatel wenig Zink in ein Reagenzglas und fülle ca. 2 cm hoch Essig ein. Beobachtung: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Wiederhole nun den Versuch mit Salzsäure anstatt Essig. Versuche das entstehende Gas vorsichtig zu entzünden. Welches Gas könnte es sein? ___________________________________________________________________________ Mit der stärkeren Salzsäure HCl kann soviel Wasserstoffgas erzeugt werden, dass an der Spitze des Glasrohrs der Wasserstoff entzündet werden kann. Als weiteres Produkt entsteht Zinkchlorid. Reaktionsgleichung: Zink + ______ + Versuch 2: ______________ HCl Zinkchlorid + ____________ ___________ + H2 Zink reagiert gern mit Schwefel (Lehrerversuch, eventuell im Freien) Material: Becherglas 50 ml, Spatel, Waage, Dreibein mit Keramik-Drahtnetz, Zündhölzer, Eisendraht, Brenner Durchführung: 8 Gramm Zink und 4 Gramm Schwefel werden im Becherglas abgewogen und gut vermischt. Die Mischung wird auf eine feuerfeste Unterlage geschüttet und mit einem glühenden Draht entzündet. Reaktionsgleichung: Zink + Schwefel _________________________ Wenn Elemente sich verbinden, heisst die Reaktion ________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 8A 19 Schwefel S Schwefel findet man in elementarer Form in Vulkangebieten. Je nach Temperatur kommt der Schwefel in verschiedenen Formen vor. Schwefel dient zur Herstellung verschiedener Grundstoffe wie Schwefelsäure, etc. und zum Vulkanisieren von Gummi. Dabei wird der klebrige Kautschuk in elastischen Gummi umgewandelt. Im Weinbau dient Schwefel als Schädlingsbekämpfungsmittel. Suche weitere Anwendungen von Schwefel: _________________________________________________________________________________________ _________________________________________________________________________________________ Versuch 1: Material: Die Eigenschaften von Schwefel Schwefelpulver, Reagenzglas, Spritzflasche mit Wasser Durchführung: Untersuche folgende Eigenschaften: Geruch: _________________________________________________________________________________ _________________________________________________________________________________________ Gib eine Spatelspitze Schwefelpulver in ein Reagenzglas, giesse ungefähr 4 cm Wasser hinzu und schüttle kräftig. Beobachtung: ___________________________________________________________________________ _________________________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 20 Posten 8B Versuch 2: Material: Schwefel S Die Erscheinungsformen von Schwefel (Streiff) Reagenzglas, Spatel, Brenner, Schwefelpulver oder Stangenschwefel, Becherglas 250 ml Durchführung: Fülle das Reagenzglas zu einem Drittel mit Schwefelpulver. Erwärme sehr langsam unter Schütteln. Stelle die Flamme am Anfang sehr klein. Beobachte die Farb- und Zustandsänderungen. Nimm das Reagenzglas zum Beobachten aus der Flamme. Farbe: Zustand: Wenn aller Schwefel geschmolzen ist, erhitze die dünnflüssige Schmelze sehr stark. Giesse am Schluss die heisse flüssige Masse schnell in das mit Wasser gefüllte Becherglas. Fische den Schwefel mit dem Spatel heraus. Beschreibe den Zustand: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Bewahre den Schwefel auf. Beobachte ihn während 15 Minuten. Beschreibe die Änderungen. ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 8C Versuch 3: Material: 21 Schwefel S Wir stellen Schweflige Säure her ca. 1/2 Erbsengrösse Stangenschwefel (S), Sauerstoff (O2) ab Flasche, Brenner, Standglas, Uhrglas, Verbrennungslöffel Ausführung: 1. Standglas ca. 1 cm hoch mit destilliertem Wasser (H2O) füllen, nur einige Körnchen Kaliumpermanganat dazugeben und gut auflösen lassen, damit sich das Wasser gleichmässig einfärbt. 2. Standglas sorgfältig mit Sauerstoff auffüllen und sofort mit dem Uhrglas zudecken. 3. Schwefel auf den Verbrennungslöffel geben, in der Brennerflamme entzünden, sofort ins Standglas halten und dieses soweit möglich zudecken, damit das beissende Gas nicht in die Atmungsluft gelangt! Warten bis der Schwefel restlos verbrannt ist. 4. Nach ca. 1 Min. den Löffel herausnehmen, in Wasser legen und das Standglas sofort wieder verschliessen. Bewege nun das Wasser im Standglas leicht und beobachte was passiert. 5. Lass das restliche Gas ausserhalb des Schulzimmers ins Freie entweichen. 6. Prüfe nun das Wasser auf den pH-Wert. Was stellst du fest? 2. Auswertung Beschreibe, wie der Schwefel verbrennt (von Anfang an!) __________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Beschreibe, das Verbrennungsprodukt Schwefeldioxid: _____________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Welche Wirkung hat das Schwefeldioxidgas auf das angefärbte Wasser? ____________________ _________________________________________________________________________________________ pH-Wert des Wassers: _____________________________________________________________________ Feststellung: ______________________________________________________________________________ _________________________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 9 22 Chlor Cl Chlor kommt in der Natur nie in elementarer Form vor. Chlor ist ein gelbgrünes, giftiges Gas von stechendem Geruch. Es ist sehr reaktionsfähig und verbindet sich gern mit Metallen. (eventuell Lehrerversuch) Er wird verwendet für _________________________________________________________________________________________ _________________________________________________________________________________________ Versuch 1: Material: Wir stellen Chlorgas her durch Elektrolyse U-Rohr, 2 Graphitstäbe mit Stopfen, Kabel, Batterie 4,5 Volt, Salzsäurelösung (HCl-Lösung, 10%) Durchführung: Man füllt die verdünnte Salzsäure in das U-Rohr, steckt die Elektroden in die Flüssigkeit und verbindet die Elektroden mit der Taschenlampen+ batterie. Die Salzsäure wird aufgespalten in ihre Elemente, nämlich H und Cl. Rieche an den Öffnungen. An welchem Pol entsteht Chlor? ________________________________________________________________ Wie nennt man die Aufspaltung einer Verbindung in die verschiedenen Elemente? ________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 10A 23 Kohlenstoff C Kohlenstoff tritt in der Natur in elementarer Form als Graphit und als Diamant auf. Russ ist fein verteilter Graphit. Eigenschaften und Verwendung von: Graphit: _________________________________________________________________________________ Diamant: ________________________________________________________________________________ Kohlenstoff ist ein reaktionsträges Element. Bei höherer Temperatur reagiert es mit Sauerstoff und bildet Kohlendioxid CO2. Erdöl enthält Verbindungen von Kohlenstoff mit Wasserstoff. Sie werden deshalb Kohlenwasserstoffe genannt. Versuch: Fein verteilter Kohlenstoff kann Farbstoffe aufnehmen (=Aktivkohle) Material: 2 Erlenmeyer 250 ml, 1 Trichter mit Faltenfilter, Farblösung (z.B. Malachitgrün, Methylenblau, Coca, Randensaft, etc), Aktivkohle , Spatel Ausführung: In den einen Erlenmeyer gibt man zur Hälfte Wasser und färbt mit sehr wenig Farbstoff leicht an. Nun gibt man einige Spatel Aktivkohle zu und schüttelt, bis die Farbe verschwunden ist. Anschliessend wird in den zweiten Erlenmeyer filtriert. Beobachtung: ____________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________ Merke: Aktivkohle wird aus verkohlten Pflanzen- oder Tierkörpern gewonnen. Sie besteht aus Körnern mit zahlreichen feinen Rillen und Kanälchen. Die winzigen Aktivkohlestäubchen sind also schwammige Gebilde mit vielen Hohlräumen. Sie haben eine besonders grosse Oberfläche, an der viele Stoffe zäh haften bleiben. Das Haften eines Stoffes an der Oberfläche eines Feststoffes nennt man Adsorption. Übrigens: 1 g hochwertige Aktivkohle besitzt eine Oberfläche von ca. 1'000 m 2. Das entsprich der Grundfläche von 10 Schulzimmern! Mit Aktivkohle lässt sich nicht nur Wasser reinigen. Man verwendet Aktivkohle auch in Filtern von Dampfabzügen, Gasmasken und ... Schuheinlagen! Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 24 Posten 10B Versuch : Material: Kohlenstoff C Welche Stoffe enthalten Kohlenstoff? Porzellanschalen, Reagenzgläser, Reagenzglashalter, Zündhölzer, Brenner, Kerzen, Zucker, Heizöl, Fett, Kunststoff, Kreide Durchführung: Versuche mit jeweils ungefähr 1 cm3 der obenstehenden Stoffe durch Erhitzen oder durch Anzünden herauszufinden, ob der betreffende Stoff Kohlenstoff in seiner schwarzen Form enthält. Kreuze in der Tabelle die entsprechende Spalte an. (eventuell Demo-Versuche) Beachte: Achte auf gute Lüftung. Einige Stoffe bilden Rückstände, die du fast nicht mehr entfernen kannst. Erhitze also nicht mehr als nötig und reinige den Arbeitsplatz wieder. Stoff Kerzenwachs Zucker Heizöl Fett Kunststoff (Zeigetasche) oder Kunststoff (alter Kugelschreiber) Kunststoff (Acrylglasresten) Kreide enthält Kohlenstoff enthält keinen Kohlenstoff Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 11A 25 Kohlendioxid C02 Kohlendioxid ist ein farbloses und geruchloses Gas. Unter erhöhtem Druck kann es verflüssigt und in schwarzen Stahlflaschen transportiert werden. Lässt man flüssiges Kohlendioxid austreten, so entsteht Trockeneis, das als Kühlmittel verwendet wird. Getränke enthalten ebenfalls Kohlendioxid, welches das Getränk angenehm säuerlich und haltbar macht. Die Pflanzen brauchen Kohlendioxid zur Produktion von Traubenzucker. (Photosynthese) Der Kohlendioxidgehalt der Atmosphäre ist in den letzten Jahren stark gestiegen, wegen der Verbrennung von Erdölprodukten. Dadurch vermindert sich die Abstrahlung von Wärme ins Weltall. Die Durchschnittstemperatur auf unserer Erde steigt (Treibhauseffekt). Dies kann unser Klima durcheinander bringen und der Landwirtschaft schaden. Versuch: Material: Nachweis von Kohlendioxid in der Atemluft Reagenzglas, Glasrohr, Kalkwasser Ca(OH)2 Durchführung: Fülle das Reagenzglas zu einem Drittel mit Kalkwasser. Blase behutsam und anhaltend durch das Glasrohr mit dem Kalkwasser. Beobachtung: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Erklärung: Unsere Nahrung enthält Kohlenstoff, welcher in unserem Körper zu Kohlendioxid verbrannt und durch die Atmung ausgeschieden wird. Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 11B 26 Kohlendioxid C02 Versuch : Reaktion von Salzsäure und Kalk (Raaf) Material: Tropftrichter, Erlenmeyerkolben, Auffanggläser, Salzsäure halbkonzentriert, Kalksteine oder Marmor, Schneckenhäuschen, Kreide, Glimmstab, Zündhölzer, Glasröhrchen, Kunststoffschlauch, Unterlage Durchführung: In den Erlenmeyerkolben gibt man kleine Stücke Kalkstein. Aus dem Tropftrichter lässt man langsam die Salzsäure herunter tropfen. Führe nach ungefähr 5 Minuten eine brennende Kerze in das Auffangglas (siehe Bild). Beachte: Salzsäure ist gefährlich Schutzbrille tragen Vorsichtig arbeiten Kleine Mengen Säure verwenden Beobachtung: ___________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Posten 11C Kohlendioxid Versuch 1A: Material: 27 C02 Eigenschaften von Kohlendioxid Becherglas, Zündhölzer, Kerze mit Drahthalter, Kohlendioxid Durchführung: Fülle in ein hohes Becherglas etwas Kohlendioxyd aus der Stahlflasche. Führe nun die brennende Kerze in das Becherglas. Du kannst so den Pegel des Kohlendioxidgases bestimmen. Aufgabe: Zähle zwei Eigenschaften von Kohlendioxid auf. oder Versuch 2B: Material: Eigenschaften von Kohlendioxid Becherglas, Zündhölzer, Kerze, Kohlendioxid Durchführung: Stelle eine brennende Kerze in ein Becherglas. Giesse aus einem zweiten Becherglas Kohlendioxid hinzu. Beobachtung: _________________________________________________________________________________________ _________________________________________________________________________________________ _________________________________________________________________________________________ Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 28 Glossar zur Elemente – Werkstatt Adsorption, adsorbieren Analyse Bauxit chemische Reaktion Dichte Edelgase Edelmetalle Elektroden Elektrolyse elementar endotherm exotherm gediegen H2 H 2O Halogene HCl Kautschuk Kohlenwasserstoffe Korrosion, korrodieren Legierung Natriumchlorid O2 Oxid Oxidation, oxidieren pH-Wert Reduktion, reduzieren Sulfid Synthese vulkanisieren ZnCl Stoffe haften an der Oberfläche eines anderen Stoffes Zerlegung einer Verbindung in die Elemente wichtigstes Aluminiumerz, benannt nach dem ersten Fundort Les Baux in Frankreich eine Umwandlung von Stoffen, bei der aus den Ausgangsstoffen neue Stoffe gebildet werden. Chem. Reaktionen sind stets von einer Energieumwandlung begleitet eine charakteristische Eigenschaft der Stoffe: Quotient aus Masse (g) und Volumen (cm3), bei Gasen g/l (dm3) Sie sind besonders reaktionsträge: Helium (He), Neon (Ne), Argon (Ar),... Sie bilden im Periodensystem die VIII Hauptgruppe Metalle, die sich nicht oder nur schlecht mit Sauerstoff verbinden: Platin (Pt). Gold (Au), Silber (Ag) Übergangsstellen in elektrischen Stromkreisen von meist metallischen Leitern in Flüssigkeiten oder Gasen. Zerlegung einer chem. Verbindung mit Hilfe elektrischer Energie als reines Element in der Natur vorkommend bei einer chem. Reaktion wird Wärme aus der Umgebung aufgenommen bei einer chem. Reaktion wird Wärme frei wie elementar, als reines Element in der Natur vorkommend Wasserstoffmolekül Wassermolekül eine Elementgruppe (VII Hauptgruppe im Periodensystem), die mit Metallen Salze bilden: Fluor (F), Chlor (Cl), Brom (Br), Iod (J) Salzsäure (Chlorwasserstoff-Gas in Wasser gelöst) Milchsaft des Kautschukbaumes, Rohstoff für die Gummiherstellung Verbindungen aus Kohlenstoff und Wasserstoff, Erdöl und Erdgas sind Kohlenstoff-Wasserstoff-Verbindungen chemische Veränderung an der Oberfläche fester Stoffe, angreifen, zerstören Gemisch aus zwei oder mehreren Metallen, das in der Schmelze hergestellt wird Kochsalz (NaCl) Sauerstoffmolekül Verbindung eines Elementes mit Sauerstoff z.B Magnesiumoxid, Eisenoxid, ...) Reaktion, bei der (sich) ein Stoff mit Sauerstoff reagiert (verbindet) Mass für die Stärke von Säuren und Laugen (Mass für den Gehalt einer Lösung an H+ - oder OH- Ionen) Reaktion, bei der einem Stoff Sauerstoff entzogen wird (Umkehrung einer Oxidation) Metalle reagieren mit Schwefel und bilden die entsprechenden Sulfide (Zinksulfid, Eisensulfid...) Aufbau einer Verbindung aus Elementen Kautschuk in Gummi umwandeln, Gummiteile miteinander verbinden Zinkchlorid: Chem. Verbindung aus Zink und Salzsäure, dabei wird Wasserstoff frei Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 29 Steckbrief zu den Metallen der Elementen-Werkstatt Name und Symbol Aussehen Verwendung Aluminium Al weiss, glänzend im Flugzeugbau, für Fahrräder und Gebrauchsgegenstände Blei Pb bläulich-weiss, glänzend Eisen Fe grau-weiss, glänzend Eigenschaften weich, Leichtmetall, widerstandsfähig gegenüber Witterungseinflüssen und vielen Chemikalien, die Oxidschicht wirkt wie ein gute Schutzhülle Taucher befestigen an ihren sehr weich, Kleidern Blei zur gut verformbar, Verminderung des Auftriebs, beständig an der Luft, zur Einfassung von Schwermetall, Glasteilen bei Glasfenstern, bildet schnell eine Bleiakku im Auto, Oxidschicht Bleischürzen schützen vor Achtung: Bleiverbindungen Röntgenstrahlen, und –dämpfe sind giftig Legierung mit Zinn dient zum Löten von Metallen meistens in der Legierung Roheisen ist hart und von Stahl, spröde, vielseitiger Werkstoff: lässt sich gut giessen, Werkzeuge, Nägel, Wasser und Luft zerstört Maschinenteile, Schiffsbau, Eisen: Rost (Eisenoxid) Eisenbahnschienen, Armierungsstahl, Brückenbau Vorkommen Dichte () / Schmelztemp. in der Natur nur in Form von Aluminiumerzen: Tonerde und Bauxit, grosse Vorräte im Erdboden, aufwendige und kostspielige Gewinnung, Al wurde erst vor 200 Jahren entdeckt in der Natur nur in Form von Verbindungen 2,70 g/cm3 660°C in der Natur ganz selten rein (Eisenmeteorite), meistens als Erz (Magnetit, Pyrit) vierthäufigstes Element der Erdkruste 7,78 g/cm3 1535°C 11,34 g/cm3 327°C Naturlehre: Aufbau der Stoffe Elemente-Werkstatt Kupfer Cu braun-rot, glänzend Magnesium Mg grau, matt Silber Ag hell-grau, glänzend Zink Zn grau-weiss, glänzend 30 für Dachabdeckungen und Dachrinnen, Gas- und Wasserleitungen, Baustoff in der Elektrotechnik (Kabel), für Legierungen von Bronze und Messing ältestes Gebrauchsmetall, seit ca. 10'000 Jahren Flugzeug – und Motorenbau Magnesiumoxid, (Magnesia) wird beim Geräteturnen verwendet weich, durch die Witterung bildet das Kupfer eine grüne Oxidschicht, zweitbester elektrischer Leiter, leitet die Wärme sehr gut in der Natur selten rein, meistens als Kupfererze 8,92 g/cm3 1083°C weich Leichtmetall reagiert mit Sauerstoff zu Magnesiumoxid, verbrennt mit leuchtender Flamme Mg ist am Aufbau des Chlorophylls beteiligt Mg ist am Aufbau der Erdrinde beteiligt 1,74 g/cm3 650°C Elektrotechnik, Herstellung von Filmen und Fotopapier, für Schmuck, med. Geräte, Münzen, Bestecke, silberhaltige Salben helfen bei Hautkrankheiten Ag schon bei den Ägyptern vor 6000 Jahren bekannt Bauteil in den Batterien, für Abdeckungen und Dachrinnen, Beschichtung von Eisen als Rostschutz, für Gehäuse von Kameras, Autoteile, für Legierungen mit Kupfer weich bester elektrischer Leiter Sliberverbindungen sind lichtempfindlich selten rein in der Natur häufiger sind die Silbererze, vermischt mit Blei 10,5 g/cm3 961°C weich, dehnbar, Schwermetall, beständig gegen Witterungseinflüsse, in der Natur nur als Verbindung: Zinksulfid (Zinkblende) 7,14 g/cm3 420°C Naturlehre: Aufbau der Stoffe Elemente-Werkstatt 31 Steckbrief zu den Nichtmetallen der Elementen-Werkstatt Name und Symbol Aussehen Chlor Cl gelbgrünes Gas Kohlenstoff C Schwefel S Kohlenstoff CO2 Verwendung Desinfektion von Trinkwasser und Schwimmbadwasser Herstellung von Farben, Arzneimitteln, Lösungsmitteln und Kunststoffen (PVC) Zwei Diamant: geschliffen Erscheinungsformen: als Schmuckstein, Diamant: durchsichtig, (Brilliant) stark lichtbrechend Rohdiamanten in Bohrköpfen für hartes Gestein, Trennscheiben für Beton Graphit: grau, Graphit: Bleistiftminen, undurchsichtig Schmiermittel, Schleifkontakte für Elektromotoren, Elektroden in Batterien gelb, blassgelb, je Grundstoff in der nach Erscheinungsform chem. Industrie, Sprengstoff, Medizin, Zündhölzer farb-, geruch- und beigemischt in geschmackloses Gas Mineralwassern, ergibt einen erfrischenden Geschmack In Feuerlöschern, festes Kohlendioxid als Trockeneis Eigenschaften Vorkommen Dichte () / Schmelztemp. stechender Geruch giftig, schwerer als Luft, reagiert mit Metallen zu Salzen, Chlor gehört zu den „Salzbildnern“ (Halogene) Diamant: härtester Stoff, leitet den el. Strom nicht, widerstandsfähig gegenüber Chemikalien kommt nur in Verbindungen vor, Cl wird aus Kochsalz (Natriumchlorid) gewonnen, Wasserstoff und Chlor in Wasser gelöst ergibt Salzsäure Diamant: elementar in der Natur, selten Bei Temperaturen zwischen 1200°-1500° C wandelt sich Diamant in Graphit um. Der Vorgang lässt sich unter hohem Druck bei 3000° C umkehren. (künstliche Diamanten). Industriediamanten sind häufig künstlich 2,95 g/l (dm3) bei 20°C -101° C häufig elementar in der Natur 2 g/cm3 119° C Graphit: weich, fühlt sich fettig an, leitet den el. Strom, widerstandsfähig gegenüber Chemikalien fest, verschieden je nach Erscheinungsform schwerer als Luft, erstickt das Feuer löslich im Wasser, Treibhausgas Diamant: 3,51 g/cm3 Graphit: 2,25 g/cm3 0,03 % in der frischen Luft und 1,98 g/l (dm3) 4% in der Ausatmungsluft, bei 20°C Entsteht bei der -79°C Verbrennung von Kohlenstoff