Parkinsontherapie
Werbung

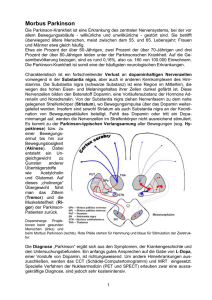
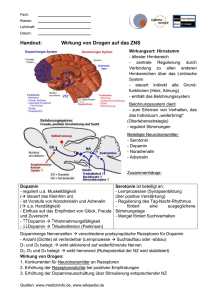
MORBUS PARKINSON neu dargestellt von Edwin H. Bessai Im Gehirn (wie im gesamten Nervensystem) werden die Impulse von Zelle zu Zelle übertragen. Die Zellen sind miteinander durch Kontaktstellen, sog. „Synapsen“, verbunden. In der Synapse ist die vorgeschaltete Zelle durch die „präsynaptische Membran“ begrenzt, der die „postsynaptische Membran“ der nachgeschalteten Zelle gegenübersteht. Präsynaptische und postsynaptische Membran sind durch einen engen Spalt (20 Millimikron = Millionstel mm), den „Synapsenspalt“ voneinander getrennt. Die Impulsübertragung erfolgt mit Hilfe von Überträgerstoffen, sog. „Neurotransmittern“, die von der präsynaptischen Membran in den synaptischen Spalt freigesetzt werden und nach Überwinden des synaptischen Spalts auf der postsynaptischen Membran von bestimmten Stoffen, sog. „Rezeptoren“ (von lat. recipere = aufnehmen, empfangen) chemisch gebunden werden. Dadurch wird ein Signal an die Zelle zur Übertragung des Impulses an die nächste Zelle gegeben (die Zelle wird zur Übertragung des Impulses aktiviert). Es gibt verschiedene Neurotransmitter und für jeden Neurotransmitter gibt es eigene, spezifische Rezeptoren. Ein Neurotransmittermangel im Gehirn hat schwerwiegende Funktionsstörungen, Erkrankungen zur Folge. Eine solche, durch einen Neurotransmittermangel gekennzeichnete Erkrankung ist auch der Morbus Parkinson. Bei dieser Erkrankung spielen vor allem drei Neurotransmitter eine Rolle: Dopamin Glutamat Acetylcholin Diese wirken nicht nur auf die Impulsübertragung, sie stehen auch in Beziehung zueinander. So sind die Neurotransmitter Glutamat und Acetylcholin Gegenspieler des Dopamin. Das bedeutet, wenn der Neurotransmitter Dopamin abnimmt nehmen die Gegenspieler Glutamat und Acetylcholin zu. Beim gesunden Menschen sind die drei Neurotransmitter in ausreichender Menge vorhanden und deshalb im Gleichgewicht. Beim Morbus Parkinson sterben die Nervenzellen die Dopamin produzieren ab. Es sind spezielle, sog. „dopaminerge Neuronen“ in der Substantia Nigra, einem bestimmten Hirnareal. Man spricht vom Untergang dieser Zellen, weil deren Anzahl beim Morbus Parkinson ständig abnimmt. Dadurch kommt es zu einem stetig ansteigenden Dopaminmangel, der wieder ein Übergewicht der Gegenspieler Glutamat und Acetylcholin 2 zur Folge hat. Vor allem der Dopaminmangel, aber auch das gestörte Gleichgewicht zwischen den Transmittern verursachen Störungen im Impulsübertragungssystem. Weil die Störungen letztlich die Folge des Untergangs dopaminerger Neuronen (wahrscheinlich aber auch anderer Neuronen) sind, muss eine ursächliche Behandlung des Morbus Parkinson, eine „kausale Therapie“, in erster Reihe die Ursache des Neuronenuntergangs beheben. Diese ist jedoch zur Zeit nicht bekannt. Man weiß heute nicht was zum Untergang der Neuronen führt und weiß aus diesem Grund auch nicht, wie dieser verhindert werden kann. Deshalb wird gegenwärtig versucht, dem Neuronenuntergang durch „Neuroprotektion“ entgegenzuwirken. Ein erster Erfolg wäre es, wenn auf diese Weise der Neuronenuntergang verlangsamt werden könnte (der Krankheitsverlauf verlangsamt werden könnte). Mit den bisher eingesetzten Substanzen (alles gängige Parkinsonmedikamente) konnte noch keine deutliche Verlangsamung des Krankheitsverlaufs erzielt werden. Deshalb werden neue, stärker neuroprotektiv wirkende Substanzen gesucht, mit denen der Neuronenuntergang merklich verlangsamt und vielleicht auch gestoppt (die Krankheit aufgehalten) oder sogar verhindert werden kann (der Ausbruch der Krankheit verhindert werden kann). Solange der Untergang der Neuronen nicht verhindert werden kann, kann eine Heilung des Morbus Parkinson nur durch Ersetzen der untergegangenen Neuronen und Regenerierung der geschädigten Neuronen erreicht werden. Die untergegangenen Neuronen könnten zum Beispiel durch „Transplantation“ dopaminerger Neuronen ersetzt werden, die gentechnisch aus Stammzellen gewonnen werden, oder durch dopaminerge Neuronen, die durch gentherapeutische „Stimulation adulter Stammzellen“ im Gehirn entstehen. Aber auch die „Neuroregeneration“ geschädigter Neuronen könnte durch gentherapeutische Stimulation möglich werden. Diese, wie auch die „Neuroprotektion“ und vor allem die „Suche nach der Ursache der Erkrankung und deren Beseitigung“ sowie eine ganze Reihe weiterer Ansätze sind Gegenstand umfangreicher Forschungen weltweit. Es sind größtenteils (Forschungs-)Ziele, deren Verwirklichung nicht in naher Zukunft zu erwarten ist, und zum Teil auch in Frage steht. Was einmal tatsächlich verwirklicht werden wird und wann, kann heute nicht vorausgesagt werden. Feststeht nur, dass der Morbus Parkinson gegenwärtig weder geheilt noch gestoppt werden kann. Auch bei der angestrebten Verlangsamung des Krankheitsverlaufes gibt es noch keinen Durchbruch. Die medikamentöse Parkinson-Therapie ist deshalb zur Zeit notgedrungen auf die Behandlung der Symptome beschränkt. Das bedeutet, dass heute nur eine „symptomatische Therapie“ möglich ist. Im Folgenden wird die „aktuelle symptomatische ParkinsonTherapie“ dargestellt. Dabei wird erstmals von drei Therapie-Ansätzen ausgegangen. Um das Wesentliche der symptomatischen Therapie zu verdeutlichen, sind alle, für das Darstellen nicht relevanten Details, ausgeklammert. So sind die, für die drei Therapie-Ansätze zur Verfügung stehenden Medikamente (bzw. Wirkstoffe) nur tabellarisch erfaßt, ohne detaillierte Hinweise auf deren spezifische Wirkung und Nebenwirkungen. 3 Auch die „potentielle Neuroprotektion“ der Parkinson-Medikamente ist aus diesem Grund ausgeklammert. Dies ist allerdings auch inhaltlich begründet, weil die Neuroprotektion keine symptomatische Therapie ist, sondern eine Kausaltherapie. 4 Symptomatische Parkinson-Therapie 2000 Neue Darstellung in drei Ansätzen Bei der symptomatischen Parkinson-Therapie wird versucht, dem Dopaminmangel entgegenzuwirken und das gestörte Gleichgewicht der drei Neurotransmitter zu verbessern. Da dem Dopaminmangel direkt und indirekt entgegengewirkt werden kann, also auf zwei unterschiedliche Arten, ergeben sich zusammen mit den Maßnahmen zur Verbesserung des Gleichgewichts zwischen den Transmittern insgesamt drei Ansätze der symptomatischen Parkinson-Therapie, die hier in den Kapiteln A, B und C dargestellt sind. A. Therapiemaßnahmen die dem Dopaminmangel direkt entgegenwirken Bei der symptomatischen Parkinson-Therapie wird in erster Reihe versucht, die Dopaminmenge im Gehirn wieder zu erhöhen, durch Zufuhr über die Blutbahn. Weil das Dopaminmolekül die Blut-Hirn-Schranke nicht passieren kann, wird eine Vorstufe von Dopamin, das „Levodopa“ (chemisches Kürzel L-DOPA), zugegeben, das nach Passieren der Blut-Hirn-Schranke in Dopamin umgewandelt wird. Damit das L-DOPA nicht schon vor der Blut-Hirn-Schranke in Dopamin umgewandelt wird, wird dem LDOPA ein Hemmstoff zugesetzt, ein Decarboxylase-Hemmer (abgekürzt DCHemmer). Davon gibt es zwei, das Benserazid und das Carbidopa. Durch den Einsatz solcher Präparate konnte die notwendige L-DOPA-Menge um bis zu 80 % reduziert werden. Damit eine kontinuierliche, tonische Dopaminrezeptorstimulation gewährleistet wird (beim gesunden Menschen stimulieren drei Dopaminmoleküle pro Sekunde die Dopamin-Rezeptoren), müssen die Levodopa-Präparate möglichst fein verteilt, im 2Stunden-Takt verabreicht werden. Die Wirkung der Präparate tritt 45 – 60 Minuten nach der Einnahme ein. Bei löslichen Präparaten, die es auch gibt, tritt die Wirkung bedeutend schneller ein, schon nach 15 – 30 Minuten. Bei der Langzeittherapie lässt die Wirkung von L-DOPA allmählich nach und es treten auch Wirkungsschwankungen (Fluktuationen), motorische Komplikationen, wie unwillkürliche Bewegungen (Dyskinesien), Psychosen und Verwirrtheitszustände auf. Der Grund für diese Spätkomplikationen (die auch als „L-DOPA-Spätsyndrom“ zusammengefaßt werden) sind wahrscheinlich neurotoxische Nebenwirkungen von LDOPA bzw. die dadurch verursachten Neuronenschädigungen. Die L-DOPASpätkomplikationen sind irreversibel. Sie lassen sich zwar reduzieren oder auch ganz vermeiden, wenn die L-DOPA-Dosis entsprechend reduziert wird, treten jedoch wieder auf, sobald die Dosis wieder erhöht wird. Weil aber die L-DOPA-Dosis wegen der Parkinsonsymptome nicht auf Dauer substantiell reduziert werden kann, ist die Behandlung der L-DOPA-Spätkomplikationen auf eine Minimierung und Feinstverteilung (1-Stundentakt und eventuell lösliche Präparate) der L-DOPA-Dosis oder in manchen Fällen eine Umverteilung der Tagesdosis (eine ungleichmäßige Verteilung, angepasst an den im Tagesverlauf unterschiedlichen Bedarf) sowie eine individuelle, die Symptome der Spätkomplikationen dämpfende Einstellung der gesamten Medikation beschränkt. Dabei müssen alle Medikamente auf ihre „Symptom- 5 steigernde“ Wirkung (die bei den einzelnen Patienten unterschiedlich ist) überprüft werden und gegebenenfalls reduziert bzw. minimiert werden. Eine andere Behandlungsmöglichkeit gibt es zur Zeit nicht. Deshalb versucht man das Auftreten der Spätkomplikationen hinauszuschieben, indem mit der L-DOPA-Therapie so spät wie möglich begonnen wird und dann die Dosis so niedrig wie möglich gehalten wird. An Stelle von L-DOPA werden heute anfangs sog. „Dopamin-Agonisten“ verabreicht. Das sind Stoffe, die ähnlich wie Dopamin wirken (Agonist kommt von lat. agere = wirken, agieren). Diese Stoffe wirken zwar nicht so gut wie L-DOPA, sie haben aber nicht die Langzeitnebenwirkungen von L-DOPA. L-DOPA wird heute erst bei Fortschreiten der Erkrankung eingesetzt. Aber auch dann werden Agonisten als Ergänzung zusätzlich verabreicht, um die Dosis von L-DOPA so gering wie möglich zu halten. Es gibt zwei Gruppen von Dopamin-Agonisten, die Gruppe der Agonisten die aus Mutterkornalkaloiden gewonnen werden, die „Ergolin-Derivate“, und die Gruppe der Agonisten die nicht aus Mutterkornalkaloiden gewonnen werden, die „Nicht-ErgolinDerivate”. Die Ergolin-Derivate wirken nicht nur auf Dopaminrezeptoren, sondern auch auf nicht-dopaminerge Rezeptoren. Dadurch kommt es teilweise zu erheblichen Nebenwirkungen, wie z. B. Blutdrucksenkung, Halluzinationen, u.a. Die Nicht-Ergolin-Derivate sind dem Dopamin am nächsten. Sie wirken wie Dopamin nur auf Dopaminrezeptoren und unterscheiden sich daher sowohl in der Wirkung, als auch vor allem in den Nebenwirkungen von den Ergolin-Derivaten. B. Therapiemaßnahmen, die dem Dopaminmangel indirekt entgegenwirken Zusätzlich zu den bei Punkt A beschriebenen Therapiemaßnahmen kann der Dopaminspiegel auch indirekt durch Hemmung des Dopaminabbaus und L-DOPA-Abbaus stabilisiert werden. Für den Abbau sind folgende zwei Enzyme verantwortlich: - Das Enzym MAO-B (= MonoAmin-Oxydase Typ B) Dieses Enzym baut Dopamin im Gehirn ab. Durch Hemmung dieses Enzyms wird weniger Dopamin abgebaut und dadurch der Dopaminspiegel im Gehirn stabilisiert. Im Frühstadium der Erkrankung kann deshalb bei Anwendung Therapiemaßnahme der Einsatz von L-DOPA hinausgezögert werden. - Das Enzym COMT (= Catechol-O-Methyl-Transferase) Dieses Enzym baut Dopamin und L-DOPA ab. dieser 6 Durch Hemmung dieses Enzyms im Gehirn (zentral) wird weniger Dopamin abgebaut und dadurch der Dopaminspiegel im Gehirn stabilisiert. Durch Hemmung dieses Enzyms vor Eindringen ins Gehirn (peripher) wird weniger L-DOPA abgebaut, so dass mehr L-DOPA ins Gehirn gelangt. Das führt zwar auch zu einer Stabilisierung des Dopaminspiegels, wirkt sich aber vor allem auf die L-DOPADosis aus, die dadurch reduziert werden kann. C. Therapiemaßnahmen zur Verbesserung des Gleichgewichts zwischen den Neurotransmittern Durch die bei Punkt A und Punkt B beschriebenen Therapiemaßnahmen kann der Dopaminspiegel zwar erhöht bzw. stabilisiert werden, er kann aber nicht auf den Normalwert angehoben werden, weil bei Auftreten der ersten Parkinsonsymptome (also bei Erkennen der Krankheit) schon ca. 60 % der dopaminproduzierenden Zellen untergegangen sind. Geht man von ursprünglich 450.000 dopaminergen Neuronen in der Substantia Nigra aus, so bedeutet das, dass davon nur noch 180.000 vorhanden sind (450.000 x 40 % = 180.000). Das Gleichgewicht der drei Neurotransmitter kann daher nur auf einem entsprechend niedereren Niveau durch Absenken des Glutamat- und Acetylcholinspiegels erreicht werden. Das Absenken des Glutamat- und Acetylcholinspiegels ist durch den Einsatz von Hemmstoffen möglich. Diese werden zwar auch von den entsprechenden Rezeptoren gebunden, geben aber kein Signal an die Zelle, den Impuls weiterzuleiten. Sie aktivieren die Zelle also nicht, sondern blockieren bloß deren Rezeptoren. Ihre Wirkung ist deshalb der Wirkung der Neurotransmitter entgegengesetzt weshalb man sie auch als deren „Antagonisten“ (lat./griech. Gegensatz) bezeichnet. Beim Einsatz der Hemmer (Antagonisten) von Glutamat bzw. Acetylcholin wird ein Teil der Rezeptoren blockiert (besetzt), so dass weniger Glutamat bzw. Acetylcholin andocken kann, deren Spiegel also sinkt und so ein gewisses Gleichgewicht zwischen den drei Neurotransmittern hergestellt wird. Im Frühstadium der Erkrankung reicht dies auch ohne Anhebung des Dopmanispiegels aus, so dass der Einsatz von L-DOPA auch auf diese Weise hinausgezögert werden kann. Die Glutamat-Hemmer haben die Bezeichnung „NMDA-Antagonisten“ weil der Glutamat-Rezeptor ein N-Methyl-D-Aspartat ist und das Kürzel dieses Stoffes NMDA ist (NMDA = N-Methyl-D-Aspartat). Die heute als NMDA-Antagonisten eingesetzten Medikamente sind aber nicht nur Glutamat-antagonistisch, sie haben auch andere Eigenschaften. Als Acetylcholin-Hemmer werden die sog. „Anticholinergika“ eingesetzt. Diese sind allerdings nur zum Teil Acetylcholin-antagonistisch, sie haben auch eine ganze Reihe anderer Eigenschaften. Aber obwohl die Anticholinergika die ältesten Parkinsonmedikamente sind, sind deren Wirkmechanismen bis heute nur ungenügend geklärt. 7 Entsprechend der hier vorgenommenen Gliederung der symptomatischen Parkinson-Therapie in die drei Kapitel A, B und C können die dafür zur Verfügung stehenden Medikamente in drei Stoffgruppen A, B und C und sechs Medikamentengruppen eingeteilt werden (siehe Tabelle 1). 8 Tabelle 1 Parkinson-Medikamente 2000 Liste der Wirkstoffe Stoffgruppe A Stoffe die dem Dopaminmangel direkt entgegenwirken 1. Levodopa Präparate Sie enthalten L-DOPA, das im Gehirn in Dopamin umgewandelt wird, und einen DCHemmer „Benserazid“ oder „Carbidopa“ - 2. L – DOPA + Benserazid L – DOPA + Carbidopa Dopamin Agonisten Sie wirken wie Dopamin. (Agonist kommt von lat. „agere“ = wirken, agieren) Ergolin-Derivate (Mutterkornalkaloid-Derivate) Kurze Halbwertzeit - Bromocriptin - Lisurid Lange Halbwertzeit - Alpha-Dihydroergocryptin - Pergolid - Cabergolin Nicht-Ergolin-Derivate (Nicht-Mutterkornalkaloid-Derivate) - Ropinirol - Pramipexol Stoffgruppe B Stoffe die dem Dopaminmangel indirekt entgegenwirken, indem sie den Abbau von Dopamin und L-DOPA hemmen 3. MAO-B Hemmer Sie blockieren das Enzym MAO-B. (= MonoAmin-Oxydase Typ B). Dieses Enzym baut Dopamin im Gehirn ab. - 4. Selegilin COMT-Hemmer Sie blockieren das Enzym COMT. (= Catechol-O-Methyl-Transferase). Dieses Enzym baut Dopamin und L-DOPA ab. Es wirkt sowohl zentral (im Gehirn) als auch peripher (vor Eindringen ins Gehirn). - Tolcapon (wirkt zentral und peripher) Entacapon (wirkt nur peripher) 9 Stoffgruppe C Stoffe die das Gleichgewicht der Neurotransmitter verbessern, indem sie die Dopamingegenspieler Glutamat und Acetylcholin hemmen – Antagonisten dieser beiden Neurotransmitter (Antagonist =lat./griech. Gegensatz) Die Medikamente dieser Stoffgruppe sind nur vorrangig Glutamat oder Acetylcholin antagonistisch, denn sie haben neben ihrer antiglutamatergen oder anticholinergen Wirkung noch eine Reihe anderer Eigenschaften die hier bei den einzelnen Medikamenten ansatzweise vermerkt sind. 5. Glutamat Antagonisten, sog. “NMDA-Antagonisten” - Amantadin Budipin Anm.: Amantadin hat neben seiner antiglutamatergen Wirkung auch anticholinerge und andere Eigenschaften. Durch die antiglutamaterge und anticholinerge Wirkung verbessert Amantadin das Gleichgewicht zwischen den Transmittern und wirkt so auf alle Parkinson Symptome, vor allem auf die motorischen. Budipin ist ein Wirkstoff mit sehr komplexen Eigenschaften. Er ist zwar wegen seiner vorrangig antiglutamatergen Wirkung ebenfalls der Gruppe der NMDA-Antagonisten zugeordnet, gilt aber wegen der vielen anderen Eigenschaften nur als partieller NMDA-Antagonist, denn Budipin wirkt auch auf das dopaminerge, cholinerge, noradrenerge und serotonerge System und auch auf das Enzym MAO-B. Durch diese komplexen Eigenschaften beeinflusst Budipin alle Parkinson Symptome. 6. Acetylcholin Antagonisten „Anticholinergika“: - Biperiden Bornaprin Trihexyphenidyl Benzatropin Metixen Orphenadrin Procyclidin Anm.: Die Anticholinergika haben vorrangig eine anticholinerge Wirkung. Ihre übrigen Eigenschaften sind nur ungenügend geklärt. Durch ihre anticholinerge Wirkung verbessern sie das Gleichgewicht zwischen den Transmittern. Dadurch und durch ihre anderen Eigenschaften wirken sie auf alle Parkinson Symptome. Wegen ihrer psychotrophen Nebenwirkungen (wie Merkfähigkeitsstörungen, Verwirrtheit, Halluzinationen u.a.) werden sie heute nur noch eingeschränkt eingesetzt.