Physikalische Thermodynamik
Werbung
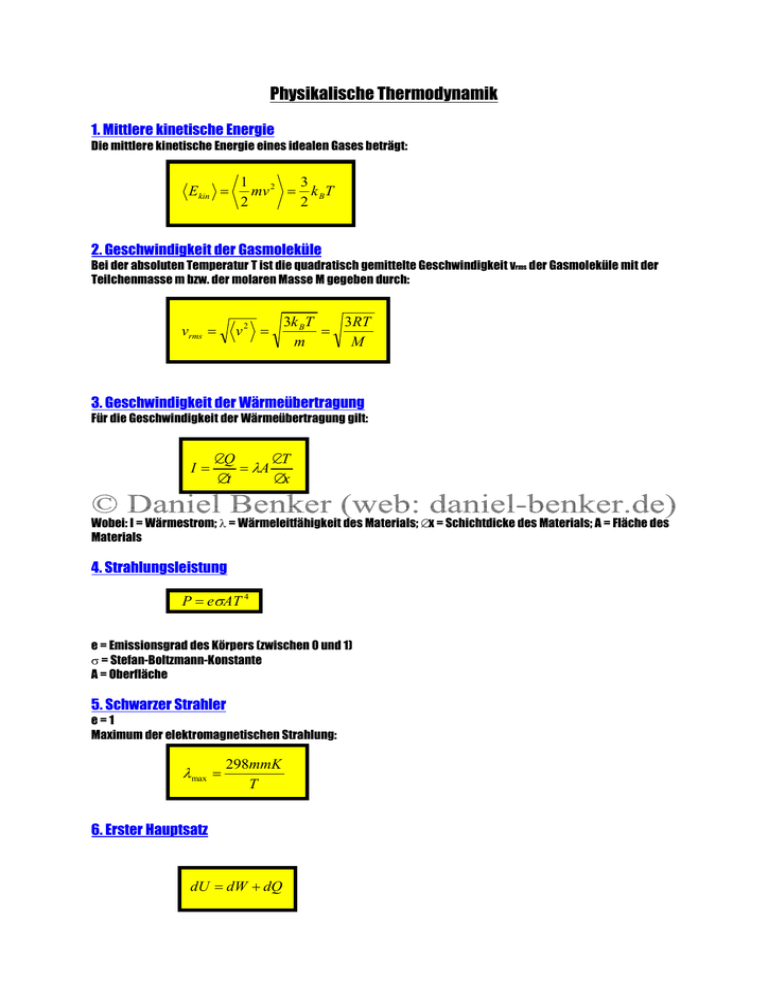
Physikalische Thermodynamik 1. Mittlere kinetische Energie Die mittlere kinetische Energie eines idealen Gases beträgt: E kin = 1 2 3 mv = k BT 2 2 2. Geschwindigkeit der Gasmoleküle Bei der absoluten Temperatur T ist die quadratisch gemittelte Geschwindigkeit vrms der Gasmoleküle mit der Teilchenmasse m bzw. der molaren Masse M gegeben durch: vrms = v2 = 3k BT 3RT = m M 3. Geschwindigkeit der Wärmeübertragung Für die Geschwindigkeit der Wärmeübertragung gilt: I= ∆Q ∆T = λA ∆t ∆x Wobei: I = Wärmestrom; λ = Wärmeleitfähigkeit des Materials; ∆x = Schichtdicke des Materials; A = Fläche des Materials 4. Strahlungsleistung P = eσAT 4 e = Emissionsgrad des Körpers (zwischen 0 und 1) σ = Stefan-Boltzmann-Konstante A = Oberfläche 5. Schwarzer Strahler e=1 Maximum der elektromagnetischen Strahlung: λmax = 298mmK T 6. Erster Hauptsatz dU = dW + dQ 7. Innere Energie U Die innere Energie eines Systems ist eine Zustandsfunktion. Das bedeutet: U hängt nur vom augenblicklichen Zustand des Systems ab und nicht davon, wie dieser Zustand erreicht wurde. Zustandsfunktionen sind auch Volumen, Druck und Temperatur. KEINE Zustandsfunktionen sind Wärme und Arbeit! Die innere Energie eines idealen Gases hängt nur von seiner absoluten Temperatur ab. Bei realen Gasen und auch Flüssigkeiten und Festkörpern hängt die innere Energie auch vom Druck und vom Volumen ab. 8. Adiabatengleichung Bei einem reversiblen Prozess vollziehen sich die Änderungen so langsam, dass das System eine Reihe von Gleichgewichtszuständen durchläuft. Jeder vom System einmal eingenommene Zustand lässt sich durch infinitesimale Änderungen eines oder mehrerer Parameter in der umgekehrten Richtung wieder erreichen. Während eines isobaren Prozesses bleibt der Druck konstant, und während eines isothermen Prozesses ändert sich die Temperatur nicht. Bei einem adiabatischen Prozess wird keine Wärme zwischen System und Umgebung übertragen. Während der reversiblen adiabatischen Expansion eines idealen Gases gilt stets die Adiabatengleichung: PV γ = const. Darin ist γ der Quotient der Wärmekapazitäten bei konstantem Druck und konstantem Volumen: γ= CP CV 9. reversible Expansion Die Volumenarbeit eines reversibel expandierenden Systems ist gegeben durch: W = − ∫ PdV Im Falle der isothermen Expansion: Wisotherm = − nRT ln V2 V1 10. Wärmekapazität Die Wärmekapazität bei konstantem Volumen entspricht der Änderung der inneren Energie mit der Temperatur: CV = ∂U ∂T Bei einem idealen Gas ist die Wärmekapazität bei konstantem Druck um nR größer als bei konstantem Volumen: C P = CV + nR Die Wärmekapazitäten idealer Gase bei konstantem Volumen sind: Einatomiges Gas: 3 CV = nR 2 Zweiatomiges Gas: 5 CV = nR 2 11. Gleichverteilungssatz Befindet sich ein System im Gleichgewicht, so entfällt auf jeden Freiheitsgrad die mittlere Energie (½)kBT pro Teilchen. Einatomige Gase haben drei Freiheitsgrade der kinetischen Energie. Zweiatomige Gase besitzen zwei weitere Freiheitsgrade, nämlich die der Rotation um die beiden Achsen senkrecht zur Kernverbindungsachse. Aus dem Gleichverteilungssatz folgt auch die Regel von Dulong und Petit: Die molare Wärmekapazität der meisten Festkörper beträgt 3R. Dies kommt von den 6 möglichen Freiheitsgraden(je drei für die kinetische und die potentielle Energie der Schwingung). 12. Zweiter Hauptsatz Nach dem Zweiten Hauptsatz in der Formulierung von Clausius kann keine zyklisch arbeitende Kältemaschine Wärme aus einem kälteren Reservoir in ein wärmeres Reservoir übertragen, ohne dass gleichzeitig Arbeit zugeführt werden muss. 13. Entropie Bei jedem irreversiblen Prozess geht das Universum in einen weniger geordneten Zustand über. Dieser hat eine höhere Wahrscheinlichkeit. Ein Maß für die Unordnung eines Systems ist dessen Entropie. Sie ist eine Zustandsfunktion. Die Entropieänderung ist definiert als ∆S = ∫ dQrev T Darin ist dQrev die dem System zu- oder abgeführte Wärmemenge, und zwar bei einem Prozess, der reversibel zwischen dem jeweils betrachteten Anfangs- und Endzustand abläuft. Die Entropie eines gegebenen Systems kann zu- oder abnehmen; die Entropie des Universums oder irgendeines isolierten Systems allerdings kann niemals abnehmen. Bei einem reversiblen Prozess bleibt die Entropie des Universums konstant; dagegen nimmt sie bei einem irreversiblen Prozess zu. Bei einem irreversiblen Prozess steigt die Entropie SU des Universums, und die Wärmemenge Wn = T∆SU wird entwertet, kann also nicht mehr in Arbeit umgewandelt werden. Die Entropie hängt mit der Wahrscheinlichkeit des betreffenden Zustands des Systems zusammen. Ein Zustand höherer Ordnung tritt mit geringerer Wahrscheinlichkeit auf. Ein isoliertes System (ebenso das Universum) strebt einem Zustand geringerer Ordnung, höherer Wahrscheinlichkeit und höherer Entropie zu. 14. Dritter Hauptsatz Eine mögliche Formulierung des dritten Hauptsatzes ist das Nernstsche Wärmetheorem, nach dem jede ideal kristallisierte reine Substanz am absoluten Nullpunkt die Entropie Null hat.











