Chemie der Hauptgruppenelemente
Werbung

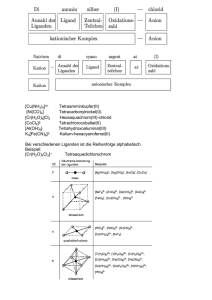
Chemie der Hauptgruppenelemente Hansjörg Grützmacher [email protected] Sekretariat: Frau Rüegg H 129 Ziel: ●Kenntnis allgemeiner Begriffe und Definitionen. ●Strukturchemie von anorganischen Verbindungen. ●Kenntnis der grundlegenden Verbindungstypen, ihrer Eigenschaften und Reaktivität. Atome Struktur (Verhalten von Elektronen in Atomen), Ionisierungsenergien, Elektronenaffinität, Elektronegativität Moleküle Ionen A+ B– Struktur, Dynamik, Reaktivität Radien Festkörperstrukturen (Gitter) Materialien Schmp.646 °C Schmp.−93.7 °C 3 Mehrelektronensysteme 1. Die Wellenfunktionen für Mehrelektronensysteme sind nicht exakt lösbar. Jedoch: Die Orbitale sind wasserstoffähnlich. 2. Die Orbitale werden durch die Quantenzahlen n, l und m beschrieben. 3. Die winkelabhängigen Wellenfunktionen φ, θ haben die gleichen Formen wie Einelektronen-(H)-Orbitale . 4. Wegen der erhöhten Kernladung sind die Radialfunktionen R zu kleineren Radien kontrahiert. Die Orbitalenergien sind niedriger. 6. Wichtig: Die Energie des Orbitals hängt von n und l ab! Aufhebung der Entartung von s, p und d Orbitalen. Elektron „2“ r12 θ2 Elektron „1“ r1 r2 φ2 θ1 Kern φ1 Bedenken Sie: Der Ort der Elektronen ist unbestimmt (Heisenberg‘sche Unschärferelation). Das macht die Bestimmung von r12, der Elektron-Elektron-Wechselwirkung und eine exakte Lösung der SchrödingerGleichung für ein Mehrelektronensystem unmöglich! Mehrelektronensysteme Pauliprinzip (Ausschlussprinzip): Wenn zwei Elektronen in einem System vertauscht werden, muss die Gesamtwellenfunktion Ψ ihr Vorzeichen wechseln. Das bedingt die Definition einer weiteren Quantenzahl: der Spinquantenzahl ms (+½, −½). Zwei Elektronen dürfen niemals in allen vier Quantenzahlen übereinstimmen; jedes Orbital kann nur maximal mit zwei Elektronen besetzt werden (einem α,β-Elektronenpaar). Aufbauprinzip Ein Orbitalschema wird immer bei den niedrigsten Energien beginnend zu den höchsten Energien besetzt. (Auffüllen des Schemas von „unten nach oben“) Hund‘sche Regel: Entartete Orbitale werden zunächst einfach mit Elektronen gleichen Spins besetzt (Maximierung des Gesamtspins S = │Σms│). Warum haben die ns Orbitale eine niedrigere Energie als die np Orbitale? Mehrelektronensysteme Ionisierungsenergie H: He+: He: Li: physikalisch relevant: R2 Kernladung Iv 1313 kJ mol-1 5250 kJ mol-1 2372 kJ mol-1 520 kJ mol-1 R2 gibt die relative ElektronendichteVerteilung als Funktion des Abstandes r vom Kern an. Diese ist für s Orbitale am Kernort maximal für alle anderen Orbitale (p,d, f,..) ist R2 = 0. Z +1 +2 +2 +3 Warum sind die Ionisierungsenergien für He und Li so „niedrig“? R2/ e pm3 n = 2, l = 0 2s R2/ n = 2, l = 1 2p e pm3 Die Elektron-Elektron-Wechselwirkung in Mehrelektronensystemen wirkt sich wie eine Abschirmung der Kernladung aus. r/pm 2s “durchdringt” besser den Rumpf, es „spürt“ die Kernladung Z stärker und wird weniger abgeschirmt: E2s < E2p[*] [*]: Für Li ist r2s > r2p aber dennoch E2s < E2p r/pm Mehrelektronensysteme Bis zur Konfiguration 1s2, 2s2, 2p6, 3s2, 3p6 (Ar, Z = 18) dominiert n die Energie der Orbitale. Ab dem Element K (Z = 19) macht sich der Einfluss von l bemerkbar und das 4s wird vor dem 3d Orbital besetzt: Die Elektronenkonfiguration von K ist (Ar)4s1 Begründung: 4s durchdringt den Rumpf gut, daher ist der Einfluss der Kernladung hoch, E4s < E3d. Ist 4s jedoch vollbesetzt (Ca, Z = 20), so wird beim nächsten Element Sc, Z =21, das 3d-Orbital schlechter als 4p abgeschirmt (r4s > r3d), die Energie von 3d sinkt und Sc hat die Valenzelektronenkonfiguration: [Ar]4s2, 3d1 Mit dem Element Sc 1 beginnt die erste Übergangsmetallreihe, in der sukzessive das 3d Orbital besetzt wird: Sc 4s2 3d1 / Ti 4s2 3d2 / V 4s2 3d3 / Cr 4s1 3d5 /Mn 4s2 3d5 / Fe 4s2 3d6 Co 4s2 3d7 / Ni 4s2 3d8 /Cu 4s1 3d10 / Zn 4s2 3d10 /. Mehrelektronensysteme Für H sind die Energien der s, p und d-Orbitale für jedes n entartet. Für alle anderen Atome sind die Energien dieser Orbitale nicht entartet. Sie werden jedoch mit zunehmendem Z immer ähnlicher. l=0 n=1 2 1. Übergangsmetallreihe: 3d - 4p 2. Übergangsmetallreihe: 4d – 5p 3 3. Übergangsmetallreihe: 5d – 6p Lanthanoiden: 4f – 5d 4 Actinoiden: 5f – 6d 5 6 7 8 11 1 2 3 4 Mehrelektronensysteme: Slater-Regeln Orbitalenergie: 2π2 m Z2 e4 En= − n h2 12 Effektive Kernladungszahl: Zeff = Z − S Abschirmungskonstante S für ein ns oder np Elektron Elektronen mit höherer Ouantenzahl tragen zu S nicht bei: nS > n : S = 0 Abschirmungskonstante Elektronen mit gleicher n schirmen Z nur schwach ab (35%) : nS = n : S = 0.35 Elektronen auf einer niedrigeren Schale mit n-1 schirmen Z um 85% ab: nS = n - 1: S = 0.85 kernnahe Elektronen schirmen Z ganz ab: nS < n - 1: S = 1.0 Kern Z nS: Hauptquantenzahl des e, das zu S beiträgt. n: Hauptquantenzahl des e für das S berechnet wird. Berechnung von Zeff für Mehrelektronensysteme nach den Slater-Regeln Berechnung der Abschirmungskonstante für ein s oder p (Valenz)elektron: S = 0.35Σe(nS=n) + 0.85Σe(nS=n-1) + 1.0Σe(nS<n-1) Beispiel: S für ein s,p-Valenzelektron in einem S-Atom: Konfiguration: (1s2), (2s2, 2p6), (3s2, 3p4) S = (2×1.0) + (8×0.85) + (5×0.35) = 10.55; Zeff = 16 − 10.55 = 5.45 Für d-Valenzelektronen gilt eine modifizierte Regel: Wird die Elektronenkonfiguration nach steigender Haupt-, n, und Nebenquantenzahl, l, wie: (1s), (2s, 2p), (3s, 3p), (3d), (4s, 4p), (4d), (4f) (5s, 5p),…. geordnet, so schirmen alle Elektronen in den Klammerausdrücken links von einem d oder f Elektron die Kernladung Z um den Betrag 1.0 ab. d oder f Elektronen im gleichen Klammerausdruck mit gleicher n schirmen Z um den Betrag 0.35 ab. Beispiel: S für ein 3d-Valenzelektron in einem Mn-Atom: Konfiguration: (1s2), (2s2, 2p6), (3s2, 3p6), (3d5), (4s2) S = (18×1.0) + (4×0.35) = 19.4; Zeff = 25 − 19.4 = 5.6 Beachte: d und f Elektronen werden durch Elektronen in der unmittelbar darunter liegenden „Schale“ wirkungsvoller abgeschirmt als s oder p Elektronen. (Aber: d-Elektronen schirmen nach dieser Regel genauso effektiv ab wie s,p-Elektronen. Das ist nicht richtig und wird in modernen Versionen berücksichtigt). Effektive Kernladungszahlen Zeff nach den Slater-Regeln 14 Trends: Zeff nimmt innerhalb einer Periode von links nach rechts stark zu (∆Zeff = +3.25). Dabei ändert sich Zeff regelmässig um 0.65. Zeff nimmt (schwächer) innerhalb einer Gruppe von oben nach unten zu (∆Zeff = 2.4). Die Zunahme erfolgt sprunghaft: Von den Elementen der 2. zur 3. Periode um 0.9, von den Elementen der 3. zur 4. Periode um 1.5. Danach bleibt Zeff für Elemente der 4. – 6. Periode innerhalb jeder Gruppe konstant. Ionisierungsenergien A(g) → A+(g) + e− Trends: Innerhalb einer Periode nimmt Iv zu. Begründung: Iv ~ Zeff. Innerhalb einer Gruppe nimmt Iv ab obwohl Zeff zunimmt. Begründung : Gegenläufiger Effekt von Iv ~ Zeff und Iv ~ 1/n . „Anomalien“: Iv(B) << Iv(Be), Iv(O) << Iv(N) Iv(Al) < Iv(Mg), Iv(S) < Iv(P) 1. atomare Ionisierungsenergie, Iv, (kJ mol−1) 15 der Elemente aus Gruppe 13 – 18 Elektronenaffinität: A–(g) → A (g) + e− Elektronenaffinität (kJ Iv(A–) = EA Trends: Innerhalb einer Periode nimmt EA zu. Begründung: EA ~ Zeff. Die EA‘s weisen besonders viele „Anomalien“ auf: a) EA(N) < EA(O) b) EA(2.Periode) < EA(3. Periode) c) EA (Edelgase) sind negativ, d.h. der Zerfall der Edelgasanionen ist exotherm (-30 bis -40 kJ mol−1) mol−1) 16 der Elemente aus Gruppe 13 – 18 Kovalente Radien (Å) der p-Block-Elemente Die kovalenten Radien, rkov, der p-Blockelemente ändern sich regelmässig: Sie nehmen innerhalb einer Gruppe zu: rkov, ~ n, und nehmen innerhalb einer Periode von links nach rechts ab: rkov, ~ 1/Zeff. Die Radien von Kationen sind kleiner, die Radien von Anionen sind grösser als die Kovalenzradien der entsprechenden Atome (siehe Teil 7). 17 18 Spektroskopische Elektronegativität Definition nach Pauling: Vermögen eines Atoms in einem Molekül, die Elektronendichte an sich heranzuziehen. χspec = (m εp + n εs) / (m + n) εp, εs: gemittelte Ionisierungsenergien der s- bzw. p-Orbitale m,n: Anzahl der p- bzw. s-Elektronen Für die p-Block-Elemente berechnete Allen-Elektronegativitäten 14 Spektroskopische Elektronegativität Änderung von χspec innerhalb der Perioden Einbau der 3d (Sc-Zn) und 4d (Y-Cd) Übergangsmetalle Änderung von χspec innerhalb der Gruppen 3D-Periodensystem nach Allen 19 Valenz, Oxidationszahl, Koordinationszahl & Formalladung Zwei der wichtigsten Faktoren, die eine Abschätzung der Eigenschaften eines kovalent aufgebauten Moleküls erlauben, sind die: Valenzelektronenzahl = gesamte Anzahl von Valenzelektronen an einem Atom in einem Molekül (Oktett- und 18 Elektronenregel) und die Valenz = Anzahl von Elektronen, die ein Atom für Bindungen zu seinen Nachbaratomen verwendet. (N.V. Sidgwick, the Electronic Theory of Valency; The Clarendon Press, Oxford 1927) Zahl der ValenzValenz = elektronen in dem freien Atom Zahl der nicht-bindenden Elektronen des Atoms im Molekül 16 Valenz Die Bestimmung der Valenz eines Atoms in einem Molekül erfordert das Zeichnen einer vernünftigen Resonanzstruktur und kann nicht aus der Molekülformel abgeleitet werden. Die Valenz eines Atoms in einem Molekül kann die Anzahl der Valenzelektronen des freien Atoms (Gruppenvalenz) nicht übersteigen: Maximale Valenz eines Atoms in einem Molekül = Gruppenvalenz Ist die Valenz kleiner als die Gruppenvalenz, so sind nicht-bindende Elektronen am Atom in dem betrachteten Molekül vorhanden. Ist die Valenz scheinbar grösser als die Gruppenvalenz, so ist (i) das Molekül nicht korrekt formuliert worden; (ii) nicht alle Bindungen können als 2-Zentren-2-Elektronen (2z-2e) Bindungen beschrieben werden. H H •• N H H H Valenz = N: 5 – 2 = 3 H: 1 – 0 = 1 freies Elektronenpaar drei 2z-2e Bindungen C + H H H C: 4 – 0 = 4 ≠ 5 H: 1 – 0 = 1 kein freies Elektronenpaar 2z-2e Bindungen ? H H B B H H H H B: 3 – 0 = 3 ≠ 4 H: 1 – 0 = 1 ≠ 2 kein freies Elektronenpaar 2z-2e Bindungen ? 17 Formale Oxidationszahl Die formale Oxidationszahl eines Atoms in einem Molekül wird erhalten, wenn der Aufbau eines Moleküls als ionisch erachtet wird und alle Bindungen heterolytisch so gespalten werden, das die Liganden eine geschlossene Elektronenschale erhalten. Ausnahme: Homonukleare Bindungen werden homolytisch gespalten. Meistens ändert sich die Ladung, die einfachen einatomigen Liganden zugewiesen wird, nicht von einer Verbindung zu anderen. Ausnahme: H kann als H+ (1s0) oder H− (1s2) vorliegen. In diesem Fall werden die Ladungen entsprechend den Elektronegativitäten verteilt. Formale Oxidationszahl = Ladung des Moleküls Ladung auf den Liganden Valenzelektronen des/der Ladung des Valenzelektronen des/der − freien Ligandenatoms/gruppe = Liganden nach heterolytischem freien Ligandenatoms/gruppe Bindungsbruch Ladung = 1 − 2 = −1 Ligandenatom: A H Ligandengruppe: A •• O H •• Ladung = (7) − (8) = −1 18 Beispiele Valenz & formale Oxidationszahl Heteronukleare Bindungen = heterolytischer Bindungsbruch; Homonukleare Bindungen = homolytischer Bindungsbruch; O.Z. = Molekülladung - Ligandenladungen H −1 H −1 −1 Zentralatom Si H −1 H −1 Ligandenatom O −1 C HO Si H H H −1 O.Z.(Si) = 0 − (4 × −1) = +4 Valenz: Si = 4 Ligandenatom −1 H H Si H O.Z.(Si) = 0 − (3 × −1) = +3 Valenz: Si = 4 O.Z. ≠ Valenz −2 +1 Zentralatom Ladung des – Moleküls −2 O Ligandengruppe O.Z.(C) = −1 − [(2 × −2) + (−1)] = +4 Valenz: C = 4 +1 H C H F −1 F −1 O.Z.(C) = 0 − [(2 × −1) + (2 × 1)]= 0 Valenz: C = 4 19 O.Z. ≠ Valenz Valenz & formale Oxidationszahl •• Normalerweise wird die formale Oxidationszahl für das Zentralatom eines Moleküls berechnet. Sie kann jedoch prinzipiell für alle Atome in einem Molekül berechnet werden. Bei der Festlegung der Ligandenladungen müssen eventuell Formalladungen berücksichtigt werden. Beispiel Hydrogencarbonat, [HCO3]–: Oxidationszahl für =O: Valenzelektronen HO-C-O– vor heterolytischem Bindungsbruch: • •O [1 + (2×6) + 4 + (1)] = 18 Valenzelektronen HO-C-O– nach heterolytischem Bindungsbruch: – [1 + (2×6) + 2 + (1)] = 16 C H Ladung der HO-C-O– Gruppe: 18 – 16 = 2 O O.Z.(=O) = 0 – 2 = –2 O (! Ladung nicht doppelt zählen) Oxidationszahl für -O– : • •O Valenzelektronen HO-C=O vor heterolytischem Bindungsbruch: [1 + (2×6) + 4] = 17 – Valenzelektronen HO-C=O nach heterolytischem Bindungsbruch: H C [1 + (2×6) + 3] = 16 O O Ladung der HO-C-O– Gruppe: 17 – 16 = 1 O.Z.(=O) = –1 – 1 = –2 •• •• •• •• •• •• •• •• •• •• •• •• • •O +1 O – •• •• •• O C •• •• H Oxidationszahl für –O–H: Valenzelektronen O=C-O– vor heterolytischem Bindungsbruch: [(2×6) + 4 + (1)] = 17 Valenzelektronen O=C-O– nach heterolytischem Bindungsbruch: [(2×6) + 3 + (1)] = 16 Ladung der O=C-O– Gruppe: 17 – 16 = 1 O.Z.(O) = 0 − [1 + 1] = –2 Valenz & formale Oxidationszahl O −2 +1 H −2 P O O −2 −1 H O – +3 H H Gruppenladung OH = −1 O.Z.(P) = −1 − [(2 × −2) + (2 × −1)]= +5 Valenz = 5 Si H −1 H −1 H Si Si H H Si H Si H H H H Gruppenladung SiH3 = 0 O.Z.(Si(SiH3)4) = 0 − (4 × 0) = 0 Valenz = 4 O.Z. (Si(SiH3)4) = +3 21 Valenz = 4 Valenz & formale Oxidationszahl Es gibt keine systematische Übereinstimmung von Valenz und Oxidationszahl (q+ , q−) Valenz ≠ formaler Oxidationszahl, wenn: (i) Es liegen homonukleare Bindungen vor. (ii) Die Liganden am betreffenden Atom sind entgegengesetzt geladen (z.B. H+, Cl−). (iii) Das Molekül ist geladen und ein Ligand dissoziiert als Kation (z. B. H+): Beispiel: In [NH4]+ ist Stickstoff pentavalent (Valenz = 5) aber die Oxidationszahl ist −3. H +1 + −3 N +1 H H +1 H +1 Die Übereinstimmung von Valenz und Oxidationszahl (+ oder −) gilt nur für einfache neutrale Elementwasserstoffverbindungen, AHn, und ist zufällig! 22 Anzahl von (geteilten = kovalenten) 2Z-2e-Bindungen & Koordinationszahl Für einfache neutrale Elementwasserstoffverbindungen AHn ist die Anzahl der 2Z-2e-Bindungen gleich der Koordinationszahl und gleich der Valenz. Diese Übereinstimmung ist ebenfalls zufällig und gilt nicht wenn das betreffende Atom, A, eine Formalladung trägt. Zahl der Elektronen auf dem Atom A im Molekül nach homolytischem Bruch aller Bindungen Zahl der Valenzelektronen Fomalladung = in dem freien Atom A H H − B H H H Valenz: 3 2Z-2e: 4 H + C H H H Valenz: 4 2Z-2e: 4 N H H H Valenz: 5 2Z-2e: 4 23 Fragmentierungsmethode zur Zuweisung von formalen Oxidationszahlen (überschätzt den ionichen Charakter von Bindungen) heterolytisch A A ••q– + X Die Liganden erhalten eine geschlossene Elektronenschale; X = Cl, CH3; q = 1 heterolytisch dative Bindungen A (Lewis-Säure-Basenpaar) homonukleare kovalente Bindungen X q+ Aq=0 + Xq=0 X •• heteronukleare kovalente (polare) Bindungen Die Liganden erhalten eine geschlossene Elektronenschale; Die Ladung ändert sich nicht. homolytisch X A• X + A• Fragmentierungsmethode zur Zuweisung von Formalladungen (überschätzt den kovalenten Charakter von Bindungen) homolytisch A X A• + X• 28 Koordinationszahl &Valenz Die Koordinationszahl ist gleich der Zahl benachbarter Atome, die an das betrachtete Atom im Molekül gebunden sind. Koordinationszahl und Valenz stimmen nicht überein: wenn: (i) Das betrachtete Atom eine Mehrfachbindung eingeht. CH3 H 3C H 2C CH2 HC K.Z.: 3 Valenz : 4 K.Z.: 4 Valenz: 4 CH K.Z.: 2 Valenz : 4 (ii) Das betrachtete Atom über eine dative Bindung an ein Nachbaratom/gruppe gebunden ist. K.Z.: 4 Valenz: 3 H B H + •• H H N B H H K.Z.: 3 Valenz: 3 H K.Z.: 3 Valenz: 3 H H H H N H K.Z.: 4 Valenz: 5 In einer dativen Bindung liefert ein Bindungspartner beide Bindungselektronen. Dadurch wird an einem Atom die Valenz erhöht an dem anderen nicht. An beiden Atomen erhöht 29 sich die Koordinationszahl um +1. Molekül Valenzelektronen Nichtbindende im freien Atom Elektronen Valenz formale 2Z-2e Oxidationszahl Bindungen K.Z. Beispiele wo Valenz = Oxidationszahl = Anzahl von 2Z-2e-Bindungen = Koordinationszahl BH3 3 0 3 +3 3 3 CH4 4 0 4 −4 4 4 NH3 5 2 3 −3 3 3 H2O 6 4 2 −2 2 2 HF 7 6 1 −1 1 1 Beispiele wo Valenz ≠ Oxidationszahl H3Si-SiH3 4 0 4 −3 4 4 CH2Cl2 4 0 4 0 4 4 [H3O]+ 6 2 4 −2 3 3 Beispiele wo Valenz ≠ Anzahl von 2Z-2e-Bindungen [BH4]− 3 0 3 +3 4 4 [NH4]+ 5 0 5 −3 4 4 Beispiele wo Valenz ≠ K.Z. H2C=CH2 4 0 4 −2 4 3 HC≡CH 4 0 4 −1 4 2 H3N-BH3 3 0 3 +3 4 4 30 Ein kompliziertes Beispiel… + – Na N B −1 H N N H H N B −1 +3 N N N GaCl – NaCl B: Oxidationszahl: +3 Valenz: 3 Koordinationszahl: 4 Formalladung: -1 N B −1 N N +1 N N +1 +1 N GaI3 N +1 N Bindungsbrüche zur Bestimmung der formalen Oxidationszahl: Heteronukleare (polare) Bindungen: heterolytisch Dative Bindungen (): heterolytisch Homonukleare Bindungen: homolytisch Bindungsbrüche zur Bestimmung der Formalladung: Alle Bindungen: homolytisch +1 N N +1 Ga1−1 +1 I Ga2 −1 +3 I I Ga −2 •• +1 Ga: Oxidationszahl: +1 Valenz: 1 Koordinationszahl: 3 Formalladung: -2 N Ga1 : Oxidationszahl: +1 Valenz: 3 Koordinationszahl: 4 Formalladung: -1 Ga2 : Oxidationszahl: +3 Valenz: 3 Koordinationszahl: 4 Formalladung: -1 31 Oxidationszahlen in Übergangsmetallkomplexen Bei Übergangsmetallkomplexen unterscheidet man die formale Oxidationszahl von der spektroskopischen Oxidationszahl. Die formale Oxidationszahl wird wie zuvor durch heterolytische Spaltung aller Liganden erhalten. d-Valenzelektronenkonfiguration des Metalls im Komplex i PrO Ti i PrO OiPr Ti4+, 4 OiPr− d0 Ti ist tetravalent Fe0, 5 CO d8 Fe ist zerovalent OiPr O C OC Fe C O CO CO 32 Oxidationszahlen in Übergangsmetallkomplexen Es gibt Fälle, in denen die formale Oxidationszahl nicht der d-Valenzelektronenkonfiguration dn entspricht, z.B. wenn Radikale X• an das Metall koordinieren. dn kann durch spektroskopische Methoden bestimmt werden. Es ist daher sinnvoll, Metallatome in Übergangsmetallkomplexen durch eine spektroskopische Oxidationszahl zu charakterisieren. Diese hat physikalische Bedeutung. Periodensystem Spektroskopie Valenzelektronenn des Metallatoms spektroskopische d = zahl des freien − Oxidationszahl im Komplex Metallatoms 29 Oxidationszahlen in Übergangsmetallkomplexen 33 Beispiele: spektroskopische Oxidationszahl formale Oxidationszahl Ti (OiPr)4 O O O II Pd O Ti4+, d0 = Ti4+, d0 Pd2+, d8 = Pd2+, d8 [Pd(acac)2] bessere Darstellung der elektronischen Struktur O N N O N V Fe N Fe5+, d3 ≠ Fe4+, d4 N IV Fe N +• N S R OTyr NHis H2O S Cytochrom P450 R + N Cu III N OTyr His OTyr-Cys Galaktose Oxidase Cu3+, d8 ≠ Cu2+, d9 NHis H 2O + N His Cu II OTyr-Cys • 34 Oxidationszahl & Formalladung & physikalisch relevante Ladung Keine Oxidationszahl oder Formalladung gibt die tatsächliche Ladung auf einem Atom in einem Molekül an. In Hauptgruppenelementen weicht diese selten von ±1 ab! Molekül Oxidationszahl Berechnete Ladung Formalladung CH4 −4 −0.82 0 [CH3]+ −2 0.35 +1 NH3 −3 −1.05 0 [NH4]+ −3 −0.84 +1 35 Der Nutzen von Valenz & Oxidationszahl Die formale Oxidationszahl ist das Resultat eines Formalismus und erlaubt keine allgemein gültigen Aussagen über die Reaktivität oder Stabilität einer Verbindung. Sie ist wichtig für das Aufstellen von Redoxgleichungen. Die Valenz eines Atoms in einem Molekül gibt an wie viele Elektronen dieses Atom für Bindungen verwendet hat. Mit dem Konzept der Valenz kann untersucht werden, ob (i) ein Atom genügend Elektronen hat, um die Ligandenatome in unmittelbarer Nachbarschaft über 2Z-2e-Bindungen zu koordinieren. (ii) ein Atom überschüssige Elektronen für weitere Bindungen zur Verfügung stellen kann. Beispiel: Die Annahme, dass C in CH5+ eine Formalladung von +1 trägt und alle CH Bindungen 2Z-2e Bindungen sind, ergibt die Valenz 6 für Kohlenstoff. Wird angenommen, dass eine CHBindung protoniert wird und CH5+ ein Komplex aus CH3+ und H2 ist, so wird eine vernünftige Valenz von 4 erreicht. H + C H H H H Oxidationszahl -4 Valenz: 6 (! unmöglich !) H H H + C H H Oxidationszahl -2 Valenz: 4 32 Zusammenfassung Valenz = Zahl der zur Bindung verwendeten Elektronen eines Atoms in einem Molekül Es ist sinnvoll Hauptgruppenelementverbindungen durch die Valenzen der Atome im Molekül zu beschreiben: Zahl der ValenzValenz = elektronen in dem freien Atom Zahl der nicht-bindenden Elektronen des Atoms im Molekül Übergangsmetallverbindungen werden meist durch die spektroskopische Oxidationszahl charakterisiert. Diese ist gleich der Valenz des Metallzentrums im Komplex. spektroskopische Valenzelektronen- n Oxidationszahl = zahl des freien − d des Metallatoms im Komplex (Valenz) Metallatoms 33