Lehrstuhl für Physikalische Chemie
Werbung

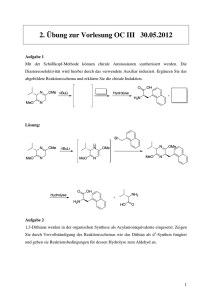
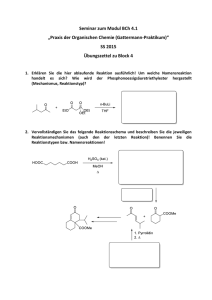
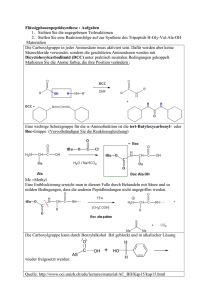
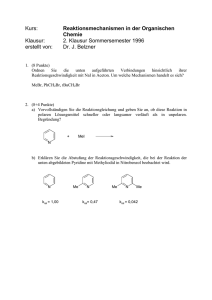
Universität Regensburg SS2009 Institut für Physikalische und Theoretische Chemie (IPTC) Prof. B. Dick Klausur Physikalische Chemie V, Teil: Kinetik für Studierende der Chemie 21.7.2009, 10:00-12:00 1.Aufgabe: (15 Punkte) Bei Reaktionstemperaturen zwischen 800 K und 1200 K zerfällt Essigsäure gemäß folgendem Reaktionsschema: k1 A: CH3COOH B: CH3COOH k2 CH4 + CO2 CH2CO + H2O Beide Teilreaktionen A und B sind Reaktionen erster Ordnung, wobei Geschwindigkeitskonstanten bei 1189 K jeweils kA = 3,74 s-1 und kB = 4,65 s-1 betragen. die a) Stellen Sie die differentiellen Zeitgesetze für die beiden Teilreaktionen auf und leiten Sie einen Ausdruck für die Halbwertszeiten der Teilreaktionen t1A/ 2 und t1B/ 2 her. b) Berechnen Sie die Halbwertszeit der Essigsäure unter Annahme, dass die Halbwertszeit der Gesamtreaktion t1/ 2 mit den Halbwertszeiten der Teilreaktionen wie folgt zusammenhängt: 1 1 1 = A + B t1 / 2 t1 / 2 t1 / 2 c) Bestimmen Sie die Zeit nach der bereits 99 % der Essigsäure zerfallen ist, unter Annahme, dass die Geschwindigkeitskonstante der Gesamtreaktion k=kA+kB. d) Skizzieren Sie die zum obigen Reaktionsschema dazugehörigen Konzentrationsprofile des Edukts und der Produkte in Abhängigkeit von der Zeit. 2. Aufgabe: (25 Punkte) Chymotrypsin ist ein Verdauungsenzym, welches die Spaltung des Substrat-Analogons Acetyl-L-Tryptophanamid (ATA) im menschlichen Körper katalysiert. In einem Versuch soll die Verträglichkeit dieser Enymreaktion mit der Michaelis-Menten-Theorie überprüft werden. -1- Dazu wird die von 1 µg Chymotrypsin (MW = 27,8 kDa) hydrolysierte Menge an ATA pro Minute in Abhängigkeit von der Substratkonzentration in einem Reaktionsansatz von 1ml gemessen. a) Geben Sie ein typisches Reaktionsschema für eine Reaktion, die der MichaelisMenten-Kinetik gehorcht, an und formulieren Sie die dazugehörigen differentiellen Zeitgesetze für alle Reaktionsteilnehmer. Erläutern Sie, welche Näherung zur Lösung des Gleichungssystems notwendig ist und unter welchen Bedingungen sie verwendet werden kann. b) Leiten Sie mit Hilfe der Zeitgesetze aus Teilaufgabe 2a) einen Ausdruck für die Konzentration des Zwischenproduktes und die Produktbildungsgeschwindigkeit her. c) Skizzieren Sie die zum Reaktionsschema aus Teilaufgabe 2a) dazugehörigen Konzentrationsprofile des Substrats, Enzym-Substrat-Komplexes und des Produktes in Abhängigkeit von der Zeit. Erklären Sie, anhand der Auftragung, wieso die Näherung aus 2a) in diesem Falle verwendet werden kann. d) Prüfen Sie anhand einer geeigneten Auftragung, ob obige Enzymreaktion der Michaelis-Menten-Kinetik gehorcht. Verwenden Sie hierzu folgenden Messwerte: Konzentration ATA Produktbildungsgeschwindigkeit [μM] [nmol/(min ml)] 2 62,0 5 108,0 7,5 129,6 10 144,0 30 185,1 50 196,4 100 205.2 e) Wenn dies der Fall ist, bestimmen Sie für diese Enzymreaktion aus der Auftragung die Michaelis-Konstante und den Maximal-Wert der Produktbildungsgeschwindigkeit, sowie die Wechselzahl des Enzyms. Gehen Sie hierbei davon aus, dass das Enzym nur ein aktives Zentrum besitzt. 3. Aufgabe: (10 Punkte) Die van’t Hoff’sche RGT Regel besagt, dass eine Erhöhung der Reaktionstemperatur um 10°C bei vielen Reaktionen meist eine Verdoppelung bis Vervierfachung der Reaktionsgeschwindigkeit bei sonst gleichbleibenden Bedingungen zur Folge hat. Berechnen Sie die Aktivierungsenergie einer Reaktion, die der RGT-Regel gehorcht und daher bei einem Sprung der Temperatur von 25°C auf 35°C a) eine Verdopplung bzw. b) eine Vervierfachung der Reaktionsgeschwindigkeit erfährt. Konstanten: Gaskonstante R=8.31441 J K-1 mol-1 , 1 Da = 1.66054 10-27 kg Hinweis: 1. Wiederholungsklausur PCV, 5.10.2009, 10:00-12:00, H44 -2-