Atome - Moleküle - Formeln - Hausdorf-im-web
Werbung

Chemie 8H
Name: ___________________________
Thema: Atome - Moleküle - Formeln
Klasse: _______
Datum: ___________
Alle Stoffe bestehen aus _______________
Schon die griechischen Philosophen Leukipp und Demokrit (ca. 450 v Chr.) glaubten, dass Materie aus kleinen
Teilchen besteht. Sie nannten diese Teilchen "atomos": Unteilbare. Heute wissen wir zwar, dass Atome keineswegs
unteilbar sind. Gleichwohl damals von den Griechen entworfene Bild nicht völlig falsch: Tatsächlich hängen die
Eigenschaften der Materie von den Eigenschaften der Atome, aus denen sie besteht, ab.
Nach diesem Modell bestehen die Stoffe aus sehr kleinen, kugelförmigen Teilchen. Diese
kleinsten Teilchen der Stoffe nennt man ___________.
Wir können uns die Größe, oder besser die Winzigkeit, der Atome kaum vorstellen. Würde man die Eisenatome, die
in einem Stecknadelkopf enthalten sind, wie bei einer Perlenkette dicht nebeneinander aufreihen, und säßen auf
jedem Millimeter 5 Millionen Eisenatome, diese Kette würde dann 50 mal von der Erde bis zum Mond reichen!
Das Kugelteilchenmodell für Atome verwendete bereits 1809 der englische Naturwissenschaftler J. DALTON, um
damit den Aufbau von Elementen und Verbindungen zu erklären. Er nahm an, dass Elemente nur aus einer Art von
Atomen bestehen.
Elemente sind Stoffe, die ______________________________________________
Unsere gesamte stoffliche Welt besteht aus nicht mehr als 92 Atomsorten, die man Elemente nennt. Sie sind im
'Periodensystem der Elemente' zusammengefasst.
Nach diesem Modell gibt es also 92 Atomsorten verschiedener Größe und Masse. Zum Beispiel ist der
Durchmesser eines Kupferatoms 1,2mal so groß wie der eines Schwefelatoms. Die Masse des Kupferatoms ist
etwa 2mal so groß wie die des Schwefelatoms.
Die Atome der verschiedenen Elemente unterscheiden sich
______________________________________________________________
Eine Verbindung, kann bei einer chemischen Reaktion aus Elementen entstehen. Da ein Element aus einer Art
von Atomen besteht, müssen in einer Verbindung verschiedene Atomarten miteinander verbunden sein.
Verbindungen sind Stoffe, die ____________________________________
______________________________________________________________
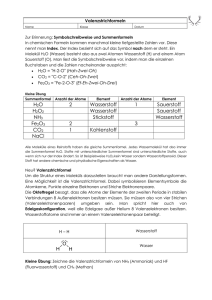
Atome verbinden sich zu Molekülen: Zeichne folgende Kugelmodelle:
Sauerstoffmolekül
Kohlenstoffdioxidmolekül
___________________________________________________________________________
SAB_CH08_Atome01.doc
www.hausdorf-im-web.de Feb. 2004
Seite 1
Die Atome der Elemente haben verschiedene Massen
Element
gls / Symbol
Masse
in u
Wo begegnet uns dieses Element
im Alltag?
Wasserstoff
Kohlenstoff
Stickstoff
Sauerstoff
Natrium
Magnesium
Aluminium
Phosphor
Schwefel
Chlor
Eisen
Kupfer
Silber
Gold
Blei
Uran
gls = gasförmig / flüssig / fest
___________________________________________________________________________
SAB_CH08_Atome01.doc
www.hausdorf-im-web.de Feb. 2004
Seite 2
Die Atome der Elemente haben verschiedene Massen
Element
Symbol
in u
Masse
in u
Element
Symbol
Masse
Wasserstoff H
1
Schwefel
S
32
Kohlenstoff C
12
Chlor
Cl
35
Stickstoff
N
14
Eisen
Fe
56
Sauerstoff
0
16
Kupfer
Cu
64
Natrium
Na
23
Silber
Ag
108
Magnesium Mg
24
Gold
Au
197
Aluminium
AI
27
Blei
Pb
207
Phospor
P
31
Uran
U
238
Für die Masse eines Wasserstoffatoms wird hier vereinfacht die Atommasseneinheit 1 u
eingesetzt . Die Zahlen geben dann an, wieviel mal größer die Atommassen anderer Elemente
im Vergleich zu Wasserstoffatomen sind.
Zusatzinformationen:
Schon die alten griechischen Philosophen Leukipp und Demokrit glaubten, dass Materie aus
kleinen Teilchen besteht. Sie nannten diese Teilchen "atomos", Unteilbare. Heute wissen wir
zwar, dass Atome keineswegs unteilbar sind. Gleichwohl ist das von Leukipp und Demokrit
entworfene Bild nicht völlig falsch: Tatsächlich hängen die Eigenschaften der Materie von den
Eigenschaften der Atome, aus denen sie besteht, ab.
Der griechische Philosoph Leukipp (um 450-370 v. Chr.) und sein Schüler Demokrit (460-371 v.
Chr.) waren die ersten, die sich die Materie aus unteilbaren Grundbausteinen (griechisch:
atomos) aufgebaut vorstellten. Diese Atome sollten ihrer Vorstellung nach bereits die
Eigenschaften der aus ihnen aufgebauten Materie aufweisen. Welche dieser Ideen von Leukipp
und welche von Demokrit stammen, lässt sich heute nicht mehr feststellen, da Leukipp im
Gegensatz zu Demokrit keinerlei Schriften hinterließ.
Erste experimentelle Hinweise darauf, dass die Materie tatsächlich aus kleinen Bausteinen
aufgebaut ist, fanden sich erst Anfang des 19. Jahrhunderts. Damals stießen Chemiker wie
Joseph Louis Proust (1755-1826) und John Dalton (1766-1844) darauf, dass sich die
chemischen Elemente nur in bestimmten ganzzahligen Verhältnissen miteinander zu Molekülen
verbinden. John Dalton erklärte dieses Phänomen 1808 damit, dass die Elemente aus nicht
mehr teilbaren, kleinsten Einheiten bestehen und griff für diese Teile den alten griechischen
Begriff des Atoms wieder auf.
___________________________________________________________________________
SAB_CH08_Atome01.doc
www.hausdorf-im-web.de Feb. 2004
Seite 3
Dass Atome jedoch keineswegs unteilbar sind, bewies 1897 der britische Physiker Joseph J.
Thomson (1856-1940). In seinen Experimenten mit einer Glühkathode konnte er zeigen, dass
sich aus den Atomen kleinere, elektrisch geladene Teilchen herausschlagen lassen - die
Elektronen. Thomson stellte sich Atome als winzige, elastische Kügelchen vor, in denen Masse
und positive elektrische Ladung gleichmäßig verteilt sind. Eingebettet in diese Masse sind, wie
Rosinen in einem Kuchenteig, die punktförmigen, elektrisch negativen Elektronen.
Alle Materie des Universums, auf der Erde oder in den Sternen, in Lebewesen oder Gestein,
ist zusammengesetzt aus fundamentalen Bausteinen, den Molekülen und Atomen.
Jeder Wassertropfen z.B. besteht aus einer unvorstellbar großen Zahl von 'Wassermolekülen'
(ungefähr 30 Quadrillionen, bzw. in mathematischer Darstellung 3*1019), von denen jedes
wiederum aus zwei Atomen 'Wasserstoff (H)' und einem Atom 'Sauerstoff (O)', abgekürzt H2O,
gebildet wird.
Unsere gesamte stoffliche Welt besteht aus nicht mehr als 92 Atomsorten, die man 'Elemente'
nennt. Sie sind im 'Periodensystem der Elemente' zusammengefasst, einem unentbehrlichen
Werkzeug für alle Physiker und Chemiker.
Wie man die ganze materielle Welt auf diese 92 Bausteine zurückgeführt und, vor allem,
wie man die Existenz der Atome und Moleküle bewiesen und ihre Eigenschaften festgestellt hat,
ist eines der spannendsten Kapitel in der Geschichte der Wissenschaft und der Entwicklung des
menschlichen Geistes. Es umfasst Erkenntnisse, die nicht nur unser physikalisches Weltbild
bestimmt und unsere Vorstellung vom Universum revolutioniert haben, sondern auch die ganze
Fülle der modernen Technik - einschließlich ihrer dunklen Seiten - erst ermöglichten.
Erst gegen Ende des 18. Jahrhunderts, als die Naturforscher begannen, verschiedene Stoffe
wie z.B. Wasser systematisch zu zerlegen und wieder zusammenzusetzen, wurde Demokrits
Vorstellung von den Atomen wiederbelebt -und diesmal endgültig. Dalton entdeckte das Gesetz
der 'konstanten Proportionen': synthetisiert man einen Stoff aus zwei oder mehreren
unterschiedlichen Bestandteilen, so weisen diese stets das gleiche Massen- und
Volumenverhältnis auf. Um z.B. 18 Gramm Wasser aus den 'Elementen' Wasserstoff und
Sauerstoff herzustellen, braucht man zwei Volumenteile Wasserstoff auf ein Volumenteil
Sauerstoff bzw. exakt zwei Gramm Wasserstoff und sechzehn Gramm Sauerstoff;
überschüssige Mengen eines der beiden Elemente werden nicht synthetisiert. Diese in vielen
analogen Experimenten bestätigte Befunde konnte man ohne künstliche Annahmen nur so
erklären: es gibt gewisse Grundstoffe ('Elemente' wie Wasserstoff, Sauerstoff...), deren kleinste
Einheiten ('Atome') Massen haben, die ein ganzzahliges Vielfache der Masse des leichtesten
Atoms, des Wasserstoffatoms, sind. Diese 'Atome' verbinden sich miteinander in ganzzahligen
Verhältnissen zu 'Molekülen'. Für die Atommasse eines Elements, bezogen auf die Masse des
Wasserstoffatoms, hat man später den etwas ungenauen Begriff 'Atomgewicht' eingeführt.
___________________________________________________________________________
SAB_CH08_Atome01.doc
www.hausdorf-im-web.de Feb. 2004
Seite 4