Übungsaufgaben zum Themenkomplex „Atombau“ und „PSE“
Werbung

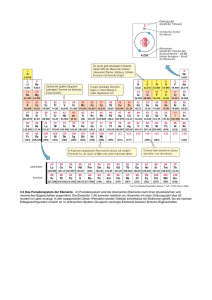
Übungsaufgaben zum Themenkomplex „Atombau“ und „PSE“ 1) Der sehr dichte und kleine Atomkern besteht aus Protonen und Neutronen, die Atomhülle aus Elektronen. Aufgrund Ihres Wissens über die Anziehung und Abstoßung geladener Teilchen: Welche zwei Paradoxa treten auf ? Wie können diese aufgelöst werden ? LÖSUNG: 1) die auf den Atomkern konzentrierten positiven Ladungen sollten sich elektrostatisch abstoßen => Austausch von π-Mesonen als sehr starke attraktive Kraft. 2) Die negativ geladenen Elektronen sollten in den positiven Kern stürzen („UVKatastrophe“) => Bohr: Einführen von stabilen Bahnen, Quantenmechanik: Wellennatur des Elektrons. 2) Das griechische Wort für Bernstein ist Elektron (Ελεκτρον). Warum wurde ein Elementarteilchen nach diesem fossilen Harz benannt ? LÖSUNG: Beim Reiben des Bernsteins an einem Tuch fließen negative Ladungsträger (=Elektronen) auf den Bernstein über (Reibungselektrizität). Dieser zieht darauf hin beispielsweise Samenkügelchen an. 3) Welche(s) der drei Elementarteilchen, die Atome aufbauen, beeinflussen die folgenden Eigenschaften eines Atoms • Die Natur des Atoms (also, ob ein Atom z.B. Eisen oder Fluor ist) Protonen • Die Masse des Atoms Protonen+Neutronen(+Elektronen) • Die nach außen wirkende elektrische Ladung des Atoms Protonen-Elektronen • ob es radioaktiv ist oder nicht Verhältnis Protonen/Neutronen 4) In nachfolgender Abbildung ist das rutherfordsche Experiment schematisch zusammengefasst. Welcher der gestreuten α-Strahlen a-e ist am aussagekräftigsteten bezüglich des Aufbaus der Atome ? c: Das Atom ist großteils leer, so dass die meisten α-Teilchen ungehindert passieren können, a und e: Die starke Reflexion der positiven Teilchen deutet darauf hin, dass der Atomkern positiv ist und die positive Ladung auf einen engen Raum konzentriert ist. 5) Betrachten Sie das Element 22086Rn. Welche der folgenden Aussagen sind korrekt ? • Das Teilchen hat 86 Protonen. • Die Massezahl des Teilchens ist 86. ja nein • Die Ordnungszahl des Teilchens • Das Teilchen besitzt 220 Neutronen. ist 220. nein nein besitzt 220 Nukleonen. • Das Teilchen hat 86 Neutronen. • Es nein ja • Das Teilchen hat 86 Elektronen. • Das Teilchen hat 134 Neutronen. ja ja 6) Als Mendelejev sein Periodensystem entwickelte, waren viele Elemente, unter ihnen Germanium, noch unbekannt. Er erkannte jedoch, daß unterhalb des Siliciums ein „Loch“ war, sagte voraus, daß das „Eka-Silicium“ schließlich entdeckt werden würde und ging sogar so weit, daß er aufgrund der Eigenschaften der Elemente überhalb und unterhalb dieses „Lochs“ die Eigenschaften des Eka-Siliciums vorhersagte. Füllen Sie die Tabelle aus, indem Sie die Eigenschaften des Siliciums und Zinns in die Tabelle eintragen, bilden Sie die Mittelwerte und vergleichen Sie mit den physikalischen Eigenschaften des Germaniums (Die Werte können Sie aus einem Periodensystem oder einem Lehrbuch entnehmen). Silicium Zinn Mittelwert von Si und Germanium Si Sn Sn (“Eka-Sililcium“) Ge atomare Masse [g/mol] 28.0855 118.69 73.38 72.59 Dichte [g/cm³] 2.328 7.285 4.807 5.329 spezifische 10-6 9.1x104 0.45x10-3 2x10-2 Leitfähigkeit [Scm-1] Schmelzpunkt [°C] 1410 231.91 820 947.4 Siedepunkt [°C] 2477 2687 2582 2830 7) Die folgende Tabelle enthält die relativen Atommassen einiger Elemente, wie sie im Periodensystem zu finden sind. Element relative Atommasse Kohlenstoff 12.011 Wasserstoff 1.008 Chlor 35.453 Beryllium 9.01218 Fluor 18.998403 Arsen 74.9216 a) Erklären Sie, warum die Atommasse von Kohlenstoff in dieser Tabelle nicht exakt bei 12.000 liegt ! Isotopengemisch: Einfluß von 13C (ca. 1.1 %) und zu einem verschwindend geringen Anteil 14C. b) Wasserstoff existiert in den Isotopen 1H (99.9855 %), 2H=D (0.0145 %) und 3 H=T (10-5 %). Welche relative Atommasse sollte Wasserstoff demnach besitzen, wenn Sie pro Nukleon eine Masse von 1.0087 u annehmen ? Vergleichen Sie mit dem Tabellenwert. Woraus resultiert die Abweichung ? rel. Atommasse Literatur: 1.0079; nach Rechnung: 1.0088; Abweichung: Massendefekt. c) Chlor findet sich in der Natur als Isotopengemisch 35Cl/37Cl. Schätzen Sie anhand der Atommasse des Chlors das Verhältnis der beiden Isotope ab und vergleichen Sie mit dem Literaturwert. Abschätzung mit Atommasse von ca. 35.5: 35-Cl zu 37-Cl etwa 3:1. Tatsächlich: 75.77 % 35-Cl, 24.23 % 37-Cl. d) Sie sehen die Atommassen von Beryllium, Fluor und Arsen aufgeführt. Hierbei handelt es sich um Reinelemente (nur ein Isotop in der Natur). Das Wasserstoffisotop 1H besitzt die Atommasse 1.00782519. Warum liegen die genauen Atommassen im Falle des 1H und 9Be etwas überhalb der gerundeten Massen von 1 bzw. 9, im Falle des 19F und 75As jedoch unterhalb ? Warum widersprechen die Werte dem Phänomen des Massendefekts nicht ? Grund: atomare Massen auf 12C bezogen. Elemente vor C daher trotz Massendefekt überhalb der ganzzahligen Werte, Elemente nach C unterhalb der ganzzahligen Werte, wie durch den Massendefekt erwartet. Kein Widerspruch zum Massendefekt, lediglich ein Resultat der Definition um 12C. 8) Als Chemiker sollte es eine Selbstverständlichkeit sein, das Periodensystem auswendig zu beherrschen. Versuchen Sie sich innerhalb einer halben Stunde das Periodensystem der Elemente weitestgehend einzuprägen. • Spielen Sie im unteren „Spielfeld“ anschließend „Rösselsprung“: Starten Sie bei Wasserstoff, springen Sie wie das Pferd beim Schachspiel von Element zu Element und füllen Sie das leere PSE aus. (Es wird nicht ernsthaft erwartet, dass die Studenten diese Aufgabe erfüllen) • • Um was handelt es sich bei den Elementen, die in der Treppe (staircase, weiße Felder) liegen ? Welche Elemente des PSE sind Metalle, welche sind Nichtmetalle ? staircase: Halbmetalle (metalloids), hellgrau: Metalle, dunkelgrau: Nichtmetalle • Welche Elemente sind bei Normalbedingungen flüssig ? Welche Element der Hauptgruppen sind zusätzlich an einem warmen Sommertag flüssig ? Quecksilber (Hg) und Brom (Br), außerdem bei leicht erhöhten Temperaturen Gallium (Ga) und Caesium (Cs). • Was ist das schwerste Element, das noch nicht nur in Form radioaktiver Isotope vorkommt ? Bismut (Bi), von dem allerdings seit neuestem behauptet wird, daß es ebenfalls radioaktiv ist (Halbwertszeit 1.9*1019a, α-Strahler, vgl. Nature 422, 876-878,24 Apr. 2003) Das Erdalkalimetall mit dem größten Atomradius findet sich in Periode Nr. (1) 1 ____ (2) 2 ____ (3) 6 ____ (4) 7 _ x _ Welches Element hat das niedrigste 1. Ionisierungspotential ? (1) Kalium _ x _ (2) Calcium ____ (3) Rubidium ____ (4) Strontium __ Welche Elektronenkonfiguration K-L-M-N entspricht einem Übergangsmetall ? (1) 2-2 ____ (2) 2-8-2 ____ (3) 2-8-8-2 ____ (4) 2-8-9-2 _ x __ Welches Element der Gruppe VI-A hat die größte Elektronenaffinität ? (1) Te ____ (2) Se ____ (3) S ____ (4) O _ x _ 9) Was versteht man unter der „Schrägbeziehung“ im Periodensystem ? Woraus resultiert Sie ? Geben Sie einige Beispiele ! chemisch ähnliches Verhalten von Elementen, die im PSE schräg zueinander stehen, insbesondere in der 1. und 2. Achterperiode, z.B. Be und Al, B und Si. Ursache: sehr ähnliches Ladungs/Radius-Verhältnis. Welches Element E bildet am einfachsten ein zweiwertiges Kation E2+ ? (1) Calcium __ x (2) Sauerstoff ____ (3) Natrium ____ (4) Aluminium ____ 10) Welches Element hat die höchste Elektronenaffinität ? (1) O ____ (2) F _ x _ (3) He ____ (4) Cl ____ Beantworten Sie die folgenden multiple-choice-Fragen ! Die Nichtmetalle finden sich im Periodensystem tendentiell (1) ganz links ___ (2) unten ___ (3) in der Mitte ___ (4) oben rechts _x_ Elemente mit sowohl Metall- als auch Nichtmetallcharakter nennt man (1) Halogene___ (2) Chalkogene___ (3) Halbmetalle_ x (4) Übergangsmetalle __ Was ist die Ordnungszahl eines Alkalimetalls ? (1) 10 ____ (2) 11 _ x _ (3) 12 ____ (4) 13 ____ Welches der Gruppe 17 Elemente hat die geringste Elektronenaffinität ? (1) Fluor ____ (2) Chlor ____ (3) Brom ____ (4) Iod _ x _ Welches Element der 3. Periode hat den ausgeprägtesten Metallcharakter ? (1) Natrium _ x _ (2) Aluminium ____ (3) Silicium ____ (4) Phosphor ____ Welches Element hat die höchste Elektronegativität ? (1) O ____ (2) F ____ (3) He __ x (4) Cl ____ Das Element der 3. Periode mit dem höchsten 1. Ionisierungspotential ist ein (1) Edelgas _ x _ (2) Halogen ___ (3) Alkalimetall ___ (4) Erdalkalimetall ___ Welches Ion hat den kleinsten Radius ? (1) Ba2+ ____ (2) Ca2+ ____ (3) Mg2+ __ x (4) Sr2+ ____ Welches Element bildet Ionen, die größer als das Atom sind ? (1) Na _ x _ (2) Ne ____ (3) Ba ____ (4) Sr ____ Welche Elektronenkonfiguration hat das Atom der 2. Periode mit dem größten Radius ? (1) 1s22s1 _ x _ (2) 1s22s2 ____ (3) 1s22s22p1 ____ (4) 1s22s22p2 ____ Geht man innerhalb einer Periode von links nach rechts, dann werden die Elektronegativitäten (1) steigen _ x _ (2) fallen ____ (3) gleich bleiben ____ Geht man innerhalb einer Periode von links nach rechts, dann sinkt (1) das Ionisierungspotential ____ (2) der Atomradius _ x _ (3)die Elektronenaffinität ____ 11) Wieviele und welche Quantenzustände kann ein Elektron mit n = 4 einnehmen ? Zahl der Zustände = 2n² = 32. im einzelnen: l = 0 , m=0 l= 1 , m=-1,0,+1 l= 2 , m=-2,-1,0,+1,+2 l= 3 , m=-3,-2,-1,0,+1,+2,+3 noch jeweils mit spin up und spin down ergibt 32 mögliche Zustände. 12) Übergangsmetalle der n. Periode können sowohl von der n. s-Schale, als auch von der (n-1). d-Schale Elektronen abgeben. Ermitteln Sie die Elektronenkonfiguration der folgenden Elemente und bestimmen sie welche Elektronen entfernt werden, um die entsprechenden Kationen zu erzeugen ! Element Symbol Elektronenkonfiguration Ladung Elektronenkonfiguration des Elements als des Kations Kation Scandium Sc 1s22s22p63s23p64s23d1 6 2 6 2 10 +4 1s22s22p63s23p64s23d104p65s04d0 Molybdän Mo 1s22s22p63s23p64s23d104p65s14d5 +6 1s22s22p63s23p64s23d104p65s04d0 2 2 6 2 6 2 6 2 2 6 2 6 2 8 1s 2s 2p 3s 3p 4s 3d 6 2 2 1s22s22p63s23p64s03d0 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d Fe 2 +3 Zirkonium Zr Eisen 2 +2 1s22s22p63s23p64s13d5 +3 1s22s22p63s23p64s03d5 +2 1s22s22p63s23p64s03d8 Nickel Ni 1s 2s 2p 3s 3p 4s 3d Silber Ag 1s22s22p63s23p64s23d104p65s14d10 +1 2 2 6 2 6 2 10 Zink Zn 1s 2s 2p 3s 3p 4s 3d Chrom Cr 1s22s22p63s23p64s13d5 1s22s22p63s23p64s23d104p65s04d10 +2 1s22s22p63s23p64s03d10 +3 1s22s22p63s23p64s03d3 +6 1s22s22p63s23p64s03d0 13) Die Orbitalenergien des Wasserstoffatoms sind nur eine Funktion der Hauptquantenzahl n. Warum gilt dies für die schwereren Elemente nicht mehr ? Welche Quantenzahlen nehmen hier auf die Energie Einfluß ? schwerere Elemente sind Mehrelektronensysteme, die neben den WW Elektron-Kern auch Elektron-Elektron Wechselwirkungen beinhalten. Dies führt zu einer energetischen Differenzierung der Elektronen in den verschiedenen Unterschalen. Die Quantenzahlen n und l nehmen hier auf die Energie Einfluß. In einem anisotropen Kraftfeld außerdem auch ml und ms. 14) Skizzieren Sie den Verlauf des Ionisierungspotentials, des Atomradius und der Elektronenaffinität der 3. Periode und erläutern Sie die Unstetigkeiten ! siehe Vorlesungsskript. Unstetigkeiten bei Verwirklichung von s2- , s2p3- und d5Zuständen. 15) Informieren Sie sich über den inert-pair-Effekt bei den schweren Elementen der Hauptgruppen und dessen Ursache. Bei schweren Hauptgruppenelementen werden selten die maximalen Oxidationszahlen verwirklicht, die stabilsten Verbindungen sind meist ns2np0-konfiguriert (z.B. Tl(I), Pb(II)). Das s2-Elektronenpaar ist durch seine relative Nähe zum hochgeladenen Kern besonders schwer oxidativ zu entfernen. 16) Wie groß sind die deBroglie-Wellenlängen eines Elektrons im Wasserstoffatom (m=9.109*10-31 kg, v=2.2*106 m/s) und eines Porsche 911 (m=1000 kg, v=250 km/h)? Berechnen Sie die Ortsunschärfen, wenn sie annehmen, daß ∆v=2.2*104 m/s bzw. ∆v=1 mm/s beträgt (zum Vergleich: Der Atomradius des H-Atom liegt im Bereich 10-10m). Interpretieren Sie die beiden Ergebnisse ! Porsche: λ=9.5*10-39m; ∆x=h ; => Im makroskopischen quantenmechanische Betrachtung sinnlos (aber nicht falsch). Elektron: λ=0.33 nm; ∆x=10-8; => Ortsunschärfe größer als der Bahnradius => Bohrsches Modell kann nicht stimmen.