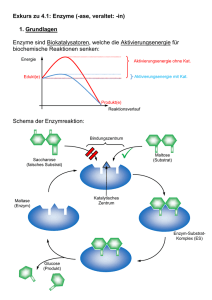
Praktikum Pharmakologie
Werbung

Praktikum Pharmakologie Biotransformation II Metabolische Aktivierung , Prodrugs – Verbesserung der GI-Resorption z.B. R-COOH (bei ph8 im Dünndarm R-COO- + H+) → Veresterung (+ HOR' → R-CO-O-R') dies wird z.B. bei ACE-Hemmern gemacht (Captopril, Ramipril, Fosinopril u.a.) – Umwandlung zum Wirkstoff erst in der Zielzelle Bioaktivierung z.B. durch Viral Rna-Kodierte Enzyme → Aciclovir (dort muss Triphosphat für DNA-Einbau entstehen, Viruskodierte Thymidinkinase macht das, dann Einbau in DNA und Kettenabbruch) Bioaktivierung von Protonenpumpenhemmern / PPHs: (Omeprazol, Bantoprozol) Aktivierung durch Säure → kovalente Bindung H+/K+-ATPase („Zerstörung“) Molekül in Magensaftresistenter Form → auf Aktivierung folgt schnell Inaktivierung durch weitere Säure PPHs werden folglich erst im Dünndarm aufgenommen, gelangen systemisch von basolateral zur ATPase, dort in sauren Kanalikuli Aktivierung Pharmakologische Wirkung von Metaboliten → Verlängerung der Wirkdauer (wenn der Metabolit eine längere t ½ hat. z.B. ASS t ½ 15min , Metabolit Salicylsäure 3h → Steuerbarkeit der pharmakologischen Wirkung verschlechtert sich Problem auch bei Diazepam /Valium. T ½ 40h, --Hauptmetaboliten-→ Nordazepam / Tranxilium N t ½ 70h → Oxazepam / Adumbran t ½ 8h (dieses ist also für Steuerbarkeit günstiger) Biotoxifizierung v.a. Durch Phase I , häufig Epoxidbildung (also dreieckRing aus O C C) → chemisch reaktiv (elektrophile „C“, also nucleophile Angriffe z.B. durch Stickstoffelektronen sehr häufig, es entsteht neue kovalente Bindung.) → R-NH2 in Protein → „Zerstörung“, Zelltod, Zytotoxizität R-NH2 in DNA → Mutationen, Krebs Detoxifizierung von Epoxiden durch H2O, durch hohe Konz von H2O wird Hauptmenge entgiftet Chinone, Chinonimine Chinone z.B. aus Estrogenen (Ring a) Chinonimine z.B. Paracetamol → Lebertoxizität Reaktion mit R-SH : cys (u.a. Glutathion <- Tripeptid Glu-Cys-Gly) → Glutathionaddukte (=Phase II) Paracetamol (name vgl Formel) Metabolische Aktivierung : Dehydrogenasereaktion → Parachinonimin → 1. Konjugation mit GSH →→→ Mercaptursäure (Detoxifizierung) Hauptweg, solange Dosis nicht zu ↑ (für GSH), dann nämlich 2. Reaktion mit zellulären Proteinen (klaut denen benötigte SH-Gruppe) → Funktionsverlust → Hepatotoxizität → therapeutische Breite beim Menschen nicht zu groß... v.a. Kinder Mercaptursäurenmessung im Urin → Biomarker der Belastung durch Fremdstoffe/Arzneistoffe (häufiges Endprodukt z.B. von kleinen polycyclischen Aromaten) 1 / 75 rechtenwald.com 2 / 75 rechtenwald.com Enzyminduktion Mehrsynthese von Enzymen der Biotransformation (v.a. Phase I wichtig) durch: – Arzneistoff selbst – andere Fremdstoffe therapeutischer Konzentrationsbereich wird bei induziertem Enzym (z.B. Raucher) oft gar nicht erreicht! Auf jeden Fall Cmax niedriger, t ½ verkürzt → AUC erniedrigt anderes Bsp. Pille Enzyminhibition Enzyme werden gehemmt durch Stoff B → AUC (Stoff A) wird höher Cmax, t ½ , AUC , tox, NW, UAW → alles geht ↑! Problem : Geringe therapeutische Breite Inhibitoren v.a. CYP3A Auch beim Absetzen eines Indukotrs oder Inhibitors ein Problem! Stichwort Arzneimittelinteraktion Pharmakogenetik genetische Polymorphismen und seltene Defekte arzneistoffabbauender Enzyme z.B. – Pseudo- oder Butyrylcholinesterase: bei 1/2000 von Succinylcholin als Muskelrelaxans bei Ops → sehr viel längere Beatmung nötig gewesen – Cyp2D6 5-10% – Alkoholdehydrogenase CYP2D6 – bei 8% in de Enzym inaktiv – bei 20% aller Arzneistoffe an BT beteiligt – massgeblich für Elimination Antidepressiva, Antiarrhythmika und Betablocker – individuelle Geschwindigkeit kann durch „Phänotypisierung“ bestimmt werden ,wir nehmen Dextromethorphan (verschreibungsfreier Hustenstiller), Urinprobe mit negativer Kontrolle, bestimmung von DEX und DOC (Metabolit) mittels Massenspektrometrie 3 / 75 rechtenwald.com Fr. Phase 1 '(Funktionalisierung): Cytochrom p450-monooxygenasen, dehydrogenasen (alkohol/ Acetaldehyd, ..), oxidasen (z.B. MAO), Esterasen, Hydrolasen Phase 2 (Konjugation): Glucoronyl-Transferase, Sulfotransferase, Glutathion-Transferase, NAcetyl-Transferasen, Sulfotransferasen (Phase 3: Transport.... P-Glykoprotein, Multi-Drug-Resistance-Proteins,...) 50% aller Arzneistoffe zunächst über CYP3a4 Cyp2d6 , Cyp2c9 auch häufig cyp2e1: ethanol Enzyminduktion: wiederholte Gabe einer Substanz → gesteigerte Synthese/Aktivität des Enzyms → Fremdstoff wird (meistens) schneller zu unwirksamen Metaboliten abgebaut → Wirksamkeitsverlust → bei längerdauernder Medikation → Erniedrigung Plasmakonz. → Fremdstoff wird bioaktiviert → Toxizität ↑ → Plasmaspiegel körpereigener Wirkstoffe kann unter Normalwert fallen → Arzneistoffwechselwirkungen Enzyminduktoren – Arzneistoffe – Phenobarbital – cyp2, 3 (ewig viele – Griseofulvin (Cyp3) – Primidon – cyp2 (2b1, 2b2) – Carbamazepin - > cyp3 – Rifampicin -> cyp2, 3 Genussmittel – Rauchen – polycyclische aromatische Khs -> cyp1 – Ethanol – Cyp2e1 Umweltgifte – DDT – PCBs – Dibenzodioxine – Dibenzofurane -> Cyp1 (1a1, 1a2), gst, ugt1a6 Folgen der Enzyminduktion – orale Kontrazeptiva... Rifampicin induziert cyp3a4 -> orale kontrazeptiva werden über cyp3a4 schneller abgebaut -> unerwünschte Schwangerschaften bei Tuberkulosepatienten unter Rifampicin – orale antikoagulantien – cyp3a4 -> gefahr von gefäßverschluss steigt Ausmaß der Induktion – 2b1: Phenobarbital – bis Faktor 60... Enzymhemmung -> erhöht BV 4 / 75 rechtenwald.com Arzneimittel – Cimetidin – Alternative Ranitidin – Azolantimycotika – Makrolidantibiotika – HIV-Proteaseinhibitoren Genussmittel – Grapefruitsaft -> Hemmung von Cyp3a4 -> dramatischer Anstieg der Plasmaspiegel und damit Schwere Nebenwirkungen (z.B: Verapamil, Ciclosporin, Midazolam, Terfenadin Grund: Cyp3a4 Hemmung durch Naringenin -> Metabolimus ↓ -> Plasmakonz ↑ Hemmung von cyp1a2 -> Abnahme der Mutagenität von Substanzen , die über cyp1a2 aktiviert werden, z.B. Aflatoxin B1, PAKs ein Fall: Rhabdomyolyse (Auflösung quergestreifter Muskelfasern) unter Behandlung mit CSEHemmern (Cholesterinsenker) nach Konsum von Grapefruitsaft (nach 2jähriger komplikationsloser vorheriger Therapie) Arzneistoffe bei denen Enzyminhibition zu relevanten Überdosierungen führen kann – Tolbutamid – Simvastatin -> Alternative: Pravastatin – Ciclosporin – Terfenadin – Theophyllin – Orale Koagulantien -> Blutungen Polymorphismus – Definition: Genetischer Polymorphismus bezeichnet eine Genveränderung, die häufiger als 1% in der Bevölkerung auftritt – Erstmalig klinisch aufgefallen bei Muskelrelaxans Succinylcholin: Einzelne Patienten zeigten extrem Verlängerte Wirkdauer – Erklärung: Defekt des abbauenden Enzyms Pseudocholinesterase Phase I: Pseudocholinesterase - Häufigkeit .bei weißen 1:3000, bei schwarzen / orientalen viel selterne – Suxamethonium: stark verlängerte Muskelrelaxation : Beatmung länger nötig! – .... genetische polymorphismen des Fremdstoffmetabolismus ph1: cyp2e6, cyp2c19, cyp2c9, cyp2d6, cyp3a5 .... mikr. Epoxidhydrolase, fmo3, alkohol/aldehyddehydrogenase ph2: gstm1, gstt1, gstp1, ugt1a1, nat2 ph3: mdr1, oatps (organischer anionentransporter), mrps Bsp cyp2d6, polymorphismus entweder nur 1 oder 2 allele betroffen extrem langsam 7%, langsam 5-10%, normal 80%, gesteigert 2-3% Frage 3: Häufigkeit Polymorphismen siehe Zettel 5 / 75 rechtenwald.com Bsp Thiopurin-S-Methyltransferase – Immunsuppressivum Azathioprin... AI-Erkrankungen, Krebs Behandlung – schwere leukopenien , folge infektionen, teilweise letal bei mangel Thiopurin-SMethyltransferase... Schwere form 1/300, leichte 1/10 – -> Genoypisierung vor jeder ↑dosierten Azathioprin-Therapie? Cyp2d6 – beteiligt am Metabolimus von ~20% der Arzneistoffe – substrate klein, mit basischen N-Atom – Expression in Leber, nicht induzierbar, – inhibition möglich durch Arzneistoffe – polymorphismus: keine, normale, hohe Aktivität – Variation 10k-Fach zwischen Individuen Kaukasier : poor metabolizer 8% (s.o.) – Entdeckt mir Spartein und Debrisoquin – klinisch relevant bei Antiarrhythmika und cyclischen Antidepressiva -> Dosis erniedrigen Phase I : Aldehyddehydrogenase Metabolimus von Ethanol Ethanol -> Acetaldehyd -> Essigsäure – – – – – – ALDH2-Isoenzym bei Asiaten inaktiv Acetaldehyd-Syndrom bereits bei Konsum kleiner Alkoholmengen kommt es zu unangenehmen Erscheinungen wie Hautrötung, Kopfschmerzen, Kältegefühl in den Extremitäten und Übelkeit oft auch HerzKreislauf-beschwerden Antabus(r) Disulfiram (Tetraethylthiuramdisulfid) Blockierung des Enzyms Acetaldehyddehydrogenase -> Symptome nach kleinen Mengen zur Entwöhnung, Therapie quasi obsolet heute Ebenso durch Coprin (Faltentintling) Phase II: N-Acetyltransferasen – Cytos. /mitoch. Enzyme in vielen Geweben – Substrate : N und O – Hydrophilie nimmt ab! – Aktivierte Cosubstrat: Acetyl-COA – Im Mensch NAT 1 und 2 – Hund u. Ratte schlecht <> Mensch gut – Tuberkulostatikum Isoniazid – Langsamacetylierer (40-70% der Europäer) höheres Blasenkrebs-Risiko durch aromatische Amine (Benzidin) (NAT2) Acetylierung des Tuberkulostatikums Isoniazid – langsame Acetylierer : periphere Neuropathien, Hepatitis – schnelle Acetylierer: ungenügende Wirkung bei Tuberkulose 6 / 75 rechtenwald.com 2. woche Rechneraria Plasmakonzentration in Abhängigkeit von Zeit – siehe Vorlesung bei i.v. - initialer anstieg, dann zunächst vorwiegend Verteilung, danach Elimination: a) Biotransformation „hepatische Clearance“ + b) Ausscheidung der unveränderten S. „renale Clearance“ mathematische Funktion: a) Biotransformation (enzymatisch) (Michaelis-Menten) Geschwindigkeit ist proportional der herrschenden Konzentration b) renale Ausscheidung (Filtration im Glomerulum) ebenfalls v ~ c -> beide Prozesse folgen einer Kinetik 1. Ordnung (abhängig von einer Variablen) -> dc / dt proportional zu c = -k * c k = Eliminationskonstante c(t) = co*e-k*t ln c(t) = ln co – k*t -> Gerade, wenn c im log-Massstab dargestellt wird („lineare Kinetik“) 1. Parameter: Eliminationshalbwertszeit t½ c (t ½ ) = c0 / 2 ½ = 1 * e-k*t1/2 ; -> -> k= ln2 / t½ für t½ = 1h -> k = 0,639 / h vorsicht mit den Einheiten – s / min / h, yg / mg / g , ml / l 2. Verwandte Kenngröße für Elimination: Clearance Cl (ml /min) Plasmaclearance: Plasmavolumen, das pro Zeiteinheit vom Stoff befreit wird (Ausscheidung plus Biotransformation!) Cltot = Clrenal + Clextrarenal Cltot = VD * k = VD * ln2 / t½ Obacht beim Rechnen: wenn Verteilungsvolumen pro kg und Clearance pro Mensch angegeben ist -> Standardmensch (70kg) einsetzen VD : Bezug Menge im Körper – Plasmakonzentration (therapeutisch) Bsp.: Digoxin – therapeutischer Blutspiegel 1 ng/ml Plasma – VD = 7 l / kg – 80 kg-Mensch = 560 l – VD = Menge / Plasmakonzentration – Menge: 560000 * 1ng = 560000 ng = 0,56 mg – Cltot = 120 ml/min – pro Tag = 120 * 1440 ml =etwa 200000 ml Plasma / d von Digoxin befreit -> 200000 ng/Tag Elimination -> 0,2 mg Tagesdosis – vgl Rote Liste: Lanicor Tabletten zu 0,25 mg 7 / 75 rechtenwald.com Bestimmung der Clearance Cltot = Dosisi.v. / AUCi.v. Vol / Zeit = Menge / Konz*Zeit = Menge / Menge/Vol * Zeit = Vol / Zeit Cltot = Clrenal + Clextrarenal Clrenal = Menge, die in definierter Zeitspanne im Urin ausgeschieden ist / Konzentration im Plasma zum Zeitpunkt in der Mitte der Urinsammelperiode -> Clextrarenal = Cltot – Clrenal Q0: extrarenale Eliminationsfraktion , „Bruchteil“, kann gehen von 0bis1 (entspricht 0 bis 100%) Q0 = 0 (niedrig) -> renale Elimination 100%, alles unverändert über die Niere, Nierenfunktion beachten! v.a. Bei niedriger therapeutischer Breite (beachte auch: alte Menschen, bei 70jährigen Creatininclearance idR um 50% gesunken) Q0 = 1 (↑) -> renal unverändert 0% -> alles Biotransformiert (aber Vorsicht: die Metaboliten können durchaus renal ausgeschieden werden – also Nierenfunktion nicht wurscht. Deshalb in Tabellen Q0 der wichtigen Metaboliten (pharmakologisch aktiv) angegeben) BV = Bioverfügbarkeit (orale) siehe Pharma Vorlesung Ergänzung zum Blatt: Aufgabe 3: Verteilungsvolumen für Ethanol: VD ~ 0,6 l / kg Frau, 0,65 l / kg Mann entspricht realem Raum, dem wässrigen Kompartimenten 8 / 75 rechtenwald.com Pharmakokinetik: Parameter die Veränderung der Menge eines Wirkstoffes im Organismus wird mit Hilfe der folgenden pharmakokinetischer Parameter beschrieben: Verteilungsvolumen (V) (l/kg) Eliminationskonstante (ke) (sec-1) Halbwertszeit (t) (sec) Clearance (CL) (l/kg*s) Bioverfügbarkeit % Konzentration im Blut ( c) mol/l Qo -> Clextrarenal / Cltot bei einer Q0 von 0,5 muss bei Niereninsuffizienz idR nicht eingegriffen werden -> therapeutische Breite reicht dafür aus (ausnahme Spezialfälle) vgl Enzymexpression Leber – große interindividuelle Unterschiede -> trotzdem idR keine Wirkungsunterschiede 2b) ersten wert ausser acht lassen, ab dem 2. punkt starten dann kommt 12min raus. Haha. Sehr lustig! Ln c(t) = ln co -k*t k = ( ln co – ln c(t) ) / t k = ln 2 / t ½ t ½ = t * ln2 / ln co – ln c(t) = t*ln2 / ln (co/c(t)) -> da ich ersten wert herausfallen lasse, ziehe ich den letzten wert 10 minuten vor 50 min * ln2 / ln (802,86 / 54,29 ) = 12 min 2 c) k = ln2/t ½ = 0,06 min-1 Verteilungsvolumen = Dosis / Plasmakonzentration je größer das Verteilungsvolumen, desto größer ist der Anteil, der sich ausserhalb des Plasmaraumes befindet substanzspezifisch, konzentrationsunabhängig fettgewebe: lipophile substanzen knochen: calciumähnliche substanzen (Sr, pb), chelatbildner (tetracycline, bisphosphonate) alkoholtest: die polizeiwerte sind um den faktor 1,3 kleiner als wirkliche plasmakonzentrationen 9 / 75 rechtenwald.com Dosis-Wirkungs-Beziehungen 2 Arten a) Intensität an 1 Zelle, 1 Individuum kontinuierliches Mass (Kann jeden wert annehmen, auch mit Kommastellen) Bsp: Kraft (Muskelzelle), Blutdruck (Mensch) Definiert durch Michaelis-Menten-Kurve (Hyperbolisch), KD, RL / Rtot = [L]/[L]+KD übertragen in logarithimische x-Achse [Ligand]: sigmoide Kurve (obacht: flacher Kurvenverlauf im niedrigen Bereich ist hier keine Schwelle!) Entscheidend für Kurvenform: Mechanismus der Interaktion Bsp: Schmerzunterdrückung: Maximal Mögliche Wirkung und Dosisbereiche (Wirkstärke) unterscheiden sich stark bei ASS, Codein, Morphin b) an einem Kollektiv/Gruppe/Population Anzahl Individuen, die bei gegebener Dosis einen definierten Effekt zeigen. Ja oder nein? Quantales Mass (im Ggs zum kontinuierlichen) wen hat's erwischt und wen nicht? Bsp.: Alkohol – alle trinken 1 Glas Wein – müssen auf Strich gehen – wer kann noch geradeaus laufen? Graphisch – Inzidenz [%] vs log Dosis -> sigmoidaler Verlauf Treppe keine Kurve da immer wieder Individuen dazukommen Entscheidend für Kurvenform: die individuelle Empfindlichkeit = Toleranzverteilung Therapeutische Breite definierter therapeutischer Effekt (Bsp: Blutdruck ↓ 20mm) abstand zum unerwünschten/toxischen Effekt Bildung Quotient zwischen – therapeutischem Effekt bei jedem Zweiten ED50 – unerwünschtem Effekt bei jedem Zweiten UD50 -> 1. Quotient: UD50/ED50 = möglichst groß (Faktor 2 bloß z.B. bei Antiarrhythmika) 2. Quotient: „Steilheit“ UD05/ED95 = möglichst groß (entscheidend bei kleinem 1. Quotient) Toxikologische Grenzwerte = Dosis oder Konzentration eines Gefahrstoffes, für die gelten soll: Darüber: giftig, Da↓: ungiftig Geht so nicht! „Individuelle Empfindlichkeit“ – Alter – genetische Faktoren – Lebensstilfaktoren – bestehende Krankheiten je enger das belastete Kollektiv gefasst wird, desto besser können Grenzwerte definiert werden. Bsp.: Arbeitsplatz (Alter 18-65, Krankheiten – relativ gesunde Subpopulation) -> MAK (liegt höher als RW (Richtwerte) für z.B. Stoffe in der Umgebungsluft -> Dauerexposition auch besonders empfindlicher Individuen) idR RWII = MAK / 50 Maximale Arbeitsplatzkonzentrationen: MAK 10 / 75 rechtenwald.com Der MAK-Wert ist die höchstzulässige Konzentration eines Arbeitsstoffes als Gas, Damp oder Schwebstoff in der Luft am Arbeitsplatz, die nach gegenwärtigem Stand der Kenntnis auch bei wiederholter und langfristeiger, in der Regel 8stdg. Exposition jedoch bei Einhaltung einer Durchschlnittl. Wochenarbeitszeit von 40stdn im allgemeinen die Gesundheit der beschäftigten nicht beeinträchtigt und diese nicht unangemessen belästigt. Ppm = Volumenteile Substanz / 1Mio Volumenteile Luft ppm* mol.gewicht /24 -> mg /m³ Luft Toxikologische Grenzwerte , Richtwerte, Leitlinien („Dschungel“) siehe Blatt -> bei Überschreitung MAK-Werte: Massnahmen müssen vom Arbeitgeber getroffen werden Lebensmittel Zusatzstoffe + Rückstände von Pestiziden Zulassung <-> Verbot Tox.Studien vielfältige Endpunkte Nachweisgrenze: darüber Signifikanz des adversen Effektes NOAEL no observed adverse effect level LOAEL lowest observed adverse effect level NOAEL / Sicherheitsfaktoren (faktor 10 idR) : Extrapolation Tier -> Mensch / individuelle Empfindlichkeit (faktor 10 idR) -> min. 100 d.h. Eine Überschreitung um den Faktor 2 oder 3 ist kein toxikologisches Problem Grenzwerte für Lebensmittel (Konzentrationsangabe) -> siehe Blatt Biomonitoring wir messen nicht auf der expositionsseite sondern die interne Dosis im Menschen / biochemische, funktionelle Effekte Dosis-Biomonitoring : interne Dosis, Belastungsdosis Effekt-Biomonitoring: biochemischer Effekt (z.B. Mutationen bei mutagenen/kanzerogenen Stoffen), Funktioneller Effekt (Bsp. Bestimmung Blutgerinnungszeit bei Behandlung mit Cumarinen wie z.B. Phenprocoumon) Modulationen in der Ereigniskette gemäß individueller Unteschiede (genetisch, Lebensstil, u.a.) Kontaminanten in der Umwelt alle sind betroffen, nicht nur speziell exponierte oder Medikamentenschlucker v.a. Metalle oder schwer abbaubare organische Verbindungen (wie halogenierte Aromaten, Dioxine, PCBs (polychlorierte Biphenyle <- Hydrauliköl, Dielektrika in Transformatorenstationen), Pestizide (DDT, Dieldrin) Frage, die sich stellt: Ist ein Individuum überdurchschnittlich belastet? -> Quellen suchen + eliminieren ≠ Frage nach toxikologischen Effekten Graphische Auftragung: Häufigkeit des Vorkommens einer Konzentration im Plasma 11 / 75 rechtenwald.com statistisches Mass: Referenzwert = Perzentile 95 der Häufigkeitsverteilung für Konzentration 12 / 75 rechtenwald.com Woche 3 Aufgabe 1 – Pentobarbital (Schlafmittel); Adrenalin / Tachykardie; CO-Vergiftung – allergische Reaktion – 2 verschiedene bindungsstellen verstoffwechselung geschwindigkeit unterschiedlich (z.B. Metoprolol CYP2D6) – Alkohol – Unfälle/Infarktrisiko Aufgabe 4 Referenzwerte werden in den nächsten Jahren sinken, da Stoffe inzwischen verboten sind. PCDD polychlorierte dibenzodioxine 2,3,7,8- TCDD das giftigste, was menschen hergestellt haben dti 1 pg (mit Sicherheitsfaktor) Toxizität Mensch-Ratte-Meerschweinchen hier ausnahmsweise überhaupt nicht vergleichbar 13 / 75 rechtenwald.com zur Kinetik 26.10.05 Kumulation bei repetitiver Gabe (gut im kleinen Pharma Buch) einstellen eines steady state, dieser muss im therapeutischen Bereich liegen Faustregel: 4-5 t ½ bis steady state (Fließgleichgewicht) erreicht ist bei kurzer Eliminationshalbwertszeit weniger lang Menge im Körper im steady state – wie groß ist die? (bei oraler Aufnahme) Proportional – BV – D Einzeldosis – t½ – umgekehrt proportional zum Dosierungsintervall tau Mss = BV * D * t½ / ln2 * tau Menge im steady state = Bioverfügbarkeit * Einzeldosis * HWZ / ln2 * Dosierungsintervall Css = BV * D / tau * Cltot Plasmakonzentration = Bioverfügbarkeit * einzeldosis / Dosierungsintervall * totale Clearance Digoxin z.B. Css 1 yg / l -> passt 0,25 mg 1 x täglich p.o.? Css = 0,75 * 0,25 / 24*60 * 120 = 1.08 * 10-6 mg / ml -> 1,08 yg / l -> HuRrA eS StImMt! Dosisreduktion bei Niereninsuffizienz Q0 extrarenale Eliminationsfraktion falls Q0 = 0 -> alles unverändert über die Niere weg Funktion Niere entscheidend! Wenn Clearance halbiert (statt 100 ml/min nur 50) -> wie müssen wir dosis von Digoxin (Q0 0,33) reduzieren? 1-Q0 – renaler Teil – muss angepasst werden -> Dosisreduktion um 0,33 auf 0,66 (also statt 0,25 mg/d 0,16 mg/d) Alternative: Intervallveränderung (aber in bezug auf compliance nicht gut) (DE / tau)Ni = (DE / tau)No [(1-Q0) * ClNi / ClNo + Q0] Formel aus Aktories zeigt, dass wir an beiden schrauben können – Dosis oder Intervall Korrektur in der Eckigen Klammer 14 / 75 rechtenwald.com Grundlagen der Vergiftungslehre 840k Todesfälle in der Bundesrepublik 2002 Davon: Verletzungen/Vergiftungen: 34k Davon: Transportmittelunfälle und Stürze: 14k Suizide 11k (die Mehrzahl stofflich bedingt) Medikamente: 2/3 aller Intoxikationen auch häufig: Haushaltsprodukte / technische und gewerbliche Produkte / Genussmittel, Drogen und Alkohol (12/7/6 %) bei Kindern idR sehr leichte Verläufe, Pflanzen und Pilze sind praktisch kein ernsthaftes Problem, problematisch da v.a. Medikamente („ah das kind hat meine medikamente erwischt“) Antidepressiva habne unterschiedliche Tode/ Mio Verschrebungen-Raten ganz hart: Desipramin Grundlagen der Vergiftungsbehandlung Primäre Dekontamination bei oraler Aufnahme „Aufnahme aus dem Magen-Darm-Trakt vermindern / verlangsamen“ Aktivkohle sofort möglich, keine absolute KI, 1-2g pro kg KG Stellenwert: Optimal, DAS A UND O wenn genügend ↑ dosiert ungenügend bei: Lösungsmitteln, Alkoholen (idR bei den beiden ein Dosisproblem), Metallionen, Säuren und Laugen wenig Probleme: Obstipation (Aspiration bei Erbrechen) Erbrechen auslösen? Viele Kontraindikationen! Wirkung begrenzt, bei Sirupus Ipecacuanhae verzögert (15-50min) keine Emesis auslösen bei – Lösungsmitteln wie Petroleum (-> Aspirationspneumonie – Zestörung Surfactantschicht und damit Oberflächenspannungserhöhung) – Detergentien (<- Entschäumere: Simeticon / Dimeticon) – ätzenden Stoffen (Laugen, Säuren <- sofort Verdünnen) – krampfauslösenden Noxen (Amphetamine, Ecstasy) Stellenwert: viel schlechter als Aktivkohle Magenspülung („Aktivismus“ falls zu spät) Nur geringe Entleerung! Nie mehr als 30% gemessen (Digoxin, Imipramin) Probleme: Spülung in den dünndarm! -> oft Verschlechterung des Zustandes! Spitalinfrastruktur notwendig; Intubation angezeigt KI: wie bei Emesis! Stellenwert: falls innerhalb 1 Std.: Begünstigung „nicht ausgeschlossen“ bei MeOH, Fe, Li besser wirksam als Aktivkohle Orthograde Darmspülung (auch zur Endoskopievorbereitung) Sinnvoll bei hohen Dosen von Substanzen, die schlecht an Aktivkohle binden (Fe, Li) Fordtran'sche Lösung, in der Klinik auf per Magensonde = iso-osmotischer Elektrolyt (Na-K-Cl-HCO3-SO4) + Polyethylenglykol KI: GI-Blutung, Perforation, Passagebehinderung Nebenwirkungen: ev. Abdominalkrämpfe + Erbrechen Als Laxantien: Glaubersalz (=Natriumsulfat); Macrogol 15 / 75 rechtenwald.com Sekundäre Dekontamination „Elimination beschleunigen“ Aktivkohle repetitiv 3-4mal alle 2-4 Std 25-50g kann Ausscheidung steigern! Bsp.: i.v. Phenobarbital t ½ um 64% ↓, Cltot 3x ↑ = EHK (enterohepatischer Kreislauf) unterbrechen (wichtig u.a. bei Herzglykosiden, Steroiden) und „gastrointestinale Dialyse“ (auch: Colestyramin statt Aktivkohle – aber nicht besonders besser) Renale Ausscheidung beschleunigen -> Volumen, Furosemid Saure Stoffe: Urin durch NaHCO3 Infusion alkalisch machen Barbiturate (sehr gut bei schwach Sauren), Salicylate (weniger gut) KI: Elektrolytstörung! Extrakorporale Elimination Hämodialyse (aufwändig!): Li, Salicylate, Methanol, Ethylenglykol Unwirksam bei Noxen mit hoher Plasmaeiweißbindung Komplexbildung – Antikörper: – – Digitalis-Antitoxin Botulinus-Antitoxin Schlangenserum Chelatoren: DMSA = 2,3-Dimercaptosuccinat: DMPS = 2,3-Di-mercapto-1-Propansulfonat: Deferoxamin: Eisen(III)-Hexacyanoferrat(II): Hydroxycobalamin (Vit. B12a; Co+) Pb As, Cr, Hg Fe TI, Cs CN- Substanz wird nicht vernichtet, aber die Freisetzung verzögert/ der Plasmaspiegel gesenkt Spezifika Calciumgluconat Beclomethason ... Vergiftungsfälle: 9. Semester im Rahmen der speziellen Akutbehandlung – Paracetamol – tricyclische Antidepressiva – Alkohol + Kombinationen – CO / CH4 16 / 75 rechtenwald.com Charakteristische Symptomkombinationen Puls Bd Auge Art der Wirkung und Beispiel Antidota ↑ ↑ Mydriasis Sympathomimetisch cocain, ampthetamine, ecstasy ↓ ↓ Miosis Cholinerg (Sekretion, Peristaltik) Organophosphate Muscarin-Pilze (Risspilze, Trichterlinger) Atropin, Biperiden (ev. Beatmung) ↑ (↑) Mydriasis Anticholinerg (Agitiertheit, Rhytmusstörung) TC-Antidepressiva div. Alkaloide (atropin) Physostigmin ↓ ~ Miosis Atemdepression Opioide cave: Kombinationen Benzodiazepine, Alkohol Naloxon 17 / 75 rechtenwald.com Primäre und sekundäre Giftelimination vor / nach Resorption Primär: – Erbrechen – Magenspülung – Hautreinigung – Instillation von Adsorbentien (Aktivkohle) Sekundär: – Wdh. Gabe von Aktivkohle (enterohepatischer Kreislauf) – Hämodialyse, Hämoperfusion (v.a. Für lipophile Stoffe) – Forcierte Diurese – Antidottherapie Auslösen von Erbrechen – Kochsalz-Emesis 1-2 Glas gesättigte Kochsalzlösung (2 Esslöffel / Glas Wasser) + evtl Reizen der Rachenhinterwand bei ausbleibendem Erbrechen: Apomorphin bzw. Magenspülung (Gefahr von NaClVergiftungen) „Hausmittel für einsame Berghütten“ – Apomorphin-Emesis 0,1-0,15 mg / kg Apomorphin s.c. + 10 mg Norfenefrin (Novadral(r)) i.m. Zur Kreislaufstabilisierung + 1-2 Glas Wasser trinken lassen Wirkeintritt nach 4-5min – bei Kindern weder Kochsalz noch Apomorphin! Ipecacuanha-Emesis Sirup Ipecacuanhae 10-30 ml entsprechend 1-3 jahre + 100-200 ml Wasser od. Saft dazu, evtl Reizung der Rachenhinterwand, bei ausbleibendem Erbrechen Magenspülung kann schon 30min dauern Kontraindikationen – relativ: Giftaufnahme > 1h zurück – Bewusstseinseintrübung – mangelnde Überwachungsmöglichkeit – Herz- oder Ateminsuffizienz – Gravidität – Krämpfe – Einnahme von Säuren oder Laugen Organischen Lösungsmitteln (z.B. Benzin, Lampenöle) schaumbildenden Substanzen Antiemetisch wirkenden Substanzen (z.B. Neuroleptika) 18 / 75 rechtenwald.com Intoxikationen Benzodiazepine z.B. Flunitrazepam, Triazolam Symptome v.a. Atemdepression und Koma Therapie: Aktivkohle, bei Koma Einsatz von Flumazenil (Benzodiazepin-Rezeptorantagonist) „Austitration“ Paracetamol Weg im Organismus Biotransformation (Sulfat, Glucuronsäure) -> Elimination geringe Mengen: Oxidation -> p-Aminobenzochinon – Glutathion-> Mercaptursäure -> Elimination – Reaktion mit Zellulären Proteinen -> Lebernekrose (bei hohen Dosen aufgrund von Glutathionverarmung) Vergiftungsphasen: 1. Phase: Anorexie, Nausea, Erbrechen 2. Phase: scheinbare Erholung, Leberzellnekrose 3. Phase: Ikterus, Gerinnungsstörungen, Leberversagen Antidot N-Acetylcystein bereitstellen von SH-Gruppen für Reaktion mit Chinon und Cystein als Baustein für GSH evtl Leber-TX Bestimmung der Plasmakonzentration zur Abschätzung des Risikos von Leberschäden nach Paracetamol-Einnahme in den ersten 4h Aktivkohle Naloxon Antagonist am Opiatrezeptor geht nicht bei Buprenorphin Intoxikation mit Opioiden Symptome v.a. – Miosis – Atemdepression – Tod durch Atemlähmung – Bewusstlosigkeit Therapie: Beatmung + Naloxon i.v. (cave: kurze HWZ, mehrfache Gabe) Vorsicht bei Drogenabhängigen : Entzugssyndrom (Kreislaufversagen) Simethicon (saab simplex(R), auch bei Säuglingen gegen Blähungen) bei Schaumbildenden Substanzen Bicarbonat (HCO3) Forcierte alkalische Diurese z.B. bei Vergiftung mit Salicylaten, Barbituraten – Vorraussetzungen: hydrophil, nicht eiweißgebundne, überwiegend renale Elimination – Infusion großer Flüssigkeitsmengen + Schleifendiuretika (Harnvolumen > 500 ml / h) + Alkalisierung des Urin-pH durch Natriumbicarbonat – schwache Säure liegen in ionisierter Form vor und werden im proximalen Tubulusepithel nicht 19 / 75 rechtenwald.com rückresorbiert z.B. Barbiturate / Salicylate cave: Hirn- und Lungenödem bei Volumenbelastung , Störugnen des Elektrolythaushaltes Biperiden Intoxikation mit Neuroleptika Symptome : v.a. Dyskinesien, sonst alles mögliche wie Krämpfe, Hypothermie, Tachy/Bradykardie, Herzrhytmusstörungen, Sedation bis zum Koma oder Hyperreaktivität und Delir Therapie : Erbrechen unwirksam, Hämoperfusion auch schlecht, Magenspülung nur am Beginn mit großen Mengen, also lieber Aktivkohle, primär + sekundäre Elimination; bei Krämpfen Diazepam , natürlich gegen extrapyrimidale Symptome Biperiden (Akineton(r)), bei Hypotension Noradrenalin oder Dopamin Phytomenadion Antidot: Cumarinderivate und andere Vitamin-K-Antagonisten (Warfarin) therapeutisch bei Vitamin-K-Mangel (und damit verbundenen Gerinnungsstörungen Calcium Antidot bei Flusssäure (Fluorwasserstoffsäure) z.B. in Steinreiniger, starkes Penetrationsvermögen bis in Knochen -> Calciumgluconatgel, Ca2+-Kanalblocker Sauerstoff Kohlenmonoxidvergiftung andere Reizgase CO-Vergiftung Symptome in Abhängigkeit von HbCO-Gehalt ab 5-10% Beginn mit Einschränkung des Visus bei 60-70% Tod innerhalb 1h Therapie neben O²-Gabe Natirumbicarbonat zur Korrektur der Azidose Physostigmin (Carbamat) Antidot: Parasympatholytika -> Digitalis, Tricyclische Antidepressiva, Amitriptylin, Atropin... Mechanismus: Parasympathomimetikum – hemmt Ach-Esterase -> Ach ↑ Tollkirsche, Stechapfel, Engelstrompete! Symptome: – Rötung gesicht – Trockene Schleimhäute – Pulsbeschleunigung – Mydriasis zur Therapie natürlich auch Aktivkohle und symptomatisch Diazepam , Atem+Kreislaufstabilisierung, Blasenkatheter, Abkühlung Physostigmingabe i.v. Oder i.m. Atropin Antidot: Trichterlinge, Risspilze (Muskarinvergiftung), Insektizide/Pestizide (Organophosphate, Carbamate) 20 / 75 rechtenwald.com Silibinin bei Knollenblätterpilz (amanitin) „zum Schutz der Leber“ Deferoxamin Antidot: Metalle v.a. Eisen, Aluminium cyp2d6-Besprechung Bsp: Lipophiler Fremdstoff (Paracetamol) rein , Hydrophiler Metabolit raus (Mercaptursäure) (cyp2e1) Biotransformation Fremdstoff Funktionalisierung Phase I : Oxidation, Reduktion, hydrolyse Metabolit A Konjugation Phase II: Glucuronsäure, Sulfat, GSH, Acetyl, AS Metabolit B Cytochrom p450 Enzyme – Vorkommen: 90% in Leber – zentrale Enzyme für oxidativen Phase-I-Metabolismus – Führen Vielzahl von Funktionalisierungsreaktionen durch – Einteilung entsprechend Homologie in Aminosäuresequenz – Bei Säugern 14 CYP Familien mit 26 Subfamilien – Relevant für Arzneistoffwechsel: Familie 1, 2 und 3, davon 7 Subfamilien mit 12 Isoformen – Meistens breite Substratspezifität: Arzneistoffe mit unterschiedlicher chemischer Struktur – Aber bestimmte Substanz kann spezifisch von 1 Enzymisoform umgesetzt werden – Individuelle Unterschiede in Enzymaktivität über cyp2d6 verstoffwechselt werden... amitriptylin, clomipramine, codein, fluoxetin, metoprolol, propafenon, tamoxiphen,... Web-Page Clinically used Drugs Metabolized by Cytochrome p450 ... substrate, inhibitoren, induktoren http://medicine.iupui.edu/flockhart/clinlist.htm http://www.gentest.com glücklicherweise werden die meisten stoffe von mehr als einem enzym verstoffwechselt z.B. Verapamil (Natriumkanalblocker) von 6 Stück Ursache der individuellen Unterschiede in der Enzymaktivität – mutationen in den verantwortlichen Genen: Polymorphismus, wenn Häufigkeit > 1% – Enzyminduktion – Enzyminhibition Aktivitätsunterschiede p450 2c19 10 pmol/mg *min – 650.... Cytochrom P450 2d6 – beteiligt am Metabolismus von ca 20% der Arzneistoffe – Substrate: kleine Moleküle mit basischem Stickstoffatom – Expression in Leber nicht induzierbar durch Xenobiotika – Inhibition möglich durch Arzneistoffe 21 / 75 rechtenwald.com Polymorphismus -> keine, normale, hohe Aktivität - Variation 10k-fach zwischen Individuen - „Poor metabolizer PM“ ohne Enzymaktivität - „extensive Metabolizer EM“ mit Enzymaktivität - Kaukasier: 8% PM – Entdeckt mit Spartein und Debrisoquin Folgen des Polymorphismus für den Arzneistoffwechsel siehe Aktories... – inzwischen über 60 cyp2d6 mutationen bekannt wir messen dextromethorphan und dextrorphan (metabolit), bestimmen Metabolic ratio = Konz DEX / Konz DOR log MR Urin05/321 : EM wir ham zwei poor und einen superextensiven Arzneistoffe, die von cyp2d6 metabolisiert werden beta-blocker (alprenolol, bufuralol, metoprolol, propranolol, Timolol), antiarrhytmika (Encainid, Flecainid,,,), tricyclische antidepressiva (amitryptilin, Clomipramin,...) , serotonin-reuptake-hemmer (Fluoxetin....), neuroleptika(Haloperidol, ...) nebenwirkungen von tricyclischen Antidepressiva Akute Nebenwirkungen Störungen der Funktion des vegetativen Systems: – trockenheit der Mund- und Nasenschleimhaut – Blasenentleerungsstörungen – Orthostatische Hypotension – Tachykardie Akute Vergiftung (Suizid) – Krämpfe – Arrhythmien -> tod es gibt Dosisempfehlungen für Antidepressiva für poor metabolizer (von medikament zu medikament unterschiedlich Tamoxifen – kompetitive Hemmung Östrogenrezeptor – Anwendung als Cytostatikum beim Mammakarzinom – in USA: Prävention bei ↑risiko-Personen (20 mg > 50% Reduktion von Tumoren – UW: diverse z.B. hot flashes – Zufall: Paroxat (SRI) – CYP2d6 liefert Metaboliten in geringen Mengen, der für hot flashes verantwortlich ist (interessant: bei poor metabolizern waren nebenwirkungen geringer Zusammenfassung – Untesrchiede in der enzymaktivität sind genetsich beidngt. Mutationen in den verantwortlichen genen führen zu keiner , herbabgesetzter oder extrem hoher enzymaktivität verlgichen mit dem wildtyp 22 / 75 rechtenwald.com – – – – die konsequenzen sind unterschiedliche blutspiegel. Bei kleiner therapeutischer breite eines arzenistoffes können bei den betroffenen individuen deshalb nebewnirkungen oder gar kein effekt auftreten zur phänotypisierung wird eine „probe drug“ eingenommen und die konzentration der ausgangssubstanz und des metaboliten gemessen. Zur bestimmung der individuellen metabolischen leistung wird der „metabolic ration“ mr berechnet. Er ist das verhältnis der konzentrationen oder mengen von arzneistoff zu metabolit in der europäischen bevölkerung: poor metabolizer 8% ultrarapid metabolizer ca 1-2% extensive metabolizer restliche 90% klinisch relevant sidn vor allem tricylclische Antidepressiva Antiarrhytmika genetsiche polymophismen des fremdstoffmetabolismus phase I. Cyp2d6, cyp2c19, cyp2c9, cyp2b6, cy3a5, mikr. Epoxidhydrolase, fmo3, alkohol/aldehyddh phase II: GSTM1, GSTT1, GSTP1, UGT1A1, NAT2 phase III: mdr-1 (multi drug resistance or p-glykoprotein) OATPS (organic anion transporters) Aldehyd-Dehydrogenase – ALDH2-Isoenzym – bei asiaten inaktiv – acetaldehy-syndrom bereits bei Konsum kleiner Alkoholmengen kommt es zu uangenehmen Erscheinungen wie Hautrötung, Kopfschmerzen, Kältegefühl in den Extremitäten und Übelkeit, oft auch HerzKreislauf-Beschwerden – Antabus ® – Disulfiram (Tetraethylthiuramdisulfid) – Blockierung des Enzyms Acetaldehyddehydrogenase noch n Beispiel: Glucose-6-phosphat-Dehydrogenase-Mangel (Favismus) – Häufigkeit Farbige, Inder, mediterrane Bevölkerung : 10% – Nebenwirkugnen Methämoglobin, Hämolyse – Verursachende Arzneimittel Sulfonamide, Antimalariamittel,... Hämolyse dadurch über Interaktion mit Glutathion-Reduktase (durch NADp/h) -> Aufbrechen von Disulfidbrücken vermindert -> Gefahr Hämolyse thiopurin s-methyltransferase medikamente: azathioprin (schwere leukopenien, teils letaler ausgang; beschrieben bei den langsamen metabolisierern) dihydropyrimidin-dehydrogenase medikament: 5-fluorouracil (schwere teils letale toxizität bei trägern des enzymmangels 23 / 75 rechtenwald.com Zusammenfassung: Variabilität des Fremdstoffmetabolismus – genetische polymorphismen – geschlecht – inhibition kompetitiv (substrat(produkt) irreversibel (suizidhemmung) – induktion – alter – physiologische veränderungen (z.B. hepatitis , cholestase , tumor ) – ? Antibiotika im Ggs zu anderen Arzneimitteln sind alle Pharmakodynamischen Wirkungen (auf Patienten / menshcliche Zellen) im Prinzip unerwünscht Wichtig ist die Wirkung auf den Erreger! Wir haben's also mit 3, nicht wie sonst mit 2 Entitäten zu tun (AB – Patient – Erreger) Unterschiede Bakterien – Mensch p-Amino-Benzöe-Säure -> Dihydrofolsäure -> Tetrahydrofolsäure Zellwand (gram+,-) DNA und RNA- Verwertung z.B. Ribosomengröße Penicilline alle gegen grampositive Bakterien, gramnegative Kokken, Spirochäten und Borellien Unterschiedliche Subgruppen mit präferentieller Erweiterung des Keimspektrums – Benzylpenicillin (Penicillin G) – Phenoxypenicillin (Penicillin V) – magensäurestabil, oral applizierbar – Aminopenicilline (Ampicillin, Amoxicillin) (iv, oral) – Acylaminopenicilline (Piperacillin) (stark richtung gramnegative, auch gegen Pseudomonas) – Isoxazolylpenicilline (Flucloxacillin) („Staphylokokkenpenicillin“) Zeichnung: Penicillingrundstruktur, der beta-Laktam-Ring! usw Die unterschiedlichen Gruppen unterschieden sich nur in einem Restsubstituenten Angriffspunkt Bakterienwand Penicillin W: Hemmung der Peptidoglykansynthese K: kleines Verteilungsvolumen (nur extrazellulär), meist renale Elimination (30min-1h) UAW: Allergien, neurotoxische Reaktionen, Durchfall und Exantheme (Aminopenicilline), cholestatische Hepatitis (Flucloxacillin) – aber kaum Überdosierungsprobleme („20g werden schon vertragen“) KI: Penicillinallergie Unterstützung der Antibiose: Beta-Lactamase-Hemmer – Clauvulansäure (+Amoxicillin) (GI-Nebenwirkungen häufig bis zum cholestatischen Ikterus, wird nur noch selten angewandt) – Sulbactam (+Ampicillin) – Tazobactam (+Piperacillin) (Reservekombination bei schweren, resistenten Infektionen) Typische Lobärpneumonie 24 / 75 rechtenwald.com – – Erreger: Pneumokokken >> H. Influenzae > Klebsiellen (evtl auch Moraxella, Legionellen...) Therapie: 1. Wahl Cefuroxim für 3 Tage i.v. Gefolgt von Cefuroximaxetil p.o. Für 10 Tage plus Clarithromycin oder Azithromycin 2. Wahl Gruppe 4-Fluorchinolone (Moxi- oder Gatifloxacin) Cephalosporine Gruppe Parenteral Oral 1 (Basis-C.) Cefazolin Cefachlor 2 (intermediär-C.) Cefuroxim Cefuroximaxetil 3 (Breitspektrum-C.) A: Cefotaxim, Ceftriaxon B: Ceftazidim (ebenfalls vs Pseudomonas) Cefibuten 4 (Pseudomonaden-C.) Cefsulodin 5 (Anaerobier-C.) Cefoxitim Nicht wirksam gegen Staphylokokken, die gegen Penicillin resistent sind, gegen Enterokokken („Enterokokkenlücke“), atypische Bakterien Atypische (interstitielle) Pneumonie – Erreger: Mykoplasmen > Chlamydien > Legionellen – Therapie: 1. Wahl - Makrolide 2. Wahl - Doxycylin oder Gruppe 4-Fluorchinolone Makrolide S: Erythromycin, Clarithromycin, Roxithromycin, Azithromycin W: Hemmung der 50S-Ribosom-Untereinheit K: Substanzabhängig orale BV abhängig von Nahrungsaufnahme UAW: kolikartige Bauchschmerzen, cholestatische Hepatitis, Hörstörungen, long QT-syndrom, Cyp3a4-Hemmung KI: Stillzeit, Allergie, Gaben von QT-verlängernden Stoffen I: u.a. Infktion mit atypischen Erregern, Penicilinallergie, Erythromycin Bronchopenumonie – Erreger: häufig Mischinfektion aus Pneumokokken und H.influenzae – Therapie: Sultamicillin (fixe Kombi aus beta-Lactamase-Hemmer und Aminopenicillin oder orales Gruppe 2-Cephalosporin oder Gruppe 4-Fluorchinolon p.o. 25 / 75 rechtenwald.com Pyelonephritis (HWI) – Keimzahlbestimmung, Urinkultur, Antibiogramm – erst kalkulierte antibiotische Behandlung Amoxicillin oder Co-Trimoxazol oder Levofloxacin – dann gezielte Therapie (nach Antibiogramm) Co-Trimoxazol S: Sulfonamid + Trimethoprim W: Hemmung der Folsäure-Synthese K: BV>90% für beide Substanzen UAW: GI-Störungen, allergische Reaktionen, Hämatotoxizität KI: Überempfindlichkeit, Gravidität, Früh- und Neugeborene I: Harnwegsinfekt (unkompliziert: auch Trimethoprim allein) Prophylaxe gegen Penumocystis carinii-Infektionen Fluorchinolone – Gruppeneinteilung 1. Harnwegsinfekte (Norfloxacin) 2. Infektionen mit gramnegativen Keimen (Ofloxacin, Ciprofloxacin) 3. zusätzliche Aktivität gegen grampositive und atypische Erreger (Levofloxacin) 4. zusätzliche Aktivität gegen grampositive und atypische Erreger sowie Anaerobier (Moxifloxacin – nicht bei HWI da keine renale Ausscheidung, Gatifloxacin) Gruppe 3+4 gut bei AWI 2 gut bei nosokomialen Infektionen Fluorchinolone W Hemmung der bakteriellen Topoisomerasen K BV: Norfloxacin 30-40%, andere >70% ausser Moxifloxacin grossteils unverändert renal mehrwertige Ionen reduzieren BV bis 90%! (Vorsicht Milchprodukte, Eisen, u.a. -> getrennt von Mahlzeiten einnehmen) UAW GI-Störungen, Photodermatosen, ZNS-Störungen, Knorpel- und Wachstumsstörungen, hepatotoxisch, kardiotoxisch, Sehnenentzündungen und -rupturen KI Schwangerschaft, Stillzeit, Wachstumsphase, ZNS-Erkrankungen Zeit- und konzentrationsabhängige Wirkung von Antibiotika früher war Ziel möglichst lange über der MHK zu bleiben (z.B. Penicilline) neuer: möglichst hohe Dosis kurzzeitig – Kp(max) (z.B. Fluorchinolone, Aminoglykoside)- so vermeidet man auch v.a. Durch Wirkdauer auftretende UAWs postantibiotischer Effekt: Bakterium wird noch weiter geschädigt selbst wenn Antibiotikum aus Blut entfernt wird... Bakterielle Meningitis 26 / 75 rechtenwald.com Ätiologie Empirische AB-Therapie (sofort oder <30min) Neugeborene (<3 Mo) B-Streptokokken Listeria monocytogenes gram—Darmbakterien Cefotaxim + Ampicillin + Gentamycin Kinder 3 Mo-5a Pneumokokken Meningokokken Haemophilus influenzae Ceftriaxon (evtl. + Dexamethason) Kinder > 5a Pneumokokken Meningokokken Ceftriaxon (evtl. + Dexamethason) Borelliose Therapie Stadium 1 Lokalinfektion, Tage bis Wochen nach Biss Doxycylin, Amoxicillin oder Cefuroximaxetil Stadium 2 dissemenierte Infektion (Wochen bis Monate) Ceftriaxon Stadium 3 persistierende Infektion (Monate bis Jahre) Doxycylin Tetrazykline S Doxycylin W Hemmung der 70S-Ribosom-Untereinheit K BV > 90%, abhängig von Nahrung (Chelatbildung) UAW Durchfall, Übelkeit, hepatotoxische, photo- und immunallergische Reaktionen, Ablagerungen in Zähnen und Knochen KI Schwangerschaft, Kinder < 12a I Infektion mit atypischen Erregern Borreliose, nicht-gonorrhiosche Urethritis Akne (½ Dosis), Brucellose(+Rifampicin), Pest Fragen 1. Antibiotika-assoziierter Durchfall 2. Antibiotika-Gabe in der Schwangerschaft 3. sinnvolle Gründe für AB-Kombinationen 4. nosokomiale Infektionen 5. Wie behandeln Sie einen grippalen Infekt? 27 / 75 rechtenwald.com Antibiotika und Durchfall Antibiotika-assoziierte Diarrhoe (AAD) Def: 3 weiche oder flüssige stühle / tag auftreten wenige stunden bis 2 monate nach antibiotika-einnahme häufigkeit häufigste nebenwirkung von antibiotika (5-25%) ursachen – kohlenhydrat-metabolismus – verminderter gallensäuremetabolismus – direkte antibiotika-effekte auf motilität und schleimhäute (erythromycin bindet an motilin-rezeptoren und bewirkt kontraktionen von magen und duodenum, beschleunigte magenentleerung und funktionelle diarrhoe, clavulansäure bewirkt auch motilitätssteigerung des dünndarms) bei Chlostridium difficile: pseudomembranöse Enterokolitis, toxinvermittelt Symptome können noch lange nach absetzen der Therapie auftreten Behandlung von Infektionen mit Clostridium difficile – Absetzen des Antibiotikums – Behandlung der Diarrhoe – Antibiotikagabe: Metronidazol , Vancomycin – Colestyramin zur Absorption des Toxins – Repopulation des Darms mit Mikroorganismen / Probiotika (z.B. Saccharomyces boulardii) – bei rückfallhafter schwerer Infektion: Infusion durch Kolonskopie aller Bakterien eines gesunden Spenders (aus dem Stuhl isoliert) Antibiotika in der Schwangerschaft Allgemeine Hinweise Spiegel sind niedriger wegen : Zunahme des Gesamtkörperwassers, ansteig des scheinbaren verteilungsvolumens , anstieg der glomerulären filtrationsrate und renale exkretion von vielen antibiotika evtl serumspiegelkontrolle bei schwangeren Kontraindiziert – chlorampenicol: embryotoxisch/ teratogen im tierversuch.. – gyrasehemmer: schädigung des gelenkknorpelwachstums (mitochondrienstoffwechsel bakterienstoffwechsel recht ähnlich...) – tetracycline: zahnverfärbungen, schmelzdefekte, verzögerung des knochenwachstums (ab 4. monat) – aminoglykoside: embryotoxisch/teratogen (1.tm), fetotoxisch (2+3.tm), ototoxisch – gentamycin: nur bei vitaler indikation z.b.. pyelonephritis – wenig erfahrung aber im Tierversuch nicht embryotoxisch/teratogen: ampicillin/sulbactam clindamycin aztreonam – rifampicin: k.i. 1. tm (aber: tuberkulose-therapie grundsätzlich möglich), im 3. tm: risiko von postnatalen blutungen bei mutter & kind 28 / 75 rechtenwald.com – – nitrofuration: k.i. In den letzten wochen: gefahr hämolytischer anämie des neugeborenen bei G6phosphat-mmangel, potentiell mutagen ... aber in USA empfohlen bei wiederkehrender Cystitis Vancomycin: parenterale Therapie k.i., oral möglich Was kann man geben? – Penicilline – Cephalosporine – Erythromycin Häufige Infektionen in der Schwangerschaft HWIs – Häufigkeit 2-8%, 20-30% entwickeln pyelonephritis – prädisposition: veränderungen, die zu temporärer obstruktion des harneliters führen, veränderung der immunantwort (partielle immunsuppression) – gefahr: frühgeburt, erhöhte neugeborenen-letalität, die durch antibiotika-gabe gesenkt werden kann cystitis: 3-7 tage amoxicillin + BLI, cephalosporin (gr2+3 cefuroxim, cetriaxon), nitrofuratoin (screening auf asymptomatische bakteriurie im 1. trimenon + behandlung akute pyelonephritis: stationäre behandlung (parenterale antibiotikagabe: cephalosporin z.b. ceftriaxon oder erweitertes spektrum-penicillin) Sinnvolle Gründe für eine AB-Kombination siehe Billy-Blatt – Empfindlichkeitserhöhung für beta-Lactamase-bildende Keime beta-lactam-antibiotikum + beta-lactamase-hemmstoff: clavulansäure und amoxicillin, clavulansäure/ticarcillin, sulbactam/ampicillin; tazobactam/piperacillin – verhinderung der resistenzentwicklung tuberkulose pseudomonas-infektion: induktion von beta-lactamase ampc durch beta-lactam-ab, die nicht durch clavulansäure hemmbar ist; deshalb kombination ceftazidim+tobramycin, piperacillin+ciprofloxacin – bei Mischinfektionen Cephalosporin + Metronidazol (Aerobier / Anaerobier z.B. Peritonitis) Synergie: 1. Blockade von sequentiellen Schritten in der synthese der folsäure (trimethoprim, sulfamethoxazol bakterizid) 2. blockade von sequentiellen Schritten in der Proteinsynthese quinupristin / dalfopristin (kombination bakterizid anstelle bakteriostatisch; streptogramine bei grampositiven problemkeimen z.b. e. Faecium; dalfopristin bindet an 50S ribosomen und inhibiert elongation ; quinopristin inhibiert extension und führt zu freisetzung von unvollständigen proteinketten) 3. ein antibiotikum verstärkt die penetration eines anderen penicillin und aminoglykoside z.B. ampicillin / gentamycin gegen viele entekokken (endocarditis); cephalosporine und aminogylkoside gegen klebsiella pneumoniae; ticarcillin oder piperacillin und aminoglykoside gegen pseudomonas und andere gramnegative organismen 4. verhinderung des abbaus: imipenem / cilastatin breite empirische initialtherapie: meropenem + vancomycin 29 / 75 rechtenwald.com Nachteile / nicht-sinnvolle ab-kombinationen – größeres risiko einer überempfindlichkeitsreaktion und / oder erhöhung der toxizität – sich entwickelnde resistenzen sind schwieriger zu behandeln – möglichkeit des antagonismus: tetracyclin/penicillin bei pneumokokken meningitis: mortalität 79% versus 30% für penicillin (arch. Intern. Med. 1951) Antibiotika-Kombinationstherapie vermindert die Mortalität bei schwerstkranken Patienten mit Pneumokokken- Pneumonie Nosokomiale Infektionen ca 5% aller akut behandelten Krankenhauspatienten (USA: > 2 Mio, 8800 Todesfälle / Jahr 1995 Organmanifestation Organ Häufigkeit HwI (Katheter) 34,00% Blut (i.v. Katheter) 14,00% Untere Atemwege (intubation, beatmungsgerät..) 13% (sterblichkeit 30%) Operationswunden-infektionen 17,00% Andere (z.b. GI, haut, .. 21,00% Wichtige antibiotika-resistente Problemkeime (in .de) erweitertes spektrum-beta-lactamase (ESBL-)produzierende Enterobacteriaceae (blaTEM, blaSHV) 1-6% Vancomycin-resistenter Enterococcus faecium (VRE) 7% Methicillin – resistenter staph. Aureus (MRSA) 11,8% SARI: surveillance der antibiotika-anwendung und der bakteriellen resistenzen auf intensivstationen : veröffentlicht jedes jahr zahlen (check the net) Wie behandelt man einen grippalen Infekt? Antibiotikagabe ist bei virusinfektionen nicht sinnvoll 70% viral bedingt, 3,5% bakteriell, 25% unklare ätiologie Realität: die meisten antibiotika-verschreibungen im ambulanten bereich sind für akute infektionen der atemwege/grippale infekte gründe für die vermeidung von unnötigem antibiotika-gebrauch: – exzessiver antibiotikagebrauch führt zur entstehung und verbreitung von resistenten keimen – voraugehender antibiotika-gebrauch (beta-lactam-ab) ist ein wichtiger risikofaktor für die infektion mit antibiotika-resistenten s. Pneumoniae – direkte risiken einer unnötigen antibiotikagabe: allergien, superinfektionen, durchfall, arzneimittelinteraktionen – riesige kosten: 1,3 mrd $ für inf. d. Atemwege (usa 1998) 30 / 75 rechtenwald.com Asthma Bild: Röntgen: Deutlich erhöhte Lungentransparenz Atemnot, idR unproduktiver Hustenanfall v.a. Bei Kindern gute Prognose idR nicht progrediente Verschlechterung wichtigste Basistherapie ist antientzündlich, nicht Bronchodilatation (diese ist symptomatisch, ändert aber nichts am Krankheitsverlauf) Pathophysiologie Allergene (extrinsic Asthma) 10% Staub, Kälte, Anstrengung/Hyperventilation, SO2, Ozon, Aspirin (intrinsic Asthma) 10% Mischform 80% -> Leukozytenaktivierung: Entzündung -> -> Histamin, Bradykinin -> Leukotrienen Bronchokonstriktion Schleimhautödem Sympathikus -> β2AR -> cAMP -> Bronchodilatation Parasympathikus -> mAChR -> Ca2+ -> Bronchokonstriktion β2-Rezeptoragonisten – Stoffe Kurzwirksam: Terbutalin, Salbutamol, (Fenoterol) -> akuter Asthmaanfall Langwirksam: Formoterol, Salmeterol -> vorteile Dauertherapie Sonderfall: Clenbuterol (klinisch irrelevant) -> Leistungssport -> Muskelvermehrung – Wirkmechanismus Bronchodilatation freisetzungshemmung von Entzündungsmediatoren Aktivierung der mukoziliären Clearance – Pharmakokinetik Kurzwirksam: Wirkdauer wenige h Langwirksam: 12h – UWi Kardial: Tachykardie, Arrhythmien Muskulär: Tremor Zentralnervös: Unruhe, Angst – Therapie Alle Asthmapatienten sollten kurzwirksame beta2-Rezeptroagonisten als Bedarfsmedikation verwenden bei schwerem Asthma auch langwirksame beta2-Rezeptoragonisten Keine Anwendung von Salmeterol im akuten Asthmaanfall! Beta2-vermittelte Bronchodilatation mAChR -> Gq -> PLC -> IP3 -> Ca2+ -> CaM -> Myosinleichtkettenkinase -> Phosphorylierung von Myosinleichtketten -> Kontraktion Leukotriene wirken an Lunge über selben Signalweg! 31 / 75 rechtenwald.com beta2AR -> Gs -> cAMP -> PKA -> Phosphorylierung Myosinleichtkettenkinase (Inaktiviert diese) Glucocorticoide – Stoffe Glucocorticoide Potenz Bvoral (%) Cortisol 1 Prednisolon 4 T1/2 85 Tagesdosis 3 60-120 mg p.o. Dexamethason 30 3,5 Beclomethason 19000 30 2 0,1-04 mg Budesonid 31000 10 2 0,2-1,6 mg Fluticason 93000 1* 14 0,5-2 Möglichst niedrige Bioverfügbarkeit wegen hohem Verschluckprozent! Cushing-Schwelle: 2,5-10 mg Prednisolon bzw. Äquivalent (Problem der Negativen Rückkopplung auf Hypothalamus/Hypophyse die dann endogene Cortisolsynthese hemmt) * jedoch sehr lipophil mit .rel. Hoher systemischer BV und Cortisolsuppresion schon bei normalen Dosen p.i. – Wirkmechanismus Antiphlogistisch (Hemmung von Sofort- und Spätreaktion) Verstärkte Expression von beta2-adrenergen Rezeptoren – Pharmakokinetik s.o. – UWi Lokal: orale Candidiasis, Heiserkeit (Myopathie M.vocale) (dagegen Mundhygiene: Spülen nach Applikation) Systemisch (bei Budesonid > 800 yg/d p.i.): - Nebennierenrindenfunktion ↓ - Osteoporose (über katabole Wirkung) - Hautatrophie - Katarakt Wachstumsverzögerung bei Kindern – Therapie Niedrigdosiert per inhalationem bereits bei leichtem Asthma (Ausnahme: Kinder) Oral bei schwerem Asthma Wirkmechanismus glucocorticoide Glucocorticoide wirken auf Leukozytenaktivierung / Entzündung Glucocorticoidrezeptor wird internalisiert, bindet als Dimer an GRE (Glucocorticoid-Responsive Element) -> Transkriptionsregulation (sowohl positiv – z.B. NF-kappab - als auch negativ – z.B. COX. LipOX, PLA2) dazu noch nichtgenomische Effekte: z.B. PI3Kinase... (kardiovaskuläre protektive Wirkung) Mastzellstabilisatoren – Stoffe Cromoglicinsäure-DiNa 32 / 75 rechtenwald.com – – – – Nedocromil Wirkmechanismus Freisetzungshemmung von Entzündungsmediatoren („Mastzellstabilisatoren“) Besonders wirksam bei allergischem Asthma Schwächer anti-inflammatorisch als Glucocorticoide Pharmakokinetik keine systemische Resorption (aromatische Carbonsäuren) Applikation bei Kindern < 5 Jahre schwierig UWi Husten (5%, nach Pulverinhalation) Dermatitis, Myositis, Gastroenteritis (2%) Therapie Prävention insbesondere von allergischem Asthma Anwendung v.a. Bei Kindern: zur Reduktion / Obsoletisierung der Glucocorticoiddosis keine Anwendung im akuten Asthmaanfall Leukotrienrezeptor-antagonisten – Stoffe Montelukast (Singulair®) u.a. – Wirkmechanismus Kompetitiver Antagonist an Leukotrienrezeptoren (LTC4, LTD4, LTE4) - Bronchospasmolyyse - Antiphlogistisch – Pharmakokinetik Orale BV 70%, t ½ 4,5 h – UWi Kopfschmerzen, Schwindel Fieber Abdominalschmerzen – Therapie Zugelassen für „Pat. Mit mildem bis mäßigem Asthma, die mit Betamimetika und inhalierten Kortikosteroiden nicht auskommen“ (4-10 mg p.o. Abends als Zusatztherapie zu GC) Kaum Wirksamkeitsbelege Theophyllin – Stoffe Reines Theophyllin (Theophyllinderivate ... nur Nachteile) – Wirkmechanismus Blockade von Adenosinrezeptoren Hemmung von Phosphodiesterasen (PDE3/4) -> Bronchodilatation, antiphlogistisch, mukoziliäre Clearance ↑ – Pharmakokinetik BV gut, t1/2 3-24h (je nach CYPs) Plasma-Konz: 5-15 mg therapeutisch, 20mg toxisch Spiegel Messen! – UWi Herz: Arrhythmien ZNS: Schlafstörungen, Tremor, Krämpfe GIT: Übelkeit, Erbrechen, Reflux – Therapie Asthmaanfall: 300-400 mg p.o. Oder i.v. (keine Inhalation möglich...) 33 / 75 rechtenwald.com Langzeittherapie mit 200-400 mg starten, nach 2-3 d Erhöhung auf 500-850 mg/d – Blutspiegelbestimmungen Langzeit bei COPD 34 / 75 rechtenwald.com Stufentherapie des Asthma bronchiale Symptome Nacht FEV1 Akut Dauermedikation 1 < 2/wo <2/mo >80% keine 2 >2/wo >2/mo >80% 3 Tägl. >1/wo 61-79% Beta-Mimetika (max 4 mal täglich) Tag Medikation 4 ständig häufig <60% Corticoide p.i. (niedrig) oder cromone p.i. (Kinder) Corticoide p.i. (mittel) langwirkendes beta-Mimetikum p.i. (oder Theophyllin oder Montelukast) Corticoide p.i. (↑) + p.o. Langwirkendes beta-Mimetikum p.i. (oder Theophyllin) Wenn > 3 Mo stabil, eine Stufe zurückgehen Therapie eines leichten Asthmaanfalls Atemfrequenz unter 25/min , Herzfrequenz unter 120/min, normales Sprechen ist noch möglich – Kurzwirksamer beta2-Agonist inhalativ (2 Hübe, ggf. alle 10min wiederholen) – Prednisolon 50 mg i.v. – Theophyllin 200 mg oral Akuttherapie eines Status Asthmaticus Atemfrequenz > 25/min , HF > 120/min, Sprechen kaum möglich, Notfalleinweisung, sitzender Transport, O2 per Nasensonde – Prenisolon 125-250 mg i.v. Alle 4-6 h – Kurzwirksamer beta2-Agonist inhalativ (4 Hübe, vorangegangene Therapie berücksichtigen!) – Theophyllin 200 mg langsam i.v. (intravenöser beta-Agonist nur bei jüngeren Pat. Unter EKG-Kontrolle) – Beatmung/endoskopische Absaugung bei schwerer respiratorischer Insuffizienz (pO2 < 50/pCO2 > 55) 35 / 75 rechtenwald.com COPD 90% Dauerraucher, „selbstgemacht“, brutale Zunahme Differentialdiagnose Asthma-COPD Asthma bronchiale COPD Alter Kinder, Jugendliche Erw.>40J. Ursachen Allergene, Trigger Exogene Noxen (90% Rauchen, Stäube) Atemnot In Ruhe Bei Belastung Auftreten Anfallsweise Dauernd Komplikationen Status asthmaticus Emphysem, Cor pulmonale, Pneumonie, Bronchiektasen Therapie Beta2-Mimetika, Corticoide, Cromoglykat, Theophyllin Tiotropium IdR stagnativ oder sogar limitiert Grundsätzlich progredient Stadium FEV1 Symptomatik Pph I >80% Husten, Auswurf Mukoziläre Insuffizienz IIA 50-80% Dyspnoe bei größerer Belastugn Schleimsekretion / lymphozytäre Infiltration IIB 30-50% Dyspnoe bei leichter Belastung III <30% Obstrukt. Emphysem, Atrophie der Resp. Insuffizienz, Cor Bronchialschleimhaut pulmonale mit exspirator. Kollaps Raucher verlieren pro Jahr ca. 60-200 ml FEV1 pro Jahr Nichtraucher verlieren 25 ml FEV1 pro Jahr Bei FEV1 = 1 l beträgt die 5-Jahres-Überlebensrate 50% Therapie der COPD Anticholinergika Ipratropiumbromid p.i. , Tiotropium p.i. Beta2-Agonisten p.i. Theophyllin Falls beta2-Agonisten nicht ausreichend wirksam sind, Dauertherapie nur bei Wirksamkeitsnachweis (Auslassversuch) Glucocorticoide Besserung nur bei 10-15% der Pat. (asthmatische Komponente) -> Therapieversuch unter spirometrischer Kontrolle 36 / 75 rechtenwald.com Anticholinergika Ipratropiumbromid p.i. , Tiotropium p.i. Expektoranzien – dafür gibt's keine Grund! Keinerlei Wirksamkeitsnachweis Ambroxol, Bromhexin, Azetylcystein Muskarinrezeptor-Antagonisten – Stoffe Ipratropium, Tiotropium – Wirkmechanismus Antagonismus an muskarinischen Acetylcholinrezeptoren – Pharmakokinetik Applikation p.i. Ipratropium: t ½ 3 h -> Wirkdauer 4-6h Tiotropium : t ½ 5d -> Wirkdauer > 24h – UWi parasympatholytisch: Mundtrockenheit ZNS: Kopfschmerzen Vorsicht bei: Engwinkelglaukom, Miktionsstörungen – Therapie wirken vorbeugend und nicht sofort beschwerdelindernd (Wirkeintritt nach 30-60min) 37 / 75 rechtenwald.com Fragen Glucocorticoide – Erläutern sie den Begriff „Cushing-Schwelle“ Cushing-Schwelle: 2,5-10 mg Prednisolon bzw. Äquivalent (Problem der Negativen Rückkopplung auf Hypothalamus/Hypophyse die dann endogene Cortisolsynthese hemmt) – Können Corticoide, die unterhalb der Schwelle dosiert werden, pharmakologische Effekte oder Nebenwirkungen auslösen? Weshalb? Beides. Die Schwelle gilt als obere Standardgrenze für die Dosis, demzufolge werden da↓ i.d.R die erwünschten pharmakologischen Effekte bereits erreicht. Nebenwirkungen können auch bei wesentlich niedrigeren Dosierungen auftreten, da die CushingSchwelle eine davon unabhängige Größe ist, die sich auf den Cortisolproduktionssuppressionseffekt bezieht. Andere Nebenwirkungen sind u.a. die unterdrückung gewünschter Gewebeheilungsvorgänge und eine gesteigerte Anfälligkeit für Mikrobiologische Erreger, Nebennierenrindenfunktion ↓, Osteoporose (über katabole Wirkung und Vitamin D3-Antagonismus), Hautatrophie, Katarakt, Wachstumsverzögerung bei Kindern (Störung Wachstumshormonbildung) bei Inhalation Heiserkeit und orale Candidiasis Beta-Mimetika – Welche Indikationen haben kurz- bzw. langwirkende Beta2-Mimetika? Bronchodilatation, Hemmung der Mastzelldegranulation und erhöhte mukoziliäre Clearance Alle Asthmapatienten sollten kurzwirksame beta2-Rezeptoragonisten als Bedarfsmedikation verwenden bei schwerem Asthma auch langwirksame beta2-Rezeptoragonisten bei COPD langwirksame p.i.; kurzwirksame bei auftretenden Asthmaanfällen – Weshalb sind beim Asthma-Anfall beta2-Mimetika indiziert, beim anaphylaktischen Schock aber Adrenalin? Asthma-Anfall: akute Verlegung d. Atemwege mit Bronchospasmus → β 2-Mimetika zur Bronchodilation Anaphylaktischer Schock: allerg. Rkt. I → Volumenmangel durch generalisierte Vasodilation, Brocnhospasmus; Indikation für Adrenalin (→ β1-Rzpt.): Vaskokonstriktion + Bronchodilation; β2-MIMETIKA NICHT KONTRAINDIZIERT: als Spray o. i.v. bei Bronchospasmus Standardmedikation: Adrenalin, 250mg-1g Prednisolon, Volumen Substitution durch i.v. Infusion einer Elektrolylösung – Die systemische gabe von beta2-mimetika würde zur vasodilatation führen, welche nicht erwünscht wäre. Ausserdem würden die wichtigen beta1-wirkungen auf das herz sowie die alpha1-vermittelte vasokonstriktion fehlen Welche therapeutische Bedeutung hat die beta2/beta1-Selektivität der beta-Mimetika? die β-Rezeptoren haben unterschiedliche Funktionen: z.B. β1 am Herz → pos. chrono-, ino- & bathmotrop, an den Gefäßen → Konstriktion; β2 an Bronchien → Dilation, an Koronar-Pulmonalarterien → Dilation → große Bedeutung für Therapie, da so viel gezielter u. selektiver behandelt werden kann Bei gabe von beta2-selektiven mimetika werden Wirkungen auf das herz weitestgehend vermieden. – – – Diskutieren sie Gründe, weshalb Theophyllin erst bei der Stufe3 des Asthma indiziert ist teuer schwierige Dosierung, ständige Blutspiegelbestimmungen notwendig beta2-mimetika + Glucocorticoide haben höhere Wirkstärke Nennen sie sinnvolle / nicht-sinnvolle Kombinationen von Anti-Asthmatika sinnvoll: Corticoide p.i. (mittel) + Theophyllin / oder beta-Mimetikum / oder Montelukast nicht sinnvoll: beta-Mimetikum und Theophyllin und Montelukast Anticholinergika: nur im Spezialfall vagus induzierten Asthmas für welche atemwegserkrankungen werden antihistaminika eingesetzt ? Als Antiallergika, sie vermitteln u.a. Bronchokonstriktion (H1-Antihistaminika der 1. Generation wie Bamipin, Clemastin, Dimetinden) diejenigen der 2. Generation wirken nicht mehr auf das ZNS (u.a. Cetirizin, Loratadin) 38 / 75 rechtenwald.com Attacke auf den Heuschnupfen 39 / 75 rechtenwald.com Diabetes Mellitus Anamnestische Indikatoren sind ja bekannt.... aber osmotische Diurese Sehstörungen , die kommen und gehen (inkonstant ) -> spricht sehr für Typ I Labo↓suchungen – nüchtern-BZ – urin glukose/ketonkörper – HbA1c – lipidstatus – nüchtern-insulin/c-peptid – auto-ak (90% positiv: insulin, GAD, Tyrosinphosphatase IA-2, Inselzellantigene) – (OGTT) Diagnose ?? DD?? Typ 1 D.m.; maligne Systemerkrankung Zusatzuntersuchungen? Spätsyndrom-Bestandsaufnahme (Funduskopie, Albuminurie, ggf. CreaClearance, neurologische Untersuchung – Vibration!, Fussuntersuchung) Diagnosekriterien 1. Klinische symptome und Zeitpunktsunabhängige plasmaglucose von > 200 mg/dl (180 mg/dl Vollblut) oder 2. nüchtern plasmaglucose > 126 (110 mg/dl Vollblut) oder 3. 2h-plasmaglucose > 200 im OGTT diagnosekriterien der gestörten glucosehomöstase – impaired fasting glucose (IFG) nüchtern plasmaglucose >110 / < 126 – impaired glucose tolerance (IGT) „gestörte glukosetoleranz“ 2h plasmaglucose > 140 / < 200 wichtig – hier kann durch Lebensumstellung am meisten erreicht werden – oft eine Normalisierung der Werte – normale nüchternglucose, normale glucosetoleranz nüchtern plasmaglucose <110 2h-plasmaglucose < 140 Ätiologische Klassifikation (nach ADA 1997) I. typ 1 diabetes (beta -Zelldestruktion, absoluter Insulinmangel) a. immunvermittelt b. Idiopathisch II. Typ 2 diabetes (Insulinresistenz und sekretionsdefizit) III.„typ3“ (andere spezifische typen) Klassifikation nach klinischem Schweregrad (WHO 2000) v.a. Nach Insulinbedarf IGT impaired glucose tolerance NIR non insulin requiring(typ2 frühstadium) IRC insulin requiring for control (typ2) 40 / 75 rechtenwald.com IRS insulin requiring for survival (typ 1 und spätstadium typ 2) NIDDM und IDDM sind obsolet!!! blabla insulinregulation insulin-signaltransduktion bilder gibt's im buch Therapie D.m. Typ 1: Humanes Insulin und Analoga präproinsulin u.a. bla blabla Insulinanaloga – Unterschied zum humanen Insulin? Variieren davon nur in ihren kinetischen Eigenschaften, Wirkungen am Insulinrezeptor sind alle Lys-Pro-Insulin Destabilisierung des Insulin-Hexamers durch Austausch von Lys und Prolin neigung zur Hexamerbildung beim Isoelektrischen Punktmaximal Insulin Glargin- Verzögerungsprinzip isoelektrischer Punkt ziemlich nah bei pH der subcutis (pH7,4) lösung in spritze ph4 also bei spritzen hexamerbildung diese dissoziieren dann langsam gelangen fast nur als monomere durch die gefäßwand / zur wirkung Humaninsulin (Alt-Insulin) : Essabstand beachten – ca ½ h bis Wirkungseintritt erhebliche individuelle Unterschiede – Kernkompetenz des Diabetikers – sich selbst kennenlernen Nachts besonders schwierig zu kontrollieren dawn – phänomen: vermehrter insulinbedarf in den frühen morgenstunden sie brauchen unbedingt den nächtlichen blutzuckergehalt um die therapie darauf abzustimmen ui ui neuentwicklung: levemir (insulin detemir ® ) -> Albumingebunden, dissoziiert recht konstant ab, hat ebenso wie glargin (lantus ® ) gute lange plateauwirkung Insulinanaloga – Humaninsulin und herkömmliche Basalinsuline sind weiterhin Therapiestandard – Analoga konnten bisher keine Überlegenheit in Endpunktstudien zeigen – Analoga bleiben sonderindikationen vorbehalten – kurze therapieerfahrung! Abhängigkeit der Wirkdauer des applizierten Insulins: 1. Insulinart (Alt, Basal, Analogon) 2. Injektionsort (Schnell wirksam: Bauchhaut. Basalinsuline: Extremitäten) 3. Konzentration: U100 > U40 4. Dosis 5. Eleminationsgeschwindigkeit: Niere 60% > Leber 40% (cave Niereninsuffizienz) 41 / 75 rechtenwald.com physiologisch 60% präsystemische Elemination, bei s.c. Applikation können keine physiologischen Spiegel in der Leber erreicht werden Konventionelle Insulintherapie (nicht zeitgemäß) fixe mischung aus Basalinsulin + Altinsulin meistens 70/30 injektion morgens + abends, dazu mahlzeiten anpassen schlechte Compliance, ältere Patienten Intensivierte Insulin-Therapie Therapie der Wahl bei Typ 1, Senkung der Spätkomplikationen um 50-75% Trennung von Basalinsulin und Altinsulin bzw kurzwirksames Insulinanalogon Kontrolle Nahrungsunabhängige glucose durch Basalinsulin, nahrungsabhängige durch Altinsulin Basis-Bolus-Prinzip beim Normalinsulin zu berücksichtigen: Faktoren tageszeitenabhängig: morgens ca 2 E/BE, mittags 1 E/BE, abens 1,5 E/BE stichwort postprandiale glucosekontrolle a) bz 2h postprandial möglichst 140 mg/dl b) normaler bz vor der nächsten hauptmahlzeit Faustregel: 1 E normalinsulin senkt den blutzucker um 30-40 mg/dl Therapieprinzipien typ2diabtiker – gewichtsabnahme und allgemeine lebensführung – medikamentöse kardiovaskuläre prophylaxe – blutzuckernormalisierung pankreas: reduzierte insulinsekretion (sulfonylharnstoffe, metiglinid-analoga) leber: erhöhte glucoseproduktion (metformin, thiazolidindione) – fettgewebe, skelettmuskel: insulinresistenz (Metformin, thiazolidindione) – insulin -> Angriff der Hyperglykämie – – Metformin ist das einzige präparat, das gewichtsneutral oder sogar senkend ist Biguanide Metformin – Wirkmechanismus Sulfonylharnstoffe „leider immer noch das meistverordnete medikament“ Glinide (kurzwirksamer) glinide – one meal- one pill , no meal – no pill 42 / 75 rechtenwald.com Fragen 1. Ein typ1-diabetiker, der einen ziel-blutzucker von 100-120 mg / dl anstrebt, ist durch folgende daten charakterisiert : insulin / BE faktor 1 (mittags) und 2 (abends) Insulin-bzw-äquivalent 30 mg/dl, der patient isst üblicherweise mittags 3 und abends 4 BE. Berechnen sie die dosis des mahlzeitinsulins für das mittagessen (präprandialer bz 70 mg/ dl ) und das abendessen (präpradialer bz 180 mg / dl) 2. gestationsdiabetes 3. dyslipoproteinämie beim diabetes mellitus 4. diabetes mellitus und hypertonie andere fragen, die diskutiert werden sollten: – kardiotoxische wirkung der sh – thiazolidindione (wirkungsmechanismus, vorteile, nachteile) – besonderheiten von insulin-glargin) ich mach 4. und besonderheiten von insulin-glargin 43 / 75 rechtenwald.com Insulinpumpen (CSII – kontinuierliche subcutane Insulininjektion) ... sorgen für das Basalinsulin nach eingestelltem Tagesprofil ... messen nicht selbst den Blutzucker (Thrombogenität der Sensoren nocht zu ↑) ... Bolusgabe nach Bedarf Gefahren – hohe Compliancevorraussetzung – Katheter verrutscht/blockiert ... -> Hyperglykämie & Ketoazidose – erhöhte Inzidenz lokaler Infektionen Indikation – vor allem bei sonst nicht in den Griff zu bekommendem Dawn-Phänomen (2. Nachthälfte) und jungem Patienten – bei Gestationsdiabetes – Diabetisches Fuss-Syndrom – Polyneuropathien Charcot-fuß: Fuß mit Osteomyelitis u.a. , der sich aufgrund diabetes nicht mehr regeneriert Gastroparese: Degeneration vagale Innervation des Magens – glucoseaufnahme sinkt /verändert sich -> verhindert mit ein festes schema ohne kontrollen C-Peptid Kontrolle -> wie ↑ ist die endogene Insulinproduktion wird höchstens mal beim Diabetologen/in der Klinik gemacht (teuer) Basalratentest zur bestimmung Basalinsulin Pat. Darf nicht essen (am besten morgends nüchtern), spritzt nur sein Basalinsulin , dann über 6h alle 2h blutzucker messen idealerweise bleibt er um die 120 das ganze an 3 tagen – vormittags – mittags -abends Blutzucker um 4 uhr messen – gibt Aufschluss ob nächtlicher Unterzucker gegeben insulinwirkung auf kind bei gestationsdiabetes -> insulin plazentagängig -> makrosom (kind zu groß), häufiger präeklampsie, , erhöhte pränatale Mortalität und perinatale Morbidität gestatationsdiabetesfrauen haben häufiger HWI, hydramnion (zuviel fruchtwasser) bei hohem risiko ogtt selbst bei normalem BZ gerechtfertigt orale Antidiabetika kontrainDIZIERT intensivierte konventionelle Insulintherapie wenn Diät nicht ausreichend cave: zunehmende insulinempfindlichkeit 8-12SSW abnehmende Insulinempfindlichkeit 2. hälfte Schwangerschaft zurückkehrende insulinempfindlichkeit sofort nach entbindung!! -> bei optimaler BZ-Einstellung kindersterblichkeit wie bei nichtdiabetikern zielwerte: lipoproteine ldl-c < 100 hdl-c > 40 (frauen >50 besser) tg < 150 alles mg/dl 44 / 75 rechtenwald.com akut sehr hohe triglyceridwerte können akute pankreatitis machen therapie dyslipoproteinämie bei d.m. – mediterrane diät, kein alk, gewichtsabnahme undk örperliche aktivität – bz-optimierung (verbessert auch die dyslipoproteinämie insbes. TG ↓) – statin (22% risikoreduktion von kardiovaskulären ereignissen durch simvastatin auch bei normalem ldl-c , heart protection studien) – fibrate: heterogene studienergebnisse -> koronare sterblichkeit anscheinend erhöht , also keine sekundärprophylaxe damit nur bei pankreatitis Thiazolidindione – langsamer Wirkungseintritt, maximal nach 2-3 monaten – endogenes insulin für wirkung notwendig, euglykäm – verbesserung der insulinsensibilität – indikation : monotherapie bei metforminunverträglichkeit, sonst in kombination mit metformin oder sh – uw: ödeminduktion durch na-retention, dekompensation einer herzinsuffizienz, hepatotoxizität, gewichtszunahme, für pioglitazon: erhöhte inzidenz von urotehl -ca – ki: HI, leberinsuffizienz, kombination mit insulin (weil dieses ebenfalls körperflüssigkeit ↑) – cave : keine langzeitefrahrungen – proactive studie: keine verbesserung der kardiovaskulären Mortalität, Herzinsuffizienz ↑ , Bsp für Gefahr von Datenmanipulation (Lancat 2005, 366) Diabetes mellitus und Hypertonus Ep: – 20-60% eder patienten mit DM, beim typ2-dm als Teil des metabolischen syndroms, bei typ1-dm oft als zeichen der beginnenden diabetischen nephropathie – diabetische hypertoniker haben doppelt so hohes kardiovaskuläres risiko für normoglykämische hypertoniker – jede 10mmHg RR-Senkung reduzieren diabetes-bezogenen Tod um 15% (UKPDS studie) Ziel-RR: <130/80mmHg Th: – Na-restriktion, gewichtsabnahme (RR ↓ 1 mmHg/kg) – bei KHK nach Myokardinfarkt und bei HI beta-blocker (nw: masikerung einer hypoglykämie und vermidnerte hepatische glucosefreisetzung) carvedilol (insulinsensitivtät ↑ ) ev. Besser als metoprolol (hba1c ↑) – bei mikroalbuminurie / nephropathie und herzinsuffizienz vorteile für ACE-Inhibitoren/AT1Blocker (diese nur wenn ACE-H nicht vertragen werden -Hustenanfälle) (Stoffwechselneutral) – prinzipiell auch Diuretika (geringe BZ und TG /LDL-C ↑, aber billig) und Calciumkanablcoker (nur verapamil-typ, aber nicht herzinsuffizienz) möglich -> i.d.R. Sind 2 und mehr Medikamente möglich 45 / 75 rechtenwald.com Schmäärrrz Postoperative Schmerzen kleinere oder ambulante ... ASS wird nicht eingesetzt s.u. Arachidonsäuremetabolismus PLA2 setzt aus Triglyceriden die Arachidonsäure frei – die Lipoxygenase LOX baut daraus Leukotriene (LTB4, LTC4, LTD4, LTE4) – die Cyclooxygenase COX baut daraus PGG2 Hydroperoxidase -> PGH2 -> Thromboxane (TXA2), Prostaglandine (PGF2alpha, PGE2), Prostacycline (PGI2) LTB4 Chemotaxis, von LTC4 bis PGF2alpha überwiegend Vasokonstriktion/Bronchokonstriktion, ab PGE2 Vasodilatation, Broncholyse Leukotriene Kapillarpermeabilität ↑ Thromboxane Thrombocytenaggregation ↑ Prostacyclin Thrombocytenaggregation ↓ im Magen: PGE2 Säuresekretion ↓, Schleimproduktion ↑ Unerwünschte Wirkungen der ASS – Verlängerung der Blutungszeit immer 650 mg verdoppeln die Blutungszeit für 4-7 Tage – – GI-Beschwerdenn Mikroblutungen im Magen häufig immer 3-8 ml /Tag, klinisch unbedeutend – Magenblutungen selten unauffällig – Magenblutungen lebensbedrohlich – Magenulcera sehr selten bei Dauergebrauch, > 4x pro Woche, > 3mo sehr selten bei Dauergebrauch, > 4x pro Woche, > 3mo – – Asthmaanfall Reye-Syndrom bei Asthmatikern bei Kindern sehr selten, aber meist tödlich Unerwünschte Wirkungen von COX-Inhibitoren ASS irreversibler inhibitor vgl mit reversiblen inhibitoren -> fr COX-Isoformen physiologische Regulation -> COX-1, PGHS-1 konstitutiv -> Thrombocyten, Magen-/Darmmucosa, Endothel, Niere inflammatorischer Stimulus -> COX-2, PGHS-2 induziert -> Makrophagen und andere Zelle mit Rolle im Entzündungsgeschehen blibla das Konzept wankt! War auslöser für COX2-selektive Inhibitorenentwicklung rofecoxib (vioxx ® ), valdecoxib schon wieder vom markt... 46 / 75 rechtenwald.com Wirkungsmechanismus Salicylsäure IkappaB-Kinase spaltet NfkappaB von IkappaB ab, NfkappaB in zellkern an DNA -> verstärkte transkription von COX-2 Salicylsäure hemmt die IkappaB-Kinase Wirksamkeit von Analgetika NNT (numbers needed to treat) Ibuprofen ~2 Paracetamol ~3 schlecht: Codein NNT = number needed to treat Anzahl der behandelten Patienten n Anzahl mit erreichtem Behandlungziel en Anzahl der Kontrollpatienten (z.B. Placebo) c Anzahl Kontrollen imt erreichtem Behandlungsziel Ec ARR : absolute risk reduction ARR = en/n – ec/c NNT = 1 /ARR n=100, en=60, c=100, ec=20 ARR = 0,4 -> NNT = 2,5 Schmerzskalen: mit Gesichtern, Verbale Deskription, Visuelle Analogskala, Numerische Ratingskala problem der definition: 50% maxTOTPAR gilt als Erfolg (50% maximale Schmerzlinderung) evidenz-basierte information z.b. http://www.jr2.ox.ac.uk/bandolier Akute Toxizität von ASS therapeutische Dosierung ASS entkoppelt oxidative Phosphorylierung: O2 Verbrauch, CO2 Produktion ↑ indirekte Atemstimulation / direkte Atemstimulation -> respiratorische Alkalose -> ausgleich durch renale Bicarbonatausscheidung -> kompensierte respiratorische Alkalose toxische Dosierung Atemdepression bei niedrigen Bicarbonatspiegeln: CO2 Produktion unkompensiert -> respiratorische Acidose Säureakkumulation: ASS, Lactat, Pyruvat -> metabolische Acidose Akute Toxizität von Paracetamol Ausscheidung : unverändert 10%, R : Glucuronsäure 55%, Schwefelsäure 30% 47 / 75 rechtenwald.com Chinonimine -> - GSH 5% -> raus problem: wenn Glucuronsäurereserven erschöpft sind wird letzter Weg verstärkt beschritten, das Reaktive Zwischenprodukt des Chinonimins (vor der GSH-Konjugation) lagert sich an -> führt zur Leberzirrhose Chronische Toxizität von COX-Inhibitoren Nierenschädigung durch verminderte Prostaglandinsynthese „Analgetika-Niere“ Dauergebrauch – Abusus wird häufig durch Kombinationspräparate ausgelöst Kombinationspräparate ASS – Paracetamol – Koffein +: Kombination erlaubt geringere Dosen einzelner Wirkstoffe, Coffein hat eine analgetische Wirkung -: nur sinnvoll für substanzen mit unterschiedlichen wirkmechanismen, potentielle sensibilisierung gegen mehrere substanzen , widersprüchliche Daten, Coffein ist ein zentrales Stimulans und motiviert zur Wiedereinnahme Kolikschmerzen Nierenkolik Freisetzung von PGE2 und PGI2 Vasodilataion der afferenten Arteriolen GFR ↑ urethraler Druck ↑ Mittel der Wahl: NSAID wie Diclofenac Gallenkolik Nitrate können die Symptomatik verbessern Glyceroltrinitrat oder ISDN sublingual NSAID mindern Kontraktion der Gallenwege z.B. Diclofenac warum sind Opioide bei Kolikschmerzen zweite Wahl? Opioide sind spasmogen! Wenn man sie doch benutzt : Nierenkolik: + Butylscopolamin Gallenkolik: +Nitrat Kolikschmerzen und Metamizol ...eine deutsche Gewohnheit! Seit den 30er Jahren sind Agranulocytosen durch Metamizol und andere Pyrazolone bekannt! Metamizol in den USA 1977 verobten ,nur noch phenazon in analgetischen ohrentropfen im Handel Schweden: 1974 verboten, 1995 wiedereingeführt, 1999 erneut verboten Kolikschmerzen und Pethidin Pethidin- Meperidine (US) Vergleich mit Morphin: ähnliche maxiale analgetische Wirkung 48 / 75 rechtenwald.com keine Hemmung der Wehentätigkeit geringere spasmogene Effekte an glatter Muskulatur ABER: Druckwerte im Gallengang werden stärker erhöht! Also bei Gallenkolik keine gute idee Metabolit Norpethidin wirkt konvulsiv stärker emetisch wirksam als Morphin Herzinfarkt eine vielzahl von substanzen, u.a. ASS und Morphin (bezug zum heutigen Thema ah jo) ASS : Hemmung Thrombocytenaggregation Morphin: Analgesie, Sedation, Euphorie, Vasodilatation Adjuvante Schmerztherapie zur Linderung von UAW: Antiemetika, Laxantien Co-Analgetika: Glucocorticoide, Antidepressiva, anticonvulsiva, neuroleptika Schwere chronische Schmerzen Conotoxin: hemmt N-Typ Ca2+-Kanäle quellen: Kegelschnecken (conus blabla's) Fragen 1. Erklären sie den Begriff „Aspirinasthma“ hemmung cox -> leukotrien -% ↑ -> Bronchokonstriktion ↑ 2. Warum ist ASS in der Schwangerschaft kontraindiziert? 1.+2. trimenon strenge indikationsstellung, 3. trimenon KI tierexperimentell : implantationsstörungen + fehlbildungen wahrschinelich keine effekte bei therapeutischen dosen Vorzeitiger schluss ductus botalli (wird durch Prostaglandine offen gehalten), verzögerung und verlängerung geburt, wehenhemmung, unter geburt erhöhter blutverlust, bei neugeborenen häufiger intrakranielle blutungen Stillzeit - hohe dosen KI, strenge indikationsstellung bie niedrigen dosen - nachteilige wirkungen auf säuglinge bei gelegentlicher einnahme nicht beobachtet - bei regelmäßiger einnahme hoher dosen abstillen erwägen (entgiftung, kernikterus) -> grundsatz der vorsicht, keine harten daten... 3. Anwendung von antipyretischen Analgetika bei Niereninsuffizienz normal nicht, weil prostaglandine gebraucht werden (für autoregulationsmechanismus der niere, gegenspieler von NA + AT-II) - PGE2 , PGI2 setzen renin aus nierenrinde frei - steigern den renalen blutfluss und die diurese -> anhaltenden hemmung der intrarenalen pg-synthese und damit verminderung der nierendurchblutung (v.a. Bei nierenvorschädigung) -> regel: saure nsaid bei niereninsuffizienz meiden, paracetamol (das auf zentrale COX wirkt) bei leberinsuffizienz 4. Warum erhöht Rofecoxib die Inzidenz von Herzinfarkten? Wir hemmen prostacyclin (endotheliale COX-2), aber nicht thromboxanbildung (thrombozytäre COX-1), verschieben dadurch das gleichgewicht und erhöhen die thrombocytenaggregation -> zunahme thrombembolischer ereignisse Was ist für andere COX2-Inhibitoren wie Celecoxib oder Etoricoxib zu erwarten? 49 / 75 rechtenwald.com (Celecoxib deutlich weniger COX-2 selektiv, Etoricoxib sehr seletiv) ein gruppeneffekt ist aufgrund der bedeutung der konstitutiven endothelialen cox2 expression zu erwarten da die cox2 selektivität von celecoxib geringer ist, sollten thrombembolische ereignisse häufiger als bei unselektiven inhibitoren , aber seltener als bei rofecoxib sein übrigens celecoxib vergleichbare cox2-selektivität hat diclofenac(voltaren) empfehlungen der arzneimittelkomission - indikation: behandlung von erkrankungen des rheumatischen formenkreises - coxibe sind bei allen kardiovaskulären risikopatienten KI - bei patienten > 65 jahren strenge indikation - zeitlich möglichst eng begrenzt (intermittierend bis ½ jahr ) - nicht vor oder unmittelbar nach chirurgischen eingriffen Alternativen: NSAID + low-dose ASS + PPI (protonenpumpeninhibitoren) nichtopoiod-Analgetika (Paracetamol) schwach wirkende opiate (tramal, tilidin,...) 5. Warum verstärken Glucocorticoide die gastrointestinalen unerwünschten Wirkungen von COXInhibitoren? Hemmung COX-Induktion Über lipocortin hemmung der PLA2 (weniger arachidonsäure, weniger input für die COX) „verzehnfachung“ risiko 50 / 75 rechtenwald.com Fakten zu Schmerzen und Schmerztherapie – patienten mit chronischen schmerzen befinden sich durchschnittlich 11 jahre und bei 9 ärzten in behandlung, bevor sie an eine spezialisierte schmerzambulanz überwiesen werde n – weltweit sterben 90% der tumorpatienten mit unzureichend behandelten schmerzen – die pro-kopf verschreibung von opioiden ist in dänemark 10x so ↑ wie in .de – schmerz ist DAS symptom, mit dem der patiente den arzt aufsucht. An dessen linderung wird der erfolg der behandlung gemessen Schmerzentstehung und -Leitung Bradykinin, Serotonin, Histamin, Kalium , Prostaglandine, Leukotriene (letzte beide „nur“ Sensibilatoren) Grundsätze der Schmerztherapie – genaue Anamnese (Art, Ort, Zeit ) – Ursachen- vor Symptomtherapie – Glyceroltrinitrat bei Angina pectoris – Pilocarpin bei Glaukomanfall – Colchicin bei Gichtanfall – Triptane bei Migräne – Mischpräparate bieten weniger Vorteile aber häufige Nachteile (z.B. unterschieliche Pharmakokinetik, größere Suchtwirkungen) – Entzündungshemmung durch Antiphlogistika, Kühlung, Ruhigstellung www.akdae.de frei verfügbare leitlinien zur pharmakotherapie Flupirtin und Nefopam – zentraler Angriffspunkt (aber nicht an Opioidrezeptoren) – keine Hemmung der COX (deshalb nicht antipyretisch/ antiphlogistisch) – beide mittelstark wirksam (zwischen codein und morphin) flupirtin (katadolon ® ) – aktivierung von girk-kanälen -> membranpotential-stabilisierung, hemmungg von nmdarezeptoren (glutamat) – muskelrelaxation durch hemmung der motoneuronaktivität – uaw: müdigkeit, schwindel, gi, lebertoxisch nefopam (silentan ® ) – beeinflussung von absteigenden, schmerzmodulierenden bahnen (wiederaufnahmehemmung von noradrenalin und serotonin)? – Auch anticholinerg und antihistaminerg – uaw: anstieg von Hf und RR, GI, schweißausbruch, konfusion, schläfrigkeit, mundtrockenheit, halluzinationen, miktionsstörungen wirkung und nutzen (noch) nicht definierbar 51 / 75 rechtenwald.com Hypertonie er führt uns ein und hält uns die Wurst vor die Nase (die ersten zwei Sätze ah ja) Kardiovaskuläre Erkrankungen sind die häufigste Todesursache in der westlichen Welt Definition Hypertonie Systolisch Diastolisch Optimal <120 mmHg <80mmHg Normal 120-129 80-84 ↑normal/borderline hypert. 130-139 85-89 Grad I 140-159 90-99 Grad II 160-179 100-109 Grad III >180 >110 Systol. Hypertonus („White coat“ hypertonus) >140 <90 Bei den Graden reicht ein kriterium systolisch oder diastolisch Zielwert Diabetiker: 130 / 80 Hypertonus: Organschäden Myokardinfarkt 66% T Hirnmassenblutung 14% T ↑druckenzephalopathie Hirninfarkt Retinopathie Stauungspapille KHK LVH Herzinsuffizienz (cor hypertonicum) Aneurysma dissecans Arteriosklerose Niereninsuffizienz Arteriolosklerose Claudicatio intermittens Gangränm Komplikationen je mehr risikofaktoren zusammenkommen und je höher Blutdruck desto höher Wahrscheinlichkei für diese Epidemiologie Deutschland Prävalenz bei GW 140/90 mmHg: .de 55%, .eu 44%, .us 28% davon behandelt 16%, 27%, 53% -> offensichtlich genetische Prädisposition für Blut↑druck für europäer 25% der Weltbevölkerung 52 / 75 rechtenwald.com .de: 33% der Männer > 50a 30% der Bevölkerung 30ger Regel bei uns haben – 30% bevölkerung blut↑druck – 30% der hypertoniker wissen nichts davon – nur 30% der erkannten hypertoniker werden behandelt – davon nur 30% korrekt eingestellt d.h. > 85% der Hypertoniker sind gar nicht oder ungenügend behandelt! Entwicklung Antihypertensiva – 1949 „Antisympathikotone“ Reserpin – 1958 Diuretika HCT – 1963 Calcium-Antagonisten Verapamil – 1965 beta-blocker Propranolol – 1975 alpha-1-blocker Prazosin – 1981 ACE-inhibitoren captopril – 1995 AT1-rezeptor-blocker losartan „zentrale“ Antisympathotonika klinische relevanz nur noch gering zentrale alpha-Rezeptoren werden stimuliert, wirken dann inhibitorisch reserpin (heut nimmer genommen): irreversible hemmung Clonidin (stimulation zentraler alpha2-AR, Reservemittel) – nucleus tractus solitarii Guanfacin (notfallmedizin), alpha1+2 medulla oblongata Alpha-Methyldopa (bei Schwangerschaftshypertonus: weder embryotoxisch noch fetotoxisch – bei neueren keine Erfahrungen da und es findet sich ja kein Testkollektiv) periphere Antisympathotonika Reserpin alpha-Methyldopa Clonidin Urapidil (ebrantil) Rein periphere alpha-Blocker welche nur postsynaptische alpha1-rezeptoren in peripherie inhibieren idR keine synergistischen Effekte auf andere Rezeptoren Vorteil: günstigeres Nebenwirkungsprofil Hydralazin, Dihydralazin, Minoxidil (periphere Arteriolen), CAVE: Reflextachykardie, Wassereinlagerung Diazoxid, Na-Nitroprussid (5% Glucose, Lichtschutz) : alpha1-inhibition arteriolen und venolen + Ca-Antagonismus ; CAVE: nur-intra-op/rr-krise, cyanidintoxikation, metabol. Azidose, Wassereinlagerung . Ein Traum : mit tropfengeschwindigkeit blutdruck einstellbar, sobald ich infusion abdreh ist wirkung auch weg – nur auf intensivmedizinischen Stationen über ZVK Hypertonie: Therapie heute Monotherapie versus frühzeitige Kombinationstherapie Monotherapie (Diuretika, ACE-Hemmer/AT1-Antagonisten, Betablocker, Ca-Antagonisten) heute: überwiegend frühe kombinationstherapie, synergistische Effekte und Dosissenkung möglich 53 / 75 rechtenwald.com -> damit günstigeres Nebenwirkungsprofil Diuretika: – Thiaziddiuretika (distales Konvolut) (Hydrochlorothiazid HCT, Chlorthalidon: ALLHAT-Studie) – Langwirksame (HWZ z.b. 18 statt 4 h) Thiazidanaloga (Xipamid, Indipamid) – Schleifendiuretika (henlesche schleife, die besten Power-Hauer) (Furosemid, Torasemid) – K-sparende Diuretika (Amilorid, Triamteren) – Aldosteronantagonisten (Spironolacton, Eplerenon) Beta-Blocker: – Cave intrinsische Aktivität und Cave Selektivität – Mandatorisch (=obligatorisch) Post-Infarkt immer betablocker – bei Asthmatikern k.i. Ace-Hemmer – Cave: Hyperkaliämie, Cave Nierenaterienstenose – sinvoll: post-TM_Infarkt (anti-remodelling) – nie K-Sparende diuretika mit ACE-Hemmer wegen möglicher wirkungsumkehr – PREMIER (Perindopril / Indipamid vs. Enalapril Mono) Dihydropyridine – CAVE: KHK; Herzinsuffizienz – außer: Amlodipin (Norvasc), Felodipin (Modip / Munobal) Kombinationstherapie Diuretika + + K+-neutrale Nicht-K -sparende ACE-Hemmer/AT1Antagonisten Betablocker Ca-Antagonisten – nur Dihydropiridine! Bild: Hypertonie: Therapie-Pentagramm 2003 Diuretikum (keine K-Sparer mit AT1/ACE) synergistisch zu den anderen Betablocker Dihydropyridine AT1-Blocker? ACE-Hemmer neben 5 1st-line-Therapeutika gibt's die 2nd-line Therapeutika Gruppe Substanzen AT1-Antagonisten (Reserve bei ACE-Hemmer NW- aber 20x so teuer wie der Rest – Studienmäßig aber nicht besser) Losartan Valsartan Candesartan Ibesartan Bemerkungen Nur non-inferiority gezeigt bei: HI / KHK-post Infarkt sinvvoll bei nephrolog. Begleiterkrankung 54 / 75 rechtenwald.com Gruppe Ca-Antagonisten, und zwar - Benzothiazepine - Phenylalkylamine Zentral wirksame Antisympathotonika Substanzen Diltiazem (NORDIL: noninferior to diur. /betablocker) CAVE: bei Kombination mit betaBlockern! Sinnvoll bei: prinzmetal-angina Verapamil (APSIS: noninferior to beta-blocker) CAVE: nie mit beta-blockern kombinieren sinnvoll bei: VH-Tachykardien, pAVK Clonidin (Test bei v.a Phäochr.) Zentral: stimul. Inihibitor. A2-AR peripher: stimul. Präsyn (inhib) a2AR peripher: stimul postsyn (aktiv) a2b-AR a-Methyldopa Reserpin Periphere Vasodilatantien Nepresol Hydralazin Cynt Minoxidil Lonolox Na-Nitroprussid Nipruss Alpha1-Blocker Phenoxybenzamin Bemerkungen Nur bei Lebensgefahr ,..... Regitin Phentolamin Urapidil Ebrantil Doxazosin Prazosin Aktuelle Daten zur Kombinationstherapie - das lass mer mal Antihypertensiva – Wirksamkeit einzelner Substanzklassen – Diuretika LVH-Regression (Banddickenabnahme vom Herzmuskel – neuester Lieblingsparameter) 7-11% Vorlastsenkung, Minderung der LV-Wandspannung, Reduktion LA-Größe ALLHAT-Study: kein Vorteil moderner Antihypertensiva gegenüber Chlorthalidon (bezogen auf Monosubstanztherapie)..... am billigsten – LVH-Regression 8,5-9% Verbesserung LV-Steifheit (Relaxation Verbesserung Koronarreserve, Endothelfunktion (geringer als ACE-Hemmer) – beta-Blocker LVH-Regression 6% Frequenzkontrolle, verlängerte Diastolendauer, verbesserte Sauerstoffausschöpfung zwingend bei Z.n. Hernzinfarkt! – ACE-Hemmer LVH-Regression 13-15% Verbesserte Endothelfunktion, Reduktion Myokardfibrose Verbesserte koronare Mikroperfusion – AT1-Blocker LVH-Regression 15-18% (sagt Pharmaindustrie – Verkaufsargument eben ... gibt sich wohl nix) Herabsetzung Tonus glatter Gefäßmuskulatur, Verbesserte Myokardfunktion 55 / 75 rechtenwald.com Verbesserte Endothelfunktion, Reduktion Myokardfibrose Nebenwirkungen einzelner Substanzklassen – Diuretika: CAVE Elektrolyte (u.a. Muskelkrämpfe, Herzrhythmusstörungen ... K, Mg) Harnsäureerhöhung Prodiabetogen – Ca-Antagonisten (Dihydropiridine) CAVE Flush (u.a. Hautrötung, Juckreiz) Beinödeme Herzrhythmusstörungen (v.a. Nicht-Dihydropiridine) – Beta-Blocker Cave Asthma (u.a. Status-Induktion) -> erste Tablette unter Aufsicht Bradykardie, höhergradige AV-Blockierungen Prodiabetogen, erektile Dysfunktion – ACE-Hemmer Cave Hyperkaliämie (niemals K-sparende Diuretika / Aldosteronantagonisten ohne regelmäßige K-Kontrollen) ; Creatinin-Anstieg (Niere) Angio(neurotisches)ödem (verzögerte Bradikininabbau) Reizhusten – AT1-Blocker Cave Hyperkaliämie (niemals K-sparende Diuretika / Aldosteronantagonisten ohne regelmäßige K-Kontrollen) selten Angioödem/Reizhusten 56 / 75 rechtenwald.com Hausaufgaben ein 75jähriger Patient mit z.n. 3Fach Bypass stellt sich in ihrer Praxis vor. Bekannte fettstoffwechselstörung, mit CSE-Hemmer eingestellt kein Diabetes RR170/95 mmHg 1. welche Antihypertensiva sollten sie hier obligat, welche vorzugsweise rezeptieren? 2. Und warum? 3. Nenne sie wesentliche Aussagen und therapeutische Konsequenzen der ALLHAT-Studie 1. nach Herzinfarkt obligat beta-Blocker vorzugsweise: ACEI/ARB möglich: Dihydropyridine 2./3. Generation nicht: Verapamil / Diltiazem (nicht-Dihydropyridine – wegen Herzwirkung) mit beta-Blockern (in Kombination stark neg. chronotrop/inotrop) nicht: alpha-Blocker 2. 1. Sekundärprophylaxe, Mortalitätsreduktion , Diastolendauer ↑, koronare Perfusion ↑ 2. verhindert lv-Remodeling myocardfibrose ↓, koronare mikroperfusion ↑ CHF-Prophylaxe (SOLVD-studies) 3. Ca-Antagonisten v.a. Wenn lv-hypertrophie und EF > 45% Verbessserung lv-stiffness : relaxation ↑ 4. verapamil /diltiazem + (oblig) beta-Blocker CAVE Sinusarrrest! Alpha-Blocker: HI-Beschleunigung, in ALLHAT-Studie Abbruch 3. Diuretika bzgl. harter Endpunkte genauso wirksam wie die neueren Medikamente alpha1-blocker rausgefallen eine 65jährige Patientin mit anamnestisch langjährigem Hypertonus stellt sich wegen BelastungsDyspnoe in Ihrer Praxi vor. Keine Fettstoffwechselstörung , kein Diabetes RR 180/100 mmHg im Labor Creatinin bei 4.2 mg/dl , HnSt 60 mg/dl (stark eingeschränkte Nierenfunktion eben) 1. welche pathophysiologischen Zusammenhänge vermuten sie? 2. Welche Antihypertensiva sollten in dieser Situation vorzugsweise eingesetzt werden und warum? 3. Worauf ist insbesondere bei dieser Patientin im Falle einer Kombination von Diuretika mit ACEHemmern zu achten ? Mechanismus! 1. 1. Essentieller Hypertoneus 2. LVH mit diastolischer Relaxationsstörung 3. diastol. Füllungsstörung erklärt Luftnot v.a. Bei Belastung („physiolog.“ Tachykardie) 4. sekundär hypertensiver Nierenschaden: Glomerulosklerose -> Niereninsuffizienz 2. alles ausser Kaliumsparern 1. ACEI/ARB verhindern LV-Remodeling, Nephroprotektion (GFR ↓) 2. Ca2+-Antagonisten wenn EF > 45% 3. Vorlastsenker: Diuretika (ggf. Nitrate) 4. beta-Blocker: Verlängert Diastolendauer CAVE: Verapamil / Diltiazem + beta-Blocker KI wg. pot. Sinusarrrest! 3. CAVE: Niemals K+-Sparer bei chron. Niereninsuffizienz! (ACEI sparen ja auch schon K+, also auch nicht so notwendig) Ab Crea um 2.5-3 mg/dl i.d.R. Nur Schleifendiuretika wirksam! Eine 35jährige Patientin mit bekanntem allergischem Asthma bronchiale stellt sich bei ihnen im 57 / 75 rechtenwald.com Dienst 5:30 morgens mit pochenden Kopfschmerzen und in letzter Zeit gehäuft aufgetretenem Nasenbluten vor (2 Leitsymptome für Blut↑druck) kein Nikotinkonsum, RR 165/95 mmHg also juveniler ↑druck 1. welche antihypertensiva in dieser situation vorzugsweise und warum? 2. Welche antihypertensiva in dieser Situation kontraindiziert? 1. 1. Ca2+-Antagonisten, alternativ 2. ACEI bzw. ARB (weniger häufig UAW Reizhusten +/- mildes nicht K+-sparendes Diuretikum 3. ggf. Clonidin s.c. (bei junger Frau gleichzeitig diagnostisch: bei Phäochromozytom kein Abfall endogener Katecholamine obacht: Phäochromozytom (Tumor des Nebennierenmarks -> erhöhte Adrenalinausschüttng) 2. 1. Beta-Blocker wegen allerg. Asthma bronchiale, insbesondere bei Dauertherapie mit (langwirksamen) beta2-Mimetika 2. PDE-Hemmer-Therapie wegen potent. RR-Steigerung absetzen (sind heute bei Asthma sowieso nur 2. Wahl!!!) (Mechanismus Hemmung cAMP-Abbau nicht nur an Bronchien, sondern auch am Herzen) Eine 67jährige insulin-pflichtige diabetikerin (typII) , halbjahreskontrolle keine herzbeschwerden kein nikotinkonsum RR 150/95 1. welche antihypertensiva , wie ↑ ist zielblutdruck? 1. ACEI bzw ARB (weniger häufig UAW Reizhusten) – gute evidence-based Studienlage für beide Substanzen +/- mildes nicht K-sparendes Diuretikum 2. ggf kardioselektive Beta-Blocker 3. ggf. Ca2+-Antagonisten 4. Ziel-RR bei Diabetikern : 130/80mmHg 2. welche antihypertensiva sind in dieser situation zu meiden? 1. Thiazid-Diuretika (diabetogen) 2. Nicht meiden (wurde früher mal postuliert) Beta-Blocker! Betablocker – Propranolol (nicht-selektiv , beta1=beta2) – Bisoprolol (Selektiv , beta1 > beta2) – Metoprolol (Selektiv , beta1 > beta2) – Atenolol (Selektiv , beta1 > beta2) Mechanismen – HZV ↓ – Reninfreisetzung ↓ – präsynaptische Na-Freisetzung ↓ – Empfindlichkeit Barorezeptoren ↑ – zentraler Sympathikotonus ↓ UAW – Av-Block II-III, Bradykardie (beta1) KI : <35-40/min – Bronchokonstriktion (beta2) 58 / 75 rechtenwald.com – – – – KI: Asthma: Status-Induktion, beta2-Pflichtige COPD periphere Vasokonstriktion (beta2) Hypoglykämie (beta2 Leber + SM) Diabetiker-Warnsymptome werden kaschiert : Tachykardie ↓, kalter Schweiß ↑ trotzdem keine KI! Hyperkaliämie (Hemmung des RAAS) Müdigkeit (verschwindet nach Wochen, aber erhöhte Therapieabbruchgefahr) Calcium-Kanalblocker Dihydropyridin-Typ – Nifedipin (1. Generation) = kurzwirksam nur als Nifedipin-Retard einsetzen! – Felodipin (2. Generation) = länger wirksam – Amlodipin (3. Generation) = 1x tägl. Gabe Kationisch-amphiphile – Verapamil (Phenylalkylamin – Diltiazem (Benzothiazepin) Effekte Mechanismus: Hemmung des Ca2+-Einstroms in glatten Gefäßmuskeln und dem Herzmuskel über die Blockade des L-Typ-Calcium-Kanals Dihydropyridine: nur auf Gefäße : Vasodilatation (Arterien + Arteriolen) Verapamil / Diltiazem : ausserdem auf Herz (Schlagfrequenz, AV-Überletiung, Kontraktionskraft alles ↓) Wirkung: – Vaso-/Koronardilatation (bei KHK!) , Nachlastsenkung – bei LVH Besserung der diastolischen Compliance (Besserung Bluteinstrom) – bei Asthmatikern Verapamil zur Kontrolle der Reflextachykardie (beta2-Agonist-bedingt) UAW – Flush (u.a. Hautrötung, Juckreiz) – hydrostatische Knöchelödeme – Herzrhythmusstörungen (v.a. Nicht Dihydropyridine Verapamil / Diltiazem) – gastroösophagealer Reflux – Obstipation (Verapamil) – kompensatorisch: Sympathikotonus ↑, Reninfreisetzung ↑ Thiazide – Hydrochlorothiazid – Chlorthalidon Mechanismus – Hemmung des Na-Cl-Cotransporters im frühdistalen Tubulus Natriurese, sek. Kaliurese, Ca2+-Retention – Bindung an K+-Kanäle 59 / 75 rechtenwald.com Effekte – Plasmavolumen ↓ – peripherer Gefäßwiderstand ↓ Vasodilatation durch Aktivierung von K+-Kanälen – K+-Ausscheidung ↑ 2+ – Ca -Ausscheidung ↓ vorteilhaft bei Osteoporose UAW – Anstieg Hämatokrit (Thrombose) – Hypokaliämie (plötzlicher Herztod) Na und H2o Verlust -> Aktivierung RAAS -> sek K-Verlust -> Komb. Mit ACE-I / AT1-Blocker oder K-sparendem Diuretikum sinnvoll – Hyperuricämie (Gicht) Schleifendiuretika Furosemid u.a. Mechanismus Hemmung Na/K/2Cl Cotransporters aufsteigender Schenkel Henle-Schleife (interstitielle Osmolarität sinkt und damit auch die Fähigkeit zur Wasserretention) Effekte – deutlich stärkere Wirkung als Thiazide – schneller Wirkeintritt (15-30min) – Mg und Ca Ausscheidung ↑ – K-Ausschediung ↑ UAW – Anstieg Hämokrit (Thrombosegefahr) – Hypokaliämie – Hypomagnesämie (Muskelkrämpfe) – Hypocacämie – Hyperuricämie (Gicht) wegen Konkurrenz an Transporter – Aktivierung RAAS -> Komb mit ACE-I / AT1-Bl K+-sparende Diuretika Amilorid Thriamteren in Kombination mit Thiaziden oder Schleifendiuretika zur Verhinderung einer Hypokaliämie Harnausscheidung wird nur minimal verstärkt (0-1%) Mechanismus Hemmung der (aldosteronabh.) Na+-Resorption im extremen distalen Tubulus -> Reduktion der transepithelialen Potentialdifferenz -> K+-Ausstrom sinkt UAW – Hyperkaliämie 60 / 75 rechtenwald.com CAVE: Kombination mit ACE-Hemmern / AT1-Blockern, Aldosteronantagonisten, nur bei regelmäßiger K+-Kontrolle RAAS ja das kennen wir schon ... Angiotensin II greift an an: – AT1-Rezeptor gut verstanden, Vasokonstriktion, Aldosteron-Synthese/Freisetzung, Sympathikusaktivierung, Wachstum und Fibrose von Herz und Gefäßen – AT2-Rezeptor Schlecht verstanden, selten im Körper embryonal: Nierenentwicklung antiproliferierender Effekt (HI) Vasodilatation Angriffspunkte: ACE -Inhibitor (ACE) -> UAW über Bradykinin ↑ (das auch über ACE inaktiviert wird) / Subst. P Vasodilatation trockener Husten (das Bradykinin offenbar wichtigster Bestandteil der Medikamentenwirkung) AT1-Rezeptorblocker (AT1-Rezeptor) ACE-Hemmer Effekte – Synthese Angiotensin II ↓ – Vasokonstriktion ↓ Aldosteronsekretion ↓ – Abbau der vasodilatierenden Peptide Bradykinin, Kallidin, Substanz P ↓ UAW – Hyperkaliämie aufgrund geirnger Aldosteronsekretion – Reizhusten (20%) verzögerter Bradykininabbau – Crea-Anstieg (Niere) – Angio(neurotisches)ödem verzögerter Bradykininabbau bei Larynxschwellung Erstickungsgefahr ATII erhält den GF-Druck aufrecht durch Kontraktion Vas Afferens – deswegen bei Nierenarterienstenose ACE-Hemmer KI ein anstieg des Kreatinins unter ACE-Hemmer innerhalb der ersten 4 Wochen um über 20% weist mit sehr hoher Wahrscheinlichkeit auf eine bilaterale Nierenarterienstenose hin KI – Beidseitige Nierenarterienstenose (s.o.) 61 / 75 rechtenwald.com AT1-Rezeptorblocker („Sartane“) Mechanismus Blockade des Angiotensin AT1-Rezeptors in der Niere und an den Blutgefäßen Effekte – RR Steigerung durch Angiotensin II ↓ + – Aldosteronsekretion (Na - und Wasserretention) ↓ – noch was UAW – Hyperkaliämie – sehr selten Reizhusten und Angio(neurotisches)ödem Hypertonie: Therapie-Pentagramm aktuell Bild: Hypertonie: Therapie-Pentagramm 2003 • Diuretikum synergistisch zu den anderen (Thiazide/Schleifendiuretika wegen Kaliumverlust gerne mit AT1-Blockern/ACE-Hemmern (aber keine K-Sparer mit AT1/ACE) ) • Betablocker • Dihydropyridine • AT1-Blocker? • ACE-Hemmer Synergismen auch Dihydropyridine + Betablocker Dihydropyridine + ACE-Hemmer 62 / 75 rechtenwald.com Koronarsyndrome – KHK Fallbsp: – nikotin 20/die – pos. familienanamnese (vater myokardinfarkt) – hyperlipoproteinämie (gesamt-cholest. 250 mg/dl, ldl 150, hdl 31) – keine art Hypertonie – kein diab mel Anamnese: – bei küchenmontage plötzl. Kopfschmerzen einnahme 800 mg ibuprofen -> keine wesentliche besserung – zusätzlich thorakales druckgefühl und dyspnoe – extreme schmerzen in beiden händen und unwohlsein -> notarzt innerhalb von 60min nach symptombeginn EKG: ST-Hebung bei akutem Koronarsyndrom 42% st-hebung – und 58% eben nicht – stemi: akuter (Q-wave -> transmural) Infarkt in aller regel (40 von 42%) – nstemi: trop pos.: akuter (non q-wave) infarkt (oder auch q-wave) – nstemi: trop neg.: instabile AP / andere Ursache (Bandscheibenvorfall/ Speiseröhrenentzündung...) Bild: Verlauf Arterioskleose (Lipidkernbildung usw) entscheidend: Plaqueruptur macht den Infarkt akutes koronarsyndrom definition: ruptur oder erosion eines atherosklerotischen plaques mit „offenem ausgang“ (dynamischer prozess) infakrt Qw/NQMI (Okklusion/Embolisierung) – instabile AP (wachstum) – stabile AP (Rückbildung) Akuter STEMI: Zeitfaktor jenseits von 8 h ist Ereignis schon eingetreten kaum noch reversibel, vergiss den Hubschrauber Baby im kleinen KKH lieber Lyse statt Transport in Spezialklinik größtes Problem: Benachrichtigung Arzt dauert im Schnitt 3h -> viel zu lang!!! wiedereröffnungsversuch „sinnvoll“ bis 24h nach Ereignis Therapie ASS, Heparin supportiv/symptomatisch: – schmerzbekämpfung (morphin... )sedierung ( valium) – koronarerweiterung mit nitroperfusor – beta-blocker (antitachykard) cave infarktgröße / induzierte insuffizienz – clopidogrel – .... – ist ja jetzt nicht so thema ?! 63 / 75 rechtenwald.com Sekundärprävention – ASS und/oder Clopidogrel – betablocker – ACE-Hemmer – Statine – Eplerenon (Aldosteronantagonist) – Glitazone Stabile KHK 1. Konservative Therapie – anschlussheilbehandlung Ziel: sekundärprävention – bewegungstherapie (koronarsport) – ernährungsumstellung (cholesterinarme kost, zuckerarme diät) – ballaststoffreiche fettarme kost, fischöl – rr-selbstkontrolle, salzarme ernährung – nikotinentwöhnung / -abstinenz – berufliche wiedereingliederung – stressprophylaxe /-verarbeitung, autogenes Training – Vitamin C/E/B6/Folsäure bringen keinen Benefit 2. Pharmakotherapie obligat: prognose-verbessernde medikamente – thrombozytenaggregationshemmer (Ass und /oder thienopyridine (v..a clopidogrel)) – betablocker ohne ISA (intrins....) – ace-inhibitoren (at1-blocker – aldosteron-antagonisten (eplerenon) – cse-hemmer (statine) – insulin-sensitizer (glitazone) cave: beinödeme, herzpumpschwäche Pharmakologische Thrombozytenhemmung ass hemmt cox -> txa2 ↓ ticlopidin / clopidogrel stabile khk basistherapie 1. thrombozytenaggregationshemmer 1.1. Azetylsalizylsäure (unselekt. COX1/2-Inhibitor) ASS min. 100 mg/d 1.2. Thienopyridine (Inhibitoren der thrombozytären p2y12-rezeptoren) -> Hemmung der adp-abhängigen thrombozytenaktivierung nach 7d (!) tiklopidin (reservemittel: neutro-/thrombopenien!) clopidogrel (iscover/plavix) achtung: ASS+Clopidogrel bei best. subgruppen wirksamer als ASS alleine! 1.3. GPIIb/IIIa-Inhibitoren -> Hemmung bindung fibrinoge an giib/iiia-rez Monoklonale AK (Abciximab, Reopro ®) 2. Antianginöse Therapie (kein Mortalitätsbenefit!) 2.1. Nitrate (Freisetzung von NO -> Aktiviert Guanylatzyklase -> cGMP -> Vasodilatation) Glyceroltrinitrat (Nitro-Spray/Kapseln zur Anfallscoupierung) Isosorbidnitrat (ISDN) cave: Tachyphylaxie ! (Toleranzentwicklung -> immer weitere Dosissteigerung) 64 / 75 rechtenwald.com 3. 4. 5. 6. 7. 8. Isosorbinmononitrat (ISMN lange biolog hwz pentanitrate (Pentalong) keine Tachyphylaxie, senkt PA-Druck 2.2 Molsidomin (Corvaton ret. ) Wirkmechanismus wie Nitrate , aber keine Tachyphylaxie! (Gut für das Problem der 5 UhrMorgens-Ereignis-Prophylaxe, deswegen gibt man Molsidomin abends zum Nitrat morgens) Beta-Blocker (Blockade des Neurohumoralen Systems) - Senkung sauerstoffbedarf am herzen, rr ↓, hf ↓, wandspannung ↓ - antiarrhythmogen - cave KI bei asthma , bradykardie < 39/min, av-block > 1. grades unterscheidung in gruppen: kardioselektiv ja/nein, ISA ja/nein nks, nisa: nadolol(solgol), propranolol (dociton), carvedilol (dilatrend, querto) heute genutze v.a. Ks, nisa: atenolol (tenormin), metoprolol (beloc/zok), bisoprolol (concor) rest wurscht ACE-Hemmer / AT1-Blocker (Wirkung: Vor- und Nachlastsenkung) - wirden dem „remodeling“ des linken Ventrikel nach HI entgegen „reverse-remodeling“ - reduktion mortalität bei patieten mit „myokardnarbe“ nach infarkt - auch präventiv wirksam, mortalitätsreduktion bis zu 45% - v.a. Wirksam bei eingeschränkter LV-funktion (viel hilft viel) - evtl. auch kombinationsbehandlung sinnvoll cave: addition der nw aber nicht des benefits laut charm-studie bei EF> 40% Aldosteronantagonisten (spironolacton / eplerenon) Blockade des Endgliedes des RAAS spätdistal am Na/K-tauscher - Na-Exkretion (gering diuretisch) - K-Retention - Antifibrotisch, verbessertes „reverse-remodeling“ - Reduktion der Mortalität bei KHK / ischämischer Kardiomyopathie - wirksam bei LVEF < 40% / HI / diab mel - „on top“ : reduktion der kardiovask. Mortalität um weitere 17% Ca2+-Antagonisten (wirkung : v.a. Nachlastsenkung, mortalitätsreduktion nicht gezeigt?!) - verapamil (Phenylalkylamin-) typ: antiarrhythmisch (va.a bei SVES), cave nie mit betablockern kombinieren - dilitazem (benzothiazepin) typ: geringer antiarrhythmisch, spasmolytisch, ind: v.a. PrinzmetalAngina - nifedinpin (dihydropyridin-)typ: nicht antiarrhytmisch; v.a. Blutdrucksenkung , cave: kurzwirksame ca-antagonisten erhöhen bei KHK mortalität ; KI: instabile AP: akuter myokardinfarkt – also sind die dihydropyridine primär nicht an Bord sagt der Käptn! CSE-Hemmer (wirkung: cholesterinsynthese/LDL ↓ + pleiotrope Effekte) Statine gelten als Goldstandard in der kardiovaskulären Prävention (Simva- und Pravastatin sind inkorporier in das DMP – disease management program - KHK) prakt. Alle statine gleichwertig mittlere Mortalitätsreduktion ca 30% Kombination mit Ezetrol, Nicotinsäure möglich (... falls TG ↑, HDL niedrig) mit zunehmendem Abstand vom Infarkt werden Statine immer seltener gegeben Nebenwirkungen: gastrointestinale NW, ZNS-NW (schwindel/kopfschmerz), reversibler transaminasenanstieg, hepatitis, cholestase, autoimmunhämolyse, ck-anstieg, myosisis, myopathie, rhabdomyolyse Insulin-Sensitizer (Glitazone) Proactive-Studie, Pioglitazon Reduktion der Mortalität bei DM tpyII Antiatherogene Wirkung (Diabetes-unabhängig (!) allerdings nur n=50 in studie) – dramatische 65 / 75 rechtenwald.com Reduktion restenose-Rate! CAPRIE studie (3 a follow-up: – clopidogrel gegenüber ass 8,7% risikoreduktion für ischämische folgeereignisse (NNT 200) – geringere blutungsrate unter clopidogrel (gegenüber ass) – besonders bei subgruppen mit erhöhtem kardiovaskulären risiko – nur bei diesen 20x höherer preis gerechtfertigt mit lipidstoffwechselstörung (RR 19% NNT 37) mit insulinpflichtigem diabetes (18%, nnt 26 mit z.n. Bypass-op (31%, nnt 15) mit anderer gefäßmanifestation (15%, nnt71) CURE-Studie – clopidogrel + ass vs placebo + ass – primärer kumulat. Endpunkt kardiovask. Tod, myokardinfarkt, schlaganfall nach 12 monaten : -20%!!!! – Folgerung: 1 jahr lang clopidogrel-empfehlung, danach noch die o.g. Risikogruppen aus caprie Nitrate – Wirkmechanismus bei KHK Relaxation der (glatten) gefäßmuskulatur -> Vasodilatation V>A-> Reflextachykardie -> V -> Vorlast ↓, LVEDP ↓, HZV ↓ -> Subendokardialer Koronar-arterieller Widerstand ↓ A-> RR ↓ Nachlast ↓ Myokardialer O2-Bedarf ↓ Koronarien-Diameter ↑ kollateralen-diameter ↑ -> Ischämiereduktion (weniger Angina pectoris, mehr kontraktilität , weniger ST-Senkung) 66 / 75 rechtenwald.com Aufgaben ein 45jähriger Raucher stellt sich nun schon wiederholt wegen Brustengegefühl (in Ruhe!) in ihrer Praxis vor in dem von ihnen jüngst veranlassten Herzkatheter kein Nachweis von Stenose kein diabetes . 1. welche substanz sollten sie hier Vorzugsweise rezeptieren.. 2. ... und warum ? 3. Nennen sie wesenlichte sonstige indiaktionsgebiete und eigenschaften der vertreter dieser substanzgruppe 65jähriger patient mit bekannter khk, z.n. Herzinfarkt und 3fach bypass vonr 4 jahren (seitdem nichtraucher) zur routinekontrolle arterieller Hypertonus und nicht-insulin-pflichtiger diabetes. Keine beschwerden ekg zeigt typische zeichen eines alten hinterwandinfarkts 1. stellen sie einen therapieplan auf 2. welche risikofaktoren müssen sie kontrollieren? 3. Welchen ldl-spiegel zielen sie an ? Im notdienst: 60 jährige patientin mit z.n. Vorderwandinfarkt bei koronarer 2-gefäß-erkrankung langjähriger hypertonus und AA bei vorhofflimmern (bekannt) akut: zunehmende luftnot nikotin: noch immer ca 20 zigaretten / tag auskultation der lunge ergibt eine typischen expiratorischen stridor . Herzenzyme im serum sind unauffällig 1. akuttherapie? 2. Langfristige therapie? 3. Therapieplan + rezept ein 38jähriger patient mit z.n. Vorderwandinfarkt, zum glück erfolgereiche reperfusion und stentimplantation verlaufkontrolle nac h erfolgter reha (aber ohne entlassungsbrief) 1. welche medikamten müssen, welche sollten in dieser situation eingesetzt werden und warum? 2. Welche faktoren muß der patient in dieser situation selber kontrollieren? 67 / 75 rechtenwald.com Chronische Herzinsuffizienz typischer HI-Patient: sitzt aufrecht rum (Lungenödem), Halsvenenstauung , starke schmerzen, Luftnot Herz: enorm dilatiert Ursachen HI – 40% KHK + Hypertonie – 24% Hypertonie – 10% KHK – familiäre Kardiomyopathien – Myokarditis 3t-häufigste Todesursache .de (nach chronisch ischämischer Herzkrankheit und akutem Myokardinfarkt) Pathophysiologie HI HZV ↓ -> Kompensationsmechanismen (Sympathikus ↑, RAAS ↑) circulus vitiosus H-Glykoside, Sympathomimetika, PDE-I HZV ↓ beta-Blocker Kompensationsmechanismen Myozytenschaden Sympathikus Fibrose Renin Vasokonstriktion Angiotensin Flüssigkeitsretention Aldosteron Diuretika ACE-Inh Spironolacton Medikamente nie K-Sparer, da wir eigentlich immer mit ACE-Hemmern therapieren Diuretika Thiazide (nicht bei GFR < 30-40ml/min) (und gel. Schleifendiuretika – idR ergänzend) HCT / Xipamid: HWZ 6-14h, Chlortalidon: langwirksam (48h) Furosemid: schnell und stark (0,5-6h) variable Bioverfügbarkeit (30-70%) Neuere Schleifendiuretika: länger Wirksam, BV >80% UAW Diurese-bedingt: Thromboseneigung, Elektrolytstörungen (bei Schleifendiuretika Ca2+ ↓, bei Thiaziden Ca2+ ↑) Furosemid: Ototoxizität ACE-Hemmstoffe Captopril. Enalapril usw Hemmung kat. Zentrum ACE Captopril mit kurzer HWZ -> 3xtäglich Enalapril usw 1x tgl Vasodilatation: Blutdruck ; HI Fraglich: Nephroprotektion 68 / 75 rechtenwald.com UAW AT-rezeptor-vermittelt: First-dose-Phänomen (initiale Hypotension, deswegen erste Tablette unter Kontrolle), Hypotension, Niereninsuffizienz, Hyperkaliämie Bradykinin-vermittelt: Husten (5%), Hautrötung, Angioödem KI: bekanntes Angioödem, bilaterale Nierenarterienstenose (effektiver Filtrationsdruck sinkt -> vas afferens ist eh schon fast zu, vas efferens – da ist die vasodilatation – geht auf), Schwangerschaft (enorm teratogen) Antiotensin-Rezeptor-Antagonisten Losartan usw Antagonisten am AT1-Rezeptor rel .niedrige BV Therapie: Hypertonie, HI (nur Losartan), Nephropathie (nur Irbesartan) UAW AT-Rez-Vermittelt: 1st dose-Phänomen, Hypotension, Niereninsuffizienz, Hyperkaliämie Seltener: Husten, Angioödem Neuentdeckung in letzten Jahren: großer Teil Aldosteron wird in Gefäßen produziert Problem: trotz ACE-Inh-Therapie nach halbem Jahr wieder gleicher Aldosteronspiegel deshalb: Aldosteron-Inhibitor zusätzlich zum ACE-Hemmer ganz wuschig Spironolacton: „dreckig“ an mehreren anderen Rezeptoren, cave Gynäkomastie & Hyperkaliämie Eplerenone: ↑spezifisch, keine Gynäkomastie Wirkeintritt erst nach Tagen (weil Aldosteron an nukleärem Rezeptor angreift und die bestehenden Proteine erst mal den Geist aufgeben müssen) Therapie: HI, Hyperaldosteronismus UAW: Hyperkaliämie (nicht bei Niereninsuffizienz, nicht > 65 Jahre) Vorsicht bei Kombination mit ACE-Hemmern Spironolacton: Gynäkomastie Beta-blocker wirksamste Einzelsubstanz auch zusätzlich zum ACE-Hemmer noch deutlich was nur 3 Substanze für HI zugelassen: Metoprolol, Bisoprolol (beide ohne ISA, beta1-selektiv), Carvedilol (unselektiv, alpha1-Blockade) KI Asthma cave: diab mel, PAVK (besser kein Carvedilol) wichtig: zunächst geht's den Patienten schlechter, nach 2-3 Monaten besser -> einschleichende Dosierung („HI-Packungen“) Digitalis / Herzglykoside bei niedriger Dosierung (0,5-0,8ng) bessere Prognose, doch schon leicht höhere Dosierung kann mortalitätssteigernd sein Digoxin/Digitoxin Sympathomimetika bei HI Dopamin, Dobutamin als Dauertherapie ungeeignet nur kurzfristig, wenn wir das Herz sonst nicht zum schlagen bekommen „dobutamine holiday“ sie schädigen das Herz weiter – also immer so kurz wie möglich Dopamin-Stimulation von D1 > beta1 > alpha1-Rezeptoren D1 – renale und mesent. Vasodilatation; beta1 – pos. inotrop; alpha1 – periph. Vasokonstriktion Dobutamin – Stimulation von beta1-Rezeptoren – pos. inotrop, periphere Vasodilatation 69 / 75 rechtenwald.com Pk Applikation nur i.v. , Individuelle Titration UAW Arrhythmien – exzessive Tachykardie, Myokardischämie, Myokard-toxisch, erhöhte Mortalität! Th: Dopamin: Stabilisierung des hypotensiven Patienten Dobutamin: bei refraktärer Herzinsuffizienz, zur Überbrückung vor Transplantation PDE-Inhibitoren bei HI Amrinon, Milrinon, Enoximon WM PDE3-Inhibition -> cAMP hoch -> pos inotrope Wirkung, Vasodilatation PK Applikation i.v. UAW (wie Dobutamin) Th schwere, anderweitig nicht therapierbare HI 70 / 75 rechtenwald.com NYHA-Klassifikation: 4 Schweregrade der HI, je nach Symptomen wann welche Medikamente? I II III Diuretika IV Bei Flüssigkeitsretention Mortalität (↓) ACE-I ↓ AldosteronAntagonisten ↓ Beta-Blocker Nach KHK Digoxin VH-Flimmern ↓ (wenn symptomatisch unter Triple-Therapie) ↔ Aber entscheidend ist , dass der Typ einfach nur therapiert wird! Und zwar optimal und nicht so lala wie in der Wildbahn. 71 / 75 rechtenwald.com Fragen Warum ist die Applikation von nichtsteroidalen Antirheumatika bei Herzinsuffizienz problematisch? Die Niere... Funktionen COX1 Thrombozyten Aggregation hoch, Vasokonstriktion / COX2 Endothel Aggregation runter / Vasodilatation Niere Blutfluss hoch / Natriurese, Kaliurese (quasi synergistisch) bei Block geht dann Nierenfunktion runter PGE2/PGI2 v-> Vasodilatation Vas afferens -> Steigerung der Nierenperfusion + GFR PGE2 verminderte Na+-Rückresorption in der Henle-Schleife = Natriurese PGI2 erhöhte Renin-Freisetzung -> ATII konstringiert das Vas efferens mehr als das Vas afferens -> ATII ist für die Aufrechterhaltung des Filtrationsdrucks notwendig (insbes. Bei beidseitiger Nierenarterienstenose) -> Aldosteronsekretion hoch -> vermehrte K+-Ausscheidung Akute NSAR-GAbe – sofortige Abnahme renale Durchblutung – vasokonstrikt. Signale können in der Niere nicht mjehr durch lokales pGI2 kompensiert werden -> Gefahr von akuten Tubulusnekrosen und akutem Nierenversagen – COX-Inhibitoren können eine akute Dekompensation einer bestehenden chronischen Niereninsuffizienz auslösen Chronische NSAR-Gabe 1. NSAR führen zu na, k , h2o-retention -> steigendes Risiko für Hypertonie, Ödeme, HyperKaliämie, HI (gilt nicht für niedrig dosiertes Aspirin , 100mg/d) 2. Die renalen UAW sind bei HI stärker (RAAS-Voraktivierung) 3. langfristiger NSAR-Gebrauch : Rrmittel steigt ca 5mm Hg -> Hospitalisierungsrisiko HI-Pat verdoppelt COX-2 Hemmer sind noch blöder, weil die günstige hemmung der thrombaggr eindeutig COX1Hemmung zugrueliegt Niere COX2 wird in renalen stressituationen hochreguliert -> wäre protektiv, aber wir hemmen's ja dann Welches analgetikum verwenden sie zur Kopfschmerztherapie bei HI? Paracetamol bei starken Schmerzen sind auch niedrig potente Opioide wie Tramadol Goldene Regel: Paracetamol nicht bei Leberinsuffizienz, COX-Hemmer nicht bei Niereninsuffizienz Stellenwert von Digitalis in der HI-Therapie? HG hemmen N-K-ATPase -> Na/Ca-Austauscher wird gehemmt -> Ca2+iz steigt -> reflektorisch mehr transport ins SM über Ca2+-ATPase pos. inotrope wirkung: 72 / 75 rechtenwald.com verstärkte aktivierung der kontraktilen proteine = stärkere systolische Entleerung der Herzventrikel Abnahme der Restblutmenge sowie der Herzgröße Erhöhung des O2-Verbrauchs aber in geringerem Maße, als von der Zunahme der Herzarbeit her zu erwarten wäre neg chronotrop: 1. kardial höheres HZV bewirkt abnahme des reflektorisch erhöhten sympathikotonus + verbesserte Nierendurchblutung -> RAAS runter 2. extrakardial: hemmung der na/k-ATPase auch an anderen erregbaren geweben: Aktivierung von Vaguskernen und Sensitivierung der Barorezeptoren -> Symp runter, Parasymp hoch (vegetative Umstellung hat großen Anteil am therapeutischen Erfolg pos bathmotrop: zunehmende Hemmung der Na/K-ATPase -> [K+]i runter, [Na+]i hoch – Abnahme des maximalen diastolischen Potentials und steilerwerden der diastolischen Depolarisation – Gesteigerte Automatie der Zelle, vermehrt heterotope Erregungsbildung durch Senkung der Reizschwelle neg. dromotrop aufgrund Anreicherung von [Na+]i ist die Na-Leitfähigkeit und damit die Geschwindigkeit Erregungsleitung vermindert cave: enges therap Fenster, bei Überdosierung Arrhythmiegefahr (durch spontane Ca2+-Freisetzung -> AP / ektope Erregungen) im Tox. Bereich starke AP-Verkürzung (schnellere Inaktivierung der L-Typ-Ca2+-Kanäle – Verkürzung Plateau), spätes Nachpotential / Nachkontraktion Indikationen: – Einsatz bei NYHA II, III und IV – wenn unter Triple-Therapie Patient immer noch symptomatisch – Supraventrikuläre Tachykardien und Tachyarrhythmien – Vorhofflattern, Vorhofflimmern Digitalisintoxikation Herz-Gesunde: atropin /ipratropium, bei asystolie, beta-AR-Agonisten (isoprenalin ) /temp schrittmacher bei HI: kammerextrasystolen therapie: Kalium bei Hypokaliämie (K vermindert digitalisbindung und bewirkt abnahme der diastolischen depolarisation, verringert dadurch heterotope automatien) Unterscheidung.. Digitoxin Polarität Lipophiler Digoxin (dieses hat zusätzliche OH-Gruppe) Hydrophiler 73 / 75 rechtenwald.com Digitoxin Digoxin (dieses hat zusätzliche OH-Gruppe) OBV >90% 70-80% Plasmabindung >90 20-40 Metabolisierter anteil >70 enterohep <30 Elimination Hep/ren Ren Hwz 7-10d 33-36h Tägl orale erhaltungsdosis 0,07-1mg 0,15-0,3mg Plasmaspiegel 10-20 (?) (ng/ml) keine klin studie 0,5-0,6 Dosisred bei Niereninsuffizienz - Ja UAW AV-Block, ventrikuläre Tachyarrhythmien, Farbsehstörungen, Übelkeit IA: beta-Blocker (Frequenzabsenkung), Thiazide, Schleifendiuretika (Hypokaliämie -> Gefahr Intoxikation) Verapamil (Hemmung des enteralen Auswärtstransports v. Digoxin) KI: AV-Block II-III, ventrikuläre Tachyarrhythmien, Hypokaliämie, Hypercalciämie (z.B. bei Hyperparathyreoidismus) KIen gegen beta-Blocker-Therapie bei HI? Mechanismen Absolut: – akute (dekompensierte) Herzinsuffizienz – Schock (da Tachykardie eine Bedarfstachykardie ist und die periphere Vasokonstriktion verstärkt würde) – AV-Block II+III (neg. Chronotrop und dromotrop – schwere COPD (v.a. Beta-Mimetikapflichtige , die nicht mehr mit Glucokortikoiden alleine auskommen, ausserdem KI bei allergischem Asthma) – symptomatische Bradykardie (weiter neg. chronotrop) – vasospastische Angina pectoris (Prinzmetal-Angina -> Verapamil) – Phäochromozytom (KI vor alpha-Blocker-Gabe sonst Gefahr hypertoner Krisen) Relativ: – COPD – Diabetes (Blockade des Sympathikus verhindert Wahrnehmung der über beta2-Blockade Hemmung der Glykolyse, Verstärkung der Hypoglykämie) – vasospastische periphere Durchblutungsstörungen (pAVK, Raynaud-Syndrom) – Hypotonie (Rrsyst <100 mmHg) – Sinusknotensyndrom (Sinusknoten vernarbt, EKG: Sinusbradykardie...) zugelassen für HI: Metoprolol, Bisoprolol, Carvedilol 74 / 75 rechtenwald.com Wie therapieren sie eine akute dekompensierte HI mit Lungenödem? Nicht-medikamentöse Therapie: – Patient aufrecht setzen (venöses Pooling) – Sauerstoff über Nasensonde, notfalls Beatmung Medikamentös. – Morphin (2-5 mg iv, beruhigt den Patienten und vasodilatation) – Furosemid (20-40 mg iv, schnell venös vasodilatierend, diuretisch) – Nitroglycerin (iv , venös vasodilatation) – pos. inotrope Substanzen (Dobutamin, PDE-Hemmer, wenn es zum RR-Abfall / Schock kommt) Inwieweit unterscheidet sich die Wirkung von ACE-Hemmern und AT1-Rezeptorblockern? bekannt 75 / 75 rechtenwald.com