Fachliche Inhalte Chemie am JKG Jahrgänge 5
Werbung

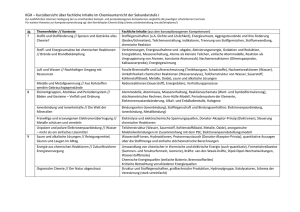
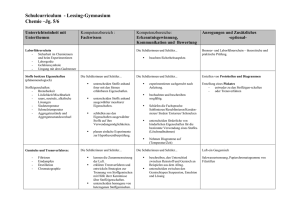
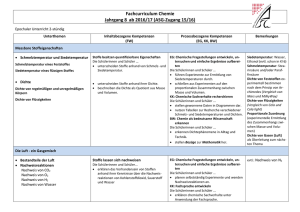
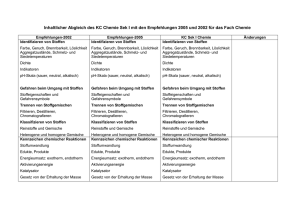
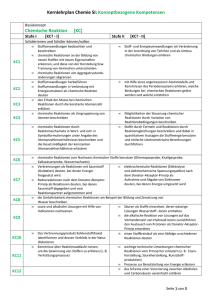
Übersicht über die zentralen Unterrichtsinhalte im Fach Chemie am JohannesKepler-Gymnasium Garbsen Die niedersächsischen Kerncurricula Chemie für das Gymnasium Schuljahrgänge 5-10 (Hannover, 2007) und für die gymnasiale Oberstufe (Hannover, 2009) beschreiben inhaltsbezogene Kompetenzen (Fachwissen/Fachkenntnisse) und prozessbezogene Kompetenzen (Erkenntnisgewinnung/Fachmethoden, Kommunikation und Bewertung/ Reflexion). Diese Kompetenzen sollen von den Schülerinnen und Schüler innerhalb der Doppeljahrgänge 5/6, 7/8 und 9/10 und in den Kurshalbjahren 11.1, 11.2, 12.1 und 12.2 der Oberstufe erworben werden. Das schuleigene Fachcurriculum setzt diese Vorgaben am Johannes-Kepler-Gymnasium Garbsen um. Einen Überblick über die zentralen fachlichen Inhalte gibt die folgende Zusammenstellung. Weitergehende Informationen können dem schuleigenen Fachcurriculum sowie den Kerncurricula entnommen werden. Doppeljahrgang 5/6: - Sicherheitsregeln im Labor, - Erstellen von Versuchsprotokollen, - Umgang mit dem Gasbrenner, - Stoffeigenschaften: Brennbarkeit, Löslichkeit, saure, neutrale, alkalische Lösungen, Aggregatzustände, Siedetemperatur, Schmelztemperatur, - Trennverfahren: Chromatographie, Destillation. Doppeljahrgang 7/8: - Reinstoffe und Gemische, - Nachweisreaktionen für Kohlenstoffdioxid, Sauerstoff, Wasser, - einfaches Atommodell, - Aggregatzustände auf der Teilchenebene, - Dichte (proportionale Zuordnung zwischen der Masse einer Stoffportion und der Anzahl an Teilchen/Bausteinen), - Elemente und Verbindungen, - Chemische Reaktionen auf Stoff- und Teilchenebene, - Gesetz von der Erhaltung der Masse, - Bildung konstanter Atomanzahlverhältnisse in chemischen Verbindungen, - Reaktionsgleichungen aufstellen, - Umkehrbarkeit von chemischen Reaktionen, - Energieumsatz bei chemischen Reaktionen (exotherme und endotherme Reaktionen, Energieinhalt von Stoffen, Energieaustausch mit der Umgebung), - Zusammenhang zwischen Bewegungsenergie der Teilchen und der Temperatur, - Wirkung eines Katalysators auf die Aktivierungsenergie, - Stoff-/Atomkreisläufe, - Verbrennungsprozess als chemische Reaktion, Sauerstoffübertragungsreaktionen. Doppeljahrgang 9/10 - Stoffportion und Stoffmenge (Satz von Avogadro, Stoffmengeneinheit Mol, molare Masse, Stoffmengenkonzentration), - Elementfamilien, - Nachweisreaktionen: Flammenfärbung, Halogenid-Ionen, H+/H3O+-Ionen, OH--Ionen, (pH-Skala), - Periodensystem der Elemente (PSE), - Atome und Ionen (Leitfähigkeit von Salzen: Feststoff, Schmelze, Lösung), - Bau von Atomen aus Protonen, Neutronen und Elektronen, 1 - Atomhülle, Energieniveaus, Ionisierungsenergien, Atombau und Periodensystem der Elemente (PSE), Ionenbindung und Atombindung/Elektronenpaarbindung, Edelgaskonfiguration, Stoffeigenschaften und Bindungsmodelle, Elektronenpaarabstoßungsmodell (EPA-Modell), Polare und unpolaren Atombindungen/Elektronenpaarbindungen, Elektronegativität, Stoffeigenschaften und zwischenmolekulare Wechselwirkungen (Dipol-Dipol-Kräfte, van der Waals-Kräfte, Wasserstoffbrücken), Stoffklassen oder -gruppen: Metalle, Nichtmetalle, Salze, Donator-Akzeptor-Reaktionen (Säure-Base-Reaktionen - Übertragung von Protonen, Redoxreaktionen - Übertragung von Elektronen), Nachweis von Kohlenstoff- und Wasserstoff-Atomen in Verbindungen, Stoffklassen oder -gruppen: Alkane, Alkanole, Lewis-Formel, Isomerie (Alkane, Alkanole), Energieträger und Rohstoffe für die chemische Industrie, chemische Reaktion als Spaltung und Bildung von Bindungen, Beeinflussbarkeit chemischer Reaktionen durch den Einsatz von Katalysatoren. Hinweise zu den Jahrgängen 11-12: Kurse auf erhöhtem Anforderungsniveau unterscheiden sich von denen auf grundlegendem Anforderungsniveau u.a. durch eine stärkere theoretische Durchdringung und Vernetzung der genannten Inhalte sowie durch das Ausmaß der mathematischen Behandlung. Inhalte, die nur für Kurse auf erhöhtem Anforderungsniveau verbindlich sind, werden im Folgenden mit (eA) gekennzeichnet. Kurshalbjahr 11.1 Kursthema: Protonenübertragungsreaktionen, Gleichgewicht Reaktionsgeschwindigkeit, chemisches Protonenübertragungsreaktionen: - Wiederholung und Vertiefung von Brönsted-Konzept und Säure/Base-Titrationen, - Autoprotolyse, Ionenprodukt des Wassers Kw, - pH-Wert und pH-Wert-Berechnung, - schwache Säuren und Basen, Säure- und Basenstärke, - Indikatoren, - Titrationskurven - Puffersysteme. Reaktionsgeschwindigkeit: - Definition der Reaktionsgeschwindigkeit, - Abhängigkeit der Reaktionsgeschwindigkeit von Temperatur, Druck, Konzentration, Zerteilungsgrad und Katalysatoren. Chemisches Gleichgewicht: - Umkehrbarkeit als Phänomen, - dynamisches Gleichgewicht, - Verschiebung des Gleichgewichts durch Temperatur, Druck und Konzentration, Anwendung des Prinzips von Le Chatelier, - Gleichgewichtskonstante und Massenwirkungsgesetz, qualitativer Zusammenhang zwischen der Gleichgewichtskonstanten und der Gleichgewichtslage. 2 Kurshalbjahr 11.2 Kursthema: Vielfalt organischer Stoffklassen und Reaktionen Vielfalt organischer Stoffklassen und Reaktionen: - Homologe Reihen (Alkane, Alkene,…), - IUPAC-Nomenklatur zur Benennung organischer Verbindungen, - Einfach- und Mehrfachbindungen, - Isomerie, - Elektronenpaarabstoßungsmodell, - radikalische Substitution SR (auch Reaktionsmechanismus), - induktive Effekte, - Halogenkohlenwasserstoffe, - Polarität von Molekülen, - Zusammenhang zwischen Molekülstruktur und Stoffeigenschaften, - Reaktionstypen: Substitution, Addition, Eliminierung und Kondensation, - Mechanismus der elektrophilen Addition AE (eA), - sauerstoffhaltige organische Verbindungen (Alkanole, Ether, Alkanale, Alkanone, Alkansäuren, Ester), - Oxidationsreihen, - Redoxgleichungen, - Erklärung der Stärke organischer Säuren, - Mesomerie, - Aromaten insbesondere Benzol), - Reaktionsmöglichkeiten funktioneller Gruppen, radikalische, elektrophile und nucleophile Teilchen, - Nachweisreaktionen (Doppelbindungen mit Brom, reduzierende Stoffe mit FehlingProbe), - einen gegebenen Reaktionsmechanismen versprachlichen, - aus einem Text oder aus experimentellen Daten einen Reaktionsmechanismus ableiten, - einen Syntheseweg aufstellen. Erdöl und Erdgas: - Entstehung und Zusammensetzung von Erdöl und Erdgas, - Stofftrennung durch fraktionierte Destillation und Gaschromatographie, - Erdöl/Erdgas als Energieträger, - Berechnung von Standard-Reaktionsenthalpien aus Standard-Bildungsenthalpien, - Wirkungsgrad, - Klimawandel und Treibhauseffekt. Kurshalbjahr 12.1 Kursthema: Antrieb chemischer Reaktionen, Elektronenübertragungsreaktionen Antrieb chemischer Reaktionen: - Energieumwandlung – Energieerhaltung (1. Hauptsatz der Thermodynamik), - Systembegriff, - innere Energie, Kernenergie, chemische Energie, thermische Energie, Enthalpie, - Enthalpiediagramme, Aktivierungsenergie, Übergangszustand, Katalysatorwirkung, - Berechnung von Standard-Reaktionsenthalpien aus Standard-Bildungsenthalpien, - Wirkungsgrad, - Entropie als Maß für die Unordnung eines Systems (eA), - Kriterien für den freiwilligen Ablauf chemischer Reaktionen (eA), 3 - Berechnungen mit der Gibbs-Helmholtz-Gleichung (eA). Elektronenübertragungsreaktionen: - Redoxreaktionen als Elektronenübertragungsreaktion, als chemische Gleichgewicht, als Donator-Akzeptor-Reaktionen, - korrespondierende Redoxpaare, - Oxidationszahlen, - Redoxgleichungen, - Aufbau und Funktion galvanischer Zellen, - elektrochemische Spannungsreihe, - Standard-Wasserstoffhalbzelle und Standardpotenzial, - Standardpotenziale und Vorhersage des Reaktionsablaufs, - Berechnung von Zellspannungen, - galvanische Zelle als Kopplung zweier Redoxgleichgewichte, - elektrochemische Doppelschicht als Redoxgleichgewicht, - Konzentrationsabhängigkeit des Elektrodenpotenzials (eA), - Berechnungen mit der vereinfachten Nernstgleichung (eA), - Darstellung in einem Diagramm (eA), - Bau und Funktion von Elektrolysezellen, - Elektrolyse als Umkehrung der galvanischen Zelle, - technische Elektrolysen, - elektrochemische Energieträger (Bau, Funktion und Unterschiede von Batterien, Akkumulatoren, Brennstoffzellen). Kurshalbjahr 12.2 Kursthema: Makromolekulare Stoffe Kunststoffe: - Einteilung der Kunststoffe in Duroplaste, Thermoplaste und Elastomere, - Erklärung der Stoffeigenschaften mit der Molekülstruktur, - Anwendungsbereiche, - Reaktionstypen Polymerisation und Polykondensation, - Mechanismus der radikalischen Polymerisation, - Recycling. Bausteine des Lebens: - Molekülstruktur und funktionellen Gruppen von Alkanolen, Alkanalen, Estern, Fettsäuren und Aminosäuren, - Klassifizierung von Kohlenhydraten (Glucose, Fructose, Saccharose, Stärke), Proteinen, Lipiden (Fetten), - Nachweisreaktionen (Fehling-Probe, Iod-Stärke-Reaktion). 4