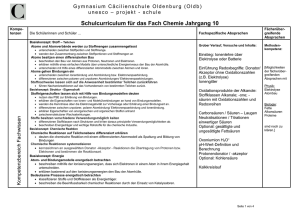
Fachwissen
Werbung
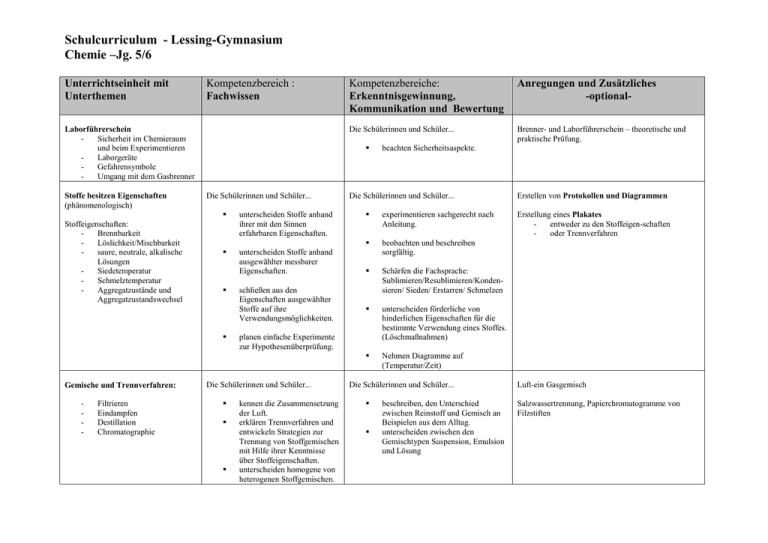
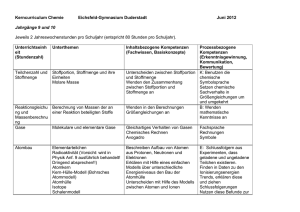
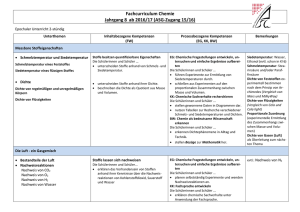
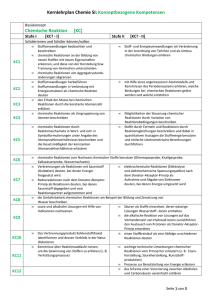
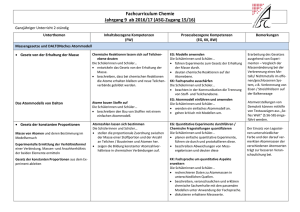
Schulcurriculum - Lessing-Gymnasium Chemie –Jg. 5/6 Unterrichtseinheit mit Unterthemen Kompetenzbereich : Fachwissen Laborführerschein Sicherheit im Chemieraum und beim Experimentieren Laborgeräte Gefahrensymbole Umgang mit dem Gasbrenner Stoffe besitzen Eigenschaften (phänomenologisch) Stoffeigenschaften: Brennbarkeit Löslichkeit/Mischbarkeit saure, neutrale, alkalische Lösungen Siedetemperatur Schmelztemperatur Aggregatzustände und Aggregatzustandswechsel - Filtrieren Eindampfen Destillation Chromatographie Anregungen und Zusätzliches -optional- Die Schülerinnen und Schüler... Brenner- und Laborführerschein – theoretische und praktische Prüfung. Die Schülerinnen und Schüler... unterscheiden Stoffe anhand ihrer mit den Sinnen erfahrbaren Eigenschaften. unterscheiden Stoffe anhand ausgewählter messbarer Eigenschaften. Gemische und Trennverfahren: Kompetenzbereiche: Erkenntnisgewinnung, Kommunikation und Bewertung schließen aus den Eigenschaften ausgewählter Stoffe auf ihre Verwendungsmöglichkeiten. Die Schülerinnen und Schüler... experimentieren sachgerecht nach Anleitung. beobachten und beschreiben sorgfältig. Schärfen die Fachsprache: Sublimieren/Resublimieren/Kondensieren/ Sieden/ Erstarren/ Schmelzen unterscheiden förderliche von hinderlichen Eigenschaften für die bestimmte Verwendung eines Stoffes. (Löschmaßnahmen) Nehmen Diagramme auf (Temperatur/Zeit) planen einfache Experimente zur Hypothesenüberprüfung. Die Schülerinnen und Schüler... kennen die Zusammensetzung der Luft. erklären Trennverfahren und entwickeln Strategien zur Trennung von Stoffgemischen mit Hilfe ihrer Kenntnisse über Stoffeigenschaften. unterscheiden homogene von heterogenen Stoffgemischen. beachten Sicherheitsaspekte. Die Schülerinnen und Schüler... beschreiben, den Unterschied zwischen Reinstoff und Gemisch an Beispielen aus dem Alltag. unterscheiden zwischen den Gemischtypen Suspension, Emulsion und Lösung Erstellen von Protokollen und Diagrammen Erstellung eines Plakates entweder zu den Stoffeigen-schaften oder Trennverfahren Luft-ein Gasgemisch Salzwassertrennung, Papierchromatogramme von Filzstiften Jg. 7-8 Unterrichtseinheit mit Unterthemen Kompetenzbereich : Fachwissen Kompetenzbereiche: Erkenntnisgewinnung, Kommunikation und Bewertung Anregungen und Zusätzliches Stoffeigenschaften II Die Schülerinnen und Schüler... Die Schülerinnen und Schüler... Dichte als proportionale Zuordnung (für Feststoffe, Flüssigkeiten, ggf. Gase) (Die Schülerinnen und Schüler... stellen Bezüge zur Mathematik (Einheiten und Volumenberechnungen am Bsp. der Dichte) her. - Teilchenmodell (Aggregatzustände II) Dichte Chemische Reaktion - - Stoffumsatz (Vernichtung /Erhaltung) Energieumsatz exotherme / endotherme Reaktionen Wortgleichungen Aktivierungsenergie Katalysator beschreiben anhand geeigneter Modelle den submikroskopischen Bau von Stoffen. beschreiben die Aggregatzustände auf der Teilchenebene. beschreiben das Vorhandensein identischer und für einen Stoff charakteristischer Teilchen/ Bausteine als ein wesentliches Merkmal für die Eigenschaften eines Stoffes. Die Schülerinnen und Schüler... beschreiben, dass nach einer chemischen Reaktion die Ausgangsstoffe nicht mehr vorliegen und gleichzeitig immer neue Stoffe entstehen. beschreiben, dass chemische Reaktionen immer mit einem Energieumsatz verbunden sind. 2 beschreiben, dass chemische Reaktionen grundsätzlich umkehrbar sind. prüfen Darstellungen zum Teilchenmodell in Medien und hinterfragen sie fachlich. protokollieren den Verlauf und die Ergebnisse von Untersuchungen in angemessener Form (Text, Tabelle). Die Schülerinnen und Schüler... diskutieren die erarbeiteten Modelle. erkennen den Nutzen des Teilchenmodells. unterscheiden zwischen Stoffebene und Teilchenebene. erkennen, dass chemische Reaktionen in der Alltagswelt stattfinden. erkennen die Bedeutung chemischer Reaktionen für Natur und Technik. unterscheiden Fachsprache von Alltagssprache beim Beschreiben chemischer Reaktionen. argumentieren fachlich korrekt und folgerichtig über ihre Versuche. diskutieren Einwände selbstkritisch. Absprache mit der Physik über „Energieformen“ (wird in Physik in Kl.7 eingeführt) (bei chemischen Reaktionen „chemische Energie“) Energiediagramme erstellen a) Verbrennungsprozesse Die Schülerinnen und Schüler... - Sauerstoffübertragu ngsprozesse - Reaktionen von Metallen und Nichtmetallen mit Sauerstoff - Metallgewinnung - Sauerstoffaffinitätsr eihe b) Atome bauen Stoffe auf - - Gesetz von der Erhaltung der Masse Atommodell nach Dalton Atomsymbole Begrifflichkeiten: Oxidation, Reduktion und Redoxreaktion erklären das Vorhandensein von Stoffen anhand ihrer Kenntnisse über Nachweisreaktionen. Nachweisreaktionen: Sauerstoff Kohlenstoff-dioxid Wasser Wdhl: Luftzusammensetzung Oxidation vor b), Reduktion nach b) möglich Die Schülerinnen und Schüler... Entwickeln das Gesetz von der Erhaltung der Masse. beschreiben, dass bei chemischen Reaktionen die Atome erhalten bleiben und neue Teilchenverbände gebildet werden. formulieren Vorstellungen zu Edukten und Produkten. beschreiben, veranschaulichen oder erklären chemische Sachverhalte mit den passenden Modellen unter Anwendung der Fachsprache. gehen kritisch mit Modellen um. erkennen die Allgemeingültigkeit von Gesetzen. Die Schülerinnen und Schüler... diskutieren die erarbeiteten Modelle. --> MODELLKRITIK benutzen Atomsymbole. deuten chemische Reaktionen auf Atomebene. Planen Überprüfungsexperimente und führen sie unter Beachtung von Sicherheitsaspekten durch. entwickeln und vergleichen Verbesserungsvorschläge von Versuchsdurchführungen. wenden ein einfaches Atommodell an. Modelle: aus Knete, Würfelzucker, Pappe, Moosgummi etc. 3 Atomanzahlen und quantitative Bestimmungen Die Schülerinnen und Schüler... - - Atomgrößen Atommassen Atomanzahl in Stoffportionen Gesetz der konstanten Proportionen Molare Masse stellen die proportionale Zuordnung zwischen der Masse einer Stoffportion und der Anzahl an Teilchen/Bausteinen und Atomen her. unterscheiden zwischen Stoffportion und Stoffmenge. zeigen die Bildung konstanter Atomanzahlverhältnisse in chemischen Verbindungen auf. Gase und Moleküle Eigenschaften von Gasen Satz von Avogadro Mol als Stoffmengeneinheit Molekülbegriff Molvolumen 24L/mol Die Schülerinnen und Schüler... Erstellen von Reaktionsgleichungen Die Schülerinnen und Schüler... - 4 Verhältnisformeln Reaktionsgleichung en wenden den Zusammenhang zwischen Stoffportionen und Stoffmengen an. verknüpfen Stoff- und Teilchenebene. Formulieren vollständige Reaktionsgleichungen und gleichen sie stöchiometrisch aus aus. Die Schülerinnen und Schüler... recherchieren Daten zu Atommassen in unterschiedlichen Quellen. --> PSE beschreiben, veranschaulichen und erklären chemische Sachverhalte mit den passenden Modellen unter Anwendung der Fachsprache. diskutieren erhaltene Messwerte. Die Schülerinnen und Schüler… • wenden Kenntnisse aus der Mathematik an, jedoch werden Potenzen erst später behandelt; somit müssen 10er – Potenzen selbst erläutert werden. • „mol“ wird im Sinne einer Anzahl („n“) verwandt; Die Schülerinnen und Schüler... wenden in den Berechnungen Größengleichungen an. benutzen die chemische Symbolsprache. setzen chemische Sachverhalte in Größengleichungen um und umgekehrt. Die Schülerinnen und Schüler... Ermitteln die Verhältnisformeln (anhand der Wertigkeiten) Die Schülerinnen und Schüler... wenden Kenntnisse aus der Mathematik an. – Jg. 9-10 Unterrichtseinheit mit Unterthemen Kompetenzbereich : Fachwissen Kompetenzbereiche: Erkenntnisgewinnung, Kommunikation und Bewertung Anregungen und Zusätzliches Elementfamilien Die Schülerinnen und Schüler... Die Schülerinnen und Schüler... - Alkalimetalle Halogene Flammenfärbung Stoffklassen: Metalle Nichtmetalle Periodensystem: Ableiten des PSE Anwenden des PSE führen ihre Kenntnisse aus dem bisherigen Unterricht zusammen, um neue Erkenntnisse zu gewinnen. erkennen die Prognosefähigkeit ihres Wissens über den Aufbau des PSE. Die Schülerinnen und Schüler... Atombau - nutzen das PSE zur Ordnung und Klassifizierung der ihnen bekannten Elemente. finden in Daten und Experimenten zu Elementen Trends, erklären diese und ziehen Schlussfolgerungen. wenden Sicherheitsaspekte beim Experimentieren an. beschreiben, veranschaulichen und erklären das PSE. argumentieren fachlich korrekt und folgerichtig. planen, strukturieren und präsentieren ggf. ihre Arbeit als Team. - ordnen Elemente bestimmten Elementfamilien zu und vergleichen die Elemente innerhalb einer Familie und stellen Gemeinsamkeiten und Unterschiede fest. Kern-Hülle-Modell Modell über Ionisierungsenergie Valenzelektronen Die Schülerinnen und Schüler... beschreiben mithilfe der Ionisierungsenergien, dass sich Elektronen in einem Atom in ihrem Energiegehalt unterscheiden. erklären basierend auf den Ionisierungsenergien den Bau der Atomhülle. beschreiben den Bau von Atomen aus Protonen, Neutronen und Elektronen. erklären mithilfe eines einfachen Modells über unterschiedliche Energieniveaus den Bau der Atomhülle. wenden das Energiestufenmodell des Atoms auf das Periodensystem der Elemente an. finden in Daten zu den Ionisierungsenergien Trends, Strukturen und Beziehungen, erklären diese und ziehen Schlussfolgerungen. Schüler recherchieren Daten zu Elementen Erdalkalimetalle Edelgase Die Schülerinnen und Schüler... Rückbezug zum PSE zeigen die Bedeutung der differenzierten Atomvorstellung für die Entwicklung der Naturwissenschaften auf. stellen Bezüge zur Physik (Radioaktivität) her, Absprache. stellen Anwendungsbezüge zur Physik (Kernbau, elektrostatische Anziehung, eV) her. beschreiben, veranschaulichen und erklären chemische Sachverhalte unter Verwendung der Fachsprache und/oder mithilfe von Modellen und Darstellungen. 5 Salze und Ionenbindungen - - Bau von Salzen Leitfähigkeit Untersuchungen: Feststoffen, Schmelze und Lösungen Nachweise von Ionen (Halogenid-Ionen) Edelgaskonfiguration Elektronenübertragungsreaktionen Die Schülerinnen und Schüler... Bindungen - - - Elektronenpaarbindung /Atombindung Lewis-Formel (Elektronenstrichforme l) Polare Elektronenpaarbindung en Elektronegativität zwischenmolekulare Wechselwirkungen: Dipol-Dipol, van der Waals, Wasserstoffbrücken 6 erklären die unterschiedlichen Eigenschaften der Stoffe (anorganische und organische) anhand geeigneter Bindungsmodelle. nutzen das PSE zur Erklärung von Bindungen. erklären die Eigenschaften von Ionen- und Molekülverbindungen anhand von Bindungsmodellen. wenden die Kenntnisse über die Elektronegativität zur Vorhersage oder Erklärung einer Bindungsart an. differenzieren zwischen unpolarer, polarer Atombindung/ Elektronenpaarbindung und Ionenbindung. schlussfolgern aus Experimenten, dass geladene und ungeladene Teilchen existieren. Silbernitrat-Nachweisreaktionen Die Schülerinnen und Schüler... kennzeichnen an ausgewählten Donator-Akzeptor-Reaktionen die Übertragung von Protonen bzw. Elektronen und bestimmen die Reaktionsart. Die Schülerinnen und Schüler... unterscheiden mit Hilfe eines differenzierten Atommodells zwischen Atomen und Ionen. Die Schülerinnen und Schüler... Die Schülerinnen und Schüler... teilen chemische Reaktionen nach bestimmten Prinzipien ein. Die Schülerinnen und Schüler... Die Schülerinnen und Schüler... wenden Bindungsmodelle an, um chemische Fragestellungen zu bearbeiten. erklären die unterschiedlichen Eigenschaften der Stoffe (anorganische und organische) anhand geeigneter Bindungsmodelle. • wählen geeignete Formen der Modelldarstellung aus und fertigen Anschauungsmodelle an. • präsentieren ihre Anschauungsmodelle. gehen kritisch mit Modellen um Säure, Base – Reaktionen - - charakteristische Teilchen in sauren und alkalischen Lösungen: H+/H3O+-Ionen, OH-Ionen, Neutralisation pH-Skala Indikatoren Stoffmengenkonzentrat ion organische Chemie - Nachweis von Kohlenstoff- und Wasserstoff-Atomen in Verbindungen; - Nomenklatur und homologe Reihen der: Alkane und der Alkanole, - Wichtige Stoffeigenschaften der Alkane und Alkanole (Smp., Sdp., Löslichkeit, Hydrohilie) Die Schülerinnen und Schüler... kennzeichnen an ausgewählten Donator-Akzeptor-Reaktionen die Übertragung von Protonen und bestimmen die Reaktionsart. führen Nachweisreaktionen auf das Vorhandensein von bestimmten Teilchen zurück. planen geeignete Untersuchungen und werten die Ergebnisse kritisch aus. werten vorgegebene quantitative Daten aus. Die Schülerinnen und Schüler... Die Schülerinnen und Schüler... Die Schülerinnen und Schüler... klassifizieren Stoffe und Stoffklassen als Energieträger. erklären die unterschiedlichen Stoffeigenschaften und Reaktionsverhalten der Stoffe anhand ihrer Struktur - Aldehyde,Ketone und Carbonsäuren - Darstellung in Form von Halbstrukturformeln und Skelettformeln (Gerüstformeln) - Isomerie sollen die Brønsted-Theorie zur Beschreibung von Säuren und Laugen anwenden planen Experimente zur Untersuchung von Kohlenwasserstoffen diskutieren und bewerten gesellschaftsrelevante Chemische Reaktionen (z. B. großtechnische Prozesse) aus unterschiedlichen Perspektiven.erkennen die Bedeutung von Energieübertragungen in ihrer Umwelt (z. B. Treibstoffe). beschreiben die Beeinflussbarkeit chemischer Reaktionen durch den Einsatz von Katalysatoren. erkennen, diskutieren und bewerten die Bedeutung von Energieträgern. erkennen und bewerten die global wirksamen Einflüsse des Menschen (z. B. Treibhauseffekt) und wenden ihre bisherigen Chemiekenntnisse zur Entwicklung von Lösungsstrategien an. Die Schülerinnen und Schüler... stellen Bezüge zu anderen Fächern wie Erdkunde, PolitikWirtschaft (z. B. Erdöl) her. - Rohstoffe und Energieträger: Erdgas, Erdöl, Kohle, Treibstoffe - Katalysatoren (Biologiebezug : Enzyme) - Treibhauseffekt stellen Bezüge zur Biologie und Physik (z. B. Ernährung, “Kraft-Wärme-Kopplung“) her. 7