Seminar zu Diabetes mellitus
Werbung

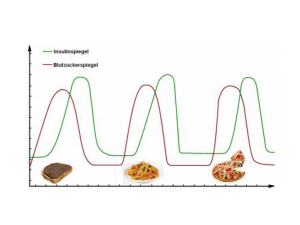
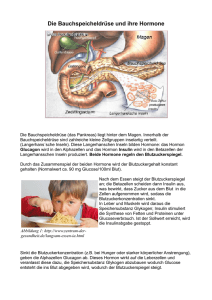
Diabetes mellitus Diabetes Es gibt zwei Typen von Diabetes mellitus: juveniler Diabetes mellitus (Typ I) und Altersdiabetes (Typ II). Außerdem gibt es Diabetes salina renalis, bei dem der Salzhaushalt der Niere nicht stimmt: Es werden keine Mineralokortikoide mehr hergestellt. Bei Diabetes insipidus ist die ADH-Produktion gestört und es wird zuviel Flüssigkeit ausgeschieden. Wir reden heute nur über Diabetes mellitus. Typen des Diabetes mellitus Beim Typ I werden die insulinproduzierenden Zellen in der Bauchspeicheldrüse abgetötet, und es gibt einen absoluten Insulinmangel. Dies kann durch Autoimmunerkrankungen hervorgerufen werden, wobei Antigene spezifisch gegen Membranmoleküle der Langerhans‘schen Inselzellen gebildet werden. Normalerweise werden körpereigene Antigene (ca. 9 AS) auf den Zelloberflächen an MHC I-Molekülen (major histocompatibility complex) präsentiert. Die Autoimmunerkrankung wird praktisch immer dadurch ausgelöst, dass ein körperfremdes Antigen, das körpereigenen sehr ähnlich ist, in erhöhter Konzentration präsentiert wird. Bei sehr vielen Autoimmunerkrankungen wird eine Mutation des MHC I festgestellt. Es gibt eine genetische Präposition für Typ I-Diabetes, bei dem die Autoimmunerkrankung praktisch prädestiniert ist. Das Mittel des Alters, in dem Typ I auftritt, ist 12 Jahre; Typ II tritt ab 40 Jahren bis 80 Jahren sehr häufig auf. Die Häufung bei 12 Jahren liegt daran, dass gewisse Infektionen immer gehäuft in einem bestimmten Alter auftreten; auslösende Viruserkrankungen treten anscheinend gehäuft in diesem Alter auf. Beim Typ II hat man keine spezifische Genese; es kann sein, dass mit zunehmendem Alter weniger Insulin produziert wird, es kann sein, dass die Zielzellen weniger Insulinrezeptoren exprimieren, es können noch andere Gründe vorliegen. Viele der Typ II-Patienten haben ein metabolisches Syndrom, d.h. Fettleibigkeit, hoher Fettgehalt im Blut, ... Vorbeugend und symptommildernd bei Typ II-Diabetikern wirkt fettarme Ernährung und Sport. Insulin (und Proteinproduktion allgemein) Insulin ist ein Proteohormon, das aus 51 Aminosäuren in zwei Untereinheiten besteht; Molekulargewicht 5700 Dalton, es kann sich Temperatur-, Konzentrations-, und pH-abhängig zu Aggregaten bis zu 57000Da zusammenlagern. Die Dosis an Insulin wird in IE oder IU (internationale Einheiten) pro mg gemessen. Gemessen wird dabei die Wirkung, so dass man bei reiner Substanz immer die Wirkung normiert hat. Früher gab man Schweineinsulin, das sich nur in einer Aminosäure, der letzten der B-Kette, vom humanen Insulin unterscheidet. Heute macht man dies nicht mehr, da Unverträglichkeiten auftraten; es wurde auf Grund der einen unterschiedlichen AS Antikörper produziert, so dass man mit der Zeit immer mehr spritzen musste. Heute wird humanes Insulin von E. coli produziert, indem man die gesplicete mRNA mit reverser Transkriptase in die Bakterien eingeschleust wird. Dabei werden zuerst aus der hnRNA die zwei Introns herausgeschnitten, die mRNA wird dann über die Kernporen ins Cytosol abgegeben, bindet an freie Ribosomen, die anfangen zu translatieren; an den Anfang des Proteins bindet dann ein SRP (signal recognition particle), das an Rezeptoren am rER bindet und dabei das Ribosom mit dem rER verbindet, so dass das Protein ins Lumen des rER abgegeben wird. Das SRP geht dann wieder ins Cytosol zurück, während das Protein produziert wird. Die fertigen Proteine werden dann in Vesikeln, die mit SNAREs versehen sind, abgespalten, die nur an den cis-Golgi-Apparat gehen, da er die passenden target-SNAREs hat. Der Weg geht schließlich über den medialen und trans-Golgi-Apparat, und die (modifizierten) Proteine (Insulin wird nicht modifiziert) werden in Sekretgranula abgeschnürt. Die SNAREs sind überall dran, also auch von cis zu medial, von medial zu trans, von trans zur Zellmembran. Insulin wird ausgeschleust, wenn Glucose über den insulinunabhängigen GluT-2 aufgenommen wird, worauf erhöht ATP produziert wird, was zu einer Zelldepolarisation mit Einstrom von Calciumionen führt, worauf die Insulinvesicel mit der Membran verschmelzen. GluT-2 deshalb, weil der KM hoch ist, also die Affinität niedrig, so dass der Konzentrationsgradient hoch sein muss, damit über diesen Transporter Glucose aufgenommen werden kann. Die normale Insulinkonzentration im Blut beträgt 5mM, bei >10mM wird über GluT-2 Glucose aufgenommen. Die aufgenommene Glucose gibt (über Glukokinase) Glucose-6-Phosphat; hierbei ist wieder die Affinität der GK niedrig, so dass auch intrazellulär eine hohe Glukosekonzentration vorhanden sein muss. Das G6-P geht in die Glykolyse, Atmungskette usw., ATP wird produziert, das die Kaliumkanäle blockiert, worauf Calcium einströmt, das über Calmodulin die Ausschüttung von Vesiceln stimuliert. Jetzt ham wir Insulin und C-Protein freigesetzt; das Insulin gelangt jetzt übers Blut ohne Transporter (da Insulin wasserlöslich ist) zu den Zielzellen, wo es vom Insulinrezeptor angenommen wird. Dieser Rezeptor ist Wachstumsfaktorrezeptoren sehr ähnlich, hat sich wahrscheinlich daraus entwickelt (IGF = insulin-like growth factor, PDGF = platelet-derived growth factor, Thrombozyten machen also Wachstumsfaktoren). Beim Binden von Insulin gibt es eine Konformationsänderung bis hinunter in die Transmembrandomäne, die sich selbst phosphoryliert und eine Tyronsinkinaseaktivität entfaltet, also Tyrosinreste phosphorylieren kann. Der PDGF-Rezeptor aktiviert z.B. RAS, das über GTP RAF aktiviert, das MAPKK phosphoryliert, das in dieser aktiven Form MAP-Kinase phosphoryliert, die im Kern die Translation beeinflusst. Wenn der Insulinrezeptor nun Insulin abkriegt, werden GluT-4 (Glucose-Transporter 4) in Skelettmuskulatur und Fettzellen in die Membran eingebaut, das sind insulinabhängige Glucosetransporter. Name Glut 1 Glut 2 Glut 3 Glut 4 Glut 5 Glut 6 Glut 7 Vorkommen Erythrocyten, Endothelzellen, viele Gewebszellen Funktion Basale Glucoseversorgung, Blut-HirnSchranke Hepatocyten, Beta-Zellen des Pankreas, Epithelzellen Glucoseaufnahme in der Leber, transepithelialer der Niere und des Darms Transport Zentrales Nervensystem und andere Gewebszellen Basale Glucoseversorgung, Glucoseaufnahme aus der Cerebrospinal-Flüssigkeit Skelettmuskulatur, Fettgewebe (wird insulinabhängig Insulinabhängige Glucoseversorgung des Orgain die Plasmamembran transloziert) nismus Darm, Spermatozoen Fructosetransport Pseudogen, wird nicht exprimiert Leber Glucoseabgabe aus der Leber Die Leber hat auch Insulinrezeptoren, da sie die Regulation von Schlüsselenzymen über Insulin ebenfalls benötigt. Diabetisches Koma: Hyperglykämie, kataboler Stoffwechsel, Polyurie, es werden Ketonkörper produziert, die zu einer metabolischen Azidose führen, die weder durch die Lunge noch die Nieren kompensiert werden kann. Todesursachen bei Diabetikern: Sehr häufig an Koronarsklerose, dann Arteriosklerose, Karzinom (hat nix mit Diabetes zu tun), Nierenerkrankungen, Infektionen durch geschwächte Immunabwehr, Gangräne (Absterben von Gewebe durch chronische Minderdurchblutung). Die Gefäßveränderungen bei Insulinmangel (Mikroangiopathie) bewirken Herzinfarkt usw. Ein Marker sind die Reaktionen von Zucker mit Proteinen; hierbei reagieren die offenkettigen Zucker mit Aminosäuren zu einer Schiff‘schen Base, die sich durch Amadori-Umlagerung in eine stabile Endverbindung verwandelt. Wenn der Zucker mit Hämoglobin reagiert, entsteht Hb A1C. Normal sind 3-5% an dieser Verbindung, bei Diabetikern liegen 1016% vor. Die Angiopathien entstehen durch hormonelle Einflüsse, also den erhöhten Spiegel an kontra-insulinären Hormonen wie Glucagon, Adrenalin, Cortisol, Wachstumshormon, durch metabolische Einflüsse und genetische Einflüsse. Bei guter Stoffwechselführung ist das Ausmaß der Angiopathien hoch und die Lebensdauer deutlich erniedrigt; bei guter Stoffwechselführung können auch gar keine Angiopathien auftreten.